PENGENDALI
DEPA
IN
ALIAN REBAH KECAMBAH CABAI
AGUS WAHID SALIM
EPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
2012
BAI MERAH
Effectiveness of Antagonist Agents in Controlling Red Pepper Damping Off
AW Salim and MS Sinaga
Department of Plant Protection
Faculty of Agricultural, Bogor Agricultural University, Bogor
Oneof the major problems during cultivating of chilli is antrachnose disease. The
cause of chili anthracnose can various as Colletotrichum acutatum, C. gloeosporoides, and Gloeosporium piperatum. Pathogens can cause seed
decay, damping off, and anthracnose fruit rot. The objective of experiment is to evaluate the effectiveness of several antagonist agents in controlling damping off disease. The identification results show that the cause of anthracnose which can be isolated from the seeds and chilies are Gloeosporium piperatum. Antagonist agent Trichoderma harzianum (TH1), Gliocladium fimbriatum (G84), Bacillus subtilis (B12), and Pseudomonas fluorescens (P1) can inhibited the growth of pathogen colonies in vitro as 100%, 100%, 95.43%, and 39.83%. In the in vivo test is known that isolates TH1, G84, B12, and P1 is very effective (100%) in the controlling of chili damping off. Both of single treatment or combination treatment antagonist agents were not different significantly to control the damping off disease. The fourth of antagonist agents are very potential in controlling the damping off disease of red pepper germination.
AGUS WAHID SALIM. Keefektifan Agens Antagonis Dalam Pengendalian Rebah Kecambah Cabai Merah. Dibimbing oleh MEITY SURADJI SINAGA.
Salah satu permasalahan utama dalam budidaya cabai adalah penyakit antraknosa. Penyebab antraknosa pada cabai dapat berbeda-beda seperti Colletotrichum acutatum, C. gloeosporioides, dan Gloeosporium piperatum. Patogen dapat menyebabkan busuk benih, rebah kecambah dan busuk buah antraknosa. Tujuan utama dari percobaan ini adalah untuk mengkaji keefektifan beberapa agens antagonis dalam mengendalikan penyakit rebah kecambah. Hasil identifikasi menunjukkan bahwa penyebab antraknosa yang dapat diisolasi dari benih dan buah cabai adalah Gloeosporium piperatum. Agens antagonis Trichoderma harzianum (TH1), Gliocladium fimbriatum (G84), Bacillus subtilis (B12), dan Pseudomonas fluorescens (P1) berturut-turut menghambat pertumbuhan koloni patogen secara in vitro sebesar 100%, 100%, 95,43%, dan 39.83%. Pada uji in vivo diketahui bahwa isolat TH1, G84, B12, dan P1 sangat efektif (100%) dalam mengendalikan rebah kecambah cabai. Baik perlakuan tunggal maupun perlakuan kombinasi agens antagonis tidak berbeda secara nyata dalam mengendalikan penyakit rebah kecambah. Keempat agens antagonis sangat potensial dalam mengendalikan penyakit rebah kecambah pada persemaian cabai merah.
PENGENDALI
sebagai salah s di Departemen Prot
DEPA
IN
ALIAN REBAH KECAMBAH CABAI
AGUS WAHID SALIM
A34080012
Skripsi
h satu syarat untuk memperoleh gelar Sarjana P roteksi Tanaman, Fakultas Pertanian, Institut Pe
EPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
2012
BAI MERAH
na Pertanian Pertanian Bogor
Kecambah Cabai Merah Nama Mahasiswa : Agus Wahid Salim
NIM : A34080012
Disetujui, Dosen Pembimbing
Prof. Dr. Ir. Meity Suradji Sinaga, MSc. NIP. 19501125 197603 2 002
Diketahui,
Ketua Departemen Proteksi Tanaman
Dr. Ir. Abdjad Asih Nawangsih, MSi.
NIP. 19650621 198910 2 001
Penulis dilahirkan di Subang, Jawa Barat pada tanggal 11 November 1989. Penulis merupakan putra kedua dari dua bersaudara pasangan Bapak Wahyudin dan Ibu Yoyoh Nurasyiah.
Penulis menyelesaikan pendidikan sekolah menengah atas di SMA Negeri 1 Jalan Cagak, Subang pada tahun 2008. Pada tahun yang sama penulis melanjutkan studinya di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk Institut Pertanian Bogor (USMI).
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah melimpahkan rahmat-Nya, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Keefektifan Agens Antagonis dalam Pengendalian Rebah Kecambah Cabai Merah”. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman, Institut Pertanian Bogor. Penelitian dilaksanakan di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Institut Pertanian Bogor dari bulan Maret sampai bulan Juli 2012.
Penulis menyadari bahwa tanpa bimbingan, dukungan, dan bantuan dari berbagai pihak, penulis tidak dapat berbuat maksimal dalam menyelesaikan skripsi ini. Untuk itu dengan rasa tulus pada kesempatan ini, penulis ingin menyampaikan ucapan terima kasih kepada:
1. Prof. Dr. Ir. Meity Suradji Sinaga, MSc. selaku dosen pembimbing yang senantiasa memberikan bimbingan, masukan, dan arahan kepada penulis; 2. Dr. Ir. Yayi Munara Kusumah, MSi. selaku dosen penguji tamu yang telah
memberikan arahan dan saran yang bermanfaat;
3. Ayahanda Wahyudin dan Ibunda Yoyoh Nurasiah yang tak henti-hentinya memberi perhatian dan bantuan moril maupun spiritual, disetiap langkah, gerak, dan ucapnya merupakan doa bagi penulis, serta kakak penulis Siti Nur Hidayah;
4. Keluarga besar Ibu Kokom Komariah (alm) dan Ibu Asmi Anah yang selalu memberikan doa dan dukungannya kepada penulis;
5. Sahabat seperjuangan Proteksi Tanaman, khususnya kepada Siti Syarah Maesyaroh, Susanti, Anissa Nur Fajrina, Imam Khoiri, Ni Nengah Putri Adyani, dan Hamdayanti;
6. Rekan kerja di Laboratorium Mikologi, Bapak Dadang Surachman, mba Dian Safitri, Swinda, Mas Evan, Mba Dilla, Mba Riyana, Mba Ratna, dan Mba Ita; 7. Mahasiswa, dosen, staff, beserta laboran Departemen Proteksi Tanaman, serta
semua pihak yang tidak dapat disebutkan satu persatu.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun untuk ke depannya. Akhir kata penulis serahkan skripsi ini dengan penuh rasa bangga.
Bogor, September 2012
DAFTAR ISI
Faktor yang Mempengaruhi Perkembangan Penyakit ... 7
Pengendalian Penyakit ... 8
Isolasi dan Identifikasi Cendawan Patogen ... 14
Uji Antagonisme in vitro ... 15
Uji Keefektifan Agens Antagonis in vivo ... 16
Rancangan Percobaan dan Analisis Data ... 18
HASIL DAN PEMBAHASAN ... 19
Isolasi dan Identifikasi Cendawan Patogen ... 19
Uji Antagonisme in vitro ... 20
KESIMPULAN DAN SARAN ... 30
Kesimpulan ... 30
Saran ... 30
DAFTAR PUSTAKA ... 31
DAFTAR TABEL
Halaman 1 Penghambatan secara in vitro (%) agens antagonis terhadap
DAFTAR GAMBAR
Halaman 1 Hasil isolasi patogen pada media PDA ... 19 2 Uji antagonisme in vitro pada 1 hsp ... 21 3 Uji antagonisme in vitro pada 10 hsp ... 22 4 Gejala rebah kecambah pada uji keefektifan agens antagonis dengan
inokulasi Gloeosporium piperatum ... 24 5 Patogen hasil reisolasi dari kecambah yang menunjukkan gejala
DAFTAR LAMPIRAN
Halaman
1 Vigor kecambah cabai pada uji keefektifan agens antagonis in vivo .... 36 2 Jari-jari pertumbuhan koloni patogen G. piperatum pada media PDA
termodifikasi ... 37 3 Persen penghambatan pertumbuhan koloni G. piperatum oleh agens
antagonis ... 38
4 Hasil analisis ragam (ANOVA) uji antagonisme in vitro pada PDA… 38
5 Hasil analisis ragam (ANOVA) dari daya kecambah benih normal (%) pada uji keefektifan agens antagonis in vivo ... 38
6 Hasil analisis ragam (ANOVA) dari kejadian penyakit rebah kecambah (%) pada uji keefektifan agens antagonis in vivo... 39
7 Hasil analisis ragam (ANOVA) dari tinggi kecambah normal (mm)
pada uji keefektifan agens antagonis in vivo... 39
8 Hasil analisis ragam (ANOVA) dari jumlah daun kecambah (helai)
PENDAHULUAN
Latar Belakang
Cabai merah (Capsicum annum L.) merupakan suatu komoditas sayuran yang tidak dapat ditinggalkan masyarakat Indonesia dalam kehidupan sehari-hari. Selain memiliki kandungan gizi yang cukup tinggi, cabai telah menjadi bumbu utama dalam masakan orang Indonesia, sehingga sangat potensial secara ekonomis. Pemanfaatan cabai sebagai bumbu masak, bahan baku berbagai industri makanan, minuman dan obat-obatan, serta pemasarannya dalam bentuk segar dan olahan menambah pentingnya komoditas tersebut untuk diusahakan.
Produksi cabai besar di Indonesia pada tahun 2011, yaitu sebesar 888.852 ribu ton dengan luas area panen 121.063 ribu hektar, dan rerata produktivitas sebesar 7.34 ton per hektar. Hal ini menunjukkan bahwa terjadi kenaikan produksi sebesar 81.692 ribu ton (10.12%) dibandingkan produksi cabai besar pada tahun 2010. Kenaikan tersebut disebabkan oleh peningkatan produktivitas sebesar 0.76 ton per hektar (11.55%) dengan keadaan luas panen terjadi penurunan sebesar 1.692 ribu hektar (1.38%). Peningkatan produksi cabai besar tahun 2011, berdasarkan presentase menurut wilayah peningkatan produksi di Pulau Jawa sebesar 15.424 ribu ton (45.67%), sedangkan untuk luar Pulau Jawa peningkatannya sebesar 66.268 ribu ton (54.33%) (BPS 2012).
cukup tinggi yaitu mencapai 80%, sedangkan pada musim kemarau jauh lebih rendah yaitu berkisar 20% sampai 35% (Widodo 2007).
Patogen antraknosa dapat terbawa benih dan menyebabkan busuk benih, rebah kecambah, serta busuk buah antraknosa (Bailey et al. 1992). Serangan pada benih menyebabkan kegagalan untuk berkecambah dan pada kecambah dapat menimbulkan rebah kecambah (damping off). Serangan pada tanaman dewasa menimbulkan mati pucuk (die back) dan infeksi lebih lanjut menyebabkan busuk kering pada batang (Suryaningsih et al. 1996). Pada daun dan batang muda mulai dari perkecambahan hingga pembungaan patogen tersebut dapat bersifat laten, kemudian patogen dapat aktif menginfeksi pada tahapan tertentu, biasanya pada buah yang mulai matang secara fisiologis (BPTS 1996). Selain itu, penyebab antraknosa ini dapat mempertahankan diri pada sisa-sisa tanaman sakit dan selanjutnya konidia disebarkan oleh angin, benih atau tanah (Semangun 2000).
Mukerji dan Garg (2000), menyatakan bahwa pada umumnya pengendalian penyakit antraknosa termasuk rebah kecambah pada cabai merah masih bergantung kepada fungisida. Dampak penggunaan fungisida secara luas dan terus menerus menyebabkan munculnya strain-strain cendawan yang tahan terhadap fungisida, sehingga perlu konsep pengendalian secara terpadu. Pada pengendalian penyakit secara terpadu budidaya tanaman sehat dan pengendalian hayati diprioritaskan.
cendawan patogen antraknosa melalui mekanisme antibiosis secara in vitro. Sutariati et al. (2006), juga mengemukakan bahwa sebagian besar isolat rizobakteri mampu memproduksi enzim ekstraseluler (kitinase, protease, dan selulase), mensintesis senyawa HCN dan senyawa siderofor, serta melarutkan fosfat, sehingga efektif dalam mengendalikan penyebab antraknosa.
Tujuan Penelitian
Percobaan ini bertujuan untuk mengevaluasi tingkat kefektifan beberapa agens antagonis seperti dalam mengendalikan dan menekan kejadian penyakit rebah kecambah pada cabai merah.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah diketahuinya
keefektifan beberapa agens antagonis dalam menekan pertumbuhan koloni patogen, sehingga dapat dikembangkan sebagai metode pengendalian hayati untuk
TINJAUAN PUSTAKA
Karakteristik Tanaman Cabai
Tanaman cabai (Capsicum annum L.) tergolong divisi Magnoliophyta, kelas Magnolipsida, ordo Solanales, Family Solanaceae, genus Capsicum. Beberapa spesies Capsicum antara lain Capsicum annum L., C. Pubescens Ruiz dan Pavon., C. frutescens L., C. chinensis Jacquin., dan C. pendulum Willdenow. Spesies C. annum L. banyak dibudidayakan dan penting secara ekonomis. Spesies ini mempunyai berbagai bentuk dan ukuran, meliputi rasa buah yang pedas dan manis (BPTS 1996).
Rubatzky dan Yamaguchi (1997), mengemukakan bahwa sistem perakaran cabai dangkal, diawali dengan akar tunggang (akar primer) kemudian tumbuh akar rambut ke samping (akar lateral atau akar sekunder). Panjang akar primer berkisar 35-50 cm dan akar lateral sekitar 35-45 cm. Akar lateral cepat berkembang di dalam tanah dan menyebar pada kedalaman 10-15 cm. Batang utama tegak, berkayu, dan bercabang banyak dengan tinggi sekitar 45-50 cm. pembentukan kayu pada batang utama mulai terjadi pada umur 30 hari setelah tanam (hst). Pada setiap ketiak daun akan tumbuh tunas baru yang dimulai pada umur 10 hst. Tipe percabangan tegak atau menyebar tergantung spesiesnya. Daun-daun tumbuh pada tunas samping secara berurutan, sedangkan pada batang utama tersebut tersusun secara spiral. Tanaman cabai mempunyai tangkai daun panjang, daun tunggal dengan helai daun berbentuk ovate atau lanceolate, agak kaku, berwarna hijau muda sampai hijau gelap dengan tepi rata.
Budidaya Tanaman Cabai
Cabai merah dapat dibudidayakan di dataran rendah maupun di dataran
tinggi, di lahan sawah ataupun di lahan tegalan. Keberhasilan dalam budidaya
tanaman cabai, selain perlu dipenuhi persyaratan tumbuh pokok yaitu keadaan
iklim dan tanah yang cocok untuk tanaman cabai, juga teknik budidaya yang tepat
perlu diketahui. Agar mampu tumbuh dengan optimal, tanaman cabai merah
untuk pertumbuhan dan pembungaannya adalah antara (21-27)oC dan untuk
pembuahannya antara (15.5-21)oC. Suhu udara yang paling cocok untuk
pertumbuhan cabai merah rata-rata adalah 16oC pada malam hari, dan minimum
23oC pada siang hari. Cabai merah tidak menghendaki curah hujan yang tinggi
atau iklim yang basah, karena pada keadaan tersebut tanaman akan mudah
terserang penyakit, terutama yang disebabkan oleh cendawan. Curah hujan yang
baik untuk pertumbuhan tanaman cabai adalah sekitar 600-1250 mm per tahun
(BPTS 1996).
Pertumbuhan tanaman cabai merah yang baik memerlukan mutu bibit yang baik, dan untuk mendapatkan bibit yang baik, diperlukan benih yang baik pula. Benih cabai merah yang baik dapat diperoleh dengan menyeleksi tanaman cabai merah yang akan diambil buahnya untuk benih. Benih yang berasal dari bagian tengah buah cabai yang telah matang penuh dapat menghasilkan tanaman cabai yang berproduksi tinggi. Sebelum disemai, benih cabai sebaiknya direndam dahulu dalam air panas (50oC) selama ± 1 jam untuk mempercepat perkecambahan. Benih disemai di tempat yang telah disiapkan. Media persemaian yang baik berupa campuran pupuk kandang yang telah matang dan tanah (1:1). Benih disemai dengan jarak 5 cm x 5 cm, lubang tanam sedalam 0.5-1 cm, kemudian ditutup dengan lapisan tanah yang halus, selanjutnya ditutup dengan daun pisang atau plastik. Setelah benih berkecambah, tutup daun pisang atau
plastik dibuka. Perkecambahan yang baik perlu temperatur antara (24-28)oC, sedangkan temperatur optimum untuk pertumbuhan bibit sampai dipindahkan ke lapangan antara (22-25)oC (BPTS 1996).
daun tanaman dan permukaan tanah kering sebelum malam hari untuk mencegah terjadinya rebah kecambah (BPTS 1996).
Penyakit Antraknosa
Penyakit antraknosa pada cabai yang dapat menyebabkan gejala rebah kecambah di persemaian disebabkan oleh genus Colletotrichum, terdiri atas lima spesies Colletotrichum gloeosporoides, C. capsici, C. dematium, C. cocodes, dan C. acutatum. Cendawan Colletotrichum gloeosporoides merupakan cendawan patogen penyebab antraknosa pada tanaman buah-buahan terutama di daerah tropis seperti Indonesia (Kelemu et al. 1997). Di Indonesia cendawan
Colletotrichum yang paling banyak menyerang pertanaman cabai adalah C. capsici dan C. gloeosporoides (Suryaningsih et al. 1996). Thaung (2008), juga
melaporkan bahwa cendawan Gloeosporium piperatum merupakan patogen yang dapat menyebabkan penyakit antraknosa pada cabai merah di Myanmar.
Sebaran Penyakit
Akhir-akhir ini diketahui bahwa patogen antraknosa banyak ditemukan menyerang pertanaman cabai di Indonesia. Hasil penelitian Widodo (2007), menunjukkan bahwa penyakit antraknosa pada cabai di Bogor, Brebes, Bandung, Pasir Sarongge, Payakumbuh, dan Mojokerto disebabkan oleh Colletotrichum gloeosporoides dan C. acutatum. Populasi C. gloeosporoides di lapangan 5-6 kali lebih banyak daripada populasi C. acutatum (Holliday 1980). Serangan cendawan Colletotrichum capsici dan C. gloeosporoides itu membuat buah berwarna kuning kecoklatan, mengerut, dan mengering (Suryaningsih et al. 1996).
Daur Penyakit
terbentuknya buah matang secara fisiologis. Selain itu patogen dapat mempertahankan diri pada sisa-sisa tanaman sakit. Selanjutnya konidia disebarkan oleh angin, benih atau tanah (Semangun 2000). Menurut Agrios (2005), patogen dapat terbawa benih dan mampu bertahan pada sisa tanaman, bersifat laten, dan sewaktu-waktu dapat aktif menginfeksi pada buah.
Gejala Penyakit Rebah Kecambah
Kehilangan hasil buah cabai merah yang disebabkan penyakit antraknosa ini bervariasi antara 21%-65%. Terdapat cendawan dominan yang dapat menyebabkan penyakit antraknosa pada cabai merah. Gejala penyakit ini berupa bercak kecil pada buah cabai. Selama musim hujan bercak ini berkembang cepat, bahkan pada lingkungan kondusif penyakit ini dapat menghancurkan seluruh areal pertanaman cabai (Syukur 2007).
Serangan pada benih menyebabkan kegagalan untuk berkecambah dan pada kecambah dapat menimbulkan rebah kecambah (damping off). Serangan pada tanaman dewasa menimbulkan mati pucuk (die back) dan infeksi lebih lanjut menyebabkan busuk kering pada batang (Suryaningsih et al. 1996). Pada daun dan batang muda mulai dari perkecambahan hingga pembungaan patogen tersebut dapat bersifat laten, kemungkinan patogen dapat aktif menginfeksi pada tahapan tertentu, biasanya pada buah yang mulai matang secara fisiologis (BPTS 1996).
Faktor yang Mempengaruhi Perkembangan Penyakit
Pengendalian Penyakit
Pengendalian terpadu lebih diutamakan dalam memperoleh hasil maksimal yaitu penerapan pengendalian secara kultur teknis, mekanis atau fisik, biologi, genetika dan kimia. Strategi utama dalam mengendalikan penyakit ini antara lain adalah dengan menggunakan benih tanaman yang sehat, menghindari terjadinya luka, meningkatkan kandungan bahan organik dalam tanah, dan pengendalian kimiawi dengan produk sistemik (Agrios 2005). Sinaga (2004), mengemukakan bahwa prinsip pengendalian penyakit secara tradisional yaitu penghindaran, eksklusi, eradikasi, proteksi, resistensi, dan terapi tetap dimanfaatkan untuk
digunakan menjadi taktik-taktik pengendalian dalam penyusunan suatu stategi pengendalian yang holistik.
Pengendalian Hayati
Pengendalian yang selalu dilakukan petani untuk menyelamatkan tanamannya yaitu dengan menggunakan pestisida senyawa kimia sintetis. Pestisida yang digunakan selain tidak khas terhadap spesies patogen tular tanah, juga belum tentu mampu mencapai lokasi patogen, kegagalan pengendalian ini didukung oleh kemampuan patogen dalam membentuk pertahanan diri serta mempunyai kisaran inang yang luas. Berdasarkan ekobiologi umumnya patogen,
maka pengendalian hayati berpeluang baik untuk berhasil (Sinaga 2004).
Sinaga (2006), mengemukakan bahwa aplikasi agens antagonis menunjukkan inisiasi langsung dalam menekan inokulum patogen, mencegah kolonisasi patogen, melindungi perkecambahan biji dan akar tanaman dari infeksi, selain itu agens antagonis dapat langsung menghambat patogen dengan sekresi antibiotik, berkompetisi terhadap ruang dan nutrisi, menginduksi proses ketahanan tanaman, serta interaksi langsung dengan patogen. Interaksi yang terjadi berupa hiperparasit, hiperpatogen melalui destruksi unit-unit propagatif (propagul) atau biomassa, sehingga dapat mengurangi kepadatan inokulum dan aktivitas patogen.
Trichoderma harzianum
Cendawan Trichoderma harzianum merupakan cendawan yang termasuk kelas Deuteromycetes. Agens antagonis T. harzianum memiliki aktivitas antifungal yang tinggi karena dapat memproduksi enzim litik dan antibiotik (antifungal). Selain itu, T. harzianum juga dapat berkompetisi dengan patogen dan dapat memacu pertumbuhan tanaman. Pada umumnya, T. harzianum banyak ditemukan di tanah hutan maupun tanah pertanian atau pada substrat berkayu. Cendawan ini merupakan agens biokontrol yang dapat hidup dalam ekosistem yang berbeda, dapat menyeimbangkan tanah, dan tidak berbahaya bagi organisme bermanfaat lainnya (Amin et al. 2010).
Widyastuti (2006), mengemukakan bahwa saat berada pada kondisi kaya
Morfologi secara mikroskopis untuk cendawan T. harzianum adalah konidiofor hialin, bercabang banyak, fialid tunggal atau dengan kelompok, konidia (phialospora) hialin, berwarna hijau, sel tunggal, oval, biasanya mudah dikenali dengan pertumbuhannya yang cepat, bersifat saprofitik di tanah atau pada
kayu, beberapa spesies dilaporkan bersifat parasit pada cendawan lain (Barnett dan Hunter 1998). Klamidospora berwarna cokelat kebulatan
(Watanabe 2002). Produk T. harzianum dapat mengontrol penyebab penyakit rebah kecambah atau penyakit pada akar tanaman hias dan bibit pohon kehutanan, dan dapat diaplikasikan pada benih untuk mengendalikan rebah kecambah (Whipps dan Lumsden 2001).
Gliocladium spp.
Cendawan Gliocladium spp. dapat mengendalikan beberapa patogen tular tanah. Cendawan tersebut dapat mengolonisasi mikroba patogen, sehingga mikroba patogen tidak dapat berkembang. Agens biokontrol Gliocladium spp. merupakan cendawan antagonis yang memiliki mekanisme hiperparasitisme dan dapat memproduksi bahan antifungi. Bahan antifungi yang dihasilkan Gliocladium spp. berupa antibiotik gliotoksin dan viridin yang dapat menekan perkembangan mikroba lain (Whipps dan Lumsden 2001).
Bacillus subtilis
Mikroba agens antagonis yang saat ini diketahui mempunyai potensi sebagai pengendali penyakit antraknosa pada cabai ialah Bacillus subtilis. Bakteri Bacillus subtilis bersifat antagonis terhadap penyakit tanaman yang disebabkan oleh bakteri atau cendawan, ditemukan di lingkungan tanah perkebunan bawang dan cabai. Bakteri ini menghasilkan antibiotik, diantaranya polymixin, difficidin, subtillin, dan mycobacillin yang mempunyai aktivitas fungisida dan digunakan sebagai agens biokontrol (Earl et al. 2008).
Bakteri B. subtilis memiliki kemampuan sebagai agens antagonis terhadap cendawan patogen secara in vitro karena mampu memproduksi zat aktif sebagai antifungi yang merupakan isomer dari senyawa iturin-A, diprodukasi secara ekstraseluler, stabil terhadap suhu panas, dan tidak larut dalam air maupun asam lemah. Senyawa iturin-A merupakan senyawa amina yang dapat mencegah sporulasi, menghambat pada tahap awal pertumbuhan cendawan patogen, sehingga konidia tidak terbentuk dan pada akhirnya pertumbuhan miselium menjadi steril (Gunawan 2005).
Di bagian proteksi Balai Penelitian Tanaman Sayuran (Balitsa) Lembang, Bacillus subtilis telah dibuat dalam bentuk formulasi biopestisida dengan nama Bs 001 50 WP. Berdasarkan penelitian Gunawan (2005), formulasi biopestisida Bs 001 50 WP berpotensi menekan intensitas penyakit antraknosa sebesar 2.67%
tidak berbeda nyata dengan perlakuan fungisida kimia Bi 1/48 WP sebesar 2.07%. Hal ini memberikan indikasi bahwa formula Bs 001 50 WP dapat digunakan sebagai biofungisida yang memiliki daya pengendalian penyakit antraknosa setara dengan fungisida kimia.
Pseudomonas fluorescens
Bakteri antagonis Pseudomonas fluorescens juga dapat menghasilkan metabolit seperti siderofor, hidrogen sianida, antibiotik, atau enzim ekstraselluler yang bersifat antagonis melawan patogen. Metabolit-metabolit tersebut berguna untuk memacu pertumbuhan tanaman (Hasanuddin 2003). Siderofor dapat menekan perkembangan patogen secara aktif dalam persaingan besi (Fe) karena senyawa ini memiliki berat molekul rendah dengan affinitas yang sangat kuat terhadap Fe (III). Beberapa penelitian menunjukkan bahwa siderofor berpendarfluor kuning kehijauan yang dihasilkan oleh pseudomonad pendarfluor disebut sebagai pseudobactin bermanfaat untuk pertumbuhan tanaman (Maleki et al. 2010).
Bakteri antagonis P. fluorescens merupakan salah satu golongan PGPR yang memiliki mekanisme biokontrol yang melibatkan produksi antibiotik berupa phenazine-1-carboxyclic acid, 2,4-diacetyl phloroglucinol, oomycin, pyoluteorin, pyrrolnitrin, kanosamine, zwittermycin-A, dan pantocin A (Fernando et al. 2005). Antagonisme bersifat kompetisi dan lisis. Kompetisi terjadi dalam pemanfaatan nutrisi dan ruang tumbuh, sedangkan lisis ditunjukkan dengan zona bening pada media tumbuh uji (Anik 2001). Beberapa strain dari P. fluorescens dapat menekan penyakit pada tanaman serta melindungi benih dan akar dari serangan cendawan tular tanah dan bakteri patogen (Corbell dan Loper 1995).
Agens biokontrol Pseudomonas fluorescens agak spesifik mengenai
kemampuannya untuk melindungi tanaman dari patogen tular tanah. Bakteri antagonis P. flourescens termasuk kedalam bakteri yang dapat ditemukan
dimana saja (ubiquitous), seringkali ditemukan pada bagian tanaman (permukaan daun dan akar), dan sisa tanaman yang membusuk, serta pada tanah dan air (Couillerot et al. 2008).
Botrytis cinerea, Altenaria kikuchiana, Fusarium oxysporum, F. solani, dan Phytophthora capsici (Kim et al. 2007).
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Percobaan dilaksanakan dari bulan Maret sampai bulan Juli 2012 di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Bahan Penelitian
Bahan-bahan yang digunakan pada percobaan berupa isolat cendawan antagonis hasil eksplorasi Prof. Meity Suradji Sinaga, yaitu Trichoderma harzianum (TH1), dan Gliocladium fimbriatum (G84), sedangkan isolat bakteri antagonis merupakan hasil penelitian dan eksplorasi Dr. Abdjad Asih Nawangsih, yaitu Pseudomonas fluorescens (P1), dan Bacillus subtilis (B12). Isolat cendawan patogen hasil isolasi dari buah dan benih cabai yang terinfeksi antraknosa, benih cabai besar varietas GELORA dengan merk dagang CAP MUTIARA BUMI, air steril, media Nutrient Agar (NA), media Potato Dextrose Agar (PDA), media Nutrient Broth (NB), NaOCl 1%, kompos steril, dan tanah steril.
Metode Penelitian
Isolasi dan Identifikasi Cendawan Patogen
Uji Antagonisme in vitro
Uji antagonisme in vitro antara agens antagonis dengan patogen dilakukan dengan menggunakan metode uji ganda pada media PDA. Agens antagonis Trichoderma harzianum (TH1), Gliocladium fimbriatum (G84), Bacillus subtilis (B12), dan Pseudomonas fluorescens (P1) diinokulasikan pada media PDA termodifikasi dengan jarak 3 cm dari koloni cendawan patogen. Tiap perlakuan dilakukan sebanyak 3 ulangan. Pengamatan dilakukan dengan mengukur jari-jari koloni cendawan patogen yang menjauhi koloni agens antagonis (R1) dan jari-jari koloni cendawan patogen yang mendekati agens antagonis (R2), serta menghitung penghambatan agens antagonis (H). Pengamatan dimulai 24 jam setelah kedua isolat uji diinokulasikan sampai hari kesepuluh setelah perlakuan.
Kemampuan Penghambatan
Besarnya pengaruh penghambatan agens antagonis terhadap patogen dihitung dengan menggunakan rumus persentase:
Keterangan :
P : Koloni cendawan patogen
A : Koloni cendawan antagonis
R1 : Jari-jari koloni patogen yang menjauhi koloni cendawan antagonis (mm)
R2 : Jari-jari koloni patogen yang mendekati koloni cendawan antagonis (mm)
H = (R1-R2) x 100% R1
Keterangan :
H : Persentase penghambatan agens antagonis (%)
R1 : Jari-jari koloni patogen yang menjauhi koloni agens antagonis (mm)
R2 : Jari-jari koloni patogen yang mendekati koloni agens antagonis (mm)
R2 A
3 cm R1 P
Catatan : bila koloni pertumbuhan patogen sudah tertutup oleh koloni agens antagonis, maka dianggap persentase penghambatan agens antagonis (H) = 100%.
Uji Keefektifan Agens Antagonis in vivo
Keefektifan penghambatan agens antagonis dilakukan secara in vivo pada kecambah cabai merah. Media tanam yang digunakan dalam polibag adalah kompos dan tanah steril (1:6). Uji keefektifan agens antagonis in vivo meliputi faktor dengan inokulasi dan tanpa inokulasi patogen. Perlakuan tunggal meliputi perlakuan kontrol (K), Trichoderma harzianum (TH1), Gliocladium fimbriatum (G84), Bacillus subtilis (B12), dan Pseudomonas fluorescens (P1), sedangkan perlakuan kombinasi meliputi (THB12), (THP1), (G84B12), (G84P1), (THG84), dan (B12P1). Setiap perlakuan dilakukan sebanyak 5 ulangan.
Aplikasi agens antagonis dilakukan melalui penyiraman suspensi langsung ke lubang tanam dan dengan perendaman benih dalam suspensi agens antagonis. Penyiraman suspensi dilakukan pada agens antagonis golongan cendawan yaitu Trichoderma harzianum (TH1) dan Gliocladium fimbriatum (G84), sedangkan perendaman benih dilakukan pada agens antagonis golongan bakteri yaitu Bacillus subtilis (B12) dan Pseudomonas fluorescens (P1). Suspensi agens antagonis golongan cendawan didapatkan dari hasil peremajaan biakan antagonis selama 7 hari. Biakan dalam cawan petri yang berumur 7 hari ditambahkan air steril sebanyak 10 ml kemudian digerus menggunakan spatula. Hasil gerusan diambil sebanyak 1 ml untuk dimasukkan ke dalam tabung reaksi yang berisi 9 ml air steril dengan menggunakan pipet volumetrik. Sebelum diaplikasikan jumlah konidia cendawan dihitung menggunakan haemasitometer, dan didapatkan hasil 1.18 x 107 konidia/ml untuk Gliocladium fimbriatum dan 1.23 x 107 konidia/ml untuk Trichoderma harzianum. Suspensi cendawan antagonis diaplikasikan langsung ke dalam lubang tanam.
pengenceran 10-8. Hasil pengenceran kemudian dilakukan plating untuk dihitung jumlah koloni pada tiap pengencerannya, dan didapatkan hasil untuk Bacillus subtilis sebanyak 1.85 x 109 CFU pada pengenceran 10-6 dengan kerapatan optik (OD) sebesar 0.61, sedangkan untuk Pseudomonas fluorescens dengan kerapatan optik 0.75 didapatkan hasil sebanyak 1.12 x 109 CFU pada pengenceran 10-5. Kerapatan optik (optical dencity) pada setiap isolat bakteri antagonis ditentukan dengan menggunakan spectrophotometer pada panjang gelombang 600 nm.
Aplikasi perendaman benih pada pengenceran yang telah ditentukan dan diketahui banyaknya koloni bakteri per unit, suspensi bakteri tersebut dituangkan ke dalam cawan petri yang telah berisi benih cabai dan ditunggu selama ± 1 jam untuk selanjutnya ditanam ke polibag dengan menanam 3 benih untuk masing-masing polibag. Perlakuan K, TH1, dan G84 dilakukan perendaman hanya pada air steril agar tidak terkontaminasi bakteri antagonis yang digunakan. Hal ini dilakukan karena perendaman benih berhubungan dengan budidaya cabai, yaitu untuk membantu terjadinya perkecambahan benih, benih cabai harus direndam terlebih dahulu dalam air sebelum di tanam.
Air steril sebanyak 10 ml dituangkan ke dalam biakan patogen kemudian digerus dengan menggunakan spatula. Hasil gerusan diambil sebanyak 1 ml dan dimasukan ke dalam tabung reaksi yang berisi 9 ml air steril. Suspensi patogen hasil peremajaan selama 7 hari kemudian dihitung kerapatan konidianya dengan menggunakan haemasitometer. Hasil perhitungan menunjukkan bahwa kerapatan konidia patogen sebanyak 2.5 x 105 konidia/ml. Inokulasi patogen dilakukan dengan penyiraman suspensi ke kecambah cabai pada hari ke 5 setelah aplikasi agens antagonis. Benih cabai dipelihara selama 21 hari, dan dilakukan pengamatan pada 6 hari setelah perlakuan (hsp) agens antagonis atau 1 hsp patogen dengan peubah yang diamati adalah daya kecambah benih, kejadian penyakit, tinggi kecambah, jumlah daun, dan vigor tanaman.
Kejadian penyakit (intensitas penyakit) dapat ditentukan dengan menggunakan rumus sebagai berikut:
KP = n x 100%
Keterangan:
KP : Kejadian penyakit (%)
n : Jumlah kecambah yang sakit
N : Jumlah kecambah yang diamati
Kecambah yang menunjukkan gejala rebah kecambah direisolasi untuk diidentifikasi lebih lanjut mengenai patogen yang menyebabkan rebah pada kecambah.
Rancangan Percobaan dan Analisis Data
Rancangan percobaan yang digunakan pada uji antagonisme in vitro adalah Rancangan Acak Lengkap (RAL). Masing-masing perlakuan dilakukan sebanyak 3 ulangan, sehingga terdapat 12 unit percobaan untuk uji antagonisme in vitro. Rancangan percobaan yang digunakan pada uji keefektifan agens antagonis in vivo adalah rancangan Faktorial RAL 11x2 dengan 2 faktor (faktor dengan inokulasi patogen dan faktor tanpa inokulasi patogen). Masing-masing perlakuan dilakukan sebanyak 5 ulangan, sehingga terdapat 110 unit percobaan. Data yang diperoleh dianalisis dengan Microsoft Office Excel 2007 dan analisis ragam (ANOVA) menggunakan program Statistical Analysis System (SAS) versi 9.1.3. Perlakuan yang berpengaruh nyata diuji lanjut dengan uji Duncan pada taraf
Isol n Gloeosporium sp. (identifikasi sementara) oni cendawan yang berwarna putih keabuan bang menjadi abu-abu tua, yang membentuk koni
bulat (Gambar 1), dan aservuli tidak disertai ke
olasi patogen pada media PDA: (A) Buah Caba knosa; (B) Koloni Gloeosporium sp.;
porium sp.; dan (D) Konidiofor Gloeosporium
ervulus (Gambar 1A) sebagai tempat terbentukn ng menempel pada ujungnya. Aservulus ini t il pengukuran panjang dan lebar konidia rata-r an konidia berwarna jingga atau merah jam rkan Barnet dan Hunter (1998), menunjukkan ium piperatum dan hasil identifikasi ini 2001), yang mengemukakan bahwa karakter
peratum mirip dengan karakteristik morfologi hwa koloni berwarna putih keabuan sampa
utama pada genus Colletotrichum dan Gloeosporium terletak pada keberadaan setae.
Rahayu (1994), mengemukakan bahwa pada genus Colletotrichum terdapat setae pada aservulus, sedangkan pada genus Gloeosporium tidak terdapat setae pada aservulus. Menurut Rumahlewang (2008) dan Hanlin (1989), konidia Gloeosporium piperatum hialin, bersel satu, bentuk konidia silindrik ujung membulat dengan panjang dan lebar konidia (15.5-18.6 x 5.4-6) m2, sedangkan bentuk konidia C. acutatum silindrik dengan ujung meruncing serta memiliki panjang dan lebar konidia (8.5-10 x 4.5-6) µm2.
Identifikasi berdasarkan metode konvensional atau berdasarkan
karakteristik morfologi memang cukup sulit untuk membedakan Gloeosporium piperatum dan Colletotrichum gloeosporoides (Freeman et al. 1998), sehingga hanya dilakukan identifikasi sementara. Identifikasi patogen tidak dilakukan lebih lanjut dengan menggunakan metode identifikasi molekuler karena percobaan ini tidak difokuskan pada identifikasi patogen penyebab rebah kecambah, namun difokuskan pada pengendalian rebah kecambah pada cabai merah.
Biakan murni patogen terus diremajakan untuk digunakan pada uji antagonisme in vitro dan uji keefektifan agens antagonis in vivo.
Uji Antagonisme in vitro
Tabel 1 Penghambata
atan secara in vitro (%) agens antagonis terhada . piperatum
huruf yang sama menunjukkan hasil yang tidak be an 5%).
k ragam menunjukkan bahwa perlakuan a menghambat patogen Gloeosporium piperat umbuhan koloni G. piperatum oleh isolat TH1
k isolat TH1 maupun G84 mampu menghamb hari) dengan keefektifan penghambatan sebesa
l penelitian Ajith dan Laksmidevi (2010), serta porkan bahwa Trichoderma spp. dan Gliocladi
patogen pada tanaman pertanian terutama pato apat menghasilkan antibiotik trichodermin dan
pertama nampak perkembangan koloni agens t koloni cendawan G. piperatum secara nyata. ganda memiliki diameter koloni yang beragam
Koloni agens
ns antagonis Trichoderma harzianum (TH1) d menunjukkan pertumbuhan yang cepat dan ha
rtumbuhan diameter koloni tercepat ditunjukka , sedangkan pertumbuhan diameter isolat TH1 2010), mengemukakan bahwa Trichoderma spp. da
ens biokontrol yang dengan cepat mampu meng kan aktivitas patogen dengan menghasilkan buhan koloni bakteri antagonis Bacillus subt
escens (P1) hampir sama dengan diameter koloni kontak langsung diantara kedua koloni.
antagonisme in vitro pada 10 hsp: (A) piperatum); (B) Isolat TH1; (C) Isolat G84; (D)
solat P1
ntara kedua koloni terjadi pada 6 hari setelah t TH1 dan G84 menunjukkan penghambatan um pada hari ke-3, pertumbuhan yang cepa
hiperparasitisme, lisis atau antibiosis, serta kom ni didukung oleh Zivcovic et al. (2010), yang
wan T. harzianum dan Gliocladium sp. mam n perkembangan koloni patogen antraknosa pada c
tumbuh koloni isolat TH1 dan isolat G84. Kedua isolat tersebut mengalami over growth terhadap G. piperatum. Sinaga et al. (1992), melaporkan bahwa isolat Gliocladium deliquescens (G-Muara) dan Gliocaldium fimbriatum (G84) mampu mengantagonis Colletotrichum capsici pada hari ke-3 setelah inokulasi dengan penghambatan rata-rata di atas 50% sehingga berpotensi sebagai agens pengendalian hayati penyakit antaknosa cabai.
Kemampuan penghambatan in vitro isolat Bacillus subtilis (B12) terhadap G. piperatum nampak jelas pada 10 hari setelah perlakuan (hsp) sebesar 95.433% (Tabel 1). Interaksi antara isolat B12 dengan G. piperatum memperlihatkan adanya zona penghambatan (Gambar 3D). Hal ini menunjukkan bahwa isolat
antagonis B12 mampu menghambat pertumbuhan koloni G. piperatum melalui mekanisme antibiosis atau lisis. Penghambatan oleh isolat B12 didukung oleh hasil penelitian Kusnadi et al. (2009), yang melaporkan bahwa isolat B. subtilis dapat menghasilkan metabolit sekunder iturin-A yang berperan sebagai anti cendawan dan aktif menghambat spesies-spesies cendawan dengan rentang yang luas melalui mekanisme lisis atau antibiosis.
Kemampuan penghambatan in vitro patogen oleh antagonis Pseudomonas fluorescens (P1) relatif rendah dan berbeda nyata dibandingkan ketiga agens antagonis lainnya (Tabel 1). Hartal et al. (2010), juga mengemukakan bahwa agens biokontrol Trichoderma sp. dan Gliocladium sp. memiliki kemampuan tumbuh yang lebih cepat dibandingkan agens biokontrol lain. Namun, Couilerot et al. (2008), melaporkan bahwa Pseudomonas fluorescens berpotensi sebagai agens biokontrol khususnya pada daerah perakaran sehingga lebih efektif apabila diaplikasikan langsung ke daerah perakaran. Yi et al. (2005) dan Than et al. (2008), juga mengemukakan bahwa isolat bakteri Bacillus spp. dan Pseudomonas fluorescens dapat menekan dan menghambat pertumbuhan koloni patogen penyebab antraknosa pada cabai merah.
U
Uji Keefektifan Agens Antagonis in vivo h kecambah pada perlakuan tanpa inokulasi a
pak pada 11 hari setelah perlakuan (hsp) da mun setelah 21 hsp kejadian penyakit rebah ke ejadian penyakit rebah kecambah pada 21 hs or kecambah cabai turun, hal ini karena pa
mudian kecambah rebah, layu dan akhirnya ma
rebah kecambah pada uji keefektifan agens ant si Gloeosporium piperatum: (A-G) Kontrol da nasi G84P1
h et al. (1996), melaporkan bahwa antraknos agalan untuk berkecambah, dapat menim ebah kecambah ditandai dengan mati pucuk da g. Kecambah yang menunjukkan gejala rebah disebabkan oleh Gloeosporium piperatum. H
melalui metode post
postulat Koch. Hasil reisolasi dan identifikasi bah kecambah adalah Gloeosporium piperatum nokulum yang diinokulasikan pada kecambah cabai.
n hasil reisolasi dari kecambah yang menunjukka bah: (A) Koloni Gloseosporium piperatum da
ratum
nunjukkan bahwa patogen Gloeosporium piperat anaman cabai dan dapat menyerang tanama (2008), melaporkan bahwa Gloeosporium pi enginfeksi tanaman cabai pada segala fase pe ai, termasuk menyebabkan rebah kecambah.
ifan agens antagonis in vivo dilakukan dengan nokulasi dan tanpa inokulasi patogen. Aplikasi
n inokulasi patogen bertujuan untuk mengeta lam menekan kejadian penyakit rebah kecam
agonis pada faktor tanpa inokulasi patogen oksik agens biokontrol uji terhadap kecambah caba
n sidik ragam (ANOVA), aplikasi agens antag kombinasi pada 21 hari setelah perlakuan (hs
patogen berpengaruh nyata terhadap daya k tinggi kecambah, dan jumlah daun kecambah, nokulasi patogen penggunaan agens antagonis ber
ambah benih, tinggi kecambah, dan jumlah da pengaruh nyata terhadap kejadian penyakit re
dua faktor berpengaruh nyata terhadap semu
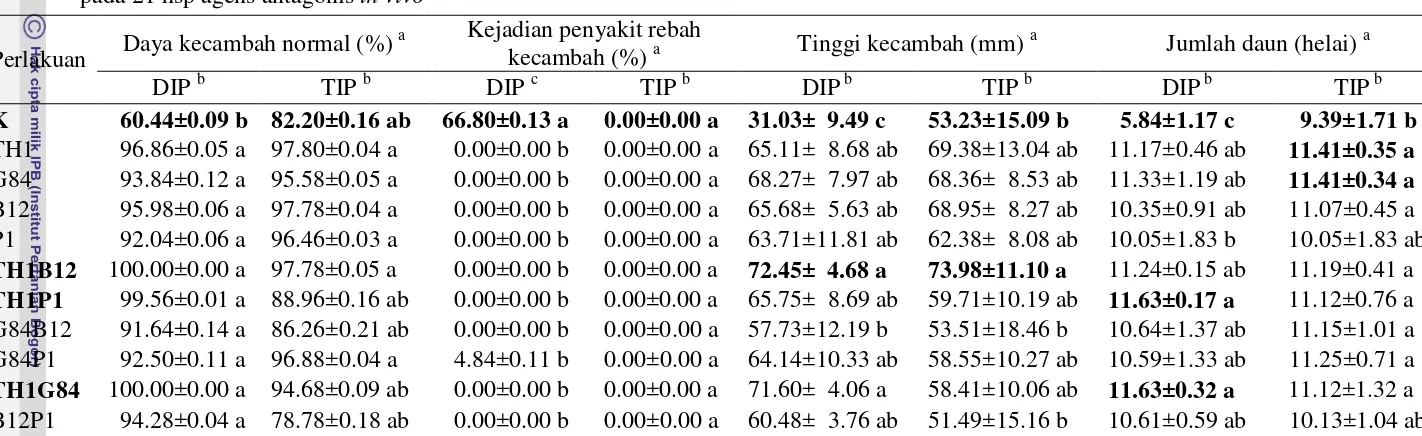
Tabel 2 Rerata daya kecambah normal (%), kejadian penyakit rebah kecambah (%), tinggi kecambah (mm), dan rerata jumlah daun kecambah cabai pada 21 hsp agens antagonis in vivo
Perlakuan Daya kecambah normal (%)
a Kejadian penyakit rebah
kecambah (%) a Tinggi kecambah (mm)
a
Jumlah daun (helai) a
DIP b TIP b DIP c TIP b DIP b TIP b DIP b TIP b
K 60.44±0.09 b 82.20±0.16 ab 66.80±0.13 a 0.00±0.00 a 31.03± 9.49 c 53.23±15.09 b 5.84±1.17 c 9.39±1.71 b
TH1 96.86±0.05 a 97.80±0.04 a 0.00±0.00 b 0.00±0.00 a 65.11± 8.68 ab 69.38±13.04 ab 11.17±0.46 ab 11.41±0.35 a
G84 93.84±0.12 a 95.58±0.05 a 0.00±0.00 b 0.00±0.00 a 68.27± 7.97 ab 68.36± 8.53 ab 11.33±1.19 ab 11.41±0.34 a
B12 95.98±0.06 a 97.78±0.04 a 0.00±0.00 b 0.00±0.00 a 65.68± 5.63 ab 68.95± 8.27 ab 10.35±0.91 ab 11.07±0.45 a P1 92.04±0.06 a 96.46±0.03 a 0.00±0.00 b 0.00±0.00 a 63.71±11.81 ab 62.38± 8.08 ab 10.05±1.83 b 10.05±1.83 ab
TH1B12 100.00±0.00 a 97.78±0.05 a 0.00±0.00 b 0.00±0.00 a 72.45± 4.68 a 73.98±11.10 a 11.24±0.15 ab 11.19±0.41 a
TH1P1 99.56±0.01 a 88.96±0.16 ab 0.00±0.00 b 0.00±0.00 a 65.75± 8.69 ab 59.71±10.19 ab 11.63±0.17 a 11.12±0.76 a G84B12 91.64±0.14 a 86.26±0.21 ab 0.00±0.00 b 0.00±0.00 a 57.73±12.19 b 53.51±18.46 b 10.64±1.37 ab 11.15±1.01 a G84P1 92.50±0.11 a 96.88±0.04 a 4.84±0.11 b 0.00±0.00 a 64.14±10.33 ab 58.55±10.27 ab 10.59±1.33 ab 11.25±0.71 a
TH1G84 100.00±0.00 a 94.68±0.09 ab 0.00±0.00 b 0.00±0.00 a 71.60± 4.06 a 58.41±10.06 ab 11.63±0.32 a 11.12±1.32 a B12P1 94.28±0.04 a 78.78±0.18 ab 0.00±0.00 b 0.00±0.00 a 60.48± 3.76 ab 51.49±15.16 b 10.61±0.59 ab 10.13±1.04 ab
a
Angka yang diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata (uji selang ganda Duncan 5%).
b
DIP = dengan inokulasi patogen, TIP = tanpa inokulasi patogen.
c
Angka yang diikuti huruf yang sama menunjukkan data hasil transformasi menggunakan Arcsin.
Daya kecambah benih pada perlakuan kontrol yang diinokulasikan patogen cukup tinggi yaitu sebesar 60.48%. Menurut Sinaga et al. (1992), daya kecambah benih dari cabai sakit yang masih cukup baik dapat membahayakan tanaman cabai karena peluang patogen terinfeksi laten sampai pembentukan buah akan semakin besar. Daya kecambah benih pada faktor tanpa inokulasi patogen menunjukkan rerata daya kecambah yang tinggi di setiap perlakuan.
Penggunaan agens antagonis menunjukkan persentase kejadian penyakit pada faktor dengan inokulasi patogen yang tidak berbeda secara nyata. Keefektifan agens antagonis terlihat pada setiap perlakuan agens antagonis yang menunjukkan persentase kejadian penyakit rebah kecambah sebesar 0% (Tabel 2). Kejadian penyakit pada setiap perlakuan agens antagonis berkorelasi negatif dengan perlakuan kontrol, sehingga persentase keefektifan agens antagonis dalam menekan kejadian penyakit rebah kecambah ialah sebesar 100%. Hal ini menunjukkan bahwa agens biokontrol uji sangat efektif dalam menekan kejadian penyakit rebah kecambah.
Penggunaan agens antagonis disamping dapat menginduksi ketahanan kecambah dalam menekan kejadian penyakit rebah kecambah, juga dapat meningkatkan vigor kecambah. Vigor kecambah yang meningkat terlihat pada rerata tinggi kecambah dan jumlah daun yang lebih baik dibandingkan tanpa penggunaan agens antagonis (kontrol).
Vigor kecambah yang baik pada faktor dengan inokulasi patogen diperlihatkan oleh tinggi kecambah pada perlakuan kombinasi TH1B12 serta jumlah daun pada perlakuan kombinasi TH1P1 dan TH1G84, sedangkan vigor kecambah terbaik pada faktor tanpa inokulasi patogen diperlihatkan oleh tinggi kecambah pada perlakuan kombinasi TH1B12 serta jumlah daun pada perlakuan tunggal TH1 dan G84 (Tabel 2).
viridin yang dapat m
kecambah pada 21 hsp: (A) Kontrol dengan inokul ontrol tanpa inokulasi patogen; (C) Perlakuan onis dengan inokulasi patogen; (D) Perlakuan onis tanpa inokulasi patogen; (E) Perlakuan kom onis dengan inokulasi patogen; dan (F) Perla
antagonis tanpa inokulasi patogen
al. (2006), juga mengemukakan bahwa sebag pu memproduksi enzim ekstraseluler (kitinase sis senyawa HCN dan senyawa siderofor, s fektif dalam mengendalikan penyebab antra dihasilkan rizobakteri tersebut disamping dapat ga dapat memacu pertumbuhan tanaman.
Penggunaan agens antagonis Trichoderma harzianum (TH1), Gliocladium fimbriatum (G84), Bacillus subtilis (B12), dan Pseudomonas fluorescens (P1) secara tunggal lebih efisien dibandingkan dengan penggunaan agens antagonis secara kombinasi (Tabel 2). Hal ini diperkuat oleh Than et al. (2008) dan Yi et al. (2005), yang melaporkan bahwa Bacillus subtilis dan Pseudomonas flourescens, serta isolat cendawan Trichoderma spp. efektif dalam menekan infeksi patogen penyebab antraknosa pada cabai. Aplikasi agens antagonis secara tunggal lebih efisien dibandingkan aplikasi agens antagonis secara kombinasi, hal ini berdasarkan rerata daya kecambah benih dan vigor kecambah. Rerata daya kecambah benih dan vigor kecambah pada perlakuan tunggal agens antagonis
KESIMPULAN DAN SARAN
Kesimpulan
Patogen antraknosa uji yang teridentifikasi sebagai Gloeosporium piperatum bersifat virulen terhadap kecambah cabai. Isolat agens antagonis Trichoderma harzianum (TH1), Gliocladium fimbriatum (G84), Bacillus subtilis (B12), dan Pseudomonas fluorescens (P1) secara in vitro efektif dalam menekan pertumbuhan koloni Gloeosporium piperatum berturut-turut sebesar 100%, 100%,
95.43%, dan 39.83%. Penggunaan agens antagonis secara in vivo baik perlakuan tunggal maupun perlakuan kombinasi sangat efektif dalam mengendalikan rebah kecambah, mampu meningkatkan vigor kecambah, serta tidak bersifat fitotoksik terhadap kecambah cabai. Aplikasi agens antagonis secara tunggal lebih efisien dibandingkan aplikasi secara kombinasi.
Saran
Perlu dilakukan penelitian lanjutan untuk mengevaluasi tingkat keefektifan
kombinasi agens antagonis T. harzianum, G. fimbriatum, B. subtilis, dan P. fluorescens terhadap penyakit antraknosa sampai tanaman cabai berbuah dalam
DAFTAR PUSTAKA
Agrios GN. 2005. Plant Pathology. 5th ed. London (UK): Elsevier Academic Press.
Ajith PS, Lakshmidevi N. 2010. Effect of volatile and nonvolatile compounds of Trichoderma spp. against Colletotrichum capsici incitant of anthracnose on bell peppers. Nature and Science. 8(9): 265-269.
Amin F, Razdan VK, Mohiddin FA. Bhat KA. Banday S. 2010. Potential of Trichoderma species as biocontrol agents of soil borne fungal propagules. J Phytol 2(10):38-41.
Anik S. 2001. Uji antagonisme Bacillus sp., Pseudomonas fluorescens B29, dan Trichoderma harzianum terhadap bakteri Pseudomonas Solanacearum E.F. Smith pada benih kacang tanah [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Bailey JA, O’Connel RJ, Pring, Nash C. 1992. Infection strategies of Colletotrichum spesies. Di dalam: Bailey dan Jegger, editor. Colletotrichum: Biology, Pathology, and Control. Wallingford (UK): CAB International. Hlm 88-120.
Barnett HL, Hunter BB. 1998. Ilustrated Genera of Imperfect Fungi. 4th ed. Minnesota (US): APS Press.
[BPS] Balai Pusat Statistik. 2012. Laporan Bulanan Data Sosial Ekonomi. Jakarta (ID): BPS.
[BPTS] Balai Penelitian Tanaman Sayuran. 1996. Teknologi Produksi Cabai Merah. Lembang (ID): BPTS.
Corbell N & Loper JE. 1995. Global regulator of secondary metabolite production in Pseudomonas fluorescens Pf-5. Journal of Bacteriology.177(21):6230-6236.
Couillerot O, Combaret CP, Mellado JC, Loccoz YM. 2008. Pseudomonas fluorescens and closely related Pseudomonas fluorescens as biocontrol agents of soil borne phytopathogens. Journal compilation. 48: 505–512. Earl AM, Losick R, Kolter R. 2008. Ecology and genomics of Bacillus subtilis.
Trends in Microbiology. 16(6): 269-276.
Fernando DWG, Nakkeeran S, Zhang Y. 2005. Biosynthesis of antibiotics by PGPR and its relation in biocontrol of plant disease. Di dalam: Siddiqui ZA, editor. PGPR: Biocontrol and Biofertilization. Aligarh: Springer. Hlm 67-109.
Gunawan OS. 2005. Uji efektivitas biopestisida sebagai pengendali biologi terhadap penyakit antraknosa pada cabai merah. Jurnal Hortikultura. 15(4): 297-302.
Hanlin RT. 1989. Illustrated Genera of Ascomycetes Volume I. Minnesota (US): APS Press.
Hartal, Misnawaty, Budi I. 2010. Efektifitas Trichoderma sp. dan Gliocladium sp. dalam pengendalian layu Fusarium pada tanaman krisan. JIPI. 12(1): 7-12. Hasanuddin. 2003. Peningkatan peranan mikroorganisme dalam sistem pengendalian tumbuhan secara terpadu. USU digital library 1[internet]. [diunduh 2012 September 24]. Tersedia pada: http//library.usu.ac.id/download/fp/fp-hasanuddin.pdf.
Holliday P. 1980. Fungus Disease of Tropical Crops. Cambridge. Melbourne Sidney (AU): University Press.
Istikorini Y. 2006. Efektifitas cendawan endofit untuk mengendalikan penyakit antraknosa, meningkatkan pertumbuhan dan hasil cabai (Capsicum annum L.) [skripsi]. Bogor (ID): Fakultas Pertanian, Institut Pertanian Bogor. Kelemu S, Badel JL, Moreno CX, Miles JW, Cakhraborty S, Ferdinandes CD,
Charchar MJ. 1997. Biodiversity, epidemiology and virulence of Colletotrichum gloeosporoides. Tropical Grasslands. 31(1): 387-392. Kim JD, Kim B, Lee CG. 2007. Alga lytic activity of Pseudomonas fluorescens
against the red tide causing marine alga Heterosigma akashiwo. Biological Control. 41(1): 296-303.
Krik PM, Cannon PF, David JC, Stalpers JA. 2001. Dictionary of The Fungi. 9th ed. Wallingford (UK): CABI Publising.
Kusnadi, Sutarya R, Munandar A. 2009. Pengaruh biofungisida Bacillus subtilis dan mulsa terhadap serangan penyakit antraknosa pada cabai merah (Capsicum annum L.). Biosainstifika. 1(2): 124-138.
Maleki M, Mostafaee S, Mokhtarnejad L, Farzaneh M. 2010. Characterization of Pseudomonas fluorescens strain CV6 isolated from cucumber rhizosphere in Varamin as a potential biocontrol agent. Crop Science. 4(9): 676-683. Mattjik AA, Sumertajaya M. 2006. Perancangan Percobaan dengan Aplikasi
SAS dan Minitab. Bogor (ID): Institut Pertanian Bogor Press.
Mueller GM, Bills GF, Foster MS. 2004. Biodiversity of Fungi Inventory and Monitoring Methods. London (UK): Elsevier Academic Press, Inc.
Mukerji KG, Garg KL. 2000. Biocontrol of Plant Diseases Volume I. Florida (US): CRC Press, Inc.
Rubatzky VE, Yamaguchi M. 1997. World Vegetables. Principles, Production, and Nutritive Values. 2nd ed. Chapman and Hall. New York (US). Hlm 843.
Rumahlewang W. 2008. Penyakit penting tanaman sayuran [internet]. [diunduh 2012 Agustus 29]. Tersedia pada: file:///C:/Documents %20and%20Settings/user/Desktop/KLINIK%20TANAMAN%20%28Wil helmina%20Rumahlewang,%20SP,MP%29%20%20Penyakit%20Penting %20Tanaman%20Sayuran.htm.
Semangun H. 2000. Penyakit-Penyakit Tanaman Perkebunan di Indonesia. 4th ed. Yogyakarta (ID): Gadjah Mada University Press.
Sinaga MS, Widodo, Poernomo BWS, Supramana. 1992. Kemungkinan pengendalian hayati bagi Colletotrichum capsici (Syd.) Butl. et Bisby penyebab antraknosa pada cabai. Di dalam: Bappenas, editor. Laporan akhir penelitian pendukung PHT dalam rangka pelaksanaan program nasional pengendalian hama terpadu. Kerjasama Prasarana Fisik Bappenas dengan Fakultas Pertanian IPB; Bogor (ID), 1992 Apr. Hlm 1-29.
Sinaga MS. 2004. Strategi pengelolaan penyakit penting tanaman karet di Indonesia pada masa mendatang. Di dalam: Situmorang et al., editor. Strategi Pengelolaan Penyakit Tanaman Karet untuk Mempertahankan Potensi Produksi Mendukung Industri Perkaretan Indonesia Tahun 2020. Prosiding Pertemuan Teknis; Palembang (ID), 2004 Okt 6-7. Pusat Penelitian Karet. Hlm 11-20.
Sinaga MS. 2006. Dasar-Dasar Ilmu Penyakit Tumbuhan. 2nd ed. Jakarta (ID): Penebar Swadaya.
Sreekanth D, Sushim GK, Syed A, Khan BM, Ahmad A. 2011. Molecular and morphological characterization of a taxol producing endophytic fungus, Gliocladium spp., from Taxus baccata. Mycobiology. 39(3): 151-157.
Suharno. 2001. Pengujian keefektifan Pseudomonas fluorescens B29 dan Bacillus sp. dalam menekan penyakit hawar daun bakteri pada padi varietas IR-64 [tesis]. Bogor: Institut Pertanian Bogor.
Suryaningsih E, Sutarya R, Duriat As. 1996. Penyakit tanaman cabai merah dan pengendaliannya. Di dalam: Duriat et al., editor. Teknologi produkasi tanaman cabai. Bandung (ID): Balitsa Lembang.
Sutariati GAK, Widodo, Sudarsono, Ilyas S. 2006. Karakter fisiologis dan keefektifan isolat rizobakteri sebagai agens antagonis Colletotrichum capsici dan rizobakteri pemacu pertumbuhan tanaman cabai. Jurnal Ilmiah Pertanian KULTURA. 41(1): 28 – 34.
Syukur M. 2007. Mencari Genotip Cabai Tahan Antraknosa. Bogor (ID): IPB press.
Thaung MM. 2008. Biodiversity survey of Coelomycetes in Burma. Australasian Mycologist. 27 (2): 74-110.
Watanabe T. 2002. Pictorial Atlas of Soil and Seed Fungi. 2nd ed. Florida (US): CSC Press.
Wharton PS, Uribeondo JD. 2004. The biology of Colletotrichum acutatum. Anales del Jardin Botanico de Madrid (ESP). 61: 3-22.
Whipps JM, Lumsden RD. 2001. Commercial Use of Fungi as Plant Disease Biological Control Agents: Status and Prospects. Di dalam: Butt et al., editor. Fungi as Biocontrol Agents Progress, Problems and Potential. New York (US): CABI Publishing. Hlm 1-21.
Widyastuti SM. 2006. The biological control of Ganoderma root rot by Trichoderma. Di dalam: Potter et al., editor. Heart rot and root rot in tropical Acacia plantations. Proceedings of a Workshop Held; Yogyakarta (ID), 2006 Feb 7–9. Canberra (AU): ACIAR Proceedings. 124: hlm 67-74. Widodo, Sinaga MS, Anas I, Machmud M. 1993. Penggunaan Pseudomonas spp.
kelompok fluorescens untuk pengendalian penyakit akar gada (Plasmodiophora brassicae Wor.) pada caisin (Brassica campestris L. var chinensis (Rupr) Olson). Buletin Hama dan Penyakit Tumbuhan. 6(2): 94-105.
Widodo. 2007. Status of Chili Anthracnose in Indonesia. First International Symposium on Chili Anthracnose. Seoul National University. Seoul. Korea. 2007 Sep 17-19.
Yani A. 2009. Control of post harvest fungal infection Colletotrichum capsici cause anthracnose at chilli fruit (Capsicum annum L.) [abstrak]. Di dalam: Koleksi Teknologi Pertanian Tepat Guna; 2009 Okt 18; Lampung (ID) [internet]. [diunduh 2012 Mei 24]; Tersedia pada: file:///C:/Documents%20and%20Settings/user/My%20Documents/net/hhd %20b.htm.
Yurnalis. 2006. Pengaruh aplikasi pupuk organik dan pupuk anorganik terhadap pertumbuhan, produksi serta mutu benih kacang tanah (Arachis hypogaea L.) [disertasi]. Bogor (ID): Fakultas Pertanian, Institut Pertanian Bogor. Yi Y, Kim H, Choi GJ, Cho KY, Lim Y. 2005. Antifungal activity of Bacillus sp.
against pepper anthracnose. Biotecnhology. 48 (3): 151-152.
Lampiran 1 Vigor kecambah cabai pada uji keefektifan agens antagonis in vivo.
Keterangan: (A) Perlakuan agens antagonis dengan diinokulasikan patogen dan (B) Perlakuan agens antagonis tanpa diinokulasikan patogen.
A
Lampiran 2 Pertumbuhan jari-jari koloni patogen G. piperatum pada media PDA termodifikasi.
Perlakuan
Jari-jari G. piperatum (mm)
Hari ke- 1 2 3 4 5 6 7 8 9 10
R1 R2 R1 R2 R1 R2 R1 R2 R1 R2 R1 R2 R1 R2 R1 R2 R1 R2 R1 R2
Kontrol 3.50 3.50 5.00 5.00 11.00 11.00 14.00 14.00 17.50 17.50 23.50 23.50 28.00 28.00 31.00 31.00 34.50 34.50 34.50 34.50
TH1 1 2.00 1.00 6.00 5.00 7.00 5.00 8.00 5.00 6.50 5.00 7.00 3.50 6.00 3.00 6.00 0.00 5.00 0.00 4.00 0.00
TH1 2 3.00 1.00 6.00 4.00 9.00 5.00 11.00 5.00 10.00 5.00 11.00 4.50 11.00 4.50 10.00 0.00 9.00 0.00 3.00 0.00
TH1 3 3.00 2.00 5.50 4.50 1.00 5.00 11.00 5.00 10.00 4.50 10.00 4.50 10.00 4.50 10.00 0.00 9.00 0.00 8.00 0.00
G84 1 3.00 1.00 7.00 5.00 9.00 5.00 9.00 5.00 9.00 5.00 9.00 5.00 9.00 5.00 8.00 0.00 8.00 0.00 5.00 0.00
G84 2 2.00 1.00 6.00 4.00 8.00 5.00 10.00 4.00 10.00 4.00 10.00 4.00 9.00 3.50 8.00 0.00 8.00 0.00 5.00 0.00
G84 3 2.00 1.00 6.00 4.00 7.00 3.00 7.00 3.00 8.00 3.00 8.00 2.50 7.00 2.00 7.00 0.00 6.00 0.00 2.00 0.00
B12 1 2.00 1.00 6.00 5.00 10.00 9.00 14.00 11.00 12.00 11.00 20.00 11.00 24.00 12.00 28.00 2.00 28.00 2.00 30.00 2.00
B12 2 2.00 1.00 6.00 5.00 10.00 9.00 13.00 11.00 18.00 11.00 21.00 11.00 25.00 11.00 28.00 1.00 28.00 1.00 30.00 1.00
B12 3 2.00 1.00 6.50 5.00 11.00 8.00 14.00 10.00 19.00 9.00 21.00 10.00 23.00 10.00 29.00 3.00 28.00 3.00 28.00 3.00
P1 1 1.00 1.00 6.00 6.00 10.00 9.00 14.00 13.00 17.00 17.00 22.00 21.00 26.00 24.00 30.00 18.00 30.00 18.00 30.00 18.00
P1 2 2.00 1.00 7.00 5.50 10.00 9.00 14.00 14.oo 18.00 18.00 22.00 22.00 25.00 24.00 28.00 16.00 30.00 16.00 30.00 16.00
P1 3 3.00 1.00 7.00 6.00 10.00 9.00 14.00 13.50 17.00 17.00 21.00 21.00 25.00 25.00 28.00 19.00 30.00 19.00 30.00 19.00
Lampiran 3 Persentase penghambatan agens antagonis (%) terhadap pertumbuhan koloni G. piperatum pada media PDA termodifikasi.
Lampiran 4 Hasil analisis ragam (ANOVA) uji antagonisme in vitro pada PDA.
SK DB JK KT F-hitung Pr > F
Lampiran 5 Hasil analisis ragam (ANOVA) dari daya kecambah benih normal (%) pada uji keefektifan agens antagonis in vivo.
SK DB JK KT F-hitung Pr > F
Perlakuan Ulangan Persesntase penghambatan (%)
Lampiran 6 Hasil analisis ragam (ANOVA) dari kejadian penyakit rebah kecambah (%) pada uji keefektifan agens antagonis in vivo.
SK DB JK KT F-hitung Pr > F
Perlakuan 21 0.37814269 0.01800679 11.028 <.0001 Dengan patogen 10 0.17684589 0.01768459 10.831 <.0001 Tanpa patogen 1 0.00000000 0.00000000 0.000 <.0001 Interaksi 10 0.17684589 0.01768459 10.831 <.0001
Galat 67 0.10939240 0.00163300
Total 109 0.84112700
Lampiran 7 Hasil analisis ragam (ANOVA) dari tinggi kecambah normal (mm) pada uji keefektifan agens antagonis in vivo.
SK DB JK KT F-hitung Pr > F
Perlakuan 21 9209.486 418.61300 2.931 <.0001 Dengan patogen 10 7043.129 704.31290 4.931 <.0001 Tanpa patogen 1 14.589 14.58900 0.102 0.7150 Interaksi 10 2151.766 215.17669 1.507 0.0451 Galat 67 9569.521 142.82870
Total 109 27988.490
Lampiran 8 Hasil analisis ragam (ANOVA) dari jumlah daun kecambah (helai) pada uji keefektifan agens antagonis in vivo.
SK DB JK KT F-hitung Pr > F
Perlakuan 21 157.45075 7.4976546 5.437 <.0001 Dengan patogen 10 120.89844 12.0898436 8.767 <.0001 Tanpa patogen 1 4.03586 4.0358627 2.927 0.0531 Interaksi 10 32.51645 3.2516447 2.358 0.0020 Galat 67 92.39264 1.3789950
Effectiveness of Antagonist Agents in Controlling Red Pepper Damping Off
AW Salim and MS Sinaga
Department of Plant Protection
Faculty of Agricultural, Bogor Agricultural University, Bogor
Oneof the major problems during cultivating of chilli is antrachnose disease. The
cause of chili anthracnose can various as Colletotrichum acutatum, C. gloeosporoides, and Gloeosporium piperatum. Pathogens can cause seed
decay, damping off, and anthracnose fruit rot. The objective of experiment is to evaluate the effectiveness of several antagonist agents in controlling damping off disease. The identification results show that the cause of anthracnose which can be isolated from the seeds and chilies are Gloeosporium piperatum. Antagonist agent Trichoderma harzianum (TH1), Gliocladium fimbriatum (G84), Bacillus subtilis (B12), and Pseudomonas fluorescens (P1) can inhibited the growth of pathogen colonies in vitro as 100%, 100%, 95.43%, and 39.83%. In the in vivo test is known that isolates TH1, G84, B12, and P1 is very effective (100%) in the controlling of chili damping off. Both of single treatment or combination treatment antagonist agents were not different significantly to control the damping off disease. The fourth of antagonist agents are very potential in controlling the damping off disease of red pepper germination.
AGUS WAHID SALIM. Keefektifan Agens Antagonis Dalam Pengendalian Rebah Kecambah Cabai Merah. Dibimbing oleh MEITY SURADJI SINAGA.
Salah satu permasalahan utama dalam budidaya cabai adalah penyakit antraknosa. Penyebab antraknosa pada cabai dapat berbeda-beda seperti Colletotrichum acutatum, C. gloeosporioides, dan Gloeosporium piperatum. Patogen dapat menyebabkan busuk benih, rebah kecambah dan busuk buah antraknosa. Tujuan utama dari percobaan ini adalah untuk mengkaji keefektifan beberapa agens antagonis dalam mengendalikan penyakit rebah kecambah. Hasil identifikasi menunjukkan bahwa penyebab antraknosa yang dapat diisolasi dari benih dan buah cabai adalah Gloeosporium piperatum. Agens antagonis Trichoderma harzianum (TH1), Gliocladium fimbriatum (G84), Bacillus subtilis (B12), dan Pseudomonas fluorescens (P1) berturut-turut menghambat pertumbuhan koloni patogen secara in vitro sebesar 100%, 100%, 95,43%, dan 39.83%. Pada uji in vivo diketahui bahwa isolat TH1, G84, B12, dan P1 sangat efektif (100%) dalam mengendalikan rebah kecambah cabai. Baik perlakuan tunggal maupun perlakuan kombinasi agens antagonis tidak berbeda secara nyata dalam mengendalikan penyakit rebah kecambah. Keempat agens antagonis sangat potensial dalam mengendalikan penyakit rebah kecambah pada persemaian cabai merah.
PENDAHULUAN
Latar Belakang
Cabai merah (Capsicum annum L.) merupakan suatu komoditas sayuran yang tidak dapat ditinggalkan masyarakat Indonesia dalam kehidupan sehari-hari. Selain memiliki kandungan gizi yang cukup tinggi, cabai telah menjadi bumbu utama dalam masakan orang Indonesia, sehingga sangat potensial secara ekonomis. Pemanfaatan cabai sebagai bumbu masak, bahan baku berbagai industri makanan, minuman dan obat-obatan, serta pemasarannya dalam bentuk segar dan olahan menambah pentingnya komoditas tersebut untuk diusahakan.
Produksi cabai besar di Indonesia pada tahun 2011, yaitu sebesar 888.852 ribu ton dengan luas area panen 121.063 ribu hektar, dan rerata produktivitas sebesar 7.34 ton per hektar. Hal ini menunjukkan bahwa terjadi kenaikan produksi sebesar 81.692 ribu ton (10.12%) dibandingkan produksi cabai besar pada tahun 2010. Kenaikan tersebut disebabkan oleh peningkatan produktivitas sebesar 0.76 ton per hektar (11.55%) dengan keadaan luas panen terjadi penurunan sebesar 1.692 ribu hektar (1.38%). Peningkatan produksi cabai besar tahun 2011, berdasarkan presentase menurut wilayah peningkatan produksi di Pulau Jawa sebesar 15.424 ribu ton (45.67%), sedangkan untuk luar Pulau Jawa peningkatannya sebesar 66.268 ribu ton (54.33%) (BPS 2012).
cukup tinggi yaitu mencapai 80%, sedangkan pada musim kemarau jauh lebih rendah yaitu berkisar 20% sampai 35% (Widodo 2007).
Patogen antraknosa dapat terbawa benih dan menyebabkan busuk benih, rebah kecambah, serta busuk buah antraknosa (Bailey et al. 1992). Serangan pada benih menyebabkan kegagalan untuk berkecambah dan pada kecambah dapat menimbulkan rebah kecambah (damping off). Serangan pada tanaman dewasa menimbulkan mati pucuk (die back) dan infeksi lebih lanjut menyebabkan busuk kering pada batang (Suryaningsih et al. 1996). Pada daun dan batang muda mulai dari perkecambahan hingga pembungaan patogen tersebut dapat bersifat laten, kemudian patogen dapat aktif menginfeksi pada tahapan tertentu, biasanya pada buah yang mulai matang secara fisiologis (BPTS 1996). Selain itu, penyebab antraknosa ini dapat mempertahankan diri pada sisa-sisa tanaman sakit dan selanjutnya konidia disebarkan oleh angin, benih atau tanah (Semangun 2000).
Mukerji dan Garg (2000), menyatakan bahwa pada umumnya pengendalian penyakit antraknosa termasuk rebah kecambah pada cabai merah masih bergantung kepada fungisida. Dampak penggunaan fungisida secara luas dan terus menerus menyebabkan munculnya strain-strain cendawan yang tahan terhadap fungisida, sehingga perlu konsep pengendalian secara terpadu. Pada pengendalian penyakit secara terpadu budidaya tanaman sehat dan pengendalian hayati diprioritaskan.