KARAKTERISTIK
FERMENTASI
IN VITRO RANSUM
MENGANDUNG
50%
PROTEIN
ASAL
UREA
YANG
DISUPLEMENTASI
KROMIUM
ATAU
KOBALT
SKRIPSI
DHIKI MARDIANA JANUARI
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
RINGKASAN
Dhiki Mardiana Januari. D24080227. 2012. Karakteristik Fermentasi In Vitro
Ransum Mengandung 50% Protein Asal Urea yang Disuplementasi Kromium atau Kobalt. Skripsi. Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Prof. Dr. Ir. Toto Toharmat, M.Agr.Sc Pembimbing Anggota : Dr. Ir. Heri Ahmad Sukria, M.Sc
Urea merupakan salah satu contoh nitrogen bukan protein (NBP) yang biasanya ditambahkan pada pakan ruminansia sebagai sumber nitrogen untuk pembentukan protein mikroba, namun untuk mencapai utilisasi yang optimum dari urea diperlukan unsur mikro seperti kromium (Cr) dan kobalt (Co). Unsur Cr essensial bagi mikroba rumen karena merupakan komponen GTF (glucose tolerance factor) yang dapat meningkatkan pengambilan glukosa dari lingkungannya dan dapat menurunkan efek negatif antibakteri. Bakteri rumen menggunakan Co dalam sintesis
vitamin B12. Dalam struktur molekul vitamin B12 yang kompleks, Co berada pada
pusat dari cincin tetra-ring porphryn. Pada sel mamalia, vitamin B12 berfungsi sebagia kofaktor enzim methylmalonyl-CoA mutase dalam mengkonversi
methylmalonyl-CoA menjadi succinyl-CoA yang merupakan intermediat dalam produksi asam propionat. Mineral mikro memiliki kisaran kadar dalam ransum antara keracunan dan kekurangan yang sangat sempit sehingga interaksinya dengan minneral lain sangat menentukan kecukupan mineral tersebut. Suplementasi mineral mikro dalam bentuk organik dapat mengurangi pengaruh negatif adanya interaksi dengan mineral lain.
Terkait dengan hal tersebut maka penelitian ini dilakukan untuk membandingkan pengaruh perlakuan penambahan unsur Cr atau Co dalam bentuk organik maupun inorganik pada utilisasi nitrogen secara in vitro. Penelitian ini menggunakan Rancangan Acak Lengkap dengan 4 ransum perlakuan dan 6 waktu pengamatan. Perlakuan yang diuji yaitu: P1 = ransum basal + Cr organik 3 ppm, P2 = ransum basal + Cr anorganik 3 ppm, P3 = ransum basal + Co organik 3 ppm, P4 = ransum basal + Co anorganik 3 ppm. Peubah yang diukur adalah kecernaan bahan kering (KCBK) dan bahan organik (KCBO), kadar volatile fatty acids (VFA) dan N-NH3 filtrat media fermentasi. Data yang diperoleh diuji dengan analisa deskriptif.
Perlakuan penambahan Cr organik pada ransum memberikan hasil yang paling baik terhadap konsentrasi VFA , koefisien cerna bahan kering dan bahan organik. Dibandingkan perlakuan lainnya. Namun penambahan mineral Cr organik, Cr anorganik, Co organik, dan Co anorganik tidak memepengaruhi laju penggunaan NH3 untuk sintesa protein mikroba.
ABSTRACT
In Vitro Fermentation Characteristics of Ration Containing 50% Protein Based Urea and Supplemented with Chromium or Cobalt.
Januari, D. M., T. Toharmat and H. A. Sukria
Urea is one of non protein nitrogen (NPN) source usually added in ruminant diet as nitrogen source for the formation of microbial protein. Chromium (Cr) and Cobalt (Co) are essential mineral for rumen microbe, therefore to achieve optimum utilization of urea is needed micro elements. Dietary micro minerals indicates a narrow range between toxicity and deficiency level. Therefore there are many factors dictating the status of the micro mineral. Micro-mineral supplementation in organic forms reduces the interaction effects among minerals. The purpose of research was to evaluate the effect of Cr and Co supplementation on fermentation charactyeristics of a diet containing 50% protein based urea. The data obtained by descriptive explanation. The result showed that the concentration of N-NH3 was not different among treatments. Dietary supplementation of Cr organic improved ruminal fermentability and dietary urea utilization of the ration resulted in the increase in dry and organic matter digestibility. The conclusion was Cr organic supplementation improved ruminal fermentability and dietary urea utilization of the ration resulted in the increase in dry and organic matter digestibility.
KARAKTERISTIK
FERMENTASI
IN VITRO RANSUM
MENGANDUNG
50%
PROTEIN
ASAL
UREA
YANG
DISUPLEMENTASI
KROMIUM
ATAU
KOBALT
DHIKI MARDIANA JANUARI D24080227
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
Judul : Karakteristik Fermentasi In Vitro Ransum Mengandung 50% Protein Asal Urea Yang Disuplementasi Kromium atau Kobalt
Nama : Dhiki Mardiana Januari NIM : D240802227
Menyetujui, Pembimbing Utama,
(Prof. Dr. Ir. Toto Toharmat, M.Agr.Sc.) NIP. 19590902 198303 1 003
Pembimbing Anggota,
(Dr. Ir. Heri Ahmad Sukria, M.Sc.) NIP. 19660705 199103 1 003
Mengetahui, Ketua Departemen,
Ilmu Nutrisi dan Teknologi Pakan
(Dr. Ir. Idat Galih Permana, M.Sc.Agr) NIP. 19670506 199103 1 001
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 19 Januari 1991 di Teluk Betung, Bandar Lampung. Penulis merupakan anak terakhir dari dua bersaudara pasangan Widodo Soepardi, B.Sc dan Septrida Maria, BBA.
Penulis memperoleh pendidikan yang dimulai pada tahun 1996 di SDN 2 Rawalaut, Bandar Lampung dan lulus pada tahun 2002, kemudian penulis melanjutkan pendidikan di SMP Negeri 4 Bandar Lampung dan lulus pada tahun 2005 dan melanjutkan pendidikan Sekolah
Menengah Atas di SMA Negeri 53 Jakarta dan lulus pada tahun 2008. Pada tahun 2008 penulis diterima di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih Departemen Nutrisi dan Teknologi Pakan sebagai major dan minor pada bidang keahlian Budidaya dan Pengolahan Hasil Ternak Pedaging.
KATA PENGANTAR
Puji syukur yang senantiasa dipanjatkan kepada Allah SWT atas limpahan rahmat dan karuniaNya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi sebagai tugas akhir pada Fakultas Peternakan IPB. Skripsi tersebut berjudul “Karakteristik Fermentasi In Vitro Ransum Mengandung 50% Protein Asal Urea yang Disuplementasi Kromium atau Kobalt ” yang bertujuan untuk mengkaji pengaruh suplementasi kromium atau kobalt baik dalam bentuk organik maupun inorganik pada fermentasi senyawa nitorgen in vitro. Protein merupakan salah satu komponen pakan yang penting dalam mendukung metabolisme tubuh ternak. Pakan yang dijadikan sumber protein umumnya memiliki harga yang mahal dan akan megalami degradasi pada rumen ternak ruminansia. Namun ternak ruminansia memiliki kemampuan untuk mengkonversi nitrogen menjadi protein mikroba yang nantinya akan dijadikan sumber protein. Sintesis protein oleh mikroba dalam rumen ternak ruminansia dapat berjalan dengan sempurna jika nutrien lain cukup tersedia termasuk mineral mikro. Penelitian ini merupakan lanjutan dari kegiatan penelitian tim dari Program Kreativitas Mahasiswa (PKM) Direktorat Jenderal Pendidikan Tinggi Kemenbud, 2012.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam proses penyusunan skripsi ini. Penulis menyadari bahwa dalam penulisan dan penyusunan skripsi ini jauh dari kesempurnaan. Semoga penulisan dapat memberikan manfaat bagi para pembacanya.
Bogor, September 2012
Rancangan Percobaan ... 17
Perlakuan ... 17
Parameter yang Diamati ... 18
HASIL DAN PEMBAHASAN ... 20
Pola Perubahan Konsentrasi N-NH3 ... 20
Pola Perubahan Konsentrasi VFA (Vollatile Fatty Acid) ... 22
Kecernaan Bahan Kering dan Organik ... 25
KESIMPULAN DAN SARAN ... 27
Kesimpulan ... 27
Saran ... 27
UCAPAN TERIMA KASIH ... 28
DAFTAR PUSTAKA ... 29
DAFTAR TABEL
Nomor Halaman
1. Kandungan Nutrien Ransum Basal yang Digunakan sebagai
Media Fermentasi In Vitro ... 18 2. Rataan Konsentrasi VFA dan NH3 pada Media Fermentasi
Pakan dengan Perlakuan Berbeda (In Vitro)... 20 3. Nilai Koefisien Cerna Bahan Kering (KCBK) dan Bahan
DAFTAR GAMBAR
Nomor Halaman
1. Struktur Ikatan Kromium dengan asam nikotinat dan asam amino
glutation ... 8
2. Struktur Kimia Cr-Pikolinat ... 9
3. Proses Sintesis Protein Mikroba ... 12
4. Proses Pembentukan VFA ... 13
5. Konsentrasi N-NH3 pada Media Fermentasi Pakan dengan Perlakuan Berbeda dengan Lama Fermentasi 1-48 Jam ... 21
PENDAHULUAN
Latar Belakang
Protein merupakan unsur pakan yang penting dalam metabolisme tubuh ternak. Pada umumnya protein pakan di dalam rumen akan terdegradasi sehingga diperlukan suplai sumber protein yang bervariasi baik yang mudah terdegradasi maupun yang tahan degradasi. Keseimbangan jenis protein tersebut menentukan efisiensi penggunaan protein oleh ternak ruminansia. Penyediaan protein dengan pendekatan peningkatan jumlah suplai sumber protein akan meningkatkan biaya pakan. Hal tersebut terkait dengan keadaan bahwa pakan sumber protein merupakan salah satu sumber pakan yang memiliki harga yang tinggi dibandingkan dengan sumber nutrien lainnya.
Protein pakan di dalam rumen akan diubah menjadi amonia terlebih dahulu sebelum digunakan oleh mikroba untuk sintesis protein tubuhnya (Sutardi, 1977). Suryadi (1993) menyatakan bahwa ruminansia dapat hidup dengan ransum berkualitas rendah dan mampu memanfaatkan senyawa NBP (nitrogen bukan protein) untuk pembentukan protein mikroba sebagai protein pakan. Salah satu sumber NBP yang sering digunakan sebagai pakan adalah urea.
Urea lebih sering digunakan dalam pakan ruminansia karena ketersediaannya yang cukup. Tingkat penggunaan urea yang disarankan adalah tidak melebihi 3% dari campuran konsentrat (McDonald, 1972). Urea tidak dapat menggantikan protein. Namun urea dapat mensuplai nitrogen sebagai komponen dari protein mikroba, namun molekul lainnya diperoleh dari sumber lain seperti kerangka karbon (Sutardi, 1977) dan hidrogen berasal dari karbohidarat yang mudah terfermentasi. Beberapa persyaratan yang harus dipenuhi agar diperoleh utilisasi optimum adalah ketersediaan energi yang cukup dan mudah tersedia serta perlunya unsur mikro yang cukup (Neumann dan Snapp, 1969). Beberapa contoh unsur mikro yaitu Cr, Mn, Cu, Zn, Co, F.
Suplementasi Cr dalam bentuk organik maupun inorganik dapat menurunkan efek negatif antibakteri dengan berperan sebagai GTF walaupun tanpa ada insulin (Linder, 1992). Unsur Cr diperkirakan juga diperlukan mikroba untuk menunjang pertumbuhan yang normal. Batas maksimum toleransi konsentrasi Cr dalam ransum adalah 3000 mg/kg dalam bentuk oksida dan 1000 mg/kg dalam bentuk klorida (NRC, 2001).
Kobalt (Co) merupakan salah satu unsur esensial untuk pertumbuhan hewan dan merupakan bagian dari molekul vitamin B12 (Arifin, 2008) yang dapat disentesis oleh bakteri di dalam rumen. Dalam struktur molekul vitamin B12 yang kompleks, atom Co berada pada pusat cincin tetra-ring porphryn sehingga disebut
cyanocobalamin (Parakkasi, 1999). Pada sel mamalia, vitamin B12 mempunyai dua fungsi yang berbeda, yaitu methylcobalamin digunakan oleh enzim methionine synthase untuk mengubah homosistein menjadi metionin sedangkan 5’-
deoxyadenosylcobalamin digunakan oleh enzim methylmalonyl-CoA mutase dalam konversi methylmalonyl-CoA menjadi succinyl-CoA (Norris, 2002). Succinyl-CoA
adalah suatu senyawa intermediat dalam produksi asam propionat (Hobson dan Stewart, 1997). Defisiensi Co dapat menurunkan jumlah mikroorganisme rumen. Kadar Co yang dianjurkan oleh NRC (2001) yaitu sebesar 0,1-10 ppm untuk anak sapi.
Mineral mikro memiliki kisaran kadar dalam ransum antara keracunan dan kekurangan yang sangat sempit. Absorpsi mineral mikro yang berlebihan pada pakan dengan kadar mineral tinggi menyebabkan keracunan dan menurunkan performan produksi ternak. Pembatasan kadar mineral mikro dalam ransum dapat menyebabkan defisiensi akibat adanya antagonisme antar mineral. Pemanfaatan mineral dalam bentuk senyawa organik memiliki beberapa keuntungan yang salah satu diantaranya adalah mengurangi interaksi antar mineral Suplementasi mineral organik dapat mengatasi disortasi status mineral pada ternak (Adawiah et al., 2006 ). Sintesis mineral organik dapat dilakukan melalui proses biofermentasi dengan bantuan mikroorganisme (Muktiani dan Tampubolon, 2001).
tingkat produksi ternak ruminansia khusunya di Indonesia. Penambahan Cr organik pada taraf 1 ppm dan Cr anorganik pada taraf pemberian 4 ppm meningkatkan konsentrasi VFA dan menurunkan konsentrasi NH3 (Jayanegara et al., 2006).
Tujuan
TINJAUAN PUSTAKA
Protein Mikroba Pada Ruminasia
Sutardi (1977) menyatakan bahwa secara umum sebagian protein yang terkandung didalam pakan ternak ruminansia akan diubah menjadi protein mikroba terlebih dahulu sebelum digunakan oleh ruminansia. Ada dua cara yang dilakukan agar jumlah protein pakan lebih banyak tersedia bagi ternak yaitu dengan pembentukan protein by pass dan dengan cara memberikan senyawa nitrogen bukan protein (NBP) kepada ternak, sehingga dengan begitu maka ruminansia dapat hidup dengan ransum berkualitas protein rendah dan dapat menggunakan senyawa NBP untuk pembentukan protein mikroba di dalam rumen.
Salah satu sifat mikroba rumen adalah mampu menggunakan amonia untuk membentuk protein tubuhnya (Suryadi, 1993). Menurut Sutardi (1977) hal tersebut terjadi karena mikroba rumen tidak mempunyai sistem enzim yang dapat mengangkut asam amino ke dalam tubuhnya sehingga semua asam amino harus diubah menjadi amonia terlebih dahulu dan kemudian baru dapat dimanfaatkan oleh mikroba rumen. Sumber energi yang digunakan oleh mikroba berasal dari gula (monosakarida) yang terlarut dalam cairan rumen dengan begitu maka ketersediaan monosakarida terlalut mempengaruhi aktifitas bakteri untuk menghabiskan amonia (Arora, 1995), artinya bahwa untuk menginkorporasikan amonia ke dalam tubuh mikroba guna disintesis menjadi protein tubuhnya memerlukan energi, sehingga apabila mikroba kekurangan energi maka daya menyerap amonianya jadi terbatas dan berakibat terakumulasinya NH3 pada cairan rumen (Jayanegara et al., 2006). Laconi (1998) menyatakan bahwa laju pencernaan karbohidrat menjadi faktor penentu proses sintesis protein mikroba didalam rumen. Arora (1989) menyatakan bahwa sintesis protein mikroba tergantung pada kecepatan pemecahan nitrogen pakan, kecepatan absorbsi amonia dan asam amino, kebutuhan mikroba akan asam amino, dan jenis fermentasi rumen yang dipengaruhi jenis pakan.
berarti bahwa keberhasilan memacu laju pembentukan protein mikroba akan sangat berpengaruh dalam pemenuhan kebutuhan asam amino ternaknya.
Manfaat Urea dalam Sintesis Protein Mikroba
Beberapa sumber nitrogen bukan protein (NBP) misalnya urea, biuret, garam-amonia dan beberapa amida dapat digunakan sebagai sumber N untuk ruminan. Sumber NBP yang paling banyak digunakan dalam praktek pemberian pakan ternak ruminasia adalah urea. Penggunaan NBP dalam ransum tidak dapat menghasilkan penampilan ternak yang sama persis dengan penggunaan true protein, hasilnya selalu lebih rendah (Parakkasi, 1999). Keuntungan penggunaan urea sebagai bahan baku pembentukan protein mikroba pada pakan ruminansia dalam praktek terutama karena harganya yang relatif murah, kandungan protein kasarnya tinggi dan berbentuk senyawa sederhana sehingga dapat digunakan sebagai sumber protein oleh mikroba rumen (Enseminger dan Olentine, 1978). Selain menguntungkan, penggunaan urea dalam ransum juga memiliki kerugian karena menyebabkan keracunan bila penggunaannya tidak sesuai dengan semestinya (Parakkasi, 1999).
Penggunaan urea akan menunjukkan hasil yang bermanfaat bila ditambahkan pada ransum yang mengandung protein rendah. Keefisienan pemakaian urea dalam ransum terjadi jika amonia yang terbentuk masih seimbang terhadap kemampuan mikroba rumen dalam menggunakan amonia (Suryadi,1993). Level penggunaan urea yang dianjurkan adalah 1 % dari bahan kering ransum dan tidak lebih melebihi 3% dari campuran konsentrat atau tidak lebih dari sepertiga dari kebutuhan protein (Chalupa, 1968).
Peran Mineral Organik dalam Sintesis Protein Mikroba
Mineral mikro yaitu mineral yang dibutuhkan dalam jumlah sedikit dan umumnya terdapat pada jaringan dengan konsentrasi yang kecil (Arifin, 2008). Beberapa mineral mikro yaitu Fe, Mo, Cu, Zn, Co, I, dan Se serta mineral Cr ( McDonald et al., 1998; Spears, 1999; Sutardi, 2002). Mineral mikro memiliki kisaran kadar dalam ransum antara keracunan dan kekurangan yang sangat sempit. Absorpsi mineral yang berlebihan pada pakan dengan kadar mineral tinggi menyebabkan keracunan dan menurunkan performan produksi ternak. Pembatasan kadar mineral mikro dalam ransum dapat menyebabkan defisiensi akibat adanya antagonisme antar mineral.
Telah diketahui bahwa mineral yang terdapat dalam pakan alami berada pada suatu bentuk kompleks dengan senyawa organik (Simanjuntak, 2004). Penggunaan kompleks mineral organik sebagai sumber unsur mineral bagi ternak semakin meningkat karena lebih tinggi potensi ketersediaan biologisnya dibandingkan sumber mineral anorganik (Schell dan Kornegay, 1996).
Mineral organik adalah mineral yang berasal dari proses “chelate“ garam
metal yang terlarut dengan asam-asam amino atau protein yang terhidrolisis (Lyons, 1993). Salah bentuk mineral organik adalah mineral proteinat (Simanjuntak, 2004). Mineral proteinat adalah mineral yang berasal dari kelompok transisi yang telah berikatan dengan asam-asam amino dengan membentuk struktur cincin terbuka, mempunyai pH stabil, dan bermuatan netral (Simanjuntak, 2004). Unsur mineral yang berada dalam bentuk ikatan mineral-protein diketahui dapat mengurangi interaksi antar mineral dan senyawa organik lain yang beakibat akan menurunkan kemampuan penyerapan pada saluran pencernaan. Mineral anorganik yang digunakan sebagai sumber mineral ransum tidak dapat diserap tubuh ternak karena berubah menjadi senyawa kompleks akibat terjadi interaksi antar mineral atau senyawa lain pada pakan (Lyons, 1993).
Keterlibatan Kromium dalam Sintesis Protein Mikroba
Kromium (Cr) merupakan mineral yang esensial bagi manusia maupun hewan, terutama dalam metabolisme karbohidrat dan lemak (Mertz, 1993). Unsur Cr dikelompokkan dalam mineral mikro (trace mineral) yang esensial dan secara fisiologis peran utama Cr berkaitan dengan metabolisme glukosa dengan meningkatkan aktivitas insulin. Unsur Cr tergolong dalam unsur transisi yang mempunyai bilangan oksidasi 0, 2+, 3+, 4+, 6+ tetapi pada umumnya Cr bervalensi 3 merupakan bentuk Cr yang stabil. Unsur Cr2+ jarang ditemukan dalam sistem bilogis karena apabila terjadi kontak dengan udara akan ditransformasikan menjadi Cr3+ sedangkan Cr4+ dan Cr6+ bersifat toksik. Unsur Cr6+ bersifat karsinogenik karena Cr6+ dapat berikatan dengan protein dan asam nukleat serta berikatan dengan materi genetik. Kemampuan ternak untuk memaksimumkan fungsi karbohidrat sebagai sumber energi diperkirakan dapat dilakukan dengan pendekatan intraseluler, yaitu dengan meningkatkan entri glukosa ke dalam sel melalui penggunaan kromium. Unsur Cr disamping penting dalam metabolisme tubuh ternak, Cr juga merupakan mineral essensial bagi mikroba rumen (Jayanegara et al., 2006). Batas maksimum toleransi konsentrasi Cr dalam ransum adalah 3000 mg/kg dalam bentuk oksida dan 1000 mg/kg dalam bentuk klorida (NRC, 2001).
Glucose Tolerance Factor (GTF)
Gambar 1. Struktur ikatan kromium dengan asam nikotinat dan asam amino glutation
Sumber: Linder (1992)
Kromium (Cr) Organik
Suplementasi mineral anorganik, termasuk Cr anorganik, yang selama ini umum digunakan ternyata mempunyai sifat yang merugikan. Pemberian Cr dalam bentuk organik akan memberikan efek positif karena lebih mudah diabsorpsi (Astuti
et al., 2006).
Mineral Cr dalam bentuk heksavalen (Cr6+) dapat menimbulkan toksisitas walaupun tingkat absorpsinya di usus tinggi, sedangkan bentuk trivalen (Cr3+) yang tidak beracun sangat sulit diserap (Cefalu dan Hu, 2004; McDowell, 1992). Kompleks kromium organik terdapat dalam bentuk Cr chelate, Cr proteinat, dan Cr
pikolinat. Senyawa Cr chelate berasal dari proses chelate garam mineral yang terlarut dengan asam amino atau protein yang terhidrolisis (Lindemann, 1996).
Pembentukan Cr organik dapat dilakukan dengan inkorporasi Cr ke dalam fungi. Hal tersebut dilakukan melalui proses biofermentasi yang menggunakan fungi sebagai produsen dengan substrat yang diperkaya dengan mineral Cr anorganik. Proses biofermentasi tersebut sangat ditentukan oleh spesies fungi yang paling tepat untuk menghasilkan Cr organik. Selama ini sangat sedikit penelitian yang mempelajari spesies fungi yang dapat digunakan secara optimal sebagai carrier
dalam produksi Cr organik (Olin et al., 1994).
Astuti (2006) menyatakan bahwa fungi yang memberikan nilai inkorporasi Cr dan efisiensi terbaik adalah Rhizopus oryzae. Kapang Rhizopus sp. dapat mendukung inkorporasi Cr yang semakin tinggi dengan bertambahnya level Cr, hal ini berarti
(4000 ppm). Tingginya inkorporasi Cr dengan semakin tingginya level Cr disebabkan oleh semakin banyaknya Cr yang digunakan oleh sel kapang yang selanjutnya akan berikatan dengan protein kapang, sehingga dapat menghasilkan nilai inkorporasi yang tinggi. Penggunaan kapang Rhizopus sp. pada substrat sumber karbohidrat mengakibatkan uptake Cr yang tinggi, karena Cr berhubungan dengan metabolisme karbohidrat (Astuti, 2005).
. Suplementasi Cr dalam bentuk organik maupun inorganik dapat menurunkan efek negatif antibakteri dengan berperan sebagai GTF walaupun tanpa ada insulin (Linder, 1992). Kadar optimum penggunaan Cr organik yaitu 1000 mg/kg (Astuti et al., 2006 ; Jayanegara et al., 2006).
Gambar 2. Struktur Kimia Cr-Pikolinat
Sumber: Mooney dan Cromwell (1995)
Kobalt (Co)
Kobalt (Co) merupakan unsur mineral esensial untuk pertumbuhan hewan,
dan merupakan bagian dari molekul vitamin B12. Konversi Co dari dalam tanah
menjadi vitamin B12 pada makanan hingga dicerna hewan nonruminansia
kadang-kadang disebut sebagai siklus kobalt (Arifin, 2008).
Co yang lebih banyak dibandingkan dengan monogastrik (Parakkasi, 1999). Kadar Co yang dianjurkan oleh NRC (2001) yaitu sebesar 0,1-10 ppm untuk anak sapi dan sebesar 0,07 mg/kg(Winter et al., 1977).
Sianokobalamin/B12
Dalam struktur molekul dari vitamin B12 yang kompleks , terlihat bahwa atom Co berada pada pusat dari suatu cincin tetra-ring porphryn. Grup sianida melekat pada atom Co karena adanya grup tersebut maka disebut dengan
cyanocobalamin (Parakkasi, 1999). Vitamin B12 berperan sebagai kofaktor dua enzim yaitu methylmalonyl koenzim A mutase yang mempengaruhi tahap awal selama konversi asam propionat menjadi glukosa melalui asam suksinat sebagai sumber energi dan ester grup-grup methyl dari homosistein menjadi metionin yang dikatalis oleh metionin sintetase (Kennedy et al., 1992). Selanjutnya Norris (2002) menyatakan bahwa pada sel mamalia vitamin B12 mempunyai dua fungsi yang berbeda, yaitu methylcobalamin digunakan oleh enzim methionin syntase untuk mengubah homosistein menjadi metionin sedangkan 5-deoxyadenosylcobalamin
digunakan oleh enzim methylmalonyl-CoA menjadi succinyl-CoA. Succynil-CoA
adalah suatu senyawa intermediet produksi asam propionat (Hobson dan Stewart, 1997). Defisiensi mineral Co mengakibatkan menurunnya jumlah mikroba rumen dan mengakibatkan berkurangnya aktifitas enzim malonil-CoA mutase dan metionin sintetase. Dalam membicarakan vitamin B12 hendaknya suplai Co dalam pakan tidak dilupakan karena merupakan bahan dalam pembentukan vitamin tersebut (Parakkasi, 1999).
Kapang Rhizopus sp.
Kapang merupakan organisme eukariotik heterotrof yang dapat menghasilkan spora. Kapang banyak terdapat dalam bentuk simbion dengan organisme lain baik secara mutualisme ataupun parasitisme (Setiyarto, 2011). Salah satu contoh kapang yang mudah ditemukan adalah Rhizopus sp. Kapang Rhizopus sp. tergolong dalam kelas Zygomycetes dan merupakan salah satu jenis kapang yang tumbuh pada roti, buah, dan makanan lainnya (Pelczar et al., 1986). Umumnya kapang ini banyak dijumpai pada proses fermentasi pembuatan tempe (Shurtleff dan Ayogi, 1979). Kapang jenis ini tergolong dalam genus Rhizopus, famili mucoraceae, ordo
spesifik Rhizopus menurut Setiyarto (2011) adalah sebagai berikut ; (1) hifa nonseptat (tidak bersekat), (2) mempunyai stolon dan rhizoid yang warnanya gelap jika sudah tua, (3) sporangiofora tumbuh pada noda dimana terbentuk juga rhizoid, (4) sporangia biasanya besar dan berwarna hitam, (5) kolumela agak bulat dan apofisis berbentuk seperti cangkir, (6) tidak mempunyai sporangiola, (7) membentuk hifa vegetatif yang melakukan penetrasi pada substrat dan hifa fertil yang memproduksi sporangia pada ujung sporangiofora, (8) pertumbuhannya cepat, membentuk miselium seperti kapas.
Menurut Puls dan Poutanen (1989) kecernaan pakan yang mengandung serat akan meningkat jika mengalami fermentasi dengan kapang. Darana (1995) menyatakan bahwa Rhizopussp. dapat menghasilkan senyawa antibakteri yang dapat menghambat beberapa jenis bakteri rumen, selanjutnya Jayanegara et al. (2006) menyatakan bahwa Rhizopus sp. memiliki zat antagonistik terhadap bakteri yang menyebabkan adanya hambatan dalam penyerapan monosakarida oleh bakteri rumen.
Amonia (NH3)
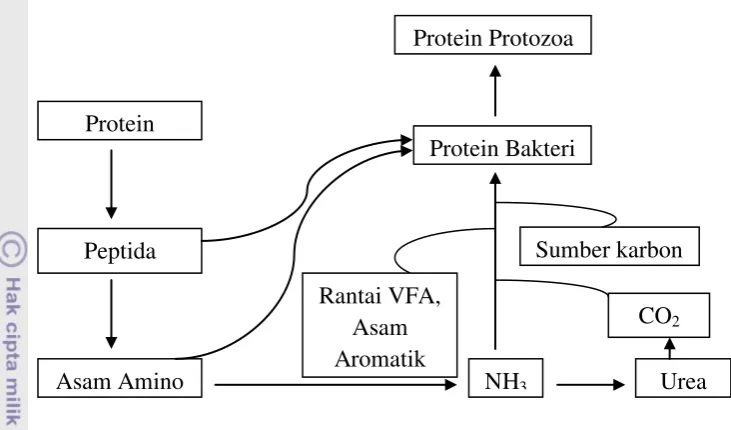
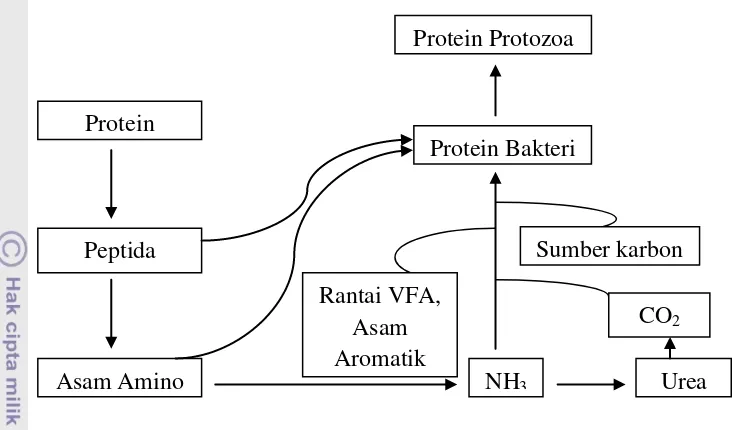
Gambar.4 Proses Sintesis Protein Mikroba
Sumber:Hobson dan Stewart (1997)
Volatile Fatty Acid (VFA)
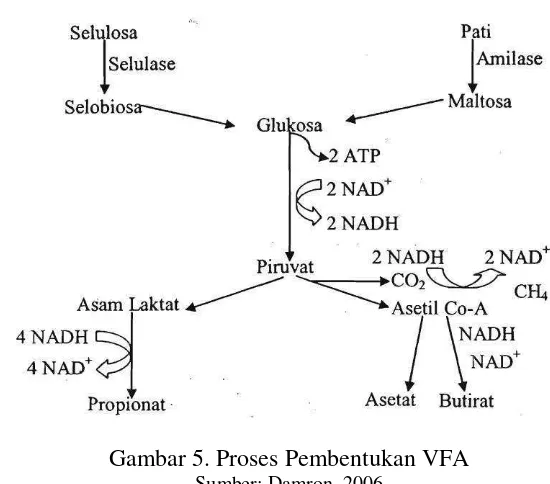
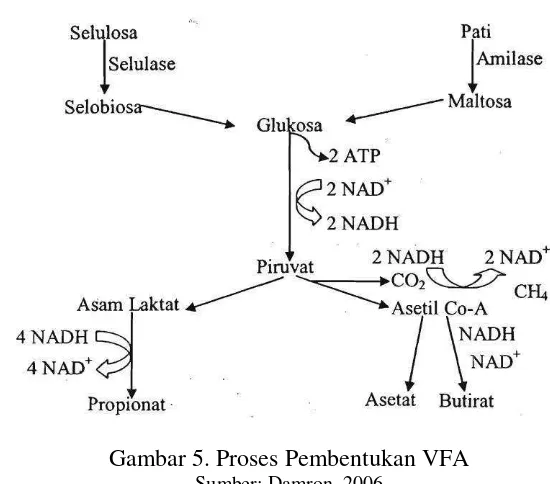
VFA merupakan energi berupa asam-asam lemak atsiri yang berasal dari proses pencernaan karbohidrat dalam rumen ternak ruminansia. VFA terdiri dari asetat, propionat, butirat, valerat, dan format (Schlegel, 1994) selanjutnya hasil pencernaan karbohidrat dalam rumen adalah VFA yang terdiri dari asam asetat, asam propionat, asam butirat, asam valerat, asam isobutirat, asam 2-metil butirat, dan asam iso-valerat (Forbes dan Frances,1993). VFA berfungsi sebagai sumber energi bagi mikroba rumen dan merupakan sumber kerangka karbon bagi pembentukan protein mikroba (Sutardi, 1977).
Produksi VFA didalam cairan rumen dapat digunakan sebagai tolak ukur fermentabilitas pakan (Hartati, 1998) dan aktivitas mikroba dan mencirikan banyaknya produksi VFA yang dihasilkan (Church, 1971). VFA diperoleh dari dari proses hidrolisis lemak oleh bakteri lipolitik menjadi asam lemak dan gliserol, kemudian gliserol difermentasi lebih lanjut untuk menjadi VFA. VFA juga merupakan produk akhir fermentasi karbohidrat (Sakinah, 2005). VFA juga berasal dari hidrolisa karbohidrat menjadi monosakrida dan disakarida yang kemudian difermentasi lebih lanjut (McDonald et al.,1998) Kisaran konsentrasi produksi total VFA pada cairan rumen yang mendukung pertumbuhan mikroba yaitu 80-160 mM (Sutardi, 1977).
Protein
Peptida
Asam Amino NH3 Urea
Protein Bakteri Protein Protozoa
Rantai VFA, Asam Aromatik
Gambar 5. Proses Pembentukan VFA
Sumber: Damron, 2006
Kecernaan Bahan Kering dan Organik
Kecernaan pakan dapat didefinisikan sebagai zat makanan yang tidak dikeluarkan melalui feses dengan asumsi zat makanan tersebut dapat diserap oleh saluran pencernaan. Kecernaan biasanya dinyatakan dalam persentase (McDonald et al., 2002). Kecernaan dapat diukur melalui dua metode yaitu secra metode in vitro
dan in vivo . Kecernaan melalui metode in vitro dipengaruhi oleh beberapa faktor yaitu pencampuran pakan, cairan rumen dan inokulan, pH kondisi fermentasi, pengaturan suhu fermentasi, lamanya waktu inkubasi, ukuran partikel sampel dan buffer (Selly, 1994). Dalam pemanfaatan bahan organik, pH rumen menjadi faktor penting pada sistem pencernaan ruminansia sedangkan degradasi ransum dipengaruhi oleh struktur makanan, ruminasi, produk saliva, dan pH optimum. Kecernaan pakan juga sangat bergantung pada mikroba rumen (Laconi, 1998).
organik. Nilai koefisien kecernaan diatas 60% merupakan nilai kecernaan pakan yang tinggi (Sutardi,1980).
In vitro
In vitro adalah proses metabolisme yang terjadi diluar tubuh ternak dimanaprinsipnya menyerupai kondisi rumen (Johnson,1966). Menurut Tisserand (1989) metode in vitro sering digunakan untuk mengetahui kecernaan hewan, pakan, dan hasil proses pencernaan dalam saluran pencernaan ternak. Beberapa keuntungan yang diperoleh dari analisa in vitro yaitu dapat dilakukan dalam waktu singkat dan biaya yang relatif murah, lebih mudah untuk mengontrol kondisinya dan memerlukan jumlah sampel yang lebih sedikit (Church,1979).
MATERI DAN METODE
Lokasi dan Waktu
Penelitian ini berlangsung selama 2 bulan sejak Desember 2011-Februari 2012. Analisa proksimat pakan dilakukan di Laboratorium PAU (Pusat Antar Universitas) IPB. Pembuatan Cr organik dan Co organik serta analisa konsentrasi NH3, VFA, dan kecernaan pakan dilakukan di Laboratorium Ilmu Nutrisi Ternak Perah, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Materi
Metode in vitro menggunakan larutan Mc. Dougall, gas CO2, dan cairan rumen segar. Cairan rumen yang digunakan berasal dari rumah pemotongan hewan Bubulak, Bogor. Ransum basal yang digunakan terdiri dari rumput gajah, jagung, onggok, dedak halus, dan urea. Kedelai tanpa kulit yang direbus, CrCl3 , CoCl2, dan kapang Rhizopus sp. digunakan dalam pembuatan Cr organik dan Co organik.
Peralatan yang digunakan berupa pisau, tampah, plastik, lilin, korek api, rak bambu, oven 600C, hammer mill, timbangan 5 kg, separangkat alat analisa in vitro
yang terdiri dari tabung fermentor, tutup karet, shaker water bath, pipet mohr, bulp, labu erlenmeyer, sentrifuse, vortex mixer, pipet tetes, tabung reaksi, botol film,
freezzer, cawan Conway, mikro pipet, buret, statip, stirrer, serangkaian alat VFA, cawan porselen, kertas saring Whattman, alat penyaring, oven 1050C, tanur, eksikator, neraca, dan gegep.
Prosedur
Persiapan pembuatan kromium organik
Persiapan pembuatan kobalt organik
Sebanyak 2 kg kacang kedelai yang telahdirebus hingga lunak, dikupas dan dicampurkan dengan 4 g ragi tempe (Rhizopus sp.). Bahan tersebut kemudian ditambah 50 larutan CoCl3 hingga kadar Cr dalam bahan kering bahan mencapai 3000 ppm. Kemudian campuran tersebut dimasukkan ke dalam plastik yang telah dilubangi permukaannya dan difermentasi selama 9 hari. Hasil fermentasi tersebut dipotong-potong kecil, dikeringkan dalam oven 600C, kemudian digiling menggunakan hummer mill dan disimpan dalam kemasan plastik serta diletakkan pada ruangan yang tidak lembab.
Pembuatan ransum basal
Bahan pakan ransum basal yang digunakan terdiri dari rumput gajah, jagung, onggok, dedak halus, dan urea. Rumput gajah yang digunakan dikeringkan terlebih dahulu dan digiling. Masing-masing bahan yang dicampurkan dalam keadaan kering dan telah digiling halus. Bahan yang dicampurkan pertama kali adalah urea dengan dedak halus, kemudian dilanjutkan dengan onggok dan jagung, dan yang terakhir dicampurkan dengan rumput gajah hingga semua tercampur merata.
Pengambilan cairan rumen
Cairan rumen diambil dari rumah pemotongan hewan Bubulak, Bogor. Cairan rumen dibawa menggunakan termos yang sebelumnya diisi dengan air panas hingga mencapai suhu 39°C. Air di dalam termos tidak boleh dibuang hingga cairan rumen didapatkan sehingga suhu cairan rumen dapat dipertahankan pada 39oC. Dinding rumen dari sapi yang telah dipotong dirobek dengan pisau kemudian isi rumen diambil dan dimasukkan ke dalam termos yang baru saja dikeluarkan air panasnya. Isi rumen diperas dengan menggunakan kain kasa dan dimasukkan ke dalam tabung fermentor yang telah dikondisikan suhunya sekitar 39oC kemudian dialiri CO2.
Teknik In Vitro
pencernaan fermentatif dilakukan pada jam ke-1, ke-3, ke-5, ke-7, ke-24, dan ke-48. Pada saat akhir fermentasi tersebut, tutup karet tabung fermentor dibuka, diteteskan 2-3 tetes HgCl2 untuk membunuh mikroba. Tabung fermentor dimasukkan ke dalam
sentrifuge untuk sentrifuge selama 10 menit. Substrat terpisah menjadi endapan di bagian bawah dan supernatan yang bening berada di bagian atas. Supernatan diambil untuk analisa kadar NH3 dan VFA. Supernatan dimasukkan ke botol film, apabila tidak dilakukan analisis segera, sampel disimpan di freezer.
Rancangan Percobaan
Penelitian ini menggunakan 4 perlakuan dan 6 waktu fermentasi. Perlakuan ransum tersebut adalah P1 (ransum basal+Cr organik 3 ppm), P2 (ransum basal+Cr inorganik 3 ppm), P3 (ransum basal+Co organik 3 ppm), dan P4 (ransum basal+Co inorganik 3 ppm). Waktu fermentasi adalah 1, 3, 5, 7, 24 dan 48 untuk analisa konsentrasi NH3 dan VFA, sedangkan analisa kecernaan bahan kering (KCBK) dan kecernaan bahan organik (KCBO) dilakukan fermentasi hingga 48 jam. Data yang diperoleh dianalisis dengan uji deskriptif.
Perlakuan
Ransum basal yang digunakan pada penelitian ini disusun atas 30% hijauan dalam bentuk kering dan 70% bahan penyusun konsentrat. Proporsi komponen ransum dan kandungan nutrien ransum dapat dilihat pada Tabel 1. Perlakuan dalam kajian ini adalah penambahan Cr organik, Cr inorganik, Co organik dan Co inorganik. Ransum perlakuan tersebut adalah:
P1 = ransum basal + Kromium organik 3 ppm
P2 = ransum basal + Kromium inorganik (CrCl3)3 ppm P3 = ransum basal + Kobalt organik 3 ppm
Tabel 1. Kandungan Nutrien Ransum Basal yang Digunakan Sebagai Media
Rumput gajah 30 Bahan kering 87,57
Jagung 29 Abu 8,53
Onggok 26 Protein kasar 14,81
Dedak halus 12 Lemak kasar 2,40
Urea 3 Serat kasar 17,64
Beta- N 56,62
TDN 70,02
Keterangan : ransum tanpa menggunakan urea mengandung 7,79 % protein kasar.
Peubah yang Diamati
Konsentrasi NH3 (Conway Micro Difussion Methode)
Pengukuran NH3 menggunakan cawan Conway. Bibir cawan Conway dan tutup diolesi dengan vaselin, supernatan yang berasal dari proses fermentasi di ambil 1,0 ml kemudian ditempatkan pada salah satu ujung alur cawan Conway. Larutan Na2CO3 jenuh sebanyak 1,0 ml di tempatkan pada salah satu ujung cawan Conway
bersebelahan dengan supernatan (tidak boleh campur). Larutan asam borat berindikator sebanyak 1,0 ml di tempatkan dalam cawan kecil yang terletak di tengah cawan Conway. Cawan Conway yang sudah di olesi vaselin di tutup rapat hingga kedap udara, larutan Na2CO3 dicampur dengan supernatan hingga merata dengan cara menggoyang-goyangkan dan memiringkan cawan tersebut. Setelah itu dibiarkan selama 24 jam dalam suhu kamar. Setelah 24 jam tutup cawan dibuka, asam borat berindikator dititrasi dengan H2SO4 0,005 N sampai terjadi perubahan warna dari biru menjadi merah. Hasil titrasi dihitung dengan menggunakan rumus.
mM NH3 = ml H2SO4 x N H2SO4 x 1000 g sampel x Bksampel
Konsentrasi VFA (Steam Destilation Methode)
mendidih dan menghasilkan uap yang akan masuk ke tabung destilasi. Saat terbentuk uap air maka analisis VFA bisa dimulai. Supernatan yang sama dengan analisa NH3 diambil sebanyak 5 ml, kemudian dimasukan ke dalam tabung destilasi,
Erlenmeyer yang berisi 5 ml NaOH 0.5 N ditempatkan di bawah selang penampungan. Sebanyak 1 ml H2SO4 15% dimasukkan ke dalam tabung destilasi yang sebelumnya diisi larutan sampel, kemudian segera penutup kacanya ditutup. Uap air panas akan mendesak VFA dan akan terkondensasi dalam pendingin. Air yang terbentuk ditampung dengan labu Erlenmeyer yang berisi 5 ml NaOH 0,5N sampai mencapai 300 ml. Phenolphtalein ditambahkan sebanyak 2-3 tetes dan destilat dititrasi dengan HCl 0,5N sampai warna titrat berubah dari merah menjadi berubah menjadi merah muda. Produksi VFA total dihitung menggunakan rumus.
mM VFA = (a-b)ml x N HCl x 1000/5ml
g sampel x BK sampel
Keterangan: a = volume titran blangko; b = volume titran contoh.
Kecernaan Bahan Kering dan Organik
Pada akhir fermentasi selama 48 jam dalam kondisi anaerob, tabung disentrifuse pada kecepatan 4000 rpm selama 15 menit dan supernatan dibuang. Endapan hasil sentrifuge selama 15 menit yang selanjutnya endapat ditambah 50 ml larutan pepsin-HCl 0,2%. Campuran tersebut lalu diinkubasi kembali selama 48 jam tanpa tutup karet. Pada akhir inkubasi seluruh isi tabung disaring dengan kertas saring Whatman no 41 (yang sudah diketahui bobotnya) dengan bantuan pompa vacum. Endapan yang tersaring kertas saring dimasukkan ke dalam cawan porselen, setelah itu dimasukkan ke dalam oven 105⁰C selama 24 jam. Setelah 24 jam, cawan porselen+kertas saring+residu dikeluarkan, dimasukkan ke dalam eksikator dan ditimbang untuk mengetahui kadar bahan keringnya. Selanjutnya bahan dalam cawan dipijarkan atau diabukan dalam tanur listrik selama 6 jam pada suhu 450 – 600oC, kemudian ditimbang untuk mengetahui kadar bahan organiknya. Sebagai blanko, dipakai residu isi tabung asal fermentasi tanpa sampel.
%KCBK = BK sampel (g) – ((BK residu (g) – BK blanko (g)) x 100% BK sampel
HASIL DAN PEMBAHASAN
Pola Perubahan Konsetrasi N-NH3
Fermentasi pakan di dalam rumen ternak ruminansia melibatkan aktifitas mikroba rumen. Aktifitas fermentasi tersebut meliputi hidrolisis komponen bahan organik dan menghasilkan VFA (vollatile fatty acid), N-NH3 (amonia), dan gas. Nilai VFA dan N-NH3 filtrat hasil fermentasi yang mengambarkan karakteristik pola fermentasi bahan ditunjukkan pada Tabel 2.
Tabel 2. Rataan konsentrasi VFA dan N-NH3 pada Media Fermentasi Pakan dengan Perlakuan Berbeda (In vitro)
Perlakuan mM-VFA mM N-NH3
P1 135,36 ± 26,57 14,40 ± 6,02
P2 91,20 ± 27,02 16,39 ± 7,21
P3 80,40 ± 39,88 15,92 ± 5,58
P4 103,96 ± 28,65 18,06 ± 7,46
Keterangan: P1= ransum basal + cr organik 3ppm, P2 = ransum basal + cr inorganik 3 ppm, P3 = ransum basal + co organik 3 ppm, P4 = ransum basal + co inorganik 3 ppm
0
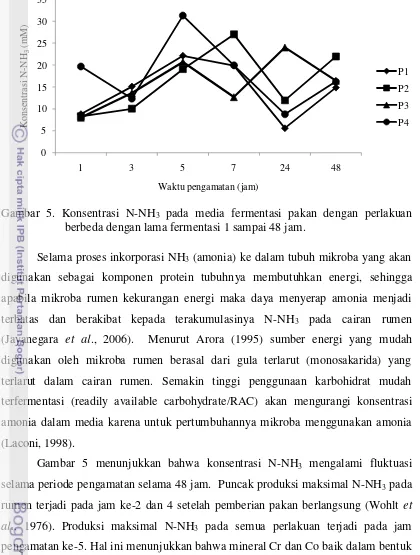
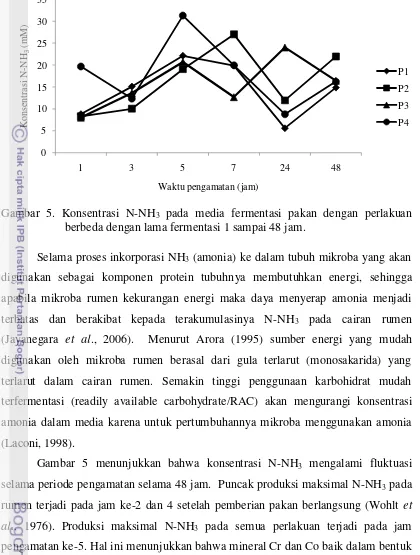
Gambar 5. Konsentrasi N-NH3 pada media fermentasi pakan dengan perlakuan berbeda dengan lama fermentasi 1 sampai 48 jam.
Selama proses inkorporasi NH3 (amonia) ke dalam tubuh mikroba yang akan digunakan sebagai komponen protein tubuhnya membutuhkan energi, sehingga apabila mikroba rumen kekurangan energi maka daya menyerap amonia menjadi terbatas dan berakibat kepada terakumulasinya N-NH3 pada cairan rumen (Jayanegara et al., 2006). Menurut Arora (1995) sumber energi yang mudah digunakan oleh mikroba rumen berasal dari gula terlarut (monosakarida) yang terlarut dalam cairan rumen. Semakin tinggi penggunaan karbohidrat mudah terfermentasi (readily available carbohydrate/RAC) akan mengurangi konsentrasi amonia dalam media karena untuk pertumbuhannya mikroba menggunakan amonia (Laconi, 1998).
menekan konsentrasi N-NH3. Kondisi tersebut menunjukkan bahwa degradasi protein lebih cepat daripada sintesis protein mikroba (McDonald et.al., 2002). Namun hal ini berarti bahwa Cr organik dan Co organik mampu meningkatkan penggunaan NH3 oleh mikroba rumen untuk disintesis menjadi asam amino dan diinkorporasikan ke dalam protein mikroba.
Pada pengamatan konsentrasi N-NH3 (Tabel 2) diperoleh infomasi bahwa tidak terjadi perbedaan konsentrasi N-NH3 pada perlakuan yang diberikan baik penambahan mineral organik maupun inorganik. Berdasarkan Tabel 2 dapat dinyatakan bahwa produksi N-NH3 yang dihasilkan masih dalam kisaran normal dengan nilai 14-18 mM walaupun tidak diberi pakan sumber protein murni. Menurut Wohlt et al. (1976) konsentrasi optimum N-NH3 dalam rumen memiliki nilai kisaran antara 6-21 mM. Kadar N-NH3 dalam kajian ini menunjukkan bahwa urea diduga sebagai penyumbang N-NH3 terbesar dalam media cairan rumen selain N-NH3 yang berasal dari pakan yang digunakan. Berdasarkan Tabel 2, dapat diperoleh informasi bahwa pada kondisi tersebut penambahan Cr ataupun Co dalam pakan masih efektif untuk menstimulasi penggunaan N-NH3 guna proses sintesis protein mikroba hingga kadar urea ransum hingga 3 %. Kondisi seperti ini menyatakan bahwa produksi dan konsentrasi N-NH3 tidak dipengaruhi oleh keberadaan mineral Cr atau Co baik dalam bentuk organik maupun inorganik. Menurut Laconi (1998) faktor yang mempengaruhi konsentrasi N-NH3 adalah karbohidrat dalam pakan.
Pola Perubahan Konsentrsi VFA (Volatille Fatty Acid)
0 berbeda dengan lama fermentasi 1 sampai 48 jam.
Berdasarkan Gambar 6 dan Tabel 1 diperoleh informasi bahwa pada pengamatan rataan konsentrasi VFA dapat dinyatakan setiap perlakuan memberikan pengaruh yang cukup berbeda. Berdasarkan Tabel 2, diperoleh informasi bahwa P1 memiliki konsentrasi VFA yang cenderung lebih baik dibandingkan perlakuan lainnya yaitu sebesar 135,36 + 26,57 mM. Ransum P1 merupakan perlakuan pakan yang ditambahkan dengan Cr organik sebesar 3 ppm. Tinginya nilai VFA pada perlakuan tersebut diperkirakan disebabkan karena adanya suplementasi unsur Cr yang merupakan mineral essensial bagi mikroba rumen (Jayanegara et al., 2006). Menurut Burton (1995) unsur Cr akan membentuk senyawa GTF (glucose tolerance factor) jika Cr berikatan dengan 2 asam nikotinat dan 3 asam amino yang terkandung dalam glutation (glutamat, glisin, dan sistein). GTF berperan dalam peningkatan asupan glukosa ke dalam sel mikroba yang akan mempengaruhi aktifitasnya, sehingga diduga bahwa semakin tinggi asupan glukosa oleh bakteri maka akan meningkatkan aktifitasnya juga begitupun sebaliknya semakin rendah asupan glukosa maka semakin rendah pula aktifitas dari mikroba rumen.
karena sifat dari mineral anorganik yang sulit diserap dibandingkan dengan mineral organik.
Kobalt merupakan salah satu mineral esensial bagi ruminansia, yaitu sebagai kofaktor dalam sintesis vitamin B12 oleh mikroba rumen. Vitamin B12 memiliki dua fungsi yang berbeda , yaitu methycobalamin digunakan oleh enzim methionin syntase
untuk mengubah homosistein menjadi metionin sedangkan 5-deoxyadenosylcobalamin digunakan oleh enzim methymalonyl-CoA mutase dalam konversi methylmalonyl-CoA menjadi succinyl-CoA (Norris,2002). Succinyl-CoA
adalah suatu intermediet produksi asam propionat (Hobson dan Stewart, 1997). Perlakuan P3 memberikan hasil konsentrasi VFA paling rendah yaitu sebesar 80,40 + 39,88 mM. Perlakuan P3 merupakan perlakuan penambahan mineral Co organik ke dalam pakan dan Co organik yang digunakan mengandung Rhizopus sp. Menurut Darana (1995) Rhizopus sp. dapat menghasilkan senyawa antibakteri yang dapat menghambat beberapa jenis bakteri rumen. Selanjutnya Jayanegara et al. (2006) menyatakan bahwa Rhizopus sp. memiliki zat antagonistik terhadap bakteri yang menyebabkan adanya hambatan dalam penyerapan monosakrida oleh bakteri rumen, penghambatan tersebut kemungkinan terjadi pada bakteri pensintesis vitamin B12. Pada perlakuan P4 yaitu penambahan mineral Co anorganik dalam bentuk senyawa CoCl memberikan hasil yang lebih baik dari P3 yaitu sebesar 103,96 + 28,65 mM hal ini disebabkan karena Co dalam bentuk anorganik tidak mengandung senyawa yang dihasilkan oleh Rhizopus sp. yang dapat menghambat aktifitas mikroba rumen seperti pada mineral Co organik.
Perlakuan P1 dan P3 memiliki kesamaan perlakuan yang diberikan yaitu penambahan mineral mikro dalam bentuk organik, namun terdapat perbedaan diantara keduanya hal tersebut karena penambahan Cr dapat membentuk GTF yang diduga mampu membantu meningkatkan penyerapan energi oleh mikroba untuk menjalankan aktivitasnya walaupun terdapat zat antagonistik yang dihasilkan oleh
Rhizopus sp. Sebaliknya penambahan Co organik tidak dapat menghasilkan senyawa yang mampu menyeimbangkan zat antagonistik yang dihasilkan oleh
menghasilkan konsentrasi VFA total lebih besar daripada Co organik, walaupun keduanya merupakan senyawa organik.
Kecernaan Bahan Kering dan Organik
Kecernaan pakan menunjukkan bagian pakan yang terserap dan dinyatakan dalam persentase (McDonald et al., 2002). Kecernaan melalui metode in vitro
dipengaruhi oleh beberapa faktor yaitu pencampuran pakan, cairan rumen dan inokulan, pH kondisi fermentasi, pengaturan suhu fermentasi, lamanya waktu inkubasi, ukuran partikel sampel dan buffer (Selly, 1994). Kecernaan biasanya diukur dalam dua bentuk yaitu kecernaan bahan kering (KCBK) dan kecernaan bahan organik (KCBO). Nilai koefisien cerna bahan kering (KCBK) dan bahan organik (KCBO) ditunjukkan pada Tabel 3.
Tabel 3. Nilai Koefisien Cerna Bahan Kering (KCBK) dan Bahan Organik (KCBO) Ransum yang Disuplementasi Cr dan Co
Perlakuan KCBK (%) KCBO (%)
P1 73,00 ± 2,10 75,29 ± 2,19
P2 65,29 ± 2,72 67,40 ± 3,65
P3 66,24 ± 1,85 69,98 ± 2,67
P4 68,40 ± 0,93 70,19 ± 1,04
Keterangan : P1= ransum basal + Cr organik 3 ppm, P2 = ransum basal + Cr inorganik 3ppm, P3 = ransum basal + Co organik 3 ppm, P4 = ransum basal + Co inorganik 3 ppm.
Terdapat variasi koefisien cerna bahan kering dan bahan organik pada setiap perlakuan yang diberikan. Berdasarkan data yang ditunjukkan pada Tabel 3 koefisien cerna bahan kering dan bahan organik pada P1 menunjukkan nilai yang paling tinggi dibandingkan pada perlakuan lainnya. Hal ini disebabkan karena terdapatnya struktur GTF yang dapat meningkatkan aktivitas mikroba dalam mendegradasi pakan. Perlakuan P2, P3 , dan P4 mempunyai nilai KCBK dan KCBO yang tidak terlalu jauh antara setiap perlakuan tersebut.
bahan kering dipengaruhi oleh faktor-faktor yang mempengaruhi kecernaan bahan organik karena sebagian besar komponen penyusun bahan kering terdiri atas bahan organik.
KESIMPULAN DAN SARAN
Kesimpulan
Suplementasi mineral Cr atau Co dalam bentuk organik ataupun inorganik memberikan pengaruh berbeda terhadap pola fermentasi bahan pakan dalam rumen. Penambahan Cr dalam bentuk organik pada pakan memberikan pengaruh paling baik terhadap kecernaan bahan kering ransum karena Cr organik mendukung peningkatan produksi VFA dan penggunaan N-NH3 dibandingkan dengan penambahan Cr inorganik, Co organik, dan Co inorganik.
Saran
UCAPAN TERIMAKASIH
Puji syukur dipanjatkan kehadirat Allah SWT sehingga penulis mampu menyelesaikan penelitian dan penulisan skripsi berjudul “Karakteristik Fermentasi
In Vitro Ransum Mengandung 50% Protein Asal Urea Yang Disuplementasi Kromium Atau Kobalt ”.
Penulis ingin mengucapkan terimakasih kepada Prof. Dr. Ir. Toto Toharmat, MAgrSc. selaku pembimbing utama skripsi dan Dr. Ir. Heri Ahmad Sukria, MSc. selaku pembimbing anggota dan pembimbing akademik atas bimbingannya, motivasi, dan ilmu-ilmu serta nasehat yang diberikan sejak perencanaan hingga terselesaikannya skripsi ini. Terima kasih kepada Ir. Lilis Khotijah. MSi selaku dosen penguji seminar, kepada Dr.Ir. Idat Galih Permana, M.Agr.Sc dan Dr. Rudi Priyanto selaku doseen penguji sidang. Penulis mengucapkan terimakasih kepada Ibu Dian Anggraini atas kerja samanya di laboratorium dan bantuannya selama penelitian berlangsung.
DAFTAR PUSTAKA
Adawiah, T. Sutardi, T. Toharmat, W. Manalu, Nahrowi, & U.H. Tanuwiria. 2006 .Suplementasi sabun mineral dan mineral organik serta kacang kedelai sangrai pada domba. J. Media Peternakan 29 (1): 27-34.
Arifin, Z. 2008. Beberapa unsur mineral esensial mikro dalam sistem biologi dan metode analisisnya. J. Litbang Pertanian 27 (3): 99-105.
Arora, S. P. 1989. Pencernaan Mikroba pada Ruminansia. Terjemahan: R. Murwani. Gadjah Mada University Press, Yogyakarta.
Arora, S. P. 1995. Pencernaan Mikroba pada Ruminansia. Edisi ke-2. Gadjah Mada University Press, Yogyakarta.
Astuti, D. A., B. Sastradipradja, Kiranadi, & E. Budiarti. 1993. Pengaruh perlakuan jerami jagung dengan asam asetat terhadap metabolisme in vitro dan invivo
pada kambing laktasi. Laporan Penelitian. Fakultas Kedokteran Hewan. Institut Pertanian Bogor, Bogor.
Astuti, W. D. 2005. Produksi kromium organik dari fungi serta peranannya bagi aktivitas fermentasi rumen. Tesis. Sekolah Pascasarjana. Institut Pertanian Bogor.
Astuti, W. D., T. Sutardi, D. Evvyernie, & T. Toharmat. 2006. Inkorporasi kromium pada khamir dan kapang dengan substrat dasar singkong yang diberi kromium anorganik. J. Media Peternakan 29 (2): 83-88.
Bailey, J. D., R. P. Ansotegui, J. A. Paterson, C. K. Swenson, & A. B. Johnson. 2001. Effects of supplementing combination of inorganic and complexes copper on performance and liver mineral status of beef heifers consuming antagonist. J. Anim. Sci. 79: 2926-2934.
Bestari, J. 2007. Suplementasi kromium pikolinat murni dalam ransum sapi perah dara yang dipelihara di dataran rendah. Tesis. Sekolah Pascasarjana. Institut Pertanian Bogor.
Burton, J. L. 1995. Suplementasi chromium and its benefits to the bovine immune system. J. Animal Feed Science Technology. 53: 117-133.
Cefalu, W. T. & F. B. Hu. 2004. Role of chromium human health and in diabetes. J. Diabets Care (11): 2741-2751. Edition. John Willey and Sons. Inc, New York.
Darana, S. 1995. Penggunaan Sorghum bicolor L.Moench yang difermentasi dengan kapang Rhizopus oligosporus dalam ransum ayam broiler. Disertasi. Program Pascasarjana, Institut Pertanian Bogor, Bogor.
Enseminger, M. E & C. G. Olentine. 1978. Feeds and Nutrient Complete. First Edition. The Enseminger Publishing Company, California.
Fardiaz, S. 1989. Fisiologi Fermentasi. Pusat Antar Universitas. Institut Pertanian Bogor, Bogor.
Forbez, J.M. & J. France. 1993. Quantitive Aspect of Ruminant Digestion and Metabolis. CAB International, London.
Goedeken, F.K., T.J. Klopfenstein, T.A. Stock, & R.A Britton. 1990. Hydrolized feather meal as a protein sources for growing calves. J. Animal Science. 68: 2945.
Groff, J.L. & S.S. Grooper. 2000. Advanced Nutrition and Human Metabolism. Third Edition. Wadsworth Thomson Learning, Belmont CA.
Hartati, E. 1998. Suplementasi minyak lemuru dan seng ke dalam ransum yang mengandung silase pod kakao dan urea untuk memacu pertumbuhan sapi
Holstein jantan. Disertasi. Program Pascasarjana, Institut Pertanian Bogor, Bogor.
Hobson, P.N & C.S. Stewart. 1997. The Rumen Microbial Ecosystem. Blackie Academic & Professional, London.
Jayanegara, A., A. S Tjakradidjaja, & T. Sutardi. 2006 .Fermentabilitas dan kecernaan in vitro ransum limbah agroindustri yang disuplementasi kromium anorganik dan organik. J. Media Peternakan 29 (2): 54-62.
Johnson, R. R. 1966. Technique and procedures for in vitro and in vivo rumen studies. J. Animal Science. 25: 855-875.
Kennedy, D. G., W. J. Balnchflower., J.M. Scott., D. G. Weir., Molloy., Kennedy S., & P. B. Young. 1992. Cobalt-vitamin B12 deficiency decreases methionine synthase activity and phospofolipid methylation in sheep. J. Nutrition. 122: 1384-1390.
Laconi, E.B. 1998. Peningkatan mutu pod kakao melalui amoniasi dengan urea dan biofermentasi dengan Phanerochaete chrysosporium serta penjabarannya ke dalam formulasi ransum ruminansia. Disertasi. Fakultas Peternakan. Institut Pertanian Bogor, Bogor.
Lindemann, M. D. 1996. Organic Chromium-The Missing Link in Farm Animal Nutrition. In Proceedings of the 12th Annual-Symphosium on Biotechnology in the Feed Industry, Nottingham University Press.
Linder M.C. 1992. Nutrisi dan Metabolisme Mikromineral dalam : Biokimia Nutrisi dan Metabolisme dengan Pemakaian secara Klinis. Cetakan Pertama. Penerbit Universitas Indonesia Press.
Lyons. 1993. Protected Animals : An expensive luxury or a cost effective necessity. Didalam : Biotechnology “ The Use of Scientifically Proven Natural Products to Increase Practical Value”. Proceedings Asia Pacific Lecture of Altech. August 16-26. P: 23-33.
Marston H.R & Smith R.M. 1950. Control of cobalt deficiency in sheep by injection of vitamin B12. Nature 170:792-793.
McDonald, P., R. A. Edwards & J.F.D. Greenhalgh. 1998. Animal Nutrition. John Willey and Sons Inc., New York.
McDonald, P., R. A. Edwards, J.F.D. Greenhalgh & C.A. Morgan. 2002. Animal Nutrition. 6th Ed. Prentice Hall, London.
McDowel, L. R. 1992. Minerals in Animal and Human Nutrition. Academic Press, London.
Mooney, K. W & G. L. Cromwell. 1995. Effects of dietary chromium picolinate supplementation on growth, carcass characteristic, and acretion rates of carcass tissues in growing-finishing swine. J. Animal Science (73) : 3351-3357.
Muktiani, A & B .I. M. Tampubolon. 2001. Produksi mineral organik berbasis metabolik promotor sintesis susu sebagai upaya revitalisasiusaha peternakan sapi perah. Laporan Akhir Penelitian. Fakultas Peternakan. Universitas Diponegoro, Semarang.
[NRC] National Research Council. 2001. Nutrient Requirements of Dairy Cattle.7th Ed.National Academic Press,Washington D.C.
Norris, J. 2002. Vit. B12: Are you getting it?. http://www.purachlorella.com.brl/doc/.B122002.pdf. [1 Mei 2012].
Olin, K. L., D. M. Starnes, W. H. Armstrong, & C. L. Kearn. 1994. Comparative Retention/Absorption of 51Cr from 51Cr Chloride, 51Cr Nicitinate, and 51 Cr Picolinate in a rat model. J.Trace elements in medicine (11) : 182-191.
Parakkasi, A. 1999. Ilmu Nutrisi dan Makanan Ternak Ruminan. UI-Press. Universitas Indonesia, Jakarta.
Pelchzar, M. J., E. C. S. Chan & N. R. Krieg. 1986. Microbiology. Fifth Edition. McGraw-Hill Book Co., Singapore.
Piliang, W.G. & D.A.H. Soewondo. 2006. Fisiologi Nutrisi Volume II. Edisi Revisi ; Januari 2006. IPB Press, Bogor.
Puls, J & K. Poutanen. 1989. Mechanism of Enzymic Hidrolysis of Hemicelulloses (Xylan) and Dures for Determination of The Enzyme Activities Involved. BFH Institut of Chemistry Leuschnerstr, Hamburg.
Schell, T. C & E. T. Kornegay. 1996. Zinc concentration in tissues and performance of weanling pigs fed pharmalogical levels of Zinc from ZnO, Zn-methionine, Zn-Lysine, or ZnW. J. Animal Science 74 (7) : 1584-1593.
Schlegel. H.G., 1994. Mikrobiologi Umum, Terjemahan : R. M. Tedjo Bangkoro. Gadja Mada University Press, Yogyakarta.
Setiyarto, C. 2011. Peningkatan kadar protein kasar ampas kulit nanas melalui fermentasi media padat. Skripsi. Fakultas Teknologi Pertanian. Institut Pertanian Bogor, Bogor.
Selly. 1994. Peningkatan kualitas pakan serat bermutu rendah dan amoniasi dan inokulan digesta rumen, Skripsi. Fakultas Peternakan. Institu Pertanian Bogor, Bogor.
Shurtleff, W & Ayogi. 1979. The Book of Tempe: A Super Soy Food from Indonesia. Harper and Row, New York.
Simanjuntak, M.C. 2004. Karakteristik Zn-Organik dan pengaruh suplementasinya terhadap kecernaan pakan serat (In Vitro). Tesis. Sekolah Pascasarjana. Institut Pertanian Bogor.
Sniffen, C.J, & P.H. Robinson. 1987. Microbial growth and flow as influenced by dietary manipulation. J. Dairy Sci. 63:1248.
Spears, J.W. 1999. Reevaluation of the metabolic essentiality of minerals. J. Animal Science 12 (6): 1002-1008.
Suryadi. 1993. Pemanfaatan silase onggok basah dengan suplementasi urea dalam ransum pertumbuhan domba lokal. Tesis. Program Pascasarjana KPK Institut Pertanian Bogor-Universitas Andalas, Padang.
Sutardi.T. 1977. Ikhtisar Ruminansia. Bahan Penataran Khusus Peternakan Sapi Perah di Kayu Ambon-Lembang. Direktorat Jendral Peternakan. Deptan, Bandung.
Sutardi, T. 1979. Ketahanan protein bahan makanan terhadap degradasi mikroba rumen dan manfaatnya bagi peningkatan produktivitas ternak. Prosiding Seminar Hasil Penelitian dan Penunjang Peternakan LPP IPB, Bogor.
Sutardi. 1980. Landasan Ilmu Nutrisi I. Fakultas Peternakan. Institut Pertanian Bogor, Bogor.
Sutardi, T. 2002. Teknologi Pakan dan Aplikasinya. Pelatihan Manajemen Pengelolaan Ternak Potong. Pemerintah Propinsi Kepulauan Bangka Belitung Dinas Pertanian dan Kehutanan, 29 Oktober-2 November 2002.
Tilley, J. M. A & R. A. Terry. 1963. A two stage technique for the In vitro digestion of forage crops. J. British Grassland Society (18) : 104-111.
Tisserand. J. L. 1989. Biological In Vitro and In Sacco methods In : Evaluation of Straws in Ruminant Feeding. Elsevier Applied Science, London and New York.
Winter,W. M., B. D. Seibert & R. E. Kuchel. 1977. Cobalt deficiency of cattle grazing improved pastures in northern Cape York Peninsula, Australian. J. of Experimental Agricultural and Animal Husbandary (17) :10-15.
Wohlt, J. E., J. H. Clark, & F.S. 1976. Effect of sampling location, time, and method of concentration of ammonia nitrogen in rumen fluid. J. Dairy Science (59) : 459-464.
PENDAHULUAN
Latar Belakang
Protein merupakan unsur pakan yang penting dalam metabolisme tubuh ternak. Pada umumnya protein pakan di dalam rumen akan terdegradasi sehingga diperlukan suplai sumber protein yang bervariasi baik yang mudah terdegradasi maupun yang tahan degradasi. Keseimbangan jenis protein tersebut menentukan efisiensi penggunaan protein oleh ternak ruminansia. Penyediaan protein dengan pendekatan peningkatan jumlah suplai sumber protein akan meningkatkan biaya pakan. Hal tersebut terkait dengan keadaan bahwa pakan sumber protein merupakan salah satu sumber pakan yang memiliki harga yang tinggi dibandingkan dengan sumber nutrien lainnya.
Protein pakan di dalam rumen akan diubah menjadi amonia terlebih dahulu sebelum digunakan oleh mikroba untuk sintesis protein tubuhnya (Sutardi, 1977). Suryadi (1993) menyatakan bahwa ruminansia dapat hidup dengan ransum berkualitas rendah dan mampu memanfaatkan senyawa NBP (nitrogen bukan protein) untuk pembentukan protein mikroba sebagai protein pakan. Salah satu sumber NBP yang sering digunakan sebagai pakan adalah urea.
Urea lebih sering digunakan dalam pakan ruminansia karena ketersediaannya yang cukup. Tingkat penggunaan urea yang disarankan adalah tidak melebihi 3% dari campuran konsentrat (McDonald, 1972). Urea tidak dapat menggantikan protein. Namun urea dapat mensuplai nitrogen sebagai komponen dari protein mikroba, namun molekul lainnya diperoleh dari sumber lain seperti kerangka karbon (Sutardi, 1977) dan hidrogen berasal dari karbohidarat yang mudah terfermentasi. Beberapa persyaratan yang harus dipenuhi agar diperoleh utilisasi optimum adalah ketersediaan energi yang cukup dan mudah tersedia serta perlunya unsur mikro yang cukup (Neumann dan Snapp, 1969). Beberapa contoh unsur mikro yaitu Cr, Mn, Cu, Zn, Co, F.
Suplementasi Cr dalam bentuk organik maupun inorganik dapat menurunkan efek negatif antibakteri dengan berperan sebagai GTF walaupun tanpa ada insulin (Linder, 1992). Unsur Cr diperkirakan juga diperlukan mikroba untuk menunjang pertumbuhan yang normal. Batas maksimum toleransi konsentrasi Cr dalam ransum adalah 3000 mg/kg dalam bentuk oksida dan 1000 mg/kg dalam bentuk klorida (NRC, 2001).
Kobalt (Co) merupakan salah satu unsur esensial untuk pertumbuhan hewan dan merupakan bagian dari molekul vitamin B12 (Arifin, 2008) yang dapat disentesis oleh bakteri di dalam rumen. Dalam struktur molekul vitamin B12 yang kompleks, atom Co berada pada pusat cincin tetra-ring porphryn sehingga disebut
cyanocobalamin (Parakkasi, 1999). Pada sel mamalia, vitamin B12 mempunyai dua fungsi yang berbeda, yaitu methylcobalamin digunakan oleh enzim methionine synthase untuk mengubah homosistein menjadi metionin sedangkan 5’-
deoxyadenosylcobalamin digunakan oleh enzim methylmalonyl-CoA mutase dalam konversi methylmalonyl-CoA menjadi succinyl-CoA (Norris, 2002). Succinyl-CoA
adalah suatu senyawa intermediat dalam produksi asam propionat (Hobson dan Stewart, 1997). Defisiensi Co dapat menurunkan jumlah mikroorganisme rumen. Kadar Co yang dianjurkan oleh NRC (2001) yaitu sebesar 0,1-10 ppm untuk anak sapi.
Mineral mikro memiliki kisaran kadar dalam ransum antara keracunan dan kekurangan yang sangat sempit. Absorpsi mineral mikro yang berlebihan pada pakan dengan kadar mineral tinggi menyebabkan keracunan dan menurunkan performan produksi ternak. Pembatasan kadar mineral mikro dalam ransum dapat menyebabkan defisiensi akibat adanya antagonisme antar mineral. Pemanfaatan mineral dalam bentuk senyawa organik memiliki beberapa keuntungan yang salah satu diantaranya adalah mengurangi interaksi antar mineral Suplementasi mineral organik dapat mengatasi disortasi status mineral pada ternak (Adawiah et al., 2006 ). Sintesis mineral organik dapat dilakukan melalui proses biofermentasi dengan bantuan mikroorganisme (Muktiani dan Tampubolon, 2001).
tingkat produksi ternak ruminansia khusunya di Indonesia. Penambahan Cr organik pada taraf 1 ppm dan Cr anorganik pada taraf pemberian 4 ppm meningkatkan konsentrasi VFA dan menurunkan konsentrasi NH3 (Jayanegara et al., 2006).
Tujuan
TINJAUAN PUSTAKA
Protein Mikroba Pada Ruminasia
Sutardi (1977) menyatakan bahwa secara umum sebagian protein yang terkandung didalam pakan ternak ruminansia akan diubah menjadi protein mikroba terlebih dahulu sebelum digunakan oleh ruminansia. Ada dua cara yang dilakukan agar jumlah protein pakan lebih banyak tersedia bagi ternak yaitu dengan pembentukan protein by pass dan dengan cara memberikan senyawa nitrogen bukan protein (NBP) kepada ternak, sehingga dengan begitu maka ruminansia dapat hidup dengan ransum berkualitas protein rendah dan dapat menggunakan senyawa NBP untuk pembentukan protein mikroba di dalam rumen.
Salah satu sifat mikroba rumen adalah mampu menggunakan amonia untuk membentuk protein tubuhnya (Suryadi, 1993). Menurut Sutardi (1977) hal tersebut terjadi karena mikroba rumen tidak mempunyai sistem enzim yang dapat mengangkut asam amino ke dalam tubuhnya sehingga semua asam amino harus diubah menjadi amonia terlebih dahulu dan kemudian baru dapat dimanfaatkan oleh mikroba rumen. Sumber energi yang digunakan oleh mikroba berasal dari gula (monosakarida) yang terlarut dalam cairan rumen dengan begitu maka ketersediaan monosakarida terlalut mempengaruhi aktifitas bakteri untuk menghabiskan amonia (Arora, 1995), artinya bahwa untuk menginkorporasikan amonia ke dalam tubuh mikroba guna disintesis menjadi protein tubuhnya memerlukan energi, sehingga apabila mikroba kekurangan energi maka daya menyerap amonianya jadi terbatas dan berakibat terakumulasinya NH3 pada cairan rumen (Jayanegara et al., 2006). Laconi (1998) menyatakan bahwa laju pencernaan karbohidrat menjadi faktor penentu proses sintesis protein mikroba didalam rumen. Arora (1989) menyatakan bahwa sintesis protein mikroba tergantung pada kecepatan pemecahan nitrogen pakan, kecepatan absorbsi amonia dan asam amino, kebutuhan mikroba akan asam amino, dan jenis fermentasi rumen yang dipengaruhi jenis pakan.
berarti bahwa keberhasilan memacu laju pembentukan protein mikroba akan sangat berpengaruh dalam pemenuhan kebutuhan asam amino ternaknya.
Manfaat Urea dalam Sintesis Protein Mikroba
Beberapa sumber nitrogen bukan protein (NBP) misalnya urea, biuret, garam-amonia dan beberapa amida dapat digunakan sebagai sumber N untuk ruminan. Sumber NBP yang paling banyak digunakan dalam praktek pemberian pakan ternak ruminasia adalah urea. Penggunaan NBP dalam ransum tidak dapat menghasilkan penampilan ternak yang sama persis dengan penggunaan true protein, hasilnya selalu lebih rendah (Parakkasi, 1999). Keuntungan penggunaan urea sebagai bahan baku pembentukan protein mikroba pada pakan ruminansia dalam praktek terutama karena harganya yang relatif murah, kandungan protein kasarnya tinggi dan berbentuk senyawa sederhana sehingga dapat digunakan sebagai sumber protein oleh mikroba rumen (Enseminger dan Olentine, 1978). Selain menguntungkan, penggunaan urea dalam ransum juga memiliki kerugian karena menyebabkan keracunan bila penggunaannya tidak sesuai dengan semestinya (Parakkasi, 1999).
Penggunaan urea akan menunjukkan hasil yang bermanfaat bila ditambahkan pada ransum yang mengandung protein rendah. Keefisienan pemakaian urea dalam ransum terjadi jika amonia yang terbentuk masih seimbang terhadap kemampuan mikroba rumen dalam menggunakan amonia (Suryadi,1993). Level penggunaan urea yang dianjurkan adalah 1 % dari bahan kering ransum dan tidak lebih melebihi 3% dari campuran konsentrat atau tidak lebih dari sepertiga dari kebutuhan protein (Chalupa, 1968).