Lampiran 2. Sampel yang digunakan
Gambar 2. Daun Tempuyung yang berbunga putih
Lampiran 3. Gambar Alat-Alat yang Digunakan
Gambar 4. Spektrofotometer Serapan AtomHitachi Z-2000
Lampiran 4. Bagan Alir Proses Dekstruksi Kering
1. Bagan Alir Proses Destruksi kering (Daun Tempuyung bunga putih)
Dibersihkan dari pengotoran
Dicuci bersih
Dikeringkan
Dihaluskan dengan blender
Ditimbang seksama 10 gram di dalam krus porselen
Diarangkan di atas hot plateselama 9 jam
Diabukan dalam tanur dengan temperatur
awal1000C dan perlahan-lahan temperatur
dinaikkan hingga suhu 5000C dengan
interval 250Csetiap 5 menit
Dilakukan selama72jam dan dibiarkan dingin
pada desikator
Ditambah 5 ml HNO3 (1:1)
Diuapkan pada hot plate sampai kering
Dimasukkan kembali ke dalam tanur dengan
temperatur awal 1000C dan
perlahan-lahantemperatur dinaikkan hingga suhu
5000C dengan interval 250 setiap 5 menit
Dilakukan selama 72
jam dan dibiarkan dinginpada desikator Daun Tempuyung
bunga putih
Sampel yang telah dihaluskan
Abu
2. Bagan Alir Proses Destruksi kering (Daun Tempuyung bunga kuning)
Dibersihkan dari pengotoran
Dicuci bersih
Dikeringkan
Dihaluskan dengan blender
Ditimbang seksama 10 gram di dalam krus porselen
Diarangkan di atas hot plateselama 9 jam
Diabukan dalam tanur dengan temperature
awal1000C dan perlahan-lahan temperatur
dinaikkan hingga suhu 5000C dengan
interval 250Csetiap 5 menit
Dilakukan selama 9 jam dan dibiarkan
dingin pada desikator
Ditambah 5 ml HNO3 (1:1)
Diuapkan pada hot plate sampai kering
Dimasukkan kembali ke dalam tanur dengan
temperatur awal 1000C dan
perlahan-lahantemperatur dinaikkan hingga suhu
5000C dengan interval 250 setiap 5 menit
Dilakukan selama 1 jam dan dibiarkan
dinginpada desikator Daun Tempuyung
bunga kuning
Sampel yang telah dihaluskan
Abu
Lampiran 5. Bagan Alir Proses Pembuatan Larutan Sampel
Dilarutkan dengan 5 mL HNO3 (1:1)
dalamkrus porselen
Dituang ke dalam labu tentukur 50 mL
Dibilas krus dengan aqua demineralisata
sebanyak 3 kali
Dicukupkan volumenya hingga garis tanda
Disaring dengan kertas saring Whatman
No.42
Dibuang 5 ml untuk menjenuhkan kertas
saring
Dimasukkan ke dalam botol
Dilakukan analisa kuantitatif dengan
Spektrofotometer Serapan Atom pada λ
589,0 untuk logam natrium, λ 766,5 nm
untuklogam kalium, λ 422,7 nm untuk
logam kalsium dan λ 248,3 untuk logam besi Sampel yang telah
didestruksi
Filtrat
Larutan Sampel
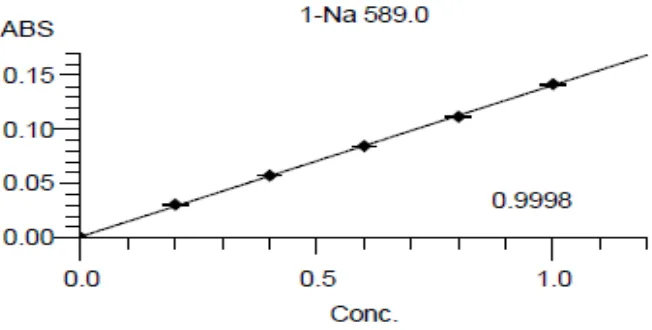
Lampiran 6. Data Kalibrasi Natrium dengan Spektrofotometri Serapan Atom dan Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r)
No Konsentrasi (µ g/ml) (X) Absorbansi (Y) 1. 2. 3. 4. 5. 6. 0,0000 0,2000 0,4000 0,6000 0,8000 1,0000 -0,0002 0,0305 0,0573 0,0846 0,1117 0,1480
No. X Y XY X2 Y2
1. 0.0000 -0,0002 0.0000 0.0000 0,00000004
2. 0,2000 0,0305 0,00610 0,0400 0,00093025
3. 0,4000 0.0573 0,022920 0,1600 0.00328329
4. 0,6000 0,0846 0,05076 0,3600 0.00715716
5. 0,8000 0,1117 0,08936 0,6400 0.01247689
6. 1,0000 0,148 0,14180 1,0000 0.02010724
∑ 3,0000
X
�= 0,5000
0,4259
Y
� = 0,070983
0,31094 2,2000 0,04395483
a
=
∑XY - ∑X∑Y n⁄∑X2-(∑X)2⁄n
a
=
0,31094 - (3)(0,4259)/6 2,2 - (3)2/6 a = 0,139985714Y �= � X� + b b = Y� – a X�
= 0,000990143
Maka persamaan garis regresinya adalah : Y = 0,139985714 X + 0,000990143
r = ∑XY - ∑X∑Y n⁄
��∑X2-�∑X)2�⁄ ��∑n Y2-�∑Y)2⁄ �n
r = 0,31094 - (3)(0,4259)/6
��2,2 - (3)2/6��0,04395483 – (0,4259)2/6�
r = 0,09799
0,098010817
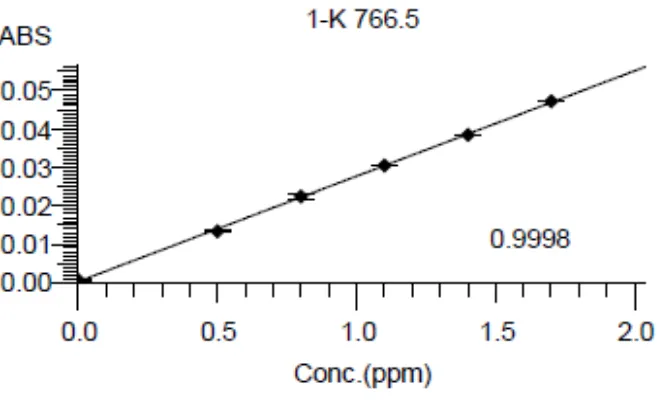
Lampiran 7. Data Kalibrasi Kalium dengan Spektrofotometer Serapan Atom dan Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r)
No Konsentrasi (µ g/ml) (X) Absorbansi (Y) 1. 2. 3. 4. 5. 6. 0,0000 0,5000 0,8000 1,1000 1,4000 1,7000 0,0007 0,0134 0,0225 0,0305 0,0385 0,0472
No. X Y XY X2 Y2
1. 0.0000 0,0007 0.0000 0.0000 0,00000049
2. 0,5000 0,0134 0,0067 0,2500 0,00017956
3. 0,8000 0,0225 0,0180 0,6400 0.00050625
4. 1,1000 0,0305 0,0335 1,2100 0.00093025
5. 1,4000 0,0385 0,0539 1,9600 0.00148225
6. 1,7000 0,0472 0,0802 2,8900 0.00222784
∑ 5,5000
X
�= 0,9166
0,1521
Y
� = 0,02535
0,19239 6,95 0,000532615
a
=
∑XY - ∑X∑Y n⁄∑X2-(∑X)2⁄n
a
=
0,19239 - (5,5)(0,1521)/6 6,95 - (5,5)2/6a = 0,02775
Y �= � X� + b b = Y� – a X�
= - 0,000085
Maka persamaan garis regresinya adalah : Y = 0,02775 X – 0,000085
r =
∑XY - ∑X∑Y n⁄��∑X2-�∑X)2�⁄ ��∑n Y2-�∑Y)2⁄ �n
r =
0,199239 - (5,5)(0,1521 )/6��6,95 - (5,5)2/6��0,00532615 – (0,1521)2/6�
Lampiran 8. Data Kalibrasi Kalsium dengan Spektrofotometer Serapan Atom dan Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r)
No Konsentrasi (µ g/ml) (X) Absorbansi (Y) 1. 2. 3. 4. 5. 6. 0,0000 1,0000 1,5000 2,0000 2,5000 3,0000 0,0001 0,0510 0,0727 0,0940 0,1163 0,1390
No. X Y XY X2 Y2
1. 0.0000 0,0001 0.0000 0.0000 0,00000001
2. 1,0000 0,0510 0,0510 1,0000 0,00260100
3. 1,5000 0,0727 0,10905 2,2500 0,00528529
4. 2,0000 0,0940 0,1880 4,0000 0,00883600
5. 2,5000 0,1163 0,29075 6,2500 0,01352569
6. 3,0000 0,1390 0,4170 9,0000 0,01932100
∑ 10,0000
X
� = 1,6667
0,4731
Y
� = 0,07885
1,0558 22,5 0,04956899
a
=
∑XY - ∑X∑Y n⁄∑X2-(∑X)2⁄n
a
=
1,0558 - (10)(0,4731)/6 22,5 - (10)2/6a = 0,045823
= 0,07885 – (0,04823)(1,6667) = 0,00248
Maka persamaan garis regresinya adalah : Y = 0,045823 X + 0,00248
r = ∑XY - ∑X∑Y n⁄
��∑X2-�∑X)2�⁄ ��∑n Y2-�∑Y)2⁄ �n
r = 1,0558 - (10)(0,4731 )/6
��22,5 - (10)2/6��0,04956899 – (0,4731)2/6�
r = 0,2673
0,26748
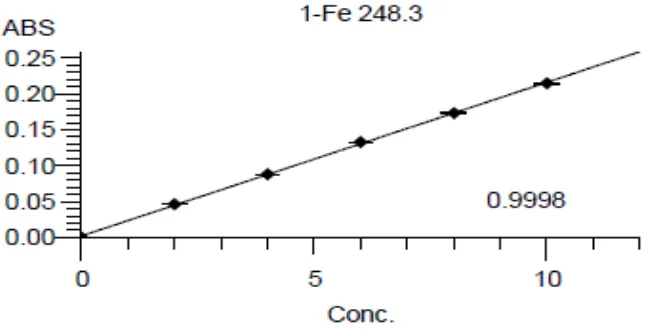
Lampiran 9. Data Kalibrasi Besi dengan Spektrofotometer Serapan Atom dan Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r)
No Konsentrasi (µ g/ml) (X) Absorbansi (Y) 1. 2. 3. 4. 5. 6. 0,0000 2,0000 4,0000 6,0000 8,0000 10,000 0,0001 0,0463 0,0882 0,1330 0,1733 0,2147
No. X Y XY X2 Y2
1. 0.0000 0,0001 0.0000 0.0000 0,00000001
2. 2,0000 0,0463 0,0926 4,0000 0,00214369
3. 4,0000 0,0882 0,3528 16,0000 0,00777924
4. 6,0000 0,1330 0,7980 36,0000 0,01768900
5. 8,0000 0,1733 1,3864 64,0000 0,03003289
6. 10,000 0,2147 2,1470 100,0000 0,04609609
∑ 30,000
X
�= 5,0000
0,6555
Y
� = 0,10925
4,7768 220,0000 0,10374092
a
=
∑XY - ∑X∑Y n⁄∑X2-(∑X)2⁄n
a
=
4,7768 - (30)(0,6555)/6220 - (30)2/6
a = 0,021418
Y �= � X� + b b = Y� – a X�
= 0,00216
Maka persamaan garis regresinya adalah : Y = 0,021418 X + 0,00216
r = ∑XY - ∑X∑Y n⁄
��∑X2-�∑X)2�⁄ ��∑n Y2-�∑Y)2⁄ �n
r = 4,3768 - (30)(0,6555 )/6
��220 - (30)2/6��0,10374092 – (0,6555)2/6�
r = 1,4993
1,499642674
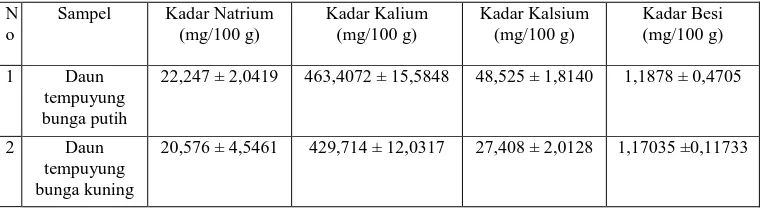
Lampiran 10. Hasil Analisis Kadar Natrium, Kalium, Kalsium dan Besi dalam Daun Tempuyung Bunga Putih (DTBP)
1. Hasil Analisis Natrium
2. Hasil Analisis Kalium
3. Hasil Analisis Kalsium
No Sampel
Berat Sampel (g) Serapan (A) Konsentrasi (µg/ml) Kadar (mg/100 g) 1. 2. 3. 4. 5. 6. DTBP 1 DTBP 2 DTBP 3 DTBP 4 DTBP 5 DTBP 6 10,0023 10,0085 10,0023 10,0213 10,9682 10,9997 0,0608 0,0620 0,0622 0,0637 0,0744 0,0845 0,4272 0,4358 0,4372 0,4479 0,5244 0,5965 21,3550 21,7729 21,8549 22,3510 23,9054 27,1143
No Sampel
Berat Sampel (g) Serapan (A) Konsentrasi (µg/ml) Kadar (mg/100 g) 1. 2. 3. 4. 5. 6. DTBP 1 DTBP 2 DTBP 3 DTBP 4 DTBP 5 DTBP 6 10,0026 10,0002 10,0006 10,4325 10,8569 10,0004 0,0315 0,0297 0,0322 0,0329 0,0354 0,0325 1,13819 1,07333 1,16342 1,18864 1,27873 1,17423 455,157 429,311 465,340 455,745 471,121 469,673
No Sampel
4. Hasil Analisis Besi
No Sampel
Lampiran 11. Hasil Analisis Kadar Natrium, Kalium, Kalsium dan Besi dalam Daun Tempuyung Bunga Kuning (DTBK)
1. Hasil Analisis Natrium
2. Hasil Analisis Kalium
3. Hasil Analisis Kalsium
No Sampel
Berat Sampel (g) Serapan (A) Konsentrasi (µg/ml) Kadar (mg/100 g) 1. 2. 3. 4. 5. 6. DTBK 1 DTBK 2 DTBK 3 DTBK 4 DTBK 5 DTBK 6 10,0022 10,0010 10,2344 10,5531 10,0231 10,0987 0,0482 0,0487 0,0603 0,0726 0,0635 0,0642 0,3372 0,3408 0,4236 0,5115 0,4465 0,4515 16,8586 17,0382 20,6949 24,2345 22,2775 22,3543
No Sampel
Berat Sampel (g) Serapan (A) Konsentrasi (µg/ml) Kadar (mg/100 g) 1. 2. 3. 4. 5. 6. DTBK 1 DTBK 2 DTBK 3 DTBK 4 DTBK 5 DTBK 6 10,0017 10,0024 10,0022 10,0254 10,0784 10,0025 0,0300 0,0295 0,0296 0,0302 0,0305 0,0289 1,0841 1,0661 1,0697 1,0914 1,1022 1,0445 433,566 426,337 427,785 435,453 437,450 417,695
No Sampel
4. Hasil Analisis Besi
No Sampel
Lampiran 12. Contoh perhitungan Kadar Natrium, Kalium, Kalsium dan Besi dalam Sampel
1. Contoh Perhitungan Kadar Natrium
Berat sampel yang ditimbang = 10,0023 gram
Absorbansi (Y) = 0,0608
Persamaan regresi :Y = 0,139985714 X + 0,000990143
X = 0,0608−0,000990143
0,139985714 = 0,4272µg/mL
Konsentrasi natrium = 0,4272µg/mL
Kadar natrium(µg/g) =Konsentrasi(µg mL⁄ ) ×Volume(mL) ×Faktorpengenceran Beratsampel(g)
=0,4272µg mL⁄ ×50mL×(50 0,5⁄ )
10,0023 g = 213,550µg/g
= 21,3550 g/100g
2. Contoh Perhitungan Kadar Kalium
Berat sampel yang ditimbang = 10,0026
Absorbansi (Y) = 0,0315
Persamaan regresi :Y = 0,02775 X – 0,000085
X
=
0,0315 +0,0000850,02775 = 1,13819µg/mL
Konsentrasi kalium = 1,13819 µg/mL
Kadar kalium (µg/g) =Konsentrasi(µg mL⁄ ) ×Volume(mL) ×Faktorpengenceran Beratsampel(g)
= 1,13819 µg mL⁄ ×100 mL×(100/0,25)
= 4551,57µg/g
= 455,157 mg/100g
3. Contoh Perhitungan Kadar Kalsium
Berat sampel yang ditimbang = 10,0006
Absorbansi (Y) = 0,0851
Persamaan regresi :Y = 0,045823 X + 0,00248
X = 0,0851−0,00248
0,045823 = 1,8030µg/mL
Konsentrasi kalsium = 1,8030 µg/mL
Kadar kalsium (µg/g)=Konsentrasi(µg mL⁄ ) ×Volume(mL) ×Faktorpengenceran Beratsampel(g)
= 1,8030µg mL⁄ ×25mL×(25/0,25)
10,0006 g = 450,722µg/g
= 45,0722 mg/100g
4. Contoh Perhitungan Kadar Besi
Berat sampel yang ditimbang = 10,0025
Absorbansi (Y) = 0,0773
Persamaan regresi :Y = 0,021418 X + 0,00216
X =0,0773−0,00216
0,021418 = 3,5082µg/mL
Konsentrasi besi = 3,5082 µg/mL
Kadar besi (µg/g) =Konsentrasi(µg mL⁄ ) ×Volume(mL) ×Faktorpengenceran Beratsampel(g)
= 3,5082µg mL⁄ ×50mL×1
= 2,2911 mg/100g
Lampiran 13
.
Perhitungan Statistik Kadar Natrium dalam Sampel1. Perhitungan Statistik Kadar Natrium dalam Daun Tempuyung Bunga Putih
No. Xi
Kadar (mg/100g) (Xi - ��) (Xi - ��)
2
1. 21,3550 -1,703 2,9002
2. 21,7729 -1.2851 1,6514
3. 21,8549 -1,2031 1,4474
4. 22,3510 -0.707 0,4998
5. 23,9054 0,8474 0,7180
6. 27,1143 4,0563 16,4535
∑ 138,3535
��= 23,058
23,6703
SD
=�
∑(Xi−X) 2 �−1=
�
23,67036−1
=
2,1757Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = 5 diperoleh nilai
t tabel = α/2, dk = 4,0321.
Data diterima jikat hitung <ttabel.
t hitung =
�
Xi −�� �� √�⁄�
t hitung 1 =
�
−1,703
t hitung 2 =
�
−1,2851
2,1757⁄√6
�
= 1,4468 (Data diterima)t hitung 3 =
�
−1,2031
2,1757⁄√6
�
= 1,3545 (Data diterima)t hitung 4 =
�
−0,707
2,1757⁄√6
�
= 0,7959 (Data diterima)t hitung 5 =
�
0,8474
2,1757⁄√6
�
= 0,9540 (Data diterima)t hitung 6 =
�
4,0563
2,1757⁄√6
�
= 4,5668 (Data ditolak)Dari hasil uji statistik diatas, diketahui bahwa kadar no. 6 ditolak, sehingga
dilakukan kembali uji statistik tanpa mengikutsertakan data no.6.
No. Xi
Kadar (mg/100g) (Xi - ��) (Xi - ��)
2
1. 21,3550 -0,892 0,7956
2. 21,7729 -0,4741 0,2247
3. 21,8549 -0,3921 0,1537
4. 22,3510 0,104 0,0108
5. 23,9054 1,6584 2,7502
∑ 111,2392
�� = 22,247
3,935
SD
=�
∑(Xi−X) 2 �−1=
�
3,9355−1
=
0,9918t tabel = α/2, dk = 4,6041.
Data diterima jika t hitung <ttabel.
t hitung =
�
Xi −�� �� √�⁄�
t hitung 1 =
�
−0,892
0,9918⁄√4
�
= 2,0112 (Data diterima)t hitung 2 =
�
−0,4741
0,9918⁄√4
�
= 1,0689 (Data diterima)t hitung 3 =
�
−0,3921
0,9918⁄√4
�
= 0,8841 (Data diterima)t hitung 4 =
�
0,104
0,9918⁄√4
�
= 0,2344 (Data diterima)t hitung 5 =
�
1,6584
0,9918⁄√4
�
= 3,7393 (Data diterima)Dari hasil perhitungan t hitung <ttabel,maka semua data tersebut diterima.
Kadar natrium sebenarnya (µ) dalam daun tempuyung bunga putih :
µ = X ± (t(α/2), dk) x SD/√�
= 22,247± (4,6041 x 0,9918/√4)mg/100g
2. Perhitungan Statistik Kadar Natrium dalam Daun Tempuyung Bunga
Kuning
No. Xi
Kadar (mg/100g) (Xi - ��) (Xi - ��)
2
1.
16,8586 -3,7174 13,819
2.
17,0382 -3,5378 12,516
3.
20,6949 0,1189 0,0141
4.
24,2345 3,6585 13,384
5.
22,2775 1,7015 2,895
6.
22,3543 1,7783 3,162
∑ 123,458
�� = 20,576
45,7901
SD
=�
∑(Xi−X) 2 �−1=
�
45,79016−1
=
2,762Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = 5 diperoleh nilai
t tabel = α/2, dk = 4,0321.
Data diterima jikat hitung <ttabel.
t hitung =
�
Xi −�� �� √�⁄�
t hitung 1 =
�
−3,7174
2,762⁄√6
�
= 3,297 (Data diterima)t hitung 2 =
�
−3,5378
t hitung 3 =
�
0,1189
2,762⁄√6
�
= 0,105 (Data diterima)t hitung 4 =
�
3,6585
2,762⁄√6
�
= 3,244 (Data diterima)t hitung 5 =
�
1,7015
2,762⁄√6
�
= 1,509 (Data diterima)t hitung 6 =
�
1,7783
2,762⁄√6
�
= 1,577 (Data diterima)Karena t hitung <ttabel,maka semua data tersebut diterima.
Kadar natrium sebenarnya (µ) dalam daun tempuyung bunga kuning :
µ = X ± (t(α/2), dk) x SD/√�
= 20,576 ± (4,0321 x 1,1275/√6) mg/100g
Lampiran 14
.
Perhitungan Statistik Kadar Kalium dalam Sampel1. Perhitungan Statistik Kadar Kalium dalam Daun Tempuyung Bunga Putih
No. Xi
Kadar (mg/100g) (Xi - ��) (Xi - ��)
2
1. 455,157 -2,563 6,568
2. 429,311 -28,409 807,07
3. 465,340 7,62 58,06
4. 455,745 -1,975 3,900
5. 471,121 13,401 179,58
6. 469,673 11,953 142,87
∑ 2746,347
��= 457,72
1198,048
SD
=�
∑(Xi−X) 2 �−1=
�
1198,0486−1
=
15,47Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = 5 diperoleh nilai
t tabel = α/2, dk = 4,0321.
Data diterima jikat hitung <ttabel.
t hitung =
�
Xi −�� �� √�⁄�
t hitung 1 =
�
−2,563
15,47⁄√6
�
= 0,4058 (Data diterima)t hitung 2 =
�
−28,409
t hitung 3 =
�
7,62
15,47⁄√6
�
= 1,206 (Data diterima)t hitung 4 =
�
−1,975
15,47⁄√6
�
= 0,312 (Data diterima)t hitung 5 =
�
13,401
15,47⁄√6
�
= 2,12 (Data diterima)t hitung 6 =
�
11,953
15,47⁄√6
�
= 1,892 (Data diterima)Dari hasil uji statistik diatas, diketahui bahwa kadar no. 2 ditolak, sehingga
dilakukan kembali uji statistik tanpa mengikutsertakan data no.2.
No. Xi
Kadar (mg/100g) (Xi - ��) (Xi - ��)
2
1. 455,157 -8,2502 68,06
2. 465,340 1,9328 3,735
3. 455,745 -7,66 58,70
4. 471,121 7,71 59,50
5. 469,673 6,26 39,26
∑ 2317,036
�� = 463,4072
229,255
SD
=�
∑(Xi−X) 2 �−1=
�
229,2555−1
=
7,570Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = 4 diperoleh nilai
t tabel = α/2, dk = 4,6041.
t hitung =
�
Xi −�� �� √�⁄�
t hitung 1 =
�
−8,2502
7,570⁄√4
�
= 2,43 (Data diterima)t hitung 2 =
�
1,9328
7,570⁄√4
�
= 0,5709 (Data diterima)t hitung 3 =
�
−7,66
7,570⁄√4
�
= 2,262(Data diterima)t hitung 4 =
�
7,71
7,570⁄√4
�
= 2,277(Data diterima)t hitung 5 =
�
6,26
7,570⁄√4
�
= 1,8493 (Data diterima)Dari hasil perhitungan t hitung <ttabel,maka semua data tersebut diterima.
Kadar kalium sebenarnya (µ) dalam daun tempuyung bunga putih :
µ = X ± (t(α/2), dk) x SD/√�
= 463,4072± (4,6041 x 7,570/√4)mg/100g
2. Perhitungan Statistik Kadar Kalium dalam Daun Tempuyung Bunga
Kuning
No. Xi
Kadar (mg/100g) (Xi - ��) (Xi - ��)
2
1.
433,566 3,852 14,837
2.
426,337 -3,377 11,404
3.
427,785 -1,929 3,721
4.
435,453 5,739 32,936
5.
437,450 7,736 59,845
6.
417,695 -12,019 144,45
∑ 2578,286
�� = 429,714
267,193
SD
=�
∑(Xi−X) 2 �−1=
�
267,1936−1
=
7,310Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = 5 diperoleh nilai
t tabel = α/2, dk = 4,0321.
Data diterima jikathitung <ttabel.
t hitung =
�
Xi −�� �� √�⁄�
t hitung 1 =
�
3,852
7,310⁄√6
�
= 1,2908 (Data diterima)t hitung 2 =
�
−3,377
t hitung 3 =
�
−1,929
7,310⁄√6
�
= 0,6464 (Data diterima)t hitung 4 =
�
5,739
7,310⁄√6
�
= 1,9232 (Data diterima)t hitung 5 =
�
7,736
7,310⁄√6
�
= 2,5924 (Data diterima)t hitung 6 =
�
−12,019
7,310⁄√6
�
= 4,0278 (Data diterima)Karena t hitung <ttabel,maka semua data tersebut diterima.
Kadar kalium sebenarnya (µ) dalam daun tempuyung bunga kuning :
µ = X ± (t(α/2), dk) x SD/√�
= 429,714 ± (4,0321 x 7,310/√6) mg/100g
Lampiran 15
.
Perhitungan Statistik Kadar Kalsium dalam Sampel1. Perhitungan Statistik Kadar Kalsium dalam Daun Tempuyung Bunga
Putih
No. Xi
Kadar (mg/100g) (Xi - ��) (Xi - ��)
2
1. 45,0722 -2,8768 8,2759
2. 49,6731 1,7241 2,9725
3. 48,9994 1,0504 1,1033
4. 47,6858 -0,2632 0,0692
5. 48,8322 0,8832 0,7800
6. 47,4368 -0,5122 0,2623
∑ 287,6995
�� = 47,949
13,4632
SD
=�
∑(Xi−X) 2 �−1=
�
13,46326−1
=
1,640Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = 5 diperoleh nilai
t tabel = α/2, dk = 4,0321.
Data diterima jikathitung <ttabel.
t hitung =
�
Xi −�� �� √�⁄�
t hitung 1 =
�
−2,8768
t hitung 2 =
�
1,7241
1,640⁄√6
�
= 2,5752 (Data diterima)t hitung 3 =
�
1,0504
1,640⁄√6
�
= 1,5689 (Data diterima)t hitung 4 =
�
−0,2632
1,640⁄√6
�
= 0,3931 (Data diterima)t hitung 5 =
�
0,8832
1,640⁄√6
�
= 1,3191 (Data diterima)t hitung 6 =
�
−0,5122
1,640⁄√6
�
= 0,7650 (Data diterima)Dari hasil uji statistik diatas, diketahui bahwa kadar no. 1 ditolak, sehingga
dilakukan kembali uji statistik tanpa mengikutsertakan data no.1.
No. Xi
Kadar (mg/100g) (Xi - ��) (Xi - ��)
2
1. 49,6731 1,1481 1,318
2. 48,9994 0,4744 0,225
3. 47,6858 -0,8392 0,704
4. 48,8322 0,3072 0,094
5. 47,4368 -1,0882 1,184
∑ 242,6273
�� = 48,525
3,525
SD
=�
∑(Xi−X) 2 �−1=
�
3,5255−1
=
0,8812t tabel = α/2, dk = 4,6041.
Data diterima jika t hitung <ttabel.
t hitung =
�
Xi −�� �� √�⁄�
t hitung 1 =
�
1,1481
0,8812⁄√5
�
= 2,9133 (Data diterima)t hitung 2 =
�
0,4744
0,8812⁄√5
�
= 1,2040 (Data diterima)t hitung 3 =
�
−0,8392
0,8812⁄√5
�
= 2,1299 (Data diterima)t hitung 4 =
�
0,3072
0,8812⁄√5
�
= 0,7796(Data diterima)t hitung 5 =
�
−1,0882
0,8812⁄√5
�
= 2,7619 (Data diterima)Dari hasil perhitungan t hitung <ttabel,maka semua data tersebut diterima.
Kadar kalsium sebenarnya (µ) dalam daun tempuyung bunga putih :
µ = X ± (t(α/2), dk) x SD/√�
= 48,525± (4,6041 x 0,8812/√5)mg/100g
2. Perhitungan Statistik Kadar Kalsium dalam Daun Tempuyung Bunga
Kuning
No. Xi
Kadar (mg/100g) (Xi - ��) (Xi - ��)
2
1.
28,9785 1,5705 2,466
2.
28,8560 1,448 2,096
3.
25,6583 -1,7497 3,061
4.
26,4497 -0,958 0,918
5.
27,6989 0,2909 0,084
6.
26,8114 -0,5966 0,355
∑ 164,4528
�� = 27,408
8,98
SD
=�
∑(Xi−X) 2 �−1=
�
8,986−1
=
1,223Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = 5 diperoleh nilai
t tabel = α/2, dk = 4,0321.
Data diterima jikathitung <ttabel.
t hitung =
�
Xi −�� �� √�⁄�
t hitung 1 =
�
1,5705
1,223⁄√6
�
= 3,146 (Data diterima)t hitung 2 =
�
1,448
t hitung 3 =
�
−1,7497
1,223⁄√6
�
= 3,5050 (Data diterima)t hitung 4 =
�
−0,958
1,223⁄√6
�
= 1,9190 (Data diterima)t hitung 5 =
�
0,2909
1,223⁄√6
�
= 0,5827 (Data diterima)t hitung 6 =
�
−0,5966
1,223⁄√6
�
= 1,1951 (Data diterima)Karena t hitung <ttabel,maka semua data tersebut diterima.
Kadar kalsium sebenarnya (µ) dalam daun tempuyung bunga kuning :
µ = X ± (t(α/2), dk) x SD/√�
= 27,408 ± (4,0321 x 1,223/√6) mg/100g
Lampiran 16
.
Perhitungan Statistik Kadar Besi dalam Sampel1. Perhitungan Statistik Kadar Besi dalam Daun Tempuyung Bunga Putih
No. Xi
Kadar (mg/100g) (Xi - ��) (Xi - ��)
2
1. 1,7536 -0,1244 0,0154
2. 2,2911 0,4131 0,1706
3. 2,1006 0,2226 0,0495
4. 2,0435 0,1655 0,0273
5. 1,5789 -0,2991 0,0894
6. 1,5041 -0,3739 0,1398
∑ 11,2718
��= 1,878
0,492
SD
=�
∑(Xi−X) 2 �−1=
�
0,4926−1
=
0,286Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = 5 diperoleh nilai
t tabel = α/2, dk = 4,0321.
Data diterima jikathitung<ttabel.
t hitung =
�
Xi −�� �� √�⁄�
t hitung 1 =
�
−0,1244
0,286⁄√6
�
= 1,065 (Data diterima)t hitung 2 =
�
0,4131t hitung 3 =
�
0,2226
0,286⁄√6
�
= 1,9074 (Data diterima)t hitung 4 =
�
0,1655
0,286⁄√6
�
= 1,4181 (Data diterima)t hitung 5 =
�
−0,2991
0,286⁄√6
�
= 2,5629 (Data diterima)t hitung 6 =
�
0,3739
0,286⁄√6
�
= 3,2039 (Data diterima)Dari hasil perhitungan t hitung <ttabel,maka semua data tersebut diterima.
Kadar besi sebenarnya (µ) dalam daun tempuyung bunga putih :
µ = X ± (t(α/2), dk) x SD/√�
= 1,878± (4,0321 x 0,286/√6)mg/100g
= (1,878± 0,4705)mg/100g
2. Perhitungan Statistik Kadar Besi dalam Daun Tempuyung Bunga Kuning
No. Xi
Kadar (mg/100g) (Xi - ��) (Xi - ��)
2
1.
1,2521 0,08175 0,00668
2.
1,2545 0,08415 0,00708
3.
1,1051 -0,06525 0,00425
4.
1,1494 -0,020095 0,000438
5.
1,0863 -0,08405 0,00706
6.
1,1747 0,00435 0,0000189
∑ 7,0221
�� = 1,17035
0,02552
=
�
0,025526−1
=
0,0714Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = 5 diperoleh nilai
t tabel = α/2, dk = 4,0321.
Data diterima jikat hitung <ttabel.
t hitung =
�
Xi −�� �� √�⁄�
t hitung 1 =
�
0,08175
0,0714⁄√6
�
= 2,809 (Data diterima)t hitung 2 =
�
0,08415
0,0714⁄√6
�
= 2,8917 (Data diterima)t hitung 3 =
�
−0,06525
0,0714⁄√6
�
= 2,2422 (Data diterima)t hitung 4 =
�
−0,02095
0,0714⁄√6
�
= 0,7199 (Data diterima)t hitung 5 =
�
−0,08405
0,0714⁄√6
�
= 2,8883 (Data diterima)t hitung 6 =
�
0,00435
0,0714⁄√6
�
= 0,1494 (Data diterima)Dari hasil perhitungan t hitung<ttabel,maka semua data tersebut diterima.
Kadar besi sebenarnya (µ) dalam daun tempuyung bunga kuning :
µ = X ± (t(α/2), dk) x SD/√�
= 1,17035± (4,0321 x 0,0714/√6)mg/100g
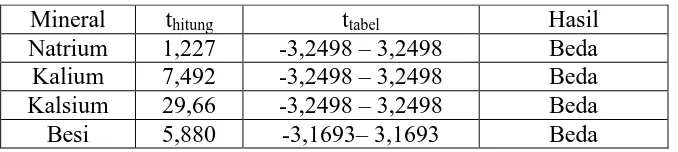
Lampiran 17. Pengujian Beda Nilai Rata-rata Natrium dalam Daun Tempuyung
No. Bunga Putih Bunga Kuning
1 X1 = 22,247 X2 = 20,576
2 S1 = 0,9918 S2 = 2,762
Dilakukan uji F dengan taraf kepercayaan 99% untuk mengetahui apakah variasi
kedua populasi sama (σ1= σ2) atau berbeda (σ1≠ σ2).
− Ho : σ1 =σ2
H1 : σ1 ≠ σ2
− dk data 1 =4, dan dk data 2 = 5
Nilai kritis F yang diperoleh dari tabel (F 0,01/2 (4,5)) adalah 22,45
Daerah kritis penolakan : Jika Fo ≥ 22,45
− Fo =
S12 S22=
0,99182
2,7622
=
0,1289− Dari hasil ini menunjukkan bahwa Ho diterima dan H1 ditolak sehingga
disimpulkan bahwa σ1 =σ2. Kemudian dilanjutkan dengan uji beda nilai
rata-rata menggunakan distribusi t.
Karena ragam populasi sama (σ1 =σ2), maka simpangan bakunya adalah:
Sp = �
��1−1�S
12 + ��2−1�S22 �1 + �2−2
= ��5 -1�0,99182 + �6 -1�2,7622
5 +6-2
=
2,162H1 : µ1 ≠ µ2
− Dengan menggunakan taraf kepercayaan 99% dengan α = 1% → t 0,01/2 =
± 3,2498
untuk df = 5 + 6 – 2 = 9
− Daerah kritis penerimaan : -3,2498 ≤ t
o ≤ 3,2498
Daerah kritis penolakan : t
o < -3,2498 atau to > 3,2498 − Pengujian statistik
to =
�X�1- X�2�
����1 n1
� �+ �1� �n2
= (22,247−20,576) 2,162�1 5⁄ + 1 6⁄
= 1,277
− Karena to = 1,277 dimana -3,2498≤ 1,277≤ 3,2498 maka hipotesis
diterima. Berarti terdapat perbedaan signifikan rata-rata kadar natrium
Lampiran 18. Pengujian Beda Nilai Rata-Rata Kalium dalam Daun tempuyung
No. Bunga Putih Bunga Kuning
1 X1 = 463,4072 X2 = 429,714
2 S1 = 7,570 S2 = 7,310
Dilakukan uji F dengan taraf kepercayaan 99% untuk mengetahui apakah variasi
kedua populasi sama (σ1= σ2) atau berbeda (σ1≠ σ2).
− Ho : σ1 =σ2
H1 : σ1 ≠ σ2
− dk data 1 =4, dan dk data 2 = 5
Nilai kritis F yang diperoleh dari tabel (F 0,01/2 (4,5)) adalah 22,45
Daerah kritis penolakan : Jika Fo ≥ 22,45
− Fo =
S
12
S22=
7,5702
7,3102
=
1,072− Dari hasil ini menunjukkan bahwa Ho diterima dan H1ditolak sehingga
disimpulkan bahwa σ1 =σ2. Kemudian dilanjutkan dengan uji beda nilai
rata-rata menggunakan distribusi t.
Karena ragam populasi sama (σ1 =σ2), maka simpangan bakunya adalah:
Sp = �
��1−1�S
12 + ��2−1�S22 �1 + �2−2
=
�
�5 -1�7,5702 + �6 -1�7,3102
5 +6-2
=
7,427− Ho : µ1 = µ2
− Dengan menggunakan taraf kepercayaan 99% dengan α = 1% → t 0,01/2 =
± 3,2498
untuk df = 5 + 6 – 2 = 9
− Daerah kritis penerimaan : -3,2498 ≤ t
o ≤ 3,2498
Daerah kritis penolakan : t
o < -3,2498 atau to > 3,2498 − Pengujian statistik
to =
�X�1- X�2�
����1 n1
� �+ �1� �n2
= (463 ,4072−429,714) 7,427�1 5⁄ + 1 6⁄
= 7,492
− Karenato= 7,492 > 3,2498maka hipotesis ditolak. Berarti terdapat perbedaan signifikan rata-rata kadar kalium dalam daun tempuyung bunga putih dan
Lampiran19. Pengujian Beda Nilai Rata-Rata Kalsium dalam Daun tempuyung
No. Bunga Putih Bunga Kuning
1 X1 = 48,525 X2 = 27,408
2 S1 = 0,8812 S2 = 1,223
Dilakukan uji F dengan taraf kepercayaan 99% untuk mengetahui apakah variasi
kedua populasi sama (σ1= σ2) atau berbeda (σ1≠ σ2).
− Ho : σ1 =σ2
H1 : σ1 ≠ σ2
− dk data 1 =4, dan dk data 2 = 5
Nilai kritis F yang diperoleh dari tabel (F 0,01/2 (4,5)) adalah 22,45
Daerah kritis penolakan : Jika Fo ≥ 22,45
− Fo =
S
12
S22=
0,88122
1,2232
=
0,5191− Dari hasil ini menunjukkan bahwa Ho diterima dan H1ditolak sehingga
disimpulkan bahwa σ1 =σ2. Kemudian dilanjutkan dengan uji beda nilai
rata-rata menggunakan distribusi t.
Karena ragam populasi sama (σ1 =σ2), maka simpangan bakunya adalah:
Sp = �
��1−1�S
12 + ��2−1�S22 �1 + �2−2
=
�
�5 -1�0,88122 + �6 -1�1,2232
5 +6-2
=
1,176− Ho : µ1 = µ2
− Dengan menggunakan taraf kepercayaan 99% dengan α = 1% → t 0,01/2 =
± 3,2498
untuk df = 5 + 6 – 2 = 9
− Daerah kritis penerimaan : -3,2498 ≤ t
o ≤ 3,2498
Daerah kritis penolakan : t
o < -3,2498 atau to > 3,2498 − Pengujian statistik
to =
�X�1- X�2�
����1 n1
� �+ �1� �n2
= (48,525−27,408) 1,176�1 5⁄ + 1 6⁄
= 29,66
− Karenato= 29,66> 3,2498maka hipotesis ditolak. Berarti terdapat perbedaan signifikan rata-rata kadar kalsium dalam daun tempuyung bunga putih dan
Lampiran 20. Pengujian Beda Nilai Rata-Rata Besi dalam Daun tempuyung
No. Bunga Putih Bunga Kuning
1 X1 = 1,878 X2 = 1,17035
2 S1 = 0,286 S2 = 0,0714
Dilakukan uji F dengan taraf kepercayaan 99% untuk mengetahui apakah variasi
kedua populasi sama (σ1= σ2) atau berbeda (σ1≠ σ2).
− Ho : σ1 =σ2
H1 : σ1 ≠ σ2
− dk data 1 =5, dan dk data 2 = 5
Nilai kritis F yang diperoleh dari tabel (F 0,01/2 (5,5)) adalah 14,94
Daerah kritis penolakan : Jika Fo ≥ 14,94
− Fo =
S
12
S22=
0,2862
0,07142
=
16,0448− Dari hasil ini menunjukkan bahwa Ho ditolak dan H1diterima sehingga
disimpulkan bahwa σ1 =σ2. Kemudian dilanjutkan dengan uji beda nilai
rata-rata menggunakan distribusi t.
Karena ragam populasi sama (σ1 =σ2), maka simpangan bakunya adalah:
Sp = �
��1−1�S
12 + ��2−1�S22 �1 + �2−2
=
�
�6 -1�0,2862 + �6 -1�0,07142
6 +6-2
=
0,2084− Ho : µ1 = µ2
− Dengan menggunakan taraf kepercayaan 99% dengan α = 1% → t 0,01/2 =
± 3,1693
untuk df = 6 + 6 – 2 = 10
− Daerah kritis penerimaan : 3,1693≤ t
o ≤ 3,1693
Daerah kritis penolakan : t
o <-3,1693atau to >3,1693 − Pengujian statistik
to =
�X�1- X�2�
����1 n1
� �+ �1� �n2
= (1,878−1,17035 ) 0,2084�1 6⁄ + 1 6⁄
= 5,880
− Karena to = 5,880>3,1693maka hipotesis ditolak. Berarti terdapat
perbedaan signifikan rata-ratakadar besi dalam daun tempuyung bunga
Lampiran 21. PerhitunganPenambahan Masing-MasingLarutan Baku pada Daun Tempuyung
1. Penambahan Larutan Baku Untuk Natrium
Kadar natrium = 22,247 ± 2,0419 mg/100 g
≈ 22 mg/100 g
Penambahan baku 7,1% = 22 mg
100 g× 7,1 g
100 ml =156,2 µg/ml
156,2 µg/ml= 1000 μg ml × Y⁄
10 g
= 1,562 ml ≈ 1,6 ml (baku yang ditambahkan)
2. Penambahan Larutan Baku Untuk Kalium
Kadar kalium = 463,4072 ± 15,5848 mg/100 g
≈463 mg/100 g
Penambahan baku 21% = 463 mg
100 g × 10 g
100 ml = 972,3 µg/ml
972,,3 µg/ml = 1000 μg ml × Y⁄
10 g
= 9,723 ml ≈9,8 ml (baku yang ditambahkan)
3. Penambahan Larutan Baku Untuk Kalsium
Kadar kalsium = 48,525 ± 1,8140 mg/100 g
≈ 49 mg/100 g
Penambahan baku 2,4% = 49 mg
100 g× 2,4 g
100 ml =117,6 µg/ml
117,6 µg/ml= 1000 μg ml × Y⁄
10 g
4. Penambahan Larutan Baku Untuk Besi
Kadar besi = 1,878± 0,4705mg/100 g
≈2 mg/100 g
Penambahan baku 50% = 2 mg
100 g× 50 g
100 ml = 10 µg/ml
10 µg/ml= 1000 μg ml × Y⁄
10 g
Lampiran 22.Hasil Uji Perolehan Kembali Natrium, Kalium, Kalsium dan Besi Setelah Penambahan Masing-masing Larutan Bakupada Daun Tempuyung
1. Hasil Analisis Kadar Natrium Setelah Ditambahkan Larutan Baku Natrium
Sebanyak 1,6 mL (konsentrasi 1000 µg/mL)
Sampel Berat Sampel (g)
Absorbansi Konsentrasi (µg/mL)
Kadar
(mg/100g)
1 10,0085 0,1002
0,7087 35,409
2 10,0026 0,1014
0,7172 35,850
3 10,0012 0,1031
0,7294 36,465
∑ = 30,0123
�� = 10,0041
∑ = 2,1553
��= 0,7184
∑ = 107,724 Kadar = 35,908
2. Hasil Analisis Kadar Kalium Setelah Ditambahkan Larutan Baku Kalium
Sebanyak 9,8 mL (konsentrasi 1000 µg/mL)
Sampel Berat Sampel (g)
Absorbansi Konsentrasi (µg/mL)
Kadar
(mg/100g)
1 10,0986 0,0401
1,4481 573,584
2 10,0095 0,0383
1,3832 552,772
3 10,0673 0,0408
1,4733 585,380
∑ = 30,2609
�� = 10,0869
∑ = 4,3046
��= 1,4348
3. Hasil Analisis Kadar Kalsium Setelah Ditambahkan Larutan Baku Kalsium
Sebanyak 1,2 mL (konsentrasi 1000 µg/mL)
Sampel Berat Sampel (g)
Absorbansi Konsentrasi (µg/mL)
Kadar
(mg/100g)
1 10,0032 0,1133
2,4184 60,4406
2 10,0151 0,1123
2,3966 59,8246
3 10,0005 0,1062
2,2634 56,5799
∑ = 30,0192
�� = 10,0064
∑ =7,0784
��= 2,3594
∑ = 176,8451 Kadar = 58,9483
4. Hasil Analisis Kadar Besi Setelah Ditambahkan Larutan Baku Besi Sebanyak
0,1 mL (konsentrasi 1000 µg/mL)
Sampel Berat Sampel (g)
Absorbansi Konsentrasi (µg/mL)
Kadar
(mg/100g)
1 10,0022 0,1305
5,9921 2,9953
2 10,0182 0,1332
6,118 3,0534
3 10,0135 0,1341
6,1602 3,0759
∑ = 30,0339
�� = 10,0113
∑ =18,2703
��= 6,0901
Lampiran 23. Perhitungan Uji Perolehan Kembali Kadar Natrium, Kalium, Kalsium dan Besi pada Daun Tempuyung
1. Perhitungan Uji Perolehan Kembali Kadar Natrium Sampel 1
Berat sampel yang ditimbang = 10,0085 g
Absorbansi = 0,1002
Persamaan regresi : Y = 0,139985714 X + 0,000990143
X
=
0,1002−0,0009901430,139985714 = 0,7087µg/mL
Konsentrasi setelah ditambah larutan baku = 0,7087 µg/mL
CF=
Konsentrasi(µg mL⁄ ) ×Volume(mL) ×Faktorpengenceran Beratsampel(g)
=
0,7087µg mL⁄ ×50mL×10010,0085 g = 354,049µg/g =35,409 mg/100g
Kadar sampel 1 setelah ditambahkan larutan baku (CF) = 35,409 mg/100g
Kadar rata-rata sampel sebelum ditambahkan larutan baku (CA) =22,247 mg/100g Berat sampel rata-rata uji recovery = 10,0041 g
Kadar larutan baku yang ditambahkan (C*A)
(C*A)=
Konsentrasi baku yang ditambahkan
Berat sampel rata-rata × mL yang ditambahkan
=1000µg/mL
10,0041 g × 1,6 mL
= 15,993 mg/100g
% Perolehan Kembali natrium = CF-CA
CA* X 100%
=35,409–22,247
15,993
×
100%= 82,29 %
Sampel 2
Berat sampel yang ditimbang = 10,0026 g
Absorbansi = 0,1014
Persamaan regresi : Y = 0,139985714 X + 0,000990143
X
=
0,1014−0,0009901430,139985714 = 0,7172µg/mL
Konsentrasi setelah ditambah larutan baku = 0,7172 µg/mL
CF=
Konsentrasi(µg mL⁄ ) ×Volume(mL) ×Faktorpengenceran Beratsampel(g)
=
0,7172µg mL⁄ ×50mL×10010,0026 g = 358,50 µg/g
=35,850 mg/100g
Kadar sampel 1 setelah ditambahkan larutan baku (CF) = 35,850 mg/100g
Kadar rata-rata sampel sebelum ditambahkan larutan baku (CA) =22,247 mg/100g Berat sampel rata-rata uji recovery = 10,0041 g
Kadar larutan baku yang ditambahkan (C*A)
(C*A)=
Konsentrasi baku yang ditambahkan
=1000µg/mL
10,0041 g × 1,6 mL
= 159,93 µg/g
= 15,993 mg/100g
% Perolehan Kembali natrium = CF-CA
CA* X 100%
=35,850–22,247
15,993
×
100%= 85,05 %
Sampel 3
Berat sampel yang ditimbang = 10,0012 g
Absorbansi = 0,1031
Persamaan regresi : Y = 0,139985714 X + 0,000990143
X
=
0,1031−0,0009901430,139985714 = 0,7294µg/mL
Konsentrasi setelah ditambah larutan baku = 0,7294 µg/mL
CF=
Konsentrasi(µg mL⁄ ) ×Volume(mL) ×Faktorpengenceran Beratsampel(g)
=
0,7294µg mL⁄ ×50mL×10010,0012 g = 364,65 µg/g
=36,465 mg/100g
Kadar sampel 1 setelah ditambahkan larutan baku (CF) = 36,465 mg/100g
Kadar larutan baku yang ditambahkan (C*A)
(C*A)=
Konsentrasi baku yang ditambahkan
Berat sampel rata-rata × mL yang ditambahkan
=1000µg/mL
10,0041 g × 1,6 mL
= 159,93 µg/g
= 15,993 mg/100g
% Perolehan Kembali natrium = CF-CA
CA* X 100%
=36,465–22,247
15,993
×
100%= 88,90 %
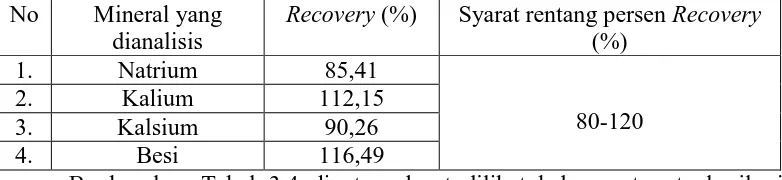
Rata-rata % Perolehan Kembali natrium = 82,29% +85,05% + 88,90%
3
=85,41%
2. Perhitungan Uji Perolehan Kembali Kadar Kalium Sampel 1
Berat sampel yang ditimbang = 10,0986 g
Absorbansi = 0,0401
Persamaan regresi : Y = 0,02775 X - 0,000085
X
=
0,0401 +0,0000850,02775 = 1,4481 µg/mL
Konsentrasi setelah ditambah larutan baku = 1,4481 µg/mL
CF=
=
1,4481µg mL⁄ ×100mL×40010,0986 g = 5735,84 µg/g =573,584 mg/100g
Kadar sampel 1 setelah ditambahkan larutan baku (CF) = 573,584 mg/100g Kadar rata-rata sampel sebelum ditambahkan larutan baku (CA) =457,724mg/100g Berat sampel rata-rata uji recovery = 10,0896 g
Kadar larutan baku yang ditambahkan (C*A)
(C*A)=
Konsentrasi baku yang ditambahkan
Berat sampel rata-rata × mL yang ditambahkan
=1000µg/mL
10,0896 g × 9,8 mL
= 971,557 µg/g
= 97,1557 mg/100g
% Perolehan Kembali Kalium = CF-CA
CA* X 100%
=573,584–457,724
97,1557
× 100%
= 119,25 %
Sampel 2
Berat sampel yang ditimbang = 10,0095 g
Absorbansi = 0,0383
Persamaan regresi : Y = 0,02775 X - 0,000085
X
=
0,0383 +0,000085Konsentrasi setelah ditambah larutan baku = 1,3832 µg/mL
CF=
Konsentrasi(µg mL⁄ ) ×Volume(mL) ×Faktorpengenceran Beratsampel(g)
=
1,3832µg mL⁄ ×100mL×40010,0095 g = 5527,72 µg/g =552,772 mg/100g
Kadar sampel 1 setelah ditambahkan larutan baku (CF) = 552,772 mg/100g Kadar rata-rata sampel sebelum ditambahkan larutan baku (CA) =457,724mg/100g Berat sampel rata-rata uji recovery = 10,0896 g
Kadar larutan baku yang ditambahkan (C*A)
(C*A)=
Konsentrasi baku yang ditambahkan
Berat sampel rata-rata × mL yang ditambahkan
=1000µg/mL
10,0896 g × 9,8 mL
= 971,557 µg/g
= 97,1557 mg/100g
% Perolehan Kembali Kalium = CF-CA
CA* X 100%
=552,772–457,724
97,1557
×
100%= 97,83 %
Sampel 3
Berat sampel yang ditimbang = 10,0673 g
Persamaan regresi : Y = 0,02775 X - 0,000085
X
=
0,0408 +0,0000850,02775 = 1,4733 µg/mL
Konsentrasi setelah ditambah larutan baku = 1,4733 µg/mL
CF=
Konsentrasi(µg mL⁄ ) ×Volume(mL) ×Faktorpengenceran Beratsampel(g)
=
1,4733µg mL⁄ ×100mL×40010,0986 g = 5853,80 µg/g =585,380 mg/100g
Kadar sampel 1 setelah ditambahkan larutan baku (CF) = 585,380 mg/100g Kadar rata-rata sampel sebelum ditambahkan larutan baku (CA) =457,724mg/100g Berat sampel rata-rata uji recovery = 10,0896 g
Kadar larutan baku yang ditambahkan (C*A)
(C*A)=
Konsentrasi baku yang ditambahkan
Berat sampel rata-rata × mL yang ditambahkan
=1000µg/mL
10,0896 g × 9,8 mL
= 971,557 µg/g
= 97,1557 mg/100g
% Perolehan Kembali Kalium = CF-CA
CA* X 100%
=585,380–457,724
97,1557
×
100%Rata-rata % Perolehan Kembali Kalium = 119,25% +97,83% + 119,39%
3
=112,15%
3. Perhitungan Uji Perolehan Kembali Kadar Kalsium Sampel 1
Berat sampel yang ditimbang = 10,0032 g
Absorbansi = 0,1133
Persamaan regresi : Y = 0,045823 X + 0,00248
X
=
0,1133 −0,002480,045823 = 2,4184µg/mL
Konsentrasi setelah ditambah larutan baku = 2,4184µg/mL
CF=
Konsentrasi(µg mL⁄ ) ×Volume(mL) ×Faktorpengenceran Beratsampel(g)
=
2,4184µg mL⁄ ×25mL× 10010,0032 g = 604,406µg/g = 60,4406 mg/100g
Kadar sampel 1 setelah ditambahkan larutan baku (CF) = 60,4442mg/100g
Kadar rata-rata sampel sebelum ditambahkan larutan baku (CA) =48,7861mg/100g Berat sampel rata-rata uji recovery = 10,0064 g
Kadar larutan baku yang ditambahkan (C*A)
(C*A)=
Konsentrasi baku yang ditambahkan
=1000µg/mL
10,0064 g × 1,2 mL
= 119,923 µg/g
= 11,9923mg/100g
% Perolehan Kembali Kalsium = CF-CA
CA* X 100%
=60,4442 - 48,7861
11,9923
×
100%= 97,21%
Sampel 2
Berat sampel yang ditimbang = 10,0151g
Absorbansi = 0,1123
Persamaan regresi : Y = 0,045823 X + 0,00248
X
=
0,1123 − 0,002480,045823 = 2,3966µg/mL
Konsentrasi setelah ditambah larutan baku = 2,3966µg/mL
CF=
Konsentrasi(µg mL⁄ ) ×Volume(mL) ×Faktorpengenceran Beratsampel(g)
=
2,3966µg mL⁄ ×25mL×10010,0151 g = 598,246 µg/g = 59,8246 mg/100g
Kadar sampel 1 setelah ditambahkan larutan baku (CF) = 59,8246mg/100g
Kadar larutan baku yang ditambahkan (C*A)
(C*A)=
Konsentrasi baku yang ditambahkan
Berat sampel rata-rata × mL yang ditambahkan
=1000µg/mL
10,0064 g × 1,2 mL
= 119,923µg/g
= 11,9923 mg/100g
% Perolehan Kembali Kalsium = CF-CA
CA* X 100%
=59,8246 -48,7861
11,9923
×
100%= 92,04 %
Sampel 3
Berat sampel yang ditimbang = 10,0005g
Absorbansi = 0,1062
Persamaan regresi : Y = 0,045823 X + 0,00248
X
=
0,1062 − 0,002480,045823 = 2,2634µg/mL
Konsentrasi setelah ditambah larutan baku = 2,2634µg/mL
CF= Konsentrasi(µg mL⁄ ) ×Volume(mL) ×Faktorpengenceran Beratsampel(g)
=
2,2634µg mL⁄ ×25mL×100Kadar sampel 1 setelah ditambahkan larutan baku (CF) = 58,5621mg/100g
Kadar rata-rata sampel sebelum ditambahkan larutan baku (CA) = 48,7861mg/100g Berat sampel rata-rata uji recovery = 10,0064 g
Kadar larutan baku yang ditambahkan (C*A)
(C*A)=
Konsentrasi baku yang ditambahkan
Berat sampel rata-rata × mL yang ditambahkan
=1000µg/mL
10,0064 g × 1,2 mL
= 119,923µg/g
= 11,9923 mg/100g
% Perolehan Kembali Kalsium = CF-CA
CA* X 100%
=58,5621 - 48,7861
11,9923
×
100%= 81,52 %
Rata-rata % Perolehan Kembali Kalsium = 97,21% + 92,04% + 81,52%
3
= 90,26%
4. Perhitungan Uji Perolehan Kembali Kadar Besi Sampel 1
Berat sampel yang ditimbang = 10,0022 g
Absorbansi = 0,1305
Persamaan regresi : Y = 0,021418 X + 0,00216
X
=
0,1305 −0,00216Konsentrasi setelah ditambah larutan baku = 5,9921 µg/mL
CF=
Konsentrasi(µg mL⁄ ) ×Volume(mL) ×Faktorpengenceran Beratsampel(g)
=
5,9921µg mL⁄ ×50mL× 110,0022 g = 29,953 µg/g =2,9953 mg/100g
Kadar sampel 1 setelah ditambahkan larutan baku (CF) = 2,9953 mg/100g
Kadar rata-rata sampel sebelum ditambahkan larutan baku (CA) =1,8786 mg/100g Berat sampel rata-rata uji recovery = 10,0113 g
Kadar larutan baku yang ditambahkan (C*A)
(C*A)=
Konsentrasi baku yang ditambahkan
Berat sampel rata-rata × mL yang ditambahkan
=1000µg/mL
10,0113 g × 0,1 mL
= 99,88 µg/g
= 0,9988 mg/100g
% Perolehan Kembali besi = CF-CA
CA* X 100%
=2,9953 –1,8786
0,9988
×
100%= 111,86%
Sampel 2
Berat sampel yang ditimbang = 10,0182 g
Persamaan regresi : Y = 0,021418 X + 0,00216
X
=
0,1332 −0,002160,021418 = 6,118 µg/mL
Konsentrasi setelah ditambah larutan baku = 6,118 µg/mL
CF= Konsentrasi(µg mL⁄ ) ×Volume(mL) ×Faktorpengenceran Beratsampel(g)
=
6,118µg mL⁄ ×50mL× 110,0182 g = 30,534µg/g =3,0534 mg/100g
Kadar sampel 1 setelah ditambahkan larutan baku (CF) = 3,0534mg/100g
Kadar rata-rata sampel sebelum ditambahkan larutan baku (CA) =1,8786 mg/100g Berat sampel rata-rata uji recovery = 10,0113 g
Kadar larutan baku yang ditambahkan (C*A)
(C*A)=
Konsentrasi baku yang ditambahkan
Berat sampel rata-rata × mL yang ditambahkan
=1000µg/mL
10,0113 g × 0,1 mL
= 99,88 µg/g
= 0,9988 mg/100g
% Perolehan Kembali besi = CF-CA
CA* X 100%
=3,0534 –1,8786
0,9988
×
100%= 117,67%
Berat sampel yang ditimbang = 10,0135 g
Absorbansi = 0,1341
Persamaan regresi : Y = 0,021418 X + 0,00216
X
=
0,1341 −0,002160,021418 = 6,1602 µg/mL
Konsentrasi setelah ditambah larutan baku = 6,1602 µg/mL
CF=
Konsentrasi(µg mL⁄ ) ×Volume(mL) ×Faktorpengenceran Beratsampel(g)
=
6,1602µg mL⁄ ×50mL× 1 10,0135 g= 30,759 µg/g =3,0759 mg/100g
Kadar sampel 1 setelah ditambahkan larutan baku (CF) = 3,0759 mg/100g
Kadar rata-rata sampel sebelum ditambahkan larutan baku (CA) =1,8786 mg/100g Berat sampel rata-rata uji recovery = 10,0113 g
Kadar larutan baku yang ditambahkan (C*A)
(C*A)=
Konsentrasi baku yang ditambahkan
Berat sampel rata-rata × mL yang ditambahkan
=1000µg/mL
10,0113 g × 0,1 mL
= 99,88 µg/g
= 0,9988 mg/100g
% Perolehan Kembali besi = CF-CA
CA* X 100%
=3,0759 –1,8786
= 119,96%
Rata-rata % Perolehan Kembali Besi = 111,86% + 117,67% + 119,96%
3
=116,49%
Lampiran 24. Perhitungan Simpangan Baku Relatif (RSD) Natrium, Kalium, Kalsium dan Besidalam Daun Tempuyung
1. Perhitungan Simpangan Baku Relatif (RSD) Natrium dalam Sampel
No. Kadar % Perolehan Kembali
(Xi)
(Xi - X� ) (Xi - X� )2
1.
35,409 -0,499 0,249001
2.
35,850 -0,058 0,003364
3.
36,465 0,557 0,310249
∑ 107,724
0,562614
X �
35,908
SD
=
�
∑�Xi - X�� 2n -1
=
�
0,5626143−1
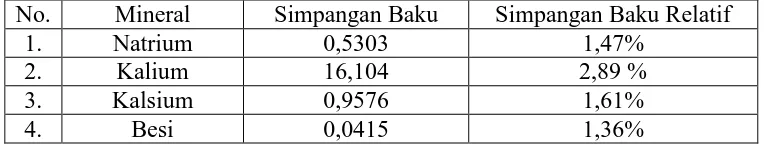
=
0,5303RSD = SD
X� × 100%
= 0,5303
35,908× 100%
= 1,47 %
2. Perhitungan Simpangan Baku Relatif (RSD) Kalium dalam Sampel
(Xi)
1.
573,584 3,006 9,036036
2.
552,772 -17,806 317,053636
3.
585,380 14,802 219,099204
∑ 1711,736
545,188876
X �
570,578
SD
=
�
∑�Xi - X�� 2n -1
=
�
5451888763−1
=
16,104RSD = SD
X� × 100%
= 16,104
570,578× 100%
= 2,89 %
3. Perhitungan Simpangan Baku Relatif (RSD) Kalsium dalam Daun tempuyung
No. Kadar % Perolehan Kembali
(Xi)
(Xi - X� ) (Xi - X� )2
1.
60,4406 0,8315 0,69139225
2.
59,8246 0,2155 0,04644025
3.
58,5621 -1,047 1,096209
∑ 178,8273 1,8340415
X
� 59,6091
SD
=
�
∑�Xi - X�� 2n -1
=
�
1,8340415=
0,9576RSD = SD
X� × 100%
= 0,9576
59,6091× 100%
= 1,61 %
4. Perhitungan Simpangan Baku Relatif (RSD) Besi dalam Daun tempuyung
No. Kadar % Perolehan Kembali
(Xi)
(Xi - X� ) (Xi - X� )2
1.
2,9953 -0,0462 0,00213444
2.
3,0534 0,0119 0,00014161
3.
3,0759 0,0344 0,00118336
∑ 9,1246
0,00345941
X �
3,0415
SD
=
�
∑�Xi - X�� 2n -1
=
�
0,003459413−1
=
0,0415RSD = SD
X� × 100%
= 0,0415
3,0415× 100%
Lampiran 25. Perhitungan Batas Deteksi dan Batas Kuantitasi 1. Perhitungan Batas Deteksi dan Batas Kuantitasi Natrium Y = 0,139985 X + 0,00099
Slope = 0,139985
No. Konsentrasi
(µg/ml)
X
Absorbansi
Y Yi Y - Yi (Y–Yi)2
1. 0,0000 -0,0002 0,00099
0,00119 0,0000014161
2. 0,2000 0,0305 0,028987
0,001513 0,000002289169
3. 0,4000 0,0573 0,056984
0,000316 0,000000099856
4. 0,6000 0,0846 0,084981
-0,000381 0,000000145161
5. 0,8000 0,1117 0,112988
-0,001288 0,000001658944
6. 1,0000 0,148 0,140975
0,007025 0,0000493506
∑ 3,0000 0,00005495983
Simpangan Baku Sy�x =
�
∑�Y -Yi�2
n -2
=
�
0,000054959834
= 0,003706745
Batas deteksi (LOD)
=
=
3 × 0,003706745 0,139985= 0,07943µg/mL
Batas kuantitasi (LOQ) =
10 ×Sy�x slope
= 10 ×0,003706745 0,139985
= 0,26479µg/mL
2. Perhitungan Batas Deteksi dan Batas Kuantitasi Kalium Y = 0,02775 X - 0,000085
Slope = 0,02775
No. Konsentrasi
(µg/ml)
X
Absorbansi
Y Yi Y - Yi (Y–Yi)2
1.
0,0000 0,0007
-0,000085
0,000785
0,000000616225
2. 0,5000 0,0134 0,01379
-0,00039 0,0000001521
3. 0,8000 0,0225 0,022115
0,000385 0,000000148225
4. 1,1000 0,0305 0,03044
0,00006 0,0000000036
5. 1,4000 0,0385 0,038765
-0,000265 0,000000070225
6. 1,7000 0,0472 0,04709
0,00011 0,0000000121
∑ 5,5000 0,000001002505
Simpangan Baku Sy�x =
�
∑�Y -Yi�2
n -2
=
�
0,0000010025054
Batas deteksi (LOD)
=
3 ×Sy�x slope
=
3 × 0,0005006258 0,02775= 0,05412µg/mL
Batas kuantitasi (LOQ) =
10 ×Sy�x slope
= 10 ×0,0005006258 0,02775
= 0,18040µg/mL
3. Perhitungan Batas Deteksi dan Batas Kuantitasi Kalsium Y = 0,045823 X + 0,00248
Slope = 0,045823
No. Konsentrasi
(µg/ml)
X
Absorbansi
Y Yi Y - Yi (Y–Yi)2
1. 0,0000 0,0001 0,00248
-0,00238 0,0000056644
2. 1,0000 0,0510 0,04830
0,0027 0,00000729
3. 1,5000 0,0727 0,07121
0,00149 0,0000022201
4. 2,0000 0,0940 0,09412
-0,00012 0,0000000144
5. 2,5000 0,1163 0,11703
-0,00073 0,0000005329
6. 3,0000 0,1390 0,13994
-0,00094 0,0000008836
∑ 10,0000 0,0000166054
Simpangan Baku Sy�x =
�
∑�Y -Yi�2
=
�
0,0000166054 4= 0,002037486
Batas deteksi (LOD)
=
3 ×Sy�x slope
=
3 × 0,002037486 0,045823= 0,13339µg/mL
Batas kuantitasi (LOQ) =
10 ×Sy�x slope
= 10 ×0,002037486 0,045823
= 0,44464µg/mL
4. Perhitungan Batas Deteksi dan Batas Kuantitasi Besi Y = 0,021418 X + 0,00216
Slope = 0,021418
No. Konsentrasi
(µg/ml)
X
Absorbansi
Y Yi Y - Yi (Y–Yi)2
1. 0,0000 0,0001 0,00216
-0,00206 0,0000042436
2. 2,0000 0,0463 0,044996
0,001304 0,000001700416
3. 4,0000 0,0882 0,087832
0,000368 0,000000135424
4. 6,0000 0,1330 0,130668
0,002332 0,000005438224
5. 8,0000 0,1733 0,173504
-0,000204 0,000000041616
6. 10,0000 0,2147 0,21634
-0,00164 0,0000026896
Simpangan Baku Sy�x =
�
∑�Y -Yi�2
n -2
=
�
0,000014248884
= 0,001887384
Batas deteksi (LOD)
=
3 ×Sy�x slope
=
3 × 0,001887384 0,021418= 0,26436µg/mL
Batas kuantitasi (LOQ) =
10 ×Sy�x slope
= 10 ×0,001887384 0,021418
DAFTAR PUSTAKA
Almatsier, S. (1998). Prinsip Dasar Ilmu Gizi. Jakarta: Gramedia Pustaka Utama. Halaman 228, 235-237, 246-247.
Bassett, J., Denney, R.C., Jeffery, G.H., dan Mendham, J. (1991). Vogel’s Textbook of Quantitative Inorganic Analysis Including Elementary Instrumental Analysis.Penerjemah: Ahmad Hadiyana Pudjaatmaka dan Lukman Setiono. (1994). Buku Ajar Vogel Kimia Analisis Kuantitatif Anorganik. Edisi Keempat. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 372, 512, 973, 463, 516.
Ermer, J., dan Miller, J.H.M. (2005). Method Validation in Pharmaceutical Analysis. Weinheim: Wiley-Vch Verlag GmbH & Co. KGaA. Halaman 171.
Gandjar, I.G., dan Rohman, A. (2009). Kimia Farmasi Analisis. Cetakan IV. Yogyakarta: Pustaka Pelajar. Halaman 22.
Harmanto, N. (2004). Menggempur Asam Urat & Rematik Dengan Mahkota Dewa. Jakarta: Agromedia Pustaka. Halaman 54.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Review Artikel. Majalah Ilmu Kefarmasian. 1(3): 117-119, 121-122, 127-130.
Helrich, K. (1990). Official Methods of Analysis of The Association of Official Analytical Chemist. Edisi ke 15. Virginia: Assocoation of Official Analytical Chemist. Halaman 42.
Herliana, E. (2013). Penyakit Asam Urat Kandas Berkat Herbal. Jakarta: Fmedia (Imprint Agromedia Pustaka). Halaman 105.
Jeffery, G.H. (1989). Quantitaive Chemical Analysis. Edisi kelima. New York. Logman Scientific & Technical. Halaman 779, 780, 783.
Khopkar, S.M. (2008). Konsep Dasar Kimia Analitik. Penerjemah Saptorahardjo. A. Jakarta: UI Press. Halaman 35,283, 395.
Nasution, L.R. (2012). Penetapan Kadar Besi dan Kalsium Dalam kacang Hijau (Phaseolus radiates L.) Dengan Dan Tanpa Kulit Biji Yang Terdapat Di Pasaran Secara Spektrofotometri Serapan Atom. Skripsi. Medan: USU.
Sudjana. (2005). Metode Statistika. Edisi Keenam. Bandung: Tarsito. Halaman 93.
Tan, T.H., dan Kirana, R. (2007). Obat-obat Penting. Edisi Ketujuh. Cetakan I Jakarta: PT Elex Media Komputindo Kelompok Kompas-Gramedia. Halaman 625, 698.
Utami, P. (2005). Tanaman Obat untuk Mengatasi Rematik & Asam Urat. Cetakan II. Jakarta: Agromedia Pustaka. Hal.50.
Watson, D. (2005). Analisis Farmasi. Edisi Kedua. Jakarta: Penerbit Buku Kedokteran. Hal.169-170.
BAB III
METODE PENELITIAN
3.1 Tempat danWaktuPenelitian
Penelitian ini dilakukan di Laboratorium Penelitian Fakultas Farmasi
Universitas Sumatera Utara pada bulan Januari-April 2015.
3.2Bahan-bahan 3.2.1 Sampel
Sampel yang digunakan dalam penelitian ini adalah daun tempuyung yang
diperoleh di JL. Marelan VII Pasar I Tengah, Lingkungan V Kelurahan Tanah
Enam Ratus, Kecamatan Medan Marelan dan JL. Raya Medan Berastagi,
Berastagi.
3.2.2 Pereaksi
Akuademineralisata, asam nitrat 65% b/v, larutan baku besi 1000 µg/mL,
larutan baku kalium 1000 µg/mL, larutan baku kalsium 1000 µg/mL, larutan baku
natrium 1000 µg/mL.
3.3 Alat-alat
Spektrofotometer Serapan Atom Hitachi Z-2000 lengkap dengan Lampu katoda
besi, kalium, kalsium dan natrium, neraca analitik (AND GF-200), hot plate
(FISONS), alat tanur (Nabertherm), blender, kertas saring, krus porselen, spatula,
desikator dan alat – alat gelas (Pyrex).
3.4 Identifikasi Sampel
Identifikasi tanaman tempuyungdilakukan di Pusat Penelitian dan
3.5 Pembuatan Pereaksi 3.5.1 Larutan HNO3 (1:1)
Sebanyak 500 mL larutan HNO3 65% b/v diencerkan dengan 500 mL
akuademineralisata (Herlich, 1990)
3.6 Prosedur Penelitian 3.6.1 Penyiapan Sampel
Daun tempuyung yang berbunga putih dan yangberbunga kuning, dicuci dengan
air mengalir dandibilasdenganakuademineralisataditiriskan dan diangin-anginkan
lalu dipotong kasar dan dihaluskan dengan menggunakan blender.
3.6.2 Proses Destruksi Kering
Sampel yang telah dihaluskan ditimbang seksamasebanyak ± 10 g dalam
krus porselen, dipanaskan di atas hot plate sampai kering dan mengarang.
Diabukan di tanur dengan temperatur awal 100o C dan perlahan-lahan temperatur
dinaikkan menjadi 500o C dengan interval 25o C setiap 5 menit. Pengabuan
dilakukan selama 72 jam dan dibiarkan dingin (Helrich, 1990).
3.6.3 Pembuatan LarutanSampel
Hasil destruksi dilarutkan dalam 5 mL HNO3 (1:1) kemudian dipanaskan
di atas hot plate hingga larutan menjadi bening. Hasilnya dimasukkan ke dalam
labu tentukur 50 mL dan krus porselen dibilas dengan akua demineralisata
sebanyak 3 kali. Dicukupkan volumenya dengan akua demineralisata hingga garis
tanda, lalu disaring dengan kertas Whatman N0. 42 dengan membuang 5 mL
filtrat pertama, kemudian filtrat selanjutnya ditampung didalam botol kaca.
Larutan ini digunakan untuk analisis kuantitatif (Helrich, 1990). Perlakuan yang
3.6.4AnalisisKuantitatif
3.6.4.1 Pembuatan Kurva KalibrasiNatrium
Larutan bakunatrium (1000 µg/mL) dipipet sebanyak 1 mL, dimasukkan ke dalam
labu tentukur 100 mL dan dicukupkan hingga garis tanda dengan
akuademineralisata (konsentrasi 10 µg/mL).
Larutan untuk kurva kalibrasi dibuat dengan memipet larutan baku 10 µg/mL
sebanyak 1,0; 2,0; 3,0; 4,0; dan 5,0 mL, masing-masing dimasukkan ke dalam
labu tentukur 50 mL dan dicukupkan hingga garis tanda dengan akua
demineralisata masing-masing konsentrasinya0,2; 0,4; 0,6; 0,8 dan 1,0 µg/mL dan
diukur pada panjang gelombang 589,0 nm dengan nyala udara-asetilen.
3.6.4.2Pembuatan KurvaKalibrasiKalium
Larutan baku kalium (1000 µg/mL) dipipet sebanyak 1 mL, dimasukkan ke dalam
labu tentukur 100 mL dan dicukupkan hingga garis tanda dengan
akuademineralisata (konsentrasi 10µg/mL).
Larutan untuk kurva kalibrasi dibuat dengan memipet larutan baku 10 µg/mL
sebanyak 2,5; 4,0; 5,5;7,0; dan 8,5 mL, masing-masing dimasukkan ke dalam labu
tentukur 50 mL dan dicukupkan hingga garis tanda dengan akuademineralisata
masing-masing konsentrasinya0,5; 0,8; 1,1; 1,4 dan 1,7µg/mL dan diukur pada