Adrianto, A. 2011. Enkapsulasi Lactobacillus casei dengan Teknik Ekstrusi Sebagai Starter untuk Pembuatan Dadih Susu Sapi. [Skripsi]. Institut Pertanian Bogor.
Anal, A. K. and Singh, H. 2007. Recent Advances in Microencapsulation of Probiotics for Industrial Applications and Targeted Delivery. Journal
Trends in Food Science & Technology. 18: 240–251.
Annan, N.T., Borza, A.D., Hansen, L.T., 2008. Encapsulation in Alginate–coated Gelatin Microspheres Improves Survival of The Probiotic Bifidobacterium
adolescentis 15703T during Exposure to Simulated Gastrointestinal
Condition. Food Research International. 41: 184–193.
Ayama, H., Sumpavapol, P., Chanthachum, S. 2014. Effect of Encapsulation of Selected Probiotic Cell on Survival in Simulated Gastrointestinal Tract Condition. Journal of Science Technology. 36 (3): 291–299.
Azhar, F. 2013. Pengaruh Pemberian Probiotik dan Prebiotik Terhadap Performan Juvenile Ikan Kerapu Bebek (Comilepte saltivelis). Buletin Veteriner
Udayana. 6: 1–9.
Buckle, K. A., Edwards, R. A., Fleet, G. H. dan Wootton, M. C. 1987. Ilmu Pangan. UI Press. Jakarta.
Castilla, O. S., Calleros, C. L., Galindo, H. S. G., Ramirez, J. A. and Carter, E. J. V. 2010. Textural Properties of Alginate–Pectin Beads and Survivability of Entrapped Lactobacillus casei in Simulated Gastrointestinal Condition and in Yoghurt. Food Research International. 43: 111–117.
Champagne, C. P. and Fustier, P. 2007. Microencapsulation for Delivery of Bioactive Compounds into Foods. Current Opinion in Biotechnology. 18(2): 184–190.
Corona–Hernandez, R. I., ´Alvarez–Parrilla, E., Lizardi–Mendoza, J., Islas– Rubio, A. R., Rosa, L. A. and Wall–Medrano, A. 2013. Structural Stability and Viability of Microencapsulated Probiotic Bacteria. Comprehensive
Reviews in Food Science and Food Safety. 12(6): 614–628.
Crowe, J. H., Oliver, A. E. and Tablin, F. 2002. Is There A Single Biochemical Adaptation to Anhydrobiosis. Integrative and Comparative Biology. 42: 497–503.
Cruz, P. M., Ibanez, A. L., Hermosillo, O. A. M. and Saad, H. C. R. 2012. Review Article Use of Probiotics in Aquaculture. International Scholarly Research
Desmond, C., Ross, R. P., O'Callaghan, E., Fitzgerald, G. and Stanton, C. 2002. Improved Survival of Lactobacillus paracasei NFBC 338 in Spray–Dried Powders Containing Gum Acacia. Journal of Applied Microbiology. 93(6): 1003–1011.
[FAO] Food and Agriculture Organization. 2002. Guidelines for The Evaluation of Probiotics in Food. London, United Kingdom.
Feucht, Aand Kwak, H. S. 2013. Microencapsulation of Lactic Acid Bacteria.
Korean Journal of Food Science and Technology.33(2): 229–238.
Fritzen–Freire, C.B., Prudêncio, E.S., Pinto, S.S., Muñoz I.B. and Amboni R.D.M. C. 2013. Effect of Microencapsulation on Survival of
Bifidobacterium BB–12 Exposed to SimulatedGastrointestinal Conditions
and Heat Treatments. Food Science Technology. 50: 39–44.
Fuller, R. 1992. Probiotics: The Science Basis. Chapman and Hall. London.
Fu, N. and Chen, X. D. 2011. Towards A Maximal Cell Survival in Convective Thermal Drying Processes. Food Research International. 44: 1127–1149.
Gatesoupe, F. J. 1999. The Use of Probiotic in Aquaculture. Review. Aquaculture. 180(2): 147–165.
Gibson, G. R. and Roberfroid, M. B. 1995. Dietary Modulation of The Human Colonic Microbiota. Introducing The Concept of Prebiotics. Journal of
Nutrition. 125: 1401–1412.
Gourbeyre, P., Denery, S. and Bodinier, M. 2011. Probiotics, Prebiotics and Synbiotics: Impact on The Gut System and Allergic Reactions. Journal of
Leukocyte Biology. 89(5): 685–695.
Harmayani, E., Ngatirah., Rahayu, E.S. and Utami, T. 2001. Ketahanan dan Viabilitas Probiotik Bakteri Asam Laktat selama Proses Pembuatan Kultur Kering dengan Metode Freeze dan Spray Drying. Jurnal Teknologi dan
Industri Pangan. 12: 126–132.
Hsio, H. C., Lian, W. C. and Chou, C. C. 2004. Effect of Packaging Conditions and Temperature on Viability of Microencapsulated Bifidobacteria During Storage. Journal of the Science of Food and Agriculture. 84(2): 134–139.
Kailasapathy, K. 2002. Microencapsulation of Probiotic Bacteria: Technology and Potential Applications. Current Issues Interest of Microbiology. 3(2): 39– 48.
Krasaekoopt, W., Bhandari, B. and Deeth, H. 2003. Evaluation of Encapsulation Techniques of Probiotics for Yoghurt. Review. International Dairy
Journal. 13: 3–13.
Kuar, N. and Gupta, A. K. 2002. Application of Inulin and Oligofructose. British
Journal of Nutrition. 1: 193–197.
Li, X. Y., Chen, X. G., Cha, D. S., Park, H. J. and Liu, C. S. 2009. Microencapsulation of A Probiotic Bacteria with Alginate–Gelatin and Its Properties. Journal of Microencapsulation. 26(4): 315–324.
Lian, W. C., Hsio, H. C. and Chou, C. C. 2003. Viability of Microencapsulated Bifidobacteria in Simulated Gastric Juice and Bile Solution. International
Journal of Food Microbiology. 86: 293 – 301.
Maciel, G. M., Chaves, K. S., Grosso, C. R. F. and Gigante, M. L. 2014. Microencapsulation of Lactobacillus acidophilus La–5 by Spray–Drying Using Sweet Whey and Skim Milk as Encapsulating Materials. Journal of
Dairy Science. 97: 1991–1998.
Marteau, P., Minekus, M., Havenaar, R.and Huis In’t veld, J. H. J. 1997. Survival of Lactic Acid Bacteria in A Dynamic Model of The Stomach and Small Intestine: Validation and The Effects of Bile. Journal Dairy Science. 80: 1031–1037.
McNeely, W. H and Pettit, D. J. 1973. Alginat in Industrial Gum Polysaccharides and Their Derivates. Academic Press. New York.
Mortazavian, A., Razavi, S. H., Ehsani, R. M. and Sohrabvandi, S. 2007. Principles and Methods of Microencapsulation of Probiotic Microorganisms. Iranian Journal of Biotechnology. 5(1): 1–18.
Nag, A. 2011. Development of A Microencapsulation Technique for Probiotic Bacteria Lactobacillus casei 431 Using A Protein–Polysaccharide Complex. [Thesis]. New Zealand: Massey University.
Nedovic, V., Kalusevic, A., Manojlovic, V., Levic S. and Bugarski, B. 2011. An Overview of Encapsulation Technologies for Food Applications. Procedia
Food Science. 1: 1806–1815.
Nursyirwani, Asmara, W.,Wahyuni, A. E. T. H., dan Triyanto. 2011. Properti Probiotik Isolat Bakteri Asam Laktat untuk Mengendalikan Pertumbuhan
Vibrio alginolyticus pada Ikan Kerapu Macan (Epinephelus fuscoguttatus). Ilmu Kelautan. 16: 151–158.
Pan, L. X., Fang, X. J., Yu, Z. 2013. Encapsulation in Alginate–Skim Milk Microspheres Improves Viability of Lactobacillus bulgaricus in Simulated Gastrointestinal Conditions. International Journal of Food Sciences and Nutrition. 64(3): 380–384
Parker, R. B. 1974. Probiotics The Other Half of The Antibiotic Story. Animal
Nutrien Health. 29: 4–8.
Poshadri, A and Kuna, A. 2010. Microencapsulation Technology. Review.
Journal Of Research Angrau. 38(1): 86–102.
Refstie, S., Bakke–Mckellep, A. M., Penn, M. H., Sundby, A., Shearer, K. D. and Krogdahl, A. 2006. Capacity for Digestive Hydrolysis and Amino Acid Absorption in Atlantic Salmon (Salmosalar) Fed Diets with Soybeans Meal or Inulin with or without Addition of Antibiotics. Aquaculture. 261: 392–406.
Rizqiati, H. 2006. Ketahanan dan Viabilitas Lactobacillus plantarum yang Dienkapsulasi dengan Susu Skim dan Gum Arab Setelah Pengeringan dan Penyimpanan. [Thesis]. Institut Pertanian Bogor.
Rodrigues, A. P., Hirsch, D., Figueiredo, H. C. P., Logato, P. V. R. and Moraes, A. M. 2006. Production and Characterisation of Alginate Microparticle Incorporating Aeromonas hydrophila Designed for Fish Oral Vaccination.
Process Biochemistry. 41: 638–643.
Rosas–Ledesma, P., Leon–Rubio, J. M., Alarcon, F. J., Morinigo, M. A., Balebona, M. C. 2012. Calcium Alginate Capsules for Oral Administration of Fish Probiotic Bacteria: Assessment of Optimal Conditions for Encapsulation. Aquaculture Research. 43: 106–116.
Setiawati, J. E., Tarsim, Adiputra, Y.T. dan Hudaidah, S. 2013. Pengaruh Penambahan Probiotik pada Pakan dengan Dosis Berbeda Terhadap Pertumbuhan, Kelulus hidupan, Efisiensi Pakan dan Retensi Protein Ikan Patin (Pangasius hypophthialmus). Jurnal Rekayasa dan Teknologi
Budidaya Perairan. 1: 151–162.
Shah, N.P. 2000. Probiotic Bacteria: Selective Enumeration and Survival in Dairy Foods. Journal of Dairy Science. 83: 894–907.
Sheu, T. Y. and Marshall, R. T. 1993. Microencapsulation of Lactobacilli in Calcium Alginate Gels. Journal of Food Science.54: 557 – 561.
Sitinjak, T. P. 2015. Pengendalian Biofilm Edwardsiella tarda pada Permukaan Sisik Ikan dan Plastik PVC dengan Senyawa Antimikroba yang Dihasilkan oleh Bakteri Asam Laktat (BAL). [Skripsi]. Universitas Sumatera Utara.
Starch and Evaluation of Survival in Simulated Gastrointestinal Conditions and in Yoghurt. International Journal of Food Microbiology. 62: 47–55.
Syahrurahman, A. 1994. Mikrobiologi Kedokteran. Penerbit Bina Rupa Aksara. Jakarta.
Verschuere, L., Rombaut, G., Sorgeloos, P. and Verstraete, W. 2000. Probiotic Bacteria as Biological Control Agents in Aquaculture. Microbiology and
Molecular Biology Reviews. 64: 655–671.
Vidhyalaksmi, R., Bhakyaraj, R and Subhasree, R. S. 2009. Encapsulation The Future of Probiotic. Review. Advance in Biological Research. 3: 96–103.
METODE PENELITIAN
3.1. Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Juli sampai September 2015 bertempat di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2. Prosedur Penelitian
3.2.1. Pemeriksaan dan Persiapan Kultur BAL PG 7
Bakteri asam laktat isolat PG 7 merupakan hasil isolasi dari saluran pencernaan ikan nila (Sitinjak, 2015)terlebih dahulu disubkultur dalam 10 ml MRSB dan diinkubasi pada suhu 37 °C selama 24 jam. Pemeriksaan kemurnian kultur dilakukan melalui pemeriksaan morfologi secara mikroskopik dengan metode pewarnaan Gram dan uji katalase. BAL adalah kelompok bakteri Gram positif dan katalase negatif. Pemanenan kultur dilakukan dengan menumbuhkan kembali BAL PG 7dalam 10 ml MRSB selama 24 jam pada suhu 37 °C. Satu ml dari kultur diinokulasikan pada 100 ml MRSB, yang digunakan sebagai kultur antara. Sebanyak 10 ml kultur antara ditumbuhkan pada 1000 ml MRSB (1:100) yang digunakan untuk produksi biomassa (Harmayani et al. 2001 dengan modifikasi pada media). Selanjutnya biomasa dipanen pada akhir fase logaritmik (kultur berumur 18 jam) (Sitinjak, 2015). Sel dipanen dengan cara sentrifugasi pada kecepatan 5000 xg selama 10 menit pada 4 °C, dan dicuci dengan PBS (Phospate Buffered Saline) sebanyak 3 kali (Li et al. 2009 dengan modifikasi).
3.2.2 Enkapsulasi Sinbiotik dengan Teknik Ekstrusi
menggunakan syringe23G x 1¼ (0,60 x 32 mm) dengan jarak tetes ±10 cm dan dilakukan pengadukan 150-200 rpm menggunakan magnetic stirrer. Pengerasan mikrokapsul dilakukan selama satu jam (Li et al. 2009). Mikrokapsulyang dihasilkan kemudian disaring dan dibilas dengan NaCl (0,85%) steril untuk mendapatkan struktur yang kompak. Mikrokapsulbasah dimasukkan ke dalam wadah steril. Penghitungan jumlah sel yang terenkapsulasi dalam mikrokapsulmengacu pada metode Sheu dan Marshal (1993). Sebanyak 1 gram mikrokapsul basah disuspensikan ke dalam PBS (0,1 M; pH 7,1) dan dicukupkan volumenya hingga 10 ml, lalu dihomogenkan dengan vorteks selama 30 menit dan diencerkan berseri menggunakan garam fisiologis. Sebanyak 1 ml dari pengenceran diinokulasikan pada MRS agar dengan metode tuang, diinkubasi pada suhu 37 °C selama 48 jam dan dihitung jumlah koloni bakteri yang tumbuh. Selanjutnya dilakukan pemeriksaan ukuran dan bentuk mikrokapsul. Penghitungan efisiensi enkapsulasi adalah sebagai berikut:
EE (%)=Xt
Xi×100%
EE = Efisiensi Enkapsulasi (%)
Xt = Jumlah sel bakteri terenkapsulasi (log CFU g-1)
Xi = Jumlah sel bakteri inisial yang akan dienkapsulasi (log CFU g-1)
3.2.3. Pengeringan Mikrokapsul
Pengeringan dilakukan dengan metode hot air oven pada suhu 40 °C. Waktu pengeringan dilakukan hingga dicapai jumlah sel bakteri yang cenderung stabil sebelum akhirnya mengalami penurunan. Mikrokapsul disebarkan ke dalam cawan petri steril kemudian dimasukkan ke dalam oven bersuhu 40 °C. Setiap 30 menit dilakukan penghitungan jumlah sel dan penimbangan mikrokapsul. Penimbangan mikrokapsul dilakukan untuk mengetahui kadar air setelah proses pengeringan. Penghitungan kadar air mikrokapsul adalah sebagai berikut:
Kat=MBt-MBK
Kat = Kadar air mikrokapsul pada jam ke-t (%) MBt = Massa mikrokapsul pada jam ke-t (gram)
MBK = Massa kering (dry matter) mikrokapsul (105 °C) (gram)
t = Waktu (lama) pengeringan (menit)
Sebelum dan setelah proses pengeringan dilakukan penghitungan jumlah sel terenkapsulasi untuk menguji pengaruh enkapsulasi terhadap ketahanan atau viabilitas sel selama proses pengeringan. Penghitungan jumlah sel yang bertahan setelah proses pengeringan dilakukan dengan mensuspensikan 1 gram mikrokapsul kering ke dalam PBS (0,1 M, pH 7,1) dan dicukupkan volumenya hingga 10 ml lalu dihomogenkan dengan vorteks selama 30 menit hingga mikrokapsul hancur dan diencerkan berseri menggunakan garam fisiologis. Sebanyak 1 ml dari pengenceran diinokulasikan pada MRS agar dengan metode tuang dinkubasi pada suhu 37 °C selama 48 jam dan dihitung jumlah koloni bakteri yang tumbuh (Sheu dan Marshal, 1993).
3.2.4 Uji Viabilitas Sinbiotik Terenkapsulasi pada Suhu dan Masa Simpan Pengujian viabilitas terhadap suhu dan masa simpan dilakukan dengan cara menyimpan kapsul dalam wadah steril selama 4 minggu pada suhu 4 °C dan suhu ambient. Penurunan viabilitas sel dihitung setiap 1 minggu. Satu gram mikrokapsul dimasukkan dalam ke dalam PBS dan dicukupkan volumenya hingga 10 ml lalu dihomogenkan dengan vorteks dibuat seri pengenceran dan diinokulasikan pada MRS agar diinkubasi selama 24-48 jam pada suhu 37 °C. Persentase ketahanan atau viabilitas sel dinyatakan sebagai berikut:
Ketahanan (%) = Log cfu gram ⁄ kapsul setelah penyimpanan pada waktu t
Log cfu gram ⁄ kapsul awal sebelum penyimpanan ×100%
3.2.5. Analisis Total Kapang Khamir Mikrokapsul
3.2.6. Uji Viabilitas Sel Bebas dan Sinbiotik Terenkapsulasi dalam Simulasi pH Lambung dan Cairan Usus Ikan
Bakteri asam laktat isolat PG7merupakan hasil isolasi dari saluran pencernaan ikan Nila, sehingga untuk melakukan uji ketahanannya disesuaikan dengan kondisi saluran pencernaan ikan Nila. Sel bebas dalam larutan NaCl fisiologis (108-109 CFU/ml) dan 1 gram kapsul dimasukkan ke dalam 9 mL garam fisiologis pH 2 (simulasi pH lambung) yang diatur dengan menggunakan HCL 1M, diinkubasi selama 30, 60, 90, dan 120 menit pada suhu 37 oC. Kemudian kapsul ditransfer ke dalam larutan PBS pH 6,8 (simulasi cairan intestinal), diinkubasi selama 180 menit pada suhu 37 °C (Rodrigues et al. 2006; Li et al. 2009). Populasi sel yang bertahan di dalam kapsul dihitung setiap 30 menit dengan cawan hitung pada media MRS agar lalu diinkubasi pada suhu 37 °C selama 24 jam.
3.2.7. Analisis Kecepatan Pembebasan (Release) Sel Terenkapsulasi
Sebanyak 1 gram kapsul dimasukkan ke dalam PBS pH 6,8 (disesuaikan dengan pH cairan intestinal) dan dicukupkan volumenya hingga 10 ml, diinkubasi pada suhu 37 °C dengan kecepatan 100 rpm (Pan et al. 2013). Jumlah sel bakteri yang terbebas (release) dihitung setiap 30 menit hingga dicapai persentase sel
release sebesar 100% dengan metode hitungan cawan pada media MRS agar
setelah diinkubasi pada 37 °C selama 48 jam. Penghitungan persentase sel release pada waktu-t adalah sebagai berikut:
Sel release (%) = Log cfu ml ⁄ sel release pada waktu-t
HASIL DAN PEMBAHASAN
4.1. Ukuran, Morfologi dan Efisiensi Enkapsulasi Mikrokapsul
Enkapsulasi probiotik menggunakan campuran alginat, susu skim, dan inulin dengan teknik ekstrusi menghasilkan mikrokapsul dengan diameter rata-rata 1,91±0,27 mm dan memiliki struktur yang kompak berbentuk bola (spherical) (Gambar 4.1). Ukuran mikrokapsul yang dihasilkan pada penelitian ini diduga cukup baik untuk diaplikasikan pada ikan secara oral karena ukurannya yang relatif kecil. Beberapa penelitian mengaplikasikan mikrokapsul secara oral pada ikan, diantaranya Rosas-ledesma et al. (2012) mengenkapsulasi Shewanellaputrefaciens diaplikasikan pada ikan S. senegalensis secara oral
menghasilkan kapsul dengan ukuran 2,5-3,18 mm. Hasilnya menunjukkan bahwa enkapsulasi Shewanella putrefaciens yang diberikan secara oral pada ikan menunjukkan ketahanan yang tinggi pada saluran pencernaan dibandingkan dengan pemberian probiotik dalam bentuk sel bebas yang dicampurkan pada pelet ikan.
Gambar 4.1. Mikrokapsul sinbiotik isolat BAL PG7 hasil enkapsulasi metode ekstrusi dengan mikroskop stereo (a) pencahayaan bawah (b) pencahayaan atas
Pada penelitian ini, diperoleh efisiensi enkapsulasi sebesar 92,69% yang menunjukkan bahwa mikrokapsul memiliki efektivitas yang tinggi dalam menjerat sel. Tingginya tingkat efisiensi pada mikrokapsul ini dipengaruhi oleh konsentrasi bahan pengkapsul. Penelitian Castilla et al. (2010) menemukan bahwa efisiensi
enkapsulasi meningkat secara signifikan dengan meningkatnya konsentrasi biopolimer. Krasaekoopt et al. (2003), melaporkan bahwa efisiensi enkapsulasi probiotik dengan metoda ekstrusi dan emulsi dalam menjerat sel adalah sebesar 80−95 %.
4.2 Viabilitas dan Kadar Air Mikrokapsul Setelah Pengeringan
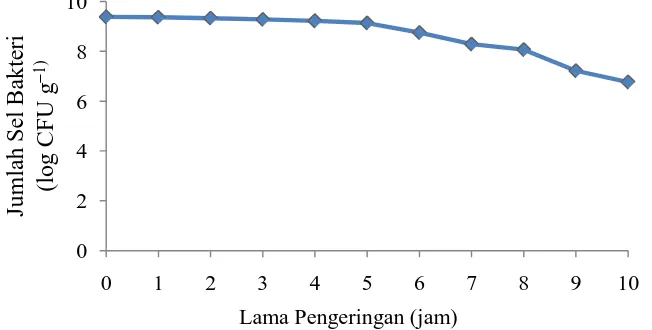
Mikrokapsul yang dihasilkan dari proses enkapsulasi selanjutnya dikeringkan menggunakan oven bersuhu 40 °C. Pengeringan ini bertujuan untuk mendapatkan sel terenkapsulasi dalam bentuk kering. Grafik pengaruh pengeringan terhadap viabilitas sel terenkapsulasi dapat dilihat pada Gambar 4.2.
Gambar 4.2. Grafik pengaruh lama pengeringan terhadap viabilitas BAL isolat PG7 terenkapsulasi
Ketahanan mikrokapsul selama pengeringan juga dipengaruhi oleh bahan pengisi yang digunakan, yaitu susu skim. Ketersediaan laktosa dan protein susu pada susu skim akan berinteraksi dengan membran sel bakteri untuk mencegah kerusakan membran selama proses penghilangan air (Hsio et al. 2011). Penelitian Adrianto (2011) menunjukkan bahwa, setelah pengeringan selama 6 jam viabilitas bakteri terenkapsulasi dengan bahan alginat-skim lebih tinggi (2,1 x 105 CFU g-1) dibandingkan dengan bahan alginat saja (< 102CFU g-1). Pada penelitian ini, waktu pengeringan yang digunakan untuk mengeringkan mikrokapsul pada suhu 40 °C adalah selama 8 jam dengan jumlah populasi sebesar 8,07 log CFU g-1 yang merupakan jumlah produk probiotik yang masih layak untuk digunakan.
4.3 Viabilitas Mikrokapsul Selama Penyimpanan
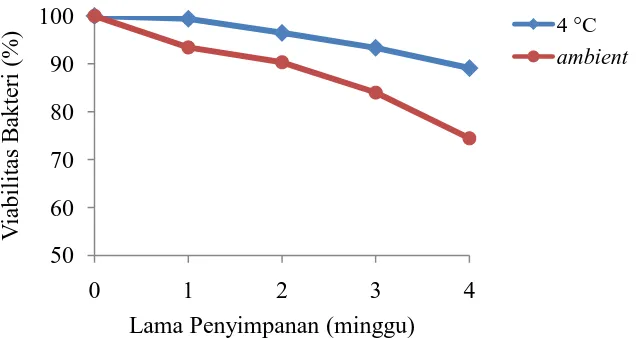
Mikrokapsul yang telah dikeringkan selanjutnya disimpan pada suhu 4 °C dan suhu ambient selama 4 minggu. Viabilitas bakteri terenkapsulasi menurun seiring dengan meningkatnya masa simpan. Pada suhu 4 °C, penurunan jumlah sel bakteri mikrokapsul setelah 4 minggu adalah 0,88 log CFU g-1 dengan viabilitas sebesar 89,10%, secara signifikan lebih tinggi dibandingkan pada suhu ambient dimana terjadi penurunan 2,06 log CFU g-1 dan viabilitas mikrokapsul sebesar 74,47% (Gambar 4.3).
Gambar 4.3. Grafik viabiltas BAL isolat PG7 terenkapsulasi selama penyimpanan pada suhu 4 °C dan suhu ambient
Jumlah bakteri terenkapsulasi hingga minggu ke-4 pada suhu 4 °C dan suhu ambient berturut-turut sebesar 7,19 dan 6,01 log CFU g-1. Hasil ini
menunjukkan bahwa mikrokapsul pada suhu 4 °C bisa disimpan dalam waktu lebih dari 4 minggu. Hasil yang sama juga dilaporkan oleh Maciel et al. (2014), viabilitas Lactobacillusacidophilus yang dienkapsulasi dengan susu skim yang disimpan pada suhu 4 °C sebesar 7,11±0,12 CFU g-1, lebih tinggi dibandingkan suhu penyimpanan 25 °C yakni 6,94±0,06 log CFU g-1.
Penelitian Pan et al. (2013), viabilitas L. bulgaricus yang dienkapsulasi dengan alginat-susu skim pada penyimpanan 4 °C selama 4 minggu menurun sebesar 1,74 log CFU g-1. Dalam hal ini penyimpanan mikrokapsul pada suhu 4 °C lebih baik dibandingkan suhu ruang karena penyimpanan pada suhu 4 °C menyebabkan pertumbuhan bakteri lebih lambat sehingga nutrisi tersedia untuk pertumbuhan dalam waktu yang lebih panjang, oleh karena itu sel bakteri dapat bertahan hidup dalam waktu yang lebih lama. Pada penelitian ini, viabilitas mikrokapsul masih cukup tinggi pada suhu 4 °C hingga minggu ke-4 yakni 1,6 x 107CFU g-1. Jumlah ini masih layak digunakan karena jumlah minimal probiotik yang baik untuk digunakan menurut WHO adalah 107CFU g-1.
4.4 Analisis Total Kapang Khamir Mikrokapsul
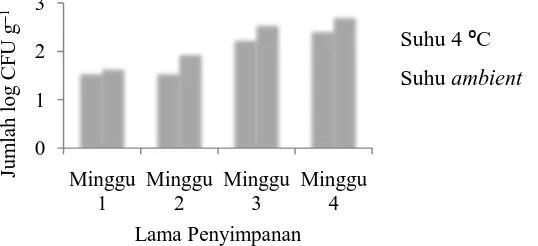
Setelah penyimpanan ditemukan adanya kontaminasi khamir pada mikrokapsul tetapi tidak ditemukan kapang. Total khamir pada mikrokapsul yang disimpan pada suhu 4 °C dan suhu ambien hingga minggu ke-4 berturut-turut ialah2,48 dan 2,77 log CFU g-1 (Gambar 4.4). Adanya kontaminasi ini diduga karena suhu pengeringan yang digunakan masih terlalu rendah untuk menghilangkan kontaminasi khamir.
Jumlah kontaminasi khamir pada penelitian ini lebih tinggi dibandingkan hasil yang dilaporkan oleh Risqiati et al. (2009) dimana kontaminasi kapang khamir pada mikrokapsul probiotik dengan teknik pengeringan spray-dry yaitu sekitar 1,2-1,9 log CFU g-1. Sedangkan, Seveline (2005) melaporkan kontaminasi kapang khamir pada produk mikrokapsul probiotik dengan teknik spray-dry dengan bahan enkapsulan dekstrin dan triasil gliserol sekitar 0,5-1,1 log CFU g-1. Pada spesifikasi persyaratan mutu SNI no. 01-2970-1999 standar maksimal angka cemaran mikroba total yang ditetapkan adalah 5 x 105 CFU g-1. Pada penelititan ini, kontaminasi khamir pada mikrokapsul jumlahnya masih di bawah standar maksimal angka cemaran mikroba, sehingga produk yang dihasilkan masih aman untuk digunakan.
4.5 Viabilitas Sel Bebas dan Mikrokapsul dalam Kondisi Simulasi pH Lambung dan Cairan Usus
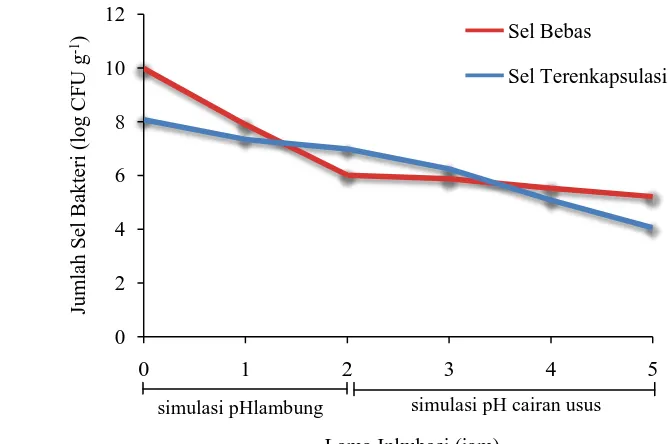
Dalam menjalankan perannya, sel probiotik harus bertahan hidup pada sistem pencernaan untuk dapat memberikan manfaat bagi inang. Simulasi asam lambung dan usus halus dilakukan untuk menguji ketahanan bakteri dalam bentuk sel bebas dan terenkapsulasi terhadap kondisi pH lambung dan usus. Hasil penelitian menunjukkan sel probiotik dalam bentuk terenkapsulasi memberikan ketahanan yang lebih baik terhadap pH lambungdibandingkan dalam bentuk sel bebas (Gambar 4.5).
yang lebih tinggi pada simulasi gastrointestinal dibandingkan dengan enkapsulasi bakteri tanpa prebiotik. Ayama et al. (2014), menyatakan bahwa enkapsulasi probiotik dalam alginat 3% dan hi-maize 2% memberikan ketahanan sebesar 92,97% setelah terpapar selama 3 jam pada simulasi asam lambung.
Gambar 4.5. Grafik populasi sel bebas dan sel terenkapsulasi BAL isolat PG 7 pada kondisi simulasi pH lambung dan cairan usus
Selama simulasi pH cairan usus, populasi sel bebas tetap stabil dan tidak mengalami penurunan jumlah sel yang signifikan. Hal ini disebabkan karena pH simulasi cairan usus adalah pH netral yang merupakan kondisi yang sesuai bagi sel bakteri untuk tetap hidup. Sedangkan pada sel terenkapsulasi, jumlah sel di dalam mikrokapsul berangsur-angsur menurun diduga karena sel keluar dari mikrokapsul menuju cairan usus. Pada cairan simulasi usus, struktur mikrokapsul mengembang, menyebabkan pori-pori mikrokapsul semakin membesar sehingga sel yang terperangkap dalam kapsul keluar menuju cairan usus (Kailasapathy et al. 2002). Hasil yang hampir sama juga diperoleh Annan et al. (2008), dimana
populasi B. adolescentis dalam bentuk sel bebas tetap stabil pada simulasi cairan usus hingga 4 jam diduga karena sel bakteri melakukan pemulihan (recovery) setelah kerusakan akibat terpapar pH rendah, sementara Li et al. (2009) melaporkan bahwa jumlah L. casei terenkapsulasi yang keluar dari kapsul lebih
0
tinggi pada simulasi pH cairan usus (pH 6,8) dibandingkan pada simulasi pH lambung (pH 2).
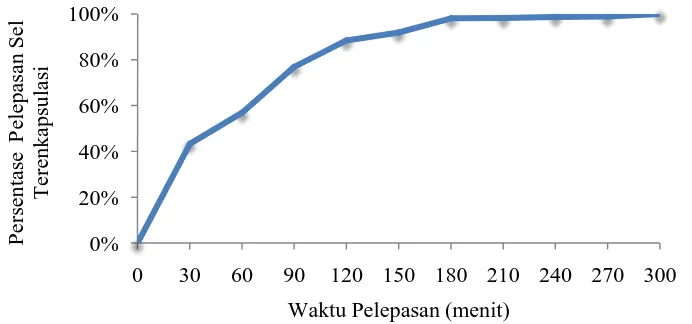
4.6 Kemampuan Pelepasan (Release) Sel Terenkapsulasi
Selain harus bertahan hidup pada lingkungan yang kurang menguntungkan, probiotik terenkapsulasi juga harus mampu keluar (release) dari mikrokapsul untuk dapat memberikan manfaat baik pada targetnya. Mikrokapsul dari bahan alginat akan mengembang pada pH netral menyebabkan pori-pori kapsul semakin membesar sehingga memberikan jalan bagi sel-sel bakteri untuk keluar.
Kemampuan sel untuk keluar dari mikrokapsul setelah direndam pada PBS (PhosphateBufferSaline) pH 6,8 meningkat secara signifikan seiring dengan meningkatnya waktu inkubasi. Pada 30 menit pertama persentase jumlah sel yang keluar sebesar 43,67% dari jumlah sel awal kemudian meningkat hingga 98,09% setelah 3 jam. Setelah diinkubasi selama 4-5 jam, kemampuan sel release berturut-turut sebesar 98,65% dan 99,91% (Gambar 4.6). Kecepatan sel release ini diduga dipengaruhi oleh konsentrasi alginat. Semakin rendah konsentrasi alginat yang digunakan, akan mempercepat pelepasan sel dari mikrokapsul. Penelitian Ayama et al. (2013) menemukan bahwa kemampuan L. plantarum untuk keluar dari kapsul alginat pada larutan PBS pH 7,2 selama 2 jam sebesar 97,00; 90, 25; 87,81 % dengan konsentrasi alginat berturut-turut 1,2 dan 3%.
Gambar 4.6 Kemampuan sel terenkapsulasi isolat PG7 release pada pH netral
Dalam aplikasinya pada lingkungan akuatik, probiotik terenkapsulasi juga dapat keluar dari mikrokapsul menuju lingkungan hidup (air) untuk melindungi
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Probiotik air tawar yang dienkapsulasi dengan alginat-susu skim dan penambahan prebiotik inulin memiliki ketahanan tinggi selama proses pengeringan suhu 40 °C, lama penyimpanan, dan kondisi pH saluran pencernaan. Mikrokapsul secara umum berbentuk bulat dan kompak dengan diameter rata-rata 1,91±0,27 mm dan merupakan ukuran yang cukup baik untuk diaplikasikan pada ikan secara oral. Jumlah kontaminasi khamir setelah penyimpanan satu bulan berkisar 2,48-2,77 log CFU/g. Viabilitas probiotik air tawar terenkapsulasi secara signifikan lebih tinggi dibandingkan dalam bentuk sel bebas pada simulasi pH saluran pencernaan. Probiotik air tawar juga mampu keluar dari mikrokapsul secara keseluruhan pada pH netral selama 3 jam. Mikrokapsul probiotik air tawar dengan penambahan prebiotik inulin ini menunjukkan karakteristik yang cukup baik dan efisien dalam mempertahankan viabilitas probiotik pada kondisi pH saluran pencernaan, lama penyimpanan, pengeringan, tingkat kontaminasi, serta mampu keluar pada pH netral sehingga cukup baik untuk diaplikasi pada budi daya ikan air tawar.
5.2 Saran
2.1. Probiotik Akuakultur
Probiotik didefinisikan sebagai sel mikroba hidup yang jika dikonsumsi dalam jumlah yang cukup akan memberikan manfaat kesehatan (FAO, 2002). Istilah probiotik pertama kali didefinisikan oleh Parker pada tahun 1974 sebagai organisme atau substansi yang berkontribusi terhadap keseimbangan saluran pencernaan. Sedangkan Fuller (1992), mengembangkan definisi ini menjadi suplemen yang tersusun oleh mikroba hidup yang memberi manfaat dengan meningkatkan keseimbangan mikroba saluran usus hewan inang. Adapun Gatesoupe (1999), mendefinisikan probiotik sebagai sel mikroba yang masuk ke saluran pencernaan dan masih tetap hidup untuk memberikan dampak kesehatan. Selain meningkatkan keseimbangkan mikroba dalam saluran pencernaan, probiotik juga telah dilaporkan berperan dalam memodulasi imunitas, menurunkan kadar kolestrol, membantu penguraian laktosa dan mencegah kanker (Kaisalapathy, 2002).
mikroba yang ditambahkan untuk memberi manfaat pada saluran pencernaan, pada struktur permukaan dan pada lingkungan hidup inang (Verschuere et al. 2000).
Keamanan dan kemanjuran probiotik sangat ditentukan oleh karakter dan jumlah bakteri yang digunakan. Oleh karena itu, dalam menilai keamanan dan kemanjuran suatu produk probiotik beberapa faktor harus diperhatikan diantaranya sifat-sifat bakteri yang akan digunakan seperti kemampuan bakteri untuk terus hidup (viability) selama proses produksi, ketika bakteri berada dalam produk (carrier), ketika berada dalam saluran pencernaan dan ketika dalam penyimpanan. Bakteri mudah mengalami degradasi oleh panas, cahaya, kelembapan, dan oksigen. Produk probiotik biasanya harus disimpan di pendingin untuk dijaga agar bakteri tetap hidup dan aktif. Sifat bakteri probiotik lainnya yang harus diperhatikan adalah ketahanannya terhadap antibiotik dan tidak memiliki sifat virulen (dapat menyebabkan penyakit) (Corona-Hernandez, 2013).
Mikroba yang umum digunakan sebagai probiotik adalah bakteri asam laktat (BAL) karena kemampuannya mengkonversi laktosa menjadi asam laktat. Beberapa BAL probiotik yang digunakan pada budi daya akuakultur antara lain
Bacillus, Carnobacterium divergens, Alteromonas, Lactobacillus helveticus, L.
lactis, L. casei, L. rhamnosus, L.acidophilus, Streptococcus thermophilus,
Streptomyces, Enterococcus faecium, Micrococcus luteus, Pseudomonas
fluorescens, Tetraselmis suecica, Pediococcus acidilactici,dan Shewanella
putrefaciens (Cruz et al. 2012).
2.2.Bakteri Asam Laktat
pertumbuhannya hanya terbatas pada lingkungan yang menyediakan cukup gula atau bisa disebut dengan lingkungan yang kaya nutrisi. Kemampuan mereka untuk mengasilkan senyawa (biosintesis) juga terbatas dan kebutuhan nutrisi kompleks BAL meliputiasam amino,vitamin, purin, dan pirimidin (Syahrurahman, 1994).
2.3. Prebiotik
Prebiotik didefinisikan sebagai suatu bahan makanan yang tidak dapat dicerna namun memberikan manfaat positif bagi tubuh karena secara selektif menstimulir pertumbuhan dan aktivitas bakteri baik dalam usus besar (Gibson dan Roberfroid, 1995). Prebiotik pada umumnya merupakan karbohidrat seperti fruktooligo sakarida (FOS), galaktooligosakarida (GOS), transgalaktooligosakarida (TOS), dan laktulosa. Fruktooligosakarida (FOS) adalah nama umum dari jenis oligosakarida yang mengandung fruktosa, yang termasuk didalamnya adalah inulin dan oligofruktosa (Yousefian & Amiri, 2009).
Inulin merupakan salah satu jenis fruktan atau polimer fruktosa yang mengandung sekitar 35 unit fruktosa yang dihubungkan dengan ikatan ß-2,1 glikosidik. Inulin banyak terdapat dalam umbi tanaman seperti akar dahlia, artichoke, chicory, dan bawang (Kuar & Gupta, 2002). Aplikasi prebiotik inulin sebagai pakan pada sistem akuakultur telah memberikan manfaat yang signifikan. Refstie et al. (2006), melaporkan bahwa suplementasi pakan ikan dengan inulin mampu meningkatkan efisiensi dan absorpsi pakan pada ikan salmon. Olsen et al. (2001), melaporkan bahwa inulin yang ditambahkan pada pakan secara signifikan meningkatkan populasi mikroflora pada saluran pencernaan ikan.
Prebiotik juga digunakan sebagai bahan enkapsulan, karena sifatnya yang
nondigestible. Penggunaannya sering dikombinasikan dengan bahan karbohidrat
maupun protein. Kombinasi susu skim-inulin ataupun oligosakarida dalam enkapsulasi menghasilkan perlindungan yang tinggi bagi Bifidobacterium BB-12 pada kondisi simulasi saluran pencernaan dan proses pemanasan (Fritzen-Freire et
al. 2013).
meningkatkan daya tahan hidup bakteri probiotik oleh karena substrat yang spesifik telah tersedia untuk aktivitasnya sehingga inang mendapat manfaat yang lebih sempurna dari kombinasi ini (Gourbeyre et al. 2011; Jirillo et al. 2012).
2.4. Enkapsulasi
Enkapsulasi didefinisikan sebagai proses menyalut suatu substansi dalam bahan pelindung. Substansi yang dilindungi dapat disebut inti (core), pengisi (filler) ataupun muatan internal. Subtansi tersebut dapat berupa molekul bioaktif (seperti antioksidan, mineral, vitamin, fitosterol, lutein, asam lemak, lycopen dan sel hidup (seperti probiotik). Sedangkan bahan pelindung disebut mantel (coating), membran, kapsul, material pembawa (carrier) ataupun matriks (Nedovic et al. 2011).
Enkapsulasi membantu memisahkan material inti dengan lingkungannya hingga material tersebut terlepas (release) ke lingkungan (Kailasapathy, 2002). Dalam hal ini, kapsul berperan sebagai membran yang membatasi material inti dengan lingkungan juga mengatur pelepasannya ketika mencapai lingkungan target. Sehingga, ukuran dan bahan kapsul harus disesuaikan agar material inti mudah berdifusi keluar kapsul (Vidhyalakshmi et al. 2009). Kapsul terbuat dari bahan semipermeabel, tipis, berbentuk bulat dan kuat sehingga material inti dapat tertahan dalam kapsul. Ukuran dari kapsul umumnya bervariasi dari beberapa mikrometer hingga milimeter (Anal & Singh, 2007).
Enkapsulasi secara alami dapat terjadi ketika sel bakteri tumbuh dan menghasilkan ekso-polisakarida. Sel mikroba terperangkap dalam sekret yang dihasilkannya sebagai struktur pelindung atau kapsul sehingga mikroba tidak langsung terpapar dengan faktor lingkungan. Banyak bakteri asam laktat yang mampu mensintesis ekso-polisakarida tetapi dalam kondisi yang tidak mencukupi untuk menyalut sel mikroba tersebut secara keseluruhan (Shah, 2000).
probiotik selama proses enkapsulasi dan pengeringan, pembuatan produk dan penyimpanan, ketahanannya dalam kondisi saluran pencernaan, seta kemampuan sel untuk release ke lingkungan target (Krasaekoopt et al. 2003; Mortazavian et
al. 2007).
2.5. Teknik Ekstruksi
Metode yang paling umum dalam enkapsulasi bakteri probiotik adalah penyalutan dalam bentuk matriks gel dengan teknik ekstrusi atau emulsi (menggunakan mekanisme pembentukan gel ionotrofik), spray drying, spray
chilling dan freeze drying (Nag, 2011). Metode lainnya adalah koaservasi,
liposom, molekuler inklusi, fluidized bed coating, sentrifugal suspension
separation, liofilisasi, ko-kristalisasi (Champagne & Futsier, 2007; Poshadri &
Kuna, 2010).
Teknik ekstrusi merupakan salah satu teknik paling umum untuk memproduksi kapsul hidrokoloid. Metode ini juga dikenal sebagai metode tetesan (droplet method) dan mampu mempertahankan viabilitas probiotik hingga 95% (Feucht & Kwak, 2013). Teknik ekstrusi dilakukan dengan cara menambahkan mikroorganisme probiotik ke dalam larutan hidrokoloid natrium alginat, kemudian diteteskan ke dalam larutan pengeras (CaCl2) menggunakan syringe sehingga terbentuk beads (Krasaekoopt et al. 2003). Diameter beads yang dihasilkan berkisar 0,3-3 mm. Ukuran dan bentuk beads bergantung pada diameter jarum dan jarak tetes jarum dengan larutan CaCl2 serta konsentrasi hidrokoloid dan larutan pengeras yang digunakan (Anal & Singh, 2007). Metode ini lebih populer karena kemudahannya, sederhana, biaya yang dibutuhkan lebih rendah dan mampu menjaga viabilitas sel (Krasaekoopt et al. 2003; Mortazavian
et al. 2007). Selain itu, melalui teknik ekstrusi dapat dihasilkan bentuk beads yang
lebih seragam bila dibandingkan dengan teknik emulsi (Nazzaro et al. 2012).
Beads yang dihasilkan dengan teknik ekstrusi masih berbentuk jel dan
diperlukan proses pengeringan lanjutan untuk mendapatkan bentuk kering. Pada tahap pengeringan, untuk mendapatkan sel terenkapsulasi berbentuk serbuk atau granul dapat dilakukan dengan beberapa teknik, yaitu pengering beku (freeze
drying) (Lian et al. 2003, Picot & Lacroix, 2004). Namun, penggunaan teknik
freeze drying relatif mahal dan sangat sulit diaplikasikan pada skala industri
(Mortazavian et al. 2007), sedangkan penggunaan teknik spray drying membutuhkan suhu operasi yang tinggi sehingga kurang cocok diaplikasikan untuk enkapsulasi probiotik (Kailasapathy, 2002). Proses pengeringan lainnyadapat dilakukan dengan beberapa metode, yaitu menggunakan hot air
oven, vaccum dryer, atau microwave. Diantara metode tersebut, hot air oven
merupakan metode yang sederhana dan mudah untuk diaplikasikan.
2.6. Bahan Enkapsulan
Salah satu tahapan tepenting dalam teknik enkapsulasi adalah pemilihan bahan pengkapsul (enkapsulan) yang tepat, yang dapat membentuk lapisan (film) yang tipis sehingga mampu melepaskan (release) material inti dalam lingkungan target dan melindungi material inti dari kerusakan. Material tersebut juga harus stabil selama melewati saluran pencernaan inang, masa pemprosesan, dan penyimpanan (Kailasapathy, 2002; Mortazavian et al. 2007).
Bahan enkapsulan dapat dipilih dari berbagai polimer alami ataupun sintetis. Polimer yang biasa digunakan dalam proses enkapsulasi bakteri probiotik adalah polisakarida yang diekstrak dari rumput laut (karagenaan dan alginat), tumbuhan (pati dan turunannya, gum arab), bakteri (gellan dan xanthan), protein hewan (kasein, whey, skim, gelatin) dan kitosan (Shah, 2000; Chavarri et al. 2010). Penggunaan bahan untuk enkapsulasi perlu dipertimbangkan, karena masing-masing bahan mempunyai karakter yang berbeda dan belum tentu cocok dengan bahan inti yang akan dienkapsulasi (Desmond et al. 2002).
2.6.1. Alginat
CaCl2, karena ikatan silang yang terbentuk antara anion karboksilat (COO-) dari monomer alginat dan kation divalen (Ca2+) (McNeely & Pettit, 1973).
Kalsium alginat telah banyak digunakan dalam teknik enkapsulasi bakteri probiotik, umumnya pada konsentrasi berkisar 0,5-4%. Keuntungan penggunaan alginat sebagai bahan pengkapsul adalah mampu membentuk matriks gel dan menjerat bakteri dengan mudah, non-toksik, murah, mudah digunakan dan dapat melepaskan (releasing) bakteri (Mortazavian et al. 2007; Kailasapathy, 2002).
2.6.2. Susu Skim
Susu skim adalah susu tanpa lemak yang dibuat dengan menghilangkan sebagian besar air dan lemak yang terdapat dalam susu. Susu skim diperoleh dari pemisahan susu menjadi skim dan krim. Susu skim mengandung semua komponen gizi dalam susu yang tidak dipisahkan, kecuali lemak dan vitamin-vitamin yang larut dalam lemak (Buckle et al. 1987).
PENDAHULUAN
1.1. Latar Belakang
Pengembangan budi daya ikan tawar sering terkendala penyakit yang disebabkan oleh bakteri patogen. Dalam upaya mengatasi serangan patogen, petani dan pengusaha ikan banyak menggunakan bahan-bahan kimia maupun antibiotik yang dapat meningkatkan resistensi bakteri patogen. Selain itu penggunaan bahan-bahan kimia dan antibiotik pada budi daya ikan akan memberikan dampak negatif bagi lingkungan, ikan yang bersangkutan dan manusia yang mengkonsumsinya. Oleh sebab itu, diperlukan langkah antisipatif untuk pengendalian penyakit pada ikan yang berpedoman pada kaidah keseimbangan ekosistem salah satunya adalah penggunaan bakteri probiotik sebagai agen kontrol mikroba (Khasani, 2007).
Probiotik didefinisikan sebagai sel mikroba yang jika dikonsumsi dalam jumlah yang cukup akan memberikan manfaat kesehatan. Probiotik pada sistem akuakultur dapat memberikan pengaruh menguntungkan bagi inang melalui modifikasi bentuk asosiasi dengan inang atau bagi komunitas mikroba lingkungan hidupnya, meningkatkan respon kekebalan inang terhadap patogen, meningkatkan nilai nutrisi pakan, dan meningkatkan kualitas air (Verschuere et al. 2000).
Aplikasi probiotik akuakultur untuk mengendalikan patogen pada budi daya ikan telah banyak dilakukan, antara lain oleh Azhar, 2013; Setiawati et
al.,2013; dan Nursyirwani et al., 2011. Akan tetapi, viabilitas dan kelangsungan
Enkapsulasi merupakan proses penyalutan suatu substansi, dalam hal ini probiotik sebagai bahan inti dengan menggunakan bahan enkapsulasi tertentu yang berperan sebagai membran pelindung untuk memisahkan material inti dengan lingkungannya hingga material tersebut terlepas (release) ke lingkungan. Beberapa metode untuk menyiapkan bakteri terenkapsulasi telah dikembangkan, misalnya penjeratan sel mikroba dalam kalsium-alginat. Enkapsulasi menggunakan kalsium-alginat untuk melindungi probiotik dalam kondisi saluran pencernaan menunjukkan viabilitas yang lebih tinggi dibanding sel bakteri bebas. (Sheu & Marshall, 1993). Penggunakan kalsium-alginat ini relatif lebih praktis, murah, dapat terurai dalam tubuh serta tidak beracun sehingga aman bila digunakan.
Enkapsulasi menggunakan alginat biasa ditambahkan dengan berbagai jenis bahan tambahan yang berfungsi sebagai bahan pengisi atau sebagai penyalut (coating) untuk meningkatkan ketahanan mekanik kapsul.Penggunaan bahan tambahan untuk enkapsulasi perlu dipertimbangkan, karena masing-masing bahan mempunyai karakter yang berbeda dan belum tentu sesuai dengan bahan inti yang dienkapsulasi. Dari beberapa penelitian, penggunaan bahan penyalut berbasis protein memberikan hasil ketahanan yang lebih baik. Salah satunya adalah susu skim (Adrianto, 2011; Hsio et al., 2014; Fu & Chen, 2011; García, 2011; Fritzen-Freire., 2013). Selain bahan enkapsulan, proses enkapsulasi juga disertai dengan penambahan prebiotik untuk meningkatkan viabilitas sel bakteri seperti inulin. Kombinasi antara probiotik dan prebiotik sering disebut dengan sinbiotik.
1.2. Permasalahan
Viabilitas dan stabilitas bakteri probiotik dalam menghadapi lingkungan yang kurang menguntungkan masih menjadi kendala pada sistem budi daya ikan air tawar. Oleh karena itu, bakteri probiotik perlu diberikan perlindungan fisik salah satunya adalah metode enkapsulasi dengan teknik ekstrusi menggunakan bahan pengkapsul seperti alginat dan susu skim serta penambahan prebiotik inulin. Viabilitas bakteri terenkapsulasi dapat menurun akibat oksidasi, pH, suhu, kadar air, dan kontaminan. Maka, karakteristik mikrokapsul perlu dikaji untuk mengetahui pengaruh enkapsulasi terhadap viabilitas bakteri selama masa penyimpanan, kondisi saluran pencernaan ikan, lama pengeringan, dan kontaminan serta kecepatan pelepasan sel (release).
1.3. Tujuan
Penelitian ini bertujuan untuk mengkaji karakteristik mikrokapsul isolat bakteri asam laktat sebagai probiotik air tawar yang dienkapsulasi menggunakan bahan alginat-susu skim dan penambahan prebiotik inulin melalui parameter kualitatif, diantaranya sifat mikrogeometri mikrokapsul (bentuk dan ukuran), kecepatan pembebasan sel ke lingkungan, viabilitas sel probiotik selama berada dalam penyimpanan, simulasi kondisi saluran pencernaan ikan, lama pengeringan, dan kontaminasi kapang khamir.
1.4. Hipotesis
Sel bakteri terenkapsulasi memiliki viabilitas yang lebih tinggi dari sel bebas. Enkapsulasi dengan karakteristik tertentu mampu menjaga viabilitas sel probiotik selama berada dalam penyimpanan, simulasi kondisi saluran pencernaan ikan, lama pengeringan, kontaminasi kapang khamir, dan mampu keluar ke lingkungan target.
1.5. Manfaat
ABSTRAK
Aplikasi probiotik pada budi daya ikan air tawar merupakan salah satu alternatif pencegahan penyakit pada ikan. Akan tetapi, viabilitas dan kelangsungan hidup probiotik yang rendah pada saat aplikasi masih menjadi kendala. Enkapsulasi dilakukan bertujuan untuk menjaga viabilitas probiotik selama penyimpanan dan aplikasi. Pada penelitian ini, campuran alginat-susu skim dan prebiotik inulin digunakan untuk mengenkapsulasi bakteri asam laktat PG7 yang diisolasi dari saluran pencernaan ikan nila (Oreochromisniloticus) yang diperoleh dari penelitian sebelumnya. Proses enkapsulasi dilakukan dengan teknik ekstrusi, selanjutnya mikrokapsul diuji ketahanannya pada lama penyimpanan, kondisi saluran pencernaan, lama pengeringan, kontaminan serta kecepatan release. Hasil yang diperoleh mengindikasikan bahwa enkapsulasi secara efektif melindungi sel probiotik dari proses pengeringan, simulasi pH saluran pencernaan dan kondisi penyimpanan. Mikrokapsul yang dihasilkanberbentuk bulat dengan ukuran 1,91 ± 0,27 mm dan efisiensi enkapsulasi 92,96%. Probiotik terenkapsulasi mampu keluar dari mikrokapsul secara keseluruhan dalam kondisi simulasi pH cairan usus (pH 6,8) selama 3 jam. Viabilitas probiotik terenkapsulasi bertahan sebesar 7,19 log CFU/g pada penyimpanan suhu 4 °C selama 4 minggu. Ketahanan probiotik terenkapsulasi pada cairan simulasi pH lambung (pH 2; 2 jam) sebesar 85,75%. Jumlah kontaminasi khamir pada mikrokapsul setelah penyimpanan 4 minggu sebesar 2,48-2,77 log CFU/g. Mikrokapsul sinbiotik ini menunjukkan karakteristik yang cukup baik dan efisien dalam mempertahankan viabilitas bakteri sehingga cukup baik untuk diaplikasikan pada budi daya ikan air tawar.
ACID BACTERIA ISOLATE PG7 ENCAPSULATED BY ALGINATE, SKIM MILK, AND INULIN
ABSTRACT
The application of probiotics in aquaculture represents an alternative way for fish disease prevention. However, low viability and survival in application of probiotic still being an obstacle. Encapsulation has been used to maintain probiotic viability during storage and application. In the present study, combination of alginate-skim milk and inulin prebiotic were used to encapsulate lactic acid bacteria PG7 isolated from digestive tract of tilapia fish (Oreochromisniloticus) from previous study. Encapsulation had been prepared by extrusion method, then the encapsulated bacteria were tested for its survival during storage time, simulated gastointestinal condition, drying process, contaminant and release speed. The result obtained indicated that encapsulation effectively protected the probiotic from drying process, simulated gastointestinal condition and storage. The spherical microcapsule was obtained with size of 1.91±0,27 mm and encapsulation efficiency was 92.96%. Encapsulated probiotic could be completely released from microspheres in simulated intestinal fluid (pH 6.8). The viability of encapsulated probiotic retained around 7.19 log CFU/g when stored at 4 °C for 4 weeks. The survival rate of encapsulated probiotic in simulated gastric fluid (pH 2; 2 h) was 85.75%. Total yeast contamination in microsphere after 4 weeks of storage were about 2.48-2.77 log CFU/g. This synbiotic microcapsule of isolate PG7 showed good characteristic and efficient in maintaining viability of bacteriain unfavourable condition, therefore it might be usefull to be applied in aquaculture.
DENGAN ALGINAT, SUSU SKIM, DAN INULIN
SKRIPSI
HARNISYA NASUTION
110805016
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
KARAKTERISASI MIKROKAPSUL SINBIOTIK BAKTERI
ASAM LAKTAT ISOLAT PG7 YANG DIENKAPSULASI
DENGAN ALGINAT, SUSU SKIM, DAN INULIN
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat
mencapai gelar Sarjana Sains
HARNISYA NASUTION
110805016
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
Judul : Karakterisasi Mikrokapsul Sinbiotik Bakteri Asam Laktat Isolat PG7 yang Dienkapsulasi dengan Alginat, Susu Skim dan Inulin
Kategori : Skripsi
Nama : Harnisya Nasution
Nomor Induk Mahasiswa : 110805016
Program Studi : Sarjana (S1) Biologi
Departemen : Biologi
Fakultas : Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di
Medan, April 2016
Komisi Pembimbing :
Pembimbing 2 , Pembimbing 1,
Dra. Nunuk Priyani, M. Sc. Dr. It Jamilah, M. Sc.
NIP: 196404281999032002 NIP. 196310121991032003
Disetujui Oleh
Departemen Biologi FMIPA USU Ketua,
KARAKTERISASI MIKROKAPSUL SINBIOTIK BAKTERI ASAM LAKTAT ISOLAT PG7 YANG DIENKAPSULASI DENGAN ALGINAT,
SUSU SKIM DAN INULIN
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, April 2016
Puji dan syukur penulis ucapkan kehadirat Allah SWT yang telah memberikan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penulisan skripsi ini. Skripsi yang berjudul “Karakterisasi Mikrokapsul Sinbiotik Bakteri Asam Laktat Isolat PG7 yang Dienkapsulasi dengan Alginat, Susu Skim dan Inulin” dibuat sebagai salah satu syarat untuk meraih gelar Sarjana Sains FMIPA, Universitas Sumatera Utara, Medan.
Terimakasih yang sebesar-besarnya penulis sampaikan kepada Ibu Dr. It Jamilah, M.Sc. selaku pembimbing I dan Ibu Dra. Nunuk Priyani, M.Sc. selaku pembimbing II yang telah banyak meluangkan waktu, tenaga dan pikiran saat bimbingan, pada masa penelitian hingga penulisan skiripsi ini. Ucapan terimakasih juga penulis sampaikan kepada Bapak Prof. Dr. Dwi Suryanto, M.Sc. dan Bapak Dr. Miswar Budi Mulya, M.Si. selaku dosen penguji yang telah memberikan banyak masukan dan arahan dalam penyempurnaan penulisan skripsi ini. Kepada Ibu Dr. Nursahara Pasaribu M.Sc. selaku Ketua Departemen Biologi FMIPA USU, Ibu Dr. Saleha Hannum, M.Si. selaku Dosen Penasehat Akademik yang telah memberikan nasehat dan semangat selama masa perkuliahan. Terima kasih kepada Ibu Nurhasni Muluk, Kak Siti, Bang Erwin, Ibu Rosalina Ginting, seluruh dosen dan staf pengajar di Departemen Biologi FMIPA USU yang telah membimbing dan membekali penulis dengan berbagai disiplin ilmu.
Ucapan terima kasih penulis sampaikan kepada kedua orang tua, ayahanda dan ibunda tercinta, Kholid Nasution dan Eryani yang selalu memberikan doa, semangat, dukungan dan pengorbanan yang begitu besar kepada penulis. Kepada adik Elvira Frisca Nasution dan Muhammad Hafiz Nasution serta seluruh keluarga besar penulis atas segala bantuan baik moril maupun materil hingga skripsi ini selesai.
Penulis juga menyampaikan terima kasih kepada sahabat penelitian Ria Yelvi Ningsih dan Virza Ratika I. P. yang telah berbagi suka dan duka selama penelitian, bertukarpikiran serta saling memberikan semangat. Terima kasih kepada semua pihak yang ikut membantu dalam penelitian ini. Kepada sahabat-sahabat yang menjalani penelitian di Lab. Mikrobiologi, sahabat-sahabat-sahabat-sahabat terbaik Desi Munthe, Khairiyah, Yentiti K, Sri Desy, serta teman-teman seangkatan Biologi 2011 terimakasih atas semangat dan kerja samanya. Terima kasih kepada rekan-rekan asisten Lab. Biologi LIDA dan Anmortum. Kepada abang dan kakak angkatan 2009, 2010 dan adik-adik angkatan 2012, 2013 dan 2014. Kepada HIMABIO, IPKB serta semua pihak yang ikut dalam membantu dari awal perkuliahan hingga penyelesaian penulisan skripsi ini.
pengetahuan. Semoga Allah SWT membalas kebaikan kita semua. Amin Ya Rabbal Alamin.
Medan, April 2016
ABSTRAK
Aplikasi probiotik pada budi daya ikan air tawar merupakan salah satu alternatif pencegahan penyakit pada ikan. Akan tetapi, viabilitas dan kelangsungan hidup probiotik yang rendah pada saat aplikasi masih menjadi kendala. Enkapsulasi dilakukan bertujuan untuk menjaga viabilitas probiotik selama penyimpanan dan aplikasi. Pada penelitian ini, campuran alginat-susu skim dan prebiotik inulin digunakan untuk mengenkapsulasi bakteri asam laktat PG7 yang diisolasi dari saluran pencernaan ikan nila (Oreochromisniloticus) yang diperoleh dari penelitian sebelumnya. Proses enkapsulasi dilakukan dengan teknik ekstrusi, selanjutnya mikrokapsul diuji ketahanannya pada lama penyimpanan, kondisi saluran pencernaan, lama pengeringan, kontaminan serta kecepatan release. Hasil yang diperoleh mengindikasikan bahwa enkapsulasi secara efektif melindungi sel probiotik dari proses pengeringan, simulasi pH saluran pencernaan dan kondisi penyimpanan. Mikrokapsul yang dihasilkanberbentuk bulat dengan ukuran 1,91 ± 0,27 mm dan efisiensi enkapsulasi 92,96%. Probiotik terenkapsulasi mampu keluar dari mikrokapsul secara keseluruhan dalam kondisi simulasi pH cairan usus (pH 6,8) selama 3 jam. Viabilitas probiotik terenkapsulasi bertahan sebesar 7,19 log CFU/g pada penyimpanan suhu 4 °C selama 4 minggu. Ketahanan probiotik terenkapsulasi pada cairan simulasi pH lambung (pH 2; 2 jam) sebesar 85,75%. Jumlah kontaminasi khamir pada mikrokapsul setelah penyimpanan 4 minggu sebesar 2,48-2,77 log CFU/g. Mikrokapsul sinbiotik ini menunjukkan karakteristik yang cukup baik dan efisien dalam mempertahankan viabilitas bakteri sehingga cukup baik untuk diaplikasikan pada budi daya ikan air tawar.
ACID BACTERIA ISOLATE PG7 ENCAPSULATED BY ALGINATE, SKIM MILK, AND INULIN
ABSTRACT
The application of probiotics in aquaculture represents an alternative way for fish disease prevention. However, low viability and survival in application of probiotic still being an obstacle. Encapsulation has been used to maintain probiotic viability during storage and application. In the present study, combination of alginate-skim milk and inulin prebiotic were used to encapsulate lactic acid bacteria PG7 isolated from digestive tract of tilapia fish (Oreochromisniloticus) from previous study. Encapsulation had been prepared by extrusion method, then the encapsulated bacteria were tested for its survival during storage time, simulated gastointestinal condition, drying process, contaminant and release speed. The result obtained indicated that encapsulation effectively protected the probiotic from drying process, simulated gastointestinal condition and storage. The spherical microcapsule was obtained with size of 1.91±0,27 mm and encapsulation efficiency was 92.96%. Encapsulated probiotic could be completely released from microspheres in simulated intestinal fluid (pH 6.8). The viability of encapsulated probiotic retained around 7.19 log CFU/g when stored at 4 °C for 4 weeks. The survival rate of encapsulated probiotic in simulated gastric fluid (pH 2; 2 h) was 85.75%. Total yeast contamination in microsphere after 4 weeks of storage were about 2.48-2.77 log CFU/g. This synbiotic microcapsule of isolate PG7 showed good characteristic and efficient in maintaining viability of bacteriain unfavourable condition, therefore it might be usefull to be applied in aquaculture.
Halaman
BAB 3. METODE PENELITIAN 11
3.1. Waktu dan Tempat 11
dalam Simulasi pH Lambung dan Cairan Usus 14 3.2.7. Analisis Kecepatan Pembebasan Sel Terenkapsulasi 14
BAB 4. HASIL DAN PEMBAHASAN 15
4.5 Viabilitas Sel Bebas dan Mikrokapsul dalam Kondisi
Simulasi Asam lambung dan Cairan Usus 19
4.6 Kemampuan PembebasanSel Terenkapsulasi 21
BAB 5. KESIMPULAN DAN SARAN 22
5.1 Kesimpulan 22
5.2 Saran 22
Nomor Judul Halaman
4.1 Mikrokapsul sinbiotik isolat BAL PG7 hasil enkapsulasi metode ekstrusi dengan mikroskop stereo 15
4.2 Grafik pengaruh lama pengeringan terhadap viabilitas
BAL isolat PG7 terenkapsulasi 16
4.3 Grafik viabilitas BAL isolat PG7 terenkapsulasi
selama penyimpanan pada suhu 4 °C dan suhu ambient 17
4.4 Grafik jumlah kontaminasi khamir pada mikrokapsul
selama penyimpanan 18
4.5 Grafik populasi sel bebas dan sel terenkapsulasi BAL isolat PG7 pada kondisi simulai pH lambung dan
cairan usus 20
4.6 Grafik kemampuan sel terenkapsulasi BAL isolat PG7