VIABILITAS BAKTERI ASAM LAKTAT DALAM
ENKAPSULASI SINBIOTIK TERHADAP PENYIMPANAN
DAN ASAM LAMBUNG TIRUAN
SKRIPSI
OLEH
RIRIS DELIMA PURBA
100805027
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
VIABILITAS BAKTERI ASAM LAKTAT DALAM
ENKAPSULASI SINBIOTIK TERHADAP PENYIMPANAN
DAN ASAM LAMBUNG TIRUAN
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
OLEH
RIRIS DELIMA PURBA
100805027
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Viabilitas Bakteri Asam Laktat Dalam
Enkapsulasi Sinbiotik Terhadap Penyimpanan dan Asam Lambung Tiruan
Kategori : Skripsi
Nama : Riris Delima Purba
Program Studi : Sarjana (S1) Biologi Nomor Induk Mahasiswa : 100805027
Fakultas : Matematika dan Ilmu Pengetahuan
Alam Universitas Sumatera Utara
Disetujui di
Medan, Februari 2015
Komisi Pembimbing:
Pembimbing 2, Pembimbing 1,
Dra. Nunuk Priyani, M.Sc. Dr. It Jamilah, M.Sc. NIP: 196404281996032001 NIP: 196310121991032003
Disetujui Oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
VIABILITAS ENKAPSULASI SINBIOTIK ISOLAT BAL DENGAN BERBAGAI BAHAN ENKAPSULAN SELAMA MASA SIMPAN DAN
SIMULASI ASAM LAMBUNG
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Februari 2015
PENGHARGAAN
Puji dan syukur penulis ucapkan ke hadirat Tuhan YME yang telah memberikan Berkat dan Kasih-Nya sehingga penulis dapat menyelesaikan penulisan skripsi ini.
Skripsi yang berjudul “Viabilitas Bakteri Asam Laktat Dalam Enkapsulasi
Sinbiotik Terhadap Penyimpanan dan Asam Lambung Tiruan” dibuat sebagai salah satu syarat untuk meraih gelar sarjana Sains FMIPA USU Medan.
Ucapan terima kasih terbesar pertama kali penulis sampaikan kepada kedua orang tua penulis, ayahanda dan ibunda tercinta, B. T. Purba dan Rosinta Lumban Gaol yang selalu memberikan doa, dukungan, semangat, perhatian, pengorbanan dan kasih sayangnya yang besar kepada penulis. Kepada kakak, abang, Lidya Irawati Purba, H. Sitohang, Anna Elizabeth Purba, A.Md., H. Sibarani, Siska Angelia Purba, A. Md., Mathilda Joice Purba, A.Md. dan kepada adikku Netty Herlina Purba, A. Md. yang selalu dapat menghibur, memberi dukungan dan memotivasi penulis. Kepada seluruh keluarga besarku atas segala bantuan yang diberikan kepada penulis baik moril maupun materil.
Terimakasih penulis sampaikan kepada ibu Dr. It Jamilah, M.Sc. selaku pembimbing 1 dan ibu Dra. Nunuk Priyani, M.Sc. selaku pembimbing 2 yang telah memberi bimbingan dan banyak masukan selama pelaksanaan penelitian dan penyusunan skripsi ini. Ucapan terima kasih juga penulis ucapkan kepada Bapak Prof. Dr. Dwi Suryanto, M.Sc. dan ibu Dr. Saleha Hanum, M.Si. selaku dosen penguji yang telah memberikan banyak masukan demi kesempurnaan skripsi ini.
Dalam kesempatan ini penulis juga menyampaikan ucapan terima kasih kepada sahabat terkasih Herclus Tampubolon dan kepada teman-temanku Juwita Sihombing, Lisbet Simatupang, Silvia Julita Saragih, Tiur Mawarni Parhusip, Sri Rejeki Samosir, Veronika H. L. Tobing yang selalu menasehati dan berbagi cerita bersama. Kepada sahabat satu penelitianku Santa Lusia Natalia yang menantiasa memberi warna dalam menjalani penelitian ini, serta rekan sesame penelitian Nurul Fadhillah, Ledi Beneta Marbun, Yuli Evalintina Gultom, Hendika Zupliker, Devi Permata Sari, Arance Yoane terima kasih telah menciptakan senyum ditengah penatnya pengerjaan penelitian ini. Terimakasih kepada seniorku Bang AAN dan Bang Imam yang senantiasa memberi bantuan dalam penyelesaian skripsi ini. Terimakasih juga buat adik asuhku Villa Tamora Purba dan Wilda Hutagalung buat perhatiannya dan kasih sayangnya selama ini. Tak terlupakan teman-teman stambuk 2010 ‘BioRev’ yang namanya tidak bisa disebutkan satu persatu, terima kasih sudah membuatku lebih dewasa. Terima kasih kepada rekan-rekan asisten Frico, Poppy, Virza, Chandra, Steven dan Devi dan semuanya yang tidak dapat penulis tuliskan satu persatu, terima kasih atas kerjasamanya selama di bangku perkuliahan.
Akhirnya dengan penuh ketulusan dan kerendahan hati, penulis menyadari bahwa hasil penelitian ini masih jauh dari kesempurnaan. Oleh karena itu penulis mengharapkan kritik dan saran yang bersifat membangun dari semua pihak demi kesempurnaan hasil penelitian ini. Semoga Tuhan YME membalas semua kebaikan kita dengan balasan yang setimpal.
VIABILITAS BAKTERI ASAM LAKTAT DALAM
ENKAPSULASI SINBIOTIK TERHADAP PENYIMPANAN
DAN ASAM LAMBUNG TIRUAN
ABSTRAK
Probiotik merupakan mikroorganisme hidup yang dapat memberikan manfaat kesehatan bagi inang. Sel bebas probiotik dapat mengalami penurunan viabilitas terhadap pengaruh lingkungan. Penelitian ini bertujuan untuk mendapatkan bakteri asam laktat potensial kandidat probiotik dan bahan enkapsulan yang mampu mempertahankan viabilitas sel selama penyimpanan dan larutan asam lambung tiruan. Sebanyak empat isolat bakteri asam laktat diuji antagonis terhadap Escherichia coli, Staphylococcus aureus dan Salmonella typhimurium.
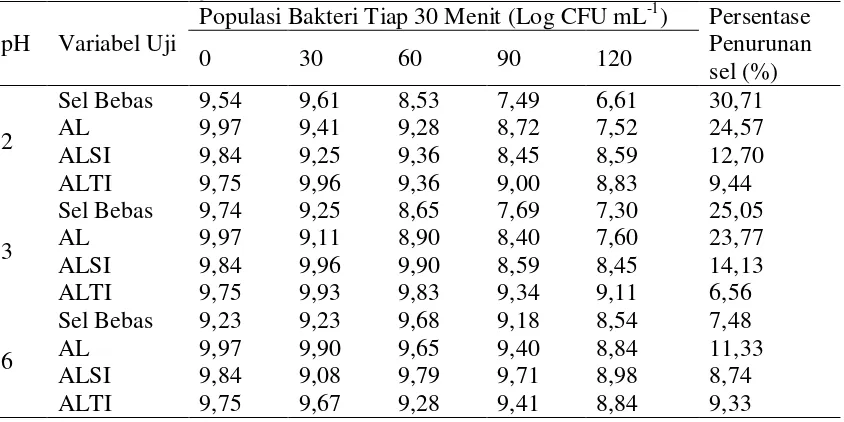
Isolat potensial yang didapat ialah AK2 dengan diameter penghambatan yang paling besar yaitu 15.60 mm, 16.09 mm dan 8.12 mm. Isolat AK2 dienkapsulasi dengan 3 variasi enkapsulan yaitu alginat (AL), alginat-susu skim-inulin (ALSI) dan alginat-tepung kedelai-inulin (ALTI) dengan metode ekstrusi. Karakterisasi sinbiotik BAL hasil enkapsulasi dilakukan dengan menguji viabilitas sel probiotik pada kapsul terhadap variasi suhu 4 oC dan 27 oC selama 4 minggu masa penyimpanan. Hasilnya menunjukkan bahwa populasi bakteri setelah 4 minggu penyimpanan relatif stabil yaitu 7 – 10 log CFU mL-1 pada ketiga tipe kapsul. Ketahanan sel probiotik bebas maupun sel sinbiotik terenkapsulasi terhadap asam lambung tiruan dilakukan dengan variasi pH yaitu pH 2, pH 3 dan pH 6. Sel bebas dan sel dalam kapsul AL tidak mampu mempertahankan viabilitas selnya pada pH 2 selama 2 jam dengan penurunan 34.31% dan 24.57% sedangkan ALSI dan ALTI mampu mempertahankan viabilitas sel dengan penurunan hanya 12.70% dan 9.44%. Enkapsulasi BAL dan prebiotik lapis ganda dengan alginat-susu skim dan alginat-tepung kedelai mampu menjaga viabilitas sel terhadap penyimpanan dan dalam asam lambung tiruan.
VIABILITY OF LACTIC ACID BACTERIA IN SYNBIOTIC
ENCAPSULATION DURING STORAGE AND IN SIMULATED
GASTRIC JUICE
ABSTRACT
Probiotics are living microorganisms that provide health benefits to the host. Probiotics in the form of free-cells may decrease cell viability against environmental influences. This study aimed to get the lactic acid bacteria as probiotic potential candidate and encapsulated materials which are able to maintain cell viability during storage and in simulated gastric juice. The four isolates of lactic acid bacteria were examined using antagonist tested against
Escherichia coli, Staphylococcus aureus and Salmonella typhimurium. Potential isolate obtained was AK2 with the greatest inhibition diameter 15.60 mm, 16.09 mm and 8.12 mm. AK2 has been encapsulated with 3 type materials namely alginate (AL), alginate-skim milk-inulin (ALSI) and alginate-soy flour-inulin (ALTI) by extrusion method. Characterization of synbiotic was performed by cell viability test of probiotic capsules at two different temperatures; 4 oC and 27 oC for 4 weeks of storage. Total population of bacteria after 4 weeks of storage was relatively stable at 7-10 log CFU mL-1 in all three types of capsules. Survival of free-cell and encapsulated cell against simulated gastric juice has been performed with various pH; 2, 3 and 6 for 2 hours. Free-cell and AL capsule were unable to maintain cell viability at pH 2 for 2 hours by decreasing 27.92% and 34.31% respectively while ALSI and ALTI capsules were able to maintain cell viability by reduction value of 12.70% and 9.44% respectively. Encapsulation double-layer of lactic acid bacteria and prebiotic by alginate-skim milk and alginate-soy flour were able to maintain the viability cell during storage and in simulated gastric juice.
DAFTAR ISI
2.6 Viabilitas Bakteri Asam Laktat Terenkapsulasi 15
BAB 3. Bahan dan Metoda
4.1 Pemeriksaan Kemurnian Kultur Bakteri Asam Laktat (BAL) 21 4.2 Seleksi BAL Potensial Sebagai Kandidat Probiotik 22 4.3 Penentuan Kurva Pertumbuhan BAL Potensial Isolat AK2 24 4.4 Enkapsulasi dan Pengeringan Sinbiotik BAL AK2 26 4.5 Uji Viabilitas Kapsul Kultur BAL Selama Penyimpanan 28 4.6 Uji Ketahanan Sel Bebas dan Sinbiotik Terenkapsulasi Dalam
BAB 5. Kesimpulan dan Saran
5.1 Kesimpulan 37
5.2 Saran 37
DAFTAR GAMBAR
Nomor
Gambar Halaman
1 Kurva Pertumbuhan BAL 24
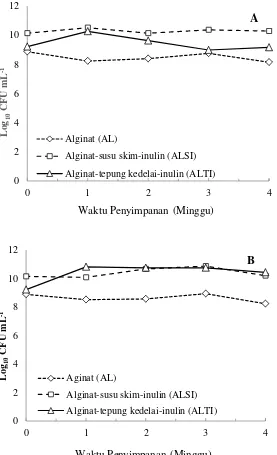
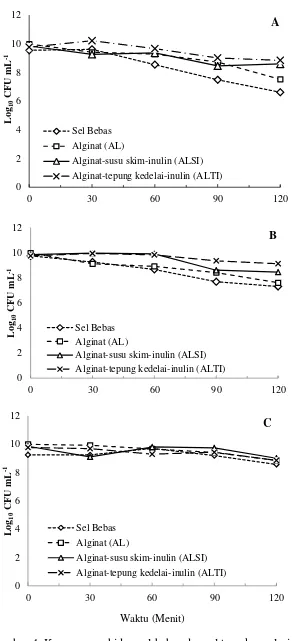
2 Kapsul (beads) sinbiotik hasil enkapsulasi metode ekstrusi 26 3 Viabilitas bakteri pada suhu simpan A. 4 oC dan B. 27 oC 29 4 Kemampuan hidup sel bebas dan sel terenkapsulasi dalam
larutan asam lambung tiruan pada pH 2.0 (A), pH 3.0 (B) dan pH 6.0 (C)
DAFTAR TABEL
Nomor
Tabel Halaman
1 Morfologi Bakteri Asam Laktat 21
2 Diamater Penghambatan (mm) dan Indeks Antimikrobial Isolat BAL Terhadap Bakteri Patogen
22
3 Viabilitas bakteri terhadap masa simpan dan suhu penyimpanan
28
4 Viabilitas Sel Bebas dan Sel Terenkapsulasi Terhadap Larutan Asam Lambung Tiruan Selama 2 jam
DAFTAR LAMPIRAN
Nomor
Lampiran Halaman
A Seleksi BAL Potensial Sebagai Kandidat Probiotik 44
B Pembuatan Kurva Pertumbuhan BAL 45
C Alur Kerja Enkapsulasi dan Pengeringan Sinbiotik Dengan Metode Ekstrusi
46
D Uji Viabilitas Kapsul Sinbiotik Setelah Enkapsulasi 47 E Uji Ketahanan Sel Bebas dan Sel Terenkapsulasi Dalam
Kondisi Asam Lambung Tiruan
48
VIABILITAS BAKTERI ASAM LAKTAT DALAM
ENKAPSULASI SINBIOTIK TERHADAP PENYIMPANAN
DAN ASAM LAMBUNG TIRUAN
ABSTRAK
Probiotik merupakan mikroorganisme hidup yang dapat memberikan manfaat kesehatan bagi inang. Sel bebas probiotik dapat mengalami penurunan viabilitas terhadap pengaruh lingkungan. Penelitian ini bertujuan untuk mendapatkan bakteri asam laktat potensial kandidat probiotik dan bahan enkapsulan yang mampu mempertahankan viabilitas sel selama penyimpanan dan larutan asam lambung tiruan. Sebanyak empat isolat bakteri asam laktat diuji antagonis terhadap Escherichia coli, Staphylococcus aureus dan Salmonella typhimurium.
Isolat potensial yang didapat ialah AK2 dengan diameter penghambatan yang paling besar yaitu 15.60 mm, 16.09 mm dan 8.12 mm. Isolat AK2 dienkapsulasi dengan 3 variasi enkapsulan yaitu alginat (AL), alginat-susu skim-inulin (ALSI) dan alginat-tepung kedelai-inulin (ALTI) dengan metode ekstrusi. Karakterisasi sinbiotik BAL hasil enkapsulasi dilakukan dengan menguji viabilitas sel probiotik pada kapsul terhadap variasi suhu 4 oC dan 27 oC selama 4 minggu masa penyimpanan. Hasilnya menunjukkan bahwa populasi bakteri setelah 4 minggu penyimpanan relatif stabil yaitu 7 – 10 log CFU mL-1 pada ketiga tipe kapsul. Ketahanan sel probiotik bebas maupun sel sinbiotik terenkapsulasi terhadap asam lambung tiruan dilakukan dengan variasi pH yaitu pH 2, pH 3 dan pH 6. Sel bebas dan sel dalam kapsul AL tidak mampu mempertahankan viabilitas selnya pada pH 2 selama 2 jam dengan penurunan 34.31% dan 24.57% sedangkan ALSI dan ALTI mampu mempertahankan viabilitas sel dengan penurunan hanya 12.70% dan 9.44%. Enkapsulasi BAL dan prebiotik lapis ganda dengan alginat-susu skim dan alginat-tepung kedelai mampu menjaga viabilitas sel terhadap penyimpanan dan dalam asam lambung tiruan.
VIABILITY OF LACTIC ACID BACTERIA IN SYNBIOTIC
ENCAPSULATION DURING STORAGE AND IN SIMULATED
GASTRIC JUICE
ABSTRACT
Probiotics are living microorganisms that provide health benefits to the host. Probiotics in the form of free-cells may decrease cell viability against environmental influences. This study aimed to get the lactic acid bacteria as probiotic potential candidate and encapsulated materials which are able to maintain cell viability during storage and in simulated gastric juice. The four isolates of lactic acid bacteria were examined using antagonist tested against
Escherichia coli, Staphylococcus aureus and Salmonella typhimurium. Potential isolate obtained was AK2 with the greatest inhibition diameter 15.60 mm, 16.09 mm and 8.12 mm. AK2 has been encapsulated with 3 type materials namely alginate (AL), alginate-skim milk-inulin (ALSI) and alginate-soy flour-inulin (ALTI) by extrusion method. Characterization of synbiotic was performed by cell viability test of probiotic capsules at two different temperatures; 4 oC and 27 oC for 4 weeks of storage. Total population of bacteria after 4 weeks of storage was relatively stable at 7-10 log CFU mL-1 in all three types of capsules. Survival of free-cell and encapsulated cell against simulated gastric juice has been performed with various pH; 2, 3 and 6 for 2 hours. Free-cell and AL capsule were unable to maintain cell viability at pH 2 for 2 hours by decreasing 27.92% and 34.31% respectively while ALSI and ALTI capsules were able to maintain cell viability by reduction value of 12.70% and 9.44% respectively. Encapsulation double-layer of lactic acid bacteria and prebiotic by alginate-skim milk and alginate-soy flour were able to maintain the viability cell during storage and in simulated gastric juice.
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Makanan tidak selamanya dipertimbangkan oleh konsumen sebatas rasa dan
kebutuhan nutrisi saja, namun juga kemampuannya dalam memberikan manfaat
kesehatan tertentu di luar nilai nutrisi dasarnya. Sekarang ini, perhatian pasar
makanan fungsional adalah menargetkan makanan yang dapat meningkatkan
keseimbangan dan aktivitas mikroflora usus (Saarela et al., 2002). Hal ini dapat
dilakukan dengan menambahkan probiotik pada pangan guna meningkatkan mutu
makanan.
Probiotik didefinisikan sebagai mikroorganisme hidup yang jika diberikan
dalam jumlah yang cukup dapat memberikan manfaat kesehatan pada inang
(FAO/WHO, 2001). Probiotik adalah mikroorganisme yang dimasukkan secara
oral ke dalam saluran pencernaan yang dapat memberikan kontribusi positif
terhadap aktivitas mikroflora usus untuk kesehatan inang (Saarela et al., 2002).
Banyak bakteri probiotik termasuk kelompok bakteri asam laktat (BAL). BAL
terbagi menjadi 8 genus antara lain Lactobacillus, Streptococcus, Lactococcus,
Pediococcus, Enterococcus, Leuconostoc, Bifidobacterium, dan Corinebacterium.
Bakteri probiotik bermanfaat bagi kesehatan yang berhubungan dengan
pencernaan yaitu mengurangi iritasi kolon, konstipasi dan diare. Probiotik juga
dapat menghambat pelekatan bakteri patogen seperti Escherichia, Clostridium,
Salmonella dan Campylobacter ke lumen usus. Selain itu, probiotik mampu
mensintesis vitamin B, menurunkan tingkat amonia dalam darah, penyerapan
kolesterol dan menghambatan pembentukan tumor (Ziemer dan Gibson, 1998).
Studi lain dilakukan oleh Medellin-Pena dan Griffiths (2009) mengujikan
pengaruh Lactobacillus acidophilus La-5 dalam mencegah infeksi Escherichia
coli pada usus secara in vitro dan in vivo (Tharani, 2012).
Mikroorganisme probiotik yang dibutuhkan guna memberikan manfaat
kesehatan bergantung pada strain, jumlah probiotik, media pembawa dan
Dosis tinggi probiotik diperlukan guna mengimbangi kemungkinan penurunan
jumlah sel probiotik hidup selama pemrosesan dan penyimpanan probiotik
(Waterman dan Small, 1998). Jumlah sel probiotik yang hidup dapat mengalami
penurunan selama pemrosesan dan penyimpanan. Oleh karena itu, perlu diberi
perlakuan guna meningkatkan viabilitas sel selama pemrosesan dan penyimpanan.
Perlakuan yang diberikan dapat dilakukan dengan menyalut probiotik dengan
suatu bahan/media pembawa.
Enkapsulasi adalah proses atau teknik untuk menyalut inti yang berupa
suatu senyawa aktif padat, cair, gas, ataupun sel dengan suatu bahan pelindung
tertentu yang dapat mengurangi kerusakan senyawa aktif tersebut. Enkapsulasi
beberapa kultur bakteri termasuk probiotik dilakukan untuk memperpanjang masa
simpan dan mengubah menjadi bentuk kapsul agar lebih mudah dalam
penggunaannya (Krasaekoopt et al., 2003). Enkapsulasi bakteri probiotik
bermanfaat untuk mempertahankan viabilitasnya dan melindungi probiotik dari
kerusakan akibat kondisi lingkungan yang tidak menguntungkan (Wu et al., 2000).
Sel probiotik dapat dienkapsulasi bersama dengan bahan prebiotik atau
bahan cryoprotectant untuk meningkatkan viabilitas sel. Enkapsulasi dengan
teknik ini meningkatkan kelangsungan hidup probiotik dalam produk (Sultana et
al., 2000). Enkapsulasi dengan alginat dan prebiotik disebut dengan koenkapsulasi.
Koenkapsulasi merupakan cara lain untuk meningkatkan viabilitas probiotik
(Godward & Kailasapathy, 2003). Menggabungkan prebiotik dan kalsium alginat
sebagai bahan penyalut dapat lebih melindungi probiotik dalam makanan dan juga
dalam saluran pencernaan yang disebut dengan sinbiosis (Chen et al., 2005).
Probiotik dan prebiotik digabung menjadi sinbiotik. Enkapsulasi sinbiotik yang
ditambahkan bahan enkapsulan seperti alginat dapat menghasilkan viabilitas
tertinggi dari probiotik (Chen et al., 2005).
Jenis enkapsulan yang digunakan dalam produksi kapsul diketahui mampu
meningkatkan kemampuan hidup probiotik. Penggunaan protein kacang kedelai
dan protein whey yang digabungkan dengan alginat mampu meningkatkan daya
hidup probiotik dalam kondisi asam lambung tiruan pH 2, dimana alginat saja
tidak mampu meningkatkan perlindungan probiotik. Penggunaan protein sebagai
3
pori kapsul yang sangat sedikit mungkin berperan dalam menghambat masuknya
cairan asam lambung tiruan ke dalam kapsul sehingga daya hidup probiotik tinggi
(Wood, 2010).
Susu skim merupakan salah satu bahan penyalut yang umum digunakan,
terutama sebagai penyalut matriks yang diaplikasikan secara oral (Young et al.,
1995; Victor dan Heldman, 2001). Susu skim mengandung protein yang cukup
tinggi. Selain susu skim, protein kedelai dapat digunakan sebagai bahan
enkapsulasi baik sebagai pengkapsul tunggal maupun campuran dengan
polisakarida (Favaro-Trindade et al., 2010; Nesterenko et al., 2012).
Penelitian tentang enkapsulasi BAL probiotik sebelumnya sudah
dilakukan dengan berbagai variasi bahan enkapsulan dan teknik enkapsulasi
(Corcoran et al., 2003; Picot dan Lacroix, 2004; Triana et al., 2006; Kotikalapudi
(2009; Rizqiati et al., 2009; Wood, 2010; Mirzaeei dan Arya, 2012). Prosedur
enkapsulasi yang dilakukan oleh Wood (2010) ialah enkapsulasi L. rhamnosus
menggunakan bahan isolat protein whey (whey protein isolate), isolat protein
kacang kapri (pea protein isolate) dan alginat dengan metode ekstrusi dan emulsi,
sedangkan Kotikolapudi (2009) melakukan enkapsulasi terhadap Lactobacillus
acidophilus ATCC 11975 dengan metode ekstrusi dengan bahan alginat dan isolat
protein kacang hijau (pea protein isolat). L. acidophilus kemudian diuji ketahanan
terhadap asam lambung tiruan menunjukkan penurunan populasi sel ~1 log CFU
mL-1 selama 2 jam dimana sel yang tidak dienkapsul mengalami penurunan
populasi sel >6 log CFU mL-1.
1.2 Permasalahan
Permasalahan dalam penelitian ini ialah
a. Isolat BAL manakah yang paling efektif sebagai probiotik dalam menghambat
pertumbuhan bakteri patogen E. coli, S. thypimurium dan S. aureus pada
saluran pencernaan?
b. Komposisi enkapsulan manakah yang paling efektif dalam menjaga stabilitas
populasi sel BAL terenkapsulasi?
c. Bagaimana pengaruh suhu dan masa simpan terhadap viabilitas sel BAL
d. Apa pengaruh sinbiotik terenkapsulasi terhadap viabilitas sel BAL dalam
kondisi asam lambung tiruan?
1.3 Tujuan Penelitian
Tujuan penelitian ini ialah
a. untuk mengetahui isolat BAL yang paling efektif dalam menghambat
pertumbuhan bakteri patogen E. coli, S. thypimurium dan S. aureus pada
saluran pencernaan
b. untuk mengetahui komposisi enkapsulan yang paling efektif dalam menjaga
stabilitas populasi sel BAL terenkapsulasi
c. untuk mengetahui pengaruh suhu dan masa simpan terhadap viabilitas sel BAL
terenkapsulasi
d. untuk mengetahui pengaruh sinbiotik terenkapsulasi terhadap viabilitas sel
BAL dalam kondisi asam lambung tiruan
1.4 Hipotesis
Enkapsulasi BAL potensial dengan jenis bahan pengkapsul alginat,
alginat-inulin-tepung kedelai dan alginat-inulin-susu skim dapat menjaga
viabilitas sel terhadap masa simpan dan suhu penyimpanan. Sinbiotik
terenkapsulasi juga dapat meningkatkan viabilitas sel dalam kondisi asam
lambung tiruan dibandingkan dengan sel bebas.
1.5 Manfaat Penelitian
Manfaat penelitian ini ialah:
a. mendapatkan jenis enkapsulan yang cocok untuk BAL potensial kandidat
probiotik yang merupakan isolat lokal Sumatera Utara
b. mendapatkan teknik/metode untuk aplikasi BAL kandidat probiotik
BAB 2
TINJAUAN PUSTAKA
2.1 Probiotik
Kata probiotik berasal dari bahasa Yunani yang berarti “for life”. Probiotik pertama kali didefinisikan oleh Kollath tahun 1953 untuk menandai semua
kompleks makanan organik dan anorganik untuk membedakannya dari antibiotik
berbahaya. Bakteri probiotik merupakan mikroorganisme non patogen yang jika
dikonsumsi memberikan pengaruh positif terhadap fisiologi dan kesehatan
inangnya (Schrezenmeir dan de Vrese, 2001). Saat ini, probiotik didefinisikan
sebagai mikroorganisme hidup (bakteri atau khamir) yang jika dikonsumsi dalam
jumlah yang cukup akan memberikan manfaat kesehatan bagi inang (FAO/WHO,
2001).
Probiotik memiliki pengaruh yang menguntungkan seperti menstimulasi
pertumbuhan mikroorganisme yang diinginkan, menekan populasi bakteri
merugikan dan memperkuat mekanisme pertahanan alami tubuh (Dunne, 2001).
Senyawa-senyawa racun yang dihasilkan dari metabolisme protein dan lemak,
serta hasil pemecahan enzim tertentu menjadi semakin berkurang bila bakteri
probiotik dapat menjalankan peranannya dalam meningkatkan kesehatan.
Probiotik dapat menghasikan berbagai senyawa hasil metabolisme seperti asam
laktat, H2O2 dan bakteriosin bersifat antimikroba. Berbagai enzim yang juga dapat
dihasilkan oleh probiotik seperti laktase yang membantu mengatasi intoleransi
terhadap laktosa dan bile salt hydrolase yang membantu menurunkan kolesterol.
Selain itu, probiotik memiliki aktivitas antikarsinogenik dan stimulator sistem
imun (Nagao et al., 2000; Horie et al., 2002).
Pada umumnya bakteri yang memiliki fungsi probiotik tergolong ke dalam
bakteri asam laktat. Menurut Salminen et al. (2004), syarat yang harus dipenuhi
oleh bakteri asam laktat yang berfungsi sebagai probiotik antara lain: (1) suatu
probiotik harus nonpatogen yang mewakili mikroorganisme normal usus dari
inang tertentu dan masih aktif pada kondisi asam lambung dan konsentrasi garam
empedu yang tinggi di dalam usus halus, (2) suatu probiotik yang baik harus
yang tinggi pada usus, (3) probiotik yang ideal dapat mengkolonisasi beberapa
bagian saluran usus untuk sementara, (4) probiotik dapat memproduksi
asam-asam organik secara efisien dan memiliki sifat antimikroba terhadap bakteri yang
merugikan, (5) mudah diproduksi, mampu tumbuh dalam sistem produksi skala
besar dan dapat hidup selama kondisi penyimpanan.
2.2 Prebiotik
Prebiotik didefinisikan sebagai komponen makanan yang tidak dapat dicerna oleh
tubuh inang yang memberikan manfaat menguntungkan bagi inang. Senyawa ini
dapat meningkatkan pertumbuhan dan/atau aktivitas satu atau lebih bakteri pada
kolon dan juga dapat meningkatkan kesehatan inang (Gibson dan Wang, 1994;
Purwijatiningsih, 2011; Solange et al., 2007; Kotikalapudi, 2009). Menurut
Purwijatiningsih (2011) menambahkan bahwa prebiotik dapat menstimulasi
pertumbuhan bakteri menguntungkan dalam usus manusia. Karbohidrat yang
tidak dapat dicerna (oligosakarida) merupakan senyawa berberat molekul rendah
dan merupakan senyawa antara gula sederhana dan polisakarida (Solange et al.,
2007; Kotikalapudi, 2009).
Menurut Khomsan (2004), banyak mengkonsumsi sumber prebiotik akan
membantu perkembangbiakan probiotik. Beberapa prebiotik yang mengandung
fruktosa seperti inulin dan fruktooligosakarida diketahui mampu mengubah
komposisi mikrobiota dalam sistem pencernaan ke arah dominasi Bifidobacterium.
Hal tersebut sering disebut efek bifidogenik (Fook et al., 1999). Beberapa efek
positif dari bifidogenik adalah penghambatan pertumbuhan Escherichia coli,
Clostridia dan berbagai bakteri patogen, penurunan terjadinya kasus diare,
penyerapan senyawa-senyawa beracun, penurunan kadar kolestrol dalam serum,
membantu proses pembentukan dan pembuangan feses serta membantu tubuh
dalam penyerapan kalsium (Ninnes, 1999).
Menurut Gibson dan Roberfroid (1995), komponen makanan
diklasifikasikan sebagai prebiotik jika memiliki kriteria sebagai berikut:
a. tidak dapat dihidrolisis maupun diserap oleh sistem pencernaan bagian atas
b. mampu menyebabkan pertumbuhan dan/atau aktivasi satu atau lebih bakteri
7
c. mampu mengubah mikrobiota kolon menjadi komposisi yang lebih sehat
d. mampu menginduksi pengaruh sitemik dari kesehatan inang.
Karbohidrat yang tidak tercerna umumnya digunakan sebagai prebiotik
karena dapat terbentuk secara alami dan beberapa dapat memenuhi kriteria
sebagai prebiotik. Karbohidrat yang tidak tercerna ialah resistant starch (pati yang
tidak dihidrolisis dalam usus halus), polisakarida non-pati (hemiselulosa, pektin,
gum) dan oligosakarida (galaktooligosakarida [GOS], fruktoligosakarida [FOS])
(Gibson dan Roberfroid, 1995; van Dokkum dan van den Heuvel, 2001).
Fruktooligosakarida atau oligofruktosa adalah satu-satunya oligosakarida
yang memiliki semua kriteria prebiotik (Gibson dan Roberfroid, 1995). FOS
mengandung β-(1→2) glikosida yang mengikat β-D-fruktosa. Inulin adalah
polisakarida utama yang menghasilkan FOS dan secara alami dijumpai pada
tanaman Chicory dan akar tanaman Artichoke dari Jerusalem (Roberfroid, 2000).
FOS dapat dihasilkan dari hidrolisis inulin dengan asam atau enzim inulase dan
dari sukrosa menggunakan osyl-transferase.
2.3 Bakteri Asam Laktat (BAL)
Bakteri asam laktat mempunyai karakteristik morfologi, fisiologi dan metabolit
tertentu. Deskripsi secara umum dari bakteri ini adalah termasuk dalam bakteri
Gram positif, tidak berspora, berbentuk bulat maupun batang, dan menghasilkan
asam laktat sebagai mayoritas produk akhir selama fermentasi karbohidrat
(Axelsson, 2004). Bakteri asam laktat termasuk mikroorganisme yang aman jika
ditambahkan dalam pangan karena bersifat tidak toksik dan tidak menghasilkan
toksin. Bakteri asam laktat juga disebut sebagai biopreservatif karena dapat
menghambat pertumbuhan bakteri patogen dan mampu membawa dampak positif
bagi kesehatan manusia (Smid dan Gorris, 2007).
Bakteri asam laktat memiliki beberapa keunggulan yaitu: 1) BAL mampu
menghasilkan senyawa-senyawa yang dapat memberikan rasa dan aroma spesifik
pada makanan fermentasi (Rahayu, 2001), 2) BAL mampu meningkatkan nilai
cerna pada makanan fermentasi karena dapat melakukan pemotongan pada bahan
makanan yang sulit dicerna sehingga dapat langsung diserap oleh tubuh, misalnya
menghasilkan senyawa antimikrobial yang mampu menghambat pertumbuhan
mikrobial patogen dan pembusuk pada bahan makanan sehingga dapat
memperpanjang masa simpan produk tersebut.
Ada 3 genus utama bakteri yang berperan sebagai probiotik yaitu
Lactobacillus, Bifidobacterium dan Streptococcus (Fuller, 1992). Bakteri lainnya
yang digunakan sebagai probiotik termasuk ke dalam genus Leuconostoc,
Pediococcus, Propionibacterium dan Bacillus. Beberapa khamir seperti
Saccharomyces cerevisiae dan Candida pintolopesii. Kapang seperti Aspergillus
niger dan Aspergillus oryzae juga digunakan sebagai probiotik untuk pakan
hewan.
Bakteri Lactobacilli memiliki karakteristik seperti ukurannya besar, tidak
membentuk spora, Gram positif, dan respirasi anaerob atau mikroaerofilik (Fooks
et al., 1999). Bakteri golongan ini memiliki aktivitas antimikroba yang
disebabkan oleh pembentukan hidrogen peroksida. Isolat tersebut dapat
menghambat pertumbuhan Pseudomonas dan Bacillus (Price dalam Supenti,
1996). Bakteriosin merupakan senyawa - senyawa polipeptida atau protein yang
bersifat bakterisidal yang dapat dihasilkan oleh kultur starter bakteri asam laktat,
terutama L. plantarum. Bakteriosin juga memiliki aktivitas antimikroba terhadap
bakteri lain yang berkerabat dekat dengannya. Spesies Lactobacillus ialah L.
delbreuckii subspecies bulgaricus, L. acidophilus, L. casei, L. germentum, L.
plantarum, L. brevis, L. cellobious, L. lactis dan L. reuteri.
Bifidobacteria memiliki karakteristik yaitu ukurannya besar, Gram positif,
berbentuk batang dan bersifat mikroaerofilik (Fuller, 1992). Pemanfaatan
Bifidobacteria sebagai probiotik diawali oleh penelitian oleh Tisser tahun 1905.
Tisser menunjukkan bahwa bayi yang masih menyusui ASI memiliki
Bifidobacteria sebagai organisme dominan pada fesesnya, dan tidak demikian
halnya dengan bayi yang diberi susu formula (Fuller, 1992). Spesies
Bifidobacteria ialah B. adolescentis, B. animals, B. bifidum, B. infantis, B. longum
dan B. thermophilum (Fuller, 1992).
Streptococci adalah bakteri berbentuk bulat kecil, Gram positif dan
biasanya dijumpai berpasangan atau berbentuk rantai pendek (Fooks et al., 1999).
9
pada ada/tidak ada oksigen (Alcamo, 1997). Spesies Streptococcus ialah S.
salivarius (subspesies S. thermophilus), S. lactis, S. cremoris, S. diatilactis dan S.
intermedius (S. anginosus) (Fuller, 1992).
2.4 Enkapsulasi
Enkapsulasi adalah suatu proses pembungkusan (coating) suatu bahan inti yaitu
bakteri probiotik dengan menggunakan bahan enkapsulasi tertentu yang
bermanfaat untuk mempertahankan viabilitasnya dan melindungi probiotik dari
kerusakan akibat kondisi lingkungan yang tidak menguntungkan (Wu et al., 2000).
Pacifico et al. (2001) menyatakan bahwa untuk komponen yang bersifat peka
seperti mikroorganisme, dapat dienkapsulasi untuk meningkatkan viabilitas dan
umur simpannya.
Teknik enkapsulasi saat ini telah digunakan untuk menstabilkan sel
probiotik (Champagne dan Fustier 2007; Heidebach et al 2009, 2010; Weinbreck
et al 2010). Enkapsulasi probiotik telah banyak dilakukan untuk meningkatkan
ketahanan atau viabilitas sel probiotik selama proses pemrosesan dan
penyimpanan (Homayouni et al. 2008; Krasaekoopt et al. 2006), serta
meningkatkan ketahanan selama dalam saluran pencernaan (pH rendah dan cairan
empedu) (Sultana et al. 2000, Picot dan Lacroix 2004, Mandal et al. 2006, Castilla
et al. 2010).
Metode enkapsulasi dengan sodium alginat dalam kalsium klorida (CaCl2)
telah digunakan untuk enkapsulasi L. acidophilus dengan tujuan melindungi
bakteri tersebut dari kondisi asam pada cairan lambung. Berbagai penelitian telah
menunjukkan bahwa kalsium alginat melindungi imobilisasi sel kultur lebih baik
dengan meningkatnya ketahanan bakteri dibandingkan tanpa enkapsulasi (Anal
dan Singh, 2007).
Sifat kapsul dari suatu probiotik harus disesuaikan dengan tujuan
penggunaan probiotik pada suatu produk. Membran kapsul dirancang untuk
melindungi sel dan dapat melepaskan sel dengan laju pelepasan yang terkontrol
pada kondisi yang spesifik serta memungkinkan terjadinya difusi molekul yang
berukuran kecil (sel, metabolit dan substrat) melintasi membran (Vidyalakshmi et
jenis bahan yang digunakan (Kailasapathy 2002, Krasaekoopt et al. 2003,
Mortazavian et al. 2007, Vidyalakshmi et al. 2009).
2.4.1 Metode Ekstrusi
Teknik ekstrusi adalah suatu teknik enkapsulasi tertua dan prosedur umum dalam
memproduksi kapsul hidrokoloid (King, 1995). Teknik ekstrusi dilakukan dengan
cara menambahkan mikroorganisme probiotik ke dalam larutan hidrokoloid
seperti natrium alginat, kemudian diteteskan ke dalam larutan pengeras (CaCl2)
menggunakan syringe sehingga terbentuk manik-manik (beads). Kemudian
dilakukan pengeringan manik-manik dengan beberapa metode yaitu dengan hot
air oven, vacuum drying, dan microwave (Shariff et al. 2007).
Ukuran dan bentuk manik-manik yang dihasilkan bergantung pada
diameter jarum dan jarak tetes jarum dengan larutan CaCl2 (Krasaekoopt et al.
2003). Alginat umum digunakan sebagai material pendukung pada teknik ini.
Konsentrasi alginat yang digunakan untuk membentuk manik-manik bervariasi
mulai dari konsentrasi terendah 0,6% untuk membentuk gel dengan 0,3 M CaCl2
hingga konsentrasi 1-2% alginat dan 0,005-1,5 M CaCl2. Jika konsentrasi natrium
alginat meningkat, ukuran manik-manik juga meningkat. Penggunakan syringe
berdiameter 0,27 mm menghasilkan manik-manik dengan ukuran 2-3 mm.
Komposisi alginat juga mempengaruhi ukuran manik-manik, manik-manik
dengan ukuran yang kecil dihasilkan oleh konsentrasi rendah dari guluronik
sebagai penyusun alginat (Krasaekoopt et al., 2003).
Keefektifan dari bahan dan teknik enkapsulasi yang digunakan untuk
menghasilkan probiotik terenkapsulasi dapat dievaluasi dengan beberapa
parameter kualitatif, diantaranya viabilitas sel probiotik selama proses enkapsulasi
dan pengeringan, pembuatan produk dan penyimpanan, kelarutan manik-manik
dan kemampuan sel untuk release serta sifat mikrogeometri manik-manik (bentuk
dan ukuran) (Mortazavian et al., 2007). Tingkat ketahanan bakteri probiotik
setelah diberi beberapa perlakuan dapat diukur dengan metode plate count (Roka
11
2.4.2 Metode Emulsi
Teknik emulsi adalah suatu teknik kimia untuk enkapsulasi sel hidup
probiotik dan menggunakan hidrokoloid (alginat, carrageenan dan pektin)
sebagai bahan pengkapsul. Teknik emulsi melibatkan dua fase yaitu fase
nonkontinu dan fase kontinu (Krasaekopt et al., 2003). Fase nonkontinu
mengandung probiotik dan polimer hidrokoloid yang akan mengkapsul probiotik,
dan fase kontinu berisi minyak nabati seperti minyak kedelai, minyak canola atau
minyak jagung. Fase nonkontinu dimasukkan ke dalam fase kontinu dan
dihomogenkan hingga membentuk emulsi air dalam minyak. Tween 80 atau
emulsifier lainnya ditambahkan ke dalam fase kontinu tersebut dengan konsentrasi
0,2% dan 0,5% untuk memastikan homogenitasnya (Sultana et al., 2000;
Truelstrup-Hansen et al., 2002; Krasaekoopt et al., 2003; Muthukumarasamy et
al., 2006). Ketika emulsi telah terbentuk, larutan pengikat silang ditambahkan
untuk membentuk partikel gel dalam minyak (Krasaekoopt et al., 2003) dan
kapsul yang terbentuk kemudian dipisahkan. Ukuran kapsul dipengaruhi oleh
kecepatan pengadukan dan konsentrasi hidrokoloid dan umumnya ukurannya
berkisar 25 µ m hingga 2 mm (Wood, 2010).
2.5 Enkapsulan
Bahan yang umum digunakan untuk enkapsulasi ialah berbagai jenis polisakarida
dan protein seperti pati, alginat, gum arab, gelatin, karagenan, albumin dan kasein.
Penggunaan bahan untuk enkapsulasi perlu dipertimbangkan karena
masing-masing bahan mempunyai karakter yang berbeda dan belum tentu cocok dengan
bahan inti yang akan dienkapsulasi (Desmond et al., 2002). Bahan pelindung yang
biasa digunakan diantaranya susu skim, laktosa, sukrosa, dan maltodekstin.
Enkapsulasi dapat meningkatkan viabilitas bakteri probiotik dibandingkan
dengan sel bebas tanpa enkapsulasi (Chandramouli et al., 2003). Bahan-bahan
yang dapat digunakan sebagai enkapsulan ialah lemak, lilin, turunan gliserol, gula,
pati alami dan pati termodifikasi, dekstrin, gum, protein, skim, gelatin, dan
turunan selulosa (Vidhyalakshmi et al., 2009). Beberapa penelitian melaporkan
bahwa enkapsulasi menggunakan kalsium-alginat-resistant starch polymer
(Adhikari et al., 2000) dan polimer protein whey (Picot dan Lacroix, 2004) dapat
meningkatkan viabilitas bakteri probiotik pada yoghurt selama penyimpanan.
Dave et al. (1997) dalam Adhikari (2000) menyatakan bahwa penambahan
suplemen seperti cystein, bubuk whey, konsentrat protein whey dan hidrolis asam
kasein dapat meningkatkan ketahanan Bifidobacteria, namun hanya dalam jumlah
yang kecil.
2.5.1 Alginat
Alginat adalah polisakarida alami yang diekstrak dari alga coklat dan berfungsi
meningkatkan viskositas dan daya ikat pada yoghurt (Kailasapathy ,1996). Kation
divalent seperti ikatan kalsium dengan alginat dapat meningkatkan viskositas atau
bentuk geltergantung pada konsentrasinya. Enkapsulasi sel menggunakan sodium
alginat telah banyak dilakukan seperti pengikatan kation dengan kalsium pada
yoghurt.
Alginat membentuk garam yang larut dalam air dengan kation monovalen,
serta amin dengan berat molekul rendah, dan ion magnesium. Oleh karena alginat
merupakan molekul linear dengan berat molekul tinggi, maka mudah sekali
menyerap air. Alasan tersebut yang menyebabkan alginat baik sekali fungsinya
sebagai bahan penyalut. Di berbagai keadaan, alginat dapat berfungsi sebagai
senyawa pengikat daya suspensi larutan (stabilisator) dengan proses pengentalan
larutan itu sendiri. Pada sistem lain, alginat mampu menjaga suspensi karena
muatan negatif serta ukuran kalorinya yang memungkinkan membentuk
pembungkus bagi partikel yang tersuspensi. Sifat viskositas alginat yang tinggi
mampu mempengaruhistabilitas emulsi dalam air (Winarno, 1996).
Alginat bersifat non toksik bila digunakan untuk imobilisasi sel dan
keuntungan ini dapat diterima sebagai makanan tambahan. Meskipun alginat telah
digunakan secara luas untuk enkapsulasi probiotik, tetapi tidak terlihat beberapa
keseragaman kondisi enkapsulasi. Konsentrasi sodium alginat bervariasi dari 0,5 –
4%, sehingga menghasilkan kesimpulan yang berbeda mengenai penggunaan
kalsium alginat sebagai matriks untuk enkapsulasi bakteri (Chandramouli et al.,
13
Beberapa contoh penelitian yang menggunakan alginat sebagai bahan
enkapsulasi ialah seperti yang dilakukan oleh Purwandhani et al. (2007) yang
mengkapsul sel menggunakan metoda pelapisan (coating) dengan dua metode,
yaitu metoda ekstrusi dan emulsi. Pada masing-masing metoda dilakukan
enkapsulasi satu lapis (single coating) dan dua lapis (double coating). Metoda satu
lapis menggunakan alginat dan metoda dua lapis yaitu menggunakan protein (susu
skim) sebagai lapis yang pertama dan alginat sebagai lapisan kedua.
2.5.2 Susu Skim
Susu skim merupakan salah satu emulator, berupa serbuk kering yang dihasilkan
dari proses pengeringan susu yang tidak mengandung lemak dan telah
dipasteurisasi. Susu skim tidak mengandung air sehingga dapat disimpan selama
tiga tahun. Susu ini mengandung laktosa, protein susu dan mineral pada proporsi
yang relatif sama. Produk ini harus disimpan dalam suhu dingin, kering dan harus
dijauhkan dari air selama masa penyimpanan. Berbagai proses industri susu skim
dapat digunakan. Keterlibatan susu skim pada bidang pangan yaitu pada
pembuatan roti untuk meningkatkan rasa, produk susu fermentasi, pembuatan es
krim, produk daging, beberapa produk sereal, pengemulsi atau sebagai bahan
pengganti telur pada berbagai macam produk, dan sebagainya (Yulinery et al.,
2006).
Susu skim atau disebut whey protein mengandung nutrien yang relatif
kaya, terutama kandungan gula. Gula susu, yaitu laktosa, yang terdapat pada susu
skim berkisar antara 49,5%-52%. Keadaan ini baik untuk mendukung
pertumbuhan strain Lactobacillus yang umumnya memiliki enzim laktase yang
mampu mengubah laktosa menjadi glukosa. Strain probiotik yang diinokulasi
pada media susu skim diharapkan mampu menunjukkan pertumbuhan yang cepat.
Pertumbuhan dikatakan cepat ialah apabila mampu tumbuh minimal mencapai 108
cfu/ml dalam waktu 24 jam inkubasi (Guarner dan Scaafsma, 1998).
Dibandingkan dengan protein lain, protein susu sangat baik digunakan sebagai
material pengkapsulasi. Seperti halnya gelatin, protein susu mampu membentuk
Isolat protein whey (WPI) menunjukkan peningkatan daya hidup probiotik
dalam simulasi kondisi lambung baik sebagai tambahan isolat pada kultur bakteri
maupun sebagai material dinding untuk enkapsulasi. Bifidobacterium infantis
telah diujikan pada simulasi kondisi lambung pada pH 2 selama 3 jam dalam
1 g L-1 WPI (Charteris et al., 1998). Adanya WPI secara signifikan meningkatkan
daya hidup ketika dibandingkan dengan bakteri yang diinkubasi dalam simulasi
kondisi lambung tanpa WPI. L. rhamnosus telah dienkapsulasi dengan metode
ekstrusi menggunakan 70:30 campuran dari 12% WPI: bakteri yang diinjeksi
melalui jarum ke dalam larutan (16,7% CaCl2, 0,1% pepton dan 0,04% tween)
(Wood, 2010).
Bahan pengkapsul yang berbahan utama protein baik dalam melindungi sel
yang terenkapsulasi maupun sebagai bahan makanan bagi sel. Diantara protein
lainnya, protein susu merupakan protein yang paling digemari sebagai bahan
enkapsulasi dikarenakan sifat fisik-kimianya. Seperti gelatin, protein susu dapat
membentuk gel dalam kondisi yang sesuai. Protein susu ialah bahan pembawa
alami untuk sel probiotik dan disebabkan oleh struktur, sifat fisik-kimia dan
sifatnya yang biokompatibel (Livney, 2010).
2.5.3 Tepung Kedelai
Ekstrak protein yang berasal dari produk turunan hewan (protein whey, gelatin,
kasein) dan yang berasal dari tumbuhan (protein kedelai, protein kacang ercis (pea
protein), protein sereal) digunakan secara luas untuk enkapsulasi senyawa aktif.
Penggunaan protein nabati sebagai material pembentuk dinding dalam enkapsulasi
menggambarkan tren “green” dalam bidang obat, kosmetik dan industri makanan.
Pada aplikasi makanan, protein tumbuhan dikenal tidak menyebabkan alergi
dibandingkan dengan protein turunan hewan (Jenkins et al., 2007; Li et al., 2012).
Karena itu, beberapa tahun belakangan ini pengembangan aplikasi baru dari
produk tumbuhan yang kaya protein menjadi lingkup penelitian yang diminati.
Tepung kedelai ialah tepung yang dihasilkan biji kedelai yang dikuliti dan
mengandung 50% protein (Berk, 1992). Kandungan protein yang cukup tinggi ini
baik dalam melindungi sel pada kapsul. Protein kedelai memiliki sifat fungsional
15
stabilisasi emulsi, gelatin, busa dan pembentukan film yang baik (Franzen dan
Kinsella, 1976). Glycinin dan conglycin pada kedelai hampir sama (perbandingan
berat molekul, komposisi asam amino, struktur subunit) dengan legumin dan
vicilin pada ercis (Koyoro dan Powers, 1987).
2.6 Viabilitas Bakteri Asam Laktat Terenkapsulasi
Enkapsulasi mampu meningkatkan viabilitas sel selama fermentasi dan
penyimpanan (5,59 x 1012 dan 4,35 x 1010 untuk probiotik terenkapsulasi vs 4,47 x
1010 dan 2,08 x 108 untuk probiotik bebas). Selain itu enkapsulasi dengan
alginat-inulin-xanthan gum mampu meningkatkan viabilitas sel secara signifikan
dibandingkan sel bebas. Nazzaro et al. (2009) dalam penelitiannya melakukan
enkapsulasi L. acidophilus dengan teknik ekstrusi menggunakan alginat 2%,
CaCl2 0,05 M, dan dengan perlakuan khusus berupa penambahan 1% prebiotik
inulin dan 0,15% xanthan gum. L. acidophilus terenkapsulasi memiliki
kemampuan tumbuh baik dalam jus wortel dan bertahan selama 8 minggu
penyimpanan pada suhu 4 oC. Viabilitas B. bifidum BB-12 dan L. acidophilus
LA-5 yang dienkapsulasi dengan Na-alginat baik dengan teknik ekstrusi maupun
emulsi dan menggunakan white-brined cheese telah dilakukan (Ozer et al., 2009).
Kedua teknik enkapsulasi menunjukkan efektivitas dalam menjaga jumlah bakteri
probiotik lebih tinggi dibandingkan level minimum (>107 cfu/ml). Sementara
jumlah bakteri probiotik non-enkapsulasi menurun kira-kira 103 cfu/ml,
penurunan lebih terbatas dalam keju yang mengandung sel enkapsulasi (kira-kira
BAB 3
METODE PENELITIAN
3.1 Waktu dan Lokasi
Penelitian ini akan dilaksanakan pada bulan Januari 2014 sampai dengan
selesai di Laboratorium Mikrobiologi, Fakultas Matematika dan Ilmu
Pengetahuan Alam, Universitas Sumatera Utara dan di Laboratorium
Mikrobiologi, Balai Teknik Kesehatan Lingkungan Kelas I Medan serta di
Laboratorium Terpadu Kedokteran, Fakultas Kedokteran, Universitas Sumatera
Utara.
3.2 Bahan dan Alat
Bahan-bahan utama yang digunakan dalam penelitian ini ialah isolat
bakteri asam laktat (BAL) asal tambak ikan, Sumatera Utara yang diisolasi oleh
Harahap, 2013; Mayasari, 2013; Sitepu, 2013. Bakteri patogen yang digunakan
adalah Escherichia coli, Staphylococcus aureus, dan Salmonella thypimurium.
Bahan media tumbuh bakteri yang digunakan adalah media deMan’s Rogosa
Sharpe agar (MRSA), deMan’s Rogosa Sharpe broth (MRSB) dan nutrient agar
(NA), nutrient broth (NB), Muller Hinton agar (MHA), plate count agar (PCA).
Bahan-bahan lain yang diperlukan ialah alginat, susu skim, tepung kedelai, inulin,
canola oil, gliserol, CaCl2, phosphate buffer saline (PBS), kertas cakram, larutan
NaCl fisiologis 0,85%, alkohol 70% dan akuades steril. Alat-alat yang diperlukan
ialah erlenmeyer, cawan petri, tabung reaksi, beaker glass, jarum ose, spatula,
pinset, syringe, bunsen, hot plate, spektrofotometer, laminar air flow, pH meter,
neraca analitik, oven, otoklaf, kulkas, jangka sorong, mesin pengocok, pipet
volum, inkubator, gelas ukur, mikropipet, stirrer, dll.
3.3 Rancangan Percobaan
Penelitian dilakukan secara deskriptif dengan 2 kali pengulangan dengan
mengumpulkan data BAL potensial dalam menghambat pertumbuhan Salmonella
17
alginat, alginat-susu skim-inulin dan alginat-tepung kedelai-inulin. Karakterisasi
bahan enkapsulan yang paling efektif menjaga sel pada ketiga jenis kapsul
dilakukan dengan menghitung viabilitas selama penyimpanan pada suhu 4 °C dan
27 °C selama 4 minggu.. Karakterisasi sel bebas dan sel dalam ketiga jenis kapsul
juga dilakukan terhadap kondisi asam lambung tiruan dengan variasi pH 2, 3 dan
6 dengan interval 30 menit selama 2 jam dengan menghitung viabilitas sel setelah
dimasukkan dalam larutan asam lambung tiruan.
3.4 Prosedur Penelitian
3.4.1 Persiapan Kultur BAL
Isolat kultur koleksi bakteri asam laktat dari media miring diinokulasikan
sebanyak satu ose ke dalam media MRSB kemudian diinkubasi selama 48 jam
pada suhu 37 °C. Kemudian dilakukan pemeriksaan kemurnian kultur.
Pemeriksaan kemurnian kultur BAL potensial dilakukan untuk memastikan
kemurnian kultur yang dilakukan melalui pemeriksaan morfologi secara
mikroskopik dengan metode pewarnaan Gram dan uji katalase. Metode
pewarnaan mengacu pada Fardiaz (1989), yaitu preparat bakteri yang telah
dioleskan pada gelas objek, ditetesi dengan kristal violet dan dibilas dengan
akuades. Preparat dikeringudarakan kemudian ditetesi dengan larutan lugol iodin
dan kembali dibilas dengan akuades. Preparat kemudian dikering-udarakan,
selanjutnya ditetesi dengan alkohol 95% sebagai bahan pemucat. Pewarnaan
terakhir menggunakan safranin, pembilasan dilakukan dengan auades, preparat
dikeringudarakan. Bakteri yang telah diwarnai diamati dibawah mikroskop
dengan pembesaran 100x. Metode pengujian katalase mengacu pada McFaddin
(1983), uji katalase dilakukan dengan meneteskan larutan H2O2 3% pada kultur
muda (umur 24 jam). Sifat reaksi terhadap uji katalase ditentukan dengan
pemunculan gelembung gas CO2 merupakan hasil positif terhadap pengujian.
3.4.2 Seleksi BAL Potensial Sebagai Kandidat Probiotik
Dalam pengujian isolat potensial BAL digunakan kertas cakram kosong dengan
diameter 6 mm. Cakram dimasukkan ke dalam cawan petri kosong steril.
kemudian dipipet sebanyak 10 µl selanjutnya diteteskan pada permukaan kertas
cakram dan ditunggu selama ± 1 jam hingga kultur BAL berdifusi ke dalam
cakram. Cakram ini akan digunakan untuk uji antagonis dengan bakteri patogen
uji.
Sebanyak 10 ml media MHA masing-masing dituangkan ke dalam petri
steril dan dibiarkan memadat. Cotton bud steril dicelupkan ke dalam
masing-masing suspensi biakan bakteri patogen Escherichia coli, Staphylococcus aureus
dan Salmonella thypimurium masing-masing dengan kepadatan sel 108 cfu/ml dan
diusapkan perlahan-lahan pada permukaan media uji secara merata, selanjutnya
dibiarkan mengering pada suhu kamar selama beberapa menit. Dengan
menggunakan pinset steril, cakram yang telah ditetesi kultur BAL diletakkan
secara teratur pada permukaan media uji.
Kultur uji diinkubasi selama 24 jam pada suhu 37 °C di dalam inkubator.
Setelah masa inkubasi, diameter zona hambat (daerah bening) di sekitar cakram
diukur dengan menggunakan jangka sorong. Aktivitas senyawa antimikroba BAL
dapat dilihat dengan adanya zona hambat di sekitar cakram. Daerah bening di
sekitar cakram menunjukkan uji positif. Isolat yang menunjukkan zona bening
terbesar dipilih untuk uji selanjutnya.
3.4.3 Pembuatan Kurva Pertumbuhan
Pembuatan kurva pertumbuhan bakteri asam laktat dilakukan dengan metode
Cappucino & Sherman (1987) untuk mengetahui jumlah sel BAL pada Optical
Density/OD tertentu dan untuk mengetahui waktu pemanenan BAL. Pembuatan
kurva dilakukan dengan menggunakan medium MRSB. Modifikasi dari metode
Cappucino & Sherman (1987) ialah jenis media yang digunakan yaitu MRSB.
Sebelumnya perlu dilakukan aktivasi terhadap isolat bakteri. Pertama, sebanyak 1
ose kultur kerja diinokulasi ke dalam 10 ml MRSB, diinkubasi selama 24 jam
pada suhu 37 oC. Kedua, sebanyak 1 ml kultur aktivasi pertama diinokulasikan ke
dalam 9 ml MRSB. Ketiga, sebanyak 2 ml dari aktivasi kedua dimasukkan ke
dalam 18 ml MRSB diinkubasi selama 24 jam pada suhu 37 oC.
Inokulum untuk kurva pertumbuhan memiliki jumlah sel yang disiapkan
19
dalam Erlenmeyer yang berisi 45 ml MRSB dan diinkubasi pada suhu 37 oC.
Kerapatan optik (optical density/OD) biakan tersebut diukur dengan
spektrofotometer pada panjang gelombang 520 nm hingga kerapatan optiknya
setara 0.5. Sebanyak 20 ml (10% v/v) inokulum dengan biakan dengan OD 0.5
Pembuatan kurva pertumbuhan diawali dengan memasukkan 20 ml yang telah
diketahui kerapatan optiknya ke dalam 180 ml MRSB dan diinkubasi selama 24
jam pada suhu 37 oC. Kurva pertumbuhan dibuat dengan mengukur kerapatan
optik dengan menggunakan spektrofotometer pada panjang gelombang 520 nm
setiap 3 jam selama 24 jam. Hasil yang didapat dikonversi sebagai kurva
pertumbuhan bakteri yang dapat menjadi acuan sebagai waktu pemanenan bakteri
asam laktat pada pengujian selanjutnya.
3.4.4 Enkapsulasi dan Pengeringan Sinbiotik dengan Teknik Ekstrusi
Enkapsulasi Sinbiotik BAL teknik ekstrusi dilakukan dengan metode
Reyed (2007). Modifikasi metode ialah jumlah inokulum awal, dan jenis bahan
pengkapsul. Tahap awal pembuatan sinbiotik terenkapsulasi dimulai dengan
menumbuhkan isolat BAL potensial secara terpisah, masing-masing sebanyak
10% (v/v) dalam MRSB dan diinkubasi pada suhu 37 °C serta dipanen pada fase
logaritmik (lama inkubasi sesuai hasil dari penelitian sebelumnya). Sel bakteri
dipanen dengan cara disentrifugasi dengan kecepatan 10.000 rpm pada suhu 4 °C
selama 20 menit. Sel bakteri yang diperoleh kemudian dilarutkan pada 100 ml
campuran yang terdiri atas tepung kedelai 2% (b/v), gliserol 5% (v/v), inulin 2%
(b/v), dan Ca 0,1% (b/v), diperangkap selama 45 menit di dalam 100 ml
larutan alginat steril dengan konsentrasi 3% (b/v). Campuran tersebut diteteskan
pada Ca (0,1 M). Setelah satu jam gel dipindahkan dalam larutan fisiologis
(0,85%) untuk mendapatkan struktur gel yang kompak. Butiran gel yang terbentuk
dipindahkan ke air destilasi dan dilakukan pemutaran secara perlahan selama 1
jam untuk menghilangkan CaCO3 dan mendapatkan butiran yang lebih keras.
Selanjutnya dilakukan pengeringan dengan menggunakan metode Hot air oven.
Perlakuan kemudian diulangi dengan bahan susu skim 2% (b/v), gliserol 5% (v/v),
3.4.5 Uji Viabilitas Kapsul Kultur BAL Setelah Enkapsulasi
Uji viabilitas kapsul kultur BAL dilakukan dengan metode Triana et al.
(2006). Uji viabilitas dilakukan segera setelah proses enkapsulasi selesai dan
setelah disimpan selama 1 bulan pada suhu 4 °C dan 27 °C. Viabilitas sel
terenkapsulasi dihitung pada minggu 0, 1, 2, 3 dan 4 dihitung pada suhu 4 °C dan
27 °C dengan menggunakan metode Total Plate Count pada media PCA.
3.4.6 Uji Ketahanan Sel Bebas dan Sinbiotik Terenkapsulasi Dalam Cairan
Asam Lambung Tiruan
Uji ketahanan sel bebas dan sinbiotik terenkapsulasi dalam cairan asam
lambung tiruan dilakukan dengan metode Wood (2010). Ketahanan sel bebas dan
sel terenkapsulasi dalam cairan asam lambung tiruan (0,08 M HCl dengan 0,2%
(w/v) NaCl; Rao et al., 1989) yang ditambahkan larutan buffer diuji dengan nilai
pH 6, 3 dan 2 (diatur dengan menggunakan NaOH 1 M dan HCl 1 M) . Sebanyak
0,5 ml sel bebas dan sel terenkapsulasi dalam larutan NaCl fisiologis (10-8-10-9
CFU mL-1) masing-masing ditambahkan ke dalam 9,5 ml larutan asam lambung
tiruan dan diinkubasi pada suhu 37 oC. Sampel pada cairan asam lambung tiruan
pada pH 6 dikeluarkan dari inkubator pada interval waktu 20 menit selama 2 jam,
sedangkan pada cairan asam lambung tiruan pada pH 3 dan 2, sampel dikeluarkan
dari inkubator pada interval waktu 5 menit selama 30 menit pertama, kemudian
pada interval 30 menit hingga 2 jam. Pada setiap interval waktu yang ditentukan,
sampel dikeluarkan dari inkubator. Sampel yang mengandung sel terenkapsulasi
dihomogenisasi. Sampel diuji viabilitasnya dengan membuat seri pengenceran
dalam larutan NaCl fisiologis 0,85% dan dilakukan penghitungan Total Plate
Count dalam PCA lalu diinkubasi pada suhu 37 oC selama 48 jam. Perlakuan
BAB 4
HASIL DAN PEMBAHASAN
4.1 Kemurnian Kultur Bakteri Asam Laktat (BAL)
Kemurnian kultur bakteri dilakukan terhadap isolat bakteri asal tambak ikan yaitu
usus ikan nila (US), air kolam (AK) dan endapan kolam (EK). Empat jenis isolat
yang diuji kemurniannya ialah AK2, AK5, EK5 dan US5. Berdasarkan hasil
pemeriksaan secara pewarnaan Gram dan uji katalase diperoleh hasil yang
disajikan pada tabel 1.
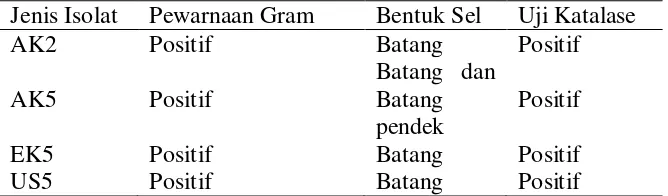
Tabel 1. Karakter Bakteri Asam Laktat
Jenis Isolat Pewarnaan Gram Bentuk Sel Uji Katalase
AK2 Positif Batang Positif
Pada pewarnaan Gram, 4 isolat yang diuji bersifat Gram positif, berbentuk
batang kecuali isolat AK5 yang memiliki 2 bentuk sel yaitu batang dan batang
pendek. Gram positif menunjukkan bahwa pewarna kristal violet dapat diikat
dengan baik oleh sel bakteri dan tidak dapat dilunturkan oleh alkohol. Hal ini
berkaitan dengan struktur dinding sel bakteri. Bakteri Gram positif memiliki
struktur dinding sel dengan komposisi peptidoglikan yang tebal dan lipid yang
tipis (Sutrisna, 2013). Karakteristik isolat AK2, EK5 dan US5 murni berdasarkan
profil fenotip seperti berdasarkan dinding sel bakteri melalui pewarnaan Gram
serta bentuk dari masing-masing isolat BAL yang sudah diisolasi sebelumnya dari
tambak ikan di Sumatera Utara (Harahap, 2013; Mayasari, 2013; Sitepu, 2013).
Pada uji katalase terhadap 4 isolat bakteri asam laktat seluruhnya bersifat
katalase positif. Hal ini menunjukkan bakteri mampu menghasilkan enzim
katalase untuk mengurai H2O2 menjadi H2O dan O2. Lactobacilli merupakan salah
satu genus bakteri asam laktat yang melimpah di alam yang ditemukan pada
organisme Gram positif, berbentuk batang atau batang pendek, tidak membentuk
spora dan katalase negatif (Hammes dan Vogel, 1995). Bagaimanapun, beberapa
spesies Lactobacilli dapat membentuk katalase atau sitokrom pada media yang
mengandung hematin maupun senyawa lain terkait hematin dan beberapa
Lactobacilli dapat juga menghasilkan katalase non-heme yang disebut
pseudokatalase yang menyebabkan kerancuan dalam hal identifikasi BAL
(Holzapfel et al., 2001).
4.2 Seleksi BAL Potensial Sebagai Kandidat Probiotik
Seleksi BAL potensial dilakukan terhadap empat jenis isolat yaitu: AK2, AK5,
EK5 dan US5. BAL potensial ditentukan dari seberapa besar zona bening yang
terbentuk dari hasil uji antagonistik sel BAL terhadap bakteri patogen pangan
Escherichia coli, Staphylococcus aureus dan Salmonella thypimurium. Uji
antagonistik dilakukan dengan metode difusi cakram. Dari hasil uji antagonistik
isolat BAL dengan bakteri patogen didapatkan data isolat BAL yang mampu
menghambat pertumbuhan bakteri patogen yang disajikan pada Tabel 2.
Tabel 2. Diameter Penghambatan (mm) Isolat BAL Terhadap Bakteri Patogen
Isolat
pertumbuhan ketiga jenis patogen yaitu isolat AK2 dengan diameter
penghambatan yaitu 15,60 mm pada E. coli, 16,09 mm pada S. aureus dan 8,12
mm pada S. typhimurium. Berdasarkan hasil seleksi bakteri, diketahui bahwa
isolat AK2 memiliki aktivitas antibakteri terhadap patogen pangan yang terbesar
dibandingkan dengan isolat lainnya sehingga isolat AK2 dianggap potensial untuk
uji berikutnya. Diameter zona hambat yang dihasilkan oleh isolat AK2 terhadap
bakteri patogen memiliki nilai rata-rata yang mampu dihasilkan oleh isolat BAL
23
Kazemipoor et al. (2012) melakukan uji aktivitas antibakteri bakteri asam
laktat Lactobacillus animalis, Lactobacillus rhamnosus, Lactobacillus fermentum
dan Lactobacillus reuteri yang diisolasi dari sayuran fermentasi dengan bakteri
patogen pangan menggunakan metode sumur (5 mm). Dari 4 isolat BAL yang
diujikan, Lactobacillus animalis memiliki diameter penghambatan terbesar yaitu
20 ± 1,3 mm terhadap E. coli dan 13 ± 1,7 mm terhadap S. aureus.
Tadesse et al. (2005) juga melakukan uji aktivitas antibakteri bakteri asam
laktat genus Lactobacillus, Leuconostoc, Pediococcus dan Streptococcus yang
diisolasi dari Borde dan Shamita (minuman fermentasi tradisional Ethiopia)
terhadap bakteri patogen menggunakan metode difusi cakram dengan sterile filter
disc 12 mm. Hasilnya ialah dari 4 genus BAL yang digunakan, isolat
Lactobacillus menghasilkan diameter zona hambat yang lebih besar dibandingkan
dengan genus lainnya dengan diameter sebesar 17,3 ± 0,46 mm terhadap
probiotik Lactobacillus sporogenes mampu menghambat patogen dengan
diameter penghambatan 8,33 ± 0,67 mm terhadap Salmonella sp. dan 10,67 ± 0,67
mm terhadap S. aureus.
Tharmaraj dan Shah (2009) menguji aktivitas antibakteri probiotik
Lactobacillus casei strain Shirota yang diisolasi dari yakult dan Lactobacillus
rhamnosus yang diisolasi dari yoghurt Valiaa terhadap patogen pangan
menggunakan metode sumur (7 mm). Hasil uji menunjukkan adanya aktivitas
antibakteri probiotik L. casei dan L. rhamnosus dengan diameter zona
penghambatan sebesar 14 mm dan 15 mm terhadap E. coli, 13 mm dan 15 mm
terhadap S. typhimurium dan 14 mm dan 23 mm terhadap S. aureus.
Yesillik et al. (2011) melakukan uji aktivitas antimikroba produk
fermentasi komersial salah satunya kefir terhadap beberapa patogen pangan. Kefir
komersial yang diujikan memiliki aktivitas antibakteri sebesar 16,7 ± 0,79 mm
aureus ATCC 25923 dan 14,0 ± 0,34 mm terhadap Salmonella typhimurium
ATCC 14028 selama 24 jam inkubasi.
4.3 Kurva Pertumbuhan BAL Potensial Isolat AK2
Penentuan kurva pertumbuhan bakteri dilakukan untuk mengetahui informasi
waktu pertumbuhan bakteri pada tiap fase pertumbuhan yang terdiri dari fase
adaptasi, fase pertumbuhan logaritmik, fase stasioner dan fase kematian. Kurva
pertumbuhan menunjukkan waktu kapan bakteri memasuki fase pertumbuhan
tertentu yang dibutuhkan untuk berbagai tujuan seperti mengetahui waktu yang
tepat untuk memanen senyawa metabolit sekunder, memanen sel untuk uji
antagonistik, memanen sel untuk enkapsulasi dan lain sebagainya. Kurva
pertumbuhan BAL isolat AK2 menunjukkan kapan sel memasuki fase awal
stasioner yang sesuai untuk waktu pemanenan bakteri untuk tujuan enkapsulasi sel
seperti ditunjukkan pada Gambar 1.
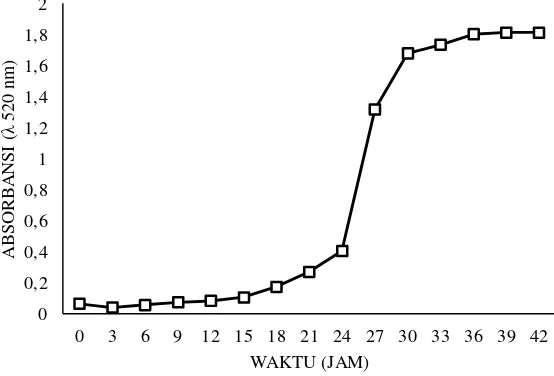
Gambar 1. Kurva pertumbuhan isolat AK2
Pembuatan kurva dilakukan dengan membuat kultur kerja AK2 10%.
Sebanyak 10 mL kultur kerja AK2 OD 0.5 (λ520 nm) dari kultur cair di MRSB
sebelumnya diinokulasikan ke 90 mL dalam media MRSB baru. Kultur kemudian
diinkubasi pada suhu 37 oC pada inkubator shaker dan diukur kepadatan optik
(Optical Density = OD) setiap 3 jam selama 48 jam. Dari grafik kurva
pertumbuhan isolat AK2 diketahui bahwa fase lag atau fase adaptasi bakteri cukup
panjang berkisar antara jam ke-0 hingga jam ke-15. Fase logaritmik dimulai dari
25
jam ke-15 dengan OD 0.1 hingga jam ke-36 dengan nilai OD 1.8. Bakteri
mencapai fase awal stasioner pada jam ke-36 dengan nilai OD 1.8. Fase
pertumbuhan lambat bakteri adalah jam ke-33 hingga jam ke-36 dan setelah itu
bakteri memasuki fase stasioner.
Pemanenan bakteri AK2 untuk tujuan enkapsulasi sel dilakukan pada fase
akhir logaritmik atau awal fase stasioner pada jam ke-36 berdasarkan kurva
pertumbuhan. Pemanenan pada fase ini bertujuan untuk memperpendek waktu
adaptasi kembali bakteri yang akan dienkapsulasi. Total sel bakteri pada saat
pemanenan (36 jam) menunjukkan nilai mencapai 108 – 109 CFU mL-1.
Pentingnya mendapatkan konsentrasi sel 8- 9 log CFU mL-1 dimaksudkan untuk
memberikan jumlah sel yang cukup untuk enkapsulasi dan meningkatkan jumlah
bakteri yang tetap hidup dalam kondisi asam lambung tiruan. Selain itu,
pemanenan pada akhir fase logaritmik dilakukan dengan harapan bakteri mulai
memproduksi senyawa metabolit yang salah satunya berupa asam sehingga
bakteri toleran terhadap paparan asam pada kondisi asam lambung tiruan sehingga
dapat meningkatkan viabilitas dan daya hidup bakteri.
Usmiati dan Marwati (2007) melakukan pembuatan kurva pertumbuhan
bakteri asam laktat SCG 1223 dalam media nutrient broth. Bakteri memasuki fase
stasioner pada jam ke-7. Berdasarkan pada kurva pertumbuhan BAL SCG 1223,
pada titik fase logaritmik (ditunjukkan oleh garis logaritmik sebelum memasuki
fase stasioner) nilai pH terendah pada jam ke-6. Meningkatnya jumlah biomassa
menyebabkan jumlah metabolit sekunder (bakteriosin) yang dihasilkan akan
meningkat kemudian turun setelah mencapai fase stasioner (Boe, 1996).
Pembuatan kurva pertumbuhan isolat juga dilaporkan oleh Yuliana (2008) yang
menggunakan isolat BAL T5 pada media MRS cair. Isolat T5 memiliki fase
adaptasi relatif singkat yang terjadi pada jam ke-0 hingga ke-3 jam pertama,
sedangkan bakteri memasuki fase logaritmik terjadi pada jam ke 3 sampai dengan
jam ke 9.
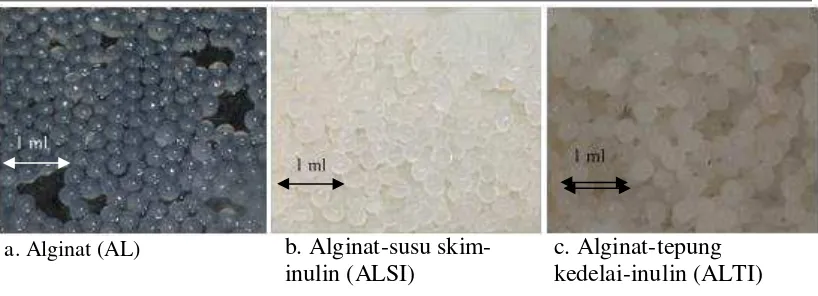
4.4 Enkapsulasi dan Pengeringan Sinbiotik BAL AK2
Isolat bakteri asam laktat AK2 telah berhasil dienkapsulasi menggunakan metode