LAMPIRAN
Lampiran 1: Komposisi dan Penyiapan Media Pengkayaan (Enrichment
Media), Komposisi Media Sakarifikasi
a. Komposisi media pengkayaan (enrichment media) (Sniegowski et al., 2002) yang telah dimodifikasi yaitu Yeast Extract 0,3%, Malt Extract 0,5%, Pepton 0,5%, Sukrosa 0,5%, Glukosa 0,5%, Etanol (v/v) 7,6%, Kloramfenikol 200 µg dan HCl 1 M 1 ml, dilarutkan dalam 1000 ml akuades hingga homogen dan disterilisasi menggunakan autoklaf pada suhu 121oC selama 15 menit.
Lampiran 2. Alur Kerja Penelitian
Isolasi Khamir dari Nira, Tuak dan Laru Asal Pulau Nias
Karakterisasi Morfologi dan Mikroskopis
Uji Penapisan Isolat Khamir Terhadap Etanol
Pembuatan Tepung Limbah
Sakarifikasi Enzimatis Menggunakan Aspergillus niger
Peremajaan Isolat Khamir
Pembuatan Starter
Penyiapan Medium Fermentasi
Lampiran 3. Foto Hasil Penelitian
Inkubasi Hari Ke-5 Isolat PN1 dalam Medium Fermentasi Mengandung Limbah
Kentang
Inkubasi Hari Ke-5 Isolat PN2 dalam Medium Fermentasi Mengandung Limbah
Kentang
Inkubasi Hari Ke-5 Isolat PN1 dalam Medium Fermentasi Mengandung Limbah
Talas
Inkubasi Hari Ke-5 Isolat PN2 dalam Medium Fermentasi Mengandung Limbah
Talas Inkubasi Hari Ke-1 Isolasi Khamir dari
Laru dalam Media Pengkayaan
Lampiran 4. Data Uji Penapisan Khamir Terhadap Etanol
Kode Isolat Jumlah Koloni (Log CFU/ml)
0% 5% 10% 15%
PN1 7,537 7,324 7,068 6,886
PN2 7,276 7,155 7,107 6,806
PN3 7,371 7,004 6,079 5
PN4 7,217 6,913 5,954 5
PN5 6,86 5,477 0 0
PN6 7,214 7,212 6,29 0
Lampiran 5. Kurva Standar Glukosa
y = 0,0013x + 0,0045 R² = 0,9967
0 0,2 0,4 0,6 0,8 1 1,2 1,4
0 200 400 600 800 1000 1200
Nila
i A
bs
o
rba
ns
i
Lampiran 6. Data Pertumbuhan PN1 dan PN2 Selama Fermentasi
Jenis Isolat dan Limbah
Jumlah Koloni (Log CFU/ml)
Hari Ke-1 Hari Ke-2 Hari Ke-3 Hari Ke-4 Hari Ke-5
PN1 (Kentang)
7,264 7,367 7,411 7,382 7,324
PN1 (Singkong)
7,193 7,264 7,392 7,372 7,336
PN1 (Talas)
7,551 7,576 7,614 7,646 7,582
PN2 (Kentang)
7,139 7,283 7,338 7,311 7,294
PN2 (Singkong)
7,049 7,064 7,17 7,178 7,123
PN2 (Talas)
7,389 7,462 7,569 7,507 7,421
DAFTAR PUSTAKA
Adini, S., Kusdiyantini, E., Budiharjo, A. 2015. Produksi Bioetanol dari Rumput Laut dan Limbah Agar Gracilaria sp. dengan Metode Sakarifikasi yang Berbeda. BIOMA. 16(2): 65-75.
Arnata, I.W., Dwi, S., Richana, N. 2009. Bioprocess Technology to Produce Bioethanol from Cassava by Co-Culture Trichoderma viride, Aspergillus niger and Saccharomyces cerevisiae. Prossiding International Conference on Biotechnology for Sustainable Future.
Arnata, I., Anggreni, A. 2013. Rekayasa Bioproses Produksi Bioetanol dari Ubi Kayu dengan Teknologi Ko-Kultur Ragi Tape dan Saccharomyces cerevisiae. Agrointek. 7(1): 21-28.
Barh, D. and Mazumdar, B.C. 2008. Comparative Nutritive Values of Palm Saps Before and After Their Partial Fermentation and Effective Use of Wild Date (Phoenix Sylvestris Roxb.) Sap in Treatment of Anemia. J. Medicine Medical Sci. 3(2): 173-176.
Barlina, R. dan Lay,A. 1994. Pengolahan Nira Kelapa untuk Produk Fermentasi Nata De Coco, Alkohol dan Asam Cuka. Jurnal Penelitian Kelapa. 7(2): 9-12.
Brock, T. and Brock, K. 1978. Basic Microbiology with Applications. Second Edition. New Jersey: Prentice-Hall, Inc., Englewood Cliffs. pp. 76.
Buckle, K.A., Edwards,R.A., Fleet,G.H., Wootton,M. 1985. Ilmu Pangan. Jakarta: UI Press.
Cassey, G. 1996. Ethanol Tolerance in Yeasts. Crit. Rev. Microbiol. 13: 219-290. Chandrasena, G., Keerthipala, A.P., Walker, G.M. 2006. Isolation and
Characterization of Sri Lanka Yeast Germplasm and Its Evaluation for Alcohol Production. J. Institute Brewing. 112: 302-307.
Chaplin M.F. and Buckle, C. 1990. Enzyme Technology. New York: Cambridge University Press.
Cuzin, N., Farinet and Segretain. 1991. Anaerobic Fermentation of Solid Cassava Wastes in Continuous Pilot Scale Fermenter. In: Grassi, G., Delmon, B., Molle J.F., Zibetta H. (Eds). Biomass for Energy and Industry. 4th Edition. London: E.C. Conference Elsevier Applied Science.
Dyanti, 2002. Studi Komparatif Gula Merah Kelapa dan Gula Merah Aren. Jurusan Teknologi Pangan Dan Gizi, Fakultas Teknologi Pertanian, Institut Pertanian Bogor. [SKRIPSI]
Erika, S.S. 2005. Uji Toksisitas Ekstrak Kulit Batang Raru (Shorea faguetiana
Heim) Menggunakan Brine Shrimp Lethality Test (BSLT) Departemen Teknologi Hasil Hutan, Fakultas Kehutanan IPB. Bogor.[SKRIPSI].
Eshaq, F.S., Mir, N.A., Mahzharuddin, K.M. 2011. Production of Bioethanol From Next Generation Feed-Stock Alga Spirogyra Species. Inter. J. Eng. Sci. Technol.. 3(2): 1749-1755.
Fardiaz, S. 1988. Fisiologi Fermentasi. Bogor: Pau IPB.
Galeote, A., Blondin, B., Dequin, S., Sablayrolles, M. 2001. Stress Effects of Ethanol on Fermentation Kinetics by Stationary-Phase Cells of Saccharomyces Cerevisiae. Biotechnol Lett. 23: 677–681.
Gray, W.D. 1948. Further Studies on the Alcohol Tolerance of Yeast : Its Relationship to Cell Storage Products. J. Bacteriol. 55(1): 53-59.
Hallsworth, J.E., Nomura, Y. and Iwahara, M. 1998. Ethanol Induced Water Stress and Fungal Growth. J. Ferment. Bioeng. 86(1): 451–456.
Hawksworth, D.L., Kirk,P.M., Sutton, B.C., Pegler, D.N. 1995. Ainsworth &
Bisby’s Dictionary of the Fungi. 8th Editions. Wallingford-UK: CAB
International.
Hermansyah, Novia, Sugiyama, M., Satoshi, H. 2015. Candida tropicalis Isolated from Tuak, a North Sumatera-Indonesian Traditional Beverage, for Bioethanol Production. Microbiol. Biotechnol. Lett. 43(3): 241-248.
Hu, X.H., Wang, M.H., Tan, T., Li, J.R., Yang, H., Leach, L., Zhang, R.M., Luo, Z.W. 2007. Genetic Dissection of Ethanol Tolerance in the Budding Yeast Saccharomyces cerevisiae. Genetics. 175: 1479–1487.
Ikegami, S. 1997. Tuak dalam Masyarakat Batak Toba: Laporan Singkat Tentang Aspek Sosial Budaya Penggunaan Nira. Japan: Southeast Asian Studies Kyoto University.
Nanas (Ananas comosus L. Merr). Jurusan Biologi FMIPA-ITS. Surabaya. [SKRIPSI].
Ingram, L.O and Buttke T.M. 1984. Effects of Alcohol on Microorganism. Adv. Physiol. 25: 253-300.
Irfan, M. 2013. Pengembangan Produksi Bioetanol dari Limbah Pertanian. J. Kutubkhanah. 16(1): 1-6.
Juriah,S., Susilowati, A., Setyaningsih, R. 2004. Fermentasi Etanol dari Limbah Padat Tapioka (Onggok) oleh Aspergillus niger dan Zymomonas mobilis. Bioteknologi. 1(1):7-12.
Kawado, A., Suizu, T., Imayasu, S., Shigematsu, T. 1992. Highly Efficient Sporulation Induced by Glutathione or Glutathionethiol Ester in Sake and Wild Type Yeast. J. Ferment. Bioeng. 104: 257-268.
Khaing, T.W., Weine, N., Mya, M. 2008. Isolation, Characterization and Screening of Thermo Tolerant, Ethanol Tolerant Indigenous Yeasts and Study on The Effectiveness of Immobilized Cell For Ethanol Production. J. Sci. Technol. 1:12-14.
Khairani, R. 2007. Jagung Sebagai Bahan Biofuel. Universitas Padjajaran.
Kim, G.S., Myung, K.S., Kim Y.J., Oh, K.K., Kim, J.S., Ryu, H.J., Kim, K.H. 2010. Methode of Producing Biofuel Using Sea Algae. Seoul: World Intelectual Property Organization.
Kumalaningsih, S. dan Hidayat,N. 1995. Mikrobiologi Hasil Pertanian. Malang: IKIP Press.
Kumar, R., Shankar, T., Anandapandian, K. 2011. Characterization of Alcohol Resistant Yeast Saccharomyces cerevisiae Isolated from Toddy. Inter. Res. J. Microbiol. 2(10): 399-405.
Kurtzman, C.P. and Fell J.W. 2006. Yeast Systematics and Phylogeny– Implications of Molecular Identification Methods for Studies in Ecology. Dalam: Rosa, C. and Peter G. (Eds). 2006. The Yeast Handbook: Biodiversity and Ecophysiologi of Yeasts. Springer-Verlag, Berlin, pp. 11-30.
Kurtzman, C.P., Fell J.W., Boekhout, T. and Robert, V. 2011. The Yeast, A Taxonomic Study. Elsevier B.V. pp. 90.
Lay, B. 1994. Analisis Mikroba di Laboratorium. PT. Grafindo Persada: Jakarta. Hlm. 117.
Lee, W. and Huang, C. 2000. Modelling of Ethanol Fermentation Using Zymomonas mobilis ATCC 10988 Grown on the Media Containing Glucose and Fructose. Biochem. Eng J. 4 (3): 217-227.
Lempang, M. 2000. Rendemen Produksi Gula Aren (Arenga pinnata Merr.). Buletin Penelitian Kehutanan Balai Penelitian Kehutanan. 6(1): 17-28.
Lin, Y. and Tanaka, S. 2006. Ethanol Fermentation from Biomass Resources: Current State and Prospects. Appl. Microbiol. Biotechnol. 69: 627–642. Maris, A.J.A., Abbott, D.A., Pronk, J.T. 2006. Alcoholic Fermentation of Carbon
Sources in Biomass Hydrolysates by Saccharomyces cerevisiae: Current Status. Process Biochem. 80: 391-418.
Mc Lellan, P.J., Daugulis, A.J., Li, J. 1999. The Incidence of Oscillatory Behavior in The Continous Fermentations of Z. mobilis. Biotechnology Progress. 15 (4): 667-680.
Meaden, P.G., Arneborg, N., Guldfeldt, L.U., Siegumfeldt, H., Jakobsen, M. 1999. Endocytosis and Vacuolar Morphology in Saccharomyces cerevisiae are Altered in Response to Ethanol Stress or Heat Shock. Yeast. 15: 1211– 1222.
Minier, M., Goma, G. 1982. Ethanol Production by Extractive Fermentation. Biotechnology and Bioengineering, John Wiley & 5ons, Inc.
Mirdamadi, S., Sadeghi, H., Sharafi, N., Fallahpour, M., Mohseni, F., Bakhtiari, M.R. 2002. Comparison of Lactic Acid Isomers Produced by Fungal and Bacterial Strains. Iran Biomed J. 6 (2&3): 69-75.
Mishra, P. and Prasad, R. 1989. Relationship Between Ethanol Tolerance and Fatty Acyl Composition of Saccharomyces cerevisiae. Appl Microbiol Biotechnol. 30: 294–298.
Naiola, E. 2008. Mikrobia Amilolitik pada Nira dan Laru dari Pulau Timor, Nusa Tenggara Timur. Biodiversitas. 9(3): 165-168.
Narendranath, N.V. and Power, R. 2005. Relationship Between pH and Medium Dissolved Solids in Terms of Growth and Metabolism of Lactobacilli and Saccharomyces cerevisiae During Ethanol Production. Appl and Environ Microbiol. 71(5): 2239–2243.
Hutan. Badan Litbang Kehutanan. Bogor. J. Penelitian Hasil Hutan. 4(25): 1-11.
Pham, T.K. and Wright, P.C. 2008. The Proteomic Response of Saccharomyces cerevisiae in Very High Glucose Conditions with Amino Acid Supplementation. J. Proteome. Res . 7: 4766–4774.
Pontoh, J. 2012. Metode Analisa dan Komponen Kimia dalam Nira dan Gula Aren. Aren untuk Pangan dan Alternatif Energi Terbarukan.
Priest, F.G. 1992. Enzymes Extracelluler. In Lederberg, J. (Ed.) Encyclopedia Of Microbiology. San Fransisco: Academic Press Inc.
Pujoyuwono, M.D., Trinovia, N., Richana, D.S., Damardjati, Murdiyanto, U. 1997. Karakterisasi Enzim Amilase dari Beberapa Strain Bakteri Indegenous Indonesia. Prosiding Seminar Teknologi Pangan. Bogor: Balai Penelitian Bioteknologi Pangan.
Rahmansyah, M., Kanti. 1999. Isolat-Isolat Khamir Dari Minuman Tradisional Laru Di NTT. Berita Biologi. 4(5): 255-63.
Rahmawati, A. dan Sutrisno, A. 2015. Hidrolisis Tepung Ubi Jalar Ungu (Ipomea batatas L.) Secara Enzimatis menjadi Sirup Glukosa Fungsional: Kajian Pustaka. J. Pangan dan Agroindustri. 3(3): 1152-1159.
Rahmawaty, W., Kusumastuti, Aryanti. 2012. Karakterisasi Pati Talas (Colocasia esculenta (L.) Schott) Sebagai Alternatif Sumber Pati Industri di Indonesia. J. Teknologi Kimia dan Industri. 1(1): 347-351.
Reed, G. 1975. Enzymes in Food Processing. 2nd ed. London: Academic Press. Roger, S., D. Michael, Edward, A.A. 1993. The Microbial World. New Jersey:
Practice-Hall Inc.
Rudolf, A., Malek, A., Guido,A., Gunnar, L. 2005. A Comparisson Between Batch and Fed Batch Simultaneous Saccharification and Fermentation of Steam Pretreated Spruce. J. Enz. Microbiol. Technol. 37: 195-204.
Sampaio, J.P. and Goncalves, P. 2008. Natural Populations of Saccharomyces kudriavzevii in Portugal are Associated with Oak Bark and are Simpatric with S. cerevisiae and S. paradoxus. Appl. Environt. Microbiol. 74: 2144-52.
Sarfat, M., Rahayuningsih, M., Suryani, A., Setyaningsih, D. 2013. Modifikasi Fermentasi Hidrolisat Asam Eucheuma cottonii Menjadi Bioetanol Menggunakan Saccharomyces cerevisiae dan Pachysolen tannophilus. J. Teknologi Industri Pertanian. 23(3): 199-209.
Schneiter, R. 2004. Genetics, Molecular and Cell Biology of Yeast. University of Friburgensis.
Seftian, D., Ferdinand, A., Faizal, M. 2012. Pembuatan Etanol dari Kulit Pisang Menggunakan Metode Hidrolisis Enzimatik Dan Fermentasi. J. Teknik Kimia. 1(18): 10-16.
Sniegowski, P.D., Dombrowski, P.G., Fingerman, E. 2002. Saccharomyces cerevisiae and Saccharomyces paradoxus coexist in a natural woodland site in North America and display different levels of reproductive isolation from European conspecifics. FEMS Yeast Res. 1: 299–306.
Sondari, W.D., Achmad, S., Tjandra, S. 2006. Screening of Alcohol Tolerant Yeast of Saccharomyces cerevisiae. J. Teknik Kimia Indonesia. 5(2): 409-414.
Spencer, J.F.T. and D.M. Spencer. 1997. Yeasts in Natural and Artificial Habitats. Berlin: Springer Verlag.
Tima, M.T. 2011. Optimasi Hidrolisis Pati dalam Limbah Kulit Kentang oleh Aspergillus niger untuk Produksi Bioetanol. UM Malang.
Troyer, J.R. 1953. A Relationship Between Cell Multiplication and Alcohol Tolerance in Yeast. Mycologia. 45: 20-39.
Volk, W. and Wheeler M. 1971. Basic Microbiology. Sixth Edition. New York: Harper & Row Publishers.
Walker, G.M. 1998. Yeast Physiology and Biotechnology. England: John Wiley & Sons Ltd.
Watson, K. and Rose, A.H. 1980. Fatty-acyl Composition of the Lipids of Saccharomyces cerevisiae Grown Aerobically or Anaerobically in Media Containing Different Fatty-Acids. J. General Microbiol. 117: 225-233. Wigyanto, S. dan Novita. 2001. Pengaruh Konsentrasi Gula Reduksi Sari Hati
Nanas dan Inokulum Saccharomyces cerevisiae pada Fermentasi Etanol. J. Teknologi Pertanian. 2(1): 68-77.
Yoshikawa, K., Tanaka, T., Furusawa, C., Nagahisa, K., Hirasawa, T. and Shimizu, H. 2009. Comprehensive Phenotypic Analysis for Identification of Genes Affecting Growth Under Ethanol Stress in Saccharomyces Cerevisiae. Fems Yeast Res. 9: 32–44.
Yudoamijoyo, M., Darwis, A.A., Sa’id, E.G. 1992. Teknologi Fermentasi. Penerbit Rajawali Press Dengan Pusat Antar Universitas Bioteknologi IPB: Jakarta.
Zakpaa, H.D., Mensah, E.E.M. and Johnson,F.S. 2009. Production of Bioethanol From Corncobs Using Aspergillus niger and Saccharomyces cerevisiae in Simultaneous Saccharification and Fermentation. Afr. J. Biotechnol. 8(13): 3018-3022.
BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan April 2016 sampai dengan Agustus 2016 di Laboratorium Mikrobiologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2 Isolasi Khamir
Sampel nira, tuak dan laru diambil dari Pulau Nias pada dua lokasi yang berbeda. Nira aren, tuak aren dan laru dari kulit pohon durian diambil dari Desa Hilimbowo, Gunungsitoli Selatan. Nira kelapa, tuak kelapa dan laru dari kulit pohon golikhe diambil dari Desa Humene, Gunungsitoli Idanoi. Sebanyak 100 ml sampel cair dimasukkan ke dalam sampel cup steril kemudian disimpan di dalam cool box, sedangkan sampel padat dimasukkan ke dalam kantong plastik dan dibawa ke laboratorium untuk diisolasi.
Isolasi khamir dari nira dan tuak dilakukan dengan menggunakan media Glucose Yeast Pepton Agar (GYPA). Sebanyak 1 ml sampel dilarutkan dalam 10 ml NaCl fisiologis. Pengenceran dilakukan dengan seri 10-2, 10-3, 10-4 dan 10-5. Suspensi diinokulasikan sebanyak 0,1 ml dari masing-masing pengenceran dan disebar ke media GYPA. Kultur diinkubasi selama 48 jam pada suhu ambien (Naiola, 2008).
dimurnikan, dan disimpan dalam media miring GYPA dalam refrigerator hingga pekerjaan selanjutnya (Sniegowski et al., 2002).
3.3 Pengamatan Morfologi Khamir
Pengamatan morfologi koloni khamir secara langsung dilakukan berdasarkan Kurtzman et al., (2011) dengan ciri-ciri yang diamati yaitu tekstur, warna, permukaan, elevasi dan tepi koloni. Pengamatan dilakukan pada biakan berumur 48 jam atau lebih yang ditumbuhkan dalam media Malt Extract Agar (MEA) di dalam inkubator. Pengamatan koloni khamir secara mikroskopis dilakukan berdasarkan Lay (1994) dan Kurtzman et al., (2011) dengan ciri-ciri yang diamati yaitu bentuk sel, jenis pertunasan, askospora, blastospora dan pseudohifa/hifa.
3.4 Uji Toleransi Khamir Terhadap Etanol
Isolat khamir diuji tingkat toleransinya terhadap etanol pada media dengan konsentrasi etanol yang bervariasi. Sebanyak 1 ml khamir dengan kekeruhan setara larutan Mc.Farland diinokulasikan pada 10 ml media Glucose Yeast Peptone Broth (GYPB) dengan konsentrasi etanol p.a. yang berbeda (0, 5, 10 dan 15%) (Khaing et al., 2009). Tabung diinkubasi pada suhu ambien selama 48 jam. Setelah diinkubasi, sel khamir diukur viabilitasnya dalam media GYPA dan dihitung hasilnya dalam Log CFU/ml. Masing-masing perlakuan diulang sebanyak 2 kali. Khamir dengan tingkat toleransi terhadap etanol paling tinggi, digunakan pada tahapan selanjutnya.
3.5 Pembuatan Tepung Limbah
kemudian disimpan untuk selanjutnya digunakan sebagai bahan utama media fermentasi bioetanol (Adini et al., 2015).
3.6 Sakarifikasi Enzimatis Menggunakan Aspergillus niger
Tepung limbah yang akan digunakan sebagai bahan baku fermentasi bioetanol disakarifikasi terlebih dahulu. Sakarifikasi bertujuan mengubah komponen pati pada limbah menjadi monosakarida (glukosa) yang akan digunakan khamir dalam proses fermentasi. Proses sakarifikasi dilakukan oleh jamur Aspergillus niger. Isolat jamur A. niger yang digunakan dalam penelitian ini berasal dari Laboratorium Hama & Penyakit Tanaman, Fakultas Pertanian, Universitas Sumatera Utara.
Isolat A. niger diremajakan terlebih dahulu sebelum digunakan dalam proses sakarifikasi dengan menumbuhkannya pada media Potato Dextrose Agar (PDA) dan diinkubasi selama 5 hari pada inkubator jamur. Isolat khamir dari media PDA diinokulasikan pada media yang mengandung tepung limbah dan agar dengan perbandingan 1,5% : 1% dan diinkubasi selama 72 jam di dalam inkubator jamur.
Sebanyak 1000 ml medium sakarifikasi (Lampiran 1 Halaman 39) yang mengandung 3% tepung limbah dihomogenkan dalam beaker glass 1000 ml. Medium sakarifikasi yang telah homogen dibagi ke dalam lima erlenmeyer, masing-masing erlenmeyer berisi 200 ml medium sakarifikasi. Medium sakarifikasi disterilisasi dengan menggunakan autoklaf. Media yang telah steril diinokulasikan dengan A. niger dari media padat yang mengandung tepung limbah menggunakan cork borer, diinkubasi selama 72 jam pada suhu ambien di atas shaker dengan kecepatan 120 rpm (Eshaq et al., 2011). Pengukuran kadar gula reduksi dengan metode 3,5 dinitrosalicylic acid (DNS) dan pengukuran pH media menggunakan pH meter dilakukan pada hari ke-0 dan hari ke-3 proses sakarifikasi.
3.7 Peremajaan Isolat Khamir
diinokulasikan ke dalam 50 ml media (glukosa 10 g/l; Yeast extract 1,0 g/l; KH2PO4 0,1 g/l; MgSO4.7H2O 0,1 g/l; dan (NH4)2SO4, 0,1 g/l) dalam erlenmeyer, kemudian diinkubasi pada suhu ambien selama 24 jam menggunakan orbital shaker dengan kecepatan 100 rpm (Samsuri et al., 2007).
3.8 Pembuatan Starter
Kultur biakan khamir hasil peremajaan digunakan untuk pembuatan starter. Sebanyak 50 ml media hasil sakarifikasi dipisahkan dari miselium A. niger menggunakan Kertas Whatmann No. 42 secara aseptis. Media hasil sakarifikasi tersebut akan digunakan sebagai medium fermentasi oleh khamir. Hasil penyaringan ditampung dalam erlenmeyer 100 ml yang telah steril. Sebanyak 10% (v/v) kultur biakan khamir hasil peremajaan dengan OD600 = 0.1 diinokulasikan ke dalam media hasil sakarifikasi (medium fermentasi), diinkubasi selama 24 jam pada suhu ambien diatas shaker dengan kecepatan 100 rpm (Samsuri et al., 2007).
3.9 Penyiapan Medium Fermentasi
3.10 Produksi Bioetanol
Sebanyak 10% (v/v) starter kultur khamir dengan OD600 = 0.1 diinokulasikan ke dalam masing-masing erlenmeyer, diinkubasi pada suhu ambien selama 120 jam. Sebanyak 2 ml sampel dari kelima ulangan diambil dan dihomogenkan di dalam sample cup steril untuk kemudian digunakan dalam pengukuran kadar gula reduksi, pH dan jumlah koloni khamir yang dilakukan setiap 24 jam selama proses produksi bioetanol. Pengukuran kadar gula reduksi dilakukan dengan metode 3,5-dinitrosalicylic acid (DNS). Pengukuran pH dengan menggunakan pH meter. Perhitungan jumlah sel khamir dilakukan dengan metode Total Plate Count (TPC). Untuk perhitungan estimasi jumlah sel dapat dihitung dengan rumus :
Estimasi Jumlah Sel = Jumlah Koloni x � � �1 (Log CFU/ml) Untuk menghitung persentase efisiensi fermentasi dapat dihitung dengan rumus :
Efisiensi Fermentasi = � �ℎ �ℎ � � � �ℎ �� � � x 100%
BAB 4
HASIL DAN PEMBAHASAN
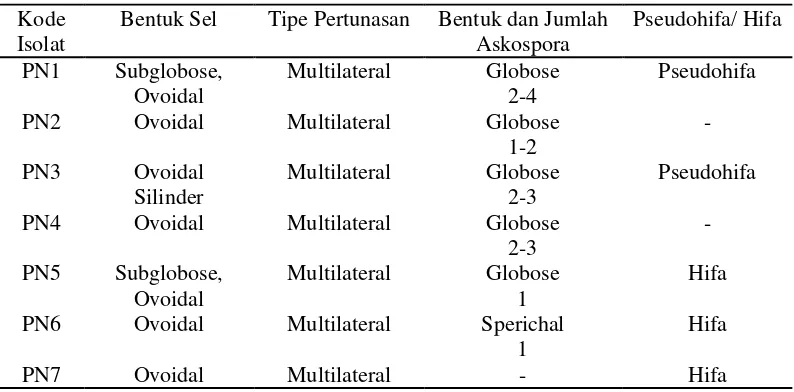
4.1 Karakteristik Isolat Khamir dari Nira, Tuak dan Laru Asal Pulau Nias Isolasi khamir dari nira dan tuak didapatkan 4 isolat khamir berbeda yang diinkubasi menggunakan media Glucose Yeast Pepton Agar (GYPA), sedangkan isolasi khamir dari laru didapatkan 3 isolat khamir berbeda yang diinkubasi dengan menggunakan enrichment media. Tujuh isolat khamir menunjukkan karakteristik morfologi dan karakteristik mikroskopis yang berbeda-beda seperti ditunjukkan oleh tabel berikut :
Tabel 1. Karakteristik morfologi khamir yang diisolasi dari nira, tuak dan laru asal Pulau Nias
Kode Isolat
Morfologi Koloni
Tekstur Permukaan Tepi Elevasi Warna
PN 1 Berbutir Halus Rata Cembung Putih
Kekuningan
PN 2 Berbutir Halus Rata Cembung Putih
Kekuningan PN 3 Berbutir Halus Bergelombang Cembung Putih
Kekuningan
PN 4 Berbutir Halus Rata Cembung Putih
Kekuningan PN 5 Bermembran Berlipat Berhifa Terangkat Putih
Kekuningan PN 6 Bermembran Berlipat Berhifa Terangkat Putih
Kekuningan PN 7 Bermembran Berlipat Berhifa Terangkat Putih
kekuningan Keterangan: PN = Pulau Nias
Isolat khamir yang telah dikarakterisasi berdasarkan morfologinya kemudian dikarakterisasi secara mikroskopis (Tabel 2).
Tabel 2. Karakteristik mikroskopik khamir yang diisolasi dari nira, tuak dan laru asal Pulau Nias
Kode Isolat
Bentuk Sel Tipe Pertunasan Bentuk dan Jumlah Askospora
Pseudohifa/ Hifa
PN1 Subglobose, Ovoidal
Multilateral Globose 2-4
Pseudohifa
PN2 Ovoidal Multilateral Globose
1-2
-
PN3 Ovoidal Silinder
Multilateral Globose 2-3
Pseudohifa
PN4 Ovoidal Multilateral Globose
2-3
-
PN5 Subglobose, Ovoidal
Multilateral Globose 1
Hifa
PN6 Ovoidal Multilateral Sperichal
1
Hifa
PN7 Ovoidal Multilateral - Hifa
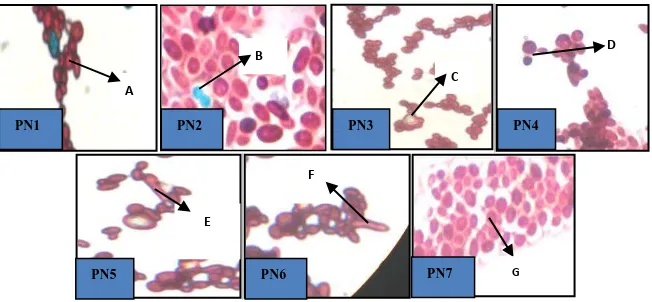
Berdasarkan hasil pengamatan karakteristik mikroskopis menunjukkan karakteristik yang berbeda. Bentuk sel isolat khamir bervariasi yaitu subglobose, ovoidal dan silinder. Khamir juga mempunyai variasi bentuk sel seperti globose, oval, subglobose, ellipsoid, dan sausage (Hawksworth et al., 1995). Setelah 2 minggu diinkubasikan pada media Yeast-Malt Extract Agar (YMEA), 7 isolat tidak membentuk pigmen, dan berwarna putih kekuningan. Menurut Spencer dan Spencer (1997), hampir 90% khamir mempunyai penampakan morfologi putih kekuningan. Keseluruhan isolat khamir memiliki jenis pertunasan multilateral. Sebagian besar isolat khamir memiliki bentuk askospora globose dengan jumlah yang sangat bervariasi, tetapi isolat PN6 memiliki bentuk sperichal. Berdasarkan jenis hifa, terdapat 2 isolat khamir yang membentuk pseudohifa, sedangkan 3 isolat khamir membentuk hifa sejati, dan 2 isolat khamir tidak memiliki keduanya. Gambar karakteristik mikroskopik masing-masing isolat khamir dapat dilihat pada (Gambar 1).
khamir perfekti, yaitu khamir yang dapat melakukan perkembangbiakan secara seksual dan aseksual, yaitu dengan cara membentuk tunas (budding). Pengamatan siklus seksual khamir merupakan salah satu kunci identifikasi yang cukup penting dalam membedakan khamir seksual dan aseksual, oleh sebab itu banyak media dan metode yang dikembangkan untuk merangsang pembentukan askospora.
Gambar 1. Hasil pengamatan morfologi khamir secara mikroskopis dengan mikroskop cahaya perbesaran 1000x (A)Sel Khamir; (B)Askospora; (C)Pseudohifa; (D)Pertunasan Multilateral; (E)Hifa; (F)Hifa; (G)Sel Khamir Tanpa Askospora
Berdasarkan penelitian yang dikembangkan oleh Kawado et al., (1992) kemampuan khamir untuk membentuk askospora dapat hilang apabila khamir disimpan dalam waktu yang cukup lama. Kawado et al., (1992) telah berhasil mengembangkan media pembentukan spora yang diperkaya dengan glutathione, dimana zat tersebut berfungsi untuk merangsang aktivitas enzim glikolitik yang berlanjut dengan meningkatnya sintesis glutathionthiol ester pada khamir yang ditumbuhkan pada media tersebut.
Kecenderungan beberapa strain khamir membentuk rangkaian sel menghasilkan formasi pseudohifa yang didefinisikan sebagai suatu filamen yang tersusun oleh rangkaian sel khamir dan dibentuk selama proses pertunasan (budding). Beberapa khamir memiliki septat sejati yang kemudian tumbuh dan bercabang membentuk hifa. Perbedaan mendasar antara hifa dan pseudohifa yaitu, hifa memiliki septa yang lurus dan pada umumnya berdiferensiasi dari tepi vakuola sedangkan pseudohifa tidak memiliki septa, ujung interkalarnya membelok dan tidak bias (Kurtzman et al., 2011).
F
F
E
D
C B
A
PN1 PN2 PN3 PN4
4.2 Uji Toleransi Khamir Terhadap Etanol
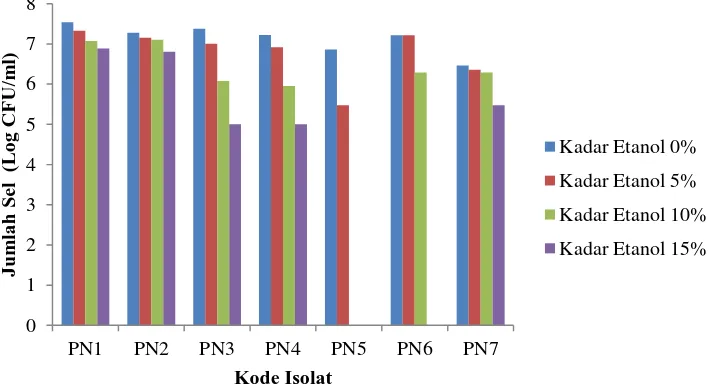
Uji toleransi khamir terhadap etanol dilakukan untuk mengetahui toleransi sel khamir terhadap etanol di lingkungan. Masing-masing isolat ditumbuhkan pada media GYPB selama 48 jam, kemudian diukur viabilitasnya pada media GYPA dan dihitung hasilnya dalam Log CFU/ml. Hasil pengamatan uji toleransi khamir terhadap etanol dapat dilihat pada (Gambar 2).
Gambar 2. Viabilitas isolat khamir pada medium GYPB dengan variasi konsentrasi etanol
Hasil pengamatan menunjukkan bahwa, viabilitas masing-masing isolat khamir terhadap etanol berbeda-beda. Semakin tinggi kadar etanol pada media, semakin sedikit jumlah koloni khamir yang tumbuh. Semua isolat dapat tumbuh pada media dengan kadar etanol 0% dan 5%, sedangkan pada media dengan kadar etanol 10% semua isolat khamir dapat tumbuh kecuali PN5. Isolat khamir yang dapat tumbuh pada media dengan kadar etanol 15% yaitu PN1, PN2, PN3, PN4 dan PN7 dengan jumlah koloni antara 5-6,89 Log CFU/ml (Data selengkapnya dapat dilihat pada Lampiran 4 Halaman 42). Isolat PN1 dan PN2 dengan jumlah koloni khamir paling banyak yaitu 6,886 Log CFU/ml dan 6,806 Log CFU/ml dipilih untuk digunakan pada tahapan selanjutnya.
Tingkat toleransi sel khamir terhadap etanol merupakan faktor penting dalam memilih strain khamir yang digunakan pada proses fermentasi bioetanol
0 1 2 3 4 5 6 7 8
PN1 PN2 PN3 PN4 PN5 PN6 PN7
J um la h Sel ( L o g CF U/m l) Kode Isolat
Kadar Etanol 0%
Kadar Etanol 5%
Kadar Etanol 10%
(Cassey, 1996). Khamir dengan tingkat toleransi terhadap etanol yang tinggi efektif meningkatkan produksi bioetanol dan dari keseluruhan proses fermentasi (Chandrasena et al., 2006).
Gambar 3. Hasil uji toleransi khamir terhadap etanol dengan konsentrasi 15% pada medium GYPA (A) PN1; (B) PN2; (C) PN3; (D) PN4; (E) PN5; (F) PN6; (G) PN7
Secara visual tingkat toleransi khamir terhadap etanol dengan konsentrasi 15% dapat dilihat pada (Gambar 3) dengan menghitung jumlah sel khamir yang tumbuh pada media GYPA. Dari gambar tersebut, dapat diketahui bahwa isolat khamir PN1 dan PN2 memiliki viabilitas paling tinggi ketika ditumbuhkan pada media GYPB mengandung etanol dengan konsentrasi 15%. Hal ini ditunjukkan dengan banyaknya jumlah sel khamir yang tumbuh pada media GYPA.
Efek konsentrasi etanol terhadap pertumbuhan sel dan viabilitas Saccharomyces cerevisiae telah diteliti oleh Kumar et al., (2011) yang melaporkan bahwa S. cerevisiae memiliki toleransi terhadap etanol hingga konsentrasi etanol 15% pada media. Hasil yang kurang lebih sama juga dilaporkan oleh Khaing et al., (2008), yang menyimpulkan bahwa S. cerevisiae strain KY1 dan KY3 toleran terhadap kadar etanol 15% pada media sedangkan KY2 toleran hingga konsentrasi etanol 20% dan menunjukkan hasil fermentasi etanol maksimum selama periode inkubasi.
Akumulasi etanol pada kultur cair dapat menjadi faktor stres/tekanan bagi sel khamir selama fermentasi. Meskipun S. cerevisiae toleran terhadap kadar etanol yang tinggi, secara relatif konsentrasi etanol yang tinggi menghambat pertumbuhan sel dan viabilitas, membatasi produktifitas fermentasi dan volume
A B C D
etanol yang dihasilkan (Galeote et al., 2001). Banyak peneliti menemukan bahwa lemak memiliki peran yang penting dan merupakan salah satu faktor penentu sifat resistensi khamir terhadap etanol. Gray (1948) dan Troyer (1953) menyatakan bahwa strain khamir yang lebih resisten terhadap etanol, memiliki kandungan lipid yang banyak. Penelitian Watson (1982), menunjukkan bahwa residu asam lemak tidak jenuh pada membran fosfolipid (kecuali ergosterol) penting untuk resistensi Saccharomyces terhadap konsentrasi etanol yang tinggi. Etanol mempengaruhi metabolisme sel dan biosintesis makromolekular dengan menginduksi produksi Heat Shock Protein (HSP), menurunkan kecepatan akumulasi RNA dan protein, meningkatkan frekuensi terjadinya mutasi, mengubah metabolisme, menyebabkan terjadinya denaturasi dan penurunan aktifitas protein intraselular dan enzim glikolisis (Hu et al., 2007).
Biosintesis triptofan secara khusus terlibat dalam respon terhadap stres etanol pada S. cerevisiae. Strain khamir dengan gen biosintesis triptofan yang overexpressing menunjukkan toleransi etanol hingga 5% (v/v), sama dengan hasil yang ditunjukkan ketika dilakukan penambahan triptofan pada media. Peran biosintesis triptofan dalam meningkatkan toleransi terhadap stres etanol hingga saat ini belum diketahui dengan jelas walaupun beberapa penelitian menyatakan terdapat hubungan antara biosintesis dan transport asam amino terhadap toleransi stres etanol yaitu bahwa etanol mengacaukan fungsi membran yang berdampak pada pengiriman asam amino ke dalam sel (Pham and Wright, 2008; Yoshikawa et al., 2009).
4.3 Sakarifikasi Enzimatis Menggunakan Aspergillus niger
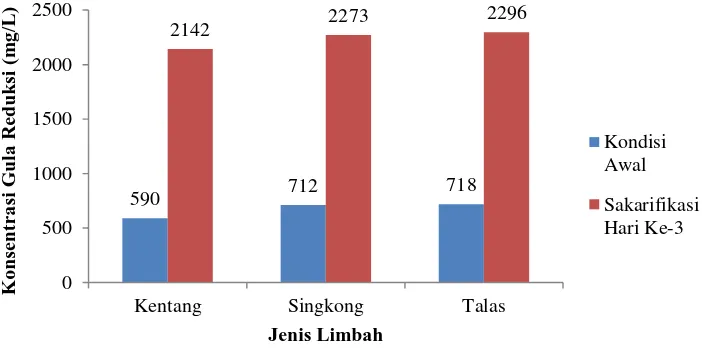
Adanya aktivitas enzim α-amilase dan glukoamilase yang dihasilkan dari A. niger menyebabkan pati terhidrolisis menjadi gula reduksi, sehingga pada proses sakarifikasi limbah terjadi peningkatan konsentrasi gula reduksi dari kondisi awal sebelum sakarifikasi sampai hari ke-3 sakarifikasi. Peningkatan jumlah gula reduksi setelah proses sakarifikasi dapat dilihat pada (Gambar 4) :
Gambar 4. Peningkatan konsentrasi gula reduksi pada medium dari kondisi awal hingga sakarifikasi hari ke-3
Berdasarkan hasil pengamatan, ketiga jenis limbah mengalami peningkatan konsentrasi gula reduksi setelah proses sakarifikasi. Limbah kupasan kentang, singkong dan talas secara berturut-turut mengalami peningkatan konsentrasi gula reduksi sebesar 263%, 219% dan 220% dengan konsentrasi akhir gula reduksi sebesar 2142 mg/L, 2273 mg/L dan 2296 mg/L.
Menurut penelitian Chinedu et al., (2008) kapang A. niger mampu menghasilkan gula reduksi sebesar 4,27 mg/ml untuk limbah agar dan untuk rumput laut Gracilaria sp. sebesar 0,99 mg/ml. Hasil tersebut lebih besar dibandingkan hidrolisis selulosa oleh kapang A. niger pada serbuk gergaji, bagas dan pulp yaitu sebesar 0,38 mg/ml, 0,55 mg/ml dan 0,53 mg/ml. Kadar gula reduksi untuk medium rumput laut Gracilaria sp. menghasilkan jumlah yang lebih rendah dibandingkan dengan medium limbah agar. Hal tersebut diduga karena rumput laut Gracilaria sp. memiliki dinding sel yang didalamnya masih terdapat berbagai jenis polisakarida kompleks seperti galaktan dan selulosa.
590 712 718
2142 2273 2296
0 500 1000 1500 2000 2500
Kentang Singkong Talas
Perbedaan jenis polisakarida pada limbah dapat mempengaruhi aktivitas hidrolisis. Semakin kompleks jenis polisakarida yang terdapat pada limbah, maka semakin sulit untuk dihidrolisis oleh enzim.
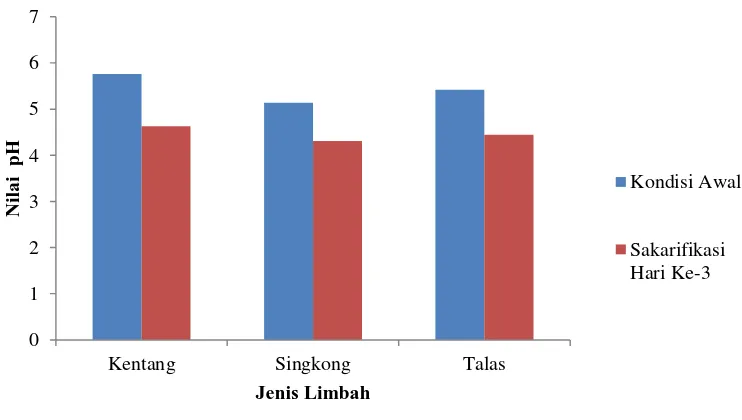
Aktivitas optimum enzim berkisar pada nilai pH pertumbuhan mikroorganisme penghasil enzim tersebut. Enzim amilase umumnya stabil pada kisaran nilai pH 5,5-7,0. Aktivitas optimum umumnya terjadi pada nilai pH 4,8 – 6,5 (Pujoyuwono et al., 1997). Sedangkan aktivitas optimum enzim glukoamilase terjadi pada pH 4,5 (Rahmawaty dan Sutrisno, 2015). Nilai pH dari media mempengaruhi sturktur dan aktivitas enzim dalam proses sakarifikasi. Pada (Gambar 5) dapat diketahui bahwa semua substrat mengalami penurunan pH pada hari ke-3 yang disebabkan oleh akumulasi asam-asam organik pada medium.
Gambar 5. Penurunan pH medium dari kondisi awal hingga sakarifikasi hari ke-3
Proses sakarifikasi oleh enzim α-amilase dan glukoamilase pada substrat pati cair menyebabkan pH substrat akan turun menjadi lebih asam daripada pH optimum enzim ini (Priest, 1992). Hal ini disebabkan selama proses sakarifikasi berlangsung selain menghasilkan glukosa, A.niger juga menghasilkan asam-asam organik terutama asam sitrat (Rogers et al, 1993). Penurunan pH selama proses sakarifikasi berlangsung, berpengaruh pada proses pemecahan pati menjadi gula reduksi selanjutnya. Apabila pH substrat di bawah pH optimum maka enzim α
-0 1 2 3 4 5 6 7
Kentang Singkong Talas
Nila
i
pH
Jenis Limbah
Kondisi Awal
amilase dan glukoamilase dari A. niger tidak dapat bekerja dengan maksimum. Menurut Reed (1975), aktivitas α-amilase pada tepung gandum turun dengan cepat apabila pH di bawah 4,0 dan aktivitas lebih rendah di atas 5,0. Ketika pH di bawah 4, konsentrasi gula reduksi yang dihasilkan juga menurun.
4.4 Potensi Isolat Khamir Terpilih Dalam Menghasilkan Bioetanol Dari Tepung Limbah
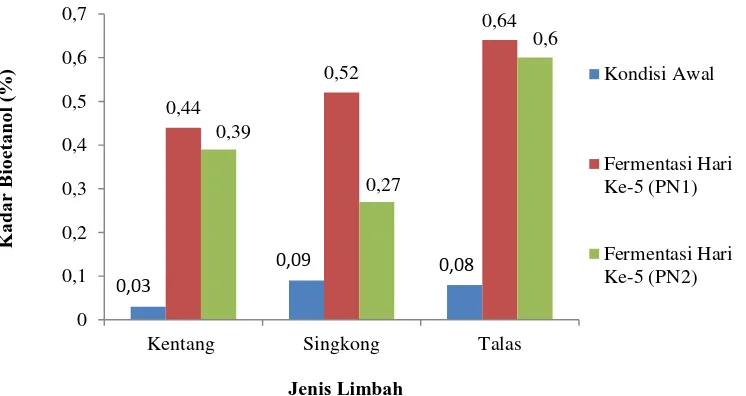
Dua isolat khamir, yaitu PN1 dan PN2 diuji kemampuannya dalam memproduksi bioetanol dari tiga jenis limbah. Kadar bioetanol yang dihasilkan dapat dilihat pada (Gambar 6). Berdasarkan data tersebut diketahui bahwa kadar bioetanol dari setiap substrat mengalami peningkatan pada hari ke-5. Kondisi awal sebelum proses fermentasi berlangsung, medium yang mengandung tepung limbah memiliki kadar etanol antara 0,03 - 0,09%. Pada umumnya buah, sayur dan umbi-umbian mengandung etanol secara alami namun kadarnya masih di bawah 1% (Indrawati et al., 2009).
Gambar 6. Peningkatan kadar bioetanol (%) dari kondisi awal sebelum fermentasi hingga fermentasi hari ke-5
Isolat PN1 menghasilkan kadar etanol paling tinggi sebesar 0,64% pada medium fermentasi mengandung limbah talas. Isolat PN2 menghasilkan bioetanol dengan kadar 0,60%, juga pada medium fermentasi mengandung limbah talas. Hal
0,03 0,09 0,08 0,44 0,52 0,64 0,39 0,27 0,6 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7
Kentang Singkong Talas
ini bergantung pada jumlah gula reduksi yang dikonversi oleh sel khamir menjadi bioetanol. Penggunaan gula reduksi oleh khamir menyebabkan konsentrasi gula reduksi pada medium fermentasi menurun. Berdasarkan hasil pengamatan konsentrasi gula reduksi pada medium fermentasi munurun seiring dengan jumlah hari inkubasi. Persentase penurunan konsentrasi gula reduksi pada medium fermentasi dari kondisi awal hingga hari ke-5 dapat dilihat pada (Gambar 7).
Gambar 7. Penurunan konsentrasi gula reduksi pada medium fermentasi
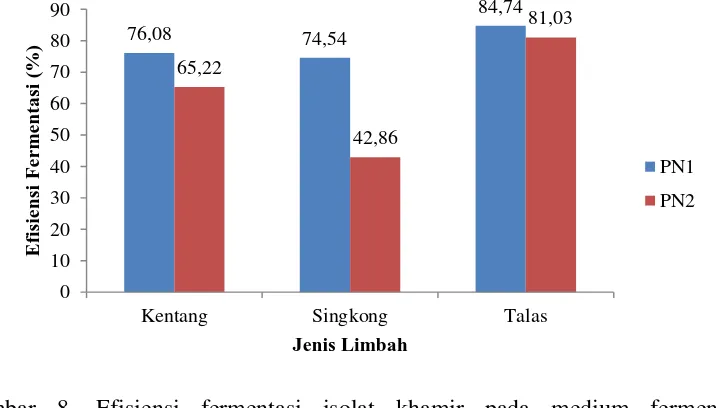
Gambar 8. Efisiensi fermentasi isolat khamir pada medium fermentasi mengandung limbah 44,72 47,03 50,04 42,67 42,27 49,43 38 40 42 44 46 48 50 52
Kentang Singkong Talas
P enurun a n K o ns ent ra si G ula Reduk si (%) Jenis Limbah PN1 PN2 76,08 74,54 84,74 65,22 42,86 81,03 0 10 20 30 40 50 60 70 80 90
Kentang Singkong Talas
Dari data dapat diketahui persentase penurunan konsentrasi gula reduksi tertinggi secara berturut-turut terdapat pada medium fermentasi mengandung limbah talas dengan menggunakan isolat PN1, medium fermentasi mengandung limbah talas dengan menggunakan isolat PN2 dan medium fermentasi mengandung limbah singkong dengan menggunakan isolat PN1 yaitu sebesar 50,04%, 49,43% dan 47,03%. Hal ini sesuai dengan Yudoamijoyo et al (1992) yang menyatakan bahwa semakin banyak gula reduksi yang dapat dimanfaatkan oleh sel, semakin tinggi juga kadar etanol yang dihasilkan.
Secara teoritis, satu mol glukosa dapat diubah menjadi dua mol etanol dan dua mol karbondioksida atau dengan perbandingan bobot tiap 50 gram glukosa akan menghasilkan 100 gram etanol. Adanya kondisi tersebut memerlukan suatu upaya untuk menggunakan bahan baku yang murah agar dapat mengurangi biaya produksi bioetanol (Lee dan Huang, 2000). Menurut Kumalaningsih dan Hidayat (1995) bahwa efisiensi fermentasi dapat diketahui dengan membandingkan banyaknya hasil alkohol melalui proses fermentasi dengan alkohol yang dihasilkan secara teoritis dari glukosa. Efisiensi fermentasi isolat PN1 dan PN2 pada medium fermentasi mengandung limbah dapat dilihat pada (Gambar 8).
Dari data dapat diketahui bahwa isolat PN1 dan PN2 secara berturut-turut memiliki persentase efisiensi fermentasi terbesar pada medium fermentasi mengandung limbah talas yaitu sebesar 84,74% dan 81,03% selama lima hari waktu fermentasi. Efisiensi fermentasi merupakan persentase konsentrasi etanol hasil produksi terhadap konsentrasi etanol secara teoritis. Secara teoritis 100% glukosa diubah menjadi 51,1% etanol dan 48,9% menjadi CO2 (Rudolf et al., 2005).
Efisiensi fermentasi menunjukkan persentase glukosa yang dimanfaatkan sel khamir untuk pembentukan etanol, sedangkan sisanya dimanfaatkan untuk proses lain, seperti untuk mempertahankan metabolisme sel, untuk pembentukan biomassa dan dalam proses terbentuknya senyawa-senyawa asam organik berupa asam asetat, asam laktat dan asam piruvat (Arnata, 2009).
penelitian tersebut menujukkan bahwa produksi etanol tertinggi dari Pachysolen tannophilus IPBCC AC IX adalah 0,11% (v/v), dengan 15,39% efisiensi penggunaan substrat, dan 2,60% efisiensi fermentasi yang difermentasi selam 4 hari. Sedangkan produksi etanol tertinggi dengan perlakuan culture refresh menggunakan S. cerevisiae IPBCCAL IX teradaptasi setelah fermentasi berlangsung 24 jam oleh S. cerevisiae IPBCC AL IX teradaptasi adalah 1,76% (v/v) etanol pada fermentasi cair, dengan 53,06% efisiensi penggunaan substrat, dan 43,53% efisiensi fermentasi yang difermentasi selama 6 hari. Penelitian fermentasi etanol dari limbah padat tapioka (onggok) oleh Aspergillus niger dan Zymomonas mobilis oleh Juariah et al., (2004) menemukan bahwa konsentrasi etanol yang dihasilkan selama proses fermentasi adalah 0,7% dan efisiensi pengubahan gula reduksi hasil sakarifikasi menjadi etanol oleh Z. mobilis adalah 83% selama 4 hari fermentasi. Berdasarkan data tersebut dapat disimpulkan bahwa isolat khamir PN1 dan PN2 memiliki efisiensi fermentasi yang cukup tinggi tetapi waktu fermentasi terlalu lama yaitu 5 hari.
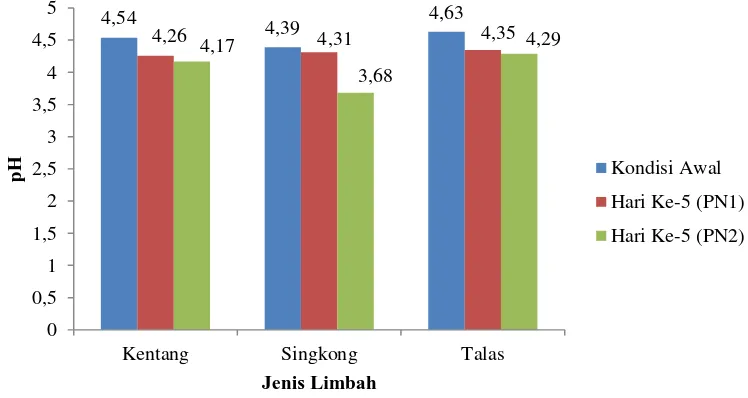
Gambar 9. Penurunan pH pada medium fermentasi
Proses fermentasi dipengaruhi oleh kondisi pH medium fermentasi karena nilai pH mempengaruhi pertumbuhan khamir. Menurut Kurtzman et al., (2011) rentang pH yang sesuai untuk pertumbuhan khamir adalah 4,5-5,0. Selama proses
4,54 4,39 4,63
4,26 4,17 4,31 4,35
3,68
4,29
0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5
Kentang Singkong Talas
pH
Jenis Limbah
Kondisi Awal
Hari Ke-5 (PN1)
dapat dilihat pada (Gambar 9). Berdasarkan data dapat diketahui bahwa keseluruhan medium fermentasi yang mengandung limbah dengan penambahan isolat PN1 maupun PN2 mengalami penurunan pH hingga hari ke-5 fermentasi. Nilai pH paling rendah yaitu pada medium limbah singkong dengan penambahan isolat PN2 yaitu sebesar 3,68.
Penurunan pH yang terjadi selama proses fermentasi disebabkan karena selama proses fermentasi selain terbentuk senyawa alkohol juga terbentuk senyawa asam organik. Terbentuknya senyawa asam dapat disebabkan oleh adanya oksigen, sehingga metabolisme mikroba berlangsung secara aerob. Suasana aerob sebenarnya tidak diharapkan dalam proses pembentukan bioetanol karena substrat berupa glukosa yang seharusnya dikonversi menjadi bioetanol akan dikonversi lebih lanjut menjadi senyawa asam terutama asam-asam organik (Arnata dan Anggreni, 2013).
Kestabilan pH intraseluler sangat penting bagi pertumbuhan khamir, karena terdapat banyak enzim fungsional selama proses pertumbuhan dan metabolisme sel khamir. Enzim-enzim tersebut dapat bekerja maksimal jika berada pada kisaran pH yang optimal. Sel khamir akan memerlukan banyak energi pada saat terjadi penyimpangan pH dari kisaran yang optimal. Energi tersebut digunakan untuk memompa ion hidrogen baik ke dalam maupun keluar sel agar kondisi pH intraseluler tetap dalam kondisi yang stabil. Sel khamir akan mengalami kesulitan dalam menjaga kestabilan pH medium, jika penyimpangan pH yang terjadi terlalu besar dari kisaran optimal sehingga enzim tidak dapat berfungsi secara normal. Enzim yang mengalami deaktivasi, karena tidak dapat berfungsi secara normal akan menyebabkan sel khamir tidak mampu membentuk etanol dengan efisien karena terganggunya proses metabolisme sel (Narendranath and Power, 2005).
Pertumbuhan sel khamir selama proses fermentasi dihitung pada hari ke-1 hingga hari ke-5. Berdasarkan hasil pengamatan pertumbuhan khamir rata-rata meningkat hingga hari ke-3 tetapi menurun pada hari ke-4 dan hari ke-5. Hasil pengukuran pertumbuhan sel khamir pada medium fermentasi dapat dilihat pada (Gambar 10).
Jumlah paling tinggi populasi sel awal isolat khamir yaitu PN1 pada medium fermentasi mengandung limbah singkong sebanyak 7,551 Log CFU/ml, meningkat pada hari ke-3 yaitu sebanyak 7,614 Log CFU/ml dan menurun pada hari ke-5 yaitu sebanyak 7,582 Log CFU/ml. Jumlah populasi awal terendah yaitu PN2 pada medium fermentasi mengandung limbah singkong sebanyak 7,049 Log CFU/ml, meningkat pada hari ke-3 yaitu sebanyak 7,170 Log CFU/ml dan menurun pada hari ke-5 yaitu sebanyak 7,123 Log CFU/ml. (Data selengkapnya dapat dilihat pada (Lampiran 6 Halaman 44).
Gambar 10. Pertumbuhan PN1 dan PN2 selama fermentasi pada substrat mengandung limbah kupasan kentang, singkong dan talas
Fermentasi hari ke-1 hingga hari ke-3 menunjukkan adanya peningkatan jumlah sel khamir yang menandakan saat itu khamir dalam kondisi aktif
6,7 6,8 6,9 7 7,1 7,2 7,3 7,4 7,5 7,6 7,7 J um la h Sel (L o g CF U/m l)
Jenis Isolat dan Limbah
Hari Ke-1
Hari Ke-2
Hari Ke-3
Hari Ke-4
fermentasi rata-rata menunjukkan pola pertumbuhan yang sama. Pertumbuhan khamir mulai menurun pada masa inkubasi hari ke-4 dan ke-5. Terjadinya penurunan jumlah sel menunjukkan bahwa sel khamir banyak yang mengalami kematian karena pada masa inkubasi tersebut, ketersediaan nutrisi dalam medium sudah mulai habis dan kondisi medium yang sudah mulai toksik akibat akumulasi hasil metabolit sel khamir seperti etanol.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Isolasi khamir dari nira, tuak dan laru asal Pulau Nias diperoleh 7 isolat khamir. Dua isolat khamir dengan toleransi paling tinggi terhadap etanol yaitu PN1 dan PN2 digunakan untuk memfermentasi limbah kupasan kentang, limbah singkong dan talas menghasilkan bioetanol. Bioetanol paling banyak secara berturut-turut dihasilkan oleh isolat PN1 dan PN2 pada medium fermentasi mengandung limbah kupasan talas dengan kadar bioetanol 0,64% dan 0,60%. Efisiensi fermentasi isolat PN1 dan PN2 pada medium fermentasi tersebut tergolong tinggi yaitu 83,74% dan 81,03%.
5.2 Saran
BAB 2
TINJAUAN PUSTAKA
2.1 Khamir (yeast)
Khamir merupakan jamur mikroskopis, eukariotik dan uniseluler. Ukuran sel khamir pada umumnya lebih besar dibandingkan dengan sel bakteri. Khamir memiliki dua mekanisme reproduksi yaitu reproduksi seksual dan aseksual. Semua khamir dapat berkembang biak secara aseksual, tetapi tidak semua khamir dapat melakukan reproduksi seksual. Khamir yang hanya dapat bereproduksi secara aseksual masuk dalam kelas Deuteromycetes atau jamur imperfecti (Volk et al., 1971).
Khamir melakukan reproduksi aseksual dengan cara bertunas (budding), pembelahan langsung atau dengan hifa. Sebagian besar khamir melakukan reproduksi seksual dengan membentuk asci, yang mengandung askospora haploid dengan jumlah bervariasi antara satu hingga delapan askospora. Askospora dapat menyatu dengan nukleus dan membelah seiring dengan pembelahan vegetatif, tetapi beberapa khamir memiliki askospora yang menyatu dengan askospora lain (Schneiter, 2004).
Khamir dapat ditemukan pada berbagai tempat di lingkungan terutama substrat yang kaya gula. Khamir telah berhasil diisolasi dari daun, bunga, buah-buahan, biji-bijian, serangga, kotoran hewan dan tanah (Spencer and Spencer, 1997). Khamir dari kelompok Saccharomycetales terdapat pada kulit kayu pohon tertentu dan juga pada buah-buahan serta lingkungan dengan kadar gula yang tinggi seperti nektar dan nira (Sampaio et al., 2008).
Saccharomyces cerevisiae merupakan salah satu jenis khamir yang telah dikenal secara luas dan banyak dimanfaatkan terutama dalam proses fermentasi. Organisme ini sudah sejak lama digunakan memfermentasikan gula dari beras, gandum, gerst dan jagung untuk memproduksi minuman beralkohol dan juga digunakan oleh industri makanan sebagai pengembang adonan roti. Proses fermentasi yang dilakukan khamir menghasilkan gas karbondioksida dan etanol. Karbondioksida terperangkap di dalam gelembung-gelembung kecil sehingga roti dapat mengembang. Khamir sering diolah menjadi suplemen vitamin karena khamir mengandung 50% protein serta merupakan sumber vitamin B, niacin dan asam folat yang sangat baik (Schneiter, 2004).
Saccharomyces cerevisiae merupakan khamir yang sangat penting dalam bioindustri. Toleransinya terhadap etanol merupakan karakter yang menentukan sehingga mikroorganisme ini dapat digunakan sebagai sumber biofermentasi. Toleransi yang tinggi terhadap etanol disebabkan komposisi lipid yang unik dari membran plasmanya yang menyintesis lebih banyak ergosterol dibandingkan dengan kolesterol dan fosfolipid. Kolesterol dan fosfolipid mengandung residu asam lemak tidak jenuh dalam proporsi yang sangat tinggi (Ingram et al., 1984).
2.2 Nira
Nira adalah cairan manis yang diperoleh dari air batang atau getah tandan bunga tanaman seperti tebu, bit, sorgum, mapel, siwalan, bunga dahlia dan tanaman dari keluarga palma seperti aren, kelapa, nipah, sagu, kurma dan sebagainya. Produk-produk nira dapat digolongkan dalam dua kelompok, yaitu yang tidak mengalami proses fermentasi dan yang mengalami fermentasi (Barlina dan Lay, 1994). Nira yang masih segar dapat langsung diminum dan digunakan untuk obat sariawan, TBC, disentri, wasir dan untuk memperlancar buang air besar. Nira yang telah mengalami fermentasi (peragian) berubah menjadi tuak (Ismanto et al., 1995).
Nias karena tuak dapat digunakan sebagai sarana keakraban, sebagai pengungkapan rasa terima kasih dan juga minuman persahabatan (Laoli et al., 1995).
2.1.1 Nira Kelapa
Nira merupakan cairan bening, terdapat dalam tandan bunga kelapa yang belum terbuka (Dyanti, 2002). Rasa manis pada nira kelapa disebabkan kandungan sukrosanya yang cukup tinggi. Xia et al (2011) mendapatkan kandungan sukrosa sebesar 14% pada nira kelapa segar yang baru disadap, sedangkan Barh dan Mazumdar (2008) mendapatkan kandungan gula 9,3 gr/100 ml nira kelapa segar. Komposisi kimia nira kelapa disajikan pada tabel berikut :
Komposisi Kimia Nira Kelapa
No Komposisi Kimia Kandungan
1 Total Gula (g) 9,30
2 Total Protein (mg) 13,30
3 Total lipids (g) 0,03
4 Calcum (mg) 1,62
5 Magnesium (mg) 2,15
6 Iron (mg) 1,20
7 Sodium (mg) 6,95
8 Potassium (mg) 3,16
9 Cu (mg) 0,03
10 Zinc (mg) 0,03
11 P (mg) 1,55
12 Niacin (mg) 0,02
13 Thiamine (mg) 0,02
14 Riboflavin (mg) 0,03
15 Ascorbic acid (mg) 2,93
16 Vitamin A (IU) 43,0
17 Ethanol (%) (v/v) 0,0
18 pH (keasaman) 7,4
Sumber: Barh dan Mazumdar, 2008
2.2.2 Nira Aren
Ragi dan bakteri merupakan mikroorganisme utama yang mengubah komposisi karbohidrat dalam nira. Kecepatan perubahan oleh mikroorganisme ini sangat tergantung pada konsentrasi kontaminasi awal. Dengan keadaan di lapangan, yaitu penyadapan dengan kondisi terbuka di atas pohon, dapat dikatakan bahwa tingkat kontaminasi cukup tinggi tetapi masih bervariasi pula dari setiap perlakuan penyadapan (Pontoh, 2012).
Dalam keadaan segar nira berasa manis, berbau khas nira dan tidak berwarna. Nira aren mengandung beberapa zat gizi antara lain karbohidrat, protein, lemak dan mineral. Rasa manis pada nira disebabkan kandungan karbohidratnya mencapai 11,28%. Nira yang baru menetes dari tandan bunga mempunyai pH sekitar 7 (pH netral), akan tetapi pengaruh keadaan sekitarnya menyebabkan nira aren terkontaminasi dan mengalami fermentasi sehingga rasa manis pada nira aren cepat berubah menjadi asam (pH menurun) (Lempang, 2000).
2.3 Laru
Laru merupakan sebutan untuk kelompok jenis kulit kayu yang ditambahkan pada
nira dengan tujuan meningkatkan cita rasa dan kadar alkohol minuman tuak.
(Ikegami, 1997). Penelitian Erika (2005), menyebutkan bahwa kulit kayu dari tumbuhan meranti (Shorea faguetiana Heim) dapat digunakan sebagai laru.
Penelitian Pasaribu (2007), menemukan bahwa salah satu jenis laru yang berasal
dari Kabupaten Tapanuli Tengah diidentifikasi sebagai giam (Cotylelobium
melanoxylon Pierre). Lebih lanjut disebutkan bahwa jenis ini memiliki komponen
kimia kayu berturut-turut adalah sebagai berikut: hemiselulosa 29,26%,
alphaselulosa 37,35%, lignin 22,26% dan pentosan 17,31 %. Selanjutnya kadar
ekstraktif kayu laru yang larut dalam air dingin 3,19%, air panas 9,08%, alkohol
benzena 1,76%, NaOH (1%) 19,27%. Masyarakat Tapanuli Tengah juga menggunakan resak (Vatica pauciflora Blume) sebagai laru untuk campuran dalam minuman tuak (Ikegami, 1997).
biasa menggunakan kulit kayu pohon durian, kulit kayu pohon langsat, kulit kayu pohon golikhe dan berbagai macam kulit kayu tumbuhan lain sebagai laru. Menurut masyarakat setempat, kulit kayu dikeringkan di bawah sinar matahari kemudian disimpan di tempat yang kering. Sebelum digunakan laru diremukkan dan dibakar ujungnya untuk memberikan aroma yang khas pada tuak.
2.4 Fermentasi
Fermentasi merupakan proses pemecahan karbohidrat dibawah kondisi anaerobik menghasilkan bentuk yang stabil dari produk-produk fermentasi yaitu senyawa organik yang menjadi penerima elektron terakhir dalam proses ini (Volk et al., 1971). Ketika glukosa difermentasi menjadi etanol akan terjadi reaksi :
Glukosa (C6H12O6) 2 Etanol (C2H5OH) + 2CO2
Proses ini dilakukan oleh khamir dan merupakan proses penting dan bernilai ekonomi tinggi karena berhubungan dengan produksi alkohol yang merupakan unsur penting pembuatan bir, wine, whiskey dan lain sebagainya. Fermentasi yang sama terjadi pada pembuatan roti, tetapi unsur pokok yang penting adalah CO2 yang dihasilkan sehingga roti dapat mengembang. Ketika khamir memfermentasi glukosa dalam kondisi aerobik, produk akhirnya adalah karbondioksida dan air
Glukosa (C6H12O6) + 6O2 6CO2 + 6 H2O
karena pada reaksi ini keseluruhan karbon dari glukosa diubah menjadi CO2, lebih banyak energi yang dilepas (Brock and Brock, 1978).
Ada beberapa karakteristik mikroorganisme yang digunakan untuk fermentasi antara lain mempunyai kemampuan tumbuh dan berkembang biak dengan cepat dalam substrat yang sesuai, dapat menghasilkan enzim dengan cepat untuk mengubah glukosa menjadi alkohol, mempunyai daya fermentasi yang tinggi terhadap glukosa, fruktosa, galaktosa dan maltosa, mempunyai daya tahan dalam lingkungan dengan kadar alkohol yang relatif tinggi, serta tahan terhadap mikroorganisme lain(Minier dan Goma, 1982).
2.5 Bioetanol
Bioetanol merupakan cairan hasil proses fermentasi gula dari sumber karbohidrat (pati) menggunakan bantuan mikroorganisme. Bioetanol adalah cairan tak berwarna dengan karakteristik antara lain mudah menguap, mudah terbakar, larut dalam air, tidak karsinogenik dan jika terjadi pencemaran tidak memberikan dampak lingkungan yang signifikan. (Seftian et al., 2012). Bioetanol adalah salah satu bahan bakar alternatif yang dapat diperbaharui, ramah lingkungan, dan menghasilkan gas emisi karbon yang rendah dibandingkan dengan bensin atau sejenisnya. Beberapa negara maju telah lebih dahulu mengembangkan bioetanol sebagai biofuel, Indonesia tidak mau tertinggal untuk turut serta mengembangkan etanol sebagai bahan bakar alternatif (Khairani, 2007).
Pada saat ini, pengembangan produksi bioetanol di Indonesia sedang berkembang pesat. Penggunaan bioenergi secara luas dikenal ramah lingkungan dan dapat meningkatkan performa dari kendaraan. Produksi bioetanol juga dapat secara langsung bermanfaat pada sektor pertanian karena produksi bioetanol dapat memanfaatkan beberapa produk pertanian seperti singkong, jagung, kentang, sagu, dan talas (Sondari et al., 2006).
menimbulkan permasalahan baru jika dikonversi terus menerus menjadi bioetanol karena bahan-bahan tersebut berpotensi juga sebagai bahan pangan (Lin et al., 2006).
2.6 Pemanfaatan Limbah Untuk Produksi Bioetanol
Limbah pertanian yang keberadaannnya sangat berlimpah di Indonesia dapat menjadi bahan baku pembuatan bioetanol. Pengembangan limbah pertanian untuk produksi bioetanol tidak akan mengganggu ketahanan pangan nasional. Selain itu,
hal ini dapat mengurangi dampak negatif pencemaran lingkungan. Bioetanol dapat dibuat dari bahan-bahan bergula, berpati (karbohidrat), ataupun berserat, seperti limbah kulit singkong, limbah kulit kentang dan limbah kulit talas (Irfan, 2013).
Umbi singkong (Manihot utilissima) sebanyak 10 miliar ton, dapat menghasilkan limbah 0,3 miliar ton tetapi pemanfaatannya hanya mencapai 0,1 milliar ton (Sriroth, 2008). Setiap singkong yang dikupas dapat menghasilkan 15-20% kulit umbi dengan kandungan karbohidrat berkisar antara 68-85% dari berat keseluruhan kulit umbi singkong, sehingga memiliki potensi yang cukup besar untuk digunakan sebagai bahan baku produksi bioetanol (Cuzin et al., 1991).
Limbah kulit kentang (Solanum tuberosum) adalah salah satu contoh limbah organik yang dapat digunakan sebagai bahan dasar pembuatan bioetanol. Selama ini kupasan kentang umumnya digunakan sebagai makanan ternak, pupuk organik, dan terkadang hanya dibuang begitu saja menjadi sampah. Kandungan kimia yang terdapat dalam kupasan kentang belum diketahui secara spesifik, namun dari penelitian yang telah dilakukan oleh Tima, (2011) kandungan karbohidrat yang terdapat dalam kupasan kentang cukup tinggi.
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Etanol yang berasal dari biomassa dan dapat digunakan sebagai pengganti bahan bakar fosil disebut bioetanol (Lin dan Tanaka, 2006). Bioetanol merupakan cairan hasil proses fermentasi gula menggunakan bantuan mikroorganisme. Karakteristik bioetanol antara lain mudah menguap, mudah terbakar, larut dalam air, tidak karsinogenik dan jika terjadi pencemaran tidak memberikan dampak lingkungan yang signifikan. Bioetanol diproduksi dengan cara fermentasi menggunakan bahan baku hayati (Seftian et al., 2012). Produksi bioetanol secara langsung memberi dampak pada sektor pertanian karena produk limbah pertanian seperti limbah singkong, kentang, sagu, talas dan jagung dapat dimanfaatkan sebagai bahan baku pembuatan bioetanol (Sondari et al., 2006).
Limbah pertanian yang keberadaannnya sangat berlimpah di Indonesia dapat menjadi bahan baku pembuatan bioetanol. Pemanfaatan limbah pertanian untuk produksi bioetanol tidak akan mengganggu ketahanan pangan nasional dan
dapat mengurangi dampak negatif pencemaran lingkungan oleh limbah itu sendiri.
Limbah kulit singkong, kentang dan talas dapat dimanfaatkan sebagai bahan baku pembuatan bioetanol karena masih mengandung karbohidrat dalam bentuk pati (Irfan, 2013).
menunjukkan bahwa ketiga jenis limbah tersebut memiliki potensi yang cukup besar untuk digunakan sebagai bahan baku pembuatan bioetanol.
Bioetanol dihasilkan melalui proses fermentasi yang melibatkan mikroorganisme golongan khamir. Khamir dapat ditemukan pada substrat yang kaya gula seperti nira. Suku Nias memanfaatkan nira menjadi minuman fermentasi tradisional mengandung alkohol yang disebut tuak (tuo mbanua). Menurut Rahmansyah (1999), khamir yang terdapat pada nira dan tuak memiliki potensi untuk dimanfaatkan dalam menghasilkan bioetanol. Penelitian terbaru yang dilakukan oleh Hermansyah et al., (2015), telah mengisolasi Candida tropicalis asal tuak Sumatera Utara yang diproduksi oleh suku Batak dan berpotensi menghasilkan bioetanol. Kulit kayu beberapa jenis tumbuhan digunakan oleh suku Nias sebagai laru dalam pembuatan tuak. Penambahan laru bertujuan untuk meningkatkan cita rasa dan kadar alkohol minuman tuak. Naiola (2008) telah mengisolasi Pichia anomala dari kulit kayu tanaman Alstonia acuminata Miq yang digunakan masyarakat Nusa Tenggara Timur sebagai laru, tetapi kemampuannya dalam menghasilkan bioetanol belum diteliti.
1.2 Permasalahan
Limbah pertanian yaitu kupasan kulit singkong, kentang dan talas memiliki kandungan pati yang masih bisa dimanfaatkan untuk memproduksi bioetanol. Khamir asal minuman fermentasi tradisional diharapkan dapat menjadi bibit mikroorganisme lokal yang unggul dalam memproduksi bioetanol. Saat ini isolasi khamir dari nira, tuak dan laru asal Pulau Nias belum dilakukan. Oleh karena itu perlu dilakukan isolasi dan uji kemampuan khamir dari nira, tuak dan laru asal Pulau Nias dalam menghasilkan bioetanol dengan menggunakan limbah pertanian sebagai bahan baku.
1.3 Tujuan Penelitian
a. Untuk mengisolasi khamir (yeast) dari nira, tuak dan laru asal Pulau Nias b. Untuk mengetahui potensi isolat khamir dalam memfermentasi beberapa
1.4 Manfaat Penelitian
ABSTRAK
Bioetanol merupakan hasil proses fermentasi gula menggunakan khamir. Banyak strain dari khamir telah diisolasi untuk mengetahui kemampuannya memproduksi bioetanol. Penelitian ini dilakukan untuk mengisolasi khamir potensial dari nira, tuak dan laru asal Pulau Nias dalam memproduksi bioetanol dari beberapa jenis limbah yaitu limbah kupasan kentang, limbah kupasan singkong dan limbah kupasan talas. Sebanyak 7 isolat khamir telah diisolasi untuk mengetahui tingkat toleransinya terhadap etanol di lingkungan. Dua isolat PN1 dan PN2 menunjukkan tingkat toleransi terhadap etanol paling tinggi pada konsentrasi etanol 15%. Dua isolat khamir ini digunakan untuk memproduksi bioetanol pada medium fermentasi mengandung 3% tepung limbah selama 5 hari inkubasi. Hasil menunjukkan bahwa isolat khamir PN1 dan PN2 pada medium fermentasi mengandung limbah talas secara berturut-turut menghasilkan bioetanol sebesar 0.64 dan 0.60%, dengan efisiensi fermentasi 83.74 dan 81.03%.
ABSTRACT
Bioethanol is a product of sugar fermentation by yeast. Many strains of yeast have been isolated for their abilities to produce bioethanol. This study was conducted to isolate and to evaluate yeast potential from nira, tuak and laru from Nias Island in
producing bioethanol from crop’s wastes such as potato, cassava and taro peel
wastes. A total of 7 yeasts were isolated and tested for their ethanol tolerance. Two isolates, PN1 and PN2, showed the most tolerant to medium containing 15% ethanol. Both of these yeast isolates were used to produce bioethanol using fermentation medium containing 3% of waste powder for 5 days of incubation. The result showed that PN1 and PN2 in taro peel waste medium produced 0.64 and 0.60% of bioethanol, while their fermentation efficiency were 83.74 and 81.03%, respectively.
SKRIPSI
OLEH
ESTER RAISA KRISTIANI LASE 120805073
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
OLEH
ESTER RAISA KRISTIANI LASE 120805073
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
Judul : Isolasi Khamir dari Nira, Tuak dan Laru Asal Pulau Nias dan Uji Kemampuannya dalam Memproduksi Bioetanol dari Limbah
Kategori : Skripsi
Nama : Ester Raisa Kristiani Lase Nomor Induk Mahasiswa : 120805073
Program Studi : Sarjana (S1) Biologi
Departemen : Biologi
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di Medan, Januari 2017
Komisi Pembimbing :
Pembimbing 2, Pembimbing 1,
Dra. Nunuk Priyani, M.Sc. Prof. Dr. Dwi Suryanto, M.Sc. NIP. 196404281996032001 NIP. 196404091994031003
Disetujui Oleh
Departemen Biologi FMIPA USU Ketua,
ISOLASI KHAMIR DARI NIRA, TUAK DAN LARU ASAL PULAU NIAS DAN UJI KEMAMPUANNYA DALAM MEMPRODUKSI BIOETANOL
DARI LIMBAH
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Januari 2017
Puji syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa atas kasih dan anugerahNya sehingga penulis dapat menyeelesaikan skripsi yang berjudul “Isolasi Khamir dari Nira, Tuak dan Laru Asal Pulau Nias dan Uji
Kemampuannya dalam memproduksi Bioetanol dari Limbah”. Skripsi ini
dibuat sebagai salah satu syarat untuk meraih gelar Sarjana Sains pada Fakultas MIPA USU Medan.
Terimakasih penulis sampaikan kepada Bapak Prof. Dr. Dwi Suryanto, M.Sc. selaku dosen pembimbing 1 dan Ibu Dra. Nunuk Priyani, M.Sc. selaku dosen pembimbing 2 yang telah memberi bimbingan dan banyak masukan selama pelaksanaan penelitian dan penyusunan skripsi ini. Ucapan terimakasih juga penulis ucapkan kepada Ibu Dr. It. Jamilah, M.Sc. dan Ibu Masitta Tanjung, S.Si,M.Si. selaku dosen penguji yang telah memberi banyak masukan dan arahan dalam penyempurnaan penulisan skripsi ini. Ucapan terimakasih juga penulis sampaikan kepada Ibu Dr. Nursahara Pasaribu, M.Sc. selaku Ketua Departemen Biologi FMIPA USU, Ibu Dr. Saleha Hanum, M.Si. selaku Sekretaris Departemen Biologi FMIPA USU, Ibu Nurhasni Muluk, Bang Erwin dan Ibu Rosalina Ginting selaku staff pegawai Departemen Biologi FMIPA USU.
Ucapan terimakasih terbesar, penulis sampaikan kepada Ibunda tercinta, Else Eflin Lase, SKM yang selalu memberikan doa, dukungan, semangat, kesabaran, perhatian, pengorbanan dan kasih sayang yang begitu besar kepada penulis, dan juga kepada Almarhum Ayahanda Sozatulo Lase yang telah mengajarkan penulis sifat yang tak pernah putus asa, bertanggung jawab, mengingatkan untuk selalu bersyukur dan mengandalkan Tuhan Yesus dalam setiap rencana. Skripsi ini penulis hadiahkan kepada ayahanda, penulis berjanji selalu menjadi yang terbaik dan membanggakan. Terimakasih kepada keluarga besar penulis Almarhum Kakek tercinta serta Oma tersayang yang tidak pernah
lupa untuk mendoakan penulis, Almarhum Tante Sa’a serta Tante Talu, yang
dengan tulus menjaga, menemani dan menyayangi penulis pada masa awal perkuliahan, Papi dan Mami, Bang Arif, Kak Elsa, Kak Lely, Kak Siska, Adikku Janice dan Dwiki, yang telah memberi doa dan dukungannya.
yang sulit untuk dilupakan. Penulis juga mengucapkan banyak terimakasih kepada Bang Adrian Hartanto dan Bang Tonisman Harefa yang telah meluangkan waktu untuk berdiskusi dan membantu penulis dalam menyelesaikan penelitian ini. Ucapan terimakasih terkhusus kepada Bang Trisno Harefa yang tidak pernah bosan mendengarkan setiap keluh kesah dan mendoakan penulis.
Akhirnya dengan penuh ketulusan dan kerendahan hati, penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu penulis mengharapkan kritik dan saran yang bersifat membangun dari semua pihak demi kesempurnaan skripsi ini. Semoga Tuhan Yang Maha Esa membalas semua kebaikan dan ketulusan kita. Amin.
Medan, Januari 2017
ABSTRAK
Bioetanol merupakan hasil proses fermentasi gula menggunakan khamir. Banyak strain dari khamir telah diisolasi untuk mengetahui kemampuannya memproduksi bioetanol. Penelitian ini dilakukan untuk mengisolasi khamir potensial dari nira, tuak dan laru asal Pulau Nias dalam memproduksi bioetanol dari beberapa jenis limbah yaitu limbah kupasan kentang, limbah kupasan singkong dan limbah kupasan talas. Sebanyak 7 isolat khamir telah diisolasi untuk mengetahui tingkat toleransinya terhadap etanol di lingkungan. Dua isolat PN1 dan PN2 menunjukkan tingkat toleransi terhadap etanol paling tinggi pada konsentrasi etanol 15%. Dua isolat khamir ini digunakan untuk memproduksi bioetanol pada medium fermentasi mengandung 3% tepung limbah selama 5 hari inkubasi. Hasil menunjukkan bahwa isolat khamir PN1 dan PN2 pada medium fermentasi mengandung limbah talas secara berturut-turut menghasilkan bioetanol sebesar 0.64 dan 0.60%, dengan efisiensi fermentasi 83.74 dan 81.03%.
ABSTRACT
Bioethanol is a product of sugar fermentation by yeast. Many strains of yeast have been isolated for their abilities to produce bioethanol. This study was conducted to isolate and to evaluate yeast potential from nira, tuak and laru from Nias Island in producing bioethanol from crop’s wastes such as potato, cassava and taro peel wastes. A total of 7 yeasts were isolated and tested for their ethanol tolerance. Two isolates, PN1 and PN2, showed the most tolerant to medium containing 15% ethanol. Both of these yeast isolates were used to produce bioethanol using fermentation medium containing 3% of waste powder for 5 days of incubation. The result showed that PN1 and PN2 in