ABSTRACT
PRELIMINARY STUDY ON PREPARATION AND
CHARACTERIZATION OF NixCuyFe(1-x-y)O 3±ᵹ NANOCATALYSTS AND ACTIVITY TEST FOR CONVERSION OF CO2 AND H2 INTO
ALCOHOL
By
Septhian Try Sulistiyo
Climate change as a result of global warming is happening lately increasingly alarming and unavoidable. This is caused by increasing concentrations of greenhouse gases (GHG) in the earth's upper atmosphere. One of the efforts to tackle greenhouse gases is through conversion, especially conversion of CO2 gas which is the main component of the largest in greenhouse gases. One method of converting CO2 gas that has been developed is the catalytic hydrogenation to produce alcohol. The conversion method is done with the help of a catalyst. In this research, preparation nanokatalis NiyFe(1-x-y)CuxO3±ᵹ (dimana x = 0,1 - 0,4) by
sol-gel method, and its catalytic activity test against conversion reaction (CO2 +
H2) to alcohol at a temperature 100o C – 400o C. Acid content analysis using
gravimetric method indicated that Ni0.2Cu0.4Fe0.4O4 nanocatalyst has the highest
acidity of 30,75 mmole pyridine/g.catatlyst. FTIR analysis demosntrated that Lewis acid sites is more dominant than BrØnsted – Lowry acid sites in the three nanocatalysts investigated. Surface marphology analysis showed that NiyCuxFe (1-x-y)O4 nanocatalysts are not completely homogeneous, with particle sizes ranging
between ±85. Conversion experiments indicated that all three catalysts prepared are active to convert CO2 with hydrogen into ethanol and selective in the
temperature range investigated, with the highest ethanol produced is 90 ppm.
ABSTRAK
STUDI PENDAHULUAN PEMBUATAN DAN KARAKTERISASI NANOKATALIS NiyFe(1-x-y)CuxO3±ᵹ SERTA UJI AKTIVITAS PADA
KONVERSI (CO2+ H2) Oleh
Septhian Try Sulistiyo
Perubahan iklim sebagai akibat pemanasan global yang terjadi akhir-akhir ini semakin mengkhawatirkan dan tidak dapat dihindari. Ini disebabkan oleh meningkatnya konsentrasi gas rumah kaca (GRK) yang ada di lapisan atmosfer bumi. Salah satu upaya untuk menanggulangi gas rumah kaca adalah melalui konversi, khususnya konversi gas CO2 yang merupakan komponen utama terbesar
dalam gas rumah kaca. Salah satu metode konversi gas CO2 yang telah banyak
dikembangkan adalah hidrogenasi katalitik untuk menghasilkan alkohol. Metode konversi ini dilakukan dengan bantuan katalis. Dalam penelitian ini dilakukan preparasi nanokatalis NiyFe(1-x-y)CuxO3±ᵹ (dimana x = 0,1 - 0,4) dengan metode
sol-gel, serta uji aktifitas katalitiknya terhadap reaksi konversi (CO2 + H2)
menjadi alkohol pada suhu 100o C – 400o C. Hasil analisis keasaman menggunakan metode Gravimetri menunjukan katalis Ni0.2Cu0.4Fe0.4O4 memiliki
nilai keasaman tertinggi yaitu 30,75 mmol piridin/g katalis, jika dibandingkan dengan katalis Ni0.2Cu0.1Fe0.7O4, Ni0.2Cu0.2Fe0.6O4 dan Ni0.2Cu0.3Fe0.5O4. Hasil
analisis keasaman katalis NiyCoxFe(1-x-y)O4 menggunakan Spektrofotometri Infra
Merah (FTIR) menunjukan situs asam Lewis lebih dominan dibandingkan dengan situs Bronsted-Lowry. Hasil analisis morfologi permukaan katalis NiyCuxFe (1-x-y)O4 yang dipreparasi dapat dikatakan belum homogen. Ukuran partikel yang telah
mencapai nano dengan ukuran partikel ± 85nm. Hasil uji aktivitas katalis NiyCuxFe(1-x-y)O4±δ terhadap konversi CO2/H2 menunjukkan bahwa katalis
NiyCuxFe(1-x-y)O4±δ aktif dan selektif terhadap pembentukan etanol. Analisis
menggunakan Kromatografi Gas menunjukkan bahwa katalis Ni0.2Cu0.1Fe0.7O4
STUDI PENDAHULUAN PEMBUATAN DAN KARAKTERISASI
NANOKATALIS Ni
yCu
xFe
(1-x-y)O4±δ SERTA UJI AKTIVITAS PADA
KONVERSI (CO
2+H
2)
Oleh
Septhian Try Sulistiyo
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
STUDI PENDAHULUAN PEMBUATAN DAN KARAKTERISASI NANOKATALIS NiyFe(1-x-y)CuxO3±ᵹ SERTA UJI AKTIVITAS PADA
KONVERSI (CO2+ H2)
(Skripsi)
SEPTHIAN TRY SULISTIYO
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
v
DAFTAR GAMBAR
Gambar Halaman
1. Model koordinasi antara CO2dengan logam ………. 7
2. Siklus reaksi katalisis ………. 10
3. Struktur kristal spinel ferite……… 12
4. Mekanisme karbida ……… 15
5. Mekanisme enol ………. 15
6. Mekanisme penyisipan CO ……… 16
7. Proses pembentukan puncak pada XRD ……… 18
8. Difraktogram nanokristal NiFe2O4………. 19
9. Difraktogram standar NiFe2O4……… 20
10. Skema Instrumentasi FTIR ………. 21
11. Contoh spectra FTIR dalam penentuan jenis situs asam ………… 22
12. Skema Kerja SEM ……… 24
13. Mikrograf SEM NiFe2O4……….. 25
14. Susunan komponen-komponen instrumentasi kromatografi gas .. 26
15. Skema reaktor katalitik ………. 31
16. Serbuk prekursor NiyCuxFe(1-x-y)O4... 34
17. Padatan bubuk NiyCuxFe(1-x-y)O4 setelah proses kalsinasi... 35
18. Difraktogram nanokatalis NiyCuxFe(1-x-y)O4... 37
vi
20. Spektra IR nanokatalis NiyCuxFe(1-x-y)O4 ... 40
21. Mikrograf SEM katalis FNCu 01... 45
22. Mikrograf SEM katalis FNCu 02... 46
23. Mikrograf SEM katalis FNCu 03... 47
24. Mikrograf SEM katalis FNCu 04... 48
25. Kromatogram hasil uji aktivitas katalis FNCo 01... 50
26. Kromatogram hasil uji aktivitas katalis FNCo 02... 51
27. Kromatogram hasil uji aktivitas katalis FNCo 03... 52
28. Kromatogram hasil uji aktivitas katalis FNCo 03... 53
iii
Analisis Produk Dengan Kromatografi Gas……….. 32
iv
DAFTAR TABEL
Tabel Halaman
1. Sifat-sifat fisika dan kimia CO2……… 6
2. Puncak-puncak representatif difraktogram acuan... 36
3.Puncak-puncak representatif dari difraktogram nanokatalis... 37
4. Keasaman katalis... 38
Judul : Studi Pendahuluan Pembuatan dan Karakterisasi Nanokatalis NiyFe(1-x-y)CuxO4 serta Uji Aktivitas pada Konversi (CO2 + H2)
Nama : Septhian Try Sulistiyo
NPM : 0717011067
Jurusan : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI
1. Komisi Pembimbing
Dr. Rudy T. M. Situmeang, M.Sc Wasinton Simanjuntak, Ph.D NIP. 19600616.1988111001 NIP. 19590706.1988111001
2. Ketua Jurusan Kimia
MENGESAHKAN
1. Tim Penguji
Ketua : Dr. Rudy T. M. Situmeang, M.Sc. ...
Sekretaris : Wasinton Simanjuntak, Ph.D. ...
Penguji
Bukan pembimbing : Prof. Sutopo Hadi, Ph.D ...
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Prof. Suharso, Ph.D.
NIP. 19690530 199512 1001
Memanjakan diri untuk mendewasakan pikiran
Harus santai saat berpikir dan serius dalam berpenampilan
(Merphin)
Seseorang yang optimis akan melihat adanya kesempatan
dalam setiap malapetaka, sedangkan orang pesimis melihat
malapetaka dalam setiap kesempatan (Muhammad SAW).
Tuhan itu maha penyayang, itu sebabnya yang baik bagi
kita akan diharuskan-Nya.
Meskipun Tuhan memberikan kita kebebasan untuk
memilih, sesungguhnya Tuhan lebih berpihak kepada
pilihan baik kita (Mario Teguh).
Dengan menyebut nama Allah yang maha pengasih lagi
maha penyayang dan dengan segala rasa syukur kepada
Allah SWT, aku persembahkan karya ku ini untuk :
Bapak dan Ibu tersayang, yang senantiasa mendo’akan,
mendukung, memberi semangat, dan kegigihan serta
perjuangan dan pengorbanan Ibu dan Bapak untuk ku
sampai bisa seperti ini semoga kasih sayang dan
lindungan Allah SWT tak lepas dari kalian.
Kakak ku, Rudy Agustaria dan Lely Myutiara Susanti
serta seluruh keluarga besar ku yang tidak dapat ku
sebutkan satu persatu yang senantiasa mendoa’kan,
mendukung dan memberi semangat, tanpa kalian aku tak
akan pernah meraih semua ini.
Zeniaana, terima kasih untuk kesabaran dan pacuan
semangat serta doa yang selalu diberikan.
Seluruh Sahabat terbaiku
Almamater tercinta Universitas Lampung.
Guru-guru yang telah menjadi pembangkit semangatku.
RIWAYAT HIDUP
Penulis dilahirkan di Branti Raya pada tanggal 27 September
1989, anak ke tiga dari tiga bersaudara, yang merupakan buah
kasih dari pasangan Ayahanda Soebandi dan Ibunda
Sulistiyati.
Penulis menyelesaikan pendidikan Sekolah Dasar di SD Negeri 2 Branti Raya
pada tahun 2001, Sekolah Lanjutan Tingkat Perama (SLTP) Negeri 1 Natar pada
tahun 2004, dan Sekolah Menengah Kejuruan (SMK) Negeri 2 Bandar Lampung
pada tahun 2007. Penulis diterima sebagai mahasiswa Jurusan Kimia Fakultas
Matematika dan Ilmu Pengetahuan Alam Universitas Lampung pada tahun 2007
melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB).
Selama menjadi mahasiswa, penulis pernah aktif dalam organisasi kemahasiswaan
Himpunan Mahasiswa Kimia (HIMAKI) periode 2007 - 2008 sebagai anggota
Biro Usaha Mandiri (BUM) HIMAKI periode 2008 – 2009. Penulis pernah
menjadi asisten praktikum Kimia Dasar untuk mahasiswa Jurusan
Agroekoteknologi Fakultas Pertanian periode 2010 – 2011, asisten praktikum
Kimia Dasar untuk mahasiswa Jurusan Geofisika Fakultas Teknik periode 2010 –
Pertanian Fakultas Pertanian periode 2011– 2012, asisten praktikum Kimia Medik
untuk mahasiswa jurusan Pendidikan Kedokteran Fakultas Kedokteran dan
asisten Kimia Fisika untuk mahasiswa Jurusan FMIPA Kimia periode 2010 –
2011 dan periode 2011 – 2012.
Pada bulan Januari 2011 penulis menyelesaikan Praktik Kerja Lapangan di
SANWACANA
Alhamdulillahi robbil’alamin. Segala puji dan syukur hanya milik Allah SWT,
Dzat yang senantiasa menganugerahkan ilmu pengetahuan kepada manusia
dengan perantara kalam, sehingga atas kehendak dan izin-Nya penulis dapat
menyelesaikan skripsi dengan judul ʻ ʻ Studi Pendahuluan Pembuatan dan
Karakterisasi Nanokatalis NiyCuxFe(1-x-y)O4±δ Serta Uji Aktivitas Pada Konversi
(CO2+H2) ’’ dengan baik. Shalawat serta salam semoga selalu tercurah kepada
Nabi Muhammad SAW beserta keluarga, sahabat serta pengikutnya yang setia
hingga Yaumil Akhir. Amin.
Skripsi ini disusun sebagai salah satu syarat untuk mendapatkan gelar Sarjana
Sains pada Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam,
Universitas Lampung. Tidak sedikit kendala yang dihadapi penulis dalam
pelaksanaan serta dalam penulisan skripsi ini, tapi Alhamdulillah, Allah
menunjukkan kemurahan-Nya melalalui orang-orang yang dipercaya untuk
membantu penulis, sehingga kendala tersebut dapat ditaklukkan. Dalam
kesempatan ini, penulis menyampaikan banyak terima kasih kepada :
1. Bapak dan Ibu, yang memberikan pendidikan pertama di dunia ini, motivasi,
pengorbanan, serta do’a yang tiada henti-hentinya demi kelancaran penulis
dalam menuntut ilmu.
2. Bapak Dr. Rudy TM Situmeang, M.Sc., selaku pembimbing utama, guru,
rekan, sekaligus ayah bagi penulis yang dengan sabar memberikan bimbingan
3. Bapak Wasinton Simanjuntak, Ph.D., selaku pembimbing II penulis, atas
saran, masukan dan diskusi-diskusinya hingga selesainya skripsi ini.
4. Bapak Prof. Sutopo Hadi, Ph.D., selaku pembahas, atas semua kritik, saran
dan masukan kepada penulis dalam menyelesaikan skripsi ini.
5. Bapak Andi Setiawan, Ph.D., selaku Ketua Jurusan Kimia Fakultas
Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
6. Bapak Prof. Suharso, Ph.D., selaku Dekan Fakultas Matematika dan Ilmu
Pengetahua Alam Universitas Lampung.
7. Bapak Sonny Widiarto, S.Si. M.Sc., selaku pembimbing Akademik yang
telah memberikan motivasi dan arahan selama masa kuliah.
8. Segenap staf pengajar dan karyawan Jurusan Kimia Fakultas Matematika dan
Ilmu Pengetahuan Alam Universitas Lampung.
9. Keluarga besar penulis yang selalu memberikan saran, motivasi, dukungan,
keceriaan dan canda tawa yang tercipta selama ini.
10. My Special One Ana, atas motivasi dan pacuan semangat yang diberikan
kepada penulis.
11. Sahabat-sahabat terbaik ku, Heriyanto (Jaulax, Pep, Pepi), Mitra (mitro),
Afriorawan (Mou), Gunadi ,Wikan (Gembul) S.Si., M.Ishom, S.Si., Hady N,
S.Si., Aprian AB, Merphin (Tulang) dan Iwan.
12. Teman-teman Kimia angkatan 2007 : Kimia Fisik : Mitra Septanto, S.Si.,
Sunardi Sutrisna, S.Si., Gia Asmoro, S.Si., Sudarmono, Riri Napitupulu,
Kartika Sari, Sari Handayani, S.Si., Organik : Eka Epriynati, S.Si., Astri
Rahayu, Dewi Puspa NC, S.Si., Gunadi Senang, Heriyanto, Aprian AB,
Dewi FS, S.Si., Andi Yuli Fitriani, S.Si., Murdiyah, Dewi Asmarani, S.Si.,
Rivera Sialagan, S.Si., Yuni Rahmania, S.Si. Analitik : Hady Novadianto,
S.Si., Yohanes Wikan AN, S.Si., Nurtika Kurniati, S.Si., Clara Citra Resmie,
S.Si., Tristian Martika, S.Si., Dwi Puji Astuti, S.Si., Yanti Lianita, Refi
Indarosa. Biokimia : Putri Amalia, S.Si., Eka Sulis Sundari, S.Si., Feby Dwi
Indri, S.Si., Ratna Maulina Dewi, S.Si., Hade Sastra Wiyana, S.Si., Sartika
Putri F, S.Si., Winda Rahma Wati, Nova Budiani, Asih Yuni Astuti.
13. Catalyst Crew : Kak Sukmawibowo, S.Si., yang telah banyak memberi
masukan, saran, semangat, motivasi dan diskusi-diskusinya kepada penulis,
Mb. Nova F, S.Si yang belum sempat membantu kerja dalam penelitian
penulis, M.Subari lanjutin perjuangan, Kiki jangan putus asa penelitianany
memang lama jangan terburu-buru nanti hasilnya jelek dan Dani jangan malas
ke lab ajak adik-adiknya, harus banyak belajar sama kakak-kakanya jangan
malu bertanya.
14. Teman-teman Kimia angkatan 2006, 2008, 2009, 2010, dan 2011.
15. Teman-teman lab Biomassa Universitas Lampung.
16. Teman-teman Kantin Bude.
17. Teman-teman Kosan Aprian dan Angsa Putih.
18. Teman-teman di bengkel Malau.
19. Semua pihak yang telah membantu dan mendukung penulis dalam
penyusunan skripsi ini.
Penulis berharap semoga Allah SWT mencatat dan membalas semua kebaikan
yang diberikan kepada penulis. Amin. Akhir kata penulis menyadari bahwa
berharap semoga skripsi yang sangat ssederhana ini dapat bermanfaat dan
memiliki nilai guna khususnya bagi rekan-rekan mahasiswa dan pembaca pada
umumnya. Amin.
Bandar Lampung, Febuari 2013
I. PENDAHULUAN
A. Latar Belakang
Perubahan iklim global mendapat perhatian yang sangat besar dalam beberapa
dekade terakhir. Perubahan iklim sebagai akibat pemanasan global yang terjadi
akhir-akhir ini semakin mengkhawatirkan dan tidak dapat dihindari. Ini
disebabkan oleh meningkatnya konsentrasi gas rumah kaca (GRK) yang ada di
lapisan atmosfer bumi . Apabila dibiarkan akan semakin mengancam terhadap
keberadaan semua makhluk yang hidup di muka bumi ini, tanpa terkecuali
manusia. Pemanasan global tersebut disebabkan oleh gas polutan seperti CO2,
NO2, dan SO2 yang dibuang sebagai hasil pembakaran bahan bakar fosil dan
aktivitas lainya (Santoso dan Yudiartono,2006).
Karbon dioksida merupakan salah satu gas rumah kaca, memiliki pengaruh sangat
besar terhadap terjadinya pemanasan global. Sumber utama emisi CO2 adalah
penggunaan bahan bakar fosil untuk berbagai kegiatan manusia, terutama industri
yang menyumbangkan 74% dari total emisi gas CO2 (Sugiyono, 2006) dan setiap
tahunnya jumlah gas CO2 yang diemisikan ke atmosfer dapat mencapai 22 x 106
2
karena masih besarnya ketergantungan terhadap bahan bakar fosil sebagai
pemenuh kebutuhan energi (http://www.co2now.org).
Salah satu upaya untuk menanggulangi gas rumah kaca adalah melalui konversi,
khususnya konversi gas CO2 yang merupakan komponen utama terbesar dalam
gas rumah kaca (Indala, 2004). Dengan metode konversi, gas CO2 diubah
menjadi senyawa-senyawa kimia yang bermanfaat seperti olefin ringan atau
hidrokarbon cair (Jun et al., 2006), metanol dan senyawa alkohol lainnya (Cabrera
et al., 1998 ; Joo, 1999 ; Olah et al., 2009), dimetil eter (Olah et al., 2009), LPG,
etilen dan propilen (Fujiwara et al., 1995). Salah satu metode konversi gas CO2
yang telah banyak dikembangkan adalah hidrogenasi katalitik untuk menghasilkan
alkohol. Metode konversi ini dilakukan dengan bantuan katalis. Menurut Joo dan
Jung (2003), katalis yang digunakan dalam reaksi hidrogenasi katalitik CO2 harus
memiliki keaktifan dan kestabilan terhadap reaksi pergeseran terbalik air dan gas
(Reverse Water-Gas Shift, RWGS) dan reaksi Fischer-Tropsch. Karena CO2 akan
diubah menjadi CO melalui reaksi RWGS, dan selanjutnya diubah menjadi
produk yang diinginkan melalui reaksi sintesis Fischer-Tropsch (Joo, 1999).
Wokaun et al (1999) menunjukan bahwa katalis dengan rumus umum X/ZrO2
(dimana X = Cu, Ni, Ag, Rh, Pd, Pt, dan Au) dapat digunakan dalam hidrogenasi
katalitik untuk menghasilkan alkohol , meskipun hasil konversi sangat kecil dan
selektifitas berkisar 30 sampai 97%. Selain itu suhu dan tekanan reaksi yang
dibutuhkan cukup tinggi yaitu 490-570o C dan tekanan 100 bar. Udron (1997)
3
CO2/H2 menjadi metanol dan senyawa alkohol lainya pada suhu 250-350o C dan
tekanan 30-90 bar dengan selektifitas 60 sampai 70%. Hal ini menunjukan
aktivitas katalitik katalis berbasis Cu lebih beik karena terjadi pada suhu dan
tekanan lebih rendah.
Pada penelitian sebelumnya yang dilakukan oleh Situmeang et al (2010) konversi
CO2/H2 dengan katalis NiFe2O4 (dimana perbandingan mol Ni terhadap Fe 0,1 –
0,5) yang dipreparasi menggunakan metode sol-gel sitrat dengan ukuran partikel ≤
50μm, serta uji aktivitas katalitik dilakukan pada kondisi suhu 100 – 400oC dan
tekanan 1 atm, diperoleh senyawa alkohol metanol, etanol, propanol dan butanol.
Pada penelitian ini katalis Ni0,2Fe0,8O4 adalah katalis yang memiliki aktivitas
paling tinggi terhadap konversi CO2/H2 menjadi alkohol pada suhu 200oC dan
400oC dengan rendemen alkohol 793,62 ppm.
Selain pengembangan jenis katalis upaya lain yang potensial untuk meningkatkan
konversi CO2 + H2 adalah menggunakan nanokatalis. Nanokatalis memiliki
aktivitas yang lebih baik sebagai katalis karena material nanokatalis memiliki
area permukaan yang luas dan rasio-rasio atom yang tersebar secara merata pada
permukaanya. Sifat ini menguntungkan untuk transfer massa di dalam pori-pori
dan juga menyumbangkan antar muka yang besar untuk reaksi-reaksi adsorpsi dan
katalitik (Widegren et al., 2003). Menurut El-Kherbawi (2010), katalis dengan
berbagai macam campuran oksida logam dalam suatu sistem katalis mempunyai
4
Berdasarkan penjelasan di atas dan mengacu pada penelitian sebelumnya, maka
dalam penelitian ini dilakukan preparasi nanokatalis NiyFe(1-x-y)CuxO3±ᵹ (dimana
x = 0,1 - 0,4) dengan metode sol-gel, serta uji aktivitas katalitiknya terhadap
reaksi konversi (CO2 + H2) menjadi alkohol pada suhu 100o C – 400oC.
B. Tujuan Penelitian
Mendapatkan nanokatalis NiyFe(1-x-y)CuxO3±ᵹ, dan menguji keaktifan nanokatalis
NiyFe(1-x-y)CuxO3±ᵹ terhadap reaksi konversi (CO2 + H2) pada suhu 100 – 400oC
dan melihat pengaruh penambahan logam Cu dalam aktivitas katalitiknya.
C. Manfaat Penelitian
Memberi gambaran tentang penggunaan nanokatalis NiyFe(1-x-y)CuxO3±ᵹ pada
reaksi hidrogenasi katalitik yang merupakan penanganan efek gas rumah kaca dan
II. TINJAUAN PUSTAKA
A. Gas Rumah Kaca
Gas Rumah Kaca (GRK) merupakan gas di udara di atas lapisan permukaan bumi
(atmosfer) yang secara alami memungkinkan sebagian panas dari matahari ditahan
di atas permukaan bumi. Dengan adanya gas rumah kaca di atmosfer, sinar
matahari yang masuk atmosfer dapat diserap dan menghangatkan udara. Energi
matahari dalam bentuk panas dan cahaya memanaskan bumi sehingga suhu
meningkat. Sebagian dari panas ini dikembalikan ke angkasa,tetapi sebagian
besar terperangkap oleh molekul- molekul gas rumah kaca seperti CO2, CH4 dan
N2O (Sugiyono, 2006). Suhu rata-rata dipermukaan bumi naik 33°C lebih tinggi
menjadi 15°C dari seandainya tidak ada gas rumah kaca (-18°C), suhu yang
terlalu dingin bagi kehidupan manusia. Dengan demikian gas rumah kaca
membuat suhu di bumi pada titik yang layak huni bagi makhluk hidup (Santoso
dan Yudiartono, 2006).
B. Karbon Dioksida (CO2)
CO2 merupakan molekul linear yang simetris, dengan panjang ikatan C – O
sebesar 1,16 Å (Volpin and Kolomnikov, 1972). Beberapa sifat fisika dan kimia
6
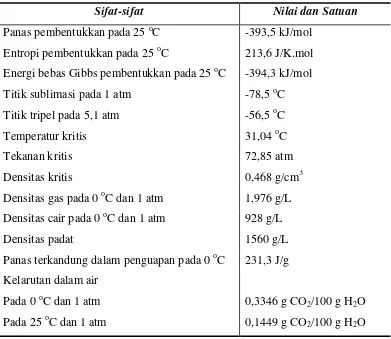
Tabel 1. Sifat-sifat fisika dan kimia dari CO2 (Song et al., 2002)
Sifat-sifat Nilai dan Satuan
Panas pembentukkan pada 25 oC -393,5 kJ/mol Entropi pembentukkan pada 25 oC 213,6 J/K.mol
Energi bebas Gibbs pembentukkan pada 25 oC -394,3 kJ/mol
Titik sublimasi pada 1 atm -78,5 oC Titik tripel pada 5,1 atm -56,5 oC Temperatur kritis 31,04 oC
Tekanan kritis 72,85 atm
Densitas kritis 0,468 g/cm3 Densitas gas pada 0 oC dan 1 atm 1,976 g/L Densitas cair pada 0 oC dan 1 atm 928 g/L
Densitas padat 1560 g/L
Panas terkandung dalam penguapan pada 0 oC 231,3 J/g Kelarutan dalam air
Pada 0 oC dan 1 atm Pada 25 oC dan 1 atm
0,3346 g CO2/100 g H2O
0,1449 g CO2/100 g H2O
Dari Tabel 1 di atas, panas pembentukkan (∆H˚) dan energi bebas Gibbs
pembentukkan (∆G˚) dari CO2 adalah dua sifat penting. Nilai-nilai tersebut secara
luas digunakan untuk memperkirakan panas pembentukkan dan energi bebas
Gibbs standar dari berbagai reaksi (Indala, 2004).
CO2 adalah molekul yang sangat stabil, akibatnya sejumlah energi harus diberikan
untuk mendorong reaksi ke arah yang diinginkan (Creutz and Fujita, 2000).
Namun, berdasarkan energi bebas Gibbs-nya, energi yang diberikan untuk
7
bersama dengan reaktan lain yang memiliki energi bebas Gibbs yang lebih besar
seperti metana, karbon (grafit), atau hidrogen (Song et al., 2002).
Karbon dioksida menunjukkan beberapa model koordinasi dengan senyawa logam
transisi, yang pertama melalui donasi pasangan elektron bebas dari oksigen ke
orbital kosong dari logam. Kedua melalui donasi elektron dari logam ke orbital
karbon dengan membentuk turunan asam logam. Dan ketiga melalui
pembentukkan kompleks-π melalui ikatan ganda C = O. Ketiga model koordinasi
tersebut ditunjukkan pada Gambar 1 berikut.
M O C O M
Gambar 1. Model koordinasi antara CO2 dengan logam
(I) melalui donasi elektron bebas oksigen ke orbital kosong dari logam (II) melalui donasi elektron dari logam ke orbital karbon
(III) melalui pembentukkan kompleks-π melalui ikatan ganda C = O
Dari ketiga model koordinasi di atas, model II dan III adalah model yang paling
disukai. Model pertama hanya akan terjadi jika senyawa logam merupakan asam
Lewis yang kuat (Volpin and Kolomnikov, 1972).
C. Material Nanopartikel
Nanopartikel didefinisikan sebagai partikulat yang terdispersi atau
partikel-partikel padatan dengan ukuran partikel-partikel berkisar 10 – 100 nm (Mohanraj and
Chen, 2006 ; Sietsma et al., 2007 ; Abdullah dkk., 2008). Material nanopartikel
8
dan kimia yang sangat berbeda dari bulk materialnya, seperti kekuatan mekanik,
elektronik, magnetik, kestabilan termal, katalitik dan optik (Mahaleh et al., 2008;
Deraz et al., 2009). Ada dua hal utama yang membuat nanopartikel berbeda
dengan material sejenis dalam ukuran besar (bulk) yaitu : (a) karena ukurannya
yang kecil, nanopartikel memiliki nilai perbandingan antara luas permukaan dan
volume yang lebih besar jika dibandingkan dengan partikel sejenis dalam ukuran
besar. Ini membuat nanopartikel bersifat lebih reaktif. Reaktivitas material
ditentukan oleh atom-atom di permukaan, karena hanya atom-atom tersebut yang
bersentuhan langsung dengan material lain; (b) ketika ukuran partikel menuju
orde nanometer, hukum fisika yang berlaku lebih didominasi oleh hukum-hukum
fisika kuantum (Abdullah et al., 2008).
Sifat-sifat yang berubah pada nanopartikel biasanya berkaitan dengan
fenomena-fenomena berikut ini. Pertama adalah fenomena-fenomena kuantum sebagai akibat
keterbatasan ruang gerak elektron dan pembawa muatan lainnya dalam partikel.
Fenomena ini berimbas pada beberapa sifat material seperti perubahan warna
yang dipancarkan, transparansi, kekuatan mekanik, konduktivitas listrik dan
magnetisasi. Kedua adalah perubahan rasio jumlah atom yang menempati
permukaan terhadap jumlah total atom. Fenomena ini berimbas pada perubahan
titik didih, titik beku, dan reaktivitas kimia. Perubahan-perubahan tersebut
diharapkan dapat menjadi keunggulaan nanopartikel dibandingkan partikel sejenis
9
Material nanopartikel menunjukkan potensi sebagai katalis karena material
nanopartikel memiliki area permukaan yang luas dan rasio-rasio atom yang
tersebar secara merata pada permukaanya, sifat ini menguntungkan untuk transfer
massa di dalam pori-pori dan juga menyumbangkan antar muka yang besar untuk
reaksi-reaksi adsorpsi dan katalitik (Widegren et al., 2003). Selain itu, material
nanopartikel telah banyak dimanfaatkan sebagai katalis untuk menghasilkan
bahan bakar dan zat kimia serta katalis untuk mengurangi pencemaran lingkungan
(Sietsma et al., 2007).
Banyak metode yang telah dikembangkan untuk preparasi material nanopartikel,
seperti metode pemanasan sederhana dalam larutan polimer. Secara sederhana
prinsip kerja dari metode ini adalah mencampurkan logam nitrat dalam air dengan
larutan polimer dengan berat molekul tinggi yang disertai dengan pemanasan
(Abdullah et al., 2008). Metode sintesis koloid, prinsip kerja dari metode ini
adalah membuat suatu larutan koloid yang kemudian ditambahkan surfaktan, yang
akan mendeaktivasi pertumbuhan partikel koloid dan melindungi permukaan
koloid (Soderlind, 2008). Metode pembakaran, dalam metode ini logam nitrat
dicampurkan dengan suatu asam amino (glisin) dalam air, kemudian dipanaskan
sampai mendidih dan sampai terbentuk bubur kering yang produknya berupa
oksida logam (soderlind, 2008). Metode kopresipitasi, prinsip kerja dari metode
ini adalah dengan mengubah suatu garam logam menjadi endapan dengan
menggunakan pengendap basa hidroksida atau karbonat, yang kemudian diubah
10
prinsip kerja dari metode ini adalah hidrolisis garam logam menjadi sol, yang
kemudian sol ini mengalami kondensasi membentuk gel (Ismunandar, 2006).
D. Katalis
Katalis didefinisikan oleh Berzelius sebagai suatu senyawa yang dapat
meningkatkan laju dari suatu reaksi kimia, tapi tanpa terkonsumsi selama reaksi
(Stoltze, 2000). Katalis dapat membentuk ikatan dengan molekul-molekul yang
bereaksi, dan membiarkan mereka bereaksi untuk membentuk produk kemudian
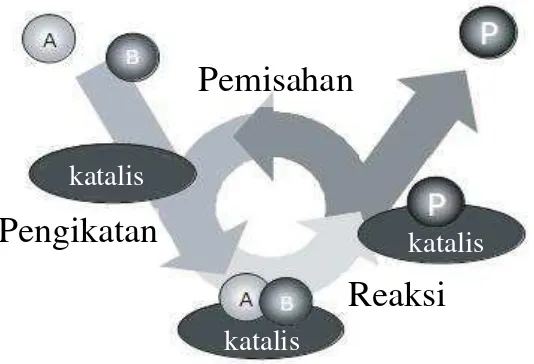
terlepas dari katalis. Suatu reaksi terkatalisis digambarkan sebagai suatu siklus
peristiwa dimana katalis berpartisipasi dalam reaksi dan kembali ke bentuk
semula pada akhir siklus. Siklus tersebut digambarkan pada Gambar 2 berikut
(Chorkendroff and Niemantsverdriet, 2003).
Gambar 2. Siklus reaksi terkatalisis
Gambar 2. Siklus reaksi katalisis
Dari Gambar 2 di atas, siklus diawali dengan pengikatan molekul-molekul A dan
B (reaktan) pada katalis. Kemudian A dan B bereaksi dalam bentuk kompleks ini
katalis
katalis
katalis
Pemisahan
Pengikatan
11
membentuk produk P, yang juga terikat pada katalis. Pada tahap akhir, P terpisah
dari katalis sehingga siklus kembali ke bentuk semula.
Secara umum, katalis dikelompokkan menjadi dua kelompok yaitu katalis
homogen dan katalis heterogen. Untuk katalis homogen, katalis dan reaktan
berada dalam fase yang sama. Sedangkan untuk katalis heterogen, katalis dan
reaktan berada pada fase yang berbeda. Untuk tujuan praktis, penggunaan katalis
heterogen saat ini lebih disukai dibandingkan dengan katalis homogen
(Chorkendroff and Niemantsverdriet, 2003)
Saat ini, proses katalitik heterogen dibagi menjadi dua kelompok besar,
reaksi-reaksi reduksi-oksidasi (redoks), dan reaksi-reaksi-reaksi-reaksi asam-basa. Reaksi-reaksi-reaksi
redoks meliputi reaksi-reaksi dimana katalis mempengaruhi pemecahan ikatan
secara homolitik pada molekul-molekul reaktan menghasilkan elektron tak
berpasangan, dan kemudian membentuk ikatan secara homolitik dengan katalis
melibatkan elektron dari katalis. Sedangkan reaksi-reaksi asam-basa meliputi
reaksi-reaksi dimana reaktan membentuk ikatan heterolitik dengan katalis melalui
penggunaan pasangan elektron bebas dari katalis atau reaktan (Li, 2005).
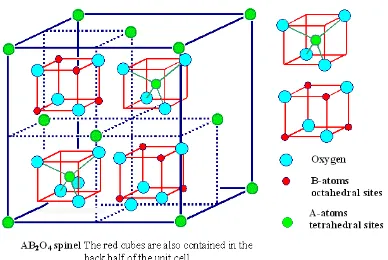
E. Spinel Ferite
Spinel ferite adalah material magnetik yang sangat penting, karena sifat magnetik,
elektrik dan kestabilan termal dari material tersebut sangat menarik. Spinel ferite
ini secara teknologi penting dan telah banyak digunakan dalam berbagai aplikasi
12
sistem pembawa obat dan zat pewarna (Maensiri et al., 2007; Kasapoglu et al.,
2007). Spinel ferite memiliki rumus umum AB2O4 dimana A adalah kation-kation
bervalensi 2 seperti Fe, Ni, Co, dll., yang menempati posisi tetrahedral dalam
struktu kristalnya dan B adalah kation-kation bervalensi 3 seperti Fe, Mn, Cr dll.,
yang menempati posisi oktahedral dalam struktur kristalnya, serta terdistribusi
pada lattice fcc yang terbentuk oleh ion O2- (Kasapoglu et al., 2007 ; Almeida et
al., 2008 ; Iftimie et al., 2006). Gambar 3 berikut adalah struktur kristal spinel
ferite.
Gambar 3. Struktur Kristal Spinel Ferite
Kation – kation yang terdistribusi dalam struktur spinel terdapat dalam tiga bentuk
yaitu normal, terbalik (inverse) dan diantara normal dan terbalik. Pada posisi
normal ion – ion logam bervalensi 2 terletak pada posisi tetrahedral (posisi A)
atau dapat dituliskan (M2+)A[M23+]BO4, pada posisi terbalik (inverse) ion – ion
logam bervalensi 2 terletak pada posisi oktahedral (posisi B) atau dapat dituliskan
(M3+)
A[M2+M3+]BO4 dan posisi diantara normal dan terbalik, setengah dari ion -
ion logam bervalensi 2 dan 3 menempati posisi tetrahedral dan oktahedral atau
13
Nikel ferite (NiFe2O4) merupakan salah satu material spinel ferite yang sangat
penting. Nikel ferite ini memiliki struktur spinel terbalik (inverse) dimana
setengah dari ion Fe mengisi pada posisi tetrahedral (posisi A) dan sisanya
menempati posisi pada oktahedral (posisi B) hal ini dapat dituliskan dengan
rumus (Fe3+1.0)[Ni2+1.0Fe3+1.0]O2-4 (Kasapoglu et al., 2007 ; Maensiri et al., 2007).
NiFe2O4 telah banyak digunkan sebagai katalis untuk benzoilasi toluen dengan
benzil klorida dan kemampuan sebagai sensor gas klorin pada konsentrasi rendah
(Ramankutty and Sugunan, 2001 ; Reddy et al., 1999 ; Iftimie et al., 2006) untuk
reaksi hidrogenasi (CO2 + H2) menjadi senyawa alkohol (Situmeang et al., 2010).
F. Hidrogenasi Katalitik CO2
Hidrogenasi katalitik CO2 merupakan gabungan dua tahap reaksi yaitu pergeseran
terbalik air dan gas (RWGS) dan reaksi sintesis Fischer-Tropsch (Joo dan Jung,
2003). RWGS adalah reaksi antara CO2 dengan H2 untuk menghasilkan CO dan
H2O. Konversi CO2 menjadi CO ini memainkan peran yang sangat penting dalam
hidrogenasi CO2, karena kestabilan CO2 tidak memungkinkan untuk melakukan
hidrogenasi secara langsung (Joo, 1999). Persamaan reaksi untuk RWGS adalah
O H CO H
CO2 2katalis 2 H0 41kJ mol,G0 29kJ mol
CO yang dihasilkan dari RWGS kemudian mengalami reaksi hidrogenasi melalui
reaksi sintesis Fischer-Tropsch. Produk yang dihasilkan dapat berupa
parafin-parafin linear, α-olefin, ataupun hidrokarbon mengandung oksigen seperti alkohol
14
Konversi gas CO2 menjadi senyawa alkohol dapat dilakukan dengan mereaksikan
gas CO2 dengan gas H2, yang mana gas H2 merupakan agen reduksi yang terbaik.
Reaksi pembentukan senyawa alkohol dari gas CO2 dan H2 seperti metanol (1)
juga dapat diikuti dengan pembentukan produk-produk senyawa kimia lainnya
seperti reaksi Sabatier (2), reaksi Bosch (3), reaksi pergeseran air dan gas (4)
dimetileter (5), dan asam format (6). Mekanisme reaksi di atas dapat dituliskan di
bawah ini :
Reaksi (1), (2), (3),dan (5), adalah reaksi eksotermis sedangkan reaksi (4) dan (6)
adalah reaksi endotermis. Pada reaksi di atas seluruh reaksi sebanding dan
bersaing (Atkins, 2004).
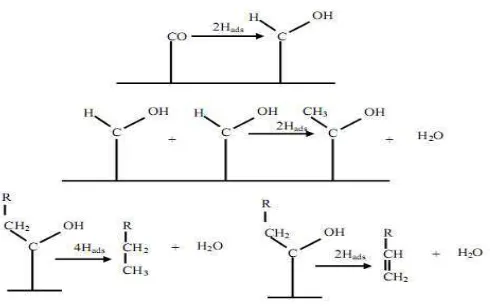
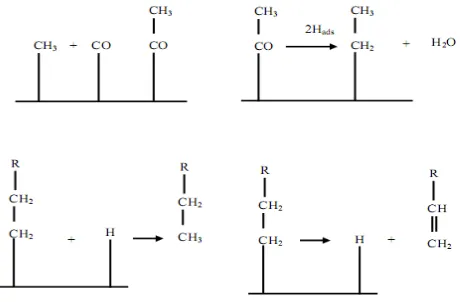
Mekanisme reaksi sintesis Fischer-Tropsch secara garis besar dikelompokkan
menjadi 3 yaitu, mekanisme karbida, mekanisme enol, dan mekanisme penyisipan
CO. Mekanisme karbida diajukan oleh Fischer dan Tropsch pada tahun 1926.
Dalam mekanisme ini, CO yang teradsorpsi dipisahkan menjadi C dan O, karbida
yang terbentuk kemudian terhidrogenasi menjadi CHx (monomer). Monomer
15
membentuk produk. Mekanisme ini digambarkan pada Gambar 4 berikut (Fischer
dan Tropsch, 1926).
Gambar 4. Mekanisme karbida
Mekanisme enol diajukan oleh Storch et al., (1951). Dalam mekanisme ini,
pertumbuhan rantai diinisiasi melalui kondensasi dua spesies hidroksikarbena
teradsorpsi (CHOHads) dengan mengeliminasi air. Mekanisme enol ini
ditunjukkan dalam Gambar 5 berikut.
Gambar 5. Mekanisme enol
Mekanisme yang terakhir, mekanisme penyisipan CO diajukan oleh Pichler and
16
dalam ikatan alkil metil. Karbon teroksigenasi kemudian mengalami hidrogenasi
untuk menghilangkan oksigen. Gambar 6 berikut menunjukkan mekanisme
penyisipan CO.
Gambar 6. Mekanisme penyisipan CO
G. Karakterisasi Katalis
Karakterisasi adalah hal yang sangat penting dalam bidang katalisis. Beberapa
metode seperti difraksi, spektroskopi, dan mikroskopi memberikan kemudahan
dalam menyelidiki sifat-sifat suatu katalis, sehingga diharapkan kita dapat
mendapatkan pemahaman yang lebih baik tentang katalis agar kita dapat
meningkatkan atau mendesain suatu katalis yang memiliki aktivitas yang lebih
baik (Chorkendorf and Niemantsverdriet, 2003).
17
Analisis struktur kristal katalis dilakukan menggunakan instrumentasi difraksi
sinar-X (X-ray Difraction/XRD). XRD merupakan salah satu metode karakterisasi
material yang paling tua dan paling sering digunakan hingga saat ini. Teknik ini
digunakan untuk mengidentifikasi suatu material berdasarkan fasa kristalin dalam
material dengan cara menentukan parameter kisi serta untuk mendapatkan ukuran
partikel suatu material (Auda, 2009).
Metode XRD didasarkan pada fakta bahwa pola difraksi sinar-X untuk
masing-masing material kristalin adalah karakteristik. Dengan demikian, bila pencocokan
yang tepat dapat dilakukan antara pola difraksi sinar-X dari sampel yang tidak
diketahui dengan sampel yang telah diketahui, maka identitas dari sampel yang
tidak diketahui itu dapat diketahui (Skoog dan Leary, 1992).
Difraksi sinar-X terjadi pada hamburan elastis foton-foton sinar-X oleh atom
dalam sebuah kisi periodik. Hamburan monokromatis sinar-X dalam fasa tersebut
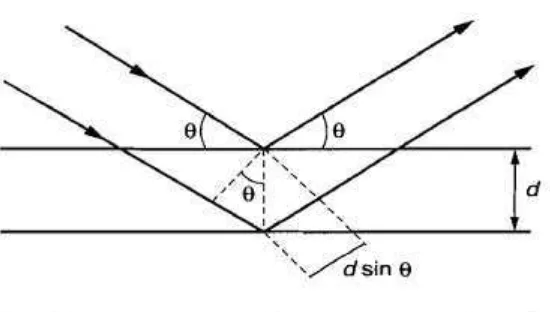
memberikan interferensi yang konstruktif. Dasar dari penggunaan XRD untuk
mempelajari kisi kristal adalah berdasarkan persamaan Bragg (Ismunandar, 2006):
θ = sudut antara sinar datang dengan bidang normal n = bilangan bulat yang disebut sebagai orde pembiasan
18
Gambar 7 berikut menunjukkan proses terjadinya pembentukkan puncak-puncak
difraksi pada XRD.
Gambar 7. Proses pembentukkan puncak pada XRD
Berdasarkan persamaan Bragg, jika seberkas sinar-X dijatuhkan pada sampel
kristal, maka bidang kristal itu akan membiaskan sinar-X yang memiliki panjang
gelombang yang sama dengan jarak antar kisi dalam kristal tersebut. Sinar yang
dibiaskan akan ditangkap oleh detektor, kemudian diterjemahkan sebagai puncak
difraksi. Semakin banyak bidang kristal yang sama terdapat dalam sampel,
semakin kuat intensitas pembiasan yang dihasilkan. Tiap puncak yang muncul
pada pola XRD mewakili satu puncak bidang kristal yang memiliki orientasi
tertentu dalam sumbu tiga dimensi (Auda, 2009).
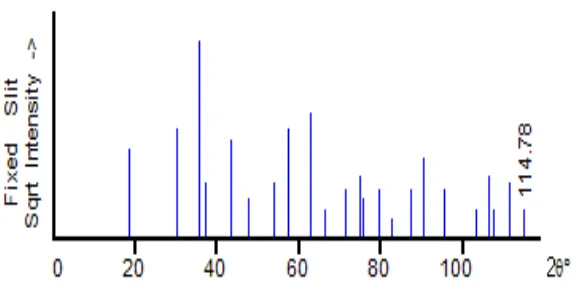
Gambar 8 berikut adalah contoh difraktogram sinar-X NiFe2O4 yang dipreparasi
19
Gambar 8. Difraktogram nanokristal NiFe2O4 (Kasapoglu et al., 2007).
Difraktogram di atas diinterpretasikan melalui pencocokan dengan difraktogram
standar. Gambar 9 berikut adalah difraktogram standar yang digunakan dalam
pencocokan difraktogram di atas.
Gambar 9. Difraktogram standar NiFe2O4 PDF 10-0325 (PCPDFwin, 1997)
Dari Gambar 9 di atas, puncak-puncak yang mewakili NiFe2O4terdapat pada 2θ
20
2. Keasaman Katalis
Keasaman katalis dapat dikategorikan menjadi dua yaitu jumlah situs asam dan
jenis situs asam. Jumlah situs asam memberikan informasi tentang banyaknya
situs asam yang terkandung pada katalis, yang pada umumnya berbanding lurus
dengan situs aktif pada katalis yang menentukan keaktifan suatu katalis.
Penentuan jumlah situs asam dalam katalis dapat dilakukan dengan menggunakan
metode gravimetri melalui adsorpsi basa adsorbat dalam fasa gas pada permukaan
katalis (ASTM, 2005).
Basa adsorbat yang dapat digunakan untuk menentukan jumlah situs asam katalis
antara lain amoniak atau piridin. Jumlah situs asam menggunakan adsorpsi
amoniak sebagai basa adsorbat merupakan penentuan jumlah situs asam total
katalis, dengan asumsi bahwa ukuran molekul amoniak yang kecil sehingga
memungkinkan masuk sampai ke dalam pori-pori katalis. Sedangkan penentuan
jumlah situs asam menggunakan piridin sebagai basa adsorbat merupakan
penentuan jumlah situs asam yang terdapat pada permukaan katalis, dengan
asumsi bahwa ukuran molekul piridin yang relatif besar sehingga hanya dapat
teradsorpsi pada permukaan katalis (Rodiansono dkk., 2007).
Penetuan jenis situs asam pada katalis dapat ditentukan menggunakan
spektroskopi infra merah (FTIR) dari katalis yang telah mengadsorpsi basa
adsorbat (Seddigi, 2003). Spektroskopi inframerah adalah metode analisis yang
21
menghasilkan perubahan keadaan vibrasi dan rotasi sampel. Frekuensi yang
diabsorpsi tergantung pada frekuensi vibrasi dari molekul (karakteristik).
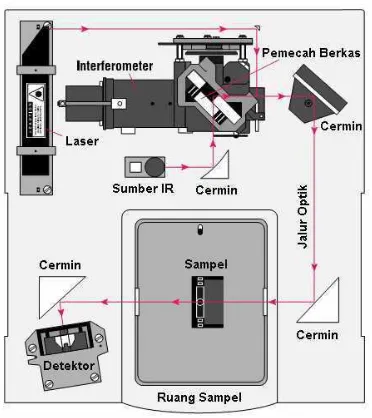
Instumen FTIR menggunakan sistem yang disebut dengan interferometer untuk
mengumpulkan spektrum. Interferometer terdiri atas sumber radiasi, pemisah
berkas, dua buah cermin, laser dan detektor. Intensitas absorpsi bergantung pada
seberapa efektif energy foton inframerah dipindahkan ke molekul, yang
dipengaruhi oleh perubahan momen dipol yang terjadi akibat vibrasi molekul
(Åmand and Tullin, 1999). Skema lengkap dari instrumentasi FTIR ditunjukan
pada Gambar 10.
Gambar 10. Skema instrumentasi FTIR.
Berdasarkan Gambar 10 cara kerja dari instrumentasi FTIR adalah sebagai
22
Energi inframerah diemisikan dari sumber bergerak melalui celah sempit untuk
mengontrol jumlah energi yang akan diberikan ke sampel. Di sisi lain, berkas
laser memasuki interferometer dan kemudian terjadi “pengkodean spektra”
menghasilkan sinyal interferogram yang kemudian keluar dari interferogram.
Berkas laser kemudian memasuki ruang sampel, berkas akan diteruskan atau
dipantulkan oleh permukaan sampel tergantung dari energinya, yang mana
merupakan karakteristik dari sampel. Berkas akhirnya sampai ke detektor
(Bradley, 2008).
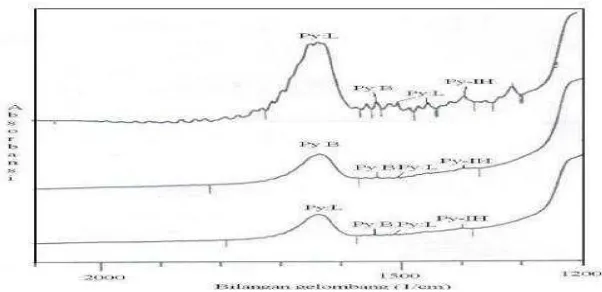
Dari spektra yang dihasilkan dari FTIR, jenis situs asam (Brønsted-Lowry atau
Lewis) yang terdapat pada katalis dapat diketahui melalui puncak-puncak serapan
yang dihasilkan dari interaksi basa adsorbat dengan situs-situs asam tersebut. Pada
penggunaan piridin sebagai basa adsorbat, situs asam Brønsted-Lowry akan
ditandai dengan puncak serapan pada bilangan-bilangan gelombang 1485 – 1500,
~1620, dan ~1640 cm-1. Sedangkan untuk situs asam Lewis ditandai dengan
puncak-puncak serapan pada bilangan-bilangan gelombang 1447 – 1460, 1488 –
1503, ~1580, dan 1600 – 1633 cm-1 (Tanabe, 1981).
Gambar 11 berikut adalah contoh spektra FTIR dalam analisis penentuan jenis
23
Gambar 11. Contoh spektra FTIR dalam penentuan jenis situs asam (Rodiansono dkk., 2007)
4. Analisis Morfologi Permukaan Katalis
Interaksi antara gas dan permukaan material dan reaksi-reaksi pada permukaan
material memiliki peran yang sangat penting dalam bidang katalisis. Siklus awal
katalsis diawali dengan adsorpsi molekul reaktan pada permukaan katalis. Oleh
karena itu kita perlu untuk mempelajari morfologi permukaan dari katalis
(Chorkendorff and Niemantsverdriet, 2003). Untuk mempelajari morfologi
permukaan katalis dapat menggunakan instrumentasi Scanning Electron
Microscopy (SEM) (Ertl et al., 2000).
SEM merupakan metode untuk menggambarkan permukaan suatu bahan dengan
resolusi yang tinggi. Resolusi yang tinggi pada SEM dihasilkan dari penggunaan
elektron dalam menggambarkan permukaan bahan. Resolusi yang dihasilkan juga
jauh lebih tinggi dibandingkan dengan mikroskop cahaya (0,1 – 0,2 nm untuk
SEM dan 200 nm untuk mikroskop cahaya) (Hanke, 2001).
24
Gambar 12. Skema kerja dari SEM
SEM memiliki beberapa peralatan utama antara lain :
1. Pistol elektron, berupa filamen yang terbuat dari unsur yang mudah
melepas eketron misalnya tungsten.
2. Lensa untuk elektron, berupa lensa magnetik karena elektron yang
bermuatan negatif dapat dibelokkan oleh medan magnet.
3. Sistem vakum, karena elektron sangat kecil dan ringan maka jika ada
molekul udara yang lain elektron yang berjalan menuju sasaran akan
terpencar oleh tumbukan sebelum mengenai sasaran.
Dari Gambar 12 di atas, sebuah pistol elektron memproduksi berkas elektron dan
25
sampel. Berkas elektron yang terfokus memindai (scan) keseluruhan sampel
dengan diarahkan oleh kumparan pemindai. Ketika elektron mengenai sampel,
maka sampel akan mengeluarkan elektron yang baru yang akan diterima oleh
detektor (Hanke, 2001).
Gambar yang dihasilkan SEM, dibentuk dari elektron sekunder yang dipantulkan
sampel pada peristiwa penembakan berkas elektron dari alat. Permukaan yang
lebih tinggi akan memberikan warna yang lebih cerah daripada permukaan yang
lebih rendah, ini diakibatkan oleh lebih banyaknya elektron sekunder yang
dibebaskan menuju detektor (Ertl et al., 2000). Gambar 13 berikut ini adalah
contoh mikrograp SEM untuk NiFe2O4
Gambar 13. Mikrograf SEM dari NiFe2O4 (Kasapoglu et al., 2007)
Dari Gambar 13 di atas, dapat dilihat bahwa NiFe2O4 yang disintesis secara
keseluruhan memiliki morfologi permukaan yang seragam dengan bentuk partikel
oktahedron.
H. Kromatografi Gas
Kromatografi adalah metode pemisahan suatu campuran berdasarkan partisi
26
besar dan fase bergerak yang mengalir sepanjang fase diam. Kromatografi gas
merupakan cabang kromatografi yang saat ini paling populer, dimana substansi
yang dianalisis terdapat dalam keadaan gas atau keadaan uap (Brewer, 1998).
Dalam kromatografi gas, sampel diuapkan dan dibawa oleh fase bergerak berupa
gas pembawa (carrier gas) melalui kolom. Sampel terpartisi pada fase diam,
berdasarkan perbedaan kekuatan interaksinya dengan fase diam pada temperature
yang diberikan. Komponen-komponen sampel (disebut solut atau analit) terpisah
satu sama lain berdasarkan tekanan uap relatif dan afinitasnya terhadap fase
stasioner. Proses pemisahan ini disebut elusi (McNair and Miller, 1997).
Sistem kromatografi gas terdiri dari 6 komponen utama yaitu, gas pembawa dan
pengendali aliran, injektor, detektor, oven, kolom dan suatu sistem data. Susunan
komponen-komponen kromatografi gas ditunjukan oleh Gambar 14 (Rood, 2007).
27
Komponen penting dalam kromatografi gas yaitu :
1. Tangki Pembawa gas yang dilengkapi dengan pengatur tekanan
2. Tempat injeksi sampel
3. Kolom
4. Detektor yang dilengkapi dengan thermostat
5. Penguat arus (amplifier)
III. METODELOGI PENELITIAN
A. Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Biomassa Jurusan Kimia FMIPA
Universitas Lampung. Analisis Difraksi Sinar-X dilakukan di Laboratorium Pusat
Teknologi Bahan Industri Nuklir (PTBIN) Batan Serpong, analisis morfologi
permukaan dilakukan di Laboratorium Biomassa Universitas Lampung, analisis
keasaman dilakukan di Laboratorium Biomassa Universitas Lampung. Uji
aktivitas katalis dilakukan di Laboratorium Biomassa Universitas Lampung, dan
analisis hasil uji aktivitas dilakukan di Laboratorium Biomassa Universitas
Lampung. Penelitian ini dilakukan dari bulan Januari 2012 sampai dengan bulan
Januari 2013.
B. Alat dan Bahan
Peralatan yang digunakan dalam penelitian ini antara lain, pengaduk magnetik,
furnace, neraca analitik, difraktometer sinar-X, Scanning Electron Microscopy,
Fourier Transform Infra Red (FTIR), reaktor katalitik, Kromatografi Gas (KG),
29
Bahan-bahan kimia yang digunakan dalam penelitian ini antara lain, feri nitrat
Fe(NO3)3.9H2O (Merck, 99%), nikel nitrat Ni(NO3)2.6H2O (Merck, 99%),
tembaga nitrat (Merck, 99%) Cu(NO3)2.6H2O, piridin (J.T. Baker), C5H5N, putih
telur, gas argon (Bumi Waras 99,95%), gas hidrogen (BOC 99,99%), gas CO2
(BOC 99,99%), dan akuades/bides.
C. Prosedur Kerja
1. Pembuatan Nanokatalis
Pembuatan nanokatalis NiyFe(1-x-y)CuxO3±ᵹ (variabel x = 0.1 – 0.4; y = 0,2)
dilakukan dengan cara melarutkan 60 mL putih telur dalam 40 mL aquades.
Larutan kemudian diaduk menggunakan pengaduk magnet pada suhu ruang
sampai diperoleh larutan yang homogen. Kemudian larutan putih telur dibagi
menjadi 3 bagian yaitu pada tabung pertama terdiri dari 30 mL putih telur dan
2,3986 g Ni(NO3)2.6H2O, tabung ke dua terdiri dari 50 mL putih telur dan 3,3325
g Fe(NO3)3.9H2O, dan tabung ketiga terdiri dari 20 mL putih telur dan 1,9933 g
Cu(NO3)2.3H2O (untuk x = 0,1). Kemudian masing-masing campuran diaduk
menggunakan pengaduk magnet selama 2 jam pada suhu ruang sampai diperoleh
larutan yang homogen. Setelah itu, masing-masing campuran larutan dicampur
menjadi satu dan diaduk menggunakan pengaduk magnet selama 2 jam pada suhu
ruang sampai diperoleh larutan yang homogen. Kemudian, campuran dipanaskan
menggunakan hot plate pada suhu 80oC sampai terbentuk padatan prekursor
30
600oC selama 2 jam (Maensiri et al., 2007). Perlakuan yang sama juga dilakukan
unutk sintesis NiyFe(1-x-y)CuxO3±ᵹ (x = 0,2 ; 0,3 dan 0,4; y = 0,2).
2. Karakterisasi Katalis
a. Analisis Struktur Kristal
Analisis struktur kristal dilakukan menggunakan instrumentasi difraksi sinar-X
(XRD). Prosedur analisis ini disesuaikan dengan penelitian yang telah dilakukan
oleh Maiti et al., (1973). Analisis dilakukan menggunakan radiasi CuKα (1,5425
Å), tabung sinar-X dioperasikan pada 40 kV dan 200 mA. Rentang difraksi yang
diukur (2θ) dalam rentang 10 – 80o, dengan scan step size 0,02o/menit.
Puncak-puncak yang terdapat pada difraktogram kemudian diidentifikasi menggunakan
metode Search Match dengan standar file data yang terdapat dalam program
PCPDF-win 1997 (Drbohlavova et al., 2009).
b. Analisis Kuantitatif Kristal
Analisis kuantitatif kristal dilakukan dengan metode penghalusan data XRD
menggunakan software riedveld. Salah satu software penghalusan data XRD
yaitu program bernama retica. Menjalankan program riedtveld bernama retica
dilakukan langkah-langkah berikut:
a. Menyiapkan tiga buah file dengan baik yakni: file data(hasil data XRD), file input (program dibuat sendiri)berisi panjang gelombang yang digunakan XRD, pengambilan sudut difraksi 20 dan File output.
31
c. Mendapatkan hasil olahan data dari retica dengan analisis jika ≤ 4 maka file input yang dibuat dikatakan cukup berhasil.
d. Analisis Keasaman Katalis
Penentuan jumlah situs asam pada katalis dilakukan secara gravimetri (ASTM,
2005) melalui kemisorpsi basa piridin. 0,2 g katalis ditimbang, dimasukkan ke
dalam wadah dan diletakkan di dalam desikator bersama basa piridin. Desikator di
tutup selama 24 jam untuk memberikan waktu katalis mengadsorpsi basa piridin.
Setelah 24 jam, sampel katalis dikeluarkan dan dibiarkan di tempat terbuka
selama 2 jam. Kemudian sampel katalis ditimbang. Selanjutnya jumlah situs asam
yang terdapat pada katalis ditentukan menggunakan persamaan berikut.
Dimana, w1 = Berat wadah kosong
w2 = Berat wadah + cuplikan
w3 = Berat wadah + cuplikan yang telah mengadsorpsi piridin
BM = Bobot molekul piridin.
Penentuan jenis situs asam katalis, dilakukan secara kualitatif menggunakan
spektroskopi inframerah. Sampel katalis yang dianalisis dicampur dengan KBr
kemudian dimasukkan ke dalam vessel sampel, lalu dilakukan pengukuran.
Kemudian dilakukan analisis dari spektra yang didapat pada daerah bilangan
32
e. Analisis Morfologi Permukaan Katalis
Analisis morfologi permukaan katalis dilakukan menggunakan Scanning Electron
Microscopy (SEM). 0,1 g sampel katalis yang akan dianalisis ditempatkan pada
wadah sampel yang mengandung sticking tape tembaga, kemudian sampel dilapisi
lapisan tipis emas atau bahan yang besifat konduktor lainnya (Drbohlavova et al.,
2009). Kemudian sampel tersebut diberikan berkas elektron. Berkas elektron akan
dipantulkan oleh sampel untuk kemudian ditangkap detektor membentuk foto
(Hanke, 2001).
3. Uji Aktivitas Katalis
Aktivitas katalitik dari katalis diuji menggunakan reaktor dengan skema kerja
reaktor digambarkan pada Gambar 15 berikut.
Gambar 15. Skema reaktor katalitik
Keterangan :
1 – 3 = regulator (flowmeter), 4 – 6 = pengatur aliran gas, 7 = wadah pencampur, 8 – 9 =
penghubung swagelock, 10 = termokopel, 11 = wadah katalis, 12 = furnace, 13 = valve, 14 =
33
Sampel katalis sebanyak 20 mg ditempatkan pada tabung reaktor. Kemudian
katalis dipanaskan sampai suhu reaksi, suhu kemudian dipertahankan selama 30
menit. Kemudian dialirkan gas CO2, H2 dan Ar dengan perbandingan CO2 : H2 = 1
: 3, dan laju aliran total CO2, H2 dan Ar adalah 50 mL/menit atau setara 3 L/jam,
reaksi kemudian dibiarkan selama 30 menit. Variasi suhu yang dilakukan adalah
100oC, 200oC, 300oC dan 400oC. Hasil katalisis yang keluar dari tabung reaktor
kemudian ditampung dalam wadah penampung. Hasil dari uji aktivitas ini
selanjutnya dianalisis menggunakan Kromatografi Gas.
4. Analisis Produk dengan Kromatografi Gas
Sebanyak 20 μL hasil dari uji aktivitas diinjeksikan ke dalam instrumentasi
kromatografi gas. Instrumentasi kromatografi gas diatur dengan
parameter-parameter sebagai berikut :
Fase gerak : gas helium (5 mL/menit) dan gas nitrogen (5 mL/menit)
Kolom : PEG (polyethylene glycol) 2 M sepanjang 4 meter
Detektor : TCD
Suhu : 150oC (injektor) dan 120oC (kolom)
Analisis produk alkohol secara kuantitatif dilakukan dengan cara membuat kurva
standar dari larutan standar metanol, etanol, propanol, butanol dan pentanol,
sedangkan untuk asam karboksilat kurva standar dibuat dari larutan standar asam
formiat, asam etanoat, dan asam propanoat. Kemudian kromatogram hasil uji
analisis yang diperoleh dibandingkan terhadap kromatogram standar alkohol dan
asam karboksilat dengan cara membandingkan waktu retensi produk analisis
34
terbentuk dilakukan dengan cara perhitungan integrator yaitu menghitung luas
area bawah puncak kromatogram sampel dan dibandingkan dengan luas puncak
kromatogram standar yang telah diketahui konsentrasinya. Karena luas area
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan hasil yang didapat dari penelitian ini maka dapat diambil
kesimpulan bahwa :
1. Katalis yang disintesis menggunakan metode sol-gel dan sonofikasi secara
simultan dengan putih telur adalah nanokatalis NiCuFe2O4.
2. Hasil analisis sinar-X (XRD) menunjukkan bahwa fasa kristalin CuFe2O4
lebih dominan dibanding fasa kristalin NiFe2O4, selain itu terdapat juga
fasa kristalin Fe3O4, CuO, dan NiO.
3. Katalis Ni0,2Cu0,4Fe0,4O4 (FNCu 04) memiliki tingkat keasaman tertinggi
yaitu 30,75mmol piridin/g katalis jika dibandingkan dengan katalis
Ni0,2Cu0,2Fe0,6O4 (FNCu 03) yaitu 24,05mmol piridin/g katalis
Ni0,2Cu0,3Fe0,5O4 (FNCu 03) yaitu 19,32mmol piridin/g katalis dan
Ni0,2Cu0,1Fe0,7O4 (FNCu 01) yaitu 14,39mmol piridin/g katalis.
4. Hasil analisis FTIR , situs asam yang mendominasi pada permukaan
katalis adalah situs asam Lewis.
5. Hasil analisis menggunakan SEM menunjukan bahwa katalis
Ni0,2Cu0,4Fe0,4O4 (FNCu 02) berukuran nano ±85nm, dengan morfologi
57
6. Secara umum katalis NiyCuxFe(1-x-y)O4 aktif dalam konversi CO2/H2 dan
selektif terhadap pembentukan etanol.
B. Saran
Berdasarkan penelitian yang telah dilakukan, pada penelitian selanjutnya perlu
disarankan untuk :
1. Pada sintesis katalis metode penambahan bahan tidak bersaman,
melainkan dengan membagi menjadi 3 bagian, agar putih telur dan ketiga
bahan pembuat katalis homogen terlebih untuk menghindari aglomerasi
2. Melakukan metode sonifikasi pada sintesis katalis dengan waktu 60-90
menit untuk mendapatkan katalis berukuran nano dengan morfologi
permukaan yang seragam (homogen) dengan sifat-sifat katalis yang lebih
baik.
3. Melakukan variasi perbandingan laju alir CO2 dan H2 pada uji aktivitas
DAFTAR PUSTAKA
Abdullah, M., Yudistira V., Nirmin, dan Khairurrijal. 2008. Sintesis Nanomaterial. Jurnal Nanosains dan Nanoteknologi. 1, p. 33–36.
Ahmed, S. R., and P. Kofinas. 2005. Magnetic properties and morphology of block copolymer-cobalt oxide nanocomposites. Journal of Magnetism and Magnetic Materials. 288, p. 219 – 223.
Almeida, J. M. A., C. T. Meneses, A. S. de Menezes, R. F. Jardim, and J. M. Sasaki. 2008. Synthesis and Characterization of NiMn2O4
nanoparticles using gelatin as organic precursor. Jmmm. 320, p.
304-307.
Ǻmand, L. A. and C. J. Tullin. 1999. The Theory Behind FTIR Analysis: Application Examples From Measurement at the 12 MW Circulating Fluidized Bed Boiler at Chalmers. Dept. of Energy Conversion
Chalmers University of Technology. Gıtenborg, Sweden, p. 1 – 15.
Anonim. Karbon dioksida (CO2) . http://www.co2now.org/CO2/indexing.
exercises.html. Diakses 23 juli 2011.
ASTM D4824-03. 2005. Test Method for Determination of Catalyst Acidity by Ammonia Chemisortption. Annual Book of ASTM.
Atkins., P.W. 2004. Physical Chemistry. 10th Ed.W.H Freeman and Company,
New York. USA.
Auda, H. Y. 2009. Spektroskopi Difraksi Sinar-X (X-ray Difraction/XRD).
Fakultas Teknik Universitas Sebelas Maret.
Bakhtiari, M., F. Khorasheh, A. Zamanian, A. Nakhaeipour, and M. Irani. 2008.
Preparation, Evaluation and Characterization of Monolithic Catalysts For Fischer-Tropsch Synthesis. Petroleum & Coal, 50, p. 56 – 61.
Bradley, M. 2008. Advantages of Fourier Transform Spectrometer. Thermo
Fischer Scientific. Technical Note: 50674.
Brewer, L. W. 1998. Gas Chromatography. Springer-Verlag. Berlin. pp. 257 –
276.
Budinski, K.G. and Budinski, M.K. 1999. Engineering Material (Properties and Selection). Prentice Hall. Uppar Saddle River Publishing. New Jersey.
59
Cabrera, I. M., M. L. Granados, P. Terreros, and J. L. G. Fierro. 1998. CO2 Hydrogenation Over Pd-Modified Methanol Synthesis Catalysts.
Catalysis Today, 45, p. 251 – 256.
Chauhan, S. S., C. Ojha, and A.K. Shrivastava. 2009. Synthesis and characterization of CuFe2O4 nanoparticles. Journal of Theoretical & Applied Sciences, International Journal of Theoretical & Applied Sciences, vol. 2, p. 9 – 11.
Chorkendroff, I. and J. W. Niemantsverdriet. 2003. Concept of Modern Catalysis and Kinetics. Wiley-VCH GmbH & Co. New York, p. 2 – 4.
Creutz, C. and E. Fujita. 2000. Carbon Management: Implications for R&D in the Chemical Sciences and Technology: A Workshop Report to the Chemical Sciences Roundtable. The National Academies Press.
Washington D. C.
Drbohlavova, J., R. Hrdy, V. Adam, R. Kizek, O. Schneeweiss, J. Hubalek. 2009.
Preparation and Properties of Various Magnetic Nanoparticles.
Sensors, Vol. 9, p. 2352 – 2362.
Deraz, N. M., M. M. Selim, and M. Ramadan. 2009. Processing and Properties of Nanocrystalline Ni and NiO Catalysts. Materials Chemistry and Physics.113, p. 269-275. Pressures from Gasification Product of Coal. Brenstoff-Chemie, 7, p.
97-104.
Fujiwara, M., R. Kieffer, H. Ando, Q. Xu, and Y. Souma. 1995. Hydrogenation of Carbon Dioxide over Fe-ZnO/HY Composite Catalyst. LERCSI,
ECPM Strasbourg. France, p. 1 – 5.
Hanke, L. D. 2001. Hanbook of Analytical Methods for Materials. Materials
Evaluation and Engineering Inc. Plymouth, p. 35 – 38.
Iftimie, N., E. Rezlescu, P. D. Popa, and N. Rezlescu. 2006. Gas Sensitivity of Nanocrystalline Nickel Ferrite. Journal of Optoelectronics and Advanced Materials.8, No.3, p. 1016-1018.
Indala, S. 2004. Development and Integration of New Processes Consuming Carbon Dioxide in Multi-Plant Chemical Production Complexes.Thesis. Department of Chemical Engineering. Andhra
University.India, p. 4 – 22.
Ismunandar. 2006. Padatan Oksida Logam: Struktur, Sintesis, dan Sifat-sifatnya.
60
Joo, O. S. 1999. Camere Process for Carbon Dioxide Hydrogenation to Form Methanol. Catalysis Laboratory. Korea Institute of Science and
Technology. Seoul. South Korea, p. 686 – 689.
Joo, O. S. and K. D. Jung. 2003. Stability of ZnAl2O4 Catalyst for Reverse-Water
Gas-Shift Reaction (RWGS). Bull. Korean Chem. Soc., 24, p. 86– 90.
Jun, K. W., S. J. Lee, M. J. Choi, and K. W. Lee. 2006. Catalytic Hydrogenation of CO2 Into Hydrocarbons: Support Effects on Fe and Fe-K Catalyst. Catalyst Division. Korea Research Institute of Chemical Technology. Taejon. Korea, p. 1411 – 1414.
Kasapoglu, N., A. Baykal, M. S. Toprak, Y. Koseoglu, and H. Bayrakdar. 2007. Synthesis and Characterization of NiFe2O4 Nano-Octahedrons by
EDTA-Assisted Hydrothermal Method. Turk. J. Chem. 31, p.
659-666.
Kim, K. D., S. S. Kim, Y. H. Choa and H. T. Kim. 2007. Formation and Surface Modification of Fe3O4 Nanoparticles by Co-precipitation and Sol-gel
Method. Journal of industrial engineering chemistry. l13, p. 1137 -
1141.
Lecloux, A. J., and J. P. Pirarad. 1998. High-Temperature Catalyst Through Sol-Gel Synthesis. Journal of Non-Crystalline Solids. 225, p. 146 - 152.
Li, Z. 2005. Novel Solid Basa Catalyst for Michael Additions: Synthesis, Characterization and Application. Dissertation.
Mathematisch-Narurwissenschaftlichen Fakultät I. Humboldt-Universität. Berlin, p.2
– 4.
Maensiri, S., C. Masingboon, B. Bonochom, and S. Seraphin. 2007. A simple route to synthesize nickel ferrite (NiFe2O4) nanoparticles using egg
white. J. scriptamat. 56, p. 797-800.
Mahaleh, Y. Bahari Molla., S. K. Sadrnezhaad, and D. Hosseini. 2008. NiO
Nanoparticles Synthesis by Chemical Precipitation and Effect of Applied Surfactant on Distribution of Particle Size. Hindawi Publishing Corporation Journal of Nanomaterials Volume 2008, Article ID
470595, 4 pages.
Maiti, G. C., M. L. Kundu, S. K. Ghosh, and B. K. Banerjee. 1973. Cyrstallite Size Measurements and Phase Transformation of Fe2O3, Cr2O3 and
Fe2O3- Cr2O3 System by X-Ray Difraction Method. Physical Research Wing.Fertilizer Corporation of India Limited, p. 496 – 505.
Manova, E., T. Tsoncheva, Cl. Estournes, D. Paneva, K. Tenchev, I. Mitov, L. Petrov. 2005. Nanosized Iron and Iron – Cobalt Spinel Oxides as Catalysts for Methanol decomposition. J. apcata. 11, p. 5.
McNair, H. M. and J. M. Miller. 1997. Basic Gas Chromatography. John Wiley &
Sons, Inc. Canada, p. 1 – 14.
61
More, R. M., T. J. Shinde, N. D. Choudhari, and P. N. Vasambekar. 2005. Effect on Temperature on X-ray, IR and Magnetic Properties of Nickel Ferrite Prepared by Oxalate co-precipitation method. Journal of Materials Science : Materials in Electronics.16, p.721.
Olah, G. A., A. Goeppert, and G. K Surya Prakash. 2009. Chemical Recycling of Carbon Dioxidde to Methanol and Dimethyl Ether : From Greenhouse Gas to Renewable, Environmentally Carbon Neutral Fuels and Synthetic Hydrocarbons. J. Org. Chem. 74B, p. 487-498.
Parry, E. P. 1963. An Infrared Study of Pyridine Adsorbed on Acidic Solids. Characterization of Surface Acidity. Journal of Catalysis. 2, p. 371 -
379.
Perego,C., and P. Villa. 1997. Catalyst Preparation Methods. Catalysis Today.34,
p. 281 - 305.
Pichler, H. and H. Schulz. 1970. Recent Results in the Synthesis of Hydrocarbons from Carbon Monoxide and Hydrogen. Chemie Ingenieur Technik,
42, p. 1162 – 1174.
Pinna, F. 1998. Supported Metal Catalyst Preparation. Catalysis Today. 41, p.
129-137.
Ramankutty, C.G. and S. Sugunan. 2001. Surface properties and catalytic activity of ferospinel of Nickel, Cobalt, and Coper, prepared by soft chemical methods. Appl. Catal. A 218, 39-51.
Rataq, A., I. Meliana, M. Lopes Granados, P. Terreros. 1998. CO2 hydrogenation
over Pd-modified methanol synthesis catalysts. Catalysis Today 45. P.
251-256.
Reddy, C.V.G., S.V. Manorama and V.J. Rao. 1999. Semiconducting Gas Sensor for Chlorine Based on Inverse Spinel Nickel Ferrite. Sens. Actuators B: Chemical 55, 90-95.
Rodiansono, W., Trisunaryanti, dan Triyono. 2007. Pembuatan, Karakterisasi dan Uji Aktifitas Katalis NiMo/Z dan NiMo/Z-Nb2O5 pada Reaksi
Hidrorengkah Fraksi Sampah Plastik Menjadi Fraksi Bensin. Berkala
MIPA, 17, p. 44 – 54.
Rood, D. 2007. The Troubleshooting and Maintenance Guide for Gas Chromatographers, Fourth Eddition. Willey-VCH Verlag GmbH &
Co. KGaA, Weinheim, p. 3 – 13.
Santosa, J. dan Yudiartono. 2006. Analisis Prakiraan Kebutuhan Energi Nasional Jangka Panjang Di Indonesia. Strategi Penyediaan Listrik Nasional
Dalam Rangka Mengantisipasi Pemanfaatan PLTU Batu Bara Skala Kecil, PLTN, Dan Energi Terbarukan, p. 1-12.
Seddigi, Z. S. 2003. Acidic Properties of HZSM-5 Using Acetonylacetone, TPD Ammonia, and FTIR of Adsorbed Pyridine. The Arabian Journal for Science and Engineering. 27, p. 149 – 156.