ABSTRAK
STUDI PENAMBAHAN SENYAWA EKSTRAK BIJI PINANG (Areca catechu, L.) Sebagai INHIBITOR KERAK KALSIUM SULFAT
(CaSO4) Dengan METODE UNSEEDED EXPERIMENT
Oleh
Silvana Maya Pratiwi
Dalam penelitian ini telah dilakukan penambahan inhibitor senyawa ekstrak biji pinang pada kerak kalsium sulfat (CaSO4) menggunakan metode tanpa penambahan bibit kristal (unseeded experiment) pada konsentrasi CaSO4 sebesar 0,15; 0,20 dan 0,25 M serta variasi inhibitor sebesar 50, 150, dan 250 ppm. Hasil penelitian berdasarkan analisis kualitatif menggunakan Scanning Electron Microscopy (SEM) menunjukkan bahwa ukuran kristal CaSO4 tanpa penambahan inhibitor lebih besar dibandingkan dengan penambahan inhibitor. Sedangkan analisis kuantitatif menggunakan Particle Size Analyzer (PSA) menunjukkan
bahwa distribusi ukuran partikel kerak CaSO4 menjadi lebih kecil dengan adanya penambahan inhibitor yang dinilai berdasarkan pada ukuran rata-rata partikel kerak CaSO4 yakni tanpa penambahan inhibitor memiliki ukuran rata-rata 7,5 nm sebanyak 29,26 %, sedangkan setelah penambahan inhibitor memiliki ukuran rata-rata sebesar 6,5 sebanyak 24,06 %. Berdasarkan persentase (%) kemampuan menghambat, konsentrasi optimum inhibitor dalam menghambat kerak CaSO4 0,15 M yaitu pada konsentrasi 250 ppm dengan hasil 24 %.
ABSTRACT
ADDITIONAL STUDIES OF COMPOUND PINANG EXTRACT (Areca catechu, L.) AS INHIBITOR OF CALCIUM SULFATE (CaSO4) With
UNSEEDED METHODS EXPERIMENT
By
Silvana Maya Pratiwi
In this research, it has been conducted addition of compound inhibitor pinang extract on the calcium sulfate (CaSO4) scale using unseeded experiments at various concentrations of growth solutions from 0,15; 0,20 and 0,25 M. The various concentrations of inhibitors added were around 50, 150, and 250 ppm. The results based on qualitative analysis using Optical Microscopy and Scanning Electron Microscopy (SEM) showed that size of CaSO4 crystal without the addition of inhibitor is bigger than with the addition of inhibitor, whereas quantitative analysis using a Particle Size Analyzer (PSA) showed that the distribution of particle size of CaSO4 crystals with the addition of inhibitor is smaller than without the addition of inhibitor which have an average size of 7.5 nm at 29,26 %, while after the addition of inhibitors have an average size of 6.5 as much as 24.06 %. Based on the percentage (%) of inhibitor ability, the optimum concentration of inhibitor in inhibitiny scale formation of CaSO4 in the growth solution of 0,15 M is 250 ppm with the result of 24%.
RIWAYAT HIDUP
Penulis dilahirkan di Bandarlampung pada tanggal 20 Januari 1992 sebagai anak pertama dari pasangan Bapak Agung
Wicahyono dan Ibu Azrah.
Penulis mulai menjejakkan kaki dibangku sekolah untuk pertama kalinya di Taman Kanak-kanak Aisyiyah Bustanul
Athfal pada tahun 1997, Menyelesaikan pendidikan di SDN 1 Sidodadi pada tahun 2004, Sekolah Menengah Pertama di SMPN 16 Bandarlampung pada tahun
2007, dan Sekolah Menengah Atas di SMAN 14 Bandarlampung pada tahun 2010. Penulis terdaftar sebagai mahasiswi di Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung pada tahun 2010 melalui jalur
Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN)
Selama menjadi mahasiswi, penulis pernah aktif dalam organisasi Himpunan Mahasiswa Kimia (HIMAKI) Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Lampung sebagai Kader Muda HIMAKI (KAMI) pada periode 2010
– 2011, Redaktur pelaksana Unit Kegiatan Mahasiswa Fakultas (UKMF) Natural
pada periode 2011-2012, Pimpinan Redaksi UKMF Natural pada periode
2012-2013. Selain itu, penulis juga pernah mengikuti organisasi Badan Eksekutif Mahasiswa (BEM) Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas
Selama menjadi mahasiswa, penulis juga pernah menjadi asisten Praktikum Kimia Dasar untuk mahasiswa Fakultas Pertanian Jurusan Teknik Pertanian dan
Teknologi Hasil Pertanian tahun 2013. Pada tahun 2013 penulis menyelesaikan Kerja Praktek Lapangan (PKL) yang berjudul ”Efek Penambahan Senyawa
Ekstrak Biji Pinang (Areca catechu, L.) Sebagai Inhibitor Kerak Kalsium Sulfat
(CaSO4) dengan Metode Unseeded Experiment” di Laboratorium Kimia
Segala Puji dan Syukur Kepada Allah SWT
Kupersembahkan Karya Kecilku ini
Teruntuk
Ayah dan Ibuku tersayang
yang senantiasa memberikan kasih sayang,
perhatian, dukungan, dan motivasi,
serta selalu mendoakan keberhasilanku
Seluruh keluarga besar dan adikku tercinta yang selalu mendoaakan keberhasilanku
Sahabat dan teman-temanku yang selalu berbagi kebahagiaan
Seseorang yang kelak akan mendampingi hidupku
MOTO
Niscaya Allah akan meninggikan orang-orang yang beriman di antaramu dan orang-orang yang diberi ilmu pengetahuan beberapa derajat. Dan Allah
Maha Mengetahui apa yang kamu kerjakan. (QS. Al Mujaadilah : 11)
Kesuksesan tidak diukur dengan apa yang anda raih, tapi dari keberhasilan menghadapi tantangan dan keberanian yang anda pertahankan dalam mengatasi
segala persoalan.
(Orison Swett Marden, penulis-pendiri Majalah Success)
If you don’t like a rule, just follow it. Reach on the top and change the rule
(Adolf Hitler)
Bersikap rendah hati, menyadari bahwa masih banyak kekurangan adalah satu syarat penting lainnya dalam belajar.
SANWACANA
Puji syukur kehadirat Allah SWT yang telah memberikan segala bentuk rahmat, hidayah dan ridho-Nya yang tak bertepi. Shalawat serta salam teruntuk Nabi Muhammad SAW. Berbekal pengetahuan dan pengalaman yang telah diperoleh,
penulis mampu menyelesaikan skripsi yang berjudul
”Studi Penambahan Senyawa Ekstrak Biji Pinang (Areca catechu, L.) Sebagai Inhibitor Kerak Kalsium Sulfat (CaSO4) dengan Metode
Unseeded Experiment”
Dengan segenap jiwa yang dilandasi dengan ketulusan hati, penulis mengucapkan
terima kasih kepada :
1. Bapak Prof. Suharso, Ph.D selaku Dekan Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Lampung, dan dosen pembimbing utama atas segala bimbingan, bantuan, saran dan nasihat, serta motivasinya yang sangat berarti bagi penulis selama penelitian hingga selesainya skripsi ini.
2. Ibu Prof. Dr. Buhani, M.Si selaku pembimbing kedua atas segala bimbingan, bantuan, saran, serta motivasinya yang sangat berarti bagi penulis selama penelitian hingga selesainya skripsi ini.
4. Bapak Rudy T Situmeang, Ph.D. selaku pembimbing akademik atas segala
bimbingan dan motivasi yang telah diberikan kepada penulis.
5. Bapak Dr. Suripto Dwi Yuwono, M.T. selaku Ketua Jurusan Kimia Fakultas
Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
6. Seluruh Staf Pengajar dan karyawan Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
7. Kedua orang tuaku tercinta, Ayah Agung Wicahyono dan Ibu Azrah, S.Pd, atas segala limpahan kasih sayang, doa restu, motivasi, semangat, nasihat,
dukungan dan pengorbanan untuk pendidikan anak-anaknya.
8. Adikku Radina Ferzya, atas segala doa, dukungan dan semangatnya yang sangat berharga bagi penulis. Semoga tahun depan bisa masuk universitas
yang diimpikan.
9. Seluruh keluarga besarku, terutama Alm. Nyik yang telah merawatku sejak kecil, atas segala limpahan kasih sayang, doa restu, nasihat, dan saran
10.Partner penelitianku Fauziyyah Mu’min Siddiq S.Si. untuk bantuan, kesabaran, keceriaan, diskusi, saran dan kritik yang telah dicurahkan.
11.Sahabat-sahabat di Kamse Fajria Faiza, Syifa Kusuma Wardani, Lolita Napatilova, Surtini Karlina Sari, Kristi Arina atas kebersamaan dan
keceriaannya selama ini. Semoga Allah SWT terus menjaga persaudaraan kita.
12.Sahabat-sahabat terbaikku sejak SMP hingga sekarang Hesti Setianingrum,
Anggi Meriska, Esika Putri Oktavira, Mariati Hutagalung, dan Sintia Maharani atas kebersamaan dan keceriaan yang terus terjaga sampai kini.
13.Sahabat-sahabat terbaikku sejak SMA di genk edelweis hingga sekarang Dwi
Jayanti, S.Pd, Herwinda, Putri Ery Yuninda, A.Md, Sri Wahyuni, A.Md.Keb, abang Eji Pramana, S.E, Wahyu Prasetyo, S.Pd, Okgi Fernanda, A.Md,
Beng-beng, M. Faris, S.st dan mas Rizal atas kebersamaan dan keceriaan yang terus terjaga sampai kini. Semoga agenda kumpul-kumpul akan terus terjalin sampai kapanpun.
14.Sahabat-sahabat terbaikku Ryzkita Prima, S.P dan Reza Asmitara terimakasih segala macam bentuk dukungan, motivasi, dan telinganya dalam
mendengarkan berbagai macam cerita yang diutarakan.
15.Kawan-kawan di Anorganisme Wynda Dwi Anggraini, S.Si, Hapin Afriani S.Si, Sevina Silvi S.Si, Widya Afriliani Wijaya S.Si, Agung Supriyanto S.Si,
Fauziyyah Mu’min Siddiq S.Si, Martha Selvina Gultom, Rini Handayani
Rotua. P, serta adik-adik satu bimbingan terima kasih untuk semua kerjasama dan bantuannya.
16.Teman-teman se-angkatan 2010, Adetia Fatmawati, Rahmat Kurniawan, Rina Rachmawati. S., S.Si, Ariyanti, M. Prasetio Ersa, M. Nurul Fajri, Chyntia
Gustianda .P, Putri Heriyani, S.Si, Nur Robiah, Putri Sari Dewi, Elly
Setiawati, Rully Prayetno, Lailatul Hasanah, Indah Aprianti, Rani Anggraini,
Maria Anggraini, Faradilla Syani, Hanif Amrulloh ZA, S.Si, Leni Astuti, S.Si dan Juni Zulhijah, terimakasih untuk persaudaraan, cerita dan kenangan yang dibina selama menempuh pendidikan di kampus.
17.Teman – teman KKN Kebangsaan di Aceh Besar, Miftah Farid Artama, S.Si, Finta, Fitria Ilmita, Bang Reza, Kak Icut, dan Bang Udin atas
18.Seluruh kawan-kawan di UKMF Natural Herman, Dica,Umi, Khairil, Sigit,
Sepria, Asti, Estu, Nafilata, Puja.
19.Sahabat-sahabat di pers mahasiswa mbak Rikawati, Gita Leviana, Vina
Oktavia, mbak Yusnaeni
20.Seluruh volunteer dan adik-adik asuh di Rumah Baca Asma Nadia (RBAN) Lampung
21.Kawan-kawan sepermainan di komunitas Farras Mardhatila, Farah Mardhatila, Encip, Nina, Kak Feri, Kak Nanda, Kak Adam, Kak Ucup,
Maspaeng, Dekavivi, Frilly, Vike, Ena, Fika, atu sophie, om yopie 22.Seluruh keluarga besar Jurusan Kimia Angkatan 2008 – 2013.
23.Seluruh karyawan/karyawati Jurusan Kimia, Mba Nora, Bunda (Instrument),
Mba Liza, Uni Kidas, Om Udin, Om Nomo, Pa Man, Ibu Kantin Cinta, Mba Win atas bimbingan, dan perhatian yang telah diberikan kepada penulis; 24.Almamater tercinta, Universitas Lampung.
25.Semua pihak yang telah membantu penulis selama kuliah, penelitian, hingga penulisan skripsi ini.
Akhir kata, penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan,
akan tetapi sedikit harapan semoga skripsi yang sederhana ini dapat berguna dan bermanfaat bagi kita semua. Amiin.
Bandar lampung, 10 Desember 2014
DAFTAR ISI
C. Proses Pengendapan Senyawa Anorganik pada Peralatan Industri………... 8
D. Faktor Pembentuk Kristal ... … 8
1. Kristalisasi ... … 9
2. Kelarutan Endapan ... ... 10
3. Derajat Lewat-Jenuh (Supersaturasi) ... ... 11
E. Kerak CaSO4 ... ... 14
1. Proses Pembentukan Kerak Kalsium Sulfat ... ... 16
2. Pengaruh Terbentuknya Kerak Kalsium Sulfat ... ... 18
F. Metode Pencegahan Terbentuknya Kerak CaSO4 ... ... 18
1. Unseeded Experiment………... 25
3. Instrumentasi PSA (Sedigraf)……….. 27
2. Pengujian Ekstrak Biji Pinang Sebagai Inhibitor dalam Pengendapan Kristal CaSO4 ……… 31
a. Penentuan Laju Pertumbuhan CaSO4 Tanpa Penambahan Inhibitor pada Konsentrasi yang Berbeda ……… 32
b. Penentuan Laju Pertumbuhan CaSO4 dengan Penambahan Inhibitor pada Konsentrasi yang Berbeda ………. 32
3. Analisa Data ... 33
IV. HASIL PENGAMATAN DAN PEMBAHASAN A. Analisis Ekstrak Biji Pinang dengan Menggunakan Spektrofotometer Infra Red (IR) ……….... 35
B. Penentuan Laju Pertumbuhan Kristal Kalsium Sulfat (CaSO4) dengan Variasi Konsentrasi Larutan Pertumbuhan dan Tanpa Penambahan Inhibitor ………..... 36
C. Penentuan Laju Pertumbuhan Kristal Kalsium Sulfat (CaSO4) dengan Variasi Konsentrasi Inhibitor dan Variasi Konsentrasi Larutan Pertumbuhan ………... 38
1. Penentuan Laju Pertumbuhan Inti Kristal Kalsium Sulfat (CaSO4) dengan Variasi Konsentrasi Inhibitor pada Larutan Pertumbuhan 0,15 M ………. 38
2. Penentuan Laju Pertumbuhan Inti Kristal Kalsium Sulfat (CaSO4) dengan Variasi Konsentrasi Inhibitor pada Larutan Pertumbuhan 0,20 M ………. 40
3. Penentuan Laju Pertumbuhan Inti Kristal Kalsium Sulfat (CaSO4) dengan Variasi Konsentrasi Inhibitor pada Larutan Pertumbuhan 0,25 M ………. 41 D. Analisis Permukaan Kerak CaSO4 Menggunakan SEM ……….… 43 E. Analisis Distribusi Ukuran Partikel CaSO4 Menggunakan PSA …..46
LAMPIRAN
DAFTAR TABEL
Tabel Halaman
DAFTAR GAMBAR
Halaman
1. Diagram Temperatur-Konsentrasi ... 12
2. Skema Umum Mekanisme Pembentukkan Deposit Kerak Air ... 17
3. Tahap Kristalisasi ... 17
4. Reaksi Hidrolis Polifosfat ... 22
5. Biji Pinang………….. ... 23
6. Struktur Asam Tanat ... 25
7. Skema Bagan SEM ... 27
8. Diagram Proses Fraksinasi Massa dalam Sendigraf ... 29
9. Diagram Alir Penelitian ... 34
10.Hasil Analisis IR Ekstrak Biji Pinang ... 35
11.Grafik Perbandingan Laju Pertumbuhan CaSO4 denganVariasi Konsentrasi Larutan Pertumbuhan dan Tanpa Penambahan Inhibitor ... 37
12.Grafik Laju Pertumbuhan CaSO4 0,15 M dengan atau Tanpa Penambahan Inhibitor Ekstrak Biji Pinang ... 38
14.Grafik Laju Pertumbuhan CaSO4 0,25 M dengan atau Tanpa
Penambahan Inhibitor Ekstrak Biji Pinang ... 42 15.Morfologi Kerak CaSO4 0,15 M dengan Metode Unseeded
Experiment dengan dan Tanpa Penambahan Ekstrak Biji Pinang
250 ppm Menggunakan SEM dengan Perbesaran 50 x ... 44 16.Morfologi Kerak CaSO4 0,15 M dengan Metode Unseeded
Experiment dengan dan Tanpa Penambahan Ekstrak Biji Pinang
250 ppm Menggunakan SEM dengan Perbesaran 500 x ... 44 17.Morfologi Kerak CaSO4 0,15 M dengan Metode Unseeded
Experiment dengan dan tanpa Penambahan Ekstrak Biji Pinang
250 ppm Menggunakan SEM dengan Perbesaran 1000 x ... 45
18.Grafik Distribusi Ukuran Partikel Kerak CaSO4 0,15 M dengan atau Tanpa Penambahan Inhibitor Ekstrak Biji Pinang 250 ppm dengan Menggunakan Metode Unseeded Experiment
1
I. PENDAHULUAN
A. Latar Belakang
Kerak adalah suatu deposit keras dari senyawa anorganik yang sebagian besar
terjadi pada permukaan peralatan penukar panas yang disebabkan oleh pengendapan partikel mineral dalam air (Bhatia, 2003).
Penyebab terbentuknya endapan kerak pada pipa-pipa di industri adalah
terdapatnya senyawa-senyawa pembentuk kerak dalam air dengan jumlah yang melebihi kelarutannya pada keadaan kesetimbangan sehingga terbentuk kristal. Kristal tersebut akan memperkecil diameter dan menghambat aliran fluida pada
sistem pipa tersebut. Terganggunya aliran fluida menyebabkan tekanan semakin tinggi sehingga kemungkinan pipa mengalami kerusakan (Asnawati, 2001).
Saat ini pengolahan air dan pencegahan pembentukan kerak umumnya dilakukan
secara kimiawi seperti resin penukar ion dan penambahan inhibitor kerak. Metode kimiawi ini dapat mengubah sifat kimia larutan sehingga tidak cukup aman untuk digunakan pada rumah tangga dan industri makanan. Selain itu investasinya yang
2
Berbagai metode untuk mengontrol pembentukan kerak telah banyak dilakukan,
antara lain dengan cara pelunakan dan pembebasan mineral air, akan tetapi penggunaan air bebas mineral dalam industri-industri besar membutuhkan biaya
yang cukup tinggi. Hal ini karena sebagian besar biaya ditujukan untuk menyediakan air bebas mineral. Metode lain yang dapat dilakukan untuk
mengontrol pembentukan kerak yaitu menggunakan asam untuk menurunkan pH
larutan, rentang pH efektif untuk mencegah pengendapan kerak adalah 6,5 sampai 8,0. Namun menghilangkan kerak menggunakan asam dengan konsentrasi tinggi
tidak efektif karena dapat meningkatkan laju korosi dan konduktivitas, serta mempunyai tingkat bahaya yang cukup tinggi dalam penanganannya (Lestari, 2008).
Berdasarkan beberapa kelemahan tersebut di atas, maka saat ini telah
dikembangkan salah satu metode efektif yang dapat digunakan untuk mengurangi laju pertumbuhan kerak yaitu dengan menginjeksikan bahan-bahan kimia
pencegah kerak (scale inhibitor) ke dalam air formasi. Salah satu prinsip kerja
dari scale inhibitor yaitu proses penjebakan antara inhibitor kerakdengan
unsur-unsur pembentuk kerak. Senyawa hasil penjebakan yang terbentuk larut dalam air
sehingga menutup kemungkinan pertumbuhan kristal yang besar serta dapat mencegah kristal kerak untuk melekat pada permukaan pipa. Adapun
faktor-faktor yang perlu dipertimbangkan dalam pemilihan scale inhibitor adalah :
keefektifan, kestabilan, kecocokan dan biaya. Sifat dari scale inhibitor yang
sangat diharapkan stabil dalam air pada waktu yang panjang dan temperatur yang
3
Pada umumnya terdapat dua macam scale inhibitor yang digunakan yaitu scale
inhibitor anorganik dan organik. Scale inhibitor anorganik yang banyak
digunakan adalah jenis fosfat, kondesat fosfat dan dehidrat fosfat, sedangkan
untuk scale inhibitor organik yang biasa digunakan adalah organofosfonat,
organofosfat ester dan polimer-polimer organik. Menurut penelitian yang telah dilakukan sebelumnya, Asnawati (2001) menggunakan inhibitor kerak organik
seperti organofosfonat efektif untuk kerak CaCO3, organofosfat ester efektif untuk kerak CaSO4, dan polimer-polimer organik efektif untuk kerak CaCO3, CaSO4,
dan BaSO4. Namun Inhibitor kerak tersebut umumnya digunakan pada konsentrasi tinggi sehingga dapat meningkatkan laju korosi, menaikkan nilai konduktivitas dan total padatan terlarut. Hal-hal inilah yang mendasari untuk
dilakukan penelitian lebih lanjut untuk mengetahui inhibitor kerak baru yang lebih efektif jika digunakan pada konsentrasi rendah dan suhu tinggi.
Proses pengendapan senyawa-senyawa anorganik biasa terjadi pada
peralatan-peralatan industri yang melibatkan air garam seperti industri minyak dan gas, proses desalinasi dan ketel serta industri kimia (Badr dan Yassin, 2007; Lestari et
al., 2004). Hal ini disebabkan karena terdapatnya unsur-unsur anorganik
pembentuk kerak seperti logam kalsium dalam jumlah yang melebihi
kelarutannya pada keadaan kesetimbangan. Terakumulasinya endapan-endapan
dari senyawa anorganik tersebut dapat menimbulkan masalah seperti kerak (Weijnen et al., 1993; Maley, 1999). Oleh karena itu, pada penelitian ini
digunakan ekstrak biji pinang sebagai inhibitor yang diharapkan mampu
4
Berdasarkan penelitian yang telah dilakukan sebelumnya (Asmarani, 2011),
diketahui bahwa asam tanat (tanin) yang terdapat pada tanaman, seperti tanaman gambir dapat digunakan sebagai inhibitor pertumbuhan kerak kalsium karbonat.
Seperti halnya gambir, senyawa yang dominan pada biji pinang adalah tanin dan alkaloid.
Menurut Panjaitan (2008), biji pinang mengandung 0,3 – 0,6 % alkaloid, seperti
arekolin (C6H13NO2), arekolidine, arekain guvakolin, guvasine, dan isoguvasine. Selain itu juga mengandung red tanin 15 %, lemak 14 %, kanji dan resin. Biji segar mengandung kira-kira 50 % lebih banyak alkaloid dibandingkan biji yang
telah di proses.
5
B. Tujuan Penelitian
Tujuan dilakukannya penelitian ini adalah:
1. Mengetahui pengaruh penambahan senyawa ekstrak biji pinang sebagai inhibitor CaSO4 pada konsentrasi yang berbeda.
2. Mendapatkan perbandingan efektifitas penambahan senyawa ekstrak biji
pinang sebagai inhibitor kerak CaSO4.
C. Manfaat Penelitian
Hasil penelitian ini memberikan pengetahuan mengenai pencegahan timbulnya kerak, dan dapat dikembangkan untuk memperoleh inhibitor yang mampu
6
II. TINJAUAN PUSTAKA
A. Kerak
Kerak didefinisikan sebagai suatu deposit dari senyawa-senyawa anorganik yang
terendapkan dan membentuk timbunan kristal pada permukaan suatu substansi (Kemmer, 1979). Kerak terbentuk karena tercapainya keadaan larutan lewat jenuh. Dalam keadaan larutan lewat jenuh beberapa molekul akan bergabung
membentuk inti kristal. Inti kristal ini akan terlarut kembali jika ukurannya lebih kecil dari ukuran partikel kritis sementara itu kristal-kristal akan berkembang bila ukurannya lebih besar dari partikel kritis. Apabila ukuran inti kristal menjadi
lebih besar dari inti kritis, maka akan mulailah pertumbuhan kristal, dari kristal kecil membentuk kristal dengan ukuran yang lebih besar (penebalan lapisan
kerak). Kristal-kristal yang terbentuk mempunyai muatan ion lebih rendah dan cenderung untuk menggumpal sehingga terbentuklah kerak (Lestari, 2008; Hasson dan Semiat, 2005).
Kerak juga dapat terbentuk karena campuran air yang digunakan tidak sesuai. Campuran air tersebut tidak sesuai jika air berinteraksi secara kimia dan mineralnya mengendap jika dicampurkan. Contoh tipe air yang tidak sesuai
7 Campuran air ini menyebabkan terbentuknya endapan CaSO4 (Badr and Yassin,
2007).
Komponen khas kerak yang sering dijumpai adalah sebagai berikut :
(i) Kalsium sulfat (CaSO4), (ii) Kalsium karbonat (CaCO3: turunan dari kalsium
bikarbonat), (iii) Kalsium dan seng fosfat, (iv) Kalsium fosfat, sejumlah besar kalsium dan ortofosfat, (v) Silika dengan konsentrasi tinggi, (vi) Besi dioksida,
senyawa yang disebabkan oleh kurangnya kontrol korosi atau alami berasal dari besi yang teroksidasi, (vii) Besi fosfat, senyawa yang disebabkan karena
pembentukan lapisan film dari inhibitor fosfat, (viii) Mangan dioksida, mangan
teroksidasi tingkat tinggi, (ix) Magnesium silika, silika dan magnesium pada konsentrasi tinggi dengan pH tinggi, (x) Magnesium karbonat, magnesium dengan
konsentrasi tinggi dan pH tinggi serta CO2 tinggi (Lestari, 2008; Nunn, 1997).
B. Mekanisme Pembentukan Kerak
Pembentukan kerak dan deposit endapan lain adalah proses kristalisasi yang
kompleks. Kecepatan pembentukan lapisan awal kerak dan kecepatan pertumbuhan yang berikutnya ditentukan melalui interaksi dari beberapa kecepatan proses antara lain: nukleasi, difusi, reaksi kimia, kesesuaian pola
geometris molekul-molekul dan atom-atom kristal kerak. Walaupun tidak semua, unsur pokok pembentukan kerak mineral adalah kebalikan dapat larut, yaitu
kelarutannya cenderung turun terhadap kenaikan suhu. Oleh karena itu, bila larutan lewat jenuh bersinggungan dengan permukaan transfer panas, mineral
8 Pada saat larutan menjadi lewat jenuh dan nukleasi terjadi, kondisi ini sangat
cocok dan ideal untuk pertumbuhan kristal partikel kerak. Senyawa-senyawa yang dibawa air seperti kalsium sulfat, magnesium sulfat, barium sulfat, magnesium
karbonat, kalsium karbonat, silikat, dan lain-lain dapat mengendap dan membentuk kerak sebagai akibat dari beda tekanan, perubahan temperatur, perubahan pH, dan lain-lain. Perubahan-perubahan tersebut terjadi dalam
peralatan-peralatan proses, penukar panas, evaporator, boiler, cooling tower, dan
lain-lain (Salimin dan Gunandjar, 2007).
C. Proses Pengendapan Senyawa Anorganik Pada Peralatan Industri
Proses pengendapan senyawa-senyawa anorganik biasa terjadi pada
peralatan-peralatan industri yang melibatkan air garam seperti industri minyak dan gas, proses desalinasi dan ketel serta industri kimia. Hal ini disebabkan karena
terdapatnya unsur-unsur anorganik pembentuk kerak seperti logam kalsium dalam
jumlah yang melebihi kelarutannya pada keadaan kesetimbangan.
Terakumulasinya endapan-endapan dari senyawa anorganik tersebut dapat menimbulkan masalah seperti kerak (Weijnen et al.,1983; Maley, 1999).
D. Faktor Pembentuk Kristal
Ukuran kristal yang terbentuk selama pengendapan, tergantung pada dua faktor
penting, yaitu laju pembentukan inti (nukleasi) dan laju pertumbuhan kristal. Laju pembentukan inti dapat dinyatakan dengan jumlah inti yang terbentuk dalam
9 terbentuk yang terdiri dari partikel-partikel kecil. Laju pembentukan inti
tergantung pada derajat lewat jenuh dari larutan. Semakin tinggi derajat lewat jenuh maka semakin besar kemungkinan untuk membentuk inti baru sehingga
akan semakin besar laju pembentukan inti. Laju pertumbuhan kristal merupakan faktor penting lainnya yang akan mempengaruhi ukuran kristal yang terbentuk selama pengendapan berlangsung. Semakin tinggi laju pertumbuhan maka kristal
yang terbentuk akan besar. Laju pertumbuhan kristal juga tergantung pada derajat lewat jenuh (Svehla, 1990).
1. Kristalisasi
Menurut Brown (1978), kristalisasi adalah suatu proses pembentukan kristal
dari larutannya dan kristal yang dihasilkan dapat dipisahkan secara mekanik. Pertumbuhan kristal dapat terjadi bila konsentrasi suatu zat terlarut dalam larutannya melewati kadar kelarutan lewat jenuhnya pada suhu tertentu.
Kondisi kelarutan lewat jenuh dapat diperoleh dengan jalan pendinginan larutan pekat panas, penguapan larutan encer, kombinasi proses penguapan dan pendinginan, dan dengan penambahan zat lain untuk menurunkan
kelarutannya. Kristalisasi memiliki dua tahap proses, yaitu tahap
pembentukan inti yang merupakan tahap mulai terbentuknya zat padat baru,
10 2. Kelarutan Endapan
Endapan adalah zat yang memisahkan diri sebagai suatu fase padat dari
larutan. Endapan dapat berupa kristal atau koloid, dan dapat dikeluarkan dari larutan dengan penyaringan atau pemusingan. Endapan terbentuk jika larutan
menjadi terlalu jenuh dengan zat bersangkutan. Kelarutan (S) suatu endapan, menurut definisi adalah sama dengan konsentrasi molar dari larutan jenuhnya.
Kelarutan tergantung berbagai kondisi, seperti temperatur, tekanan, konsentrasi, bahan-bahan lain dalam larutan itu dan pada komposisi pelarutnya.
Kelarutan tergantung juga pada sifat dan konsentrasi zat-zat lain, terutama
ion-ion dalam campuran itu. Ada perbedaan yang besar antara efek dari ion sejenis dan ion asing. Ion sejenis adalah suatu ion yang juga merupakan salah satu bahan endapan. Umumnya dapat dikatakan bahwa suatu endapan
berkurang banyak sekali jika salah satu ion sejenis terdapat dalam jumlah berlebihan, meskipun efek ini mungkin diimbangi dengan pembentukan suatu
kompleks yang dapat larut dengan ion sejenis yang berlebihan itu. Dengan adanya ion asing, kelarutan endapan bertambah, tetapi pertambahan ini umumnya sedikit, kecuali jika terjadi reaksi kimia (seperti pembentukan
kompleks atau reaksi asam-basa) antara endapan dan ion asing, pertambahan kelarutannya menjadi lebih besar.
Hasil kali kelarutan memungkinkan kita untuk menerangkan dan juga
11 ketika kesetimbangan tercapai antara fase padat dari garam yang hanya
sedikit larut dalam larutan itu. Jika hasil kali ion berbeda dengan hasil kali kelarutan, maka sistem itu akan berusaha menyesuaikan, sehingga hasil kali
ion mencapai nilai hasil kali kelarutan. Jadi, jika hasil kali ion dengan sengaja dibuat lebih besar dari hasil kali kelarutan, penyesuaian oleh sistem mengakibatkan mengendapnya garam larutan. Sebaliknya, jika hasil kali ion
dibuat lebih kecil dari hasil kali kelarutan, kesetimbangan dalam sistem dicapai kembali dengan melarutnya sebagian garam padat ke dalam larutan.
Hasil kali kelarutan menentukan keadaaan kesetimbangan, tetapi tidak memberikan informasi tentang laju ketika kesetimbangan itu terjadi.
Kelebihan zat pengendap yang terlalu banyak dapat mengakibatkan sebagian
endapan melarut kembali, sebagai akibat bertambahnya efek garam atau akibat pembentukan ion kompleks. Dalam hal ini hasil kali kelarutan dari kalsium sulfat pada temperatur ruang sebesar 2,3 x 10-4 mol/L (Svehla, 1990).
3. Derajat Lewat-Jenuh (Supersaturasi)
Larutan lewat jenuh (Gambar 1) adalah larutan yang mengandung zat terlarut lebih besar daripada yang dibutuhkan pada sistem kesetimbangan larutan jenuh. Kondisi kelarutan lewat jenuh dapat diperoleh dengan jalan
pendinginan larutan pekat panas, penguapan larutan encer, kombinasi proses penguapan dan pendinginan serta dengan penambahan zat lain untuk
12
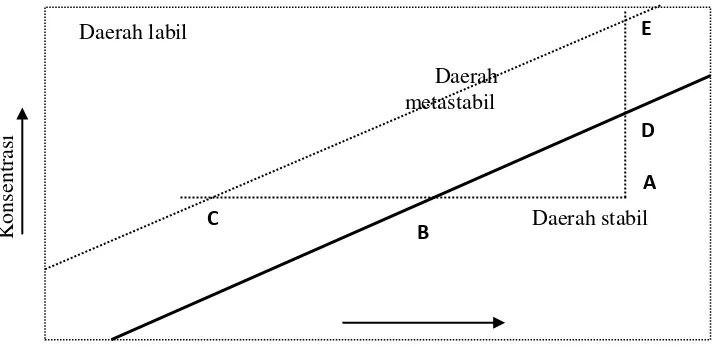
Gambar 1. Diagram temperatur – konsentrasi (Wafiroh, 1995).
Garis tebal adalah kelarutan normal untuk zat terlarut dalam pelarut. Garis
putus-putus adalah kurva lewat jenuh, posisinya dalam diagram tergantung pada zat-zat pengotor. Pada diagram di atas, kondisi kelarutan dibagi dalam tiga bagian yaitu daerah stabil, metastabil, dan daerah labil. Daerah stabil adalah daerah larutan
yang tidak mengalami kristalisasi. Daerah yang memungkinkan terjadinya
kristalisasi tidak spontan adalah daerah metastabil, sedangkan daerah labil adalah
daerah yang memungkinkan terjadinya kristalisasi secara spontan.
Pada diagram temperatur – konsentrasi, jika suatu larutan yang terletak pada titik A dan didinginkan tanpa kehilangan volume pelarut (garis ABC), maka
pembentukan inti secara spontan tidak akan terjadi sampai kondisi C tercapai. Larutan lewat jenuh dapat juga tercapai dengan mengurangi sejumlah volume palarut dari pelarutnya dengan proses penguapan. Hal ini ditunjukkan dengan
13 Menurut Lestari (2008) faktor-faktor yang mempengaruhi timbulnya kerak antara
lain yaitu :
1. Kualitas Air
Pembentukan kerak dipengaruhi oleh konsentrasi komponen-komponen pembentuk kerak (kesadahan kalsium, konsentrasi fosfat), pH, dan konsentrasi bahan penghambat kerak dalam air.
2. Temperatur Air
Pada umumnya komponen pembentuk kerak cenderung mengendap atau
menempel sebagai kerak pada temperatur tinggi. Hal ini disebabkan karena kelarutannya menurun dengan naiknya temperatur. Laju pengerakan mulai meningkat pada temperatur air 50 oC atau lebih dan
kadang-kadang kerak terbentuk pada temperatur air diatas 60 oC. 3. Laju Alir Air
Laju pembentukan kerak akan meningkat dengan turunnya laju alir sistem.
Dalam kondisi tanpa pemakaian penghambat kerak, pada sistem dengan laju alir 0,6 m/detik maka laju pembentukan kerak hanya seperlima
dibanding pada laju alir air 0,2 m /detik.
Beberapa reaksi yang menunjukkan terbentuknya endapan (deposit) antara lain (Halimatuddahliana, 2003) :
1. CaCl2 + Na2SO4 CaSO4 + 2 NaCl Kalsium sulfat terdapat dalam air terkontaminasi 2. BaCl2 + Na2SO4 BaSO4 + 2 NaCl
14 3. Ca(HCO3)2 CaCO3 + CO2 + H2O
Kalsium karbonat terdapat dalam air terkontaminasi karena penurunan tekanan, panas dan agitasi (pengadukan).
Dibawah ini adalah tiga prinsip mekanisme pembentukan kerak (Badr dan Yassin,
2007) :
1. Campuran dua air garam yang tidak sesuai (umumnya air formasi
mengandung banyak kation seperti kalsium, barium, dan stronsium, bercampur dengan sulfat yang banyak terdapat dalam air laut, menghasilkan kerak sulfat seperti CaSO4)
Ca2+ (Sr2+ atau Ba2+) + SO
42- CaSO4 (SrSO4 atau BaSO4)
2. Penurunan tekanan dan kenaikan temperatur air garam, yang akan menurunkan kelarutan garam (umumnya mineral yang paling banyak mengendap adalah kerak karbonat seperti CaCO3)
Ca(HCO3)2 CaCO3 + CO2 + H2O
3. Penguapan air garam, menghasilkan peningkatan konsentrasi garam
melebihi batas kelarutan dan membentuk endapan garam
E. Kerak CaSO4
Kalsium adalah logam putih perak dan agak lunak yang diproduksi dengan elektrolisis garam kalsium klorida (CaCl2). Unsur tersebut melebur pada 845 °C,
15 kalsium (II), Ca2+, dalam larutan-larutan air. Garam-garamnya biasa berupa
bubuk putih dan membentuk larutan yang tak berwarna kecuali anionnya berwarna (Saito, 1996; Svehla, 1990).
Berikut ini adalah reaksi menunjukkan terbentuknya endapan dan kerak kalsium
sulfat :
CaCl2(aq) + Na2SO4(aq) CaSO4(s) + 2 NaCl(aq)
Ca2+ + SO42- CaSO4
Nilai hasil kali kelarutan endapan kalsium sulfat pada suhu 25 dan 80 oC adalah 2,3 x 10-4 dan 9 x 10-4. Kalsium membentuk kerak keras ketika berkombinasi
dengan sulfat. Kerak CaSO4 kemudian dapat dihindari jika suhu operasi
dipertahankan dibawah 421 oC dan dengan memberikan inhibitor kerak (Al-Sofi
et al., 1994).
CaSO4 merupakan salah satu jenis kerak non alkali. Kerak ini dikenal dengan tiga
bentuk yaitu anhidrat (CaSO4) stabil pada temperatur 98 oC, hemihidrat
(CaSO4.1/2H2O) stabil antara 98-170 oC dan dihidrat (CaSO4.2H2O). Semua ini
terbentuk karena adanya perbedaan temperatur dan konsentrasi air laut. Pada air sirkulasi dengan kesadahan kalsium tinggi, kalsium sulfat (CaSO4.2H2O) dapat terendapkan sesuai dengan temperatur air. Kelarutan CaSO4 bertambah dengan
16
1. Proses Pembentukan Kerak CaSO4
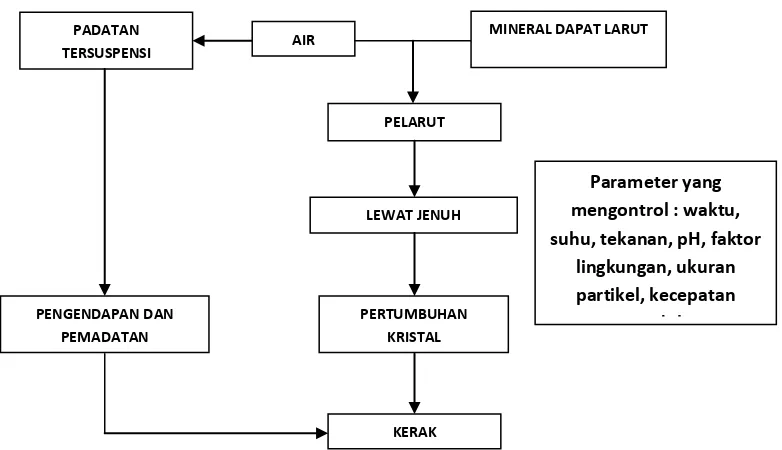
Pembentukan kerak CaSO4 (Gambar 2) merupakan proses kristalisasi.
Kristalisasi adalah peristiwa pembentukan partikel-partikel zat padat dalam suatu fase homogen. Kristalisasi dari larutan dapat terjadi jika padatan
terlarut dalam keadaan berlebih (di luar kesetimbangan), maka sistem akan mencapai kesetimbangan dengan cara mengkristalkan padatan terlarut (Dewi
dan Ali, 2003).
Kristalisasi senyawa dalam larutan langsung pada permukaan transfer panas dimana kerak terbentuk memerlukan tiga faktor simultan yaitu konsentrasi lewat jenuh (supersaturation), nukleasi (terbentuknya inti kristal) dan waktu
kontak yang memadai. Pada saat terjadi penguapan, kondisi jenuh (saturation) dan kondisi lewat jenuh (supersaturation)dicapai secara
simultan melalui pemekatan larutan dan penurunan daya larut setimbang saat
kenaikan suhu menjadi suhu penguapan. Pembentukan inti kristal terjadi saat larutan jenuh, dan kemudian sewaktu larutan melewati kondisi lewat jenuh
maka terjadilah pertumbuhan kristal, ukuran kristal bertambah besar dan selanjutnya melalui gaya gravitasi kristal jatuh dan terpisah dari larutan. Mekanisme tersebut memerlukan waktu kontak antara larutan dan permukaan
17
Gambar 2. Skema umum mekanisme pembentukan deposit kerak air (Salimin dan Gunandjar, 2007).
Penjelasan sederhana pembentukan kerak (kristalisasi) ditunjukkan pada Gambar 3.
Gambar 3. Tahapan kristalisasi (Zeiher et al., 2003).
Kristal suhu, tekanan, pH, faktor
lingkungan, ukuran partikel, kecepatan
18
2. Pengaruh Terbentuknya Kerak CaSO4
Endapan kerak merupakan salah satu masalah penting dan umumnya
terbentuk di pipa-pipa peralatan industri. Contohnya pada sistem injeksi air yang umumnya ada di ladang minyak, banyaknya kerak akan menurunkan
produksi minyak dan gas (Badr dan Yassin, 2007). Pada penelitiannya, Halimatuddahliana (2003) menyimpulkan bahwa pembentukan kerak pada
operasi produksi minyak bumi dapat mengurangi produktivitas sumur akibat tersumbatnya pipa, pompa, dan katub.
Kerak yang terbentuk pada pipa-pipa peralatan industri akan memperkecil
diameter dan menghambat aliran fluida pada sistem pipa tersebut. Terganggunya
aliran fluida menyebabkan suhu semakin naik dan tekanan semakin tinggi sehingga kemungkinan pipa akan pecah (Asnawati, 2001). Endapan kerak yang banyak dijumpai pada peralatan-peralatan industri minyak dan gas, proses
desalinasi, ketel serta industri kimia salah satunya adalah kerak CaSO4 (Badr dan Yassin, 2007; Lestari, 2000). Oleh karena itu, perlu dilakukan pencegahan
pembentukan kerak untuk mengurangi atau menghilangkan kerak kalsium sulfat yang terdapat pada peralatan-peralatan industri.
F. Metode Pencegahan Terbentuknya Kerak CaSO4
19 1. Pengendalian pH
Pengendalian pH dengan penginjeksian asam (asam sulfat atau asam klorida) telah lama diterapkan untuk mencegah pengerakan oleh garam-garam kalsium,
garam logam bivalen dan garam fosfat. Kelarutan bahan pembentukan kerak biasanya meningkat pada pH yang lebih rendah. Pada pH 6,5 atau kurang, korosi pada baja karbon, tembaga dan paduan tembaga dengan cepat akan
berlangsung pada pH efektif untuk mencegah pengendapan kerak yaitu pada pH 7,0 sampai 7,5. Oleh karena itu, suatu sistem otomatis penginjeksian asam
diperlukan untuk mengendalikan pH secara tepat. Lagi pula, asam sulfat dan asam klorida mempunyai tingkat bahaya yang cukup tinggi dalam
penanganannya.
Untuk mencegah terjadinya kerak pada air yang mengandung kesadahan tinggi perlu adanya pelunakan dengan menggunakan kapur dan soda abu
(pengolahan kapur dingin). Masalah kerak tidak akan di jumpai apabila
dipakai air bebas mineral karena seluruh garam-garam yang terlarut dapat dihilangkan. Oleh karena itu pemakaian air bebas mineral merupakan metoda yang tepat untuk menghambat kerak di dalam suatu sistem dengan
pembebanan panas tinggi dimana pengolahan konvensional dengan bahan penghambat kerak tidak berhasil (Lestari et al., 2004). Namun penggunaan air
20 2. Penggunaan Inhibitor Kerak
Pada umumnya, inhibitor kerak adalah bahan kimia yang menghentikan atau
mencegah terbentuknya kerak bila ditambahkan pada konsentrasi yang kecil pada air (Halimatuddahliana, 2003). Penggunaan bahan kimia ini sangat
menarik, karena dengan dosis yang sangat rendah dapat mencukupi untuk mencegah kerak dalam periode yang lama (Cowan, 1976). Salah satu prinsip
kerja dari scale inhibitor yaitu pembentukan senyawa kompleks (kelat) antara
inhibitor kerakdengan unsur-unsur pembentuk kerak. Senyawa kompleks yang terbentuk larut dalam air sehingga menutup kemungkinan pertumbuhan
kristal yang besar (Patton, 1981). Biasanya, penggunaan bahan kimia
tambahan untuk mencegah pembentukan kerak didukung dengan penggunaan
bola-bola spons untuk membersihkan secara mekanis permukaan bagian dalam pipa.
Terdapat beberapa syarat-syarat yang harus dimiliki senyawa kimia sebagai inhibitor kerak yaitu :
1. Inhibitor kerak harus menunjukkan kestabilan termal yang cukup dan efektif untuk mencegah terbentuknya air sadah dari pembentukan kerak. 2. Inhibitor kerak harus dapat merusak struktur kristal dan padatan
tersuspensi lain yang mungkin akan terbentuk.
3. Inhibitor kerak juga harus memiliki tingkat keamanan yang tinggi dalam
21 Mekanisme kerja inhibitor kerak terbagi menjadi dua, yaitu :
1. Inhibitor kerak dapat teradsorpsi pada permukaan kristal kerak pada saat mulai terbentuk. Inhibitor merupakan kristal yang besar yang dapat
menutupi kristal yang kecil dan menghalangi pertumbuhan selanjutnya. 2. Bahan kimia dapat dengan mudah mencegah menempelnya suatu
partikel-partikel pada permukaan padatan (Suharso et al., 2007).
Pada umumnya inhibitor kerak yang digunakan di ladang-ladang minyak atau pada peralatan industri dibagi menjadi dua macam yaitu inhibitor kerak anorganik dan inhibitor kerak organik. Senyawa anorganik fosfat yang umum digunakan
sebagai inhibitor adalah kondesat fosfat dan dehidrat fosfat. Pada dasarnya bahan-bahan kimia ini mengandung grup P-O-P dan cenderung untuk melekat
pada permukaan kristal. Sedangkan inhibitor kerak organik yang biasa digunakan adalah organofosfonat, organofosfat ester dan polimer-polimer organik (Asnawati, 2001). Inhibitor kerak yang pernah digunakan yaitu polimer-polimer yang larut
dalam air dan senyawa fosfonat.
Salah satu inhibitor kerak dari polimer-polimer yang larut dalam air yaitu polifosfat. Polifosfat merupakan inhibitor kerak yang murah namun
keefektifannya terbatas. Keunggulan polifosfat sebagai inhibitor kerak CaSO4
antara lain karena kemampuannya untuk menyerap pada permukaan kristal yang mikroskopik, menghambat pertumbuhan kristal pada batas konsentrasi rendah dan
strukturnya yang mampu merusak padatan tersuspensi. Hal ini dapat mencegah pertumbuhan kristal lebih lanjut, atau setidaknya memperlambat proses
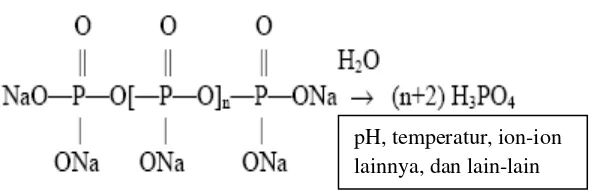
22 terhidrolisis pada temperatur di atas 90 °C menghasilkan ortofosfat (Al-Deffeeri,
2006). Reaksi hidrolisis polifosfat (Gambar 4) merupakan fungsi dari temperatur, pH, waktu, dan adanya ion-ion lain.
Gambar 4. Reaksi hidrolisis polifosfat (Gill, 1999).
Ortofosfat yang dihasilkan dapat menyebabkan menurunnya kemampuan untuk
menghambat pertumbuhan kerak dan menyebabkan terbentuknya kerak baru dari presipitasi kalsium fosfat (Gill, 1999), sehingga penggunaan polifosfat sebagai
inhibitor kerak hanya efektif pada temperatur rendah (Al-Deffeeri, 2006).
G. Tanaman Pinang dan Kandungan di Dalamnya
Pinang sirih (Areca catechu L) merupakan salah satu tanaman obat yang banyak
dimanfaatkan untuk tujuan komersil karena memiliki nilai ekonomis yang tinggi dalam berbagai bidang, hanya belum banyak dikelola. Biji Pinang mengandung
0,3 – 0,6 % alkaloid, seperti arekolin (C6H13NO2), arekolidine, arekain guvakolin, guvasine, dan isoguvasine. Selain itu juga mengandung red tanin 15 %, lemak 14 %, kanji dan resin. Biji segar mengandung kira-kira 50 % lebih banyak alkaloid
dibandingkan biji yang telah dproses (Sugianto, 2010).
23 Tanin adalah salah satu senyawa yang terkandung dalam buah pinang yang
kadarnya cukup tinggi. Tanin diperoleh dengan cara ekstraksi dengan pelarut air dan etanol karena tanin dapat larut dalam pelarut tersebut. Tanin merupakan
senyawa yang sangat penting penggunaannya dalam bidang kesehatan dan bidang industri (Suryadi, 1984).
Kandungan dan khasiat tanaman pinang dapat dijadikan tanaman pagar, penghijauan, bahan bangunan, dan hiasan, bagian-bagian tanamannya sangat
berkhasiat menyembuhkan beberapa penyakit. Pinang terutama ditanam untuk dimanfaatkan bijinya (Syukur, 2009).
Gambar 5. Biji pinang
Klasifikasi Tanaman Pinang :
Regnum : Plantae
Divisi : Magnoliophyta
Kelas : Liliopsida
Ordo : Arecaceae
Genus : Areca
24
H. Komponen Kimia Biji Pinang
Biji buah pinang mengandung alkaloid, seperti arekolin (C8H13NO2),
arekolidine, arekain, guvakolin, guvasine dan isoguvasine, tanin terkondensasi, tannin terhidrolisis, flavan, senyawa fenolik, asam galat, getah, lignin, minyak
menguap dan tidak menguap, serta garam (Wang dan Lee, 1996). Nonaka (1989) menyebutkan bahwa biji buah pinang mengandung proantosianidin, yaitu suatu
tannin terkondensasi yang termasuk dalam golongan flavonoid. Proantosianidin mempunyai efek antibakteri, antivirus, antikarsinogenik, inflamasi, anti-alergi, dan vasodilatasi (Fine, 2000).
I. Asam Tanat
Asam tanat (Gambar 6) merupakan unsur dasar dalam zat warna kimia tanaman. Asam tanat banyak terdapat dalam kayu oak, walnut, mahogani, dan gambir.
Asam tanat merupakan salah satu golongan tanin terhidrolisis dan termasuk asam lemah. Rumus kimia dari asam tanat adalah C41H32O26. Pusat molekul dari asam
tanat adalah glukosa, dimana terjadi esterifikasi gugus hidroksil dari karboksilat dengan gugus asam galat. Ikatan ester dari asam tanat mudah mengalami hidrolisis dengan bantuan katalis asam, basa, enzim, dan air panas. Hidrolisis
25
Gambar 6. Struktur Asam Tanat (Hagerman, 2002).
H. Analisis Menggunakan Unseeded Experiment, SEM dan Instrument PSA
Pada penelitian ini dilakukan beberapa analisis terhadap kristal CaSO4 yang
terbentuk. Analisis tersebut meliputi analisis seeded dan unseeded experiment,
analisis morfologi permukaan kristal CaSO4 menggunakan SEM dan analisis distribusi ukuran partikel menggunakan PSA. Hal ini bertujuan untuk mengetahui
seberapa efektif ekstrak biji pinang dalam menghambat pembentukan kerak CaCO3.
1. Unseeded Experiment
Unseeded Experiment merupakan salah satu metode pembentukan kristal
dengan cara tanpa menambahkan bibit kristal ke dalam larutan
pertumbuhan. Hal ini dilakukan untuk melihat laju pertumbuhan kerak kalsium sulfatsetelah ditambahkan senyawa ekstrak biji pinang dengan
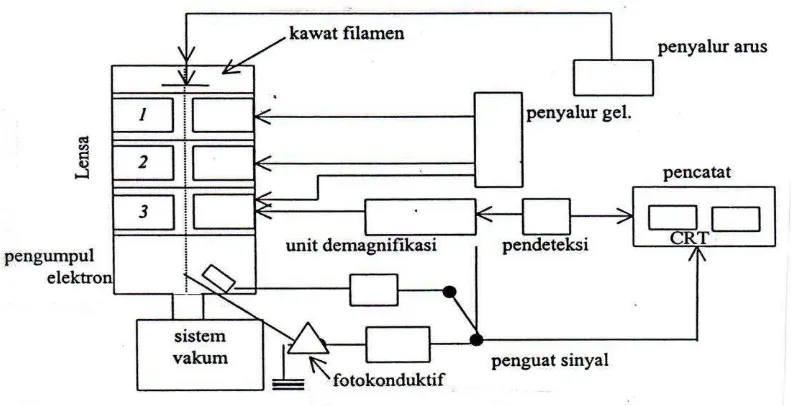
26 2. Instrumentasi Scanning Electron Mycroscopy (SEM)
SEM adalah salah satu jenis mikroskop elektron yang dapat mengamati dan menganalisis karakteristik struktur mikro dari bahan padat yang
konduktif maupun yang nonkonduktif. Sistem pencahayaan pada SEM menggunakan radiasi elektron yang mempunyai λ = 200 – 0,1 Å, daya pisah (resolusi) yang tinggi sekitar 5 nm sehingga dapat dicapai
perbesaran hingga ± 100.000 kali (Gambar 7) dan menghasilkan gambar atau citra yang tampak seperti tiga dimensi karena mempunyai depth of
field yang tinggi. Sehingga SEM mampu menghasilkan gambar atau
citra yang lebih baik dibandingkan dengan hasil mikroskop optik.
Aplikasi mikroskop elektron ini tidak hanya terbatas pada analisis logam
dan paduan di bidang metalurgi, melainkan dapat diaplikasikan di berbagai bidang lain, seperti farmasi, pertanian, biologi, kedokteran dan industri bahan elektronika, komponen mesin serta pesawat terbang.
Pada prinsipnya mikroskop elektron dapat mengamati morfologi,
struktur mikro, komposisi, dan distribusi unsur. Untuk menentukan komposisi unsur secara kualitatif dan kuantitatif perlu dirangkaikan satu perangkat alat Energy Dispersive X-ray Spectrometer (EDS)atau
Wavelength Dispersive X-ray Spectrometer (WDS)(Handayani et al.,
27
Gambar 7. Skema Bagan SEM (Gabriel, 1985).
4. Instrumentasi Particle Size Analyzer (Sedigraf)
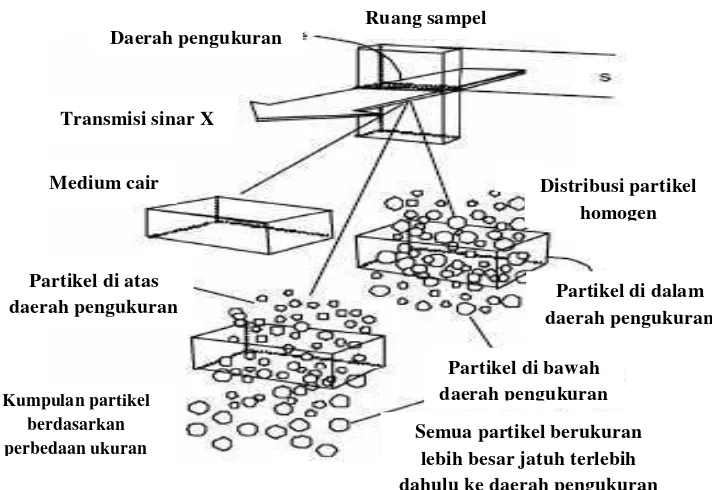
Metode sedigraf digunakan untuk menentukan distribusi ukuran partikel
yang secara luassudah dipakai dalam berbagai aplikasi sejak tahun 1967. Instrumentasi ini sudah melalui pembuktian dalam kecepatan,
kemampuan penanganan sampel, dan reduksi data dan presentasi sejak diperkenalkan. Dasar metode analisis, pengukuran partikel dengan
mengukur kecepatan dan penentuan fraksinasi massa dengan kerelatifan absorbsi sinar-X pada energi yang rendah.
Sedigraf menggunakan sinar-X sebagai tanda horizontal tipis untuk
mengukur konsentrasi partikel massa secara langsung dalam medium cairan. Ini dilakukan pada pengukuran pertama intensitas massa, Imax dari garis dasar atau keterangan atau informasi yang ditransmisikan
28 berupa padatan dimasukkan ke wadah cairan dan dicampur sampai
penyebaran aliran suspensi sampel berupa padatan homogen dan penyebaran cairan dipompa melalui sel.
Sampel berupa padatan lebih banyak mengabsorbsi sinar-X daripada
cairan, oleh karena itu transmisi sinar-X dikurangi. Sejak pencampuran suspensi yang homogen, intensitas diasumsikan sebagai nilai konstan Imin
untuk transmisi sinar-X dalam skala pengurangan yang penuh.
Aliran pencampuran dihentikan dan penyebaran yang homogen dimulai untuk menyelesaikan pentransmisian intensitas sinar-X yang dimonitor pada depth - s. Selama proses sedimentasi, partikel yang besar
menempati tempat pertama di bawah zona pengukuran dan pada akhirnya, semua partikel menempati level ini dan yang tertinggal hanya cairan yang bersih. Semakin banyak partikel besar yang menempati di
29
Gambar 8. Diagram proses fraksinasi massa dalam sedigraf (Webb, 2002).
Ruang sampel Daerah pengukuran
Transmisi sinar X
Medium cair
Partikel di atas daerah pengukuran
Distribusi partikel homogen
Partikel di dalam daerah pengukuran
Partikel di bawah daerah pengukuran
Semua partikel berukuran lebih besar jatuh terlebih dahulu ke daerah pengukuran Kumpulan partikel
30
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Mei – Agustus 2014 di Laboratorium
Kimia Anorganik Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung. Identifikasi menggunakan spektrofotometer IR dilakukan di
Laboratorium Kimia Organik Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Gajah Mada. Selain itu, analisis menggunakan instrument PSA (Coulter LS 1000) dan instrument SEM (Jeol JSM-6360la) dilakukan di Laboratorium Uji Material BATAN Serpong.
B. Alat dan Bahan
Alat-alat yang digunakan pada penelitian ini yaitu alat-alat gelas, botol-botol
plastik, waterbath, pengaduk magnet, neraca analitik Ainshworth AA-160,
Mikroskop Optik, Scanning Electron Microscopy (SEM) Jeol JSM-6360la, dan
Particle Size Analyzer (PSA) Coulter LS 1000.
Adapun bahan-bahan yang digunakan dalam penelitian ini yaitu CaCl2 anhidrat,
31
C. Prosedur Penelitian
1. Pembuatan Ekstrak Biji Pinang
Ekstrak biji pinang dibuat dengan cara mengeringkan buah pinang yang telah dikupas kulitnya dan bijinya dipotong menjadi kecil. Untuk menghilangkan kadar air yang masih tersisa pada biji pinang, biji dikeringkan kembali
dengan menggunakan oven dan ditimbang hingga beratnya konstan, kemudian dihaluskan dengan menggunakan blender. Selanjutnya dibuat
larutan biji pinang dengan konsentrasi 1000 ppm, sebanyak 1 gram serbuk biji pinang dilarutkan dalam akuades hingga volumenya mencapai 1 liter dalam gelas bejana. Larutan tersebut diaduk menggunakan pengaduk magnet
selama 2-3 jam pada suhu 90 °C kemudian larutan disaring menggunakan kertas saring. Larutan yang dihasilkan merupakan ekstrak biji pinang. Untuk mengetahui gugus fungsi yang terdapat pada ekstrak biji pinang dilakukan
analisis menggunakan spektrofotometer IR.
2. Pengujian Ekstrak Biji Pinang Sebagai Inhibitor dalam Pengendapan Kristal CaSO4
Tahapan untuk menguji ekstrak biji pinang sebagai inhibitor dalam
32
a. Penentuan Laju Pertumbuhan CaSO4 tanpa Penambahan Inhibitor pada Konsentrasi yang Berbeda
Larutan pertumbuhan dibuat dengan cara melarutkan 0,15 M CaCl2 dan
0,15 M Na2SO4 masing-masing dalam akuades hingga mencapai volume 200 mL. Masing-masing larutan dimasukkan ke dalam gelas kimia dan diaduk menggunakan pengaduk magnet selama 10-15 menit pada suhu
90 °C untuk menghomogenkan larutan. Selanjutnya, kedua larutan tersebut dicampur agar terbentuk kerak CaSO4 kemudian dimasukkan ke
dalam 6 gelas plastik masing-masing 50 mL dan diletakkan dalam water
bath pada suhu 90 °C selama 10-15 menit untuk mencapai
kesetimbangan. Pengamatan akan dilakukan setiap lima menit sekali.
Dalam lima menit sekali, satu botol diambil kemudian larutan dalam botol tersebut disaring menggunakan kertas saring, dicuci dengan akuades dan dikeringkan menggunakan oven pada suhu 90 °C selama
3-4 jam. Percobaan ini diulangi dengan variasi konsentrasi larutan CaCl2 dan Na2SO4 sebesar 0,20 dan 0,25 M. Endapan yang terbentuk
ditimbang, kemudian dilakukan analisis menggunakan instrumen SEM, dan distribusi ukuran partikel dalam endapannya menggunakan PSA.
b. Penentuan Laju Pertumbuhan CaSO4 dengan Penambahan Inhibitor pada Konsentrasi yang Berbeda
Larutan pertumbuhan dibuat dengan cara melarutkan 0,15 M CaCl2 dan 0,15 M Na2SO4 masing-masing dalam larutan ekstrak biji pinang 50 ppm
33
10-15 menit pada suhu 90 °C untuk menghomogenkan larutan.
Selanjutnya, kedua larutan tersebut dicampur agar terbentuk kerak CaSO4 kemudian dimasukkan ke dalam 6 gelas plastik masing-masing 50 mL
dan diletakkan dalam waterbath pada suhu 90 °C selama 10-15 menit
untuk mencapai kesetimbangan. Pengamatan akan dilakukan setiap lima menit sekali. Setiap lima menit, satu gelas diambil kemudian larutan
dalam gelas tersebut disaring menggunakan kertas saring, dicuci dengan akuades dan dikeringkan menggunakan oven pada suhu 90 °C selama 3-4
jam. Percobaan ini diulangi dengan variasi konsentrasi larutan CaCl2 dan Na2SO4 sebesar 0,20 dan 0,25 M. Endapan yang terbentuk ditimbang, kemudian dilakukan analisis menggunakan instrumen SEM, dan
distribusi ukuran partikel dalam endapannya menggunakan PSA.
3. Analisa Data
Data yang diperoleh berupa jumlah endapan terhadap waktu dengan variasi konsentrasi larutan pertumbuhan dan variasi konsentrasi inhibitor, masing-masing akan diplotkan sebagai jumlah endapan terhadap waktu menggunakan
Microsoft Excell. Nilai slope yang diperoleh dari masing-masing grafik
merupakan pertumbuhan kerak CaSO4. Morfologi kerak CaSO4 sebelum atau
34
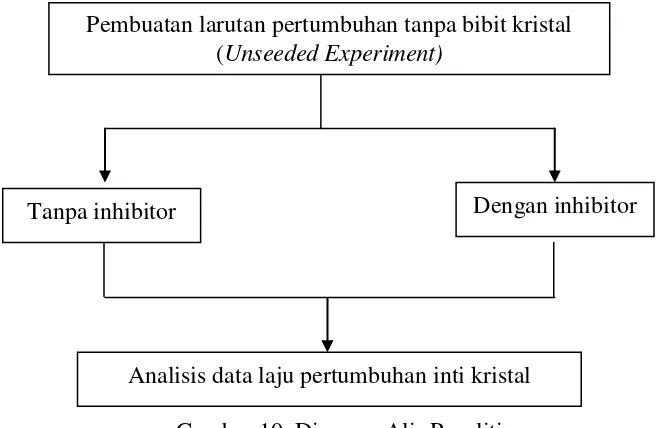
Secara keseluruhan penelitian ini terangkum dalam diagram alir penelitian yang
ditunjukkan dalam Gambar 10.
Gambar 10. Diagram Alir Penelitian Pembuatan larutan pertumbuhan tanpa bibit kristal
(Unseeded Experiment)
Tanpa inhibitor Dengan inhibitor
49
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan penelitian yang telah dilakukan, maka diperoleh simpulan sebagai berikut:
1. Senyawa ekstrak biji pinang dapat digunakan sebagai inhibitor kerak
CaSO4, hal ini dapat dilihat dari perbedaan nilai laju pertumbuhan, morfologi, dan ukuran partikel inti kristal CaSO4.
2. Pada penelitian ini, konsentrasi optimum inhibitor ekstrak biji pinang dalam menghambat laju pertumbuhan inti serta pertumbuhan kerak CaSO4 0,15 M adalah 250 ppm dengan keefektifan sebesar 24 %.
3. Analisis menggunakan SEM menunjukkan bahwa morfologi permukaan kerak CaSO4 sebelum penambahan inhibitor lebih padat dan rapat permukaannya dibandingkan sesudah penambahan inhibitor senyawa
ekstrak biji pinang yang terlihat lebih tipis dan rapuh permukaannya.
4. Analisis menggunakan PSA menunjukkan bahwa distribusi ukuran partikel
50
B. Saran
Untuk meningkatkan penelitian yang telah dilakukan, maka penulis memberikan saran melalui tulisan ini yaitu dilakukan penelitian terhadap jenis kerak lain
DAFTAR PUSTAKA
Al-Deffeeri, N.S. 2006. Heat Transfer Measurement as a Criterion For Performance Evaluation of Scale Inhibition in MSF Plants in Kuwait. Desalination. Vol. 204. pp. 423-436.
Al-Sofi, M.A., T. Hamada, Y. Tanaka, and A.A.Saad. 1994. Laboratory Testing of antiscalant Threshold Effectiveness. The Second Gulf Water Conference, Bahrain. Vol. I., p. 66.
Amjad, Z. 1987. Kinetics of crystal growth of calcium sulfate dihydrate, The influence of polymer composition, molecular weight, and solution pH. Can. J. Chem. Vol. 66., p.24.
Asmarani, D. 2011. Pengaruh Penambahan Senyawa Turunan Kaliksarena dan Ekstrak Gambir Sebagai Inhibitor Kerak Kalsium Sulfat (CaSO4). (Skripsi Tidak Diterbitkan). Jurusan Kimia FMIPA Universitas
Lampung. Lampung.
Asnawati. 2001. Pengaruh Temperatur Terhadap Reaksi Fosfonat dalam
Inhibitor Kerak pada Sumur Minyak. Jurnal ILMU DASAR. Vol.2.
No.1:20.
Badr, A. and A. A. M. Yassin. 2007. Barium Sulfate Scale Formation in Oil Reservoir During Water Injection at High-Barium Formation Water.
Journal of Applied Sciences. 7 (17) ; 2393-2403.
Bhatia, A. 2003. Cooling Water Problems and Solutions, Continuing Education
and Development, Inc. 9 Greyridge Farm Court Stony Point, NY 10980. Course no: M05-009.
Brown, G. G. 1978. Unit Operasi. John Willey and Sons. Tokyo.
Cowan, J. C. and D. J. Weintritt. 1976. Water-Formed Scale Deposit. Houston.
Texas. Gulf Publishing Co.
Dewi, D.F., dan M. Ali. 2003. Penyisihan Fosfat dengan Proses Kristalisasi dalam Reaktor Terfluidasi Menggunakan Media Pasir Silika. Jurnal
52
Fine, A.M. 2000. Oligomeric Proanthocyanidin Complexes: History, Structure, and phytopharmaceutical Applications. Altern Med Rev. 5(2):144-151.
Gabriel, B.l. 1985. SEM : A User’s Manual for Material Science. American
Society for Metal.
Gill, J. S. 1999. A Novel Inhibitor For Scale Control in Water Desalination.
Desalination. Vol. 124. pp. 43-50.
Hagerman, A.E. 2002. Condensed Tannin Structural Chemistry. Department of
Chemistry and Biochemistry, Miami University, Oxford, OH 45056.
Halimatuddahliana. 2003. Pencegahan Korosi dan Scale Pada Proses Produksi Minyak Bumi. Laporan Penelitian Universitas Sumatera Utara.
Medan.
Hamed, A., M.A.Karim. M.A.Al-Sofi, M.Ghulam. Mustafa, and A.G.Dalvi. 1997. The Performance of Different Aantiscalants in Multi-Stage Flash Distillers. Acquired Experience Symposium. Al-Jubail. 1558-1574.
Handayani, A., Sumaryo and A. Sitompul. 1996. Teknik Pengamatan
Strukturmikro dengan SEM-EDAX. Makalah Kunjungan dan Demo PTBIN BATAN. Serpong.
Hasson, D. and R. Semiat. 2005. Scale Control in Saline and Wastewater Desalination. Israel Journal of Chemistry. Vol. 46. pp. 97-104.
Kemmer, F. N. 1979. The Nalco Water Hand Book. Nalco Chemical Co. Mc
Graw Hill Book CO. New York, 20. pp. 1-19.
Kozic, V. and L.C.Lipus. 2003. Magnetic water treatment for a less tenacious scale. Journal Chem. Inf. Comput. Sci., 43, 1815-1819.
Lestari, D.E. 2000. Penelusuran Unsur Pembentuk Kerak pada Sistem Pendingin Sekunder Reaktor GA Siwabessy dengan Metoda Analisis Aktivasi Neutron (AAN). Prosiding Hasil Penelitian P2TRR. Hal 115-121.
Lestari, D. E., G. R. Sunaryo, Y. E. Yulianto, S. Alibasyah dan S. B. Utomo. 2004. Kimia Air Reaktor Riset G.A.Siwabessy. Makalah Penelitian P2TRR dan P2TKN BATAN. Serpong.
Lestari, D.E. 2008. Kimia Air, Pelatihan Operator dan Supervisor Reaktor Riset.
Pusat Pendidikan dan Pelatihan BATAN. Serpong. Maley, M. 1999. Inhibition of Calcite Nucleation and Growth Using
Phosphonate. Curtin University of Technology Western Australia.
53
Nonaka, G. 1989. Isolation and structure elucidation of tannins. Pure & Appl, Chem. 61 (3): 357-360.
Nunn, R.G. 1997. Water Treatment Essentials far Boiler Plant Operation. Mc
Graw Hill. New York.
Panjaitan, R. 2008. Penggunaan Tanaman Kelapa, Pinang, dan Aren Sebagai Tanaman Obat. Warta Puslitbangbun. Vol. 13
Patel, S. 1999. New antifoulants for deposit control in MSF and MED plants.
Desalination 124. 63-74.
Patton, C. 1981. Oilfield Water System. 2 ed. Cambeel Petroleum Series.
Oklahoma. pp. 49-79.
Saito,T. 1996. Buku Teks Kimia Anorganik Online. Alih Bahasa oleh Ismunandar.
Diakses melalui www.google.com pada tanggal 20 Februari 2014 pukul 15.00 WIB.
Salimin, Z., dan Gunandjar. 2007. Penggunaan EDTA sebagai Pencegah
Timbulnya Kerak pada Evaporasi Limbah Radioaktif Cair. Prosiding PPI – PDIPTN. Pustek Akselerator dan Proses Bahan – BATAN.
Yogyakarta.
Suharso, Buhani, T. Suhartati., dan A. Laila. 2007. Uji Coba Aditif Pada Pengendapan Kristal dengan Penambahan Bibit Kristal dan Tanpa Penambahan Bibit Kristal. Laporan Penelitian Universitas Lampung.
Lampung.
Suryadi, E. 1984. Penelitian Pembuatan Tepung Pinang dan Sifat-Sifat Fisika Kimianya. Balai Penelitian dan Pengembangan Industri. Banda
Aceh.
Svehla, G. 1990. Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro.
Alih Bahasa Oleh L. Setiono dan A. H pudjaatmaka. PT. Kalman Media Pustaka. Jakarta.
Syukur, M., 2009. Teknik Budidaya Pinang. [http://www. CCRC-FARMASI – UGM]. Yogyakarta. Diakses melalui www.google.com pada
tanggal 20 Februari 2014 pukul 15.00 WIB.
Wafiroh, S. 1995. Pemurnian Garam Rakyat Dengan Kristalisasi Bertingkat.
54
Wang, C.K. and W. H. Lee. 1996. Separation, Characteristics, and Biological Activities of Phenolics in Areca Fruit, J. Agric. Food Chem.,
44(8):2014 -2019.
Webb, P.A., 2002. Interpretation of Particle Size Reported by Different Analytical Technique diakses melalui www.micromeristics.com pada tanggal 5
Maret 2014 Pukul 14.00 WIB.
Weijnen, M. P. C., W. G. J. Marchee and G. M. V. Rosmalen. 1983. A
Quantification of The Effectiveness of an Inhibitor on The Growth Process of a Scalant. Desalination. Vol. 47. pp. 81-92.