UIN SYARIF HIDAYATULLAH JAKARTA
PEMBUATAN TABLET SALUT FILM SAMBUNG SILANG
KITOSAN
–
TRIPOLIFOSFAT DENGAN METODE SEMPROT
SKRIPSI
DWIKKY SUNU PRAYOGO NIM: 1110102000030
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
PEMBUATAN TABLET SALUT FILM SAMBUNG SILANG
KITOSAN
–
TRIPOLIFOSFAT DENGAN METODE SEMPROT
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
DWIKKY SUNU PRAYOGO 1110102000030
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
iii
HALAMAN PERNYATAAN ORISINALITAS
Skripsi ini adalah hasil karya sendiri, dan semua sumber yang dikutip maupun dirujuk
telah saya nyatakan dengan benar.
Nama : Dwikky Sunu Prayogo
NIM : 1110102000030
Tanda Tangan :
LEMBAR PERSETUJUAN PEMBIMBING
Nama : Dwikky Sunu Prayogo
NIM : 1110102000030
Program Studi : Farmasi
Judul : Pembuatan Tablet Salut Film Sambung Silang Kitosan – Tripolifosfat dengan Metode Semprot
Menyetujui :
Pembimbing I Pembimbing II
Yuni Anggraeni, M.Farm., Apt Sabrina M.Farm., Apt NIP: 198310282009012008 NIP: 197902222007102001
Mengetahui
Ketua Program Studi Farmasi UIN Syarif Hidayatullah Jakarta
v
HALAMAN PENGESAHAN
Skripsi ini diajukan oleh
Nama : Dwikky Sunu Prayogo
NIM : 1110102000030
Program Studi : Farmasi
Judul Skripsi : Pembuatan Tablet Salut Film Sambung Silang Kitosan – Tripolifosfat dengan Metode Semprot
Telah berhasil dipertahankan dihadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
DEWAN PENGUJI
Pembimbing 1 : Yuni Anggraeni, M.Farm., Apt ( )
Pembimbing 2 : Sabrina, M.Farm., Apt ( )
Penguji 1 : Ofa Suzanti Betha, M.Si, Apt ( )
Penguji 2 : Nelly Suryani, Ph.D, Apt ( )
Ditetapkan di : Jakarta
ABSTRAK
Nama : Dwikky Sunu Prayogo
Program Studi : Farmasi
Judul : Pembuatan Tablet Salut Film Sambung Silang Kitosan – Natrium Tripolifosfat dengan Metode Semprot
Kitosan merupakan salah satu polimer alami yang mempunyai potensi dalam sediaan farmasi sebagai bagian dari sistem penghantaran obat. Penelitian ini bertujuan untuk mengetahui efek sambung silang kitosan – natrium tripolifosfat dalam bentuk salut film terhadap pelepasan obat. Tablet salut dibuat dengan menggunakan panci penyalutan dan proses sambung silang antara kitosan dengan natrium tripolifosfat dilakukan dengan cara penyemprotan. Tablet yang dihasilkan dievaluasi penampilan fisik tablet yang telah disalut, penambahan bobot, tebal dan diameter tablet salut, waktu hancur tablet serta uji disolusi tablet salut. Tablet salut film kitosan – natrium tripolifosfat yang dihasilkan memiliki waktu hancur 21,83 ± 2,63 menit dibandingkan dengan tablet inti dan tablet salut kitosan yang waktu hancur nya masing-masing 6 ±1 dan 5,66 ± 0,51 menit. Profil pelepasan propranolol pada tablet salut film dalam media asam dan dapar fosfat dalam waktu 30 menit masing-masing 34,976 ± 1,132% dan 15,442 ± 0,360%. Pelepasan propranolol pada tablet inti dalam asam dan dapar fosfat pada menit 30 masing-masing adalah 85,81 ± 0,3602% dan 96,444 ± 2,542%. Hal ini menunjukkan bahwa salut film kitosan – NaTPP mempunyai potensi untuk menahan pelepasan obat.
vii ABSTRACT
Name : Dwikky Sunu Prayogo
Major : Pharmacy
Title : Preparation of Film-coated Tablet of Crosslinked Chitosan – Sodium tripoliphospate with Spray Method
Chitosan is a natural polymer that has a potency in pharmaceutical preparations as a part of a drug delivery system. The objective of this study was to determine the effect of crosslinked chitosan - sodium tripolyphosphate as a film coated tablets on drug release. Film coated tablets were prepared by using a coating pan and crosslinking between chitosan with sodium tripolyphosphate was done by spraying. The tablets was evaluated with a few parameters such as physical appearance, weight gain, tablet’s width and diameter, disintegration test and dissolution test. Film coated chitosan-sodium tripolyphospate tablets has disintegrated in 21.83 ± 2.63 minutes compared to standard tablet’s 6 ± 1 minutes and film coated chitosan tablet’s 5,66 ± 0,51 minutes. The dissolution rate of propranolol on film-coated tablets in acidic medium and phosphate buffer within 30 minutes were 34,97 ± 1,13% and 15,44 ± 0,360% respectively. The dissolution rate of propranolol on standard tablet in acidic medium and phosphate buffer within 30 minutes were 85,81 ± 0,36% and 96,44 ± 2.54% respectively. The results showed that the film-coated tablet of chitosan – sodium tripolyphospate has the potency to sustain the drug release from tablet.
KATA PENGANTAR
Alhamdulillahirabbil`alamiin, segala puji dan syukur penulis ucapkan kehadirat Allah SWT yang telah melimpahkan rahmat dan ridho-Nya sehingga penulis dapat menyelesaikan penyusunan skripsi ini hingga selesai. Penulisan skripsi yang berjudul “Pembuatan Tablet Salut Film Kitosan – Natrium Tripolifosfat dengan Metode Semprot” bertujuan untuk memenuhi persyaratan guna memperoleh gelar Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Pada kesempatan ini penulis menyadari bahwa, tanpa bantuan dan bimbingan dari berbagai pihak, dari masa perkuliahan sampai pada penyusunan skripsi ini, sangatlah sulit bagi saya untuk menyelesaikan skripsi ini. Oleh karena itu, saya mengucapkan rasa terima kasih dan penghargaan yang sebesar-besarnya kepada :
1. Yuni Anggraeni, M.Farm., Apt dan Sabrina, M.Farm., Apt., selaku dosen pembimbing yang telah banyak membantu dan membimbing penulis dalam proses pengerjaan skripsi.
2. Kedua orangtuaku tercinta, Yusneliati dan Marwoto, terima kasih telah memberikan kasih sayang dan perhatian kepadaku. Terima kasih telah selalu mendoakanku tanpa putus disetiap malammu. Terima kasih atas segala dukungan energi dan moril yang selalu kalian berikan. Kalianlah salah satu motivasiku untuk menyelesaikan sekolahku di farmasi. Semoga Allah akan selalu memberi keselamatan, cinta, kasih sayang serta keberkahan dunia dan akhirat.
3. Drs. Umar Mansur, M.Sc., Apt selaku ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta
ix
5. Prof. Dr. (hc) dr. M. K. Tadjudin, Sp. And., selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
6. Adik dan kakakku, Naurah Nabilah Sunu, Arisyi Sunu Pradono, Satryo Sunu Prabowo yang telah memberikan doa, semangat, dan dukungan sehingga penelitian ini dapat berjalan dengan lancar.
7. Kakak-kakak laboran FKIK, ka Rachmadi, ka Eris, ka liken, ka Lisna, ka Tiwi, ka Eris, Mba Rani, serta kakak laboran laboratorium sediaan solid pak Soleh atas bantuan dan kerjasamanya selama kegiatan penelitian.
8. Delvina Ginting dan Nirmala Kasih, teman dan partner dengan pembimbing yang sama, yang sudah sangat banyak membantu dan memberi saran dalam proses pengerjaan penelitian dari awal sampai akhir yang tanpa mereka penelitian ini akan sangat sulit untuk diselesaikan.
9. Teman – teman seperjuangan, Hadi, Mirza, Afifah, Liana, Deisy, Hanny, Diah, Denny, Myra, Salsa, teman teman seperjuangan farmasi angkatan 2010 dan teman – teman “pavilioons", Arum, Danie, Rendi, Fikri dan lainnya dan juga pihak-pihak lain yang tidak dapat disebutkan satu persatu, yang telah memberikan bantuan dan dukungan hingga terwujudnya skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, namun penulis berharap semoga hasil penelitian ini dapat bermanfaat bagi perkembangan ilmu pengetahuan pada umumnya dan ilmu farmasi pada khususnya. Akhir kata, penulis berharap Allah SWT akan membalas segala kebaikan semua pihak yang telah membantu saya dalam penelitian ini.
Ciputat, 6 Oktober 2014
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI
TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya yang bertanda tangan di bawah ini :
Nama : Dwikky Sunu Prayogo
NIM : 1110102000030
Program Studi : Farmasi
Fakultas : Fakultas Kedokteran dan Ilmu Kesehatan (FKIK) Jenis Karya : Skripsi
demi pengembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya, dengan judul
PEMBUATAN TABLET SALUT FILM SAMBUNG SILANG KITOSAN – NATRIUM TRIPOLIFOSFAT DENGAN METODE SEMPROT
untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
Dengan demikian persetujuan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Dibuat di : Ciputat Pada tanggal 6 Oktober 2014
Yang menyatakan,
xi DAFTAR ISI
HALAMAN PERNYATAAN ORISINALITAS ... iii
LEMBAR PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI... x
DAFTAR ISI ... xi
2.2 Natrium Tripolifosfat ... 5
2.3 Crosslink Kitosan – Natrium Tripolifosfat ... 5
2.4 Tablet ... 7
2.5 Tablet Salut Film ... 8
2.6 Proses Penyalutan Tablet ... 8
2.6.1Komponen Formulasi Salut Film ... 9
2.7 Sistem Pelepasan Terkendali ... 11
2.8.1 Gliserin ... 11
2.8.2 Sorbitol ... 12
BAB 3 METODOLOGI PENELITIAN ... 13
3.1 Tempat dan Waktu Penelitian ... 13
3.2 Alat dan Bahan ... 13
3.2.1 Alat ... 13
3.2.2 Bahan ... 13
3.3 Metode Penelitian ... 14
3.3.1 Penelitian Pendahuluan ... 14
3.3.2 Pemilihan Tablet sebagai Substrat ... 16
3.3.3 Evaluasi Tablet Inti ... 17
3.3.4 Penyalutan Tablet ... 18
3.3.5 Evaluasi Tablet Salut Film ... 19
3.3.6 Pembuatan Kurva Kalibrasi dalam Asam dan Dapar Fosfat ... 20
3.3.7 Uji Disolusi... 20
BAB 4 HASIL DAN PEMBAHASAN ... 21
4.1. Uji Pendahuluan ... 21
4.2. Pemilihan Tablet sebagai Substrat ... 23
4.3 Keseragaman Kandungan ... 24
4.4 Evaluasi Tablet Salut ... 24
4.5 Waktu Hancur Tablet ... 26
4.6 Uji Disolusi ... 26
BAB 5KESIMPULAN DAN SARAN ... 30
5.1. Kesimpulan ... 30
5.2. Saran ... 30
DAFTAR PUSTAKA ... 31
xiii
DAFTAR TABEL
Tabel 3.1.Komposisi larutan film ……….. 15
Tabel 3.2.Formula penyalut tablet ……….. 19
Tabel 4.1 Hasil Evaluasi Film …..………. 21
Tabel 4.2 Data Evaluasi Tablet OD dan KF ……….………. 23
Tabel 4.3 Evaluasi Tablet Salut Kitosan – Natrium Tripolifosfat…….. 25
Tabel 4.4 Data Waktu Hancur Tablet dalam Asam dan Aquadest.…… 26
Tabel 4.5 Data Hasil Uji Disolusi Tablet dalam Asam ……….… 27
Gambar 2.1.Struktur Kitosan ……… 4
Gambar 2.2.Struktur natrium tripolifosfat ……… 5
Gambar 2.3. Interaksi kitosan dengan tripolifosfat……… 7
Gambar 2.4. Struktur Kimia Gliserin ……… 11
Gambar 2.5. Struktur Kimia Sorbitol ……… 12
Gambar 3.1. Contoh Potongan Film untuk Uji Mekanik ………. 16
Gambar 4.1. Tablet Salut Kitosan – Natrium Tripolifosfat …………. 24
Gambar 4.2 Jumlah Kumulatif Obat yang Terdisolusi dari Tablet Inti dan Tablet Salut dalam Asam ………... 27
xv
DAFTAR LAMPIRAN
Lampiran 1 Alur Penelitian ………. 35
Lampiran 2 Alat –alat yang digunakan ……….. 36
Lampiran 3. Ketebalan ukuran film ……… 38
Lampiran 4. Data Uji Mekanik Film-1………. 39
Lampiran 5. Data Uji Mekanik Film-2……….. 40
Lampiran 6. Hasil normalitas dan homogenitas data SPSS perubahan metode dan konsentrasi terhadap EB dan TS ………….. 41
Lampiran 7. Hasil Kruskal Wallis tentang perbedaan metode terhadap EB ………... 43
Lampiran 8. Hasil Uji Anova tentang perbedaan metode terhadap TS 44
Lampiran 9. Hasil Uji Kruskal Wallis tentang Perbedaan Konsentrasi terhadap EB ………... 44
Lampiran 10. Hasil Uji Anova tentang Perbedaan Konsentrasi terhadap TS ……… 45
Lampiran 11. Hasil Post Hoc Test ………. 45
Lampiran 12. Data Kehilangan Bobot ………..….. 46
Lampiran 13 Data Kekerasan Tablet ………...…….. 46
Lampiran 14. Data Friabilitas Tablet ………..…….….. 46
Lampiran 15. Data Absorbansi Uji Keseragaman Kandungan ……… 47
Lampiran 16. Data Waktu Hancur Tablet dalam Media Asam ……… 48
Lampiran 17 Data Waktu Hancur Tablet dalam Media Aquadest …… 48
Lampiran 18. Tabel dan Kurva Kalibrasi Propranolol dalam Asam.…. 49 Lampiran 19. Tabel dan Kurva Kalibrasi Propranolol dalam Dapar…. 50 Lampiran 20. Data Uji Disolusi Tablet Inti dalam Asam ………….. 51
Lampiran 21. Data Uji Disolusi Tablet Inti dalam Dapar Fosfat ……. 52
Lampiran 22. Data Uji Disolusi Tablet Salut dalam Asam ………….. 53
1.1 Latar Belakang
Kitosan adalah polisakarida alami yang telah banyak digunakan dalam sediaan farmasi. Kitosan diperoleh dari proses deasetilasi kitin yang merupakan polimer alami dengan keberadaan yang melimpah karena berasal dari limbah produk laut seperti udang, cumi-cumi, dan kepiting. Potensi kitosan dalam sediaan farmasi mulai dilirik karena selain ketersediaannya yang melimpah dan bersifat alami juga memiliki banyak manfaat dan efek samping yang minim (Singla dan Chawla, 2001).
Kitosan telah banyak dimanfaatkan dalam berbagai macam sediaan di antaranya pada aplikasi sediaan okuler topikal, implantasi, injeksi, peningkat penetrasi, meningkatkan penyembuhan luka serta bahan penyalut (Berger et al, 2003). Sebagai bahan penyalut tablet, kitosan diharapkan dapat melindungi zat aktif serta memodifikasi penampilan dan pelepasan obat sebagaimana fungsi polimer penyalut tablet yang lain. Penelitian yang telah dilakukan oleh Hilmi (2011) memanfaatkan kitosan sebagai polimer film penyalut tablet untuk melindungi zat aktif dalam substrat. Penelitian tersebut menunjukkan bahwa pelepasan zat aktif pada uji disolusi dengan media asam cukup besar sehingga salut film tersebut tidak dapat digunakan dalam memperlambat pelepasan. Oleh karena itu harus ada modifikasi pada kitosan agar dapat dimanfaatkan sebagai polimer pada tablet salut film lepas lambat.
2
UIN SYARIF HIDAYATULLAH JAKARTA
kitosan menyebabkan pengurangan daya pengembangan dan sensitivitas pH khususnya pada pH rendah sehingga menurunkan laju pelepasan obat (Berger et al, 2003).
Ada beberapa penelitian yang telah memanfaatkan kitosan dengan ikatan silang untuk mendapatkan hasil yang lebih baik. Penelitian oleh Ko et al., (2002) dalam jurnal Agnihotri, Mallikarjuna dan Aminabhavi (2004) menyatakan bahwa dengan membuat mikropartikel kitosan yang disambung silang secara ionik dengan tripolifosfat menyebabkan laju pelepasan felodipin yang lebih lambat. Pada penelitian oleh Anggraeni (2012) telah dilakukan pembuatan film dengan bahan kitosan yang disambung silang dengan tripolifosfat yang mengandung asiatikosida. Pada penelitian tersebut, pencampuran tripolifosfat dilakukan dalam bentuk larutan dengan pengadukan secara teratur. Walaupun film yang didapatkan belum maksimal tetapi film yang dihasilkan mampu menahan pelepasan obat.
Melihat potensi ikatan silang kitosan dengan tripolifosfat yang mampu menahan pelepasan obat, peneliti akan mencoba memanfaatkan kemampuan menahan pelepasan obat tersebut dalam bentuk tablet salut film. Ikatan silang antara kitosan dengan tripolifosfat dilakukan pada saat penyemprotan. Diharapkan dari modifikasi metode ini diperoleh hasil film dan tablet salut film yang baik dan memiliki sifat untuk mengatur laju pelepasan obat sesuai yang diharapkan. Propranolol digunakan sebagai model obat untuk mengetahui profil pelepasan film yang dihasilkan. Adapun ruang lingkup penelitian ini meliputi penelitian pendahuluan metode pembentukan ikatan silang, evaluasi tablet inti, penyalutan tablet inti dan evaluasi tablet salut film.
1.2 Perumusan Masalah
a. Bagaimanakah karakteristik film dan tablet salut film yang dihasilkan dari sambung silang antara kitosan – tripolifosfat menggunakan metode semprot?
1.3 Hipotesis
1.4 Tujuan
Penelitian ini bertujuan untuk mengetahui efek sambung silang kitosan-natrium tripolifosfat dalam bentuk salut film dan efeknya terhadap pelepasan obat.
1.5 Manfaat Penelitian
4 BAB 2
TINJAUAN PUSTAKA
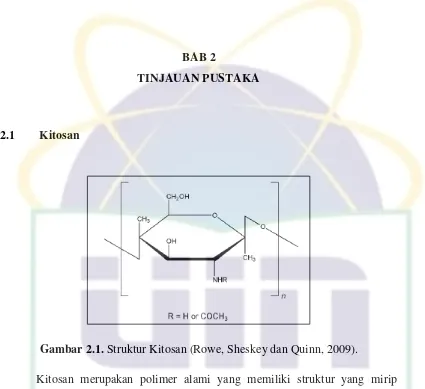
2.1 Kitosan
Gambar 2.1. Struktur Kitosan (Rowe, Sheskey dan Quinn, 2009).
Kitosan merupakan polimer alami yang memiliki struktur yang mirip dengan selulosa dan bersifat biodegradable, biokompatibel, dan bioadhesif dan mulai banyak digunakan untuk sediaan farmasi sebagai bagian dari sistem penghantaran obat. Kitosan merupakan kopolimer dari glukosamina dan N-asetil glukosamina terhubung oleh ikatan β 1–4 glukosidik dan diperoleh dengan deasetilasi kitin. Berat molekul dan derajat deasetilasinya dapat dimodifikasi saat persiapannya untuk merubah sifatnya. Kitosan memiliki gugus amina bebas serta gugus hidroksil yang dapat dimodifikasi untuk memperoleh turunan kitosan. Kitosan larut dalam beberapa larutan asam misalnya asam asetat, asam laktat, serta beberapa senyawa N-alkylidinasi dan N-asilasi (Bhumkar dan Pokharkhar, 2006).
Keunggulan kitosan sebagai polimer adalah karena kitosan memiliki banyak manfaat. Berdasarkan sifat kimianya antara lain bersifat polymin linear, memiliki gugus amino reaktif dan gugus hidroksil reaktif, serta merupakan agen pengkelat bagi banyak ion logam transisi. Sedangkan sifat biologi kitosan antara lain adalah biokompatibel karena merupakan polimer alami dan bersifat aman dan tidak toksik. Kitosan juga bersifat biodegradable karena dapat terdekomposisi dalam tubuh. Kitosan dapat terikat pada sel mikroba dan mammalia, memiliki efek regeneratif pada jaringan penghubung. Kitosan juga memiliki sifat hemostatik dan fungistatik serta anti tumor dan anticholesteremic (Dutta, Dutta & Tripathi, 2004). Karena memiliki banyak manfaat, penelitian mengenai pemanfaatan kitosan dalam dunia farmasi sangat diperlukan.
2.2 Natrium Tripolifosfat
Gambar 2.2. Struktur natrium tripolifosfat (Chemical Book, 2014)
Natrium tripolifosfat yang juga mempunyai nama kimia pentasodium trifosfat merupakan senyawa yang mempunyai muatan negatif yang banyak. Natrium tripolifosfat yang merupakan multivalent fosfat adalah anion dengan berat molekul rendah. Melalui pendekatan gelasi ionik, kitosan yang memiliki polikation atau muatan positif hasil protonasi dalam suasana asam, dapat berinteraksi secara elektrostatis dengan polianion sebagai zat peng-crosslink yaitu tripolifosfat. Tripolifosfat sering digunakan karena bersifat nontoksik, mempunyai kemampuan untuk membentuk gel secara cepat dan kemampuannya untuk berinteraksi secara elektrostatis dengan kitosan (Aydin dan Pulat, 2012).
2.3 Crosslink Kitosan – Natrium Tripolifosfat
6
UIN SYARIF HIDAYATULLAH JAKARTA
Gambar 2.3. Interaksi kitosan dengan tripolifosfat (a) deprotonasi, (b) cross-linking ion (Bhumkar dan Pokharkhar, 2006)
2.4 Tablet
Tablet adalah sediaan padat kompak, yang dibuat secara kempa cetak, dalam bentuk tabung pipih atau sirkuler, kedua permukaannya rata atau cembung, mengandung satu jenis obat atau lebih dengan atau tanpa zat tambahan (Farmakope Indonesia III, 1979). Tablet terdapat dalam berbagai ragam bentuk, ukuran, bobot, kekerasan,, ketebalan, sifat disolusi dan disintegrasi dan aspek lain, tergantung pada penggunaan yang dimaksudkan dan metode pembuatannya (Siregar, 2008).
Beberapa keuntungan sediaan tablet antara lain:
1. Kemudahan pemberian dosis obat yang tepat dan akurat
2. Sifat tablet yang mudah dibawa, bentuk kompak, stabilitas yang memadai, mudah diberikan.
3. Harga pada umumnya relatif lebih murah dibandingkan dengan semua bentuk sediaan oral lainnya.
8
UIN SYARIF HIDAYATULLAH JAKARTA
5. Dapat diformulasikan sedemikian rupa sehingga laju pelepasan obatnya bisa dikondisikan sesuai kebutuhan.
6. Cocok untuk produksi skala besar.
2.5 Tablet Salut Film
Tablet salut selaput merupakan bagian terpadu dari proses pengembangan bentuk sediaan. Proses salut selaput meliputi penyalutan salut polimer tipis yang seragam pada permukaan substrat solid. Substrat dapat berupa tablet, kaplet, pelet, granul atau partikel-partikel. Secara khas, salut itu kira-kira setebal 25 sampai 100 µm dan disalutkan untuk menyempurnakan sifat-sifat fisik dan kimia substrat (Siregar, 2008). Penyalutan adalah proses dimana lapisan luar yang kering dari bahan penyalut melapisi permukaan dari bentuk sediaan untuk mencapai tujuan tertentu. Tablet salut dapat menutupi rasa, bau maupun warna obat. Tablet salut dapat mengatur laju pelepasan obat dari tablet. Selain itu, penyalutan tablet juga dapat memberikan perlindungan fisik dan kimia, serta dapat melindungi obat dari suasana asam di gastrointestinal (dengan pembuatan tablet salut enterik). Penyalutan juga dapat menghindari inkompabilitas dalam formulasi sediaan (Ankit et al, 2012). Kelebihan dari penyalut dengan gula ialah lebih tahan lama, lebih sedikit bahan, waktu yang lebih sedikit untuk penggunaannya. Selaput ini pecah dalam saluran lambung – usus (Ansel, 2005).
Beberapa tujuan penggunaan salut selaput dibandingkan tablet standard antara lain:
1. Melindungi zat aktif dalam substrat dari faktor lingkungan seperti cahaya, kelembaban, dan udara serta memperbaiki stabilitas kimia dan fisika. 2. Memodifikasi penampilan produk.
3. Menutupi cita rasa, tekstur, dan aroma yang tidak menyenangkan. 4. Mengendalikan atau memodifikasi pelepasan zat aktif
2.6 Proses Penyalutan Tablet
bentuk sediaan padat seperti tablet, granul atau partikel lain. Ketebalan penyalutan tersebut berkisar antara 20 sampai 100 µm. Proses penyalutan pada umumnya adalah tablet atau granul yang melewati zona penyemprotan dimana setelahnya zat yang telah disemprotkan dikeringkan sebelum bagian zat penyalut selanjutnya disemprotkan. Aktivitas ini dilakukan berulang – ulang sampai proses penyalutan selesai. Formulasi penyalutan film intinya terdiri atas polimer dengan beberapa komponen tambahan diantaranya, plasticizer, pigment, opacifier, surfactant, waxes. Dari komponen-komponen tersebut, ditambahkan sesuai dengan kebutuhan dan tujuan yang ingin dicapai sehingga standardnya tidak semua komponen tambahan tersebut ditambahkan ke dalam formulasi. Dalam keadaan tertentu, lapisan film dari polimer bahkan dapat mengandung zat aktif (Hogan, 2002). Alat yang digunakan dalam proses penyalutan adalah sebuah pan berputar yang dialiri oleh aliran udara panas. Alat ini termasuk alat yang sederhana, karena seiring dengan perkembangan zaman, terdapat inovasi dan modifikasi pada alat penyalut seperti Pellegrini coating pans, driam, the butterfly coating pans, yang untuk memperoleh hasil yang maksimal dan sesuai kebutuhan (Cole, 2012).
2.6.1 Komponen Formulasi Salut Film 2.6.1.1 Polimer
10
UIN SYARIF HIDAYATULLAH JAKARTA 2.6.1.2Plasticizer
Plasticizer pada umumnya adalah zat dengan berat molekul rendah yang punya kapasitas merubah sifat fisik polimer sehingga dapat berfungsi lebih baik sebagai bahan dalam proses salut film. Mekanisme kerja plasticizer pada umumnya dengan menginterpose molekul plasticizer pada helaian polimer sehingga memecah interaksi polimer-polimer. Hal ini dilakukan karena interaksi plasticizer dengan polimer dianggap lebih kuat dibandingkan dengan interaksi polimer-polimer (Hogan, 2002). Contoh plasticizer yang standard digunakan adalah polyol seperti gliserol (gliserin), propilen glikol, polietilen glikol; ester organic seperti ester phthalate, ester sitrat; gliserida seperti minyak jarak, monogliserida terasetilasi, dan minyak kelapa terfraksionasi (Hogan, 2002).
Pada salut film, plasticizer memiliki kemampuan untuk stress internal pada salut film. Selain itu, pada salut film yang bertujuan memiliki efek modifikasi pelepasan pada sediaan, harus kuat secara mekanik supaya lapisan film tidak rusak pada saat proses penyalutan (Hogan, 2002).
2.6.1.3Pewarna / Opacifier
Kelompok bahan ini digunakan untuk meningkatkan penampilan produk yang dihasilkan namun juga bermanfaat dalam beberapa hal lain diantaranya:
1. Identifikasi produk oleh produsen yang standard digunakan pada GMP (Good Manufacturing Practice) serta membantu mengidentifikasi obat pada pasien dengan pengobatan lebih dari 1 obat.
2. Meningkatkan kesan merek suatu produk sehingga mengurangi kesempatan untuk produsen lain meniru produknya.
3. Pewarna pada batasan tertentu memiliki efek opacifying yang dapat menentukan hasil optimal yang dapat melindungi bahan obat dari cahaya pada saat penyalutan.
2.7 Sistem Pelepasan Terkendali
Sistem penghantaran obat dengan laju pelepasan obat terkendali ditujukan untuk memaksimalkan efek terapi obat. Salah satu cara untuk memodifikasi pelepasan zat aktif dalam sediaan khususnya dalam tablet adalah dengan penyalutan. Penyalutan tablet dilakukan dengan menggunakan polimer sebagai film yang akan menyeliputi tablet. Pelepasan obat bergantung pada ketebalan dan laju disolusi membran polimer yang menyeliputi inti. Dengan menyalut inti obat dengan membran polimer dengan ketebalan tertentu, pelepasan obat dapat ditunda sampai waktu tertentu, misal 1, 3, 6, atau 12 jam setelah pemberian obat (Hillery, Lloyd dan Swarbrick, 2005).
2.8 Zat Tambahan dalam Formulasi Film 2.8.1 Gliserin
12
UIN SYARIF HIDAYATULLAH JAKARTA 2.8.2 Sorbitol
METODOLOGI PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Kimia Obat Farmasi FKIK UIN Jakarta, Laboratorium Sediaan Padat Farmasi FKIK UIN Jakarta, Laboratorium Penelitian I Farmasi FKIK UIN Jakarta, Laboratorium Penelitian II Farmasi FKIK UIN Jakarta, Laboratorium Farmakologi FKIK UIN Jakarta, Bagian PAIR BATAN, Laboratorium Sediaan Solid Universitas Pancasila. Penelitian berlangsung dari bulan Februari sampai bulan oktober 2014.
3.2 Alat dan Bahan
3.2.1 Alat
Alat yang digunakan dalam penelitian ini terdiri dari: timbangan analitik (AND GH-120), pH meter (horiba F-52), magnetic stirrer (advantec SRS710HA), hair dryer, viskometer Haake 6R, moisture analyzer, dissolution tester (erweka DT626HH), friabilator EF – 2, disintegration tester (electrolab ED-2L), hardness tester TBH 225, desikator, kompressor, spray gun, spatula, oven (eyela NDO- 400, Jepang), pan coating, spektrofotometer UV visible hitachi U-2910, mikroskop optik olympus IX 71, Jepang, mikrometer digital (mitutoyo, Jepang), tensile tester Strograph-R1 (Toyoseiki, Jepang), alat potong dumb bell (Saitama dengan standar ASTM-D 1822-1, Jepang), corongbuchner dan alat-alat gelas standar laboratorium lainnya.
3.2.2 Bahan
14
UIN SYARIF HIDAYATULLAH JAKARTA 3.3 Metode Penelitian
3.3.1 Penelitian Pendahuluan 3.3.1.1 Pembuatan Film
Penelitian ini dilakukan untuk mendapatkan konsentrasi natrium tripolifosfat (NaTPP) dan metode optimum yang menghasilkan film dengan tekstur dan homogenitas yang baik. Optimasi ini dilakukan dengan menggunakan pistol semprot dan kompressor untuk menghasilkan film kitosan di substrat kaca yang dikeringkan dengan aliran udara panas. Variasi yang dilakukan adalah pada konsentrasi natrium tripolifosfat dan urutan penyemprotan larutan pembentuk film.
Dibuat larutan kitosan 1% b/v dalam asam asetat 2% v/v. Larutan disimpan sampai gelembung hilang. Lalu dibuat campuran plasticizer gliserin dengan sorbitol 70% 1:1. Larutan plasticizer lalu ditambahkan dengan konsentrasi 75% b/b kitosan ke larutan kitosan sampai homogen. Lalu dibuat larutan natrium tripolifosfat pada konsentrasi 0,05%, 0,1%, 0,5%, 1% b/v. Metode pembentukan film divariasikan dengan merubah perlakuan yang dilakukan setelah penyemprotan awal larutan kitosan. Film lalu dibuat di plat kaca dengan ukuran 9x9 menggunakan pistol semprot dengan berbagai macam metode:
a. Metode 1 : larutan kitosan disemprot dan dipanaskan sampai terbentuk film lalu disemprot natrium tripolifosfat
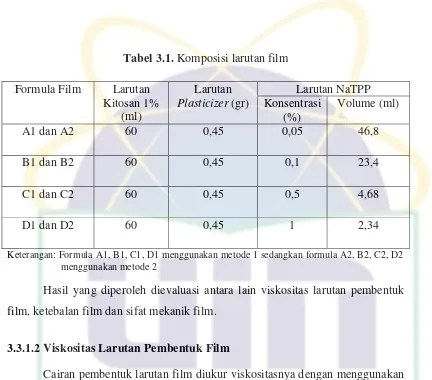
Tabel 3.1. Komposisi larutan film
Keterangan: Formula A1, B1, C1, D1 menggunakan metode 1 sedangkan formula A2, B2, C2, D2 menggunakan metode 2
Hasil yang diperoleh dievaluasi antara lain viskositas larutan pembentuk film, ketebalan film dan sifat mekanik film.
3.3.1.2 Viskositas Larutan Pembentuk Film
Cairan pembentuk larutan film diukur viskositasnya dengan menggunakan viskotester Haake dengan No. Spindel R2 pada kecepatan 100 rpm. Nilai masing-masing viskositas dicatat dan dibandingkan antara masing-masing-masing-masing fomula (Rane dan Kale, 2009, dengan modifikasi).
3.3.1.3 Ketebalan Film
Ketebalan film diukur dengan menggunakan mikrometer digital. Setiap film yang telah diukur dicatat ketebalan filmnya (Rane dan Kale, 2009, dengan modifikasi).
3.3.1.4 Sifat Mekanik Film
16
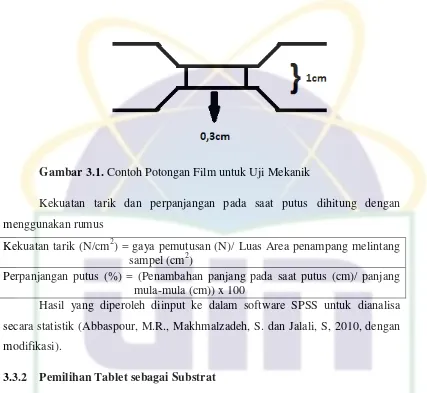
UIN SYARIF HIDAYATULLAH JAKARTA Gambar 3.1. Contoh Potongan Film untuk Uji Mekanik
Kekuatan tarik dan perpanjangan pada saat putus dihitung dengan menggunakan rumus
Kekuatan tarik (N/cm2) = gaya pemutusan (N)/ Luas Area penampang melintang sampel (cm2)
Perpanjangan putus (%) = (Penambahan panjang pada saat putus (cm)/ panjang mula-mula (cm)) x 100
Hasil yang diperoleh diinput ke dalam software SPSS untuk dianalisa secara statistik (Abbaspour, M.R., Makhmalzadeh, S. dan Jalali, S, 2010, dengan modifikasi).
3.3.2 Pemilihan Tablet sebagai Substrat
Pada penelitian ini, digunakan tablet propranolol yang digunakan sebagai substrat pada proses penyemprotan film. Tablet yang tersedia adalah tablet propranolol KF dan OD. Tablet-tablet tersebut akan diuji sebelum digunakan sebagai substrat pada penelitian ini untuk memastikan kestabilan fisik tablet dalam proses penyalutan.
3.3.2.1 Kehilangan Bobot
Keterangan:
Wloss = kehilangan bobot (%) A0 = jumlah bobot awal (gram) A1 = jumlah bobot akhir (gram)
3.3.2.2 Kekerasan Tablet
Sebanyak 20 tablet, masing-masing diuji kekerasan dengan alat hardness tester. Kekerasan tablet diukur terhadap luas permukaan tablet dengan menggunakan beban yang dinyatakan dalam kilopound (kp) (Lachman, Lieberman & Kanig, 1986).
3.3.2.3 Friabilitas / Keregasan
Menurut USP, uji friabilitas dilakukan dengan alat friability tester menggunakan tablet dengan bobot ±200 mg dengan jumlah total berat mendekati 6,5 gram untuk tablet dengan berat satuan di bawah 650 mg. Jumlah tablet yang digunakan pada uji ini sebanyak 33 tablet. Parameter yang diuji adalah kerapuhan tablet terhadap gesekan atau bantingan selama waktu tertentu menggunakan alat friability tester. Uji friabilitas dilakukan selama 4 menit dengan kecepatan 25 rpm. Tablet yang baik mempunyai friabilitas kurang dari 1% (US Pharmacopeia 30,
3.3.3 Evaluasi Tablet Inti 3.3.3.1 Keseragaman Kandungan
Uji keseragaman kandungan dilakukan dengan 10 tablet, tiap tablet dimasukkan ke dalam labu ukur 100 ml, ditambahkan 5 ml HCl 1% sambil digoyang sampai hancur. Sebanyak 70 ml metanol ditambahkan, lalu disonikasi selama 1 menit. Metanol diencerkan sampai tanda. Larutan tersebut kemudian
18
UIN SYARIF HIDAYATULLAH JAKARTA
disentrifus sebanyak 3 ml dan diambil supernatannya. Hasil sentrifus kemudian diencerkan dengan metanol secara kuantitatif hingga kadar lebih kurang 40 µg per ml. Sebagai larutan baku, ditimbang dengan seksama sebanyak 40 mg propranolol lalu dilarutkan dan diencerkan dengan metanol hingga kadarnya lebih kurang 40 µg per ml. Ukur serapan larutan uji dan larutan baku pada panjang gelombang 290 nm (Farmakope Indonesia edisi 4, 1995). Hitung jumlah dalam mg propranolol dalam tablet dengan rumus
( ) =
Keterangan:
T = jumlah mg propranolol HCl dalam tablet yang tertera etiket
D = kadar larutan uji dalam µg per ml, berdasarkan kadar tiap tablet yang tertera pada etiket dan pengenceran yang dilakukan.
Au = serapan larutan uji As = serapan larutan baku
3.3.3.2 Waktu hancur
Dilakukan dengan alat disintegrator tester menggunakan 6 tablet KF menggunakan medium aquadest dan asam HCl 0,1 N pada suhu 37±2ºC.
3.3.4 Penyalutan Tablet
19
untuk mengetahui apakah tablet yang telah disalut sudah membentuk film yang tahan asam. Tablet yang sudah tersalut ditimbang dan disimpan dalam wadah tertutup berisi silica gel (Hilmi, 2011, dengan modifikasi).
Tabel 3.2. Formula Penyalut Tablet yang Digunakan
Bahan Jumlah
3.3.5 Evaluasi Tablet Salut Film 3.3.5.1 Penampilan fisik
Tablet yang sudah disalut diamati secara visual meliputi warna dan homogenitas.
3.3.5.2 Penambahan Bobot
Penambahan bobot dihitung setelah proses penyalutan tablet. Tablet yang telah disalut ditimbang seluruhnya dan diukur bobot rata-ratanya dan dibandingkan dengan bobot rata- rata tablet inti sebelum proses penyalutan (Abbaspour, M.R., Makhmalzadeh, S. dan Jalali, S, 2010, dengan modifikasi).
Keterangan:
Wgain = Penambahan bobot (%) W0 = jumlah bobot awal (gram) W1 = jumlah bobot akhir (gram)
3.3.5.3 Tebal dan Diameter Tablet Salut
Tebal dan diameter tablet yang telah disalut diukur menggunakan jangka sorong (Rane dan Kale, 2009).
20
UIN SYARIF HIDAYATULLAH JAKARTA 3.3.5.4 Uji Waktu Hancur Tablet Salut
Uji hancur yang dilakukan untuk tablet salut kitosan dan salut sambung silang kitosan-natrium tripolifosfat, dilakukan dengan alat disintegrator tester menggunakan 6 tablet yang berisi media asam dan aquadest pada suhu 37±2ºC. Tablet diharapkan tidak hancur selama kurang lebih 2 jam (WHO, 2011)
3.3.6 Pembuatan Kurva Kalibrasi dalam Asam dan Dapar Fosfat
Ditimbang secara akurat 50 mg propranolol kemudian dilarutkan dalam masing-masing 100 ml HCl 0,1 N dan dapar fosfat pH 6,8 sehingga diperoleh larutan induk standar asam dan dapar fosfat sebesar 500 μg/mL. Dari larutan induk tersebut diambil sebanyak sebanyak 500, 1000, 1500, 2000, 2500 dan 3000 μL kemudian ditambahkan sampai 50 ml sehingga dihasilkan larutan dengan konsentrasi 5, 10, 15, 20, 25, 30 ppm.
3.3.7 Uji Disolusi
BAB 4
HASIL DAN PEMBAHASAN
4.1. Uji Pendahuluan
Pada awal penelitian, dilakukan uji pendahuluan dengan variasi berbagai konsentrasi NaTPP dengan menyemprotkan larutan penyalut pada substrat kaca untuk membuat simulasi penyalutan film pada tablet dan kemudian dievaluasi film yang terbentuk serta viskositas larutan pembentuk film.
22
UIN SYARIF HIDAYATULLAH JAKARTA
salut tablet yang sebenarnya. Aliran udara panas yang dihasilkan tidak dapat memberi aliran udara panas yang sama di seluruh permukaan film sehingga menghasilkan ketebalan film yang tidak konsisten.
Dari hasil uji mekanik diperoleh data persentase elongation at break (EB) dan tensile strength (TS). Elongation at break merupakan data yang menunjukkan perubahan panjang yang terjadi dari panjang semula sampai film putus saat diberikan gaya penarikan. Sedangkan tensile strength merupakan gaya rentang yang diperlukan agar film yang diuji terputus saat diberikan gaya penarikan. Berdasarkan tabel di atas, diperoleh nilai EB terbaik yaitu 60% pada konsentrasi NaTPP 0,5% sedangkan nilai TS terbaik yaitu 2387,35 N/cm2 pada konsentrasi 0,1%. Nilai EB pada konsentrasi NaTPP 0,5% merupakan yang terbaik, namun perbedaan metode dan konsentrasi tidak menunjukkan perbedaan yang signifikan terhadap nilai EB. Nilai TS yang terbaik yang didapat pada konsentrasi 0,1% dan perbedaan metode tidak memberikan perbedaan yang signifikan sedangkan perbedaan konsentrasi pada 0,1% terhadap 0,05% dan 0,5% tidak signifikan dan signifikan terhadap konsentrasi 1%. Karena nilai TS pada konsentrasi 1% sangat rendah, sehingga konsentrasi yang digunakan pada penelitian kali ini adalah 0,1%. Nilai EB dan TS sangat penting karena menunjukkan kekuatan film yang akan terbentuk pada tablet pada saat penyalutan. Film dengan nilai EB dan TS tinggi akan menghasilkan film yang lebih tahan, khususnya pada proses penyalutan di mana film yang terbentuk pada tablet akan mengalami kontak fisik secara terus menerus dengan panci penyalutan dalam waktu yang cukup lama.
Viskositas larutan kitosan sebagai larutan pembentuk film didapat sebesar 98 cPs dengan menggunakan spindle R2 dan 200 rpm. Viskositas yang diperoleh tidak tinggi. Viskositas larutan penyalut tidak boleh terlalu tinggi, karena dapat mengakibatkan sulitnya penyemprotan larutan penyalut dari pistol semprot pada saat proses penyalutan.
konsentrasi 0,1% dengan nilai EB dan TS yang lebih tinggi secara konsisten dipilih untuk digunakan dalam proses penyalutan selanjutnya.
4.2. Pemilihan Tablet sebagai Substrat
Tablet yang digunakan dalam proses penyalutan adalah tablet yang tersedia di pasaran. Oleh karena itu, tablet yang akan digunakan akan diuji terlebih dahulu daya tahannya dalam proses penyalutan melalui beberapa uji yaitu kehilangan bobot, kekerasan tablet dan friabilitas tablet.
Tabel 4.2. Data Evaluasi Tablet OD dan KF Merk Tablet Kehilangan Bobot
Tablet (%)
Uji kehilangan bobot yang dilakukan sebagai simulasi pada keadaan penyalutan yang sebenarnya. Tablet dengan persentase kehilangan bobot yang lebih besar menunjukkan bahwa tabletnya rapuh saat mengalami proses penyalutan dan dapat berdampak pada permukaan film yang akan terbentuk pada tablet tidak sempurna. Berdasarkan hasil data uji kehilangan bobot tablet didapat data bahwa tablet KF memiliki persen kehilangan bobot yang lebih kecil dibandingkan persen kehilangan bobot tablet OD.
24
UIN SYARIF HIDAYATULLAH JAKARTA 4.3 Keseragaman Kandungan
Tablet KF yang akan digunakan untuk proses selanjutnya, diuji keseragaman kandungannya dengan prosedur yang telah ditetapkan oleh Farmakope Indonesia edisi 4. Hal ini dimaksudkan untuk memastikan kandungan propranolol dalam tablet seragam.
Data keseragaman kandungan yang diperoleh cukup seragam, walaupun dari 10 kali pengulangan pengujian keseragaman kandungan, semuanya tidak mencapai kandungan yang tertera dalam etiket yaitu 40 mg. Rata-rata kandungan propranolol pada tablet yaitu 36,12 ± 1,01 mg atau sekitar 90,31%. Hal yang dapat mempengaruhi yaitu kandungan propranolol sebenarnya yang terkandung dalam tablet tidak mencapai 40 mg sehingga saat diuji menunjukkan hasil di bawah 40 mg. Hal ini dikarenakan adanya rentang berat tablet yang diperbolehkan pada saat produksi sehingga dapat memengaruhi kandungan propranolol yang ada pada tablet. Hal lain yang dapat memengaruhi hasil keseragaman kandungan adalah asal produsen pada saat pembelian propranolol yang digunakan sebagai standar dengan asal produsen yang digunakan sebagai tablet inti berbeda sehingga kemurnian propranolol antara standar dan tablet inti dapat berbeda.
4.4 Evaluasi Tablet Salut
Tablet yang telah disalut dievaluasi dari berbagai macam parameter.
Tabel 4.3. Hasil Evaluasi Tablet Salut Kitosan – Natrium Tripolifosfat
Parameter Hasil
Permukaan Halus, rata
Warna Kuning muda
Bau Tidak berbau
Bobot rata-rata 206,58 mg
% Penambahan bobot 1,443%
Tebal 3,85 mm
Diameter 8,7 mm
26
UIN SYARIF HIDAYATULLAH JAKARTA 4.5 Waktu Hancur Tablet
Tablet yang sudah melewati proses penyalutan kemudian diuji waktu hancurnya dengan menggunakan disintegration tester menggunakan media asam dan aquadest. Tablet yang diuji sebanyak 6 tablet sesuai ketentuan farmakope.
Tabel 4.4 Data Waktu Hancur Tablet dalam Asam dan Aquadest
Medium Tablet Inti
Berdasarkan uji waktu hancur tablet yang telah dilakukan, lapisan salut film yang ada pada tablet dapat memperlambat waktu hancur tablet. Hal ini menunjukkan bahwa film hasil sambung silang kitosan-natrium tripolifosfat mempunyai potensi untuk menahan pelepasan obat dalam tablet. Potensi penahanan pelepasan obat dapat diketahui lebih lanjut dengan uji disolusi.
4.6 Uji Disolusi
Uji disolusi dilakukan untuk mengetahui profil pelepasan obat pada tablet yang telah melalui proses penyalutan. Uji disolusi dilakukan dengan menggunakan dua media, yaitu media asam HCl 0,1 N dan media dapar fosfat pH 6,8.
Tabel 4.5 Data Hasil Uji Disolusi Tablet dalam Asam
28
UIN SYARIF HIDAYATULLAH JAKARTA Tabel 4.6 Hasil Data Uji Disolusi dalam Dapar Fosfat
Waktu
Gambar 4.3. Grafik Jumlah Kumulatif Obat yang Terdisolusi dari Tablet Inti dan Tablet Salut dalam Dapar
tablet salut film mencapai lebih dari 75% pada waktu 120 menit. Film kitosan dalam medium asam akan terlarutsehingga memicu pelepasan obat. Hal ini dapat dikurangi dengan melakukan sambung silang dengan natrium tripolifosfat sehingga dapat mengurangi pelepasan obat pada tablet (Berger et al, 2003). Pada disolusi tablet inti pada medium dapar, kandungan obat hampir terdisolusi seluruhnya pada menit ke 15, yaitu sekitar 94,34%. Tablet salut film dalam medium dapar fosfat menunjukkan pelepasan obat yang lebih lambat dalam waktu 15 menit, yaitu 6,3%. Hal ini disebabkan lapisan film menghambat masuknya medium dapar masuk ke dalam tablet sehingga pelepasan obat yang terjadi jauh lebih lambat. Pelepasan obat pada tablet salut film dalam media asam dalam waktu 60 menit adalah 75,28% dan pada media dapar adalah 70,01%. Walaupun begitu, pelepasan obat propranolol dengan sistem penghantaran obat sustained release diharapkan tidak lebih dari 30% dalam waktu satu jam. Hal ini dikarenakan apabila pelepasan lebih dari 30% akan menyebabkan dose dumping (Khandai, et al, 2010). Oleh karena itu, hasil yang diperoleh menunjukkan bahwa tablet salut kitosan-natrium tripolifosfat yang dibuat dalam penelitian ini tidak bisa dikategorikan ke dalam bentuk sediaan sustained release.
30 BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Tablet salut film kitosan – NaTPP yang dihasilkan memiliki waktu hancur 21,83 ± 2,63 menit dibandingkan dengan tablet inti yang waktu hancur nya 6 ±1 menit. Hal ini menunjukkan bahwa salut film kitosan – NaTPP dapat memperlambat waktu hancur tablet.
2. Profil pelepasan propranolol pada tablet salut film dalam media asam dan dapar fosfat dalam waktu 30 menit masing-masing 34,976 ± 1,132% dan 15,442 ± 0,360%. Pelepasan propranolol pada tablet inti dalam asam dan dapar fosfat pada menit 30 masing-masing adalah 85,81 ± 0,3602% dan 96,444 ± 2,542%. Hal ini menunjukkan bahwa salut film kitosan – NaTPP mempunyai potensi untuk memperlambat pelepasan obat, walaupun belum maksimal.
5.2. Saran
1. Perlu penelitian lanjutan tentang metode penyalutan yang optimal dan lebih stabil untuk menggunakan kombinasi sambung silang kitosan – natrium tripolifosfat sebagai larutan penyalut serta menggunakan tablet yang khusus digunakan pada proses penyalutan.
DAFTAR PUSTAKA
Abbaspour, M.R., Makhmalzadeh. S. & Jalali. S. (2010). Study of free-films and coated tablets based on HPMC and Microcrystalline Cellulose, aimed for improved stability of moisture-sensitive drugs. Jundishapur Journal of Natural Pharmaceutical Products, 2010; 5 (1): 6-17
Agnihotri, S.A., Mallikarjuna, N.N., & Aminabhavi, T.M. (2004). Recent advances on chitosan-based micro- and nanoparticles in drug delivery. Journal of Controlled Release 100: 5 –28
Anggraeni, Y. (2012). Tesis Preparasi dan Karakterisasi Film Sambung Silang Kitosan – Tripolifosfat yang Mengandung Asiatikosida sebagai Pembalut
Bioaktif untuk Luka. Fakultas Matematika dan Ilmu Pengetahuan Alam Program Magister Ilmu Kefarmasian. Universitas Indonesia. Depok
Ankit, G., Ajay, B., Kumar, K.M., Neetu, K., Seth, G.L., Bihani, S.D. (2012). Tablet Coating Techniques: Concepts and Recent Trends. International Research Journal of Pharmacy, ISSN 2230-8407.
Anonim. (2006). The Japanese Pharmcopeia (ed 15). Evaluation and Licensing Division, Pharmaceutical and Food Safety Bureau, Ministry of Health, Labour, and Welfare. Japan
Anonim. (1995). Farmakope Indonesia (ed 4). Departemen Kesehatan Republik Indonesia. Jakarta.
Anonim. (1985). Farmakope Indonesia (ed 3). Departemen Kesehatan Republik Indonesia. Jakarta.
Anonim. (2007). United State Pharmacopeia 30 (ed 25). United States Pharmacopeial Convention. United States of America
Ansel, H.C. (2005). Pengantar Bentuk Sediaan Farmasi (ed. 4). Penerbit Universitas Indonesia (UI-Press). Jakarta.
32
UIN SYARIF HIDAYATULLAH JAKARTA
Berger, J., Reist, M., Mayera, J.M., Felt, O., Peppas, N.A., Gurny, R. (2004). Structure and interactions in covalently and ionically crosslinked chitosan hydrogels for biomedical applications. European Journal of Pharmaceutics and Biopharmaceutics, 57 19–34.
Bhumkar, D.R. & Pokharkhar, V.B., (2006). Studies on Effect of pH on Cross-linking of Chitosan With Sodium Tripolyphosphate: A Technical Note. AAPS PharmSciTech 2006; 7 (2) Article 50
Chemical Book. (2010). Februari 11, 2014.
http://www.chemicalbook.com/chemicalproductproperty_en_CB6270667.h
tm
Dutta, P.K., Dutta, J. & Tripathi, V.S. (2004). Chitin and Chitosan: Chemistry, properties and applications. Journal of Scientific and Industrial Research, Vol. 63 pp 20 – 31.
Flynn, G.L. (1982). Considerations in controlled release drug delivery system. Pharm. Tech 6, 33–39,
Hillery, A.M., Lloyd, A.W., Swarbrick, J. (2005) Drug Delivery and Targeting for Pharmacists and Pharmaceutical Scientists. Taylor & Francis Inc. New York
Hilmi, A.P. (2011). Skripsi Formulasi Tablet Salt Film Ekstrak Etanol Daun Laban Abang (Aglaia elliptica Blume) Menggunakan Polimer Kitosan.
Fakultas Kedokteran dan Ilmu Kesehatan Program Studi Farmasi. Universitas Islam Negeri Syarif Hidayatullah Jakarta. Ciputat.
Hoffman, B.B. (2006). Therapy of Hipertension dalam Goodman & Gilman’s The Pharmacological Basis of Therapeutics.(ed 11). Editor. L.L. Brunton. Mc Graw-Hill. New York
Hogan, J.E., Cole, G., Aulton, M.E. (2002). Pharmaceutical Coating Technology. Taylor & Francis e-library. 1900 Frost Road Suite 101, Bristol, United Kingdom.
Khandai, M., Chakraborty, S., Sharma, A., Panda, D., Khanam, N. dan Panda, S.K. (2010). Development of propranolol hydrochloride matrix tablets: an investigation on effects of combination of hydrophilic and hydrophobic matrix formers using multiple comparison analysis. International Journal of Pharmaceutical Sciences Review and Research. Volume 1 Issue 2 Article 1
Ko, J.A., Park, H.J., Hwang, S.J., Park, J.B. dan Lee, J.S (2002). Preparation and characterization of chitosan microparticles intended for controlled drug delivery. Int. J. Pharm 249. 165 -174
Lachman,L., Lieberman, H.A. dan Kanig, J. L. (1986). The theory and practice of Industrial Pharmacy (3rd ed). Philadelphia: Lea & Febriger.
Ranade, V.V., Hollinger, M.A. (2004) Drug Delivery System (2nd ed). CRC Press. New York
Rowe, R.C., Sheskey, P.J., & Quinn, M.E. (2009). Handbook of Pharmaceutical Excipient (ed.6). London: Pharmaceutical Press.
Rane, S. dan Kale, V. (2009). Evaluation of modified Guar Gum as film coating material. International Journal of ChemTech Research. Vol.1, No.2, pp 180-182
Salger, S.V., Danki, L.S., Hiremath, S., Sayeed, A. (2010). Preparation and Evaluation of Sustained Release Matrix Tablets of Propranolol Hydrochloride. International Journal of Pharma and Bio Sciences Vol.1, Issue-4
Shu, X.Z. & Zhu, K.J. (2002). The influence of multivalent phosphate structure on the properties of ionically cross-linked chitosan films for controlled drug release. European Journal of Pharmaceutics and Biopharmaceutics 54 (2002) 235–243
34
UIN SYARIF HIDAYATULLAH JAKARTA
DAFTAR LAMPIRAN
Lampiran 1 Alur Penelitian
Uji
PendahuluanEvaluasi Film pada Substrat
Pemilihan Tablet sebagai Substrat
Evaluasi Tablet Inti
Penyalutan Tablet
Evaluasi Tablet Salut Film
Uji Disintegrasi
Tablet Uji Disolusi Tablet
36
UIN SYARIF HIDAYATULLAH JAKARTA
Lampiran 2 Alat – alat yang digunakan
Kompressor
Kompressor Hardness Tester
Friabilator Coating Pan
Dumbbell Astm-D-1822-L
Hairdryer Disintegration Tester
Dissolution Tester Spectrofotometer UV-VIS
Viskometer Haake
38
UIN SYARIF HIDAYATULLAH JAKARTA
Lampiran 3. Ketebalan ukuran film
Formula Film
Ketebalan film
Tengah (mm)
Pinggir #1(mm)
Pinggir #2 (mm)
Rata-rata (mm)
Simpangan Baku
A1 0,043 0,048 0,049 0,046 0,003
B1 0,058 0,063 0,059 0,06 0,002
C1 0,055 0,058 0,059 0,057 0,002
D1 0,077 0,077 0,068 0,074 0,005
A2 0,056 0,052 0,079 0,062 0,014
B2 0,057 0,054 0,058 0,056 0,002
C2 0,072 0,065 0,063 0,066 0,004
Lampiran 4. Data Uji Mekanik Film-1
40
UIN SYARIF HIDAYATULLAH JAKARTA
Lampiran 5. Data Uji Mekanik Film-2
Metode Konsentrasi Elongation at break (%)
Untuk menghitung % Elongation at Break (EB) adalah
% = � − �� %
Keterangan:
% = , − � %
= 20%
Untuk menghitung Tensile Strength (TS)adalah
= � � � �
Keterangan:
F = gaya pada saat film putus (kg x9,8 ms-2 / N) Lebar Film = 0,3 cm
= , � ,, � ,
= 1328 kg/cm2
Lampiran 6. Hasil normalitas dan homogenitas data SPSS perubahan metode dan konsentrasi terhadap EB dan TS
Tests of Normality
Metode Kolmogorov-Smirnova Shapiro-Wilk
Statistic Df Sig. Statistic df Sig.
EB
metode A .314 12 .002 .763 12 .004
metode B .250 12 .037 .858 12 .046
TS metode A .220 12 .112 .871 12 .067
metode B .214 12 .137 .916 12 .254
42
Based on Median and with
adjusted df .044 1 20.848 .836
Based on trimmed mean .204 1 22 .656
TS
Based on Mean .370 1 22 .549
Based on Median .138 1 22 .714
Based on Median and with
adjusted df .138 1 21.970 .714
Based on trimmed mean .388 1 22 .540
Tests of Normality
konsentrasi Kolmogorov-Smirnova Shapiro-Wilk
Statistic df Sig. Statistic df Sig.
*. This is a lower bound of the true significance.
Test of Homogeneity of Variance
Levene Statistic df1 df2 Sig.
EB
Based on Mean .360 3 20 .783
Based on Median .208 3 20 .889
Based on Median and with
adjusted df .208 3 15.000 .889
Based on trimmed mean .338 3 20 .798
TS
Based on Mean 1.475 3 20 .251
Based on Median .479 3 20 .700
Based on Median and with
adjusted df .479 3 15.182 .701
Based on trimmed mean 1.380 3 20 .278
Keterangan: Nilai normalitas <0,05 menunjukkan bahwa penyebaran data yang ada tidak normal sehingga digunakan Uji Kruskal Wallis.
Lampiran 7. Hasil Kruskal Wallis tentang perbedaan metode terhadap EB
Ranks
44
UIN SYARIF HIDAYATULLAH JAKARTA
Lampiran 8. Hasil Uji Anova tentang perbedaan metode terhadap TS
ANOVA
TS
Sum of Squares df Mean Square F Sig.
Between Groups 95759.403 1 95759.403 .229 .637
Within Groups 9208637.669 22 418574.440
Total 9304397.073 23
Keterangan: untuk uji Anova, p > 0,05 menunjukkan bahwa hasil yang tidak signifikan.
Lampiran 10. Hasil Uji Anova tentang Perbedaan Konsentrasi terhadap TS
ANOVA
TS
Sum of Squares df Mean Square F Sig.
Between Groups 6536546.894 3 2178848.965 15.744 .000
Within Groups 2767850.179 20 138392.509
Total 9304397.073 23
Keterangan: untuk uji Anova, p > 0,05 menunjukkan bahwa hasil yang tidak signifikan.
Lampiran 11. Hasil Post Hoc Test
Multiple Comparisons
Std. Error Sig. 95% Confidence Interval
Lower Bound Upper Bound
0,05%
0,1% -60.92000 214.78090 .780 -508.9451 387.1051
0,5% 550.99833* 214.78090 .018 102.9732 999.0234
1% 1235.53667* 214.78090 .000 787.5116 1683.5618
0,1%
0,05% 60.92000 214.78090 .780 -387.1051 508.9451
0,5% 611.91833* 214.78090 .010 163.8932 1059.9434
1% 1296.45667* 214.78090 .000 848.4316 1744.4818
0,5%
0,05% -550.99833* 214.78090 .018 -999.0234 -102.9732
0,1% -611.91833* 214.78090 .010 -1059.9434 -163.8932
1% 684.53833* 214.78090 .005 236.5132 1132.5634
1%
0,05% -1235.53667* 214.78090 .000 -1683.5618 -787.5116
0,1% -1296.45667* 214.78090 .000 -1744.4818 -848.4316
0,5% -684.53833* 214.78090 .005 -1132.5634 -236.5132
46
UIN SYARIF HIDAYATULLAH JAKARTA
Lampiran 12. Data Kehilangan Bobot Merk Tablet Bobot total sebelum
pengujian (gram)
Lampiran 13.Data Kekerasan Tablet
Merk Tablet Rata – rata nilai Kekerasan Tablet (kP)
Tablet OD 3,262 ± 0,214
Tablet KF 9,506 ± 2,026
Lampiran 14. Data Friabilitas Tablet
Merk Tablet Bobot sebelum Uji Friabilitas (gram)
Untuk menghitung persen friabilitas tablet menggunakan rumus
= − x %
Keterangan:
F = friabilitas (%)
= , , − , x %
= 0,01%
Lampiran 15. Data Absorbansi Uji Keseragaman Kandungan
Tablet
T = jumlah mg propranolol HCl dalam tablet yang tertera etiket
D = kadar larutan uji dalam µg per ml, berdasarkan kadar tiap tablet yang tertera pada etiket dan pengenceran yang dilakukan.
Au = serapan larutan uji As = serapan larutan baku
Sehingga untuk menghitung kandungan obat pada tablet
( ) = ,,
48
UIN SYARIF HIDAYATULLAH JAKARTA
Lampiran 16. Data Waktu Hancur Tablet dalam Media Asam Waktu Hancur (menit)
Tablet 1 Tablet 2 Tablet 3 Tablet 4 Tablet 5 Tablet 6
Tablet Inti 5 7 6 6 5 7
Tablet Salut
Kitosan-NaTPP
20 20 25 25 19 22
Tablet Salut Kitosan
6 6 6 5 5 6
`
Lampiran 17 Data Waktu Hancur Tablet dalam Media Aquadest
Waktu Hancur (menit)
Tablet 1 Tablet 2 Tablet 3 Tablet 4 Tablet 5 Tablet 6
Tablet Inti 5 5 5 5 5 5
Tablet Salut
Kitosan-NaTPP
90 90 90 90 59 75
Tablet Salut Kitosan
Lampiran 18. Tabel dan Kurva Kalibrasi Propranolol dalam Asam
R² = 0,998 y = 0,021x - 0,0031
-0,1 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7
0 5 10 15 20 25 30 35
Abso
rb
an
si
Konsentrasi (ppm) konsentrasi absorbansi
0 0
50
UIN SYARIF HIDAYATULLAH JAKARTA
Lampiran 19. Tabel dan Kurva Kalibrasi Propranolol dalam Dapar Fosfat
Lampiran 20. Data Uji Disolusi Tablet inti dalam Asam
I II III I II III I II III I II III I II III
0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0
5 0,32 0,456 0,44 15,44 21,89 21,13 0,08 0,12 0,12 13,90 19,70 19,02 38,48 54,53 52,64
15 0,554 0,705 0,71 26,53 33,69 33,93 0,15 0,19 0,19 23,96 30,43 30,64 66,32 84,23 84,81
30 0,718 0,716 0,711 34,31 34,21 33,97 0,19 0,19 0,19 31,08 31,07 30,85 86,04 85,99 85,40
45 0,729 0,721 0,718 34,83 34,45 34,31 0,19 0,19 0,19 31,72 31,45 31,32 87,81 87,05 86,69
60 0,725 0,71 0,709 34,64 33,93 33,88 0,19 0,19 0,19 31,72 31,15 31,10 87,82 86,23 86,10
120
0,722 0,718 0,715 34,50 34,31 34,16 0,19 0,19 0,19 31,77 31,66 31,53 87,94 87,64 87,27
% terdisolusi menit
ke-Abs. Propanolol C (ppm) Faktor Koreksi (FK) Jumlah Obat yang Terdisolusi
52
UIN SYARIF HIDAYATULLAH JAKARTA
Lampiran 21. Data Uji Disolusi Tablet inti dalam Dapar Fosfat
I II III I II III I II III I II III I II III
0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0
5 0,387 0,311 0,391 21,02 16,87 21,23 0,12 0,09 0,12 18,91 15,18 19,11 52,36 42,03 52,90
15 0,691 0,684 0,707 37,60 37,21 38,47 0,21 0,20 0,21 33,94 33,58 34,73 93,95 92,94 96,13
30 0,696 0,694 0,727 37,87 37,76 39,56 0,21 0,21 0,22 34,37 34,25 35,90 95,15 94,81 99,37
45 0,698 0,688 0,712 37,98 37,43 38,74 0,21 0,21 0,21 34,66 34,14 35,36 95,94 94,51 97,88
60 0,71 0,685 0,707 38,63 37,27 38,47 0,21 0,20 0,21 35,43 34,18 35,30 98,09 94,62 97,73
120 0,701 0,68 0,71 38,14 37,00 38,63
0,21 0,20 0,21 35,18 34,12 35,64 97,39 94,45 98,66
% terdisolusi
Lampiran 22. Data Uji Disolusi Tablet Salut dalam Asam
I II III I II III I II III I II III I II III
0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0
5 0,048 0,042 0,035 2,43 2,15 1,81 0,01 0,01 0,01 2,19 1,93 1,63 6,06 5,35 4,52
15 0,128 0,132 0,119 6,24 6,43 5,81 0,03 0,04 0,03 5,63 5,80 5,24 15,58 16,05 14,50
30 0,301 0,282 0,29 14,47 13,57 13,95 0,08 0,07 0,08 13,07 12,25 12,59 36,17 33,91 34,85
45 0,451 0,44 0,44 21,61 21,08 21,08 0,12 0,12 0,12 19,56 19,08 19,08 54,14 52,83 52,82
60 0,638 0,617 0,626 30,50 29,50 29,93 0,17 0,16 0,16 27,67 26,77 27,15 76,60 74,09 75,15
120
0,71 0,718 0,733 33,93 34,31 35,02 0,19 0,19 0,19 30,91 31,24 31,88 85,55 86,47 88,24
Jumlah Obat yang Terdisolusi
(mg) % terdisolusi
menit
54
UIN SYARIF HIDAYATULLAH JAKARTA
Lampiran 23. Data Uji Disolusi Tablet Salut dalam Dapar Fosfat
I II III I II III I II III I II III I II III
0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0
5 0,014 0,014 0,015 0,67 0,67 0,73 0,00 0,00 0,00 0,60 0,60 0,65 1,67 1,67 1,81
15 0,046 0,046 0,052 2,42 2,42 2,74 0,01 0,01 0,02 2,18 2,18 2,47 6,03 6,03 6,85
30 0,112 0,117 0,116 6,02 6,29 6,24 0,03 0,03 0,03 5,43 5,68 5,63 15,03 15,71 15,58
45 0,302 0,218 0,197 16,38 11,80 10,65 0,09 0,06 0,06 14,79 10,66 9,64 40,93 29,52 26,67
60 0,452 0,524 0,568 24,56 28,49 30,89 0,14 0,16 0,17 22,23 25,74 27,90 61,54 71,26 77,23
120
0,619 0,681 0,703 33,67 37,05 38,25 0,19 0,20 0,21 30,55 33,59 34,68 84,57 92,99 96,00
% terdisolusi
Untuk mengetahui persen terdisolusi obat dalam tablet dalam media asam maka, Diketahui : y = 0,021x - 0,0031
y0 = 0
y5 = 0,32
y15 = 0,554
kadar zat aktif dalam sediaan = 36,12 mg
Ditanya : C0 =? % terdisolusi zat aktif pada t0 = ? C5 =? % terdisolusi zat aktif pada t5 = ? C15 =? % terdisolusi zat aktif pada t15 = ? a. Mencari nilai x pada menit ke 0
y = 0,021x - 0,0031
0 = 0,021x - 0,0031
C0 = 0 ppm
b. Mencari nilai x pada menit ke 5
y = 0,021x - 0,0031
0,32 = 0,021x - 0,0031
C5 = 15,44 ppm
c. Mencari nilai x pada menit ke 15
y = 0,021x - 0,0031
0,55 = 0,021x - 0,0031
C15 = 26,53 ppm
d. Jumlah zat aktif yang terdisolusi pada menit ke 0
Disolusi = C0 x Volume (L) x Faktor Pengenceran (FP)
Disolusi = 0 x 0,9 x 1 = 0 mg
% terdisolusi = � � �
56
UIN SYARIF HIDAYATULLAH JAKARTA
% terdisolusi =
, � % = %
e. Jumlah zat aktif yang terdisolusi pada menit ke 5
Faktor koreksi t0 = C0 x � � � �
� ℎ �
Faktor koreksi = 0 x
9 = 0
Disolusi = (C5 + FK0) x Volume (L) x FP
Disolusi = (15,44 + 0) x 0,9 x 1 = 13,9 mg
% terdisolusi = � � �
� � � %
% terdisolusi = ,9
, � % = , %
f. Jumlah zat aktif yang terdisolusi pada menit ke 15
Faktor koreksi t5 = C5 x � � � �
� ℎ �
Faktor koreksi = 15,44 x
9 = 0,08
Disolusi = (C15+FK0+FK15) x Volume (L) x FP
Disolusi = (26,53 + 0+0,08) x 0,9 x 1 = 23,96 mg
% terdisolusi = � � �
� � � %
% terdisolusi = ,9