RESPON
Phaeophleospora sp.
TERHADAP FUNGISIDA
BERBAHAN AKTIF TEMBAGA OKSIDA SECARA IN VITRO
SKRIPSI
ADRIAN DONNELLIUS SIMBOLON 101201067
BUDIDAYA HUTAN
PROGRAM STUDI KEHUTANAN FAKULTAS PERTANIAN UNIVERSITAS SUMATERA UTARA
LEMBAR PENGESAHAN
Judul Peneletian : Respon Phaeophleospora sp. Terhadap Fungisida Berbahan Aktif Tembaga Oksida secara in vitro Nama : Adrian Donnellius Simbolon
NIM : 101201067
Program Studi : Kehutanan
Minat : Budidaya Hutan
Disetujui oleh Komisi Pembimbing
Dr.Ir. Edy Batara Mulya Siregar, MS Nelly Anna S.Hut.,M.Si
Ketua Anggota
Mengetahui,
ABSTRAK
ADRIAN SIMBOLON : Respon Phaeophleospora sp. Terhadap Fungisida Berbahan Aktif Tembaga Oksida secara in vitro. Dibawah bimbingan Edy Batara Mulya Siregar dan Nelly Anna.
Phaeophleospora sp. merupakan patogen utama yang menyerang Eukaliptus. Patogen ini merupakan salah satu masalah utama yang menyerang pertanaman Eukaliptus di manapun di dunia terutama di Indonesia. Fungisida digunakan untuk memberantas dan mencegah perkembangan fungi. Fungisida yang digunakan dalam penelitian ini adalah fungisida kontak dengan bahan aktif Tembaga Oksida 56%. Penelitian ini bertujuan mengukur luas, diameter, kerapatan spora dan mengkarakterisasi bentuk hifa Phaeophleospora sp. setelah diberi perlakuan. Sampel yang digunakan diambil dari koleksi Phaeophleospora sp. yang di dapat dari penelitian sebelumnya. Penelitian ini dilakukan di Laboratorium Bioteknologi Hutan dan Laboratorium Hama dan Penyakit Tanaman, Fakultas Pertanian, Universitas Sumatera Utara.
Hasil penelitian menunjukkan konsentrasi perlakuan tembaga oksida 0 mg/ml, 0.28 mg/ml, 0.56 mg/ml, 0.64 mg/ml, 1.12 mg/ml tidak berpengaruh nyata.
ABSTRACT
ADRIAN SIMBOLON : Response Phaeophleospora sp. of Active Substance Fungicide Cuprum Oxide At on In Vitro. Under guidance of Edy Batara Mulya Siregar and Nelly Anna.
Phaeophleospora sp. is a major disease that attacks the Eucalyptus. This diseases is seen as one of the main problems that attacks Eucalyptus plantations anywhere in the world. Fungicides are used to eradicate and prevent the development of fungi. Fungicide used is a contact fungicide with active material Cuprum Oxide 56%. This aims research is to measure the area, diameter, density of spores and characterize hyphae form of Phaeophleospora sp. after being treated. The sample used was taken from the collection Phaeophleospora sp. obtained from previous researchs. This research was conducted at Forest Biotechnology Laboratory and Pest and Plant Disease Laboratory , Faculty of Agriculture, University of North Sumatera. The results showed the concentration of fungicide 0 mg / ml, 0.28 mg / ml, 0.56 mg / ml, 0.64 mg / ml, 1.12 mg / ml had no significant effect.
RIWAYAT HIDUP
Penulis lahir di Sidikalang pada tanggal 18 April 1992 dari Ayah B. Simbolon, S.pd dan R. Sianturi. Menamatkan Sekolah Dasar dari SDN 030277 pada Tahun 2004. Kemudian melanjutkan sekolah di SMP N 1 Sidikalang yang tamat tahun 2007. Melanjut ke SMA Negeri 1 Sidikalang tamat tahun 2010.
Tahun 2010 melanjutkan ke Perguruan Tinggi Universitas Sumatera Utara melalui jalur UMB dengan jurusan Kehutanan. Penulis melakukan penelitian dengan judul Respon Phaeophleospora sp. Terhadap Fungisida Berbahan Aktif Tembaga Oksida secara in vitro.
KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadirat Tuhan Yang Maha Esa, karena rahmatNya penulis dapat menyelesaikan penyusunan skripsi yang berjudul “Respon Phaeophleospora sp. Terhadap Fungisida Berbahan Aktif Tembaga Oksida secara in vitro ” ini dengan baik. Tujuan penelitian untuk Mengukur efektifitas fungisida dalam mengendalikan penyakit busuk daun, mengukur luas dan diameter koloni jamur Phaeophleospora sp., menghitung kerapatan Phaeophleospora sp., mengkarakterisasi bentuk Phaeophleospora sp. setelah
diberi perlakuan. Skripsi ini merupakan tugas akhir untuk menyelesaikan studi pada jenjang Strata satu (S1) Kehutanan menurut kurikulum Program Studi Kehutanan, Fakultas Pertanian, Universitas Sumatera Utara, Medan.
Penulis mengucakan terima kasih yang sebesar besarnya kepada : kedua orang tua, ayahanda B. Simbolon, S.pd dan ibunda R. Sianturi yang telah banyak memberi dukungan dengan baik kepada penulis, saudara penulis (R. Simbolon, M. Silalahi, Revita, Lia, Imanuel, Septian, Nesya, Guardi) yang selalu memberi semangat dan doa kepada penulis, Dr. Ir. Edy Batara Mulya Siregar, M.S selaku ketua komisi pembimbing dan Nelly Anna, S.Hut, M.Si selaku anggota komisi pembimbing dalam penulisan skripsi ini, teman-teman satu penelitian,teman-teman seperjuangan Noa, Mario, Riston, Septo, Gusti, dan semua penelitian,teman-teman-penelitian,teman-teman BDH 2010 yang telah memberikan dukungan kepada penulis.
DAFTAR ISI
Inokulasi jamur patogen ... 13
Pengamatan ... 13
Diameter koloni Phaeophleospora sp ... 14
Luas koloni Phaeophleospora sp ... 14
Persentase hambatan relatif koloni Phaeophleospora sp 14
Kerapatan spora Phaeophleospora sp. ... 15
Luas koloni Phaeophleospora sp ... 15
Analisis data ... 16
HASIL DAN PEMBAHASAN Respon Phaeophleospora sp ... 17
Tampilan Makroskopis... 17
Diameter koloni Phaeophleospora sp. ... 18
Bentuk dan warna koloni ... 18
Persentase hambatan relatif koloni Phaeophleospora sp ... 21
Luas koloni Phaeophleospora sp ... 22
Tampilan Mikroskopis. ... 23
Kerapatan spora ... 23
Pengamatan bentuk spora ... 24
KESIMPULAN DAN SARAN Kesimpulan ... 26
Saran ... 26
DAFTAR PUSTAKA ... 27
DAFTAR TABEL
No. Halaman
1. Bentuk dan warna koloni Phaeophleospora sp. pada pengamatan
14 HSI ... 18
2. Uji F taraf 5% diameter fungi Phaeophleospora sp ... 20
3. Uji F taraf 5% diameter fungi Phaeophleospora sp ... 21
4. Uji F taraf 5 % luas koloni fungi Phaeophleospora sp ... 22
5. Hambatan relatif koloni jamur Phaeophleospora sp. ... 22
DAFTAR GAMBAR
No. Halaman
1. Rumus bangun tembaga oksida... 12
2. Tampilan depan Phaeophleospora sp. ... 17
3. Grafik pertumbuhan diameter Phaeophleospora sp. ... 19
DAFTAR LAMPIRAN
No. Halaman
ABSTRAK
ADRIAN SIMBOLON : Respon Phaeophleospora sp. Terhadap Fungisida Berbahan Aktif Tembaga Oksida secara in vitro. Dibawah bimbingan Edy Batara Mulya Siregar dan Nelly Anna.
Phaeophleospora sp. merupakan patogen utama yang menyerang Eukaliptus. Patogen ini merupakan salah satu masalah utama yang menyerang pertanaman Eukaliptus di manapun di dunia terutama di Indonesia. Fungisida digunakan untuk memberantas dan mencegah perkembangan fungi. Fungisida yang digunakan dalam penelitian ini adalah fungisida kontak dengan bahan aktif Tembaga Oksida 56%. Penelitian ini bertujuan mengukur luas, diameter, kerapatan spora dan mengkarakterisasi bentuk hifa Phaeophleospora sp. setelah diberi perlakuan. Sampel yang digunakan diambil dari koleksi Phaeophleospora sp. yang di dapat dari penelitian sebelumnya. Penelitian ini dilakukan di Laboratorium Bioteknologi Hutan dan Laboratorium Hama dan Penyakit Tanaman, Fakultas Pertanian, Universitas Sumatera Utara.
Hasil penelitian menunjukkan konsentrasi perlakuan tembaga oksida 0 mg/ml, 0.28 mg/ml, 0.56 mg/ml, 0.64 mg/ml, 1.12 mg/ml tidak berpengaruh nyata.
ABSTRACT
ADRIAN SIMBOLON : Response Phaeophleospora sp. of Active Substance Fungicide Cuprum Oxide At on In Vitro. Under guidance of Edy Batara Mulya Siregar and Nelly Anna.
Phaeophleospora sp. is a major disease that attacks the Eucalyptus. This diseases is seen as one of the main problems that attacks Eucalyptus plantations anywhere in the world. Fungicides are used to eradicate and prevent the development of fungi. Fungicide used is a contact fungicide with active material Cuprum Oxide 56%. This aims research is to measure the area, diameter, density of spores and characterize hyphae form of Phaeophleospora sp. after being treated. The sample used was taken from the collection Phaeophleospora sp. obtained from previous researchs. This research was conducted at Forest Biotechnology Laboratory and Pest and Plant Disease Laboratory , Faculty of Agriculture, University of North Sumatera. The results showed the concentration of fungicide 0 mg / ml, 0.28 mg / ml, 0.56 mg / ml, 0.64 mg / ml, 1.12 mg / ml had no significant effect.
11
PENDAHULUAN
Latar Belakang
Hutan tanaman berfokus pada pengembangan jenis tanaman cepat tumbuh (fast growing species) dan berdaur hidup pendek sebagai tanaman pokoknya. Tanaman eukaliptus merupakan salah satu tanaman yang pertumbuhannya cepat (fast growing species). Eukaliptus merupakan salah satu jenis kayu yang digunakan sebagai bahan baku pulp atau bubur kertas (Widarto, 1996).
Eucalyptus sp. (Myrtaceae) telah banyak ditanam di beberapa negara tropis Tanaman, pada lahan yang luas. Spesies-spesies lain yang telah dicoba penanaman dalam skala kecil, seperti E. Camadulensis, E. Grandis, E. Pellita, E. Tereticornis, dan E. Torreliana. Penanaman Eukaliptus paling banyak dilakukan di Sumatera ( Aceh, Sumatera Utara, Jambi) dan Kalimantan (Nair,2000).
Ditinjau dari segi kualitas hidup eukaliptus mempunyai banyak gangguan penyakit. Menurut Rahayu (1999) penyakit pohon Eucalyptus urophylla berupa bercak daun (leaf spot disease) disebabkan kelas Deutromycetes, Macrophonasp., Curvulariasp., Pestalotia sp., Gleosporium sp., Helmintosporium sp. Bercak daun umum terjadi di persemaian atau tanaman di lapangan.
Phaeophleospora (Kirramyces) adalah patogen yang menyerang daun
grandis di Sumatera dan tingkat keparahan hawar daun menyebabkan fungi ini disebut Kirramyces (Old, et al.,2003a).
Penyakit daun Destructans dan hawar pucuk yang disebabkan P. destructans merupakan penyakit utama yang menyerang Eukaliptus di area Danau Toba. Penyakit ini ditemukan pertama kali di Aek Nauli, kira- kira sepuluh tahun yang lalu. Penyakit ini dipandang sebagai salah satu masalah utama yang menyerang pertanaman Eukaliptus di manapun di dunia. Oleh karena kerusakan yang dapat ditimbulkannya maka perlu dilakukan penelitian yang berguna untuk mengetahui resistensi dari tanaman Eucalyptus spp. terhadap Phaeophleospora sp (Silalahi, 2008).
mengandung fungisida yang akan di uji. Ketiga, mengukur respirasi dari jamur dalam pengaruh fungisida yang akan diuji (Semangun, 2000).
Tujuan Penelitian
1. Mengukur respon Phaeophleospora sp. (luas, diameter, hambatan relatif, kerapatan spora) terhadap perlakuan konsentrasi fungisida berbahan aktif tembaga oksida (0 mg/ml, 0.28 mg/ml, 0.56 mg/ml, 0.84 mg/ml, 1.12 mg/ml). 2. Mengkarakterisasi pertumbuhan koloni (bentuk, warna, tekstur) dan
perubahan hifa terhadap perlakuan konsentrasi fungisida berbahan aktif tembaga oksida (0 mg/ml, 0.28 mg/ml, 0.56 mg/ml, 0.84 mg/ml, 1.12 mg/ml).
Hipotesis Penelitian
Respon Phaeophleospora sp. (luas, diameter, hambatan relatif, kerapatan spora, bentuk, warna, tekstur) terhadap fungisida berbahan aktif tembaga oksida bepengaruh nyata.
Manfaat Penelitian
1. Sebagai informasi atau masukan tentang konsentrasi yang tepat yang disebabkan oleh Phaeophleospora sp. pada pembibitan tanaman Eucalyptus spp.
TINJAUAN PUSTAKA
Eukaliptus (Eucalyptus spp.)
Tanaman Eucalyptus spp. merupakan famili Myrtaceae, terdiri atas lebih kurang 700 jenis. Jenis Eucalyptus spp. dapat berupa semak dan perdu sampai mencapai ketinggian 100 meter. Batang umumnya bulat, lurus, tidak berbanir dan sedikit bercabang. Pohon pada umumnya bertajuk sedikit ramping, ringan dan banyak meloloskan cahaya matahari. Cabangnya lebih banyak membuat sudut ke atas, jarang-jarang dan daunnya tidak begitu lebat. Daunnya berbentuk lanset hingga bulat telur memanjang dan bagian ujungnya runcing membentuk kait. Jenis-jenis yang sudah dikenal umum antara lain E. deglupta, E. urophylla, E. camadulensis, E. grandis, E. pellita, E. tereticornis, dan E. torreliana (Latifah, 2004).
Eucalyptus spp. merupakan salah satu tanaman yang bersifat fast growing
(tanaman cepat tumbuh). Eucalyptus spp. juga dikenal sebagai tanaman yang dapat bertahan hidup pada musim kering. Tanaman ini mempunyai sistem perakaran yang dalam namun jika ditanam di daerah dengan curah hujan sedikit maka perakarannya cenderung membentuk jaringan rapat dekat permukaan tanah untuk memungkinkan menyerap setiap tetes air yang jatuh di cekaman tersebut. (Poerwowidodo, 1991).
Curvularia sp., Pestalotia sp., Gleosporium sp., Helmintosporium sp. Bercak daun umum terjadi di persemaian atau tanaman di lapangan.
Berdasarkan hasil penelitian Silalahi (2008) yang telah dilakukan sebelumnya di lokasi pembibitan Toba Pulp Lestari Porsea, diperoleh fungi patogen penyakit tanaman dengan mengamati ciri makroskopik dan mikroskopiknya. Hasil penelitian menunjukkan terdapat lima spesies fungi yaitu Cylindrocladium reteaudii, Mycosphaerella sp.,Cryptosporiopsis sp. dan ada dua spesies dari Phaeophleospora sp. Berdasarkan pengamatan gejala penyakit tanaman pada pembibitan ditemukan tiga jenis gejala yaitu hawar daun, black mildow, dan bercak daun.
Berdasarkan hasil penelitian yang telah dilakukan sebelumnya di lokasi pembibitan PT. Toba Pulp Lestari Porsea diperoleh gejala penyakit pada eukaliptus berupa hawar daun atau leaf blight yang berukuran kecil kemudian menyebar menutupi bagian daun. Gejala penyakit ini pada daun berukuran kecil dan berwarna merah dan dapat menyebar pada daun sekitarnya sehingga daun akan kering, mati dan gugur. Fungi penyebab gejala penyakit yang ditemukan di lokasi pembibitan PT.Toba Pulp Lestari Porsea adalah Cylindrocladium reteaudii, Mycosphaerella sp.,Cryptosporiopsis sp. dan ada dua spesies dari Phaeophleospora sp. (Silalahi, 2008).
Berikut taksonomi dari Phaeophleospora destructans Kingdom : Fungi
Phylum : Ascomycota Kelas : Dothideomycetes Ordo : Capnodiales
Famili : Mycosphaerellaceae Genus : Phaeophleospora
Spesies : Phaeophleospora destructans (M.J. Wingfield & Crous, 1996) Patogen ini ditemukan pada tahun 2000, menyerang perkebunan klonal E. camaldulensis di timur Thailand dan pada tahun 2002 ditemukan untuk pertama
kalinya di beberapa lokasi, meliputi selatan, tengah dan utara Vietnam, pada spesies E. camaldulensis, E. urophylla dan klon hibrid. Penyebaran yang cepat menunjukkan adanya serangan patogen ke tanaman hingga bahkan menyerang benih, dan hal ini berpotensi sebagai ancaman serius bagi eukaliptus di Asia Tenggara. Dalam rangka untuk membantu mengatasi penyakit ini, klon toleran dipilih dan ditempatkan di Sumatera (Barber, 2004).
Penyakit ini memiliki sifat menginfeksi, apabila satu daun tanaman telah terinfeksi patogen ini maka akan terjadi penularan penyakit pada daun yang berdekatan hingga dapat mengakibatkan kematian bibit tanaman. Penularan sering kali terlihat dimulai dari bagian pangkal bibit tanaman hingga mencapai daun bagian ujung tanaman. Patogen ini biasanya berada di bawah tajuk pohon dan dapat menyebabkan penghancuran secara signifikan pada semai di pembibitan (Old et al., 2003).
Penyakit ini umumnya ditemukan pada tanaman eukaliptus di Sumatera Utara. Plot percobaan dari E. globulus di Habinsaran terinfeksi dalam jumlah besar. Penyakit ini ditemukan pada areal pembibitan dan areal penanaman. Penyakit ini biasanya ditemukan pada daun dewasa, terutama pada bibit-bibit yang persediaannya berlebih. Jika tingkat infeksi sudah tinggi, penyakit ini dapat menyebabkan gugurnya daun pada usia muda (Alfenas, 1993).
Fungisida
Fungisida adalah senyawa kimia beracun untuk memberantas dan mencegah perkembangan fungi/ jamur. Penggunaan fungisida adalah termasuk dalam pengendalian secara chemis (kimia). Adapun keuntungan yang diperoleh adalah: mudah diaplikasikan, memerlukan sedikit tenaga kerja, penggunaanya
praktis, jenis dan ragamnya bervariasi, hasil pengendalian tuntas ( Djojosumarto, 2000).
fungisida yang tidak dapat diserap oleh jaringan tanaman, yaitu fungisida ini hanya membentuk lapisan penghalang di permukaan daun tanaman sehingga perkecambahan spora dan miselia jamur menjadi terhambat. Ketiga fungisida sistem lokal yaitu fungisida yang diabsorpsi oleh jaringan tanaman tetapi tidak ditransformasikan ke bagian tanaman lainnya. Pada fungisida, terutama fungisida sistematik dan nonsistematik, pembagian ini erat hubungannya dengan sifat dan aktivitas fungisida terhadap jasad sasarannya (Djojosumarto, 2000).
Fungisida sistemik
Bahan-bahan aktif yang dapat ditemui terkandung di dalam fungisida sistemik adalah Benomyl, Thiram, Carbendazim, Mancozeb, Oksadisil, Propineb, dan Metalaksil. Benomyl adalah fungisida yang diperkenalkan pada tahun 1968 oleh Du Pont. Benomyl adalah fungisida sistemik benzimidazole yang bersifat racun selektif bagi mikroorganisme dan invertebrata, khususnya cacing tanah.
Fungisida kontak
Fungisida kontak bekerja melalui paparan langsung pada cendawan. Fungisida kontak akan membunuh cendawan yang terkena paparan bahan aktif. Sebenarnya cara ini adalah cara yang tidak tepat, karena cendawan dewasa memiliki daya tahan hidup lebih kuat, sehingga cendawan yang tidak mati karena terkena paparan bahan aktif kontak dan dosis bahan aktif sistemik yang kurang, dapat menjadi resisten terhadap bahan aktif yang terkandung di dalam fungisida (Sembiring, 2008).
Fungisida dengan kombinasi bahan-bahan beresidu dan bersifat sistemik sangat aktif baik secara in vitro maupun in vivo untuk menekan pertumbuhan patogen golongan Oomycetes, serta penyebab penyakit hawar daun, rebah kecambah, busuk daun dan penyakit daun lainnya dengan daya aktif yang tinggi.
Aplikasinya pada tanah atau daun dengan tekanan rendah (Magallona, et.al., 1991).
Fungisida sistemik lokal
Fungisida sistemik lokal diabsorbsi oleh jaringan tanaman, tetapi tidak ditranslokasikan ke bagian tanaman lainnya. Bahan aktif hanya akan terserap ke sel-sel jaringan yang tidak terlalu dalam dan tidak sampai masuk hingga pembuluh angkut. Menurut mekanisme kerjanya, fungisida dibagi menjadi dua kelompok, yaitu:
1. Multisite Inhibitor
bersifat multisite inhibitor (merusak di banyak proses metabolisme) ini umumnya berspektrum luas. Contoh bahan aktifnya adalah maneb, mankozeb, zineb, probineb, ziram, thiram.
2. Monosite Inhibitor
Monosite inhibitor disebut juga sebagai site specific, yaitu fungisida yang bekerja dengan menghambat salah satu proses metabolisme cendawan, misalnya hanya menghambat sintesis protein atau hanya menghambat respirasi. Sifatnya yang hanya bekerja di satu tempat ini (spectrum sempit) menyebabkan mudah timbulnya resistensi candawan. Contoh bahan aktifnya adalah tembaga oksida, metalaksil, oksadisil, dan benalaksil.
(Hriday, 2006).
Tembaga
air. Warna ini benar-benar khas hanya untuk ion tetraakuokuprat (II) [Cu(H2O)4]2+ saja. Garam-garam tembaga (II) anhidrat,seperti tembaga (II) sulfat anhidrat CuSO4, berwarna putih (atau sedikit kuning). Dalam larutan air selalu terdapat ion kompleks tetraakuo (Vogel, 1990:229).
Tembaga Oksida
`Tembaga oksida adalah Fungisida/ bakterisida kontak dalam bentuk tepung merah berbahan aktif Tembaga oksida 56% (setara dengan 50% tembaga)
yang dapat disuspensikan dalam air untuk mengendalikan penyakit busuk daun
pada tanaman kentang, cacar daun pada tanaman teh, busuk daun pada tanaman
kakao, karat daun pada tanaman kopi dan cacar daun pada berbagai jenis tanaman
kehutanan. Tembaga oksida digunakan untuk melindungi tanaman dari penyakit- penyakit yang dapat menyebabkan kerugian secara ekonomi yang disebabkan oleh jamur (Thomson, 1992).
Rumus bangun Tembaga oksida:
Menurut Djojosumarto (2000) Fungisida disebut bersifat kontak karena Cara kerjanya hanya mematikan bagian yang terkena saja dan tidak Sumber: Nelwati, 2003
ditranslokasikan dalam jaringan tanaman. Cara kerja tembaga oksida yaitu membentuk lapisan penghalang di permukaan tanaman (umumnya daun) tempat fungisida disemprotkan. Fungisida ini hanya berfungsi mencegah infeksi cendawan dengan cara menghambat perkecambahan spora atau miselia jamur yang menempel di permukaan tanaman. Karena itu, tembaga oksida berfungsi sebagai protektan dan hanya efektif bila digunakan sebelum tanaman terinfeksi oleh penyakit.
Penelitian terkait
Julinar (2009) dalam uji efektifitas fungisida sistemik dan fungisida non
sistemik terhadap perkembangan penyakit hawar daun (Helminthosporium
turcicum) pada beberapa varietas tanaman jagung (Zea mays L) menyimpulkan
bahwa fungisida non sistemik berbahan aktif mankozeb 80% efektif dalam
mengendalikan penyakit Helminthosporium turcicum dengan dosis 1.7 g/l air.
Tarigan (1998) dalam uji efektifitas fungisida sistemik dan fungisida non
sistemik terhadap perkembangan penyakit bercak kelabu (Cercospora zeae
-maydis) pada beberapa varietas tanaman jagung (Zea mays L) juga menyimpulkan
bahwa fungisida kontak berbahan aktif Klorotalonil 75% efektif mengendalikan penyakit Cercospora zeae -maydis dengan dosis 4.5 g/3 l air.
Muainah (2003) dalam uji efikasi beberapa fungisida untuk
mengendalikan Pythium spp pada pembibitan tanaman tembakau Deli (Nicotiana
tabaccum L) menyimpulkan bahawa fungisida kontak berbahan aktif
Propamocarb HCl efektif dalam mengendalikan penyakit Pythium spp di
lapangan dengan dosis 2 cc/l, namun tidak efektif secara in vitro terhadap jamur
METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Bioteknologi Program Studi Kehutanan dan di Laboratorium Hama dan Penyakit Tanaman Program Studi Agroekoteknologi, Fakultas Pertanian Universitas Sumatera Utara. Penelitian dilakukan pada bulan Februari sampai April 2015.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah media PDA, fungisida berbahan aktif tembaga oksida 56%, fungi Phaeophleospora sp., alkohol 70%, aquades, aluminium foil, kertas tissue, kalmicetine.
Alat yang digunakan dalam penelitian adalah kamera digital, mikroskop, autoklaf, Laminar Airflow, cawan petri, erlenmeyer, pinset, gunting, gelas ukur, tabung reaksi, pipet tetes, overhead stirrer, sarung tangan, masker, timbangan analitik, kaca preparat, haemocytometer, lampu bunsen, gunting, alat tulis, sungkup, plastik clingwrap, millipore dan sprayer.
Prosedur Penelitian Sampel uji
Sampel yang digunakan diambil dari koleksi Phaeophleospora sp. yang di dapat dari penelitian sebelumnya.
Inokulasi jamur patogen
homogen. Fungisida diteteskan dengan konsentrasi 0 mg/ml, 0.28 mg/ml, 0.56 mg/ml, 0.84 mg/ml, 1.12 mg/ml ke media PDA. Inokulum jamur Phaeophleospora sp yang berdiameter 5 mm diletakkan ditengah-tengah cawan
petri yang sudah diberi perlakuan sebelumnya, kemudian diinkubasi pada suhu kamar, dan diamati pertumbuhannya selama 14 hari atau sampai kontrol memenuhi cawan petri .
Pengamatan
1. Diameter koloni Phaeophleospora sp.
Pengamatan dan pengukuran diameter dilakukan setiap hari selama 14 hari atau sampai kontrol memenuhi cawan petri. Pengukuran diameter menggunakan kertas millimeter block yang cara perhitungannya dengan membuat garis vertikal dan horizontal yang titik potong kedua garisnya tepat di tengah koloni jamur. Cara pengukuran pada cawan petri berdasarkan rumus sebagai berikut :
� =d1 + d2
2 Keterangan :
D = diameter jamur Phaeophleospora sp.
d1 = diameter vertikal koloni jamur Phaeophleospora sp. d2 = diameter horizontal koloni jamur Phaeophleospora sp 2. Luas koloni Phaeophleospora sp.
jari-jarinya. Luas lingkaran koloni jamur dihitung menggunakan rumus (A = πr2)
dan masukkan rata-rata jari-jari koloni jamur yang telah diukur (Mahartha, dkk., 2013).
3. Persentase hambatan relatif koloni Phaeophleospora sp.
Kemampuan hambatan relatif fungisida terhadap pertumbuhan jamur Phaeophleospora sp. dihitung sampai jamur telah tumbuh. Persentasi hambatan dihitung menurut rumus Pande et al, (1982) dalam Noveriza dan Tombe (2003) adalah sebagai berikut:
HR =dk−dp
dk x 100%
Keterangan :
HR = hambatan relatif dk = diameter kontrol dp = diameter perlakuan
Pengaruh suatu fungisida dinilai dari kategori yang dikemukakan oleh Irasakti dan Sukatsa (1987) sebagai berikut :
0 = tidak berpengaruh
>0-20 % = sangat kurang berpengaruh >20-40 % = kurang berpengaruh >40 – 60 % = cukup berpengaruh >60 – 80 % = berpengaruh
>80 % = sangat berpengaruh 4. Kerapatan spora Phaeophleospora sp.
S = t−d n x 0,25
Keterangan :
S = kerapatan spora per gram media
t = banyak spora yang dihitung pada kotak d = tingkat pengenceran
n = banyak kotak kecil yang diamati 106 = konstanta kerapatan spora 5. Analisis Data
Data dianalisis secara statistik menggunakan pola rancangan acak lengkap (RAL) non faktorial dengan model linier sebagai berikut:
Y
ij= μ + τi
+ εij
Keterangan:
Yij = pengamatan pada perlakuan ke-i dan ulangan ke-j μ = rataan umum
τi = pengaruh perlakuan ke-i
εij = pengaruh acak pada perlakuan ke-i dan ulangan ke-j i = perlakuan ke-i (1, 2, 3, 4, 5)
j = ulangan ke-j (1, 2, 3, 4, 5) (Hanafiah, 2000)
HASIL DAN PEMBAHASAN
Tampilan Makroskopis
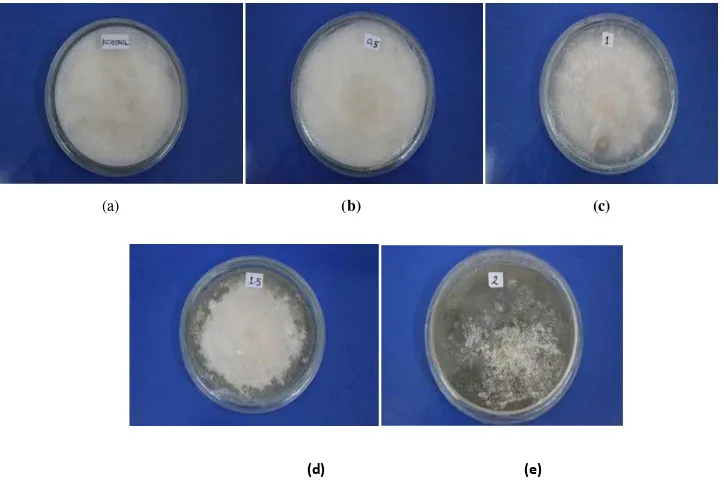
Pengamatan dilakukan setiap hari selama 14 hari dengan cara mengukur pertambahan diameter fungi setelah diberi perlakuan dan mengamati perubahan fungi seperti bentuk, tekstur dan warna. Pengamatan makroskopis dilakukan dengan mengamati karakteristik diameter, luas dan hambatan relatif. Menurut Burgess et al. (2006) bahwa koloni Phaeophleospora sp. berwarna kemerahmudaan, pertumbuhannya lambat, dan bertekstur lembut seperti bulu. Dari hasil isolasi biakan murni diperoleh isolat dengan ciri fisik yang sama yaitu berwarna kemerahmudaan dan bertekstur lembut seperti bulu.
(a) (b) (c)
(d) (e)
Pengamatan makroskopis Phaeophleospora sp. membandingkan ciri-ciri dari hasil isolasi sebelum diberi perlakuan dan setelah diberi perlakuan. Pada konsentrasi perlakuan 0.28 mg/ml dan 0.56 mg/ml belum terjadi perubahan fisik jika dibandingkan dengan kontrol. Perubahan fisik pada fungi mulai tampak berbeda pada konsentrasi perlakuan 0.84 mg/ml dan 1.12 mg/ml. Penambahan fungisida yang bersifat kontak memberi pengaruh terhadap pertumbuhan Phaeophleospora sp.. Hal ini sesuai dengan pernyataan Sembiring (2008) yang
menyatakan penambahan fungisida pada media tumbuh akan berpengaruh menekan pertumbuhan koloni Phaeophleospora sp. walaupun dengan konsentrasi rendah fungisida kontak cukup kompatibel dan berpengaruh positif terhadap pertumbuhan Phaeophleospora sp.
Bentuk dan warna koloni
Tabel 1. Bentuk dan warna koloni Phaeophleospora sp. pada pengamatan 14 HSI No Perlakuan (mg/ml) Bentuk koloni Warna koloni
Diameter koloni Phaeophleospora sp.
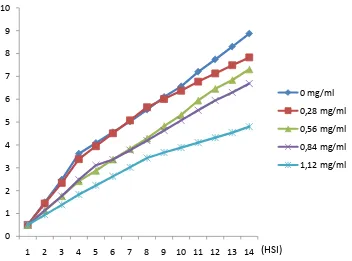
Pertumbuhan diameter Phaeophleospora sp. selama 14 HSI disajikan pada gambar 3;
Gambar 3. Grafik pertumbuhan diameter koloni fungi Phaeophleospora sp.
Pengukuran diameter dilakukan pada hari ke- 4 HSI. Pengukuran dilakukan setiap 4 hari sampai hari ke- 14 HSI. Pertumbuhan diameter koloni fungi Phaeophleospora sp. pada konsentrasi perlakuan 0 mg/ml cukup stabil dalam setiap pengamatan, hal ini berbeda dengan konsentrasi perlakuan 1.12 mg/ml yang mengalami penurunan (Gambar 3).
Pertumbuhan Phaeophleospora sp. pada konsentrasi perlakuan 1.12 mg/ml lambat, dikarenakan penambahan fungisida pada media tumbuh akan berpengaruh menekan pertumbuhan koloni Phaeophleospora sp. walaupun dengan konsentrasi rendah fungisida kontak cukup kompatibel dan berpengaruh positif
terhadap pertumbuhan Phaeophleospora sp. Tiancang et al. (2008) juga menyatakan bahwa fungisida tembaga oksida pada dosis tertentu menunjukkan penghambatan pada perkecambahan dan pemencaran konidia pada miselium. Penghambatan perkecambahan konidia akan menurunkan jumlah konidia yang dihasilkan.
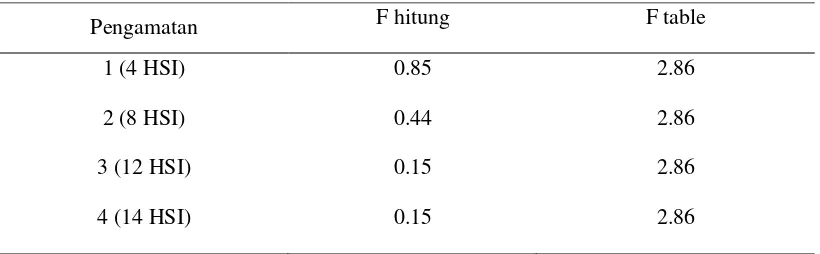
Setelah dilakukan uji statistik, respon Phaeophleospora sp. tidak berpengaruh nyata. Data pengujian statistik Phaeophleospora sp. disajikan pada tabel 2;
Tabel 2. Uji F taraf 5% diameter fungi Phaeophleospora sp.
Pengamatan F hitung F table
1 (4 HSI) 0.85 2.86
2 (8 HSI) 0.44 2.86
3 (12 HSI) 0.15 2.86
4 (14 HSI) 0.15 2.86
sintesa protein, tetapi secara umum menghambat dan bereaksi terhadap sel atau bagian-bagian patogen dan menghambat banyak fungsi metabolisme, menghambat penggabungan glicosamine dengan zat kitin pada dinding sel.
Luas koloni Phaeophleospora sp.
Hasil pengamatan rata- rata luas koloni Phaeophleospora sp. disajikan pada tabel 3;
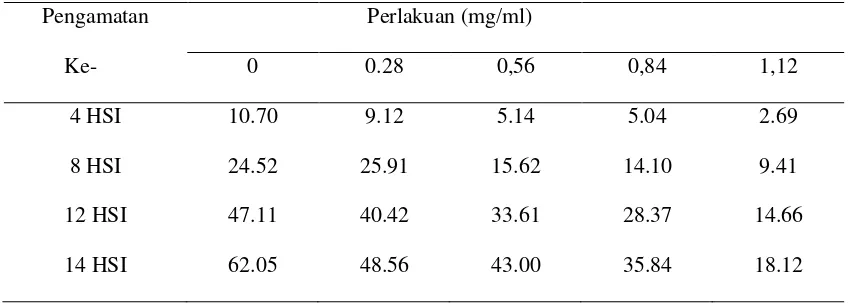
Tabel 3. Rata- rata luas koloni (mm) fungi Phaeophleospora sp.
Pengamatan Perlakuan (mg/ml)
Ke- 0 0.28 0,56 0,84 1,12
4 HSI 10.70 9.12 5.14 5.04 2.69
8 HSI 24.52 25.91 15.62 14.10 9.41
12 HSI 47.11 40.42 33.61 28.37 14.66
14 HSI 62.05 48.56 43.00 35.84 18.12
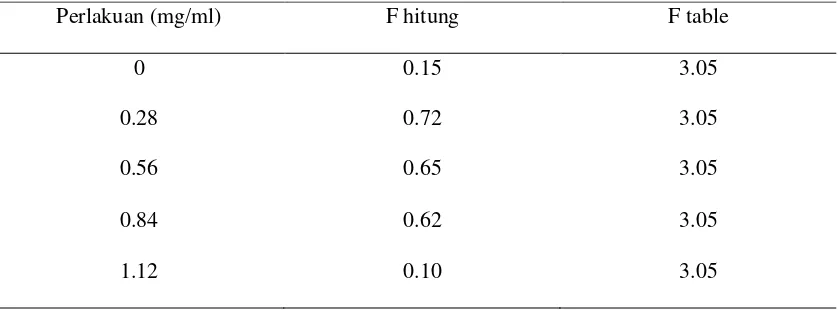
Hasil uji F taraf 5 % luas koloni fungi Phaeophleospora sp. disajikan pada tabel 4:
Tabel 4. Uji F taraf 5 % luas koloni fungi Phaeophleospora sp.
Perlakuan (mg/ml) F hitung F table
0 0.15 3.05
0.28 0.72 3.05
0.56 0.65 3.05
0.84 0.62 3.05
1.12 0.10 3.05
Berdasarkan uji F taraf 5% luas koloni jamur Phaeophleospora sp. tidak berpengaruh nyata terhadap pemberian fungisida pada setiap perlakuan.
Persentase hambatan relatif (HR) koloni Phaeophleospora sp.
Persentasi hasil hambatan relatif respon fungi Phaeophleospora sp. terhadap fungisida berbahan aktif tembaga oksida disajikan pada tabel 5;
Tabel 5. Hambatan relatif koloni jamur Phaeophleospora sp.
Perlakuan (mg/ml) Hambatan relatif (%)
0 0
0.28 11.72
0.56 17.58
0.84 24.57
Persentase daya hambat fungisida berbahan aktif tembaga oksida terhadap jamur Phaeophleospora sp. tidak berpengaruh nyata. Hal ini ditunjukkan pada persentase konsentrasi perlakuan 0 mg/ml ( 11.72%), dari persentase yang didapat konsentrasi perlakuan tersebut sangat kurang berpengaruh. Sedangkan pada konsentrasi perlakuan 1.12 mg/ml (45.88%) persentasi yang didapat konsentrasi perlakuan tersebut cukup berpengaruh. ( Irasakti dan Sukatsa, 1987) .
Pengamatan Mikroskopis Kerapatan spora
Kerapatan spora dapat diketahui setelah fungi dipanen (14 HSI) dan diukur dengan mengunakan rumus yang dikemukakan oleh Chi (1997). Berikut tabel kerapatan spora Phaeophleospora sp.;
Tabel 5. Kerapatan spora Phaeophleospora sp.
Perlakuan (mg/ml) Kerapatan spora (cfu)
0 18 x 104
0.28 9 x 104
0.56 6 x 104
0.84 5,5 x 104
1.12 5 x 104
Hasil perhitungan kerapatan spora yang dilakukan didapat hasil bahwa perlakuan konsentrasi fungisida 0.28 mg/ml memiliki kerapatan spora yg lebih besar yaitu sebesar 18 x 104 cfu dan kerapatan spora yg terkecil ditunjukkan fungi yang diberi konsentrasi fungisida 1.12 mg/ml yaitu sebesar 5 x 104 cfu. Tiancang et al. (2008) menyatakan bahwa tembaga oksida pada dosis tertentu menunjukkan
pembentukan acervuli pada miselium. Penghambatan perkecambahan konidia akan menurunkan jumlah konidia yang dihasilkan. Pembentukan acervuli penting karena acervuli merupakan konidiofor yang berperan dalam penghasilan konidia dan penyebarannya. Tembaga oksida juga menghambat banyak fungsi kerja sel jamur yang berperan dalam terganggunya transfer energi ke seluruh bagian sel.
Pengamatan bentuk hifa
Pengamatan bentuk hifa bertujuan untuk mengetahui perubahan bentuk hifa setelah fungi diberi perlakuan. Dari hasil pengamatan didapat hasil sebagai berikut;
(a) (b) (c)
(d) (e)
Gambar 2. Hifa Phaeophleospora sp. pada perlakuan 0 mg/ml (a), 0.28 mg/ml (b), 0.56 mg/ml (c), 0.84 mg/ml (d), 1.12 mg/ml (e).
Phaeophleospora sp. mempunyai hifa dengan panjang antara 30-150µm
memiliki sekat rata-rata diatas 4. Menurut Old (2003) spora-spora fungi Phaeophleospora sp. berbentuk silindris ataupun berbentuk batang ramping spora
secara berkelompok. Pada setiap spora terdapat berupa dinding-dinding kasar yang terdiri dari beberapa buah sekat.
KESIMPULAN DAN SARAN
Kesimpulan
Kesimpulan dari penelitian ini adalah ;
1. Tidak terdapat perbedaan respon Phaeophleospora sp. terhadap setiap konsentrasi perlakuan fungisida berbahan aktif tembaga oksida terhadap (luas, diameter, hambatan relatif, kerapatan spora) fungi Phaeophleospora sp.
2. Perubahan bentuk hifa setelah diberi perlakuan tidak menunjukkan adanya perbedaan, namun memberikan pengaruh pada bentuk, warna, dan tekstur pada konsentrasi perlakuan 0.84 mg/ml dan 1.12 mg/ml.
Saran
Masih diperlukan penelitian lanjutan uji respon Phaeophleospora sp. terhadap fungisida berbahan aktif tembaga oksida 56% terhadap Phaeophleospora sp. diduga jenis fungi ini telah resisten terhadap bahan aktif yang terkandung di
DAFTAR PUSTAKA
Alfenas, A.C. 1993. Potential and Present Status of Eucalyptus and Acacia mangium in Northern Sumatera. Universidade Federal de Vicosa. Departamento de Fitopatologia. Brazil.
Barber, P.A. 2004. Forest Pathology: The Threat of Disease to Plantation Forests in Indonesia. Plant Pathology Journal, 3 (2). pp. 97-104. Murdoch University.
Djojosumarto, P.A, 2000. Tehnik Aplikasi Fungisida Pertanian. Kanisius. Yogyakarta. Hlm 46.
Gortz A & Dias L. 2011. Use of Propineb for Physiological Curative Treatment Under Zinc Deficiency. Bayer Crop Science. Jerman
Hanafiah, K. A. 2005. Rancangan Percobaan:Teori dan Aplikasi. PT Grafindo Persada, Jakarta.
Hriday Chaube, V.S. Pundhir (2006). Crop Diseases and Their Management. Prentice-Hall of India Pvt.Ltd. ISBN 978-81-203-2674-3. Page.292-3 Irasakti, L. dan Sukatsa. 1987. Uji Kemempanan Beberapa Fungisida Terhadap
Penyakit Bercak Coklat pada Tanaman Padi . Gatra Penelitian Penyakit Tumbuhan Dalam Pengendalian Secara Terpadu, PFI, Surabaya, 24-26, November, hal. 55-70.
Latifah, S. 2004. Pertanaman dan Hasil Tegakan Eucalyptus grandis di Hutan Tanaman Indus Magallona, E. D., Soehardjan and H. Lumban tobing, 1990. Pesticides in Estate
Crop Protection in Indonesia. Directorate General Of Estate Crop. p. 38. Misato T & Kakiki. 1977. Inhibition of Fungal Cell Wall Synthesis and Cell
Membrane Function. Antifungal Compounds Vol II. New York.
Nair, K. S. S. 2000. Insects Pest and Diseases in Indonesian Forest an Assessmentof the Major Threats, Research Efforte and Literature. Center for International Forestry Research (CIFOR). Bogor.
Nelwati. 2003. Uji Efektivitas Fungisida Sistematik dan Non- Sistematik Terhadap Perkembangan Penyakit Karat (Puccinia arachidis, Speg) pada Tanaman Kacang Tanah (Arachis hypogae L.). Universitas Sumatera Utara. Medan
Old, K.M., M.J. Wingfield, and Z.Q. Yuan, 2003b. A Manual of Diseases of Eucalypts in South-East Asia. Center for International Forestry Research (CIFOR), Bogor.
Poerwowidodo. 1991. Gatra Tanah dalam Pembangunan Hutan Tanaman di Indonesia. Penerbit Rajawali. Jakarta.
Rahayu, S. 1999. Penyakit Tanaman Hutan d Indonesia: Gejala, Penyebab dan Teknik Pengendaliannya. Kanisius. Yogyakarta.
Sastroutomo, S. S., 1992. Pestisida, Dasar-Dasar Dan Dampak Penggunaanya. Gramedia Pustaka Utama, Jakarta.
Semangun, H. 2000. Penyakit- penyakit Tanaman Pangan di Indonesia. Gadjah Mada University Press. Yogyakarta.
Sembiring, K. W., 2008. Efektivitas Mancozeb Dan Metalaxy Dalam Menghambat Pertumbuhan Cylindrocladium scoparium. Hawley Boedijn et Reitsma Penyebab Penyakit Busuk Daun Teh (Camelia sinensis. L) Di Laboratorium. Universitas Sumatera Utara. Medan.
Silalahi, N.R. 2008. Inventarisasi Fungi Patogen pada Daun Bibit Tanaman Eucalyptus spp. (Studi Kasus Di Pembibitan PT.Toba Pulp Lestari Porsea Sumatera Utara). Departemen Ilmu Kehutanan. Universitas Sumatera Utara. Tidak Dipublikasikan.
Thomson, W. T., 1992. Agriculure chemicals. Book IV: Fungicides, Thomson Publication, Fresno, California. p. 153.
Tiancang Z., Zhao H., Huang L., Xi H., Zhou D., & Cheng J. 2008. Efficacy of Propineb for Controling Leaf Blotch Caused by Marssonina coronaria and its Effect on Zinc Content in Apple Leaves. J. Acta Phytophyla Sinica 35(6): 519-524.
Vogel. 1990. Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro. Jilid I. PT. Kalman Media Pusaka. Jakarta.
Widarto, L. 1996. Perbanyakan Tanaman dengan Biji, Stek, Cangkok, Sambung, Okulasi dan Kultur Jaringan. Kanisius. Yogyakarta.
LAMPIRAN
Lampiran 1. Data diameter Phaeophleospora sp.
Diameter koloni jamur (mm) Phaeophleospora sp konsentrasi perlakuan 0 mg/ ml
Hari ke - Ulangan Rata- rata
10 7.86 5.60 5.40 7.00 5.99 6.37
11 8.04 6.10 5.85 7.50 6.36 6.77
12 8.22 6.40 6.30 8.00 6.73 7.13
13 8.30 6.70 6.85 8.50 7.10 7.49
14 8.40 7.00 7.25 9.00 7.50 7.83
Diameter koloni jamur (mm) Phaeophleospora sp konsentrasi perlakuan 0.56 mg/ml
7 3.61 2.89 3.65 3.95 4.75 3.77
8 4.00 3.25 4.00 4.50 5.20 4.19
9 4.83 3.58 4.51 4.79 5.45 4.63
10 5.66 3.91 5.02 5.08 5.70 5.07
11 6.49 4.24 5.53 5.37 5.95 5.51
12 7.32 4.57 6.04 5.60 6.20 5.94
13 7.70 4.90 6.55 5.89 6.45 6.29
14 8.15 5.25 7.10 6.25 6.70 6.69
Diameter koloni jamur (mm) Phaeophleospora sp konsentrasi perlakuan 1.12 mg/ml
Hari ke - Ulangan Rata- rata
1 2 3 4 5
1 0.50 0.50 0.50 0.50 0.50 0.50
2 0.75 1.03 1.00 0.82 1.10 0.94
3 1.00 1.56 1.50 1.14 1.70 1.38
4 1.50 2.10 2.00 1.46 2.10 1.83
5 1.87 2.57 2.37 1.78 2.55 2.22
6 2.24 3.04 2.74 2.10 3.00 2.62
7 2.61 3.51 3.11 2.42 3.45 3.02
8 3.00 4.00 3.50 2.74 3.90 3.42
9 3.35 4.20 3.73 3.06 3.99 3.66
10 3.70 4.30 3.96 3.38 4.08 3.88
11 4.05 4.40 4.19 3.70 4.17 4.10
12 4.40 4.50 4.42 4.02 4.26 4.32
13 4.75 4.60 4.65 4.34 4.35 4.53
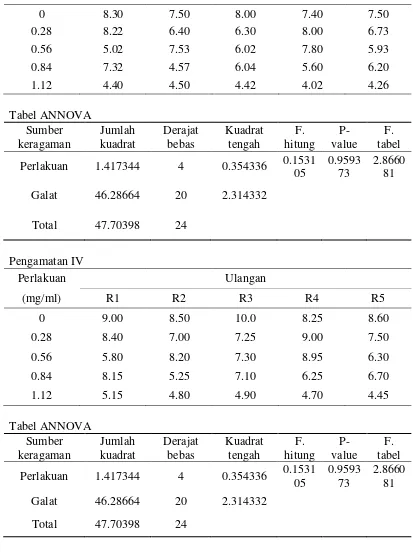
Lampiran 2. Uji F Taraf 5% Diameter Fungi Phaeophleospora sp. Perlakuan 2.951576 4 0.737894 0.8510
48 Perlakuan 3.049264 4 0.762316 0.4436
0 8.30 7.50 8.00 7.40 7.50 Perlakuan 1.417344 4 0.354336 0.1531
05 Perlakuan 1.417344 4 0.354336 0.1531
Lampiran 3. Uji F Taraf 5% Luas Fungi Phaeophleospora sp. Luas fungi Phaeophleospora sp. konsentrasi perlakuan 0 mg/ml
Pengamatan ke- R1 R2 R3 R4 R5 Rata- rata
Perlakuan 341.9343 4 85.48357 0.1533 37
Luas fungi Phaeophleospora sp. konsentrasi perlakuan 0,28 mg/ml
Pengamatan ke- R1 R2 R3 R4 R5 Rata- rata
Luas fungi Phaeophleospora sp. konsentrasi perlakuan 0,56 mg/ml
Perlakuan 941.7196 4 235.4299 0.6528 25
Luas fungi Phaeophleospora sp. konsentrasi perlakuan 0,84 mg/ml
Pengamatan ke- R1 R2 R3 R4 R5 Rata- rata
Perlakuan 553.3251 4 138.3313 0.6279 47
Luas fungi Phaeophleospora sp. konsentrasi perlakuan 1,12 mg/ml
Pengamatan ke R1 R2 R3 R4 R5 Rata- rata
1 1.76 3.46 3.14 1.67 3.46 2.69
2 7.06 12.56 9.61 5.89 11.93 9.41
Tabel ANNOVA Sumber keragaman
Jumlah kuadrat
Derajat bebas
Kuadrat tengah
F
hitung P-value F tabel
Perlakuan 20.91217 4 5.228043 0.1096 45
0.9772 64
3.0555 68 Galat 715.2241 15 47.68161