perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
MODIFIKASI TEKNIK KROMATOGRAFI KOLOM UNTUK
PEMISAHAN TRIGLISERIDA DARI EKSTRAK P
andanus
conoideus
Lamk
VARIAN BUAH KUNING
Disusun Oleh:
KURNIA DYAH SUGESTI
M0305041
SKRIPSI
Ditulis dan Diajukan untuk memenuhi sebagian persyaratan mendapatkan gelar sarjana Sains Kimia
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
UNVERSITAS SEBELAS MARET
SURAKARTA
Oktober, 2010
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
HALAMAN PENGESAHAN
Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sebelas Maret Surakarta Telah Mengesahkan Skripsi Mahasiswa:
Kurnia Dyah Sugesti M 0305041, dengan judul ”Modifikasi Teknik
Kromatografi Kolom untuk Pemisahan Trigliserida dari Ekstrak Pandanus
conoideus Lamk Varian Buah Kuning”
Skripsi ini dibimbing oleh:
Pembimbing I
Dr.rer.nat Fajar Rakhman W,M.Si
NIP 19730605 200003 1001
Pembimbing II
M. Widyo Wartono, M.Si
NIP 19760822 200501 1001
Dipertahankan di depan Tim Penguji Skripsi pada:
Hari : Kamis
Tanggal : 07 Oktober 2010
Anggota Tim Penguji:
1. Dra. Tri Martini, M.Si 1...
NIP 19581029 198503 2002
2. Yuniawan Hidayat, M.Si 2. ...
NIP 19790605 200501 1001
Disahkan Oleh
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sebelas Maret Surakarta
Ketua Jurusan Kimia,
Prof. Drs. Sentot Budi Rahardjo, Ph.D.
NIP 19560507 198601 1001
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul
”MODIFIKASI TEKNIK KROMATOGRAFI KOLOM UNTUK PEMISAHAN
TRIGLISERIDA DARI EKSTRAK PANDANUS CONOIDEUS LAMK VARIAN
BUAH KUNING” adalah benar-benar hasil penelitian sendiri dan tidak terdapat
karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu
perguruan tinggi, dan sepanjang pengetahuan saya juga tidak terdapat kerja atau
pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara
tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Surakarta, Oktober 2010
Kurnia Dyah Sugesti
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
MODIFIKASI TEKNIK KROMATOGRAFI KOLOM UNTUK PEMISAHAN TRIGLISERIDA DARI EKSTRAK (Pandanus conoideus
Lamk) VARIAN BUAH KUNING
KURNIA DYAH SUGESTI
Jurusan Kimia, Fakultas MIPA, Universitas Sebelas Maret
ABSTRAK
Buah kuning merupakan salah satu varian dari Buah Merah (Pandanus conoideus Lamk). Perbedaan utama dari ekstrak buah kuning dengan ekstrak buah merah adalah kadar asam lemak tak jenuh dan senyawa antioksidannya dimana dalam ekstrak buah merah mempunyai kadar yang lebih banyak daripada ekstrak buah kuning. Pada penelitian ini telah dilakukan pemisahan trigliserida dari ekstrak buah kuning dengan modifikasi teknik kromatografi kolom. Modifikasi dilakukan dengan menambahkan alumina basa dan agen pengoksidasi berupa MnO2 kedalam fasa diam silika gel. Elusi dilakukan dengan menggunakan fasa
gerak petroleum eter dan dietil eter. Fraksi yang dihasilkan kemudian diidentifikasi dengan menggunakan IR dan GC-MS.
Pemisahan menggunakan fasa diam silika gel-alumina (2:3) dengan penambahan MnO2 3% menghasilkan 3 fraksi. Spektra FT-IR dari fraksi pertama
menunjukkan adanya serapan yang khas untuk beberapa gugus fungsi yaitu ester dari trigliserida dan alkana rantai panjang. Spektra GC-MS menunjukkan metil ester dari asam lemak yaitu asam oleat, palmitat, dan stearat serta teridentifikasi senyawa 1-0-oktadekanoil-1,2-etanadiol dan glikol-1-palmitat yang merupakan produk tak sempurna dari oksidasi trigliseridanya. Komponen trigliserida telah terpisah dari senyawa lain dalam ekstrak buah seperti β-karoten dan tokoferol. Kedua senyawa tersebut merupakan antioksidan yang dapat mencegah oksidasi asam lemak tak jenuh. Dari hasil analisis, diketahui bahwa trigliserida dapat dipisahkan dari senyawa yang lain dengan modifikasi teknik kromatografi kolom tanpa merusak senyawa tersebut karena keberadaan senyawa antioksidan dapat melindungi trigliserida dari reaksi oksidasi.
Kata kunci: Buah kuning, modifikasi kromatografi kolom, trigliserida, senyawa antioksidan, auto-oksidasi.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
MODIFICATION OF COLUMN CHROMATOGRAPHY TECHNIQUE FOR TRIGLYCERIDES SEPARATION FROM Pandanus conoideus
LAMK VARIANT YELLOW FRUIT
KURNIA DYAH SUGESTI
Department of Chemistry, Faculty of Mathematic and Sciences Sebelas Maret University
ABSTRACT
Yellow fruit is one variant of Pandanus conoideus Lamk. The main different of yellow and red fruit extract is the concentration of unsaturated fatty acid and antioxidant agent where the red fruit much higher than yellow fruit. Triglycerides separated from yellow fruit extract using modification of column chromatography was done. The modification was done by an addition of basisch alumina and oxidizing agent that is MnO2 into stationary phase. Fractions was
obtained from separation then determined by IR and GC-MS.
Separation used stationary phase of silica gel-alumina(2:3) by an addition MnO2 3% result 3 fractions. Spectra IR from the first fraction showed the
presence of several characteristic functional groups, that is ester from triglycerides and long chain alkane. GC-MS spectrum showed metyl ester from triglycerides such as oleic acid palmitate acid, and stearate acid also new compound was identified as 1-0-octadecanoyl-1,2-ethanediol and glycol-1-palmitate which the unperfect product from triglycerides oxidation. Triglycerides have been separated from other compound in extract such as β-karoten and tokoferol. Both of them are antioxidant that prevent unsaturated fatty acid oxidation. From the analysis result, could be known that triglycerides could be separated from the other compound with modification of column chromatography without changed this compound because the antioxidant were protecting triglycerides from oxidation reaction.
Key word : yellow fruit, modification of column chromatography, triglyserides, ontioxidant agent, auto-oxidation.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user MOTTO
Sesungguhnya sesudah kesulitan itu ada kemudahan. Maka apabila kamu telah selesai (dari suatu urusan), Kerjakanlah dengan sungguh-sungguh
(urusan) yang lain. (Alam Nasyrah: 6-7)
Tinta bagi seorang pelajar lebih suci nilainya daripada darah seorang martir ( Muhammad SAW)
Semua yang pasti di dunia ini adalah ketidakpastian itu sendiri dan Tuhan memelihara ketidakpastian itu pada seluruh umat manusia agar manusia
terus belajar dan terus bermimpi (Albert Einstein)
Sebaik-baiknya manusia adalah manusia yang memberi manfaat untuk orang lain
(5 cm)
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user PERSEMBAHAN
Kupersembahkan perjuangan ku ini kepada:
Ibu dan bapak yang telah memberikanku kesempatan untuk
membanggakan kalian dengan cara ku
Kakak dan adik tercinta yang selalu mendukungku
Someone yang selalu setia menungguku ur still the one
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user KATA PENGANTAR
Puji syukur kepada Allah SWT yang telah memberikan rahmat-Nya
sehingga penulis dapat menyelesaikan skripsi ini. Skripsi yang berjudul “
Modifikasi Teknik Kromatografi Kolom untuk Pemisahan Trigliserida dari
Ekstrak Pandanus conoideus Lamk Varian Buah Kuning ” ini disusun atas
dukungan dari berbagai pihak. Dari dasar hati penulis menyampaikan terima kasih
kepada:
1. Prof. Drs. Sentot Budi Rahardjo, Ph.D selaku Ketua Jurusan Kimia Fakultas
Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret,
Surakarta.
2. Dr.rer.nat. Fajar Rakhman Wibowo,M.Si selaku pembimbing I dan
pembimbing akademik, terimakasih atas bantuan, arahan dan kesabarannya
membimbing selama melakukan penelitian dan penyusunan skripsi ini.
3. M. Widyo Wartono, M.Si selaku pembimbing II, yang telah memberikan
bimbingan dan arahan.
4. I.F. Nurcahyo, Msi., selaku Ketua Laboratorium Kimia Fakultas Matematika
dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret.
5. Seluruh Dosen di Jurusan Kimia, Kimia Fakultas Matematika dan Ilmu
Pengetahuan Alam, Universitas Sebelas Maret atas ilmu yang berguna dalam
menyusun skripsi ini.
6. Para Laboran di Laboratorium Kimia Fakultas Matematika dan Ilmu
Pengetahuan Alam, Universitas Sebelas Maret atas bantuan dan kerjasama
yang baik.
7. Teman-temanku angkatan 2005 yang senantiasa mendukungku. Special
thank’s for Sulis, Arini, Erma, Lenia, Okly, ijup, Sofi.
8. Semua pihak yang tidak dapat kami sebutkan satu persatu.
Semoga Allah SWT membalas jerih payah dan pengorbanan yang telah diberikan
dengan balasan yang lebih baik.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna. Oleh
karena itu, penulis mengharapkan kritik dan saran yang membangun dalam rangka
untuk menyempurnakan skripsi ini. Akhir kata, semoga karya kecil in dapat
memberikan manfaat bagi ilmu pengetahuan dan bagi pembaca.
Surakarta, Oktober 2010
Kurnia Dyah Sugesti
perpustakaan.uns.ac.id digilib.uns.ac.id
2. Komponen-komponen pada ekstrak buah kuning ... 7
a. Komponen trigliserida ... 8
1) Trigliserida... 8
2) Asam lemak bebas ... 9
perpustakaan.uns.ac.id digilib.uns.ac.id
D. Prosedur Penelitian... 26
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
C. Pemisahan dengan kromatografi kolom flash ... 33
D. Identifikasi senyawa ... 36
E. Pengaruh penambahan alumina dan MnO2 ... 45
F. Pengaruh keberadaan antioksidan dalam ekstrah buah kuning . 46 BAB V. KESIMPULAN DAN SARAN... 49
a. Kesimpulan... 49
a. Saran .. ... 49
DAFTAR PUSTAKA ... ... 50
LAMPIRAN... 54
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user DAFTAR TABEL
Halaman
Tabel 1. Beberapa asam lemak yang umum... 8
Tabel 2. Komposisi asam lemak dari minyak buah kuning ... 10
Tabel 3. Urutan kepolaran eluen, elusi senyawa dan kekuatan adsorben
dalam kromatografi ... 19
Tabel 4. Harga Rf dari spot hasil pemisahan buah kuning ... 30
Tabel 5. Harga Rf, warna dan berat total tiap fraksi ... 35
Tabel 6. Perbandingan data GC-MS dengan kandungan dalam ekstrak
buah kuning ... 44
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user DAFTAR GAMBAR
Halaman
Gambar 1. Buah kuning ... 6
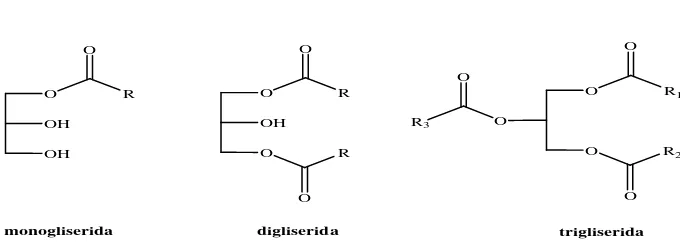
Gambar 2. Struktur molekul monogliserida, digliserida dan trigliserida 9 Gambar 3. Reaksi kondensasi asam lemak ... 9
Gambar 4. Contoh struktur molekul asam lemak bebas (asam oleat) ... 10
Gambar 5. Mekanisme oksidasi asam lemak pada tahap inisiasi dan propagasi ... 11
Gambar 6. Konversi β-karoten ... 14
Gambar 7. Struktur α-tokoferol ... 15
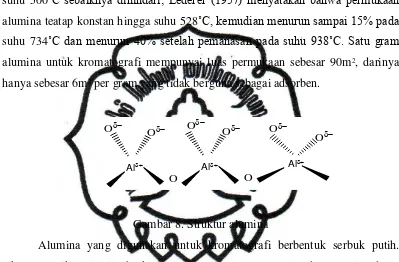
Gambar 8. Struktur alumina ... 20
Gambar 9. Struktur dasar alumina a) asam, b) netral, c) basa ... 21
Gambar 10. Struktur silika gel ... 22
Gambar 11. Pengubahan vitamin A menjadi retinal oleh MnO2 ... 23
Gambar 12. Plat KLT ekstrak buah kuning dengan modifikasi Si-Al (2:3)+MnO2 a). 3% dan b). 5% ... 31
Gambar 13. Kromatografi kolom flash ... 33
Gambar 14. Grafik perubahan masa tabung hasil pemisahan dengan kromatografi kolom flash ... 34
Gambar 15. Perbandingan Rf plat silika gel awal dengan Rf dari eluat ... 35
Gambar 16. Puncak-puncak serapan analisis FT-IR terhadap fraksi pertama ... 37
Gambar 17a. Kromatogram GC-MS ekstrak buah kuning murni ... 38
Gambar 17b. kromatogram GC-MS fraksi trigliserida………. 38
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user DAFTAR LAMPIRAN
Halaman
Lampiran 1. Kolom kromatografi modifikasi... 54
Lampiran 2. Gambar plat pemisahan dengan silika gel dan silika+alumina (2:3)... 55
Lampiran 3. Kondisi operasi GC-MS QP2010S Shimadzu ... 56
Lampiran 4. Spektrum analisis GC-MS ekstrak buah kuning murni ... 57
Lampiran 5. Spektrum analisis GC-MS fraksi trigliserida ... 59
Lampiran 6. Spektrum FT-IR fraksi trigliserida ... 64
Lampiran 7. Bagan alir cara kerja ... 65
perpustakaan.uns.ac.id digilib.uns.ac.id
conoideus diantaranya adalah merah panjang, merah pendek, cokelat dan kuning
(Budi, 2001). Beberapa bukti empiris menunjukkan bahwa P. conoideus varian
kuning (yang kemudian dikenal dengan buah kuning) dapat bertindak sebagai
obat antikanker meskipun mekanisme penghambatan terhadap sel kanker oleh
buah ini belum sepenuhnya dapat diketahui (Astirin, 2008).
Analisis pendahuluan terhadap ekstrak buah kuning terungkap bahwa
ekstrak buah kuning mengandung: total karoten (9.500 ppm); β-karoten (240
ppm); tokoferol (10.400 ppm) dan beberapa asam lemak seperti asam oleat, asam
linoleat dan asam palmitat serta omega 3 dan omega 9 yang dikenal sebagai
antioksidan yang dapat mencegah berbagai penyakit termasuk kanker (Budi,
2001). Kandungan senyawa dalam buah kuning hampir sama dengan varian buah
merah panjang hanya berbeda dalam komposisi asam lemak jenuhnya dan kadar
asam lemak tak jenuh serta senyawa antioksidannya.
Asam lemak terdapat dalam tumbuhan terutama dalam bentuk terikat,
teresterkan dengan gliserol sebagai lemak yaitu berupa triasil gliserol atau
trigliserida (Harborne, 1987; Muchalal, 2004). Ikatan tak jenuh yang ada dalam
asam lemak merupakan pusat aktif yang dapat bereaksi dengan oksigen.
Peroksidasi (auto-oksidasi) lipida dapat menyebabkan kerusakan jaringan tubuh
secara in vivo sehingga menimbulkan beberapa penyakit seperti kanker. Efek yang
merusak ini ditimbulkan oleh radikal bebas (ROO*, RO*, OH*) yang dihasilkan
saat pembentukan peroksida dari asam lemak. Keberadaan antioksidan dalam
ekstrak buah dapat menghambat atau mencegah reaksi auto-oksidasi pada lipida.
Senyawa ini dapat memberikan atom hidrogen secara cepat pada radikal peroksida
(ROO*, RO*, OH*) dan mengubahnya ke bentuk yang lebih stabil.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
Autooksidasi yang terjadi pada asam lemak relatif lebih cepat apabila
ekstrak lipida dalam ekstrak buah dipisahkan dari komponen senyawa yang lain.
Sebaliknya apabila dilakukan pemisahan langsung dari bahan awal reaksi
autooksidasinya menjadi lebih lambat. Amplifikasi yang dilakukan dengan
menambahkan oksidator pada proses kolom akan dapat diketahui seberapa besar
kekuatan oksidasi dari asam lemak tak jenuhnya dan ketahanan terhadap reaksi
oksidasi karena keberadaan senyawa antioksidan yang terdapat pada ekstrak buah.
Penelitian yang telah dilakukan pada ekstrak lipida dari ekstrak buah
merah menggunakan kromatografi lapis tipis (KLT) dengan fasa diam modifikasi
yaitu berupa silika gel-alumina (2:3) dan oksidator berupa MnO2 diperoleh hasil
suatu produk turunan asam lemak yaitu berupa dioktil phtalat dan bis(2-etilheksil)
adipat (Handayani, 2008). Sedangkan ekstrak β-karoten dari buah merah juga
telah dipisahkan dengan menggunakan teknik modifikasi tersebut. Modifikasi fasa
diam tersebut menyebabkan senyawa β-karoten mengalami perubahan (Rumanthi,
2008).
Adanya perbedaan komposisi dalam ekstrak buah merah dan ekstrak buah
kuning dimungkinkan berpengaruh terhadap proses pemisahan senyawanya.
Kandungan asam lemak tak jenuh dalam ekstrak buah merah lebih besar daripada
ekstrak buah kuning, sehingga kemungkinan asam lemak yang bereaksi dengan
oksidator lebih besar pada buah merah. Berdasarkan hal tersebut, pada penelitian
ini dilakukan modifikasi yang sama dengan modifikasi yang dilakukan pada
ekstrak buah merah dengan memperhatikan pengaruh perbedaan kadar asam
lemak dan potensi antioksidan dengan penambahan oksidator yang tinggi, apakah
reaksi yang terjadi akan sekuat pada buah merah jika modifikasi ini dilakukan
pada buah kuning.
B. Perumusan Masalah 1. Identifikasi Masalah
Buah kuning (Pandanus conoideus Lamk.) mengandung trigliserida dan
senyawa lain seperti β-karoten dan tokoferol. Komposisi utama dalam ekstrak
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
dalam ekstrak buah kuning sekitar 58,018%, sedangkan kandungan asam lemak
tak jenuh dalam ekstrak buah merah sekitar 65,74%. Selisih asam lemak tak jenuh
dalam ekstrak buah kuning dan ekstrak buah merah sebesar 7,722%. Dalam
ekstrak buah merah juga terdapat adanya asam lemak bebas. Selain komposisi
asam lemak, komposisi antioksidan dalam ekstrak buah kuning juga berbeda
dengan ekstrak buah merah. Total antioksidan dalam ekstrak buah kuning sebesar
20.140 ppm (2,014%), sedangkan total antioksidan dalam eksrak buah merah
sebesar 23.700 ppm (2,37 %). Selisih antioksidan dalam ekstrak buah merah dan
ekstrak buah kuning sebesar 3.560 ppm (0,356%).
Asam lemak dalam ekstrak buah kuning dapat dipisahkan dari senyawa
lain dengan berbagai macam teknik pemisahan diantaranya kromatografi kolom.
Penambahan alumina dalam fasa diam dapat mengakibatkan perubahan
irreversibel.Alumina menyebabkan reaksi saponifikasi gliserida dan auto-oksidasi
asam lemak (Schultz, 1962). Alumina untuk kromatografi berada dalam bentuk
basa (pH 9,5), asam (pH 4,5 dalam air) dan netral. Alumina basa merupakan
alumina yang lebih reaktif dibandingkan dengan alumina lainnya dan dapat
menyebabkan reaksi polimerisasi, kondensasi dan dehidrasi (Gordon, 1972;
Cannel, 1998). Penambahan oksidator (MnO2) pada fasa diam juga dapat
mengoksidasi senyawa alkohol menjadi aldehid. Ekstrak lipida dari ekstrak buah
merah memerlukan komposisi MnO2 sebanyak 1,5% untuk dapat berubah menjadi
bentuk turunannya (Handayani, 2008). Sedangkan ekstrak β-karoten
membutuhkan MnO2 sebanyak 5% untuk dapat berubah (Rumanthi, 2008).
Modifikasi yang telah dilakukan untuk ekstrak buah merah akan diperoleh
senyawa turunan asam lemak yang berupa dioktil pthalat (Novianti,2010).
Modifikasi yang dilakukan tanpa memisahkan senyawa awal dari komponen yang
lain akan menurunkan produk dioktil pthalat yang dihasilkan. Apabila dilakukan
modifikasi yang sama untuk buah kuning dimungkinkan akan terjadi reaksi yang
sama dan dapat juga berbeda. Mengingat perbedaan kadar antara asam lemak
dalam ekstrak buah kuning dengan ekstrak buah merah serta perbedaan kadar
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user 2. Batasan Masalah
1. Sari buah kuning yang digunakan adalah sari buah kuning dari papua yang
diproduksi oleh I Made Budi.
2. Teknik yang digunakan untuk memisahkan dan atau mereaksikan
trigliserida didalam ekstrak buah kuning adalah teknik kromatografi kolom
yang dimodifikasi fasa diamnya.
3. Fasa diam yang digunakan adalah campuran silika-alumina basa dengan
perbandingan 2:3 dan penambahan MnO2 3% dan 5%.
3. Rumusan Masalah
1. Apakah dapat dilakukan pemisahan trigliserida dalam ekstrak buah kunig
dengan menggunakan modifikasi teknik kromatografi kolom yaitu berupa
penambahan alumina basa dan oksidator kedalam fasa diam silika gel,
dengan memperhatikan pengaruh senyawa antioksidan dalam ekstrak
tersebut.
2. Dengan memperhatikan perbedaan kadar antara asam lemak tak jenuh dan
antioksidan dalam ekstrak buah merah dan ekstrak buah kuning apakah
dalam fraksi trigliseridanya dapat dihasilkan senyawa turunan asam lemak
(dioktil pthalat) seperti yang diperoleh dalam ekstrak buah merah.
C. Tujuan Penelitian
Tujuan penelitian ini adalah untuk memisahkan trigliserida dari ekstrak
buah kuning menggunakan modifikasi kolom kromatografi dengan
memperhatikan adanya pengaruh senyawa antioksidan dalam ekstrak buah kuning
serta perbedaan kadar antara asam lemak tak jenuh dan senyawa antioksidannya
sehingga dapat diketahui pada ekstrak trigliserida kemungkinan dihasilkannya
senyawa dioktil ptalat seperti pada ekstrak buah merah.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user D. Manfaat Penelitian
Manfaat yang dapat diambil dari penelitian ini adalah memberikan
informasi reaksi sekaligus pemisahan trigliserida dari ekstrak buah kuning
menggunakan modifikasi teknik kromatografi kolom dengan memperhatikan
pengaruh dari adanya suatu antioksidan dan perbedaan kadar asam lemak tak
jenuh serta senyawa antioksidan di dalam ekstrak buah kuning dan ekstrak buah
merah.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user BAB II
LANDASAN TEORI
A. Tinjauan Pustaka 1. Buah Kuning
Buah kuning (Pandanus conoideus Lamk.) termasuk dalam famili
Pandanaceae dengan varian kuning. Didaerah asalnya Papua, tanaman ini dikenal
dengan nama sait, mongka memyeri, atau barkum. Buah ini tersebar hampir di
seluruh wilayah Bumi Cendrawasih terutama di Pegunungan Arfak. Buah kuning
berwarna kuning muda. Ukurannya mencapai panjang 102 cm, diameter 20 cm
dan bobot 4 – 7,5 kg. Buah dibungkus dengan daun memanjang, pohonnya
menjulang setinggi 16 – 17 m, ditopang akar – akar tunjang berdiameter 6 – 7 cm
sepanjang 2,5 – 3,7 m. daun berwarna hijau tua, lanset dan ujung meruncing.
Panjang daun 88 – 102 cm dan lebar 6 – 10 cm. seluruh tepi daun ditumbuhi duri
sepanjang 1 mm ( Mangan, 2005 ).
Gambar 1. Buah kuning
Bagi masyarakat Wamena, buah kuning digunakan untuk pesta adat,
namun banyak pula yang memanfaatkannya sebagai obat. Khasiat buah merah dan
buah kuning yang sudah dikonsumsi turun-temurun di Papua dipercaya mampu
menyembuhkan berbagai penyakit seperti penyakit mata, kulit, kanker rahim dan
kanker paru-paru serta kanker hati (Moeljopawiro, 2007).
β-Karoten dalam buah kuning berfungsi memperlambat berlangsungnya penumpukan flek pada arteri. Interaksinya dengan protein meningkatkan produksi
antibodi. Ini meningkatkan jumlah sel pembunuh alami yang dapat menekan
kehadiran sel-sel kanker dan menangkal radikal bebas senyawa karsinogen
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
penyebab kanker. Konsumsi β-karoten rutin membuat tubuh dapat memperbanyak
sel-sel alami pembasmi penyakit. Bertambahnya sel-sel tersebut akan menekan
kehadiran sel kanker dengan menetralisir radikal bebas senyawa karsinogen
penyebab kanker. Tokoferol (vitamin E) berfungsi hampir sama dengan β-karoten
yaitu pencegah penyakit degeneratif. Tokoferol akan mematikan serbuan radikal
bebas dan menetralisir kolesterol dalam darah (Dermawan, 2005; Duryatmo,
2005; Sofia, 2005).
2. Komponen-Komponen pada Ekstrak Buah Kuning
Komponen penyusun buah kuning terdiri dari trigliserida dan non
trigliserida. Asam-asam lemak penyusun trigliserida terdiri dari asam lemak jenuh
dan asam lemak tak jenuh. Asam lemak merupakan asam organik berantai
panjang yang mempunyai atom karbon dari (C4:0) sampai (C20:0). Asam lemak
mempunyai gugus karboksil tunggal dan ekor hidrokarbon non polar yang
panjang, yang menyebabkan kebanyakan lipid bersifat tidak larut didalam air
(Lehninger, 1990). Asam lemak jenuh adalah asam lemak dengan rantai karbon
yang tidak mengandung ikatan rangkap, sedangkan asam lemak tidak jenuh adalah
asam lemak yang mengandung satu atau lebih ikatan rangkap (Poedjiadi, 1994).
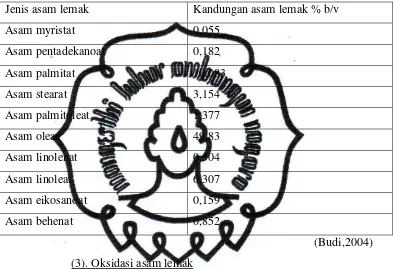
Beberapa contoh asam lemak disajikan dalam tabel 1.
Keberadaan ikatan ganda pada asam lemak tak jenuh menjadikannya
memiliki dua bentuk: cis dan trans. Semua asam lemak nabati alami hanya
memiliki bentuk cis (dilambangkan dengan "Z"). Asam lemak bentuk trans
(trans fatty acid, dilambangkan dengan "E") hanya diproduksi oleh sisa
metabolisme hewan atau dibuat secara sintetis. Akibat polarisasi atom H,
asam lemak cis memiliki rantai yang melengkung. Asam lemak trans karena
atom H-nya berseberangan tidak mengalami efek polarisasi yang kuat dan
rantainya tetap relatif lurus.
Warna minyak disebabkan oleh adanya pigmen, karena asam lemak dan
gliseridanya tidak berwarna. Warna orange dan kuning disebabkan adanya pigmen
karoten yang larut dalam minyak tersebut. Apabila minyak dihidrogenasi, maka
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
pengurangan warna pada minyak. Karoten tidak stabil pada suhu tinggi dan bila
minyak diolah dengan menggunakan uap panas, maka karoten akan kehilangan
warnanya (Ketaren, 1986).
Tabel 1. Beberapa Asam Lemak yang Umum
Nama Rumus
Trigliserida adalah triester dari gliserol dengan asam-asam lemak, yaitu
asam-asam karboksilat beratom karbon 6 s/d 30. Trigliserida banyak dikandung
dalam minyak dan lemak, merupakan komponen terbesar penyusun ekstrak buah
kuning. Selain trigliserida, terdapat juga monogliserida dan digliserida. Struktur
molekul dari ketiga macam gliserid tersebut dapat dilihat pada Gambar 1.
(Puspasari, 2007).
perpustakaan.uns.ac.id digilib.uns.ac.id
Gambar 2. Struktur molekul monogliserida, digliserida, dan trigliserida
R1, R2, dan R3 merupakan rantai hidrokarbon yang berupa asam lemak dengan
jumlah atom C lebih besar dari sepuluh. Senyawa inilah yang akan dikonversi
menjadi ester melalui reaksi transesterifikasi.
Trigliserida yang pada suhu kamar berupa zat padat disebut lemak,
sedangkan trigliserida yang berupa cairan disebut minyak. Secara kimia, lemak
sebagian besar terdiri atas asam lemak jenuh dan minyak mengandung lebih
banyak asam tidak jenuh (Robinson, 1991). Oleh karena itu, molekul trigliserida
bila terkondensasi hasilnya adalah satu molekul gliserol dan tiga asam lemak
dengan melepaskan tiga molekul air.
Gambar 3. Reaksi kondensasi asam lemak
Trigliserida yang terkandung dalam minyak merupakan campuran berbagai
macam asam lemak dan kecil kemungkinan yang sejenis (Astuti, 2002). Proses
hidrolisis yang dilakukan biasanya dengan penambahan sejumlah basa yang
dikenal dengan reaksi penyabunan atau saponifikasi. Selain dalam bentuk
trigliserida asam lemak dalam ekstrak buah kuning juga terdapat dalam bentuk
asam lemak bebas.
(2). Asam lemak bebas
Asam lemak bebas adalah asam lemak yang terpisahkan dari trigliserida,
digliserida, monogliserida, dan gliserin bebas. Hal ini dapat disebabkan oleh
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
dapat meningkatkan kadar asam lemak bebas dalam minyak nabati.
HC – (CH2)7 – COOH
║
HC – (CH2)7 – CH3
Gambar 4. Contoh struktur asam lemak bebas (asam oleat)
Tabel 2. Komposisi asam lemak dari minyak buah kuning
Jenis asam lemak Kandungan asam lemak % b/v
Asam myristat 0,055
Proses oksidasi dapat berlangsung jika terjadi kontak antara sejumlah
oksigen dengan minyak atau lemak, umumnya yang berupa asam lemak tak jenuh.
Mekanisme oksidasi lipida terjadi dari beberapa tahap. Menurut Meyes (1997) dan
Hamilton (1983), autooksidasi lipida berjalan dengan dua tahap. Selama tahap
pertama, oksidasi berjalan lambat dengan laju kecepatan seragam. Tahap pertama
ini sering disebut periode induksi. Oksidasi pada periode induksi ini berlangsung
beberapa waktu sampai pada waktu titik tertentu dimana reaksi memasuki tahap
kedua yang mempunyai laju oksidasi dipercepat. Laju pada oksidasi tahap kedua
beberapa kali lebih cepat dari laju oksidasi tahap pertama. Asam lemak yang
memiliki ikatan rangkap lebih banyak (misal asam linoleat) bereaksi lebih cepat
dibanding yang berikatan rangkap lebih sedikit (metil oleat) sehingga periode
induksinya lebih pendek.
perpustakaan.uns.ac.id digilib.uns.ac.id
Gambar 5. Mekanisme oksidasi asam lemak pada tahap inisiasi dan propagasi
Mekanisme oksidasi lipida tidak jenuh diawali dengan tahap inisiasi,
yaitu berbentuknya radikal bebas (R*) bila lipida kontak dengan panas, cahaya,
ion metal dan oksigen. Reaksi ini terjadi pada group metilen yang berdekatan
dengan ikatan rangkap –C=C- (Buck, 1991). Ditambahkan oleh Gordon (1990),
tahap inisiasi terjadi karena bantuan sumber energi ekstenal seperti panas, cahaya
atau energi tinggi dari radiasi, inisiasi kimia dengan terlarutnya ion logam atau
metaprotein seperti haem. Tahap selanjutnya adalah tahap propagasi dimana
autooksidasi berawal ketika radikal lipida (R*) hasil tahap inisiasi bertemu
dengan oksigen membentuk radikal peroksida (ROO*). Reaksi oksigenasi ini
terjadi sangat cepat dengan energi aktivitas hampir nol sehingga konsentrasi
ROO* yang terbentuk jauh lebih besar dari konsentrasi R* dalam sistem
makanan dimana oksigen berada (Gordon, 1990). Radikal peroksida yang
terbentuk akan mengekstrak ion hidrogen dari lipida lain (R1H) membentuk
hidroperoksida (ROOH) dan molekul radikal lipida baru (R1*). Selanjutnya
reaksi autooksidasi ini akan berulang sehingga merupakan reaksi berantai. Tahap
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
sangat tidak stabil terpecah menjadi senyawa organik berantai pendek seperti
aldehid, keton, alkohol dan asam (Rusmono, 2000). Peranan biologi yang penting
dari lipid adalah sebagai : (1) komponen struktur membran; (2) lapisan pelindung
pada beberapa jasad; (3) bentuk energi cadangan; (4) komponen permukaan sel
yang berperan dalam proses interaksi antara sel dengan senyawa kimia di luar sel,
seperti dalam proses kekebalan jaringan; dan (5) sebagai komponen dalam proses
pengangkutan melalui membran (Wirahadikusuma, 1985).
b. Komponen Non Trigliserida (1). Karotenoid
Karotenoid adalah suatu senyawa golongan terpena yang merupakan
golongan pigmen yang larut dalam lipida dan tersebar luas, terdapat dalam semua
jenis tumbuhan. Pada tumbuhan, karotenoid mempunyai dua fungsi, yaitu suatu
pigmen pembantu dalam fotosintesis dan sebagai pewarna pada bunga dan buah.
Dalam bunga, karotenoid kebanyakan berupa zat warna kuning sedangkan di
dalam buah dapat juga berupa zat warna jingga atau merah (Harborne, J. B.,
1996). Ada banyak jenis karotenoid yang telah banyak ditemukan. Hidrokarbon karotenoid seperti β-karoten dan lycopene, dikenal dengan karoten, sedangkan turunan teroksigenasinya disebut xanthophyl. Di alam, karotenoid stabil terdapat
dalam bentuk all-trans (all-E), tetapi juga ada sejumlah kecil yang terdapat dalam
bentuk cis (Z). Modifikasi atas kerangka karotenoid dasar, terjadi dan
menghasilkan berbagai macam metabolit. Metabolit karotenoid yang paling
penting adalah vitamin A (Richard B. Herbert, 1995). Di antara lebih dari 400
jenis karotenoid yang layak ditentukan sifat-sifatnya dengan baik, hanya sekitar
30 jenis yang mempunyai aktivitas sebagai provitamin A. Untuk manusia dan
hewan-hewan percobaan, kelompok karotenoid yang aktif secara biologis, secara
tidak seragam mengandung paling sedikit satu cincin β-ionon yang tidak
tersubstitusi. Karotenoid yang paling aktif adalah all-transβ-karoten.
β-Karoten adalah salah satu jenis senyawa hidrokarbon karotenoid yang merupakan senyawa golongan tetraterpenoid (Winarsi, 2007). Adanya ikatan
ganda menyebabkan β-karoten peka terhadap oksidasi. Oksidasi β-karoten akan
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
mangan. Oksidasi akan terjadi secara acak pada rantai karbon yang mengandung
ikatan rangkap. β-karoten merupakan penangkap oksigen dan sebagai antioksidan
yang potensial, tetapi β-karoten efektif sebagai pengikat radikal bebas bila hanya
tersedia oksigen 2 – 20 %. Pada tekanan oksigen tinggi diatas kisaran fisiologis,
karoten dapat bersifat pro-oksidan (Burton, 1989).
β-Karoten mengandung ikatan rangkap terkonjugasi yang memberikan karakter pro-oksidan, akibatnya akan sangat mudah diserang melalui penambahan
radikal peroksil.
β-caroten + ROO* β-car* β-car* + O2 β-car-OO*
β-car* + ROO* produk tak aktif
Radikal β-karoten (β-car*) yang terbentuk bereaksi dengan cepat dan reversible dengan oksigen untuk membentuk radikal peroksil yang baru (β-car-OO*).
Reaktivitas β-karoten menjadi radikal peroksil dan stabilitas pembentukan β-car* adalah dua gambaran penting yang memberikan molekul tersebut kemampuan antioksidan. Reaktivitas β-karoten artinya senyawa tersebut
mempunyai potensi untuk menyerang radikal peroksil yang diturunkan dari
molekul lipida yang lain, walaupun ketika berada pada konsentrasi rendah. Stabilitas β-car* artinya adalah pada tekanan O2 yang rendah, bentuk tersebut
dapat mendominasi seluruh bentuk radikal peroksil. Radikal β-car* dapat dilepaskan dari sistem reaksi dengan radikal peroksil yang lain (Burton, 1988).
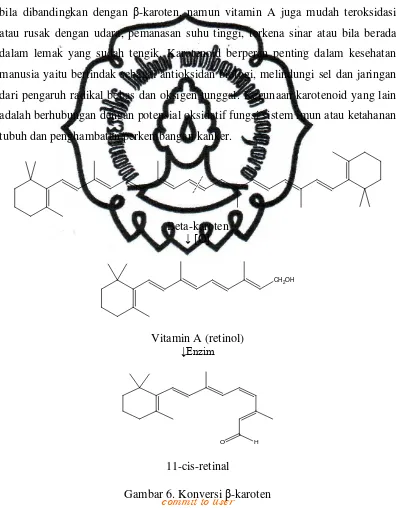
β-Karoten memiliki 11 ikatan rangkap karbon-karbon yang terkonjugasi. Zat ini merupakan prekursor biologis bagi vitamin A, yaitu alkohol tak jenuh
berkarbon 20, yang juga disebut retinol. Retinol ini menghasilkan 11-cis-retinal
(Gambar 5). Konversi vitamin A menjadi 11-cis-retinal tidak hanya melibatkan
oksidasi gugus alkohol menjadi aldehid, tetapi juga isomerisasi trans menjadi cis
pada ikatan rangkap C11 – C12 (Hart, 2003). Dalam tubuh, satu molekul β-karoten
akan diubah menjadi dua molekul retinil dan dipecah dalam mukosa dari usus
kecil oleh β-karoten- dioksigenase menjadi retinol, sebuah bentuk dari vitamin A.
Retinol dioksidasi menjadi retinaldehid dan sebagian kecil aldehid ini diubah
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
Penjelasan tersebut menunjukkan bahwa β-karoten dalam tubuh dapat diubah
menjadi vitamin A melalui reaksi oksidasi enzimatis. Namun, penelitian Lederrer
(1957) menunjukkan bahwa vitamin A dapat dioksidasi menjadi retinen (salah
satu bentuk vitamin A) menggunakan teknik kromatografi dengan penambahan
MnO2 pada fasa diamnya.
Vitamin A secara umum relatif lebih stabil dalam panas, asam dan basa
bila dibandingkan dengan β-karoten, namun vitamin A juga mudah teroksidasi
atau rusak dengan udara, pemanasan suhu tinggi, terkena sinar atau bila berada
dalam lemak yang sudah tengik. Karotenoid berperan penting dalam kesehatan
manusia yaitu bertindak sebagai antioksidan biologi, melindungi sel dan jaringan
dari pengaruh radikal bebas dan oksigen tunggal. Kegunaan karotenoid yang lain
adalah berhubungan dengan potensial oksidatif fungsi sistem imun atau ketahanan
tubuh dan penghambatan perkembangan kanker.
Beta-karoten ↓ [O]
CH2OH
Vitamin A (retinol) ↓Enzim
O H
11-cis-retinal
Gambar 6. Konversi β-karoten
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user (b). Tokoferol
Tokoferol merupakan senyawa kimia yang mempunyai aktivitas vitamin
E. Tokoferol dalam minyak dapat berfungsi sebagai antioksidan sehingga minyak
dan karoten yang terkandung didalamnya dapat terlindungi dari oksidasi. Sebagai
antioksidan tokoferol berfungsi sebagai donor hidrogen yang mampu mengubah
radikal peroksil menjadi radikal tokoferol yang kurang reaktif, sehingga mampu
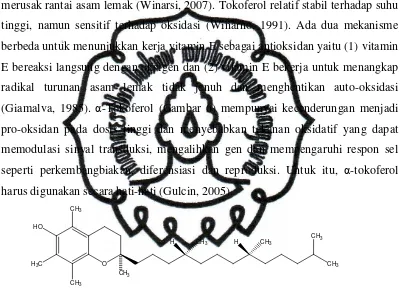
merusak rantai asam lemak (Winarsi, 2007). Tokoferol relatif stabil terhadap suhu
tinggi, namun sensitif terhadap oksidasi (Winarno, 1991). Ada dua mekanisme
berbeda untuk menunjukkan kerja vitamin E sebagai antioksidan yaitu (1) vitamin
E bereaksi langsung dengan oksigen dan (2) vitamin E bekerja untuk menangkap
radikal turunan asam lemak tidak jenuh dan menghentikan auto-oksidasi
(Giamalva, 1985). α-Tokoferol (Gambar 6) mempunyai kecenderungan menjadi
pro-oksidan pada dosis tinggi dan menyebabkan tekanan oksidatif yang dapat
memodulasi sinyal transduksi, mengalihkan gen dan mempengaruhi respon sel
seperti perkembangbiakan, diferensiasi dan reproduksi. Untuk itu, α-tokoferol
harus digunakan secara hati-hati (Gulcin, 2005).
O
Gambar 7. Struktur α-Tokoferol
c. Aktivitas Antioksidan (1). Radikal Bebas
Radikal bebas merupakan sekelompok zat kimia yang sangat reaktif
karena memiliki satu atau lebih elektron yang tidak berpasangan. Radikal
bebas adalah oksidan, tetapi tidak semua oksidan merupakan radikal bebas.
Oksidan merupakan senyawa yang dapat menerima elektron dan radikal bebas
merupakan atom atau gugus yang orbital luarnya memiliki elektron yang tidak
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
(Reactive Oxygen Species = ROS) diproduksi secara terus menerus di dalam
tubuh manusia sebagai akibat proses metabolisme normal (Langseth, 1995).
Selama makanan dioksidasi untuk menghasilkan energi, sejumlah
radikal bebas juga terbentuk. Radikal bebas berfungsi untuk memberikan
perlindungan tubuh terhadap serangan bakteri dan parasit. Namun tidak
menyerang sasaran spesifik, sehingga akan menyerang asam lemak tidak jenuh
ganda dari membran sel, struktur sel, dan DNA. Radikal bebas adalah
oksidan, tetapi tidak semua oksidan merupakan radikal bebas. Oksidan
merupakan senyawa yang dapat menerima elektron dan radikal bebas
merupakan atom atau gugus yang orbital luarnya memiliki elektron yang
tidak berpasangan. Radikal bebas dan senyawa oksigen reaktif yang diproduksi
dalam jumlah yang normal, penting untuk fungsi biologi (Haryatmi, 2004).
Beberapa hipotesis menjelaskan tentang radikal bebas pada diabetes
mellitus, seperti glikosilasi protein non enzimatik, autooksidasi glukosa gangguan
metabolisme glutation, perubahan enzim antioksidan dan pembentukan lipid
peroksidasi. Peningkatan radikal bebas secara umum menyebabkan gangguan
fungsi sel dan kerusakan oksidatif pada membran. Pada kondisi tertentu
antioksidan mempertahankan sistem perlindungan tubuh melalui efek penghambat
pembentukan radikal bebas. Efisiensi mekanisme pertahanan tersebut mengalami
perubahan pada diabetes mellitus. Penangkapan radikal bebas yang tidak efektif
dapat menyebabkan kerusakan jaringan (Rajasekaran et al., 2005 ; Kaleem et al.,
2006). Radikal bebas bereaksi dengan biomembran menyebabkan destruksi
oksidatif asam lemak tak jenuh membentuk aldehid sitotoksik melalui peroksidasi
lipid. Selanjutnya peroksidasi lipid diukur dengan thiobarbituric acid reactive
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user (2). Antioksidan
Suatu senyawa dikatakan memiliki sifat antioksidan bila senyawa tersebut
mampu mendonasikan satu atau lebih elektron kepada senyawa perooksidan,
kemudian mengubah senyawa oksidan menjadi senyawa yang lebih stabil.
Berdasarkan mekanisme kerjanya, antioksidan dapat dikelompokkan menjadi tiga
kelompok, yaitu:
(a). Antioksidan primer(antioksidan endogen atau antioksidan enzimatis),
contohnya enzim peroksidase dismutase, katalase dan glutation peroksidase.
Enzim-enzim ini mampu menekan atau menghambat pembentukan radikal
bebas dengan cara memutus reaksi berantai dan mengubahnya menjadi produk
stabil. Reaksi ini disebut sebagi chain-breaking-antioxidant.
(b). Antioksidan sekunder (antioksidan eksogen atau antioksidan non
enzimatis). Contoh antioksidan sekunder ialah vitamin E, vitamin C, β-karoten,
isoflavon, asam urat, bilirubin dan albumin. Senyawa-senyawa ini dikenal
sebagai penangkap radikal bebas (scavenger free radical), kemudian mencegah
amplifikasi radikal.
(c). Antioksidan tersier, misalnya enzim DNA-repair, metionin sulfoksida
reduktase, yang berperan dalam perbaikan biomolekul yang disebabkan oleh
radikal bebas (Winarsi, 2005).
Penambahan antioksidan (AH) dengan konsentrasi rendah pada lipida
dapat menghambat atau mencegah reaksi auto-oksidasi. Penambahan tersebut
dapat menghalangi reaksi oksidasi pada tahap insiasi dan propagasi dengan
memberikan atom hidrogen secara cepat ke radikal lipida (R*, ROO*) dan
mengubahnya menjadi bentuk lebih stabil.
Tahap inisiasi: R* + AH → RH + A*
Tahap propagasi: ROO* + AH → ROOH + A*
Sementara itu, turunan radikal antioksidan (A*) tersebut memiliki keadaan yang
lebih stabil dibanding radikal lipida dan tidak mempunyai cukup energi untuk
dapat bereaksi dengan molekul lipida lain membentuk radikal baru (Schultz, 1962,
deMan, 1997).
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
Pada penghambatan oksidasi lipida, salah satu masalah yang menarik
adalah mekanisme dimana antioksidan menstabilkan vitamin A dan karoten.
Struktur oksida terjadi melalui ikatan oksigen pada bagian tak jenuh dari cincin.
Namun hal ini tidak terjadi pada rantai. Antioksidan fenolik menghambat oksidasi
tersebut. Aktivitas vitamin A sebagai antioksidan diperkuat dengan menggunakan
antioksidan fenolik (Schultz, 1962; Paiva, 1999).
3. Kromatografi
Kromatografi mencakup berbagai proses berdasarkan perbedaan distribusi
antara dua fasa dari penyusun cuplikan. Satu fasa tetap tinggal dalam sistem dan
dinamakan fasa diam, sedangkan fasa yang lain dinamakan fasa gerak untuk
memperkolasi melalui celah-celah fasa diam. Gerakan fasa gerak menyebabkan
perbedaan migrasi dari penyusun cuplikan. (Sudjadi, 1988). Pemisahan secara
kromatografi dilakukan dengan cara mengubah langsung beberapa sifat fisika
umum dari molekul. Sifat utama yang terlibat adalah kecenderungan molekul
untuk melarut dalam cairan (kelarutan), kecenderungan molekul untuk melekat
pada permukaan serbuk halus (adsorpsi, penyerapan) dan kecenderungan molekul
untuk menguap atau berubah ke keadaan uap (keatsirian) (Gritter, Bobbitt, 1991).
Jika fasa gerak digerakkan melalui fasa diam untuk menghasilkan
pemisahan kromatografi, proses ini dikenal sebagai pengembangan.
Pengembangan ialah proses pemisahan campuran cuplikan akibat pelarut
pengembang merambat naik dalam lapisan. Setelah senyawa-senyawa dipisahkan
dengan pengembangan, hasilnya dideteksi (divisualisasi atau ditampakkan). Jika
senyawa-senyawa yang dipisahkan benar-benar dikeluarkan dari sistem, maka
senyawa itu telah dielusi. Senyawa yang telah dipisahkan disebut solut atau
cuplikan (Gritter, 1991).
a. Kromatografi kolom
Kromatografi kolom merupakan kromatografi cair yang dilakukan dalam
kolom besar. Kromatografi kolom merupakan metode terbaik untuk pemisahan
campuran dalam jumlah besar (lebih dari satu gram). Kadang-kadang cara ini
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
adalah untuk mendapatkan hasil zat murni secara preparatif dari campuran dan
untuk pemisahan zat pada penentuan kuantitatif maupun kualitatif. Pada
kromatografi kolom, campuran yang akan dipisahkan diletakkan berupa pita pada
bagian atas kolom penyerap yang berada dalam tabung kaca, tabung logam, atau
tabung plastik. Pelarut dibiarkan mengalir melalui kolom karena aliran yang
disebabkan oleh gaya berat atau didorong dengan tekanan. Walaupun banyak jenis
penyerap telah dipakai untuk kolom, silika gel dan alumina merupakan penyerap
paling banyak digunakan. (Gritter, 1991).
Tabel 3. Urutan kepolaran eluen, elusi senyawa, dan kekuatan adsorben dalam kromatografi
asetat (98,5:1,5) umumnya digunakan untuk pemisahan lipida non polar.
Mobilitas terbesar ditunjukkan oleh ester kolesterol diikuti oleh triasilgliserol,
asam lemak bebas, kolesterol, diasilgliserol, monoasilgliserol (Holme, 1993).
b. Alumina
Alumina (Al2O3) adalah salah satu adsorben yang digunakan pada
kromatografi. Penyerap ini seringkali dipakai untuk pemisahan alkaloid, zat
warna, fenol, steroid, vitamin-vitamin, karoten dan asam-asam amino.
(Sastrohamidjoyo, 2002). Alumina yang diperoleh dari perdagangan dengan
bersifat asam netral atau basa. Alumina, terutama bila bersifat alkali, sering
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
dapat menyebabkan kondensasi dari aldehid-aldehid dan keton-keton, hingga bila
hal ini terjadi dapat menyebabkan isomerisasi dari berbagai senyawa seperti
terpen dan sterol. (Sastrohamidjoyo, 2002). Hal ini dapat dicegah dengan
mencucinya dengan larutan asam atau dengan air (terakhir diikuti dengan
metanol), kemudian direaktivasi pada suhu 200˚C. Pemanasan alumina diatas
suhu 500˚C sebaiknya dihindari; Lederer (1957) menyatakan bahwa permukaan
alumina teatap konstan hingga suhu 528˚C, kemudian menurun sampai 15% pada
suhu 734˚C dan menurun 40% setelah pemanasan pada suhu 938˚C. Satu gram
alumina untuk kromatografi mempunyai luas permukaan sebesar 90m2, darinya
hanya sebesar 6m2 per gram yang tidak berguna sebagai adsorben.
Ald+ Ald+
Alumina yang digunakan untuk kromatografi berbentuk serbuk putih.
Ukuran partikel alumina berkisar 50 – 200 µm (70 – 290 mesh). Alumina dapat
dihasilkan dengan permukaan asam, basa, dan netral, berdasarkan pH dari
adsorben. Alumina asam mempunyai pH mendekati 4 dan paling berguna untuk
pemisahan senyawa asam seperti asam karboksilat. Alumina asam dapat
menyebabkan dehidrasi alkohol (terutama alkohol tersier). Alumina basa (pH
mendekati 10) berguna untuk pemisahan senyawa basa seperti alkaloid. Alumina
basa dapat menyebabkan hidrolisis ester. Alumina juga dapat menyebabkan
hidrolisis dari lipida alkalilabile (Renkonsen, 1961). Alumina netral (pH
mendekati 7) sering digunakan untuk pemisahan senyawa non polar seperti steroid
(Cannel, 1998; Gordon, 1972).
perpustakaan.uns.ac.id digilib.uns.ac.id
Gambar 9. Struktur Dasar Alumina (a) Asam, (b) Netral, (c) Basa
Alumina dapat bertindak sebagai katalis superbasa dan menyebabkan
isomerisasi ikatan rangkap pada olefin. Logam Na akan terionisasi dan elektron
yang terlepas akan berpindah ke atom oksigen. Atom oksigen dengan muatan
negatif yang lebih tinggi akan menghasilkan kemampuan donor elektron yang
kuat. Atom oksigen memiliki jumlah elektron yang lebih banyak akan mempunyai
kemampuan donor elektron yang lebih tinggi dan mempunyai kebasaan yang
tinggi pula (Widodo, 2002). Alumina bila digunakan dengan eluen organic akan
menyerap aromatik dan hidrokarbon tidak jenuh, karotenoid, steroid, alkaloid dan
produk alam lainnya. Alumina dapat mengkatalisis reaksi inter maupun
intramolekular, terutama senyawa yang sensitif terhadap basa seperti alkali
(Bratihwaite and Smith, 1995). Pemisahan beberapa lipida menggunakan kolom
alumina menghasilkan peningkatan kemampuan adsorbsi dimulai dari
hidrokarbon, ester kolesterol, trigliserida, kolesterol bebas, asam lemak dan
fosfatida (Holme, 1993).
c. Silika Gel
Kebanyakan penyerap yang digunakan adalah silika gel. Penyerap ini
seringkali digunakan untuk pemisahan senyawa-senyawa asam-asam aminio,
alkaloid, gula, asam-asam lemak, lipida, minyak esensial, anion dan kation
organik, sterol dan terpenoid. Silika gel yang digunakan kebanyakan kebanyakan
diberi binder (pengikat) yang dimaksudkan untuk memberikan kekuatan pada
lapisan, dan menambah adhesi pada gelas penyokong. Pengikat yang banyak
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
telah diberi pengikat dengan kode silika gel G (Sastrohamidjoyo, 2002).
Silika merupakan adsorben yang bersifat polar. Adsorben polar ini
berinteraksi dengan molekul yang akan diadsorb melalui beberapa gaya, antara
lain dengan tarikan elektrostatik dan ikatan hidrogen. Silika merupakan asam
lemah karena adanya grup Si-OH, sedangkan alumina merupakan adsorben polar
yang bersifat basa kuat karena keberadaan O2-. Adsorben asam akan lebih
menahan komponen basa untuk menaikkan kebasaannya, demikian juga pada
pada adsorben basa akan cenderung menahan komponen asam. Penanganan silika
gel yang diperoleh secara komersial, biasanya diaktifkan dengan pemanasan pada
suhu 100˚C selama 24 jam kemudian mengerikannya dalam desikator selama 24
jam (Lederer, 1957).
dilakukan dengan menggunakan padatan mangan dioksida, MnO2. Kekuatan
oksidasi reagen ini tergantung pada ukuran partikel dan derajad hidrasinya. Reaksi
oksidasi terjadi pada permukaan oksida dan mengakibatkan pembentukan radikal
sebagai intermediet. Produk samping dari reaksi ini adalah manganese (MnO).
Solven seperti petroleum eter, aseton, dan metilen klorida, dimana oksida tidak
dapat larut, digunakan dalam oksidasi. Pentingnya menggunakan solven karena
reaksi terjadi melalui koordinasi substrat dan reagen. Solven dapat mempengaruhi
derajad adsorpsi dan desorpsi alkohol pada mangan dioksida. Jika alkohol primer
atau sekunder digunakan sebagai solven, kompetisi adsorpsi situs alkohol akan
mengurangi hasil produk oksidasi.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
Alkohol jenuh juga teroksidasi oleh MnO2, tetapi dengan kecepatan yang
lebih lambat dibandingkan dengan benzil atau alil alkohol. Hal ini menjadikan
reagen MnO2 kemoselektif untuk jenis alkohol ini. Benzil dan alil alkohol primer
diubah menjadi aldehid sedangkan bentuk sekundernya menjadi keton.
C C
Gambar 11. Pengubahan vitamin A menjadi retinal oleh MnO2
Mangan dioksida dapat digunakan untuk mengubah vitamin A menjadi retinal
dengan menggunakan petroleum eter sebagai solven (Palleros, 2000; Smith,
1946).
B. Kerangka Pemikiran
Buah kuning merupakan sub spesies dari buah merah, Ekstrak buah
kuning mengandung senyawa-senyawa diantaranya adalah asam lemak yang
berada dalam bentuk trigliserida dan senyawa antioksidan seperti β-karoten dan
tokoferol. Trigliserida dalam ekstrak akan dipisahkan dengan menggunakan
teknik modifikasi fasa diam kromatografi kolom.
Berdasarkan penelitian sebelumnya kandungan asam lemak dan β-karoten
dalam buah merah dapat dipisahkan dan dioksidasi dengan menggunakan metode
kromatografi yang dimodifikasi fase diamnya dengan penambahan alumina dan
MnO2 pada silika gel. Adanya perbedaan warna yang dimiliki oleh buah kuning
dimungkinkan akan terjadi reaksi yang sama karena kandungan asam lemak dan
senyawa antioksidan dalam ekstrak buah kuning hampir seluruhnya sama dengan
ekstrak buah merah, hanya berbeda dalam kadarnya.
Alumina dapat menyebabkan reaksi saponifikasi gliserida dan
auto-oksidasi asam lemak serta hidrolisis ester. Alumina juga dapat bertindak sebagai
katalis basa yang dapat menyebabkan isomerisasi pada ikatan rangkap. Sedangkan
MnO2 dapat mengoksidasi benzil dan alil alkohol menjadi bentuk aldehid dan
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
keton. Alumina dan silika gel dapat memisahkan lipida menjadi kelas-kelasnya
dimulai dari trigliserida, asam lemak bebas, digliserida dan monogliserida.
Asam lemak tak jenuh dalam trigliserida dapat mengalami oksidasi yang
diawali dengan terbentuknya radikal bebas dengan oksigen sehingga
menghasilkan glikol dan hasil pemenggalan seperti aldehid dan asam karboksilat
berantai pendek. β-karoten dengan aktivitas vitamin A yang besar dapat dioksidasi
menjadi retinen dengan menggunakan teknik kromatografi yang fasa diamnya
diberi MnO2. β-karoten juga dapat bertindak sebagai antioksidan yang dapat
mencegah terjadinya oksidasi lipida.
Mekanisme yang mungkin terjadi adalah trigliserida, β-karoten dan
tokoferol terpisah bersama-sama. Selama elusi, ketiga senyawa tersebut bertemu
dengan oksidator. β-karoten dan tokoferol yang mempunyai fungsi sebagai
antioksidan akan menghalangi trigliserida yang mempunyai asam lemak dengan
ikatan rangkap untuk mengalami reaksi oksidasi. Sehingga selama pemisahan,
trigliserida akan terlindungi dari oksidator dan dapat dipisahkan dari ekstrak buah
kuning tanpa merusak trigliserida tersebut.
C. Hipotesis
Berdasarkan uraian diatas dapat diambil hipotesis yaitu trigliserida dapat
dipisahkan dari ekstrak buah kuning menggunakan teknik kromatografi yang
dimodifikasi fasa diamnya (penambahan alumina basa dan oksidator kedalam
silika gel). Namun dengan adanya pengaruh fasa diam modifikasi dan antioksidan
dalam ekstrak, mengakibatkan terjadi suatu reaksi yang dapat menghambat
oksidasi asam lemaknya.
Dengan adanya perbedaan daya tahan terhadap oksidasi karena perbedaan
kadar antara asam lemak dan senyawa antioksidan dalam ekstrak buah merah dan
ekstrak buah kuning dimungkinkan akan dihasilkan senyawa dioktil ptalat sebagai
turunan asam lemak yang sama dengan ekstrak buah merah.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user BAB III
METODOLOGI PENELITIAN
A. Metode Penelitian
Metode yang digunakan dalam penelitian ini adalah metode eksperimen di
laboratorium kimia. Penelitian pendahuluan adalah penentuan perbandingan fasa
gerak dan fasa diam untuk kromatografi kolom dengan metode KLT
menggunakan plat modifikasi. Fasa diam berupa campuran silika-alumina(2:3)
dengan penambahan MnO2 3% dan 5%. Setelah diperoleh data KLT dilakukan
pemisahan ekstrak buah kuning dengan kromatografi kolom menggunakan fasa
diam campuran silika-alumina(2:3) dengan penambahan MnO2 3%. Ekstrak buah
kuning dielusikan pada kolom kromatografi menggunakan eluen campuran
PE-dietil eter(1:1). Hasil pemisahan diidentifikasi dengan spektroskopi infra
merah(IR), dan Gas Chromatography – Mass Spectroscopy (GC-MS).
B. Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Kimia Dasar Fakultas Matematika
dan Ilmu Pengetahuan Alam dan Sublab Kimia Laboratorium Pusat Universitas
Sebelas Maret Surakarta. Sedangkan identifikasi dilakukan di Laboratorium
Kimia Organik Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas
Gadjah Mada Yogyakarta.Waktu kegiatan penelitian berlangsung pada bulan Juli
2009 – April 2010.
C. Alat dan Bahan yang Digunakan 1. Alat-alat yang digunakan
Alat-alat yang digunakan dalam penelitian ini adalah :
1. Kolom kromatografi tekan
2. Alat-alat gelas buatan pyrex
3. GC-MS QP2010S Shimadzu
4. IR Shimadzu FTIR Prestige 21
5. TLC Plate Coater
perpustakaan.uns.ac.id digilib.uns.ac.id
Bahan-bahan yang digunakan dalam penelitian ini adalah :
1. Ekstrak buah kuning dari Papua Irian Jaya produksi I Made Budi
2. Silika Gel 60 GF254 for TLC (Merck)
3. Aluminiumoxid 150 aktiv basisch (Merck)
4. Silica gel 60, 70-230 Mesh ASTM(Merck)
5. Aluminiumoxid 60 aktiv basisch 70-230 Mesh ASTM (Merck)
6. PE teknis (Merck)
eter. Kemudian ekstrak diinjeksikan pada syring whatman dengan ukuran
pori 0,2 µm. Ekstrak diuapkan untuk mendapatkan ekstrak pekat kembali.
2. pembuatan 0,5 % Rhodamin B dalam etanol
Sebanyak 0,4 g rhodamin B dilarutkan dalam 100ml etanol.
3. Kromatografi Lapis Tipis
KLT awal adalah KLT silika pabrik untuk identifikasi awal dari
ekstrak buah kuning dan untuk penentuan eluen. Ekstrak buah kuning
dielusikan pada plat KLT dengan cara ditotolkan dengan mikropipet. Dan
dimasukkan dalam gelas piala yang berisi eluen campuran PE dan dietil
eter dengan perbandingan (19:1; 9:1; 7:3; 5:5) sebagai larutan pengembang
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
dengan larutan rhodamin B yang akan memberikan bercak merah muda
pada plat di bawah sinar UV.
KLT selanjutnya menggunakan plat yang telah dimodifikasi. Silika
gel dipanaskan pada 120oC dan alumina dipanaskan pada 150oC selama
satu jam. Untuk plat dibuat bubur silika gel-alumina ditambahkan MnO2
3% dan 5%. Masing-masing bubur adsorben kemudian diratakan pada plat
KLT dan dikeringkan diudara. KLT dilakukan untuk penentuan banyaknya
fraksi buah kuning pada kromatografi kolom. Ekstrak buah kuning
ditotolkan pada plat KLT. Kemudian plat dielusikan dengan eluen
campuran PE:dietil eter(1:1).
4. kromatografi kolom flash
1 g Ekstrak buah kuning dielusi dalam kolom kromatografi dengan
fasa diam silika-alumina(3:2) dengan penambahan MnO2 3%. Eluen yang
digunakan PE-dietil eter dengan perbandingan 1:1, 1:2 dan 1:3. Eluat yang
dihasilkan kemudian ditampung dalam vial-vial tiap 3 mL dan dikeringkan
dari pelarutnya.
Eluat yang telah kering dari pelarut atau eluen kemudian ditimbang
dan diuji dengan KLT. Nilai Rf yang dihasilkan dibandingkan dengan nilai
Rf dari plat KLT silika gel awal. Nilai Rf yang sama dikumpulkan
kemudian fraksi yang dihasilkan diidentifikasi dengan menggunakan IR
dan GC-MS.
E. Teknik Pengumpulan dan Analisis Data a. Pengumpulan Data
Penentuan fasa diam dan eluen dengan menggunakan KLT akan diperoleh
data berupa spot-spot hasil pemisahan untuk tiap perbandingan eluen petroleum
eter dan dietil eter dan penambahan MnO2 dalam fasa diam, yang selanjutnya
hasil pemisahan yang baik akan digunakan dalam pemisahan kromatografi kolom.
Pemisahan dengan menggunakan kolom kromatografi akan dihasilkan
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
dibandingkan dengan nilai Rf awal. Fraksi yang sama dikumpulkan dan kemudian
dilakukan identifikasi.
b. Analisis Data
a. Infrared Spectroscopy (IR)
Identifikasi dengan IR dilakukan untuk menentukan gugus fungsi dari
senyawa-senyawa yang ada dalam fraksi.
b. Gas Chromatography-Mass Spectroscopy (GC-MS)
Identifikasi dengan GC-MS digunakan untuk memperkirakan
senyawa-senyawa yang dihasilkan.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. Persiapan Sampel
Ekstrak buah kuning yang digunakan dalam penelitian ini berupa cairan
minyak berwarna cokelat kekuningan. Preparasi awal sampel adalah clean up
ekstrak buah kuning menggunakan whatman TF dengan ukuran pori 0,2 µm.
Filter ini dibuat dengan menggunakan membran PTFE (Politetrafluoroethylene)
yang spesifik untuk pemisahan senyawa organik, filtrasi pelarut non air dan ideal
digunakan pada analisis HPLC, TLC, dan GC. Metode yang digunakan untuk
clean up adalah metode injeksi. Sebanyak 1 gram ekstrak buah dilarutkan dalam
10 ml dietil eter, ekstrak kemudian diinjeksikan pada syring hingga diperoleh
ekstrak encer. Ekstrak dibiarkan agar pelarut menguap hingga diperoleh ekstrak
pekat kembali.
Tujuan utama clean up adalah membersihkan pengotor dan
matriks-matriks lain dalam ekstrak buah kuning yang dapat mengganggu pemisahan.
Ekstrak awal berwarna cokelat kekuningan dan setelah dilakukan clen up
diperoleh ekstrak berwarna kuning pekat. Hal ini mengindikasikan bahwa ekstrak
telah bersih dari pengotor dan matriks-matriks lain yang dapat menggangu
pemisahan seperti senyawa tanin dan selulosa.
B. Penentuan Fasa Gerak dan Fasa Diam
Pemisahan trigliserida dalam ekstrak buah kuning diawali dengan
penentuan komposisi fasa diam dan fasa gerak yang akan digunakan. Penentuan
ini dilakukan dengan menggunakan Kromatografi Lapis Tipis (KLT). Fasa gerak
yang akan digunakan dalam kromatografi kolom ditentukan dengan menggunakan
plat TLC silica gel 60 F254. Trigliserida dan β-karoten merupakan senyawa
non-polar yang saling bercampur satu sama lain. Kedua senyawa tersebut dapat larut
dalam eluen petroleum eter dan dietil eter sehingga digunakan larutan
pengembang PE dan dietil eter. Perbandingan larutan pengembang yang
digunakan adalah 19:1, 9:1, 7:3, 1:1. Harga rf dari spot yang dihasilkan terlihat
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
pada tabel 4. Perbandingan yang digunakan adalah perbandingan fasa gerak yang
memberikan spot terbanyak dengan harga rf yang tinggi.
Tabel 4. Harga Rf dari spot hasil pemisahan ekstrak buah kuning (gambar
plat terlampir pada lampiran 2)
** lama-kelamaan menjadi pudar kemungkinan karena β-karoten
teroksidasi
Hasil terbaik diperoleh pada perbandingan 1:1 dimana dihasilkan satu spot
berwarna kuning dengan harga rf sebesar 0,8. Untuk perbandingan fasa gerak
yang lebih non polar yaitu pada perbandingan 19:1 dan 9:1 dihasilkan spot yang
tailing dan harga rf rendah, ketika kepolaran dinaikkan dihasilkan satu spot
tunggal dengan harga rf yang relatif rendah sehingga perlu dinaikkan lagi
kepolarannya hingga dihasilkan spot yang tidak tailing dan nilai rf tinggi. Adanya
satu spot mengindikasikan bahwa ekstrak kurang dapat terpisah dengan fasa diam
silika gel saja. Untuk hasil pemisahan yang lebih baik adalah dengan
pencampuran fasa diam antara silika gel dengan alumina. Alumina merupakan
adsorben kuat sehingga interaksinya mengikat solut juga lebih kuat dibanding
silika. Hal ini mengakibatkan senyawa-senyawa dalam ekstrak buah kuning yang
bersifat polar akan semakin tertahan didalam fasa diam sedangkan senyawa non
polar akan terelusi lebih cepat. Alumina yang digunakan adalah alumina yang
teraktifasi basa. Sifat basa pada alumina dapat menyebabkan reaksi saponifikasi
pada trigliserida yang akan berpengaruh pada hasil pemisahan.
Penentuan perbandingan yang digunakan antara silika gel dengan alumina
berdasarkan pada acuan penelitian sebelumnya bahwa asam lemak dan β-karoten
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
(Handayani; Rumanthi, 2008). Diduga terjadi hal yang sama untuk pemisahan
ekstrak buah kuning. Pada perbandingan ini dihasilkan 2 spot dengan harga rf
pada tabel 4. Spot pertama berwarna kuning, namun agak memudar jika dibiarkan
terlalu lama. Spot kedua tidak berwarna dan akan tampak apabila disemprot
dengan rhodamin B dan dilihat menggunakan lampu UV. Rhodamin B adalah
reagen yang digunakan untuk untuk menguji adanya trigliserida dan asam lemak
(Jork,1990). Adanya spot kedua mengindikasikan bahwa asam lemak bebas pada
ekstrak buah kuning telah terpisah dari trigliseridanya.
Kombinasi fasa diam antara silika dengan alumina untuk mendapatkan
hasil pemisahan yang paling baik sedangkan untuk pengubahan senyawanya
dilakukan dengan penambahan MnO2. MnO2 berfungsi sebagai oksidator yang
dapat mengoksidasi trigliserida. Komposisi MnO2 yang ditambahkan adalah 3%
dan 5%. Asam lemak dalam ekstrak buah merah bereaksi dengan MnO2 dan
terpisah baik pada konsentrasi minimum MnO2 1,5% (Handayani, 2008),
sedangkan β-karoten dalam ekstrak buah merah bereaksi dengan MnO2 dan
terpisah baik pada konsentrasi minimum MnO2 5% (Rumanthi,2008). Hasil ini
dapat dijadikan pertimbangan bahwa asam lemak yang belum terpisah dari β
-karoten dalam ekstrak buah kuning akan bereaksi dengan MnO2 pada kisaran
konsentrasi >1,5 % dan <5%, sehingga konsentrasi MnO2 yang digunakan adalah
3% dan 5%.
a b
Gambar 12. Plat KLT ekstrak buah kuning dengan modifikasi Si-Al (2:3)+MnO2
(a). 3% dan (b). 5%
Pemisahan dengan komposisi MnO2 5% menghasilkan 4 spot dengan jarak