PEMISAHAN PROTEIN EKSTRAK RENNET ABOMASUM
DOMBA LOKAL DENGAN METODE
KROMATOGRAFI KOLOM GEL FILTRASI
KHOIRUN NISA’
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2011
ABSTRACT
KHOIRUN NISA’. Protein Fraction of Rennet Extracted from Abomasum of Local Sheep by Gel Filtration Column Chromatography Method. Under supervision of CHAIRUN NISA’ and ITA DJUWITA.
Protein fractination of rennet extracted from abomasal mucosa of local sheep was studied by gel filtration column chromatography method to fractinate chymosin and pepsin. Two abomasal samples of young adult local sheep aged 5-12 months were used in this study. Fundic mucosae of the abomasums were extracted into rennet and were frozen stored. Extracted rennet samples were processed to fractinate the enzymes by two steps of early fractination including salt precipitation with ammonium sulfate and dialysis using dialysis tube cut off 12 kD. Dialyzed samples were further processed using gel filtration column chromatography with sephadex G-75. Crude rennet extract, dialyzed rennet and collected fractions from chromatography were examined using milk-clotting test and SDS-PAGE to identify the existence of the enzymes. The collected fractions were also examined by spectrophotometer A280. The results showed that chymosin
and pepsin were eluted in early fractions which total protein was high. The collected fractions from this study could be used to purify chymosin and pepsin using another purification method.
Kromatografi Kolom Gel Filtrasi. Dibawah bimbingan CHAIRUN NISA’ dan ITA DJUWITA.
Pemisahan protein rennet yang diekstraksi dari abomasum domba lokal dilakukan dengan metode kromatografi kolom gel filtrasi untuk memisahkan enzim pepsin dan khimosin. Pada penelitian ini digunakan dua sampel abomasum domba lokal usia dewasa muda (5-12 bulan). Mukosa fundus dari kedua sampel abomasum diekstraksi menjadi rennet dan disimpan beku. Rennet ekstrak kasar kemudian diproses lebih lanjut untuk memisahkan kedua enzim melalui dua tahapan fraksinasi awal, yaitu presipitasi garam dengan amonium sulfat dan dialisa menggunakan kantong dialisa cut off 12 kD. Hasil dialisa rennet kemudian difraksinasi lebih lanjut menggunakan kromatografi kolom gel filtrasi dengan matriks berupa sephadex-G75. Rennet ekstrak kasar, hasil dialisa rennet, dan fraksi-fraksi hasil kromatografi dianalisa menggunakan uji aktivitas koagulasi susu dan SDS-PAGE untuk mengetahui keberadaan enzim pepsin dan khimosin. Fraksi-fraksi hasil kromatografi juga dianalisa menggunakan spektrofotometer 280 nm. Hasil dari penelitian ini menunjukkan bahwa pepsin dan khimosin terelusi pada fraksi-fraksi dimana total proteinnya tinggi. Fraksi-fraksi yang diperoleh dari penelitian ini dapat digunakan untuk purifikasi lebih lanjut enzim pepsin dan khimosin menggunakan metode purifikasi lain.
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi Pemisahan Protein Ekstrak
Rennet Abomasum Domba Lokal dengan Metode Kromatografi Kolom Gel
Filtrasi adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, Oktober 2011
Khoirun Nisa’ NIM B04063319
PEMISAHAN PROTEIN EKSTRAK RENNET ABOMASUM
DOMBA LOKAL DENGAN METODE
KROMATOGRAFI KOLOM GEL FILTRASI
KHOIRUN NISA’
B04063319
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2011
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apa pun tanpa izin IPB
Nama
: Khoirun Nisa’
NIM
: B04063319
Disetujui
Pembimbing I Pembimbing II
Dr. Drh. Chairun Nisa’, M.Si, PAVet Dr. Drh. Ita Djuwita, M.Phil, PAVet (K) NIP. 19631125 198903 2 004 NIP. 19590403 198601 2 002
Diketahui :
a.n Dekan Fakultas Kedokteran Hewan
Wakil Dekan
Dr. Nastiti Kusumorini NIP.19621205 198703 2 001
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala rahmat dan karuniaNya, sehingga penulis dapat menyelesaikan skripsi hasil penelitiannya yang berjudul “Pemisahan Protein Ekstrak Rennet Abomasum Domba Lokal dengan Metode Kromatografi Kolom Gel Filtrasi”.
Pada kesempatan ini, penulis menyampaikan terima kasih kepada :
1. Ibu Dr. drh. Chairun Nisa’, M.Si, PAVet dan ibu Dr. drh. Hj. Ita Djuwita, M.Phil, PAVet (K), selaku dosen pembimbing yang telah memberikan bimbingan dan pengarahan dalam penyelesaian skripsi hasil penelitian ini. 2. Bapak Drh. Yudi Riyadi, MSi selaku dosen pembimbing akademik atas
bimbingan dan dukungan yang diberikan selama masa studi.
3. Kedua orang tua (Bpk Umar Fanany dan Ibu Siti Fauziah) serta keluarga tercinta untuk kasih sayang, dukungan, kesabaran, perhatian, bimbingan, serta doa yang tiada henti-hentinya.
4. Dosen dan staf di bagian Anatomi, Histologi, dan Embriologi FKH IPB yang telah banyak membantu selama penelitian berlangsung.
5. Direktorat Pendidikan Tinggi (DIKTI), Departemen Pendidikan Nasional RI yang telah membiayai penelitian ini yang merupakan bagian dari penelitian Hibah Bersaing Batch XVI/2 (Tahun 2009) melalui Penelitian Program Desentralisasi IPB.
6. Karunia Maghfiroh dan Jeanne Novi Tandria yang selalu memberikan dukungan dan perhatiannya, serta bantuan dan kerja samanya.
7. Rini, Vivit R. Cumala, beserta Tim Penelitian Embriologi atas segala arahan dan bantuan yang diberikan.
8. Teman-teman FKH ’43 ”AESCULAPIUS” atas kenangan yang tidak pernah terlupakan selama tiga tahun bersama.
9. Saudara seperjuangan di DKM An Nahl serta Lembaga Dakwah di Institut Pertanian Bogor atas ukhuwah, kerja sama, pendewasaan, pengingatan, amanah, serta kepercayaan yang telah diberikan.
demi kesempurnaannya. Semoga skripsi hasil penelitian ini dapat bermanfaat bagi para pembaca yang memerlukan serta berkontribusi dalam pengembangan ilmu pengetahuan.
Bogor, Oktober 2011
RIWAYAT HIDUP
Penulis dilahirkan di Kecamatan Bangil, Kabupaten Pasuruan, Jawa Timur pada tanggal 18 Mei 1989 dan merupakan anak kesepuluh dari sepuluh bersaudara dari keluarga Umar Fanany, BA dan Siti Fauziah.
Pada tahun 2000, penulis menyelesaikan pendidikan dasar di SD Muhammadiyah 2 Bangil, kemudian melanjutkan studi di SLTP Negeri 1 Bangil dan lulus pada tahun 2003. Pada tahun yang sama penulis melanjutkan studi di SMA Negeri 1 Bangil dan lulus pada tahun 2006. Kemudian pada tahun yang sama penulis diterima di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI). Pada tahun 2007, penulis mulai belajar di Fakultas Kedokteran Hewan IPB.
Selama kuliah penulis bergabung dalam Dewan Keluarga Mushola An Nahl FKH IPB sejak periode 2007/2008 sampai periode 2009/2010. Penulis juga pernah bergabung dalam Himpunan Minat dan Profesi Hewan Kesayangan dan Satwa Akuatik Eksotik FKH IPB sejak periode 2007/2008 sampai akhir periode 2008/2009. Penulis pernah menjabat sebagai Bendahara Veterinary English Club periode 2007/2008, dan bergabung dengan Ikatan Mahasiswa Kedokteran Hewan Indonesia cabang FKH IPB pada periode 2008/2009. Penulis juga pernah mengikuti program pertukaran mahasiswa selama satu tahun pada periode 2010/2011 di Hokkaido University, Sapporo, Jepang.
DAFTAR TABEL... i
DAFTAR GAMBAR... ii
DAFTAR LAMPIRAN... iii
PENDAHULUAN Latar Belakang... 1
Tujuan... 2
Manfaat... 2
TINJAUAN PUSTAKA Struktur Lambung Domba... 3
Enzim Protease... 4
Rennet... 5
Bahan Bioaktif Rennet... 6
1. Khimosin... 6
2. Pepsin... 7
Koagulasi Susu... 8
Purifikasi Enzim... 10
Kromatografi Kolom Gel Filtrasi... 13
Analisa Protein... 15
METODE PENELITIAN Waktu dan Tempat Penelitian... 17
Bahan Penelitian... 17
Metode Penelitian... 17
1. Ekstraksi rennet... 17
2. Pemisahan protein rennet... 18
2.1. Presipitasi garam dan dialisa... 18
2.2. Kromatografi kolom gel filtrasi... 19
3. Pengujian aktivitas rennet... 19
4. Analisa protein... 19
4.1. Metode SDS-PAGE... 19
4.2. Metode spektrofotometer 280 nm... 20
HASIL DAN PEMBAHASAN Abomasum dan Rennet Ekstrak Kasar... 21
Presipitasi Garam dan Dialisa Rennet... 24
Kromatografi Kolom Gel Filrasi... 27
SIMPULAN DAN SARAN Simpulan... 32
Saran... 32
DAFTAR PUSTAKA... 33
DAFTAR TABEL
Halaman 1. Perbandingan berat abomasum serta perbandingan persentase
berat mukosa fundus terhadap berat
fundus………... 21
2. Perbandingan waktu koagulasi antara ekstrak kasar dan hasil
dialisa dari sampel rennet DM2 dan sampel rennet DM4... 23
3. Perbandingan waktu koagulasi susu fraksi-fraksi hasil purifikasi sampel rennet DM2 dan sampel rennet
ii
DAFTAR GAMBAR
Halaman 1. Lambung domba dan bagian interior abomasum... 3
2. Struktur umum misel kasein pada susu... 9
3. Pemotongan rantai κ-kasein oleh enzim khimosin... 10
4. Peralatan yang digunakan dalam kromatografi kolom gel
filtrasi... 13
5. Susunan sistem kromatografi kolom gel filtrasi... 14
6. Diagram alir ekstraksi, uji aktivitas, purifikasi, dan analisis
protein rennet... 20
7. Hasil koagulasi susu dengan ekstrak kasar (DM2 dn DM4) dan
hasil dialisa (DM2’ dan DM4’) ... 22
8. Hasil gel elektroforesis menggunakan pewarnaan silver pada
sampel rennet DM2 dan DM4... 25
9. Hasil uji koagulasi fraksi ke- 4,5,6,7, dan 8 hasil kromatografi
sampel rennet DM2 dan DM4... 28
10. Nilai absorbansi ( λ = 280 nm) pada fraksi hasil kromatografi
DAFTAR LAMPIRAN
Halaman 1. Pembuatan buffer dialisa... 39
2. Pemekatan selama proses presipitasi garam dan dialisa... 40
PENDAHULUAN
Latar Belakang
Rennet merupakan bahan bioaktif berupa enzim yang dapat menggumpalkan
protein susu dan digunakan dalam produksi dadih-dadih keju (Cheeseman 1981). Saat ini industri keju di Indonesia umumnya menggunakan rennet anak sapi impor atau rennet GMO (genetic modified organisme). Pertimbangan terkait harga, populasi sapi yang menurun, cita rasa, serta kehalalan dan keamanan pangan menjadi kendala tersendiri dalam penggunaan kedua jenis rennet tersebut terutama bagi masyarakat Indonesia yang mayoritas muslim.
Domba lokal memiliki potensi sebagai salah satu penghasil rennet, yaitu dari hasil ekstraksi mukosa abomasumnya (Nisa’ et al. 2007). Namun sayangnya, pemanfaatan abomasum domba masih belum optimal. Abomasum yang merupakan lambung kelenjar hanya dianggap sebagai limbah pemotongan hewan. Produksi rennet dari abomasum domba lokal diharapkan selain meningkatkan nilai ekonomis ternak domba juga menjadi solusi untuk meningkatkan kualitas produk olahan susu di Indonesia.
Rennet yang diekstraksi dari abomasum ruminansia mengandung khimosin
dan pepsin sebagai komponen utama. Di samping itu, dalam ekstrak rennet juga terkandung protein-protein lain yang dapat mengganggu kerja kedua enzim tersebut. Tujuan akhir berupa pemanfaatan rennet domba sebagai rennet komersial mendorong perlunya dilakukan pemisahan dan pemurnian enzim protease dalam upaya menghilangkan protein-protein pengganggu tersebut. Selain itu, dengan terpisahnya enzim khimosin dan pepsin maka dapat dibuat rennet yang mengandung kedua enzim tersebut dalam komposisi tertentu untuk pembuatan berbagai jenis keju.
Pemisahan dan pemurnian protein dapat dilakukan dengan metode kromatografi ataupun metode non-kromatografi. Pemilihan metode ini didasarkan pada beberapa karakteristik yang diketahui dari suatu molekul protein, antara lain bobot molekul, muatan, ataupun sifat hidrofobiknya (Ahmed 2005). Kromatografi merupakan suatu teknik purifikasi dimana komponen dari sampel dipisahkan berdasarkan kemampuan masing-masing komponen tersebut untuk berinteraksi
dengan fase gerak (mobile phase) dan fase diam (stationary phase) yang dilalui sampel (Shetty et al. 2006). Metode non-kromatografi antara lain dapat dilakukan dengan elektroforesis, presipitasi, dan filtrasi membran (Ahmed 2005).
Kromatografi kolom gel filtrasi merupakan teknik kromatografi yang memisahkan protein dan makromolekul biologis lain berdasarkan ukuran molekul. Matriks gel filtrasi (fase diam) merupakan gel berpori yang dikemas di dalam kolom dan dielusi dengan fase gerak yang berwujud cair. Pori-pori matriks dapat menampung molekul yang berukuran lebih kecil dan memisahkannya dari molekul yang berukuran lebih besar (Balqis 2007). Bobot molekul khimosin dan pepsin telah diketahui, yaitu 31 kD dan 34,5 kD (Suhartono 1992). Pemisahan protein ekstrak rennet dengan teknik kromatografi kolom gel filtrasi diharapkan dapat memisahkan khimosin dan pepsin yang terkandung dalam ekstrak rennet domba lokal.
Tujuan
Penelitian ini bertujuan memisahkan khimosin dan pepsin dari ekstrak
rennet domba lokal dengan metode kromatografi kolom gel filtrasi dengan diawali
presipitasi garam dan dialisa.
Manfaat
Hasil dari penelitian ini diharapkan memberikan manfaat yaitu mendapatkan
rennet domba lokal yang lebih murni sebagai alternatif pengganti rennet anak sapi
impor dan telah terjamin kehalalan, kualitas, harga, dan kontinuitasnya, serta dapat meningkatkan nilai ekonomis ternak domba lokal.
TINJAUAN PUSTAKA
Struktur Lambung Domba
Lambung domba terdiri atas empat bagian yang jelas dapat dibedakan. Tiga daerah pertama adalah rumen, retikulum, dan omasum, yang secara kolektif disebut lambung depan (proventrikulus). Lambung depan memiliki selaput lendir tanpa kelenjar dan sangat efektif dalam memecah ingesta fibrosa kasar menjadi nutrisi yang dapat diserap. Lambung keempat disebut abomasum, yang merupakan lambung kelenjar dan dianalogikan dengan lambung hewan monogastrik. Pada lambung depan terjadi proses fermentasi, pencernaan mekanik, serta penyerapan, sedangkan pada abomasum terjadi pencernaan secara enzimatis (Frappier 2006).
Gambar 1 Lambung domba terdiri atas rumen (Ru), retikulum (Re), omasum (Om), dan abomasum (Ab) (A). Bagian interior abomasum menunjukkan bagian fundus (F) yang ditandai adanya plicae spiralis (tanda panah) serta bagian pilorus (P) (B). Sumber : Modifikasi dari Putra (2009).
Abomasum memiliki tiga daerah kelenjar, yakni kardia, fundus, dan pilorus. Daerah kelenjar kardia merupakan area sempit penghasil mukus pada perbatasan esofagus dan lambung. Daerah kelenjar fundus meliputi dua pertiga dari seluruh abomasum dan ditandai dengan adanya lipatan-lipatan mukosa yang disebut dengan plicae spiralis. Pada mukosa fundus terdapat empat jenis sel yang berbeda struktur dan fungsinya, yakni sel penghasil mukus (mucous cells) yang dapat dibedakan lagi atas sel mukus epitelial (mucous epithelial cells) dan sel leher (mucous neck cells), sel utama (chief cells) yang menghasilkan prekursor enzim, sel parietal (parietal cells atau oxyntic cells) yang menghasilkan asam
A B Ru Ru Re Om Ab F P
klorida (HCl), dan sel endokrin yang menghasilkan hormon-hormon pencernaan. Daerah kelenjar pilorus yang meliputi hampir sepertiga dari seluruh abomasum berada di bagian paling kaudal. Pilorus terdiri atas sel-sel penghasil mukus dan dibatasi oleh otot sphincter yang mengatur pergerakan chyme (cairan lambung) dari lambung ke duodenum serta mencegah aliran balik dari duodenum ke lambung (Colville dan Bassert 2002, Frappier 2006).
Sel-sel mukosa abomasum khususnya daerah kelenjar fundus mensekresikan beberapa jenis enzim protease yaitu pepsin, khimosin, dan gastriksin dalam bentuk prekursor inaktif (Crabbe 2004). Enzim-enzim tersebut bersifat asam dan termasuk kedalam golongan endopeptidase. Prekursor enzim yakni pepsinogen, prokhimosin, dan progastriksin akan diubah menjadi bentuk aktif oleh asam klorida (HCl) yang diproduksi oleh sel-sel parietal pada bagian fundus (Frappier 2006). Sel-sel penghasil prokhimosin ditemukan dalam jumlah yang sangat banyak pada lambung domba usia menyusu (Trisnawati 2006), dan menurun sejalan bertambahnya usia serta dipengaruhi oleh masa sapih (Arimurti 2006, Guilloteau et al. 1983). Pada domba umur dewasa muda (5-12 bulan) telah dilaporkan terdapat sel-sel penghasil prokhimosin dalam jumlah yang masih relatif banyak (Fitriyani 2006, Nisa’ et al. 2007).
Enzim Protease
Enzim protease merupakan enzim yang bekerja memecah ikatan peptida pada protein dengan cara hidrolisis. Menurut Adams dan Nout (2001), klasifikasi enzim protease didasarkan pada beberapa hal antara lain: sumber/asal protease, aksi katalitiknya (pemecahan ikatan peptida), dan sifat alami sisi aktifnya. Berdasarkan sumbernya, terdapat enzim protease yang diperoleh dari hewan, dari tanaman, ataupun dari mikroba. Berdasarkan aksi katalitiknya, enzim protease terbagi atas endopeptidase (proteinase) dan eksopeptidase. Endopeptidase memecah ikatan peptida yang sesuai (susceptible) di sepanjang rantai polipeptida, sementara eksopeptidase menghidrolisa satu asam amino dari salah satu ujung rantai polipeptida. Endopeptidase sering digunakan dalam industri pangan, dan terkadang juga digunakan secara bersamaan dengan eksopeptidase.
5
Endopeptidase diklasifikasikan lagi menjadi empat golongan berdasarkan residu pada sisi katalitiknya yakni: protease serin, protease aspartat, protease sistein dan metalloproteinase. Protease serin bekerja maksimum pada pH basa sementara protease aspartat bekerja maksimum pada pH asam. Menurut Walsh (2004) protease serin merupakan protease yang banyak diproduksi arkhaea, bakteri, eukariota, dan virus. Protease yang termasuk dalam golongan protease serin antara lain tripsin, kimotripsin, elastase, subtilisin, dan proteinase K. Protease yang termasuk dalam golongan protease aspartat antara lain pepsin, khimosin, dan protease aspartat mikrobial. Berbeda dengan kedua golongan sebelumnya, protease sistein bekerja maksimum pada pH netral. Protease yang termasuk dalam golongan protease sistein ialah papain, bromelin, dan ficin. Metalloproteinase mengandung gugus ion pada sisi katalitiknya, dan sebagian besar bekerja maksimum pada pH netral. Protease yang termasuk dalam golongan metalloproteinase antara lain kolagenase dan termolisin. Ion kalsium menstabilkan enzim-enzim tersebut sementara agen pengkhelat (chelating agents) seperti EDTA menghambat kerjanya.
Rennet
Rennet merupakan bahan bioaktif berupa enzim yang dapat menggumpalkan
susu dan digunakan dalam produksi dadih-dadih keju (Cheeseman 1981). Khimosin dan pepsin yang merupakan enzim protease aspartat adalah komponen utama dalam rennet. Rennet yang diektraksi dari anak sapi yang masih menyusu umumnya mengandung 88-94% khimosin dan 6-12% pepsin, sementara rennet yang diekstraksi dari sapi yang lebih tua dapat mengandung 90-94% pepsin dan 6-10% khimosin (Broome dan Limsowtin 1998).
Rennet pada awalnya merupakan hasil ekstraksi kasar abomasum anak sapi. Rennet dari abomasum anak sapi ini mempunyai peran sangat penting dalam
proses pengolahan keju. Saat ini rennet juga telah diekstraksi dari berbagai macam sumber termasuk abomasum hewan ruminansia lain seperti kambing (Kumar et al. 2006, Parvin 1975), unta (Wangoh et al. 1993), kerbau (Mohanty et
al. 2003), juga lambung ikan tuna (Daulay 1995), lambung anjing laut
1995), mikroba (Winarno 1983), bahkan juga diperoleh dari mikroorganisme yang dimodifikasi secara genetik (genetic modified organism = GMO) (Cmegar dan Cruegar 1984, Teuber 1993, Winarno 1983). Berbagai ekstrak rennet dapat dibuat dengan kemampuan mengkoagulasi susu yang berbeda-beda, sehingga dadih-dadih keju yang dihasilkan juga berbeda. Hal ini sangat penting untuk mengukur kemampuan tiap ekstrak rennet dalam mengkoagulasikan susu (Scott 1986).
Rennet yang diperoleh dari berbagai spesies hewan memiliki kemampuan
mengkoagulasikan susu yang bervariasi (Daulay 1990).
Rennet mikroba diisolasi dari mikroorganisme yang secara alami
menghasilkan enzim protease yang memiliki fungsi mirip dengan rennet asal hewan. Rennet mikroba telah dicoba untuk mengganti peranan rennet dari abomasum anak sapi. Rennet mikroba yang banyak digunakan antara lain berasal dari mikroorganisme seperti kapang (Mucor pusillus, M. Miehei), fungi (Endothia
parasiticus), dan bakteri (Bacillus polymyxa, B. subtilis, B. Cereus) (Winarno
1983). Kendala yang ditemui pada penggunaan rennet mikroba yakni munculnya rasa pahit pada keju. Hal ini disebabkan terbentuknya peptida pahit akibat aktivitas proteolisis yang tinggi pada rennet mikroba (Neelakantan et al.1999).
Rennet GMO diperoleh dari mikroba yang telah disisipi gen pengkode
prokhimosin dari sel-sel penghasilnya pada abomasum anak sapi. Salah satu mikroorganisme yang banyak digunakan yakni bakteri Eschericia coli, dimana gen diekspresikan dalam bentuk badan inklusi tak terlarut (insoluble). Komponen enzim dalam rennet GMO ini tidak berbeda dengan rennet yang diekstraksi langsung dari abomasum anak sapi. Selain E.coli, mikroorganisme lain yang juga digunakan yakni kapang Saccharomyces cerevisiae juga fungi berfilamen seperti
Kluyveromyces lactis, Aspergillus nidulans, A. niger, dan Trichoderma reesei
(Neelakantan et al. 1999).
Bahan Bioaktif Rennet 1. Khimosin
Khimosin yang disebut juga dengan rennin ialah suatu enzim protease aspartat, bersifat asam dan diproduksi pada abomasum ruminansia yang masih menyusu (Kumar et al. 2006). Pada mukosa abomasum, khimosin dihasilkan
7
oleh chief cell (sel utama) dalam bentuk prekursor inaktif yang dikenal dengan prokhimosin (Atallah 2007). Menurut Suhartono (1992) khimosin memiliki berat molekul 31 kD sementara prokhimosin memiliki berat molekul yang lebih besar yakni 36 kD, sementara menurut Atallah (2007) berat molekul khimosin dan prokhimosin yaitu 35,6 kD dan 40,8 kD. Enzim khimosin stabil pada pada pH 5,3-6,3 dan mempunyai titik isoelektrik sekitar 4,5 (Suhartono 1992).
Khimosin disekresikan dalam jumlah yang maksimal selama beberapa hari pasca dilahirkan, kemudian menurun seiring dengan bertambahnya usia dan digantikan oleh pepsin. Pada usia di atas satu minggu produksi khimosin akan menurun drastis, namun pada ruminansia produksi khimosin tidak pernah bernar-benar terhenti walaupun telah memasuki usia dewasa (Fox 1993). Dalam saluran pencernaan ruminansia muda, khimosin membantu susu terserap dengan mengkoagulasinya sehingga susu tidak langsung mengalir dan terbuang melalui saluran ekskresi. Khimosin mengkoagulasi susu dengan memotong ikatan peptida secara spesifik antara asam amino Phenilalanin (Phe) 105 dan Metionin (Met) 106 pada rantai kappa kasein (ĸ-kasein), sehingga segmen C-terminal hidrofilik (kasein makro peptida = CMP) terlepas menyisakan para kappa kasein (Kumar et al. 2006; Jiang et al. 2007). Hal ini kemudian menyebabkan misel kasein menjadi tidak stabil dan menggumpal. Koagulasi misel kasein juga dipengaruhi oleh konsentrasi ion kalsium (Ca2+) yang berperan sebagai jembatan antar misel kasein. Menurut Fox (1993) ikatan peptida Phe-Met akan terhidrolisa secara optimum pada pH 5,1-5,5.
Aktivitas khimosin menurun sangat cepat pada pH 3-4 diduga akibat auto degradasi, sementara penurunan aktivitas khimosin pada pH basa diduga akibat perubahan konformasi yang ireversibel. Khimosin lebih stabil pada suhu 2°C dibandingkan pada suhu kamar. Aktivitas khimosin juga menurun pada peningkatan suhu dari 44°C ke 45°C (Crabbe 2004).
2. Pepsin
Berdasarkan Harrow dan Mazur (1958), pepsin merupakan enzim protease yang dihasilkan di mukosa lambung dalam bentuk prekursornya yaitu pepsinogen. Perubahan dari bentuk pepsinogen menjadi pepsin disebabkan
suasana asam dalam lambung. Perubahan ini diikuti lepasnya salah satu asam amino dalam bentuk peptida. Dengan demikian bobot molekul pepsinogen sebesar 42,5 kD akan menurun menjadi 34,5 kD ketika menjadi pepsin. Pepsin memecah substratnya dengan menghidrolisa ikatan peptida C-terminal beberapa jenis asam amino aromatik seperti phenilalanin, tiroksin dan triptofan (Kimball 1992, St. Edward’s Univ. 2005).Pepsin stabil pada pH 5,0-5,5 (Suhartono 1992), sementara titik isoelektrik pepsin yaitu 2,85 (Harrow dan Mazur 1958).
Pepsin merupakan protease yang paling umum digunakan sebagai pengganti khimosin dalam pembuatan keju, tetapi pepsin tidak digunakan sendiri. Campuran khimosin dan pepsin dianggap paling optimum dan paling sering dipilih. Beberapa faktor yang mencegah penggunaan pepsin sendirian adalah waktu penggumpalan yang lama, gumpalan yang lunak, kehilangan lemak dalam whey, terbentuk peptida pahit, tekstur dan konsistensi keju yang lebih lunak, serta ketidakmampuan untuk aktif pada pH 6,5 (Kilara dan Iya 1984).
Pepsin merupakan enzim proteolitik alami yang terdapat dalam rennet sapi muda. Enzim ini juga terdapat dalam cairan lambung hewan dewasa. Pada hewan muda kandungan pepsin belum banyak. Seiring bertambahnya umur, maka kandungan pepsin semakin bertambah menggantikan khimosin. Rasio antara aktivitas penggumpalan dan aktivitas proteolitik dari pepsin yang dihasilkan oleh berbagai jenis hewan bervariasi (Daulay 1990).
Koagulasi Susu
Koagulasi susu adalah proses perubahan bentuk dari susu cair menjadi padatan berbetuk gel. Koagulasi terjadi karena adanya penggumpalan dari kasein yang merupakan kandungan protein terbesar dalam susu yakni sekitar 80%. Dalam susu terdapat empat tipe kasein yaitu αs1-kasein, αs2-kasein, β-kasein, dan
κ-kasein (CN) dengan perbadingan jumlah 4:1:4:1 yang seluruhnya tergabung
bersama koloid kalsium fosfat (CCP) membentuk misel kasein. Gumpalan kasein berbentuk gel yang terbentuk pada proses koagulasi susu disebut curd atau dadih.
Curd juga mengandung lemak, bakteri, air dan bahan-bahan yang terlarut dalam
9
Gambar 2 Struktur umum misel kasein pada susu. Sumber: Goff (1995).
Pembentukan curd pada proses pembuatan keju, menurut Johnson (1984), dapat terjadi melalui dua cara, yaitu koagulasi secara enzimatis dan koagulasi asam. Koagulasi menggunakan asam dapat dilakukan dengan cara menambahkan asam (biasanya asam laktat) secara langsung ke dalam susu, atau dengan penambahan bakteri asam laktat seperti Lactococcus spp. dan Leuconostoc spp. yang akan memfermentasikan laktosa menjadi asam laktat. Netralisasi muatan negatif dari kasein oleh ion H+ dari asam laktat akan menyebabkan tercapainya pH isoelektrik kasein, yaitu pH 4,6, yang mengakibatkan kasein terkoagulasi. Penggumpalan akan sempurna bila semua muatan kasein menjadi netral.
Agregasi kasein pada susu normal dicegah oleh adanya kasein makro peptida hidrofilik (disebut juga “rambut-rambut”) pada misel kasein, serta muatan negatif dari misel yang mencegah misel saling berdekatan. Koagulasi enzimatis merupakan proses yang ditujukan untuk memecah ikatan pembatas misel kasein, sehingga misel kasein dapat beragregasi (Hill 2006).
Koagulasi susu secara enzimatis terbagi kedalam tiga tahapan. Tahap pertama merupakan tahap awal penggumpalan, molekul kasein terpecah untuk mempercepat agregasi misel kasein. Tahap kedua merupakan tahap agregasi, misel kasein memerangkap air untuk membentuk struktur tiga dimensi yang memicu terbentuknya gel. Ion kalsium pada tahapan kedua saling berinteraksi dengan misel kasein sehingga mempercepat pembentukan struktur gel dan mempercepat waktu koagulasi susu. Tahapan ketiga, merupakan tahapan terakhir, yaitu pada tahapan ini kasein telah selesai teragregasi dan membentuk curd (Hill
2006). Koagulasi susu secara enzimatis sangat bergantung pada suhu, pH dan konsentrasi kalsium. Koagulasi susu biasanya tidak akan terjadi pada suhu dibawah 15 °C, dan sensitif pada perubahan pH terutama pada selang 6,5- 7,0 (Shalabi dan Fox 1981, Dalgleish 1999).
Gambar 3 Pemotongan rantai κ-kasein oleh enzim khimosin. Sumber: University of Reading.
Khimosin merupakan koagulan yang telah lama digunakan dalam industri keju dan tampaknya merupakan enzim tertua yang dikenal dalam aplikasi pembuatan keju. Sejarah menggambarkan bahwa khimosin didapat dengan mengekstraknya dari abomasum ruminansia. Khimosin bekerja menghidrolisa ikatan peptida Phe 105-Met 106 pada rantai κ-kasein, pecahnya ikatan tersebut akan menyebabkan susu menggumpal (Johnson dan Law 1999). Mekanisme pemotongan rantai κ-kasein oleh enzim khimosin dapat dilihat pada Gambar 3.
Purifikasi Enzim
Berdasarkan Ahmed (2005) purifikasi protein merupakan suatu langkah awal yang penting untuk mendapatkan komponen biologis suatu protein dalam upaya memahami fungsi biologisnya. Ada beberapa faktor yang harus diketahui sebelum melakukan purifikasi protein ataupun memisahkan suatu protein tunggal dari suatu campuran protein antara lain berat molekul, muatan, serta sifat hidrofobiknya. Berdasarkan faktor-faktor tersebut metode dalam purifikasi protein terbagi menjadi dua yakni metode kromatografi dan non-kromatografi. Metode non-kromatografi dalam hal ini antara lain elektroforesis, presipitasi, serta filtrasi membran.
11
Dalam melakukan purifikasi protein, sangat penting untuk menggunakan metode yang tidak menyebabkan terjadinya denaturasi protein khususnya protein yang menjadi target. Disamping itu, ada beberapa faktor lain yang juga harus diperhatikan dalam memilih suatu metode untuk purifikasi yakni bagaimana protein hasil purifikasi akan digunakan nantinya, jumlah protein terpurifikasi yang dibutuhkan, serta biaya dalam penyediaan pereaksi (reagent) dan material yang dibutuhkan untuk metode purifikasi tersebut. Sebagai contoh, suatu metode purifikasi yang dapat menyebabkan terjadinya denaturasi protein tidak dapat digunakan bila tujuan purifikasi ialah untuk mempelajari fungsi biologisnya namun masih bisa menjadi pilihan bila hanya ingin mengetahui struktur primer ataupun ukuran subunitnya. Metode purifikasi protein yang digunakan untuk mendapatkan protein terpurifikasi dalam jumlah mikro mungkin berbeda dengan metode yang digunakan untuk mendapatkan jumlah yang lebih banyak (Ahmed 2005).
Purifikasi akan memisahkan suatu ekstrak kasar protein menjadi beberapa fraksi yang kemudian dideteksi aktivitas dan jumlah kandungannya. Keberhasilan purifikasi protein ditentukan oleh tingginya aktivitas spesifik (specific activity) dan lipatan purifikasi (purification-fold) dari fraksi yang dihasilkan. Specific
activity diartikan sebagai total aktivitas per miligram protein per mililiter fraksi,
sementara purification-fold yaitu rasio antara specific activity dari sebuah fraksi dengan aktivitas total (total activity) dari ekstrak kasar tersebut (Ahmed 2005).
Teknik yang digunakan untuk purifikasi enzim tentunya sama dengan purifikasi protein pada umumnya. Selain diketahuinya komponen biologis dari suatu enzim, melalui purifikasi enzim juga akan diperoleh derajat purifikasi suatu enzim yang dapat digunakan dalam estimasi nilai kuantitatif dari aktivitas enzim. Faktor-faktor yang dijadikan dasar dalam purifikasi enzim juga sama dengan purifikasi protein yaitu homogenitas selama sedimentasi, elektroforesis dan kelarutan (Harrow dan Mazur 1958).
Dalam melakukan purifikasi enzim, satu atau lebih metode bisa diterapkan. Enzim bisa dipresipitasi terlebih dahulu dengan beberapa presipitan yang cocok seperti amonium sulfat, kemudian dilakukan dialisa untuk menghilangkan kelebihan amonium sulfat dan molekul pengganggu lainnya. Menurut Bollag dan
Edelstein (1991) ketika suatu larutan protein ditambah dengan garam dalam konsentrasi tinggi, protein akan terpisah dan terpresipitasi dari pelarutnya. Kondisi ini disebut dengan salting out. Pada keadaan salting out, ion-ion garam akan berikatan dengan molekul air sehingga menyebabkan penarikan selubung air yang mengelilingi permukaan protein dan mengakibatkan protein saling berinteraksi, beragregasi, dan kemudian mengendap. Amonium sulfat merupakan garam yang seringkali menjadi pilihan karena garam ini efektif dalam proses salting out, memiliki daya larut tinggi, menghasilkan panas pada tingkat yang rendah, dan relatif murah (Scopes 1994). Konsentrasi garam yang ditambahkan ke dalam suatu larutan protein mempengaruhi jumlah protein yang terpresipitasi. Kelarutan protein (pada pH dan temperatur tertentu) meningkat pada kenaikan konsentrasi garam (salting in), sehingga protein akan terlarut kembali (Harris 1989, diacu dalam Balqis 2007).
Dialisa merupakan proses difusi suatu zat terlarut melalui membran selektif permeabel dengan melawan gradien konsentrasi untuk mencapai titik keseimbangan. Gradien tersebut dibentuk dari perbedaan konsentrasi buffer pelarut dan buffer pendialisa (dialysate buffer). Dialisa dilakukan pada proses purifikasi dengan menggunakan kantong berpori yang disesuaikan dengan ukuran molekul target. Molekul yang berukuran lebih kecil dari pori-pori kantong dialisa dapat berpidah melewati membran, sementara molekul yang berukuran lebih besar akan tertahan pada satu sisi. Dengan mengganti buffer pendialisa yang berada di sisi luar kantong dialisa, molekul yang berukuran lebih kecil akan tertarik keluar secara terus-menerus hingga molekul target di dalam kantong dapat terpurifikasi. Dialisa paling efektif dilakukan dengan beberapa kali penggantian buffer pendialisa dalam satu hari perlakuan yang selanjutnya dibiarkan satu malam dalam sebuah piringan berputar. Protokol standar untuk dialisa yakni dilakukan selama 16-24 jam. Banyak faktor yang mempengaruhi keberhasilan dialisa, antara lain koefisiensi difusi, pH, suhu, waktu, konsentrasi molekul target, volume sampel, volume buffer pendialisa, seberapa sering penggantian buffer pendialisa dilakukan, luas permukan dan ketebalan kantong dialisa, muatan molekul, serta agitasi (stirring) (Spectrumlabs 2008).
13
Kromatografi Kolom Gel Filtrasi
Kromatografi merupakan suatu teknik purifikasi dimana komponen dari sampel dipisahkan berdasarkan kemampuan masing-masing komponen tersebut untuk berinteraksi dengan fase gerak (mobile phase) dan fase diam (stationary
phase) yang dilalui sampel. Walaupun saat ini telah tersedia berbagai tipe
kromatografi, pada dasarnya semua memiliki prinsip pemisahan yang sama (Shetty et al. 2006).
Berdasarkan Ahmed (2005) fase diam dapat berbentuk padat, gel, cair atau campuran padat dan cair, sementara fase gerak dapat berbentuk cair atau gas dan mengalir melewati fase diam. Semua metode kromatografi bekerja dengan dasar keseimbangan yang dicapai antara fase diam dan fase gerak. Sebagian besar metode kromatografi membutuhkan beberapa peralatan yang sama termasuk penampung buffer (buffer reservoir), tabung, pompa peristaltik (peristaltic pump), kolom, detektor ultraviolet (UV detector), pencatat grafik (chart recorder), dan pengumpul fraksi hasil purifikasi (fraction collector). Susunan sistem kromatografi yang lengkap dan bersifat otomatis dapat dilihat pada Gambar 5.
Gambar 4 Peralatan yang digunakan dalam kromatografi kolom gel filtrasi. Fraction collector (A), Kolom (B). Sumber : Atlantic lab equipment (2011), Biostad (2011).
Balqis (2007) menyebutkan bahwa pemurnian enzim protease yang biasa dilakukan adalah dengan menggunakan kromatografi kolom. Kromatografi kolom merupakan salah satu teknik kromatografi yang paling dasar dan paling umum digunakan (Shetty et al. 2006). Pada kromatografi ini digunakan sebuah tabung kaca atau plastik yang diisi dengan campuran fase gerak yang berbentuk cair dan fase diam yang berbentuk padat. Larutan sampel dituangkan di atas campuran fase diam dan fase gerak dalam tabung vertikal, dan dibiarkan mengalir melalui kedua fase di bawah pengaruh gaya gravitasi ataupun dengan tekanan dari pompa peristaltik yang dihubungkan pada tabung.
Pada kromatografi kolom, fase diam merupakan materi adsorban yang memiliki ukuran pori yang beragam (mesh size) dan memungkinkan lewatnya larutan sampel. Mesh size rendah yakni sekitar 20-50 mengandung lebih sedikit molekul per inchi persegi sehingga aliran sampel lebih cepat. Sementara mesh size yang tinggi (200-400) mengandung lebih banyak molekul per inchi perseginya sehingga aliran sampel lebih lambat dan sering digunakan dalam pemisahan larutan murni beresolusi tinggi (Shetty et al. 2006).
Gambar 5 Susunan sistem kromatografi kolom gel filtrasi. Bagian-bagian kolom yang digunakan pada gel filtrasi (A), Sistem kromatografi yang lengkap dan otomatis (B). Sumber: Hagel 1998.
Ada beberapa metode kromatografi kolom, diantaranya adalah kromatografi filtrasi gel dan kromatografi penukar ion (ion exchange). Kromatografi filtrasi gel merupakan teknik pemisahan protein dan makromolekul biologis lain berdasarkan ukuran molekul. Matriks gel filtrasi (fase diam) merupakan gel berpori yang dikemas di dalam kolom dan dielusi dengan fase gerak yang berwujud cair. Pori-pori matriks dapat menampung molekul yang berukuran lebih kecil dan
B A
15
memisahkannya dari molekul yang berukuran lebih besar. Kromatografi gel filtrasi dapat pula digunakan untuk estimasi berat molekul. Kromatografi penukar ion memanfaatkan perbedaan afinitas antara molekul bermuatan di dalam larutan dengan senyawa yang tidak reaktif yang bermuatan berlawanan sebagai pengisi kolom. Permukaan protein terdiri dari muatan positif dan negatif tergantung dari rantai samping asam amino asam dan basa (Balqis 2007). Ada dua jenis kromatografi penukar ion, yaitu anion-exchange chromatography dan
cation-exchange chromatography. Pada umumnya anion-cation-exchange chromatography
digunakan dalam purifikasi protein yang bersifat asam, sementara
cation-exchange chromatography digunakan dalam purifikasi protein yang bersifat basa
(Ahmed 2005).
Menurut Hagel (1998) kromatografi kolom gel filtrasi seringkali digunakan sebagai langkah awal sebelum dilakukan purifikasi lebih lanjut terhadap sampel dengan teknik adsorptif. Selain itu, gel filtrasi juga digunakan pada tahap akhir purifikasi untuk menghilangkan kontaminan yang masih tersisa yang kemungkinan memiliki muatan sama dengan protein target.
Analisa Protein
Analisa kimia protein terdiri atas analisa proksimat dan analisa ultimat. Menurut Winarno (1997) analisa proksimat dilakukan secara kuantitatif ataupun kualitatif. Metode Kjeldahl dan Dumas merupakan contoh analisa proksimat kuantitatif untuk menganalisa kadar protein kasar dengan dasar pengukuran kadar nitrogennya. Sementara analisa ultimat dilakukan dengan dasar pengukuran asam amino yang terkandung di dalam suatu larutan protein (Somaatmadja 1975). Beberapa cara analisa asam amino, antara lain dengan cara kromatografi kolom,
High Performance Liquid Chromatography (HPLC), mikrobiologis, dan
spektrofotometrik (Winarno 1997).
Pada metode spektrofotometrik, panjang gelombang ( λ ) yang digunakan yaitu 280 nm. Hal ini karena kandungan asam-asam amino karboksilat, terutama tirosin, serta sebagian besar protein-protein mempunyai absorbsi maksimum pada panjang gelombang tersebut. Pengukuran absorbsi pada panjang gelombang 280 nm dianggap merupakan suatu cara yang cepat, mudah, dan tidak destruktif untuk menentukan kadar protein dalam suatu larutan karena untuk beberapa protein kadar asam amino tirosin menunjukkan kadar protein (Winarno 1997).
Menurut Winarno et al. (1973) analisa asam amino bisa juga dilakukan dengan cara elektrofresis. Elektrofresis adalah suatu cara untuk memisahkan fraksi-fraksi dari suatu zat berdasarkan atas pergerakan partikel koloid yang bermuatan, di bawah pengaruh medan listrik. Berdasarkan Ahmed (2005) pada elektroforesis, protein dipisahkan berdasarkan muatan dan berat molekulnya. Suatu sampel protein dilewatkan pada suatu media berpori, antara lain berupa kertas, selulosa, asetat, ataupun gel yang terbuat dari pati, agarose, ataupun gel poliakrilamida. Gel poliakrilamida merupakan media yang paling umum digunakan pada pemisahan protein karena aplikasinya yang mudah. Gel ini terbentuk oleh adanya polimerisasi dari monomer akrilamida serta ikatan silang dengan komponen N,N’-metilen bisakrilamid. Polimerisasi ini diawali dengan adanya reaksi antara ammonium persulfat sebagai katalis dan N,N,N’,N’-tetrametilendiamin (TEMED).
Pada metode SDS-PAGE (sodium dodecyl sulphate polyacrylamide gel
electrophoresis), protein yang dipisahkan dengan elektroforesis mengalami
denaturasi akibat penambahan SDS. SDS merupakan deterjen anionik yang dapat melapisi permukaan protein dan membentuk jaring muatan negatif akibat adanya sulfat pada molekul SDS. Dengan demikian, rasio muatan per bobot molekul setiap fraksi protein sama sehingga sampel protein hanya dipisahkan berdasarkan bobot molekulnya saja. Fraksi protein yang memiliki bobot molekul lebih kecil akan bergerak lebih cepat melewati gel, sementara fraksi protein dengan bobot molekul lebih besar akan bergerak lebih lamban. SDS-PAGE dapat digunakan untuk menganalisa kemurnian protein, menentukan bobot molekul, memonitor purifikasi protein, menentukan konsentrasi protein, mendeteksi reaksi proteolisis, mendeteksi modifikasi protein, dan mengidentifikasi protein terimunopresipitasi (Ahmed 2005).
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilakukan mulai bulan Juni 2009-Juli 2010 di Laboratorium Riset Anatomi, Departemen Anatomi Fisiologi dan Farmakologi Fakultas Kedokteran Hewan Institut Pertanian Bogor, Laboratorium Pendidikan dan Layanan Terpadu Fakultas Kedokteran Hewan Institut Pertanian Bogor, dan Laboraturium Pusat Antar Universitas Institut Pertanian Bogor. Adapun pengambilan sampel dilakukan di Tempat Pemotongan Hewan (TPH) Perumahan Sindang Sari RT 04/RW 07 Ciampea, Bogor.
Bahan penelitian
Pada penelitian ini digunakan dua sampel abomasum domba lokal dewasa muda (DM) usia 5-12 bulan yang masing-masing diberi kode DM1 dan DM2. Pemberian kode diurutkan dari abomasum dengan berat terkecil. Kedua sampel diekstraksi menjadi rennet dan disimpan beku.
Metode Penelitian
1. Ektraksi rennet
Sampel abomasum yang diambil langsung di TPH. Sebelum disembelih domba diperiksa status kesehatannya dan ditentukan kisaran umurnya berdasarkan susunan gigi geliginya. Sesampai di laboratorium, abomasum disayat pada daerah kurvatura mayor untuk dikeluarkan kotoran yang ada di dalamnya dan dicuci dengan NaCl fisiologis. Meja yang akan digunakan diusahakan steril dengan cara didesinfeksi dan dinyalakan bunsen. Abomasum yang telah bersih ditimbang, selanjutnya bagian fundus dan pilorus dipisahkan dan masing-masing ditimbang kembali. Mukosa bagian fundus dikelupas secara manual, ditimbang kembali dan diekstraksi.
Proses ekstraksi yang digunakan adalah modifikasi metode Qadri et al. (1962) oleh Nisa’ et al. (2007). Mukosa fundus yang diperoleh dicincang menggunakan gunting dan ditambahkan asam asetat 10% dengan perbandingan 1:2 (mukosa : asam asetat). Untuk mempercepat proses
ekstraksi, campuran tersebut dihomogenkan menggunakan blender sebanyak lima kali (5x) @ satu menit dengan selang waktu 30 detik. Di sekitar tabung blender diberikan es batu untuk menjaga agar suhu tidak terlalu tinggi. Campuran yang telah diblender kemudian dibagi ke dalam beberapa tabung untuk disentrifugasi. Tiap tabung harus mempunyai tinggi yang sama, serta diberi label agar tidak tertukar. Sentrifugasi dilakukan dengan kecepatan 11.000 g pada suhu 4 0C selama 20 menit. Supernatan dipisahkan dari endapan dengan cara mengambil supernatan pada tabung sentrifus menggunakan mikro pipet. Hasil ekstraksi tersebut kemudian dinetralisasi menggunakan NaOH 1N sampai pH 5,4 (Putra 2009). Selanjutnya dilakukan pengujian aktivitas koagulasi susu.
2. Pemisahan protein rennet
2.1. Presipitasi garam dan dialisa
Rennet ekstrak kasar yang sudah dinetralisasi sebanyak 45 ml
dipresipitasi garam dengan 70% (persen saturasi) (Encorbio 2010) atau 45% (b/v) amonium sulfat pada suhu 4ºC untuk memisahkan enzim dengan pelarutnya. Filtrat protease dipisahkan dengan sentrifugasi 12.000 g selama 40 menit pada suhu 4ºC, lalu dilarutkan kembali dengan 4 ml buffer asetat 10 mM pH 5,4 menggunakan vortex mixer. Pembuatan buffer asetat dapat dilihat pada Lampiran 1.
Amonium sulfat yang ada dalam enzim selanjutnya dipisahkan dengan cara dialisa. Kantong dialisa (cut-off 12 kD) dipotong sepanjang 12 cm dan dicuci dengan metode Bollag dan Edelstein (1991) yang telah dimodifikasi: kantong dialisa direbus dalam campuran yang mengandung NaHCO3 2% dan 1 mM EDTA selama 10 menit. Selanjutnya kantong
dialisa direbus lagi dalam aquades selama 10 menit, dan dilakukan sebanyak dua kali. Kemudian ditunggu hingga dingin. Salah satu ujung kantong diikat dengan benang jahit, lalu 4 ml filtrat enzim dimasukkan dan ujung yang lain dijepit. Kantong dimasukkan dalam larutan buffer asetat 20 mM pH 5,4 dengan volume 100 kali volume filtrat dan di stirrer secara perlahan pada suhu ruang selama 16 jam. Buffer di luar kantong dialisa (dialysate buffer) diganti sebanyak tiga kali pada dua jam pertama, kedua dan ketiga (Spectrumlabs 2008).
19
2.2. Kromatografi kolom gel filtrasi
Hasil dialisa selanjutnya difraksinasi lebih lanjut dengan kromatografi kolom gel filtrasi. Fase diam yang digunakan yaitu gel berpori sephadex G-75 yang memiliki kisaran BM 3 - 80 kD (Pharmacia). Hasil dialisa rennet sebanyak 1,5 mL dimasukkan ke dalam kolom yang sudah diisi dengan sephadex, kemudian fraction colector (Pharmacia) mulai dioperasikan. Buffer pengelusi yang digunakan sebagai fase gerak ialah buffer asetat 10 mM pH 5,4. Ukuran fraksi yang digunakan sebesar 3 ml (100 tetes) per tabung.
3. Pengujian aktivitas rennet
Uji aktivitas rennet terhadap koagulasi susu dilakukan dengan menggunakan metode Scott (1986). Uji ini dilakukan pada ekstrak kasar
rennet yang sudah dinetralisasi, hasil dialisa rennet, dan fraksi hasil
kromatografi rennet untuk membuktikan keberadaan khimosin dan pepsin. Konsentrasi rennet yang digunakan adalah 4% (v/v) untuk ekstrak kasar, 1% (v/v) untuk hasil dialisa, dan 10% (v/v) untuk fraksi hasil kromatografi (Kumar et al. 2006). Uji koagulasi dilakukan menggunakan susu pasteurisasi dan dilakukan pada suhu 35-40ºC. Waktu yang dibutuhkan hingga koagulasi sempurna dihitung dengan pengukur waktu (stopwatch). Koagulasi sempurna ditandai dengan meningkatnya viskositas susu membentuk curd yang terpisah dari whey.
4. Analisa protein
4.1. Metode SDS-PAGE
Kualitas protein dari enzim yang terdapat pada ekstrak kasar, hasil dialisa, serta fraksi hasil kromatografi yang menunjukkan aktivitas koagulasi dianalisa menggunakan metode Sodium Dodecyl
Sulphate-Polyacrilamide Gel Electrophoresis (SDS-PAGE) (BioRad). Intensitas
warna yang tinggi pada pita mengindikasikan kualitas dan kuantitas protein yang tinggi, sedangkan warna terang mengindikasikan kualitas dan kuantitas protein yang rendah. Pita protein baru terlihat setelah diwarnai dengan pewarnaan silver. Keterangan lebih lengkap mengenai persiapan running SDS-PAGE, proses running, hingga proses pewarnaan
4.2. Metode spektrofotometer 280 nm
Nilai absorbansi dari masing-masing fraksi hasil purifikasi diukur menggunakan spektrofotometer (CE 292 Digital UV Spectrofotometer
Cecil Series 2) pada panjang gelombang (λ) 280 nm. Total protein dan
nilai absorbansi memiliki hubungan yang linear (Caprette 1995).
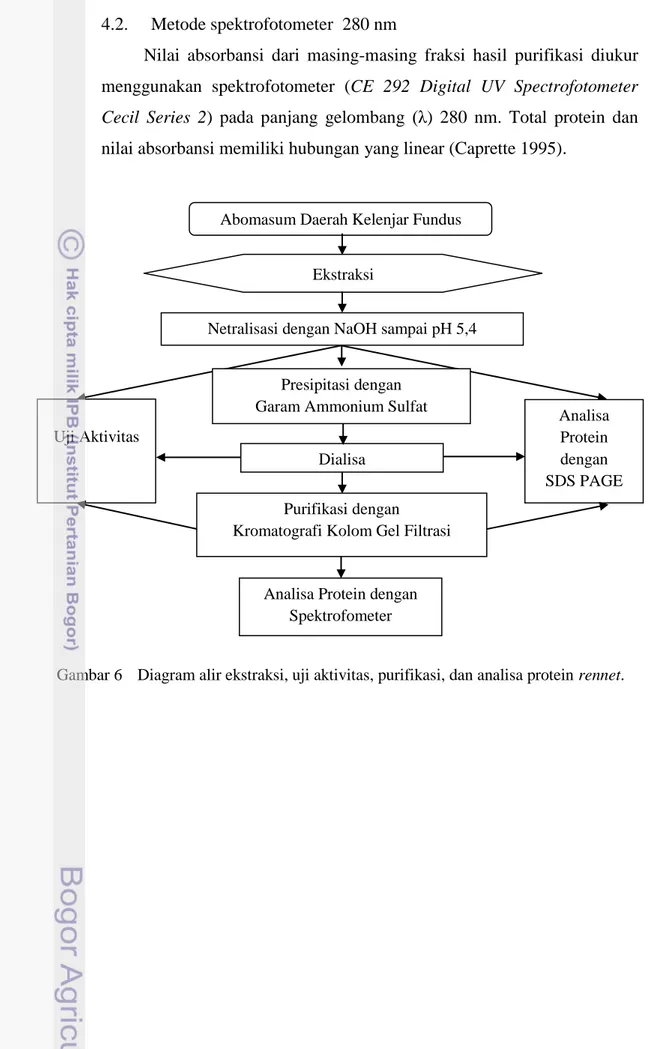
Gambar 6 Diagram alir ekstraksi, uji aktivitas, purifikasi, dan analisa protein rennet. Abomasum Daerah Kelenjar Fundus
Ekstraksi
Netralisasi dengan NaOH sampai pH 5,4
Presipitasi dengan Garam Ammonium Sulfat Uji Aktivitas Analisa Protein dengan SDS PAGE Dialisa Purifikasi dengan Kromatografi Kolom Gel Filtrasi
Analisa Protein dengan Spektrofometer
HASIL DAN PEMBAHASAN
Abomasum dan Rennet Ekstrak Kasar
Hasil penimbangan menunjukkan berat abomasum, fundus, serta mukosa fundus dari kedua sampel bervariasi (Tabel 1). Salah satu faktor yang berpengaruh dalam hal ini adalah umur domba. Semakin bertambah umur domba, maka berat abomasumnya akan semakin meningkat. Menurut Ruckebush et al. (1983), proporsi ukuran dan kapasitas masing-masing ruangan lambung ruminansia berubah sesuai dengan perubahan umur hewan.
Tabel 1 Perbandingan berat abomasum serta perbandingan persentase berat mukosa fundus terhadap berat fundus
Sampel
Berat (g)
Persentase* (%)
Abomasum Fundus Mukosa
Fundus
DM1 68,65 47,26 39,02 82,56
DM2 94,66 65,47 56,23 85,89
Rata-Rata± St. Dev 81,66±13,01 56,37±9,11 47,63±8,60 84,23±1,67
*) Persentase berat mukosa fundus terhadap berat fundus
Uji koagulasi rennet terhadap susu dari sampel ekstrak kasar DM1 dan DM2 menghasilkan curd yang kompak dan padat (Gambar 7). Enzim utama dalam
rennet yang berperan dalam mengkoagulasikan susu membentuk curd yang padat
serta whey adalah khimosin. Khimosin mengkoagulasikan susu dengan memotong ikatan peptida secara spesifik antara asam amino Phenilalanin (Phe) 105 dan Metionin (Met) 106 pada rantai kappa kasein (ĸ-kasein), sehingga segmen C-terminal hidrofilik (kasein makro peptida = CMP) terlepas menyisakan para kappa kasein (Kumar et al. 2006; Jiang et al. 2007). Hal ini kemudian menyebabkan misel kasein menjadi tidak stabil dan menggumpal. Koagulasi misel kasein juga dipengaruhi oleh konsentrasi ion kalsium (Ca2+) yang berperan sebagai jembatan antar misel kasein. Menurut Fox (1993) ikatan peptida Phe-Met akan terhidrolisa secara optimum pada pH 5,1-5,5.
Pepsin dan khimosin sama-sama dapat mengkoagulasikan susu, namun pepsin tidak bekerja secara spesifik pada rantai ĸ-kasein (Ash 1964). Berbeda dengan khimosin, pepsin memecah substratnya dengan menghidrolisa ikatan peptida C-terminal beberapa jenis asam amino aromatik seperti phenilalanin, tiroksin dan triptofan (Kimball 1992, St. Edward’s Univ. 2005). Pepsin merupakan enzim protease yang paling umum digunakan sebagai pengganti khimosin dalam pembuatan keju, namun pepsin tidak digunakan sendiri karena waktu penggumpalan yang lama, curd yang lunak, hilangnya lemak dalam whey, terbentuk peptida pahit, tekstur dan konsistensi keju yang lebih lunak, serta ketidakmampuan untuk aktif pada pH 6,5 (Kilara dan Iya 1984). Hal yang sama juga dinyatakan oleh Spreer (1998) bahwa pepsin memberikan efek koagulasi yang lemah dan proteolisis yang non spesifik. Proteolisis non spesifik merupakan pemutusan rantai peptida tertentu pada kasein di luar yang terjadi pada koagulasi normal dan terkadang menimbulkan rasa pahit yang tidak diharapkan. Namun pada proses koagulasi oleh rennet yang mengandung khimosin dan pepsin, khimosin secara ireversibel mengubah kasein menjadi para-ĸ-kasein dengan adanya ion kalsium. Selanjutnya pepsin akan bekerja pada para-ĸ-kasein ini (Murray 2000).
Gambar 7 Hasil koagulasi susu dengan ekstrak kasar (DM1 dan DM2) dan hasil dialisa (DM1’ dan DM2’) sama-sama menghasilkan koagulasi yang sempurna.
Terbentuknya curd yang kompak dan padat dari hasil uji koagulasi terhadap sampel DM1 dan DM2 menunjukkan bahwa rennet yang diekstraksi dari abomasum domba lokal usia dewasa muda masih memiliki kandungan khimosin yang cukup tinggi. Hal ini sesuai dengan pernyataan Fox (1993) bahwa produksi
DM1 DM2
23
khimosin pada lambung ruminansia tidak pernah benar-benar terhenti bahkan setelah memasuki usia dewasa. Berdasarkan penelitian yang dilakukan Fitriyani (2006) dan Nisa’ et al. (2007) diketahui bahwa pada bagian fundus abomasum domba lokal dewasa muda (5-12 bulan), sel-sel penghasil enzim khimosin ditemukan dengan jumlah masih relatif banyak dan rennet hasil ekstrasi abomasum domba pada usia tersebut masih dapat mengkoagulasikan susu dengan baik.
Rennet yang diekstraksi dari sampel abomasum DM2 mengkoagulasikan
susu lebih cepat daripada DM1 (Tabel 2). Faktor-faktor yang mempengaruhi waktu koagulasi susu antara lain aktivitas enzim khimosin, suhu, pH, dan konsentrasi ion kalsium (Dalgleish 1999). Kedua sampel diuji pada suhu 35-40 °C dan pada pH 5,4 yang merupakan kondisi optimum terjadinya koagulasi enzimatis. Pada uji koagulasi, tidak dilakukan penambahan kalsium eksternal sehingga ion-ion kalsium yang berperan dalam proses koagulasi hanya didapat dari susu. Pada pengujian kedua sampel digunakan susu dari sumber yang sama yang kemudian dipasteurisasi untuk mematikan bakteri patogen (Scott 1986). Selain faktor umur, aktivitas enzim khimosin juga dipengaruhi masa sapih (Guilloteau et al. 1983). Domba yang disapih lebih awal memiliki aktivitas khimosin lebih rendah. Dengan demikian aktivitas sampel rennet DM2 bisa lebih tinggi daripada DM1 diduga akibat penundaan masa sapih, walaupun berat sampel abomasum DM2 lebih besar dan mengindikasikan umur yang lebih tua.
Tabel 2 Perbandingan waktu koagulasi antara ekstrak kasar dan hasil dialisa dari sampel rennet DM1 dan sampel rennet DM2
Sampel Waktu Koagulasi (menit.detik)
Ekstrak Kasar DM1 10.24 DM2 3.38 Rata-Rata± St. Dev 6.81±4.85 Hasil Dialisa DM1 14.56 DM2 8.25 Rata-Rata± St. Dev 11.41±4.46
Kedua sampel rennet ekstrak kasar yang digunakan dalam penelitian ini telah mengalami penyimpanan beku. Rennet harus dapat disimpan dalam waktu yang lama, karena rennet harus selalu tersedia untuk memenuhi kebutuhan produksi keju. Berdasarkan Sari (2009) rennet yang diekstraksi dari domba usia dewasa muda (5-12 bulan) dan telah disimpan beku (pada suhu -30ºC) selama 10 bulan masih memiliki kemampuan mengkoagulasikan susu dengan baik dan tidak berbeda dengan rennet segar. Dengan demikian, penyimpanan beku tidak berpengaruh secara signifikan pada aktivitas rennet.
Presipitasi Garam dan Dialisa Rennet
Presipitasi garam pada proses fraksinasi dilakukan untuk memisahkan enzim khimosin dan pepsin dari pelarutnya. Enzim merupakan protein dan protein sangat tidak stabil dalam larutan encer. Isolasi protein seharusnya dilakukan dengan pertimbangan sifat kimia protein, dimana protein harus dalam kondisi yang relatif stabil, yaitu berada dalam larutan pekat dan pada suhu yang relatif rendah (Northrop dan Kunitz 1924, diacu dalam Harrow 1950). Presipitasi garam dilakukan dengan prinsip salting out. Pada keadaan salting out, ion-ion garam akan berikatan dengan molekul air sehingga menyebabkan penarikan selubung air yang mengelilingi permukaan protein dan mengakibatkan protein saling berinteraksi, beragregasi, dan kemudian mengendap (Bollag dan Edelstein 1991).
Enzim pepsin dan khimosin dapat terpresipitasi dengan penambahan garam netral seperti natrium klorida (NaCl), magnesium sulfat (MgSO4), dan amonium
sulfat ((NH4)2SO4) (Tauber dan Kleiner 1932). Amonium sulfat dipilih dalam
penelitian ini karena garam ini efektif dalam proses salting out, memiliki daya larut tinggi, menghasilkan panas pada tingkat yang rendah, dan relatif murah (Scopes 1994). Ekstrak kasar rennet dipresipitasi dengan amonium sulfat pada konsentrasi 70% (persen saturasi) pada suhu 4ºC (Encorbio 2010). Konsentrasi ini didapat melalui uji empirik dengan membandingkan tingginya endapan pada beberapa persen saturasi yaitu 64%, 70%, 76%, dan 88%. Dari hasil uji empirik, optimasi diperoleh pada konsentrasi 70% berdasarkan pengamatan secara kualitatif terhadap tingginya endapan. Sebagian besar protein akan terpresipitasi pada 55% amonium sulfat (persen saturasi) dan terpresipitasi maksimum pada konsentrasi 85% amonium sulfat (persen saturasi) (Bollag dan Edelstein 1991).
25
BM (kD)
Unstained Marker
Ekstrak Kasar Hasil Dialisa Hasil Kromatografi
DM1 DM2 DM1 DM2 DM1 DM2
t (menit.detik) 10.24 3.38 14.25 8.25 162.26 161.23 57.19 19.00 14.25 23.15 57.56
Fraksi ke- 5 6 4 5 6 7 8
Gambar 8 Hasil gel elektroforesis menggunakan pewarnaan silver pada sampel rennet DM1 (B, D, F dan G) dan DM2 (C, E, H, I, J, K, dan L). Pita pada lingkaran kuning diduga menunjukkan enzim khimosin dan pepsin. BM = bobot molekul, t = waktu koagulasi sempurna.
Endapan protein yang diperoleh dari tahap presipitasi garam dilarutkan kembali dalam buffer asetat 10 mM pH 5,4 sebanyak 4 mL dan dilakukan dialisa. Buffer dalam hal ini berperan mempertahankan pH enzim. Buffer asetat memiliki kisaran pH antara 3,6-5,6 (Kiernan 1990). Dengan demikian, buffer asetat sesuai digunakan untuk melarutkan kembali rennet yang mengandung enzim khimosin yang stabil pada pH 5,3-6,3 dan pepsin yang stabil pada pH 5,0-5,5 (Suhartono 1992). Alasan tersebut juga mendasari penggunaan buffer ini sebagai buffer pengelusi (fase gerak) dalam kromatografi kolom gel filtrasi untuk memurnikan khimosin dan pepsin dalam rennet.
Dialisa merupakan proses difusi suatu zat terlarut melalui membran selektif permeabel dengan melawan gradien konsentrasi untuk mencapai titik keseimbangan. Gradien tersebut dibentuk dari perbedaan konsentrasi buffer pelarut dan buffer pendialisa (dialysate buffer). Kantong dialisa yang digunakan memiliki ukuran pori-pori 12 kD sehingga molekul-molekul terlarut dengan bobot molekul (BM) sama dengan atau kurang dari 12 kD akan keluar melewati membran, sementara molekul dengan BM lebih besar akan tertahan di dalam kantong dialisa. Metode ini digunakan untuk memisahkan enzim khimosin dan pepsin dari amonium sulfat. Garam seperti amonium sulfat memiliki BM yang
97,4 116,3
21,5 55,4
kecil (132,14 g/mol = 132,14 D) (Encorbio 2010), sehingga amonium sulfat akan tertarik keluar. Sementara khimosin dengan BM 31 kD dan pepsin dengan BM 34,5 kD (Suhartono 1992), akan tertahan.
Berdasarkan protokol standar, dialisa dilakukan selama 16 jam dengan beberapa kali penggantian buffer pendialisa. Penggantian buffer pendialisa bertujuan mengoptimalkan pengeluaran molekul-molekul yang tidak dibutuhkan dari dalam kantong dialisa. Banyak faktor yang mempengaruhi optimasi proses dialisa antara lain koefisien difusi, pH, temperatur, waktu, konsentrasi protein sampel, volume sampel, volume buffer pendialisa, seberapa sering penggantian buffer pendialisa dilakukan, luas area permukaan kantong dialisa, ketebalan kantong dialisa, muatan molekul, serta agitasi (stirring) (Spectrumlabs 2008).
Hasil dialisa menunjukkan adanya pertambahan volume pada rennet dari volume 4 ml yang dimasukkan ke dalam kantong dialisa. Volume sampel rennet DM1 bertambah menjadi 7 ml, sementara pada sampel rennet domba DM2 volume bertambah menjadi 7,5 ml. Pertambahan volume ini disebabkan adanya reaksi kesetimbangan dimana amonium sulfat serta molekul-molekul lain yang keluar dari kantong dialisa digantikan oleh buffer pendialisa.
Pada uji aktivitas, hasil dialisa rennet sampel DM1 dan DM2 membutuhkan waktu lebih lama dalam mengkoagulasikan susu daripada ekstrak kasarnya (Tabel 2). Konsentrasi hasil dialisa yang digunakan dalam uji aktivitas memang lebih rendah daripada ekstrak kasar, yakni 1% (v/v) untuk hasil dialisa dan 4% (v/v) untuk rennet ekstrak kasar. Namun perbedaan konsentrasi dalam uji aktivitas ini diduga bukan merupakan penyebab, karena adanya pemekatan selama proses presipitasi garam sampai didapat hasil dialisa (Lampiran 2).
Pada hasil analisa protein dengan SDS-PAGE terlihat pita protein pada hasil dialisa kedua sampel rennet (DM1, DM2) lebih sedikit daripada rennet ekstrak kasarnya (Gambar 8). Pada saat dilakukan dialisa, molekul yang keluar dari kantong tidak hanya amonium sulfat tetapi juga molekul-molekul protein yang bobot molekulnya sama dengan atau di bawah 12 kD. Menurunnya aktivitas
rennet dapat disebabkan tereliminasinya sebagian enzim pepsin dan khimosin
selama proses presipitasi garam dan dialisa. Presipitasi garam dilakukan dengan menggunakan amonium sulfat yang merupakan garam yang paling umum
27
digunakan untuk mengikat berbagai jenis protein termasuk enzim pepsin dan khimosin (Scopes 1994, Tauber dan Kleiner 1932). Meskipun dalam penelitian ini tidak dilakukan uji aktivitas terhadap supernatan hasil presipitasi garam untuk membuktikan dugaan tersebut.
Faktor lain yang dapat menyebabkan penurunan aktivitas rennet diduga akibat dialisa yang dilakukan belum optimal dalam memisahkan ikatan antara garam amonium sulfat dan enzim. Khimosin dan pepsin yang dapat bekerja mengkoagulasikan misel kasein susu menjadi lebih sedikit, sehingga aktivitas koagulasi berlangsung lebih lambat. Waktu yang dibutuhkan untuk koagulasi susu secara sempurna berbanding terbalik dengan konsentrasi enzim (Charlson et al. 1985).
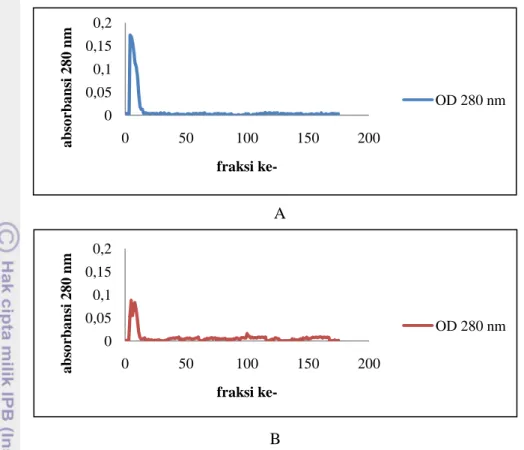
Kromatografi Kolom Gel Filtrasi
Sebanyak 175 fraksi dikoleksi dari hasil pemisahan protein sampel rennet DM1 dan DM2 dengan metode kromatografi kolom gel filtrasi. Dari fraksi-fraksi tersebut aktivitas koagulasi ditunjukkan fraksi ke-5 dan ke-6 pada hasil purifikasi sampel DM1, serta fraksi ke-4 hingga ke-8 pada hasil purifikasi sampel DM2 (Gambar 9). Jumlah fraksi yang dapat mengkoagulasikan susu dari hasil kromatografi DM1 lebih sedikit daripada hasil kromatografi DM2, karena kadar protease baik pada ekstrak kasar maupun hasil dialisa DM1 lebih rendah daripada DM2. Hal ini didasarkan pada hasil SDS-PAGE yang menunjukkan bahwa intensitas pita-pita protein ekstrak kasar dan hasil dialisa sampel DM2 lebih kuat daripada sampel DM1 (Gambar 8).
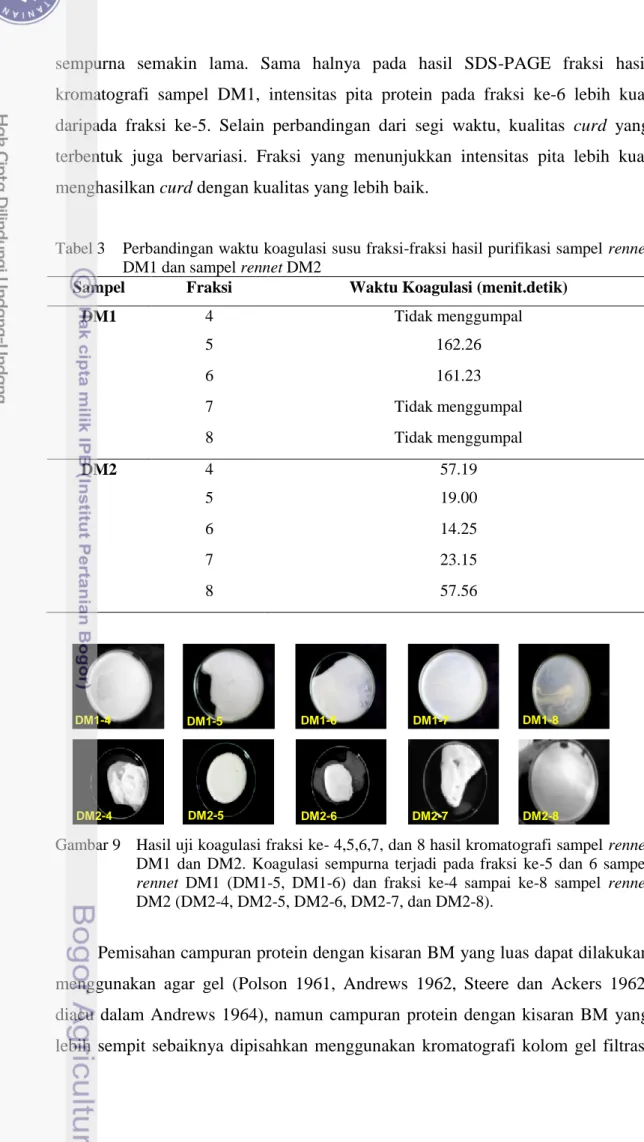
Hasil pengujian koagulasi pada hasil kromatografi sampel rennet DM1 menunjukkan fraksi ke-6 mengkoagulasikan susu lebih cepat daripada fraksi ke-5. Hasil pengujian sampel DM2 menunjukkan fraksi ke-6 mengkoagulasikan susu paling cepat, diikuti fraksi ke-5, fraksi ke-7, fraksi ke-4, dan fraksi ke-8 (Tabel 3). Pita-pita protein pada hasil SDS-PAGE memiliki korelasi positif dengan hasil pengujian koagulasi pada fraksi-fraksi tersebut (Gambar 8). Intensitas pita yang diduga menunjukkan khimosin dan pepsin pada hasil SDS-PAGE fraksi-fraksi hasil kromatografi sampel DM2 menurun dari fraksi ke-6 > ke-5 > ke-7 > ke-4 > ke-8, sebaliknya waktu yang dibutuhkan untuk mengkoagulasikan susu secara
sempurna semakin lama. Sama halnya pada hasil SDS-PAGE fraksi hasil kromatografi sampel DM1, intensitas pita protein pada fraksi ke-6 lebih kuat daripada fraksi ke-5. Selain perbandingan dari segi waktu, kualitas curd yang terbentuk juga bervariasi. Fraksi yang menunjukkan intensitas pita lebih kuat menghasilkan curd dengan kualitas yang lebih baik.
Tabel 3 Perbandingan waktu koagulasi susu fraksi-fraksi hasil purifikasi sampel rennet DM1 dan sampel rennet DM2
Sampel Fraksi Waktu Koagulasi (menit.detik)
DM1 4 Tidak menggumpal 5 162.26 6 161.23 7 Tidak menggumpal 8 Tidak menggumpal DM2 4 57.19 5 19.00 6 14.25 7 23.15 8 57.56
Gambar 9 Hasil uji koagulasi fraksi ke- 4,5,6,7, dan 8 hasil kromatografi sampel rennet DM1 dan DM2. Koagulasi sempurna terjadi pada fraksi ke-5 dan 6 sampel rennet DM1 (DM1-5, DM1-6) dan fraksi ke-4 sampai ke-8 sampel rennet DM2 (DM2-4, DM2-5, DM2-6, DM2-7, dan DM2-8).
Pemisahan campuran protein dengan kisaran BM yang luas dapat dilakukan menggunakan agar gel (Polson 1961, Andrews 1962, Steere dan Ackers 1962, diacu dalam Andrews 1964), namun campuran protein dengan kisaran BM yang lebih sempit sebaiknya dipisahkan menggunakan kromatografi kolom gel filtrasi
DM1-4 DM1-5 DM1-6 DM1-7 DM1-8