PENGENDALIAN PENYAKIT BUSUK PANGKAL BATANG
(Phytophthora capsici LEONIAN) PADA LADA (Piper nigrum L.)
DENGAN EKSTRAK PINANG, GAMBIR, SIRIH, DAN
KAPUR SIRIH
DEDEK KUSVIANTI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
ABSTRAK
DEDEK KUSVIANTI. Pengendalian Penyakit Busuk Pangkal Batang (Phytophthora capsici Leonian) pada Lada (Piper Nigrum L.) dengan Ekstrak Pinang, Gambir, Sirih, dan Kapur Sirih. Dibimbing oleh WIDODO dan DJOKO PRIJONO.
PENGENDALIAN PENYAKIT BUSUK PANGKAL BATANG
(Phytophthora capsici LEONIAN) PADA LADA (Piper nigrum L.)
DENGAN EKSTRAK PINANG, GAMBIR, SIRIH, DAN
KAPUR SIRIH
DEDEK KUSVIANTI
Skripsi
Sebagai salah satu syarat untuk memperoleh
gelar Sarjana Pertanian
di Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
Judul : Pengendalian Penyakit Busuk Pangkal batang (Phytophthora capsici Leonian) pada Lada (Piper nigrum L.) dengan
Ekstrak Pinang, Gambir, Sirih, dan Kapur Sirih
Nama Mahasiswa : Dedek Kusvianti
NRP : A34063036
Menyetujui,
Mengetahui,
Tanggal lulus:
Dosen Pembimbing I
Dr. Ir. Widodo, MS. NIP 19591115 198503 1 003
Dosen Pembimbing II
Ir. Djoko Prijono, MAgrSc. NIP 19590827 198303 1 005
Ketua Departemen Proteksi Tanaman
Dr. Ir. Dadang, MSc. NIP 19640204 19902 1 002
RIWAYAT HIDUP
Penulis dilahirkan di Tanjungpandan, Provinsi Bangka Belitung pada tanggal 22 Agustus 1989. Penulis merupakan anak kedua dari dua bersaudara keluarga Bapak Sahani Saleh dan Ibu Asmara.
Penulis menyelesaikan pendidikan menengah atas di SMA Negeri I Tanjungpandan pada tahun 2006. Pada tahun yang sama penulis melanjutkan pendidikan di Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru dan diterima di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB).
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT, yang atas limpahan Rahmat dan Karunia-Nya penulis dapat menyelesaikan penyusunan skripsi ini. Skripsi dengan judul “Pengendalian Penyakit Busuk Pangkal Batang (Phytophthora capsici Leonian) pada Lada (Piper Nigrum L.) dengan Ekstrak Pinang, Gambir, Sirih, dan Kapur Sirih” merupakan salah satu syarat untuk memperoleh gelar Sarjana di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Dr. Ir. Widodo, MS. dan Ir. Djoko Prijono, MAgrSc. yang telah banyak memberikan bimbingan dan pengarahan selama penelitian dan penulisan skripsi.
2. Dr. Ir. Purnama Hidayat, MSc. yang telah bersedia menjadi dosen penguji tamu dalam seminar tugas akhir dan ujian sarjana.
3. Dr. Ir. Kikin H. Mutaqin, MSi. sebagai dosen pembimbing akademik yang telah membimbing dan memotivasi penulis selama ini.
4. Bapak, Umak, dan Abang tercinta yang tanpa lelah menyemangati penulis dalam menyelesaikan skripsi ini.
5. Saudara-saudara di Lawalata-IPB yang selalu mendukung penulis baik suka maupun duka.
6. Teman-teman seangkatan penulis di Departemen Proteksi Tanaman, khususnya teman-teman seperjuangan di Laboratorium Mikologi Tumbuhan, Bapak Dadang Surachman, Sdri Ita Novrita, dan semua pihak yang tidak dapat penulis sebutkan satu per satu.
Semoga hasil penelitian ini bermanfaat bagi masyarakat secara umum maupun perkembangan iptek khususnya dalam bidang proteksi tanaman.
Bogor, Maret 2011
DAFTAR ISI
Daerah Asal dan Persebaran di Indonesia ... 3
Ciri Botani ... 3
Lingkungan Tumbuh ... 4
Penyakit Busuk Pangkal Batang (Phytophthora capsici L.) ... 4
Bahan Uji ... 6
Perbanyakan Isolat P. capsici ... 10
Perbanyakan Zoospora P. capsici ... 10
Metode Pengujian ... 11
Uji Penghambatan Pertumbuhan Koloni secara In Vitro ... 11
Uji Penghambatan Kemunculan dan Diameter Gejala BPB secara In Vivo ... 11
Rancangan Percobaan ... 13
Analisis Data ... 13
HASIL DAN PEMBAHASAN ... 14
Pengaruh Perlakuan terhadap Pertumbuhan Diameter Koloni Phytophthora capsici secara In Vitro ... 14
Pengaruh Perlakuan terhadap Perkembangan Gejala BPB oleh Phytophthora capsici secara In Vivo ... 18
SIMPULAN DAN SARAN ... 22
Simpulan ... 22
vii
DAFTAR TABEL
Halaman 1 Nilai skala dan kategori serangan yang digunakan untuk menghitung
keparahan penyakit (KP) penyakit pada tanaman lada ... 13 2 Pengaruh perlakuan empat jenis ekstrak (0,01%) terhadap
pertumbuhan koloni P. capsici pada 6 hari setelah inokulasi ... 14 3 Pengaruh perlakuan jenis ekstrak terhadap pertumbuhan diameter
koloni P. capsici pada 6 hari setelah inokulasi ... 17 4 Pengaruh perlakuan ekstrak uji terhadap persentase keparahan
DAFTAR GAMBAR
Halaman 1 Perkembangan koloni P. capsici akibat perlakuan dengan (a) ekstrak
pinang, (b) ekstrak gambir, (c) ekstrak pinang+gambir, dan (d) ekstrak campuran pinang + gambir + sirih + kapur sirih.
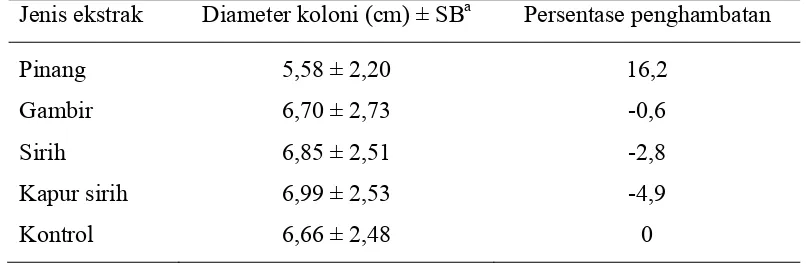
HSI: hari setelah inokulasi ... 16
2 Pengaruh perlakuan terhadap kemunculan gejala (a) dan keparahan penyakit (b) BPB oleh P. capsici secara in vivo. K: tanpa perlakuan (kontrol), F: fungisida berbahan aktif propineb 0,2%, C2: ekstrak campuran pinang + gambir + sirih + kapur sirih 0,005%, C4: ekstrak campuran pinang + gambir + sirih + kapur sirih 0,01%, dan
P4: ekstrak pinang 0,04% ... 20 3 Gejala serangan P. capsici pada 7 HSI. (a) ekstrak pinang 0,04%,
(b) ekstrak campuran pinang + gambir + sirih + kapur sirih
0,005%, (c) ekstrak campuran pinang + gambir + sirih + kapur sirih 0,01%, (d) perlakuan fungisida propineb 0,2%, dan (e) perlakuan
DAFTAR LAMPIRAN
Halaman 1 Diameter koloni Phytophthora capsici pada perlakuan ekstrak sirih
dan kapur sirih (0,01%) pada 6 hari setelah inokulasi ... 28 2 Diameter koloni Phytophthora capsici pada perlakuan ekstrak uji
pada 6 hari setelah inokulasi ... 28 3 Persentase keparahan penyakit BPB akibat perlakuan pada 11 hari
setelah inokulasi ... 29 4 Analisis ragam pengaruh perlakuan terhadap pertumbuhan koloni
P. capsici pada 6 hari setelah inokulasi ... 30 5 Analisis ragam pengaruh perlakuan ekstrak uji terhadap persentase
1
PENDAHULUAN
Latar Belakang
Lada (Piper nigrum L.) merupakan produk tertua dan terpenting di antara rempah-rempah yang diperdagangkan di dunia (Wahid 1996a). Lada diproduksi
oleh 11 negara yang terbagi dalam dua kelompok, yaitu anggota International Pepper Community (IPC) yang terdiri atas Brasil, India, Indonesia, Malaysia, Srilanka, Vietnam dan bukan anggota IPC seperti China, Thailand, Madagaskar,
Kambodia, dan Ekuador. Volume ekspor lada Indonesia pada tahun 2009
mencapai 50,642 ton, dengan nilai 140,3 juta dollar AS (Ditjenbun 2010). Di
pasar internasional, lada Indonesia mempunyai kekuatan dan daya jual tersendiri
karena cita rasanya yang khas. Lada Indonesia dikenal dengan nama Muntok white
pepper untuk lada putih dan Lampong black pepper untuk lada hitam (Yuhono
2007).
Faktor pembatas produksi lada Indonesia di antaranya serangan
Phytophthora capsici, penyebab penyakit busuk pangkal batang (BPB). Kasim
(1990) memperkirakan kerusakan tanaman lada akibat penyakit BPB di Indonesia
setiap tahunnya berkisar dari 10% sampai 15%. Gejala khas penyakit BPB ialah
kelayuan tanaman apabila patogen tersebut menyerang pangkal batang atau akar.
Infeksi pada pangkal batang menyebabkan terjadinya perubahan warna kulit
menjadi hitam. Pada keadaan lembap, gejala hitam tersebut tampak seperti
berlendir berwarna agak biru. Serangan pada akar menyebabkan tanaman layu dan
daun-daun menjadi berwarna kuning. Daun-daun yang layu sering tetap
tergantung dan berubah warna menjadi cokelat sampai hitam. Serangan patogen
pada daun menyebabkan terjadinya bercak daun. Sepanjang tepi bercak terdapat
bagian gejala hitam bergerigi seperti renda yang akan tampak jelas bila daun
diarahkan ke cahaya, sedangkan serangan pada buah menyebabkan buah berwarna
hitam dan menjadi busuk. Umumnya serangan terjadi pada buah yang letaknya
dekat permukaan tanah (Manohara & Kasim 1996).
Pengendalian BPB secara kimia merupakan usaha pengendalian yang sudah
dilakukan sejak lama di era usaha perbaikan budi daya lada dibandingkan dengan
2
diketahui efektif untuk menekan BPB baik in vitro maupun di lapangan. Fungisida dengan bahan aktif bersifat sistemik cenderung lebih efektif dan banyak
digunakan oleh petani, khususnya saat harga lada tinggi (Manohara et al. 2005). Namun demikian, penggunaan fungisida sintetik yang berlebihan dapat
berdampak buruk bagi lingkungan, terjadinya resistensi dan terbentuknya strain
baru patogen tanaman (Agrios 2005). Selain itu, kecenderungan permintaan
produk yang bebas residu membuat pengendalian yang ramah lingkungan sangat
dibutuhkan untuk mendukung sistem pertanian yang berkelanjutan dan menekan
penggunaan pestisida.
Penelitian yang pernah dilakukan menunjukkan bahwa sediaan gambir
(Uncaria gambir Roxb.) dengan formulasi 30% cukup efektif mengendalikan
penyakit bercak daun (Fusarium sp.) pada serai wangi (Andropogon nardus L.) (Idris 2007). Ekstrak etanol daun sirih (Piper betle L.) pada konsentrasi 2,25%
dan 1,5% dilaporkan dapat menghambat pertumbuhan cendawan Aspergillus
niger, Aspergillus oryzae, dan Penicillium sp. hingga 100% (Wanchaitanawonget al. 2005). Biji pinang (Areca cathecu L.) dilaporkan memiliki aktivitas anticacing, antifungi, antibakteri, antiinflamasi, antioksidan, insektisida, dan larvasida
(Wetwitayakyung et al. 2006). Ravinshanker & Subba (2009) melaporkan bahwa
pasta Vitapex yang mengandung 30% kapur sirih Ca(OH)2 cukup efektif
menghambat pertumbuhan koloni bakteri Enterococcus faecalis secara in vitro. Oleh karena itu, penggunaan gambir, pinang, sirih, dan kapur sirih perlu dilakukan
untuk mengetahui potensinya dalam mengendalian penyakit BPB pada lada.
Tujuan Penelitian
Penelitian ini bertujuan mengetahui keefektifan ekstrak pinang, gambir,
sirih, dan kapur sirih sebagai bahan pengendali penyakit busuk pangkal batang
pada lada yang disebabkan oleh P. capsici.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang potensi
ekstrak pinang, gambir, sirih, dan kapur sirih sebagai alternatif pengendalian
3
TINJAUAN PUSTAKA
Tanaman Lada Daerah Asal dan Persebaran di Indonesia
Tanaman lada (Piper nigrum) berasal dari pantai barat Ghats, Malabar, India. Lada dibawa oleh para pendatang Hindu ke Pulau Jawa antara tahun 100
SM dan 600 M. Daerah awal pemasukan tanaman lada di Indonesia tidak
diketahui dengan jelas, namun diperkirakan bahwa tanaman lada pertama kali
ditanam di daerah Karesidenan Banten (Wahid 1996a).
Penyebaran tanaman lada dari daerah Banten mula-mula mengarah ke timur
Pulau Jawa. Di daerah Banten, Jakarta, Cirebon, Jepara, Surakarta dan
Yogyakarta, lada pada mulanya diusahakan dalam bentuk perkebunan sampai
dengan abad ke-18. Bersamaan dengan itu pengusahaannya dalam bentuk
perkebunan rakyat dimulai di Sumatera (Aceh, Bengkulu, Bangka, Lampung,
Sumatera Barat, Sumatera Timur, dan Jambi) serta ke Kalimantan (Pontianak,
Banjarmasin, dan Pangkalan Bun di Kalimantan Tengah) (Wahid 1996a).
Daerah pengembangan lada saat ini adalah Lampung yang terkenal dengan
lada hitamnya (Lampong black pepper), dan Bangka yang lebih dikenal dengan lada putihnya (Muntok white pepper). Selain itu, banyak pengembangan pertanaman lada baru di Kalimantan Barat, Kalimantan Tengah dan Kalimantan
Timur, serta Sulawesi Selatan dan Sulawesi Tenggara (Manohara et al. 2005).
Ciri Botani
Tanaman lada merupakan tanaman tahunan yang memanjat dan memiliki
batang yang berbuku-buku dan silindris. tinggi tanaman dapat mencapai 10 m dan
tajuk dapat mencapai diameter 1,5 m bila dibudidayakan dengan baik. Tanaman
lada berakar tunggang dengan akar utama dapat melakukan penetrasi pada tanah
sampai kedalaman 1-2 m. Akar yang tumbuh dari buku di atas tanah tidak
memanjang dan hanya digunakan untuk menempel pada tiang pemanjat. Batang
lada berbentuk sulur dan dikelompokkan menjadi empat macam, yaitu sulur
gantung, sulur panjat, sulur buah, dan sulur tanah. Daun lada duduk tunggal
4
permukaan atas, sedangkan daun muda bervariasi (hijau muda, ungu, cokelat
muda), bergelombang atau rata. Bunga-bunga terdapat pada cabang plagiotrophic yang tersusun dalam bulir (spica) atau untai (amentum). Buah lada temasuk buah buni atau buah batu. Buah berbentuk bulat dan pada waktu masak berwarna
merah. Biji lada memiliki permukaan yang licin dan berwarna putih cokelat
(Wahid 1996b).
Lingkungan Tumbuh
Lada merupakan tanaman memanjat dari keluarga Piperaceae yang dalam
pertumbuhannya dipengaruhi oleh faktor lingkungan. Batang tanaman lada
berbuku-buku dan berbentuk sulur. Sulur panjat tumbuh lebih baik dalam keadaan
nisbi udara kurang cahaya (fototrof negatif)sedangkan sulur buah dalam keadaan
cukup cahaya (fototrof positif). Intensitas cahaya yang dibutuhkan berkisar dari
50% sampai 75%. Lada dapat tumbuh dengan baik di daerah dengan ketinggian
0-500 m dpl. Curah hujan yang paling baik untuk tanaman lada adalah 2000 - 3000
mm/tahun dengan hari hujan 110-170 hari, dan musim kemarau 2-3 bulan/tahun.
Kelembapan nisbi udara yang sesuai dari 70% sampai 90% dengan kisaran suhu
25-35 0C. Tanaman lada dapat tumbuh pada semua jenis tanah, terutama tanah
berpasir dan gembur dengan unsur hara yang cukup. Tingkat kemasaman tanah
(pH) yang sesuai berkisar 5-6.5 (Balittri 2007).
Penggunaan tiang panjat hidup (tajar) dalam budi daya lada akan membantu
mengurangi intensitas cahaya yang berlebihan dan akan membuat tanaman
berumur lebih panjang karena tanaman tidak didorong berproduksi lebih
sementara input yang diberikan terbatas. Penanaman tanaman penutup tanah akan
mengurangi cekaman kekeringan akibat kemarau dan menghambat penyebaran
Phytophthora capsici selama musim hujan. Pembuatan saluran drainase yang cukup dan terasering yang disesuaikan dengan kondisi lahan diperlukan untuk
menghindari genangan air selama musim hujan (Wahyuno 2009).
Penyakit Busuk Pangkal Batang (Phytophthora capsici L.)
5
pada tahun 1885. Sejak saat itu dilaporkan penyebaran semakin meluas ke
berbagai daerah pertanaman lada, yaitu Lampung, Bangka, Aceh, Bengkulu, Jawa
Barat, Jawa Tengah, Kalimantan Selatan, Kalimantan Timur, dan Pulau Laut
(Manohara 2000). Kerusakan akibat penyakit tersebut di Lampung pada tahun
1970 diperkirakan mencapai 52%. Kasim (1990) memperkirakan kerusakan
tanaman lada akibat penyakit BPB di Indonesia setiap tahunnya berkisar dari 10%
sampai 15% dari total tanaman lada. Saat ini serangan penyakit BPB terus meluas
hingga tidak hanya ditemukan di sentra produksi lada, yaitu Bangka dan
Lampung, tetapi telah tersebar hampir di semua pertanaman lada di Jawa,
Kalimantan, dan Sulawesi (Manohara et al. 2005).
Cendawan P. capsici dapat menyerang semua fase pertumbuhan tanaman, mulai pembibitan sampai tanaman produktif. Gejala kelayuan mendadak terjadi
apabila terjadi serangan patogen pada pangkal batang. Pangkal batang yang
terserang menjadi berwarna hitam dan pada keadaan lembap akan tampak lendir
yang berwarna kebiruan. Serangan pada akar menyebabkan tanaman layu dan
daun-daun menjadi berwarna kuning. Serangan pada daun menyebabkan gejala
bercak daun pada bagian tengah atau tepi daun. Bercak berwarna hitam dengan
tepi bergerigi seperti renda yang akan tampak jelas apabila daun diarahkan ke
cahaya. Serangan pada buah menyebabkan buah berwarna hitam dan busuk; gejala
ini biasanya banyak ditemukan pada buah yang letaknya dekat permukaan tanah
(Manohara & Kasim 1996).
Penyebaran cendawan P. capsici selain oleh air dan angin pada saat hujan, juga dapat terbawa oleh ternak peliharaan, siput/keong, manusia, alat pertanian
bekas dipakai pada tanaman sakit, dan dapat terbawa pada bibit lada sehingga
menjadi sumber inokulum bagi daerah pengembangan lada yang baru (Mulya et a.l 1986 dalam Manohara et al. 2005).
Pada dasarnya cendawan P. capsici merupakan patogen yang sulit dikendalikan, tetapi kerugian akibat penyakit ini dapat ditekan dengan melakukan
budi daya lada yang tepat dan benar. Pengendalian terpadu penyakit BPB meliputi
pengendalian secara kimia, kultur teknis dan hayati. Wahyuno (2009) menyatakan
bahwa hanya Lampung Daun Kecil dan Chunuk yang merupakan varietas toleran
6
Pengendalian secara kimia dengan menggunakan fungisida berbahan aktif
sistemik cenderung lebih efektif dan banyak digunakan oleh petani, khususnya
saat harga lada tinggi (Manohara et al. 2005). Fungisida sistemik berbahan aktif aluminium fosetil 80%, asam fosfit 400g/l, atau menaburkan mefenoksam ke
tanah sekeliling bawah tajuk tanaman dapat mencegah terjadinya penularan
penyakit (Manohara & Kasim 1996). Namun, pemakaian fungisida hendaknya
merupakan pilihan terakhir. Selain karena permintaan produk yang bebas residu
juga harga lada yang relatif tidak stabil, fungisida menjadi input yang mahal bagi
petani (Wahyuno 2009).
Pengendalian secara kultur teknis meliputi penggunaan bibit yang sehat,
penanaman tanaman penutup tanah, penggunaan tiang panjat hidup, pemupukan
yang berimbang, pembuatan drainase dan parit keliling, pemangkasan tajar,
pembuangan sulur cacing dan sulur gantung, penyiangan terbatas, serta
pemangkasan cabang lada yang ada di bagian bawah. Penanaman tanaman
kelompok Liliaceae dilaporkan akan menekan terjadinya gejala BPB karena
eksudat akar tanaman tersebut dapat menghambat perkecambahan zoospora P. capsici (Wahyuno 2009).
Pengendalian secara hayati dapat dilakukan dengan menggunakan sisa
tanaman seperti padi, palawija, dan serasah tajar yang dibenamkan ke dalam
tanah. Pengaplikasian bahan organik berupa alang-alang, jagung atau Arachis yang telah diinfestasi Trichoderma diketahui dapat menurunkan serangan P. capsici (Wahyuno 2009).
Bahan Uji Gambir
Gambir merupakan ekstrak kering dari ranting dan daun tanaman Uncaria gambir Roxb. (Rubiaceae). Gambir telah sejak lama digunakan sebagai pelengkap menyirih yang dikunyah dan dipercaya dapat menguatkan gigi (Lucida et al. 2007). Tanaman gambir merupakan tanaman perdu yang memiliki nilai ekonomi
tinggi, yaitu ekstrak (getah) daun dan ranting mengandung asam kateku tanat
7
gambir juga mengandung sedikit kuarsetin yaitu bahan pewarna kuning (Hayani
2003).
Pambayun et al. (2006) melaporkan bahwa kandungan fenol dari ekstrak etil asetat gambir menunjukkan sifat antibakteri pada bakteri gram positif, yaitu
Streptococcus mutans, Staphylococcus aureus, dan Bacillus subtilis. Selain itu, Idris (2007) melaporkan bahwa formulasi gambir 30% cukup efektif menekan
perkembangan diameter koloni cendawan Fusarium sp. penyebab penyakit bercak daun serai wangi sebesar 41,02% dan keparahan penyakit sebesar 28,81% pada
pengujian di rumah kaca. Pada penelian lain, Kresnawaty & Zainuddin (2009)
menyatakan bahwa terdapat aktivitas antioksidan dan antibakteri dari derivate
metil ekstrak etanol daun gambir.
Pinang
Tanaman pinang (Areca catechu, Palmaceae) merupakan tanaman penting di Asia yang dimanfaatkan sebagai obat herbal dan bahan campuran menyirih.
Biji pinang mengandung alkaloid, tanin, polifenol, gula, dan lemak. Alkaloid
utama pinang yaitu arekolina sedangkan arekeidina, guvasina, guvakolina, dan
arekolidina sebagai alkaloid minor (Awang 1986). Biji pinang memiliki sifat
anticacing, antifungi, antibekteri, antiinflamasi, dan antioksidan (Wetwitayaklung
et al. 2006).
Nonaka (1989) melaporkan bahwa biji buah pinang mengandung
proantosianidin, yaitu suatu tanin terkondensasi yang termasuk dalam golongan
flavonoid. Proantocyanidin merupakan senyawa fenol spesifik yang terkandung di
dalam biji pinang dan memiliki struktur seperti katekin dan epikatekin.
Proantosianidin mempunyai efek antibakteri, antivirus, antikarsinogenik,
antiinflamasi, antialergi, dan pelebaran pembuluh darah (vasodilatasi) (Fine
2000).
Sirih
Tanaman sirih (Piper betle, Piperaceae) telah lama dikenal masyarakat sebagai tumbuhan obat tradisional. Bagian tanaman yang digunakan sebagai obat
8
pendarahan, mengobati sariawan, gatal-gatal, obat batuk, dan antijamur pada kulit
(Parwata et al. 2009). Sari & Isadiartuti (2006) dalam penelitiannya melaporkan bahwa ekstrak daun sirih memiliki aktivitas antiseptik yang dapat menghilangkan
mikroorganisme pada tangan.
Daun sirih mengandung minyak atsiri dengan aroma yang khas. Minyak
atsiri sirih mengandung kavibetol yang membentuk karakter dalam
komponen-komponen minyak atsiri. Selain itu juga terkandung eugenol, kavikol, eugenol
metil eter, kineole, kariophilen, dan kadinen. Sirih banyak dimanfaatkan sebagai
bahan karminatif, stimulan, anticacing, ekspektoran, antiseptik, mengobati
dyspepsia, demam, kembung, dan filiriasis. Minyak atsiri memiliki aktivitas
antibakteri dan antioksidan yang efektif (Daniel 2006).
Minyak atsiri daun sirih dengan dosis optimum 2,5 µL/ cawan dilaporkan
memberikan hambatan pertumbuhan terhadap cendawan Candida albicans dan Trichophyton mentagrophytes dengan diameter penghambatan sebesar 15,3 dan 21 mm (Adnan et al. 2003).
Kapur Sirih
Kapur berasal dari kulit kerang laut atau cangkang dari kerang yang telah
dibakar. Kapur sirih biasa ditemukan berwarna putih baik dalam bentuk kering
dan basah. Saat kering kapur sirih berumus molekul CaO, sedangkan saat
basah/larutan berumus molekul Ca(OH)2 (Bayani 2009). Kapur sirih (Ca(OH)2)
yang dilarutkan dalam air akan terionisasi membentuk ion OH- yang bersifat basa dan dapat menetralkan suasana asam (Ismadi 1993).
Barthel et al. (2002) melaporkan bahwa pasta Ca(OH)2 efektif menghambat
pertumbuhan koloni bakteri Enterococcus faecalis hingga 100% setelah 1 dan 2 minggu masa inkubasi. Selain itu, Ravinshanker & Subba (2009) juga melaporkan
bahwa pasta Vitapex yang mengandung 30% Ca(OH)2 cukup efektif menghambat
pertumbuhan koloni E. faecalis secara in vitro.
9
BAHAN DAN METODE
Tempat dan Waktu
Penelitian ini dilaksanakan di Laboratorium Mikologi Tumbuhan,
Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor
(IPB), dari bulan Februari hingga November 2010.
Bahan Tanaman Uji
Daun lada yang digunakan dalam pengujian secara in vivo diambil dari tanaman lada varietas Lampung Daun Kecil (LDK) yang berasal dari perkebunan
lada masyarakat Membalong, Belitung.
Bahan Sumber Ekstrak
Bahan yang digunakan sebagai sumber ekstrak ialah biji pinang, gambir,
daun sirih, dan kapur sirih yang dibeli dari kios obat tradisional di Bogor.
Ekstraksi
Sumber ekstrak yaitu biji pinang, gambir, daun sirih, dan kapur sirih
masing-masing ditumbuk dengan menggunakan mortar. Setelah halus, bahan
tersebut dilarutkan dalam air dengan perbandingan 1 g bahan/100 ml aquades
untuk mendapatkan konsentrasi larutan 1%. Larutan tersebut kemudian disaring
menggunakan corong kaca berdiameter 6 cm beralaskan filter membran Whatman
0,2 µm. Hasil saringan ditampung dalam labu erlenmeyer dan disimpan sebagai
stok. Ekstrak stok pinang dan gambir kemudian diencerkan hingga didapat
konsentrasi masing-masing 0,5%. Kedua ekstrak tersebut kemudian dicampurkan
dan didapat ekstrak pinang + gambir dengan konsentrasi masing-masing
komponen 0,5%. Ekstrak pinang, gambir, sirih, dan kapur sirih kemudian
diencerkan lagi agar didapat ekstrak dengan konsentrasi 0,25 %. Ekstrak tersebut
kemudian dicampurkan dan didapat ekstrak campuran dengan konsentrasi
masing-masing komponen 0,25%.
10
Perbanyakan Isolat P. capsici
Isolat murni P. capsici diperoleh dari Balai Penelitian Tanaman Obat dan Aromatika, Bogor dan diperbanyak di Laborium Mikologi Tumbuhan, Fakultas
Pertanian, IPB. Isolat tersebut diperbanyak pada media V8.
Pembuatan media V8 memerlukan bahan V8, aquades, agar, dan CaCO3.
Sebanyak 800 ml aquades dan 15 g agar, dipanaskan dengan api sedang,
kemudian 200 ml V8 yang telah disaring dimasukkan ke dalam campuran dan
diaduk-aduk rata. Setelah campuran tersebut mendidih, api dikecilkan dan
dimasukkan sebanyak 3,5-5 g CaCO3. Campuran tersebut diaduk-aduk kembali
hingga rata. Setelah rata, V8 dimasukkan ke dalam erlenmeyer dan disterilisasi
menggunakan autoklaf dengan menggunakan uap air jenuh bertekanan 1atm
selama 15 menit pada suhu 121 0C (Shurtleff & Awerre 1997).
Media V8 yang telah disterilisasi kemudian dituang ke dalam cawan petri
sebanyak 15 ml tiap cawan. Setelah media pada cawan petri mengeras, isolat P. capsici dari agar miring diambil secukupnya dan dipindahkan ke dalam cawan menggunakan jarum inokulasi. Selanjutnya isolat diinkubasi selama 1 minggu
dalam suhu ruang.
Perbanyakan Zoospora P. capsici
Isolat patogen berdiameter 7 mm dipindahkan ke dalam media V8 dalam
cawan petri dan diinkubasi selama 4 hari dengan penyinaran lampu secara terus
menerus. Setelah 4 hari, biakan dibagi menjadi empat bagian dengan
menggunakan pisau steril. Setiap bagian dipindahkan ke dalam cawan petri baru
dan dipotong-potong menjadi blok-blok kecil dengan panjang sisi 0,5 cm2 (Wang
2000).
Air steril ditambahkan ke dalam cawan petri yang berisi agar blok hingga
menutupi permukaan blok dan diinkubasi pada suhu ruang selama 1 jam. Setelah
itu, air dibuang dan diganti dengan 18 ml air steril hingga menutupi permukaan
agar blok. Agar blok kemudian diinkubasi pada suhu 28 0C selama 24 jam dengan
penyinaran lampu terus menerus untuk menghasilkan sporangia. Selanjutnya, agar
11
pembentukan zoospora. Agar kembali dipindahkan ke suhu 28 0C dengan
penyinaran lampu selama 1 jam untuk pelepasan zoospora (Wang 2000).
Suspensi zoospora yang dihasilkan dituang ke dalam erlenmeyer.
Penghitungan jumlah zoospora dilakukan dengan menggunakan hemasitometer.
Sampel suspensi sebanyak 0,1 ml diambil dan dipindahkan ke dalam
hemasitometer dan dipanaskan pada suhu 50 0C selama 1 menit. Hal ini dilakukan
untuk menghentikan pergerakan zoospora agar mudah dihitung. Suspensi
zoospora yang diperoleh disimpan dalam keadaan dingin. Suspensi diencerkan
dengan air dingin terlebih dahulu sebelum digunakan untuk inokulasi (Wang
2000).
Metode Pengujian
Uji Penghambatan Pertumbuhan Koloni secara In Vitro
Isolat P. capsici yang berumur 4 hari diambil dengan menggunakan alat pelubang gabus berdiameter 5 mm. Isolat tersebut diinokulasikan ke dalam media
V8 yang telah dicampur dengan bahan ekstrak. Isolat yang telah diinokulasikan
diinkubasi pada suhu ruang selama 6 hari.
Perlakuan yang diberikan yaitu kontrol (K, tanpa perlakuan bahan ekstrak),
ekstrak pinang 0,01%; 0,02%; dan 0,04% dalam media V8, ekstrak gambir 0,01%;
0,02%; dan 0,04% dalam media V8, ekstrak pinang + gambir 0,005%; 0,01%; dan
0,02% dalam media V8, dan ekstrak campuran pinang + gambir + sirih + kapur
sirih 0,0025%; 0,005%; dan 0,01% dalam media V8. Inokulasi dilakukan di
laminar air flow agar perlakuan terhindar dari kontaminan. Pengamatan dilakukan setiap hari setelah inokulasi (HSI). Peubah yang dicatat yaitu perkembangan
diameter miselium terhadap waktu inkubasi.
Uji Penghambatan Kemunculan dan Diameter Gejala BPB secara In Vivo Daun lada varietas LDK dibersihkan dengan air mengalir dan dibiarkan
kering udara. Daun kemudian dicelupkan ke dalam cairan perekat dan
dikeringanginkan. Setelah itu, daun dicelupkan ke larutan ekstrak sesuai perlakuan
dan dibiarkan kering udara. Jumlah zoospora yang didapat dalam suspensi yaitu 9
12
permukaan bawah daun lada dengan menggunakan pipet mikro. Suspensi
zoospora sebanyak 0,1 ml diteteskan ke empat titik di permukaan bawah daun.
Perlakuan bahan celup yang diberikan yaitu kontrol (K, tanpa perlakuan
bahan ekstrak); fungisida berbahan aktif propineb 70% konsentrasi 0,2% dalam
larutan (F); ekstrak campuran gambir + pinang + sirih + kapur sirih konsentrasi
total 0,005% dalam larutan (C2); ekstrak campuran pinang + gambir + sirih +
kapur sirih konsentrasi total 0,01% dalam larutan (C4); dan ekstrak pinang 0,04%
dalam larutan (P4).
Tiap perlakuan diletakkan pada satu baki yang beralas tisu lembap,
kemudian sedotan plastik diletakkan di atas tisu tersebut untuk menyangga agar
permukaan daun tidak mengenai tisu. Daun disusun secara berjajar dengan
permukaan bawah daun menghadap ke atas. Daun yang telah diberi perlakuan
kemudian disungkup dengan plastik transparan. Penyungkupan dilakukan dengan
tujuan menciptakan kondisi lingkungan yang lembap agar zoospora patogen dapat
beradaptasi dan berpenetrasi ke dalam jaringan daun (Wahyuno et al. 2009). Daun diinkubasi selama 24 jam di ruang gelap dan kemudian diinkubasi
pada kondisi normal laboratorium selama 10 hari. Peubah yang digunakan yaitu
peluang kemunculan gejala dan perkembangan diameter terhadap waktu inkubasi.
Penghitungan peluang terjadinya penyakit didasarkan pada kemunculan gejala
pada titik-titik inokulasi. Gejala yang muncul menunjukkan keberhasilan patogen
menginfeksi daun tanaman. Persentase kemunculan gejala dihitung dengan rumus:
Jumlah titik yang bergejala pada tiap daun Kemunculan gejala (%) =
Jumlah titik inokulasi pada tiap daun
Keparahan penyakit (KP) didefinisikan sebagai persentase luas jaringan
tanaman yang terserang patogen dari total luasan yang diamati (Heuberger &
Townsend 1943 dalam Sinaga 2006).
∑ ni x vi
KP = x 100% Z x N
KP = keparahan penyakit (%)
N = jumlah daun yang terserang dengan nilai skala tertentu
vi = nilai skala
13
ni = jumlah daun yang diamati
Nilai skala dari 0 hingga 4 digunakan untuk menghitung KP (Tabel 1)
mengacu pada Pudjihartati et al. (2006) dalam menentukan gejala nekrosis pada daun kacang tanah.
Tabel 1 Nilai skala dan kategori serangan yang digunakan untuk menghitung keparahan penyakit (KP) BPB pada tanaman lada
Nilai skala Persentase luas bercak nekrosis terhadap luas daun per
titik inokulasi (x)
0 x = 0
1 1% < x ≤ 10%
2 10% < x ≤ 25%
3 25% < x ≤ 50%
4 > 50%
Rancangan Percobaan
Rancangan percobaan yang digunakan pada penelitian ini adalah rancangan
acak lengkap. Pengujian pengaruh bahan ekstrak secara in vitro dilakukan dengan 12 perlakuan ekstrak ditambah 1 kontrol. Masing-masing perlakuan diulang
sebanyak tiga kali dengan inokulasi isolat patogen pada media sebagai ulangan.
Pengujian pengaruh bahan ekstrak secara in vivo dilakukan dengan 3 perlakuan ekstrak, 1 kontrol, dan 1 kontrol negatif. Pengulangan sebanyak lima kali dengan
daun sebagai ulangan dan empat titik inokulasi pada daun sebagai unit perlakuan.
Analisis Data
Data pengaruh perlakuan ekstrak terhadap pertumbuhan koloni P.capsici secara in vitro dan pengaruh perlakuan ekstrak terhadap perkembangan gejala BPB secara in vivo dianalisis dengan sidik ragam menggunakan program Microsoft Excel 2007 dan Statistical Analysis System (SAS) untuk Windows versi 9.1. Pembandingan nilai tengah antar perlakuan dilakukan dengan uji selang
14
HASIL DAN PEMBAHASAN
Pengaruh Perlakuan terhadap Pertumbuhan Diameter Koloni P. capsici secara In Vitro
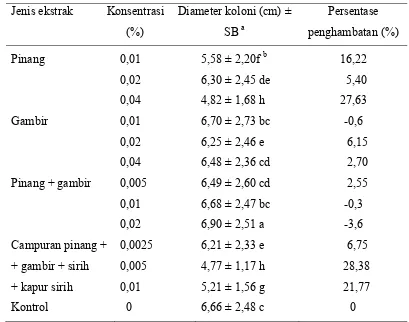
Pengujian pengaruh jenis ekstrak terhadap pertumbuhan koloni P. capsici secara in vitro pada awalnya menggunakan empat jenis ekstrak tunggal, yaitu pinang, gambir, sirih, dan kapur sirih pada konsentrasi 0,01%; 0,02%; dan 0,04%.
Namun, pada pengujian ekstrak sirih dan kapur sirih pada 0,01%, koloni patogen
tumbuh sangat cepat dan jauh melebihi pertumbuhan kontrol (Tabel 2). Hal ini
menunjukkan bahwa ekstrak sirih dan kapur sirih 0,01% tidak efektif menghambat
pertumbuhan koloni. Oleh karena itu, pada pengujian lanjutan dengan konsentrasi
0,02% dan 0,04% penggunaan ekstrak sirih dan kapur sirih ditiadakan. Pengujian
ekstrak pada konsentrasi 0,02% dan 0,04% hanya diarahkan pada pinang dan
gambir. Sementara itu, pengujian ekstrak pinang + gambir dilakukan pada
konsentrasi total 0,005%; 0,01%; dan 0,02% dan campuran empat bahan uji yang
terdiri atas pinang, sirih, gambir, dan kapur sirih dengan konsentrasi total
0,0025%; 0,005%; dan 0,01%.
Tabel 2 Pengaruh perlakuan empat jenis ekstrak (0,01%) terhadap pertumbuhan koloni P. capsici pada 6 hari setelah inokulasi
a
SB: simpangan baku.
Purnomo & Asmarayan (2005) menyatakan bahwa sirih dan lada
mempunyai kekerabatan morfologi yang dekat. Sirih juga diketahui memiliki sifat
ketahanan yang sama dengan lada terhadap P. capsici (Wahyuno et al. 2010). Priyono & Praptiwi (2006) melaporkan bahwa buah Piper sp. asal Papua
Jenis ekstrak Diameter koloni (cm) ± SBa Persentase penghambatan
Pinang 5,58 ± 2,20 16,2
Gambir 6,70 ± 2,73 -0,6
Sirih 6,85 ± 2,51 -2,8
Kapur sirih 6,99 ± 2,53 -4,9
Kontrol 6,66 ± 2,48 0
15
mengandung minyak atsiri, lemak dan asam lemak, emodol, tanin, gula pereduksi,
antrasenoid, poiluronida, glukosida, dan glikosida steroid. Adanya kandungan
senyawa kimia yang sama antara sirih dan lada menyebabkan tidak adanya
penghambatan pertumbuhan koloni pada pengujian dengan ekstrak sirih.
Perlakuan dengan kapur sirih 0,01% tidak menghambat pertumbuhan koloni
patogen karena kapur sirih yang terlarut dalam air dapat menciptakan suasana
basa. Erwin & Ribeiro (1996) melaporkan bahwa penambahan 3 g CaCO3 pada
pembuatan media V8 menjadikan pH media sebesar 7,5. Adanya penambahan
kapur sirih pada media membuat tingkat keasaman media menjadi berkurang dan
mendukung pertumbuhan patogen. Sementara itu, Manohara (1988) melaporkan
bahwa pH yang sesuai untuk pertumbuhan P. capsici pada media V8 cair adalah 3-7 dengan pH optimum 4.
Perlakuan dengan ekstrak pinang 0,01%; 0,02%; dan 0,04% masing-masing
dapat menghambat pertumbuhan koloni patogen (Gambar 1.a, Tabel 3), sementara
itu pada pengujian ekstrak gambir diketahui tidak terjadi penghambatan
pertumbuhan koloni pada konsentrasi 0,01% (Gambar 1.b, Tabel 3). Pada saat
kedua ekstrak tersebut dicampur terjadi penghambatan pada konsentrasi 0,005%,
sedangkan pada konsentrasi 0,01% dan 0,02% tidak (Gambar 1.c, Tabel 3).
Namun demikian, ketika keempat ekstrak, yaitu pinang, gambir, sirih, dan kapur
sirih dicampurkan, penghambatan pertumbuhan koloni patogen terjadi pada semua
tingkat konsentrasi. Penghambatan tertinggi ditunjukkan oleh konsentrasi
campuran 0,005% (Gambar 1.d, Tabel 3).
Wetwitayakyung (2006) menyatakan bahwa aktivitas antioksidan biji
pinang tidak hanya ditentukan oleh kadar tanin dan fenol total yang terkandung,
tetapi juga ditentukan oleh senyawa-senyawa fenolik lainnya. Nonaka (1989)
menyatakan bahwa proantocyanidin merupakan senyawa fenol spesifik yang
terkandung di dalam biji pinang dan memiliki struktur seperti katekin dan
epikatekin. Penelitian sebelumnya (Takahashi et al. 1999) menyebutkan bahwa proantocyanidin memiliki sifat antimikroba, pelindung tanaman terhadap sinar
ultraviolet, antioksidan, antimutagenetik, antitumor, antifungi, dan sebagai
16
patogen diduga merupakan aktivitas dari proantocyanidin yang terkandung dalam
ekstrak.
17
Tabel 3 Pengaruh perlakuan empat jenis ekstrak terhadap pertumbuhan diameter koloni P. capsici pada 6 hari setelah inokulasi
a
SB: simpangan baku
b
Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji selang berganda Duncan pada taraf nyata 5%.
Katekin merupakan zat aktif utama yang terkandung di dalam ekstrak
gambir. Penelitian sebelumnya menunjukkan bahwa kadar katekin dari produk
gambir Indonesia bervariasi dari 2,5 sampai dengan 95% per berat bobot (Amos
2010). Katekin pada daun strawberi menunjukkan aktivitas antifungi dengan
menghambat infeksi Alternaria alternata dengan memblok pembentukan haustoria walaupun telah terjadi perkecambahan spora dan terbentuk apresoria
(Yamamoto et al. 2000), formulasi gambir 30% dilaporkan cukup efektif terhadap cendawan Fusarium sp. penyebab penyakit bercak daun serai wangi (Idris 2007). Sementara itu, aktivitas antibakteri juga ditunjukkan ekstrak etil asetat gambir
terhadap bakteri Streptococcus mutans, Staphylococcus aureus, dan Bacillus subtilis (Pambayun et al. 2007). Namun demikian, sifat antifungi dan antibakteri yang dimiliki katekin tidak mampu menghambat pertumbuhan koloni P. capsici. Jenis ekstrak Konsentrasi
(%)
Diameter koloni (cm) ±
18
Ekstrak pinang + gambir yang digunakan pada pengujian merupakan
campuran dari bahan ekstrak pinang dan gambir dengan perbandingan volume dan
konsentrasi 1:1. Hasil pengujian menunjukkan bahwa penghambatan pertumbuhan
koloni patogen hanya ditunjukkan oleh konsentrasi 0,01% sementara konsentrasi
0,02% dan 0,04% tidak (Gambar 1.c, Tabel 3). Hal ini terjadi karena bahan aktif
yang terkandung dalam masing-masing ekstrak tidak saling kompatibel dalam
menghambat pertumbuhan patogen.
Hasil pengujian bahan campuran yang terdiri atas ekstrak pinang, gambir,
sirih, dan kapur sirih dengan perbandingan volume dan konsentrasi tiap ekstrak
1:1:1:1 dapat dilihat pada gambar 1.d. Aktivitas penghambatan pertumbuhan
koloni patogen ditunjukkan oleh setiap konsentrasi yang diberikan yaitu 0,0025%;
0,005%; dan 0,01%. Keefektifan ekstrak campuran dalam menghambat
pertumbuhan koloni patogen erat kaitannya dengan kompatibelitas bahan aktif
yang dikandung masing-masing bahan. Belum diketahui dengan pasti penyebab
kompatibelnya bahan aktif campuran terhadap penghambatan pertumbuhan
koloni.
Pengujian pengaruh perlakuan terhadap pertumbuhan diameter koloni
menunjukkan beberapa jenis ekstrak yang berpotensi menghambat pertumbuhan
P. capsici. yaitu pinang 0,04%, campuran 0,005% dan campuran 0,01%. Ketiga ekstrak tersebut memberikan pengaruh nyata terhadap pertumbuhan diameter
koloni patogen bila dibandingkan dengan kontrol. Namun, ketiga ekstrak tersebut
harus di uji secara in vivo untuk mengetahui tingkat keefektifannya pada jaringan tanaman
Pengaruh Perlakuan terhadap Perkembangan Gejala BPB oleh P. capsici secara In Vivo
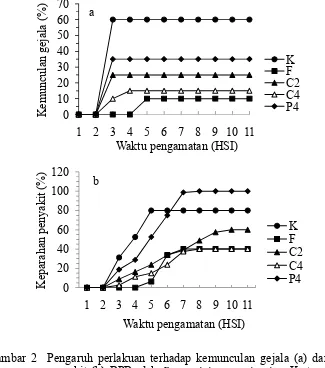
Hasil dari pengujian menunjukkan bahwa persentase kemunculan gejala tiap
perlakuan memberikan nilai yang berbeda. Kemunculan gejala tertinggi
ditunjukkan oleh ekstrak pinang 0,004% disusul oleh ekstrak campuran 0,005%,
ekstrak campuran 0,01%, dan fungisida 0,2% berbahan aktif propineb 70%.
Agrios (2005) menyatakan bahwa keberhasilan suatu infeksi ditentukan oleh
19
patogen dalam tingkat patogenik, serta suhu dan kelembapan lingkungan yang
menguntungkan patogen.
Semua perlakuan yang diberikan menunjukkan kemunculan gejala pada hari
ke-3, kecuali pada perlakuan fungisida. Persentase kemunculan gejala dari hari
ke-3 dan seterusnya menunjukkan nilai yang tetap. Perlakuan C4 menunjukkan
peningkatan persentase kemunculan gejala pada hari ke-3 dan ke-4. Perlakuan
fungisida baru menunjukkan gejala pada hari ke-4. Kemunculan gejala perlakuan
fungisida dari hari ke-4 dan seterusnya menunjukkan nilai yang tetap (Gambar
2.a).
Infeksi P. capsici lebih mudah terjadi pada permukaan bawah daun, penetrasi terjadi antara 4-6 jam setelah inokulasi dan gejala mulai tampak setelah
18 jam setelah inokulasi yang berupa titik coklat di permukaan atas daun
(Manohara & Kasim 1996). Gejala pada permukaan bawah daun meluas hingga
terlihat dengan jelas pada pengamatan hari ke tiga setelah inokulasi.
Perlakuan fungisida menunjukkan persentase kemunculan gejala terendah,
yaitu sebesar 10%. Fungisida berbahan aktif propineb 70% yang digunakan
merupakan fungisida yang bersifat racun kontak dan sangat cocok untuk
mengendalikan Phytophthora spp. dan Alternaria untuk sayur-sayuran (Anonim 2010)
Perkembangan keparahan penyakit BPB berbanding lurus dengan waktu
inkubasi. Semakin lama inkubasi, maka keparahan penyakit akan semakin tinggi
yang ditandai dengan semakin luasnya diameter gejala. Perlakuan ekstrak pinang
konsentrasi 0,04% menunjukkan keparahan penyakit tertinggi dibandingkan
perlakuan lain. Perlakuan ekstrak campuran 0,005% menunjukkan keparahan
penyakit yang lebih rendah dibandingkan kontrol dan perlakuan ekstrak campuran
0,01% menunjukkan keparahan penyakit yang tidak berbeda nyata dengan
fungisida 0,2% (Tabel 4).
Ekstrak campuran 0,01% dan fungisida 0,2% menunjukkan nilai keparahan
penyakit yang tidak berbeda nyata. Ekstrak campuran 0,01% juga memiliki daya
efikasi yang tinggi yaitu sebesar 61,17% dan hampir menyamai daya efikasi
fungisida yaitu sebesar 62,73%. Besarnya daya efikasi ekstrak campuran 0,01%
20
mengendalikan penyakit BPB. Keefektifan ekstrak campuran 0,01% tersebut
menyamai keefektifan fungisida 0,2%. Oleh karena itu, ekstrak campuran 0,01%
berpotensi untuk menggantikan fungisida dalam pengendalian P. capsici.
Gambar 2 Pengaruh perlakuan terhadap kemunculan gejala (a) dan keparahan penyakit (b) BPB oleh P. capsici secara in vivo. K: tanpa perlakuan (kontrol), F: fungisida berbahan aktif propineb 0,2%, C2: ekstrak campuran pinang + gambir + sirih + kapur sirih 0,005%, C4: ekstrak campuran pinang + gambir + sirih + kapur sirih 0,01%, dan P4: ekstrak pinang 0,04%.
Ekstrak campuran memiliki potensi yang cukup baik untuk digunakan
sebagai salah satu alternatif pengendalian P. capsici. Bahan-Bahan untuk membuat ekstrak campuran juga mudah ditemukan di berbagai daerah di
Indonesia sehingga pemanfaatan ekstrak campuran sebagai fungisida botani dapat
dilakukan secara luas. Namun demikian, agar ekstrak campuran lebih efektif
21
Tabel 4 Pengaruh perlakuan ekstrak uji terhadap persentase keparahan penyakit BPB pada 11 hari setelah inokulasi
Jenis ekstrak Konsentrasi
(%)
SB: simpangan baku
b
Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji selang berganda Duncan pada taraf nyata 5%.
Berikut gambar perkembangan gejala penyakit BPB setelah diinokulasikan
zoospora P. capsici pada 7 HSI. Gejala yang nampak sesuai dengan penelitian
Manohara et al. (2005) bahwa serangan pada daun menyebabkan gejala bercak daun pada bagian tengah atau tepi daun. Bercak berwarna hitam dengan tepi
bergerigi seperti renda yang akan nampak jelas bila daun diarahkan ke cahaya.
22
SIMPULAN DAN SARAN
Simpulan
Perlakuan ekstrak campuran pinang + gambir + sirih + kapur sirih 0,005%;
campuran pinang + gambir + sirih + kapur sirih 0,01%; dan pinang 0,04% secara
in vitro menghambat perkembangan diameter koloni P. capsici masing-masing sebesar 28,4%; 21,8%; dan 27,6%. Pada pengujian secara in vivo, penghambatan kemunculan gejala ditunjukkan oleh perlakuan campuran pinang + gambir + sirih
+ kapur sirih 0,005%; campuran pinang + gambir + sirih + kapur sirih 0,01%; dan
pinang 0,04%. Namun, potensi penghambatan keparahan penyakit hanya
ditunjukkan oleh perlakuan campuran pinang + gambir + sirih + kapur sirih
0,005% dan 0,01%. Perlakuan ekstrak campuran pinang + gambir + sirih + kapur
sirih 0,01% memiliki daya efikasi sebesar 61,2% dan hampir menyamai daya
efikasi fungisida propineb 0,2%, yaitu sebesar 62,7%.
Saran
Perlu dilakukan penelitian tentang konsentrasi formulasi yang lebih efektif
untuk menekan pertumbuhan patogen. Selain itu, perlu juga dilakukan penelitian
lebih lanjut di lapangan untuk mempelajari pengaruh langsung adanya
penghambatan penyakit BPB oleh formulasi campuran pinang + gambir + sirih +
kapur sirih.
23
DAFTAR PUSTAKA
Adnan ZA, Marlina, Kasmi K. 2003. Uji antimikroba minyak atsiri sirih (Piper betle L.). Jurnal Sains Tekhnologi Farmasi 8(1): 31-34.
Agrios GN. 2005. Plant Pathology. Edisi ke-5. Amsterdam: Elsevier.
Amos. 2010. Kandungan katekin gambir sentra produksi di Indonesia. Jurnal Standardisasi 12(3): 149-155.
Anonim. 2010. Propineb. http://www.bayercropscience.com/ BCSWeb/ CropProtection.nsf/ id / propineb.htm?open&l=EN &ccm=200020 [20 Februari 2011].
Awang M N. 1986. Estimation of arecoline contents in commersial Areca (betel) nuts and its relation to oral precancerous lesions. Singapore Medicine Journal 27(4).
[Balittri] Balai Penelitian Tanaman Rempah dan Aneka Tanaman Industri. 2007. Teknologi unggulan tanaman lada. http://balittri.litbang.deptan.go.id/ database/unggulan/bookletlada.pdf [27 Januari 2011].
Barthel et al. 2002. In situ antimicrobial effectiveness of chlorhexidine and calcium hydroxide: gel and paste versus gutta-percha points. Journal of Endodontics 28(6): 427-430.
Bayani RN. 2009. Kanker rongga mulut disebabkan oleh kebiasaan menyirih (laporan kasus) [skripsi]. Medan: Fakultas Kedokteran Gigi, Universitas Sumatera Utara.
Daniel M. 2006. Medicinal Plants: Chemistry and Properties. USA: Science Publisher.
Dhalimi A. 2006. Permasalahan gambir (Uncaria gambir L.) di Sumatera Barat dan alternative pemecahannya. Perspektif 5(1): 46-59.
[Ditjenbun] Direktorat Jenderal Perkebunan. 2010. Lada. http://ditjenbun.deptan.go.id/ cigraph/ index.php/viewstat/ exportimport/10-Lada [27 Januari 2011].
Erwin DC, Ribeiro OK. 1996. Phytophthora Diseases Worldwide. St. Paul: APS Press.
Fine AM. 2000. Oligomeric proanthocyanidin complexes: history, structure, and phytopharmaceutical applications. Alternative Medicine Review 5(2): 144-151.
Guo LY, Ko WH. 1993. Two widely accessible media for growth and reproduction of Phytophthora and Pythium speciest. Journal Series Article 3787 of the Hawaii Institute of Tropical 59(7): 2323-2325.
Hayani E. 2003. Analisis kadar catechin dari gambir dengan berbagai metode. Buletin Teknik Pertanian 8(1): 31-33.
24
Idris H. 2007. Pemakaian fungisida gambir terhadap penyakit bercak Fusarium sp. pada daun serai wangi. Jurnal Ilmu-Ilmu Pertanian Indonesia 3: 379-385.
Ismadi M. 1993. Biokimia: Suatu Pendekatan Berorientasi Kasus. Yogyakarta: Gadjah Mada University Press.
Jamsari, Yaswendri, Kasim M. 2007. Fenologi perkembangan bunga dan spesies Uncaria gambir. Biodiversitas 8(2): 141-146.
Kasim R. 1990. Pengendalian penyakit busuk pangkal batang secara terpadu. Buletin Penelitian Tanaman Industri 1:16-20.
Kresnawaty I, Zainuddin A. 2009. Aktivitas antioksidan dan antibakteri dari derivat metil ekstrak etanol daun gambir (Uncaria gambir). Jurnal Littri 15(4): 145-151.
Lucida H, Bakhtiar A, Putri WA. 2007. Formulasi sediaan antiseptik mulut dari katekin gambir. Jurnal Sains Tekhnologi Farmasi 12(1).
Manohara D. 1988. Ekologi Phytophthora palmivora (Butler) penyebab penyakit busuk pangkal batang (Piper nigrum) [disertasi]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Manohara D. 2000. Penyakit Busuk Pangkal Batang dan Agen Pengendalinya. Departemen Kehutanan dan Perkebunan, Direktorat Jenderal perkebunan Manohara D, Kasim R. 1996. Penyakit busuk pangkal batang dan
pengendaliannya. Monograf Tanaman Lada 1: 115-128.
Manohara D, Wahyuno D, dan Noveriza R. 2005. Penyakit busuk pangkal batang lada dan strategi pengendaliannya. Perkembangan Teknologi Tanaman Rempah dan Obat 17: 41-51.
Marlinda B. 2008. Analisis Daya Saing Lada Indonesia di Pasar Internasional [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Nonaka. 1989. Isolation and structure elucidation of tannins. Pure and Applied Chemistry 61(3): 357-360.
Pambayun R, Gardjito M, Sudarmadji S, Kuswanto KR. 2007. Kandungan fenol dan sifat antibakteri dari berbagai jenis ekstrak produk gambir (Uncaria gambir Roxb.). Majalah Farmasi Indoesia 18(3): 141-146.
Parwata OA, Rita WS, Yoga R. 2009. Isolasi dan uji antiradikal bebas minyak atsiri pada daun sirih (Piper betle Linn.) secara spektroskopi ultra violet-tampak. Jurnal Kimia 3(1): 7-13.
Priyono SH, Praptiwi. 2006. Identifikasi senyawa kimia dan aktivitas antibakteri ekstrak Piper sp. asal Papua. Laporan Teknis Pusat Penelitian Biologi LIPI 332(2): 3 – 6.
25
Purnomo, Asmarayan R. 2005. Hubungan kekerabatan antar spesies Piper berdasarkan sifat morfologi dan minyak atsiri daun di Yogyakarta. Biodiversitas 6(1): 12-16.
Ravishanker P, Subba RC. 2009. Antimicrobial of four calcium hydroxide formulations and chlorhexidine gel using agar diffusion model. The Internet Journal of Dental Science 8(1). http://www.ispub.com /journal/the_internet_journal_of_dental_science/ volume_8_number_1_19/ article/ antimicrobial-efficacy-of-four-calcium-hydroxide-formulations-and-chlorhexidine-gel-using-agar-diffusion-model.html.
Ristaino JB, Johnston SA. 1999. Ecologically based approaches to management of Phytophthora blight on bell pepper. Plant Disease 83(12): 1080-1089. Ronald D, Jones JB, Roberts PD. 2006. Characterization of Phytophthora
capsici associated with roots of weeds on Florida vegetable farms. Plant Disease 90(3): 345-350.
Sanogo S. 2007. Asexual reproduction of Phytophthora capsici as affected by extracts from agricultural and nonagricultural soils. Phytopathology 97: 873-878.
Sari R, Isadiartuti D. 2006. Studi efektifitas sediaan gel antiseptik tangan ekstrak daun sirih (Piper betle Linn.). Majalah Farmasi Indonesia 17(4): 163-169. Setiyono RT. 2003. Status pemuliaan tanaman lada. Perkembangan Teknologi
TRO 15(2): 1-10.
Staples GW, Bevacqua RF. 2006. Areca catechu (betel nut palm) species profiles for Pacific Island agroforestry ver. 1.3. www.traditionaltree.org.
Shurtleff MC, Awere III CW. 1997. The Plant Disease Clinic and Field Diagnosis of Abiotic Diseases. St. Paul: APS Press.
Sinaga MS. 2006. Dasar-dasar Ilmu Penyakit Tumbuhan. Jakarta: Penerbit Swadaya.
Takahashi T, Kamiya T, Hasegawa A, Yokoo Y. 1999. Procyanidin oligomers selectively and intensively promote proliferation of mouse hair epithelial cells in vitro and active hair follicle growth in vivo. The Journal of Investigative Dermatology 112(3): 310-316.
Wahid P. 1996a. Sejarah perkembangan dan daerah perkembangan tanaman lada. Monograf Tanaman Lada 1:1-11.
Wahid P. 1996b. Identifikasi tanaman lada. Monograf Tanaman Lada 1: 27-32. Wahyono D, Manohara D. 1995. Pembentukan oospora Phytophthora capsici
pada jaringan lada. Hayati :46-48.
Wahyuno D. 2009. Pengendalian terpadu busuk pangkal batang lada. Perspektif 8: 17-29.
26
Wahyuno D, Manohara D, Ningsih SD, Setijono RT. 2010. Pengembangan varietas unggul lada tahan penyakit busuk pangkal batang yang disebabkan oleh Phytophthora capsici. Jurnal Litbang Pertanian 29(3):86-95.
Wang TC. 2000. Method of assessing Phytophthora blight ( P. capsici) reaction of pepper. AVRDC Mycology: 1-2.
Wanchaitanawong P, Chaungwanit P, Poovarodom N, Nitisinprasert S. 2005. In vitro antifungal activity of Thai herbs and spice extracts against food spoilage fungi. Kasetsart Journal of Natural Science 39: 400–405.
Wetwitayakyung P, Phaechamud T, Limmatvapirat C, Keokitichai S. 2006. The study of antioxidant capacity in various parts of Areca cathecu L. Naresuan University Journal 14 (1): 1-14.
Yamamoto M, Nakatsuka S, Otani H, Kohmoto K, Nishimura S. 2000. Catechin acts an infection-inhibiting factor in strawberry leaf. Phytopathology 90(6): 595-600.
30
LAMPIRAN
28
Lampiran 1 Diameter koloni Phytophthora capsici pada perlakuan ekstrak sirih dan kapur sirih (0,01%) pada 6 hari setelah inokulasi
Lampiran 2 Diameter koloni Phytophthora capsici pada perlakuan ekstrak uji pada 6 hari setelah inokulasi
Jenis ekstrak Diameter koloni (cm)
1 2 3 4 5 6
Sirih 2,67 5,23 6,93 8,3 9 9
Kapur sirih 2,67 5,43 7,17 8,67 9 9
Jenis ekstrak Konsentrasi (%) Diameter koloni (cm)/ HSI
1 2 3 4 5 6
Pinang 0,01 1,73 4,07 5,83 6,53 7,4 7,97
0,02 1,93 4,57 6,67 7,63 8,17 8,83 0,04 1,77 4,1 4,6 5,67 6,17 6,67
Gambir 0,01 2,23 4,53 7,57 7,87 9 9
0,02 2,3 4,43 6 7,33 8,43 9 0,04 2,2 4,9 6,87 7,83 8,33 8,77 Pinang + gambir 0,005 2,17 4,37 6,43 8,13 8,87 9
0,01 2,33 4,97 6,93 8,23 8,67 9
0,02 2,37 5,13 7,27 8,67 9 9 Campuran 0,0025 2,07 4,4 6,83 7,67 8,17 8,17
0,005 2,47 4,47 5,17 5,5 5,5 5,53 0,01 2,3 4,63 6 6 6,17 6,17
29
Lampiran 3 Persentase keparahan penyakit BPB akibat perlakuan pada 11 hari setelah inokulasi
Perlakuan Konsentrasi (%)
Keparahan penyakit (%)
1 2 3 4 5 6 7 8 9 10 11
Pinang 0,04 0 0 18,75 28,75 52,5 75 98,75 100 100 100 100
Campuran 0,005
0 0 8,75 16,25 23,75 33,75 38,75 48,75 57,5 60 60
0,01
0 0 2,5 11,25 15 23,75 37,5 40 40 40 40
Fungisida 0,2
0 0 0 0 6,25 33,75 40 40 40 40 40
Kontrol 0
30
Lampiran 4 Analisis ragam pengaruh perlakuan terhadap pertumbuhan koloni
P. capsici pada 6 hari setelah inokulasi
Sumber keragaman DB JK KT F Pr > F
Jenis Ekstrak 3 70,3123611 23,4374537 413,86 <0,0001 Dosis Ekstrk 2 7,0489815 3,5244907 62,23 <0,0001 Jenis*Dosis 6 37,2191667 6,2031944 109,54 <0,0001 r(jenis*dosis) 24 5,4785185 0,2282716 4,03 <0,0001
w 5 942,0290156 188,4058031 3326,84 <0,0001
r(w) 10 0,8058879 0,0805888 1,42 0,1782
jenis*w 15 32,7001389 2,1800093 38,49 <0,0001
dosis*w 10 10,0937963 1,0093796 17,82 <0,0001
jenis*dosis*w 30 18,2225000 0,6074167 10,73 <0,0001
Model 105 1246,655010 11,032345 194,81 <0,0001
Galat 128 6,795840 0,056632
Total 233 1253,450850
Lampiran 5 Analisis ragam pengaruh perlakuan ekstrak uji terhadap persentase keparahan penyakit BPB pada 11 hari setelah inokulasi
Sumber keragaman DB JK KT F Pr > F
Perlk 4 1,46888941 0,36722235 16,41 <0,0001
r(t) 44 0,51461555 0,01169581 0,52 0,9936
perlk*t 40 0,39404315 0,00985108 0,44 0,9985
Model 88 4,55438803 0,04647335 2,08 <0,0001
Galat 186 3,93827047 0,02237654
Total 274 8,49265850