i
YULIA OKTAVIA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2014
i
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis yang berjudul Karakterisasi dan Pemurnian Enzim Selulase Kapang Endofit dari Lamun (Enhalus sp.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Insitut Pertanian Bogor.
Bogor, Agustus 2014
Yulia Oktavia
ii
RINGKASAN
YULIA OKTAVIA. Karakterisasi dan Pemurnian Enzim Selulase Kapang Endofit dari Lamun (Enhalus sp.). Dibimbing oleh TATI NURHAYATI dan KUSTIARIYAH TARMAN.
Selulase merupakan enzim ekstraseluler yang mampu mendegradasi selulosa menjadi senyawa yang lebih sederhana. Selulase terdiri atas enzim endoglukanase, eksoglukanase, dan β-glukanase. Enzim selulase selama ini dihasilkan oleh kapang yang diisolasi dari organisme dan ekosistem darat, padahal kapang yang diisolasi dari organisme laut juga memiliki potensi untuk menghasilkan selulase namun keberadaannya belum banyak dikaji. Selulase pada penelitian ini dihasilkan oleh kapang endofit yang diisolasi dari lamun (Enhalus sp.). Substrat yang digunakan yaitu limbah agar-agar. Penelitian ini bertujuan untuk menentukan waktu produksi, mengkarakterisasi dan memurnikan enzim selulase kapang endofit yang diisolasi dari lamun (Enhalus sp.).
Penelitian dilakukan dalam tiga tahap yaitu penentuan konsentrasi limbah agar-agar dan waktu inkubasi kapang penghasil selulase, karakterisasi ekstrak kasar enzim selulase, dan pemurnian enzim selulase. Parameter yang diuji yaitu
aktivitas endoglukanase, β-glukosidase, dan selulase total.
Aktivitas selulase tertinggi yaitu aktivitas endoglukanase dengan penambahan 1,5% limbah agar-agar yang diinkubasi selama sembilan hari. Selulase bekerja optimum pada pH 4 dan suhu 60 oC dengan substrat CMC. Perhitungan kinetika enzim menunjukkan nilai Km enzim endoglukanase sebesar 0,244% dengan Vmaks 0,052 U/mL. Ion logam Hg2+ dengan konsentrasi 5 mM menghambat aktivitas enzim endoglukanase hingga 74%. Pengendapan untuk mendapatkan aktivitas spesifik tertinggi yaitu penambahan aseton dengan kejenuhan 10%. Pemurnian dilakukan menggunakan kromatografi filtrasi gel Sephadex G-100. Hasil penentuan bobot molekul enzim endoglukanase diperoleh empat bobot molekul yaitu 217,96 kDa, 163,15 kDa, 129,41 kDa, dan 76,84 kDa. Kelipatan pemurnian enzim endoglukanase setelah pemurnian meningkat 17,571 kali
iii
SUMMARY
YULIA OKTAVIA. Characterization and purification of cellulase isolated from seagrass (Enhalus sp.) endophytic fungus. Supervised by TATI NURHAYATI and KUSTIARIYAH TARMAN.
Cellulase is an extracellular enzyme that can degrading cellulose into simple compound. Cellulase consist of endoglucanase, exoglucanase, and β-glucanase. Cellulase is commonly produced by fungi that isolated from organisms and terrestrial ecology, while the fungi isolated from marine organisms also have the potential to produce cellulase but the study still less. In this research cellulase was produced by endophytic fungi that isolated from seagrass (Enhalus sp.). The substrates used to produce this enzyme was waste of agar industry. The objectives of this reseach were to determine the period of cellulase production, characterize and purify the fungal cellulase.
The research was conducted in three steps including determining the concentration of agar waste and incubation period of fungi to produce cellulase, characterization of the crude extract of cellulase, and purification of cellulase. Parameters of assay were endoglucanase, β-glucosidase, and cellulase total activity.
The highest cellulase activity was represented as endoglucanase activity by the addition of 1.5% waste of agar industry incubated for nine days. Cellulase works optimally at pH 4 on 60 °C with 1% of CMC substrate. Determination of enzyme kinetics showed Km value of endoglucanse obtained for 0.244% with Vmax value 0.052 U/mL. Ion Hg2+ 5 mM inhibited endoglucanase activity to 74%. The best precipitation to obtain the highest specific activity by addition aceton on 10% saturated. Purification was done by gel filtration chromatography Sephadex G-100 The results of the determination the molecular weights endoglucanase obtained four molecular weights namely 217.96 kDa, 163.15 kDa, 129.41 kDa, and 76.84 kDa. Purify of endoglucanase increase to 17,571 fold.
iv
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
v
KARAKTERISASI DAN PEMURNIAN ENZIM SELULASE
KAPANG ENDOFIT DARI LAMUN (
Enhalus
sp.)
YULIA OKTAVIA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
vi
vii
Judul Tesis : Karakterisasi dan Pemurnian Enzim Selulase Kapang Endofit dari Lamun (Enhalus sp.)
Nama : Yulia Oktavia
NIM : C351110191
Program Studi : Teknologi Hasil Perairan
Disetujui
Komisi Pembimbing
Dr Tati Nurhayati SPi, MSi Dr Kustiariyah Tarman, SPi, MSi
Ketua Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Hasil Perairan
Dr Tati Nurhayati SPi, MSi Dr Ir Dahrul Syah, MScAgr
viii
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala rahmat dan karunia-Nya penulis dapat menyelesaikan tesis dengan judul "Karakterisasi dan Pemurnian Enzim Selulase Kapang Endofit dari Lamun (Enhalus sp.)". Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam menyelesaikan tesis ini, terutama kepada:
1. Dr Tati Nurhayati, SPi, MSi dan Dr Kustiariyah Tarman, SPi, MSi sebagai dosen pembimbing tesis yang telah senantiasa memberikan arahan dan bimbingan selama menyelesaikan tesis ini.
2. Bapak yang saya banggakan M. Yusuf AR, ibu yang saya cintai Sri Dahlia,
kakak-kakak yang saya sayangi Layli Diana, Agus Karsa Yudha, dan M. Adityawarman.
3. Keluarga besar mahasiswa sekolah pascasarjana program studi Teknologi Hasil Perairan, yang telah memberikan dorongan semangat baik selama penelitian maupun saat penyusunan tesis ini.
4. Teman-teman dan semua pihak yang tidak bisa disebutkan satu persatu.
5. Direktorat Jenderal Pendidikan Tinggi, Kementerian Pendidikan dan Kebudayaan Republik Indonesia yang telah membiayai penelitian ini melalui Program Penelitian Unggulan Perguruan Tinggi atas nama Ketua Peneliti Dr Kustiariyah Tarman, SPi, MSi dengan judul "Pengembangan Teknologi Produksi Bioetanol melalui Pemanfaatan Limbah Industri Rumput Laut dengan Kapang Endofit Indigenous Laut Indonesia" (No. 58/IT3.41.2/L1/SPK/2013).
Penulis menyadari bahwa masih terdapat kekurangan dalam penyusunan tesis ini. Penulis sangat mengharapkan kritik dan saran yang membangun. Semoga tulisan ini bermanfaat bagi pihak-pihak yang memerlukan.
Bogor, Agustus 2014
ix
Penentuan Konsentrasi Limbah Agar-agar dan Waktu Inkubasi Kapang
Penghasil Selulase 5
Karakterisasi Enzim Selulase 5
Pemurnian Enzim 6
Analisis 6
Pengujian Gula Pereduksi Metode DNS 6
Pengujian Konsentrasi Protein 6
Aktivitas Endoglukanase 7
Aktivitas β-glukosidase 8
Aktivitas Selulase Total 8
Pengukuran Bobot Molekul Enzim dan Zimogram 8
3 HASIL DAN PEMBAHASAN 9
Karakteristik Limbah Agar-agar 9
Pertumbuhan Isolat Kapang EN 10
Konsentrasi Limbah Agar-agar dan Waktu Produksi 11
Karakteristik Ekstrak Kasar Enzim Selulase 14
Nilai pH Optimum Enzim Endoglukanase 14
Suhu Optimum Enzim Endoglukanase 15
Berat Molekul Enzim dan Aktivitasnya 20
x
DAFTAR TABEL
Halaman
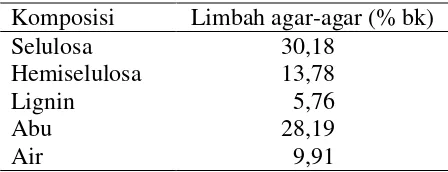
1 Komposisi kimia limbah agar-agar kertas 9
2 Perbandingan selulase isolat kapang EN dengan kapang jenis lainnya 13
3 Kelipatan pemurnian enzim selulase 19
DAFTAR GAMBAR
Halaman
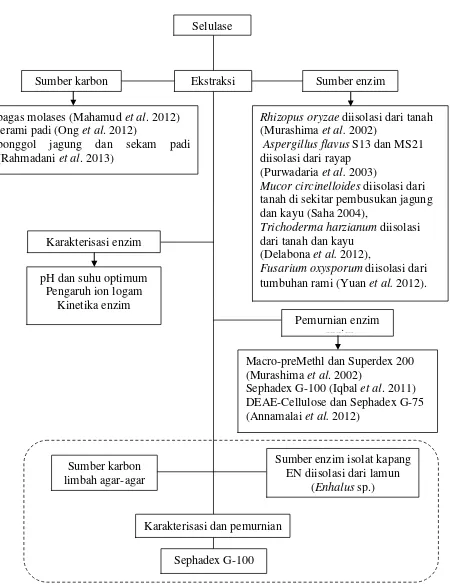
1 Roadmap penelitian enzim selulase ... 3
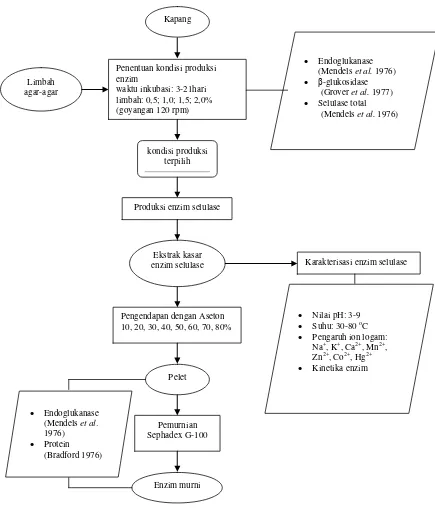
2 Diagram alir penelitian ... 7
3 Kurva pertumbuhan isolat kapang EN pada media PDB ... 10
4 Aktivitas endoglukanase pada beberapa konsentrasi limbah agar-agar terhadap lama waktu produksi ... 11
5 Aktivitas β-glukosidase pada beberapa konsentrasi limbah agar agar kertas terhadap lama waktu produksi ... 12
6 Aktivitas selulase total pada beberapa konsentrasi limbah agar-agar kertas terhadap lama waktu produksi ... 12
7 Pengaruh pH terhadap aktivitas endoglukanase ... 14
8 Pengaruh suhu terhadap aktivitas endoglukanase ... 15
9 Pengaruh konsentrasi substrat terhadap aktivitas enzim endoglukanase... 16
10 Kurva Lineaweaver-Burk endoglukanase pada penentuan Km dan Vmaks ... 16
11 Pengaruh ion logam terhadap aktivitas enzim endoglukanase ... 17
12 Pengaruh kejenuhan aseton terhadap aktivitas endoglukanase ... 18
13 Fraksi-fraksi hasil pemurnian filtrasi gel ... 19
14 Elektroforegram (a) dan zimogram (b) fraksi kromatografi filtrasi gel ... 21
DAFTAR LAMPIRAN Halaman 1 Komposisi media produksi enzim ... 26
1
1 PENDAHULUAN
Latar Belakang
Enzim selulase merupakan nama trivial kelompok enzim yang mampu mengkatalis reaksi hidrolisis selulosa dan turunan selulosa lainnya yang menghasilkan selooligosakarida (Shallom et al. 2003). Enzim ekstraseluler ini terdiri atas kompleks endo-β-1,4-glukanase (CMCase, Cx selulase endoselulase, atau carboxymethyl cellulase), kompleks ekso-β-1,4-glukanase (aviselase,
selobiohidrolase, C1 selulase), dan β-1,4-glukosidase atau selobiase yang mampu memutus ikatan β-1,4 glikosidik (Zhou et al. 2008). Enzim selulase banyak diaplikasikan pada industri pakan ternak, makanan, pertanian, tekstil, deterjen pencuci, dan industri kertas (Sukumaran et al. 2005). Menurut Mukhejee et al. (2011), enzim selulase tidak hanya diaplikasikan pada berbagai industri tetapi juga berperan penting dalam biokonversi biomassa tinggi selulosa menjadi gula dan bioalkohol.
Beberapa penelitian telah banyak mengkaji produksi selulase baik yang diisolasi dari makroorganisme maupun mikroorganisme. Menurut Meryandini et al. (2009), kapang mampu menghasilkan enzim selulase. Onofre et al. (2013) menyatakan bahwa kapang filamentous merupakan jenis kapang yang paling banyak digunakan dalam industri untuk menghasilkan enzim selulase. Selama ini kapang yang memproduksi enzim selulase merupakan kapang yang diisolasi dari ekologi dan biota darat. Contohnya Rhizopus oryzae yang diisolasi dari tanah di Jepang (Murashima et al. 2002), Aspergillus flavus S13 dan MS21 yang diisolasi dari rayap (Purwadaria et al. 2003), Mucor circinelloides yang diisolasi dari tanah di sekitar pembusukan jagung dan kayu (Saha 2004), Trichoderma harzianum yang diisolasi dari hutan hujan tropis Amazon (Delabona et al. 2012), dan Fusarium oxysporum yang diisolasi dari tumbuhan rami yang layu (Yuan et al. 2012).
Kapang yang diisolasi dari biota laut juga memiliki potensi untuk menghasilkan enzim selulase. Kapang yang diisolasi dari biota laut biasanya berupa kapang endofit yaitu jenis kapang yang tumbuh di dalam tanaman inangnya tanpa menyebabkan gejala penyakit terhadap inang dan pertumbuhannya di habitat melibatkan interaksi yang berjalan terus-menerus antara metabolisme kapang dan inangnya (Schulz et al. 2002). Enzim selulase kapang endofit yang diisolasi dari organisme laut keberadaannya belum banyak dikaji lebih lanjut. Berdasarkan penelitian sebelumnya mengenai screening kapang laut endofit peghasil enzim selulase, isolat kapang EN yang diisolasi dari lamun Enhalus sp. memiliki indeks selulolitik tertinggi dengan nilai 1,36 dibandingkan dengan isolat kapang yang diisolasi dari rumput laut, daun mangrove, lamun, dan spons (Andhikawati et al. 2014).
2
sehingga dibutuhkan substrat lain yang rendah kandungan ligninnya. Substrat lain yang rendah kandungan lignin yaitu limbah industri rumput laut.
Industri pengolahan berbasis rumput laut akan menghasilkan limbah padat sebanyak 65-75% (Kim et al. 2007). Limbah tersebut diperoleh dari hasil produksi agar, karagenan, dan alginat. Limbah rumput laut mengandung selulosa yang tinggi. Selulosa yang terkandung pada limbah pengolahan agar-agar sekitar 27,38-39,45% (Fithriani et al. 2007), sedangkan limbah pengolahan alginat mengandung selulosa sebesar 30,27% (Sari et al. 2008). Limbah hasil pengolahan di beberapa industri pengolahan rumput laut belum dimanfaatkan dan dapat menyebabkan pencemaran, padahal limbah tersebut dapat dimanfaatkan sebagai substrat penghasil enzim selulase dan diaplikasikan untuk mendegradasi selulosa limbah menghasilkan selooligosakarida yang bisa dimanfaatkan untuk pembuatan bioetanol.
Perumusan Masalah
Biomassa dengan kandungan selulosa tinggi yang banyak terdapat di alam menuntut adanya suatu agen yang mampu mendegradasinya menjadi bentuk lebih sederhana. Limbah rumput laut merupakan salah satu biomassa yang tinggi kandungan selulosa. Agen yang mampu mendegradasi selulosa yaitu mikroorganisme. Mikroorganisme pendegradasi biomassa yang kaya selulosa masih banyak didominasi oleh jenis kapang selulolitik yang diisolasi dari biota daratan, padahal kapang laut juga mempunyai potensi yang tidak kalah dengan kapang darat dalam menghasilkan enzim selulase. Eksplorasi mengenai enzim selulase yang dihasilkan kapang laut masih sedikit sehingga membuat kapang laut belum dikenal banyak orang. Oleh karena itu, informasi mengenai enzim selulase yang dihasilkan kapang laut sangat diperlukan.
Tujuan
3
Gambar 1 Roadmap penelitian enzim selulase; penelitian yang dilakukan Selulase
Sumber karbon Ekstraksi Sumber enzim
pH dan suhu optimum Pengaruh ion logam
Kinetika enzim Karakterisasi enzim
Pemurnian enzim enzim bagas molases (Mahamud et al. 2012)
jerami padi (Ong et al. 2012)
bonggol jagung dan sekam padi (Rahmadani et al. 2013)
Rhizopus oryzae diisolasi dari tanah (Murashima et al. 2002)
Aspergillus flavus S13 dan MS21 diisolasi dari rayap
(Purwadaria et al. 2003)
Mucor circinelloides diisolasi dari tanah di sekitar pembusukan jagung dan kayu (Saha 2004),
Trichoderma harzianum diisolasi dari tanah dan kayu
(Delabona et al. 2012),
Fusarium oxysporum diisolasi dari tumbuhan rami (Yuan et al. 2012).
Macro-preMethl dan Superdex 200 (Murashima et al. 2002)
Sephadex G-100 (Iqbal et al. 2011) DEAE-Cellulose dan Sephadex G-75 (Annamalai et al. 2012)
Sumber karbon limbah agar-agar
Sumber enzim isolat kapang EN diisolasi dari lamun
(Enhalus sp.)
Karakterisasi dan pemurnian
4
2 METODE
Waktu dan Tempat
Penelitian dilaksanakan mulai bulan November 2012 hingga Maret 2014 bertempat di Laboratorium Mikrobiologi Hasil Perairan dan Laboratorium Bioteknologi II, Departemen Teknologi Hasil Perairan Fakultas Perikanan dan Ilmu Kelautan. Laboratorium Pendidikan dan Layanan Fakultas Kedokteran Hewan dan Laboratorium Biokimia dan Mikrobiologi Pusat Penelitian Sumberdaya Hayati dan Bioteknologi Institut Pertanian Bogor.
Bahan dan Alat
Bahan yang digunakan pada penelitian ini meliputi kapang endofit EN yang diisolasi dari lamun Enhalus sp. yang diperoleh dari perairan Pulau Karya, Kepulauan Seribu, limbah agar-agar kertas yang diperoleh dari Pameungpeuk Garut, Jawa Barat, media Potato Dextrose Agar (PDA) (Difco), Potato Dextrose Broth (PDB) (Difco). Medium yang digunakan untuk produksi enzim selulase terdiri atas KH2PO4 (Merck), urea (Merck), MgSO4.7H2O (Merck), CaCl2.2H2O (Merck), FeSO4.7H2O (Merck), MnSO4.H2O (Merck), ZnSO4.7H2O (Merck), CoCl2.6H2O (Merck), Pepton (Oxoid), tween 80 (Merck).
Bahan-bahan yang digunakan untuk pemurnian selulase yaitu aseton, Sephadex G-100 dan bufer sitrat. Bahan kimia untuk analisis aktivitas selulase, konsentrasi protein dan gula pereduksi meliputi pNPG (Sigma Aldrich), Na2CO3 (Merck), kertas saring (Whatman no 1), Pereaksi Bradford, DNS (Sigma Aldrich), NaOH ((Merck), Na K Tartat (Merck), Fenol (Merck), Na2SO4 (Merck) dan glukosa (Merck). Logam-logam yang digunakan untuk karakterisasi enzim selulase adalah NaCl, KCl, HgCl2, CaCl2, ZnCl2, CoCl2. Pereaksi yang digunakan untuk analisis aktivitas selulase disajikan pada Lampiran 2.
Alat-alat yang digunakan meliputi spektrofotometer UV-VIS, sentrifuse
(Himac CR21G), mikropipet (Gibson), rotary shaker (Wishake), clean bench
(Thermo scientific), alat-alat gelas, seperangkat alat elektroforesis, pisau dan gunting bedah, pH-meter (Thermo), waterbath inkubator (Yamato BT25).
Prosedur Kerja
Penelitian ini terdiri dari tiga tahap. Tahap pertama yaitu penentuan konsentrasi limbah agar-agar dan waktu inkubasi kapang penghasil selulase. Tahap
5
Penentuan Konsentrasi Limbah Agar-agar dan Waktu Inkubasi Kapang Penghasil Selulase
Kapang yang ditumbuhkan pada media PDB diinkubasi selama 7 hari pada suhu kamar dengan goyangan 120 rpm, kemudian dipindahkan ke labu Erlenmeyer 500 mL yang berisi 200 mL media produksi enzim (Muthuvelayudham dan Viruthagiri 2006) (Lampiran 1) dengan sumber karbon yaitu limbah agar-agar dalam beberapa konsentrasi (0,5; 1,0; 1,5; 2,0%) yang diinkubasi dengan goyangan 120 rpm selama 3-21 hari pada suhu kamar. Supernatan sebagai enzim kasar diperoleh dengan cara sentrifugasi pada 5000 g selama 20 menit pada suhu 4 oC (Tang et al. 2012). Aktivitas selulase total diukur menurut metode Mandels et al. (1976), endoglukanase (Mandels et al. 1976), dan β-glukosidase diukur menurut metode Grover et al. (1977). Pengukuran aktivitas enzim dimulai pada hari ketiga dengan interval pengamatan setiap tiga hari. Konsentrasi sumber karbon dan waktu inkubasi yang dapat menghasilkan aktivitas optimum dipakai untuk tahap penelitian selanjutnya.
Karakterisasi Enzim Selulase
Karakterisasi enzim selulase dilakukan untuk mengetahui pH optimum, suhu optimum, konsentrasi optimum substrat, kinetika enzim, dan pengaruh beberapa logam terhadap aktivitas kerja enzim.
Penentuan pH Optimum
Nilai pH optimum enzim selulase ditentukan dengan metode Lee et al. (2007). Sebanyak 0,5 mL enzim ditambahkan 0,5 mL CMC 1% (b/v) dalam sediaan 50 mM bufer sitrat (pH 3,0-6,0) dan Tris-HCl (pH 7,0-9,0). Campuran dalam pH bufer yang beragam diinkubasi pada suhu 50 oC selama 30 menit dan aktivitas selulase diuji dengan metode DNS.
Penentuan Suhu Optimum
Suhu optimum enzim untuk menghidrolisis CMC dalam 50 mM bufer pH optimum diukur dengan menggunakan metode Lee et al. (2007). Campuran enzim dan CMC 1% diinkubasi selama 30 menit dengan perbedaan suhu (30-80 oC). Larutan DNS ditambahkan untuk menghentikan reaksi.
Kinetika Enzim
Kinetika enzim ditentukan menggunakan CMC dengan konsentrasi yang berbeda yaitu: 0,25; 0,5; 0,75; 1,0; 1,25%. Sebanyak 0,5 mL enzim dan 0,5 mL substrat dalam 50 mM bufer pH optimum diinkubasi selama 30 menit pada suhu optimum. Jumlah gula pereduksi yang dihasilkan diukur dengan metode DNS. Satu unit didefinisikan sebagai jumlah enzim yang dibutuhkan untuk melepaskan 1 µmol glukosa per menit. Konstanta Michaelis-Menten (Km) dan kecepatan maksimum (Vmaks) ditentukan dengan plot Lineweaver-Burk.
Pengaruh Ion Logam terhadap Aktivitas Selulase (Lee et al. 2007)
6
sitrat (pH optimum). Campuran dengan berbagai bahan aditif diinkubasi pada suhu dan pH optimum selama 30 menit.
Pemurnian Enzim
Pemurnian dilakukan untuk menghilangkan pengotor sehingga diperoleh enzim yang lebih murni dengan aktivitas spesifik yang lebih tinggi. Pemurnian selulase diawali dengan mengendapkan ekstrak kasar menggunakan aseton dingin (-20 oC) 10, 20, 30, 40, 50, 60, 70, dan 80% berdasarkan Scopes (1994). Pengendapan dilakukan dengan menambahkan aseton ke dalam ekstrak kasar dan diaduk selama 15 menit kemudian didiamkan selama semalam pada suhu 4 oC. Pemisahan pelet dilakukan dengan sentrifugasi pada 13000 g selama 10 menit pada suhu 4 oC. Pelet dilarutkan dalam bufer sitrat 50 mM pH optimum. Enzim tersebut dimurnikan kembali dengan mengacu pada metode Adekele et al. (2012). Enzim dimurnikan dengan kromatografi filtrasi gel dengan matriks Sephadex G-100. Fraksi yang dihasilkan diukur aktivitas dan kadar proteinnya.
Penentuan Berat Molekul dan Aktivitas Enzim
Ekstrak kasar, hasil pengendapan, dan fraksi filtrasi gel diuji menggunakan elektroforesis untuk mendapatkan elektroforegram dan zimogram guna menentukan berat molekul enzim selulase dan aktivitas selulolitiknya. Penentuan bobot molekul dilakukan berdasarkan metode Adeleke et al. (2012) dan zimogram berdasarkan metode Van Dyk et al. (2010).
Analisis
Pengujian Gula Pereduksi Metode DNS
Penentuan gula pereduksi dilakukan dengan cara spektrofotometri menggunakan pereaksi DNS dan gula standar glukosa (Miller 1960). 0,5 mL larutan gula standar dan 0,5 mL bufer direaksikan dengan 1,5 mL pereaksi DNS kemudian dipanaskan dalam air mendidih selama 5 menit lalu didinginkan hingga suhu kamar. Setelah dingin dibaca pada spektrofotometer pada panjang gelombang 550 nm. Cara yang sama dilakukan terhadap sampel sebanyak 0,5 mL. Persamaan reaksi dari larutan standar glukosa dibuat berdasarkan nilai absorbansinya terhadap konsentrasi glukosa. Kadar glukosa sampel didapat dengan cara memasukkan nilai absorbansinya ke persamaan regresi yang didapatkan.
Pengujian Konsentrasi Protein (Bradford 1976)
Persiapan pereaksi Bradford dilakukan dengan cara melarutkan 25 mg
coomassie brilliant blue G-250 dalam 12,5 mL etanol 95%, lalu ditambahkan dengan 25 mL asam fosfat 85% (b/v). Akuades ditambahkan hingga 0,5 liter jika telah larut sempurna dan disaring dengan kertas saring Whatman 1 sesaat sebelum digunakan.
7
larutan stok BSA konsentrasi 2 mg/mL. Nilai absorbansi yang didapat kemudian dimasukkan ke dalam kurva standar bradford untuk menentukan konsentrasi protein yang terkandung dalam sampel.
Gambar 2 Diagram alir penelitian
Aktivitas Endoglukanase (Mandels et al. 1976)
Penentuan aktivitas endoglukanase dilakukan menurut metode Mandels et al. (1976). Sebanyak 0,5 mL larutan enzim dan 0,5 mL larutan CMC 1% dalam bufer diinkubasi pada suhu 50 oC selama 30 menit. Untuk menghentikan reaksi
enzim selulase Karakterisasi enzim selulase
8
ditambahkan pereaksi DNS sebanyak 1,5 ml, dan dipanaskan dalam air mendidih selama 5 menit. Perhitungan untuk mendapatkan aktivitas enzim endoglukanase dibuat berdasarkan 1 µmol glukosa = 0,18 mg dan 1 unit aktivitas endoglukanase adalah 1 µmol glukosa yang dihasilkan per menit. Apabila lama inkubasi dilakukan selama 30 menit maka 1 mg glukosa yang dihasilkan per mL =
1
Satu unit endoglukanase (U/mL) = mg glukosa × 0,185 mL
Aktivitas β-glukosidase (Grover et al. 1977)
Aktivitas β-glukosidase diukur dengan menggunakan p-NPG sebagai substrat. Penentuan aktivitas enzim dilakukan sebagai berikut: 0,5 mL substrat p-NPG 20 mM dicampurkan dengan 1 mL bufer sitrat 50 mM pH 5 kemudian diinkubasi pada suhu 30 oC selama 5 menit. Sebanyak 0,5 mL enzim ditambahkan dan diinkubasi selama 15 menit. Reaksi dihentikan dengan menambahkan 2 mL Na2CO3 0,2 M. Absorbansi diukur pada panjang gelombang 400 nm. Aktivitas enzim β-glukosidase dihitung menurut persamaan:
Aktivitas β-glukosidase (U/mL) = (As-Ao) × 4 (mL) × fp 18,1 × 0,5 (mL) × 15(menit)
Aktivitas Selulase Total (Mandels et al. 1976)
Pereaksi yang dibutuhkan untuk pengujian ini sama dengan yang digunakan pada pengujian endoglukanase. Hanya pada pengujian aktivitas selulase total digunakan kertas saring Whatman no 1 ukuran 1 x 6 cm (50 mg) sebagai substrat. Penentuan nilai aktivitas enzim dilakukan sebagai berikut: filtrat enzim sebanyak 0,5 mL dan larutan bufer sebanyak 1,0 mL beserta kertas saring diinkubasi selama satu jam pada suhu 50 oC. Reaksi dihentikan dengan menambahkan 3 mL pereaksi DNS dan dipanaskan dalam air mendidih selama 5 menit. Penentuan gula pereduksi apabila diinkubasi selama satu jam, maka 1 mg glukosa yang dihasilkan per mL filtrat = 1
60×0,18 = 0,0925 unit, sehingga:
Satu unit selulase total (IU/mL) = mg glukosa ×0,0925
mL
Pengukuran Bobot Molekul Enzim (Adeleke et al. 2012) dan Zimogram (Van Dyk et al. 2010)
Metode SDS-PAGE yang dikerjakan dalam penelitian ini menggunakan 4%
stacking gel dan 8% gel akrilamid. Pewarnaan yang dilakukan adalah Silver staining. Deteksi SDS-PAGE dilakukan dengan melepaskan gel hasil elektroforesis dari cetakan dan diukur jarak migrasi bromphenol blue.
9
congo red selama 30 menit, selanjutnya direndam dengan 1 M NaCl selama 15 menit (perendaman dilakukan sebanyak 3 kali). Aktivitas selulase terlihat berupa zona bening. Zona bening diukur di sekitar pita yang terbentuk dibandingkan dengan penanda berat molekul sehingga dapat diketahui berat molekul enzim selulase yang dapat menghidrolisis substrat CMC pada gel akrilamid.
3 HASIL DAN PEMBAHASAN
Karakteristik Limbah Agar-agar
Limbah agar-agar kertas digunakan sebagai sumber karbon untuk memproduksi enzim selulase. Limbah hasil pengolahan ini terlebih dahulu dikeringkan kemudian dihaluskan menggunakan hammer mill dan disk mill,
selanjutnya diayak dengan menggunakan ayakan 100 mesh. Pengecilan ukuran partikel limbah ini diharapkan untuk memperluas permukaan sehingga mempermudah kapang dalam memanfaatkan limbah ini sebagai sumber karbon dalam menghasilkan enzim. Hasil analisis komposisi kimia limbah agar-agar kertas setelah dikeringkan dapat dilihat pada Tabel 1.
Tabel 1 Komposisi kimia limbah agar-agar kertas
Komposisi Limbah agar-agar (% bk) Selulosa
Hasil analisis kimia limbah agar-agar kertas menunjukkan bahwa kandungan selulosa limbah tinggi dan lignin yang rendah sehingga limbah agar-agar ini berpotensi sebagai substrat yang digunakan mikroorganisme untuk menghasilkan enzim selulase. Limbah agar-agar merupakan biomassa yang tidak hanya mengandung selulosa murni tetapi juga mengandung hemiselulosa dan lignin membentuk lignoselulosa. Menurut Rahmadani et al. (2013), Limbah cenderung berupa selulosa amorf, umumnya selulase lebih mudah menghidrolisis bagian amorf selulosa dibandingkan bagian kristalin.
10
Pertumbuhan Isolat Kapang EN
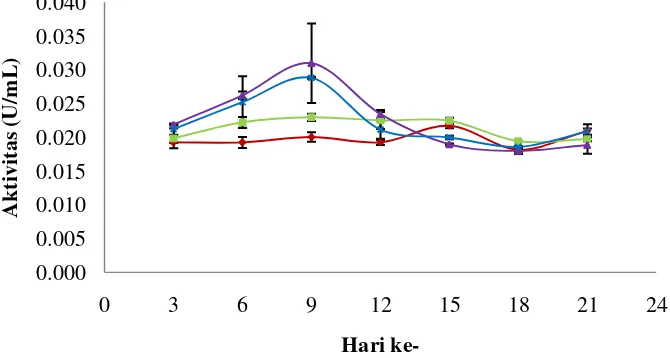
Kapang mempunyai masa pertumbuhan yang bervariasi dengan beberapa fase pertumbuhan sesuai aktivitas metabolismenya. Aktivitas metabolisme akan menurun setelah kapang melewati fase puncak pertumbuhannya. Kurva pertumbuhan kapang diperoleh dengan mengukur biomassa kering kapang dalam waktu tertentu pada media PDB. Fase-fase pertumbuhan tersebut sangat berpengaruh terhadap enzim yang dihasilkan oleh kapang. Enzim yang dihasilkan berfungsi untuk membantu dalam menguraikan makanan menjadi lebih sederhana yang kemudian dimanfaatkan untuk pertumbuhan dan perbanyakan sel pada fase eksponensial. Iqbal et al. (2011) menyatakan bahwa enzim selulase yang dihasilkan oleh kapang filamentous digunakan untuk melakukan aktivitas selulolitik yang diperlukan untuk pertumbuhan. Kurva pertumbuhan isolat kapang EN dapat dilihat pada Gambar 3.
Gambar 3 Kurva pertumbuhan isolat kapang EN pada media PDB
Berdasarkan Gambar 3 dapat dilihat bahwa fase lag kapang terjadi hingga hari ke-3. Kapang memproduksi enzim yang berfungsi untuk mendegradasi substrat yang ada di lingkungannya pada fase lag. Fase eksponensial merupakan fase percepatan pertumbuhan. Fase eksponensial kapang EN terjadi pada hari ke-3 hingga hari ke-12. Pemanenan enzim dapat dilakukan pada fase eksponensial pada pola kurva pertumbuhannya (Gandjar et al. 2006). Fase stasioner terjadi mulai pada hari ke-12. Pada fase stasioner, jumlah sel yang hidup sama dengan jumlah sel yang mati, pada fase ini pula metabolit sekunder diproduksi. Berdasarkan kurva pertumbuhan tersebut diduga waktu yang tepat untuk mengekstrak enzim selulase terjadi pada fase eksponensial yaitu hari ke-3 hingga hari ke-12.
Hasil penelitian yang dilakukan oleh Bhat dan Maheshwari (1987) menyatakan bahwa fase eksponensial kapang Trichoderma reesei terjadi mulai hari ke-2 hingga hari ke-4. Fase stasioner terjadi mulai pada hari ke-4. Sporotrichum thermophile tidak mengalami fase lag dan fase stasioner terjadi pada hari ke-2.
Trichoderma reesei dan Sporotrichum thermophile memiliki fase pertumbuhan yang lebih cepat dibandingkan dengan isolat kapang EN. Hal ini disebabkan oleh sumber karbon yang digunakan lebih sederhana yaitu glukosa.
11
Konsentrasi Limbah Agar-agar dan Waktu Produksi Enzim Selulase
Penentuan konsentrasi limbah agar-agar dan waktu inkubasi dilakukan untuk mengetahui konsentrasi dan waktu inkubasi yang tepat untuk menghasilkan enzim selulase dengan aktivitas tertinggi. Aktivitas selulase ditentukan dengan mengukur aktivitas enzim penyusun selulase yaitu endoglukanase, β-glukosidase, dan selulase total. Da silva et al. (2005) menyatakan bahwa sistem pemecahan selulosa menjadi glukosa terdiri dari tiga jenis enzim penyusun selulase yaitu endo-β-1,4-glukanase, ekso-β-1,4-glukanase, dan β-glukosidase. Pengaruh konsentrasi limbah agar-agar kertas dan lama waktu inkubasi terhadap aktivitas endoglukanase, β-glukosidase dan selulase total yang dihasilkan dari kapang isolat EN dapat dilihat pada Gambar 4, 5, dan 6. Aktivitas enzim endoglukanase mewakili aktivitas pemecahan ikatan glikosidik secara acak terhadap selulosa. Enzim β-glukosidase menunjukkan aktivitas pemecahan yang menghasilkan glukosa sedangkan selulase total diukur untuk melihat kerja sinergis beberapa enzim penyusun selulase dalam menghasilkan glukosa (Deswal et al. 2011).
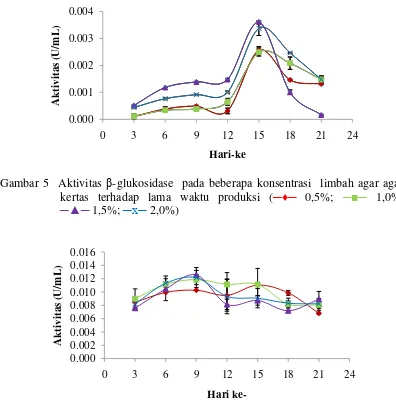
Gambar 4 Aktivitas endoglukanase pada beberapa konsentrasi limbah agar-agar terhadap lama waktu produksi (─♦─ 0,5%; ─■─ 1,0%; ─▲─ 1,5%; ─x─ 2,0%)
Aktivitas endoglukanase diuji menggunakan substrat CMC. Enzim endoglukanase merupakan komponen enzim penyusun selulase yang pertama kali bekerja untuk memecah selulosa rantai panjang. Menurut Jahangeer et al. (2005), enzim endoglukanase aktif bekerja pada daerah amorf selulosa dan menghasilkan selooligosakarida. Aktivitas endoglukanase akan meningkat dengan semakin panjangnya rantai selulosa yang akan dihidrolisis. Gambar 4 memperlihatkan aktivitas tertinggi enzim endoglukanase yaitu 0,031 U/mL terjadi pada penambahan limbah agar-agar 1,5% dengan lama waktu inkubasi sembilan hari. Aktivitas endoglukanase terus meningkat seiring semakin lamanya waktu inkubasi, namun aktivitas menurun setelah diinkubasi melebihi waktu optimumnya. Penurunan aktivitas endoglukanase pada hari ke-12 diduga rantai panjang selulosa limbah agar-agar telah terpotong menjadi rantai selulosa yang lebih pendek dengan derajat
12
polimerisasi yang lebih rendah sedangkan enzim endoglukanase hanya aktif bekerja pada selulase rantai panjang dengan derajat polimerisasi tinggi.
Gambar 5 Aktivitas β-glukosidase pada beberapa konsentrasi limbah agar agar kertas terhadap lama waktu produksi (─♦─ 0,5%; ─■─ 1,0%;
─▲─ 1,5%; ─x─ 2,0%)
Gambar 6 Aktivitas selulase total pada beberapa konsentrasi limbah agar-agar kertas terhadap lama waktu produksi (─♦─ 0,5%; ─■─ 1,0%;
─▲─ 1,5%; ─x─ 2,0%)
Aktivitas β-glukosidase diuji dengan menggunakan substrat p-NPG. Enzim
β-glukosidase akan bekerja optimum setelah enzim-enzim penyusun selulase lainnya bekerja dan menghasilkan komponen selulosa yang sederhana misalnya selobiosa. Lee et al. (2008) menyatakan bahwa β-glukosidase hanya akan bekerja memecah selobiosa untuk menghasilkan glukosa. Gambar 5 memperlihatkan bahwa aktivitas enzim β-glukosidase tertinggi (0,0036 U/mL) terdapat pada penambahan limbah agar-agar 1,5% dengan lama waktu inkubasi lima belas hari. Aktivitas β -glukosidase tertinggi terjadi pada inkubasi selama 15 hari diduga selobiosa yang dihasilkan oleh enzim penyusun selulase lainnya telah terakumulasi sehingga enzim
β-glukosidase bekerja lebih aktif pada hari ke-15. Oleh sebab itulah pada inkubasi sebelum 15 hari aktivitas β-glukosidase rendah.
13
Pengukuran aktivitas selulase total dilakukan untuk mengukur aktivitas campuran beberapa enzim penyusun selulase dalam menghidrolisis bahan yang mengandung selulosa dan menghasilkan glukosa sebagai produk akhir. Penentuan aktivitas enzim selulase total dilakukan dengan menggunakan kertas saring Whatman no 1 sebagai substrat dalam pengujiannya. Aktivitas selulase total menggambarkan pengaruh sinergis enzim endoglukanase, eksoglukanase, dan
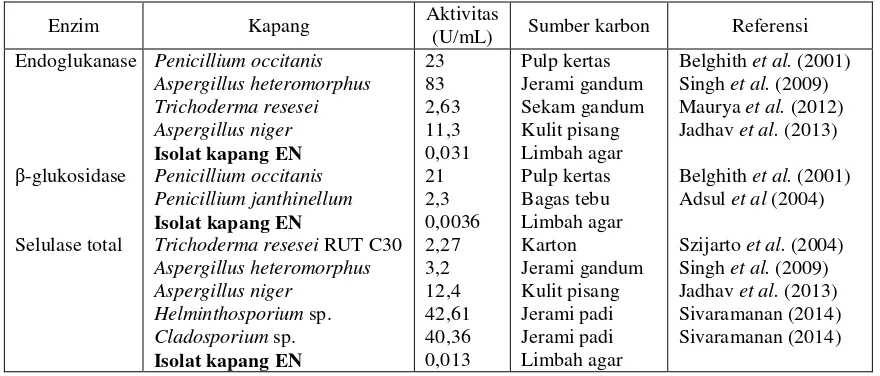
β-glukosidase. Gambar 6 memperlihatkan aktivitas enzim selulase tertinggi yaitu 0,013 U/mL terdapat pada penambahan limbah agar-agar 1,5% dengan lama inkubasi sembilan hari. Aktivitas mengalami kenaikan hingga hari ke-9 dan mengalami penurunan setelah inkubasi melebihi hari ke-9. Aktivitas selulase total yang dihasilkan masih rendah dikarenakan substrat yang digunakan merupakan selulosa tidak larut sehingga diperlukan waktu reaksi yang lebih lama agar enzim dapat berdifusi ke dalam serat selulosa. Aktivitas enzim selulase yang dihasilkan oleh beberapa jenis kapang disajikan pada Tabel 2.
Tabel 2 Perbandingan selulase isolat kapang EN dengan kapang jenis lainnya
Enzim Kapang Aktivitas
(U/mL) Sumber karbon Referensi Endoglukanase
Aktivitas endoglukanase, β-glukosidase, dan selulase total yang dihasilkan oleh isolat kapang EN masih sangat rendah dibandingkan dengan aktivitas enzim yang dihasilkan oleh kapang jenis lain (Tabel 2). Beberapa perlakuan dapat digunakan untuk meningkatkan aktivitas selulase kapang EN. Peningkatan aktivitas selulase yang telah dilakukan pada beberapa mikroorganisme antara lain: mengoptimasi sumber nutrisi kapang berupa sumber karbon dan sumber nitrogen dalam memproduksi selulase Fomitopsis sp. (Deswal et al. 2011) dan Bacillus amyoliquefaciens DL-3 (Lee et al. 2008), optimasi produksi selulase Marinobacter
sp. MSI032 dengan mengoptimasi perbedaan suhu, pH, dan pemberian ion logam yang mempengaruhi aktivitas selulase (Shanmughapriya et al. 2010), mutasi
Trichoderma sp dengan mensuspensikan spora ke dalam larutan mutagen ethidium bromide (EtBr) dan ethyl methane sulfonate (EMS)(Mursyid et al. 2007).
14
menyebabkan penurunan aktivitas selulase. Hal ini disebabkan meningkatnya konsentrasi limbah agar-agar yang ditambahkan akan menimbulkan masalah sirkulasi oksigen sehingga pertumbuhan kapang terganggu. Menurut Saropah et al. (2012), semakin banyak sumber karbon dalam media pertumbuhan maka selulase yang dihasilkan semakin meningkat, akan tetapi sumber karbon yang berlebihan dapat menghambat pertumbuhan sel karena akan mengurangi jumlah oksigen dalam media sehingga menurunkan produksi selulase.
Karakteristik Ekstrak Kasar Enzim Selulase
Karakterisasi enzim selulase dilakukan pada ekstrak kasar enzim selulase. Karakterisasi ini meliputi penentuan pH optimum, suhu optimum, pengaruh ion logam dan pengaruh konsentrasi substrat. Berdasarkan hasil pengujian aktivitas enzim selulase total menggunakan substrat kertas saring Whatman no 1,
endoglukanase menggunakan substrat CMC, dan β-glukosidase menggunakan substrat p-NPG terlihat bahwa aktivitas tertinggi yaitu endoglukanase sehingga untuk karakterisasi ekstrak kasar enzim selulase ini menggunakan CMC sebagai substrat.
Nilai pH Optimum Enzim Endoglukanase
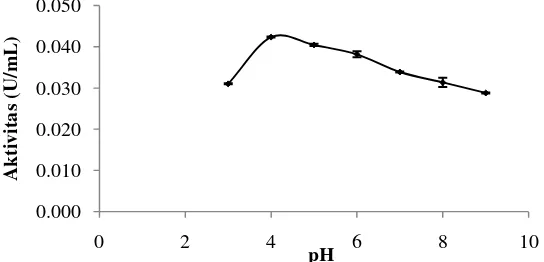
Aktivitas enzim dipengaruhi oleh pH, maka dari itu diperlukan bufer dengan pH tertentu supaya enzim dapat bekerja optimum. Enzim merupakan molekul amfoter yang mengandung sejumlah besar kelompok asam dan basa terutama terdapat pada permukaan. Muatan-muatan pada kelompok-kelompok tersebut akan berubah berdasarkan konstanta disosiasi asam terhadap pH lingkungannya. Perubahan-perubahan yang terjadi pada muatan-muatan oleh pH dapat berpengaruh terhadap aktivitas, stabilitas struktural dan daya kelarutan enzim (Chaplin dan Bukle 1990). Penentuan pH optimum dilakukan dengan penambahan bufer pada rentang pH 3-9. Hasil pengukuran aktivitas endoglukanase pada beberapa pH disajikan pada Gambar 7.
Gambar 7 Pengaruh pH terhadap aktivitas endoglukanase
Berdasarkan Gambar 7 dapat dilihat bahwa terjadi peningkatan aktivitas pada pH 4 dan pH tersebut merupakan pH optimum aktivitas ekstrak kasar endoglukanase dengan aktivitas 0,042 U/mL. Aktivitas ekstrak kasar endoglukanase mengalami penurunan pada pH 5 dan menurun drastis hingga pH 9.
15
Harshvardhan et al. (2013) menyatakan bahwa enzim selulase yang diuji menggunakan substrat CMC aktif pada kisaran pH 3-9. Hasil penelitian Thongekkaew et al. (2008) menunjukkan pH optimum endoglukanase Pichia pastoris yaitu 3,5. Menurut Yuan et al. (2012), endoglukanase yang dihasilkan oleh
Fusarium oxysporum sangat reaktif pada pH 4,5-5,5. Menurut Rastogi et al. (2010) enzim yang mampu bertahan pada kondisi asam digolongkan ke dalam enzim asidofil.
Suhu Optimum Enzim Endoglukanase
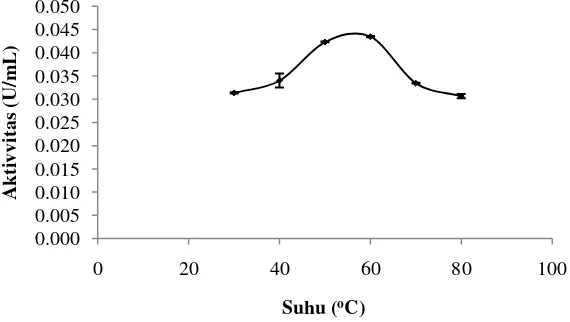
Suhu merupakan faktor yang mempengaruhi laju katalisis reaksi enzimatis. Kenaikan suhu hingga batas tertentu dapat meningkatkan aktivitas enzimatis sampai pada kondisi suhu optimum, namun kenaikan suhu yang berlebih dapat menyebabkan penurunan aktivitas enzim. Penentuan suhu optimum dilakukan pada suhu 30-80 oC. Hasil pengukuran aktivitas endoglukanase pada beberapa suhu disajikan pada Gambar 8.
Gambar 8 Pengaruh suhu terhadap aktivitas endoglukanase
Hasil pengukuran aktivitas endoglukanase pada beberapa suhu memperlihatkan aktivitas endoglukanase meningkat seiring dengan peningkatan suhu hingga suhu optimum terjadi pada suhu 60 oC dengan aktivitas 0,042 U/mL. Penurunan aktivitas terjadi dimulai pada suhu 70 oC. Hasil penelitian Yuan et al.
(2012) menunjukkan bahwa suhu optimum endoglukanase yang dihasilkan dari
Fusarium oxysporum yaitu 60 oC. Adekele et al. (2012) menyatakan bahwa aktivitas optimum enzim endoglukanase Bacillus coagulans Co4 terjadi pada suhu 60 oC. Kenaikan suhu melebihi suhu optimum dapat mengakibatkan menurunnya aktivitas enzim.
16
Kinetika Enzim Endoglukanase
Mekanisme kerja enzim ditentukan oleh jumlah atau konsentrasi substrat yang tersedia. Hasil penelitian menyebutkan konsentrasi substrat yang memberikan aktivitas endoglukanase optimum adalah 1%. Penambahan konsentrasi di bawah 1% menunjukkan aktivitas enzim yang terus meningkat. Penambahan konsentrasi di atas 1% memperlihatkan aktivitas enzim tidak mengalami kenaikan (Gambar 9). Kanti (2003) menyatakan bahwa pada konsentrasi substrat yang rendah, kecepatan reaksi enzim meningkat secara tajam. Kecepatan reaksi enzim mulai menurun dan mencapai batas kecepatan maksimum ketika ditambahkan substrat dengan konsentrasi lebih besar dari nilai Km.
Gambar 9 Pengaruh konsentrasi substrat terhadap aktivitas enzim endoglukanase
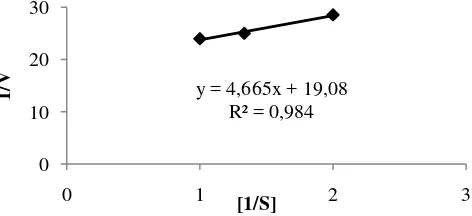
Gambar 10 Kurva Lineaweaver-Burk endoglukanase pada penentuan Km dan Vmaks
Konstanta Michaelis (Km) dan kecepatan maksimum reaksi (Vmaks) merupakan dua parameter kinetika enzim. Kinetika enzim berdasarkan persamaan Lineweaver-Burk menunjukkan bahwa nilai Km enzim selulase sebesar 0,244% dengan Vmaks 0,052 U/mL. Trivedi et al. (2011) menyatakan bahwa nilai Km enzim selulase Bacillus flexus yang diisolasi dari rumput laut sebesar 0,618%. Bacillus sp. dan Geobacillus sp. sebesar 0,108% dan 0,311% Rastogi et al. (2010). Menurut Saropah et al.(2012), nilai Km berfungsi sebagai ukuran konstanta disosiasi suatu enzim. Selulase bakteri selulolitik yang diisolasi dari bekatul memiliki nilai Km sebesar 1,694% dengan Vmaks 0,0086 U/mL.
Pengaruh Ion Logam
Beberapa ion logam ditambahkan pada reaksi uji aktivitas selulase isolat EN untuk mengetahui pengaruh ion logam terhadap aktivitas selulase. Ion logam dapat
17
meningkatkan atau menurunkan aktivitas setelah berinteraksi dengan enzim. Pengaruh ion logam terhadap aktivitas selulase dapat dilihat pada Gambar 11.
Gambar 11 Pengaruh ion logam terhadap aktivitas enzim endoglukanase
Konsentrasi ion logam yang digunakan yaitu 5 mM. Aktivitas relatif enzim endoglukanase tanpa penambahan ion logam yaitu 100%. Ion logam Na+, Mn2+, dan K+ sedikit meningkatkan aktivitas relatif menjadi 105,22%, 102,61%, dan 123,48%. Ion logam Ca2+, Co2+, dan Zn2+ sedikit menurunkan aktivitas relatif menjadi 83,48%, 64,35%, dan 93,31%. Penurunan aktivitas relatif enzim hingga 74% terjadi pada penambahan ion logam Hg2+ dengan aktivitas relatif yang tersisa 26%.
Hasil penelitian Yin et al. (2010) menunjukkan bahwa ion Na+, K+, dan Mn2+ pada konsentrasi 5 mM menghasilkan aktivitas relatif lebih tinggi dibandingkan kontrol.Penelitian yang dilakukan oleh Smriti dan Sanwal (1999) menyatakan ion Hg2+ merupakan penghambat yang kuat terhadap aktivitas enzim selulase yang diuji menggunakan substrat CMC. Menurut Lee et al. (2008), yaitu aktivitas relatif endoglukanase yang tersisa setelah penambahan ion Hg2+ sebesar 23,7%. Yin et al. (2010) menyatakan penurunan aktivitas endoglukanase akibat penambahan ion logam Hg2+ memperlihatkan bahwa sisi aktif enzim selulase memiliki gugus SH. Menurut Lee et al. (2008), inhibisi oleh ion Hg2+ bukan hanya disebabkan berikatan dengan gugus thiol tetapi juga akibat adanya interaksi dengan residu triptofan atau gugus karboksil pada asam amino enzim.
Pemurnian Enzim Endoglukanase
Presipitat Enzim Endoglukanase
Enzim kasar hasil optimasi dengan aktivitas tertinggi selanjutnya dipresipitasi dengan menambahkan aseton. Presipitasi merupakan penambahan senyawa yang hanya menggumpalkan protein dan tidak menggumpalkan bahan lain sehingga dengan sendirinya akan memisahkan dan lebih memurnikan enzim yang dihasilkan (Suhartono 1989). Presipitasi dapat dilakukan dengan penambahan garam misalnya amonium sulfat, polimer misalnya polyethylene glycol (PEG), atau pelarut organik misalnya aseton atau alkohol (Scopes 1994).
18
Presipitan yang digunakan pada penelitian ini yaitu pelarut organik aseton. Pemakaian aseton terbukti dapat mempertahankan stabilitas enzim, enzim yang diendapkan dengan pelarut organik biasanya relatif lebih murni (Suhartono 1989). Penambahan aseton ke suatu ekstrak yang berisi protein dapat menimbulkan presipitasi protein. Penambahan pelarut organik menurunkan konstanta dielektrik larutan sehingga kelarutan protein menurun (Harris 1989). Menurut Adeleke et al. (2012), presipitasi dengan penambahan aseton dapat menghasilkan aktivitas enzim yang lebih baik dibandingkan dengan penambahan amonium sulfat. Pengaruh kejenuhan aseton terhadap aktivitas enzim pada pelet setelah mengalami pengendapan disajikan pada Gambar 12.
Gambar 12 Pengaruh kejenuhan aseton terhadap aktivitas endoglukanase
Berdasarkan Gambar 12 dapat dilihat bahwa aktivitas spesifik tertinggi enzim selulase terdapat pada pengendapan aseton dengan konsentrasi 10% dengan aktivitas spesifik 0,372 U/mg. Adeleke et al. (2012) menyatakan bahwa selulase
Bacillus coagulans Co4 yang diisolasi dari kulit cokelat setelah dipresipitasi dengan 80% kejenuhan aseton memiliki aktivitas spesifik 0,29 U/mg protein. Aktivitas spesifik diperoleh dengan membandingkan aktivitas enzim terhadap konsentrasi protein. Aktivitas enzim endoglukanase pengendapan 10% sebesar 0,0252 U/mL dengan konsentrasi protein 0,065 mg/mL.
Menurunnya aktivitas endoglukanase seiring peningkatan konsentrasi aseton yang ditambahkan diduga protein enzim selulase mengalami denaturasi akibat terlalu banyaknya aseton yang ditambahkan. Pelarut organik biasanya mengikat pada sisi yang spesifik dari molekul protein dan merusak interaksi hidrofobik. Penggunaan pelarut organik dalam jumlah sedikit dan suhu yang rendah dapat mengurangi denaturasi protein (Harris 1989).
Enzim Endoglukanase Murni
Pemurnian dilakukan untuk mendapatkan enzim yang lebih murni dengan aktivitas lebih tinggi dibandingkan dengan ekstrak kasar. Hasil presipitasi enzim dapat dimurnikan menggunakan kromatografi kolom. Pada penelitian ini enzim selulase yang telah diendapkan, dimurnikan menggunakan kromatografi kolom filtrasi gel dengan matriks Sephadex G-100.
19
cukup kecil sehingga mencegah molekul besar untuk masuk ke dalamnya, tetapi dapat menampung molekul-molekul yang lebih kecil. Filtrasi gel digunakan untuk memisahkan protein yang mempunyai berat molekul tinggi dari protein atau molekul lain dengan berat molekul rendah. Salah satu bahan yang penting sebagai gel adalah dekstran yang telah mengalami cross-linkage dengan bantuan epikhlorhidin. Hasil yang didapat dekstran tidak larut dalam air namun masih memiliki kemampuan menyerap molekul air di dalam molekulnya sendiri. Daya serap ini bergantung pada jumlah cross-linkage yang terjadi. Makin banyak ikatan silang yang terbentuk maka daya serapnya semakin kurang baik. Filtrasi gel merupakan teknik pemurnian yang kapasitasnya lemah namun metode ini efektif untuk pemisahan enzim dari pelarut penggumpal dan larutan garam yang tidak dikehendaki (Suhartono 1989).
Hasil fraksinasi enzim menggunakan filtrasi gel diperoleh 56 fraksi. Fraksi-fraksi yang diperoleh selanjutnya diuji aktivitas dan kadar protein untuk menentukan fraksi yang memiliki aktivitas tertinggi. Hasil pengujian aktivitas menunjukkan terdapat beberapa puncak dengan aktivitas tinggi yaitu fraksi 3, 7, 10, 16, dan 29 (Gambar 13). Hasil presipatasi dan fraksi-fraksi dengan aktivitas tinggi dihitung kelipatan pemurniannya untuk melihat tingkat kemurnian enzim pada setiap tahapan. Hasil presipitasi menggunakan aseton dengan kejenuhan 10% menghasilkan kelipatan pemurnian sebesar 1,093 kali. Hasil kelipatan pemurnian dari beberapa fraksi yang memiliki aktivitas tinggi diketahui bahwa fraksi 10 hasil filtrasi gel menghasilkan kelipatan pemurnian tertinggi yaitu 17,571 kali (Tabel 3).
Gambar 13 Fraksi-fraksi hasil pemurnian filtrasi gel (▲ aktivitas, ● konsentrasi protein)
Tabel 3 Kelipatan pemurnian enzim selulase
Tahapan protein Spesifik Protein Aktivitas
20
Beberapa penelitian telah dilakukan untuk memurnikan enzim selulase. Annamalai et al. (2011) menggunakan DEAE-Cellulose dilanjutkan dengan Sephadex G-75 untuk memurnikan selulase dari Bacillus licheniformis AU01. Kelipatan pemurnian menggunakan DEAE-Cellulose sebesar 5,53 kali, setelah dimurnikan menggunakan Sephadex G-75 kelipatan pemurnian mencapai 8,66 kali. Iqbal et al. (2011) menyatakan bahwa kelipatan pemurnian enzim selulase
Trichoderma viridae yang dimurnikan dengan Sephadex G-100 sebesar 2,33 kali. Tang et al. (2012) menggunakan Sephadex G-100, kelipatan pemurnian meningkat menjadi 34,96 kali. Murashima et al. (2002) memurnikan enzim endoglukanase
Rhizopus oryzae menggunakan macro-preMethl HIC diperoleh kelipatan pemurnian sebesar 5 kali. Pemurnian dilanjutkan menggunakan Superdex 200, kelipatan pemurnian menjadi 18,6 kali. Pemurnian dilanjutkan kembali menggunakan MonoS diperoleh kelipatan pemurnian sebesar 109 kali.
Berat Molekul Enzim dan Aktivitasnya
Berat molekul enzim ditentukan dengan elektroforesis. Elektroforesis merupakan suatu proses perpindahan partikel-partikel bermuatan suatu campuran berdasarkan atas pergerakan partikel koloid yang bermuatan di bawah pengaruh medan listrik (Suhartono 1989). Elektroforesis menggunakan gel poliakrilamid sodium dodesil sulfat merupakan teknik elektroforesis gel untuk memisahkan protein yang bermuatan berdasarkan berat molekulnya. Protein dengan berat molekul kecil akan bergerak lebih cepat dibandingkan dengan berat molekul besar (Dunn 1989).
Pemurnian menggunakan kromatografi filtrasi gel menghasilkan beberapa fraksi puncak yang selanjutnya diuji menggunakan SDS-PAGE (Sodium dodecyl sulphate-polyacrylamide gel electrophoresis) untuk mengetahui berat molekulnya. Penentuan berat molekul dilakukan pada ekstrak kasar, pelet hasil pengendapan dengan kejenuhan aseton 10%, fraksi 3, fraksi 7, fraksi 10, dan fraksi 16. Hasil elektroforesis memperlihatkan bahwa pemisahan menggunakan filtrasi gel belum optimal karena masih banyaknya penumpukan pita pada berat molekul rendah (Gambar 14).
21
endoglukanase Cuscuta reflexa sebesar 230 kDa. Ohara et al. (2000) menyatakan bahwa enzim endoglukanase yang diperoleh dari Ruminococcus albus memiliki bobot molekul 40-250 kDa.
(a) (b)
Gambar 14 Elektroforegram (a) dan zimogram (b) fraksi kromatografi filtrasi gel; M: marker, K: ekstrak kasar, P: pelet, F3: fraksi ke-3, F7: fraksi ke-7, F10: fraksi ke-10, F16: fraksi ke-16 filtrasi gel
4 SIMPULAN DAN SARAN
Simpulan
Waktu inkubasi dan konsentrasi limbah agar-agar terbaik untuk memproduksi enzim selulase dengan aktivitas tertinggi yaitu sembilan hari inkubasi dengan penambahan limbah sebanyak 1,5%. Enzim selulase isolat kapang EN bekerja optimum pada pH 4 dan suhu 60 oC dengan konsentrasi substrat CMC 1%. Nilai Km dan Vmaks selulase sebesar 0,244% dan 0,052 U/mL. Ion Hg2+ menghambat aktivitas selulase. Bobot molekul enzim selulase adalah 217,96 kDa, 163,15 kDa, 129,41 kDa, dan 76,84 kDa. Kelipatan pemurnian enzim setelah pemurnian mencapai 17,571 kali.
Saran
22
DAFTAR PUSTAKA
Adeleke EO, Omafuvbe BO, Adewale IO, Bakare MK. 2012. Purification and characterization of a cellulase obtained from cocoa (Theobroma cacao) pod-degrading Bacillus coagulans Co4. Turk J Biochem. 37(3):222-230.
Adsul MG, Ghule JE, Singh R, Shaikh H, Bastawde KB, Gokhale DV. 2004. Polysaccharides from bagasse: applications in cellulase and xylanase production. Carbohyd Polym. 57(1):62-72.
Ali-Mursyid WM, Cahyanto MN, Sardjono, Zuprizal, Bachruddin Z. 2007. Mutasi
Trichoderma sp. untuk meningkatkan sekresi selulase. Media Kedokteran Hewan. 23(2):74-79.
Andhikawati A, Oktavia Y, Ibrahim B, Tarman K. 2014. Isolasi dan penapisan kapang laut endofit penghasil selulase. JITKT. 6(1)219-227.
Annamalai N, Rajeswari MV, Elayaraja S, Thavasi R, Vijayalakshmi S, Balasubramanian T. 2012. Purification and characterization of thermostable alkaline cellulase from marine bacterium Bacillus licheniformis AU01 by utilizing cellulosic wastes. Waste Biomass Valor. 3:305-310.
Belghith H, Ellouz-Chaabouni S, Gargouri A. 2001. Biostoning of denims by
Penicillium occitanis (Pol6) cellulases. J Biotechnol. 89(2):257-262.
Bhat KM dan Maheshwari R. 1987. Sporotrichum thermophile growth, cellulose degradation, and cellulase activity. Appl Environ Microb. 53(9):2175-2182. Bradford MM. 1976. A rapid and sensitive method for quantification of microgram
quantities of protein utilizing the principle of protein dye binding.
J Anal Biochem. 72:248-254.
Chatterjee U, Deswal GG. 1999. Purification and properties of a protein from
Lantana camara activating Cuscuta reflexa cellulase. Phytochemistry.
52(3):361-366.
Chaplin MF, Bukle C. 1990. Enzyme Technology. Cambridge (GB): Cambridge Univ Pr.
Da Silva R, Lago ES, Merheb CW, Machione MM, Park YK, Gomes E. 2005. Production xylanase and CMCase on solid state fermentation in different residues by Thermoascus auranticus miehe. Braz J Microbiomol. 36(2):235-241.
Delabona PS, Farinas CS, da Silva MR, Azzon SF, da Cruz Pradella JG. 2012. Use of a new Trichoderma harzianum strain isolated from the Amazon rainforest with pretreated sugar cane bagasse for on-site cellulase production.
Bioresource Technol. 107:517-521.
23
Grover AK, Macmurchi DD, Cushley RJ. 1977. Studies on almond emulsin β -D-glukosidase I. Isolation and characterization of biofunctional isozyme.
Biochim Biophys Acta. 482(1):98-108.
Harris ELV. 1989. Concentration of the Extract . Harris ELV and Angal S, editor. Oxford (GB): Oxford Univ Pr.
Harshvardhan K, Mishr A, Jha B. 2013. Purification and characterization of cellulase from a marine Bacillus sp. H1666: A potential agent for single step saccharification of seaweed biomass. J Mol Catal B: Enzym. 93:51-56.
Iqbal HMN, Ahmed I, Zia MA, Irfan M. 2011. Purification and characterization of the kinetic parameters of cellulase produced from wheat straw by
Trichoderma viride under SSF and its detergent compatibility. ABB. 2(3):149-156.
Jadhav AR, Girde AV, More SM, More SB, Khan S. 2013. Cellulase production by utilizing agricultural wastes. Res J Agriculture and Forestry Sci. 1(7):6-9. Jahangeer S, Khan N, Jahangeer S, Sohail M, Shahzad S, Ahmad A, Khan SA.
Screening and characterization of fungal cellulases isolated from the native environmental source. Pak J Bot. 37(3):739-748.
Kanti A. 2003. Actinomycetes selulolitik dari tanah hutan Taman Nasional Bukit Duabelas, Jambi. Biodiversitas. 6(2):85-89.
Kim GS, Myung KS, Kim YJ, Oh KK, Kim JS, Ryu HJ, dan Kim KH. 2007.
Method of Producing Biofuel Using Sea Algae. Seoul: World Intellectual Property Organization.
Lee YJ, Kim BK, Lee BH, Jo KI, Lee NK, Chung CH, Lee YC, Lee JW. 2007. Purification and characterization of cellulase produced by Bacillus amyoliquefaciens DL-3 utilizing rice hull. Bioresource Technol. 99(2):378-386.
Mahamud MR, Gomes DJ. Enzymatic saccharification of sugar cane bagasse by the crude enzyme from indigenous fungi. J Sci Res. 4(1):227-238.
Mandels M, Andreotti R, Roche C. 1976. Measurment of saccharifying cellulase.
Biotechnol and Bioeng. Symp. 6:21-33.
Maurya DP, Singh D, Pratap D, Maurya JP. 2012. Optimization of solid state fermentation conditions for the production of cellulase by Trichoderma reesei. J Environ Biol. 33:5-8.
Meryandini A, Widosari W, Maranatha B, Sunarti TC, Rachmania N, Satria H. 2009. Isolasi bakteri selulolitik dan karakterisasi enzimnya. Makara sains.13(1):33-38.
Miller GL, Blum R, Glennon WE, Burton AL, 1960. Measurement of carboxymethyl cellulase activity. Anal Biochem. 1(2):127–132.
Mukherjee S, Karmakar M, Ray RR. 2011. Production of extra cellular exoglucanase by Rhizopus oryzae from submerged fermentation of agro wastes. Rec Res Sci Tech. 3(3):69-75.
Murashima K, Nishimura T, Nakamura Y, Koga J, Moriya T, Sumida N, Yaguchi
T, Kono T. 2002. Purification and characterization of new endo-1,4-β -D-glucanases from Rhizopus oryzae. Enzyme Microb Tech. 30(3):319-326. Muthuvelayudham R dan Viruthagiri T. 2006. Fermentative production and kinetics
24
Ohara H, Karita S, Kimura T, Sakka K, Ohmiya K. 2000. Characterization of the cellulolytic complex (cellulosome). Biosci Biotechnol Biochem. 64(2):254-260.
Rahmadani AH, Susanti E. Kajian potensi limbah pertanian sebagai sumber karbon pada produksi avicelase dan CMCase dari Bacillus circulans. Valensi. 3(2):82-87.
Rastogi G, Bhalla A, Adhikari A, Bischoff KM, Hughes SR, Christopher LP, Sani RK. 2010. Characterization of thermostable cellulases produced by Bacillus
and Geobacillus strains. Bioresource Technol. 101:8798-8806.
Sari IM, Noverita, Yulneriwani. 2008. Pemanfaatan jerami padi dan alang-alang dalam fermentasi etanol menggunakan kapang Trichoderma viride dan khamir Saccharomycess cerevisiae. Jurnal Ilmiah Biologi Vis.Vitalis 2(1): 55-62.
Saha BC. 2004. Production, purification and properties of endoglucanase from a newly isolated strain of Mucor circinelloides. Process Biochem. 39(12):1871-1876.
Saropah DA, Jannah A, Maunatin A. 2012. Kinetika reaksi enzimatis ekstrak kasar enzim selulase bakteri selulolitik hasil isolasi dari bekatul. Alchemy. 2(1):34-45.
Schulz B, Boyle C, Draeger S, Römmert AK, Krohn K. 2002. Endophytic fungi: a source of novel biologically active secondary metabolites. Mycol Res.
106(9):996-1004.
Scopes RK. 1994. Protein Purification, Principles and Practice. Ed ke-2. New York (US): Springer-Verlag.
Sethi R, Padmavathi T, Sullia SB. Lignocellulose biomass degradation by marine microorganisms. Euro J Exp Bio. 3(2):129-138.
Shallom D, Soham Y. 2003. Microbial hemicellulases. Curr Opin Microbiol.
6(3):219-228.
Singh A, Singh N, Bishnoi NR. 2009. Production of cellulases by Aspergillus heteromorphus from wheat straw under submerged fermentation. WASET. 3(3):326-329.
Sivaramanan S. 2014. Isolation of cellulolytic fungi and their degradation on cellulosic agricultural wastes. JAIR. 2(8):458-463.
Smriti, Sanwal GG. 1999. Purification and characterization of a cellulase from
Catharanthus roseus stems. Phytochemistry. 52(1):7-13. Suhartono MT. 1989. Enzim dan Bioteknologi. Bogor (ID): IPB Pr.
Sukumaran RK, Singhania RR, Pandey A. 2005. Microbial cellulases-Production, applications and challenges. J Sci Ind Res. 64:832-844.
home-25
produced cellulase and commercial amylase in a rabbit feeding trial. Ind Crop Prod. 20(1):49-57.
Tang B, Pan H, Tang W, Zhang Q, Ding L, Zhang F. 2012. Fermentation and purification of cellulase from a novel strain Rhizhopus stolonifer var. reflexus
TP-02. Biomass Bioenerg 36:366-372.
Thongekkaew J, Ikeda H, Masaki K, Iefuji H. 2008. An acidic and thermostable carboxymethyl cellulase from the yeast Cryptococcus sp. S-2. Purification, characterization and improvement of its recombinant enzyme production by high cell-density fermentation of Pichia pastoris. Protein Expression Purif. 60(2):140-146.
Trivedi N, Gupta V, Kumar M, Kumari P, Reddy CRK, Jha B. 2011. An alkali-halotolerant cellulase from Bacillus flexus isolated from green seaweed Ulva lactuca. Carbohyd Polym. 83(2):891-897.
Van Dyk JS, Sakka M, Sakka K, Pletschke BI. 2010. Identification of endoglucanases, xylanases, pectinases and mannanases in the multi-enzyme complex of Bacillus licheniformis SVD1. Enzyme Microb Tech. 47(3):112-118.
Yin LJ, Lin HH, Xiao ZR. 2010. Purification and characterization of a cellulase from Bacillus subtilis YJ1. J Mar Sci Technol. 18(3):466-471.
Yuan L, Wang W, Pei Y, Lu F. 2012. Screening and identification of cellulase-producing strain of Fusarium oxysporum. Procedia Environ Sci. 12(2):1213-1219.
Zhou J, Wang YH, Chu J, Zhuang JP, Zhang SL, Yin P. 2008. Identification and purification of the main components of cellulases from a mutant strain of
26
LAMPIRAN
Lampiran 1 Komposisi media produksi enzim
Media untuk produksi Enzim (g/l)
KH2PO4 2
Urea 0,3
MgSO4.7H2O 0,3 CaCl2.2H2O 0,3
Komposisi garam Mineral (mg/l): FeSO4.7H2O 5
MnSO4.H2O 1,6 ZnSO4.7H2O 1,4 CoCl2.6H2O 2
Pepton 0,1%
Tween 80 0,1%
Limbah agar-agar 0,5; 1,0; 1,5; 2,0%
Lampiran 2 Bahan-bahan untuk pengujian aktivitas selulase
1. Bufer sitrat 50 mM, pH 5
Sebanyak 9,6 gram C6H8O7 dilarutkan dalam akuades hingga volume akhirnya 1 liter (stok A). Sebanyak 14,705 gram C6H5O7Na3.2H2O dilarutkan dalam akuades hingga volume akhirnya 1 liter (stok B). Campurkan larutan stok A dan B dengan perbandingan tepat hingga pH 5.
2. Pereaksi DNS
NaOH 1%
DNS 1%
Na K Tartat 18,2%
Fenol 0,2%
Na2SO3 0,05%
3. Subtrat CMC 1%
Sebanyak 0,1 gram CMC dilarutkan dalam 10 mL bufer sitrat 50 mM pH 5 yang telah dipanaskan terlebih dahulu. Substrat ini harus dibuat segar.
4. Na2CO3 0.2 M
Sebanyak 21,198 gram Na2CO3 dilarutkan dalam akuades hingga volume akhirnya 1 liter. Diaduk hingga larut dan disimpan pada 4 oC.
5. Substrat p-Nitrophenyl β-Glucopyranoside
27
RIWAYAT HIDUP
Penulis dilahirkan di Batumarta, Kabupaten Ogan Komering Ulu Sumatera Selatan pada tanggal 16 Oktober 1988 sebagai anak keempat dari empat bersaudara dari pasangan M. Yusuf AR dan Sri Dahlia. Pendidikan sarjana ditempuh di Program Studi Teknologi Hasil Perikanan, Fakultas Pertanian Universitas Sriwijaya, lulus pada tahun 2011. Pada tahun 2011, penulis diterima di Program Studi Teknologi Hasil Perairan pada Program Pascasarjana IPB.