PENENTUAN KONSENTRASI LOW MELTING POINT AGAROSE
DAN LYSIS SOLUTION UNTUK MENDETEKSI KERUSAKAN
DNA PADA SPERMATOZOA SAPI, DOMBA, KAMBING
TEGUH ARI PRABOWO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
subhanahu wa ta’ala
segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini berjudul Penentuan Konsentrasi Low Melting Point Agarose dan Lysis Solution untuk Mendeteksi Kerusakan DNA Spermatozoa Sapi, Domba, Kambing
Pada kesempatan ini penulis mengucapkan terimakasih yang sebesar-besarnya kepada Prof Dr Dra R Iis Arifiantini MSi dan Prof drh Dondin Sajuthi MST PhD selaku selaku ketua dan anggota komisi pembimbing atas bimbingan, arahan, perhatian dan nasihatnya selama melakukan penelitian dan penulisan karya ilmiah ini sehingga penulis dapat menyelesaikan rangkaian penelitian ini hingga selesai. Terima kasih kepada Prof Dr drh Tuty Laswardi Yusuf MSi selaku penguji luar komisi, serta Prof Dr drh Mohamad Agus Setiadi selaku Ketua Program Studi Biologi Reproduksi, Sekolah Pascasarjana IPB. Ucapan terimakasih juga penulis sampaikan kepada KEMENRISTEK DIKTI atas beasiswa yang telah diberikan dalam program Beasiswa Pascasarjana Dalam Negeri (BPPDN) Calon Dosen Tahun 2013 sehingga dapat membantu penulis selama masa studi.
Penulis menyampaikan terima kasih kepada seluruh Dosen dan Staf Program Studi Biologi Reproduksi Sekolah Pascasarjana IPB. Penulis juga tidak lupa mengucapkan terimakasih kepada teman-teman mahasiswa program studi Biologi Reproduksi, Sekolah Pascasarjana Institut Pertanian Bogor atas bantuan tenaga serta pikiran yang diberikan kepada penulis selama penulis melaksanakan studi. Ungkapan terima kasih yang sedalam-dalamnya juga disampaikan kepada ayahanda (Alm) Jamadi Amd dan ibunda Suminem Amd, kakak Nanang Wahyu Wibowo dan istri tercinta Ufi Khasanah SP atas doa, dukungan dan kasih sayangnya. Semoga karya ilmiah ini dapat memberikan informasi yang bermanfaat dan berguna bagi semuanya.
Bogor, Agustus 2016
Judul Tesis : Penentuan Konsentrasi Low Melting Point Agarose dan Lysis Solution untuk Mendeteksi Kerusakan DNA pada Spermatozoa Sapi, Domba, Kambing
Nama : Teguh Ari Prabowo NIM : B352130051
Disetujui oleh
Komisi Pembimbing
Prof Dr Dra R Iis Arifiantini, MSi
Ketua Prof drh Dondin Sajuthi, MST PhD Anggota
Diketahui oleh
Ketua Program Studi Biologi Reproduksi
Prof Dr drh Mohamad Agus Setiadi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MscAgr
i
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Penentuan Konsentrasi Low Melting Point Agarose dan Lysis Solution untuk Mendeteksi Kerusakan DNA Spermatozoa Sapi, Domba, Kambing adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2016
RINGKASAN
TEGUH ARI PRABOWO. Penentuan Konsentrasi
Low Melting Point Agarose dan Lysis Solution untuk Mendeteksi Kerusakan DNA Spermatozoa Ternak Sapi, Domba, Kambing.
Dibimbing oleh R. IIS ARIFIANTINI dan DONDIN SAJUTHI.Deoxyribose-nucleic acid (DNA) merupakan suatu polimer heliks ganda yang terdiri dari nukleotida. Setiap nukleotida terdiri dari tiga komponen; satu basa nitrogen, satu gula pentosa yang disebut deoxyribosa dan satu gugus fosfat. Basa nitrogennya bisa adenin (A), timin (T), guanin (G), atau sitosin (S). Adenin dan guanin adalah purin, basa nitrogen dengan dua cincin organik. Sitosin dan timin adalah anggota famili basa nitrogen yang dikenal sebagai pirimidin yang mempunyai satu cincin tunggal.
DNA dapat mengalami kerusakan karena perubahan polimer DNA dan secara terus menerus terpapar pada lingkungan fisik dan kimia yang sangat bervariasi yang berpotensi mengubah struktur alamiah DNA tersebut. Perubahan ini akan memengaruhi proses replikasi dan transkripsi DNA yang mengarah pada kerusakan DNA. Bentuk kerusakan yang lain adalah terputusnya struktur polimer DNA. Pemanasan yang melebihi 37ºC akan menyebabkan terputusnya ikatan glikosida yang menghubungkan basa nitrogen dan struktur gula fosfat sehingga basa nitrogen akan hilang.
Penelitian ini bertujuan untuk mengembangkan kit deteksi kerusakan DNA spermatozoa ternak yang saat ini masih impor dengan harga yang mahal. Penelitian dilakukan di Laboratorium Bioteknologi Pusat Satwa Primata (PSSP) Institut Pertanian Bogor (IPB) dan Laboratorium Unit Rehabilitasi Reproduksi (URR), Departemen Klinik Reproduksi dan patologi, Fakultas Kedokteran Hewan (FKH) IPB. Semen dikoleksi menggunakan vagina buatan sebanyak dua kali dalam seminggu yang diperoleh dari tiga ekor kambing jantan, tiga ekor domba jantan dan satu ekor sapi FH jantan.
Penelitian terdiri dari tiga tahap. Tahap I penentuan konsentrasi low melting point-agarose (LMP-agarose), tahap II penentuan lysis solution (LS), dan tahap III pengujian pewarnaan kromatin DNA spermatozoa. Konsentrasi LMP-agarose yang digunakan adalah 0.6%, 0.7% dan 0.8%. Spermatozoa dan konsentrasi LMP-agarose terbaik selanjutnya dilisiskan menggunakan tiga jenis LS. LS I (0.4M Tris, 0.8M DTT, 1% SDS), jenis LS II (0.4M Tris, 2M NaCl, 1% SDS), dan jenis LS III (0.4M Tris-HCl, 2M NaCl, 1% SDS, 0.05M EDTA) pengujian pewarnaan kromatin DNA menggunakan tiga pewarnaan yaitu eosin yellow methylene blue.
Kesimpulan penelitian ini adalah konsentrasi 0.6% LMP-agarose merupakan konsentrasi yang dapat digunakan untuk menjebak spermatozoa domba dan kambing bila dibandingkan dengan kedua konsentrasi yang diujikan, sedangkan pada spermatozoa sapi ketiga konsentrasi yang diujikan tidak dapat digunakan. Pada penelitian tahap kedua, lysis solution (LS) yang dapat digunakan untuk melisiskan membran spermatozoa ternak adalah LS III (0.4M Tris-HCl, 2M NaCl, 1% SDS, 0.05M EDTA, pH 7.5), Pewarnaan terbaik menggunakan pewarnaan eosin Yellow dan methylene blue dengan perbandingan 2:1.
iii
SUMMARY
TEGUH ARI PRABOWO. Determination of Low Melting Point Agarose Concentration and Lysis Solution to Detect DNA Damage on Bull, Ram and Buck Spermatozoa.Supervised by R. IIS ARIFIANTINI and DONDIN SAJUTHI.
Deoxyribonucleic acid (DNA) is a double helix polymer composed of nucleotides. Each nucleotide contains of three components; a nitrogen base, a pentose sugar called deoxyribosa and a phosphate group. The four types of nitrogen bases are adenine (A), thymine (T), guanine (G), and cytosine (S). Adenine and guanine are known as purines with two organic rings. Whereas cytosine and thymine are recognized as pyrimidine which having a single organic ring.
DNA damage can occurs by the changes in DNA polymer and continuously exposed to varied physical and chemical environments that could potentially change the natural structure of the DNA. This change will affect replication and transcription of DNA that lead to DNA damage. Another damage is the dissolution of DNA polymer structure. The heating above 37ºC will cause the breakdown of the glycoside bond which linking the nitrogen base and phosphate sugar which lead to the loss of nitrogen base.
The research aim to develop the detection kit of DNA damage of livestock spermatozoa which was still imported with a high price. The research was consisted of 3 phase. The first phase was determine of low-melting point agarose (LMP-agarose) concentration. The second phase was determine the lysis solution (LS), and the third phase was examine the DNA spermatozoa chromatin staining. The LMP-agarose concentrations used were 0.6%, 0.7% and 0.8%. The best concentration of LMP-agarose were lysis using three types of LS such us LS I (0.4 M Tris, 0.8 M DTT, 1% SDS), LS II (0.4 M Tris, 2 M NaCl, 1% SDS), and LS III (0.4 M Tris-HCl, 2 M NaCl, 1% SDS, 0.05 M EDTA) while examining the DNA chromatin staining was performed by eosin yellow staining and methylene blue.
The study was conducted at the Biotechnology Laboratory of Primate Center (PSSP) at Bogor Agricultural University and the Laboratory of Reproductive Rehabilitation Unit (URR) at Faculty of Veterinary Medicine (FKH) of Bogor Agricultural University. The semen was collected using an artificial vagina twice a week obtained from 3 male goats, 3 male sheeps and 1 male FH cow.
The results showed that the LMP-agarose concentration of 0.8% was the better concentration that can be used to trap the livestock spermatozoa than the other two concentrations, and the best lysis solution (LS) was LS III (0.4 m Tris-HCl, 2M NaCl, 1% SDS, 0.05M EDTA, pH 7.5,), while the best staining was by using eosin yellow and methylene blue with the ratio of 2: 1.This result can be used as detect deoxyribonucleic Acid (DNA) Damage on ram and buck Spermatoza. while for spermatozoa cows, need to do more research to determine the best concentrations of LMP agarose.
Key words: DNA spermatozoa, LMP-agarose, lysis solution, eosin yellow and
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
v
PENENTUAN KONSENTRASI LOW MELTING POINT AGAROSE
DAN LYSIS SOLUTION UNTUK MENDETEKSI KERUSAKAN
DNA PADA SPERMATOZOA SAPI, DOMBA, KAMBING
TEGUH ARI PRABOWO
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Studi Biologi Reproduksi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
vii
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xii
1 PENDAHULUAN 1
Latar Belakang 1
Kerangka Pemikiran 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Hipotesis 3
2 TINJAUAN PUSTAKA 3
Komponen Spermatozoa 5
Evaluasi Kerusakan Kromatin DNA Spermatozoa Ternak 6
3 METODE PENELITIAN 8
Tempat dan Waktu Penelitian 8
Metode Penelitian 8
Penelitian I. Menentukan konsentrasi Low Melting Point-agarose (LMP-agarose) Terbaik. 8 Penelitian II. Pengujian Jenis Lysis solution (LS) untuk Melisis
Membran Spermatozoa 9
Tahap III. Pengujian jenis pewarnaan 10
4 HASIL DAN PEMBAHASAN 10
Konsentrasi LMP-Agarose Terbaik untuk Menjebak Spermatozoa
Ternak 10
Lysis Solution (LS) Tebaik untuk Melisiskan Membran Spermatozoa
Ternak 12
Jenis Pewarnaan Terbaik untuk Mewarnai Kromatin DNA 15
5 SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR PUSTAKA 17
DAFTAR TABEL
1 Konsentrasi Low Melting Point-agarose (LMP-agarose) 8 2. Jumlah spermatozoa yang terjebak di dalam LMP-agarose
(rata-rata±SD) 11
ix
DAFTAR GAMBAR
1 Morfologi Spermatozoa 4
2 Nukleosom yang dibentuk oleh asam deoksiribonukleat (abu-abu)
dan histon oktamer (Histon H2A , H2B , H3 and H4) 7 3 Spermatozoa yang ditetesi Lysis Solution (LS) 13 4 Mekanisme EDTA dalam menginduksi fluiditas dan permeabilitas
membran lipid 14
faktor di antaranya faktor sumber daya manusia (SDM) yaitu inseminator dan peternak. Faktor betina (umur dan kesehatan reproduksi) dan faktor pejantan dalam hal ini adalah kualitas semen yang diinseminasikan. Inseminasi buatan pada saat ini sebagian besar menggunakan semen beku yang diproduksi oleh Balai Inseminasi Buatan (BIB). Indonesia saat ini memiliki dua BIB nasional yaitu BIB Lembang dan Balai Besar Inseminasi Buatan (BBIB) Singosari serta lebih dari 15 Balai Inseminasi Buatan Daerah (BIBD).
Persayaratan mutu semen beku berdasarkan Standar Nasional Indonesia (SNI) nomor 4869.1:2008 mengenai semen beku sapi, yang dikeluarkan oleh Badan Sandardisasi Nasional (BSN) setelah thawing (post thawing) harus menunjukkan spermatozoa hidup dan bergerak maju (motil spermatozoa) minimal 40 % dan skor gerakan spermatozoa minimal dua. Morrell dan Rodriguez-Martinez (2009) menyatakan sub populasi spermatozoa yang dapat memfertilisasi ovum adalah spermatozoa yang motil, viable dengan morfologi yang normal serta mempunyai kromatin yang intact. Berdasarkan pernyataan tersebut, seharusnya keempat parameter tersebut harus diuji untuk memastikan spermatozoa mampu membuahi ovum.
Pengujian motilitas, viabilitas dan morfologi spermatozoa sebelum dan setelah pembekuan di Indonesia telah banyak dilaporkan, sedangkan kerusakan kromatin Deoxyribonucleic acid (DNA) spermatozoa, baru dilaporkan oleh Priyanto et al. (2015). Penyebab kerusakan kromatin DNA menurut Rodriguez-Martinez (2009) dapat terjadi akibat perubahan polimer DNA dan secara terus menerus terpapar pada lingkungan fisik dan kimia yang bervariasi yang berpotensi mengubah struktur alamiah DNA tersebut. Perubahan ini akan memengaruhi proses replikasi (Oliva 2006) dan transkripsi DNA yang mengarah pada kerusakan DNA (Evenson et al. 2002).
Kerusakan kromatin DNA spermatozoa semakin diakui sebagai faktor penting penyebab terjadinya infertilitas. Beberapa kasus menunjukkan terdapat korelasi antara kerusakan kromatin DNA spermatozoa dengan fertilitas (Evenson dan Wixon 2006), penurunan integritas membran plasma (Nishizono et al. 2004), kesalahan kondensasi kromatin, dan peningkatan fragmentasi DNA (Yildiz et al. 2007). Priyanto et al. (2015) membandingkan pengujian DNA spermatozoa menggunakan cytochemical assay dengan pewarnaan toluidine blue dan Kit halomax, hasilnya menunjukkan Kit halomax lebih sensitif untuk menguji kerusakan spermatozoa setelah pembekuan dengan melihat dispersi kromatin yang terjadi.
2
deoxynucleotidyl transferase mediated deoxyuridine triphosphate nick end labelling (TUNEL), single cell gel electrophoresis assay (COMET), in situ nick translation (ISNT), sperm chromatin structure assay (SCSA), dan sperm chromatin dispersion (SCD). Namun metode tersebut membutuhkan biaya yang mahal dan tidak semua peralatan untuk menganalisis kerusakan kromatin DNA terdapat di Balai Inseminasi Buatan (BIB) di Indonesia.
Kit halomax merupakan produk komersial dan harus diimpor sehingga harganya mahal dan tidak efisien karena satu jenis kit hanya digunakan untuk menguji kerusakan kromatin DNA pada satu jenis ternak saja. Penggunaan Kit halomax berdasarkan prosedurnya diamati menggunakan mikroskop fluorescent yang sulit didapatkan di BIB, sehingga perlu dilakukan modifikasi dengan pewarnaan tertentu sehingga bisa diamati menggunakan Bright-field microscopy. Pengujian kromatin DNA spermatozoa sangat penting untuk dilakukan sehingga penelitian ini bertujuan untuk mengembangkan metode pengujian dispersi kromatin DNA buatan sendiri dengan prinsip kerja yang sama dengan Kit halomax tetapi dapat digunakan pada spermatozoa ternak yang memiliki morfometri spermatozoa yang hampir sama seperti domba, kambing dan sapi.
Kerangka Pemikiran
Kromatin DNA adalah protein kompleks histon yang bertanggungjawab untuk melindungi materi genetik sel spermatozoa yang dilindungi oleh membran sel tersusun dari 43% lipid, 48% protein, 9% karbohidrat dan zat-zat lain yang bergabung bersama secara non kovalen dan sangat sensitif terhadap faktor-faktor ekstrinsik seperti suhu, kekuatan ionik dan polaritas pelarut. Di dalam kromosom, DNA dibungkus ke dalam susunan kromatin. Kromatin DNA terdiri dari protein histon struktural, dan protein nonhiston. Histon berperan untuk memelihara bentuk dan struktur kromatin. Struktur kromatin dikendalikan oleh berbagai histone modifikasi, mencakup metilasi, fosforilasi, dan asetilasi yang terjadi di aminoterminal histone. Identifikasi kerusakan kromatin DNA spermatozoa penting dilakukan.
menggunakan LMP-agarose. LMP-agarose apabila dilihat secara mikroskopis akan terbentuk seperti pori-pori di mana kerapatan pori-pori ini dipengaruhi oleh konsentrasi LMP-agarose. Semakin tinggi konsentrasi LMP-agarose, maka pori-pori yang terbentuk akan semakin rapat, dan sebaliknya. Lysis Solution (LS) merupakan zat yang dapat melisiskan sel membran namun tidak merusak komponen inti sel. Proses melisiskan sel membran ini dengan cara membuat membran menjadi tidak stabil namun tidak merusak struktur DNA sehingga materi DNA dapat diamati dari luar. Kromatin DNA yang rusak akan keluar, sedangkan kromatin DNA yang masih bagus akan tetap tersusun di antara protamin dan histon sehingga tidak keluar dari sel membran. Setelah sel membran lysis maka dilakukan pewarnaan untuk mengidentifikasi kromatin. Pewarnaan yang sering digunakan untuk pewarnaan spermatozoa pada mikroskop cahaya ialah eosin dan methylen blue.
Tujuan Penelitian Tujuan penelitian ini adalah:
1. Menentukan konsentrasi Low Melting-agarose (LMP-agarose) untuk menjebak spermatozoa sapi, domba dan kambing.
2. Menentukan jenis lysis solution (LS) untuk melisiskan membran sel spermatozoa sapi, domba dan kambing.
3. Memperoleh pewarnaan yang mudah digunakan untuk identifikasi kerusakan kromatin DNA pada spermatozoa ternak yang dapat diamati dengan mikroskop binokuler.
Manfaat Penelitian
Manfaat yang diharapkan dari pelaksanaan penelitian ini adalah diperoleh Kit buatan sendiri untuk menguji kerusakan kromatin DNA spermatozoa ternak.
Hipotesis
1. Konsentrasi 0.7% LMP-agarose dapat digunakan untuk menjebak spermatozoa dengan baik.
2. Jenis LS dengan resep 0.4M Tris, 0.8M DTT, 1% SDS dan 50mM EDTA, pH 7.5 adalah yang terbaik.
3. Pewarnaan terbaik yang dapat digunakan untuk identifikasi kerusakan kromatin DNA spermatozoa ternak adalah kombinasi eosin Y dengan methylen blue satu berbanding satu.
2 TINJAUAN PUSTAKA
Fisiologi Semen dan Morfologi Spermatozoa
4
spermatozoa pada hewan ruminansia berbentuk oval, datar dengan nukleus terdiri atas kromatin yang kompak. Jumlah kromosom yang terdapat pada spermatozoa adalah haploid atau setengah dari jumlah DNA sel somatik pada spesies yang sama, yang dihasilkan dari pembelahan miosis yang terjadi selama pembentukan spermatozoa (Ball dan Peters 2004). Gilbert (1994) menyatakan bahwa spermatozoa terdiri atas suatu inti haploid, sistim penggerak spermatozoa dan kumpulan enzim yang dapat membantu kepala spermatozoa memasuki sitoplasma oosit pada saat fertilisasi. Inti haploid akan mengalami perubahan, demikian halnya dengan DNA akan mengalami pemadatan juga. Lebih lanjut dikatakan bahwa di depan inti sel spermatozoa terdapat akrosom yang berasal dari aparatus golgi dan mengandung banyak enzim-enzim.
Gambar 1 Morfologi Spermatozoa(Schill 2006)
ataupun dari media lingkungan. Lapisan plasma terdiri dari glikoprotein, fosfolipid dan lemak di mana susunannya dapat berubah apabila dalam lingkungan yang kurang sesuai misalnya pada proses pembekuan semen dapat memengaruhi kerusakan membran plasma dan berakibat pada kerusakan DNA.
Komponen Spermatozoa
Aspek yang menentukan kualitas semen adalah motilitas, konsentrasi, morfologi spermatozoa dan keutuhan kromatin DNA. Kromatin DNA merupakan salah satu parameter yang kurang mendapat perhatian pada pengolahan semen di Indonesia, padahal di luar negeri seperti Amerika, Swedia dan Belanda, pengujian keutuhan kromatin DNA merupakan salah satu faktor yang diperhitungkan dalam evaluasi semen cair dan semen beku. Kajian kerusakan kromatin DNA spermatozoa perlu dilakukan mengingat sudah cukup banyak penelitian-penelitian yang membahas korelasi antara kerusakan kromatin DNA dan fertilitas pada berbagai ternak (Sailer et al. 1996). Johnson et al. (1997) menyatakan spermatozoa terdiri atas kepala dan ekor yang keseluruhannya diselubungi oleh membran plasma.
Pada bagian kepala terdapat inti sel dengan DNA yang merupakan materi genetik jantan dan akrosom dengan enzim-enzim hidrolitik dan proteolitiknya yang dibutuhkan untuk menembus cumulus oophorus dan dinding ovum pada saat fertilisasi. Lebih lanjut Sassone-Corsi (2002) menyatakan spermatozoa terdiri atas suatu inti haploid, sistem penggerak spermatozoa dan kumpulan enzim yang dapat membantu inti memasuki sitoplasma oosit pada saat fertilisasi. Kebanyakan organel pada sitoplasma spermatozoa akan menghilang pada saat maturasi berlangsung dan tinggal beberapa organel termodifikasi yang tetap menjalankan fungsi spermatozoa. Selain itu inti haploid juga mengalami perubahan, demikian halnya dengan DNA yang akan mengalami pemadatan. (Aitken dan Krausz 2001). Lebih lanjut dikatakan bahwa di depan inti sel spermatozoa terdapat akrosom yang berasal dari aparatus golgi dan mengandung banyak enzim-enzim pencerna protein dan gula (Arpanahi et al. 2009). Struktur yang melindungi bentuk tiga dimensi inti sel disebut matriks inti. Matriks ini tersusun atas jalinan benang-benang protein yang meliputi seluruh permukaan inti sel, nukleolus, RNA, polisakarida dan selubung yang berisi pori-pori inti. Matriks sama sekali tidak mempunyai histon dan lipid serta hanya mengandung 5% DNA dalam keadaan terlindugi.
6
(Nandre et al. 2011). Selubung inti bertaut dengan filamen sitoplasma intermediet yang menjulur ke plasma membran (Chenoweth 2005).
Salah satu cara dalam mengidentifikasi kerusakan kromatin DNA spermatozoa ternak adalah dengan evaluasi secara morfometrik, yaitu mengukur bagian terpanjang dan terlebar kepala spermatozoa. Pengkajian terhadap morfometri spermatozoa perlu dilakukan untuk mengetahui karakteristik ukuran-ukuran spermatozoa pada berbagai hewan (Gizejewski et al. 2002). Gunarso (1989) menyatakan kajian morfologi dapat dilakukan dengan mikroteknik penggunaan preparat ulas yang diwarnai dengan pewarnaan khusus. Teknik ini direkomendasikan karena cukup mudah dilakukan di lapangan dan pewarnaan (staining) dapat dilakukan di laboratorium untuk selanjutnya dilakukan pengamatan morfologi.
Evaluasi Kerusakan Kromatin DNA Spermatozoa Ternak
Deoxyribose-nucleic acid (DNA) adalah asam nukleat yang mengandung materi genetik dan berfungsi untuk mengatur perkembangan biologis seluruh bentuk kehidupan secara seluler. Struktur DNA, dilihat dari organismenya berbeda. DNA prokariot tidak memiliki protein histon dan berbentuk sirkular, sedangkan DNA eukariot berbentuk linear dan memiliki protein histon. Kerusakan DNA dapat diartikan sebagai semua bentuk perubahan polimer DNA. Perubahan ini dapat memengaruhi proses replikasi dan transkripsi DNA yang mengarah pada kerusakan DNA. Konsekuensi biologisnya dapat berupa kejadian mutasi atau kematian sel bahkan kanker, kemunduran mental dan terkait pertumbuhan dan perkembangan (Meistrich et al. 2003). Kerusakan DNA dapat dilihat dari struktur DNA misalnya kromatin. Kromatin terdiri atas kompleks dari protein kromosonal histon dan non histon dengan DNA sel eukariota (Evenson et al. 2002).
Kromatin adalah kompleks dari asam deoksiribonukleat, protein histon dan protein non histon yang ditemukan pada inti sel eukariota. Kromatin merupakan bahan yang mudah diwarnai oleh suatu zat pewarna dan pada berbagai sel eukariota tingkat tinggi, ada dua bentuk kromatin pada tahap interfase yaitu eukromatin dan heterokromatin. Kromatin terfragmentasi dan menggumpal selama mitosis atau meiosis untuk membentuk wujud seperti batang yang disebut kromosom. Kromosom yang berkembang dari kromatin terbukti tersusun dari sejumlah besar protein dan asam-asam nukleat yang sekarang dikenal sebagai asam deoksiribonukleat. Dua pasang dari tiap protein histon tersebut yaitu histon H2A, H2B, H3 dan H4 membentuk oktamer dengan 145 hingga 147 pasangan basa asam deoksiribonukleat yang membungkusnya membentuk inti nukleosom (Gambar 2) (Prigent et al.1996).
Protamin adalah suatu protein utama di dalam inti spermatozoa yang
kerusakan DNA (Aoki et al. 2006). Selama tahap elongasi spermatid pada saat spermiogenesis sekitar 85 % inti spermatozoa histon akan diganti oleh protamin
(Aulanni’am et al. 2011).
Keseluruhan genom spermatozoa terdapat di dalam pilinan DNA dengan panjang rata-rata 27 kilobite. Pilinan DNA ini berikatan dengan elemen struktural inti yang disebut matriks inti. Histon merupakan protein yang terdiri dari lima sub unit yaitu histon H1, H2A, H2B, H3 dan H4. Sub unit-sub unit ini kaya akan asam amino yang bermuatan positif atau bersifat basa seperti lisin dan arginin. Histon ini akan bereaksi dengan asam deoksiribonukleat melalui interaksi antara protein yang bermuatan positif dengan fosfodiester dari asam deoksiribonukleat yang bermuatan negatif (Strahl dan Allis 2000).
Asosiasi antara satu histon dengan satu segmen asam deoksiribonukleat disebut nukleosom. Asosiasi nukleosom merupakan tahap awal pengemasan asam deoksiribonukleat ke dalam bentuk yang padat. Tiap inti nukleosom terdiri atas delapan protein histon (histon oktamer) yang kompleks dan DNA rantai ganda dengan panjang 147 pasang nukleotida. Kompleks histon oktamer ini masing-masing terdiri atas 4 molekul histon H2A, H2B, H3, dan H4. Modifikasi histon memengaruhi perubahan bentuk kromatin (Martianov et al. 2004).
Gambar 2 Nukleosom yang dibentuk oleh asam deoksiribonukleat (abu-abu) dan histon oktamer Histon H2A , H2B , H3 and H4 (Campbell et al. 2000) Asosiasi pertama deoxyribonucleic acid dengan protein berlangsung dengan histon membentuk struktur nukleosom. Empat subunit histon selain H1 akan membentuk suatu butiran protein oktamer dan setiap subunit terdapat dalam dua rangkap. Asam deoksiribonukleat kemudian akan melekat pada butiran oktamer tersebut. Pada tiap butiran terbentuk dua lilitan deoxyribonucleic acid yang panjangnya 146 pasangan basa (pb). Asosiasi ini merupakan inti
nukleosom. Dua pasang dari tiap protein
histon H2A, H2B,H3 dan H4 membentuk oktamer dengan 145-147 pb deoxyribonucleic acid yang membungkus dan membentuk inti nukleosom.
8
deoksiribonukleat, yaitu masing-masing 10 pb di hilir dan hulu deoxyribonucleic acid unsur inti nukleosom. Satu nukleosom keseluruhannya berasosiasi 166 pb ADN dengan lima jenis protein histon (Balhorn et al. 2000).
Teknik pewarnaan untuk evaluasi morfologi dan kromatin DNA spermatozoa merupakan bagian penting dalam karakterisasi spermatozoa. Identifikasi kerusakan kromatin DNA hingga saat ini belum ditemukan teknik pewarnaan yang mudah digunakan pada mikroskop binokuler . Teknik pewarnaan yang umum digunakan dalam evaluasi spermatozoa adalah pewarnaan eosin. Eosin merupakan zat warna dengan sifat asam dan termasuk ke dalam kelompok molekul yang memiliki cincin kuinoid yang ditautkan pada cincin non-kuinoid melalui atom-atom C dan O, sedangkan Methylen blue sering digunakan sebagai pewarna inti (Griesbeck et al. 2012).
3 METODE PENELITIAN
Tempat dan Waktu PenelitianPenelitian dilaksanakan di Laboratorium Biokimia Pusat Studi Satwa Primata (PSSP), Laboratorium Reproduksi Unit Rehabilitasi Reproduksi (URR), Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor (FKH-IPB). Penelitian ini berlangsung selama lima bulan, dimulai pada bulan Februari sampai bulan Juni 2015.
Metode Penelitian
Penelitian dibagi ke dalam tiga tahap. Tahap pertama adalah menentukan konsentrasi Low Melting Point-agarose (LMP-agarose) untuk menjebak spermatozoa, tahap kedua adalah mencari komposisi lysis solution terbaik dalam melisis membran spermatozoa dan tahap ketiga adalah mencari bahan pewarnaan terbaik.
Penelitian I. Menentukan konsentrasi Low Melting Point-agarose (LMP -agarose) Terbaik.
Pembuatan LMP-agarose
Pada penelitian ini konsentrasi LMP-agarose yang digunakan ada tiga jenis yaitu 0.6%; 0.7% dan 0.8% dengan komposisi seperti pada Tabel 1. Selanjutnya LMP- agarose yang telah dibuat dimasukkan dalam mikrotub 5 ml dan disimpan dalam suhu 5oC.
Tabel 1 Konsentrasi Low Melting Point-agarose (LMP-agarose)
Bahan Konsentrasi LMP-agarose
0.6 % 0.7% 0.8%
LMP (g) 0.6 0.7 0.8
Aquadest (mL) 100 100 100
Semen yang digunakan untuk menguji LMP-agarose ini adalah semen segar sapi, domba dan kambing. Semen dikoleksi menggunakan vagina buatan, dievaluasi secara makro dan mikroskopis kemudian semen dari masing-masing ternak diencerkan dengan PhosphateBufer Saline (PBS) hingga 20 juta sel/ml.
Pengujian Kerapatan LMP-agarose
Tiga konsentrasi LMP-agarose dilelehkan dalam water bath (100°C) selama 5 menit, kemudian dipindahkan ke water bath 37°C. Semen segar (sapi, kambing dan domba) yang sudah diencerkan diteteskan ke dalam LMP-Agarose. Sebanyak 20µL campuran LMP-agarose dengan semen diteteskan masing-masing
ke dalam “sumur” pada object glass khusus dan ditutup dengan cover glass. Object glass diinkubasi dalam lemari es (4°C). Cover glass diambil dengan cara digeser ke samping, selanjutnya object glass dievaluasi di bawah mikroskop binokuler (Olympus CX21), dan spermatozoa yang terdapat dalam masing-masing konsentrasi dari masing-masing ternak dihitung dari sepuluh lapangan pandang.
Penelitian II. Pengujian Jenis Lysis solution (LS) untuk Melisis Membran Spermatozoa
Persiapan lysis solution.
Jenis LS yang digunakan adalah Jenis LS 1 mengadopsi resep Chohan et al. (2006) yaitu campuran dari 0.4 M Tris, 0.8M DTT, 1% SDS, pH 7.5. Jenis LS 2 mengadopsi Fernandez et al. (2003) yaitu campuran dari 0.4 M Tris, 2 M NaCl, 1% SDS, pH 7.5. Jenis LS 3 mengadopsi Enciso et al. (2005). 0.4 M Tris-HCl, 2 M NaCl, 1% SDS, 0.05 M EDTA, pH 7.5. Seluruh LS yang telah dibuat disimpan pada tabung, dan disimpan pada suhu 5oC.
Sampel semen untuk pengujian LS.
Struktur sel pada spermatozoa sapi, kambing dan domba memiliki struktur sel yang sama sehingga dalam pengujian jenis lysis solution (LS) digunakan hanya satu jenis spermatozoa ternak yaitu spermatozoa sapi. Sampel semen yang digunakan untuk pengujian LS adalah semen beku sapi, yang diperoleh dari BIB Lembang. Semen beku disimpan pada kontainer (-196oC). Sebelum pengujian semen beku dithawing pada suhu 37oC selama 30 detik. Semen yang telah di-thawing masing-masing disimpan dalam mikrotub, selanjutnya semen beku sapi diencerkan menggunakan PBS, dengan konsentrasi akhir 15-20 juta sel/mL.
Pengujian LS pada semen beku
LMP-agarose terbaik pada tahap I yang sudah dilelehkan dan disimpan pada suhu 37°C. Sebanyak 50µL semen yang sudah diencerkan, dimasukan ke dalam tabung yang berisi LMP-agarose dan dihomogenkan. Campuran agarose dan semen selanjutya diteteskan dalam tiga buah object glass, ditutup cover glass, dan diinkubasi pada suhu 4°C selama 5menit. Cover glass kemudian diangkat perlahan dari samping, setelah itu dilakuan pengamatan menggunakan mikroskop binokuler.
10
dilanjutkan dengan direndam dalam etanol 70%, 90%, 100% (masing-masing 4 menit), dan dikeringkan. Setelah itu preparat diinkubasi dalam aquadest selama 5menit, kemudian dikeringanginkan dan direndam dalam eosin yellow (Eosin Y) 1% selama 5 menit, direndam dalam aquadest selama 5 menit, dilanjutkan dengan direndam dalam methylen blue selama 5 menit dan terakhir direndam dalam aquadest selama 5 menit. Preparat diangkat dan dikeringanginkan. Pengamatan dilakukan di bawah mikroskop binokuler dengan pebesaran 400X. Kepala spermatozoa yang mengeluarkan benang-benang kromatin menandakan bahwa membran sel spermatozoa di lisis oleh lysis solution (LS).
Tahap III. Pengujian jenis pewarnaan
Persiapan pewarna.
Jenis pewarnaan yang digunakan pada penelitian ini adalah; a) Pewarnaan bertahap Eosin Y dengan Methylene blue 1:1, b) Pewarnaan campuran Eosin Y digunakan pada tahap II, kemudian dimasukkan dalam LMP-agarose terbaik tahap I, dan dimasukkan pada LS terbaik tahap II.
Pengujian pewarna
Semen diwarnai dengan tiga macam pewarnaan berbeda sesuai metode tahap II. Preparat diamati di bawah mikroskop binokuler dengan perbesaran 400X menggunakan green filter. Pewarnaan yang dapat mewarnai benang-benang kromatin DNA spermatozoa dengan jelas merupakan pewarnaan yang dapat digunakan untuk mendeteksi kerusakan kromatin DNA spermatoza ternak.
Analisis Data
Percobaan Tahap 1 diuji secara kualitatif disajikan bentuk rataan dan standard eror mean (SEM) yang dianalisis menggunakan microsoft excell. Penelitian pada Tahap II dan III dianalisis secara deskriptif.
4 HASIL DAN PEMBAHASAN
Konsentrasi LMP-Agarose Terbaik untuk Menjebak Spermatozoa Ternak LMP-agarosa merupakan polisakarida turunan yang didapat dari alga merah yang digunakan untuk memisahkan DNA berukuran lebih dari 100bp, sedangkan untuk memisahkan DNA dengan ukuran lebih pendek dapat digunakan gel poliakrilamid (Surzycky 2000). LMP-agarosa merupakan bahan yang dapat memisahkan substansi berdasarkan ukuran substansi tersebut, ukuran pori-pori agarose dipengaruhi oleh tingkat konsentrasinya.
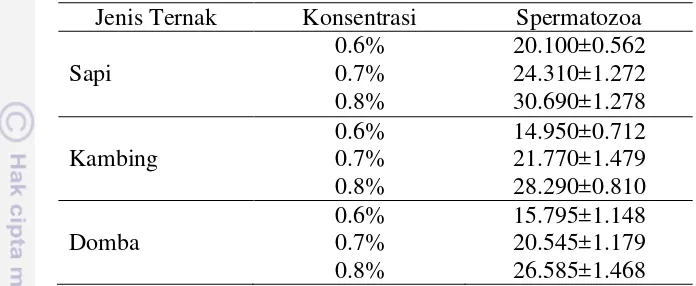
konsentrasi 0.8% LMP-agarose merupakan konsentrasi terbanyak untuk menjebak spermatozoa dengan jumlah 30.69±1.28 sel. Pada semen kambing dan domba konsentrasi LMP-agarose yang sama, spermatozoa yang terjebak paling banyak adalah 28.29±0.81 dan 26.58±1.47 sel (Tabel 2).
Tabel 2 Jumlah spermatozoa yang terjebak di dalam LMP-agarose (rata-rata±SD)
Merujuk kepada Cerolini et al. (2001) jumlah spermatozoa dalam satu lapang pandang agar mudah diamati adalah 10-15 sel spermatozoa. Berdasarkan hal tersebut pada penelitian ini konsentrasi LMP-agarose yang paling baik untuk menjebak dan mengamati spermatozoa kambing dan domba adalah konsentrasi 0.6% dengan jumlah spermatozoa yang teramati pada satu lapang pandang sebanyak 15 sel spermatozoa kambing dan 16 sel spermatozoa domba. Pada sapi, jumlah spermatozoa yang terjebak pada konsentrasi 0.6% LMP-agarose masih melebihi batas lapang pandang terbaik, sehingga pada spermatozoa sapi disarankan konsentrasi agarose dapat diturunkan untuk memudahkan pengamatan. Terjebaknya spermatozoa di dalam LMP-agarose diduga dikarenakan ukuran morfometri spermatozoa ternak lebih besar dibandingkan dengan pori-pori LMP-agarose. Bartlett dan Stirling (2003) menyatakan semakin tinggi konsentrasi agarose, semakin kaku gel yang dibuat dan pori-pori yang terbentuk semakin rapat sehingga sukar untuk dilewati molekul-molekul DNA. Konsentrasi agarose yang lebih tinggi memudahkan pemisahan DNA yang berukuran kecil, konsentasi agarose yang lebih rendah memudahkan pemisahan DNA dengan ukuran yang lebih besar.
Berdasarkan morfometrinya, panjang kepala spermatozoa sapi 0.6 µm lebih panjang dari kepala spermatozoa kambing dan domba, demikian juga lebar kepala spermatozoa sapi lebih lebar sekitar 0.20µm dibandingkan lebar kepala spermatozoa domba dan kambing (Tabel 3).
Tabel 3 Morfometri Spermatozoa Ternak
Jenis Ternak Spesifikasi Spermatozoa
Panjang Kepala (µm) Lebar Kepala (µm)
Sapi 8.94±0.24 4.59±0.24
Kambing 8.32± 0.24 4.30±0.24
Domba 8.33±0.24 4.32±0.22
Sumber : Tappa et al. (2007)
Jenis Ternak Konsentrasi Spermatozoa
12
Lebih panjang dan lebih lebarnya morfometri spermatozoa sapi memiliki arti bahwa morfometri spermatozoa sapi lebih besar daripada kambing dan domba. Oleh karena itu, pada konsentrasi LMP-agarose 0.6% jumlah spermatozoa sapi akan lebih banyak terjebak dibandingkan kedua ternak lainnya.
Lysis Solution (LS) Terbaik untuk Melisiskan Membran Spermatozoa Ternak
Menurut Holme dan Hazel (1998) tahap pertama dalam isolasi DNA adalah proses perusakan atau penghancuran membran dan dinding sel yang bertujuan untuk mengeluarkan isi sel. Metode yang dapat digunakan untuk isolasi plasmid antara lain yaitu boiling lysis, lysis with detergent, mechanical lysis, alkaline lysis, dan enzimatic digestion.
Pada penelitian tahap II, spermatozoa yang digunakan adalah spermatozoa yang bersumber dari semen beku sapi. Hal ini disebabkan komposisi membran sel dari ketiga spermatozoa ternak tersebut hampir sama yaitu terdiri dari 43% lipid, 48% protein, 9% karbohidrat dan zat-zat lain yang bergabung bersama secara non kovalen.Membran spermatozoa berfungsi untuk pemeliharaan integritas membran dan membentuk permukaan yang dinamis antar sel serta sebagai perlindungan terhadap lingkungan (Watson 2000).
Integritas membran spermatozoa adalah keutuhan membran spermatozoa atau suatu keadaan yang menunjukkan mekanisme fungsi fisiologis membran tetap terjaga sebagai kontrol terhadap sistem transport, motilitas dan viabilitas spermatozoa mempengaruhi fungsi integritas membran spermatozoa dalam ejakulasi spermatozoa yang mengalami kerusakan membran tidak dapat menunjukkan pembengkakan di bawah kondisi hypoosmotic (Esteves et al. 2008). Lipid merupakan komponen membran spermatozoa yang berperan penting dalam menjaga stabilitas dan kelangsungan hidup spermatozoa secara keseluruhan termasuk kemampuan spermatozoa untuk mengkapasitasi serta membuahi sel telur. Beberapa peneliti melaporkan lipid membran spermatozoa tersusun dari fosfolipid, kolesterol, triasilgliserol dan asam lemak bebas (Dorota dan Kurpisz 2004). Fosfolipid merupakan komponen utama lipid membran spermatozoa yang membentuk membran lapis ganda, kepala fosfolipid hidrofilik dan fosfolipid hidrofobik yang sangat penting kaitannya dengan proses fertilisasi dan mempertahankan ketidakstabilannya selama pembekuan adalah fosfolipid dan kolesterol.
Kepala fosfolipid hidrofilik membentuk permukaan membran bagian luar sedangkan kepala hidrofobik membentuk permukaan membran bagian dalam (Darnell et al. 1990). Di antara lapisan kepala fosfolipid hidrofilik dan kepala fosfolipid hidrofobik terdapat protein globular dan fibrous dengan distribusi yang bervariasi, protein-protein ini bersifat dinamis dan dapat bergerak bebas diantara kedua lapisan fosfolipid. Protein-protein pada membran ini ada yang terletak secara vertikal sehingga sebagian masuk dan menembus ke dalam dua lapisan fosfolipid (lipid bilayer) serta berinteraksi dengan bagian hidrofilik dari lipid membran yang disebut protein integral.
cahaya, aroma, hormon, obat-obatan, faktor penumbuh dan transporter), sebagai enzim dan antigen yang terlibat dalam pengenalan kepala spermatozoa (misalnya adesi zona pelusida-spermatozoa, induksi reaksi akrosom dan fusi spermatozoa sel telur). Pada bagian luar dari kedua lapisan fosfolipid terdapat karbohidrat yang sebagian besar berbentuk glikokaliks, merupakan oligosakarida yang berikatan dengan protein dan membran lipid, karbohidrat membran spermatozoa selain berfungsi sebagai sumber untuk pembentukan Adenosine Triposphate (ATP) juga berperan penting dalam membantu proses kapasitasi dan reaksi akrosom spermatozoa (Herrero et al. 2009).
Hasil penelitian pada tahap II menunjukkan bahwa spermatozoa yang diberi LS III (0.4M Tris-HCl, 2M NaCl, 1% SDS, 0.05M EDTA) dapat melisiskan membran sel spermatozoa ternak. Hal tersebut dapat dilihat pada Gambar 3.c, pada kepala spermatozoa ternak terdapat benang-benang kromatin berwarna merah yang menunjukkan adanya kerusakan kromatin DNA pada semen beku tersebut.
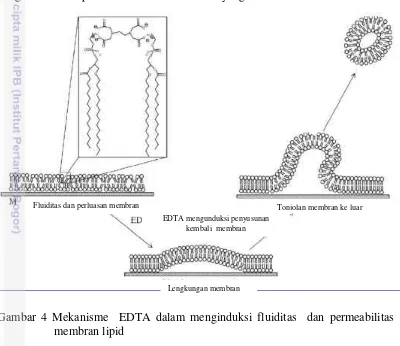
Hal ini diduga karena LS III mengandung EDTA yang berfungsi sebagai chelating agent pada proses melisiskan membran spermatozoa ternak. Ethylenediaminetetraacetic acid (EDTA) adalah pengkelat hexadentate (mempunyai enam tangan) yang mampu mengikat ion logam secara stoikiometri melalui empat gugus karboksilat dan dua kelompok amina tersier (Gyliene dan Aikaite 2003). Pelisisan membran sel dipicu interaksi molekuler antara kepala lipid dengan molekul EDTA yang mengakibatkan fluiditas dan penonjolan komponen lipid ke luar dalam interkalasi membran lipid dan pengikatan ion Gambar 3 Spermatozoa yang ditetesi Lysis Solution (LS) (a) Spermatozoa yang
diberi LS I; (b) Spermatozoa yang ditetesi LS II; (c) Spermatozoa yang diberi LS III.
a
b
14
logam. Hal ini kemudian menyebabkan ketidakstabilan membran dan melisiskan sel (Corkill dan Rapley 2008).
Prachayasittikul et al. (2007) menyatakan EDTA cenderung mengalami interkalasi dengan molekul fosfolipid melalui pembentukan jembatan garam yang melibatkan gugus amonium positif dari kolin dan gugus karbonil dari EDTA. Jembatan garam adalah bentuk khusus ikatan hidrogen kuat yang berperan penting dalam struktur dan fungsi protein (Kumar et al. 2001). Adanya jembatan garam dalam proses ini sesuai dengan metode yang dikemukakan oleh Kumar dan Nussinov (1999) sebagai gugus atom dengan muatan parsial yang berlawanan dalam jarak 3.5 Å.
Muladno (2002) menyatakan proses isolasi DNA menggunakan LS yang mengandung EDTA berfungsi merusak membran sel secara kimiawi dengan cara mengikat ion magnesium, selain itu EDTA juga berfungsi mempertahankan integritas sel maupun aktifitas enzim nuclease yang merusak asam nukleat.
Gambar 4 Mekanisme EDTA dalam menginduksi fluiditas dan permeabilitas membran lipid
Interaksi kuat antara EDTA dan gugus kepala lipid, yang berhubungan dengan tekanan area isotermal pada beberapa EDTA sehingga tetap melekat pada monolayer pada tekanan permukaan yang tinggi hingga 45 mN/m. Penyisipan EDTA ke dalam membran lipid memperluas permukaan dan memengaruhi struktural himpunan domain. Keterbatasan area yang tersedia pada membran lipid saat interkalasi EDTA ke dalam gugus kepala lipid menyebabkan adanya introduksi stres mekanik himpunan lipid, merangsang terjadinya lengkungan dan penonjolan membran (Prachayasittikul et al. 2005). Tonjolan tersebut kemudian dikeluarkan dari membran lipid, diikuti dengan penataan ulang membran.
Lengkungan membran
Fluiditas dan perluasan membran Tonjolan membran ke luar
Mekanisme yang diawali induksi EDTA terhadap fluiditas dan destabilisasi membran secara skematis digambarkan pada Gambar. 4.
Beberapa pernyataan di atas mendukung bahwa LS3 yang mengandung EDTA merupakan LS yang terbaik dalam melisiskan membran sel spermatozoa ternak.
Jenis Pewarnaan Terbaik untuk Mewarnai Kromatin DNA
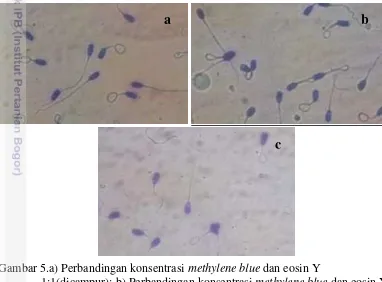
Hasil penelitian menunjukkan bahwa pewarnaan eosin Y methylen blue 1:2 memberi hasil yang lebih baik (kromatin DNA mudah diamati) bila dibandingkan dengan kedua konsentrasi.
Hal tersebut terlihat jelas pada Gambar 5.c kromatin dan membran sel spermatozoa dapat lebih jelas terlihat bila dibandingkan dengan kedua pewarna lainnya. Menurut Benson dan Brown (2004) pewarnaan eosin yellow (Eosin Y) secara khas digunakan dalam konsentrasi 1% sampai 5 % volume, yang dilarutkan dalam air atau etanol sedangkan untuk methylen blue (MB) konsentrasi yang digunakan ialah 0.5% sampai 1%.
Gambar 5.a) Perbandingan konsentrasi methylene blue dan eosin Y
1:1(dicampur); b) Perbandingan konsentrasi methylene blue dan eosin Y 1:1; c) Perbandingan konsentrasi methylene blue dan eosin Y 1:2
Menurut Harley dan Prescott (2002) MB dan eosin merupakan zat warna yang sering digunakan dalam pewarnaan sederhana, dimana MB dapat bekerja dengan baik pada membran sel karena bersifat basa alkalin (komponen kromofiknya bermuatan positif), sedangkan sitoplasma sel spermatozoa bersifat basofilik (suka terhadap basa) sehingga terjadilah gaya tarik antara komponen kromofor pada pewarna dengan sel spermatozoa. Hal tersebut menyebabkan sel spermatozoa dapat menyerap pewarna dengan sel spermatozoa. Eosin digunakan
b
a
16
pada pewarnaan negatif yang merupakan pewarna asam dan memiliki komponen kromofik yang bermuatan negatif, yang juga dimiliki oleh sitoplasma spermatozoa. Sehingga pewarna tidak dapat menembus atau terpenetrasi ke dalam sel spermatozoa karena muatan negatif pada permukaan sel spermatozoa.
5 SIMPULAN DAN SARAN
SimpulanPengembangan metode identifikasi kerusakan DNA spermatozoa ternak domba dan kambing dapat dibuat menggunakan konsentrasi LMP-agarose 0.6%, dengan lysis solution III (0.4 M Tris-HCl, 2 M NaCl, 1% SDS, 0.05 M EDTA, pH 7.5) dan diwarnai dengan menggunakan perbandingan pewarnaan Eosin Yellow dan Methylene blue 2:1.
Saran
DAFTAR PUSTAKA
Aitken R, Krausz C. 2001. Oxidative stress DNA damage and the Y chromosome. Reproduction. 122:497-506.
Aoki VW, Liu L, Jones KP, Hatasaka HH, Gibson M, Peterson CM, Carrell DT. 2006. Sperm protamine 1 protamine 2 ratios are related to in vitro fertilization pregnancy rates and predictive of fertilization ability. Mol. Reprod. Dev. 86(5): 14-15.
Arpanahi AM, Brinkworth M, Iles D, Krawetz SA, Paradowska A, Platts AE, Saida M, Steger K, Tedder P, Miller D. 2009. Endonuclease sensitive regions of human spermatozoal chromatin are highly enriched in promoter and CTFC binding sequences. Genome Research. 19:1338-1349.
Aulanni’am M, Akmal MA, Widodo SB, Sumitro, Purnomo BB. 2011. Inhibin B menghambat ekspresi molekul protamine P2 di dalam kepala spermatozoa tikus (Rattus norvegicus). J. Ked. Hewan. 5(2): 78-83.
Ball PJH, Peters AR. 2004. Reproduction in Cattle 3rd Edition. Oxford. UK: Blackwell Publishing Ltd.
Balhorn R, Brewer L, Corzett M. 2000. DNA condensation by protamine and arginine rich peptides: Analysis of toroid stability using single DNA molecules. Mol. Reprod. Dev. 56:230-234.
Bartlett J, Stirling D. 2003. PCR Protocols 2nd Edition. New Jersey: Humana
Press.
Benson HJ, Brown AE. 2004. Benson's Microbiological Applications Laboratory Manual in General Microbiology: Complete Version. 9th Ed. New York: The McGraw-Hill Companies.
Campbell NA, Reece JB, Mitchell LG. 2000. Biology 5th Edition. California: Addison Wesley Longman Inc.
Cerolini S, Maldjian A, Pizzi F, Gliozzi TM. 2001. Changes in sperm quality and lipid composition during cryopreservation of Boar semen. J Rep. 121:395-401.
Chenoweth PJ. 2005. Genetic sperm defect. Theriogenology. 56:557-567.
Corkill G, Rapley R. 2008. The Manipulation of Nucleic Acids: Basic Tools and Techiques in Molecular Biomethods Handbook 2nd Edition. New Jersey (USA): Humana Press.
Corzett M, Mazrimas J, Balhorn R. Protamine 1: protamine 2 stoichiometry in the sperm of eutherian mammals. Mol Reprod Dev. 2002. 61: 519–527.
Darnell J, Lodish H, Baltimore D, 1990. Molecular Cell Biology 2nd Edition. New York: Scientific American Book Inc.
Dorota S, Kurpirsz M. 2004. Reactive oxygen species and sperm cell. J Reprod Bio & Endo. 2:1-7.
Evenson DP, Wixon R. 2006. Clinical aspects of sperm DNA fragmentation detection and male infertility. Theriogenology. 65:979-991.
Evenson DP, Larson KL, Jost LK. 2002. Sperm chromatin structure assay: its clinical use for detecting sperm DNA fragmentation in male infertility and comparisons with other techniques. J Andro. 23: 25-43.
18
comparison of the carboxyterminal region of lycoprotein C (gC) of bovine herpesviruses (BoHV) 1.1, 1.2 and 5 from South America (SA). Vir. Res. 131: 16–22.
Gilbert SF. 1994. Developmental Biology 4th Edition. Massachusetts: Sinauer
Associates Inc.
Gizejewski Z, Marta W, Jolanta P. 2002. Seasonal Changes in the Dimensions of Red Deer (Cervus elaphus) Spermatozoa. M Polish Academy of Sciences. Research Station for Ecologycal Agriculture and Preserve Animal Breeding: 244-251.
Gyliene O, Aikaite J. 2003. Formation of binuclear EDTA and Cu (II) complexes in aqueous solutions. Polish J Chem. 77: 99−104.
Harley P, Prescott J. 2002. Laboratory Exercises in Microbiology 5rd Edition. New York: The McGraw−Hill Companies.
Herrero M, Thornton PK, Gerber P, Reid RS. 2009. Livestock, livelihoods and the environment: understanding the trade-offs. Curr Opin Env Sust. 1: 111-120. Holme DJ, Hazel P. 1998. Analytical Biochemistry 3rd Edition. London: Addision
Wesley Longman.
Johnson MH, Everit BJ. 2000. Essential Reproduction 5th Edition. United Kingdom: Blackwell Science Ltd.
Johnson L, Blanchard TL, Varner DD, Scrutchfield WL. 1997. Factors affecting spermatozogenesis in the stallion. Theriogenology. 48:1199-1216.
Kumar S, Wolfson HJ, Nussinov R. 2001. Protein flexibility and electrostatic interactions. IBM J Res Dev. 45: 499−512.
Kumar S, Nussiniv R. Salt bridge stability in monomeric proteins. J Mol Biol. 293: 1241-1255.
Morrell JM, Rodriguez-Martinez H. 2009. Biomimetic techniques for improving sperm quality in animal breeding: a review. TheOpen J Androl 1 : 1-9. Langdon WC. 2012. A comparative study on equine sperm chromatin using tehe
sperm chromatin structure asay and the sperm halomax kit. (dissertation). Texas (USA). Texas Tech University.
Lewis SE, Aitken RJ. 2005. DNA damage to spermatozoa has impacts on fertilization and pregnancy. Cell Tissue Res. 322(1):33-41.
Martianov I, Brancorsini S, Catena R, Gansmuller A, Kotaja N, Parvinen M, Sassone P, Davidson I. 2004. Polar nuclear localization of H1T2, a histone H1 variant, required for spermatid elongation and DNA condensation during spermiogenesis. Proc Natl Acad Sci U S A. 102 (8).
Meistrich ML, Mohapatra B, Shirley CR, Zhao M. 2003. Roles of transition nuclear proteins in spermiogenesis. Chromosoma. 111: 483-488.
Mengual l, Ballesca JL, Ascaso C, Oliva R. 2003. Marked Differences in Protamine Content and P1/P2 Rations in Sperm Cells from Percoll Fractions Between Patients and Control. J Androl. 24 : 438-447.
Nandre R, Derashari H, Joshi C. 2011. Evaluation of buffalo bull spermatozoa DNA damage using single cell grl elctrophoredid. A review. J Life Science and Pharm Research. 1:38-43.
Nishizono H, Shioda M, Takeo T, Irie T, Nakagata N. 2004. Decrease of fertilizing ability of mouse spermatozoa after freezing and thawing is related to cellular injury. Bio of Rep. 71: 973-978.
Oliva R. 2006. Protamine and male infertility. J Hum Rep. 12: 417-435.
Prachayasittikul V, Na Ayudhya CI, Hilterhaus L, Hinz A, Tantimongcolwat T, Galla HJ. 2005. Interaction analysis of chimeric metal-binding green fluorescent protein and artificial solid-supported lipid membrane by quartz crystal microbalance and atomic force microscopy. Biochem Biophys Res Commun. 327: 174−182.
Prachayasittikul V, Na Ayudhya CI, Tantimongcolwat T, Nantasenamat C, Galla H. 2007. EDTA-induced membrane fluidization and destabilization: biophysical studies on artificial lipid membranes. Acta Biochim Biophys Sin. 39(11): 901–913.
Prigent Y, Müller S, Dadoune JP. 1996. Immunoelectron microscopical distribution of histones H2B and H3 and protamines during human spermiogenesis. Mol. Hum. Reprod. 2: 929–935.
Priyanto L, Arifiantini RI, Yusuf TL. 2015. Deteksi kerusakan DNA spermatozoa semen segar dan semen beku sapi menggunakan pewarnaan toluidine blue. J Vet. 16(2): 48-55.
Rodriguez-Martinez H. 2009. State of the art in farm animal sperm evaluation. Rep Fertil Dev. 19: 91-101.
Sailer BL, Jost LK, Evenson DP. 1996. Bull sperm head morphomrtry related to abnormal chromatin structure and fertility. Cytometry. 24: 167-175.
Sassone-Corsi P. 2002. Unique chromatin remodeling and transcriptional regulation in spermatogenesis. Science. 296: 2176–2178.
Schill WB, Comhaire FH, Hargreave TB. 2006. Andrology for the Clinician. Springer. Berlin. 2006:598–607.
Strahl, BD dan Allis, CD. 2000. The language of covalent histone modifications. Nature. 403: 41-45.
Surzycky R. 2000. Molecular and Cellular Biology. Wadsworth Inc., Belmont. Tappa B, Afiati F, Said S. 2007. Identifikasi kepala spermatozoa sapi, kambing
dan domba secara morfometri. J Protein. 15: 159-165.
Watson PF. 2000. The causes of reduce fertility with cryopreserved semen. Anim Reprod Sci. 60-61:481-492.
20