IDENTITAS BERBASIS MOLEKULER GALUR-GALUR
Rhizopus
ASAL TEMPE SEGAR DARI BERBAGAI DAERAH
DI INDONESIA
ANASTASIA TATIK HARTANTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Identitas Berbasis Molekuler Galur-Galur Rhizopus Asal Tempe Segar dari Berbagai Daerah di Indonesia adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014
Anastasia Tatik Hartanti
RINGKASAN
ANASTASIA TATIK HARTANTI. Identitas Berbasis Molekuler Galur-Galur
Rhizopus Asal Tempe Segar dari Berbagai Daerah di Indonesia. Dibimbing oleh GAYUH RAHAYU dan IMAN HIDAYAT.
Rhizopus Ehrenb. (Zygomycetes, Zygomycota) merupakan cendawan yang bernilai ekonomi penting karena kontribusinya pada berbagai aspek kehidupan manusia, seperti sumber suplemen makanan, enzim, dan agens bioteknologi industri. Oleh sebab itu, identitas dari galur-galur Rhizopus menjadi penting.
Dalam 30 tahun terakhir, taksonomi dan identifikasi Rhizopus berubah dari pendekatan morfologi dan fisiologi ke pendekatan molekuler. Dengan pendekatan morfologi, Rhizopus dibagi dalam tiga grup, yaitu grup R. microsporus, grup R. oryzae, dan grup R. stolonifer. Pada tahun 2007, berdasarkan kombinasi morfologi, fisiologi, kompatibilitas sistem kawin, dan data molekuler, Zheng et al. mengenal 10 spesies Rhizopus dengan 7 varietas, yaitu R. americanus, R. arrhizus var. arrhizus, var. delemar, dan var. tonkinensis, R. caespitosus, R. homothallicus; R. microsporus var. microsporus, var. azygosporus, var. chinensis, var. oligosporus, var. tuberosus dan var. rhizopodiformis, R. niveus, R. reflexus,
R. schipperae, R. stolonifer, dan R. sexualis. Pada tahun 2010, Abe et al. menerima delapan spesies Rhizopus versi Zheng et al. (2007) dengan menempatkan R. niveus sebagai sinonim R. delemar, R. sexualis dan R. americanus sebagai sinonim R. stolonifer, dan mempertahankan R. oryzae dengan melibatkan sekuen gen internal transcribed spacer (ITS) rDNA, gen aktin, dan gen translation elongation factor 1α (EF-1α). Kemudian pada tahun 2013, Dolatabadi et al. menggunakan konsep Genealogy Concordance Phylogenetic Species Recognition (GCPSR) dari gen ITS, aktin, dan EF-1α, sifat fisiologi
termasuk suhu pertumbuhan maksimum, morfologi spora, uji tipe kawin, profil yang dihasilkan MALDI-ToF, dan ekologi, untuk mengevaluasi takson infraspesifik Rhizopus microsporus. Mereka menegaskan bahwa R. microsporus
tidak dapat dibagi ke takson infraspesifik.
Perubahan terbaru dalam sistematika Rhizopus ini mempengaruhi status taksonomi Rhizopus, termasuk Rhizopus dari tempe segar Indonesia. Dahulu
Rhizopus di Indonesia diidentifikasi terutama dengan pendekatan morfologi dan sidik jari DNA. Pada tahun 1970, Dwijoseputro dan Frederick mengidentifikasi 4 spesies Rhizopus, yaitu R. oligosporus, R. oryzae, R. arrhizus, dan R. stolonifer
pada tempe dan ragi tempe yang berasal dari Jakarta, Surakarta, dan Malang. R. oligosporus banyak dinyatakan sebagai inokulan tempe dari berbagai daerah di Indonesia pada tahun 2000-an, meskipun Schipper dan Stalpers pada tahun 1984 menempatkan oligosporus sebagai varietas dari R. microsporus. Pada sistem terkini, cara ini yang belum dapat mengidentifikasi Rhizopus secara tepat. Re-identifikasi Rhizopus asal tempe ini diperlukan untuk menunjang upaya standardisasi mutu tempe yang memerlukan inokulan dengan identitas yang tepat. Hasil penelitian ini diharapkan dapat menjadi informasi terkini, tentang taksonomi
Rhizopus pada tempe segar di Indonesia.
fisiologi, dan analisis molekuler filogenetik berdasarkan sekuen gen ITS pada DNA ribosom dan gen EF-1α.
Kultur murni diperoleh dengan cara mengambil hifa secara aseptik dan menginokulasinya pada medium potato dextrose agar (PDA), lalu diinkubasi pada suhu ruang. Kultur dimurnikan dan diperbanyak untuk kultur kerja, dan kultur stok. Kultur stok disimpan dalam medium trehalosa-gliserol pada suhu -80 oC. Galur Rhizopus hasil koleksi ini disimpan di Institut Pertanian Bogor Culture Collection (IPBCC), Departemen Biologi, FMIPA, IPB.
Analisis molekuler dimulai dengan ekstraksi DNA dari massa miselium yang ditumbuhkan pada medium miring PDA selama 3 hari. Ekstraksi DNA dilakukan menggunakan DNA PhytopureTM Kit Extraction (GE Healthcare, Inggris) sesuai dengan protokol pabrik. Amplifikasi Polymerase Chain Reaction daerah rDNA ITS menggunakan sepasang primer ITS5 (5'-GGAAGTAAAAGTCGTAACAAGG-3') dan ITS4 (5'-TCCTCCGCTTATTGA TATGC-3'). Amplifikasi gen EF-1α menggunakan sepasang primer MEF-10 (5'-GTTGTCATCGGTCACGTCGATTC-3') dan MEF-4 (5'-ATGACACCRACAG CGACGGTTTG-3'). Sekuen yang diperoleh dari primer ITS rDNA untuk semua galur dan EF-1α dari anggota R. microsporus diedit dengan program Chromas Pro 1.41. Semua sekuen ITS yang diperoleh, kemudian disejajarkan dengan sekuen rujukan yang diunduh dari pangkalan data DNA menggunakan program
molecular evolution and genetic analysis (MEGA) versi 5.05. Pada analisis ini, kekerabatan dianalisis dengan metode Maximum Likelihood yang melibatkan semua galur koleksi, dan Neighbor Joining untuk galur koleksi R. microsporus. Dukungan untuk cabang internal diperoleh dengan analisis bootstrap (BS) 1000 ulangan. Nilai BS sebesar 50% atau lebih akan ditampilkan. Pohon filogenetik yang dihasilkan dari analisis tersebut, diolah dengan perangkat lunak TreeGraph
versi 2.
Morfologi galur Rhizopus diamati sesuai dengan standar monograf Rhizopus
yang ditulis oleh Zheng et al. pada tahun 2007 dengan menggunakan mikroskop cahaya (Olympus BX53). Karakter fisiologi Rhizopus yang diamati ialah pertumbuhan Rhizopus pada suhu 33, 42, 46, 48 dan 51oC.
Dua spesies Rhizopus, yaitu R. delemar dan R. microsporus ditemukan berasosiasi dengan sampel tempe segar dari 26 lokasi di Indonesia. R. delemar
hanya ditemukan dari sampel tempe yang berasal dari satu lokasi (Palu, Sulawesi Tengah), sedangkan R. microsporus ditemukan dari tempe yang berasal dari berbagai lokasi di Sumatera, Jawa, Bali, Lombok, Nusa Tenggara Timur, Kalimantan, Sulawesi (selain di Palu), dan Papua Barat. Tidak ditemukannya R. delemar pada tempe yang berasal dari pulau Jawa, mengindikasikan adanya sumber daya genetik yang hilang. Hilangnya species ini diduga berkaitan dengan penggunaan inokulan komersial yang berbasis R. microsporus. Spesies lain seperti R. stolonifer dan R. oryzae yang sebelumnya pernah dilaporkan berasosiasi dengan tempe di Indonesia, juga tidak ditemukan pada penelitian ini, sedangkan
R. oligosporus yang dulu pernah dilaporkan sekarang merupakan sinonim dari R. microsporus.
SUMMARY
ANASTASIA TATIK HARTANTI. Molecular Based Identity of Rhizopus strains from Fresh Tempeh Collected from Several Regions in Indonesia. Supervised by GAYUH RAHAYU and IMAN HIDAYAT.
Rhizopus Ehrenb. (Zygomycetes, Zygomycota) are an economically an important fungal genus as their contributions to many aspects in human life, i.e. source of food supplements, enzymes, and biotechnology industry agents are significantly. The identity of Rhizopus is thus also important.
In the last 30 years, the taxonomy and identification of species belonging to
Rhizopus has significantly been changed from morphological and physiological approaches to molecular approaches. Using morphological approach, Rhizopus are divided into three groups, R. microsporus group, R. oryzae group, and R. stolonifer group. In 2007, based on a combination of morphology, physiology, mating system compatibility, and molecular data, Zheng et al. recognized 10 species of Rhizopus with 7 varieties, vis, R. americanus, R. arrhizus var. arrhizus, var. delemar, and var. tonkinensis, R caespitosus, R. homothallicus, R. microsporus var. microsporus, var. azygosporus, var. chinensis, var. oligosporus, var. tuberosus and var. rhizopodiformis, R. niveus, R. reflexus, R. stolonifer and R. sexualis. In 2010, Abe et al. used ITS rDNA, actin, and EF -1α to recognized
eight species of those of Zheng et al. They then treated R. niveus as synonym of
R. delemar, and R. americanus and R. sexualis as synonyms of R. stolonifer, and kept R. oryzae. In 2013, Dolatabadi et al. used Genealogy Concordance Phylogenetic Species Recognition (GCPSR) concept by combining ITS, actin, and EF-1α, physiological properties including maximum growth temperature, spore morphology, mating type test, e MALDI-ToF profil, and ecology to evaluate the infraspecific classification of R. microsporus. They concluded that variety is not recognized within that species.
Recent changes in the Rhizopus systematics affects the taxonomic status of
Rhizopus including those from fresh tempeh. Within current approach identification of Rhizopus in Indonesia that was based on morphological approach and DNA fingerprints gave an inappropriate information on its taxonomic status. In 1970 Dwijoseputro and Frederick identified four species of Rhizopus namely R. oligosporus, R. oryzae, R. arrhizus and R. stolonifer from tempeh and ragi tempeh were collected from Jakarta, Surakarta and Malang. R. oligosporus was often stated as tempeh inoculant from various regions in Indonesia in the year of 2000. Eventhough Schipper and Stalpers in 1984 placed oligosporus as a variety of R. microsporus. Therefore, re-identification is necessary to support the standardization of tempeh inoculant with valid identity. It is expected that this study will give accurate and up to date information about the identity of Rhizopus
from Indonesian tempeh.
then stored at -80 oC. These collections are deposited in the Bogor Agricultural University Culture Collection (IPBCC), Department of Biology, Science Faculty, IPB.
Molecular analysis was started with the extraction of DNA from the mycelia grown on PDA slant medium for 3 days. DNA extraction was performed using the DNA Extraction Kit PhytopureTM (GE Healthcare, UK) according to the manufacturer's protocol. Polymerase Chain Reaction amplification of rDNA ITS region using primer ITS5 (5'-GGAAGTAAAAGTCGTAACAAGG-3') and ITS4 (5'-TCCTCCGCTTATTGATATGC-3'). EF-1α gene amplification used MEF-10 (5'-GTTGTCATCGGTCACGTCGATTC-3') and MEF-4 (5'-ATGACACCRAC AGCGACGGTTTG-3') primer pairs. ITS Sequences of all strains and EF-1α sequences from members of R. microsporus were first edited with Chromas Pro 1:41. All ITS sequences of the strain studied then were aligned with reference sequences using MEGA version 5.05. Phylogenetic tree of all the strains was constructed based on Maximum Likelihood method, meanwhile Neighbor Joining method was used for strains of R. microsporus with bootstrap analyses using 1000 replications. The phylogenetic tree generated from the analysis were then visualized using TreeGraph 2. Morphology of Rhizopus strains were observed in accordance with the standards of Zheng et al. published in 2007, using a light microscope (Olympus BX53). Physiological character viz. maximum growth temperature was tested on various temperatures of 33, 42, 46, 48 and 51 oC.
Two species Rhizopus, i.e. R. delemar and R. microsporus were found to associate with fresh tempeh from 26 locations in Indonesia. One strain of R. delemar was found only in fresh tempeh from Palu (Central Sulawesi), while thirty five strains of R. microsporus were found in fresh tempeh from Sumatra, Java, Bali, Lombok, Nusa Tenggara, Kalimantan, Sulawesi (other than Palu), and West Papua. R. delemar was apparently lost from tempeh from Java. This may be due to the widely used of commercial inoculant that contained R. microsporus. Neither R. stolonifer nor R. oryzae that has ever been reported to associate with Indonesian tempeh, were found in this research. Further, this study adopted R. oligosporus as synonym of R. microsporus.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
IDENTITAS BERBASIS MOLEKULER GALUR-GALUR
Rhizopus
ASAL TEMPE SEGAR DARI BERBAGAI DAERAH
DI INDONESIA
ANASTASIA TATIK HARTANTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
vi
vii
Judul Tesis : Identitas Berbasis Molekuler Galur-Galur Rhizopus Asal Tempe Segar dari Berbagai Daerah di Indonesia
Nama : Anastasia Tatik Hartanti
NIM : G351110061
Disetujui oleh Komisi Pembimbing
Dr Gayuh Rahayu Ketua
Iman Hidayat, Ph.D Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi
Prof Dr Anja Meryandini
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc Agr
viii
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Yang Maha Kasih atas segala karunia-Nya sehingga penulis dapat menyelesaikan penelitian yang berjudul Identitas Berbasis Molekuler Galur-Galur Rhizopus Asal Tempe Segar dari Berbagai Daerah di Indonesia. Penelitian ini didanai oleh BPPS, Penelitian BOPTN IPB tahun 2013 atas nama Dr Gayuh Rahayu, dan Iman Hidayat, Ph.D. Penulis mengucapkan terima kasih kepada Dr Gayuh Rahayu selaku pembimbing dan Iman Hidayat, Ph.D sebagai anggota komisi pembimbing atas segala bimbingan, arahan, waktu, tenaga dan nasehat sehingga saya dapat menyelesaikan penulisan tesis ini. Ucapan terima kasih saya sampaikan kepada Prof Mien Achmad Rifai, M.Sc., Ph.D sebagai penguji luar komisi, dan Prof Dr Anja Meryandini sebagai ketua program studi Mikrobiologi yang telah banyak memberikan masukan dan saran demi kesempurnaan tesis ini.
Ucapan terima kasih penulis sampaikan kepada Departemen Pendidikan Tinggi Republik Indonesia atas beasiswa BPPS tahun 2011, dan kepada Rektor dan Jajaran Pimpinan Universitas Katolik Atmajaya Jakarta yang telah memberikan kesempatan kepada penulis untuk melanjutkan studi S2 di Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Muhammad Ilyas, M.Si, dan staf Laboratorium Biosistematika Bidang Mikrobiologi, LIPI Cibinong, Mas Dian, Sahal Muadz, Reva, ibu Mia, ibu Yeni, Anis, Ica, Senly dan Tutus yang telah banyak membantu penulis selama penelitian di Laboratorium. Ucapan terima kasih juga disampaikan kepada teman teman atas bantuannya dalam pengambilan sampel tempe yang tidak saya sebutkan satu persatu, Ibu Nani Radiastuti, M.Si, Sepriyadi Rihi, S.Si, serta teman teman Mikrotropisian 2013.
Ucapan terima kasih yang terdalam untuk suami saya tercinta, Tri Atmowidi dan anak-anakku tersayang, Patricia Arindita Eka Pradipta dan Yosafat Dimas Anandita, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2014
ix
DAFTAR ISI
DAFTAR GAMBAR
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE 2
Waktu dan Tempat penelitian 2
Pengumpulan Sampel 3 Isolasi DNA, Amplifikasi PCR, Sekuensing, dan Analisis Filogenetik 3
Pengamatan Morfologi dan Fisiologi Rhizopus 5
HASIL DAN PEMBAHASAN 5
Hasil 5
Kekerabatan Galur Rhizopus Asal Tempe 5
Morfologi dan Fisiologi Rhizopus Asal Tempe 8
Pembahasan 13
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 15
RIWAYAT HIDUP 17
x
DAFTAR GAMBAR
1 Pohon filogenetik galur Rhizopus asal tempe Indonesia berdasarkan gen ITS dengan metode maximum likelihood model T92+G+1 6 2 Pohon filogenetik galur Rhizopus microsporus asal tempe Indonesia
berdasarkan gen ITS dengan metode Neighbor Joining model
maximum composite likelihood 7
3 Pohon filogenetik galur Rhizopus microsporus asal tempe Indonesia berdasarkan gen EF dengan metode Neighbor Joining model
maximum composite likelihood 8
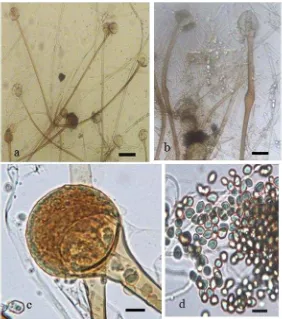
4 Rhizopus delemar: sporangiofor yang muncul dari miselium udara dengan kolumela agak bulat dan apophyses jelas, sporangiofor yang membengkak, sporangium globos, sporangiospora yang tidak teratur
bentuknya 10
1
PENDAHULUAN
Latar Belakang
Rhizopus Ehrenb. (Mucoraceae, Mucorales, Zygomycetes, Zygomycota) memiliki potensi luas dan sangat berperan dalam kehidupan manusia.
Mucoraceae dicirikan adanya sporangium, sporangiospora, kolumela, sporangiofor. Rizoid merupakan ciri pembeda Rhizopus dari genus lainnya dalam
Mucoraceae (Pitt & Hocking 2009). Rhizopus microsporus Tiegh. digunakan sebagai agens fermentasi beberapa makanan tradisional, seperti tempe di Indonesia dan koji di China dan Jepang (Zheng et al. 2007). Potensi lainnya dari
Rhizopus adalah sebagai produsen lipase (Hiol et al. 2000). Lipase dihasilkan oleh R. oryzae Went & Prins. Geerl. Enzim lipase menghidrolisis triasilgliserol (TAG) menjadi diasilgliserol (DAG) dan asam lemak bebas (Winarno 1986). Diasilgliserol dapat digunakan sebagai bahan pengemulsi dan penstabil produk-produk makanan, kosmetika, dan farmasetika (Putranto et al. 2006). Selain bermanfaat bagi manusia, beberapa spesies Rhizopus dapat merugikan manusia, seperti R. microsporus var. microsporus penyebab mukormikosis menular pada manusia (West et al. 1995). Rhizopus juga menyebabkan kerusakan hasil pertanian selama transportasi dan penyimpanan (Pitt et al. 1997).
Taksonomi dan identifikasi Rhizopus berubah secara nyata dari pendekatan morfologi dan fisiologi (Schipper 1984; Schipper dan Stalpers 1984) ke pendekatan molekuler (Abe et al. 2006, 2010; Liou et al. 2007) dalam 30 tahun terakhir. Dengan pendekatan morfologi dan fisiologi, Rhizopus dibagi dalam tiga grup, yaitu grup R. microsporus, grup R. oryzae, dan grup R. stolonifer (Schipper 1984; Schipper dan Stalpers 1984). Pembagian ini dikuatkan oleh sistematika molekuler menurut Abe et al. (2006) yang membagi Rhizopus dalam tiga cluster, yaitu cluster microsporus, cluster stolonifer, dan cluster oryzae. Pembagian
cluster ini tidak diadopsi oleh Zheng et al. (2007) dalam monografi Rhizopus yang sistematikanya disusun berdasarkan kombinasi morfologi, fisiologi, kompatibilitas sistem kawin, dan data molekuler. Zheng et al. (2007) mengenal 10 spesies
Rhizopus dan 7 varietas, yaitu R. americanus (Hesselt. & J. J. Ellis) R. Y. Zheng, G. Q. Chen & X. Y. Liu; R. arrhizus A. Fisch. var. arrhizus, var. delemar
(Wehmer & Hanzawa), dan var. tonkinensis (Vuill.) R. Y. Zheng & X. Y. Liu; R. caespitosus Schipper & Samson; R. homothallicus Hesselt. & J. J. Ellis; R. microsporus Tiegh. var. microsporus, var. azygosporus (G. F. Yuan & S. C. Jong), var. chinensis (Saito) Schipper & Stalper, var. oligosporus (Saito) Schipper & Stalper, var. tuberosus R.Y. Zheng & G. Q. Chen dan var. rhizopodiformis
(Cohn) Schipper & Stalper; R. niveus M. Yamaz; R. reflexus Bainier; R. schipperae Weitzman, McGough, Rinaldi & Dell-Latta; R. stolonifer (Ehrenb.: Fr.) Vuill.; dan R. sexualis (G. Sm.) Callen. Abe et al. (2010) memperdalam analisis clusternya dengan melibatkan sekuen gen ITS rDNA, gen aktin, dan gen
2
EF-1α, sifat fisiologi termasuk suhu pertumbuhan maksimum, morfologi spora, uji tipe kawin, profil yang dihasilkan MALDI-ToF, dan ekologi. Mereka menegaskan dalam R. microsporus tidak tepat untuk dibagi ke takson infraspesifik.
Perumusan Masalah
Perkembangan sistematika Rhizopus menyebabkan identitas Rhizopus pada tempe perlu dievaluasi, sehingga agens fermentasi kedelai ini memiliki nama berdasarkan pendekatan terkini. Sebelumnya, Dwijoseputro dan Frederick (1970) mengidentifikasi 4 spesies Rhizopus, yaitu R. oligosporus, R. oryzae, R. arrhizus, dan R. stolonifer pada tempe dan ragi tempe yang berasal dari Jakarta, Surakarta, dan Malang. R. oligosporus banyak dinyatakan sebagai inokulan tempe dari berbagai daerah di Indonesia pada tahun 2000-an (Prihatna dan Suwanto 2007; Dewi dan Azis 2011), meskipun Schipper dan Stalpers (1984) menempatkan
oligosporus sebagai varietas dari R. microsporus. Re-identifikasi Rhizopus asal tempe ini diperlukan untuk menunjang upaya standardisasi mutu tempe yang memerlukan inokulan dengan identitas yang tepat.
Tujuan Penelitian
Penelitian ini bertujuan mengidentifikasi Rhizopus asal tempe segar dari berbagai daerah di Indonesia.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menjadi informasi terkini, tentang taksonomi Rhizopus pada tempe segar di Indonesia. Di samping itu, galur-galur hasil penelitian ini juga merupakan bagian usaha konservasi Rhizopus secara ex-situ dengan penyimpanan jangka panjang.
METODE
Waktu dan Tempat penelitian
Penelitian dilaksanakan mulai dari bulan Februari 2012 sampai November 2013 di Laboratorium Biosistematika dan Lembaga Ilmu Pengetahuan Indonesia
3
Pengumpulan Sampel
Galur Rhizopus yang digunakan dalam penelitian ini diisolasi dari tempe segar yang dikumpulkan dari berbagai daerah di Indonesia dan satu galur yang diisolasi dari buah pir (Tabel 1).
Kultur murni diperoleh dengan cara mengambil hifa yang secara aseptik dan diinokulasikan pada medium Potato Dextrose Agar (PDA), lalu diinkubasi pada suhu ruang. Kultur dimurnikan dan diperbanyak untuk kultur kerja, kultur stok dan kultur koleksi. Media protektan (trehalosa-gliserol) dipergunakan sebagai medium kultur koleksi, dan selanjutnya kultur koleksi disimpan pada suhu -80 oC. Galur Rhizopus hasil koleksi ini disimpan di Institut Pertanian Bogor Culture Collection (IPBCC), Departemen Biologi, FMIPA, IPB.
Isolasi DNA, Amplifikasi PCR, Sekuensing, dan Analisis Filogenetik
Ekstraksi DNA dilakukan dari massa miselium yang ditumbuhkan pada medium miring PDA selama 3 hari. Massa miselium kemudian dimasukkan ke dalam tabung mikro 1500 µl yang berisi 500 µl Mili-Q dan disentrifugasi dengan kecepatan 10 000 rpm selama 10 menit. Selanjutnya, suspensi dibuang, sedangkan massa miselium digerus sampai menyerupai bubur. Ekstraksi DNA dilakukan menggunakan DNA PhytopureTM Kit Extraction (GE Healthcare, Inggris) sesuai dengan protokol pabrik. Amplifikasi Polymerase Chain Reaction
(PCR) daerah rDNA ITS menggunakan sepasang primer ITS5 (5'-GGAAGTAAAAGTCGTAACAAGG-3') dan ITS4 (5'-TCCTCCGCTTATTGA TATGC-3') (White et al. 1990). Amplifikasi PCR gen EF menggunakan sepasang primer MEF-10 (5'-GTTGTCATCGGTCACGTCGATTC-3') dan MEF-4 (5'-AT GACACCRACAGCGACGGTTTG-3') (Abe et al. 2007).
Semua reaksi amplifikasi PCR dilakukan dalam 25 µl campuran reaksi yang mengandung sekitar 100 ng DNA genom cetakan, 0.25 µM untuk masing-masing primer, PCR bufer 1×, dNTPs mix 0.2 mM, MgCl2 1.75 mM, dan 1 unit DNA taq polimerase. Kondisi reaksi dalam PCR sebagai berikut: predenaturasi pada suhu 94 oC selama 2 menit, denaturasi pada suhu 94 oC selama 15 detik, penempelan pada suhu 55 oC selama 30 detik, dan pemanjangan pada suhu 72 oC selama 1 menit dengan 35 siklus, dan pemanjangan akhir pada suhu 72 oC selama 5 menit (Abe et al. 2007). Selanjutnya, produk PCR dielektroforesis dalam gel agarosa 1% pada 100 volt selama 30 menit. Gel hasil PCR kemudian direndam dalam ethidium bromide selama 15 menit. Visualisasi pita pada gel digunakan Gel DocTM XR System (BIO-RAD, Jerman). Produk hasil PCR disekuensing oleh FirstBase (Malaysia).
Sekuen yang diperoleh dari primer ITS untuk semua galur dan EF-1α dari anggota R. microsporus diedit dengan program Chromas Pro 1.41 (Technelysium
Pty Ltd, Australia). Semua sekuen ITS yang diperoleh, kemudian disejajarkan dengan sekuen rujukan yang diuduh dari pangkalan data DNA the National Center for Biotechnology Information (NCBI) menggunakan multipe sequence alignment based on fast Fourier transform (Katoh et al. 2002) untuk seluruh galur. Phycomyces blakesleeanus CBS 284.35 (JN206308) digunakan sebagai
4
1 R. delemar ATH53 Palu, Sulawesi Tengah IPBCC 13.1126 KF7010007
2 R. delemar ATHpr Bogor, Jawa Barat IPBCC 13.1138 KF7010008
3 R. microsporus ATH1 Bogor, Jawa Barat IPBCC 13.1102 AB894622
4 R. microsporus ATH9 Cilacap, Jawa Tengah IPBCC 13.1103 AB894623
5 R. microsporus ATH10 Bekasi, Jawa Barat IPBCC 13.1104 KF709996
6 R. microsporus ATH11 Sukabumi, Jawa Barat IPBCC 13.1105 KF7010000
7 R. microsporus ATH13 Surabaya, Jawa Timur IPBCC 13.1106 KF7010004
8 R. microsporus ATH14 Makasar, Sulawesi selatan IPBCC 13.1107 KF7010005
9 R. microsporus ATH15 Bukit Tinggi, Sumatra Utara IPBCC 13.1108 KF709999
10 R. microsporus ATH23 Denpasar, Bali IPBCC 13.1109 KF7010006
11 R. microsporus ATH24 Malang, Jawa Timur IPBCC 13.1110 KF709978
12 R. microsporus ATH25 Samarinda, Kalimantan Timur IPBCC 13.1111 KF7010001
13 R. microsporus ATH26 Bogor, Jawa Barat IPBCC 13.1112 KF709986
14 R. microsporus ATH27 Surabaya, Jawa Timur IPBCC 13.1113 KF709985
15 R. microsporus ATH29 Medan, Sumatra Utara IPBCC 13.1114 AB894624
16 R. microsporus ATH31 Mataram, Nusa Tenggara IPBCC 13.1115 KF709984
17 R. microsporus ATH32 Pontianak, Kalimantan Barat IPBCC 13.1116 KF709992
18 R. microsporus ATH33 Raja Ampat, Papua Barat IPBCC 13.1117 KF709997
19 R. microsporus ATH35 Brebes, Jawa Tengah IPBCC 13.1118 KF709983
20 R. microsporus ATH38 Yogyakarta IPBCC 13.1119 KF709995
21 R. microsporus ATH40 Yogyakarta IPBCC 13.1120 AB894625
22 R. microsporus ATH41 Yogyakarta IPBCC 13.1121 KF709987
23 R. microsporus ATH43 Lampung IPBCC 13.1122 KF709988
24 R. microsporus ATH47 Kebumen, Jawa Tengah IPBCC 13.1123 KF7010002
25 R. microsporus ATH48 Magelang, Jawa Tengah IPBCC 13.1124 KF709982
26 R. microsporus ATH50 Kutoarjo, Jawa Tengah IPBCC 13.1125 KF7010003
27 R. microsporus ATH54 Medan, Sumatra Utara IPBCC 13.1127 KF709979
28 R. microsporus ATH55 Labuhan Batu, Sumatra Utara IPBCC 13.1128 AB894626
29 R. microsporus ATH58 Kendari, Sulawesi Tenggara IPBCC 13.1129 KF709990
30 R. microsporus ATH59 Bogor, Jawa Barat IPBCC 13.1130 KF709991
31 R. microsporus ATH60 Cilacap, Jawa Tengah IPBCC 13.1131 KF709998
32 R. microsporus ATH61 Mataram, NTB IPBCC 13.1132 KF709989
33 R. microsporus ATH63 Mataram, NTBarat IPBCC 13.1133 AB894627
34 R. microsporus ATH64 Manokwari, Papua Barat IPBCC 13.1134 KF709980
35 R. microsporus ATH65 Nabire, Papua Barat IPBCC 13.1135 KF709981
36 R. microsporus ATH66 Pontianak, Kalimantan Barat IPBCC 13.1136 KF709993
37 R. microsporus ATH67 Jambi, Sumatra IPBCC 13.1137 KF709994
5
maximum likelihood (ML) pada Molecular Evolution and Genetic Analysis
(MEGA) versi 5.05 (Tamura et al. 2011) dengan menggunakan model T92+G+1 (Tamura 3-parameter dan distribusi Gamma dengan invariant site). Kekuatan cabang internal dalam pohon filogenetik diuji dengan analisis bootstrap (BS) (Felsenstein 1985) menggunakan 1000 ulangan. Nilai BS sebesar 50% atau lebih akan ditampilkan.
Sekuen ITS dan EF-1α dari beberapa galur R. microsporus yang diperoleh, kemudian disejajarkan dengan sekuen rujukan R. microsporus yang diunduh dari pangkalan data DNA NCBI, menggunakan MUSCLE pada program MEGA. Analisis filogenetik dilakukan dengan menggunakan metode NJ pada MEGA versi 5.05 (Tamura et al. 2011) dengan menggunakan model maximum composite likelihood. Kekuatan cabang internal dalam pohon filogenetik diuji dengan analisis BS (Felsenstein 1985) menggunakan 1000 ulangan. Nilai BS sebesar 50% atau lebih akan ditampilkan. Pohon filogenetik yang dihasilkan dari ketiga analisis tersebut, diolah dengan perangkat lunak TreeGraph versi 2 (Stover dan Müller 2010).
Pengamatan Morfologi dan Fisiologi Rhizopus
Morfologi galur Rhizopus diamati sesuai dengan standar Zheng et al. (2007) dengan menggunakan mikroskop cahaya (Olympus BX53). Karakter fisiologi
Rhizopus yang diamati ialah pertumbuhan Rhizopus pada suhu 33, 42, 46, 48 dan 51 oC.
HASIL DAN PEMBAHASAN
Hasil Kekerabatan Galur Rhizopus Asal Tempe
Berdasarkan pohon ITS yang dihasilkan dari analisis ML, galur Rhizopus
dari tempe Indonesia dikelompokkan ke dalam clade R. delemar (satu galur) dan
cladeR. microsporus (35 galur) dengan masing-masing nilai BS sebesar 60% dan 100% (Gambar 1). Clade R. delemar yang terdiri atas beberapa galur rujukan, satu galur Rhizopus asal tempe dari Palu, Sulawesi Tengah, dan satu galur yang diisolasi dari buah pir asal Bogor berkerabat dekat dengan cladeR. oryzae dengan nilai BS sebesar 100%.
Clade R. microsporus dibagi menjadi dua subclade monofiletik. Subclade
pertama terdiri atas galur rujukan, yaitu R. microsporus var. azygosporus, var.
6
Gambar 1 Pohon filogenetik galurRhizopus asal tempe Indonesia berdasarkan gen ITS dengan metode maximum likelihood model T92+G+1. Nilai BS yang ditunjukkan pada cabang diperoleh dari 1000 ulangan.
7
Gambar 2 Pohon filogenetik galur Rhizopus microsporus asal tempe Indonesia berdasarkan gen ITS dengan metode Neighbor Joining model
maximum composite likelihood. Nilai BS yang ditunjukkan pada cabang diperoleh dari 1000 ulangan
Resolusi sekuen daerah ITS pada pohon filogenetik (Gambar 1) menunjukkan bahwa sekuen daerah ini tidak cukup untuk menggambarkan
Rhizopus microsporus (non var. microsporus) ke tingkat varietas. Semua varietas yang dikenal pada R. microsporus tidak membentuk cluster. Kekerabatan berdasarkan pada hasil ITS ini direkonstruksi ulang untuk galur khusus R. microsporus, yang terdiri dari beberapa galur R. microsporus hasil koleksi pada penelitian ini dan galur rujukan. Spesies R. delemar CBS 120.12T digunakan sebagai outgroup, dengan menggunakan NJ sebagai metode analisis, rekonstruksi ulang menegaskan bahwa R. microsporus tidak dapat dibagi ke dalam varietas (Gambar 2).
Marka kedua yang dipilih untuk mempelajari Rhizopus asal tempe adalah gen EF-1α. Rekonstruksi pohon filogenetik berdasarkan gen EF-1α yang terdiri semua galur R. microsporus membentuk 1 clade dengan nilai BS yang lemah. Dalam clade ini terdapat beberapa clade yang tidak menggambarkan pembagian varietas. Beberapa galur yang saat ini dipelajari tersebar dalam beberapa clade, dengan galur rujukan terdiri var. azygosporus, var. chinensis, var. microsporus,
8
Gambar 3 Pohon filogenetik galur Rhizopus microsporus asal tempe Indonesia berdasarkan gen EF-1α dengan metode Neighbor Joining model
maximum composite likelihood. Nilai BS yang ditunjukkan pada cabang diperoleh dari 1000 ulangan.
Untuk mendukung hasil analisis filogenetik, sebanyak 36 galur Rhizopus
diamati karakter morfologi dan fisiologi berdasarkan Zheng et al. (2007).
Morfologi dan Fisiologi Rhizopus Asal Tempe
Berdasarkan ciri morfologi dan fisiologi Zheng et al. (2007), galur
Rhizopus yang dikoleksi dibagi menjadi dua spesies, yaitu R. delemar (1 galur) dan R. microsporus (35 galur). Rhizopus ATH53 merupakan R. delemar karena galur ini memiliki sporangiofor yang panjangnya mencapai 800 µm. Galur
Rhizopus asal buah pir juga termasuk R. delemar dengan sporangiofor yang panjangnya mencapai 1300 µm. Selain itu, kedua galur ini mempunyai ciri lain dari R. microsporus, yaitu sporangiospora berlurik dan tumbuh pada toleran suhu sesuai dengan pertelaan R. arrhizus var. delemar sensu Zheng et al. (2007), yaitu ATH53 dan ATHpr yang tumbuh pada suhu 33 °C. Pada suhu 42 °C, ATH53 masih mampu tumbuh, tetapi ATHpr sudah tidak mampu tumbuh lagi. Suhu maksimum untuk pertumbuhan ATH53 adalah 42 °C.
9
rizoid. 32 galur dalam R. microsporus memiliki suhu pertumbuhan optimal 46 °C. Bentuk sporangiospora dan kolumela galur ini bervariasi sesuai dengan R. microsporus var. oligosporussensu Zheng et al. (2007). Variasi juga ditemukan -pada ukuran sporangiospora.
Dua galur R. microsporus, yaitu ATH40 dan ATH59 memiliki karakter morfologi sesuai dengan pertelaan R. microsporus var. rhizopodiformis sensu
Zheng et al. (2007). Kolumela galur ini khas berbentuk buah pir dan rizoid berkembang dengan baik dan sangat berlimpah. Satu galur lainnya, yaitu ATH24 memiliki ciri sesuai dengan R. microsporus var. azygosporus sensu Zheng et al.
(2007), bentuk kolumela bervariasi (bulat telur, agak bulat, bulat), dan memiliki azigosporangium berlimpah dengan suspensor tunggal.
Meskipun ciri-ciri morfologi dan fisiologi sesuai dengan pertelaan varietas dalam R. microsporus versi Zheng et al. (2007), penerapan konsep varietas tersebut tidak didukung oleh data filogeni ITS dan EF-1α. Berdasarkan pertimbangan ini, semua spesies yang ditemukan dalam penelitian ini dipertelaan ulang sebagai berikut: pada umur 3-4 hari pada suhu kamar. Stolon berkembang dengan baik, subhialin sampai cokelat keabu-abuan, septat atau aseptat. Rizoid kadang-kadang tidak ada, kalau ada seperti jari atau bercabang, tidak sama panjang, berwarna cokelat keabu-abuan, dan memucat di ujungnya. Sporangiofor tumbuh dari stolon yang berlawanan dengan rizoid, kadang-kadang dibentuk langsung dari miselium dan tanpa rizoid, soliter atau dalam kelompok 2-3, sederhana, lurus atau sedikit melengkung, panjang 403.2-812.0 µm, lebar 7.4-12.1 µm, berwarna cokelat sampai cokelat tua, aseptat, kadang-kadang bercabang tiga di puncak dan bengkak di bagian tengah. Apophyses mencolok. Sporangium agak bulat sampai bulat, diameter 55-185 µm, berwarna kekuningan sampai cokelat tua, tanpa kerah. Kolumela bulat telur sampai agak bulat (41.1-85.0 µm × 37.6-85.7 µm), halus, berwarna cokelat muda. Sporangiospora berbentuk bulat telur, kadang-kadang agak bulat, permukaan halus, atau berlurik, diameter 4.8-9.5 µm, subhialin, menjadi abu-abu gelap dalam massa. Klamidospora dan zigospora tidak ditemukan. Suhu pertumbuhan maksimum ialah 42 °C.
Bahan yang diperiksa: Sulawesi Tengah: Palu, dari tempe, 28 Agustus 2012, AT Hartanti, ATH53 (IPBCC 13.1126); Jawa Barat: Bogor, dari buah pir (Pyrus sp.), 28 Agustus 2012, AT Hartanti, ATHpr (IPBCC 13.1138 ).
Rhizopus microsporus Tiegh. Gambar 5
= R. microsporus var. oligosporus (Saito) Schipper & Stalpers, Stud. Mycol. 25: 31. 1984.
10
= R. microsporus var. azygosporus (G. F. Yuan & C. C. Jong) R. Y. Zheng.
Sydowi. 59: 327. 2007.
= R. azygosporus G. F. Yuan & S. C. Jong. Mycotaxon 20: 398. 1984.
= R. microsporus var. rhizopodiformis (Cohn) Schipper & Stalpers Stud. Mycol. 25: 30. 1984.
= R. rhizopodiformis (Cohn) Zopf in Schenk, Hand. Bot. 4: 587. 1890 = Mucor rhizopodiformis Cohn in Lichtheim, Z. Klin. Med. 7: 140. 1884.
Koloni pada PDA pada awalnya berwarna putih, kemudian menjadi kecokelatan, abu-abu kecokelatan, atau abu-abu sampai kehitaman ketika dewasa, dan memenuhi cawan Petri (diameter 9 cm ) sekitar 3-4 hari pada suhu kamar. Stolon berkembang dengan baik, subhialin sampai cokelat muda atau cokelat keabu-abuan, septat atau aseptat, kadang-kadang membengkak pada tempat tumbuhnya rizoid. Rizoid sederhana atau bercabang, tidak sama panjang, berwarna cokelat keabu-abuan, memucat di bagian ujung.
Sporangiofor muncul dari stolon dan berlawanan arah dengan rizoid, atau tumbuh langsung dari hifa udara dan bukan dari rizoid, soliter atau dalam kelompok 2-3, sederhana, lurus sampai sedikit melengkung, jarang bercabang di
11
bagian apikal, memiliki panjang 38.8-267.0 µm, lebar 3.89-17.0 µm, berwarna cokelat muda, pucat di ujungnya, biasanya aseptat, halus. Apophyses mencolok atau dangkal. Sporangium bulat agak gepeng sampai bulat, diameter 24-110 µm, berwarna kekuningan sampai cokelat gelap ketika matang, dengan kerah yang mencolok kecil atau tanpa kerah. Sporangium mudah luruh. Bentuk kolumela bervariasi mulai dari bentuk buah pir sampai lanset-bulat telur, kadang-kadang agak bulat sampai bulat, panjang 23.8-64.1 µm × lebar 17.6-43.8 µm, halus, berwarna kekuningan sampai cokelat muda. Bentuk dan ukuran sporangiospora bervariasi atau seragam, bulat telur sampai agak bulat, panjang 2.7-6.4 µm × lebar 3.3-4.6 µm, mulus, tanpa atau sedikit berlurik, subhialin, menjadi cokelat keabu-abuan atau abu-abu gelap dalam massa spora. Klamidospora soliter atau sering dalam rantai pendek, bulat atau tidak teratur bentuknya, panjang 12.0-66.5 µm × lebar 4.0-18.9 µm. Azigosporangium kadang kadang ditemukan. Zigospora tidak ditemukan. Suhu pertumbuhan maksimum 48 °C.
Bahan yang diperiksa: dari tempe, AT Hartanti. Provinsi Sumatera Utara: Medan, 4 September 2012, ATH54 (IPBCC 13.1127) dan 23 Mei 2012, ATH29 (IPBCC 13.1114), Labuhan Batu, 28 Agustus 2012, ATH55 (IPBCC 13.1128). Provinsi Sumatera Barat: Bukit Tinggi, 17 Februari 2012, ATH15 (IPBCC 13.1108). Provinsi Jambi: Jambi, 26 Desember 2012, ATH67 (IPBCC 13.1137). Lampung: Lampung, 7 Juli 2012, ATH43 (IPBCC 13.1122); Provinsi Jawa Barat: Bogor, 2 Februari 2012, ATH1 (IPBCC 13.1102) dan ATH9 (IPBCC 13.1103), 17 Februari 2012, ATH59 (IPBCC 13.1130), dan 5 Mei 2012 , ATH26 (IPBCC 13.1131). Daerah Istimewa Yogyakarta: Yogyakarta, 7 Juli 2012, ATH41 (IPBCC 13.1121), 11 Juli 2012, ATH40 (IPBCC 13.1120) dan 17 Juli 2012, ATH38 13.1136). Provinsi Nusa Tenggara Barat: Mataram, 25 Mei 2012, ATH31 (IPBCC 13.1115), dan 4 September 2012, ATH61 (IPBCC 13.1132), 4 September 2012, ATH63 (IPBCC 13.1133). Provinsi Papua Barat: Raja Ampat, 27 Mei 2012, ATH33 (IPBCC 13.1117), Manokwari, 4 September 2012, ATH64 (IPBCC 13.1134), Nabire, 4 September 2012, ATH65 (IPBCC 13.1135).
12
13
ukuran dan bentuk sporangiospora bervariasi (Gambar 5f). Azigosporangium dan zigosporangium tidak dibentuk. Suhu pertumbuhan maksimum 46 °C. Hal ini sedikit berbeda dari ATH 40 dan ATH59 yang memiliki koloni pada PDA menjadi abu-abu sampai abu-abu kehitaman ketika dewasa. Kolumelanya khas mirip buah pir ketika dewasa. Ukuran dan bentuk sporangiospora seragam dan permukaan tidak berlurik (Gambar 5g). Klamidospora soliter atau sering dalam rantai pendek (Gambar 5h). Tidak ditemukan azigosporangium dan zigosporangium. Suhu pertumbuhan maksimum ialah 48 °C. Galur lain, ATH24 adalah satu-satunya galur memiliki azigosporangium. Ciri-ciri azigosporangium tersebut antara lain agak bulat sampai bulat, hialin, crenulate permukaanya, cokelat muda, dengan suspensor tunggal yang sebagian besar terdapat di bagian bawah (Gambar 5i). Zigospora tidak ditemukan. Galur ini memiliki koloni abu-abu sampai abu-abu-abu-abu kehitaman pada PDA ketika dewasa. Kolumela bervariasi dari bentuk mirip buah pir sampai oval-bulat telur. Sporangiospora seragam dalam bentuk dan ukuran, dan agak berlurik. Suhu pertumbuhan maksimum ialah 48 °C.
Pembahasan
Tempe merupakan makanan tradisional berbahan dasar kedelai yang difermentasi sudah sejak lama secara tradisional dan dikonsumsi sebagai sumber protein utama bagi masyarakat Indonesia. Di Indonesia, tempe diproduksi dengan bantuan R. oligosporus, R. oryzae, R. arrhizus, dan R. stolonifer sebagai inokulan (Dwijoseputra dan Frederick 1970; Saono et al. 1974; Prihatna dan Suwanto 2007; Dewi dan Aziz 2011). Hasil penelitian yang dilaporkan disini menegaskan bahwa hanya dua spesies, yaitu R. delemar dan R. microsporus, yang berasosiasi dengan sampel tempe segar dari 26 daerah di Indonesia. Hal ini berarti hanya dua spesies ini yang digunakan sebagai inokulan.
Satu dari 36 galur Rhizopus koleksi penelitian ini ditetapkan sebagai R. delemar, karena isolat koleksi ini berada dalam satu clade dengan holotipe R. delemar dan beberapa isolat rujukan dari R. delemar. R. delemar ini diisolasi dari tempe segar asal Palu (Sulawesi Tengah) dan tidak ditemukan pada tempe segar dari berbagai lokasi Pulau Jawa. Padahal sebelumnya, R. delemar dilaporkan pada saat itu oleh beberapa peneliti Indonesia (Dwijoseputra dan Frederick 1970) sebagai R. arrhizus atau R. oryzae, dari beberapa lokasi di Jawa, seperti Jakarta, Surakarta, dan Malang, dan dilaporkan oleh Zheng et al. (2007) sebagai R. arrhizus var. delemar dengan koleksi no CBS 385.34, IFO 4770, dan HUT 1220. Kedudukan R. oryzae dan R. delemar terhadap R. arrhizus telah menjadi perdebatan. Re-evaluasi Rhizopus secara molekuler (Abe et al. 2010) menegaskan kembali usulannya pada tahun 2007 bahwa secara molekuler R. oryzae (sin. R. arrhizus) merupakan R. oryzae yang menghasilkan asam laktat dibedakan R. delemar yang menghasilkan asam fumaric malic.
R. delemar (ditulis sebagai R. oryzae) dan R. microsporus (ditulis sebagai
14
Barat) dengan menggunakan R. microsporus var. oligosporus sebagai inokulum. Ragi tersebut sekarang umum digunakan untuk membuat tempe di berbagai daerah di Indonesia, terutama di pulau Jawa dan Sumatera. Penggunaan ragi ini diduga berhubungan dengan tidak ditemukannya R. delemar pada tempe segar dari Jawa.
Hilangnya R. delemar ini, mungkin diakibatkan oleh penggunaan inokulan secara besar-besaran. Hal ini mendorong perlunya upaya konservasi sumber daya genetika mikrob penting di Indonesia, terutama agens fermentasi makanan berbasis kedelai. Agens fermentasi ini sebenarnya telah terpreservasi dan tersedia diberbagai kultur koleksi di negara lain, seperti The Centraalbureau voor Schimmelcultures (CBS), Belanda, Institute for Fermentation Osaka (IFO), Jepang, dan lainnya (Schipper 1984; Schipper dan Stalpers 1984; Zheng et al.
2007).
Mayoritas anggota R. microsporus secara luas memiliki hubungan erat dengan makanan fermentasi berbasis kedelai, seperti tempe (Indonesia) dan koji (Jepang dan Cina) (Zheng et al. 2007). Beberapa galur R. microsporus, mirip varietas yang dilaporkan Zheng et al. (2007), yaitu R. microsporus var.
oligosporus, var. rhizopodiformis, var. azygosporus yang juga ditemukan dalam penelitian ini. Galur R. microsporus var. oligosporus (CBS 337.62) dan R. microsporus var. azygosporus (CBS 357.93) dilaporkan berasal dari tempe Indonesia dan varietas lain R. microsporus var. rhizopodiformis (CBS 388.34) dilaporkan pertama kali dari Indonesia sebagai inokulan ragi (Schipper 1984; Schipper dan Stalpers 1984; Zheng et al. 2007).
Beberapa varietas dalam clade R. microsporus, yaitu var. chinensis, var.
microsporus, dan var. tuberosus belum pernah ditemukan di Indonesia. Dua varietas, yaitu var. chinensis dan var. tuberosus dilaporkan berasal dari koji Cina (Cina), sedangkan var. microsporus diketahui sebagai penyebab penyakit menular (mucormikosis) pada manusia (West et al. 1995). R. microsporus var.
microsporus adalah cendawan tular tanah, namun sering diisolasi dari kotoran (Zheng et al. 2007).
Galur R. microsporus memproduksi metabolit sekunder. Jennessen et al.(2005) melaporkan galur R. microsporus var. microsporus (CBS 699.68, CBS 700.68 dan CBS 112285) memproduksi rizoxin. Satu di antara ketiga galur tersebut yaitu CBS 112285 juga memproduksi rizonin. Varietas lain dalam R. microsporus (var. oligosporus CBS 112587 dan var. chinensis CBS 631.82) tidak menghasilkan rizonin dan rizoxin (Jennessen et al. 2005). Profil metabolit sekunder ini, mendukung analisis filogenetik ITS (Gambar 1).
Dolatabadi et al. (2013) mengungkapkan bahwa klasifikasi infraspesifik tidak didukung oleh analisis filogenetik. Mereka juga menyatakan bahwa klasifikasi infraspesifik R. microsporus tidak didukung oleh konsep GCPSR (gen ITS, gen aktin, dan gen EF-1α), sifat fisiologi, suhu pertumbuhan, morfologi spora, tes sistem kawin, profil protein yang dihasilkan MALDI-ToF, dan pengelompokan ekologi. Peneliti lain yang juga menggunakan ketiga marka molekuler, seperti Abe et al. (2006; 2010) belum dapat membagi Rhizopus microsporus ke dalam varietas. Prihatna dan Suwanto (2007) mengungkapkan bahwa daerah ITS, empat galur R. oligosporus (dalam tulisan ini R. oligosporus
15
AFLPnya sesuai dengan karakter fenotipnya. Oleh sebab itu, klasifikasi Rhizopus microsporus masih berpeluang untuk dievaluasi ulang dengan melibatkan lebih banyak informasi dari berbagai marka molekuler dan metabolitnya.
SIMPULAN DAN SARAN
Simpulan
Dua spesies Rhizopus, yaitu R. delemar dan R. microsporus ditemukan berasosiasi dengan sampel tempe segar dari 26 lokasi di Indonesia. R. delemar
hanya ditemukan dari tempe asal Palu (Sulawesi Tengah). Spesies R. microsporus
ditemukan pada tempe asal berbagai daerah dari Sumatera, Jawa, Bali, Lombok, NTT, Kalimantan, Sulawesi (selain di Palu), dan Papua Barat. Pada penelitian ini tidak ditemukan R. stolonifer dan R. oryzae. R. oligosporus merupakan sinonim dari R. microsporus.
Saran
Perlu usaha konservasi sumber daya genetika Rhizopus asli Indonesia, dengan melakukan koleksi dan karakterisasi Rhizopus asal tempe dari daerah daerah di Indonesia dengan jumlah sampel yang lebih banyak.
DAFTAR PUSTAKA
Abe A, Oda Y, Asano K, Sone T. 2006. The molecular phylogeny of the genus
Rhizopus based on rDNA sequences. Biosci Biotechnol Biochem. 70(10):2387-2393.doi: 10.1271/bbb.60101.
Abe A, Oda Y, Asano K, Sone T. 2007. Rhizopus delemar is the proper name for fumaric malic acid producers. Mycologia. 99(5):714-722.doi 10.3852/ mycologia.99.5.714.
Abe A, Oda Y, Asano K, Sone T. 2010. A molecular phylogeny based taxonomy of the genus Rhizopus. Biosci Biotechnol Biochem. 74(7):1325-1331.doi: 10.1271/bbb.90718.
Dewi RS, Aziz S. 2011. Isolasi Rhizopus oligosporus pada beberapa inokulum tempe di Kabupaten Banyumas. Molekul. 6(2):93-104.
Dolatabadi S, Walther G, Gerrits van den Ende A.H.G., de Hoog G.S. 2014. Diversity and delimitation of Rhizopus microsporus. Fungal Divers. 64:145-163.doi:10.1007/s13225-013-0229-6.
Dwidjoseputro D, Frederick TW. 1970. Microbiological studies of Indonesian fermented foodstuffs. Mycopathol Mycol Appl. 41:211-222.
16
Hiol A, Jonzo MD, Rugani N, Drued D, Sandra L, Comeau LC. 2000. Purification and characterization of an extracellular lipase from a thermophilic Rhizopus oryzae strain strained from palm fruit. Enzyme Microbial Technol. 26(5-6):421-430.
Jennessen J, Nielsen KF, Houbraken J, Lyhne EK, Schnurer J, Frisvad JC, Samson RA. 2005. Secondary metabolite and mycotoxin production by the
Rhizopus microsporus group. J Agric Food Chem. 53(5):1833-1840.
Katoh K, Misawa K, Kuma K. Miyata T. 2002. MAFFT: a novel method for rapid multiple sequence alignment based on fast fourier transform. Nucleic Acids Res. 30:3059-3066.doi: 10.1093/nar/gkf436.
Liou GY, Chen SR,Wei YH, Lee FL, Fu HM, Yuan GF, Stalpers JA. 2007. Polyphasic approach to the taxonomy of the Rhizopus stolonifer group. Mycol Res. 3:196-203.doi: 10.1016/j.mycres. 2006.10.003.
Pitt JI, Hocking AD. 2009. Fungi and Food Spoilage. 3th Ed. London(GB): Springer. doi 10.1007/978-0-387-92207-2_1.
Pitt JI & Hocking AD, Miscambel BF, Dharmaputra OS, Kuswanto KR. Rahayu ES & Sardjono, 1997. The mycoflora of food commodities for Indonesia. Food Mycol. 1(1):4160.
Prihatna C, Suwanto A. 2007. Phenotypic, metabolic, and genetic diversity of the Indonesian strains of Rhizopus oligosporous. J Microbiol Indones. 1(1):27-32. Putranto RA, Santoso D, Panji T, Suharyanto, Budiani A. 2006. Karakterisasi gen
penyandi lipase dari kapang Rhizopus oryzae dan Absidia corymbifera. Menara Perkebunan. 74:23-32.
Saono S, Gandjar I, Basuki T, Karsono H. 1974. Mycoflora of “ragi” and some other traditional fermented foods of Indonesia. Ann Bogorenses. 5(4):187-196. Schipper MAA, 1984. A revision of the genus Rhizopus. 1. The Rhizopus
stolonifer group and Rhizopus oryzae. Stud Mycol. 25:1-19.
Schipper MAA, Stalpers JA. 1984. A revision of the genus Rhizopus. 2. The
Rhizopus microsporus group. Stud Mycol. 25:20-34.
Stöver BC, Müller KF. 2010. TreeGraph 2: combining and visualizing evidence from different phylogenetic analyses. BMC Bioinformatics. 11:7. doi:10.1186/1471-2105-11-7.
Tamura K, Peterson D, Peterson N, Stecer G, Nei M, Kumar S. 2011. MEGA5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony. Mol Biol Evol.28:2731-2739. West BC, Oberly AD, Kwon-Chung KJ. 1995. Mucormycosis cause by Rhizopus
microsporus var. microsporus: cellulitis in the leg of a diabetic patient cured by amputation. J Clin Microbiol. 33(12):3341-3344.
White TJ, Bruns T, Lee S, Taylor JW. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. Di dalam: Innis MA, Gelfand DH, Sninsky JJ, White TJ, editor. PCR Protocols: A Guide to Methods and Applications. San Diego(US): Academic Pr. hlm.315-322.
Winarno, FG. 1986. Kimia Pangan dan Gizi. Jakarta (ID): Gramedia Pustaka Utama.
Zheng RY, Chen GQ, Huang H, Liu XY. 2007. A monograph of Rhizopus.
17
RIWAYAT HIDUP
Penulis dilahirkan di Yogyakarta pada tanggal 7 Desember 1968 sebagai anak ke-6 dari pasangan Nobertus Hadi Suprayitno (alm) dan Victoria Suyati. Penulis memperoleh gelar Sarjana Sains dalam bidang Mikrobiologi pada Fakultas Biologi, Universitas Gadjah Mada, Yogyakarta pada tahun 1993. Pada tahun 1994-1995, penulis bekerja sebagai asisten dosen di Laboratorium Genetika Tumbuhan PAU Institut Pertanian Bogor, Darmaga dan pada tahun 1999-2001, sebagai asisten dosen di Laboratorium Mikologi, Departemen Biologi, FMIPA IPB. Pada tahun 2003-2011, penulis bekerja sebagai staf kependidikan dengan jabatan sebagai Koordinator Laboratorium dan sejak tahun 2011 sampai sekarang, bekerja sebagai tenaga pengajar tetap di Fakultas Teknobiologi, Unika Atma Jaya, Jakarta. Pada tahun 2011, penulis memperoleh kesempatan melanjutkan studi ke Sekolah Pascasarjana IPB pada Program Studi Mikrobiologi. Beasiswa pendidikan Pascasarjana diperoleh dari Direktorat Jendral Perguruan Tinggi melalui program BPPS.
Penulis berpartisipasi sebagai presenter dalam “International Symposium on Tropical Fungi” pada bulan September 2013, dan pada tanggal 25-29 November 2013, penulis juga mengikuti kursus pelatihan “Dasar-Dasar Filogenetik Molekuler: Rekonstruksi & Interpretasi”. Kedua kegiatan tersebut diselenggarakan oleh Perhimpunan Mikologi Indonesia (Mikoina).