AKTIVITAS PENGHAMBATAN EKSTRAK SIRIH MERAH (Piper crocatum) TERHADAP PEMBENTUKAN MALONDIALDEHIDA
(MDA) DAN ENZIM TIROSINASE
MUSTIKA WENI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Aktivitas Penghambatan Ekstrak Sirih Merah (Piper crocatum) terhadap Pembentukan
Malondialdehida (MDA) dan Enzim Tirosinase adalah benar karya saya dengan
arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014
Mustika Weni
ABSTRAK
MUSTIKA WENI. Aktivitas Penghambatan Ekstrak Sirih Merah (Piper
crocatum) terhadap Pembentukan Malondialdehida (MDA) dan Enzim Tirosinase.
Dibimbing oleh MEGA SAFITHRI dan SYAEFUDIN.
Daun sirih merah (Piper crocatum) berkhasiat sebagai tanaman obat. Tanaman tersebut memiliki kandungan senyawa yang berperan sebagai antioksidan. Penelitian ini bertujuan menentukan aktivitas antioksidasi dan penghambatan tirosinase ekstrak daun sirih merah. Proses ekstraksi dilakukan secara terpisah menggunakan pelarut etanol dan n-heksana. Penentuan aktivitas antioksidan menggunakan metode Thiobarbituric acid (TBA), sedangkan penghambatan tirosinase menggunakan metode Microplate Reader. Hasil penelitian menunjukkan bahwa ekstrak etanol sirih merah konsentrasi 200 ppm memiliki daya hambat pembentukan malondialdehid (MDA) sama besar (α>0.05) dengan vitamin E, ekstrak n-heksana konsentrasi 200 ppm memiliki daya hambat pembentukan malondialdehid (MDA) sama besar (α>0.05) dengan vitamin E. Aktivitas penghambatan tirosinase menunjukkan bahwa ekstrak etanol sirih merah memiliki nilai IC50 sebesar 1655 ppm sedangkan ekstrak n-heksana sirih merah memiliki nilai IC50 sebesar 3090.56 ppm. Ekstrak etanol sirih merah memiliki kemampuan menghambat MDA dan enzim tirosinase lebih tinggi dibandingkan ekstrak n-heksana sirih merah.
Kata kunci : Aktivitas antioksidasi, Enzim tirosinase, Piper crocatum
ABSTRACT
MUSTIKA WENI. Inhibitory Activity of Piper crocatum Extract to Malondialdehida Formation and Tyrosinase Activity. Supervised by MEGA SAFITHRI and SYAEFUDIN.
Piper crocatum leave bark is a medicinal plant. It contains antioxidant
compounds. The objectives of this research was to determine the antioxidant activity and inhibitory activity to tyrosinase of P. crocatum extract. Extraction process of Piper crocatum was conducted separately by using the solvent ethanol 70% and n-hexane. Determination of antioxidant activity was conducted with Thiobarbituric acid method (TBA) and for tyrosinase inhibitory activity using
microplate reader. The results showed that the ethanol extract at concentration of
200 ppm higher (α>0.05), inhibitory effects than vitamin E on the formation malondialdehida. n-hexane extract at concentration of 200 ppm higher (α>0.05). Tyrosinase inhibition activity test showed the ethanol extract has IC50 1655 ppm, n-hexane extract has IC50 3090.56 ppm. Ethanol extract has inhibitory MDA and enzyme tyrosinase than n-hexane extract.
AKTIVITAS PENGHAMBATAN EKSTRAK SIRIH MERAH (Piper crocatum) TERHADAP PEMBENTUKAN MALONDIALDEHIDA (MDA)
DAN ENZIM TIROSINASE
MUSTIKA WENI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
Pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Aktivitas Penghambatan Ekstrak Sirih Merah Piper crocatum terhadap Pembentukan Malondialdehida (MDA) dan Enzim Tirosinase
Nama : Mustika Weni
NIM : G84100047
Disetujui oleh
Tanggal Lulus:
Dr Mega Safithri,SSi MSi Pembimbing I
Syaefudin, SSi MSi Pembimbing II
Diketahui oleh
PRAKATA
Bismillahirrahmanirrahim
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian yang dilaksanakan sejak bulan Januari 2014 hingga April 2014 ini adalah Aktivitas Penghambatan Ekstrak Sirih Merah (Piper crocatum) terhadap Malondialdehida (MDA) dan Enzim Tirosinase.
Terima kasih penulis ucapkan kepada Dr Mega Safithri, SSi MSi dan Syaefudin, SSi MSi selaku pembimbing yang telah banyak memberikan pengarahan dan saran. Di samping itu, penghargaan penulis sampaikan kepada Ibu Meri, Ibu Tini beserta seluruh staf Laboran Biokimia yang telah membantu selama penelitian berlangsung. Terima kasih juga disampaikan kepada mba Leli dan seluruh staf Pusat Studi Biofarmaka (PSB) yang telah banyak membantu selama pengumpulan data penelitian. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga dan teman-teman Biokimia 47 untuk segala doa, kasih sayang dan dukungannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Prosedur Penelitian 3
Pengeringan Bahan Uji 3
Penetapan Kadar Air Metode Oven 4
Ekstraksi Serbuk Daun Sirih Merah (P. crocatum) 4
Rendemen 4
Analisis Fitokimia 4
Uji Aktifitas Antioksidan Metode TBA-MDA 5
Uji Inhibitor Tirosinase 6
HASIL 7
Kadar Air dan Rendemen Daun Sirih Merah 7
Kandungan Senyawa Metabolit Sekunder Daun Sirih Merah 7 Aktivitas Antioksidasi terhadap Penghambatan Malondialdehida (MDA) 7 Penentuan Penghambatan Enzim Tirosinase pada Ekstrak Etanol 70% dan
n-Heksana 8
PEMBAHASAN 9
Pembuatan Ekstrak Etanol 70% dan n-Heksana Daun Sirih Merah 9 Kandungan Senyawa Metabolit Sekunder Daun Sirih Merah 11 Potensi Antioksidan Ekstrak Etanol 70% dan n-Heksana Daun Sirih Merah
terhadap Penghambatan MDA 11
Penentuan Penghambatan (IC50) Ekstrak Etanol 70% dan Ekstrak n-Heksana
Sirih Merah terhadap Enzim Tirosinase 14
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 15
DAFTAR GAMBAR
1 Aktivitas antioksidan dengan metode TBA ekstrak daun sirih merah 8 2 Aktivitas penghambatan tirosinase ekstrak daun sirih merah 9
3 Kurva kadar MDA terhadap waktu 12
DAFTAR TABEL
1 Rendemen ekstrak etanol 70% dan n-heksana daun sirih merah 7 2 Metabolit sekunder ekstrak etanol 70% dan n-heksana daun sirih
merah 7
DAFTAR LAMPIRAN
1 Tahapan umum penelitian 20
2 Ekstraksi daun sirih merah 20
3 Pengujian fitokimia 20
4 Penentuan waktu inkubasi maksimum asam linoleat 20 5 Analisis aktivitas antioksidan dari metode TBA 21
6 Kadar air simplisia daun sirih merah 22
7 Rendemen simplisia daun sirih merah 22
8 Rendemen simplisia ekstrak etanol 70% dan n-heksana sirih merah 22 9 Grafik hubungan antara konsentrasi inhibitor ekstrak etanol 70% dan
ekstrak n-heksana terhadap persen inhibisi 22
10 Fitokimia ekstrak etanol 70% dan n-heksana sirih merah 23 11 Hasil absorbansi kurva standar 1,1,3,3-tetrametoksipropana (TMP) 23 12 Kurva standar 1,1,3,3-tetrametoksipropana (TMP) 24 13 Absorbansi inkubasi kadar MDA (µM) terhadap waktu 24 14 Aktivitas antoksidan ekstrak etanol 70% dan ekstrak n-heksana daun
sirih merah metode TBA 24
15 Analisis perhitungan IC50 difenolase ekstrak etanol 70% dan ekstrak
n-heksana daun sirih merah 25
PENDAHULUAN
Kulit merupakan organ terbesar dan terluar tubuh manusia. Kulit langsung terkena prooksida dari lingkungan, seperti radiasi ultraviolet (UV), obat-obatan dan polusi udara. Selain pemicu eksternal serangan oksidatif, kulit juga harus menghadapi endogen spesies oksigen reaktif (ROS) dan radikal bebas lainnya, yang terus-menerus diproduksi selama metabolisme. Keseimbangan antara oksidan dan antioksidan diperlukan untuk meminimalkan kerusakan jaringan. Namun, jika keseimbangan ini terganggu stres oksidatif dapat terjadi dan hasilnya adalah kerusakan oksidatif. Spesies oksigen reaktif (ROS) diketahui menyebabkan modifikasi oksidatif DNA, protein dan lipid (Kang et al. 2005). Dalam mengatasi bahaya yang timbul akibat radikal bebas, tubuh mengembangkan mekanisme perlindungan untuk mencegah pembentukan radikal bebas dan peroksidasi lipid, termasuk pada kulit. Berbagai kompartemen kulit (epidermis, dermis, subkutis) dilengkapi dengan sistem antioksidan spesifik untuk mempertahankan keseimbangan antara ROS dan antioksidan, sehingga dapat mencegah stres oksidatif (Thiele dan Ekanayake-Mudiyanselage 2007).
Melanin pada epidermis berfungsi sebagai kromofor endogen yang akan menyerap sinar matahari sehingga dianggap sebagai pelindung dampak buruk dari sinar matahari. Melanin akan menyerap sinar matahari kemudian terjadi proses fotokimiawi yang merubah molekul-molekul yang stabil menjadi molekul yang sangat reaktif. Hasil reaksi fotokimiawi dikenal sebagai photo product antara lain ROS (reactive oxygen species) seperti oksigen singlet, anion superaktif dan radikal hidroksil. ROS yang terbentuk ini akan memicu kerja tirosinase dan berakhir dengan sintesis melanin. Produksi melanin secara berlebihan dapat mengarah pada terjadinya penumpukan melanin di lapisan epidermal
(hiperpigmentasi) dan menyebabkan kulit menjadi lebih gelap. Tirosinase
merupakan enzim yang berfungsi mengatur biosintesis melanin. Enzim tirosinase bekerja mengubah tirosin menjadi DOPA dan kemudian menjadi dopakuinon yang selanjutnya melalui beberapa tahap transformasi dikonversi menjadi melanin (Fitrie 2004). Fungsi antioksidan berperan sebagai ROS scavenger sehingga mengurangi hiperpigmentasi (Momtaz et al. 2008). Antioksida seperti flavonoid juga diduga berperan sebagai inhibitor kompetitif enzim tirosinase karena struktur dari flavonoid yang mirip dengan DOPA sebagai substrat (Chang 2009).
Senyawa antioksidan yang berperan sebagai penghambat pembentukan melanin dapat diperoleh dari senyawa sintetik ataupun dari bahan alam. Senyawa yang sering ditemukan dalam bahan kosmetik sebagai pencegah terbentuknya melanin antara lain asam askorbat, arbutin, asam kojat, merkuri dan hidrokuinon. Asam kojat memiliki aktivitas inhibisi dan kestabilan paling besar dalam menghambat pembentukan melanin, serta banyak digunakan dalam produk kosmetik dibandingkan produk pemutih lain. Namun, Miyazawa (2007) menyatakan bahwa asam kojat bersifat karsinogenik dan penggunaannya dalam konsentrasi tinggi dapat merusak kulit.
2
disukai oleh masyarakat. Hal ini disebabkan obat tradisional sangat murah, mudah didapat dan memiliki efek samping serta tingkat toksisitasnya jauh lebih rendah.
Sejauh ini ekstrak etanol sirih merah (Piper crocatum) mengandung senyawa fitokimia dan ekstrak air rebusan daun sirih merah mengandung alkaloid, flavonoid dan tanin (Safithri dan Fahma 2008). Penelitian lain menyatakan bahwa ekstrak etanol daun sirih merah memiliki aktivitas antioksidasi, yaitu dapat menghambat oksidasi asam lemak dengan daya hambat terbesar 80.40% dan sebagai radical scavenger dengan nilai IC50 85.82 ppm. Ekstrak etanol daun sirih merah juga memiliki aktivitas inhibisi terhadap enzim α-glukosidase sebesar 39.62% (Alfarabi 2010). Berdasarkan hasil penelitian Safithri et al. (2011) ekstrak air rebusan daun sirih merah (P. crocatum) memiliki aktivitas antioksidasi terhadap SOD dan katalase sebesar 3,41±0,04 U/ml dan 0,13± 0,02 mU/ml, dan total fenol sebesar 532,6 ppm. Berdasarkan hasil penelitian pra klinis menunjukkan bahwa ekstrak air rebusan formula daun sirih merah dan kayu manis dengan perbandingan 3:2 (60.55%) konsentrasi 200 ppm memiliki daya hambat yang sebanding dan tidak berbeda nyata dengan vitamin E konsentrasi 200 ppm (61.40%) (Kartika 2012). Pengujian toksisitas akut air rebusan daun sirih merah terhadap tikus percobaan Sprague dawley yang diberikan rebusan sirih merah dengan berbagai dosis, menunjukkan bahwa selama 24 jam pertama sampai 7 hari masa percobaan tidak ada hewan yang mati baik untuk kelompok dosis 0, 5, 10, maupun 20 g/kg BB. Dengan tidak adanya kematian tikus putih pada semua dosis yang diujikan, maka dapat dikatakan bahwa rebusan sirih merah tidak bersifat toksik (Safithri et al. 2012). Menurut Pranakusumanagara (1998) rebusan daun sirih merah digunakan untuk membasuh muka atau mandi. Kandungan karvakro dan arekolin yang terkandung dalam sirih merah ini yang dipercaya meremajakan kulit, memutihkan, menyegarkan dan membuat tampak lebih awet muda. Sirih merah juga mengandung senyawa flavonoid yang diduga dapat menghambat kerja enzim tirosinase (Chang 2009). Berdasarkan uraian diatas, untuk mempertimbangkan kemungkinan aplikasi sirih merah sebagai pemutih alami pada kosmetik kecantikan, maka diperlukan kajian mengenai aktivitas inhibitornya terhadap enzim tirosinase dan aktivitas antioksidan.
Penelitian ini bertujuan menentukan aktivitas antioksidan ekstrak daun sirih merah terhadap pembentukan malondialdehida (MDA) dan enzim tirosinase. Parameter yang digunakan adalah pengujian antioksidasi daun sirih merah secara
in vitro menggunakan metode tiobarbiturat (TBA) dan pengujian aktivitasnya
dalam menghambat enzim tirosinase. Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai potensi antioksidasi dan penghambatan terhadap enzim tirosinase daun sirih merah secara in vitro dan dapat dijadikan dasar pengembangan produk fitofarmaka sirih merah sebagai antioksidan dan sebagai pemutih wajah.
METODE
Bahan dan Alat
3
takar, erlenmeyer, spektrofotometer Genesys 10 UV (190-1100 nm), rotav eyela n-1100, bulp, gelas ukur, sentrifus Hettich Universal (0-6000 rpm), corong plastik, multi-well plate, ELISA reader epoch biotekdanmikropipet.
Bahan-bahan yang digunakan dalam penelitian ini adalah simplisia daun sirih merah, etanol 70%, n-heksana, HCl 2 N, akuades, pereaksi Dragendorff, pereaksi Mayer, pereaksi Wagner, metanol, etil asetat, metanol 30%, etanol 30%, etanol 99.8%, amoniak, kloroform, eter, FeCl3, tirosinase, L-3, 4-dihydroxyphenylalanine (L-DOPA), larutan standar 1,1,3,3-tetrametoksipropana (TMP) 6 M, natrium hidroksida (NaOH), asetat anhidrida, asam sulfat (H2SO4), buffer fosfat pH 6.5, buffer fosfat 0.1 M pH 7, asam linoleat, Dimethyl sulfoxide (DMSO), asam trikloroasetat (TCA) 20%, asam kojat sebagai kontrol positif dan asam tiobarbiturat (TBA) 1%.
Prosedur Penelitian
Analisis daun sirih merah dibagi dalam 3 tahap penting, yaitu analisis fitokimia dari ekstrak sirih merah, analisis antioksidan ekstrak sirih merah dengan metode TBA dan analisis inhibitor ekstrak sirih merah terhadap enzim tirosinase. Tahap awal, daun sirih merah dikeringkan dalam oven suhu 50°C selama ± 4 hari dengan tujuan untuk mengurangi kadar air pada daun sirih merah. Daun sirih merah yang sudah kering dihaluskan dengan ukuran 60 mesh. Kadar air daun sirih merah diukur dengan tujuan untuk mengetahui kadar air dari sirih merah. Kadar air tidak lebih dari 12% (b/b). Selanjutnya, daun sirih merah diekstrak dengan metode maserasi menggunakan 2 pelarut, yaitu etanol 70% dan n-heksana. Dasar pemilihan kedua pelarut ini adalah kandungan metabolit sekunder daun sirih merah (flavonoid dan minyak atsiri) diharapkan dapat terlarut dalam kedua pelarut yang digunakan. Kedua ekstrak sirih merah (etanol 70% dan n-heksana) dianalisis fitokimia, yaitu uji alkaloid, flavonoid, tanin, saponin, steroid dan triterpenoid dengan tujuan untuk mengetahui kandungan metabolit sekunder sirih merah pada kedua ekstrak. Ekstrak etanol 70% dan n-heksana selanjutnya diuji aktivitas antioksidan dengan metode TBA. Sebelum analisis ekstrak etanol 70% dan n-heksana, asam linoleat diinkubasi dengan tujuan untuk menentukan waktu inkubasi ekstrak dengan asam linoleat. Selanjutnya, dilakukan analisis penghambatan ekstrak etanol 70% dan n-heksana sirih merah terhadap enzim tirosinase dengan menggunakan metode microplate reader.
Pengeringan Bahan Uji (Safithri 2012)
4
lalu diayak dengan saringan sehingga ukuran serbuk menjadi 60 mesh. Simplisia dibungkus dengan plastik dan disimpan untuk pengujian selanjutnya.
Penetapan kadar air metode oven (AOAC 2006)
Prinsip penghitungan kadar air adalah bobot hilang pada pemanasan 105ºC dianggap sebagai kadar air yang terdapat pada sirih merah, karena titik didih air sebesar 100ºC. Cawan porselen dikeringkan di dalam oven bersuhu 105°C selama 1 jam, kemudian didinginkan dalam eksikator selama 15 menit. Cawan porselen ditimbang untuk menentukan bobot kosongnya. Cawan kosong ditimbang dan dicatat bobotnya. Dua gram simplisia daun sirih merah dimasukkan ke dalam cawan kemudian dicatat bobotnya, dikeringkan dalam oven pada suhu 105°C selama 3 jam setelah itu didinginkan dalam eksikator. Cawan porselen ditimbang kembali.
Kadar Air = × 100 % Keterangan:
a = bobot sampel sebelum dikeringkan (g) b = bobot sampel setelah dikeringkan (g)
Ekstraksi Serbuk Daun Sirih Merah (P. crocatum) (BPOM RI 2004)
Sebanyak 5 gram serbuk simplisia daun sirih merah ditambahkan pelarut dengan perbandingan 1:10 (b/v), lalu diletakkan pada shaker selama 24 jam, kemudian disaring. Perlakuan maserasi (menggunakan sampel daun, bekas maserasi sebelumnya) diulang sebanyak 3 kali. Maserat dipekatkan menggunakan
rotary evaporator pada suhu 50ºC untuk ekstrak etanol 70% dan 45ºC untuk
ekstrak n-heksana. Residu yang diperoleh ditimbang dan ditentukan rendemennya.
Rendemen
Rendemen ekstrak etanol 70% dan ekstrak n-heksana daun sirih merah dihitung dengan membandingkan bobot awal simplisia dengan bobot akhir ekstrak yang dihasilkan
% Rendemen ekstrak =
x 100%
Analisis Fitokimia (Harbone 1987)
5
Uji flavonoid. Sebanyak 0.1 gram ekstrak ditambahkan dengan 5 mL metanol 30 %, kemudian dipanaskan selama 5 menit. Filtrat yang terbentuk ditambahkan dengan 3 tetes H2SO4. Adanya flavonoid ditunjukkan dengan terbentuknya endapan warna merah.
Uji saponin. Sebanyak 0.1 gram ekstrak ditambahkan dengan 5 mL akuades kemudian dipanaskan selama 5 menit. Sampel dikocok selama 5 menit. Adanya saponin ditunjukkan dengan terbentuknya busa yang stabil setelah didiamkan selama 10 menit.
Uji triterpenoid dan steroid. Sebanyak 0.1 gram ekstrak ditambahkan dengan 5 mL etanol 30 %, kemudian dipanaskan selama 5 menit. Sampel disaring, filtrat yang diperoleh diuapkan hingga kering. Residu ditambah 0.5 mL eter dan dipindahkan ke dalam tabung reaksi, lalu ditambahkan dengan pereaksi Liebermann Burchard (3 tetes asam asetat anhiridat dan 1 tetes H2SO4 pekat). Adanya triterpenoid ditandai dengan terbentuknya warna merah atau ungu, sedangkan adanya steroid ditunjukkan dengan warna hijau atau biru.
Uji tanin. Sebanyak 0.1 gram ekstrak ditambahkan dengan 5 mL akuades, kemudian didihkan selama 5 menit. Sampel selanjutnya disaring, filtrat yang diperoleh ditambahkan dengan 5 tetes FeCl3 1% (b/v). Adanya warna biru tua atau hitam yang terbentuk menunjukkan adanya tanin.
Uji Aktivitas Antioksidan Metode TBA-MDA (Kikuzaki dan Nakatani 1993)
Penentuan kurva standar larutan 1,1,3,3-tetrametoksipropana (TMP).
Pembuatan kurva standar dilakukan dengan menggunakan larutan TMP dengan konsentrasi 1, 5, 8, 10, 13, 15, 18, 20 µM. Tiap larutan dipipet 1 mL dan ditambahkan 2 mL larutan TCA 20% dan 2 mL larutan TBA 1% dalam asam asetat 50%. Campuran reaksi diletakkan dalam penangas air 100oC selama 10 menit. Setelah dingin larutan disentrifus dengan kecepatan 3000 rpm (diameter rotor sentrifus 130 mm) selama 15 menit. Kemudian serapannya diukur pada panjang gelombang 532 nm. Larutan blanko menggunakan 1 mL akuades yang diberi perlakuan seperti larutan konsentrasi TMP lainnya (konsentrasi 0 TMP).
Penentuan waktu inkubasi asam linoleat dengan Metode TBA.
6
campuran 3 mL etanol 99.8% dan 2 mL bufer fosfat 0.1 M pH 7, kemudian ditambahkan 2 mL TCA 20% dan 2 mL TBA 1% dalam asetat 50%. Larutan blanko tersebut diletakkan dalam penangas air 100oC selama 10 menit. Larutan disentrifus dengan kecepatan 3000 rpm (diameter rotor sentrifus 130 mm) selama 15 menit.
Analisis konsentrasi malondialdehida (MDA) dengan metode TBA.
Analisis antioksidan ekstrak daun sirih merah dibuat dalam konsentrasi 25, 50, 75, 100, dan 200 ppm. Masing-masing sampel diambil sebanyak 1 mL kemudian ditambahkan 2 mL bufer fosfat 0.1 M pH 7 dan 2 mL asam linoleat 50 mM dalam etanol 99.8%. Larutan kontrol positif digunakan 1 mL α-tokoferol (200 ppm), 2 mL bufer fosfat 0.1 M pH 7 dan 2 mL asam linoleat 50 mM dalam etanol 99.8%. Semua larutan ini kemudian dimasukkan dalam botol gelap dan diinkubasi di penangas 40oC selama waktu inkubasi optimum dari metode TBA dengan mengambil 1 mL dari setiap larutan, kemudian ditambahkan 2 mL larutan TCA 20% dan 2 mL larutan TBA 1% dalam asam asetat 50%. Campuran reaksi diletakkan dalam penangas air 100oC selama 10 menit. Setelah dingin larutan disentrifus dengan kecepatan 3000 rpm (diameter rotor sentrifus 130 mm) selama 15 menit. Panjang gelombangnya diukur pada panjang gelombang 532 nm. Larutan blanko digunakan 1 mL campuran 3 mL etanol 99.8% dan 2 mL bufer fosfat 0.1 M pH 7, kemudian ditambahkan 2 mL TCA 20 % dan 2 mL TBA 1% dalam asetat 50%. Larutan blanko tersebut diletakkan dalam penangas air 100oC selama 10 menit. Larutan disentrifus dengan kecepatan 300 rpm (diameter rotor sentrifus 130 mm) selama 15 menit.
Uji Inhibitor Tirosinase (Batubara et al. 2010)
Ekstrak dilarutkan dalam DMSO hingga konsentrasinya 10.000 ppm. Larutan stok disiapkan dengan cara melarutkan ekstrak pekat kedalam bufer fosfat 50 mM (pH 6.5) hingga memperoleh konsentrasi 600 mg/mL. Ekstrak diuji dengan konsentarsi 20, 200, 400, 800, 1600 dan 3200 ppm. Asam kojat sebagai kontrol positif diuji pada konsentrasi 200 ppm ditambahkan 30 µL enzim tironase (sigma, 333unit/mL dalam bufer fosfat) dan campuran diinkubasi selama 5 menit. Setelah itu, sebanyak 110 µL substrat (L-DOPA 12 mM) ditambahkan dan campurannya diinkubasi pada suhu 37°C selam 30 menit. Larutan pada masing-masing sumur diukur nilai absorbansinya dengan menggunakan microplate reader
pada panjang gelombang 492 nm untuk menentukan persen inhibisi dan nilai konsentrasi hambat 50% (IC50). Persen inhibisi dihitung dengan cara membandingkan absorbansi sampel tanpa ekstrak (A) dengan penambahan ekstrak (B) pada panjang gelombang 492 nm.
% Inhibisi = × 100 %
Analisis data.
Analisis statistik terhadap aktivitas antioksidasi menggunakan rancangan acak lengkap, yaitu dengan uji analysis of varian (ANOVA) pada tingkat
kepercayaan λ5% dan taraf α=0.05. Data dianalisis dengan program perangkat
7
HASIL
Kadar Air dan Rendemen Daun Sirih Merah
Daun sirih merah dianalisis kadar air terlebih dahulu sebelum digunakan untuk ekstraksi. Hasil analisis kadar air menunjukkan bahwa proses pengeringan dengan oven suhu 50°C selama 4 hari mampu menurunkan kadar air hingga dibawah 10%, kadar air simplisia yang diperoleh sebesar 7.75%. Rendemen tertinggi hasil Rotary evaporator diperoleh ekstrak etanol 70% daun sirih merah sebesar 17.84%, sedangkan ekstrak n-heksana sebesar 4.88% (Tabel 1).
Tabel 1 Rendemen ekstrak etanol 70% dan n-heksana daun sirih merah
Jenis ekstrak %Rendemen ekstrak
Etanol 17.84% ± 0.66
n-heksana 4.88% ± 4.80
n = 2 kali ulangan
Kandungan Senyawa Metabolit Sekunder Daun Sirih Merah
Hasil uji fitokimia menunjukkan bahwa ekstrak etanol 70% sirih merah mengandung alkaloid, flavonoid, saponin, tanin dan steroid. Ekstrak n-heksana sirih merah mengandung saponin dan steroid (Tabel 2).
Tabel 2 Uji fitokimia ekstrak etanol 70% dan n-heksana sirih merah Senyawa Ekstrak
Ket : (+) terdeteksi; (-) tidak terdeteksi
Aktivitas Antioksidasi terhadap Pembentukan Malondialdehida (MDA)
Berdasarkan hasil yang diperlihatkan pada Gambar 1, peningkatan daya hambat ekstrak etanol 70% terhadap pembentukan MDA tidak berbanding lurus dengan konsentrasi. Vitamin E konsentrasi 200 ppm digunakan sebagai kontrol positif. Penghambatan tertinggi ekstrak etanol 70% terdapat pada konsentrasi 200 ppm sebesar 52.13%. Analisis statistik menunjukkan bahwa ekstrak etanol 70% pada konsentrasi 50 ppm tidak berbeda nyata (P<0.05) dengan konsentrasi 25 ppm dan 100 ppm tetapi berbeda nyata (P<0.05) dengan konsnetrasi 200 ppm. Ekstrak etanol 70% konsentrasi 200 ppm (52.13%) memiliki daya hambat yang tidak berbeda nyata (P<0.05) dengan vitamin E konsentrasi 200 ppm (36.42%).
8
nyata (P<0.05) dengan konsnetrasi 200 ppm. Ekstrak n-heksana konsentrasi 200 ppm (40.13%) memiliki daya hambat yang tidak berbeda nyata (P<0.05) dengan vitamin E konsentrasi 200 ppm (36.42%).
Gambar 1 Aktivitas antioksidan ekstrak daun sirih merah dengan metode TBA. ekstrak etanol 70% dan ekstrak n-heksana
Penentuan Penghambatan Enzim Tirosinasepada Ekstrak Etanol 70% dan n-Heksana
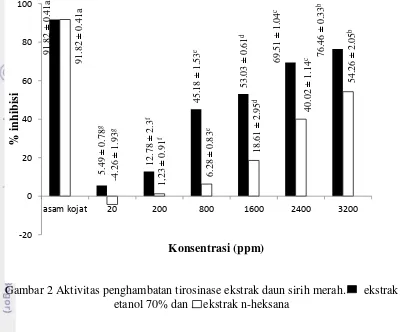
Ekstrak etanol 70% sirih merah terjadi peningkatan daya hambat terhadap aktivitas enzim tirosinase yang berbanding lurus dengan peningkatan konsentrasi (Gambar 2). Asam kojat konsentrasi 200 ppm digunakan sebagai kontrol positif. Penghambatan tertinggi terdapat pada ekstrak etanol 70% dengan konsentrasi 3200 ppm sebesar 76.457%. Analisis statistik menunjukkan bahwa ekstrak etanol 70% pada masing-masing konsentrasi (20 ppm, 200 ppm, 800 ppm, 1600 ppm, 2400 dan 3200 ppm) berbeda nyata (P<0.05). Ekstrak etanol 70% konsentrasi 200 ppm (12.78%) memiliki daya hambat yang berbeda nyata (P<0.05) dengan asam kojat konsentrasi 200 ppm (91.82%). Nilai IC50 dari ekstrak etanol 70% sebesar 1655 ppm.
9
berbeda nyata (P<0.05) dengan asam kojat konsentrasi 200 ppm (91.82%). Nilai IC50 ekstrak n-heksana sebesar 3090.56 ppm.
Gambar 2 Aktivitas penghambatan tirosinase ekstrak daun sirih merah. ekstrak etanol 70% dan ekstrak n-heksana
PEMBAHASAN
Pembuatan Ekstrak Etanol 70% dan n-Heksana Daun Sirih Merah
Daun sirih merah diekstraksi dengan proses maserasi. Ekstraksi adalah metode suatu cara untuk menarik satu atau lebih zat dari bahan asal dengan menggunakan pelarut (Syamsuni 2006). Zat aktif yang terdapat dalam simplisia tersebut dapat digolongkan ke dalam golongan minyak atsiri, alkaloid, flavonoid dan lain-lain (Depkes 2000). Tujuan utama ekstraksi ini adalah untuk mendapatkan atau memisahkan sebanyak mungkin zat-zat yang memiliki khasiat pengobatan (Syamsuni 2006). Penelitian ini menggunakan metode ekstraksi maserasi, karena metode ini prosedur dan peralatannya sederhana (Agoes 2007). Maserasi adalah penarikan cara penarikan simplisia dengan merendam simplisia tersebut dalam cairan penyari (Syamsuni 2006) dengan beberapa kali pengocokan atau pengadukan pada temperatur kamar, sedangkan remaserasi merupakan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya (Depkes 2000). Sebelum diekstraksi, terlebih dahulu simplisia daun sirih merah dikeringkan. Proses pengeringan simplisia daun sirih merah dilakukan untuk mengurangi kadar air dan mempermudah penggerusan atau pembuatan serbuk (Katno et al. 2008). Bahan dikeringkan dengan menggunakan
10
oven selama 4 hari pada suhu 50ºC. Pengeringan dengan menggunakan oven dipilih karena suhu dan kecepatan proses pengeringan dapat diatur, tidak dipengaruhi oleh cuaca, sanitasi dan higienis dapat dikendalikan. Standar kadar air maksimum simplisia adalah 10% (Depkes 2008), karena kandungan air yang tinggi dalam suatu bahan dapat mendorong terjadinya reaksi enzimatik yang mengakibatkan terjadinya perubahan kimia. Jumlah air dalam bahan pangan disebut sebagai aktivitas air (water activity = aw). Bakteri membutuhkan aw = 0.91. Oleh karena itu sebagian bakteri tidak dapat tumbuh pada aw = 0.90 atau dibawahnya, maka untuk membuat makanan tahan lama selama penyimpanan selain kadar air makanan dibuat 10% juga aw makanan harus di bawah 0.90 untuk mencegah timbulnya bakteri (Winarno 1980). Hasil pengukuran kadar air dari kedua simplisia didapatkan di bawah 10%, sehingga simplisia dapat disimpan dalam jangka waktu lama tanpa adanya kerusakan oleh mikroba (Suharmiati dan Maryani 2003).
Berdasarkan uji fitokimia pada penelitian sebelumnya, bahwa daun sirih merah mengandung senyawa flavonoid, alkaloid dan tannin (Safithri dan Fahma 2005), maka senyawa-senyawa tersebut bersifat polar terutama flavonoid. Berbagai kandungan yang terdapat dalam daun sirih merah yang diperkirakan sebagai penghambat enzim tirosinase adalah flavonoid (Chang 2009). Berdasarkan sifat flavonoid tersebut, maka untuk ekstraksi dapat digunakan etanol 70% sebagai bahan penyarinya, karena etanol 70% bersifat semi polar yang dapat melarutkan senyawa yang bersifat polar maupun non-polar. Etanol 70% tidak menyebabkan pembengkakan membran sel dan memperbaiki stabilitas bahan obat terlarut (Harborne 1987) dan relatif lebih aman digunakan. Selain itu etil p-metoksi sinamat, salah saru turunan asam sinamat merupakan salah satu golongan minyak atsiri memiliki berbagai aktivitas biologis salah satunya adalah sebagai penghambat enzim tirosinase (Rudyanto dan Hartanti 2008). Selain menggunakan etanol 70%, digunakan n-heksana sebagai pelarut karena minyak atsiri merupakan senyawa non polar sehingga dapat larut dalam senyawa non polar.
11
kadar metabolit sekunder yang terbawa oleh pelarut tersebut namun tidak dapat menentukan jenis senyawa yang terbawa tersebut.
Sampel dalam bentuk ekstrak memiliki kelebihan antara lain, banyaknya senyawa bioaktif yang terlarut karena semua senyawa tersebut dalam tanaman masih dalam bentuk konsentrat serta masih dalam bentuk alami. Komposisi alami memungkinkan semakin kecil efek samping dan perubahan aktivitas senyawa bioaktif serta mempermudah standarisasi sampel (Sinambela 2003).
Kandungan Senyawa Metabolit Sekunder Daun Sirih Merah
Sampel yang digunakan adalah ekstrak etanol 70% dan ekstrak n-heksana daun sirih merah. Uji fitokimia bertujuan untuk mengetahui adanya senyawa metabolit yang diharapkan dapat berperan sebagai antioksidan dan penghambat enzim tirosinase.
Hasil uji fitokimia ekstrak etanol 70% daun sirih merah (tabel 2) ini tidak jauh berbeda dengan hasil penelitian Salim (2006) yang menggunakan rebusan daun sirih merah yang terbukti mengandung alkaloid, flavonoid dan tanin. Kesesuaian hasil uji fitokimia antara ekstrak air rebusan dan etanol 70% membuktikan bahwa etanol 70% menarik senyawa kimia yang relatif sama dengan air. Dari ketiga senyawa tersebut (alkaloid, flavonoid dan tanin), senyawa flavonoid dilaporkan dapat menghambat enzim tirosinase (Chang 2009). Senyawa flavonoid juga berperan sebagai antioksidan seperti yang telah dilaporkan oleh (Gheldof et al. 2002). Selain senyawa flavonoid, senyawa tanin juga berfungsi sebagai antioksidan karena kemampuannya dalam menangkap radikal bebas, menghambat radikal bebas dan tumor (Dangles et al. 2000). Aktivitas antioksidan dari suatu tumbuhan sangat dipengaruhi oleh keberadaan senyawa metabolit sekunder yang terkandung.
Potensi Antioksidan Ekstrak Etanol 70% dan n-Heksana Daun Sirih Merah terhadap Penghambatan MDA
Salah satu target dari serangan radikal bebas dalam sel makhluk hidup adalah lipid pada membran sel. Peroksidasi lipid merupakan reaksi tidak terkendali dari radikal bebas terhadap komponen sel seperti asam lemak tak jenuh ganda (polyunsaturated fatty acid, PUFA) pada membran sel yang sedikitnya mengandung tiga ikatan rangkap, sehingga terbentuk radikal bebas baru yang sangat peka terhadap oksigen (radikal peroksi lipid) (Hasanah 2008). Reaksi ini berlanjut hingga membentuk produk sekunder yaitu malondialdehida (MDA).
Penelitian ini menggunakan asam linoleat yang merupakan asam lemak tak jenuh, karena dapat dengan mudah diserang oleh radikal bebas pada ikatan rangkapnya sehingga menghasilkan lipid peroksida. Asam lemak dapat rusak akibat teroksidasi oleh beberapa faktor seperti suhu, cahaya, ion-ion logam dan oksigen (Raharjo 2004). Oleh karena itu laju oksidasi asam linoleat dipercepat dengan mengatur suhu tetap pada 40oC, dan disimpan pada botol gelap berulir bertujuan menghindari faktor lain selain suhu dan oksigen.
12
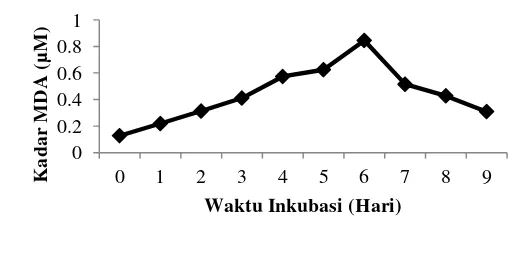
Gambar 3 Kurva kadar MDA terhadap waktu (Kartika 2013)
Berdasarkan hasil penelitian yang dilakukan Kartika (2013) absorbansi terbesar terjadi pada hari ke-6 (Gambar 3), hasil yang sama juga ditunjukkan oleh penelitian Alfarabi (2010). Pengukuran potensi antioksidasi dilakukan dua hari setelah hidroperoksida terbentuk maksimum yaitu pada hari ke-8, dengan asumsi semua hidroperoksida yang telah terbentuk terdekomposisi menjadi MDA (Kikuzaki dan Nakatani 1993).
Keberadaan MDA ini dapat dicegah apabila reaksi oksidasi asam linoleat dihambat. Senyawa antioksidan dapat menghambat proses oksidasi berlanjut tersebut dengan melengkapi elektron ke senyawa asam linoleat radikal. Senyawa antioksidan sirih merah (tanin, alkaloid dan flavonoid) didalam larutan inkubasi asam linoleat dapat dengan mudah melengkapi elektron ke senyawa radikal, oleh sebab itu senyawa MDA tidak terbentuk atau terbentuk dalam jumlah yang kecil karena proses oksidasi asam linoleat terhambat dengan adanya antioksidan. Konsentrasi ekstrak sirih merah yang digunakan untuk mengukur MDA adalah 25, 50, 75, 100, dan 200 ppm. Pemilihan kelima konsentrasi ekstrak yang digunakan berdasarkan pada batas maksimum kandungan antioksidan dalam makanan yaitu 200 ppm (Hernani dan Rahardjo 2005). Kontrol positif pada penelitian ini digunakan vitamin E 200 ppm.
Inkubasi dalam percobaan dilakukan selama 8 hari, setelah itu kadar MDA diukur dengan spektrofotometer dengan panjang gelombang 532 nm. Kurva standar yang digunakan adalah larutan 1,1,3,3-tetrametoksipropana (TMP) dengan berbagai konsentrasi. TMP merupakan senyawa turunan MDA yang cukup stabil. Persamaan garis linear yang didapat adalah y=0.086x+0.006 dengan nilai R2= 99.8%. Nilai pengukuran absorbansi pada panjang gelombang 532 nm tidak berbanding lurus dengan jumlah MDA yang terbentuk.
Hasil pengujian aktivitas antioksidan dengan MDA-TBA menunjukkan bahwa setiap ekstrak daun sirih merah mempunyai kemampuan menghambat radikal bebas MDA. Hal ini terjadi karena nilai absorbansi setiap ekstrak daun sirih merah lebih kecil dibandingkan dengan kontrol negatif. Kelima konsentrasi menunjukkan hasil yang tidak linear antara konsentrasi dengan persen penghambatannya baik pada ekstrak etanol 70%, maupun ekstrak n-heksana. Hal ini disebabkan ekstrak yang digunakan masih ekstrak kasar, sehingga masih ada kemungkinan senyawa murni yang dikandung memiliki aktivitas peredam radikal
13
bebas lebih kuat dibandingkan ekstraknya. Ekstrak kasar masih mengandung senyawa-senyawa yang dapat menghambat peredaman radikal bebas terhadap antioksidan, seperti karbohidrat, protein dan lemak yang menyebabkan aktivitas antioksidan ekstrak kasar lebih rendah dibandingkan senyawa murni. Penghambatan tertinggi ekstrak etanol 70% maupun ekstrak n-heksana terdapat pada konsentrasi 200 ppm. Konsentrasi 200 ppm ekstrak etanol 70% dan ekstrak n-heksana memiliki daya hambat yang tidak berbeda nyata (P<0.05) dengan vitamin E konsentrasi 200 ppm (36.42%). Nilai vitamin E 200 ppm pada penelitian ini mampu memberikan daya hambat terhadap pembentukan MDA sebesar 36.42%. Nilai tersebut lebih rendah dibandingkan dengan penelitian lain yang dilakukan dengan menggunakan vitamin E sebagai kontrol positif pada konsentrasi 200 ppm. Satria (2005) melaporkan bahwa pada konsentrasi 200 ppm, vitamin E mampu menghambat pembentukan MDA sebesar 93.00%, Kartika (2012) melaporkan bahwa pada konsentrasi 200 ppm, vitamin E mampu menghambat pembentukan MDA sebesar 49.82%, Martsolich (2007) melaporkan bahwa pada konsentrasi 200 ppm, vitamin E mampu menghambat pembentukan MDA sebesar 55.18%, sedangkan Sufriadi (2006) menyebutkan nilai sebesar 84.01% pada konsentrasi yang sama. Hasil yang berbeda ini terjadi karena ada faktor yang ikut mempengaruhi nilai potensi antioksidasi vitamin E sebagai kontrol positif. Walupun vitamin E yang dipakai adalah berasal dari stok yang sama, namun tidak dengan bahan-bahan lainnya. Hal ini memungkinkan adanya perbedaan kemurnian dan kualitas bahan-bahan tersebut yang dapat mempengaruhi hasil yang diperoleh. Selain itu metode yang berbeda juga ikut mempengaruhi lamanya waktu yang digunakan untuk inkubasi asam linoleat. Pada penelitian Satria (2005) dan Sufriadi (2006), digunakan metode tiosianat, sedangkan dalam penelitian ini digunakan metode TBA, sehingga perbedaan waktu inkubasi ini ikut mempengaruhi nilai potensi antioksidasi yang diperoleh. Selain itu vitamin E mudah teroksidasi, sehingga hal tersebut yang membuat kemampuan vitamin E sebagai antioksidan berkurang. Seperti yang diungkapkan Winarno 1998 bahwa vitamin E merupakan vitamin yang larut dalam lemak, tahan terhadap suhu tinggi tetapi karena bersifat antioksidan vitamin E teroksidasi terutama apabila ada lemak yang tengik, timah, garam besi dan mudah rusak oleh sinar matahari.
Selain dengan vitamin E, aktivitas antioksidasi ekstrak daun sirih merah ini dapat dibandingkan dengan tumbuhan lainnya yang memiliki aktivitas antioksidasi, contohnya dengan mengkudu dan Physalis peruviana. Kemampuan antioksidasi ekstrak daun sirih merah dengan pelarut etanol dan n-heksana ini lebih baik karena di setiap konsentrasinya tidak menunjukkan efek prooksidan bila dibandingkan dengan buah mengkudu (Morinda citrifolia L.) yang diekstrak dengan pelarut metanol (Zin et al. 2001). Namun aktivitas antioksidasinya lebih rendah bila dibandingkan dengan ekstrak etanol 95 % Physalis peruviana
konsentrasi 100 g/mL (100 ppm) yang sudah memiliki daya hambat
14
menghambat masing-masing sebesar 52.13% dan 44.13%. Adanya potensi sebagai antioksidan didasarkan pada senyawa-senyawa yang berfungsi sebagai antioksidan alami yang terdapat pada daun sirih merah antara lain flavonoid, saponin, alkaloid, tanin dan steroid. Berdasarkan hasil fitokimia, tiga senyawa falvonoid, tanin dan alkaloid merupakan senyawa yang dominan terdapat pada ekstrak etanol 70%. Ketiga senyawa ini yang dominan ada pada ekstrak etanol 70% diduga sebagai penyebab tingginya aktivitas antioksidan ekstrak etanol 70% dan air dibandingkan ekstrak n-heksana. Kandungan senyawa yang berfungsi sebagai antioksidan pada ekstrak etanol 70% dan ekstrak air relatif sama, namun aktifitas antioksidan ekstrak air lebih tinggi dibandingkan ekstrak etanol 70% diduga karena jumlah senyawa antioksidan pada kedua ekstrak berbeda.
Penentuan Penghambatan (IC50) Ekstrak Etanol 70% dan Ekstrak
n-Heksana Sirih Merah terhadap Enzim Tirosinase
Hasil pengujian penghambatan enzim tirosinase dengan ekstrak etanol 70% dan ekstrak n-heksana, peningkatan konsentrasi berbanding lurus dengan peningkatan nilai penghambatan enzim tirosinase. Ekstrak etanol 70% memiliki nilai penghambatan yang lebih tinggi dibandingkan ekstrak n-heksana, hal ini menunjukkan bahwa ekstrak etanol 70% memiliki aktivitas yang lebih baik terhadap penghambatan enzim tirosinase dibandingkan dengan ekstrak n-heksana. Nilai penghambatan ekstrak etanol 70% konsentrasi 200 ppm (12.78%) dan ekstrak n-heksana konsentrasi 200 ppm (1.23%) lebih rendah dibandingkan dengan asam kojat 200 ppm sebesar (91.82%). Dibandingkan dengan hasil penelitian yang dilakukan (Putri et al. 2010), nilai penghambatan Artocharpus
heterophyllus pada konsentrasi 150 ppm ekstrak metanol Artocharpus
heterophyllus sudah mampu menghambat enzim tirosinase sebesar 125.001%,
sedangkan ekstrak etanol 70% sirih merah pada konsentrasi 1600 ppm baru mampu menghambat enzim tirosinase sebesar 53.027%. Untuk ekstrak n-heksana pada konsentrasi 3200 ppm baru dapat menghambat enzim tirosinase sebesar 54.260%. Hal ini menunjukkan bahwa aktivitas penghambatan enzim tirosinase dari ekstrak sirih merah rendah. Hal ini disebabkan karena adanya perbedaan jenis senyawa bioaktif yang terkandung atau jumlah senyawa bioaktif yang dapat terekstrak oleh masing-masing pelarut.
Ekstrak etanol 70% dan ekstrak n-heksana diuji nilai IC50. Hasil penelitian IC50 enzim tirosinase menunjukkan bahwa ekstrak etanol 70% daun sirih merah memiliki nilai IC50 paling rendah (1655 ppm) dibandingkan dengan nilai IC50 ekstrak n-heksana (>2000 ppm). Hasil ini sama seperti yang dilaporkan Thankam
et al. (2012) bahwa ekstrak curcumin yang memiliki nilai IC50 sebesar 31.25 ppm
15
Senyawa yang diduga memiliki penghambatan terhadap enzim tirosinase adalah senyawa flavonoid, di antaranya kuersetin (golongan flavonol), streppogenin (golongan flavanon), dihidromorin (golongan flavanol), calycosin (golongan isoflavon), 2,4,2,4-tetrahidrokalkon dan likokalkon (golongan kalkon), kloroporin (golongan stilben) (Chang 2009). Golongan senyawa flavonoid yang terdapat pada daun sirih merah yaitu golongan flavonoid flavonol, flavanon, isoflavon dan auron (Arishandy 2010). Senyawa tersebut memiliki kemiripan struktur dengan substrat L-Tirosin dan L-DOPA sehingga mengarah kepada inhibitor kompetitif. Selain itu, minyak atsiri juga memiliki potensi penghambat aktivitas enzim tirosinase. Minyak atsiri yang terkandung dalam daun sirih merah
adalah golongan monoterpen (α-pinen, α-tuyan, sabinen, ß-mirsen, kamfen) dan golongan seskuiterpen (trans-kariofilen) (Ngaisah 2010). Kadar minyak atsiri yang terkandung di dalam daun sirih merah sebesar 0.727% (b/v) (Ngaisah 2010). Senyawa tersebut diharapkan dapat menghambat secara kompetitif aktivitas enzim tirosnase. Senyawa golongan flavonoid tersebut dapat terekstrak dalam pelarut etanol 70%, karena sifat flavonoid yang semi polar sehingga dapat tertarik pada pelarut semi polar (etanol 70%). Senyawa minyak atsiri dapat larut dalam senyawa yang kepolararannya rendah, yaitu n-heksana.
SIMPULAN DAN SARAN
Simpulan
Dari uji fitokimia, ekstrak etanol mengandung alkaloid, flavonoid, steroid, saponin dan tanin sedangkan ekstrak n-heksana mengandung tanin dan saponin. Ekstrak sirih merah berpotensi sebagai antioksidan dan penghambatan tirosinase dengan nilai penghambatan pembentukan MDA sebesar 52.13% dan nilai penghambatan tirosinase dengan IC50 1655 ppm untuk ekstrak etanol, sedangkan untuk ekstrak n-heksana sebesar 40.13% dan tidak berpotensi sebagai penghambat tirosinase. Ekstrak etanol memiliki kemampuan menghambat pembentukan malondialdehida dan enzim tirosinase lebih tinggi dibanding ekstrak n-heksana.
Saran
Perlu dilakukan penelitian lanjutan untuk mengetahui senyawa bioaktif dari daun sirih merah yang berperan sebagai antioksidan dan inhibitor enzim tirosinase. Selain itu, perlu dilakukan analisis potensi penghambat enzim tirosinase daun sirih merah secara in vivo.
DAFTAR PUSTAKA
Agoes G. 2007. Teknologi Bahan Alam. Bandung (ID) : ITB Pr
Alfarabi M. 2010. Kajian antidiabetogenik ekstrak daun sirih merah (Piper
16
Arishandy DNAT. 2010. Isolasi dan identifikasi senyawa flavonoid dari daun sirih merah (Piper betle L. var Rubrum) [skripsi]. Malang (ID) : Universitas Islam Negeri Maulana Malik Ibrahim Malang
[AOAC] The Association of Official Analytical Chemists. 2006. Official Methods of Analysis. Ed ke-18. Washington DC (US): Association of Official Analytical Chemist Publisher.
Batubara I, Darusman LK, Mitsunaga T, Rahminiwati M, Djauhari E. 2010. Potency of indonesia medicinal plants as tyrosinase inhibitor and antioxidant agent. J.Biol.Sci. 10:138-144.
[BPOM RI] Badan Pengawasan Obat dan Makanan Republik Indonesia. 2004.
Ekstrak Tumbuhan Indonsia Vol.2. Jakarta (ID):BPOM.
Chang TS. 2009. An updated review of tyrosinase inhibitor. J Mol Sci. 10:2440-2475.
Dangles O, Fargeix G, Dufour C. 2000. Antioxidant properties of anthocyanins
and tanninsμ a mechanistic investigation with catechin and the 3’,4’,7 -trihydroxyflavylium ion. Journal Royal Society of Chemistry. 2:1653-1663. [Depkes] Departemen Kesehatan Republik Indonesia. 2008. Farmakope Herbal
Indonesia Edisi 1. Jakarta (ID) : Departemen Kesehatan Republik Indonesia.
[Depkes] Departemen Kesehatan RI. 2000. Parameter Standar Umum Ekstrak Tumbuhan Obat. CetakanPertama. Jakarta : Depkes RI. Hal. 10-11
Fitrie AA. 2004. Histologi dari melanosit.e-USU Repository Universitas Sumatera
Utara 5:16.
Fransiska MA. 2012. Penapisan Inhibitor Tirosinase pada Empat Spesies famili Asteraceae Chrysantemum morifolium R, Gerbera jamesonil A, Dahlia rosea Cav dan Tagetes erecta. 1(1) 36-42
Gheldof N, Wang Xiao-Hong, Engeseth NJ. 2002. Identification and quantification of antioxidant components of honeys from various floral sources. Journal of Agriculturaland Food Chemistry. 50 : 5870-5877
Guenther E. 1987. Minyak Atsiri. Jilid 1. Jakarta (ID) : UI Press Hans, W Heldt. 2005. Plant Biochemistry. Elsevier Inc. California.
Harborne. 1987. Metode Fitokimia. Padmawinata K, penerjemah; Bandung (ID) : Penerbit ITB
Hartanti L, Setiawan HK. 2009. Inhibitory potential of some synthetic cinnamic acid derivatives towards tyrosinase enzyme. Indo J Chem. 9:158-168. Hasanah SNR. 2008. Aktivitas ekstrak etil asetat daun dewandaru (Eugenia
unifloria L.) sebagai agen pengkelat logam Fe dan penangkap
malonaldehida (MDA) [skripsi]. Surakarta (ID) : Fakultas Farmasi Universitas Muhammadiyah Surakarta.
Hernani, Rahardjo M. 2005. Tanaman Berkhasiat Antioksidasi. Jakarta (ID) : Penebar Swadaya.
Kang KA, Lee KH, Chae SW, Zhang R, Jung, MS, Lee YK. 2005. Eckol isolated from Ecklonia cava attenuates oxidative stress induced cell damage in lung fibroblast cells. FEBS Lett. 579: 6295-6304.
Kartika Y. 2013. Aktivitas antioksidan campuran ekstrak daun sirih merah dan kulit kayu manis [skripsi]. Bogor (ID) : Institut Pertanian Bogor
Katno, Kusumadewi AP, Sutjipto. 2008. Pengaruh waktu pengeringan terhadap kadar tanin daun jati belanda (Guazoma ulmifolia Lamk.). The Journal of
17
Kikuzaki H, Nakatani K. 1993. Antioxidant effect of some ginger constituents. J
Food Sci. 58: 1407-1410.
Kuswardhani DS. 2007. Mempelajari proses pemekatan karotenoid dari minyak sawit kasar dengan metode fraksinasi bertahap [skripsi]. Bogor (ID) : Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Miyazawa M. 2007. Inhibitory compound of tyrosinase activity from the sprout of
Polygonium hydropiper L.(Benitade). Biology Pharmaceutical Bulletin.
.30: 595-597.
Murray, Robert K, Granner DK, Mayes, PA, Rodwell VW. 2003. Biokimia Harper Edisi 25. Alih Bahasa Andry Hartono. Jakarta : EGC
Ngaisah S. 2010. Identifikasi dan uji aktifitas antibakteri minyak atsiri daun sirih merah (Piper crocatum Ruiz & Pav.) asal magelang [skripsi]. Surakarta (ID) : Universitas Sebelas Maret
Nugroho BW, Dadang, Prijono D. 2000. Pengembangan dan Pengembangan Insektisida Alami. Bogor (ID) : Pusat Kajian Pengendalian Hama Terpadu IPB.
Pranakusumanagara. 1998. Rahasia dibalik sirih merah dan ritual kecantikan mojang parahiangan [internet]. [diunduh 2014 Juni 10]. Tersedia pada : http://www.mojangjajaka. files.wordpress.com
Raharjo S. 2004. Oksidasi Lemak Pada Makanan : Implikasinya Pada Mutu Makanan dan Kesehatan [skripsi]. Yogyakarta (ID) : Universitas Gadjah Mada press.
Rudyanto M, Hartanti L. 2008. Sintesis beberapa turunan asam sinamat: pengaruh gugus yang terikat pada cincin aromatik terhadap kereaktifan benzaldehida. Indo. J. Chem. 8 (2): 226230
Safithri M, Fahma F. 2005. Potensi rebusan daun sirih merah (Piper crocatum) sebagai senyawa antihiperglikemia pada tikus putih galur Sprague Dawley. Laporan penelitian. Bogor: LPPM IPB
Safithri M et al. 2012. Analisis Proksimat dan toksisitas akut ekstrak daun sirih merah yang berpotensi sebagai antidiabetes. J. Gizi dan Pangan. 7(1) 43-48.
Safithri M. 2012. Kajian mekanisme antihiperglikemik campuran ekstrak daun sirih merah dan kulit kayu manis yang berpotensi sebagai minuman fungsional [disertasi]. Bogor (ID) : Institut Pertanian Bogor.
Salim A. 2006. Potensi rebusan daun sirih merah (Piper crocatum) sebagai senyawa antihiperglikemia pada tikus galur sparague-dawley. [skripsi]. Bogor (ID) : Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
18
Sufriadi A. 2006. Manfaat daun kayu manis (Cinnamomum burmanni) terhadap khasiat antioksidasi mahkota dewa (Phaleria macrocarpa (Scheff.) Boerl.) selama penyimpanan. [skripsi]. Bogor (ID) : Program Studi Biokimia FMIPA IPB.
Suharmiati, Maryani. 2003. Daun dewa dan sambung nyawa. Jakarta : Agromedia Pustaka
Supriyanti FMT. 2012. Studi inhibisi metanol kulit batang Artocarpus sp dalam mencegah hiperpigmentasi kulit. Jurnal Pendidikian KimiaFPMIPA UPI Syamsuni HA. 2006. Ilmu Resep. Penerbit Buku Kedokteran EGC, Jakarta.
Hal166-171
Thiele JJ, Ekanayake-Mudiyanselage S. 2007. Vitamin E in human skin: Organ-specific physilology and considerations for its use in dermatology. Mol
Aspects Med. 28: 646-667
Winarno FG. 1997. Kimia Pangan dan gizi. PT. Gramedia : Jakarta. Winarno FG. 1980. Pengantar Teknologi Pangan. Jakarta: Gramedia
Wu JS, Ng LT, Huang YM, Lin DL, Wang SS, Huang S. 2005. Antioxidant activities of Physalis peruviana. Biol. Pharm. Bull. 28(6) : 963-966. Zin MZ, Hamid AA, Osman A. 2002. Antioxidative activity of extracts from
19
20
Lampiran 1 Tahapan umum penelitian
Lampiran 2 Ekstraksi daun sirih merah
Lampiran 3 Pengujian fitokimia
Lampiran 4 Penentuan waktu inkubasi maksimum asam linoleat Daun sirih merah
Ekstraksi daun sirih merah dengan etanol 70% dan n-heksan
Analisis Fitokimia Analisis aktivitas antioksidan metode
TBA
Analisis inhibitor tirosinase
30 gram daun sirih merah ditambahkan etanol 70% untuk ekstraksi etanol dan n-heksan untuk
ekstrak n-heksan sebanyak 300 mL
Dimaserasi 24 jam suhu ruang
Rotavapor 50°C
6 mL asam linoleat dalam etanol 99,8% 6 mL buffer fosfat
3 mL akuades
Campuran dipipet kedalam botol gelap, diinkubasi 40ºC Ekstrak etanol 70% dan n-heksan
21
Lampiran 5 Analisis aktivitas antioksidan dari metode TBA
2 mL buffer fosfat 0,1 M pH 7 20 mL asam linoleat 50 mM
Diinkubasi 8 hari
2 mL TCA 20%
2 mL TBA 1% dalam asam asetat 50%
Diinkubasi 100ºC selama 10 Menit, didinginkan
1 mL diambil setiap 24 jam, ditambahkan 2 mL TCA 20% dan 2 mL TBA 1% dalam asam asetat 50%
Sampel diinkubasi 100°C selama 10 menit kemudian didinginkan
Disentrifus 3000 rpm selama 15 menit
Diukur serapannya pada panjang gelombang 532 nm
1 mL ekstrak etanol dan n-heksan daun sirih merah (25 ppm, 50 ppm, 75 ppm, 100 ppm, 200 ppm), vitamin E 200 ppm dan akuades
Diinkubasi 40ºC
Masing-masing diambil 1 mL
Larutan
Disentrifus 3000 rpm selama 15 menit, diukur panjang gelombang 532
22
Lampiran 6 Kadar air simplisia daun sirih merah
Ulangan BobotCawan
Lampiran 7 Rendemen simplisia daun sirih merah
Jenis sampel Bobot basah (g) Bobot kering (g) %Bobot basah/bobot kering
Daun sirih merah 873.03 187.41 21.47
% rendemen simplisia = Bobot kering (g) x 100 % Bobot basah (g)
= 187.41 x 100% = 21.47 % 873.03
Lampiran 8 Rendemen simplisia ekstrak etanol 70% dan n-heksan sirih merah
Ekstrak ulangan Bobot
Bobot ekstrak (g) %Rendemen ekstrak
Etanol 1 30 27.675 4.80 17.344
Etanol 2 30 27.675 5.06 18.284
n-heksan 1 30 27.675 2.29 8.275
n-heksan 2 30 27.675 0.41 1.482
Bobot terkoreksi = (bobot sampel) – (bobot sampel x kadar air) = 30 – (30 x 7.75%)
Lampiran 9 Grafik hubungan antara konsentrasi inhibitor ekstrak etanol 70% dan ekstrak n-heksana terhadap persen inhibisi
23
Lampiran 10 Fitokimia ekstrak etanol 70% dan n-heksana sirih merah Golongan
senyawa
Hasil ekstrak Keterangan Gambar
Etanol n-heksana 70%
Etanol n-heksana 70%
Flavonoid + - endapan hijau
Alkaloid + - Meyer : putih Dragendroff : merah
Wagner : coklat
Saponin + + Gelembung
Tanin + - Hijau kehitaman
Steroid dan + + Endapan hijau Triterpenoid
Ket : (+) mengandung senyawa; (-) tidak mengandung senyawa
Lampiran 11 Hasil absorban kurva standar 1,1,3,3-tetrametoksipropana (TMP)
[TMP] (µM) A1 A2 Rerata ± SD
0 0 0 0
0.5 0.05 0.044 0.05 ± 0.000
1 0.098 0.083 0.09 ± 0.000
2 0.196 0.177 0.19 ± 0.012
4 0.369 0.343 0.36 ± 0.000
5 0.457 0.394 0.43 ± 0.008
6 0.522 0.498 0.51 ± 0.001
24
Lampiran 12 Kurva standar 1,1,3,3-tetrametoksipropana (TMP)
Lampiran 13 Absorban inkubasi kadar MDA (µM) terhadap waktu ( = 532 nm)
Hari A1 A2 A3 [MDA]1 [MDA]2 [MDA]3 Rerata ± SD
Lampiran 14 Aktivitas antioksidasi ekstrak etanol 70% dan ekstrak n-heksana daun sirih merah metode TBA ( = 532 nm)
Ekstrak Konsentrasi (ppm) [%Inhibisi]1 [%inhibisi]2 Daya hambat (%)
25
Lampiran 15 Analisis perhitungan IC50 difenolase ekstrak etanol 70% dan ekstrak n-heksana daun sirih merah
Ekstrak Konsentrasi A1 A2 Rata-rata % Inhibisi IC50
Absorbansi (ppm)
Etanol 70% K (-) 0.873 0.912 0.892 -
Asam kojat (200) 0.074 0.072 0.073 91.816%a
20 0.830 0.857 0.843 5.493%g
200 0.776 0.781 0.778 12.780%f
800 0.487 0.492 0.489 45.179%e 1655
1600 0.406 0.432 0.419 53.027%d
2400 0.260 0.285 0.272 69.507%c
3200 0.208 0.213 0.210 76.457%b
n-Heksana K (-) 0.873 0.912 0.892 -
Asam kojat (200) 0.074 0.072 0.073 91.816 %a
20 0.923 0.937 0.930 - 4.260 %g
200 0.856 0.906 0.881 1.233 %f
800 0.813 0.860 0.836 6.278 %e 3090.5
1600 0.692 0.761 0.726 18.609%d
2400 0.531 0.540 0.535 40.022%c
3200 0.412 0.404 0.408 54.260%b
Persamaan Garis
y = 0.022 x + 13.59, R2 = 0.910 (ekstrak etanol) y = 0.018 x – 5.630, R2 = 0.918 (ekstrak n-heksana) % Inhibisi =
× 100 %
=
× 100 %
= 91.816%
26
27
RIWAYAT HIDUP
Penulis dilahirkan di Cirebon pada tanggal 26November 1992 dari pasangan Bapak Iwan Gunawan dan Ibu Eli.Penulis merupakan anak pertama dari dua bersaudara.Riwayat pendidikan penulis dimulai dari SD Kartika III/5/6 Cirebon tahun 1998-2004, melanjutkan pendidikan ke SMPN 5 Cirebon tahun 2004-2007, dan menyelesaikan pendidikan menengah atas di SMAN 2 Cirebontahun 2010.Pada tahun yang sama, penulis meneruskan pendidikan di Departemen Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam IPB melalui jalur SNMPTN undangan.
Selama mengikuti perkuliahan, penulis mengikuti organisasi kampus sebagai anggota divisi biro foundrising CREBs (Community of Research and
Education in Biochemistry) tahun 2012-2014.Penulispernah mengikuti berbagai
kepanitiaan seperti Lomba Karya Ilmiah Populer (LKIP) tahun2013, Seminar Kesehatan tahun 2012,Masa Pengenalan Departemen tahun 2013, dan
Biochemistry Champion League tahun 2013. Penulis juga pernah menjadi asisten