UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS ANTIOKSIDAN SERTA
PENENTUAN KANDUNGAN FENOLAT DAN
FLAVONOID TOTAL DARI BUAH PARIJOTO
(Medinilla speciosa Blume)
SKRIPSI
LELIANA NURUL WACHIDAH
NIM. 109102000052
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS ANTIOKSIDAN SERTA
PENENTUAN KANDUNGAN FENOLAT DAN
FLAVONOID TOTAL DARI BUAH PARIJOTO
(Medinilla speciosa Blume)
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
LELIANA NURUL WACHIDAH
NIM. 109102000052
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
Nama : Leliana Nurul Wachidah Program Studi : Farmasi
Judul : Uji Aktivitas Antioksidan Serta Penentuan Kandungan Fenolat dan Flavonoid Total dari Buah Parijoto (Medinilla speciosa
Blume)
Penelitian ini dilakukan untuk mengetahui aktivitas antioksidan serta untuk menentukan kandungan fenolat dan flavonoid total dari ekstrak kasar dan fraksi-fraksi (n-heksan, etil asetat dan metanol) dari buah Medinilla speciosa Blume (Melastomataceae). Aktivitas antioksidan ditentukan dengan metode DPPH (2,2 difenil-1-pikrilhidrazil). Kandugan fenolat dan flavonoid total ditentukan secara spektrofotometri masing-masing menggunakan reagen Folin-Ciocalteu dan AlCl3
yang hasilnya dinyatakan dalam ekuivalen asam galat (mg GAE/g ekstrak) dan ekuivalen rutin (mg RE/g ekstrak). Hasil menunjukkan bahwa fraksi etil asetat memiliki aktivitas antioksidan tertinggi dengan nilai IC50 20,43 μg/mL, diikuti
oleh fraksi metanol, ekstrak kasar dan fraksi n-heksan dengan nilai IC50
masing-masing 46.65, 48.24 dan 292.44 μg/mL, dibandingkan dengan vitamin C sebagai kontrol positif (17.52 μg/mL). Fraksi etil asetat memberikan kandungan fenolat total
tertinggi (580 mg GAE/g ekstrak), diikuti ekstrak kasar, fraksi metanol dan fraksi
n-heksan masing-masing 408, 388 dan 86 mg GAE/g ekstrak. Fraksi etil asetat juga memperlihatkan kandungan flavonoid total tertinggi (184 mg RE/g ekstrak), diikuti fraksi metanol, ekstrak kasar dan fraksi n-heksan masing-masing 164, 156 dan 82 mg RE/g ekstrak. Penemuan ini memperlihatkan bahwa buah M.speciosa
berpotensi memiliki potensi sebagai antioksidan alami.
Name : Leliana Nurul Wachidah Program Study : Pharmacy
Title : Antioxidant Activity and Estimation of Total Phenolic and Total Flavonoid from Medinilla speciosa Blume Fruits
This present study was conduct to investigate the antioxidant activity and determine the total phenolic and flavonoid content of crude extract and fractions (n-hexane, ethyl acetate and methanol) of fruit of Medinilla speciosa Blume (Melastomataceae). Antioxidant activity was carried out by DPPH (2,2-diphenyl-1-picrylhydrazyl)method. Total phenolic and flavonoid content were measured by Folin-Ciocalteu and AlCl3 reagents respectively, which results were expressed in
gallic acid equivalent (mg of GAE/g of extract) and rutin equivalent (mg of RE/g of sample). The result showed that ethyl acetate fraction gave the highest antioxidant activity with IC50 value 20.43 μg/mL, followed by methanol fraction,
crude extract and n-hexane fraction with IC50 value 46.65, 48.24 and 292.44
μg/mL respectively, compared with positive control ascorbic acid (17.52 μg/mL). Ethyl acetate fraction gave the highest amount of total phenolic content with 580 GAE/g of extract followed by crude extract, methanol fraction and n-hexane fraction with 408, 388 and 86 mg GAE/g of extract respectively. Ethyl acetate fraction exhibited the highest amount of total flavonoid content with 184 mg RE/g extract, followed by methanol fraction, crude extract and n-hexane fraction with 164, 156 and 82 mg RE/g extract respectively. These finding showed that fruit of
M.speciosa is potential for the development of an antioxidant agent.
Alhamdulillah, segala puji bagi Allah SWT atas segala nikmat dan
karunia-Nya sehingga saya dapat menyelesaikan penelitian dan penulisan skripsi.
Serta shalawat dan salam untuk baginda Nabi Muhammad SAW yang membawa
petunjuk bagi umat manusia, semoga kelak kita mendapatkan syafaat beliau.
Skripsi dengan judul “Penentuan Kandungan Fenolat dan Flavonoid Total
Serta Uji Aktivitas Antioksidan dari Buah Parijoto (Medinilla speciosa Blume)”
ini disusun untuk memenuhi salah satu syarat untuk memperoleh gelar sarjana
farmasi di Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Saya menyadari bahwa tanpa bantuan dan bimbingan dari berbagai pihak,
dari masa perkuliahan hingga penyusunan skripsi ini terasa sangat sulit bagi
penulis untuk menyelesaikan skripsi ini. Oleh karena itu, penulis mengucapkan
terima kasih kepada :
1. Prof. Dr. H. Chairul, Apt selaku pembimbing pertama dan
Ibu Dr. Azrifitria, M.Si., Apt selaku pembimbing kedua, yang memiliki
andil besar dalam proses penelitian dan penyelesaian skripsi saya ini,
semoga segala bantuan dan bimbingan bapak dan Ibu mendapat imbalan
yang lebih baik di sisi-Nya.
2. Kementrian Agama RI selaku pemberi beasiswa, sehingga penulis dapat
menempuh pendidikan di Program Studi Farmasi Fakultas kedokteran dan
Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3. Dr. Bambang Sunarko selaku Kepala Pusat Penelitian Biologi Lembaga
Ilmu Pengetahuan Indonesia beserta staf atas penggunaan segala fasilitas
dan bantuannya selama penelitian.
4. Prof. Dr. (hc) dr. M.K. Tadjudin, Sp. And. selaku Dekan Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif
Hidayatullah Jakarta.
5. Drs. Umar Mansur, M.Sc., Apt selaku Ketua Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif
Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitar Islam
Negerri Syarif Hidayatullah Jakarta.
7. Bapak H. Sapuan panutan dalam keluarga dan Ibu Hj. Indarti wanita
terhebat dalam hidup ini yang selalu memberikan doa, dukungan serta
nasihat. Serta Kak Khoirul Roziqin dan adik-adikku Anam, Firman, Anis
yang selalu memberikan keceriaan dalam kehidupan ini.
8. Bapak Rubawi dan keluarga yang telah membantu mengumpulkan sampel
buah parijoto (Medinilla speciosa Blume) dari Gunung Muria Kudus.
9. Rekan-rekan CSS MoRA 2009 (Community Santri Scholar of Ministry of
Religious Affair), teman-teman Farmasi 2009, teman-teman “PIM
LOVERS”, terkhusus untuk sahabat-sahabat terbaik Dila, Dhea, Nuyung,
Omi, Fina, Mila, Fitri, Fatimah, Wali, Ziza, Lulu’, Ferry, Emma, Neneng, Ainul, Dyah, Cucut, Nurul, Zaky, Gianti, Hani, Arif, yang selalu
memberikan keceriaan dalam masa perkuliahan hingga penulisan skripsi
ini selesai.
10.Laboran yang telah membantu keseharian penulis selama penelitian di
laboraturium LIPI, Teh Lina dan Teh Ana.
Saya menyadari sepenuhnya bahwa skripsi ini masih banyak kekurangan
dan jauh dari kesempurnaan. Oleh Karena itu, dengan segala kerendahan hati,
saya sangat mengharapkan kritik dan saran yang membangun demi kesempurnaan
skripsi ini.
Saya berharap semoga skripsi ini bermanfaat dan dapat member
sumbangan pengetahuan khususnya di Program Studi Farmasi Fakultas
Kedokteran dan Ilmu kesehatan, Universtas Islam Negeri Syarif Hidayatullah
Jakarta dan pembaca pada umumnya.
Ciputat, 30Juli 2013
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
2.5Senyawa Fenolat dan Flavonoid ... 11
2.6Penapisan Fitokimia ... 15
2.7Metode Ekstraksi ... 18
2.8Spektrofotometer UV-Vis ... 20
BAB 3 METODE PENELITIAN ... 23
3.4.1 Pembuatan Ekstrak Kasar ... 25
3.4.2 Partisi Ekstrak Kasar ... 25
3.4.3 Uji Susut Pengeringan ... 26
3.4.4 Penapisan Fitokimia ... 26
3.4.5 Uji Aktivitas Antioksidan ... 28
BAB 4 HASIL DAN PEMBAHASAN ... 32
4.1Hasil Penelitian ... 32
4.1.1 Hasil Ekstraksi dan Partisi ... 32
4.1.2 Hasil Uji Penapisan Fitokimia ... 32
4.1.3 Hasil Uji Susut Pengeringan ... 33
4.1.4 Hasil Uji Aktivitas Antioksidan ... 33
4.1.4 Hasil Kandungan Fenolat Total ... 36
4.1.5 Hasil Kandungan Flavonoid Total ... 38
4.2Pembahasan ... 40
BAB 5 KESIMPULAN DAN SARAN ... 50
5.1Kesimpulan ... 50
5.2Saran ... 50
Gambar 1. Buah parijoto (Medinilla speciosa Blume) ... 5
Gambar 2. Struktur kimia 1,1-difenil-2-pikrilhidrazil ... 10
Gambar 3. Struktur kimia asam galat ... 13
Gambar 4. Kerangka dasar flavonoid... 13
Gambar 5. Struktur kimia rutin ... 15
Gambar 6. Reaksi uji mayer ... 15
Gambar 7. Reaksi uji dragendorff ... 16
Gambar 8. Mekanisme reaksi pembentukan garam flavilium ... 16
Gambar 9. Reaksi hidrolisis saponin dalam air ... 17
Gambar 10. Skema instrumentasi spektrofotometer UV-VIS ... 21
Gambar 11. Kurva aktivitas antioksidan vitamin C ... 33
Gambar 12. Kurva aktivitas antioksidan ekstrak kasar, fraksi n-heksan, fraksi etil asetat dan fraksi metanol ... 35
Gambar 17. Kandungan flavonoid total ekstrak kasar, fraksi n-heksan, fraksi etil asetat dan fraksi metanol ... 39
Gambar 18. Reaksi DPPH dengan antioksidan ... 43
Gambar 19. Reaksi folin-ciocalteu dengan senyawa fenol ... 46
Gambar 20. Aktivitas antioksidan dari vitamin C ... 64
Gambar 21. Aktivitas antioksidan dari ekstrak kasar ... 64
Gambar 22. Aktivitas antioksidan dari fraksi n-heksan ... 64
Gambar 23. Aktivitas antioksidan dari fraksi etil asetat ... 65
Gambar 24. Aktivitas antioksidan dari fraksi metanol ... 65
Gambar 25. Kandungan senyawa fenolat dari asam galat ... 66
Gambar 26. Kandungan senyawa fenolat dari ekstrak kasar ... 66
Gambar 27. Kandungan senyawa fenolat dari fraksi n-heksan ... 66
Gambar 28. Kandungan Senyawa fenolat dari fraksi etil asetat ... 66
Gambar 29. Kandungan senyawa fenolat dari fraksi metanol ... 66
Gambar 30. Kandungan senyawa flavonoid dari rutin ... 67
Gambar 31. Kandungan senyawa flavonoid dari ekstrak kasar ... 67
Gambar 32. Kandungan senyawa flavonoid dari fraksi n-heksan ... 67
Gambar 33. Kandungan Senyawa flavonoid dari fraksi etil asetat ... 67
Gambar 34. Kandungan Senyawa flavonoid dari fraksi metanol ... 67
Gambar 35. Penapisan fitokimia alkaloid ... 68
Gambar 36. Penapisan fitokimia saponin ... 68
Gambar 37. Penapisan fitokimia flavonoid ... 69
Gambar 38. Penapisan fitokimia tannin ... 69
Gambar 39. Penapisan fitokimia antrakuinon ... 70
Tabel 1. Berat masing-masing fraksi n-heksan, etil asetat dan metanol ... 32 Tabel 2. Hasil uji Penapisan fitokimia ekstrak kasar, fraksi n-heksan, fraksi
etil asetat dan fraksi metanol ... 32 Tabel 3. Hasil uji susut pengeringan ekstrak kasar dan fraksi metanol ... 33 Tabel 4. Aktivitas antioksidan dari vitamin C ... 33 Tabel 5. Aktivitas antioksidan dari ekstrak kasar, fraksi n-heksan, fraksi
etil asetat dan fraksi metanol ... 34 Tabel 6. Nilai absorbansi standar asam galat... 36 Tabel 7. Kandungan fenolat total dari ekstrak kasar, fraksi n-heksan, fraksi
etil asetat dan fraksi metanol ... 37 Tabel 8. Nilai absorbansi standar rutin ... 38 Tabel 9. Kandungan Flavonoid Total dari ekstrak kasar, fraksi n-heksan,
Lampiran 1. Hasil determinasi buah parijoto (Medinilla speciosa Blume) Lampiran 2. Perhitungan persen inhibisi dan IC50
Lampiran 3. Perhitungan kandungan fenolat total Lampiran 4. Perhitungan kadar total flavonoid Lampiran 5. Analisis data
1.1 Latar belakang
Indonesia adalah negara tropis yang memiliki keanekaragaman hayati
terbesar kedua di dunia setelah Brazil (Farida et al., 2012). Kekayaan alam
tumbuhan di Indonesia terdiri atas 30.000 jenis tumbuhan dari total 40.000 jenis
tumbuhan di dunia, dimana 940 jenis diantaranya merupakan tumbuhan berkhasiat
obat (jumlah ini merupakan 90% dari jumlah tumbuhan obat di kawasan Asia)
(Nugroho, 2010).
Tanaman obat digunakan sebagai sumber obat hampir pada semua
kebiasaan di dunia. Selama dekade terakhir, penggunaan obat tradisional telah
berkembang. Hal ini terus dilakukan tidak hanya untuk perawatan kesehatan bagi
masyarakat miskin di negara-negara berkembang tetapi juga di negara-negara di
mana obat konvensional digunakan dalam perawatan kesehatan nasional
(Kamarian et al., 2013). Menurut WHO, obat-obatan herbal melayani kebutuhan
kesehatan sekitar 80% dari populasi dunia, terutama bagi jutaan orang di daerah
pedesaan di negara-negara berkembang (WHO, 2001).
Dewasa ini, dunia kedokteran banyak membahas mengenai radikal bebas
(free radical). Radikal bebas terlibat dalam penyakit degeneratif seperti
patogenesis diabetes, kerusakan hati, inflamasi, kanker, gangguan jantung,
gangguan syaraf dan proses penuaan (Onkar et al., 2012). Oleh sebab itu,
dibutuhkan antioksidan yang dapat membantu melindungi tubuh dari serangan
radikal bebas dan meredam dampak negatifnya (Winarsi, 2011). Antioksidan
merupakan senyawa yang dapat menghambat radikal bebas sehingga dapat
mencegah penyakit yang disebabkan oleh radikal bebas tersebut (Gutteridge,
2000). Sebagian besar antioksidan diproduksi secara sintetik. Beberapa contoh
antioksidan sintetik yang beredar adalah BHA (butylated hydroxyanisole), BHT
(butylated hydroxytoulene) dan TBHQ (tertiary butylated hydroquinone). Akan
tetapi antioksidan sintetik memiliki efek toksik dibandingkan dengan antioksidan
dan TBHQ adalah seperti alergi, asma, radang hidung, sakit kepala, kemerahan,
urtikaria, masalah pada mata dan perut, serta penurunan kesadaran (Race, 2009).
Baru-baru ini terjadi peningkatan pesat dalam pencarian antioksidan alami untuk
menggantikan antioksidan sintetik. Terdapat penelitian bahwa tumbuhan yang
mengandung senyawa metabolit sekunder berupa flavonoid dan fenol berguna
sebagai penangkap radikal bebas, yang memiliki aktivitas sebagai antioksidan
(Nishantini et al., 2012).
Famili Melastomataceae memiliki spesies sekitar 4500 dalam 150-166
genus (Maria et al., 2012). Telah dilaporkan beberapa jenis tumbuhan famili
Melastomataceae yang memiliki aktivitas sebagai antioksidan seperti Melastoma
malabathricum (Faravani, 2009) dan Osbeckia stellata (Suman, 2013). Salah
satu spesies dari famili Melastomataceae adalah Medinilla speciosa Blume.
M. speciosa yang dikenal di Indonesia dengan nama daerah buah parijoto
merupakan salah satu tanaman khas dari Desa Colo Kecamatan Dawe Kabupaten
Kudus Jawa Tengah. M. speciosa tumbuh liar di lereng-lereng gunung atau di
hutan-hutan dan kadang dibudidayakan sebagai tanaman hias (Wibowo dkk.,
2012). Kandungan kimia yang terdapat dalam daun dan buah adalah saponin dan
kardenolin, di samping itu buahnya juga mengandung flavonoid dan daunnya
mengandung tannin (Anonim, 2013). Dalam uji pendahuluan terhadap ekstrak
buah M. speciosa diketahui bahwa M. speciosa memiliki aktivitas penghambatan
terhadap radikal bebas DPPH sebesar 93,43% pada konsentrasi 1000 ppm. Dalam
pencarian literatur tidak ditemukan adanya referensi mengenai senyawa fenolat
dan flavonoid total serta aktivitas antioksidan dari M. speciosa. Hal inilah yang
melatarbelakangi penelitian mengenai uji aktivitas antioksidan serta penentuan
kandungan fenolat dan flavonoid total dari ekstrak Medinilla speciosa Blume serta
1.2 Rumusan masalah
Berdasarkan latar belakang tersebut, maka dibuat rumusan masalah
sebagai berikut :
1. Apakah ekstrak kasar metanol, fraksi non polar, fraksi semi polar dan
fraksi polar dari buah M. speciosa memiliki aktivitas antioksidan?
2. Berapakah kadar fenolat total dari ekstrak kasar metanol, fraksi non polar,
fraksi semi polar dan fraksi polar dari buah M .speciosa?
3. Berapakah kadar flavonoid total dari ekstrak kasar metanol, fraksi non
polar, fraksi semi polar dan fraksi polar dari buah M .speciosa?
1.3 Tujuan Penelitian
Dari rumusan masalah di atas, tujuan penelitian adalah sebagai berikut :
1. Mengetahui aktivitas antioksidan dari ekstrak kasar metanol, fraksi non
polar, fraksi semi polar dan fraksi polar dari buah M. speciosa.
2. Mengetahui kadar fenolat total dari ekstrak kasar metanol, fraksi non
polar, fraksi semi polar dan fraksi polar dari buah M. speciosa.
3. Mengetahui kadar flavonoid total dari ekstrak kasar metanol, fraksi non
polar, fraksi semi polar dan fraksi polar dari buah M. speciosa.
1.4 Manfaat Penelitian
Manfaat yang dapat diambil dari penelitian ini adalah :
1. Menambah khasanah ilmu pengetahuan tentang antioksidan dalam bidang
kesehatan serta referensi bagi penelitian selanjutnya.
2. Memberikan informasi mengenai potensi buah M. speciosa sebagai
2.1 Medinilla speciosa Blume 2.1.1 Taksonomi
Klasifikasi tanaman parijoto adalah sebagai berikut :
Kingdom : Plantae (Tumbuhan)
Subkingdom : Tracheobionta (Tumbuhan berpembuluh)
Super Divisi : Spermatophyta (Menghasilkan biji)
Divisi : Magnoliophyta (Tumbuhan berbunga)
Kelas : Magnoliopsida (berkeping dua / dikotil)
Sub Kelas : Rosidae
Ordo : Myrtales
Famili : Melastomataceae
Genus : Medinilla
Spesies : Medinilla speciosa Blume
(www.plantamor.com)
2.1.2 Pertelaan
Parijoto merupakan tanaman perdu dengan tinggi 1 - 2 m; batang bulat,
kulit dengan lapisan gabus jika tua, bergerigi, kasar, putih kecoklatan; daun
tunggal, bersilang berhadapan, tangkai pendek, bulat, lunak, warna ungu
kemerahan, helaian daun bentuk lonjong, pangkal dan ujung runcing, tepi rata,
panjang 10 - 20 cm, lebar 5 - 15 cm, pertulangan melengkung, permukaan atas
licin, berwarna hijau, permukaan bawah kasar, warna hijau kelabu; bunga
majemuk, di ketiak daun, sempurna, berkelamin ganda, kelopak 5 helai, ujung
runcing, pangkal berlekatan, panjang 3 - 8 mm, warna ungu tua, benang sari 2 kali
lipat jumlah mahkota, kepala sari berupa kuncup membengkok, warna merah
keunguan, kepala putik duduk di atas bakal buah, kepala putik bulat, ungu,
mahkota lepas, 5 helai, bentuk kuku, panjang 5-8 mm, warna merah muda; buah
warna merah keunguan; biji bulat, jumlah banyak, kecil, putih; akar serabut, putih
kotor (Anonim, 2013).
Gambar 1. Buah Parijoto (Medinilla speciosa Blume) [ Sumber : Koleksi Pribadi ]
2.1.3 Tempat Tumbuh
Merupakan tumbuhan liar di lereng-lereng gunung atau di hutan-hutan dan
kadang dibudidayakan sebagai tanaman hias. Tumbuh baik pada tanah yang
berhumus tinggi dan lembab, pada ketinggian 800 m sampai 2.300 m di atas
permukaan laut. Berbunga pada bulan November - Januari dan waktu panen yang
tepat bulan Maret - Mei (Anonim, 2013).
2.1.4 Kandungan Kimia
Daun dan buah parijoto mengandung saponin dan kardenolin, di samping
itu buahnya juga mengandung flavonoid dan daunnya mengandung tanin
(Anonim, 2013).
2.1.5 Khasiat
Secara tradisional buah M. speciosa digunakan sebagai obat sariawan,
antiradang dan antibakteri (Anonim, 2013). Parijoto dipercaya oleh masyarakat di
daerah Gunung Merapi dapat meningkatkan kesuburan janin dan kesehatan ibu
(Anggana, 2011). Sedangkan masyarakat Desa Colo Kabupaten Kudus memiliki
keyakinan jika ibu hamil mengkonsumsi parijoto, kalau anaknya laki-laki maka
2.2 Antioksidan
Antioksidan adalah senyawa yang dapat menunda, menghambat atau
mencegah oksidasi lipid atau molekul lain dengan menghambat inisiasi atau
propagasi dari reaksi rantai oksidatif (Javanmardi et al., 2003). Antioksidan
merupakan senyawa pemberi elektron (electron donor) atau reduktan. Senyawa
ini memiliki berat molekul kecil, tetapi mampu menginaktivasi berkembangnya
reaksi oksidasi, dengan cara mencegah terbentuknya radikal. Antioksidan juga
merupakan senyawa yang dapat menghambat reaksi oksidasi, dengan mengikat
radikal bebas dan molekul yang sangat reaktif. Akibatnya, kerusakan sel akan
dihambat (Winarsi, 2011).
Secara umum, antioksidan dikelompokkan menjadi 2, yaitu antioksidan
enzimatis dan non-enzimatis. Antioksidan enzimatis misalnya enzim superoksida
dismutase (SOD), katalase dan glutation peroksidase. Antioksidan non-enzimatis
dibagi dalam dua kelompok yaitu antioksidan larut lemak, seperti tokoferol,
karotenoid, flavonoid, quinon, dan bilirubin. Antioksidan non enzimatis yang
kedua adalah antioksidan larut air, seperti asam askorbat, asam urat, protein
pengikat logam, dan protein pengikat heme. Antioksidan enzimatis dan
non-enzimatis tersebut bekerja sama memerangi aktivitas senyawa oksidan dalam
tubuh. Terjadinya stres oksidatif dapat dihambat oleh kerja enzim-enzim
antioksidan dalam tubuh dan antioksidan non-enzimatik (Winarsi, 2011).
Berdasarkan mekanisme kerjanya, antioksidan digolongkan menjadi 3
kelompok, yaitu antioksidan primer, sekunder, dan tersier (Winarsi, 2011).
a. Antioksidan primer (Antioksidan Endogenus)
Antioksidan primer meliputi enzim superoksida dismutase (SOD),
katalase, dan glutation peroksidase (GSH-Px). Seuatu senyawa dikatakan sebagai
antioksidan primer apabila dapat memberikan atom hidrogen secara cepat kepada
senyawa radikal, kemudian radikal antioksidan yang terbentuk segera berubah
menjadi senyawa yang lebih stabil. Enzim superoksida dismutase (SOD), katalase,
dan glutation peroksidase menghambat pembentukan radikal bebas, dengan cara
memutus reaksi berantai (polimerisasi), kemudian mengubahnya menjadi produk
b. Antioksidan sekunder (Antioksidan Endogenus)
Antioksidan sekunder atau antioksidan non-enzimatis disebut sistem
pertahanan preventif. Dalam sistem pertahanan ini, terbentuknya senyawa oksigen
reaktif dihambat dengan cara pengkhelatan metal, atau dirusak pembentukannya.
Antioksidan sekunder dapat berupa komponen non-nutrisi dan komponen nutrisi
dari sayuran dan buah-buahan. Senyawa antioksidan non-enzimatis bekerja
dengan cara menangkap radikal bebas (free radical scavenger), kemudian
mencegah reaktivitas amplifikasinya.
c. Antioksidan tersier
Kelompok antioksidan tersier meliputi sistem enzim DNA-repair dan
metionin sulfoksida reduktase. Enzim-enzim ini berfungsi dalam perbaikan
biomolekuler yang rusak akibat reaktivitas radikal bebas. Kerusakan DNA yang
terinduksi senyawa radikal bebas dicirikan oleh rusaknya single dan double
strand, baik gugus non-basa maupun basa (Winarsi, 2011).
2.3 Radikal Bebas
Radikal bebas (free radical) adalah suatu senyawa atau molekul yang
mengandung satu atau lebih elektron tidak berpasangan pada orbital luarnya.
Adanya elektron yang tidak berpasangan menyebabkan senyawa tersebut sangat
reaktif mencari pasangan, dengan cara menyerang dan mengikat elektron molekul
yang berada di sekitarnya. Senyawa radikal bebas juga dapat mengubah suatu
molekul menjadi suatu radikal. Apabila senyawa radikal baru tersebut bertemu
dengan molekul lain, akan terbentuk radikal baru lagi, dan seterusnya sehingga
akan terjadi reaksi berantai (chainreactions) (Winarsi, 2011).
Radikal bebas sangat penting untuk setiap proses biokimia dan merupakan
bagian penting dari proses aerob dan metabolisme (Tiwari, 2001). Selama
berjalannya metabolisme, terjadi pembentukan beberapa oksidan kuat, baik di sel
darah maupun di kebanyakan sel tubuh lainnya (Murray et al., 2009). Radikal
bebas atau yang disebut Reactive Oxygen Species (ROS) yang akan menyerang
molekul lain disekitarnya sehingga menyebabkan reaksi berantai terjadi dan
menghasilkan radikal bebas yang beragam, seperti anion superoksida (O2-) dan
peroksinitrat (ONOO-) (Vimala et al.,2003). Reaksi radikal bebas merupakan
faktor penting dalam perkembangan penyakit kronis seperti kanker, hipertensi,
gagal jantung dan aterosklerosis seperti rematik dan katarak (Ostrowska, et al,
1998).
Secara umum, tahapan reaksi pembentukan radikal bebas mirip dengan
rancidity oxidative (ketengikan oksidatif), yaitu melalui tiga tahapan reaksi
berikut (Winarsi, 2011):
a. Tahap inisiasi, yaitu awal pembentukan radikal bebas. Misalnya :
Fe++ + H2O2 Fe+++ + OH-+ ●OH
R1-H + ●OH R1● + H2O
b. Tahap propagasi, yaitu pemanjangan rantai radikal.
R2-H + R1● R2● + R1-H
R3-H + R2● R3● + R2-H
c. Tahap terminasi, yaitu bereaksinya senyawa radikal dengan radikal lain atau
dengan penangkap radikal, sehingga potensi propagasinya rendah.
R1● + R1● R1-R1
R2● + R1● R2-R1
R2● + R2● R2-R2 dst
Terdapat dua sumber radikal bebas, yaitu sumber endogen yang mana
radikal bebas yang dihasilkan dalam tubuh sebagai racun oleh produk yang dari
fungsi normal dalam tubuh dan sumber eksogen yang mana produksi radikal
bebas disebabkan oleh rangsangan eksternal (Vimala et al., 2003 ).
Sumber endogen berasal dari dalam tubuh sendiri. Di dalam tubuh, radikal
bebas sering dihasilkan selama proses aerobik, seperti metabolisme, reaksi
biokimia dalam sel, detoksifikasi di hati dan pembentukan energi oleh
mitokondria.Radikal bebas diproduksi di mitokondria selama metabolisme aerob
ketika oksigen digunakan untuk mengoksidasi makanan yang kita makan untuk
menghasilkan energi. Radikal bebas dan hidrogen peroksida juga dihasilkan oleh
tubuh sebagai bagian dari sistem kekebalan tubuh untuk menyerang dan
membunuh bakteri yang menyerang. Dengan demikian, tubuh tidak membutuhkan
tidak diinginkan karena mereka dapat membunuh sel-sel dan menyebabkan
kerusakan jaringan (Vimala et al, 2003).
Sedangkan sumber eksogen dimana produksi radikal bebas berasal dari
rangsangan eksternal. Produksi radikal bebas ditingkatkan dengan mengkonsumsi
makanan tinggi lemak, minyak jenuh, daging panggang, produk makanan olahan
dan makanan basi. Gaya hidup stres, merokok dan radiasi juga meningkatkan
produksi radikal bebas. Radikal bebas juga masuk ke dalam tubuh melalui bahan
kimia yang terdapat dalam pewarna, pengawet, dan penguat rasa makanan, serta
pencemaran lingkungan dan pestisida (Vimala et al, 2003).
2.4 Uji Aktivitas Antioksidan
2.4.1 Metode Radical Scavenger dengan DPPH
DPPH merupakan radikal bebas yang stabil pada suhu kamar dan sering
digunakan untuk mengevaluasi aktivitas antioksidan beberapa senyawa atau
ekstrak bahan alam (Blois, 1958). Metode DPPH (2,2-difenil-1-pikril-hidrazil)
merupakan suatu metode yang cepat, sederhana, dan murah untuk mengukur
aktivitas antioksidan. DPPH banyak digunakan untuk menguji kemampuan dan
untuk mengevaluasi aktivitas antioksidan (Prakash et al., 2001). Metode DPPH
merupakan metode yang luas digunakan untuk mengevaluasi kemampuan
membersihakn radikal bebas dari berbagai sampel (Ebrahimzadeh et al., 2008).
Senyawa DPPH berwarna ungu karena adanya delokalisasi elektron pada
atom nitrogen setelah direaksikan dengan senyawa antioksidan menjadi
Difenilpikrilhidrazin yang berwarna kuning. Hal ini mengakibatkan ikatan
rangkap terkonjugasi menjadi lebih panjang sehingga panjang gelombang DPPH
bergeser ke panjang gelombang yang lebih panjang dengan absorbansi kuat pada
λmax 516 nm. DPPH akan tereduksi dan warnanya akan berubah menjadi kuning
setelah bereaksi dengan senyawa antioksidan. Perubahan tersebut dapat diukur
dengan spektrofotometer dan diplotkan sebagai konsentrasi (Reynetson, 2007).
Prinsip metode DPPH didasarkan pada pengurangan DPPH dengan adanya
donor hidrogen dari antioksidan terbentuk difenil pikril hidrazin (Blois, 1958).
% aktivitas penghambatan = �0−�1
�0 �
100 %
Keterangan : A0 merupakan absorban DPPH dan A1 merupakan absorban dari
Gambar 2. Struktur Kimia 1,1-Difenil-2-pikrilhidrazil [ Sumber : Artanti & Muhammad, 2012 ]
2.4.2 Metode Reducing Power
Metode Reducing power merupakan metode yang digunakan untuk
mengukur kekuatan reduksi suatu sampel. Metode ini dilakukan berdasarkan
kemampuan suatu senyawa dalam mereduksi Fe3+ menjadi Fe2+. Antioksidan
dalam sampel akan mereduksi Fe3+ menjadi Fe2+ dengan memberikan sebuah
elektron. Jumlah kompleks Fe2+ dapat diketahui dengan mengukur formasi Perl’s
Prussian blue pada panjang gelombang 700 nm. Meningkatnya absorban pada
700 nm menjadi indikasi meningkatnya kemampuan mereduksi dari antioksidan
(Ebrahimzadeh et al., 2008). Reaksi yang terjadi adalah sebagai berikut :
Fe(CN)63- + A-OH Fe(CN)64- + H+ + A=O
2.4.3 Metode Linoleat-Tiosianat
Dalam metode linoleat-tiosianat, sebagai sumber radikal adalah asam
linoleat yang merupakan asam lemak tidak jenuh. Radikal merupakan senyawa
oksidator. Radikal ini akan mengoksidasi ion fero (dari feroklorida) menjadi ion
feri yang dengan adanya ion tiosianat akan menghasilka kompleks feri-tiosianat
yang berwarna merah dan dapat diukur intensitasnya pada panjang gelombang
490 nm. Reaksi yang terjadi adalah sebagai berikut :
RO●
OH● + Fe2+ Fe3+
R●
Radikal
Fe3+ + 6CNS- Fe(CNS)63-
Merah
2.4.4 Metode Aktivitas Penghambatan Radikal Nitrat Oksida
Oksida nitrat, karena memiliki elektron yang tidak berpasangan, maka
diklasifikasikan sebagai radikal bebas dan menunjukkan reaktivitas yang penting
dengan jenis tertentu dari protein dan radikal bebas lainnya. Penghambatan secara
in vitro dari radikal nitrat oksida juga diukur sebaga aktivitas antioksidan. Metode
ini didasarkan pada inhibisi dari pembentukan radikal nitrat oksida yang
dihasilkan dari natrium nitropusid dalam dapar garam dan diukur dengan pereaksi
Griess. Dengan adanya penghambatan, absorbansi dari kromofor diukur pada
panjang gelombang 546 nm. Aktivitas ini menunjukkan sebagai reduksi dari nitrat
oksida (Shivaprassi et al., 2005).
2.4.5 Metode Aktivitas Penghambatan Radikal Hidroksil
Kapasitas penghambatan radikal hidroksil ekstrak secara langsung
berhubungan dengan aktivitas antioksidan. Metode ini melibatkan pembentukan
secara in-vitro dari radikal menggunakan Fe3+/ askorbat / EDTA / H2O2 dengan
menggunakan reaksi Fenton. Penghambatan radikal hidroksil ini dengan adanya
antioksidan diukur. Dalam salah satu metode radikal hidroksil yang terbentuk
secara oksidasi dibuat untuk bereaksi dengan DMSO (dimethyl sulphoxide) untuk
menghasilkan formaldehid. Formaldehid yang terbentuk menghasilkan warna
kuning yang intens dengan reagen Nash (ammonium asetat 2M dengan asam
asetat 0,05 M dan aseton asetil 0,02 M dalam aquadest). Intensitas warna kuning
yang terbentuk diukur pada 412 nm dengan spektrofotometri terhadap blanko
negatif. Aktivitas ini dinyatakan sebagai % penghambatan radikal hidroksil
(Shivaprassi et al., 2005).
2.5 Senyawa Fenolat dan Flavonoid
Terdapat penelitian bahwa tumbuhan yang mengandung senyawa
metabolit sekunder berupa flavonoid dan fenol berguna sebagai penangkap radikal
bebas, yang memiliki aktivitas sebagai antioksidan (Nishantini et al., 2012).
2.5.1 Senyawa Fenolat
Fenol adalah senyawa dengan gugus OH yang terikat pada cincin aromatik
(Fessenden dan Fessenden, 1986). Fenolat merupakan metabolit sekunder yang
sederhana, antraquinon, asam fenolat, kumarin, flavonoid, lignin dan tanin
(Harborne 1987).
2.5.1.1 Sifat dan Fungsi Senyawa Fenolat
Fenol sederhana berupa zat padat tanpa warna, mudah teroksidasi dan
warnanya berubah jadi gelap. Bersifat asam lemah karena adanya gugus hidroksi
(OH) sekurangnya 1 gugus hidroksi. Kelarutannya dalam air akan bertambah jika
gugus hidroksinya makin banyak, kelarutannya dalam pelarut organik polar cukup
tinggi, mudah larut dalam alkali membentuk senyawa fenolat, tetapi dalam
suasana basa laju oksidasinya sangat kuat. Fungsi fenol sederhana pada
tumbuhan antara lain sebagai transport elektron pada fotosintesis dan pengaturan
enzim tertentu. Selain itu juga berfungsi memacu perkecambahan biji (Robinson,
1995).
2.5.1.2 Fenolat Sebagai Senyawa Antioksidan
Senyawa fenol merupakan kelas utama antioksidan yang berada dalam
tumbuh-tumbuhan. Kandungan senyawa fenolat banyak diketahui sebagai
terminator radikal bebas dan pada umumnya kandungan senyawa fenolat
berkorelasi positif terhadap aktivitas antiradikal (Marinova & Batcharov, 2011).
Polifenol berperan penting dalam stabilisasi oksidasi lipid dan berhubungan
langsung dengan aktivitas antioksidan (Huang et al., 2005).
Salah satu antioksidan alami yaitu asam galat. Asam galat termasuk dalam
senyawa fenolat dan memiliki aktivitas antioksidan yang kuat (Lee et al., 2003).
Struktur asam galat disajikan pada Gambar 3. Estimasi kandungan fenolat total
dapat dilakukan dengan menggunakan pereaksi Folin-Ciocalteu (Lee et al., 2003).
Metode ini berdasarkan kekuatan mereduksi dari gugus hidroksi fenolat. Semua
senyawa fenolat termasuk fenol sederhana dapat bereaksi dengan reagen Folin
Ciocalteu (Huang et al., 2005). Kandungan fenolat total dalam tumbuhan
dinyatakan dalam GAE (gallic acid equivalent) yaitu jumlah kesetaraan miligram
Gambar 3. Struktur Kimia Asam Galat [ Sumber : Lee et al., 2003 ]
2.5.2 Senyawa Flavonoid
Flavonoid tersebar luas di alam, terutama dalam tumbuhan tingkat tinggi
dan jaringan muda. Sekitar 5 – 10% metabolit sekunder tumbuhan adalah
flavonoid. Flavonoid berperan sebagai pigmen bunga dan berperan dalam menarik
serangga untuk membantu penyerbukan. Beberapa kemungkinan fungsi flavonoid
yang lain bagi tumbuhan adalah sebagai zat pengatur tubuh, pengatur proses
fotosintesis, zat antimikroba, antivirus, antiinsektisida, dan antioksidan
(Middleton et al., 1998).
Senyawa flavonoid adalah suatu kelompok senyawa fenol. Istilah
flavonoid diberikan untuk senyawa-senyawa fenol yang berasal dari kata flavon
yaitu salah satu jenis flavonoid yang terbesar jumlahnya dalam tumbuhan (Lenny,
2006). Kerangka dasar flavonoid yaitu 15 atom karbon yang membentuk susunan
C6-C3-C6. Susunan tersebut dapat menghasilkan tiga struktur, yaitu:
1,3-diarilpropan (flavonoid), 1,2-1,3-diarilpropan (isoflavonoid), 1,1-1,3-diarilpropan
(neoflavonoid), seperti pada gambar di bawah ini.
Gambar 4. Kerangka Dasar Flavonoid sebagai Susunan C6-C3-C6
2.5.2.1 Biosintesis Flavonoid
Menurut Markham (1998), tahap-tahap pertama dari biosintesa flavonoid
suatu unit C6-C3 berkombinasi dengan tiga unit C2 menghasilkan unit C6-C3
-(C2+C2+C2). Kerangka C15 yang dihasilkan dari kombinasi ini telah mengandung
gugus-gugus fungsi oksigen pada posisi-posisi yang diperlukan.
Adapun Cincin A, berasal dari jalur poliketida, yakni kondensasi dari tiga
unit asetat atau malonat, sedangkan cincin B dan tiga atom karbon dari rantai
propan berasal dari jalur fenilpropanoid (jalur shikimat).
Selanjutnya, sebagai akibat dari berbagai perubahan yang disebabkan oleh
enzim, ketiga atom karbon dari rantai propan dapat menghasilkan gugus fungsi,
seperti ikatan rangkap, gugus hidroksil, gugus karbonil,dan sebagainya. Dengan
prinsip :
C6-C3 + C2-C2-C2 C6-C3-C6
Jalur Shikimat Jalur Asetat-Malonat
(cincin B) (cincin A)
2.5.2.2 Flavonoid Sebagai Senyawa Antioksidan
Flavonoid mampu menghambat reaksi oksidasi melalui mekanisme
penangkal radikal bebas dengan cara menyumbangkan satu elektron pada elektron
yang tidak berpasangan. Flavonoid merupakan inhibitor yang kuat terhadap
peroksidasi lipid dan juga mampu menghambat aktivitas enzim lipooksigenase
dan siklooksigenase (Rohman & Sugeng, 2005). Pembanding baku yang
digunakan adalah rutin yaitu glikosida flavonol, rutin sendiri sangat umum
ditemukan dalam tumbuhan (Harborne, 1987). Struktur kimia rutin disajikan pada
gambar 5. Kandungan flavonoid total dapat ditentukan secara spektrofometri
dengan reagen AlCl3 dan dinyatakan dalam RE (rutin equivalent) yaitu jumlah
Gambar 5. Struktur Kimia Rutin [ Sumber : Ukieyanna, 2012 ]
2.6 Penapisan Fitokimia
Tujuan utama dari penapisan fitokimia adalah menganalisis tumbuhan
untuk mengetahui kandungan bioaktif yang berguna untuk pengobatan.
Pendekatan secara penapisan fitokimia meliputi analisa kualitatif kandungan
dalam tumbuhan atau bagian tumbuhan (akar, batang, daun, bunga, buah dan biji)
terutama kandungan metabolit sekunder yang merupakan senyawa bioaktif seperti
alkaloid, flavonoid, saponin, tanin, antrakuinon dan glikosida.
a. Alkaloid
Alkaloid adalah senyawa nitrogen (N) yang merupakan hasil metabolit
sekunder pada tumbuh-tumbuhan. Umumnya alkaloid menunjukkan efek
fisiologik yang menarik, sehingga banyak digunakan sebagai obat-obatan (Guevera, 1985).
Hasil positif alkaloid pada uji Mayer ditandai dengan terbentuknya
endapan putih. Diperkirakan endapan tersebut adalah kompleks
kalium-alkaloid. Pada uji alkaloid dengan pereaksi Mayer, diperkirakan nitrogen pada
alkaloid akan bereaksi dengan ion logam K+ dari kalium tetraiodomerkurat
(II) membentuk kompleks kalium-alkaloid yang mengendap. Perkiraan reaksi
yang terjadi pada uji Mayer :
Hasil positif alkaloid pada uji Dragendorff juga ditandai dengan
terbentuknya endapan coklat muda sampai kuning. Endapan tersebut adalah
kalium - alkaloid.
Gambar 7. Reaksi uji Dragendorff [ Sumber : Marliana, 2005 ]
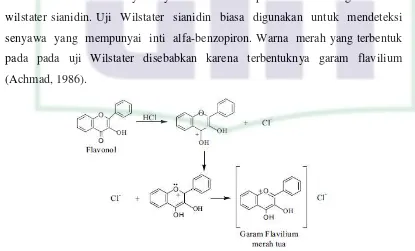
b. Flavonoid
Flavonoid adalah senyawa polifenol yang mengandung C15 terdiri atas
dua inti fenolat yang dihubungkan dengan tiga satuan karbon. Struktur umum
flavonoid juga digambarkan sebagai deretan senyawa C6-C3-C6 (Guevera, 1985).
Pendeteksian adanya senyawa flavonoid dapat dilakukan dengan metode
wilstater sianidin. Uji Wilstater sianidin biasa digunakan untuk mendeteksi
senyawa yang mempunyai inti alfa-benzopiron. Warna merah yang terbentuk
pada pada uji Wilstater disebabkan karena terbentuknya garam flavilium
(Achmad, 1986).
Gambar 8. Mekanisme reaksi pembentukan garam flavilium
[Sumber : Achmad, 1986]
c. Saponin
Saponin adalah senyawa aktif permukaan yang kuat, dapat menimbulkan
busa jika dikocok dengan air dan pada konsentrasi rendah dapat menyebabkan
hemolisis sel darah merah pada tikus. Identifikasi saponin dapat dilakukan dengan
busa yang dapat bertahan lama, setelah penambahan HCl 2N busa tidak hilang.
Timbulnya busa pada uji Forth menunjukkan adanya glikosida yang
mempunyai kemampuan membentuk buih dalam air yang terhidrolisis menjadi
glukosa dan senyawa lainnya (Guevera, 1985). Reaksi pembentukan busa
pada uji saponin ditunjukkan pada gambar berikut :
Gambar 9. Reaksi hidrolisis saponin dalam air [ Sumber : Marliana, 2005 ]
d. Tanin
Istilah “tanin” pertama kalinya digunakan untuk bahan dari tumbuhan yang mempunyai kemampuan untuk menggumpalkan protein hewan pada proses
penyamakan kulit. Saat ini tanin mempunyai nilai penting sebagai sitotoksik,
antikanker dan antitumor. Tanin terdiri dari 2 kelompok berdasarkan hasil
hidrolisanya. Tipe pertama dikenal sebagai pirogalol tanin yaitu,
senyawa-senyawa fenolik yang mempunyai ikatan ester dengan gula. Tipe kedua adalah
tannin terkondensasi yang kadang-kadang disebut katekol tanin dan merupakan
polimer dari senyawa- senyawa fenolik berhubungan dengan pigmen flavonoid. Penambahan suatu asam, kondensasi tanin akan mengalami dekomposisi menjadi
senyawa-senyawa berwarna merah yang tidak larut disebut dengan phlobaphene
atau merah tanin (Guevera, 1985).
Tanin pada ekstrak tumbuh-tumbuhan diidentifikasi dengan uji gelatin
dengan prinsip pengendap protein dari gelatin oleh tanin (Fransworth, 1996). Dan
hasil positif juga diberikan oleh pereaksi ferri klorida (FeCl3), dimana tanin
terhidrolisa memberikan warna biru atau biru-hitam, sedangkan kondensasi tanin
reaksi warna spesifik dengan FeCl3, tetapi tidak memberikan endapan dengan
gelatin.
e. Antrakuinon
Antrakuinon mungkin dijumpai baik dalam bentuk glikosida dengan ikatan
O- atau C-glikosida maupun aglikonnya. Biasanya digunakan sebagai zat warna
dan katartiks (purgatives). Turunan antrakuinon biasanya merupakan senyawa
berwarna merah jingga yang larut dalam air panas dan alkohol encer.
Identifikasinya dilakukan dengan cara uji Borntrager’s, tetapi kadang-kadang uji ini memberikan hasil negatif pada antrakuinon yang sangat stabil atau turunan
antranol, untuk itu identifikasi dilakukan modifikasi uji Borntrager’s. Antrakuinon memberikan warna yang spesifik dengan basa seperti, merah, violet dan hijau.
Secara spektrofotometri antrakuinon memberikan pita resapan yang berbeda
dengan senyawa kuinon lainnya, dimana memberikan 4 atau 5 pita resapannya
pada daerah UV dan sinar tampak. Paling tidak 3 dari pita resapan berkisar antara
215 dan 300 nm, dan lainnya diatas 430 nm (Guevera, 1985).
f. Glikosida
Glikosida merupakan senyawa alami yang terdapat pada berbagai jenis
tumbuh-tumbuhan tinggi dan memberikan pengaruh fisiologis. Senyawa ini
terbentuk dari gugus non-gula (aglikon) dan gugus gula (glikon). Gugus
aglikonnya sangat bervariasi tergantung dari jenis tumbuhan penghasil antara lain,
alkaloida, flavonoida, steroida, triterpenoida dan lain sebagainya (Guevera, 1985). Untuk pemeriksaan atau uji glikosida dapat dilakukan selain berdasarkan
aglikonnya, juga dapat dilakukan terhadap gugus gulanya karena gugus aglikon
yang sangat bervariasi, maka dapat dilakukan terhadap gugus gulanya dengan
pereaksi Keller-Kiliani (Chairul, 2003).
2.7 Metode Ekstraksi
Menurut Ketut Ristiasa dalam Parameter Standar Umum Ekstrak
Tumbuhan Obat (2000) yang dimaksud dengan ekstraksi adalah proses penarikan
kandungan senyawa kimia dari simplisia nabati atau simplisia hewani
diuapkan dengan menggunakan alat yang sesuai. Berikut adalah beberapa cara
ekstraksi dengan menggunakan pelarut.
2.7.1 Cara Dingin a. Maserasi
Maserasi merupakan cara penyarian sederhana. Maserasi dilakukan dengan
cara merendam serbuk simplisisa dalam cairan penyari dengan beberapa kali
pengocokan atau pengadukan pada temperatur ruang (kamar). Cairan penyari akan
menembus dinding sel atau masuk ke dalam rongga sel yang mengandung zat
aktif, zat aktif tersebut akan larut karena adanya perbedaan konsentrasi antara
larutan zat aktif di dalam sel dengan yang di luar sel. Larutan yang lebih pekat (di
dalam sel) didesak keluar sel, masuk ke dalam larutan di luar sel. Peristiwa
tersebut berulang sehingga terjadi keseimbangan konsentrasi antara larutan di luar
sel dan di dalam sel. Keuntungan cara penyarian dengan maserasi adalah cara
pengerjaan dan peralatan yang digunakan sederhana dan mudah diusahakan
(Ristiasa, 2000).
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna (exhaustive extraction) yang umumnya dilakukan pada temperatur
ruangan. Prinsip perkolasi adalah serbuk simplisisa ditempatkan dalam suatu
bejana silinder yang bagian bawahnya diberi sekat berpori. Cairan penyari
dialirkan dari atas ke bawah melalui serbuk tersebut, kemudian melarutkan zat
aktif dari sel-sel yang dilalui sampai mencapai keadaan jenuh (Ristiasa, 2000).
2.7.2 Cara Panas a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan
adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu
pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna
b. Soklet
Sokletasi merupakan ekstraksi menggunakan pelarut yang selalu baru
umumnya dilakukan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah
pelarut relatif konstan dengan adanya pendingin balik (Ristiasa, 2000).
c. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur ruangan, yaitu secara umum
dilakukan pada temperatur 40-500C (Ristiasa, 2000).
d. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air
(bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96-980C)
selama waktu tertentu (15-20 menit). Infus pada umumnya digunakan untuk
menarik atau mengekstraksi zat aktif yang larut dalam air dan bahan-bahan nabati.
Hasil dari ekstrak ini menghasilkan zat aktif yang tidak stabil dan mudah tercemar
oleh kuman dan kapang, sehingga ekstrak yang diperoleh dengan infus tidak boleh
disimpan lebih dari 4 jam (Ristiasa, 2000).
e. Dekok
Dekok adalah infus pada waktu yang lebih lama (> 30 menit) dan
temperatur sampai titik didih air (Ristiasa, 2000).
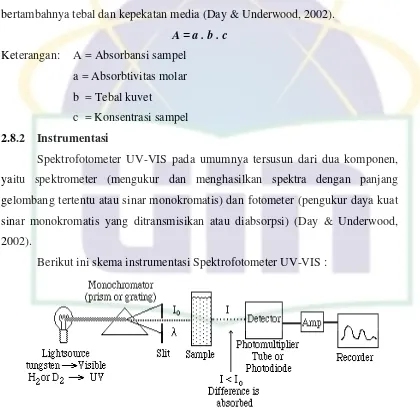
2.8 Spektrofotometer UV-Vis
Spektrofotometer UV-VIS yang terdiri dari dua komponen utama yaitu
spektrometer dan fotometer. Spektrometer menghasilkan spektra panjang
gelombang tertentu, sedangkan fotometer merupakan alat pengukur intensitas
cahaya yang ditransmisikan atau diabsorpsi. Spektrofotometer UV-VIS digunakan
untuk mengukur energi secara relatif bila energi tersebut ditransmisikan,
direfleksikan, atau diemisikan sebagai fungsi dari panjang gelombang. Sedangkan
spektrofotometri adalah suatu metode yang didasarkan pada pengukuran energi
cahaya tampak (visibel) atau cahaya untraviolet (UV) oleh suatu senyawa sebagai
2.8.1 Prinsip Dasar
Hukum yang mendasari spektrofotometri adalah hukum „Lambert-Beer’. Bila sebagian cahaya monokromatis melalui suatu media yang transparan maka
akan bertambah turunnya intensitas cahaya yang dipancarkan sebanding dengan
bertambahnya tebal dan kepekatan media (Day & Underwood, 2002).
A = a . b . c
Keterangan: A = Absorbansi sampel
a = Absorbtivitas molar
b = Tebal kuvet
c = Konsentrasi sampel
2.8.2 Instrumentasi
Spektrofotometer UV-VIS pada umumnya tersusun dari dua komponen,
yaitu spektrometer (mengukur dan menghasilkan spektra dengan panjang
gelombang tertentu atau sinar monokromatis) dan fotometer (pengukur daya kuat
sinar monokromatis yang ditransmisikan atau diabsorpsi) (Day & Underwood,
2002).
Berikut ini skema instrumentasi Spektrofotometer UV-VIS :
Gambar 10. Skema Instrumentasi Spektrofotometer UV-VIS
[ Sumber : Day & Underwood, 2002 ]
a. Sumber Cahaya
Sumber cahaya mempunyai fungsi untuk memberikan energi pada daerah
panjang gelombang yang tepat untuk pengukuran dan mempertahankan intensitas
cahaya yang tetap selama pengukuran. Spektrofotometer sinar tampak
spektrofotometer UV menggunakan lampu deuterium (D2) memiliki dibawah
375 nm. Sumber cahaya pada spektrofotometer dibagi menjadi tiga bagian :
Sumber cahaya visibel dengan lampu Wolfram atau lampu Tungsten
Sumber cahaya UV dengan lampu deuterium (D2) atau lampu hidrogen
Sumber cahaya inframerah dengan lampu Nernst atau lampu Glowen (Day &
Underwood, 2002).
b. Monokromator
Monokromator adalah suatu alat yang berfungsi untuk mengubah cahaya
polikromatik menjadi cahaya monokromatik yang kemudian dilewatkan pada
celah sempit atau slit agar memungkinkan pemisahan panjang gelombang yang
diukur. Beberapa monokromator yang biasa digunakan adalah prisma dan grating
(Willard et al., 1988).
c. Kuvet
Kuvet adalah tempat disimpannya larutan contoh yang akan diukur
serapannya yang diletakkan pada jalan cahaya dari minokromator. Pada saat
cahaya monokromatis melalui kuvet, terjadi penyerapan sejumlah tertentu cahaya,
sedangkan sebagian lainnya diteruskan ke detektor (Day & Underwood, 2002).
Kuvet visibel dan UV yang khas mempunyai panjang lintasan 1 cm, ada juga yang
mempunyai ketebalan 0,1 cm sampai 10 cm atau bahkan lebih (Willard et al.,
1988).
d. Detektor
Detektor berfungsi untuk mengubah energi cahaya yang ditransmisikan
atau diteruskan oleh kuvet, yang jatuh mengenainya menjadi suatu besaran yang
terukur. Detektor yang ideal harus mempunyai kepekaan tinggi, dan responnya
stabil pada daerah panjang gelombang pengamatan (Day & Underwood, 2002).
e. Rekorder
Rekorder merupakan bagian akhir dalam alat ini. Sinyal listrik yang
dihasilkan pada detektor dapat dibaca pada rekorder dengan mengkonversikannya
3.1 Alur Penelitian
Analsisi Data
Kandungan fenolat total dinyatakan dalam
ekuivalen asam galat (mg GAE/g ekstrak)
Kandungan flavonoid total dinyatakan dalam
ekuivalen rutin (mg RE/g ekstrak)
IC50
Penentuan kandungan fenolat total Penentuan kandungan flavonoid total Uji Aktivitas Antioksidan Maserasi dengan metanol
+ 100ml MeOH 50 %
Ekstraksi dg n-heksan 100 ml hingga fase n-heksan jernih
Ekstraksi dg etil asetat 100 ml hingga fase etil asetat jernih Buah Segar
Ekstrak kasar Ampas
Fraksi n-Heksan Fraksi Metanol-air
Fraksi Etil Asetat Fraksi Metanol
Buah dicuci dengan air mengalir Buah diblender
Buah ditimbang
3.2 Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Februari hingga Juni 2013 di
Laboratorium Produk Alam, Bidang Botani, Pusat Penelitian Biologi, Lembaga
Ilmu Pengetahuan Indonesia (LIPI) yang berada di Jalan Raya Jakarta – Bogor Km 46, Cibinong.
3.3 Bahan dan Alat 3.3.1 Bahan Uji
Bahan uji yang digunakan adalah buah parijoto (Medinilla speciosa
Blume) dengan spesifikasi warna merah muda keunguan dan rasa asam sepat yang
berasal dari Desa Japan Kecamatan Dawe Kabupaten Kudus, Jawa Tengah yng
diambil pada bulan Januari. Bahan sebelumnya telah dideterminasi di Herbarium
Bogoriense, Pusat Penelitian Biologi LIPI, Bogor, Jawa Barat.
3.3.2 Bahan Kimia
Adapun bahan kimia yang digunakan meliputi: DPPH
(2,2-difenil-1-pikril-hidrazil) (SIGMA), NaNO2 5%, AlCl3 10%, NaOH 1M, Asam Galat, Na2CO3
20%, pereaksi Folin-Ciocalteu (MERCK), Vitamin C (Phytotechnology
Laboratoreis), Rutin (Nakarai Chemicals LTD), Asam galat, pereaksi dragendorff,
pereaksi Mayer, HCl pekat, HCl 2N, H2SO4 pekat, H2SO4 1M, Magnesium, NaCl
(10%), FeCl3 (1%), amoniak (25%), aquades, n-heksan teknis, etil asetat teknis,
metanol teknis dan metanol pro analisis.
3.3.3 Alat
Alat-alat yang digunakan yaitu peralatan gelas standar, mikropipet
Eppendorf Reference 200 µL,mikropipet Socorex Swiss 1000 µL,neraca analitik
And GR-300, rotary evaporator Eyela N-1000,spatula,spektrofotometer UV-Vis
Shimadzu UV Mini 1240, ultrasonic cleaner WT-600-40, vial, dan waterbath
3.4 Cara Kerja 3.4.1 Penyiapan Bahan
Buah Medinilla speciosa Blume yang digunakan pada penelitian ini
dikumpulkan pada bulan Januari 2013 dari Gunung Muria Desa Colo Kecamatan
Dawe Kabupaten Kudus. Selanjutnya dilakukan sortasi untuk dipisahkan dari
kotoran-kotoran atau bahan-bahan asing sehingga dapat mengurangi jumlah
pengotor yang ikut terbawa dalam bahan uji kemudian dicuci dengan air mengalir
lalu diangin-anginkan hingga tidak terdapat sisa air.
Buah segar kemudian dihaluskan dengan blender. Setelah diblender
didapatkan buah segar sebanyak 1390 gram yang selanjutnya dilakukan ekstraksi.
3.4.2 Pembuatan Ekstrak Kasar
Buah segar Medinilla speciosa sebanyak 1390 gram yang telah dihaluskan
dimaserasi dengan metanol selama 24 jam. Maserat diuapkan menggunakan
rotary evaporator dengan suhu 450C. Maserasi dilakukan hingga maserat yang
diperoleh jernih. Total metanol yang digunakan untuk ekstraksi sebanyak 5000
mL Ekstrak yang diperoleh merupakan ekstrak kasar (crude extract).
3.4.3 Partisi Ekstrak Kasar
Ekstrak kasar ditimbang sebanyak 57,99 gam lalu dilarutkan kembali
dengan 100 mL metanol 50%, kemudian dimasukkan ke dalam corong pisah,
ditambah 100 mL n-heksan, dikocok beberapa saat lalu didiamkan hingga
terpisah, fase n-heksan di bagian atas dan fase metanol di bagian bawah. Partisi
dilakukan berkali-kali hingga fase n-heksan tidak berwarna. Total n-heksan yang
digunakan sebanyak 800 mL. Fase n-heksan dikumpulkan dan dipekatkan dengan
rotary evaporator tanpa menggunakan pemanasan hingga diperoleh ekstrak fraksi
n-heksan.
Fase metanol dipartisi kembali dengan etil asetat (perbandingan volume
1:1) dalam corong pisah. Partisi dilakukan berkali-kali hingga fase etil asetat tidak
berwarna lagi. Total etil asetat yang digunakan sebanyak 1500 mL. Fase etil
asetat dikumpulkan, dipekatkan dengan rotary evaporator dengan suhu 400C
Fase metanol yang telah dipisahkan dari etil asetat dipekatkan dengan
rotary evaporator suhu 500C. Ekstrak yang diperoleh lalu ditimbang.
3.4.4 Uji Susut Pengeringan
Parameter susut pengeringan dilakukan terhadap ekstrak kasar dan fraksi
metanol. Masing-masing ekstrak ditimbang sebanyak 1 gram ke dalam cawan
yang telah dipanaskan pada oven suhu 1050C selama 30 menit dan telah ditara.
Kemudian dimasukkan ke dalam oven dan dikeringkan pada suhu 1050C selama
30 menit atau hingga bobot tetap.
3.4.5 Penapisan Fitokimia
Penapisan fitokimia dilakukan terhadap ekstrak kasar, fraksi n-heksan,
fraksi etil asetat dan fraksi metanol. Uji penapisan fitokimia yang dilakukan
meliputi uji alkaloid, flavonoid, saponin, tannin, antrakuinon, dan glikosida.
Prosedur masing-masing pengujian adalah sebagai berikut (Guevara, 1985) :
1. Identifikasi Alkaloid
Ekstrak kasar, fraksi n-heksan, fraksi etil asetat dan fraksi metanol
masing-masing ditimbang sebanyak 10 mg, lalu ditambahkan 10 mL kloroform diaduk
rata. Campuran disaring kedalam tabung reaksi. Kemudian ditambahkan 0.5 mL
H2SO4 1 M dan dikocok baik-baik, dibiarkan beberapa saat. Lapisan atas yang
jernih dipipet kedalam 2 tabung reaksi kecil. Salah satunya diberikan pereaksi
Dragendorff dan tabung lainnya pereaksi Mayer 2-3 tetes. Reaksi positif apabila
menunjukkan endapan kuning jingga (orange) dengan pereaksi Dragendorff dan
endapan putih dengan pereaksi Mayer.
2. Identifikasi Flavonoid
Metode Wilstatter Cyanidin
Ekstrak kasar, fraksi n-heksan, fraksi etil asetat dan fraksi metanol
masing-masing ditimbang sebanyak 10 mg, ditambahkan 20 mL etanol dan dipipet 10 mL
larutan ke dalam tabung reaksi lain. Campuran ditambahkan 0,5 mL HCl pekat,
3-4 butir magnesium dan ditambahkan 1 mL amil alkohol. Kocok kuat-kuat dan
lapisan pelarut. Apabila terjadi pembentukan atau perubahan warna menunjukkan
reaksi positif terhadap flavonoid dan sianidin.
3. Identifikasi Saponin
Uji Forth
Ekstrak kasar, fraksi n-heksan, fraksi etil asetat dan fraksi metanol
masing-masing ditimbang sebanyak 10 mg, lalu ditambahkan 10 mL air panas.
Selanjutnya dikocok kuat selama 10 detik, akan terbentuk buih yang mantap
setinggi 1-10 cm selama 10 menit. Kemudian ditambahkan 1 tetes HCl 2N dan
diamati.
4. Identifikasi Tannin
Metode Feri Klorida
Ekstrak kasar, fraksi n-heksan, fraksi etil asetat dan fraksi metanol
masing-masing ditimbang sebanyak 10 mg, kemudian ditambahkan 20 mL air panas dan 5
tetes larutan NaCl 10%. Campuran dibagi menjadi 2 tabung reaksi, salah satunya
sebagai kontrol negatif dan yang lainnya ditambahkan larutan FeCl3 1% sebanyak
3 tetes. Perubahan warna diamati, dimana tannin terhidrolisa memberikan warna
biru atau biru-hitam, sedangkan kondensasi tannin menberikan warna biru-hijau
dan dibandingkan dengan kontrol.
5. Identifikasi Glikosida
Metode Keller-Kiliani
Ekstrak kasar, fraksi n-heksan, fraksi etil asetat dan fraksi metanol
masing-masing ditimbang sebanyak 10 mg lalu ditambah 3 mL pereaksi FeCl3 kemudian
diaduk dan pindahkan campuran kedalam tabung reaksi. Diteteskan 1 mL larutan
asam sulfat pekat melalui dinding tabung reaksi. Biarkan campuran beberapa lama
sehingga terbentuk warna dari merah kecoklatan, yang mungkin berubah menjadi
biru atau lembayung. Perubahan tersebut menunjukkan reaksi positif terhadap
6. Identifikasi Antrakuinon
Metode Borntrager’s
Ekstrak kasar, fraksi n-heksan, fraksi etil asetat dan fraksi metanol
masing-masing ditimbang sebanyak 10 mg, lalu ditambahkan 5 mL benzen. Campuran
dibagi menjadi 2 tabung reaksi, salah satunya sebagain kontrol negatif dan yang
lainnya ditambahkan 5 mL amoniak 25%. Apabila terjadi warna merah muda pada
lapisan larutan amonia menunjukkan positif adanya senyawa antrakuinon.
3.4.6 Uji aktivitas antioksidan
Uji aktivitas antioksidan dilakukan dengan metode penangkal radikal
bebas (DPPH) (Conforti et al., 2008).
1. Pembuatan larutan uji
Ekstrak kasar, fraksi n-heksan, fraksi etil asetat dan fraksi metanol
masing-masing ditimbang sebanyak 5 mg kemudian dilarutkan dengan metanol hingga 5,0
mL (ditambahkan beberapa tetes DMSO jika sampel kurang larut dalam metanol).
Dilakukan pengenceran dari masing-masing larutan ekstrak konsentrasi 1.000
µg/mL menjadi larutan dengan konsentrasi 20, 30, 40, 50, dan 60 µg/mL.
2. Pembuatan larutan vitamin C sebagai kontrol positif
Ditimbang 5 mg vitamin C kemudian dilarutkan dengan metanol hingga
5,0 mL (Konsentrasi larutan 1.000 µg/mL). Dilakukan pengenceran dari larutan
vitamin C konsentrasi 1.000 µg/mL menjadi larutan dengan konsentrasi 5, 10, 15,
20, 25 dan 30 µg/mL.
3. Pembuatan larutan DPPH (0,5 mM)
Ditimbang 9,8 mg serbuk DPPH kemudian dilarutkan dengan metanol
hingga 50 mL.
4. Pengujian aktivitas antioksidan
Masing-masing larutan uji dipipet sebanyak 1,0 mL kemudian
ditambahkan 1,0 mL larutan DPPH 0,5 mM dan ditambahkan metanol sebanyak
3 mL, didiamkan selama 30 menit (untuk kontrol negatif larutan sampel diganti
Serapan masing-masing larutan diukur dengan spektrofotometer pada panjang
gelombang 516 nm. Percobaan dilakukan tiga kali ulangan (Conforti et al., 2008).
Aktivitas antioksidan dinyatakan dalam % Inhibisi yang ditentukan
melalui persamaan :
% Inhibisi = Absorbansi Kontro l−Absorbansi Sampel
Absorbansi Kontrol x 100
5. Dihitung IC50
IC50 adalah konsentrasi yang dibutuhkan untuk mereduksi DPPH sebesar
50 %. IC50 dihitung dengan menggunakan persamaan regresi linear, konsentrasi
sampel sebagai sumbu x dan % inhibisi sebagai sumbu y.
Dari persamaan y = a + bx dapat dihitung nilai IC50 dengan menggunakan
rumus:
y = a + bx
50 = a + bx
(x) IC50 = 50−a
b
3.4.7 Penentuan Kandungan Fenolat dan Flavonoid Total
Penentuan kandungan fenolat total berdasarkan metode yang
dikembangkan oleh Orak et al. (2006) dan penetapan kandungan flavonoid total
berdasarkan metode yang dikembangkan oleh Zou et al. (2004).
3.4.6.1Penentuan Kandungan Fenolat Total
1. Pembuatan larutan uji
Ekstrak kasar, fraksi n-heksan, fraksi etil asetat dan fraksi metanol
masing-masing ditimbang sebanyak 5 mg kemudian larutkan masing-masing-masing-masing dengan
metanol:aquades (1:1) hingga 5,0 mL (konsentrasi larutan 1.000 µg/mL).
Dipepipet sebanyak 500 µL larutan uji kemudian metanol:aquades (1:1) hingga
5,0 mL (konsentrasi larutan 100 µg/mL).
2. Pembuatan larutan asam galat sebagai standar
Ditimbang 5 mg asam galat kemudian larutkan dengan metanol:aquades
500, 625, 750, 875, dan 1000 µL ke dalam labu ukur dan ditambah
metanol:aquades (1:1) hingga 5,0 mL dan didapatkan konsentrasi sampel 25, 50,
75, 100, 125, 150, 175, dan 200 µg/mL.
3. Pembuatan Larutan Na2CO3 20%
Ditimbang sebanyak 20 gram Na2CO3, lalu dilarutkan dengan aquades
hingga 100 mL.
4. Penentuan Kandungan Fenolat Total
Dipipet larutan uji dan standar sebanyak 0,1 mL ke dalam vial,
ditambahkan 7,9 mL aquades dan 0,5 mL pereaksi Folin-Ciocalteu, kemudian
didiamkan 8 menit sambil dikocok. Ditambahkan 1,5 mL larutan Na2CO3 20%,
lalu didiamkan selama 2 jam. Absorbansinya diukur pada panjang gelombang
765 nm. Percobaan dilakukan tiga kali ulangan (Orak et al. 2006).
3.4.6.2Penentuan Kandungan Flavonoid Total
1. Pembuatan Larutan Uji
Ekstrak kasar, fraksi n-heksan, fraksi etil asetat dan fraksi metanol
masing-masing ditimbang sebanyak 5 mg kemudian dilarutkan dengan metanol hingga 5,0
mL (Konsentrasi larutan 1.000 µg/mL). Dipipet sebanyak 500 µL larutan uji
kemudian metanol hingga 5,0 mL (konsentrasi larutan 100 µg/mL)
2. Pembuatan Larutan Standar
Ditimbang 5 mg rutin kemudian dilarutkan dengan metanol hingga 5,0 mL
(Konsentrasi larutan 1.000 µg/mL). Dipipet 50, 100, 150, 200, 250, 300, 350, 400,
450, dan 500 µL ke dalam labu ukur dan ditambah metanol hingga 5,0 mL dan
didapatkan konsentrasi sampel 10, 20, 30, 40, 50, 60, 70, 80, 90, dan 100 µg/mL.
3. Pembuatan Larutan NaNO2 5%
Ditimbang sebanyak 1,25 gram NaNO2, lalu dilarutkan dengan aquadest
hingga 25 mL.
4. Pembuatan Larutan AlCl3 10%
5. Pembuatan Larutan NaOH 1 M
Ditimbang 4 g NaOH , lalu dilarutkan dengan aquadest hingga 100 mL.
6. Penentuan Kandungan Flavonoid Total
Dimasukkan 1 mL larutan sampel ke dalam vial yang sebelumnya sudah
ditambahkan 4 mL aquades, dan 0,3 mL larutan NaNO2 5%, dibiarkan selama 5
menit. Larutan ditambah dengan 0,3 mL AlCl3 10% dan dibiarkan selama 6 menit,
setelah itu tambah 2 mL NaOH 1 M, segera ditambah 2,4 mL aquades, dikocok.
Absorbansinya diukur pada panjang gelombang 510 nm. Percobaan dilakukan tiga
kali ulangan (Zou et al. 2004).
3.4.8 Analisis Data
Data yang diperoleh dianalisis dengan uji-t untuk melihat hubungan
antara kandungan fenolat dan flavonoid total terhadap aktivitas antioksidan dari
ekstrak kasar metanol, fraksi n-heksan, fraksi etil asetat dan fraksi metanol dari
4.1 Hasil Penelitian
4.1.1 Hasil Ekstraksi dan Partisi
Buah parijoto sebanyak 1390 gram diekstraksi dengan 5 liter metanol
didapatkan ekstrak kasar sebanyak 64,00 gram dengan rendemen 4,60%.
Sebanyak 57,99 gram ekstrak kasar dipartisi menggunakan n-heksan, etil asetat
dan metanol dan didapatkan ekstrak masing-masing sebagai berikut :
Tabel 1. Berat masing-masing fraksi n-heksan, etil asetat dan metanol
No. Fraksi Berat (gram) Randemen (%)*
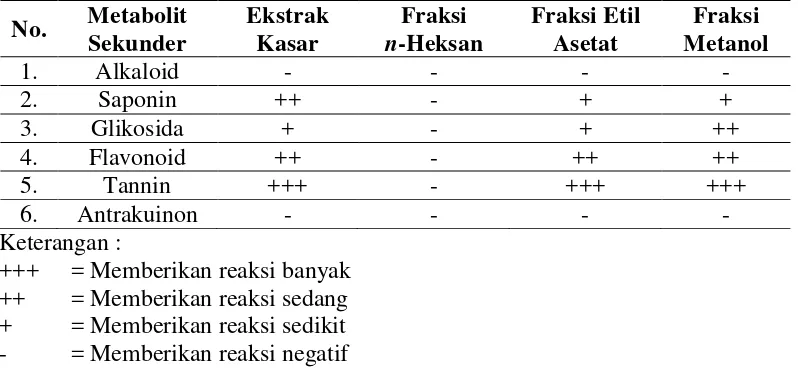
4.1.2 Hasil Uji Penapisan Fitokimia
Masing-masing ekstrak kasar, fraksi n-heksan, fraksi etil asetat dan fraksi
metanol yang telah diperoleh dilanjutkan penapisan fitokimia (Tabel 2).
Tabel 2. Hasil uji penapisan fitokimia ekstrak kasar, fraksi n-heksan, fraksi etil

![Gambar 1. Buah Parijoto (Medinilla speciosa Blume) [ Sumber : Koleksi Pribadi ]](https://thumb-ap.123doks.com/thumbv2/123dok/1111535.759413/20.595.115.536.86.478/gambar-parijoto-medinilla-speciosa-blume-sumber-koleksi-pribadi.webp)

![Gambar 3. Struktur Kimia Asam Galat [ Sumber : Lee et al., 2003 ]](https://thumb-ap.123doks.com/thumbv2/123dok/1111535.759413/28.595.123.534.68.277/gambar-struktur-kimia-asam-galat-sumber-lee-et.webp)

![Gambar 6. Reaksi Uji Mayer [ Sumber : Marliana, 2005 ]](https://thumb-ap.123doks.com/thumbv2/123dok/1111535.759413/30.595.120.533.68.293/gambar-reaksi-uji-mayer-sumber-marliana.webp)
![Gambar 9. Reaksi hidrolisis saponin dalam air [ Sumber : Marliana, 2005 ]](https://thumb-ap.123doks.com/thumbv2/123dok/1111535.759413/32.595.116.537.97.433/gambar-reaksi-hidrolisis-saponin-air-sumber-marliana.webp)