STUDI METABOLOMIK RIMPANG TEMULAWAK
DARI BERBAGAI DAERAH MENGGUNAKAN
KROMATOGRAFI GAS-SPEKTROMETRI MASSA
AENI ANGGRAINI PRALUPI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
AENI ANGGRAINI PRALUPI. Studi Metabolomik Rimpang Temulawak dari
Berbagai daerah Menggunakan Kromatografi Gas-Spektometri Massa. Dibimbing
oleh RUDI HERYANTO dan LATIFAH K DARUSMAN.
Temulawak (
Curcuma xanthorriza
) merupakan tanaman obat yang
mempunyai aktivitas sebagai antioksidan, antirematik, antihepatotoksik,
antibakteri, dan antiinflamasi. Tujuan penelitian ini adalah membuat profil
metabolit rimpang temulawak dengan kromatografi gas-spektrometri massa dan
melakukan diferensiasi rimpang temulawak yang berasal dari 5 daerah yang
berbeda menggunakan metode analisis komponen utama (PCA), serta
menjelaskan mutu rimpang temulawak berdasarkan sifat bioaktivitasnya
(toksisitas). Hasil penelitian menunjukkan bahwa keragaman senyawa metabolit
rimpang temulawak dari Bogor, Karanganyar, Sukabumi, Sragen, dan Wonogiri
berturut-turut mempunyai komposisi sebanyak 70, 70, 57, 66, dan 68 senyawa
dengan 4 komponen dominan yang sama, yaitu
α
-
kurkumena, α
-sedrena,
xantorizol, dan germakron. Analisis PCA menggunakan 2 komponen utama, yaitu
PC 1 = 60% dan PC 2 = 30%. Ekstrak rimpang temulawak yang berasal dari
daerah Bogor, Karanganyar, dan Sragen mempunyai tingkat toksisitas yang lebih
tinggi
sehingga mutu rimpang temulawak lebih baik daripada ekstrak dari daerah
Wonogiri dan Sukabumi.
ABSTRACT
AENI ANGGRAINI PRALUPI. Metabolomic Study of Temulawak Rhizome
from Different Origins Based on Gas Chromatography-Mass Spectrometry.
Supervised by RUDI HERYANTO and LATIFAH K DARUSMAN.
Skripsi
STUDI METABOLOMIK RIMPANG TEMULAWAK DARI
BERBAGAI DAERAH MENGGUNAKAN
KROMATOGRAFI GAS-SPEKTROMETRI MASSA
AENI ANGGRAINI PRALUPI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Disetujui
Pembimbing I,
Pembimbing II,
Rudi Heryanto, S.Si, M.Si.
NIP
19760428 200501 1 002
Prof. Dr. Ir. Latifah K. Darusman, MS
NIP 19530824 197603 2 003
Diketahui
Ketua Departemen Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor,
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
Tanggal Lulus:
Judul
: Studi Metabolomik Rimpang Temulawak dari Berbagai Daerah
Menggunakan Kromatografi Gas-Spektrometri Massa
Nama
: Aeni Anggraini Pralupi
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
karunia-Nya sehingga Karya ilmiah ini dapat diselesaikan. Skripsi ini disusun berdasarkan
hasil penelitian dengan judul Studi Metabolomik Rimpang Temulawak dari
Berbagai Daerah Menggunakan Kromatografi Gas-Spektrometri Massa yang
dilaksanakan mulai bulan Maret sampai dengan September 2012 di Laboraturium
Kimia Analitik, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Bapak Rudi Heryanto, S.Si, M.Si dan
Ibu Prof. Dr. Ir. Latifah K. Darusman, MS. selaku pembimbing yang telah
memberikan bimbingan, saran, arahan, dan ilmu selama penelitan dan penyusunan
karya ilmiah ini. Terima kasih kepada tim peneliti metabolomik (Ambarsari
et al.
2012) yang telah mengikutsertakan penulis dalam tema penelitian metabolomik.
Ungkapan terima kasih sebesar-besarnya penulis sampaikan kepada kedua orang
tua (Supranoto dan Rohanah), adik (Apriliaana Putri), dan Keluarga besar atas doa
yang telah diberikan dan menjadi motivasi penulis. Selain itu penulis
mengucapkan terima kasih kepada seluruh staf dan laboran Kimia Analitik atas
fasilitas dan bantuan yang telah diberikan, teman bimbingan (Septhia, Anissa,
Fakih, dan Kiki) yang telah memberikan semangat dan membantu selama
penelitian berlangsung, semoga mendapat balasan pahala dari Allah SWT.
Semoga karya ilmiah ini bermanfaat.
Bogor, November 2012
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 4 Juli 1990 dari Ayah Supranoto
dan Ibu Rohanah. Penulis merupakan anak pertama dari dua bersaudara. Penulis
memiliki satu orang adik perempuan bernama Apriliaana Putri. Tahun 2008
penulis lulus dari SMA Negeri 58 Jakarta dan pada tahun yang sama penulis
diterima di Institut Pertanian Bogor (IPB) melalui jalur USMI. Penulis tercatat
sebagai mahasiswa Departemen Kimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam, Institut Pertanian Bogor.
DAFTAR ISI
Halaman
DAFTAR TABEL ...vi
DAFTAR GAMBAR ...vi
DAFTAR LAMPIRAN
...vi
PENDAHULUAN ... 1
TINJAUAN PUSTAKA ... 2
Temulawak ... 2
Ekstraksi ... 3
Metabolomik ... 3
Kromatografi Gas-Spekrometri Massa ... 3
Kemometrik ... 4
Analisis Komonen Utama (PCA) ... 4
Uji Letalitas Larva Udang ... 4
Artemia salina
... 4
BAHAN DAN METODE ... 5
Bahan dan alat... 5
Metode ... 5
HASIL DAN PEMBAHASAN ... 7
Ekstraksi dan Uji Kualitas Rimpang Temulawak dengan Metode
Uji BSLT ... 7
Analisis Profil Metabolit Rimpang Temulawak ... 8
Pengelompokan Rimpang Temulawak dengan PCA ... 11
Pendugaan Senyawa Penciri ... 12
SIMPULAN DAN SARAN ... 12
Simpulan ... 12
Saran ... 12
DAFTAR PUSTAKA ... 13
DAFTAR TABEL
Halaman
1
Nilai LC
50ekstrak rimpang temulawak ... 7
2
Senyawa kimia pada ekstrak temulawak ... 10
DAFTAR GAMBAR
Halaman
1
Struktur xantorizol (a), kurkumin (b), dan demetoksikurkumin (c). ... 2
2
Nilai LC
50berdasarkan asal daerah ... 8
3
Senyawa α
-
curcumene (a), α
-cedrene (b), germacrone (c),
dan xanthorrizol (d). ... 8
4
Profil kromatogram ekstrak rimpang temulawak hasil analisis GC-MS. ... 9
5
Skor plot dua PC pertama data kromatogram utuh. ... 11
6
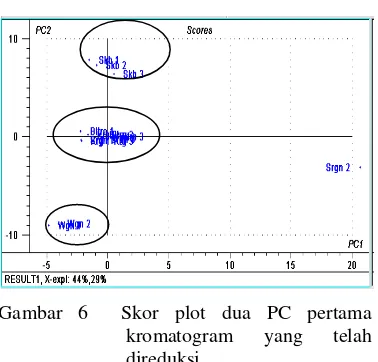
Skor plot dua PC pertama kromatogram yang telah direduksi. ... 11
7
Skor plot dua PC pertama kromatogram yang telah direduksi
dan dihilangkan pencilannya. ... 12
8
Plot
loading
PCA untuk penentuan senyawa penanda. ... 12
DAFTAR LAMPIRAN
Halaman
1
Bagan alir penelitian ... 18
2
Hasil kadar air rimpang temulawak ... 19
3
Hasil kadar abu rimpang temulawak ... 20
4
Rendemen ekstrak etil asetat rimpang temulawak ... 21
5
Hasil uji ANOVA ... 21
6
Hasil uji Duncan ... 21
7
Dugaan senyawa hasil identifikasi GC-MS ... 22
8
Referensi nilai Kovats Index (IR) yang telah dipublikasi NIST ... 24
9
Kondisi lingkungan asal daerah temulawak ... 24
10
Tahap pemrosesan kromatogram GC-MS dengan AMDIS ... 25
11
Tahap pemrosesan PCA data kromatogram berupa waktu retensi
dan luas are
a
dengan
The Unscrambler
... 26
PENDAHULUAN
Temulawak (Curcuma xanthorriza) merupakan keluarga Zingeberaceae telah banyak digunakan di Indonesia sebagai tanaman obat tradisional karena mempunyai aktivitas sebagai antioksidan, antihipertensi, antirematik, antihepatotoksik, antibakteria, dan antijamur (Sears 2005). Pemanfaatannya yang cukup luas pada bidang farmasi menyebabkan temulawak merupakan tanaman obat yang cukup potensial untuk dikembangkan. Rimpangnya mengandung komponen utama yang berkhasiat, yaitu kurkuminoid dan minyak atsiri. Kurkuminoid memberikan warna kuning pada rimpang temulawak yang terdiri atas kurkumin dan desmetoksikurkumin. Komponen kimia minyak atsiri lain yang terdapat dalam temulawak antara lain felandren, kamfer, turmerol, tolilmetilkarbinol, -kurkumen, zingiberen, kuzerenon, germakron, β -turmeron, dan xanthorizol (Rahardjo & Rostiana 2005).
Kualitas temulawak sebagai bahan baku obat dapat ditunjukkan dengan sifat bioaktivitasnya yang dipengaruhi oleh komposisi senyawa kimia dalam temulawak tersebut. Faktor-faktor yang dapat mempengaruhi keragaman komposisi kimia temulawak, yaitu kondisi lingkungan daerah asal, perbedaan jenis tanah, perbedaan iklim, perbedaan waktu panen, dan perbedaan ketinggian tempat (Xiang et al. 2011). Agar memperoleh mutu temulawak yang ajeg diperlukan suatu teknik analisis yang dapat mendeteksi berbagai molekul yang berbeda karena perbedaan kondisi agrobiofisik asal daerah temulawak tersebut.
Metabolomik merupakan salah satu
cabang penelitian “omik” yang fokus pada
identifikasi molekul metabolit pada suatu tanaman (Krastanov 2010). Sekarang ini, pendekatan studi metabolomik telah secara luas digunakan untuk menguji kualitas suatu tanaman. Dobson et al. (2010) mempelajari pebedaan fitokimia pada tanaman kentang (Solanum tuberosum) berdasarkan perbedaan asal daerah, Kim et al. (2011) menganalisis profil metabolit Angelica gigas dari asal geografis yang berbeda, Choi et al. (2010) menguji kualitas kopi yang berasal dari beberapa wilayah antara lain Asia, Amerika Serikat, dan Afrika dengan latar belakang geografis yang berbeda. Xiang et al. (2011) mengidentifikasi komposisi senyawa kimia pada tiga spesies curcuma (Curcuma
phaeocaulis, C. kwangsiensis, dan C. Wenyujin).
Teknik yang dapat digunakan untuk pemprofilan metabolit adalah spektrometri inframerah transformasi fourier (FT-IR), kromatografi gas-spektometri massa (GC-MS), kromatografi cair-spekrometri massa (LC-MS), dan elektron impact-spektometri massa (EI-MS), spektroskopi resonansi magnet inti (NMR) (Krastanov 2010). Pada penelitian ini, keragaman metabolit pada temulawak diidentifikasi menggunakan Kromatografi gas-spektometri massa (GC-MS). Keuntungan dari teknik analisis dengan GC-MS yaitu memiliki sensitivitas dan resolusi yang tinggi, menghasilkan keterulangan yang baik, mudah dalam menggunakan instrumennya dan biaya operasinya yang relatif murah (Tianniam et al.
2008).
Identifikasi senyawa dalam GC-MS dapat dilakukan dengan mencocokkan spektra massa yang terdapat dalam kumpulan data NIST dan Wiley. Senyawa yang telah berhasil diidentifikasi diperkuat kebenarannya dengan mengevaluasi nilai indeks Kovats (IR). Data hasil analisis dengan GC-MS dianalisis lebih lanjut dengan metode kemometrik karena data yang diperoleh merupakan suatu set data yang kompleks sehingga untuk penafsirannya memerlukan bantuan metode kemometrik. Metode kemometrik ini dimaksudkan untuk mengekstraksi informasi yang ada dalam ekstrak yang diuji (Darusman et al. 2007). Teknik pengenalan pola kemometrik yang digunakan adalah analisis komponen utama (PCA) dengan menggunakan perangkat lunak
The Unscrambler versi 9.7 yang dapat mengelompokkan rimpang temulawak berdasarkan perbedaan asal daerah dan mengidentifikasi senyawa penciri pada rimpang temulawak yang berkaitan dengan sifat bioaktivitasnya (toksisitas) dengan metode uji letalitas larva udang (BSLT).
TINJAUAN PUSTAKA
Temulawak
Temulawak tumbuh di hutan-hutan bebarapa pulau jawa di Indonesia, antara lain Jawa, Maluku, dan Kalimantan (Supriadi 2008). Tanaman temulawak ini sudah lama digunakan dalam pengobatan tradisional.
Curcuma berasal dari kata Arab: kurkum yang berarti kuning. xanthorriza berasal dari kata Yunani: xanthos berarti kuning dan rhiza
berarti akar. Temulawak dikenal juga dengan nama geelwortel (Belanda), Javanischer gelbwurzel (Jerman), koneng gede (Sunda), dan temolobak (Madura) (Oei et al. 1985). Berdasarkan taksonominya, temuawak termasuk ke dalam kingdom plantae, divisi Spermatophyta, subdivisi Angiospermae, kelas Monocotyledonae, ordo Zingiberales, famili Zingiberaceae, genus Curcuma, dan spesies Curcuma xanthorriza Roxb.
Temulawak merupakan tanaman obat yang berupa tumbuhan rumpun berbatang semu dengan ketinggian hingga lebih dari 1 m tetapi kurang dari 2 m, berwarna hijau atau coklat gelap. Akar rimpang terbentuk dengan sempurna dan bercabang kuat dan berwarna hijau gelap. Tiap batang mempunyai daun 2-9 helai dengan bentuk bulat memanjang, warna daun hijau atau cokelat keungguan terang sampai gelap. Rimpang temulawak dapat dipanen setelah memasuki usia 8 sampai 12 bulan. Tanaman yang siap dipanen memiliki daun dan bagian tanaman yang telah menguning dan mengering, serta memiliki rimpang besar berwarna kuning kecoklatan (Kurniawan 2011). Temulawak dapat tumbuh pada ketinggian tempat 5-1800 m dpl, iklim tropis, curah hujan 1500-4000 mm/tahun, suhu 19 sampai 35 ˚C, jenis tanah berkapur, berpasir, maupun tanah liat (Asriani 2010).
Temulawak dapat digunakan sebagai jamu untuk obat demam (malaria), pegal-pegal, dan sembelit. Air perasan atau rebusannya dapat digunakan sebagai alternatif ganguan hati dan penyakit kuning. Selain itu, ekstrak temulawak juga dapat menambah nafsu makan, menurunkan kadar kolesterol dan trigliserida darah, menghambat kerja enzim yang penting untuk pertumbuhan sel tumor, serta mencegah dan menyembuhkan jerawat (Sidik et al. 1992).
Semua bagian dari temulawak berkhasiat, namun bagian yang paling berkhasiat adalah rimpangnya atau umbinya. Menurut Sugiharto (2004) menyatakan bahwa rimpang temulawak mengandung senyawa metabolit
aktif, seperti xantorizol (Gambar 1a), kurkumin (Gambar 1b), minyak atsiri, zat pati, flavonoid, kamfor, turmerol, felandren,
mirsen, isofuranogermakren,
p-tolylmetilkarbitol, kation Fe, Ca, Na, dan K. Sedangkan menurut Wijayakusuma (2001) rimpang temulawak ini mengandung lebih dari 100 macam senyawa seperti pati, protein, serat, kurkumin, glikosida, toluil metil karbinol, kalium oksalat, essoil, L -sikloiprenmirsen, dan minyak atsiri. Kandungan kimia rimpang temulawak yang memberi arti pada penggunaannya sebagai bahan pangan, bahan baku industri, dan bahan baku obat ialah pati, minyak atsiri, dan kurkuminoid (Sidik et al. 1992). Minyak atsiri merupakan komponen dalam temulawak yang memberikan bau yang khas, sedangkan kurkuminoid yang memberikan warna kuning pada temulawak terdiri atas kurkumin dan demetoksikurkumin (Gambar 1c).
CH3
C H3 CH3
CH3
(a)
O O
H3CO
O H OCH3 OH (b) O O
H3CO
O
H OH
(c)
Ekstraksi
Ekstraksi merupakan istilah yang digunakan untuk mengambil senyawa tertentu dengan menggunakan pelarut yang sesuai. Metode ekstraksi tergantung pada polaritas senyawa yang akan diekstraksi. Prinsipnya adalah like dissolve like, yaitu pelarut polar akan melarutkan senyawa polar dan pelarut nonpolar akan melarutkan senyawa nonpolar. Pemilihan pelarut yang digunakan juga bergantung pada sifat kelarutan zat terlarut tersebut (Khopkar 2002). Suatu senyawa akan menunjukkan kelarutan yang berbeda-beda dalam pelarut yang berbeda pelarut berbeda pula.
Metode ekstraksi yang paling konvensional adalah maserasi. Metode ekstraksi terus dikembangkan untuk mempersingkat waktu ekstraksi dan mendapatkan ekstrak yang lebih banyak serta volume pelarut yang lebih sedikit. Metode sonikasi menggunakan pengaruh gelombang ultrasonik untuk membantu proses penghancuran sel daun sehingga senyawaan bioaktif yang terdapat di dalam sel akan lebih cepat keluar dan terlarut dalam pelarut. Selain itu, proses ekstraksi daun dengan metode sonikasi akan menghasilkan ekstrak yang bersifat less degradation product dan hasil yang besar (Pinarosa & Gaspare 2004). Pandiangan (2009) melakukan ekstraksi temulawak menggunakan metode maserasi menggunakan dua pelarut, yaitu etanol dan etil asetat, hasil rendemen ekstrak yang diperoleh dengan menggunakan pelarut etanol sebesar 8.63% lebih besar daripada pelarut etil asetat. sebesar 6.67%. Hal ini terjadi karena komponen polar yang terdapat dalam temulawak lebih dominan dibandingkan komponen yang bersifat polar.
Metabolomik
Metabolomik adalah ilmu yang terdiri atas kimia organik, kimia analitik, kemometrik, informatik dan biosains. Metabolomik memungkinkan klasifikasi sampel dan diskriminasi dari bermacam-macam keadaan biologi, asal dan kualitas dalam sampel melalui analisis multivariat dengan metode kemometrik. Metabolomik digunakan dalam pendekatan sistem biologi, termasuk manusia, tumbuhan, dan mikroorganisme. Selain itu, metabolomik dapat diaplikasikan di bidang kesehatan, diagnostik, industri pangan, maupun mikrobiologi (Krastanov 2010).
Beberapa pendekatan untuk metabolomik yang dapat menggolongkan secara kasar
menurut data kualitas dan jumlah metabolit yang dapat dideteksi. Pertama adalah
metabolite targeted analysis yang dapat mendeteksi dan mengkuantifikasi sekelompok kecil metabolit maupun senyawa target tunggal. Kedua adalah metabolite profiling
yang dapat mendeteksi, mengidentifikasi, dan mengkuantifikasi sekelompok besar metabolit yang dikaitkan dengan jalur biosintesis dari yang spesifik. Ketiga adalah metabolite fingerprinting yang dapat digunakan untuk melengkapi perbandingan metabolom, yang dapat dilakukan dengan analisis spektra dari komposis total tanpa perlu mengidentifikasi kelompok senyawa tersebut (Krastanov 2010). Ada beberapa langkah dalam analisis metabolomik antara lain pemprofilan, identifikasi, validasi, dan interpretasi. Pemprofilan dilakukan untuk menemukan metabolit pada sampel. Identifikasi digunakan untuk menentukan struktur kimia dari metabolit setelah pemprofilan. Validasi digunakan untuk memvalidasi senyawa yang telah diidentifikasi dan biasanya membutuhkan standar. Interpretasi merupakan langkah akhir yang dapat menghubungkan metabolit yang telah ditemukan dengan proses biologisnya. Alur kerja dari metabolomik adalah preparasi sampel, analisis, proses data, dan analisis data (Krastanov 2010).
Pendekatan metabolomik dengan analisis target dan statistik algoritma juga telah dilakukan untuk membedakan spesies kopi yang bertujuan mengontrol kualitas kopi (Choi et al. 2010). Teknik metabolomik juga telah berhasil mengarakterisasi profil metabolit Angelica gigas dari daerah tanam yang berbeda menggunakan analisis 1H NMR dan UPLC-MS (Kim et al. 2011) dan studi metabolit ekstrak bioaktif Pancratium canariense (Torras et al. 2009
).
Kromatografi Gas-Spekrometri Massa
Prinsip kerja GC-MS yaitu pada saat sampel diinjeksi kedalam injektor sampel akan diubah menjadi uap yang kemudian dibawa mengikuti aliran gas pembawa menuju detektor yang kemudian oleh detektor diubah menjadi beberapa peak kromatogram yang mana setiap peak kromatogram dihubungkan dengan spektrum massa. GC-MS ini biasa digunakan untuk analisis kualitatif senyawa organik yang pada umumnya bersifat dapat diuapkan (volatil).
berfungsi mendeteksi masing-masing komponen yang telah dipisahkan pada sistem kromatografi gas. Analisis dengan GC-MS merupakan metode yang cepat dan akurat untuk memisahkan campuran yang rumit maupun menganalisis cuplikan dalam jumlah yang sangat kecil dan menghasilkan data yang berguna mengenai struktur serta identifikasi senyawa organik (Agusta 2000).
Metode GC-MC telah digunakan oleh Catchpole et al. (2005). untuk menganalisis senyawa metabolit yang polar (seperti asam amino, amina aromatik, asam organik, gula, dan gula alkohol) dalam umbi kentang Dobson et al. (2010) mempelajari keragaman fitokimia pada umbi kentang berdasarkan perbedaan daerahnya. Derwich et al. (2010) mengidentifikasi senyawa volatil minyak atsiri pada daun Mentha pulegium yang tumbuh di daerah Maroko.
Kemometrik
Metode kemometrik merupakan suatu analisis multivariat yang menyediakan metode untuk mengurangi data berukuran besar yang diperoleh dari suatu instrument, seperti kromatografi. Multivariat merupakan salah satu teknik analisis kemometrik yang banyak digunakan untuk analisis matriks kompleks dan analisis multikomponen pada sistem sederhana. Metode kalibrasi multivariat dapat berupa multiple linier regression (MLR),
principal component regression (PCR), dan
artificial neural network (AAN) Analisis multivariat yang dapat digunakan untuk pengenalan pola antara lain adalah
exploratory data analysis (EDA) yang terdiri atas principal component analysis PCA dan
factor analysis (FA), unsupervised pattern recognation, dan supervisaed pattern recognation (Brereton 2003).
Analisis Komonen Utama (PCA)
PCA merupakan suatu teknik untuk mengurangi jumlah peubah dalam suatu matrik data. Prinsip PCA adalah mencari komponen utama yang merupakan kombinai linier dari peubah asli. Secara keseluruhan kegunaan PCA adalah untuk mengklasifikasi sampel menjadi grup yang umum, mendeteksi adanya pencilan (outliers), melakukan pemodelan data, serta menseleksi variabel untuk klasifikasi maupun untuk pemodelan. Komponen-komponen utama ini dipilih sedemikian rupa sehingga komponen utama pertama memiliki variasi terbesar dalam set data, sedangkan komponen utama kedua tegak
lurus terhadap komponen utama pertama dan memiliki variasi terbesar berikutnya (Miller & Miller 2000). Kedua komponen utama pertama ini pada umumnya digunakan sebagai bidang proyeksi utama pemeriksaan visual data multivariat.
Uji Letalitas Larva Udang
Uji letalitas larva udang dengan menggunakan metode BSLT merupakan salah satu metode uji bioaktif pada penelitian senyawa bahan alam. Metode ini telah digunakan sejak tahun 1956 untuk mengetahui residu peptisida, anastesik lokal, senyawa turunan morfin, mitotoksin, karsiogenitas suatu senyawa dan polutan air laut. Beberapa keuntungan dari uji bioaktivitas menggunakan larva udang, yaitu waktu uji yang cepat, murah, sederhana, dan tidak memerlukan keahlian serta peralatan khusus (Mayer et al.
1982). Senyawa aktif yang memiliki daya toksisitas tinggi diketahui berdasarkan nilai
lethal concentration 50% (LC50), yaitu nilai yang menunjukkan konsentrasi zat toksik yang dapat menyebabkan kematian hewan uji sampai 50%. Meyer et al. (1982) menyebutkan tingkat toksisitas suatu ekstrak LC50 ≤ γ0 µg/mL bersifat sangat toksik, 30 µg/mL ≤ LC50≤ 1000 µg/mL bersifat toksik, dan LC50 > 1000 µg/mL bersifat tidak toksik.
Artemia salina
Artemia salina merupakan kelompok udang-udangan (Crustaceae) dari filum
Arthropoda, kingdom animalia. A. salina
hidup dilingkungan danau berair asin.
Keunggulan penggunaan A. salina untuk uji BSLT ialah sifatnya yang peka terhadap bahan uji, waktu siklus hidup yang lebih cepat, mudah dibiakkan, dan harganya murah. Sifat peka A. salina kemungkinan disebabkan oleh keadaan membran kulitnya yang sangat tipis sehingga memungkinkan terjadinya difusi zat dari lingkungan yang mempengaruhi metabolisme dalam tubuhnya. Uji BSLT menggunakan A. salina dilakukan dengan menetaskan telur-telur tersebut dalam air laut yang dibantu dengan aerasi. Telur A. salina
yang baik digunakan untuk uji BSLT ialah yang berumur 48 jam sebab jika lebih dari 48 jam dikhawatirkan kematian A. salina bukan disebabkan toksisitas ekstrak melainkan oleh terbatasnya persediaan makanan (Meyer et al.
BAHAN DAN METODE
Bahan dan alat
Bahan-bahan yang digunakan dalam penelitian ini adalah temulawak yang diperoleh dari 5 daerah berbeda, yaitu Bogor (Jawa Barat), Karanganyar (Jawa Tengah), Sukabumi (Jawa Barat), Sragen (Jawa Tengah), dan Wonogiri (Jawa Tengah) dengan umur panen 9 sampai 12 bulan, data kromatogram hasil analisis GC-MS, etil asetat, air laut, dan larva udang Artemia salina. Alat-alat yang digunakan adalah peralatan gelas, penangas ultrasonik, oven, penyaring milipore filter unit berukuran 0.45
μm, penguap putar, GC-MS Simadhzu QP 2010, perangkat keras komputer, perangkat lunak The Unscrambler versi 9.7, AMDIS, dan SPSS 16.
Metode
Penelitian ini dilakukan dalam dua tahap, yaitu penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan telah dilakukan oleh Ambarsari et al. (2012) mencangkup ekstraksi rimpang temulawak dengan pelarut etil asetat dan analisis menggunakan GC-MS, sedangkan penelitian utama mencangkup penentuan kadar air dan kadar abu, evaluasi metabolit dengan indeks Kovats (IR) dengan mencocokkan nilai IR yang ada pada koleksi
database NIST 1969 dan diferensiasi metabolit dengan PCA menggunakan perangkat lunak The Unscrambler, serta uji toksisitas ekstrak etil asetat rimpang temulawak dengan metode BSLT (Lampiran 1).
Preparasi Rimpang Temulawak
Rimpang segar dari 5 daerah dicuci dengan air bersih, ditiriskan, dirajang kecil-kecil, dikeringkan, lalu diserbukan. Preparasi sampel dilakukan dua kali, sampel yang akan digunakan untuk analisis dengan GC-MS dan uji toksisitas.
Analisis Kadar Air (AOAC 2007)
Cawan porselen dikeringkan pada suhu 105 °C selama 30 menit kemudian didinginkan dalam eksikator dan ditimbang. Sebanyak 2 g serbuk temulawak kering dimasukkan ke dalam cawan dan dikeringkan pada suhu 105 °C selama 5 jam kemudian didinginkan dalam eksikator dan ditimbang. Prosedur ini dilakukan hingga diperoleh bobot
yang tetap. Kadar air contoh ditentukan dengan persamaan,
Kadar air = - × 100% Keterangan:
A= bobot contoh awal (g) B= bobot contoh kering (g)
Analisis Kadar Abu (AOAC 2007)
Cawan porselen yang bersih dan kering dimasukkan ke dalam tanur untuk menghilangkan sisa-sisa kotoran yang menempel di cawan. Setelah didinginkan dalam eksikator, cawan ditimbang. Sebanyak 2 g serbuk rimpang temulawak kering dimasukkan ke dalam cawan tersebut dan dipanaskan sampai tidak berasap kemudian dibakar dalam tanur pada suhu 600 °C selama 2 jam sampai diperoleh abu. Cawan berisi abu didinginkan dalam eksikator dan ditimbang. Kadar abu contoh dihitung dengan persamaan,
Kadar abu = × 100%
Keterangan:
A= bobot contoh awal (g) B= bobot abu (g)
Ekstraksi Rimpang dengan Etil asetat (Ambarsari et al. 2012)
Ekstraksi sampel rimpang temulawak dilakukan dua kali, pertama ekstrak sampel yang akan digunakan untuk analisis dengan GC-MS telah dilakukan oleh Ambarsari et al.
(2012) dan ekstraksi sampel untuk uji toksisitas. Ekstraksi rimpang temulawak untuk analisis GC-MS ditimbang sebanyak 200 mg sampel temulawak dari masing-masing 5 daerah kemudian dilarutkan ke dalam 4 mL etil asetat dan disonikasi selama 30 menit. Setelah itu didiamkan selama semalam dan maserat dikumpulkan dan dipekatkan dengan penguap putar. Ekstrak yang telah diperoleh kemudian disaring dengan saringan milipore
0.45 mikron kemudian diinjeksi ke dalam kolom GC-MS.
awal. Kadar air sampel digunakan sebagai faktor koreksi.
Rendemen (%) =
Keterangan:
A = bobot contoh awal (g) B = bobot ekstrak (g) C = kadar air
Analisis dengan GC-MS
Komponen kimia ekstrak rimpang temulawak dianalisis dengan GC-MS. Proses analisis menggunakan GC Shimadzu QP 2010 yang ditendem dengan detektor spektometer massa Shimadzu QP 2010; kolom kapiler DB-sns (J&W) (dimensi 30 m 0.248 nm), film thickness 0.25 µm, model aliran konstan dengan laju alir 0.5 mL/menit; gas pembawa H2; tipe injektor manual dengan volume injeksi 1 µL; suhu inlet β50 ˚C dengan teknik injeksi split; suhu awal oven 180 ˚C, waktu awal 5 menit dengan waktu operasi oven 30 menit; Program suhu diawali dengan 180 ˚C ditahan 5 menit kemudian diubah perlahan-lahan dengan laju kenaikan suhu 14 ˚C/menit hingga mencapai γ00 ˚C dan ditahan selama 5 menit.
Evaluasi Data GC-MS
Identifikasi senyawa dilakukan dengan mencocokkan spektra massa yang diperoleh hasil analisis GC-MS dengan spektra massa
database NIST dan Wiley. Selanjutnya dilakukan perhitungan nilai indeks Kovats (IR) menggunakan deret homolog n-alkana untuk memperkuat dugaan senyawa yang berhasil diidentifikasi. Konfirmasi komponen dilakukan dengan mencocokkan nilai IR komponen dengan IR yang sudah dipublikasikan NIST tahun 1969. Nilai indeks Kovats (IR) dihitung dengan persamaan,
IR=100z + 100
[
logt
( )- logt
logt ( 1)- logt
]
Keterangan:IR = Kovat Indeks retensi
t‟R
(x) = waktu retensi terkoreksi senyawa x
t‟
Rz = waktu retensi terkoreksi n-alkana dengan jumlah karbon z yang muncul sebelum komponen x
t‟R
(z+1) = waktu retensi terkoreksi n-alkana dengan jumlah karbon z+1 yang muncul setelah x
x = senyawa yang dipilih
z = n-alkana dengan jumlah karbon z
yang muncul sebelum x
z + 1 = n-alkana dengan jumlah karbon z + 1 yang muncul setelah x
(Hubschman 2009).
Analisis dengan Prinsip Komponen Utama
Data GC-MS yang telah dievaluasi kemudian diolah juga dengan metode PCA menggunakan perangkat lunak The Unscrambler untuk menentukan metabolit dominan (penciri) pada masing-masing rimpang temulawak, sehingga dapat dilakukan klasifikasi terhadap rimpang temulawak yang berasal dari daerah berbeda.
Uji Toksisitas Ekstrak Rimpang Temulawak dengan Metode BSLT
Telur A. salina direndam dalam air laut. Suhu penetasan adalah 25-γ0˚C selama 48 jam dan siap untuk uji BSLT (Nurhayati et al. 2006). Ekstrak rimpang temulawak ditimbang sebanyak 0.01 g kemudian dilarutkan dengan air laut di dalam labu takar 10 mL. Dibuat stok ekstrak dengan konsentrasi 2000 µg/mL lalu dibuat bebarapa konsentrasi, yaitu 20, 30, 40, 50, 75 dan 100 µg/mL serta blanko tanpa penambahan sampel. Pengujian dilakukan dengan memasukkan 15 ekor larva A. salina
yang berumur 48 jam ke dalam sumur (multiwell) yang telah berisi air laut kemudian ditambahkan larutan ekstrak dengan total volume sumur 2 mL. Setelah 24 jam, jumlah larva yang mati dihitung dengan bantuan kaca pembesar.
Parameter yang digunakan adalah jumlah larva yang mati 50% dari total larva uji. Kemudian dihitung nilai LC50 dengan memasukkan angka probit (50% kematian larva uji). Rumus persen kematian ditentukan dengan rumus Abbot,
% kematian larva = 15- × 100% Keterangan:
T = jumlah larva mati K = jumlah larva kontrol mati 15 = jumlah larva uji
Dengan mengetahui kematian larva
A.salina, kemudian dicari angka probit melalui tabel probit dan dibuat persamaan garis,
y = a+bx
Dari persamaan tersebut, selanjutnya LC50 dihitung dengan memasukkan nilai probit (50% kematian) (Meyer et al. 1982).
Analisis Statistik
Hasil penelitian diolah menggunakan perangkat lunak Minitab versi 14 dengan program analisys of variance (ANOVA) one-way. Selanjutnya dilakukan uji lanjut Duncan dengan software SPSS versi 16 terhadap parameter yang dianalisis meliputi hubungan perlakuan terhadap nilai LC50.
HASIL DAN PEMBAHASAN
Ekstraksi dan Uji Kualitas Rimpang Temulawak dengan Metode Uji BSLT
Hasil kadar air ekstrak temulawak dari sampel Bogor (17.03 0.19%), Sragen (16.89
0.12%), Sukabumi (19.54 1.77%), Wonogiri (17.97 0.17%), dan Karanganyar (19.95 1.45%) (Lampiran 2). Kandungan air rimpang temulawak segar cukup besar, sehingga tidak baik untuk disimpan dalam waktu yang lama. Supaya diperoleh kadar air yang kecil maka rimpang temulawak harus dikeringkan dahulu agar sampel tidak mudah rusak dan dapat disimpan pada waktu yang lama. Menurut Winarno (1992) menyatakan bahwa kadar air minimum agar bakteri tidak tumbuh ialah kurang dari 10% sehingga pada kadar air ini bahan dapat disimpan dalam jangka waktu yang lama dan risiko terkena jamur kecil. Penentuan kadar abu juga dilakukan untuk sampel rimpang temulawak dari lima daerah yang berbeda yang bertujuan menentukan kandungan mineral dalam suatu bahan. Hasil kadar abu ekstrak temulawak dari sampel Bogor (5.43 0.11%), Sragen (8.78 0.15%), Sukabumi (6.75 0.17%), Wonogiri (7.41 0.12%), dan Karanganyar (6.82 0.12%) (Lampiran 3). Kandungan mineral rimpang temulawak dari daerah Sragen lebih banyak tetapi jumlah air yang terikat secara fisik lebih sedikit dibandingankan rimpang temulawak dari daerah lain.
Sampel rimpang temulawak dari lima daerah yang berbeda diekstraksi menggunakan metode maserasi dengan pelarut etil asetat. Hasil rendemen yang diperoleh untuk ekstrak dari Bogor (9.38%), Sragen (8.78%), Sukabumi (9.87%), Wonogiri (8.84%), dan Karanganyar (9.78%) (Lampiran 4). Rendemen ekstrak ini perlu dikoreksi kandungan airnya dengan menghitung nilai
persentase kadar air. Keberadaan air dalam bahan dapat menggangu proses ekstraksi. Jika kadar air terlalu tinggi maka bahan akan mudah terserang jamur dan dalam proses ekstraksi mengakibatkan terhalangnya pelarut masuk kedalam dinding sel karena pelarut yang digunakan tidak bisa bercampur dengan air maka hasil rendemen ekstrak yang diperoleh sedikit (Meilani 2006).
Uji kualitas rimpang temulawak dilakukan dengan menguji tingkat toksisitasnya menggunakan metode BSLT dengan hewan uji adalah A. salina. Uji toksisitas menggunakan metode BSLT cukup praktis, cepat, mudah, dan cukup akurat. Senyawa aktif yang memiliki daya toksisitas diketahui berdasarkan nilai lethal concentration 50%, yaitu suatu nilai yang menunjukkan kosentrasi zat toksik yang dapat menyebabkan kematian hewan uji sampai 50%.
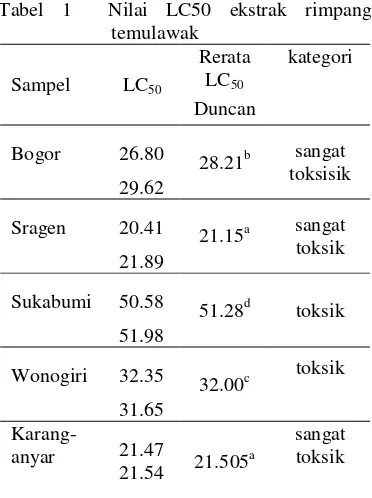
Suatu ekstrak dianggap sangat toksik bila memiliki nilai LC50 ≤ 30 µg/mL, dianggap toksik bila γ1 µg/mL ≤ LC50 ≤ 1000 µg/mL dan dianggap tidak toksik bila nilai LC50 di ≥ 1000 µg/mL (Meyer et al. 1982). Jadi, jika nilai LC50 semakin kecil dari suatu ekstrak, maka senyawa tersebut semakin tinggi keaktifannya atau semakin toksik (Tabel 1).
Tabel 1 Nilai LC50 ekstrak rimpang temulawak
Sampel LC50
Rerata LC50
kategori
Duncan
Bogor 26.80 28.21b sangat toksisik 29.62
Sragen 20.41 21.15a sangat toksik 21.89
Sukabumi 50.58 51.28d
toksik 51.98
Wonogiri 32.35 32.00c toksik
31.65 Karang-
anyar 21.47
21.54 21.505 a
sangat toksik
Angka yang diikuti oleh huruf superscripts yang sama tidak berbeda signifikan pada taraf uji (P<0.05) pada uji Duncan
Sukabumi (Gambar 2). Hasil statistik ANOVA menunjukkan bahwa p-value lebih
[image:16.595.108.302.90.743.2]kecil dibandingkan nilai α = 0.05. Nilai p-value yang diperoleh sebesar 0.00<0.05 (Lampiran 5). Berdasarkan hasil tersebut dapat disimpulkan bahwa terdapat perbedaan toksisitas antara rimpang temulawak dari daerah yang satu dengan daerah lainnya. Hal ini dapat disebabkan oleh perbedaan kandungan senyawa yang terdapat pada masing-masing rimpang temulawak karena perbedaan asal daerah yang dipengaruhi oleh kondisi lingkungan yang berbeda, seperti kondisi tanah, curah hujan, iklim, suhu lingkungan, dan ketinggian tempat. Selain itu dilakukan uji Duncan (Lampiran 6). Pada uji Duncan nilai LC50 rimpang temulawak tidak berbeda nyata adalah sampel Kranganyar dengan Sragen.
Gambar 2 Nilai LC50 berdasarkan asal daerah.
Analisis Profil Metabolit Rimpang Temulawak
Profil metabolit dari rimpang temulawak yang dianalisis dengan GC-MS berasal dari lima daerah yang berbeda, yaitu Bogor, Karanganyar, Sukabumi, Sragen, dan Wonogiri. Ekstrak rimpang yang digunakan adalah ekstrak etil asetat. Hasil analisis GC-MS berupa data kromatogram yang digunakan untuk identifikasi senyawa dengan mencocokkan spektra massa komponen kimia target dengan spektra massa yang terdapat pada library software (NIST, Wiley) dan konfirmasi komponen dilakukan dengan mencocokkan nilai indeks Kovats (IR) hasil perhitungan dengan nilai IR yang telah dipublikasi oleh koleksi database NIST tahun 1969.
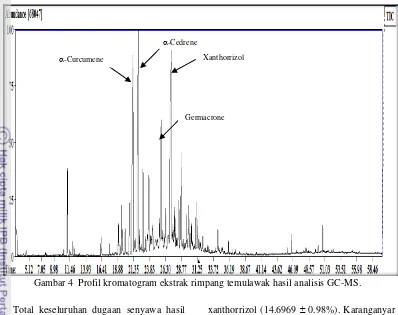
Komponen senyawa dominan dalam ekstrak rimpang temulawak adalah α -curcumene (C15H22) dengan bobot molekul
β0β.γγ5β g/mol, α-cedrene (C15H24) dengan bobot molekul 204.3511 g/mol, germacrone (C15H22O) dengan bobot molekul 218.3346 g/mol, dan xanthorrizol (C15H22O) dengan bobot molekul 218.3346 g/mol (Gambar 3). Profil kromatogram ekstrak rimpang temulawak dari masing-masing sampel memiliki kemiripan pola dengan waktu retensi sebagai sumbu x dan persen kelimpahan sebagai sumbu y (Gambar 4).
CH3
C H3 CH3
CH3 (a) C H3 H CH3 C H3 CH3 (b) O C H3 CH3 C H3 CH3
(c)
CH3 CH3 CH3
OH
CH3
(d)
Gambar 3 Senyawa α-curcumene (a), α -cedrene (b), germacrone (c), dan xanthorrizol (d).
[image:16.595.340.492.233.713.2]Total keseluruhan dugaan senyawa hasil identifikasi GC-MS pada kelima sampel Bogor, Karanganyar, Sukabumi, Sragen, dan Wonogiri berturut-turut adalah 70, 70, 57, 66, dan 68 senyawa (Lampiran 7), sedangkan komponen kimia yang berhasil diidentifikasi dan yang telah dikonfirmasi nilai indeks Kovatsnya ada 25 senyawa (Tabel 2) dari beberapa sumber referensi NIST 1969 (Lampiran 8). Jumlah senyawa dalam ekstrak rimpang temulawak dari daerah Bogor, Karanganyar, Sragen, dan Wonogiri memiliki keragaman jumlah komposisi senyawa kimia yang lebih banyak daripada komposisi senyawa yang dimiliki dari daerah Sukabumi. Hal ini mungkin disebabkan karena perbedaan ketinggian tempat tumbuh asal rimpang temulawak. Daerah Bogor, Karanganyar, Sragen, dan Wonogiri berada pada ketinggian tempat yang berkisar dari 100-500 m dpl dan Sukabumi berada pada ketinggian sekitar 584 m dpl (Lampiran 9).
Sampel rimpang temulawak dari lima daerah berbeda pada umumnya memiliki kemiripan komposisi kimia, namun memiliki persen area relatif yang bervariasi. Jumlah relatif masing-masing senyawa merupakan persentase dari peak area relatif terhadap peak area total. Komponen utama ekstrak rimpang temulawak dari Bogor adalah α-curcumene (9.6741 0.53%), α-cedrene (12.1518 0.72%), germacrone (7.7926 0.41%).
xanthorrizol (14.6969 0.98%). Karanganyar komponen utamanya adalah α-curcumene (10.2111 0.47%), α-cedrene (12.0766 0.39%), germacrone (7.0551 1.12%), xanthorrizol (15.2788 0.91%). Sukabumi komponen utamanya adalah curcumene (10.3174 0.38%), α-cedrene (12.3220 0.49%), germacrone (7.6504 0.73%), xanthorrizol (14.2820 0.91%). Sragen komponen utamanya adalah α-curcumene (10.2735 0.73%), α-cedrene (12.3890 0.75%), germacrone (6.5119 0.34%), xanthorrizol (15.9841 1.25%). Wonogiri komponen utamanya adalah α-curcumene (9.8608 0.44%), α-cedrene (12.5725 0.56%), germacrone (6.9562 0.36%), xanthorrizol (15.6804 1.17%). Senyawa α -curcumene dan germacrone paling banyak ditemukan di daerah Sukabumi. Senyawa -cendrene paling banyak ditemukan di daerah Wonogiri dan senyawa xanthorrizol banyak ditemukan di daerah Sragen.
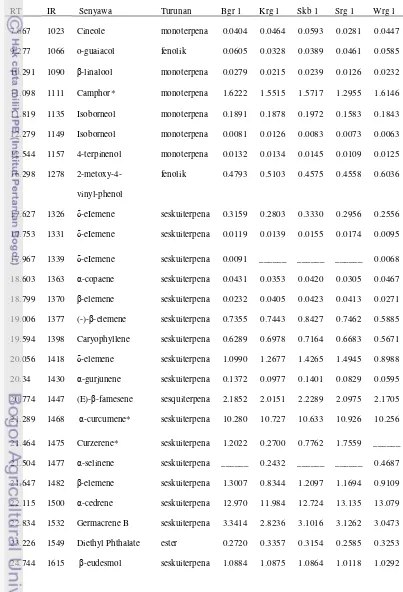
Senyawa kimia yang berhasil diidentifikasi dan dikonfirmasi nilai indeks Kovats pada
database yang telah dipublikasi oleh NIST paling banyak golongan terpenoid. Golongan terpenoid terdiri atas tiga kelompok, yaitu monoterpena, seskuiterpena, dan diterpena. Secara umum, komponen senyawa kimia yang berhasil diidentifikasi termasuk kelompok monoterpena dan sesquiterpena. Pada
-Curcumene
-Cedrene
Xanthorrizol
Germacrone
kelompok seskuiterpena ada beberapa tipe, yaitu bisabolane, cadalene, cadinene dan furanocadinane, carabrane, curcumane, elemene, germacrane, eudesmane dan furanoeudesmane, guaiane, seskuiterpena
dimers, dan seskuiterpena lain. Senyawa α -curcumane dan xanthorrizol termasuk
kelompok seskuiterpena tipe bisabolane, senyawa germacrone termasuk kelompok seskuiterpena tipe germacrane (Ravindran et al. 2007), dan α-cendrene termasuk kelompok seskuiterpena tipe cendrene (Li et al. 2011).
Tabel 2 Senyawa kimia pada ekstrak temulawak
RT IR Senyawa Turunan Bgr 1 Krg 1 Skb 1 Srg 1 Wrg 1
7.667 1023 Cineole monoterpena 0.0404 0.0464 0.0593 0.0281 0.0447
9.277 1066 o-guaiacol fenolik 0.0605 0.0328 0.0389 0.0461 0.0585
10.291 1090 -linalool monoterpena 0.0279 0.0215 0.0239 0.0126 0.0232
11.098 1111 Camphor* monoterpena 1.6222 1.5515 1.5717 1.2955 1.6146
11.819 1135 Isoborneol monoterpena 0.1891 0.1878 0.1972 0.1583 0.1843
12.279 1149 Isoborneol monoterpena 0.0081 0.0126 0.0083 0.0073 0.0063
12.544 1157 4-terpinenol monoterpena 0.0132 0.0134 0.0145 0.0109 0.0125
16.298 1278 2-metoxy-4- fenolik 0.4793 0.5103 0.4575 0.4558 0.6036
vinyl-phenol
17.627 1326 δ-eIemene seskuiterpena 0.3159 0.2803 0.3330 0.2956 0.2556
17.753 1331 δ-eIemene seskuiterpena 0.0119 0.0139 0.0155 0.0174 0.0095
17.967 1339 δ-eIemene seskuiterpena 0.0091 ______ ______ ______ 0.0068
18.603 1363 α-copaene seskuiterpena 0.0431 0.0353 0.0420 0.0305 0.0467
18.799 1370 -elemene seskuiterpena 0.0232 0.0405 0.0423 0.0413 0.0271
19.006 1377 (-)- -elemene seskuiterpena 0.7355 0.7443 0.8427 0.7462 0.5885
19.594 1398 Caryophyllene seskuiterpena 0.6289 0.6978 0.7164 0.6683 0.5671
20.056 1418 δ-elemene seskuiterpena 1.0990 1.2677 1.4265 1.4945 0.8988
20.34 1430 α-gurjunene seskuiterpena 0.1372 0.0977 0.1401 0.0829 0.0595
20.774 1447 (E)- -famesene sesquiterpena 2.1852 2.0151 2.2289 2.0975 2.1705
21.289 1468 α-curcumene* seskuiterpena 10.280 10.727 10.633 10.926 10.256
21.464 1475 Curzerene* seskuiterpena 1.2022 0.2700 0.7762 1.7559 ______
21.504 1477 α-selinene seskuiterpena ______ 0.2432 ______ ______ 0.4687
21.647 1482 -elemene seskuiterpena 1.3007 0.8344 1.2097 1.1694 0.9109
22.115 1500 α-cedrene seskuiterpena 12.970 11.984 12.724 13.135 13.079
22.834 1532 Germacrene B seskuiterpena 3.3414 2.8236 3.1016 3.1262 3.0473
23.226 1549 Diethyl Phthalate ester 0.2720 0.3357 0.3154 0.2585 0.3253
25.667 1658 Germacrone* seskuiterpena 7.7634 5.9537 8.2829 6.2098 7.3198
27.218 1730 Xanthorrizol* seskuiterpena 15.644 15.764 14.695 16.133 16.753
Tanda ____ senyawa yang tidak terdeteksi
Tanda *senyawa yang ditemukan pada temulawak dalam dictionary of natural product (DNP) dan Ravindran et al.2007.
Pengelompokan Rimpang Temulawak dengan PCA
Pengelompokan temulawak berdasarkan perbedaan asal daerahnya menggunakan analisis PCA. PCA merupakan suatu teknik untuk mengurangi jumlah peubah dalam suatu matrik data. Prinsip PCA adalah mencari komponen utama yang merupakan kombinasi linier dari peubah asli. Secara keseluruhan kegunaan PCA adalah untuk mengklasifikasi sampel menjadi grup yang umum, mendeteksi adanya pencilan (outliers), melakukan pemodelan data, serta menyeleksi variabel untuk klasifikasi maupun untuk pemodelan. Komponen-komponen utama ini dipilih sedemikian rupa sehingga komponen utama pertama memiliki variasi terbesar dalam set data, sedangkan komponen utama kedua tegak lurus terhadap komponen utama pertama dan memiliki variasi terbesar berikutnya (Miller & Miller 1984).
Penggelompokan temulawak dapat dilihat pada plot score dua dimensi. Plot score untuk dua komponen utama (PC) pertama biasanya paling berguna dalam analisis karena kedua PC ini mengandung paling banyak keragaman dalam data (Darusman et al 2007). Sampel yang mirip satu sama lain akan memiliki plot yang berdekatan (Widiastuty 2006). Analisis PCA melibatkan 214 titik berdasarkan persentase dari peak area relatif dengan total
peak area (% konsentrasi). Gambar 5 menunjukkan bahwa plot score dua PC pertama mampu menjelaskan 87% dari variasi total (PC1 = 78%, PC2= 9%). Pengelompokan sampel rimpang temulawak berdasarkan perbedaan asal daerah masih tidak jelas pengelompokkannya, hal ini mungkin dikarenakan senyawa-senyawa yang mempunyai konsentrasi kecil dapat mempengaruhi pengelompokkan. Oleh karena itu, data direduksi dengan memilih kosentrasi lebih dari 50%. Gambar 6 menunjukkan bahwa plot score dua PC pertama mampu menjelaskan 71% dari variasi total (PC1= 44%, PC2 = 29%). Variasi total yang diperoleh lebih kecil daripada analisis sebelumnya, tetapi memperoleh tiga kelompok. Kelompok I adalah Sukabumi 1, Sukabumi 2, dan Sukabumi 3. Kelompok II adalah Bogor 1, Bogor 2, Bogor 3,
Karanganyar 1, Karanganyar 2, Karanganyar 3, Sragen 1, Sragen 3 dan Wonogiri 3. Kelompok III adalah Wonogiri 1 dan Wonogiri 2. Program Unscrambler
mengidentifikasi sampel Bogor 1, Sragen 1, Sragen 2, dan Sukabumi 3 sebagai pencilan sehingga dihilangkan pada analisis selanjutnya dan diperoleh peningkatan variasi total sebesar 90% (PC1= 60% dan PC2= 30%) dengan pengelompokkan yang lebih jelas (Gambar 7).
Gambar 5 Skor plot dua PC pertama data kromatogram utuh.
[image:19.595.324.508.303.443.2] [image:19.595.324.513.477.658.2]Gambar 7 Skor plot dua PC pertama kromatogram yang telah direduksi dan dihilangkan pencilannya.
Analisis PCA diperoleh tiga kelompok, yaitu kelompok I adalah Sukabumi, kelompok II adalah Bogor, Sragen, dan Karanganyar, kelompok III adalah Wonogiri, sedangkan hasil uji toksisitas dengan metode BSLT diperoleh dua kelompok mengikuti pengelompokan Mayer et al. (1982), yaitu kelompok I dengan kategori sangat toksik adalah Bogor, Sragen, dan Karanganyar karena mempunyai nilai LC50 30 µg/mL dan kelompok II adalah Sukabumi dan Wonogiri termasuk kategori toksik karena mempunyai nilai 30 µg/mL ≤ LC50 1000 µg/mL.
Pendugaan Senyawa Penciri
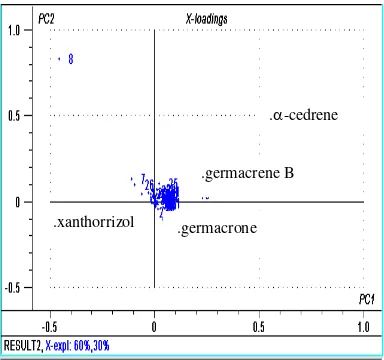
Pendugaan senyawa penciri pada masing-masing daerah dapat dilihat dari plot loading. Rimpang temulawak dari kelompok I adalah Sukabumi diduga mempunyai senyawa penciri yaitu germacrone pada waktu retensi 25.667, kelompok II adalah Bogor, Karanganyar, dan Sragen mempunyai
[image:20.595.111.301.74.503.2] [image:20.595.325.517.83.263.2]senyawa penciri yaitu α-cedrene pada waktu retensi 22.115 dan germacrene B pada waktu retensi 22.834, dan kelompok III adalah Wonogiri mempunyai senyawa penciri xanthorrizol pada waktu retensi 27.218 (Gambar 8).
Gambar 8 Plot loading PCA untuk penentuan senyawa penanda.
SIMPULAN DAN SARAN
Simpulan
Keragaman senyawa metabolit rimpang temulawak yang berhasil diidentifikasi dari 5 daerah, yaitu Bogor, Karanganyar, Sukabumi, Sragen, dan Wonogiri, berturut-turut mempunyai jumlah senyawa sebanyak 70, 70, 57, 66, dan 68 senyawa. Kondisi lingkungan mempengaruhi jumlah dan keragaman komposisi senyawa kimia dalam rimpang temulawak salah satunya adalah ketinggian tempat. Hasil analisis dengan PCA memperoleh pengelompokkan ekstrak rimpang temulawak sebanyak tiga kelompok, kelompok I adalah Sukabumi, kelompok II adalah Bogor, Karanganyar, dan Sragen, Kelompok III adalah Wonogiri. Kelompok I diduga mempunyai senyawa penciri germacrone, kelompok II diduga mempunyai senyawa penciri α-cedrene dan germacrene B, dan kelompok III diduga mempunyai senyawa penciri xanthorrizol. Hasil uji toksisitas menunjukkan bahwa ekstrak rimpang temulawak yang berasal dari daerah Bogor, Karanganyar, dan Sragen mempunyai tingkat toksisitas yang lebih tinggi sehingga kualitas rimpang temulawak lebih baik daripada ekstrak dari daerah Wonogiri dan Sukabumi.
Saran
Perlu dilakukan variasi umur tanam untuk mengetahui keragaman profil metabolit yang dihasilkan oleh rimpang temulawak dari daerah yang berbeda. Perlu evaluasi lebih lanjut. jalur biosintesis dari senyawa-senyawa
.germacrone .xanthorrizol
yang teridentifikasi. Serta penggunaan perangkat lunak yang lain seperti sigma plot
untuk memudahkan dalam interpretasi data yang diperoleh dari hasil analisis GC-MS. Perlu dilakukan analisis multivariat lain seperti PLS-DA (partial least square-discriminant analysis).
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2007. Official Methods of AOAC International. Revisi ke-2. Volume ke-1. Maryland: AOAC International.
Abella L, Cortella AR, Velasco A, Perez MJ. 2000. Ethnobotany, volatile oils and secretion tissues of Werneria poposa from Argentina. Pharm Biol 38:197-203.
Agusta. 2000. Minyak Atsiri Tumbuhan Tropika Indonesia. Bandung: ITB Pr.
Ambarsari L et al. 2012. Laporan penelitian perguruan tinggi: Produksi nanokurkumin berbasis bahan baku terstandar secara ginetik dan metabolit untuk meningkatkan nilai tambah biodiversitas lokal demi kemandirian bangsa. Direktorat Jendral Pendidikan Tinggi, Departemen Pendidikan Nasional.
Asriani D. 2010. Isolasi xantorizol dari temulawak terpilih berdasarkan nomor harapan [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
[BPPPPK] Badan Pelaksana Penyuluhan Pertanian Perikanan dan Kehutanan Kabupaten Bogor. 2011. Geografi Kabupaten Bogor [terhubung berkala]. http//:bp4k.bogor kab. go.id [23 Agustus 2012].
[BPS] Badan Pusat Statistik. 2010. Karanganyar dalam Angka 2010 [terhubung berkala]. http//:www. karanganyarkab. go.id/../Karanganyar-Dalam-Angka-2011.pdf. [23 Agustus 2012].
[BPS] Badan Pusat Statistik. 2010. Sukabumi dalam Angka 2011 [terhubung berkala]. http//:www.sukabumikota.go.id/sda2011/1 %awal.Pdf [23 Agustus 2012].
[BPS] Badan Pusat Statistik. 2006. Wonogiri dalam Angka 2006 [terhubung berkala].
http//:www.wonogirikab.go.id [23 Agustus 2012].
Bos R, Woerdenbag HJ, Kayser O, Ruslan WJ, Elfami K. 2007. Essenstial oil constituents of Piper cubeba L. fils from Indonesia. J Essent Oil Res 19:14-17.
Brereton RG. 2003. Chemometrics: Data Analysis for The Laboratory and Chemical Plant. England: J Willey.
Castel C, Fernandez X, Lizzani L, Perichet C, Lavoine S. 2006. Characterization of the chemical composition of a by product from Siam benzoin gum. J Agric Food Chem 54:8848-8854.
Cathpole GS et al. 2005. Hierarchical metabolomics demonstrates subtantia compositional similarity between genetically modified and conventional potato crops. Proc Nat Acad Sci USA
102:14458-14462.
Cavalli JF, Tomi F, Bernerdini AF, Casanova J. 2002. Chemical variability of the essential oil of helichrysum faradifani Sc. Ell. From Madagascar. J Flavour Fragr
21:111-114.
Choi MY, Choi W, Park JH, Lim J, Kwon SW. 2010. Determination of coffee origin by integrated metabolomic approach of combining multiple analytical data. Food Chem 121:1260-1268.
Darusman LK, Heryanto R, Rafi M, Wahyuni WT. 2007. Potensi daerah sidik jari spektrum inframerah sebagai penanda bioaktivitas ekstrak tanaman obat. J Ilmu Pertan Indones 12:154-162.
Deibler KD, Acree TE. Lavin EH. 1998. Aroma analysis of coffrr brew by gas chromatographyoldfactometry.Develop in Food Sci 40:69-78.
Derwich E, Benzinane Z, Taouil R. 2010. GC/MS analysis of volatile compounds of essential oil of the leaves of Mentha pulegium growing in Marocco. Chem Bull Politehn Univ 55:69.
Dob T, Dahmane D. Berraamdane T, Chelghoum C. 2005. Chemical composition of the essential oil of
Dobson G et al. 2010. A metabolomics study of cultivated potato (Solanum tuberosum) groups Andigena, Phureja, Strnotomum, and Tuberosum using gas chromatography-mass spectrometry. J Agricl food chem 58:1214-1223.
Fanciullino et al. 2005. Effects of nucleo-cytoplasmic interactions on leaf volatile compounds from Citrus somatic diploid hybrids. J Agric Food Chem 53:4517-4523.
Hubschman HJ. 2009. Handbook of GC/MS: Fundamentals and Applications. Weinheim: J Wiley.
Khalighli SF, Hadijiakhoondi A, Shahverdi AR, Mozaffarian VA, Shafiee A. 2005. Chemical composition and antimicrobial activity of the essential oil of Ferulago Bernardii Tomk. And M. Pimen. Daru
13:100-104.
Khopkar SM. 2002. Konsep Dasar Kimia Analitik. Jakarta: UI Pr.
Kim EJ et al. 2011. Metabolite profiling of
Angelica gigas from different geographical origin using 1H NMR and UPLC-MS analyses. J of Agricl Food Chem 59: 8806-8815.
Krastanov A. 2010. Matabolomics the state of art. Biotechnol & Biotechnol 24:1537-1543.
Kurniawan A. 2011. Aktivitas antioksidan dan potensi hayati dari kombinasi ekstrak empat jenis tanaman obat Indonesia [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
Li S et al. 2011. Chemical composition and product quality control of turmeric (Curcuma longa L.). Pharm Crops 2:28-54.
Marongiu B, Piras A, Porcedda S, Scorciapino A. 2005. Chemical composition of the essential oil and supercritical CO2 extract of commipohora myrrho (Ness) engl. and of Acorus calamus L.J Agric Food Chem
53:7939-7943.
Mayer BN et al. 1982. Brine shrimp: aconvenient general bioassay for active
plant constituents. J of Medica plant Res
45:31-34.
Meilani SW. 2006. Uji bioaktivitas zat ekstraktif kayu suren (Toona sureni Merr.) dan ki bonteng (Platea latifolia BL.) menggunakan brine shrimp lethality test (BLST) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Mierendorff HG, Stahl E, Posthumus MA. Van Beek TA. 2008. Composition of commercial cape chamomile oil (Eriocephalus punctuatus / Eriocephalus tenuifolius). http://www.chemische-analysenhamburg.de/Publikationen?Capeh amomileoil/. [23 September 2012].
Miller JN, Miller JC. 2000. Statistics and Chemometrics for Analytical Chemistry, 4th Edition. England: Pearson Education.
Monser HR, Karamkhani F, Nickayar B, Abdi K, Faramarzi MA. 2007. The volatile constituents of dracocephalum kotschyi oils. Chem Nat Comp 43:40-43.
Negueruela V et al. 2005. Analysis by chromatography-mass spectrometry of the essential oils from the aerial parts of
Pimpinella anagodendron Bolle. and
Pimpinella rupicola Svent., two endemic species to the Canary Islands, Spain. J Chromatogr A 1095:180-184.
Nurhayati APD, Nurlita A, Rachmat F. 2006. Uji toksisitas ekstrak Euchema alvarezil
terhadap Artemia sallina sebagai studi pendahuluan potensi antikanker. Surabaya: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Sepuluh November.
Oei BL, Apsarton Y, Puspa S, Widjaja T. 1985. Beberapa Aspek Isolasi, Identifikasi, dan penggunaan komponen-komponen Curcuma xanthorrhiza Roxb. dan Curcuma domestica Vahl. Bandung: Darya Varia Laboratoria
.
Pandiangan M. 2009. Stabilitas antimikroba ekstrak temulawak (Curcuma xanthorrhiza
Roxb.) terhadap mikroba patogen. Medika Unika 73 :365-373.
Pinarosa A, Gaspare G. 2004. Determination
under different extraction conditions. J of Pharma Biol 42:83-89.
Pitarokili D, Tzakou O, Loukis A, Harvala C. 2003. Volatile metabolites from Salvia Fruticosa as antifungal agents in soilborne pathogens. J Agric Food Chem 51:3294-3301.
Pripdeevech P, Wongpornchai S, Promsiri A. 2006. Highly volatile constituents of
Vetiveria zizanioides roots grown under different cultivation conditions. Molecules
11:817-826.
Rahardjo M, Rostiana O. 2005. Budidaya Tanaman Temulawak. Bogor: Balai Penelitian Tanaman Obat dan Aromatika.
Raina VK, Srivastava SK, Syamasunder KV. 2002.The essential oil of „greater galangal‟ [Alpinia galangal (L.) Willd] from the lower Himalayan region of India. J Flavour Fragr 17:358-360.
Raina VK et al. 2002. The essential oil composition of Curcuma longa L. cv. Roma from the plains of Northern India.J Flavour Fragr 17:99-102.
Ramezani M, Behravan J, Yazdinezhad A. 2004. Chemical composition and antimicrobial activity of volatile oil of
Artemisia horassanica from Iran. Pharm Biol 42:599-602.
Ravindran PN, Babu KN, Ivaraman K. 2007.
Turmeric The Genus Curcuma. New York: CRC Pr.
Sarkhail P, Amin G, Surmaghi MHS, Shafiee A. 2005. Composition of the volatile oils of phlomis lanceolata boiss. & hohen. phlomis anisodonta boiss. and phlomis bruguieri desf. from Iran. J Flavour Fragr
20:327-329.
Sears B. 2005. The Anti-Inflammation Zone—
Reversing the Silent Epidemic That’s
Destroying Our Health. New York: Harper & Row.
Sefidkon F, Jamzad Z, Mirza M. 2006. Chemical composition of the essential oil of five Iranian Nepeta species (N. crispa, N. mahanensis, N. ispahanica, N. eremophila and N. rivularis). J Flavour Fragr 21:764-767.
Siani AC, Garrido IS, Monteiro SS, Carvalho ES, Ramos MFS. 2004. Protium icicariba as a source of volatile essences. Biochem Syst Ecol 32:477-489.
Sidik, Muhtadi A, Mulyono MW. 1992.
Temulawak (Curcuma xanthorrhiza
Roxb.). Bandung: Yayasan Pengembangan Obat Bahan Alam.
Sugiharto. 2004. Pengaruh infus rimpang temulawak (Curcuma Xanthorriza Roxb.) terhadap kadar hemoglobin dan jumlah eritrosit tikus putih yang diberi larutan timbal nitrat [Pb(NO3)2]. Hayati 10:53-57.
Supriyadi D. 2008. Optimalisasi ekstraksi kurkuminoid temulawak (Curcuma xanthorriza Roxb.) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Tayoub G et al. 2006. Composition of volatile oils of Styrax (Styrax officinalis L.) leaves at different phenological stages. Biochem Syst Ecol 34:705-709.
Tianniam S, Tarachiwin L, Bamba T, Kobayashi A, Fukusaki E. 2008. Matabolomic profiling of Angelica acutiloba roots utilizing gas chromatography-time-of-flight-mass. spectrometry for quality assessment based on cultivation area and cultivar via multivariate pattern recognition. J of Biosci bioeng 105:655-659.
Torras L et al. 2009. Metabolic profiling of bioactive Pancratium canariense extracts by GC-MS. Phytochemistry Anal 21:80– 88.
Vujisic et al. 2006. Comparative examination of the essential oils of Anthemis ruthenica
and a-arvensis wild-growing in Serbia. J Flavour Fragr 21:458-461.
Widiastuty W. 2006. Teknik spektroskopi Inframerah transformasi fourier untuk penentuan profil kadar xantorizol dan aktivitas antioksidan temulawak [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Winarno FG. 1992. Kimia Pangan dan Giji. Jakarta: PT Gramedia.
Xiang Z, Wang X, Cai X, Zeng S. 2011. Metabolomics study on quality control and discrimination of three curcuma species based on gas chromatograp-mass spectrometry. Phytochemistry Anal
22:411-418.
Lampiran 1 Bagan alir penelitian
Kadar air
Kadar abu
Simplisia
Ekstrak temulawak
Analisis dengan GC-MS
Data kromatogram GC-MS
Evaluasi metabolit temulawak
Analisis PCA dengan
software
The
Unscrambler
Analisis
peak area
terpilih
Interpretasi profil metabolit
temulawak
Klasifikasi Metabolit
Indeks Retensi
(IR)
Jalur
biosintesis
Curcumin
Senyawa Penanda
Lampiran 2 Hasil kadar air rimpang temulawak
Sampel Ulangan
Bobot cawan
Bobot contoh
Bobot campel
setelah Kadar Rerata Standar Deviasi kosong
(g)
awal (a) (g)
pengeringan (b) (g)
air (%)
kadar air(%) Bogor 1 1.9911 2.0006 3.6550 16.83
2 1.9508 2.0016 3.6081 17.20 17.03 0.19 3 1.9287 2.0009 3.5880 17.07
Sragen 1 1.9728 2.0001 3.6326 17.01
2 1.9761 2.0011 3.6415 16.78 16.89 0.12 3 1.9451 2.0007 3.6082 16.87
Sukabumi 1 1.9227 2.0009 3.5569 18.33
2 1.9274 2.0030 3.5554 18.72 19.54 1.77 3 2.0138 2.0007 3.5827 21.58
Wonogiri 1 1.9083 2.0008 3.5504 17.93
2 1.9828 2.0007 3.6269 17.82 17.97 0.17 3 1.9653 2.0008 3.6029 18.15
Karanganyar 1 1.9297 2.0000 3.5760 17.69
2 1.9639 2.0008 3.6590 15.28 19.95 1.45 3 2.0331 2.0002 3.6755 17.89
Contoh perhitungan
Penentuan kadar air Bogor Ulangan 1
Kadar air
= -100
Keterangan:
A= bobot contoh awal (g)
B= bobot contoh kering (g)
Kadar air =
-
= 16.83%
Penentuan rerata kadar air
Kadar air rerata =
=17.03%
Penentuan standar deviasi kadar air serbuk rimpang temulawak Bogor
SD =
√∑
| ̅|
=
√
- - -Lampiran 3 Hasil kadar abu rimpang temulawak
Sampel Ulangan
Bobot cawan
Bobot sampel
Bobot sampel
setelah Kadar abu (%)
Rerata kadar abu (%)
Standar deviasi kosong
(g)
awal (a) (g)
pengeringan (b) (g)
Bogor 1 26.0588 2.0004 26.1659 5.35
2 29.4124 2.0001 29.5198 5.37 5.43 0.11 3 28.4427 2.0006 28.5539 5.56
Sragen 1 29.7378 2.0002 29.9146 8.84
2 29.9066 2.0005 30.0845 8.89 8.78 0.15 3 29.2027 2.0009 29.3799 8.61
Sukabumi 1 30.6189 2.0006 30.7552 6.81
2 27.5423 2.0003 27.6800 6.88 6.75 0.17 3 30.5153 2.0001 30.6464 6.55
Wonogiri 1 30.3299 2.0007 30.4807 7.54
2 30.3780 2.0008 30.5241 7.30 7.41 0.12 3 28.8347 2.0006 28.9825 7.39
Karanganyar 1 28.2289 2.0009 28.3654 6.82
2 26.7687 2.0002 26.9040 6.76 6.82 0.06 3 28.0541 2.0004 28.1921 6.89
Contoh perhitungan
Penentuan kadar abu Bogor Ulangan 1
Kadar abu =
Keterangan:
A= bobot contoh awal (g)
B= bobot abu (g)
Kadar abu =
× 100% = 5.35%
Penentuan rerata kadar abu
Kadar abu rerata =
=5.43%
Penentuan standar deviasi kadar air serbuk rimpang temulawak Bogor
SD =
√∑
| i-̅|β
n-1
i n
i 1
=
√
- - -Lampiran 4 Rendemen ekstrak etil asetat rimpang temulawak
Sampel
Bobot sampel awal (g)
Kadar air (%)
Bobot ekstrak (%)
Rendemen (%)
Bogor 10.0004 17.03 0.7785 9.38 Sragen 10.0012 16.89 0.7302 8.78
Sukabumi 10.0012 19.54 0.7942 9.87
Wonogiri 10.0007 17.97 0.7255 8.84 Karanganyar 10.0011 19.95 0.7836 9.78
Contoh perhitungan
Ulangan 1
Rendemen (%) =
obot sampel awal obot sampel akhir(1-kadar air)
100
=
( - )
= 9.38%
Lampiran 5 Hasil uji ANOVA
ANOVA
VAR00002
Sum of Squares df Mean Square F Sig.
Between Groups 1214.188 4 303.547 240.954 0.000
Within Groups 6.299 5 1.260
Total 1220.486 9
Lampiran 6 Hasil uji Duncan
VAR00002
VAR00001 N
= 0.05
a b c d
Sragen 2 21.1500
K.Anyar 2 21.5050
Bogor 2 28.2100
Wonogiri 2 32.0000
Sukabumi 2 51.2800
Lampiran 7 Dugaan senyawa hasil identifikasi GC-MS
RT
IR
Senyawa
Bgr 1
Krg 1
Skb 1
Srg 1
Wrg 1
7.667 1023 Cineolea 0.0404 0.0464 0.0593 0.0281 0.0447
7.793 1027 dl-limonene 0.0551 0.0258 0.0300 0.0177 0.0320
9.277 1066 o-guaiacola 0.0605 0.0328 0.0389 0.0461 0.0585
10.291 1090 -linaloola 0.0279 0.0215 0.0239 0.0126 0.0232
10.506 1094 1-methyl-4- 0.0100 0.0268 0.0177 0.0064 0.0250 sec-butylbenzene
11.098 1111 Camphor (CAS)a,b 1.6222 1.5515 1.5717 1.2955 1.6146
11.462 1123 Champhene hydrate 0.0943 0.0813 0.0943 0.0780 0.0920
11.605 1128 d-camphor 0.0582 0.0879 0.0770 0.0719 0.0573
11.819 1135 Isoborneola 0.1891 0.1878 0.1972 0.1583 0.1843
12.113 1144 1-borneolb 0.1332 0.1332 0.1296 0.0980 0.1177
12.279 1149 Isoborneola 0.0081 0.0126 0.0083 0.0073 0.0063
12.544 1157 4-terpinenola 0.0132 0.0134 0.0145 0.0109 0.0125
12.931 1168 α-terpineol 0.0441 0.0368 0.0418 0.0332 0.0378
16.298 1278 2-metoxy-4- 0.4793 0.5103 0.4575 0.4558 0.6036
vinyl-phenola
17.627 1326 δ-eIemenea 0.3159 0.2803 0.3330 0.2956 0.2556
17.753 1331 δ-eIemenea 0.0119 0.0139 0.0155 0.0174 0.0095
17.967 1339 δ-eIemenea 0.0091 ______ ______ ______ 0.0068
18.497 1359 1,1-Cyclolohexaned- 0.0409 0.0385 0.0452 0.0190 0.0502
dimethanol
18.603 1363 α.-copaenea 0.0431 0.0353 0.0420 0.0305 0.0467
18.799 1370 -elemenea 0.0232 0.0405 0.0423 0.0413 0.0271
19.006 1377 (-)- -elemenea 0.7355 0.7443 0.8427 0.7462 0.5885
19.089 1380 2-norpinene 0.1913 0.1924 0.1952 0.2029 0.1886
19.175 1384 α-zingibereneb 0.0057 0.0072 0.0061 0.0073 0.0059
19.504 1395 α-zingibereneb 1.3590 1.1860 1.4180 1.2514 1.2916
19.594 1398 Caryophyllenea 0.6289 0.6978 0.7164 0.6683 0.5671
19.873 1410 (+/-)- -muurolene 0.0713 0.0738 0.0754 0.0718 0.0554
20.056 1418 δ-elemenea 1.0990 1.2677 1.4265 1.4945 0.8988
20.2 1424 2-norpinene 0.0557 0.0569 0.0570 0.0528 0.0137
20.34 1430 α-gurjunene 0.1372 0.0977 0.1401 0.0829 0.0595
20.774 1447 (E)- -famesenea 2.1852 2.0151 2.2289 2.0975 2.1705
21.289 1468 α-curcumenea,b 10.2800 10.7272 10.6332 10.9269 10.2562
21.464 1475 Curzereneb 1.2022 0.2700 0.7762 1.7559 ______
21.504 1477 α-selinenea ______ 0.2432 ______ ______ 0.4687
21.647 1482 -elemene 1.3007 0.8344 1.2097 1.1694 0.9109
22.115 1500 α-cedrene 12.9701 11.9840 12.7244 13.1354 13.0798
22.355 1511 Spathulenol 0.3731 ______ ______ 0.3170 0.3672
22.834 1532 Germacrene Ba 3.3414 2.8236 3.1016 3.1262 3.0473
23.226 1549 Diethyl phtalatea 0.2720 0.3357 0.3154 0.2585 0.3253
23.736 1571 -elemenone 1.2267 1.9830 1.5897 1.7930 1.2699
23.967 1581 Cedren-13-ol, 8- 0.4960 0.5029 0.5348 0.4850 0.5066
24.744 1615 -eudesmola 1.0884 1.0875 1.0864 1.0118 1.0292
25.667 1658 Germacronea,b 7.7634 5.9537 8.2829 6.2098 7.3198
26.142 1679 (-)-dehydroaroma ______ 0.6548 ______ ______ ______
dendrene
26.338 1688 (S)-(+)- 2.2432 1.6334 2.3565 2.2213 2.1675
curcuphenol
27.218 1730 Xanthorrizola,b 15.6441 15.7644 14.6956 16.1332 16.7531
27.937 1764 Cembrene 0.5850 0.5578 0.9261 0.5202 0.5592
28.061 1770 Germacrone 0.5252 0.5614 ______ 0.4937 0.3840
28.404 1786 -elemene 1.6965 1.4658