PEMROFILAN METABOLIT RIMPANG
TEMULAWAK MENGGUNAKAN
KROMATOGRAFI GAS-SPEKTROSKOPI MASSA
RIZKI SEPTIANI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
RIZKI SEPTIANI. Pemrofilan Rimpang Temulawak Menggunakan Kromatografi
Gas-Spektroskopi Massa. Dibimbing oleh RUDI HERYANTO dan LATIFAH K
DARUSMAN.
Penelitian ini bertujuan mengidentifikasi metabolit pada rimpang
temulawak dan mendiskriminasi penyebaran rimpang temulawak dari 5 daerah
sentral produksi di Jawa: Bogor, Karanganyar, Sukabumi, Ngawi, dan Wonogiri.
Sampel diekstraksi dengan SPME (ekstraksi mikro fase padat) kemudian
dianalisis menggunakan GC-MS (kromatografi gas-spektroskopi massa). Senyawa
yang berhasil diidentifikasi dan dikonfirmasi untuk daerah Bogor, Karanganyar,
Sukabumi, Ngawi, dan Wonogiri berturut-turut sebanyak 36, 40, 44, 44, 47
senyawa dengan komponen dominannya adalah
α
-Cedrene (18-21%),
α
-Curcumene (15-19%), Xanthorrhizol (6-9%), dan Germacrone (5-7%). Metabolit
yang diduga sebagai penanda adalah α
-Cedrene dan
–
Sesquiphellandrene.
Pengujian aktivitas antioksidan dengan metode DPPH
(2,2-diphenyl-1-picrylhydrazil) terhadap ekstrak etil asetat rimpang temulawak membagi sampel
menjadi 4 kelompok, sedangkan diskriminasi rimpang temulawak dari asal
geografis berbeda menggunakan PCA (analisis komponen utama) membagi
sampel menjadi 3 kelompok. Oleh karena itu, komposisi metabolit rimpang
temulawak tidak dapat dikaitkan dengan aktivitas antioksidannya.
Kata kunci: temulawak, SPME, GC-MS, DPPH, PCA.
ABSTRACT
RIZKI SEPTIANI. Metabolite Profiling of
Temulawak
Rhizome Using Gas
Chromatography-Mass Spectroscopy. Supervised by RUDI HERYANTO and
LATIFAH K DARUSMAN.
The aim of this study was to identify metabolites in temulawak rhizome
and to discriminate the spread of temulawak rhizome from 5 central production
areas in Java: Bogor, Karanganyar, Sukabumi, Ngawi, and Wonogiri. The samples
were extracted by SPME (solid phase micro extraction) then were analyzed using
GC-MS (gas chromatography mass spectroscopy). Compounds that have been
identified and confirmed to Bogor, Karanganyar, Sukabumi, Ngawi, and Wonogiri
were 36, 40, 44, 44, 47 components, respectively, and the dominant compounds
were
α
-Cedrene (18-
β1%), α
-Curcumene (15-19%), Xanthorrhizol (6-9%), and
Germacrone (5-7%). The metabolites that suspected as markers were
α
-Cedrene
and
–
Sesquiphellandrene. Antioxidant activity assay using DPPH
(2,2-diphenyl-1-picrylhydrazil)
method to ethyl acetate extract of
temulawak
rhizome fell into 4
groups, while the discrimination from different geographical origins using PCA
(principal component analysis) fell into 3 groups. Therefore, metabolite
composition of the
temulawak
rhizome could not be related with its antioxidant
activity.
PEMROFILAN METABOLIT RIMPANG
TEMULAWAK MENGGUNAKAN
KROMATOGRAFI GAS-SPEKTROSKOPI MASSA
RIZKI SEPTIANI
Skripsi
Sebagai syarat untuk memperoleh gelar
Sarjana Sains
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi: Pemrofilan Metabolit Rimpang Temulawak Menggunakan
Kromatografi Gas-Spektroskopi Massa
Nama
: Rizki Septiani
NIM
: G44080028
Disetujui oleh
Rudi Heryanto, S.Si., M.Si.
Prof. Dr. Ir. Latifah K Darusman, MS
NIP 19760428 200501 1 002
NIP 19530824 197603 2 003
Diketahui oleh
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas limpahan rahmat
dan hidayah-Nya sehingga penulis dapat menyelesaikan karya ilmiah dengan
judul
Pemrofilan Metabolit Rimpang Temulawak Menggunakan Kromatografi
Gas-Spektroskopi Massa. Penelitian ini dilaksanakan pada bulan Maret-Agustus
2012 di Laboratorium Kimia Analitik Departemen Kimia Fakultas Matematika
dan Ilmu Pengetahuan Alam, IPB.
Selama melaksanakan kegiatan penelitian dan menyusun karya ilmiah,
penulis banyak mendapat bimbingan dan bantuan dari berbagai pihak. Oleh
karena itu, penulis mengucapkan terima kasih kepada Bapak Rudi Heryanto S. Si,
M.Si selaku pembimbing pertama dan Ibu Prof. Dr. Ir. Latifah K Darusman M.S
selaku pembimbing kedua, atas saran, bimbingan, dan ilmu yang telah diberikan
kepada penulis. Ucapan terima kasih disampaikan kepada tim riset metabolomik
Pusat Studi Biofarmaka LPPM IPB Bagian Analitik yang telah melibatkan penulis
dalam tema penelitian ini. Ucapan terima kasih juga penulis sampaikan kepada
seluruh staf Laboratorium Kimia Analitik dan para pegawai di Pusat Studi
Biofarmaka atas fasilitas dan bantuan yang diberikan selama penelitian. Terima
kasih juga kepada teman-teman dengan tema penelitian yang sama dengan
penulis, yaitu Septhia Rachmawati, Annisa, dan Aeni Anggraini Pralupi atas kerja
sama dan masukan yang diberikan selama mengerjakan tugas akhir.
Semoga karya ilmiah ini bermanfaat dalam bidang ilmu pengetahuan.
Bogor, November 2012
RIWAYAT HIDUP
Penulis dilahirkan di Kuala Simpang, Aceh Tamiang, NAD pada tanggal
16 September 1990 dari pasangan Ramlan dan Nursyahniar. Penulis merupakan
anak ketiga dari enam bersaudara. Abang penulis bernama Rukma, kakak penulis
bernama Rufinna, dan ketiga orang adik penulis bernama Ramanda, Nurrizka, dan
Rieswana.
Tahun 2008 penulis lulus dari SMA Patra Nusa Rantau, Aceh Tamiang,
NAD dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan
Seleksi Masuk IPB. Penulis memilih Program Studi Kimia, Departemen Kimia,
Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA ... 2
Temulawak ... 2
Uji Aktivitas Antioksidan dengan Metode DPPH ... 2
Studi Metabolomik ... 3
SPME (ekstraksi mikro fase padat) ... 4
Kromatografi Gas-Spektroskopi Massa (GC-MS) ... 5
Kemometrik ... 5
PCA (analisis komponen utama) ... 5
METODE ... 6
Bahan ... 6
Alat ... 6
Lingkup Penelitian ... 6
HASIL DAN PEMBAHASAN ... 8
Analisis Metabolit Rimpang Temulawak ... 8
Aktivitas Antioksidan Ekstrak Etil Asetat Rimpang Temulawak ... 12
Diskriminasi Rimpang Temulawak dengan PCA Berdasarkan Komposisi
Metabolit ... 14
Hubungan Komposisi Metabolit Rimpang Temulawak dengan Aktivitas
Antioksidannya ... 16
Potensi Senyawa Penanda Dalam Pengelompokan Rimpang Temulawak ... 16
SIMPULAN DAN SARAN ... 16
Simpulan ... 16
Saran ... 16
DAFTAR PUSTAKA ... 17
DAFTAR TABEL
Halaman
1
Spesifikasi dan kondisi alat GC-MS Shimadzu QP 2010 ... 6
2
Komposisi senyawa kimia dari lima sampel ekstrak SPME rimpang
temulawak ... 9
3
Hasil penentuan kadar air, kadar abu, dan rendemen ... 11
DAFTAR GAMBAR
Halaman
1
Rimpang temulawak ... 2
2
Struktur kurkuminoid ... 2
3
Struktur xanthorrhizol ... 2
4
Struktur DPPH dan reaksinya dengan antioksidan ... 3
5
Skema alat SPME ... 4
6
Mekanisme ekstraksi dan desorbsi menggunakan SPME ... 5
7
Analisis komponen utama (PCA) ... 6
8
Profil kromatogram ekstrak SPME rimpang temulawak hasil
analisis menggunakan GC-MS ... 9
9
Struktur kimia senyawa dominan ... 9
10
Grafik empat senyawa dominan pada lima sampel rimpang temulawak ... 12
11
Nilai IC
50hasil uji aktivitas antioksidan menggunakan metode DPPH ... 13
12
Skor plot dua PC pertama kromatogram utuh tanpa perlakuan
pendahuluan ... 14
13
Skor plot dua PC pertama kromatogram yang telah direduksi ... 15
14
Skor plot dua PC pertama kromatogram yang telah direduksi dan
dihilangkan pencilannya ... 15
DAFTAR LAMPIRAN
Halaman
1
Bagan alir penelitian ... 22
2
Pengolahan data kromatogram menggunakan program AMDIS ... 23
3
Pengolahan data kromatogram menggunakan program The Unscrambler ... 24
4
Kromatogram kelima sampel rimpang temulawak hasil analisis
menggunakan GC-MS ... 26
5
Peta keberagaman metabolit sekunder genus Curcuma ... 27
6
Kadar air sampel rimpang temulawak ... 28
7
Kadar abu sampel rimpang temulawak ... 28
8
Rendemen ekstrak kasar rimpang temulawak ... 29
9
Larutan sampel ekstrak rimpang temulawak setelah diinkubasi 37 °C
selama 30 menit ... 29
10
Aktivitas antioksidan ekstrak etil asetat rimpang temulawak ... 29
11
Analysis of Variance
(ANOVA) nilai IC
50ekstrak etil asetat rimpang
temulawak ... 31
PENDAHULUAN
Temulawak (Curcuma xanthorrhiza Roxb) merupakan tanaman asli Indonesia yang banyak ditemukan terutama di Jawa Barat, Jawa Tengah, Jawa Timur, DKI Jakarta, Yogyakarta, Bali, Sumatera Utara, Riau, Jambi, Kalimantan Barat dan Kalimantan Timur, Sulawesi Utara dan Sulawesi Selatan. Rimpang temulawak telah dimanfaatkan oleh industri obat tradisional sebagai jamu, herbal terstandar, dan obat fitofarmaka (Rahardjo 2010). Manfaat rimpang ini antara lain sebagai antioksidan, antiinflamasi, antibakteri, antihepatotoksik, antikolesterol, dan antikanker (Sidik 2006). Mutu tanaman obat ini dapat dilihat dari kandungan senyawa aktif kimia yang dimilikinya. Salah satu komponen aktif yang bertanggung jawab terhadap respon biologis pada rimpang temulawak adalah kurkuminoid dan xanthorrhizol (Hwang et al. 2004). Perbedaan komposisi senyawa kimia yang terdapat pada rimpang temulawak dapat menghasilkan aktivitas biologis yang berbeda. Keragaman komposisi metabolit ini dapat dipengaruhi oleh kondisi pertumbuhan termasuk daerah asal tanaman, jenis tanah yang berbeda, lingkungan budidaya yang beragam, serta waktu panen dan ketinggian yang berbeda (Yi et al. 2007. Untuk mendapatkan mutu bahan yang konsisten dalam rimpang temulawak, diperlukan suatu teknik analisis yang mampu mengidentifikasi metabolit dalam rimpang temulawak dengan kondisi agrobiofisik yang berbeda.
Studi metabolomik dapat digunakan sebagai pendekatan dalam proses identifikasi dan kuantifikasi metabolit yang terdapat pada rimpang temulawak secara keseluruhan. Metabolomik telah digunakan untuk menguji kualitas dan diskriminasi Pericaprium Citri Reticulatae dan Pericaprium Citri Reticulatae Viride (Yi et al. 2007), Citrullus lanatus (Tarachiwin et al. 2008), dan total flavonoid pada buckthorn (Lan et al. 2010). Studi metabolomik yang dikaitkan dengan bioaktivitas tanaman obat juga telah dilakukan terhadap ekstrak bioaktif Pancratium canariense (Torras et al. 2009) dan Arctium lappa (Ferracane et al. 2010).
Studi metabolomik dapat dijelaskan menggunakan pemrofilan metabolit. Pemrofilan dilakukan untuk mengidentifikasi metabolit yang ada pada organisme (Sun 2012). Teknik utama yang digunakan untuk pemrofilan metabolit adalahkromatografi gas-spektroskopi massa (GC-MS), kromatografi
cair-spektroskopi massa (LC-MS), kromatografi cair-spektroskopi massa/ spektroskopi massa (LC-MS/MS), dan elektroforesis kapiler-spektroskopi massa (CE/MS) (Halket et al. 2005).
Teknik yang digunakan pada penelitian ini adalah GC-MS. Saat ini GC-MS merupakan teknik analisis yang banyak digunakan karena memiliki sensitivitas dan resolusi yang tinggi, serta menghasilkan keterulangan yang baik. Keuntungan lain dari teknik GC-MS adalah mudah dalam menggunakan instrumennya dan biaya operasinya relatif murah (Theodoridis et al. 2012). Senyawa yang terkandung dalam ekstrak rimpang temulawak yang telah dianalisis dengan GC-MS diidentifikasi dengan mencocokkan spektrum massa dan indeks retensi Kovats dengan library atau database koleksi NIST (national institute of science and tecnology) menggunakan bantuan perangkat lunak AMDIS (automated mass spectral deconvolution and identification system). Indeks retensi Kovats dihitung dengan menggunakan standard hidrokarbon n -alkana.
Data yang diperoleh dari GC-MS berupa kromatogram dan spektrum massa dan merupakan suatu set data multivariat yang berukuran besar. Untuk mendapatkan hubungan antara komposisi senyawa dan kondisi agrobiofisik, diperlukan serangkaian teknik kemometrik yang dapat mengubah data tersebut menjadi informasi yang diinginkan. Data diolah menggunakan teknik analisis pengenalan pola, yaitu PCA (analisis komponen utama) menggunakan perangkat lunak The Unscrambler. PCA digunakan untuk memperoleh gambaran dan mendiskriminasi penyebaran sampel rimpang temulawak dari kondisi agrobiofisik yang berbeda.
Curcuma tersebut berdasarkan asal geografisnya.
Penelitian ini bertujuan melakukan pemrofilan metabolit rimpang temulawak dari lima daerah sentral produksi temulawak di Jawa, yaitu Bogor, Karanganyar, Sukabumi, Ngawi, dan Wonogiri, menggunakan GC-MS yang dikombinasikan dengan teknik PCA. Dilakukan juga pengujian aktivitas antioksidan dengan metode DPPH (2,2-diphenyl-1-picrylhydrazil) agar studi metabolomik terhadap rimpang temulawak dapat dikaitkan dengan bioaktivitasnya. Evaluasi lebih lanjut dari hasil analisis PCA dapat dilakukan untuk mendapatkan senyawa penciri.
TINJAUAN PUSTAKA
Temulawak
Temulawak termasuk ke dalam divisi Spermatophyta, subdivisi Angiospermae, kelas Monocotyledonae, ordo Zingiberales, famili Zingiberaceae, genus Curcuma, dan spesies Curcuma xanthorrhiza Roxb. (Purseglove et al. 1981). Secara umum, tanaman ini memiliki daya adaptasi yang tinggi terhadap berbagai cuaca di daerah beriklim tropis. Suhu udara yang baik untuk budi daya tanaman ini antara 19-30°C. Tanaman ini memerlukan curah hujan tahunan antara 1000-4000 mm/tahun.
Kandungan rimpang temulawak segar dapat dibedakan atas pati (48-59.64%), kurkuminoid (1.6-2.2%) dan minyak atsiri (1.48-1.63%) (Sidik 2006). Minyak asiri berupa cairan berwarna kuning atau kuning jingga, berbau aromatik tajam. Komposisinya bergantung pada umur rimpang, tempat tumbuh, teknik isolasi, teknik analisis, perbedaan varietas dan sebagainya (Hernani 2001). Kandungan utama dalam minyak atsiri temulawak adalah xanthorrhizol, germakren, trisiklin, dan alpha-aromadendren.
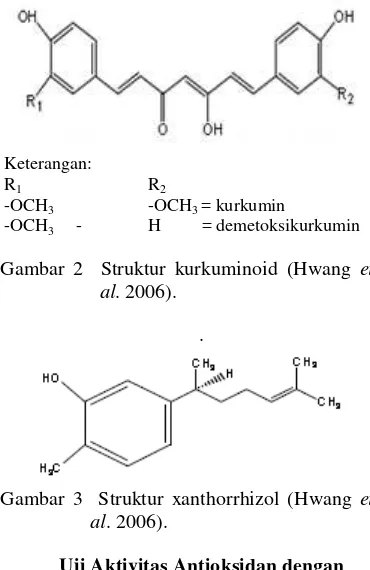
Rimpang temulawak memiliki beberapa efek farmakologi, antara lain sebagai anti-inflamasi (anti radang), antihiperlipidemia (penurun lipida darah), kholagogum (me-rangsang pengeluaran produksi cairan empedu), hepatoprotektor (mencegah pe-radangan hati), laxatif atau pencahar, diuretik untuk peluruh kencing, dan juga stomakikum (memacu nafsu makan) (Sidik 2006). Manfaat lain temulawak adalah untuk melancarkan ASI pada ibu yang sedang menyusui, bermanfaat untuk membersihkan darah dan juga menghilangkan nyeri pada persendian. Aktivitas farmakologi dari rimpang temulawak tersebut disebabkan oleh komponen aktif berupa kurkuminoid dan xanthorrhizol (Hwang et al. 2006).
Gambar 2 Struktur kurkuminoid (Hwang et al. 2006).
.
Gambar 3 Struktur xanthorrhizol (Hwang et al. 2006).
Uji Aktivitas Antioksidan dengan Metode DPPH
Antioksidan adalah senyawa kimia yang dapat menyumbangkan satu atau lebih elektron kepada radikal bebas, sehingga radikal bebas tersebut dapat diredam. Penentuan aktivitas antioksidan rimpang temulawak dapat dilakukan salah satunya dengan metode penangkapan DPPH (2,2-diphenyl-1-picrylhydrazil) yang merupakan aplikasi dari metode radical-scavenging (Blois 1958). DPPH adalah suatu radikal stabil yang dapat bereaksi dengan radikal lain membentuk suatu senyawa yang stabil atau bereaksi dengan atom hidrogen (yang berasal Gambar 1 Rimpang temulawak.
Keterangan:
R1 R2
-OCH3 -OCH3 = kurkumin
3
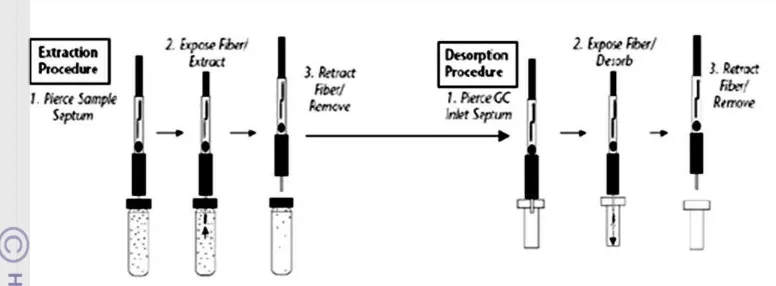
dari suatu antioksidan) membentuk DPPH tereduksi (DPPH-H). Metode ini merupakan metode penangkapan radikal yang mudah dan akurat dengan kehandalan untuk mengukur kapasitas antioksidan suatu sampel, serta memilki teknik yang sederhana (Blois 1958).
DPPH yang telah mencapai keadaan stabil akibat peranan antioksidan yang diujikan, diukur absorbansinya pada panjang gelombang maksimum DPPH. Nilai absorbansi yang terukur akan mengalami penurunan dibandingkan blanko karena adanya reduksi oleh antioksidan ataupun bereaksi dengan radikal dalam mekanisme pemutusan rantai autooksidasi. Larutan DPPH berwarna ungu, sedangkan DPPH tereduksi tidak memiliki absorpsi maksimum pada panjang gelombang sinar tampak (Gambar 4). Dengan demikian, semakin kuat aktivitas antioksidan suatu senyawa, maka semakin pudar warna ungu yang dihasilkan. Aktivitas penangkapan radikal bebas dinyatakan sebagai % inhibisi DPPH atau % aktivitas penangkapan DPPH radikal.
IC50 merupakan bilangan yang
menunjukkan konsentrasi ekstrak yang menyebabkan hilangnya 50% aktivitas DPPH. Nilai IC50 dianggap sebagai ukuran yang baik
dari efisiensi antioksidan senyawa murni ataupun ekstrak. Semakin kecil nilai IC50
berarti semakin tinggi aktvitas antioksidan.
Studi Metabolomik
Metabolomik merupakan salah satu
cabang penelitian ―omik‖ yang fokus pada
karakterisasi molekul metabolit dalam matriks biologis secara keseluruhan, melalui identifikasi profil metabolit total dalam suatu organisme (Krastanov 2010). Studi metabolomik dapat diaplikasikan pada sistem biologis, termasuk manusia, tanaman, dan mikroorganisme. Selain itu, studi metabolomik juga dapat diaplikasikan di bidang kesehatan, diagnostik, industri pangan,
maupun mikrobiologi.
Studi metabolomik terdiri atas beberapa langkah, yaitu pemrofilan, identifikasi, dan interpretasi. Pemrofilan dilakukan untuk menemukan semua metabolit yang ada pada organisme. Identifikasi adalah penentuan struktur kimia dari metabolit setelah pemrofilan (Krastanov 2010). Interpretasi merupakan langkah terakhir dalam alur kerja, dilakukan dengan membuat hubungan antara metabolit yang telah ditemukan dengan proses metabolisme.
Pemrofilan terdiri atas empat langkah, yaitu analisis sampel, menemukan fitur, nor-malisasi data, dan analisis statistik. Teknik utama yang digunakan untuk pemrofilan me-tabolit adalah kromatografi gas-spektroskopi massa (GC-MS), kromatografi cair-spektroskopi massa (LC-MS), kromatografi cair-spektroskopi massa/spektroskopi massa (LC-MS/MS), dan elektroforesis kapiler-spektroskopi massa (CE/MS) (Halket et al. 2005). Analisis sampel dengan GC-MS atau LC- MS diperlukan untuk memisahkan dan men-deteksi semua metabolit. Karena sifat kompleks dari sampel, pemisahan dilakukan untuk mempermudah deteksi metabolit sebanyak mungkin. Fitur khusus untuk meng-identifikasi semua metabolit menggunakan massa dan waktu retensi (Krastanov 2010).
Identifikasi dilakukan dengan mencocokkan spektrum massa dengan pustaka dan mencari basis data. Meskipun suatu senyawa dapat diketahui dengan mencocokkan spektrum massa dengan pustaka, namun terkadang terdapat senyawa yang memiliki spektrum yang mirip atau sama, sehingga diperlukan penentuan indeks retensi agar kedua senyawa tersebut dapat terbedakan (Krastanov 2010). Setelah metabolit diidentifikasi, perlu untuk memahami hubungan metabolit-metabolit tersebut melalui jalur biologis dalam metabolisme dengan menginterpretasikan hasil percobaan.
4
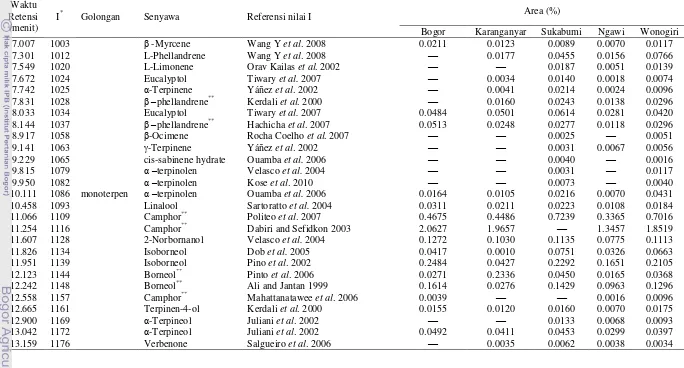
Gambar 5 Skema alat SPME (Vas & Ve´key 2004).
Studi metabolomik pada penelitian sebelumnya pernah dilakukan oleh Tianniam et al. (2008) terhadap metabolit Angelica acutiloba, oleh Torras et al. (2009) terhadap metabolit ekstrak bioaktif Pancratium canariense, oleh Dobson et al. (2010) terhadap Solanum tuberosum kelompok Andigena, Phureja, Stenotomum, dan Tuberosum, oleh Choi et al. (2010) terhadap biji kopi dari berbagai daerah, yaitu wilayah Asia, Amerika Utara, dan Afrika, oleh Kim Eun Jin (2011) terhadap Angelica gigags dari berbagai daerah di Korea, oleh Tanaka et al. (2011) terhadap metabolit taxoid yang berpotensi sebagai antikanker dari tanaman Taxus chinensis dengan variasi perbedaan umur tanaman, dan oleh Yang et al. (2012) terhadap akar Panax ginseng.
SPME (ekstraksi mikro fase padat)
Preparasi sampel merupakan tahap yang sangat penting dalam analisis karena sangat berpengaruh terhadap akurasi dan reabilitas dari waktu dan biaya analisis yang dikeluarkan. SPME merupakan metode ekstraksi yang sangat sederhana dan efisien serta tidak memerlukan pelarut. Metode ini ditemukan oleh Pawliszyn pada 1989. Metode SPME dapat digunakan secara rutin dikombinasikan dengan kromatografi gas, kromatografi cair kinerja tinggi, dan elektroforesis kapiler. Keuntungan paling utama yang diperoleh dari teknik SPME adalah dapat mereduksi waktu yang dibutuhkan untuk preparasi sampel, mengurangi biaya yang dikeluarkan untuk penggunaan pelarut, serta dapat meningkatkan limit deteksi (Pawliszyin 2001).
Alat SPME tediri dari syringe yang telah dimodifikasi dan tersusun oleh plunger yang
memungkinkan jarum syringe yang berisi fiber dapat diatur posisinya untuk keperluan ekstraksi dan desorbsi. Skema lengkap alat SPME terdapat pada Gambar 5. SPME menggunakan sorbent dalam jumlah kecil yang terdispersi pada permukaan fiber, untuk mengisolasi dan mengkonsentrasikan analat dari matriks sampel. Setelah kontak dengan matriks sampel, analat akan terabsorbsi atau teradsorbsi oleh fiber (bergantung pada jenis fiber yang dipakai) sampai tercapai kesetimbangan dalam sistem tersebut (Pawliszyin 2001).
Metode ekstraksi menggunakan SPME dapat dibagi menjadi 3 tahapan. Tahap pertama, jarum SPME dimasukkan dalam vial berisi bahan yang akan diekstrak. Selanjutnya, fiber SPME dikeluarkan. Fiber dapat dikeluarkan pada sampel secara langsung (untuk sampel cair-metode direct sampling) ataupun pada rongga udara diatas sampel (headspace sampling). Tahap terakhir, fiber ditarik kembali ke dalam jarum SPME untuk mengisolasi komponen yang telah terekstrak. Proses desorbsi komponen yang telah diekstraksi ke dalam kromatografi gas dilakukan dengan memasukkan SPME pada injection port kromatografi gas. Proses desorbsi dilakukan dengan memvariasikan parameter dan temperatur yang mengatur daya desorbsi kromatografi gas terhadap SPME. Skema ekstraksi dan desorbsi SPME ditunjukkan pada Gambar 6.
Kromatografi Gas-Spektroskopi Massa (GC-MS)
5
Beberapa komponen tanaman memiliki spektrum massa yang sangat mirip, sehingga untuk membedakannya diperlukan parameter retensi GC. Karena waktu retensi bervariasi terhadap panjang kolom, jenis fase diam, dan suhu, parameter yang lebih sesuai digunakan adalah waktu retensi relatif yang disebut indeks retensi (RI). Indeks retensi merupakan perbandingan analat dari waktu ke waktu terhadap senyawa standar yang dipilih. Selain indeks retensi ada juga indeks Kovats yang menghubungkan waktu retensi komponen dengan waktu retensi n-alkana yang dianalisis pada kondisi yang sama dengan analat.
Teknik GC-MS telah banyak digunakan dalam studi metabolomik di antaranya pemrofilan metabolit Angelica acutiloba menggunakan GC-TOF-MS (Tianniam et al. 2008), pemrofilan metabolit ekstrak bioaktif Pancratium canariense menggunakan GC-MS (Torras et al. 2009), dan studi metabolomik Solanum tuberosum kelompok Andigena, Phureja, Stenotomum, dan Tuberosum menggunakan GC-MS (Dobson et al. 2010).
Kemometrik
Kemometrik merupakan disiplin ilmu kimia yang menggunakan pendekatan matematika, statistika, dan metode lainnya dari logika formal untuk mendesain atau menyeleksi prosedur optimum untuk pengukuran dan percobaan, serta untuk memperoleh informasi yang relevant secara maksimum dengan menganalisis data kimiawi yang ada (Brereton 2003). Kemometrik menyediakan metode untuk mengurangi data berukuran besar yang diperoleh dari suatu instrumen sehingga dapat diketahui tingkat reabilitas suatu data.
Analisis multivariat merupakan salah satu teknik analisis kemometrik yang dapat diaplikasikan pada sampel yang mempunyai
lebih dari satu peubah pengukuran. Analisis multivariat yang dapat digunakan untuk pengenalan pola antara lain adalah exploratory data analysis (EDA) yang terdiri atas principal component analysis PCA dan factor analysis (FA), unsupervised pattern recognation, dan supervisaed pattern recognation (Brereton 2003). Selain itu, terdapat juga soft independent modeling of class analogy (SIMCA), discriminant analysis (DA) dan partial least square discriminat analysis (PLSDA) (Gutierrez et al. 2011).
PCA (analisis komponen utama)
Analisis komponen utama (PCA) secara umum dikenal sebagai teknik interprestasi multivariat yang paling banyak digunakan untuk mengenali pola dari suatu data sehinga data dapat dikelompokkan berdasarkan persamaan pola (Brereton 2003). PCA merupakan suatu metode analisis peubah ganda yang bertujuan menyederhanakan peubah yang diamati dengan cara menyusutkan (mereduksi) dimensinya. Secara keseluruhan kegunaan PCA adalah untuk mengklasifikasi sampel menjadi grup yang umum, mendeteksi adanya pencilan (outliers), melakukan pemodelan data, serta menseleksi variabel untuk klasifikasi maupun untuk pemodelan.
memiliki varians terbesar dalam set data, sedangkan PC kedua tegak lurus terhadap PC pertama dan memiliki varians terbesar selanjutnya (Miller & Miller 2000).
Teknik PCA berdasarkan pada dekomposisi matriks data X menjadi 2, yaitu matriks T dan matriks P yang saling tegak lurus (Gambar 7):
X = T.PT + E
T merupakan matriks skor yang meng-gambarkan varians dalam objek. P merupakan matriks loading, yaitu pengaruh peubah terhadap komponen utama yang terdiri atas data asli dalam sistem koordinat baru. E adalah galat dari model yang terbentuk, sedangkan A adalah jumlah PC yang digunakan untuk membuat model (Brereton 2003).
Gambar 7 Analisis komponen utama (PCA) (Brereton 2003).
METODE
Bahan
Bahan yang digunakan adalah simplisia rimpang temulawak yang diperoleh dari lima daerah berbeda, yaitu Bogor (Jawa Barat), Karanganyar (Jawa Tengah), Sukabumi (Jawa Barat), Ngawi (Jawa Timur), dan Wonogiri (Jawa Tengah) dengan usia panen 9-12 bulan, data hasil analisis ekstrak SPME rimpang temulawak menggunakan GC-MS, etil asetat, etanol, serbuk DPPH, dan vitamin C.
Alat
Alat-alat yang digunakan pada penelitian ini adalah peralatan gelas, neraca analitik, oven, perangkat keras komputer, serta perangkat lunak AMDIS (automated mass spectral deconvolution and identification system) dan The Unscrambler.
Lingkup Penelitian
Penelitian dilakukan dalam dua tahap yaitu penelitian pendahuluan dan penelitian utama (Lampiran 1). Penelitian pendahuluan yang telah dilakukan oleh Ambarsari et al. (2012) mencakup ekstraksi metabolit dari sampel rimpang temulawak dengan SPME dan analisis menggunakan GC-MS, sedangkan penelitian utama mencakup evaluasi metabolit dengan indeks retensi menggunakan perangkat lunak AMDIS (Lampiran 2), diskriminasi metabolit dengan PCA menggunakan perangkat lunak The Unscrambler (Lampiran 3), penentuan kadar air, kadar abu, serta uji aktivitas antioksidan ekstrak etil asetat rimpang temulawak dengan metode DPPH.
Prosedur Analisis Data
Analisis Kadar Air (AOAC 2007)
Cawan porselen dikeringkan pada suhu 105°C selama 30 menit kemudian didinginkan dalam eksikator dan ditimbang. Sebanyak 2 g serbuk rimpang temulawak kering dimasukkan ke dalam cawan dan dikeringkan pada suhu 105°C selama 5 jam kemudian didinginkan dalam eksikator dan ditimbang. Prosedur ini dilakukan hingga diperoleh bobot yang tetap. Kadar air contoh ditentukan dengan persamaan:
Kadar air (%) = 100%
A B A
Keterangan:
A = bobot contoh awal (g) B = bobot contoh kering (g)
Analisis Kadar Abu (AOAC 2007)
Penentuan kadar abu rimpang temulawak menggunakan metode gravimetri. Cawan porselen yang bersih dan kering dimasukkan ke dalam tanur untuk menghilangkan sisa-sisa kotoran yang menempel di cawan. Setelah didinginkan dalam eksikator, cawan ditimbang. Sebanyak 2 g serbuk rimpang temulawak kering dimasukkan ke dalam cawan tersebut dan dipanaskan sampai tidak berasap kemudian dibakar dalam tanur pada suhu 600°C selama 2 jam sampai diperoleh abu. Cawan berisi abu didinginkan dalam eksikator dan ditimbang. Kadar abu contoh dihitung dengan persamaan:
Kadar abu (%) = 100% A
B
Keterangan:
A = bobot contoh awal (g) B = bobot abu (g)
7
Preparasi sampel dengan SPME (solid phase microextraction)
Rimpang temulawak kering sebanyak 200 mg ditempatkan pada vial berkapasitas 10 ml. Vial berisi sampel ditutup dengan penutup karet lalu syringe SPME dimasukkan ke dalam vial. Selanjutnya vial dipanaskan menggunakan penangas air pada suhu 80°C. Ekstraksi dilakukan selama 30 menit dengan kondisi sampel tetap dipanaskan pada penangas air dengan suhu dijaga konstan pada 80°C. Setelah 30 menit syringe SPME dikeluarkan dari vial dan vial dikeluarkan dari penangas air. Selanjutnya ekstrak diinjeksikan ke dalam kolom instrumen GC-MS untuk dianalisis.
Analisis metabolit dengan GC-MS Shimadzu QP 2010
Rimpang temulawak yang telah di-ekstraksi selanjutnya dianalisis menggunakan GC-MS Shimadzu QP 2010 dengan kondisi alat dijelaskan pada Tabel 1.
Evaluasi Data GC-MS
Evaluasi metabolit dapat dilakukan dengan dua cara, yaitu menggunakan data kromatogram dan spektra massa. Kromatogram hasil analisis menggunakan GC-MS dievaluasi dengan menghitung nilai Indeks Kovat (I) dan dicocokkan dengan kromatogram senyawa hidrokarbon dengan bantuan perangkat lunak AMDIS. Konfirmasi komponen dilakukan dengan mencocokkan
nilai I komponen dengan I pembanding yang sudah dipublikasikan. Berikut cara menghitung Indeks Kovat (Hubschmann 2009):
Evaluasi spektra massa dilakukan dengan mencocokkan pola spektra pada mass spectra library koleksi NIST. Interpretasi secara manual juga dilakukan dengan cara membandingkan pola spektra komponen
Keterangan:
I = Indeks Kovat
t’R(x) = waktu retensi terkoreksi senyawa X
t’Rz = waktu retensi terkoreksi n-alkana dengan jumlah karbon Z yang muncul sebelum komponen X
t’R(z+1) = waktu retensi terkoreksi n-alkana dengan jumlah karbon Z + 1 yang setelah X
X = senyawa yang dipilih Z = n-alkana dengan jumlah
karbon Z yang muncul sebelum X
Z + 1 = n-alkana dengan jumlah karbon Z + 1 yang muncul setelah X
Tabel 1 Spesifikasi dan kondisi alat GC-MS Shimadzu QP 2010
Kondisi GC Spesifikasi dan program
Tipe Kolom Kolom kapiler GC J & W, tipe DB-5ms, 30 m x 0.25
mm, ketebalan film 0.β5 μm
Model Aliran Konstan
Aliran 0.5 ml/menit
Instrumen GC-MS
GC Tipe Shimadzu 2010
Gas Pembawa H2
Detektor MS (mass spectrometer) tipe Shimadzu QP 2010
Injektor
Tipe Manual
Volume Injeksi 1 μl
Inlet
Suhu 250°C
Teknik Injeksi Split
Temperatur Oven
Suhu Awal 180°C
Waktu Awal 5 menit
Waktu Operasi 30 menit
Program Suhu
Suhu Awal 180°C, ditahan selama 5 menit
Laju Kenaikan suhu 14°C/menit
dengan pola spektra yang sudah dipublikasikan.
Uji Aktivitas Antioksidan (Salazar-Aranda R et al. 2009)
Pengujian aktivitas penangkapan radikal DPPH secara spektrofotometri dilakukan menurut Salazar-Aranda R et al. (2009) dengan beberapa modifikasi. Sebelum pengujian dilakukan, terlebih dahulu dilakukan ekstraksi rimpang temulawak. Simplisia rimpang temulawak sebanyak 10 g diekstraksi secara sonikasi dengan 100 ml etil asetat selama 30 menit. Kemudian ekstrak disaring dan dipekatkan dengan penguap putar.
Dibuat larutan DPPH 1β5 μM dengan
melarutkan serbuk DPPH radikal dalam etanol. Ekstrak rimpang temulawak dilarutkan kembali dalam etanol dan dibuat menjadi beberapa konsentrasi, yaitu 1000, 500, 250, 125, 62.5, 31.25, 15.625, dan 7.8125 g/ml.
Campuran uji terdiri atas 500 μl ekstrak dan 500 μl DPPH dengan total volume 1 ml.
Campuran diaduk dan didiamkan dan diinkubasi menggunakan waterbath bersuhu 37 °C selama 30 menit. Setelah diinkubasi serapan masing-masing larutan dibaca pada panjang gelombang 517 nm dengan spektrofotometer UV-Vis dan etanol digunakan sebagai blanko. Perlakuan yang sama juga dilakukan terhadap larutan vitamin C yang digunakan sebagai kontrol positif. Dibuat larutan vitamin C dalam beberapa konsentrasi, yaitu 100, 50, 25, 12.5, 6.25, 3.125, 1.5625, dan 0.78125 g/ml. Setelah itu dilakukan penentuan aktivitas penangkapan DPPH radikal oleh ekstrak rimpang temulawak dalam etanol dengan rumus sebagai berikut:
% inhibisi = x100%
Keterangan:
A = absorbansi dari kontrol negatif (DPPH ditambah etanol)
B = absorbansi dari sampel (DPPH, etanol ditambah sampel)
Selanjutnya korelasi antara masing-masing konsentrasi dan persentase aktivitas diplot, dan nilai IC50 dihitung dengan interpolasi.
Aktivitas penangkapan radikal dinyatakan sebagai IC50, yaitu konsentrasi efektif dari
masing-masing ekstrak yang dapat menangkap 50% radikal DPPH.
Diskriminasi Rimpang Temulawak dengan Teknik PCA
Data GC-MS yang telah dievaluasi kemudian diolah dengan teknik PCA menggunakan perangkat lunak The Unscrambler sehingga dapat dilakukan diskriminasi rimpang temulawak dari daerah asal berbeda berdasarkan komposisi metabolitnya. Evaluasi lebih lanjut terhadap hasil PCA juga dilakukan untuk menduga senyawa penciri.
HASIL DAN PEMBAHASAN
Analisis Metabolit Rimpang Temulawak
Sampel rimpang temulawak yang diteliti berasal dari lima daerah yang berbeda secara geografis, yaitu Bogor, Karanganyar, Sukabumi, Ngawi, dan Wonogiri. Kota Bogor mempunyai rata-rata ketinggian minimum 190 m dan maksimum 330 m dari permukaan laut serta suhu rata-rata tiap bulan 26 °C. Kelembaban udara di Bogor berkisar 70% dan curah hujan rata-rata setiap tahun 3500-4000 mm (http://bogorkota.bps.go.id). Kota Karanganyar memiliki ketinggian rata-rata 511 m di atas permukaan laut serta ber-iklim tropis dengan temperatur 220-310 °C (http://karanganyarkab.bps.go.id/). Kota Su-kabumi terletak pada ketinggian dari permukaan laut bervariasi antara 0-2958 m. Kota ini mempunyai iklim tropik dengan cu-rah hujan rata-rata tahunan sebesar 2.80 mm serta suhu udara berkisar antara 20-30 °C dengan kelembaban udara 85-89% (http://sukabumikab.bps.go.id/). Kota Ngawi terletak pada ketinggian yang sangat ber-variasi, yaitu 50-2700 m di atas permukaan laut. Curah hujan di kota ini berkisar 0-9 mm/tahun (http://ngawikab.bps.go.id). Wo-nogiri terletak di ketinggian 100-500 m di atas permukaan laut dengan suhu udara rata-rata 24-32 °C. Curah hujan rata-rata di Wonogiri berkisar 1557-2476 mm/tahun (http://wonogirikab.bps.go.id).
9
dan selanjutnya dilakukan identifikasi komponen kimia.
Identifikasi komponen kimia didasarkan pada spektrum massa dan Indeks Kovats. Penelusuran library spektrum massa mampu mengidentifikasi komponen-komponen yang sebelumnya tidak diketahui. Kromatogram yang representatif dari hasil analisis disajikan pada Gambar 8, sedangkan kromatogram kelima sampel dapat dilihat pada Lampiran 4. Hasil identifikasi komponen volatil ekstrak SPME rimpang temulawak sampai waktu retensi (Rt) = 30 menit disajikan dalam Tabel 2. Selanjutnya Indeks Kovats (I) dihitung secara manual menggunakan homolog n-alkana C7-C32 dan konfirmasi komponen
dilakukan dengan mencocokkan nilai I komponen yang teridentifikasi dengan I pada database yang dimiliki oleh NIST (national institute of standar and technology) melalui situs http://webbook.nist.gov. Senyawa yang teridentifikasi dikonfirmasi juga meng-gunakan Peta Keberagaman Metabolit Sekunder Genus Curcuma (Lampiran 5) yang bersumber dari dictionary of national product (http://dnp.chemnetbase.com) serta Ravindran, Babu dan Sivaraman (2007).
Total keseluruhan komponen hasil identifikasi pada kelima sampel, Bogor, Karanganyar, Sukabumi, Ngawi, dan Wonogiri, berturut-turut adalah 36, 40, 44, 44, dan 47 senyawa dan terbagi atas golongan monoterpen dan sesquiterpen. Jumlah relatif dari masing-masing komponen dinyatakan sebagai persentase luas puncak relatif terhadap luas puncak total. Empat senyawa berikut, α-Cedrene (18-β1%), α-Curcumene (15-19%), Xanthorrhizol (6-9%), dan Germacrone (5-7%) diidentifikasi sebagai komponen dominan (Gambar 9) dilihat dari
luas areanya. Hasil ini sedikit berbeda dengan Dumadi (2008) yang melaporkan bahwa komponen kimia yang dominan terdeteksi pada analisis GC-MS dalam sampel bahan baku minyak temulawak dari daerah Tawangmangu adalah α-Curcumene (21.43%), Zingiberene (19.31%), Camphor (16.90%), Germacrone (7.54%), Camphene (3.94%), Xanthorrizol (3.22%), dan Germacrene (2.03%). Perbedaan hasil penelitian dengan yang dilaporkan oleh Dumadi (2008) dapat terjadi karena perbedaan daerah asal sampel dan cara ekstraksi. Perbedaan wilayah tumbuh suatu tanaman akan mengkibatkan perbedaan komposisi metabolit yang terkandung pada tanaman tersebut, sedangkan perbedaan cara ekstraksi dapat menyebabkan perbedaan metabolit yang dapat terekstrak.
Gambar 9 Struktur kimia senyawa dominan. Senyawa yang ditemui paling banyak pada suatu sampel belum tentu sama pada sampel yang lain (Gambar 10). Senyawa α-Cedrene paling banyak terdapat pada sampel dari Wonogiri dan paling sedikit terdapat pada sampel Sukabumi. α-Curcumene paling banyak dijumpai pada rimpang asal Sukabumi dan paling sedikit dijumpai pada rimpang asal
α-Cedrene
α-Curcumene
Xanthorrhizol
Germacrone
Gambar 8 Profil kromatogram ekstrak SPME rimpang temulawak hasil analisis GC-MS.
Germacrone
α-Cedrene
Xanthorrhizol
Tabel 2 Komposisi senyawa kimia dari lima sampel ekstrak SPME rimpang temulawak
Waktu Retensi (menit) I
* Golongan Senyawa Referensi nilai I Area (%)
Bogor Karanganyar Sukabumi Ngawi Wonogiri 7.007 1003
monoterpen
-Myrcene Wang Y et al. 2008 0.0211 0.0123 0.0089 0.0070 0.0117 7.301 1012 L-Phellandrene Wang Y et al. 2008 — 0.0177 0.0455 0.0156 0.0766 7.549 1020 L-Limonene Orav Kailas et al. 2002 — — 0.0187 0.0051 0.0139 7.672 1024 Eucalyptol Tiwary et al. 2007 — 0.0034 0.0140 0.0018 0.0074 7.742 1025 α-Terpinene Yáñez et al. 2002 — 0.0041 0.0214 0.0024 0.0096 7.831 1028 –phellandrene** Kerdali
et al. 2000 — 0.0160 0.0243 0.0138 0.0296
8.033 1034 Eucalyptol Tiwary et al. 2007 0.0484 0.0501 0.0614 0.0281 0.0420 8.144 1037 –phellandrene** Hachicha
et al. 2007 0.0513 0.0248 0.0277 0.0118 0.0296 8.917 1058 -Ocimene Rocha Coelho et al. 2007 — — 0.0025 — 0.0051 9.141 1063 -Terpinene Yáñez et al. 2002 — — 0.0031 0.0067 0.0056 9.229 1065 cis-sabinene hydrate Ouamba et al. 2006 — — 0.0040 — 0.0016 9.815 1079 α –terpinolen Velasco et al. 2004 — — 0.0031 — 0.0117 9.950 1082 α –terpinolen Kose et al. 2010 — — 0.0073 — 0.0040 10.111 1086 α –terpinolen Ouamba et al. 2006 0.0164 0.0105 0.0216 0.0070 0.0431 10.458 1093 Linalool Sartoratto et al. 2004 0.0311 0.0211 0.0223 0.0108 0.0184 11.066 1109 Camphor** Politeo et al. 2007 0.4675 0.4486 0.7239 0.3365 0.7016 11.254 1116 Camphor** Dabiri and Sefidkon 2003 2.0627 1.9657 — 1.3457 1.8519
11.607 1128 2-Norbornanol Velasco et al. 2004 0.1272 0.1030 0.1135 0.0775 0.1113 11.826 1134 Isoborneol Dob et al. 2005 0.0417 0.0010 0.0751 0.0326 0.0663 11.951 1139 Isoborneol Pino et al. 2002 0.2484 0.0427 0.2292 0.1651 0.2105 12.123 1144 Borneol** Pinto
et al. 2006 0.0271 0.2336 0.0450 0.0165 0.0368 12.242 1148 Borneol** Ali and Jantan 1999 0.1614 0.0276 0.1429 0.0963 0.1296
12.558 1157 Camphor** Mahattanatawee
et al. 2006 0.0039 — — 0.0016 0.0096
11
17.675 1328
Sesquiterpen
δ- Elemene Kerdali et al. 2000 — 0.6034 0.7395 0.5284 0.6364 18.024 1341 α-Cubebene Velasco et al. 2006 0.0312 0.0170 0.0237 0.0140 0.0268 18.654 1365 Copaene Hachicha et al. 2007 0.1080 0.0781 0.1066 0.0561 0.0982 18.843 1372 -Elemene Velasco et al. 2005 0.1005 0.1026 0.1214 0.0829 0.0933 19.058 1379 -Elemene Radulovic et al. 2007 1.6125 1.4678 1.7430 1.2304 1.4346 19.643 1400 Caryophyllene Velasco et al. 2002 0.8991 0.8731 1.5412 1.6739 0.7450 20.107 1420 -Elemene Marongiu et al. 2003 2.6814 2.5534 2.8135 2.4312 2.6136 20.242 1426 2-Norpinene Raal Arak et al. 2003 0.1966 0.1626 0.2025 0.1301 0.1900 20.448 1434 α-Caryophyllene Velasco et al. 2002 0.0992 0.0918 0.1197 0.0716 0.0901 20.817 1449 (E)- -Famesene Szafranek et al. 2005 3.7934 3.1263 3.8375 2.6533 3.5054 20.923 1453 α-Curcumene Boti et al. 2007 0.0366 0.2868 0.0434 0.2220 0.3249 21.132 1462 -Cadinene Senatore and Rigano 2001 1.3949 1.2473 — 1.0633 —
21.383 1472 α-Curcumene** Boti
et al. 2007 17.3391 17.8540 19.3662 15.8503 19.2164 21.539 1478 Curzerene** de Morais
et al. 1996 4.8211 5.3383 4.7360 5.4511 4.8986 21.657 1483 Zingiberene** Dabiri and Sefidkon 2003 2.0568 1.7793 2.4044 2.0192 2.2877
22.171 1505 α-Cedrene Simic et al. 2004 20.3938 19.7945 18.4113 19.6100 21.1584 22.323 1510 -Sesquiphellandrene Pinto Pina-Vaz et al. 2006 0.9300 — — — 0.8765 22.942 1537 Germacrene B Tzakou and Constantinidis 2005 4.9336 4.6542 4.9429 4.6294 4.6520 24.736 1615 -Eudesmol Fanciullino et al. 2005 0.2471 0.2600 — 0.3353 — 25.633 1658 Germacrone** Marongiu Piras
et al. 2005 6.2973 6.9847 6.0664 7.3466 5.9585 27.114 1724 Xanthorrhizol** Konig
et al. 2006 8.1372 8.5548 6.7905 9.8236 8.7035 30.823 1909 Dibutyl phthalate Okumura 1991 0.0156 0.0241 0.0211 0.0219 0.0203
*
Indeks Kovats hasil perhitungan dan telah dikonfirmasi dengan nilai Indeks Kovats yang sudah dipublikasi (referensi).
** Senyawa yang juga ditemukan pada temulawak (dictionary of natural product: http://dnp.chemnetbase.com)
Ngawi. Xanthorrhizol dominan pada sampel rimpang asal Ngawi, dan paling sedikit terdapat pada rimpang asal Sukabumi. Hal ini menunjukkan bahwa komposisi metabolit rimpang temulawak bervariasi terhadap daerah asal sampel.
Aktivitas Antioksidan Ekstrak Etil Asetat Rimpang Temulawak
Penentuan aktivitas antioksidan rimpang temulawak diawali dengan ekstraksi terhadap kelima sampel. Ekstraksi merupakan suatu proses selektif pengambilan zat terlarut dari suatu campuran dengan bantuan pelarut (Harborne 1987). Semakin banyak senyawa yang terambil oleh pelarut yang digunakan, maka proses ekstraksi akan semakin efektif. Ekstraksi didasarkan pada prinsip like dissolve like, artinya pelarut polar akan melarutkan senyawa yang bersifat polar, dan pelarut nonpolar akan melarutkan senyawa nonpolar. Ekstrasi dilakukan dengan metode sonikasi. Metode ekstraksi sonikasi memanfaatkan gelombang ultrasonik dengan frekuensi 42 kHz yang dapat mempercepat waktu kontak antara sampel dan pelarut meskipun pada suhu ruang. Hal ini menyebabkan proses perpindahan massa senyawa bioaktif dari dalam sel tanaman ke pelarut menjadi lebih
cepat. Sonikasi mengandalkan energi gelombang yang menyebabkan proses kavitasi, yaitu proses pembentukan gelembung-gelembung kecil akibat adanya transmisi gelombang ultrasonik untuk membantu difusi pelarut ke dalam dinding sel tanaman (Ashley et al. 2001). Pelarut etil asetat yang digunakan untuk ekstraksi bersifat semipolar dan volatil sehingga senyawa-senyawa yang terekstrak juga bersifat semi polar.
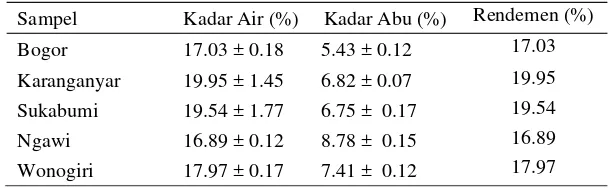
Selanjutnya jumlah senyawa yang terekstraksi dalam pelarut dapat dilihat dari rendemen hasil ekstraksi yang diperoleh. Hasil pengamatan menunjukkan bahwa rendemen ekstrak kasar rimpang tenulawak berkisar 16-20% (Tabel 3). Rendemen hasil ekstraksi tertinggi yang diperoleh adalah sampel dari Karanganyar dengan rendemen sebesar 19.95% dan rendemen terendah diperoleh ekstrak dari daerah Ngawi dengan rendemen sebesar 16.89%. Rendemen yang dihitung telah dikoreksi dengan kadar air. Kadar air, kadar abu, dan rendemen yang diperoleh disajikan pada Tabel 3. Perhitungan kadar air serta kadar abu dapat dilihat pada Lampiran 6 dan Lampiran 7, sedangkan perhitungan rendemen hasil ekstraksi dapat dilihat pada Lampiran 8.
Kadar air berguna untuk menentukan Gambar 10 Grafik empat senyawa dominan pada lima sampel rimpang temulawak.
Tabel 3 Hasil penentuan kadar air, kadar abu, dan rendemen
Sampel Kadar Air (%) Kadar Abu (%) Rendemen (%) Bogor 17.03 ± 0.18 5.43 ± 0.12 17.03 Karanganyar 19.95 ± 1.45 6.82 ± 0.07 19.95 Sukabumi 19.54 ± 1.77 6.75 ± 0.17 19.54 Ngawi 16.89 ± 0.12 8.78 ± 0.15 16.89 Wonogiri 17.97 ± 0.17 7.41 ± 0.12 17.97
13
kandungan air pada sampel karena jumlah air yang terkandung bergantung pada perlakuan yang telah dialami bahan dan kelembapan udara di tempat penyimpanan. Hasil uji kadar air memberikan nilai di atas 10% untuk semua sampel. Hal ini berarti bahwa kelima sampel tersebut tidak dapat disimpan dalam jangka waktu yang lama karena di-khawatirkan akan mengalami kerusakan dan apabila ingin disimpan lebih lama, sampel harus dikeringkan terlebih dahulu. Penyimpanan setelah pengeringan juga dapat mempengaruhi kandungan air sampel sehingga sampel kering harus disimpan di tempat dengan kelembapan rendah agar kadar air dalam sampel tidak meningkat. Kadar abu sampel ditentukan untuk mengetahui kandungan mineral dalam sampel. Mineral sebagai senyawa anorganik dalam bahan akan tertinggal dalam bentuk abu. Dari kelima sampel yang digunakan, dapat diketahui bahwa kandungan mineral paling tinggi terdapat pada sampel rimpang temulawak dari daerah Ngawi.
Pengujian menggunakan DPPH untuk mengetahui aktivitas antioksidan ekstrak etil asetat rimpang temulawak. Hasil pengukuran aktivitas antioksidan ekstrak etil asetat rimpang temulawak selanjutnya dibandingkan dengan kontrol positif yaitu vitamin C yang sudah diketahui berpotensi sebagai antioksidan. Analisis aktivitas antioksidan sampel ditentukan oleh nilai IC50 yang
didapatkan melalui persamaan regresi linier pada grafik hubungan antara aktivitas antioksidan (%) dengan konsentrasi larutan. Penggunaan metode DPPH dalam penelitian ini disebabkan karena tahapan-tahapan yang dilakukan untuk mengetahui aktivitas antioksidan dalam suatu bahan menjadi sangat mudah dan membutuhkan waktu yang singkat. Prinsip kerja dari metode ini adalah proses
reduksi senyawa radikal bebas DPPH oleh senyawa antioksidan. Proses reduksi ditandai dengan perubahan atau pemudaran warna larutan, yaitu dari warna ungu pekat (senyawa radikal bebas) menjadi warna agak kekuningan (senyawa radikal bebas yang tereduksi oleh antioksidan). Pemudaran warna akan meng-akibatkan penurunan nilai absorbansi sinar tampak dari spektro-fotometer, sehingga semakin rendah nilai absorbansi maka semakin tinggi aktivitas antioksidannya. Warna larutan pada pengu-jian aktivitas antioksidan dengan DPPH dapat dilihat pada Lampiran 9.
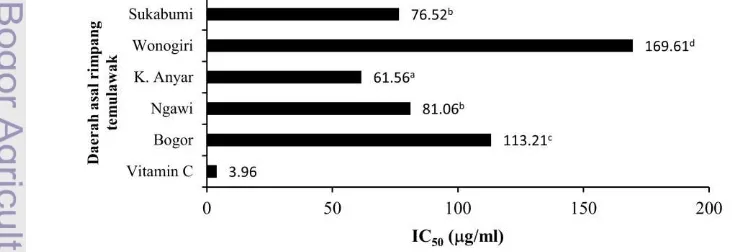
Uji aktivitas antioksidan terhadap ekstrak etil asetat rimpang temulawak menunjukkan bahwa rimpang temulawak yang berasal dari daerah Wonogiri memiliki IC50 tertinggi, yaitu
169.61 g/ml, sedangkan rimpang temulawak yang berasal dari daerah Karanganyar memiliki IC50 terkecil, yaitu sebesar 61.56 g/ml (Gambar 11 dan Lampiran 10). Sementara itu, rimpang temulawak Bogor, Ngawi dan Sukabumi memiliki nilai IC50
berturut-turut sebesar 113.21 g/ml, 81.06
g/ml, dan 76.52 g/ml. Sehingga, urutan aktivitas antioksidan kelima sampel rimpang temulawak tersebut adalah Karanganyar > Sukabumi > Ngawi > Bogor > Wonogiri. Vitamin C yang digunakan sebagai kontrol positif menghasilkan nilai IC50 sebesar 3.91 g/ml dan bila dibandingkan dengan kelima sampel rimpang temulawak, maka vitamin C memiliki aktivitas antioksidan paling tinggi karena memiliki nilai IC50 paling kecil.
Vitamin C digunakan sebagai kontrol positif karena secara umum telah banyak digunakan secara luas sebagai antioksidan alami dan hasil penelitian menunjukkan bahwa vitamin C termasuk antioksidan sangat kuat karena nilai IC50 yang dimilikinya kurang dari 5
Gambar 11 Nilai IC50 hasil uji aktivitas antioksidan menggunakan metode DPPH. (Angka yang
diikuti oleh huruf superscripts yang sama tidak berbeda signifikan pada taraf uji
14
g/ml. Berdasarkan uji statistik ANOVA, aktivitas antioksidan kelima sampel rimpang temulawak yang berasal dari daerah yang berbeda tersebut berbeda nyata (nilai P<0.05) (Lampiran 11). Artinya terdapat perbedaan aktivitas antioksidan antara rimpang temulawak dari daerah yang satu dengan yang lainnya. Hal ini dapat disebabkan oleh perbedaan kandungan senyawa yang terdapat pada masing-masing rimpang karena perbedaan lokasi tumbuh dari rimpang itu sendiri. Perbedaan kandungan atau komposisi senyawa kimia yang terdapat pada tanaman akan mengahasilkan aktivitas biologis yang berbeda pula. Keragaman komposisi senyawa aktif kimia ini dapat dipengaruhi oleh kondisi tanah dan lingkungan (Singh et al. 2010). Berdasarkan uji lanjut Duncan terhadap hasil uji aktivitas antioksidan rimpang temulawak dari lima daerah yang berbeda (Lampiran 12) membagi sampel menjadi 4 kelompok dengan urutan sebagai berikut: Karanganyar > Ngawi
Sukabumi > Bogor > Wonogiri. Gambar 11 menunjukkan bahwa nilai IC50 rimpang
temulawak dari daerah Ngawi dan Sukabumi tidak berbeda nyata. Hal ini dapat dihubungkan dengan jumlah senyawa hasil identifikasi karena aktivitas antioksidan suatu tanaman tidak hanya ditentukan oleh satu komponen. Senyawa hasil identifikasi sampel rimpang temulawak asal Sukabumi dan Ngawi berjumlah sama yaitu sebanyak 44 senyawa, diduga inilah yang menyebabkan aktivitas antioksidan keduanya sama.
Komposisi metabolit dan struktur komponen aktif ekstrak merupakan faktor penting yang mengatur aktivitas antioksidan. Aktivitas antioksidan tidak hanya dapat di-jelaskan berdasarkan kandungan senyawa tertentu. Oleh karena itu, diperlukan analisis lebih lanjut terkait isolasi dan identifikasi komponen aktif dengan informasi detail
mengenai struktur kimia yang disertai dengan pengujian in vitro dan in vivo agar aktivitas antioksidan dapat dijelaskan melalui me-kanisme reaksi.
Diskriminasi Rimpang Temulawak dengan PCA Berdasarkan Komposisi Metabolit
Diskriminasi merupakan proses mem-bedakan satu sampel dengan sampel yang lainnya dengan menemukan persamaan diantara sampel-sampel tersebut. Sampel yang memiliki banyak persamaan akan bergabung menjadi satu kelompok atau dengan kata lain sampel dengan banyak perbedaan akan membentuk kelompok yang berbeda. Diskriminasi rimpang temulawak berdasarkan daerah asal dilakukan meng-gunakan PCA. PCA dapat mengubah data kromatografi yang sangat kompleks menjadi matriks data yang mudah dipahami. Aplikasi PCA terhadap kromatogram memungkinkan reduksi data GC-MS yang berukuran besar menjadi beberapa principle component (PC) atau komponen utama, PC1, PC2, atau, PC3, dengan plot skor dua dimensi yang dapat menunjukkan keterpisahan di antara sampel-sampel. Plot skor untuk dua komponen utama pertama (PC1 dan PC2) biasanya paling berguna dalam analisis karena kedua PC ini mengandung paling banyak variasi data. Setiap komponen dalam model PCA dikarakterisasi oleh tiga atribut yang saling melengkapi, yaitu: (1) keragaman (variance) yang memberikan seberapa banyak informasi yang dapat digunakan pada PC, (2) loading yang menyatakan korelasi antara variabel-variabel dalam setiap PC, dan (3) scores yang menggambarkan sifat-sifat sampel.
Hasil analisis PCA dikatakan baik bila dengan jumlah komponen utama yang sedikit mampu menggambarkan total variasi yang
15
Gambar 13 Skor plot dua PC pertama kromatogram yang telah direduksi.
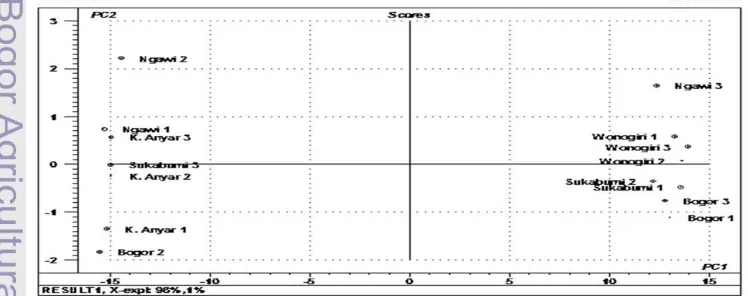
besar. Analisis PCA terlebih dahulu dilakukan pada kromatogram utuh tanpa perlakuan pendahuluan. Gambar 12 menun-jukkan bahwa plot skor dua PC pertama dapat menjelaskan 99% total variasi (PC1 = 98%, PC2 = 1%). Pengelompokan sampel tidak terlihat jelas. Program Unscrambler mende-teksi semua sampel kecuali K. Anyar 2 dan Bogor 1 sebagai pencilan (ditandai dengan lingkaran). Pencilan ini dapat disebabkan oleh adanya galat pengukuran, contoh dari kategori lain, atau kesalahan instrumental (Stchur et al. 2002).
Selanjutnya dilakukan serangkaian proses untuk meningkatkan hasil analisis kemo-metrik. Dilakukan reduksi data dengan memilih puncak-puncak (peak) yang memiliki kelimpahan lebih besar dari 25%. Perlakuan ini diharapkan dapat mengurangi wilayah kromatogram yang mengandung banyak derau. Berdasarkan Gambar 13, plot skor dua PC pertama mampu menjelaskan 97% total
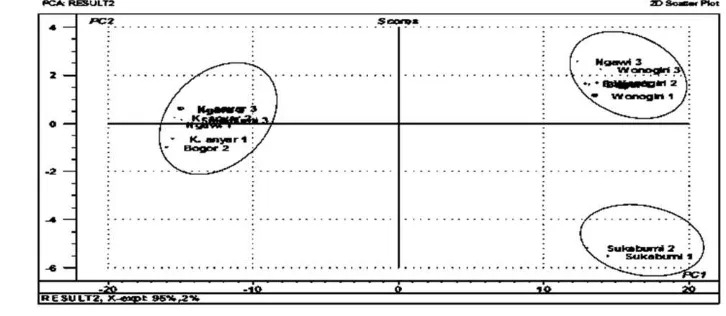
variasi (PC1 = 95%, PC2 = 2%). Variasi total yang mampu dijelaskan lebih kecil daripada analisis sebelumnya, namun sampel terlihat telah membentuk 3 kelompok. Kelompok I terdiri atas Karang-anyar 1, Karanganyar 2, Karanganyar 3, Ngawi 1, Ngawi 2, Bogor 2, dan Sukabumi 3. Kelompok II tersusun atas Wonogiri 1, Wonogiri 2, Wonogiri 3, Ngawi 3, Bogor 1 dan Bogor 3. Sampel yang termasuk kedalam kelompok III adalah Sukabumi 1 dan Suka-bumi 2. Sampel Karanganyar 3 dan Wonogiri 1 diidentikasi sebagai pencilan sehingga dihi-langkan pada analisis selanjutnya. Gambar 14 menunjukkan bahwa penghilangan pencilan mampu memperbaiki pengelompokan sampel rimpang temulawak berdasarkan asal geo-grafisnya. Analisis kemometrik yang di-lakukan mengalami peningkatan dengan kemampuan menjelaskan 99% total variasi (PC1 = 96%, PC2 = 3%)
.
Hubungan Komposisi Metabolit Rimpang Temulawak dengan Daerah Asal dan
Aktivitas Antioksidannya
Hasil uji aktivitas antioksidan dengan DPPH menyatakan bahwa kelima sampel berbeda nyata dan berdasarkan uji lanjut Duncan sampel rimpang temulawak membentuk 4 kelompok, yaitu Kelompok I (Karanganyar), Kelompok II (Sukabumi dan Ngawi), Kelompok III (Bogor), dan Kelompok IV (Wonogiri). Akan tetapi, analisis PCA menghasilkan 3 kelompok, Kelompok I (Karanganyar dan Ngawi), Kelompok II (Wonogiri dan Bogor), dan Kelompok III (Sukabumi). Dapat disimpulkan bahwa pada penelitian ini kelompok yang terbentuk dari pengujian antioksidan berbeda dengan kelompok dari analisis menggunakan PCA. Oleh karena itu, komposisi metabolit rimpang temulawak tidak dapat dihubungkan dengan aktivitas antioksidannya. Hal ini dapat terjadi karena perbedaan jenis ekstrasi yang digunakan, yaitu SPME untuk analisis metabolit rimpang temulawak dengan GC-MS dan sonikasi menggunakan pelarut etil asetat untuk pengujian aktivitas antioksidannya. Perbedaan cara ekstrasi mengakibatkan senyawa yang terekstrak juga berbeda. Hasil dari dua analisis dapat dibandingkan jika kondisi analisis keduanya sama, sedangkan pada penelitian ini analisis metabolit rimpang temulawak dan aktivitas antioksidannya tidak dilakukan pada kondisi yang sama sehingga hasil keduanya tidak bisa saling dikaitkan.
Potensi Senyawa Penanda Dalam Pengelompokan Rimpang Temulawak
Setiap titik pada plot loading PCA merupakan variabel komponen dan yang
memberikan kontribusi signifikan terhadap perbedaan antar kelompok adalah komponen yang terjauh dari kelompok utama (Yi et al. 2007). Plot loading PCA (Gambar 15) yang disesuaikan dengan plot skor (Gambar 14)
menunjukkan bahwa α-Cedrene dan –
Sesquiphellandrene mungkin dapat digunakan sebagai senyawa penanda dalam proses pengelompokan rimpang temulawak berdasarkan asal geografisnya.
SIMPULAN DAN SARAN
Simpulan
Hasil analisis ekstrak SPME meng-gunakan GC-MS masing-masing untuk daerah Bogor, Karanganyar, Ngawi, Sukabumi, dan Wonogiri berhasil mengidentifikasi berturut-turut sebanyak 36, 40, 44, 44, 47 senyawa. Komponen utama kelima ekstrak SPME rimpang temulawak hasil identifikasi menggunakan GC-MS adalah α-Cedrene (18-21%), α-Curcumene (15-19%), Cuparo-phenol (6-9%), dan Germacrone (5-7%). Metabolit yang diduga sebagai penciri adalah
α-Cedrene dan –Sesquiphellandrene. Analisis menggunakan PCA berhasil mengelompokkan sampel menjadi 3 kelompok, sedangkan hasil pengujian aktivitas antioksidan terhadap ekstrak etil asetat rimpang temulawak membagi sampel tersebut menjadi 4 kelompok. Oleh karena itu, komposisi metabolit rimpang temulawak tidak dapat dikaitkan dengan aktivitas antioksidannya.
Saran
pengujian aktivitas antioksidan. Dapat juga dilakukan pengujian aktivitas antioksidan dengan metode lain misalnya dengan CUPRAC (reduksi ion tembaga) dan FRAP (reduksi ion ferri). Diskriminasi rimpang temulawak dapat juga dilakukan menggunakan metode selain PCA misalnya dengan PLS-DA (partial least square-discriminat analysis). Terakhir, perlu dilakukan analisis lebih lanjut terkait proses metabolisme pada rimpang temulawak untuk melengkapi studi metabolomik diskrimnasi rimpang temulawak dari asal geografis yang berbeda.
DAFTAR PUSTAKA
Ali NAM and Jantan I. 1999. Essential oil of Cinnamomum tahijanum kost. from Sarawak. ASEAN Review of Biodiversity & Environment Conservation November-December, 1-4.
Ambarsari Laksmi et al. 2012. Laporan penelitian perguruan tinggi: Produksi nanokurkuminoid berbasis bahan baku terstandar secara genetik dan metabolit untuk meningkatkan nilai tambah biodiversitas lokal demi kemandirian bangsa. Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional. Ashley K, Andrews RN, Cavazosa L,
Demange M. 2001. Ultrasonic extraction as a sample preparation technique for elemental analysis by atomic spectrometry. Journal of Analytical Atomic Spectrometry 16:1147-1153.
Blois MS. 1958. Antioxidant determinations by the use of a stable free radical. Nature 181: 1199-1200.
Boti JB, Koukoua G, N'Guessan TY, Casanova J. 2007. Chemical variability of Conyza sumatrensis and Microglossa pyrifolia from Côte d'Ivoire.Flavour Fragr. J. 22: 27-31. Brereton RG. 2003. Chemometrics: Data
Analysis for The Laboratory and Chemical Plant. England: John Willey & Sons. Choi MY, Choi W, Park JH, Lim J, Kwon
SW. 2010. Determnination of coffee origins by integrated metabolomic approach of combining multiple analytical data. Food Chemistry 121: 1260-1268.
Curioni PMG, Bosset JO. 2002. Key Odorant in Various Cheese Types as Determined by Gas Chromatography-Oflactometry. International Dairy Journal 12: 959-984.
Dabiri M and Sefidkon F. 2003. Chemical compositional of Nepeta crassifolia Boiss. & Buhse oil from Iran. Flavour Fragr. J.
18: 225-227.
de Morais SM, Craveiro AA, Machado MILM, Alencar JW, Matos JA. 1996. volatile constituents of eugenia unifluora leaf oil from notheastern Brazil.J. Ess. Oil Res. 8: 449-451.
Dobson et al. 2010. A Metabolomics Study of Cultivated Potato (Solanum tuberosum) Groups Andigena, Phureja, Stenotomum, and Tuberosum Using Gas Chromatography-Mass Spectrometry. J. Agric. Food Chem. 58: 1214–1223. Dob T, Dahmane D, Berramdane
T, Chelghoum C. 2005. Chemical composition of the essential oil of Artemisia campestris L. from Algeria. Pharm. Biol. 43(6): 512-514.
Douglas F. 2000. GC/MS Analysis [terhubung berkala] http://sites.netscape.net/dougfrm [5 Januari 2012].
Dumadi SR. 2008. Kajian minyak temulawak dari Tawangmangu. Konferensi Nasional Minyak Atsiri. Surabaya, 2-4 Desember 2008. Surabaya: Pusat Teknologi Agroindustri, BPPT, Indonesia.
Fanciullino A, Gancel A, Froelicher Y, Luro F, Ollitrault P, Brillouet J. 2005. Effects of nucleo-cytoplasmic interactions on leaf volatile compounds from citrus somatic diploid hybrids. J. Agric. Food Chem. 53: 4517-4523.
Ferracane R et al. 2010. Metabolic profile of the bioactive compounds of burdock (Arctium lappa) seeds, roots and leaves. Journal of Pharmaceutical and Biomedical Analysis 51: 399-404.
Gutierrez L, Coello J, Maspoch S. 2011. Application of near infrared spectral fingerprinting and pattern recognition techniques for fast identification of Eleutherococcus senticosus. Food Research International 44:557–565. Hachicha SF, Skanji T, Barrek S, Ghrabi
18
Desf. (Lamiaceae) from Tunisia. Flavour Fragr. J. 22: 101-104.
Halket JM et al. 2005. Chemical derivatization and mass spectral libraries in metabolic profiling by GC/MS and LC/MS/MS. Journal of Experimental Botany 56 (410): 219-243.
Harborne JB. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Cetakan Kedua. Padmawita K & Soediro I, penerjemah. Bandung: Penerbit ITB. Terjemahan dari: Phytochemical methods.
Hernani. 2001. Temulawak (Curcuma xanthorriza Roxb.) Tumbuhan Obat Indonesia Penggunaan dan Khasiatnya. Jakarta: Pustaka Popular Obor.
Hubschmann HJ. 2009. Handbook of GC/MS: Fundamentals and Applications. Weinheim: WILEY-VCH Verlag GmbH & Co. KGaA.
Hwang JK, penemu; LG Household & Healthcare. 24 Feb 2004. Antibacterial composition having xanthorrhizol. US Patent 6 696 404.
Juliani HR, Koroch AR, Juliani HR, Trippi VS, Zygadlo JA. 2002. Intraespecific variation in leafoils of Lippia junelliana (mold.) tronc. Biochem. Syst. Ecol. 30: 163-170.
Kardali M, Velasco-Negueruela A, Pérez-Alonso M. 2000. Essential Oil Constituents of Sideritis ibanyezii Pau. Botanica Complutensis 24: 101-106. Kataoka H, Lord HL, Pawliszyn J. 2000.
Applications of solid-phase microextraction in food analysis. J. Chromatogr A. 880:35-62.
Kim Eun Jin et al. 2011. Metabolite Profiling of Angelica gigas from Different Geographical Origins Using 1H NMR and UPLC-MS Analyses. J. Agric. Food Chem. 59: 8806-8815.
Konig WA, Joulain D, Hochmuth DH. 2006. GC/MS Library: Terpenoids and Related Constituents of Essential Oils [terhubung berkala]
http://www.massfinder.com/mfterpenoids. htm [22 September 2012].
Kose et al. 2010. Chemical composition, antimicrobial and antioxidant activity of essential oil of endemic Ferula lycia
Boiss. Journal of Medicinal Plants Research 4(17): 1698-1703.
Krastanov A. 2010. Matebolomics-the state of art. Biotechnol & Biotechnol 24:1537-1543.
Lan K, Zhang Y, Yang JY, Xu L. 2010. Simple quality assessment approach for herbal extracts using high performance liquid chromatography–UV based metabolomics platform. J. Chromatogr. A. 1217: 1414–1418.
Lebart L, Morineau A, Warmict MK. 1984. Multivariate Descriptive Statistical Analysis. New York: John Willey & Sons. Mahattanatawee K et al. 2006. Total antioxidant activity and fiber content of selectflorida-grown tropical fruits. J. Agric. Food Chem. 54: 7γ55−7γ6γ. Marongiu B, Piras A, Porcedda S, Scorciapino
A. 2005. Chemical composition of the essential oil and supercritical CO2 extract of Commiphora myrrha (Nees) Engl. and of Acorus calamus L. J. Agric. Food Chem. 53: 7939-7943.
Marongiu B, Porcedda S, Caredda A, de Gioannis B, Vargiu L, la Colla P. 2003. Extraction of Juniperus oxycedrus ssp. Oxycedrus essential oil by supercritical carbon dioxide: influence of some process parameters and biological activity. Flavour Fragr. J. 18: 390-397. Miller JC, Miller JN. 2000. Statistic and
Chemometrics for Analytical Chemistry. Ed ke-4. Harlow: Pearson Education. Okumura T. 1991. Retention indices of
environmental chemicals on methyl silicone capillary column. Journal of Environmental Chemistry (Japan). 1(2): 333-358.
Orav A, Kailas T, Müürisepp M. 2002. Composition of blackcurrant aroma isolated from leaves, buds, and berries of Ribes nigrum L. Proc. Est. Acad. Sci. Chem. 51(4): 225-234.
Ouamba JM, et al. 2006. Volatile constituents of the essential oil leaf of Lantana salvifolia Jacq. (Verbenaceae). Flavour Fragr. J. 21: 158-161.
19
Pino JA, Marbot R, Quert R, García H. 2002. Study of essential oils of Eucalyptus resinifera Smith, E. tereticornis Smith and Corymbia maculata (Hook.) K.D. Hill & L.A.S. Johnson, grown in Cuba.Flavour Fragr. J. 17:1-4.
Pinto E, et al. 2006. Antifungal activity of the essential oil of Thymus pulegioides on Candida, Aspergillus and dermatophyte species. Journal of Medical Microbiology 55: 1367-1373.
Politeo O, Jukic M, Milos M. 2007. Chemical composition and antioxidant capacity of free volatile aglycones from basil (Ocimum basilicum L.) compared with its essential oil. Food Chem. 101: 379-385.
Purseglove JW, Brown EG, dan Green CL. 1981. Spices. London: Longmans.
Radulovic N, Lazarevic J, Ristic N, Palic R. 2007. Chemotaxonomic significance of the volatiles in the genus Stachys (Lamiaceae): Essential oil composition of four Balkan Stachys species. Biochem. Syst. Ecol. 35: 196-208.
Rahardjo M. 2010. Penerapan SOP budi daya untuk mendukung temulawak sebagai bahan baku obat potensial. Prospektif 9(2): 78-93.
Ravindran PN, Babu KN, Sivaraman K. 2007. Turmeric: The Genus Curcuma. USA: CRC Press.
Rocha SM, Coelho E, Zrostlikova J, Delgadillo I, Coimbra MA. 2007. Comprehensive two-dimensional gas chromatography with time-of-flight mass spectrometry of monoterpenoids as a powerful tool for grape origin traceability. J. Chromatogr. A 1161: 292-299.
Salazar-Aranda R et al. 2009. Antimicrobial and antioxidant activities of plants from northeast of Mexico. Evidence-Based Complementary and Alternative Medicine 2011: 1-6.
Salgueiro LR et al. 2006. Antifungal activity of the essential oil of Thymus capitellatus against Candida, Aspergillus and dermatophyte strains. Flavour Fragr. J. 21: 749–753.
Sartoratto A, et al. 2003. Composition and antimicrobial activity of essential oils from aromatic plants used in Brazil. Braz. J. Microbiol. 35: 275-280.
Senatore F, Rigano D. 2001. Essential oil of two Lippia spp. (Verbenaceae) growing wild in Guatemala. Flavour Fragr. J. 16: 169-171.
Sidik. 2006. Temulawak Cegah Kanker Payudara. [terhubung berkala] http://www.pikiranrakyat.com/rubrik/band ung raya [10 Januari 2012].
Simic A, et al. .2004. The chemical composition of some Lauraceae essential oils and their antifungal activities. Phytother. Res.18: 713-717. Singh SK, Jha SK, Chaundary A, Yadava
RDS, Rai SB. 2010. Quality control of herbal medicine by using spectroscopic techniques and multivariate statistical analysis. Pharmaceutical Biology 48: 134-141.
Stchur P, Cleveland D, Zhou J, Michel RG. 2002. A review of recent applications of near infrared spectroscopy, and the characteristics of a novel PbS CCD arraybased near infrared spectrometer. Appl. Spect. Rev.<