DETEKSI VIRUS PADA KEDELAI DI JAWA DAN RESPONS
KETAHANAN SEMBILAN VARIETAS TERHADAP
CUCUMBER MOSAIC VIRUS
STRAIN
SOYBEAN
YUNITA FAUZIAH RAHIM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Deteksi Virus pada Kedelai di Jawa dan Respons Ketahanan Sembilan Varietas terhadap
Cucumber mosaic virus strain Soybean adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
YUNITA FAUZIAH RAHIM. Deteksi Virus pada Kedelai di Jawa dan Respons Ketahanan Sembilan Varietas terhadap Cucumber mosaic virus strain Soybean. Dibimbing oleh TRI ASMIRA DAMAYANTI dan MUNIF GHULAMAHDI.
Kedelai (Glycine max [L.] Merrill) merupakan salah satu komoditas pangan penting di Indonesia. Namun produksinya belum mencukupi kebutuhan nasional sehingga kebutuhan kedelai dicukupi dengan importasi benih. Faktor pembatas menurunnya produktivitas kedelai salah satunya adalah gangguan hama dan penyakit tanaman. Penyakit tanaman kedelai yang disebabkan infeksi virus dapat mempengaruhi hasil panen secara kualitas dan kuantitas. Oleh karena importasi benih kedelai di Indonesia cukup tinggi, untuk mempertahankan dan meningkatkan produksi kedelai, maka perlu dilakukan pemutakhiran informasi terkait virus di lapangan. Penelitian bertujuan mendeteksi virus yang menginfeksi kedelai di beberapa lokasi di Jawa dan mengevaluasi respons ketahanan sembilan varietas terhadap infeksi virus yang dominan ditemukan. Survei dan pengambilan sampel dilakukan di Kecamatan Cikarawang dan Kecamatan Bogor Barat, Kabupaten Bogor (Jawa Barat), Kecamatan Gempol, Kabupaten Cirebon (Jawa Barat), Kecamatan Kasihan, Kabupaten Bantul (DI Yogyakarta), dan Kecamatan Babadan, Kabupaten Ponorogo (Jawa Timur). Sampel diambil sebanyak masing-masing 50 tanaman dengan metode purposive sampling dari setiap lokasi. Insidensi penyakit virus ditentukan secara serologi dengan mengggunakan antiserum Cucumber mosaic virus (CMV), Soybean mosaic virus (SMV), Cowpea mild mottle virus (CPMMV), dan Bean pod mottle virus (BPMV). Virus yang dominan selanjutnya dideteksi dengan RT-/PCR menggunakan primer spesifik, dan atau universal, kemudian dirunut sekuen nukleotidanya. Insidensi penyakit oleh CMV, SMV, dan CPMMV berturut-turut berkisar 72–84%, 14–24%, dan 6–8%; sedangkan BPMV tidak terdeteksi dari semua sampel. Gejala cupping dan menguning terdeteksi oleh antiserum CMV, CMV dan SMV merupakan virus yang dominan ditemukan. RT-PCR dengan primer spesifik gen CI SMV, DNA tidak teramplifikasi, namun berhasil teramplifikasi dengan primer universal Potyvirus. CMV teramplifikasi dengan primer spesifik gen CP dan DNA teramplifikasi dari gejala “cupping” dan menguning dengan primer universal Geminivirus. Homologi nukleotida tertinggi CMV terhadap CMV strain S asal Bogor (99.3%). Homologi Potyvirus tertinggi terhadap BCMV isolat Mungbean asal Cina dan strain Blackeye asal Vietnam (88.3%). Homologi Geminivirus tertinggi terhadap Pepper yellow leaf curl virus (PYLCV) asal Bogor dan Jawa (95.5%). Analisis filogenetika menunjukkan CMV-S berada dalam satu kelompok terpisah dari CMV strain lainnya. BCMV pada kedelai dalam penelitian ini membentuk kelompok terpisah dari BCMV asal negara lain, sedangkan PYLCV isolat kedelai membentuk satu kelompok dengan PYLCV isolat cabai asal Bogor dan Jawa.
Grobogan, Sinabung, dan Wilis. Inokulasi dilakukan secara mekanis pada daun yang membuka penuh. Tiap varietas terdiri atas 15 tanaman sebagai ulangan. Respons ketahanan terhadap inokulasi mekanis CMV-S diukur berdasarkan beberapa parameter penilaian penyakit (periode inkubasi, tipe gejala, keparahan penyakit, indeks keparahan penyakit, titer virus) dan parameter pertumbuhan tanaman (tinggi tanaman, masa berbunga, dan jumlah bunga). Varietas Grobogan memiliki periode inkubasi terpendek yaitu 8-14 hari setelah inokulasi, sedangkan varietas Detam-1 dan Burangrang memiliki periode inkubasi terpanjang yaitu 14-19 hari setelah inokulasi. Tipe gejala penyakit yang muncul bervariasi tergantung varietas. Indeks keparahan penyakit tertinggi pada varietas Grobogan yaitu 6.13 dengan ratio nilai absorbansi ELISA (NAE) sebesar 4.01 kali dari NAE kontrol negatif, sedangkan indeks keparahan penyakit terendah pada varietas Detam-1 yaitu 0.45 dengan ratio NAE sebesar 2.18 kali dari NAE kontrol negatif. Infeksi CMV-S dapat menghambat pertumbuhan tanaman pada beberapa varietas kedelai yang diuji. Varietas Grobogan memiliki nilai indeks sensitivitas tertinggi sebesar 2.23, sedangkan varietas Detam-2 memiliki nilai terendah sebesar 0.04 terhadap infeksi CMV-S. Berdasarkan parameter pengamatan, varietas Grobogan dikategorikan rentan, sedangkan varietas Argomulyo, Anjasmoro, Cikuray, Sinabung, dan Wilis dikategorikan toleran, dan varietas Burangrang, Detam-1, dan Detam-2 resisten terhadap infeksi CMV-S. Tiga varietas yang memperlihatkan respons tahan dapat digunakan sebagai tetua pada perakitan varietas tahan terhadap CMV-S.
SUMMARY
YUNITA FAUZIAH RAHIM. Detection of Viruses on Soybean in Java and Resistance Response of Nine Varieties Against Cucumber mosaic virus strain Soybean. Supervised by TRI ASMIRA DAMAYANTI and MUNIF GHULAMAHDI.
Soybean (Glycine max [L.] Merrill) is one of the important food commodity in Indonesia, however the production is not sufficient for national needness.Thus, seed importation is conducted to overcome it. Pest and disease is one of constraint of soybean production. Since seed importation frequency is high, to maintain and increase soybean production, its necessary to updates the information related viruses. This research aimed to detect viruses which infect soybean at several locations in Java and to evaluate the resistance response of nine soybean varieties against viral infection which is predominantly found. Survey and sampling carried out in Cikarawang and Bogor Barat, Bogor (West Java), Gempol, Cirebon (West Java), Kasihan, Bantul (Yogyakarta), and Babadan, Ponorogo (East Java). Samples were taken from 50 plants with purposive sampling method from each location. Disease incidence was determined by serological test using Soybean mosaic virus (SMV), Cucumber mosaic virus (CMV), Cowpea mild mottle virus (CPMMV) and Bean pod mottle virus (BPMV) antisera. Then, predominant virus detect by RT-/PCR using specific primers, and or universal, and then the nucleotides were sequenced. Diseases incidence of CMV, SMV, and CPMMV ranged from 72 to 84%, 14 to 24%, and 6 to 8%; whereas BPMV was not detect from all samples tested. The symptoms of cupping and yellowing was positively against CMV antiserum. CMV and SMV were predominantly detected. RT-PCR using specific primers of CI gen of SMV was not successfully amplified, however it successfully amplified by using universal primers of Potyvirus. CMV was succesfully amplified with CP specific primer and the symptoms of cupping and yellowing successfully detected with universal primers of Geminivirus. The homology of CMV was closely to CMV strain S from Bogor (99.3%). The homology of Potyvirus was closely to BCMV isolate mungbean from China and strain Blackeye from Vietnam (88.3%). The homology of Geminivirus was closely to Pepper yellow leaf curl virus (PYLCV) from Bogor and Java (95.5%). Phylogenetic analysis of CMV-S was in the one cluster and distantly separated from other strains. BCMV isolate soybean was in different cluster with BCMV from other countries. PYLCV isolate soybean was in same cluster with PYLCV from Bogor and Java.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
DETEKSI VIRUS PADA KEDELAI DI JAWA DAN RESPONS
KETAHANAN SEMBILAN VARIETAS TERHADAP
CUCUMBER MOSAIC VIRUS
STRAIN
SOYBEAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Alhamdulillahirobbil‟alamin, puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian dengan judul “Deteksi Virus pada Kedelai di Jawa dan Respons Ketahanan Sembilan Varietas terhadap Cucumber mosaic virus strain Soybean” telah dilaksanakan sejak bulan Februari 2014 hingga Mei 2015.
Terima kasih penulis ucapkan kepada Dr Ir Tri Asmira Damayanti, MAgr dan Prof Dr Ir Munif Ghulamahdi, MS yang telah memberikan arahan dan bimbingan kepada penulis selama masa penelitian dan atas benih kedelai yang diberikan untuk kegiatan penelitian. Terima kasih penulis sampaikan kepada Prof Dr Ir Sri Hendrastuti Hidayat, MSc sebagai Ketua Program Studi Fitopatologi atas petunjuk dan saran kepada penulis selama penulis mengikuti pendidikan, serta Dr Ir Kikin Hamzah Muttaqin, MSi selaku dosen penguji yang telah memberikan banyak masukan dalam menyempurnakan penulisan karya ilmiah ini.
Ungkapan terima kasih penulis sampaikan kepada Badan Pemberdayaan Sumber Daya Manusia (BPSDM) Kementerian Pertanian yang telah memberikan kesempatan kepada penulis untuk melanjutkan pendidikan di Program Studi Fitopatologi Pascasarjana IPB. Penghargaan penulis sampaikan kepada teman-teman Pengamat Hama dan Penyakit yang bertugas di lokasi survei atas bantuannya selama penulis melakukan survei dan pengambilan sampel.
Ungkapan terima kasih kepada suami, anak, orang tua, saudara, serta seluruh keluarga tercinta atas segala perhatian, doa, motivasi, dan kasih sayangnya kepada penulis selama menempuh pendidikan.
Semoga karya ilmiah ini dapat memberikan manfaat.
DAFTAR ISI
DAFTAR TABEL DAFTAR GAMBAR DAFTAR LAMPIRAN
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Kedelai 3
Taksonomi Tanaman Kedelai 3
Morfologi Tanaman Kedelai 3
Jenis Virus yang Menginfeksi Tanaman Kedelai 4
Bean pod mottle virus 4
Cowpea mild mottle virus 4
Cucumber mosaic virus 5
Geminivirus 5
Soybean mosaic virus 6
Respons Ketahanan Tanaman 7
3 METODE 8 Tempat dan Waktu Penelitian 8 Pelaksanaan Penelitian 8 Deteksi dan Identifikasi Virus dari Beberapa Pertanaman Kedelai 8
Pengambilan Sampel Daun Tanaman Kedelai 8
Insidensi Penyakit 8
Deteksi dengan Metode RT-/PCR 9
Ekstraksi Asam Nukleat 9
Sintesis cDNA 10
Amplifikasi DNA 10
Perunutan DNA dan Analisis Sekuen Nukleotida 10
Respons Ketahanan Sembilan Varietas Kedelai terhadap Infeksi CMV-S 11
Perbanyakan Inokulum 11
Penyiapan Tanaman Uji 11
Inokulasi CMV-S 11
Peubah Pengamatan 11
Pengukuran Titer Virus CMV-S 12
Prosedur Analisis Data 13 4 HASIL DAN PEMBAHASAN 14 Deteksi Virus dari Beberapa Pertanaman Kedelai di Jawa 14 Gejala Penyakit 15
Insidensi Infeksi Virus 16
Respons Ketahanan Sembilan Varietas Kedelai terhadap Infeksi CMV-S 23 Pengaruh Infeksi CMV-S terhadap Periode Inkubasi, Insidensi
Penyakit, dan Tipe Gejala 23
Pengaruh Infeksi CMV-S terhadap Indeks Keparahan Penyakit
dan Titer Virus 25
Pengaruh Infeksi CMV-S terhadap Tinggi Tanaman dan Jumlah
Bunga Mekar 25
5 SIMPULAN DAN SARAN 33
Simpulan 33
Saran 33
DAFTAR PUSTAKA 34
LAMPIRAN 42
DAFTAR TABEL
1 Gejala infeksi virus pada tanaman kedelai di beberapa lokasi di Jawa 14 2 Insidensi infeksi virus berdasarkan reaksi serologi 15
3 Insidensi infeksi campuran virus berdasarkan reaksi serologi 16 4 Tingkat homologi runutan nukleotida gen CP CMV isolat
Cikarawang, Bogor Barat, Cirebon, Bantul, Ponorogo dengan
isolat dari negara lain yang terdaftar di GenBank 18 5 Tingkat homologi runutan nukleotida gen CP Potyvirus isolat
Ponorogo dengan isolat dari negara lain yang terdaftar di
GenBank 19
6 Tingkat homologi runutan nukleotida gen CP Geminivirus isolat Bogor Barat dengan isolat dari negara lain yang
terdaftar di GenBank 20
7 Pengaruh infeksi CMV-S terhadap periode inkubasi, insiden
penyakit, dan tipe gejala 23
8 Pengaruh infeksi CMV-S terhadap indeks keparahan penyakit
dan titer virus 25
9 Persentase penghambatan tinggi tanaman sembilan varietas
kedelai 27
10 Waktu berbunga dan jumlah bunga mekar pada sembilan
varietas kedelai 28
11 Nilai indeks sensitivitas jumlah bunga mekar sembilan
varietas kedelai yang diinfeksi CMV-S 29 12 Respons ketahanan sembilan varietas kedelai terhadap infeksi
CMV-S 30
DAFTAR GAMBAR
1 Gejala infeksi virus pada beberapa lokasi pertanaman kedelai
di Jawa 15
2 Hasil amplifikasi RT-/PCR 17
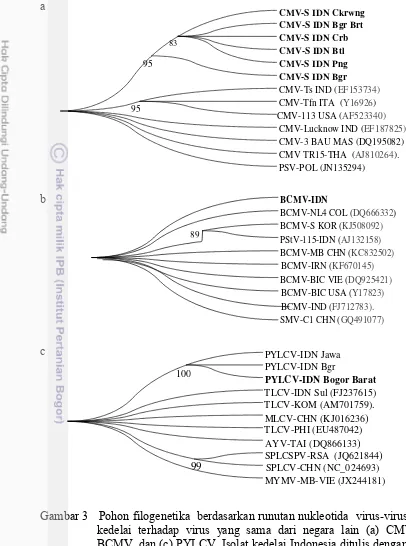
3 Pohon filogenetika berdasarkan runutan nukleotida virus-virus isolat kedelai terhadap virus yang sama dari negara lain 21 4 Tipe gejala yang muncul pada sembilan varietas yang
diinokulasi CMV-S 24
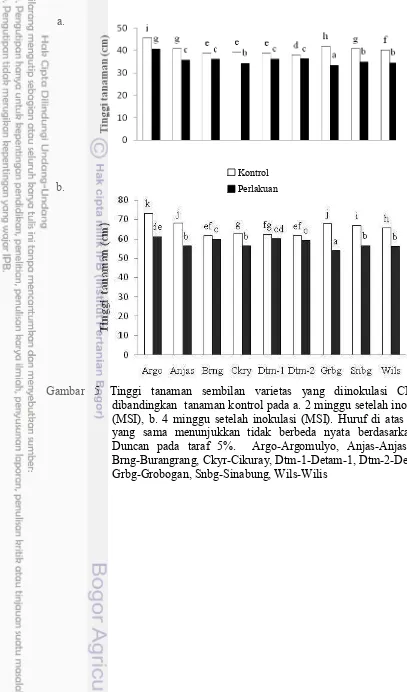
5 Tinggi tanaman sembilan varietas kedelai yang diinfeksi CMV-S dibandingkan kontrol pada 2 dan 4 minggu setelah
inokulasi 26
DAFTAR LAMPIRAN
1
Runutan basa nukleotida gen CP CMV isolat Cikarawang, Bogor
Barat, Cirebon, Bantul, Ponorogo dengan isolat dari negara lainyang terdaftar di GenBank 42
2 Runutan basa nukleotida gen CP Potyvirus isolat Ponorogo dengan isolat dari negara lain yang terdaftar di GenBank 46 3 Runutan basa nukleotida gen CP Gemiviruss isolat Bogor Barat
`
1
PENDAHULUAN
Latar Belakang
Kedelai (Glycine max [L.] Merrill) merupakan salah satu komoditas penting di Indonesia, yang dimanfaatkan sebagai bahan konsumsi pangan juga sebagai bahan baku industri olahan. Kebutuhan kedelai setiap tahunnya mencapai 2.3 juta ton biji kering (Eka et al. 2015). Kebutuhan kedelai yang cukup tinggi belum diikuti dengan produksi yang mencukupi. Produksi kedelai tahun 2009–2014 berturut-turut sebesar 974 510 ton, 907 030 ton, 851 290 ton, 843 150 ton, 779 990 ton, dan 953 960. Untuk memenuhi kebutuhan kedelai nasional, pemerintah melakukan importasi benih kedelai. Impor kedelai pada pertengahan 2014 mencapai 1.58 juta ton; sekitar ±65% dari rata-rata kebutuhan nasional (BPS 2015). Amerika Serikat dan Brazil adalah negara importir kedelai terbesar. Beberapa virus yang dilaporkan menginfeksi kedelai di Amerika Serikat yaitu, Alfalfa mosaic virus (AMV), Soybean mosaic virus (SMV) (Malapi-Nelson et al. 2009), dan Bean pod mottle virus (BPMV) (Giesler et al. 2002). Virus yang menginfeksi kedelai di Brazil yaitu Cowpea mild mottle virus (CPMMV) (Rodrigues et al. 2014), Geminivirus (Fernandes et al. 2009), SMV (Silva et al. 2004), BPMV (Anjos et al. 1999). Tingginya jumlah importasi biji kedelai ke Indonesia memungkinkan masuknya OPT baru terbawa benih.
Kedelai rentan terhadap infeksi virus yang dapat mempengaruhi hasil panen secara kualitas dan kuantitas. Beberapa virus penting pada kedelai di Indonesia ialah Soybean mosaic virus (SMV), menyebabkan penurunan produksi kedelai sebesar 25-93% (Andayanie 2012a), Soybean stunt virus (SSV)/Cucumber mosaic virus strain soybean (CMV-S) (Asadi et al. 2003), menyebabkan penurunan produksi sebesar 41-50% (Honda et al. 1988), Cowpea mild mottle virus (CPMMV), menyebabkan penurunan produksi sekitar 11–56% (Akin 2003).
Upaya penentuan strategi pengendalian virus perlu didukung oleh kemampuan mengidentifikasi virus target. Gejala infeksi virus di lapangan sangat bervariasi, karena ekspresi gejala dipengaruhi oleh virus, lingkungan, dan kultivar tanaman (Matthews 1992). Gejala penyakit yang nampak di lapangan tidak dapat diandalkan untuk mendiagnosis virus penyebab penyakit. Deteksi virus secara serologi dan deteksi asam nukleat dengan polymerase chain reaction (PCR) serta perunutan DNA yang berkembang saat ini dapat membantu identifikasi virus secara akurat.
2
Perumusan Masalah
Mengingat kedelai salah satu komoditas pangan penting Indonesia maka perlu eksplorasi virus yang dapat membatasi produksi kedelai melalui pemutakhiran informasi virus yang telah ada.
Salah satu upaya untuk meningkatkan produksi kedelai adalah menghasilkan varietas yang unggul dan tahan terhadap organisme pengganggu tanaman. Beberapa varietas kedelai yang selama ini dihasilkan melalui teknik pemuliaan lebih mengarah kepada peningkatan hasil secara kuantitas, sehingga masih diperlukan adanya pengujian terhadap respons ketahanan varietas tersebut terhadap virus yang dominan terdeteksi, sehingga rumusan masalah dalam penelitian ini adalah:
1. Belum diketahui informasi status virus-virus yang menginfeksi kedelai saat ini dan sebarannya pada beberapa lokasi pertanaman kedelai di Jawa.
2. Belum tersedia informasi ketahanan varietas kedelai unggulan terhadap infeksi virus yang ada.
Tujuan Penelitian Penelitian ini bertujuan untuk:
1. Mendeteksi dan mengidentifikasi virus-virus yang menginfeksi kedelai pada beberapa lokasi pertanaman kedelai di Jawa.
2. Mengevaluasi respons ketahanan beberapa varietas kedelai unggulan terhadap infeksi virus yang dominan terdeteksi.
Manfaat Penelitian
2
TINJAUAN PUSTAKA
Kedelai Taksonomi Tanaman Kedelai
Kedelai termasuk tanaman yang telah lama dibudidayakan dan berasal dari China (Hymowitz 1970). Pertama kali diintroduksi ke negara Amerika Serikat pada tahun 1765, dan Ontario Kanada yang merupakan penghasil kedelai terbesar (Hymowitz dan Harlan 1983). Dalam sistematika tumbuh-tumbuhan (taksonomi), tanaman kedelai diklasfikasikan sebagai berikut (Bernard dan Weiss 1973):
Divisi : Spermatophyta Class : Dicotyledone Ordo : Polypetales Famili : Leguminosae Sub famil :Papilionoideae Genus : Glycine
Species : Glycine max (L.) Merril Morfologi Tanaman Kedelai
Karakteristik kedelai yang dibudidayakan di Indonesia adalah tanaman semusim, tanaman tegak dengan tinggi 40-90 cm, bercabang, umur tanaman antara 72-90 hari. Kedelai introduksi umumnya tidak memiliki atau memiliki sangat sedikit percabangan dan sebagian bertrikoma padat baik pada daun maupun polong (Adie dan Krisnawati 2007). Selama masa pertumbuhannya, kedelai memerlukan cahaya penuh (McNellis dan Deng 1995).
Tanaman kedelai mempunyai akar tunggang dengan akar-akar cabang, pada akar-akar cabang terdapat bintil-bintil akar berisi bakteri Rhizobium japonicum. Daun terdiri atas empat tipe yang berbeda yaitu kotiledon, daun primer sederhana, beranak daun tiga (trifoliat) dan profila yaitu daun yang terletak pada pangkal tiap cabang. Bunga kedelai tergolong bunga sempurna. Polong pertama tampak setelah 10-14 hari munculnya bunga pertama. Pada batang, cabang, daun dan polong kedelai terdapat bulu yang warnanya berbeda-beda tergantung pada varietas masing-masing (Hidajat 1985).
4
Jenis Virus yang Menginfeksi Tanaman Kedelai
Bean Pod Mottle Virus (BPMV)
Bean pod mottle virus (Comoviridae; Comovirus) memiliki genom RNA bipartit positif yang terdiri atas RNA1 (± 6.0 kb) dan RNA2 (± 3.6 kb) dengan partikel yang isometrik berdiameter 28 nm. Berdasarkan karakterisasi runutan genom virus, BPMV dikelompokkan ke dalam dua sub kelompok yaitu sub kelompok I dan II (Gu et al. 2002; Gu dan Ghabrial 2005).
BPMV pertama kali diidentifikasi sebagai penyebab penyakit tanaman kedelai pada tahun 1951 di Arkansas (Ross dan Butler 1985). Selanjutnya BPMV ditemukan di Missisipi (Pitre et al. 1979) dan Carolina Utara (Ross dan Butler 1985). BPMV menyebar di sepanjang area pertanaman kedelai di USA dan menyebabkan kehilangan hasil sebesar 10 – 50% (Ross 1968).
BPMV ditularkan oleh vektor bean leaf beetles (BLB; Cerotoma trifurcata). Sejak tahun 1999 sampai 2004, insidensi penyakit yang disebabkan BPMV meningkat di wilayah Utara, yang disebabkan meningkatnya populasi dan perpindahan vektor tersebut (Giesler et al. 2002). Zaumeyer dan Thomas (1948) pertama kali menjelaskan infeksi BPMV pada kacang buncis (Phaseolus vulgaris L.), Phaseolus lunatus L. dan kedelai (Glycine max L.).
BPMV menyebabkan gejala belang, mosaik, dan malformasi daun (Gergerich, 1999). Respons tanaman kedelai terhadap infeksi BPMV bervariasi, seperti klorosis ringan sampai mosaik berat, dengan gejala yang sangat jelas pada daun-daun muda (Ross 1968; Walters 1970). Gejala nekrosis dan kematian tanaman juga dapat terjadi tergantung pada ketahanan varietas kedelai. BPMV juga dapat menyebabkan “green stem” karena terhambatnya proses kematangan batang (Schwenk dan Nickell 1980). BPMV menyebabkan kehilangan hasil pada kedelai sekitar 30–52%, dan kehilangan hasil terparah pada saat virus menginfeksi awal masa pertumbuhan tanaman (Gergerich 1999).
Cowpea mild mottle virus (CPMMV)
Cowpea mild mottle virus (Flexiviridae; Carlavirus) (Memelink et al. 1990; Giovanni et al. 2007) pertama kali dilaporkan ditemukan pada kacang tunggak (Vigna unguiculata) di Ghana (Brunt dan Kenten 1973). CPMMV memiliki genom RNA utas tunggal dengan partikel berbentuk filamen berukuran sekitar 650 x 15 nm dan selubung protein berukuran 32-36 Kda (Demski dan Kuhn 1989).
Di Indonesia, CPMMV pertama kali dilaporkan pada tanaman kedelai di Jawa tahun 1984 (Iizuka et al. 1984). Pada beberapa tahun terakhir, CPMMV telah tersebar luas di sentra produksi kedelai di Indonesia sejalan dengan meningkatnya populasi vektor virus yaitu kutukebul (Bemisia tabaci Genn.) di lapangan. Pada saat ini CPMMV juga merupakan virus utama yang menyerang pertanaman kedelai. Kehilangan hasil akibat serangan CPMMV tergantung varietas dan umur tanaman kedelai pada saat terinfeksi (Saleh dan Baliadi 2006). Kehilangan hasil kedelai akibat infeksi CPMMV dapat mencapai 50-90% (Muniyappa dan Reddy 1983).
5
laju infeksi penyakit sangat ditentukan oleh tersedianya sumber inokulum, tingkat kerentanan varietas, populasi vektor, dan faktor lingkungan yang kondusif untuk perkembangan serta aktivitas serangga vektor (Saleh dan Baliadi 2006).
Infeksi CPMMV menyebabkan mosaik, klorosis, nekrosis dan distorsi pada tanaman indikator (Iwaki et al. 1986). Kacang kedelai, (Glycine max L Merill, kacang tanah (Arachis hypogaea L.), kacang tunggak (Vigna unguiculata (L.) Walp.), tomat (Lycopersicon esculentum Mill.), kacang buncis (Vicia faba L.) and Nicotiana clevelandii Gray telah dilaporkan sebagai inang dari CPMMV (Reddy 1991).
Cucumber mosaic virus strain soybean (CMV-S)
Soybean stunt virus (SSV) pertama kali dilaporkan oleh Koshimizu dan Iizuka (1963), memiliki partikel isometrik dengan diameter 25 nm, dan teridentifikasi sebagai salah satu strain dari Cucmber mosaic virus (CMV). Berdasarkan pengujian menggunakan Sodium Dodecyl Sulphate Polyacrilamide Gel Electrophoresis (SDS-PAGE), SSV-A mengandung lima jenis RNA utama dengan berat molekul yang hampir sama dengan RNA CMV dan memiliki kesamaan berat molekul protein yakni 24 kDa. Hasil penelitian menunjukkan pula bahwa SSV-A telah membentuk pseudorekombinasi dengan CMV sehingga bisa disimpulkan bahwa SSV-A yang berasal dari tanaman kedelai merupakan strain CMV dengan serotipe khusus (Tochihara dan Hanada, 1981). CMV memiliki kisaran inang yang sangat luas, lebih dari 1000 spesies tanaman termasuk tanaman monokotil, dikotil, herba,dan pepohonan (Palukaitis et al. 1992).
CMV-S dilaporkan masuk ke Indonesia pada tahun 1973, pertama kali ditemukan di Bogor, selanjutnya menyebar ke seluruh wilayah pertanaman kedelai di pulau Jawa, (Jawa Barat, Jawa Tengah dan Jawa Timur), Sulawesi Selatan, Sumatera Barat dan Lampung serta wilayah pulau Kalimantan (Roechan 1992). Tanaman kedelai yang terinfeksi memperlihatkan gejala mosaik ringan, permukaan daun tidak rata, daun mengecil dan menyempit, serta tanaman menjadi kerdil. Gejala tersebut dapat menghilang pada beberapa varietas kedelai (Honda et al. 1988). Kehilangan hasil akibat infeksi CMV-S pada kedelai sebesar 41-50% (Honda et al. 1988).
CMV ditularkan terutama oleh serangga Aphis glycines Mats., serangga Myzus persicae Sulzer, dan Rhopalosiphum padi Linnaeus dengan kisaran inang yang cukup luas, meliputi famili Polygonaceae,Chenopodiaceae, Amaranthaceae, Leguminosae, Solanaceae, Pedaliaceae, dan Compositae. Virus ini dapat pula ditularkan melalui benih dengan persentase yang tinggi (>70%) (Honda et al. 1988). Penularan secara mekanis di lapang hampir tidak ada, kecuali dengan bantuan manusia (Roechan 1992).
Geminivirus
6
penamaan spesies baru pada tahun 2003, mengikuti pedoman yang ditetapkan oleh Komite Internasional Taksonomi Virus (ICTV) (Fauquet et al. 2003).
Begomovirus adalah salah satu genus yang memiliki arti sangat penting secara ekonomi dan secara geografis menyebar luas (Huang et al. 2006). Begomovirus hanya menginfeksi tanaman dikotil dan ditularkan oleh serangga vektor Bemisia tabaci. Sebagian besar Begomovirus memiliki genom bipartit yang disebut sebagai DNA-A dan DNA B, keduanya sangat penting untuk poliferasi virus (Hanley-Bowdoin et al. 1999). Berdasarkan organisasi genom, keragaman genetik, dan penyebaran geografis, Begomovirus dibagi atas dua grup yaitu OW (Eropa, Afrika, Asia dan Australia) and NW (Amerika) (Fontes et al. 1994). Kehilangan hasil akibat infeksi Begomovirus tercatat di berbagai negara dengan kisaran 50–80%, bahkan dapat mencapai 100% (Mohamed 2010).
Keberadaan PYLCV di Indonesia dilaporkan sejak tahun 2000 di daerah Sleman, Kulon Progo, Bantul, dan Gunung Kidul (DIY) pada cabai rawit
(Capsicum frutescens L.) dengan intensitas mencapai 100% dan pada cabai besar (C. annuum) secara sporadis (Sulandari et al. 2001). Pada percobaan di rumah
kaca, PYLCV dapat menginfeksi tanaman dari famili solanaceae, compositae, dan beberarapa leguminosae seperti kedelai (Sulandari et al. 2006).
Gejala awal yang ditimbulkan pada daun cabai rawit maupun cabai besar berupa penjernihan tulang daun (vein clearing) yang kemudian berkembang
menjadi warna kuning, penebalan tulang daun, dan penggulungan daun (cupping).
Infeksi lanjut menyebabkan daun-daun mengecil, berwarna kuning cerah, dan tanaman menjadi kerdil (Sulandari et al. 2006). Gejala pada tanaman tomat berupa daun mengecil dan kaku, tepi daun melekuk ke atas atau ke bawah (Rusli et al. 1999).
Soybean mosaic virus (SMV)
Soybean mosaic virus (Potyviridae; Potyvirus) adalah virus yang menjadi masalah serius pada area pertanaman kedelai di dunia (Wang 2009). SMV memiliki genom RNA utas tunggal dengan partikel virus berbentuk batang lentur (filamentous) berukuran panjang 650-900 nm dan diameter 11-13 nm (Chen et al. 2001; Chen et al. 2003).
SMV dilaporkan menginfeksi kedelai di Jepang, Korea selatan, Kanada, Brazil, Australia dan negara-negara yang banyak terdapat pertanaman kedelai. Infeksi SMV biasanya menyebabkan kehilangan hasil yang parah dan penurunan kualitas biji (Hill 1999; Arif dan Hasan 2002). Insidensi penyakit pada awal pertumbuhan dapat mencapai 13.42–30.10% (Koning dan Te Krony 2003; Hobbs et al. 2003; Andayanie 2012b).
7
SMV dapat ditularkan oleh benih yang terinfeksi yang merupakan sumber inokulum primer, sementara gulma juga berfungsi sebagai tempat bertahan virus tersebut. Penyebaran SMV lebih lanjut melalui aktivitas lebih dari 32 species aphid secara nonpersisten (Arif dan Hasan 2002; Steinlage et al. 2002).
Dibandingkan dengan Potyvirus yang lain, kisaran inang SMV relatif sempit. Virus tersebut dapat menginfeksi tanaman dari famili Fabaceae (termasuk Leguminosa), Amaranthaceae,Chenopodiaceae, Passifloraceae Schropulariaceae dan Solanaceae, tetapi yang terbanyak adalah Leguminoceae termasuk kedelai dan kerabat liarnya (Galvez 1963; Hill 1999).
Respons Ketahanan Tanaman
Tanaman memiliki banyak cara untuk melawan infeksi virus, namun di sisi lain, virus tanaman juga telah berevolusi untuk mengatasi berbagai respons ketahanan tanaman. Ketahanan tanaman terhadap virus terjadi pada tingkatan yang berbeda-beda dan oleh mekanisme yang bervariasi (Palukaitis dan Carr 2008). Mekanisme utama ketahanan tanaman terhadap infeksi virus yaitu menghambat replikasi virus, menghambat perpindahan sel ke sel, dan infeksi sistemik (long-distance movement) (Zailtin dan Hull 1987). Ketahanan tanaman juga dapat terjadi melalui mekanisme RNA silencing dan RNA interfering (RNAi) (Brodersen dan Voinnet 2006).
Respons tanaman terhadap infeksi patogen, termasuk virus umumnya dikelompokkan atas imun, tahan, toleran, dan rentan. Respons tanaman imun dicirikan oleh ketidakmampuan virus untuk bermultiplikasi sehingga gejala tidak terjadi (Jones dan Dangl 2006). Respons tanaman imun terhadap virus terjadi hanya pada satu genotipe dari satu spesies tapi tidak terjadi pada genotipe yang lainnya. Apabila respons imun tanaman terjadi terhadap semua biotipe patogen dan pada semua kultivar atau aksesi dari spesies tanaman tertentu, hal ini disebut sebagai non-host resistance (Bruening 2006).
Respons tahan adalah kemampuan tanaman menghambat replikasi dan penyebaran virus di dalam sel tanaman atau menghambat perkembangan gejala penyakit (Maule et al. 2007). Ketahanan ini digambarkan sebagai kemampuan tanaman untuk membatasi perkembangan virus dalam sel tertentu sehingga virus tidak menyebar ke sel-sel yang lain (Goldbach et al 2003).
Respons toleran adalah tanaman rentan terhadap infeksi virus tetapi memiliki kemampuan bertahan terhadap keberadaan dan multiplikasi virus yang ditunjukkan dengan gejala ringan atau tanpa gejala (Bruening 2006). Sebagai tambahan, respons toleransi biasanya berasosiasi dengan tereduksinya titer virus dalam tanaman (Palukaitis dan Carr 2008). Sebelumnya, Lapidot et al (1997) juga menyatakan bahwa kultivar toleran memiliki kemampuan untuk sembuh dari infeksi namun tidak mampu membatasi multiplikasi virus.
3
METODE
Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman dan di rumah kaca Fakultas Pertanian, Institut Pertanian Bogor. Penelitian ini dilaksanakan dari bulan Februari 2014 sampai dengan bulan Mei 2015.
Pelaksanaan Penelitian
A. Deteksi dan Identifikasi Virus dari Beberapa Pertanaman Kedelai di Jawa
Pengambilan sampel tanaman kedelai. Sampel tanaman kedelai diambil dari pertanaman kedelai di Kecamatan Cikarawang dan Kecamatan Bogor Barat, Kabupaten Bogor (Jawa Barat), Kecamatan Gempol, Kabupaten Cirebon (Jawa Barat), Kecamatan Kasihan, Kabupaten Bantul (DI Yogyakarta), dan Kecamatan Babadan, Kabupaten Ponorogo (Jawa Timur). Pengambilan sampel dilakukan dengan metode purposive sampling, sebanyak masing-masing 50 tanaman bergejala penyakit diambil dari setiap lokasi.
Insidensi Penyakit. Insidensi penyakit virus ditentukan dengan mendeteksi sampel tanaman dari lapangan secara serologi dengan metode dot blot immunobinding assay (DIBA) menggunakan antibodi spesifik CMV, SMV, CPMMV, dan BPMV mengikuti protokol yang digunakan Anggraini dan Hidayat (2014) dengan modifikasi minor.
Jaringan daun tanaman digerus dalam tris buffer saline (TBS:Tris-HCl 0.02 M dan NaCl 0.15 M, pH 7.5) dengan perbandingan 1:10 (b/v). Sebanyak 2 μL cairan perasan tanaman diteteskan di atas membran nitroselulosa. Setelah tetesan sampel kering, membran direndam di dalam larutan blocking non-fat milk 2% dalam TBS yang mengandung Triton X-100 dengan konsentrasi akhir 2%. Membran kemudian diinkubasi pada suhu ruang sambil digoyang dengan kecepatan 50 rpm selama 2 jam dengan menggunakan EYELA multi shaker MMS. Membran kemudian dicuci 5 kali dengan dH2O, setiap pencucian berlangsung 5 menit sambil digoyang dengan kecepatan 100 rpm.
Membran selanjutnya direndam dalam 5 mL TBS yang mengandung antibodi kedua yang berikatan dengan enzim fosfatase ditambah non-fat milk dengan konsentrasi akhir 2% dan kemudian diinkubasi semalam pada suhu 4 ºC. Membran kemudian dicuci sebanyak 5 kali dengan Tween 0.05% dalam TBS (TBST) dan direndam selama 30 menit dalam 10 mL buffer AP (Tris-HCl 0.1 M, NaCl 0.1 M dan MgCl2 5 mM pH 9.5) yang mengandung 45 μL nitro blue
9
Insidensi infeksi virus dihitung menggunakan rumus: Jumlah tanaman positif terinfeksi
Jumlah total tanaman uji Deteksi asam nukleat dengan Metode RT-/PCR
Virus target terdiri atas CMV, SMV, Potyvirus, dan Geminivirus. Tiga virus (CMV, SMV, dan Potyvirus) dideteksi dengan metode reverse transcription (RT-PCR), sedangkan Geminivirus dengan metode PCR.
Ekstraksi Asam Nukleat. RNA total diekstraksi dari daun tanaman menggunakan GeneJET Plant RNA Purification Mini Kit dengan protokol sesuai yang direkomendasikan oleh pembuatnya (Thermo Scientific).
Tahapan ekstraksi RNA total adalah sebagai berikut 500 µL Plant RNA lysis solution dimasukkan ke dalam tabung microcentrifuge, 5 µL mercaptoethanol (1% dari volume total) ditambahkan ke dalam tabung. Sebanyak 0.1 g sampel daun kedelai digerus bersama Nitrogen cair menggunakan mortar dan pistil steril, ditambahkan ke dalam tabung dan diinkubasi dalam water bath pada suhu 56 °C selama 30 menit. Tabung disentrifugasi dengan kecepatan 12 000 rpm selama 5 menit. Supernatan sampel dipindahkan ke tabung baru yang telah berisi Etanol 95% dan dicampurkan sampai rata. Campuran supernatan dan Etanol dicampurkan ke dalam purification column yang berisi Plant RNA lysis solution yang berada di dalam collection tube. Tabung disentrifugasi dengan kecepatan 12 000 rpm selama 1 menit, dan larutan yang terkumpul pada collection tube dibuang. Sebanyak 700 µl wash buffer (WB 1) ditambahkan ke dalam purification column dan disentrifugasi dengan kecepatan 12 000 rpm selama 1 menit, selanjutnya purification column dipindahkan pada collection tube 2 mL yang bersih. Sebanyak 500 µl wash buffer (WB 2) ditambahkan ke dalam purification column dan disentrifugasi dengan kecepatan 12 000 rpm selama 1 menit. Cairan yang terkumpul pada collection tube dibuang dan disentrifugasi lagi dengan kecepatan 12 000 rpm selama 1 menit. Cairan yang terkumpul pada collection tube dibuang, purification column dipindahkan ke Rnase-free collection tube yang berukuran 1.5 mL. Sebanyak 50 µL nuclease-free water ditambahkan ke bagian tengah membran purification column dan disentrifugasi dengan kecepatan 12 000 rpm selama 1 menit. Purification column dipindahkan dan tabung yang berisi cairan RNA disimpan pada suhu -20 °C yang siap digunakan sebagai template untuk sistesis cDNA.
Untuk deteksi Geminivirus, DNA total diekstraksi mengikuti protokol yang dikembangkan oleh Doyle dan Doyle (1987). Tahapan ekstraksi DNA total adalah sebagai berikut 0.1 g sampel digerus dengan Nitrogen cair, 500 µL buffer CTAB (10% Cetyl-trimethyl-ammonium bromida, 0.1 M Tris HCL pH 8, 0.05 M EDTA, 0.5 M NaCl, 1% β-mercapto-ethanol/1 mL bufer) ditambahkan dan digerus lagi sampai halus. Sap yang sudah halus dipindahkan ke dalam tabung microcentrifuge berukuran 1.5 mL. Sap tanaman diinkubasi dalam water bath pada suhu 65 ºC selama satu jam, dan setiap 10 menit tabung dibolak-balik untuk memisahkan lipid dan protein. Sebanyak 500 µL campuran Chloroform dan Isoamilalkohol (C:I = 24:1) ditambahkan ke dalam cairan sap sampel, divorteks selama ±15 menit sampai tercampur rata, selanjutnya disentrifugasi dengan kecepatan 14 000 rpm selama 15 menit. Supernatan dipindahkan ke dalam tabung baru dan ditambahkan
10
Sodium asetat (CH3COONa dengan volume 10% dari volume supernatant) dan Isopropanol (dengan volume 2/3 dari volume total). Tabung yang berisi campuran tersebut ditempatkan pada mortar dan direndam dengan Nitrogen cair selama ±1 menit, selanjutnya disentrifugasi dengan kecepatan 12 000 rpm selama 10 menit. Cairan yang terbentuk dibuang dan pellet yang terbentuk dicuci dengan 500 µL Etanol 70%, selanjutnya disentrifugasi dengan kecepatan 8000 rpm selama 5 menit. Cairan yang terbentuk dibuang dan endapan DNA yang terbentuk dikeringkan hingga benar-benar kering, selanjutnya disuspensi dengan 50-100 µL buffer TE pH 8 dan DNA siap digunakan untuk amplifikasi.
Sintesis cDNA. Sintesis complementary DNA (cDNA) dilakukan terhadap RNA total sesuai protokol yang dilaporkan Anjarsari et al. (2013). RNA total yang diperoleh digunakan sebagai template untuk sintesis first strand complementary DNA (cDNA) pada mesin PCR. Transkripsi balik menjadi cDNA (complementary DNA) melalui teknik Reverse Transcription (RT). Reaksi RT dibuat dengan total volume 20 μL yang mengandung 4 μL RNA total dan 1.5 μL oligo(dT), 4 μL bufer RT 5x, 1 μL 10 mM dNTP (deoksiribonukleotida triphosphat)), 0.7 μL DTT 50 mM, 0.7 μL RNase inhibitor, 0.7 μL M-MuLV Rev, dan 7.4 μL ddH2O. Tabung yang berisi RNA total dan oligo(dT) diinkubasi selama 5 menit pada suhu 65 °C dan kemudian disimpan pada wadah yang berisi es, selanjutnya dimasukkan ke dalam tabung yang berisi campuran reaksi 4 μL bufer RT 5x, 1 μL 10 mM dNTP (deoksiribonukleotida triphosphat)), 0.7 μL DTT 50 mM, 0.7 μL RNase inhibitor, 0.7 μL M-MuLV Rev, dan 7.4 μL ddH2O. [5‟-ACTGGGAGCACTC-CAGATGTG-3‟] dengan target amplikon ~650 pb, dan
program PCR sesuai yang dilakukan Damayanti dan Wiyono (2015). Amplifikasi SMV menggunakan pasangan primer spesifik, CI-F [5‟-GCATTCAACTGTGCG CTTAAAGAAT-3‟] dan CI-R [5‟-TTGAGGCTGCAAAAATTACTCACTT-3‟] dengan target amplikon berukuran ~1385 pb dan program PCR sesuai yang dilakukan Kim et al. (2004). Potyvirus diamplifikasi menggunakan pasangan
primer universal sebagian gen protein selubung (CP) Potyvirus MJ1 [5‟-ATGGTHTGGTGTGYATHGARAAYGG-3‟]dan MJ2 [5‟TGCTGCKGCYT
TCAT-YTG-3‟] dengan target amplikon berukuran ~320 pb dan program PCR sesuai yang dilakukan Grisoni et al. (2006). Amplifikasi Geminivirus menggunakan pasangan primer SPG1 [5′-CCCCKGTGCGWRAATCCAT-3′] dan SPG2 [5′-ATCCVAAYWTYCAGGGAGCTAA-3′] dengan target amplikon berukuran ~900 pb dan program PCR sesuai yang dilakukan Li et al. (2004).
11
∑nb (N-1)T Jumlah tanaman terinfeksi
Total tanaman yang diinokulasi X 100%
filogenetika dilakukan menggunakan software Molecular Evolutionary Genetics Analysis (MEGA 6.06) dengan model pohon Neighbor Joining menggunakan bootstrap sebanyak 1000 kali.
B. Respons Ketahanan Sembilan Varietas Kedelai terhadap Infeksi CMV-S Perbanyakan inokulum CMV-S. Inokulum diperbanyak dengan cara inokulasi mekanis. Sebanyak 0.1 g daun digerus dengan mortar menggunakan bufer fosfat 0.01 M pH 7.0 perbandingan 1:5 (b/v). Inokulasi mekanis dilakukan dengan mengoleskan sap tanaman sakit pada daun primer tanaman kedelai yang telah ditaburi karborundum 600 mesh sebagai agen peluka. Setelah sap tanaman sakit dioleskan pada daun tanaman, karborundum dibersihan dengan aquades yang mengalir (Damayanti dan Panjaitan 2014). Tanaman kedelai yang telah diinokulasi dipelihara hingga muncul gejala dan dipersiapkan sebagai sumber inokulum.
Penyiapan tanaman uji. Sembilan varietas kedelai yang diuji respons ketahanannya yaitu Argomulyo, Anjasmoro, Burangrang, Cikuray, Detam-1, Detam-2, Grobogan, Sinabung, dan Wilis, dengan masing-masing 15 tanaman sebagai ulangan. Benih tanaman kedelai disemai pada polibag yang telah berisi media tanam yang dicampur dengan pupuk kandang yang telah disterilkan dengan perbandingan 1 : 1. Media tanam selalu dijaga dalam keadaan lembab agar dapat merangsang perkecambahan dengan baik. Pemupukan dengan NPK dilakukan pada minggu pertama setelah tanam. Tanaman dipelihara dan dirawat sehingga siap untuk diinokulasi. Tanaman siap dinokulasi dengan isolat CMV-S pada umur 14 hari setelah tanam (HST).
Inokulasi CMV-S. Tanaman uji diinokulasi secara mekanis mengikuti prosedur yang dilakukan oleh Damayanti dan Panjaitan (2014), pada waktu daun trifoliat pertama telah membuka penuh pada 14 hari setelah tanam (HST). Setelah inokulasi, tanaman dipelihara sampai muncul gejala.
Peubah Pengamatan. Pengamatan dilakukan terhadap periode inkubasi, tipe gejala, insidensi penyakit, keparahan penyakit, indeks keparahan penyakit, dan titer virus. Periode inkubasi virus dihitung sejak virus diinokulasi hingga menunjukkan gejala pada tanaman. Insidensi penyakit (IP) dihitung dengan menggunakan rumus:
IP =
Indeks keparahan penyakit dihitung dengan mengukur skor penyakit pada masing-masing tanaman uji. Kategori skor yang digunakan yaitu 0=tidak bergejala; 1=gejala mosaik ringan; < 25% dari jumlah daun, 2=gejala mosaik kunimg, malformasi; 25 – 50% dari jumlah daun, 3=gejala mosaik berat; sampai 75% dari jumlah daun, 4=gejala mosaik berat; >75% dari jumlah daun.
Indeks keparahan penyakit (IKP) dihitung dengan rumus seperti yang digunakan Ntui et al. (2014) dan Krishnamoorthy et al. (2004):
12
K0 - K1 K0
n: jumlah tanaman pada masing-masing skor; b:skor; N: banyaknya skor yang dipergunakan; T: jumlah tanaman yang diamati.Tanaman dengan indeks penyakit 0.0 dikategorikan imun, <2.5 dikategorikan resisten, 2.5–5.0 dikategorikan moderat resisten/toleran, 5.1–7.5 dikategorikan rentan, > 7.5 dikategorikan sangat rentan.
Pengukuran titer virus. Daun tanaman uji dideteksi secara serologi dengan metode Double Antibody Sandwich ELISA (DAS-ELISA) menggunakan antiserum CMV dengan protokol sesuai dengan yang direkomendasikan pembuatnya (DSMZ). Plat mikrotiter diisi dengan 100 µL antibodi pertama CMV yang diencerkan dalam bufer coating (0.159 g Na2CO3, 0.29 g NaHCO3, 0.02 g NaN3, polyvinylpyrrolidone 2 g yang dilarutkan dalam 100 mL dH2O, pH 9.6) ke dalam sumuran plat mikrotiter. Plat mikrotiter diinkubasi pada suhu 37 ºC selama 2-4 jam, plat dicuci dengan 200 µL 1X phosphate buffer saline tween-20 (PBST) [8 g NaCl, 0.2 g KH2PO4, 1.15 g Na2HPO4, 0.2 g KCl, 0.2 g NaN3, 0.5 mL Tween-20, diencerkan dengan 1000 mL H2O] sebanyak 5-8 kali.
Sampel tanaman digerus dalam general extract buffer (1,3 g Na2SO3, 20 g PVP- 40, 0.2 g NaN3, 2 g powdered egg albumin, 20 g Tween-20, pH 7,4) dengan perbandingan 1 : 10 (b/v). Sap tanaman diambil sebanyak 100 μL kemudian dimasukkan kedalam sumuran plat mikrotiter dan diinkubasi semalam pada suhu 4 ºC. Sap tanaman dibuang, selanjutnya plat mikrotiter dicuci dengan PBST sebanyak 5-8 kali. Sebanyak 100 μL enzim konjugat yang dilarutkan dalam bufer ECL (2 g bovineserum albumin, 20 g PVP-40, 0.2 g NaN3) dimasukkan ke dalam sumuran dan diinkubasi pada suhu 37 ºC selama 2 jam, kemudian dibilas 5-8 kali dengan PBST. 100 μL PNP (P-nitrophenyl-phosphate) yang telah dilarutkan dalam bufer substrat (0.1 g MgCl2, 0.2 g NaN3, 97 mL dietanolamin), dimasukkan ke dalam sumuran plat mikrotiter dan diinkubasikan selama 30-60 menit pada suhu ruang sampai terjadi perubahan warna di dalam sumuran plat mikrotiter yang menandakan reaksi positif. Reaksi segera dihentikan dengan penambahan 3M NaOH. Nilai absorbansi reaksi dianalisis secara kuantitatif dengan spektrofotometer Microplate reader BIO-RAD Model 550 pada panjang gelombang 405 nm. Uji positif jika nilai absorbansi ELISA (NAE) tanaman uji 2 kali lebih besar dari NAE kontrol negatif (tanaman sehat).
Pengamatan juga dilakukan terhadap peubah agronomi yaitu tinggi tanaman (1-4 MSI), masa berbunga (4 MSI), dan jumlah bunga mekar (5-6 MSI). Penghambatan tinggi tanaman akibat infeksi virus dihitung dengan menggunakan rumus:
THR =
THR: persentase penghambatan pertumbuhan, K0: tinggi tanaman kontrol, K1: tinggi tanaman yang diinokulasi CMV-S.
13
(1-X/Xp) (1-Y/Yp)
Tingkat toleransi varietas kedelai terhadap cekaman dapat ditentukan berdasarkan nilai indeks sensitivitas cekaman (S) pada berbagai peubah. Nilai indeks sensitivitas cekaman (S) merupakan nilai relatif besarnya penurunan nilai dari berbagai peubah yang diamati pada kondisi cekaman dibandingkan dengan kondisi tanpa cekaman (kontrol) (Widoretno 2011).
Indeks sensitivitas cekaman (S) dihitung berdasarkan rumus Fischer dan Maurer (1978):
S =
Y: nilai rataan jumlah bunga mekar pada satu varietas yang dinfeksi CMV-S, Yp : nilai rataan jumlah bunga mekar pada satu varietas kontrol, X: nilai rataan jumlah bunga mekar pada semua varietas yang diinfeksi CMV-S, Xp: nilai rataan jumlah bunga mekar pada semua varietas kontrol.
Varietas dikatakan toleran terhadap cekaman tertentu jika mempunyai nilai S < 0.5, agak toleran jika 0.5 ≤ S ≤ 1, dan peka jika S > 1
4
HASIL DAN PEMBAHASAN
A Deteksi Virus dari Beberapa Pertanaman Kedelai di Jawa Gejala Penyakit
Gejala yang beragam ditemukan pada tanaman kedelai di beberapa lokasi di Jawa (Tabel 1). Gejala yang ditemukan umumnya mosaik, permukaan daun yang tidak merata/melepuh, penebalan tulang daun, malformasi daun, pinggiran daun melengkung ke atas (cupping) dan menguning (Gambar 1).
Gejala mosaik ditemukan di semua lokasi pengambilan sampel dengan intensitas ringan sampai berat, permukaan daun yang tidak rata, penebalan tulang daun dan malformasi daun. Hasil deteksi secara serologi menunjukkan gejala mosaik dapat disebabkan oleh infeksi tunggal maupun infeksi campuran oleh dua atau lebih virus. Infeksi campuran dapat menyebabkan gejala mosaik yang lebih berat, malformasi daun dan menguning.
Variasi gejala yang ditemukan di lapangan kemungkinan dapat disebabkan kultivar yang berbeda dan umur tanaman yang bervariasi saat pengambilan sampel dilakukan. Umur tanaman kedelai di lapangan berkisar 45–60 hari setelah tanam (HST). Gejala penyakit virus pada tanaman kedelai setelah melewati awal pertumbuhan (14–28 HST) sulit dibedakan dengan infeksi virus lain karena gejalanya menjadi kompleks dan bervariasi (Andayanie 2012a).
Tabel 1 Gejala infeksi virus pada tanaman kedelai di beberapa lokasi di Jawa
Lokasi
Jenis gejala1)
M R VB MD Y
Cikarawang + + + + +
Bogor Barat + - + + +
Cirebon + + - + -
Bantul + + + - -
Ponorogo + + + - -
1)
15
Gambar 1 Gejala infeksi virus pada beberapa pertanaman kedelai di Jawa; a. mosaik, b. mosaik, daun mengecil, permukaan daun tidak rata dan
tepi daun melengkung, c. daun mengecil, penebalan tulang daun, d. malformasi daun, menguning dan tepi daun melengkung ke atas, dan e. pinggiran daun menguning
Insidensi Infeksi Virus
Hasil uji serologi menunjukkan infeksi CMV paling tinggi dibandingkan dengan infeksi SMV dan CPMMV (Tabel 2). Insidensi penyakit CMV berturut-turut ialah 84%, 72%, 78%, 74% dan 82% untuk daerah Cikarawang, Bogor Barat, Cirebon, Bantul, dan Ponorogo. Beberapa sampel terinfeksi oleh beberapa virus (infeksi campuran) antara CMV dan virus lainnya (Tabel 3).
Tabel 2 Insidensi infeksi virus berdasarkan reaksi serologi
Lokasi
Insidensi Penyakit (%)
BPMV CMV CPMMV SMV
Cikarawang 0/50 (0) 42/50 (84) 3/50 (6) 8/50 (16)
Bogor Barat 0/50 (0) 36/50 (72) 0/50 (0) 0/50 (0)
Cirebon 0/50 (0) 39/50 (78) 4/50 (8) 12/50 (24)
Bantul 0/50 (0) 37/50 (74) 0/50 (0) 7/50 (14)
Ponorogo 0/50 (0) 41/50 (82) 0/50 (0) 11/50 (22)
a b c
16
Tabel 3 Insidensi infeksi campuran virus berdasarkan reaksi serologi Lokasi
Insidensi Infeksi Campuran (%)
C+CP C+S CP+S C+CP+S
Cikarawang 1/50 (2) 6/50 (12) 0/50 (0) 1/50 (2) Bogor Barat 0/50 (0) 0/50 (0) 0/50 (0) 0/50 (0) Cirebon 2/50 (4) 8/50 (16) 0/50 (0) 2/50 (4) Bantul 050 (0) 6/50 (12) 0/50 (0) 0/50 (0) Ponorogo 0/50 (0) 10/50 (20) 0/50 (0) 0/50 (0) C:CMV, CP:CPMMV, S:SMV
Hasil deteksi secara serologi menunjukkan gejala mosaik dapat disebabkan oleh infeksi tunggal maupun infeksi campuran oleh dua atau lebih virus. Infeksi campuran dapat menyebabkan gejala mosaik yang lebih berat, malformasi daun dan menguning. Infeksi tunggal oleh CMV pada kedelai menyebabkan gejala penyakit yang lebih ringan dibandingkan gejala oleh infeksi Cowpea mottle virus (CMoV) (Arogundade et al. 2009). Pada infeksi campuran beberapa virus terjadi interaksi dua virus atau lebih yang menginduksi gejala lebih parah (sinergistik) atau sebaliknya (antagonistik) (Syller 2012).
Amplifikasi DNA dan Runutan DNA
Fragmen DNA CMV berhasil diamplifikasi dengan primer spesifik gen CP (~650 pb) dari semua sampel (Gambar 2a). Fragmen DNA SMV tidak berhasil diamplifikasi dengan primer spesifik gen CI SMV dari sampel asal Ponorogo (data tidak ditampilkan) namun dari sampel yang sama berhasil diamplifikasi Potyvirus (~320 pb) (Gambar 2b). Sampel daun yang bergejala cupping serta menguning yang hanya ditemukan di lokasi Bogor Barat terdeteksi positif CMV dan Geminivirus (Gambar 2c).
Hasil analisis runutan nukleotida DNA gen CP CMV dari semua lokasi menunjukkan homologi yang tinggi sebesar 95.4–99.3% dengan CMV strain kedelai asal Bogor (FJ177303) (Tabel 3). Runutan DNA sebagian gen CP sampel Ponorogo menunjukkan homologi tertinggi sebesar 88.3% dengan BCMV isolat kacang hijau asal Cina (KC832502) dan BCMV strain Blackeye asal kacang merah dari Vietnam (DQ925421) (Tabel 4). Runutan DNA sampel dari Bogor Barat yang diamplifikasi dengan primer universal gen CP Geminivirus menunjukkan homologi tertinggi sebesar 95.5% dengan Pepper yellow leaf curl virus (PYLCV) isolat cabai asal Bogor (DQ083764) dan asal Jawa (JX416180) (Tabel 5).
17
1
M 2 3 4 5 6 M 1 2 3 4 5 6 M 1 2 3 4 5 6
18
18
Tabel 4 Tingkat homologi runutan nukleotida gen CP CMV isolat Cikarawang (Ckrw), Bogor Barat (Bgr Brt), Cirebon (Crb), Bantul (Btl), dan Ponorogo (Png) dengan isolat dari negara lain yang terdaftar di GenBank
No Asal Isolat Homologi (%)
1 2 3 4 5 6 7 8 9 10 11 12 13
1 IDN-Ckrw ID
2 IDN-Bgr Brt 95.4 ID
3 IDN-Crb 95.6 99.5 ID
4 IDN-Btl 95.7 99.3 99.5 ID
5 IDN-Png 95.6 99.1 99.3 99.8 ID
6 IDN-Bgra 95.4 98.8 99.0 99.5 99.3 ID
7 USAb 87.6 90.5 90.5 91.0 90.8 91.2 ID
8 INDc 87.6 90.5 90.5 91.0 90.8 91.2 100 ID
9 INDd 85.2 87.8 87.9 88.4 88.2 88.6 93.4 93.4 ID
10 MASe 84.5 87.4 87.4 87.8 87.6 87.9 95.4 95.4 93.1 ID
11 ITAf 87.5 90.4 90.4 90.8 90.7 91.0 99.8 99.8 93.6 95.6 ID
12 THAg 86.0 88.9 88.9 89.4 89.2 89.5 96.0 96.0 93.4 96.7 96.2 ID
13 POLh 39.2 40.5 40.4 40.8 40.8 41.1 41.9 41,9 40.5 41.4 41.7 42.4 ID
a
CMV pada kedelai (FJ177303). bCMV isolat 113 pada labu (AF523340.). cCMV strain Ts pada tomat (EF153734). dCMV pada amarilis (EF187825).
e
CMV pada lada hitam (DQ195082). fCMV strain Tfn pada tomat (Y16926) . gCMVpada ketimun (AJ810264). hPeanut stunt virus (JN135294) sebagai
pembanding luar kelompok (out group).
19
Tabel 5 Tingkat homologi runutan nukleotida gen CP Potyvirus isolat Ponorogo (Png) dengan isolat dari negara lain yang terdaftar di GenBank
No Asal Isolat
Homologi (%)
1 2 3 4 5 6 7 8 9 10
1 IDN-Png ID
2 CHNa 88.3 ID
3 VIEb 88.3 94.7 ID
4 COLc 88.0 92.9 91.7 ID 5 IRNd 87.4 95.3 93.2 93.5 ID
6 INDe 87.7 94.7 97.2 92.0 93.2 ID
7 KORf 85.2 91.1 90.1 91.7 90.7 92.3 ID
8 USAg 87.7 95.3 97.8 92.9 94.4 98.1 91.4 ID 9 IDNh 85.5 91.4 90.4 91.4 91.1 92.6 99.6 91.7 ID
10 CHNi 40.2 42.0 41.7 41.1 42.3 43.2 42.3 43.5 42.0 ID
a
BCMV isolat Mungbean pada kacang hijau (KC832502)‟ bBCMV strain Blackeye pada kacang merah (DQ925421). cBCMV strain NL4 pada kacang merah (DQ666332). dBCMV isolat Golestan
pada kacang merah (KF670145). eBCMV pada vanili (FJ712783). fBCMV isolat Habin1 pada kedelai (KJ508092), gBCMV strain Blackeye pada kacang tunggak (Y17823). hPeanut stripe virus
20
Tabel 6 Tingkat homologi runutan nukleotida gen CP Geminivirus isolat Bogor Barat (Bgr Brt) dengan isolat dari negara lain yang terdaftar di GenBank
No Asal Isolat Homologi (%)
1 2 3 4 5 6 7 8 9 10 11
1 IDN-Bgr Brt ID
2 IDN-Bgra 95.5 ID
3 IDN-Jawab 95.5 96.2 ID
4 IDN-Sulc 73.6 72.9 73.8 ID
5 KOMd 76.1 75.9 75.7 70.9 ID
6 PHIe 75.8 75.4 75.2 71.1 78.8 ID
7 CHNf 76.3 76.3 76.5 70.6 81.3 80.1 ID
8 TAIg 75.2 75.2 75.2 71.4 82.1 84.1 81.6 ID
9 RSAh 62.5 63.1 63.3 65.7 65.9 66.4 66.2 66.8 ID
10 CHNi 62.9 63.6 63.7 63.1 65.9 66.2 66.7 67.0 84.5 ID
11 VIEj 35.1 35.4 35.1 34.7 37.1 37.1 36.4 37.0 34.7 34.6 ID
a
Pepper yellow leaf curl Indonesia virus (PYLCV-In) (DQ083764). cPepper yellow leaf curl Indonesia virus A (PYLCV-In A)
(JX416180). cTomato leaf curl Sulawesi virus (TLCV-Sul) (FJ237615).dTomato leaf curl Comoros virus (TLCV-Com) (AM701759).
e
Tomato leaf curl Cebu virus (TLCV-Cebu) (EU487042). fMalvastrum leaf curl Guandong virus (MLCV-Guandong) (KJ016236).
g
Ageratum yellow vein Hualian virus (AYVV-Hualian) (DQ866133). hSweet potato geminivirus (SPG-SPLCSPV) (JQ621844). iSweet
21
a
b
c
22
`
Hasil deteksi dan identifikasi molekuler menunjukkan CMV-S adalah virus yang dominan menginfeksi kedelai di semua lokasi pengambilan sampel. Hal ini mungkin menunjukkan bahwa virus tersebut telah menyebar merata di semua lokasi pengambilan sampel. CMV-S dapat ditularkan melalui benih dan beberapa spesies kutudaun secara nonpersisten. Penularan CMV-S melalui benih cukup tinggi, yaitu 40–100% (Hartman et al. 1999). Runutan nukleotida gen CP CMV yang berasal dari seluruh lokasi pengambilan sampel memiliki homologi yang tinggi terhadap CMV-S asal Bogor serta membentuk satu kelompok tersendiri yang terpisah dengan CMV strain nonlegum asal negara lain, namun masih termasuk dalam subgrup IB.
Homologi yang tinggi antarisolat CMV dari semua lokasi pengambilan sampel menunjukkan hampir tidak ditemukan keragaman genetika gen CP CMV-S. Perbedaan geografi kurang atau tidak berkontribusi terhadap keragaman genetika CMV-S. Hal ini diduga karena telah terjadi adaptasi inang SSV (CMV-S) terhadap kedelai lokal sehingga SSV (CMV-S) membentuk satu kelompok sendiri dalam filogenetika meskipun berbeda asal secara geografis (Hong et al. 2003).
BCMV dan CMV dilaporkan menginfeksi kedelai, kacang hijau, dan kacang tanah di Jawa Barat (Green et al. 1988). Kedelai yang diinokulasi dengan BCMV menghasilkan gejala mosaik ringan yang tersebar di permukaan daun (Petrovic 2010). Berdasarkan gejala yang ditemukan di lapangan, sulit membedakan mosaik yang disebabkan CMV dan BCMV. Deteksi serologi atau asam nukleat sangat diperlukan untuk memastikan virus penyebabnya.
Reaksi silang secara serologi dapat terjadi karena kedekatan homologi gen-gen tertentu suatu virus dalam gen-genus yang sama. Gen CP SMV memiliki homologi yang sangat dekat dengan BCMV, namun terpisah jauh dengan Bean common mosaic necrosis virus (BCMNV) (Chen et al. 2003). Reaksi silang antara SMV dan BCMV diduga terjadi juga dalam penelitian ini. Sampel uji yang positif terdeteksi sebagai SMV dalam deteksi serologi, teramplifikasi hanya dengan primer universal Potyvirus dan hasil analisis runutan DNA gen CP sampel tersebut menunjukkan homologi tertinggi dengan BCMV asal Cina dan Vietnam. Hal yang sama dilaporkan terjadi juga pada Henbane mosaic potyvirus (HMV) dan Potato Y potyvirus (PVY) bereaksi positif dengan antiserum Eggplant mottle virus (EMoV) (Bhat et al. 1999) dan Tomato spotted wilt virus (TSWV) bereaksi positif dengan Chrysanthemum stem necrosis virus (CSNV) (Boben et al. 2007).
Teridentifikasinya BCMV pada kedelai belum pernah dilaporkan sebelumnya di Indonesia, walaupun kedelai dapat menjadi inang BCMV di Afrika (CABI 2007). BCMV isolat kedelai saat ini dilaporkan menjadi ancaman potensial produksi kedelai pada beberapa wilayah di Cina. Dilihat dari hubungan kekerabatannya dalam filogenetika BCMV isolat kedelai dari Cina masuk dalam grup I terpisah (distantly related) dengan BCMV isolat dan strain lainnya. Hal ini menunjukkan adanya diferensiasi ancestral dan adaptasi inang (Zhou et al. 2014). BCMV isolat kedelai asal Ponorogo juga berada pada kelompok yang terpisah dari strain BCMV atau isolat lainnya dalam filogenetika.
23
Soybean chlorotic blotch virus (SbCBV) (Alabi et al. 2010). Penularan PYLCV dengan kutukebul dalam percobaan rumah kaca menunjukkan bahwa tanaman yang termasuk famili Leguminosae (kedelai, kacang panjang, kacang hijau, orok-orok) dapat terinfeksi PYLCV walaupun intensitas serangannya lebih ringan dan masa inkubasinya relatif lebih lama (Sulandari et al. 2006). Di lapangan, pertanaman cabai, tomat, dan kacang-kacangan umumnya ditanam pada lahan yang sama sehingga kemungkinan terjadinya infeksi virus pada tanaman selain inang utama tidak dapat diabaikan sebagai salah satu cara virus bertahan di alam. Infeksi alami PYCLV pada kedelai asal Bogor Barat merupakan informasi baru yang menunjukkan ekstensi inang dari virus ini selain Solanaceae.
Berdasarkan pada hasil deteksi tersebut di atas, CMV-S masih merupakan virus yang dominan menginfeksi kedelai dengan insidensi yang paling tinggi dibandingkan dengan virus lainnya di beberapa pertanaman kedelai di Jawa. Terdeteksinya BCMV dan PYCLV dari kedelai di lapangan merupakan suatu informasi baru.
B Respons Ketahanan Sembilan Varietas Kedelai terhadap Infeksi CMV-S Pengaruh Infeksi CMV-S terhadap Periode Inkubasi, Insidensi Penyakit dan Tipe Gejala
Penularan CMV-S secara mekanis pada sembilan varietas menunjukkan periode inkubasi dan tipe gejala yang berbeda-beda. Periode inkubasi terpendek ditunjukkan oleh varietas Grobogan yaitu 8 hari setelah inokulasi (HSI), sedangkan periode inkubasi terpanjang ditunjukkan oleh varietas Detam-1 dan Burangrang yaitu 14 HSI. Insidensi penyakit berdasarkan pengamatan gejala yang tertinggi pada varietas Grobogan dan yang terendah pada varietas Detam-1 (Tabel 7).
Tabel 7 Pengaruh infeksi CMV-S terhadap periode inkubasi (PI), insidensi penyakit (IP) dan tipe gejala pada sembilan varietas kedelai
24
Periode inkubasi CMV-S pada tanaman legum cenderung lebih panjang dibandingkan CMV pada jenis tanaman lainnya. Penularan Soybean stunt virus (SSV)/CMV-S isolat Jakarta secara mekanis pada beberapa varietas kedelai menunjukkan periode inkubasi virus berkisar tujuh hari setelah inokulasi (HSI) (Suryadi et al. 2012). Perbedaan periode inkubasi pada sembilan varietas kedelai yang diuji mungkin disebabkan kemampuan virus menginfeksi serta memperbanyak diri dalam jaringan tanaman inang, sedangkan respons inang tergantung pada kesiapan tanaman untuk menerima virus dan membantu perbanyakan virus dalam jaringan tanaman (Bos 1994). Virus yang memiliki virulensi yang tinggi mampu dengan cepat menginfeksi tanaman (Maule et al. 2007). Periode inkubasi, insidensi dan keparahan penyakit diukur berdasarkan gejala yang muncul dan menandakan kemampuan virus untuk berkembang dan bergerak di dalam jaringan tanaman (Kareem dan Taiwo 2007). Tanaman yang tahan memiliki periode inkubasi yang lebih lama dibandingkan tanaman yang rentan. Tanaman yang tahan terhadap virus mampu menghambat replikasi dan penyebaran virus di dalam tanaman atau perkembangan gejala, sehingga konsentrasi virus di dalam tanaman menjadi rendah. Sebaliknya tanaman yang rentan adalah tanaman yang tidak mampu menghambat replikasi dan penyebaran virus di dalam tanaman yang dicirikan dengan konsentrasi virus yang tinggi dan masa inkubasi atau munculnya gejala yang cepat (Agrios 2005).
Penularan CMV-S secara mekanis pada sembilan varietas menunjukkan gejala sistemik yang berbeda-beda tergantung varietas. Tipe gejala yang muncul bervariasi yaitu mosaik ringan sampai berat (Gambar 4b, c, d, e, f, g, h, i, j), permukaan lamina daun yang tidak rata (rugos) (Gambar 4b, c, h, i, j) penebalan tulang daun (vein banding) (Gambar 4c ,f), dan malformasi daun (4b, c, h). Hal ini sesuai dengan pernyataan Honda et al. (1988) bahwa tanaman kedelai yang terinfeksi SSV/CMV-S memperlihatkan gejala mosaik sistemik pada daun. Gejala pada beberapa varietas dapat menghilang, daun tanaman yang terinfeksi mengecil dan sempit, sehingga tanaman menjadi kerdil.
Gambar 4 Tipe gejala yang muncul pada sembilan varietas yang diinokulasi dengan CMV-S. a. tanaman sehat, b. Argomulyo, c. Anjasmoro, d. Burangrang, e. Cikuray, f. Detam-1, g. Detam-2, h. Grobogan, i. Sinabung, j. Wilis
a b c d e
f g h i j
25
Pengaruh Infeksi CMV-S terhadap Indeks Keparahan Penyakit dan Titer Virus
Varietas Grobogan memiliki indeks keparahan penyakit yang tertinggi sebesar 6.13, sedangkan varietas Detam-1 memiliki indeks keparahan penyakit terendah sebesar 0.45. Hasil pengukuran titer virus menunjukkan rata-rata NAE sembilan varietas bervariasi antara 0.435-0.802, dengan ratio 2.19-4.01 kali lebih besar dibandingkan NAE kontrol negatif. Varietas Grobogan memiliki ratio NAE tertinggi sebesar 4.01 kali NAE kontrol negatif sedangkan varietas Detam-1 memiliki ratio NAE terendah sebesar 2.18 kali NAE kontrol negatif (Tabel 8). Tabel 8 Pengaruh infeksi CMV-S terhadap indeks keparahan penyakit dan titer
Beberapa varietas yang memiliki indeks penyakit yang sangat rendah ternyata juga positif terinfeksi CMV-S. Strausbaugh et al. (2003) mengemukakan bahwa titer virus tidak selalu berkorelasi dengan gejala, sehingga untuk menentukan respons ketahanan tanaman harus menggunakan beberapa parameter. Pengaruh Infeksi CMV-S terhadap Tinggi Tanaman dan Jumlah Bunga Mekar
26
Gambar 5 Tinggi tanaman sembilan varietas yang diinokulasi CMV-S dibandingkan tanaman kontrol pada a. 2 minggu setelah inokulasi (MSI), b. 4 minggu setelah inokulasi (MSI). Huruf di atas balok yang sama menunjukkan tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%. Argo-Argomulyo, Anjas-Anjasmoro, Brng-Burangrang, Ckyr-Cikuray, Dtm-1-Detam-1, Dtm-2-Detam2, Grbg-Grobogan, Snbg-Sinabung, Wils-Wilis
b.
[Type a
quote from the
[Type a
quote from the
Kontrol
Perlakuan [Type a
quote from the document or
`
27
Tabel 9 Persentase penghambatan tinggi tanaman sembilan varietas kedelai
Varietas Penghambatan tinggi tanaman pada Minggu Setelah Inokulasi (%)
28
`
Munculnya bunga pada tanaman kedelai menandakan dimulainya fase generatif. Masa berbunga sembilan varietas kedelai yang diinokulasi CMV-S cenderung lebih lambat dibandingkan tanaman kontrol. Selain itu jumlah bunga mekar pada beberapa varietas cenderung lebih sedikit dibandingkan tanaman kontrol. Varietas Grobogan mengalami penurunan jumlah bunga mekar paling tinggi sebesar 12.45% akibat infeksi CMV-S, sedangkan penurunan jumlah bunga mekar terendah pada varietas Cikuray sebesar 3.12% dibandingkan tanaman kontrol. Varietas Burangrang, Detam-1 dan Detam-2 tidak mengalami penurunan jumlah bunga mekar dibandingkan tanaman kontrol (Gambar 6 dan Tabel 10).
29
Berdasarkan pengukuran nilai indeks sensitivitas jumlah bunga mekar pada sembilan varietas uji, varietas Burangrang, Detam-1, dan Detam-2 tergolong toleran, sedangkan varietas lainnya tergolong peka terhadap infeksi CMV-S (Tabel 11).
Tabel 11 Nilai indeks sensitivitas jumlah bunga mekar sembilan varietas kedelai yang diinfeksi CMV-S
Varietas Nilai Indeks
Sensitivitas (S)
Fenotip
Argomulyo 1.23 Peka
Anjasmoro 2.19 Peka
Burangrang 0.24 Toleran
Cikuray 0.56 Agak toleran
Detam-1 0.09 Toleran
Detam-2 0.04 Toleran
Grobogan 2.23 Peka
Sinabung 1.72 Peka
Wilis 1.54 Peka
Terhambatnya pertumbuhan dan perkembangan beberapa varietas menunjukkan adanya gangguan fisiologis tanaman karena infeksi CMV-S. Agrios (2005) menyatakan bahwa keberadaan patogen akan mengganggu fotosintesis tanaman, sehingga menyebabkan menurunnya pertumbuhan tanaman dan produksinya. Umumnya virus menyebabkan klorosis dan kerdil. Tanaman yang terinfeksi virus berkurang laju fotosintesisnya, bahkan tinggal seperempat dibandingkan tanaman normal.
Khalimi dan Suprapta (2011) melaporkan infeksi SSV/CMV-S secara signifikan menghambat pertumbuhan tanaman yang diindikasikan oleh lambatnya pertambahan tinggi tanaman. Sebelumnya, Akin & Barmawi (2005) melaporkan terjadi pengurangan pertumbuhan vegetatif pada beberapa varietas kedelai yang diuji akibat infeksi virus. Infeksi virus terjadi pada pusat metabolisme, yaitu dalam inti dan sitoplasma tanaman inang. Virus memanfaatkan asam amino dan nukleotida tanaman inang untuk replikasi virus yang mengakibatkan tanaman kekurangan asam amino dan nukleotida untuk pertumbuhan. Infeksi SSV dapat menurunkan pertumbuhan vegetatif tanaman kedelai sebesar 5,86% dan jumlah polong total sebesar 19.29%.
Infeksi kotiledon Cucurbita pepo yang terinfeksi CMV menyebabkan penurunan laju akumulasi pati. Pada fase awal infeksi virus ditandai dengan akumulasi pati yang cepat dan sebaliknya pada fase akhir infeksi virus terjadi penurunan kemampuan untuk mengakumulasi dan mensintesis pati dan pada saat yang bersamaan terjadi peningkatan untuk mendegradasi pati. Selain itu, tanaman kehilangan kemampuan untuk menghasilkan senyawa-senyawa antara (fosforilasi) termasuk asam organik, gula, asam amino dan protein yang berperan penting untuk menghasilkan senyawa yang dibutuhkan dalam perkembangan tanaman (Hull 2002).