KINETIKA INHIBISI EKSTRAK SIDAGURI
(Sida rhombifolia Linn) TERHADAP XANTINA OKSIDASE
SECARA ELEKTROKIMIA
MUAMMAR YULIAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Kinetika Inhibisi Ekstrak Sidaguri (Sida rhombifolia) terhadap Xantina Oksidase secara Elektrokimia adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
MUAMMAR YULIAN. Kinetika Inhibisi Ekstrak Sidaguri (Sida rhombifolia) terhadap Xantina Oksidase secara Elektrokimia. Dibimbing oleh DYAH ISWANTINI PRADONO dan SRI MULIJANI.
Asam urat merupakan produk akhir dari metabolisme purin. Ketidakseimbangan antara produksi dan ekskresi kadar asam urat dalam darah akan menimbulkan hipersaturasi asam urat sehingga menyebabkan gout. Enzim yang berperan dalam sintesis asam urat adalah xantina oksidase (XO) yang mengkatalisis oksidasi hiposantina dan xantina menjadi asam urat. Allopurinol merupakan salah satu pilihan obat yang banyak digunakan untuk menurunkan kadar asam urat darah. Namun demikian, penggunaan allopurinol sebagai penurun asam urat dapat menyebabkan efek samping seperti alergi, demam, dan ganggunan pencernaan. Banyaknya efek samping dari penggunaan obat sintetis seperti allopurinol telah mendorong masyarakat untuk beralih ke pengobatan tradisional yang memanfaatkan tumbuhan obat (obat herbal).
Sida rhombifolia L. yang dikenal dengan nama sidaguri adalah tanaman obat yang telah diketahui memiliki potensi sebagai antigout. Penelitian terdahulu menunjukkan bahwa ekstrak flavonoid sidaguri memiliki daya inhibisi terhadap enzim xantina oksidase hingga 71% dan pengukuran secara spektrofotometri menunjukkan ekstrak flavonoid tumbuhan ini mengikuti mekanisme inhibisi kompetitif. Tujuan penelitian ini adalah menentukan tipe kinetika inhibisi dan IC50 dari ekstrak etanol herba sidaguri dengan metode elektrokimia serta
membandingkan linearitas dan sensitivitas pengukuran antara metode spektrofotometri dan elektrokimia. Tipe kinetika inhibisi yang terbentuk selanjutnya dapat menjelaskan kekuatan ikatan antara enzim sebagai target dan senyawa calon obat, apakah kekuatan ikatan antara enzim dan senyawa calon obat tersebut bersifat sementara (inhibisi kompetitif dan inhibisi unkompetitif) ataukah permanen (inhibisi nonkompetitif).
Hasil penelitian menghasilkan rendemen ekstrak etanol sebesar 9.82% dengan daya inhibisi mulai dari 13.64% hingga 82.69% (5.00-200 ppm) dan IC50
sebesar 91.15±5.74 ppm. Allopurinol sebagai kontrol diketahui memiliki daya inhibisi sebesar 15.26-70.95% (0.10-4.00 ppm) dan IC50sebesar 2.45±2.21 ppm.
Kinetika inhibisi dari ekstrak etanol pada konsentrasi 100 ppm menyebabkan perubahan nilai KM (0.187 mM atau meningkat sebesar 68.73%) dari 0.0855 mM
menjadi 0.2718 mM, tanpa mengalami perubahan Vmaks.
Berdasarkan hasil tersebut dapat dikatakan tipe kinetika inhibisi ekstrak sidaguri mengarah pada tipe kinetika inhibisi kompetitif dengan nilai afinitas inhibitor (α) sebesar 3.18. Besarnya nilai afinitas inhibitor (α) ekstrak terhadap enzim dapat ditentukan dengan menghitung nisbah antara nilai KM app inhibitor dan
nilai KM app tanpa inhibitor. Metode elektrokimia diketahui memberikan linearitas
pengukuran yang lebih baik dibandingkan metode spektrofotometri, masing-masing pada rentang 0.01-1.00 mM dan 0.05-0.70 mM. Sensitivitas metode elektrokimia (0.947 µA mM-1) juga dilaporkan lebih tinggi dibandingkan metode spektrofotometri (0.007 menit-1).
SUMMARY
MUAMMAR YULIAN. Inhibition Kinetics of Sida rhombifolia Extract toward Xanthine Oxidase by Electrochemical Method. Supervised by DYAH ISWANTINI PRADONO and SRI MULIJANI.
Uric acid is final product of purine metabolism. Abnormal conditions of uric acid metabolism will cause precipitation of sodium urate crystals in joints, a condition termed gout. Xanthine oxidase (XO) is an enzyme that plays an important role in purine metabolism and functions to catalyze hypoxanthine oxidation into xanthine and, xanthine into uric acid. The well known xanthine oxidase inhibitors (XOIs) is allopurinol, which is one option out of the many synthetic drugs used in modern medicine for the treatment of gout. Nevertheless, the use of allopurinol can cause side effects such as allergies, fever, and gastrointestinal disorders. The side effects of synthetic drug use such as allopurinol have prompted people to turn to traditional medicine that utilizes herbs (medicinal herbs).
Sida rhombifolia is one of the traditional medicinal plant with potential as anti-gout. The previous research showed that flavonoids crude extract from this plant could in vitro inhibit the activity of xanthine oxidase up to 71% and the kinetic study by spectrophotometric resulted that the type of flavonoids crude extract inhibition was a competitive inhibition. The purpose of research was to investigate the type of inhibition kinetics of S. Rhombifolia’s ethanol extract by electrochemical method and to compare the study of linearity and sensitivity between electrochemical and spectrophotometric methods. The determination of inhibition kinetics type which is formed can subsequently explain the inhibitory mechanism formed and describe the affinity formed between XO enzyme as a target with drug candidate compounds, whether it is temporary (competitive inhibition and uncompetitive inhibition) or permanent (non-competitive inhibition).
The results showed that the yield of S. Rhombifolia’s ethanol extract was 9.82% with the inhibition activity of 13.64% to 82.69% (5.00-200 ppm) and the value of IC50was 91.15±5.74 ppm. Allopurinol as a control showed the inhibition
activity of 15.26-70.95% (0.10-4.00 ppm) and the value of IC50was 2.45±2.21
ppm. Inibition kinetic of the ethanol extract caused a change of KM (0.187 mM or
increase 68.73%) and unchange of Vmax.
Based on the data, the type of inhibition kinetic was a competitive inhibition, that had the value of inhibitor affinity (α) of 3.18. The inhibitor affinity value (α) of the enzyme can be determined by calculating the ratio between the value of KMwith inhibitors and KMvalues without inhibitor. Linearity of xanthine
oxidase activity assay by electrochemical and spectrophotometric methods showed the range of 0.01-1.00 mM and 0.05-0.70 mM respectively. The sensitivity of electrochemical method was reported higher (0.95 µA mM-1) than the spectrophotometric method (0.007 min-1).
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kimia
KINETIKA INHIBISI EKSTRAK SIDAGURI
(Sida rhombifolia L) TERHADAP XANTINA OKSIDASE
SECARA ELEKTROKIMIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Kinetika Inhibisi Ekstrak Sidaguri (Sida rhombifolia L) terhadap Xantina Oksidase secara Elektrokimia
Nama : Muammar Yulian
NIM : G451110051
Disetujui oleh Komisi Pembimbing
Dr Sri Mulijani, MS Anggota
Diketahui oleh
Ketua Program Studi Kimia
Prof Dr Dra Purwantiningsih S, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 30 Juli 2013 Tanggal Lulus: Prof Dr Dyah Iswantini Pradono, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2012 ini ialah kinetika inhibisi, dengan judul Kinetika Inhibisi Ekstrak Sidaguri (Sida rhombifolia) terhadap Xantina Oksidase secara Elektrokimia.
Terima kasih penulis ucapkan kepada Ibu Prof Dr Dyah Iswantini Pradono, MScAgr dan Ibu Dr Sri Mulijani, MS selaku komisi pembimbing, Bapak Dr Djarot S Hamiseno, MS selaku dosen penguji luar komisi, serta seluruh dosen Pascasarjana Kimia atas segala bimbingan dan ilmu yang diberikan. Di samping itu, penghargaan penulis sampaikan kepada seluruh staf Laboratorium Kimia Fisik IPB (Bapak Mail, Ibu Ayi), Laboratorium Pusat Studi Biofarmaka IPB (Mbak Salina, Ibu Nunuk, Mbak Wiwik, Mas Zaim, Mas Nio, Mas Endi), Laboratorium Bersama Kimia IPB (Bapak Wawan, Mas Eko), dan Laboratorium Kimia Organik (Bapak Sabur) yang telah membantu selama penelitian. Ungkapan terima kasih juga disampaikan kepada Pimpinan dan keluarga besar IAIN Ar-Raniry Aceh, Kopertais Wilayah V Aceh dan Direktorat Pendidikan Tinggi Islam (Diktis) Kemenag, atas bantuan biaya pendidikan yang telah diberikan, serta kepada Ibu Prof Dr Dyah Iswantini Pradono, MScAgr yang telah memberikan bantuan biaya penelitian. Tak lupa pula, ungkapan terima kasih penulis sampaikan kepada Bang Fadhli, Ibu Trivadila, Fudhail, Dilla, Kak Titi, Qadri, group riset di Kimia Fisik (Lukman, Okik, Yuanita, Dini, Yona), teman-teman seperjuangan di Pascasarjana Kimia dan keluarga besar IKAMAPA atas masukan, saran dan motivasi yang diberikan. Untuk kedua Orang tuaku, Abayi, Adikku Masyithah, Khalida dan Safirul, Cek Is dan seluruh keluarga terima kasih atas segala doa dan kasih sayangnya. Untuk istriku tercinta Rahma, terima kasih tak hingga untuk segala kesabaran, ketabahan dan motivasimu dan untuk malaikat kecilku Sulthan Syamil Bassam dan Putroe Aaqila Bassam kalianlah sumber inspirasiku.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xi
1 PENDAHULUAN 1
Latar belakang 1
Tujuan Penelitian 3
Hipotesis 3
2 TINJAUAN PUSTAKA 3
Sidaguri (Sida rhombifolia) 3
Xantina Oksidase dan Gout (Asam Urat) 4
Kinetika Inhibisi Enzim 5
Elektrokimia 7
3 METODE 8
Bahan dan Alat 8
Langkah-langkah Penelitian 8
Ekstraksi Sidaguri 8
Elektrode Pasta Karbon 9
Pengukuran Elektrokimia 9
Penentuan Kondisi Optimum Aktivitas XO 9
Uji Daya Inhibisi Terhadap XO 9
Uji Kinetika Inhibisi Ekstrak Terhadap XO 10
Pengukuran Spektrofotometri 10
4 HASIL DAN PEMBAHASAN 10
Ekstrak Sidaguri 10
Kondisi Optimum Aktivitas XO 11
Daya Inhibisi terhadap XO dan IC50 14
Kinetika Inhibisi Ekstrak terhadap XO 16
5 SIMPULAN DAN SARAN 20
Simpulan 20
Saran 20
DAFTAR PUSTAKA 20
2
DAFTAR TABEL
1 Daya inhibisi ekstrak herba sidaguri terhadap aktivitas XO 15 2 Daya inhibisi allopurinol terhadap aktivitas XO 15
DAFTAR GAMBAR
1 Profil tumbuhan sidaguri 3
2 Mekanisme penghambatan pembentukan asam urat 4
3 Pola kinetika inhibisi yang terbentuk akibat adanya inhibitor kompetitif
dengan metode Lineweaver-Burk 5
4 Pola kinetika inhibisi yang terbentuk akibat adanya inhibitor
unkompetitif dengan metode Lineweaver-Burk 6
5 Pola kinetika inhibisi yang terbentuk akibat adanya inhibitor
nonkompetitif dengan metode Lineweaver-Burk 7
6 Proses transfer elektron dan reaksi enzimatis ke permukaan elektrode
yang dimediasi oleh mediator 11
7 Voltammogram siklik 12
8 Alur kontur hubungan antara pH dan suhu (a), suhu dan konsentrasi
(b), dan pH dan konsentrasi xantina (c) terhadap aktivitas XO 13 9 Hubungan konsentrasi substrat [xantina] dan aktivitas XO 16 10 Linearitas konsentrasi substrat [xantina] dan aktivitas XO secara
elektrokimia 17
11 Linearitas konsentrasi substrat [xantina] dan aktivitas XO secara
spektrofotometri 17
12 Kinetika inhibisi ekstrak herba sidaguri yang diplot pada persamaan
Lineweaver-Burk 18
DAFTAR LAMPIRAN
1 Diagram alir umum penelitian 25
2 Uji daya inhibisi dan penentuan IC50 ekstrak 25
3 Uji daya inhibisi dan penentuan IC50 allopurinol 26
4 Uji kinetika inhibisi 26
5 Penentuan kadar air 27
6 Kombinasi faktor-faktor peubah bebas menggunakan RSM 27
7 Hasil optimasi terhadap kombinasi RSM 28
8 Kurva hubungan konsentrasi sidaguri dan daya inhibisi 28 9 Kurva hubungan konsentrasi allopurinol dan daya inhibisi 29 10 Hubungan konsentrasi substrat dan aktivitas XO 30
11 Penentuan panjang gelombang maksimum 30
12 Kurva kalibrasi standar xantina secara spektrofotometri 31
13 Penentuan aktivitas XO (kecepatan) secara spektrofotometri 31
1
PENDAHULUAN
Latar Belakang
Asam urat merupakan produk akhir dari metabolisme purin. Kadar asam urat dalam darah adalah hasil keseimbangan antara produksi dan ekskresi. Ketika terjadi ketidakseimbangan kedua proses tersebut, maka terjadi keadaan hiperurisemia yang menimbulkan hipersaturasi asam urat sehingga menyebabkan gout (Katzung 2002). Kadar normal asam urat dalam darah pada laki-laki dewasa adalah 0.24–0.52 mmol L-1, sedangkan pada wanita lebih rendah yaitu 0.16–0.43 mmol L-1 (Maimun 2007).
Enzim yang berperan dalam sintesis asam urat adalah xantina oksidase (XO) yang sangat aktif bekerja dalam hati, usus halus dan ginjal. XO mengkatalisis oksidasi hiposantina dan xantina menjadi asam urat (Cengiz et al. 2012). Strategi pengobatan gout pada umumnya adalah dengan menurunkan kadar asam urat sampai di bawah titik jenuhnya. Allopurinol merupakan salah satu pilihan obat yang banyak digunakan untuk menurunkan kadar asam urat darah. Allopurinol bekerja dengan cara menghambat enzim XO. Namun demikian, penggunaan allopurinol sebagai penurun asam urat dapat menyebabkan efek samping seperti alergi, demam, menggigil, leukopenia, gagal ginjal dan hati, dan ganggunan pencernaan (Ganiswara et al. 1995; Liu et al. 2008).
Banyaknya efek samping dari penggunaan obat sintetis seperti allopurinol telah mendorong masyarakat untuk beralih ke pengobatan tradisional yang memanfaatkan tumbuhan obat (obat herbal). Kecenderungan masyarakat untuk back to nature dan kebijakan pemerintah yang telah mencanangkan program “Saintifikasi Jamu” dengan prioritas pada penelitian preventif 4 ramuan formula untuk gejala hiperglikemia, hipertensi, hiperkolesterolemia dan hiperurisemia/gout merupakan kondisi yang sangat prospektif untuk mengembangkan penelitian tentang tumbuhan obat berbasis keanekaragaman hayati Indonesia. Sidaguri (Sida rhombifolia) merupakan salah satu tumbuhan obat yang diakui khasiatnya sebagai antigout adalah. Ekstrak flavonoid sidaguri diketahui memiliki daya inhibisi yang tinggi terhadap XO, mulai dari 48-71% pada rentang konsentrasi ekstrak 100-800 mg L-1 (Iswantini et al. 2009). Tidak hanya dalam komposisi tunggal, potensi sidaguri sebagai antigout dalam formula gabungan memiliki daya inhibisi tertinggi bahkan melebihi allopurinol, hasil ini sudah dipatenkan dan sudah granted (Iswantini et al. 2010). Ekstrak alkohol dari akar sidaguri juga dilaporkan memiliki aktivitas sebagai antioksidan, antiinflamasi, dan antirematik (Amarender et al. 2011).
2
obat, apakah kekuatan ikatan antara enzim dan senyawa calon obat tersebut bersifat sementara (inhibisi kompetitif dan inhibisi unkompetitif) ataukah permanen (inhibisi non kompetitif).
Ekstrak kasar flavonoid herba sidaguri diketahui menunjukkan tipe kinetika inhibisi kompetitif terhadap XO (Iswantini et al. 2009). Senyawa golongan flavonol seperti luteolin dan kuersetin juga dilaporkan mengikuti kinetika inhibisi kompetitif terhadap XO (Pauff dan Hille 2009). Tipe kinetika inhibisi nonkompetitif terhadap XO di antaranya ditunjukkan oleh ekstrak daun Fraxinus angustifolia (Meriem et al. 2010) dan ekstrak akar Tephrosia purpurea (Nile dan Khobragade 2011), adapun caulerpenyne (CYN) dari ekstrak Caulerpa prolifera dilaporkan menunjukkan tipe kinetika inhibisi unkompetitif (Cengiz et al. 2012).
Metode yang umum digunakan untuk penentuan tipe kinetika inhibisi ini adalah spektrofotometri. Metode ini memiliki beberapa kelemahan di antaranya biaya yang relatif mahal karena menggunakan bahan kimia yang bermacam-macam dan dalam jumlah yang banyak, waktu yang lama karena membutuhkan preparasi sampel, kurang sensitif terutama dalam menguji sampel berwarna dan dipengaruhi oleh kekeruhan atau turbiditas. Oleh karena itu, dibutuhkan metode yang lebih mudah, murah, akurat, cepat dan sensitif dalam penentuan tipe kinetika inhibisi.
Campanella et al. (2004) melaporkan bahwa metode elektrokimia dapat mengatasi berbagai kelemahan metode spektrofotometri. Metode ini sangat menjanjikan karena waktu analisis yang relatif cepat, membutuhkan instrumen yang tidak mahal, protokol operasi yang sederhana dan akurat (Grieshaber et al. 2008). Perkembangan metode elektrokimia saat ini menjadi semakin pesat karena dapat menganalisis pada tingkat renik dan selektif (Hattu 2009), sehingga telah banyak diterapkan dalam bidang elektroanalisis, kesehatan, dan lingkungan. Metode elektrokimia juga telah banyak dimanfaatkan sebagai transduser pada biosensor dan menunjukkan perkembangan yang sangat cepat. Bahkan, Iswantini et al. (2011) telah mengembangkan biosensor glukosa menggunakan bakteri asal Indonesia sebagai pengganti enzim murni.
Biosensor elektrokimia untuk penentuan asam urat di antaranya telah dikembangkan oleh Arslan (2008) menggunakan enzim urikase yang diimobilisasi dengan gluteraldehid dan polianilina-polipirol (pani-ppy) pada permukaan elektrode platinum. Selanjutnya Priyabrata (2010) mengembangkan biosensor asam urat dengan mengimobilisasi enzim urikase menggunakan gluteraldehid dan gelatin. Biosensor asam urat amperometri berbasis enzim urikase dengan transduser H2O2 juga dilaporkan mampu merespon dengan baik asam urat pada
range 2.5-200 M (Ivekovic et al. 2012).
Penentuan tipe kinetika inhibisi ekstrak tumbuhan obat terhadap enzim XO secara elektrokimia belum dilakukan. Berbeda dengan Iswantini at al. (2009) yang sebelumnya telah menentukan tipe kinetika inhibisi dari ekstrak kasar flavonoid sidaguri dengan metode spektrofotometri. Pada penelitian ini akan dilakukan penentuan tipe kinetika inhibisi dan IC50 ekstrak etanol herba sidaguri
3
Tujuan Penelitian
Penelitian ini bertujuan menentukan IC50 dan tipe kinetika inhibisi dari
ekstrak etanol herba sidaguri menggunakan metode elektrokimia serta membandingkan linearitas dan sensitivitas pengukuran antara metode spektrofotometri dan eletrokimia.
Hipotesis
Ekstrak etanol herba sidaguri menunjukkan mekanisme kinetika inhibisi kompetitif terhadap XO dan metode elektrokimia lebih sensitif dan efektif dalam penentuan tipe kinetika inhibisi.
2
TINJAUAN PUSTAKA
Sidaguri (Sida rhombifilia)
Sidaguri merupakan tumbuhan liar yang sering ditemukan di tepi jalan, hutan, ladang, dan tempat-tempat dengan sinar matahari cerah atau sedikit terlindung. Tanaman ini tersebar pada daerah tropis di seluruh dunia dari dataran rendah sampai 1450 m di atas permukaan laut. Perdu tegak bercabang ini tingginya dapat mencapai 2 m dengan cabang kecil berambut rapat (Dalimarta 2003). Profil dan taksonomi dari sidaguri adalah sebagai berikut:
Sidaguri dikenal masyarakat luas sebagai tumbuhan yang dapat dimanfaatkan sebagai obat. Ekstrak daun sidaguri diketahui memiliki aktivitas antitumor (David et al. 1995), antihiperurisemia, antiinflamasi, dan hepatoprotektor (Rao dan Sutradhan 1997; Khalil et al. 2006; Meza 2008). Penelitian lainnya melaporkan bahwa ekstrak sidaguri menunjukkan aktivitas sebagai antioksidan (Dhalwal et al. 2007), dan antibakteri (Islam et al. 2003; Rashmi 2010).
Gambar 1 Profil tumbuhan sidaguri
Dunia : Plantae
Filum : Spermatophyta Kelas : Dicotyledoneae Ordo : Malvales Famili : Malvaceae Genus : Sida
4
Xantina Oksidase dan Gout (Asam Urat)
Xantina oksidase (XO) berperan penting dalam katabolisme purin. Di dalam tubuh, XO ditemukan di sel hati dan otot. XO merupakan suatu kompleks enzim yang terdiri atas 1332 residu asam amino, molibdenum (HO2SMo), FAD,
dan Fe2S2 sebagai pusat reaksi redoks, dengan bobot molekul sebesar 275000
dalton (Millar et al. 2002). XO mengkatalisis oksidasi hiposantina menjadi xantina dan xantina menjadi asam urat yang berperan penting pada penyakit gout. Gout atau asam urat merupakan substansi hasil akhir metabolisme purin dalam tubuh. Berdasarkan penyelidikan, 90% dari asam urat merupakan hasil katabolisme purin yang dibantu oleh enzim guanase dan XO (Shamley 2005). Orang yang memiliki kelebihan berat badan, tekanan darah tinggi, makan diet kaya protein dan minum alkohol dalam jumlah besar memiliki peningkatan risiko gout (Shiraishi dan Une 2009).
Obat yang umum digunakan untuk obat penyakit gout adalah allopurinol (Connor 2009). Allopurinol sebagai inhibitor spesifik dari enzim XO terbukti efektif dalam menurunkan kadar asam urat (Gaw et al. 1998). Peran allopurinol dalam menghambat aktivitas XO pada proses pembentukan asam urat ditunjukkan oleh Gambar 2.
Gambar 2 Mekanisme penghambatan pembentukan asam urat oleh allopurinol
5
Senyawa bioaktif polifenol yang terdapat pada teh, yaitu teaflavin, teaflavin-3-galat, teaflavin-3-3’-digalat, (-)-epigalokatekin-3-galat, dan asam galat mampu menghambat kerja XO dalam membentuk asam urat melalui mekanisme inhibisi kompetitif (Jen et al. 2000). Penelitian yang dilakukan Hsieh et al. (2007) melaporkan bahwa senyawa 6-aminopurina dari daun gandum memiliki daya inhibisi yang kuat terhadap XO dengan nilai IC50 10.8λ M. Selanjutnya ekstrak
metanol dari kulit batang Erythrina indica Lam memiliki daya inhibisi terhadap XO dengan IC50 52.75 g mL-1 (Sowndhararajan et al. 2012).
Kinetika Inhibisi Enzim
Kinetika enzim adalah salah satu cabang enzimologi yang membahas faktor-faktor yang mempengaruhi kecepatan reaksi enzimatis. Dalam mempelajari kinetika enzim, berbagai faktor penentu laju aktivitas dipelajari secara lebih seksama dan kondisinya diatur sedemikian rupa dengan harapan reaksi yang terjadi dapat lebih terkendali dan hanya diakibatkan oleh interaksi enzim-substrat. Untuk beberapa keperluan, seperti dalam mempelajari kemampuan senyawa bioaktif sebagai obat (inhibitor/aktivator), terhadap lingkungan tempat reaksi enzim tersebut berlangsung ditambahkan senyawa bioaktif dengan konsentrasi tertentu dan pola kinetika yang terbentuk dibandingkan dengan pola kinetika dasarnya untuk melihat adanya perubahan pola kinetika (Price dan Stevens 2004).
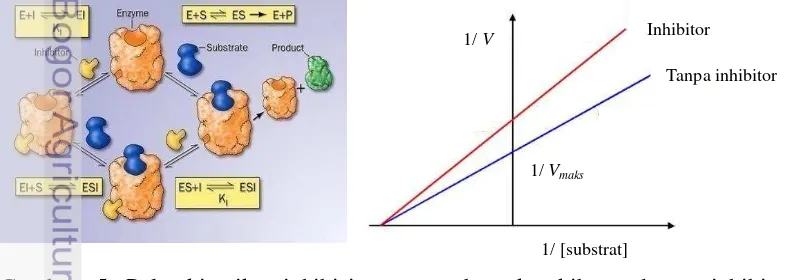
Mekanisme inhibisi dapat berlangsung secara kompetitif, unkompetitif atau nonkompetitif. Pada tipe inhibisi kompetitif, terjadi kompetisi antara substrat dengan inhibitor dalam memperebutkan sisi aktif dari enzim (Gambar 3). Pada tipe penghambatan ini, adanya inhibitor dapat menyebabkan perubahan nilai KM
(konstanta Michaelis-Menten) menjadi lebih besar dari nilai KM semula tanpa
mengubah nilai Vmaks (kecepatan maksimum reaksi enzimatis) (Thenawijaya
1995).
Gambar 3 Pola kinetika inhibisi yang terbentuk akibat adanya inhibitor kompetitif dengan metode Lineweaver-Burk.
Pada inhibisi unkompetitif, inhibitor terikat pada sisi allosterik enzim setelah terbentuk kompleks enzim substrat. Pada jenis inhibisi ini, inhibitor tidak dapat langsung berikatan dengan enzim dalam keadaan bebas, namun hanya dapat terikat jika telah terbentuk kompleks enzim substrat (Gambar 4). Dalam bentuk
1/ V
1/ Vmaks
Inhibitor
Tanpa inhibitor
6
kompleks enzim substrat-inhibitor, enzim akan kehilangan sifat katalisatornya (inaktif) dan produk tidak akan terbentuk. Produk hanya akan terbentuk, jika inhibitor terlepas dari kompleks enzim substrat-inhibitor. Inhibisi unkompetitif umunya terjadi akibat adanya akumulasi produk dari reaksi enzim itu sendiri dan sangat jarang dijumpai pada reaksi enzim yang melibatkan hanya satu substrat dan satu produk. Pola kinetika yang terbentuk akibat adanya inhibitor pada jenis inhibisi unkompeitif ini adalah terjadinya penurunan nilai KM dan Vmax dari
keadaan normalnya (Voet D dan Voet J 2001).
Gambar 4 Pola kinetika inhibisi yang terbentuk akibat adanya inhibitor unkompetitif dengan metode Lineweaver-Burk
Pada jenis inhibisi nonkompetitif, antara substrat dan inhibitor tidak terjadi kompetisi dalam memperebutkan sisi aktif enzim. Inhibitor dan substrat tidak memiliki kemiripan struktur. Inhibitor berikatan dengan enzim pada lokasi di luar sisi aktifnya. Efek penghambatan akan terjadi karena inhibitor berikatan dengan sisi allosterik enzim, dan akan mengubah bentuk sisi aktif enzim seperti ditunjukkan pada Gambar 5. Akibat dari jenis inhibisi ini adalah terjadinya penurunan Vmaks tanpa mengubah nilai KM. Berbeda dengan jenis inhibisi
unkompetitif, pada inhibisi nonkompetitif, inhibitor dapat membentuk ikatan dengan enzim dalam keadaan bebasnya di samping dapat membentuk ikatan dengan kompleks enzim substrat. Ikatan inhibitor terhadap enzim bebas dan kompleks enzim-substrat dapat meyebabkan terbentuknya kompleks enzim inhibitor dan enzim substrat-inhibitor yang bersifat tidak produktif, karena kedua kompleks ini tidak dapat membentuk produk (Voet D dan Voet J 2001).
Gambar 5 Pola kinetika inhibisi yang terbentuk akibat adanya inhibitor nonkompetitif dengan metode Lineweaver-Burk
Inhibitor
Tanpa Inhibitor
Inhibitor
Tanpa inhibitor
1/ [substrat] 1/ Vmaks
7
Produk hanya akan terbentuk jika ikatan inhibitor terlepas dari kompleks enzim substrat-inhibitor. Reaksi samping yang sangat merugikan akibat pengaruh inhibitor pada jenis penghambatan ini adalah besarnya peluang bagi sisi aktif enzim untuk berubah secara permanen dari keadaan alaminya jika terbentuk kompleks enzim inhibitor dengan ikatan yang sangat kuat. Hal ini akan menyebabkan enzim kehilangan reaktivitasnya secara permanen. Nilai KM dan Vmaks sangat sulit ditentukan secara tepat berdasarkan grafik Michaelis-Menten,
sehingga untuk mendapatkan nilai Vmaks dan KM yang lebih tepat persamaan
Michaelis-Menten tersebut ditransformasikan ke persamaan Lineweaver-Burk, Dixon, atau Eddie-Hofstee (Bintang 2010).
Elektrokimia
Elektrokimia merupakan ilmu yang mempelajari aspek elektronik dari reaksi kimia. Reaksi yang dimaksud adalah reaksi yang melibatkan adanya pelepasan dan penerimaan elektron atau yang dikenal dengan reaksi oksidasi dan reduksi (reaksi redoks). Penggunaan metode elektrokimia dalam penelitian ini adalah metode voltametri dengan teknik voltametri siklik. Pengukuran secara voltametri siklik dapat dilakukan karena adanya transfer elektron dari substrat xantina ke sisi aktif enzim molibdenum melalui Fe2S2 dan FAD membentuk
hidrogen peroksida (Heuvelen 1976).
Voltametri merupakan metode elektroanalisis yang didasarkan pada pengukuran arus listrik sebagai fungsi perubahan potensial listrik yang diterapkan pada sel elektrolisis. Metode ini umumnya menggunakan tiga elektrode, yaitu elektrode kerja, elektrode pembanding, dan elektrode pembantu. Ketiga elektrode ini merupakan penghantar/ sistem yang memungkinkan pengaliran elektron/ antaraksi kimia komponen tertentu dalam elektrolit sehingga dapat dilakukan pengukuran besaran potensial (Skoog et al. 1998; Wang 2000).
8
3
METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini meliputi sampel herba sidaguri yang diperoleh dari Pusat Studi Biofarmaka, substrat xantina dan enzim XO dari Sigma, grafit, membran dialisis, parafin cair, dan ferosena.
Alat dan instrumen yang digunakan adalah eDAQ Potensiostat-Galvanostat yang dilengkapi dengan perangkat lunak Echem v2.1.0, elektrode Ag/AgCl, elektrode pasta karbon, elektrode platina, sel elektrokimia, pipet mikro, dan spektrofotometer.
Langkah-langkah Penelitian
Penelitian ini terdiri atas beberapa tahap yaitu: pembuatan ekstrak, pembuatan elektrode pasta karbon dan pengukuran elektrokimia yang meliputi: optimasi pengukuran aktivitas enzim substrat, uji daya inhibisi, penentuan IC50,
penentuan mekanisme kinetika inhibisi serta penentuan linearitas dan sensitivitas pengukuran antara metode spektrofotometri dan metode elektrokimia. Diagram alir dari penelitian ini selengkapnya dapat dilihat pada Lampiran 1.
Ekstraksi sidaguri (BPOM 2004)
Ekstraksi sidaguri dilakukan dengan mengacu pada BPOM RI (2004). Sampel sidaguri yang telah dibersihkan dan dikeringkan, dipisahkan bagian batang maupun daunnya. Setelah itu secara terpisah, setiap bagian dihaluskan, kemudian masing-masing dicampur dengan rasio 1:1 (sampel ini selanjutnya disebut herba). Herba diekstraksi dengan pelarut etanol 30% menggunakan metode maserasi dengan rasio 1:10, sampel beserta pelarut dikocok selama 6 jam menggunakan shaker, kemudian didiamkan selama 24 jam. Filtrat dipisahkan dan proses tersebut diulangi 3 kali dengan jenis dan jumlah pelarut yang sama. Semua filtrat dikumpulkan dan diuapkan dengan radas penguap putar sehingga diperoleh ekstrak kental, kemudian dikeringkan, ditimbang dan dihitung rendemennya.
Pembuatan Elektrode pasta karbon (Mirel et al. 1998)
9
Pengukuran elektrokimia
Pengukuran elektrokimia dilakukan dengan menggunakan seperangkat alat potensiostat/galvanostat eDAQ dan komputer beserta perangkat lunak pengolah data Echem v2.1.0. Elektrode yang digunakan yaitu elektrode Ag/AgCl, platina dan elektrode pasta karbon berturut-turut sebagai elektrode rujukan, pembantu dan kerja. Parameter pengukuran dibuat sebagai berikut: Mode: Cyclic, Initial: 100 mV, Final: 100 mV, Rate: 250 mV/s, Step W: 20 ms, Upper E : 1000 mV, Lower E: 0 mV dan Range: 5 V.
Sebanyak 1.9 mL larutan bufer fosfat 0.05 M pH 7.5 ditambahkan ke dalam sel elektrokimia dan puncak arus anode yang terbentuk diamati sebagai blangko. Selanjutnya ditambahkan 100 L ferosena, 100 L larutan XO 0,1 U/mL dan substrat xantina sebanyak 1 mL ke dalam sel elektrokimia. Sebelum dilakukan pengukuran, larutan dideaerasi dengan mengalirkan gas nitrogen selama ± 1 menit. Setelah penambahan setiap zat ke dalam larutan, perubahan arus yang terjadi diamati hingga mencapai arus keadaan tunak secara runut. Sebelum dilakukan pengukuran alat terlebih dulu dikalibrasi menggunakan larutan K3[Fe(CN)6].
Penentuan kondisi optimum aktivitas enzim XO
Optimasi dilakukan pada suhu (20-30 oC), pH (6-9), dan konsentrasi xantina (0.1-1.0 mM). Metode permukaan respons (RSM) digunakan untuk pengoptimuman aktivitas XO. Metode ini dilakukan dengan cara memasukkan kombinasi faktor-faktor peubah bebas pada perangkat lunak statistika Minitab.v.14 English. Selanjutnya percobaan dilakukan sesuai dengan kombinasi yang dihasilkan untuk mendapatkan nilai aktivitas optimumnya.
Pengujian daya inhibisi terhadap XO dan penentuan IC50 (Tamta et al. 2005) Uji daya inhibisi ekstrak kasar terhadap XO dilakukan pada kondisi optimumnya. Prosedur analisis mengacu pada Tamta et al. (2005) dengan modifikasi. Pengukuran dilakukan pada kondisi optimum yang telah diperoleh sebelumnya sesuai dengan prosedur pengukuran elektrokimia. Akan tetapi sebelum ditambahkan substrat xantina, ke dalam sel elektrokimia ditambahkan ekstrak herba dengan variasi konsentrasi tertentu.
Ekstrak tidak memberikan khasiat apabila aktivitas (arus) yang terukur setelah penambahan ekstrak sama besar dengan aktivitas (arus) kontrol (perlakuan tanpa ekstrak). Semakin kecil arus yang terukur berarti ekstrak semakin berkhasiat dalam menghambat kerja XO.
Aktivitas inhibisi dinyatakan dengan inhibition concentration 50% (IC50),
yaitu konsentrasi sampel yang dapat menghambat kerja XO sebesar 50%. Nilai IC50 diperoleh dari persamaan regresi yang diperoleh dari hasil pengukuran uji
daya inhibisi dengan memasukkan nilai y=50. Pembanding yang digunakan adalah allopurinol. Terhadap allopurinol juga ditentukan daya inhibisi dan IC50 nya
10
Pengujian kinetika inhibisi ekstrak terhadap XO
Prosedur uji kinetika inhibisi mirip dengan pelaksanaan uji penentuan daya inhibisi, hanya saja pada uji kinetika, konsentrasi substrat (xantina) divariasikan mulai dari 0.01 hingga 1.00 mM. Diuji sebagaimana penentuan daya inhibisi, dari sini akan diperoleh kinetika enzim XO dalam keadaan normal.
Selanjutnya ke dalam sederetan konsentrasi substrat yang lain ditambahkan ekstrak (konsentrasi terpilih) sehingga diperoleh kinetika enzim XO-inhibitor. Data yang diperoleh kemudian dikonversi dan diinterpretasikan ke dalam persamaan kinetika enzim dalam bentuk grafik. Selanjutnya dicari persamaan garis yang terbentuk dan tipe hambatannya berdasarkan perpotongan garis antara kinetika enzim normal dengan kinetika enzim setelah mendapat perlakuan ekstrak kasar.
Pengukuran spektrofotometri (Tamta et al. 2005)
Pengukuran spektrofotometri mengacu pada Tamta et al. (2005) yang telah dimodifikasi pada suhu inkubasi. Ke dalam tabung reaksi dimasukkan 1.9 mL Larutan bufer fosfat 50 mM pH 7.5, ditambah 1 mL xantina dan 0.1 mL XO 0.1 U/mL, kemudian diinkubasi pada suhu kamar selama 45 menit. Setelah masa inkubasi, ke dalam campuran dengan segera ditambahkan 1 mL HCl 0.58 M untuk menghentikan reaksi. Campuran selanjutnya diukur serapannya menggunakan spektrofotometer UV pada panjang gelombang maksimum yang telah diperoleh sebelumnya untuk melihat seberapa besar sisa xantina yang tidak bereaksi dalam sampel uji. Jumlah asam urat yang terbentuk selanjutnya dibandingkan dengan jumlah xantina yang direaksikan. Dengan bantuan standar xantina, akan diketahui seberapa besar jumlah xantina dalam sampel uji yang bereaksi.
4
HASIL DAN PEMBAHASAN
Ekstrak Sidaguri
Sampel sidaguri yang digunakan pada penelitian ini berbentuk simplisia yang telah dikeringkan dan dihaluskan. Pengeringan sampel ini dimaksudkan untuk menghindari pengaruh mikrob, karena kandungan air dalam suatu bahan akan mempengaruhi daya tahan sampel tersebut terhadap serangan mikrob. Simplisia sidaguri ditentukan kadar airnya agar dapat diperkirakan waktu penyimpanan terbaik bagi sampel untuk menghindari pengaruh aktivitas mikrob (jamur).
11
sehingga akan memudahkan dan mempercepat proses difusi pelarut ke dalam dinding sel tumbuhan serta proses ekstraksi dapat berjalan optimal.
Ekstraksi merupakan salah satu cara pemisahan satu atau lebih komponen yang terdapat dalam suatu bahan menggunakan pelarut yang sesuai. Ekstraksi digunakan untuk memperoleh kandungan senyawa kimia yang larut dalam pelarut. Metode ekstraksi pada penelitian ini adalah metode maserasi dengan pelarut etanol 30%. Mekanisme ekstraksi pada metode maserasi adalah adanya proses difusi pelarut ke dalam dinding sel tumbuhan untuk mengekstrak senyawa yang ada di dalam tumbuhan tersebut.
Etanol merupakan pelarut serbaguna yang baik untuk ekstraksi pendahuluan. Penggunaan etanol sebagai pengekstrak juga dikarenakan etanol memiliki dua gugus yang berbeda kepolarannya, yaitu gugus hidroksil yang bersifat polar dan gugus alkil yang cenderung bersifat nonpolar. Senyawa polar maupun nonpolar pada sampel diharapkan dapat terekstrak ke dalam etanol dengan keberadaan 2 gugus ini.
Kondisi Optimum Aktivitas XO
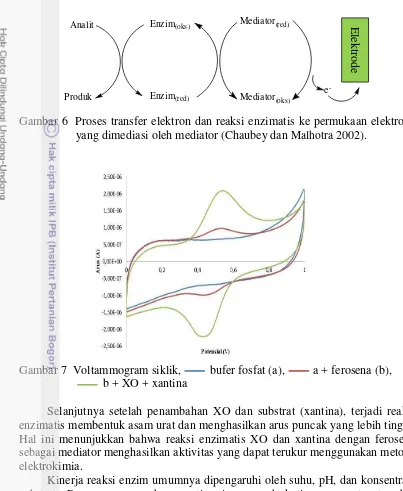
Pengukuran aktivitas XO dilakukan dengan metode voltametri siklik. Voltametri siklik merupakan salah satu metode elektroanalitik yang berdasarkan proses reduksi oksidasi pada permukaan elektrode kerja, yaitu elektrode pasta karbon. Elektrode pasta karbon adalah elektrode dengan material pasta yang merupakan penggabungan antara serbuk grafit dan parafin sebagai pengikat organik. Pemilihan elektrode pasta karbon sebagai elektroda kerja karena pembuatannya yang tidak terlalu rumit, harganya yang relatif murah, inert dan memiliki ketahanan secara kimia. Peningkatan kinerja elektrode kerja dapat dilakukan dengan penambahan mediator ke dalam larutan uji. Penambahan mediator akan mempercepat reaksi transfer elektron sehingga dapat meningkatkan respon analit agar dapat terukur (Wang 2000; Caubey dan Malhotra 2002).
Mediator yang digunakan pada pengukuran ini adalah ferosena. Pemilihan ferosena sebagai mediator, karena sifatnya yang stabil, tidak bereaksi langsung dengan substrat enzim, potensial redoks yang lebih rendah dari potensial oksidasi zat-zat pengganggu, dan tidak dipengaruhi oleh pH dan efek kekuatan ion pada media (Trivadila 2011). Ferosena berperan sebagai mediator dalam proses transfer elektron saat terjadi interaksi analit (substrat) dan enzim membentuk produk dalam kasus ini adalah interaksi antara xantina dan XO membentuk asam urat. Proses transfer elektron dan reaksi enzimatis ke permukaan elektrode yang dimediasi oleh mediator dapat dilihat pada Gambar 6. Pada pengukuran terlihat adanya peningkatan puncak arus setelah penambahan ferosena dibandingkan dengan sebelum penambahan ferosena ke dalam sel elektrokimia (Gambar 7). Arus puncak anode pada penyapuan maju sebagaimana terlihat pada Gambar 7 berhubungan dengan proses oksidasi ferosena (Fc) menjadi ion ferosenium Fc+ ([FeIII(C5H5)2]+), sedangkan penyapuan balik pada arus puncak katode
berhubungan dengan proses reduksi Fc+ menjadi Fc (Shim et al. 2009). Siklus reaksi redoks tersebut mengikuti persamaan reaksi berikut:
FeII(C5H5)2 → [FeIII(C5H5)2]+ + e-
12
e -Mediator(red)
Mediator(oks) Enzim(oks)
Enzim(red) Analit
Produk
Gambar 6 Proses transfer elektron dan reaksi enzimatis ke permukaan elektrode yang dimediasi oleh mediator (Chaubey dan Malhotra 2002).
Gambar 7 Voltammogram siklik, bufer fosfat (a), a + ferosena (b), b + XO + xantina
Selanjutnya setelah penambahan XO dan substrat (xantina), terjadi reaksi enzimatis membentuk asam urat dan menghasilkan arus puncak yang lebih tinggi. Hal ini menunjukkan bahwa reaksi enzimatis XO dan xantina dengan ferosena sebagai mediator menghasilkan aktivitas yang dapat terukur menggunakan metode elektrokimia.
Kinerja reaksi enzim umumnya dipengaruhi oleh suhu, pH, dan konsentrasi substrat. Rancangan percobaan optimasi pengaruh ketiga parameter tersebut terhadap aktivitas XO dilakukan dengan menggunakan metode permukaan respons (RSM) yang terdapat pada perangkat lunak statistik Minitab.v.14 English. Berbeda dengan optimasi secara konvensional, kondisi optimum untuk masing-masing parameter ditentukan secara terpisah tanpa memperhatikan hubungan antar parameter dalam waktu yang sama. Pada metode RSM kondisi optimum yang diperoleh telah memperhatikan hubungan masing-masing parameter terhadap respon dan hubungan antar-parameter terhadap respons.
Parameter yang dioptimumkan untuk aktivitas XO meliputi suhu (20-30 ºC), pH (6-9), dan konsentrasi xantina (0.10-1.00 mM). Parameter ini kemudian diolah dengan RSM dan menghasilkan luaran kombinasi faktor-faktor peubah bebas (Lampiran 6). Pengukuran elektrokimia untuk memperoleh respons arus puncak oksidasi (puncak anode) dilakukan sesuai dengan kombinasi tersebut. Hasil
Elektr
13
optimasi aktivitas XO diberikan pada Lampiran 7 dan alur kontur hubungan antara berbagai faktor dan puncak arus oksidasi yang dihasilkan ditunjukkan pada Gambar 8. Alur kontur menunjukkan puncak arus oksidasi yang tertinggi pada daerah dengan warna yang paling gelap (0.80–0.90 µA dan > 0.90 µA).
14
untuk masing-masing parameter suhu, pH dan konsentrasi xantina berturut-turut adalah 30 ºC, 7.5 dan 1.0 mM.
Penelitian sebelumnya oleh Iswantini et al. (2004) melaporkan kondisi optimum pengukuran pada suhu 20 ˚C, pH 7.5 dan konsentrasi substrat 0.7 mM. Kondisi pH yang sama juga dilaporkan oleh Kong et al. (2000). Adapun kondisi yang pengukuran yang berbeda lainnya di antaranya dilaporkan oleh Cengiz et al. (2012) yaitu pada suhu 37 C dan pH 9.0. Perbedaan kondisi optimum pengukuran untuk parameter suhu dan konsentrasi substrat disebabkan oleh perbedaan metode, alat dan waktu pengukuran.
Daya Inhibisi terhadap XO dan IC50
Analisis daya inhibisi ekstrak etanol herba sidaguri (daun dan batang) terhadap XO dilakukan dengan ragam konsentrasi ekstrak. Analisis pada berbagai variasi konsentrasi ini bertujuan untuk melihat pengaruh penambahan konsentrasi terhadap peningkatan daya inhibisi. Selain itu dengan ragam konsentrasi akan memudahkan dan memberikan keleluasaan terhadap pemilihan konsentrasi ekstrak yang akan digunakan sebagai kandidat pada pengujian kinetika enzim. Penentuan daya inhibisi dilakukan dengan melihat perubahan aktivitas yang dianalogikan dengan arus (I) sebelum dan sesudah penambahan ekstrak pada beberapa variasi konsentrasi.
Hasil analisis daya inhibisi ekstrak etanol herba sidaguri dapat dilihat pada Tabel 1, yang menunjukkan terdapat peningkatan daya inhibisi sejalan dengan bertambahnya konsentrasi ekstrak. Hubungan linear antara daya inhibisi dan konsentrasi ekstrak ditunjukkan dengan semakin menurunnya arus yang terukur setelah penambahan ekstrak pada berbagai variasi konsentrasi (Tabel 1).
Tabel 1 Daya inhibisi ekstrak etanol herba sidaguri terhadap aktivitas XO No [sidaguri]
15
disimpulkan bahwa metode elektrokimia dapat merespon aktivitas daya inhibisi ekstrak lebih baik dibandingkan metode spektrofotometri.
Berdasarkan data daya inhibisi yang telah diperoleh, pada penelitian ini coba ditentukan IC50,yaitu konsentrasi ekstrak yang mampu menghambat 50%
aktivitas XO. IC50 ditentukan dengan memplot hubungan antara konsentrasi dan
daya inhibisi pada kurva (Lampiran 8), dan hasil analisis menunjukkan persamaan regresi y = 0.317x + 21.105. Dari persamaan ini diperoleh IC50 ekstrak etanol
herba sidaguri sebesar 91.15±5.74 ppm. Menurut Thuong et al. (2006) suatu senyawa dikatakan aktif apabila memiliki nilai IC50 kurang dari 100 ppm.
Berdasarkan hal tersebut dapat disimpulkan bahwa ekstrak etanol herba sidaguri aktif sebagai inhibitor XO.
Sebagai pembanding pada penelitian ini juga ditentukan daya inhibisi dan IC50allopurinol. Allopurinol merupakan obat sintetik yang telah umum digunakan
untuk mengobati asam urat. Hasil analisis menunjukkan bahwa allopurinol memiliki daya inhibisi yang lebih kuat, pada konsentrasi 3 ppm sudah dapat menghambat aktivitas XO hingga 58%. Daya inhibisi allopurinol pada beberapa variasi konsentrasi dapat dilihat pada Tabel 2.
Tabel 2 Daya inhibisi allopurinol terhadap aktivitas XO No
Berdasarkan hubungan antara konsentrasi dan daya inhibisi diperoleh persamaan regresi y = 13.653x + 16.541 dan dari persamaan ini diperoleh nilai IC50sebesar 2.45±2.21 ppm (Lampiran 9). Penelitian lainnya tentang daya inhibisi
allopurinol menunjukkan IC50 allopurinol yang bervariasi di antaranya sebesar
6.10 ppm (Umamaheswari et al. 2009; Karmella dan Christine 2011), 3.74 ppm (Azmi et al. 2012) dan 4.29 ppm (Septianingsih et al. 2012). Hal ini menunjukkan bahwa metode elektrokimia yang dilakukan pada penelitian ini memberikan nilai IC50 yang relatif lebih kecil dibandingkan dengan metode
spektrofotometri yang dilaporkan oleh Umamaheswari et al. (2009) dan Azmi et al. (2012). Namun demikian penelitian lainnya juga melaporkan nilai IC50
allopurinol yang relatif lebih kecil sebesar 0.60 ppm (Wang et al. 2008). Nilai IC50 pada beberapa pengujian ini dapat saja berbeda karena dipengaruhi oleh
16
Kinetika Inhibisi Ekstrak terhadap XO
Pengaruh konsentrasi substrat terhadap aktivitas XO dapat diketahui dengan mengukur aktivitas XO dengan variasi konsentrasi substrat xantina pada rentang 0.01-1.00 mM. Gambar 9 yang identik dengan kurva Michaelis-Menten menunjukkan hubungan konsentrasi xantina dan aktivitas XO. Reaksi yang dikatalisis oleh enzim pada berbagai variasi konsentrasi substrat mengalami 2 fase, yaitu (1) jika konsentrasi substrat masih rendah, daerah yang aktif pada enzim tidak semuanya terikat pada substrat dan (2) jika jumlah molekul substrat meningkat maka daerah yang aktif terikat seluruhnya oleh substrat dan pada saat ini enzim telah bekerja dengan kapasitas penuh (Iswantini et al. 2013). Ketika konsentrasi xantina dibawah 1.00 mM, reaksi berada pada fase pertama dan ketika konsentrasi xantina mencapai 1.00 mM aktivitas XO mulai mencapai maksimum dan ini menunjukkan bahwa semua sisi aktif XO telah terikat dengan substrat sehingga penambahan substrat yang lebih tinggi tidak memberi pengaruh yang signifikan terhadap aktivitas XO.
Gambar 9 Hubungan konsentrasi substrat [xantina] dan aktivitas XO Gambar 10 menunjukkan hubungan linear antara konsentrasi substrat dan aktivitas XO dengan metode elektrokimia berada pada rentang 0.01-1.00 mM. Daerah linear yang diperoleh pada pengukuran secara elektrokimia ini lebih baik bila dibandingkan dengan hasil yang diperoleh dengan metode spektrofotometri. Pengukuran secara spektrofotometri dilakukan pada panjang gelombang maksimum ( maks) yang diperoleh pada penelitian ini yaitu pada maks 269.50 nm
(Lampiran 11). Hasil ini tidak terlalu jauh berbeda dari maks yang diperoleh
Iswantini et al. (2009) yaitu 262 nm. Pengukuran secara spektrofotometri menunjukkan daerah linear pengukuran pada rentang konsentrasi 0.05-0.50 mM (Gambar 11). Pada konsentrasi xantina > 0.50, reaksi enzimatis dengan XO memberikan ketelitian pengukuran yang tidak baik karena nilai absorbans yang diperoleh > 1.0 (Bintang 2010).
0.00 0.20 0.40 0.60 0.80 1.00 1.20
17
Gambar 10 Linearitas konsentrasi substrat [xantina] dan aktivitas XO secara elektrokimia.
Gambar 11 Linearitas konsentrasi substrat [xantina] dan aktivitas XO (kecepatan reaksi) secara spektrofotometri
Berbeda dengan pengukuran secara spektrofotometri, pada pengukuran secara elektrokimia nilai arus (µA) yang terukur dapat dianalogikan sebagai kecepatan reaksi enzimatis (Iswantini et al. 2013). Hasil analisis menunjukkan bahwa metode elektrokimia dan spektrofotometri masing-masing memberikan nilai sensitivitas sebesar 0.947 A mM-1 dan 0.007 menit-1. Semakin tinggi nilai sensitivitas menunjukkan bahwa dengan perubahan yang kecil dari konsentrasi dapat memberikan perubahan respon yang cukup besar (Amri et al. 2009). Dengan demikian metode elektrokimia cenderung memberikan sensitivitas yang lebih baik dibandingkan metode spektrofotometri dalam menentukan kecepatan reaksi enzimatis yang menjadi dasar untuk penentuan tipe kinetika inhibisi.
18
material imobilisasi (Laurinavicius et al. 2004; Balal et al. 2009; Goriushkina et al. 2010). Pengukuran secara elektrokimia lainnya melaporkan nilai sensitivitas yang beragam. Nilai sensitivitas yang lebih kecil di antaranya dilaporkan sebesar 0.55 A mM-1 (Shan et al. 2010) dan 0.062 A mM-1 (Demirkiran dan Ekinci 2012). Adapun nilai sensitivitas yang lebih besar di antaranya dilaporkan oleh Zhao et al.(200λ) sebesar 2λ.5 A mM-1.
Sensitivitas pada metode spektrofotometri juga dilaporkan beragam. Kaur et al. (2011) melaporkan nilai sensitivitas Sandell sebesar 0.0049. Penelitian lainnya menggunakan metode spektrofotometri melaporkan nilai sensitivitas sebesar 0,084λ g cm-2
(Lavudu et al. 2012). Metode elektrokimia juga dapat dilaporkan lebih efektif dibandingkan dengan metode spektrofotometri dalam penentuan tipe kinetika inhibisi karena metode elektrokimia membutuhkan waktu analisis yang lebih singkat, sensitivitas yang lebih baik dan jumlah bahan yang dibutuhkan relatif lebih sedikit.
Konsentrasi ekstrak yang dipilih dalam uji kinetika inhibisi adalah pada konsentrasi 100 ppm. Pemilihan ini berdasarkan pada kemampuan daya inhibisinya yang besar (> 50%) dan konsentrasi ini juga merupakan konsentrasi terdekat dari nilai IC50 ekstrak etanol herba sidaguri yang telah diperoleh
sebelumnya. Analisis kinetika inhibisi dari ekstrak coba ditentukan dengan metode Lineweaver-Burk dan Eadie-Hofstee. Berdasarkan hasil analisis (Lampiran 13), nilai koefisien determinasi (R2) yang diperoleh dari metode Lineweaver-Burk relatif lebih baik sehingga penentuan parameter kinetik (KM dan VMaks) dilakukan dengan metode ini (Gambar 12).
Gambar 12 Kinetika inhibisi ekstrak herba sidaguri yang diplot pada persamaan Lineweaver-Burk
Penentuan tipe kinetika inhibisi dilakukan dengan menentukan perubahan nilai konstanta Michaelis-Menten nyata (KM app) dan laju reaksi maksimum nyata
(Vmaks app) yang dianalogikan sebagai arus maksimum nyata (Imaks app). Berdasarkan
analisis terhadap grafik di atas diperoleh perubahan nilai KM app yang cukup
signifikan dan perubahan nilai Imaks app yang sangat kecil. Pola kinetika yang
terbentuk setelah penambahan ekstrak sebagai inhibitor mengakibatkan peningkatan KM app dari 0.0855 mM menjadi 0.2718 mM atau meningkat sebesar
19
penurunan nilai Imaks app dapat diasumsikan tidak terdapat perubahan (Iswantini et
al. 2012). Menurut Bintang (2010) perbedaan inhibitor kompetitif dan nonkompetitif adalah inhibitor kompetitif akan menyebabkan perubahan nilai KM app sedangkan inhibitor nonkompetitif akan menyebabkan perubahan Imaks app.
Peningkatan nilai KM app dan nilai Imaks app yang relatif tetap setelah
penambahan inhibitor mengindikasikan bahwa ekstrak etanol herba sidaguri mengarah pada tipe kinetika inhibisi kompetitif. Pada kinetika inhibisi kompetitif ini, inhibitor bereaksi dengan enzim secara kompetitif terhadap substrat untuk mengikat sisi aktif dari enzim. Tingkat penghambatan bergantung pada konsentrasi relatif substrat dan inhibitor, dan pada sebagian besar kasus dengan adanya inhibitor kompetitif laju maksimum (Vmaks) reaksi dapat dicapai jika
konsentrasi substrat cukup tinggi.
Pengukuran secara elektrokimia memberikan nilai KM app yang lebih kecil
dan nilai VMaksyang lebih besar dibandingkan dengan nilai KM app dan VMaks yang
diperoleh sebelumnya oleh Iswantini et al. (2009). KMmerupakan ukuran afinitas
substrat terhadap enzim. Semakin kecil nilai KM yang diperoleh pada metode
elektrokimia menunjukkan bahwa metode ini dapat mengukur afinitas substrat terhadap enzim meskipun pada konsentrasi yang relatif lebih rendah dibandingkan pada pengukuran secara spektrofotometri.
Besarnya nilai afinitas inhibitor (α) terhadap enzim dapat ditentukan dengan menghitung nisbah antara nilai KM app dengan inhibitor dan nilai KM app
tanpa inhibitor. Dari perhitungan diperoleh nilai α ekstrak herba sidaguri sebesar 3.18. Kondisi ini mengindikasikan adanya kompetisi yang cukup kuat antara ekstrak dan substrat untuk memperebutkan sisi aktif XO. Merujuk kepada Voet D dan Voet J (2001) yang menyebutkan bahwa inhibisi yang cukup kuat ditunjukkan dengan nilai afinitas inhibitor yang lebih besar dari 1.
20
5
SIMPULAN DAN SARAN
Simpulan
Berdasarkan penelitian diperoleh simpulan sebagai berikut:
1. Kondisi optimum pengukuran aktivitas XO secara in vitro dengan metode elektrokimia adalah pada pH bufer 7.5, suhu 30 ºC dan konsentrasi substrat sebesar 1.0 mM.
2. Uji daya inhibisi menunjukkan bahwa ekstrak etanol herba sidaguri berpotensi sebagai inhibitor XO dengan nilai IC50 < 100 ppm. Adapun allopurinol
sebagai obat sintetik memiliki daya inhibisi terhadap XO dengan IC50 2.45
ppm.
3. Metode elektrokimia menunjukkan sensitivitas yang lebih baik dibandingkan dengan metode spektrofotometri dengan nilai sensitivitas masing-masing adalah 0.95 A mM-1 dan 0.007 menit-1. Metode elektrokimia juga lebih efektif untuk diaplikasikan dalam penentuan tipe kinetika inhibisi dibandingkan metode spektrofotometri karena metode elektrokimia membutuhkan waktu analisis yang lebih singkat, sensitivitas yang lebih baik, dan jumlah bahan yang dibutuhkan relatif lebih sedikit.
4. Kinetika inhibisi ekstrak etanol herba sidaguri mengarah pada tipe kinetika inhibisi kompetitif yang ditunjukkan dari perubahan nilai KM app yang
signifikan sebelum dan sesudah penambahan ekstrak, masing masing sebesar 0.0855 mM dan 0.2718 mM.
5. Nilai afinitas inhibitor (α) yang diperoleh dari ekstrak herba sidaguri sebesar 3.18, menunjukkan adanya aktivitas inhibisi yang kuat dari ekstrak.
Saran
21
DAFTAR PUSTAKA
Amarender RG, Prapulla P, Anil CH, Chamundeeswari D, Uma MR. 2011. Free radical scavenging activity of the alcoholic extract of Sida rombifolia roots in arthritic rats. IJRPC 1(3):624-629.
Amri C, Siswanta D, Mudasir. 2009. Determination of trace nitrite as 4-(4-nitrobenzenazo)-aminonaphthalene complex by extraction spectrophotometry. Indo J Chem. 9(2):254–260.
Arslan F. 2008. An amperometric biosensor for uric acid determination prepared from Uricase immobilized in polyaniline-polypyrrole film. Sensors 8: 5492-5500.
Azmi S, Jamal P, Amid A. 2012. Xanthine oxidase inhibitory activity from potential Malaysian medicinal plant as remedies for gout. International Food Research Journal 19(1): 159-165.
Balal K, Mohammad H, Bahareh, Ali BMH, Mozhgam Z. 2009. Zeolite nonoparticle modified carbon paste electrode as a biosensor for simultaneous determination of dopamine and tryptophan. J Chim Chem 56: 789-796.
Bintang M. 2010. Biokimia-Teknik Penelitian. Jakarta: Erlangga.
[BPOM] Badan Pengawasan Obat dan Makanan Republik Indonesia. 2004. Materi Medika Indonesia. Jakarta (ID): BPOM
Campanella L, Bonnani A, Bellantoni D, Favero G, Tomasseti M. 2004. Comparison of fluorimtric, voltametric dan biosensor methods for determination of total antioxidant capacity of drug products containing acetylsalicylic acid. J PharmBiomed Anal. 36:91-99.
Cengiz, Cavaz, Yurdakoc, Aksu. 2012. Inhibition of xanthine oxidase by Caulerpenyne from Caulerpa prolifera.Turk J Biochem. 37(4):445–451. Chaubey A, Malhotra BD. 2002. Mediated biosensors. Biosensors &
Bioelectronics. 17:441–456.
Connor, Mark. 2009. Allopurinol for Pain Relief : more than just crystal clearance. British Journal of Farmacology 156:4-6.
Dalimarta S. 2003. Atlas Tumbuhan Obat Indonesia. Jilid ke-2. Jakarta (ID): Penerbit Surabaya.
David MN, Kenneth EL, Williams L. 1995. Screening for antitumor and anti-HIV activities of nine medicinal plants from Zaire. Pharm Biol. 33(6):98-106. Demirkiran N, Ekinci E. 2012. Immobilization of glucose oxidase in
GLYMO/MTEOS sol-gel film for glucose biosensor application. J Acta Chim Slov. 59:302–306.
Dhalwal K, Deshpande, Purohit. 2007. Evaluation of in vitro antioxidant activity of Sida rhombifolia (L.) Ssp. retusa (l.). Journal of Medicinal Food. 10(4): 683-688.
Gaw A, Murphy MJ, Cowan, RA, O’reilly DS, Stewart MJ, Shepherd J. 1998. Clinical Biochemistry. Longmann China Limited. Hongkong.
Gorishkina TB, Kurç BA, Jr. AS, Dzyadevych AV. 2010. Application of zeolites for immobilization of glucose oxidase in amperometric biosensors. Sensor Electronics and Microsystem Technologies 1: 36-42.
22
Hanaee J, Rashidi MR, Delazar A, Piroozpanah. 2004. Onion, a potent inhibitor of xanthine oxidase. Iran J Pharmaceut Res. 4:243-247.
Hattu. 2009. Studi voltametri dan analisis antihistamin setirizin dihidroklorida dan deksklorfeniramin maleat dalam medium surfaktan menggunakan elektroda pasta karbon [disertasi]. Bandung (ID): Institut Teknologi Bandung.
Hidayat R. 2007. Kinetika inhibisi flavonoid sidaguri (Sida rhombifolia L.) terhadap enzim Xantina oksidase [tesis]. Bogor (ID): Institut Pertanian Bogor.
Hille R. 2006. Structure and function of xanthine oxidoretuctase. Uropean J Inorganik Chem. 10: 1905-2095.
Hsieh JF, Wu SH, Yang YL, Choonga KF, Chen ST. 2007. The screening and characterization of 6-aminopurine-based xanthine oxidase inhibitors. Bioorg Med Chem. 15:3450-3456.
Indarti D, Asnawati. 2011. Karakterisasi film nata de-coco-benedict secara adsorpsi untuk sensor glukosa dalam urine. Jurnal Ilmu Dasar. 12(2):200-209.
Islam ME, Haque ME, Mosaddik MA. 2003. Cytotoxicity and antibacterial activity of Sida rhombifolia (Malvaceae) grown in Bangladesh. Phytotherapy Research. 17(8): 973-975.
Iswantini D, Darusman LK, Hidayat R. 2009. Indonesian sidaguri (Sida rhombifolia L.) as antigout and inhibition kinetics of flavonoids crude extract on the activity of xanthine oxidase. Journal of Biological Sciences. 9 (5): 504-508.
Iswantini D, Darusman LK, Rahminiwati M, Iskandar, Heryanto H penemu; Institut Pertanian Bogor. 2010. Formula ekstrak gabungan Apium graviolens dan Sida rhombifolia L. sebagai bahan fitofarmaka untuk penyakit gout: inhibitor Xantina oksidase. ID P00200400339.
Iswantini D, Nurhidayat N, Trivadila. 2011. Glucose biosensor selected Indonesia bacteria. Microbiology Indonesia. 5(1): 9-14.
Iswantini D, Nadinah, Darusman LK dan Trivadila. 2012. Inhibition kinetic of Apium graveolens L. ethanol extract and its fraction on the activity of xanthine oxidase and its active compound. Journal of Biological Sciences. 12 (1): 51-56.
Iswantini D, Nurhidayat N, Trivadila, Widiyatmoko O. 2013. Activity and stability of uricase from Lactobacillus plantarum was Immobilizated on Natural Zeolite for Uric Acid Biosensor. Pak J Biol. Sci:1-5
Ivekovic, Matea J, Matea S, Natasa Ž. 2012. Amperometric uric acid biosensor with improved analytical performances based on alkaline-stable H2O2
transducer. Int J Electrochem Sci. 7 (2012): 3252-3264.
Jen KL, Ping CC, Shoe YLS. 2000. Inhibition of xanthine oxidase and supression of intracelluler reaktive oxigen species in HL-60 cells by theaflavin-3-3- digallat, (-)-epigallocathecin-3-gallate, propyl gallate. J Agric Food Chem. 48:2736-2743.
Kaur M, Malik AK, Singh B. 2011. Fourth derivative spectrophotometric method for the determination of fungicide maneb using sodium molybdate. AmericanJournal of Analytical Chemistry. 2:158-163
23
Katno dan Pramono S. 2002. Tingkat Manfaat dan Keamanan Tanaman Obat Tradisional. Yogyakarta: Universitas Gajah Mada.
Katzung BG. 2002. Farmakologi Dasar dan Klinik, terjemahan Bagian Farmakologi Fakultas Kedokteran Universitas Indonesia. Jakarta: Salemba Medika.
Khalil NM, Sperotto JS, Manfron MP. 2006. Antiinflamatory activity of the hidroalcoholic extract of leaves of Sida rhombifolia Linn. (malvaceae). Acta Farm Bonaerense. vol 25.
Kong LD et al. 2000. Inhibition of xanthine oxidase by some Chinese medicinal plants used to treat gout. Journal of Ethnopharmacology. 73:199–207. Laurinavicius V, Razumiene J, RamanaviciusA, Ryabov AD. 2004. Wiring of
PQQ dehydrogenase. Biosensors and Bioelectronics 20:1217-1222.
Lavudu P, Rani AP, Sekaran CB, Kumar KS, Ramesh A. 2012. Determination of pramipexole dihydrochloride in tablet dosage forms by visible spectrophotometric method using acetyl acetone-formaldehyde reagent. Chemical Sciences Journal. CSJ-49.
Liu X, Chen R, Shang Y, Jiao B, Huang C. 2008. Lithospermic acid as a novel xanthine oxidase inhibitor has anti-inflammatory and hypouricemic effects in rats. Chem-Biol Interact. 176:137-142.
Maimun. 2007. Asam Urat dan Hiperuresemia. Majalah Kedokteran Nusantara Volume 40(1). Universitas Sumatera Utara.
McPherson, Richard, Matthew. 2007. Henry’s Clinical Diagnosis and Management by Laboratory Methods. Philadelphia: Saunders Elsevier. Meriem B, Karima A, Dina A, Djebbar A, Mustapha B. 2010. Kinetic study on
the inhibition of xanthine oxidase by extracts from two selected algerian plants traditionally used for the treatment of inflammatory diseases. Journal of Medicinal Food. 13(4): 896-904.
Meza R. 2008. Pengaruh ekstrak etanol daun sidaguri (Sida rhombifolia L.) terhadap kadar asam urat serum mencit putih jantan. Padang (ID): Universitas Andalas
Millar TM, Kanczler JM, Bodamyali T, Blake DR , Stevens CR. 2002. Xanthine oxidase is a peroxynitrite synthase: newly identified roles for a very old enzyme. Redox Report 7(2): 65-70.
Mirel S, Sandulescu R, Kauffmann J.M, Roman L. 1998. Electrochemical study of some 2-mercapto-5-R-ammino-1,3,4-thiadiazole derivatives using carbon paste electrodes. J Pharmaceutical and Biomedical Analysis. 18:535–544. Nile SH, Khobragade CN. 2011. Phytochemical analysis, antioxidant and
xanthine oxidase inhibitory activity of Tephrosia purpurea Linn. Root extract. Indian J Nat Prod Resour. 2(1):52-58.
Oliviera JE, Mattoso LH, Medeiros ES, Zucolotto V. 2012. Poly(lactic acid)/carbon nanotube fibers as novel platforms for glucose biosensors. Biosensors. 2:70-82; doi:10.3390/bios2010070.
Pauff J dan Hille R. 2009. Inhibition studies of bovine xanthine oxidase by luteolin, silibinin, quercetin, and curcumin. JNat Prod.72(4): 725–731. Price NC, Stevens L. 1996. Fundamental of Enzymology. 2nd Ed. New York:
Oxford University Press.
24
Rashmi RS, Uma SM, Prasanta KC. 2010. Comparative in vitro antimicrobial activity studies of Sida rhombifolia Linn fruit extracts. Int J PharmTech Res. 2(2).
Rao KS, Sutradhan MH. 1997. Anti-inflammatory and hepatoprotective activities of Sida rhombifolia Linn. Indian J Pharmacol. 29(2):110-116.
Sarawek S. 2007. Xanthine oxidase inhibition and antioxidant activity of an artichoke leaf extract (Cynara scolymus L.) and its compouns [desertasi]. Florida. University of Florida.
Septianingsih U, Susanti H, Widyaningsih W. 2012. Penghambatan aktivitas xanthine oxidase oleh ekstrak etanol akar sambiloto (Andrographis paniculata,Ness) secara in vitro. Jurnal Ilmiah Kefarmasian. 2(2): 153-163 Shamley D. 2005. Pathophysiology an Essential Text for The Allied Health
Professions. USA: Elsevier Butterworth Heinemann.
Shan C, Yang H, Han D, Zhang Q, Ivaskab A, Niu L. 2010. Graphene/AuNPs/chitosan nanocomposites film for glucose biosensing. J. Biosensors and Bioelectronics 25:1070–1074.
Shiraishi H dan Une H. 2009. The effect of the interaction between obesity and drinking on hyperuricemia in Japanese male office workers. J Epidemiol 19(1):12-16
Skoog DA, West DM, Holler FJ. 1998. Fundamentals of Analytical Chemistry. Edisi ke-7. Orlando: Saunders College.
Tamta, Kalra S, Mukhopadhyay AK. 2005. Biochemical characterization of some Pyrazolopyrimidine-based inhibitors of xanthine oxidase. Biochemistry, 71:S49-S54.
Thenawijaya M. 1995. Pengantar Kinetika Enzim. IPB Press. Bogor.
Thuong PT, Na MK, Dang NH, Hung TM, Ky PM, Thanh TV, Nam NH, Thuan ND, Sok DE, Bae KI. 2006. Antioxidant activities of Vietnamese medicinal Plants, J Natural Prod Sci.12(1):29-37.
Trivadila. 2011. Biosensor antioksidan menggunakan superoksida dismutase Deinococus radiodurans diimobilisasi pada permukaan elektrode pasta karbon dan parameter kinetikanya. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Umamaheswari M, Asokkumar K, Sivashanmugam AT, Remyaraju A, Subhadrevi V, Ravi TK. 2009. In vitro xanthine oxidase inhibitory activity of the fractions of Erythrina stricta Roxb. J-etnopharmacol.124(3):646-8 Voet D, Voet JG. 2001. Biochemistry. New York: John Willey and Sons.
Wang J. 2000. Analytical Electrochemistry 2nd Edition. USA: John Wiley & Sons Publishers.
Wang SY, Yang CW, Liao JW, Zhen WW, Chu FH, Chang ST. 2008. Essential oil from leaves of Cinnamomum osmophloeum acts as a xanthine oxidase inhibitor and reduces the serum uric acid levels in oxonated-induced mice. Phytomedicine 15:940-945.
Winarno FG. 1997. Kimia Pangan dan Gizi. Jakarta: Gramedia Pustaka Utama. Zhao C, Wan L, Wang Q, Liu S, Jiao K. 2009. Highly sensitive and selective uric
25
Lampiran 1 Diagram alir umum penelitian
Lampiran 2 Uji daya inhibisi dan penentuan IC50 ekstrak
*= [ekstrak] divariasikan pada sederetan konsentrasi
IC50 merupakan nilai konsentrasi minimal ekstrak yang dapat menginhibisi
aktivitas enzim sampai 50%. Nilai IC50 diperoleh dari persamaan regresi yang
diperoleh pada hasil pengukuran uji daya inhibisi dengan memasukkan nilai y=50.
- Dioptimasi menggunakan RSM (T, pH, [substrat]
- Uji daya inhibisi ekstrak dan allopurinol
- Penentuan IC50 ekstrak dan allopurinol
- Uji kinetika inhibisi
Kondisi optimum
Diekstraksi (BPOM 2004)
Serbuk herba sidaguri
Ekstrak herba sidaguri
Elektrode pasta karbon
Penentuan mekanisme kinetika inhibisi
Pengukuran Elektrokimia
Dimasukkan secara perlahan
Sel elektrokimia 1,9 mL larutan bufer
100 L ferosenaa
100 µL XO 1 mL xantina 1 mL ekstrak*
Dilakukan pada kondisi optimum
Diukur potensial Dan ditentukan aktivitas Xantina
oksidase
26
Lampiran 3 Uji daya inhibisi dan penentuan IC50 allopurinol
*= [allopurinol] divariasikan pada sederetan konsentrasi
Lampiran 4 Uji kinetika inhibisi
Larutan bufer 1,9 mL 0.1 mL XO
1 mL ekstrak [terpilih] 1 mL xantina
Persamaan Kinetika Enzim
Mekanisme kinetika inhibisi
Dimasukkan secara perlahan
Sel elektrokimia
Dilakukan pada kondisi optimum
Diukur potensial Dimasukkan secara
perlahan
Sel elektrokimia 1.9 mL larutan bufer
100 L ferosenaa
100 µL XO 1 mL xantina 1 mL allopurinol*
Dilakukan pada kondisi optimum
Diukur potensial Dan ditentukan aktivitas Xantina
oksidase
27
Lampiran 6 Kombinasi faktor-faktor peubah bebas menggunakan RSM
![Gambar 9 Hubungan konsentrasi substrat [xantina] dan aktivitas XO](https://thumb-ap.123doks.com/thumbv2/123dok/222398.400037/36.595.88.477.121.559/gambar-hubungan-konsentrasi-substrat-xantina-dan-aktivitas-xo.webp)
![Gambar 10 Linearitas konsentrasi substrat [xantina] dan aktivitas XO secara](https://thumb-ap.123doks.com/thumbv2/123dok/222398.400037/37.595.111.494.71.562/gambar-linearitas-konsentrasi-substrat-xantina-dan-aktivitas-secara.webp)