EFEKTIVITAS
SPAWNPRIM
SEBAGAI PEMERCEPAT
OVULASI PADA IKAN KOMET
Carassius auratus auratus
FIRMAN RAMDHANI
PROGRAM STUDI TEKNOLOGI DAN MANAJEMEN AKUAKULTUR DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
ABSTRAK
FIRMAN RAMDHANI. Efektivitas spawnprim sebagai pemercepat ovulasi pada ikan komet Carassius auratus auratus. Dibimbing oleh AGUS OMAN SUDRAJAT dan ALIMUDDIN.
Penggunaan ovaprim dalam pemijahan buatan telah mampu merangsang ikan agar berovulasi lebih cepat dibandingkan pemijahan secara alami. Namun demikian, harga ovaprim yang relatif tinggi berdampak pada biaya produksi benih yang tinggi pula. Pada penelitian pemijahan buatan menggunakan ikan komet, digunakan campuran bahan (spawnprim) aromatase inhibitor (AI), anti dopamin (AD) dan LHRH analog (LHRHa) sebagai pemicu ovulasi sekaligus menggantikan peran ovaprim. Pengaruh spawnprim ternyata dapat memicu ikan berovulasi pada jam ke-6 setelah penyuntikan. Hasil yang sama didapat pada perlakuan menggunakan ovaprim. Perbedaan signifikan hanya terlihat pada parameter tingkat ovulasi. Tingkat ovulasi yang dicapai spawnprim berkisar antara 5,98 ± 2,83% hingga 13,88 ± 2,75% dan belum mampu menyamai pencapaian ovaprim yaitu sebesar 29,44 ± 6,80%. Hal ini diduga karena pengaruh kadar AI yang terlalu tinggi (150 mg/l) dalam spawnprim. Dugaan lain adalah ikan mencapai ovulasi lebih cepat, namun keterlambatan striping menimbulkan atresia pada telur. Hasil penelitian ini menunjukkan bahwa spawnprim dapat memicu percepatan ovulasi pada ikan komet. Penggunaan spawnprim dalam kegiatan pemijahan buatan merupakan alternatif untuk menekan biaya produksi benih sehingga dapat lebih efisien.
ABSTRACT
FIRMAN RAMDHANI. The effectivity of spawnprime to induce ovulation in comet goldfish Carassius auratus auratus. Supervised by AGUS OMAN SUDRAJAT and ALIMUDDIN.
Use of ovaprim in artificial spawning has been able to stimulate the fish to ovulate faster than the natural spawning. However, the relatively high price of ovaprim impacts on seed production costs to high level. In the study of artificial spawning using goldfish, we used a mixture of materials (spawnprime) aromatase inhibitors (AI), anti-dopamine (AD) and LHRH analogue (LHRHa) as a trigger of ovulation as well as replacing the ovaprim. The spawnprime's effect was trigger fish ovulation on the 6th hour after injection. Similar results were obtained on treatment using ovaprim. Ovulatory levels of spawnprime ranged 5.98 ± 2.83% to 13.88 ± 2.75% and has not been able to match the achievement of ovaprim that is equal to 29.44 ± 6.80%. This is presumably because the influence of AI levels are too high (150 mg / l) in spawnprime. Another presumption is to fish more quickly reach ovulation, but the delay of stripping caused atresia on eggs. These results indicate that spawnprime can accelerate ovulation in goldfish. The use of
spawnprime for artificial spawning is an alternative spawning inducer to reduce the cost of seed production to become more efficient.
EFEKTIVITAS
SPAWNPRIM
SEBAGAI PEMERCEPAT
OVULASI PADA IKAN KOMET
Carassius auratus auratus
FIRMAN RAMDHANI
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan,
Institut Pertanian Bogor
PROGRAM STUDI TEKNOLOGI DAN MANAJEMEN AKUAKULTUR DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
EFEKTIVITAS SPAWNPRIM SEBAGAI PEMERCEPAT OVULASI PADA IKAN KOMET Carassius auratus auratus
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Mei 2011
Judul : Efektivitas Spawnprim Sebagai Pemercepat Ovulasi Pada Ikan Komet Carassius auratus auratus
Nama Mahasiswa : Firman Ramdhani Nomor Pokok : C14052856
Disetujui,
Pembimbing I Pembimbing II
Dr. Ir. Agus Oman Sudrajat, M.Sc Dr. Alimuddin, S.Pi, M.Sc NIP. 19640813 199103 1 001 NIP.19700103 199512 1 001
Diketahui,
Ketua Departemen Budidaya Perairan
Dr. Ir. Odang Carman, M.Sc NIP. 19591222 198601 1 001
PRAKATA
Segala puji dan syukur dipanjatkan kepada Allah SWT Maha Pemilik Pengetahuan, dengan izin-Nya semata penulis dapat terus menimba ilmu hingga mampu menyelesaikan skripsi yang berjudul “Efektivitas spawnprim sebagai pemercepat ovulasi pada ikan komet Carassius auratus auratus”. Adapun penelitian dilakukan pada bulan November 2009-Mei 2010, bertempat di Kolam Percobaan Babakan dan Laboratorium Reproduksi dan Genetik Organisme Akuatik, Departemen Budidaya Perairan, serta Laboratorium Produktivitas Lingkungan, Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan banyak terima kasih atas doa dan dukungan yang diberikan oleh kedua orang tua, kakak dan adik-adik tercinta. Demikian juga halnya dengan bimbingan yang diberikan Bapak Dr. Ir. Agus Oman Sudrajat, M.Sc selaku Dosen Pembimbing I, Bapak Dr. Alimuddin, S.Pi, M.Sc selaku Dosen Pembimbing II, serta Bapak Ir. Dadang Shafruddin, MS selaku Dosen Pembimbing Akademik sekaligus Dosen Penguji Tamu pada sidang skripsi. Tidak lupa terima kasih penulis ucapkan kepada staf Departemen BDP, staf teknisi Kolam Percobaan Babakan, rekan satu penelitian –Rezi Hidayat, S.Pi dan M. Ahya Rafiuddin, S.Pi– serta pihak lain yang telah banyak membantu dan terlibat dalam penyusunan skripsi ini. Rasa syukur juga penulis panjatkan atas kebersamaan dengan teman-teman BDP angkatan 42, teman satu atap di P-House, Pondok Al-Izzah B dan Warung Sakinah yang selalu mengalirkan inspirasi.
Akhir kata, penulis sangat berharap bahwa skripsi ini dapat bermanfaat bagi semua pihak.
Bogor, Mei 2011
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Indramayu tanggal 19 Mei 1986 dari ayah Emor Mardianawijaya dan ibu S. Sri Wahyuni. Penulis merupakan anak kedua dari empat bersaudara. Pendidikan formal yang dilalui penulis adalah SMAN 1 Cirebon dan lulus tahun 2005. Pada tahun yang sama, penulis lulus seleksi masuk IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) dan memilih mayor Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Selama mengikuti perkuliahan, penulis pernah melakukan praktek magang pembenihan udang vaname di PT. Triwindu Graha Manunggal (TWM), Anyer. Penulis juga pernah menjadi asisten mata kuliah Dasar-Dasar Genetika Ikan semester genap 2008/2009 dan Pendidikan Agama Islam semester genap 2008/2009. Selain itu penulis juga aktif menjadi pengurus Badan Eksekutif Mahasiswa Fakultas Perikanan dan Ilmu Kelautan periode 2006/2007, Forum Keluarga Muslim Fakultas Perikanan dan Ilmu Kelautan periode 2006/2007 dan 2007/2008 serta Lembaga Pengajaran Qur’an Alhurriyah IPB periode 2007/2008. Tugas akhir dalam pendidikan tinggi diselesaikan dengan menulis skripsi yang berjudul “Efektivitas spawnprim sebagai pemercepat ovulasi pada ikan komet
ii
III. HASIL DAN PEMBAHASAN ... 11
3.1 Hasil ... 11
3.1.1 Tingkat Keberhasilan dan Lama Waktu Ovulasi ... 11
3.1.2. Tingkat Ovulasi ... 11
3.1.3 Derajat Pembuahan ... 12
3.1.4 Derajat Penetasan ... 13
3.1.5 Tingkat Kelangsungan Hidup ... 13
3.2 Pembahasan ... 14
IV. KESIMPULAN DAN SARAN ... 23
4.1 Kesimpulan ... 23
4.2 Saran ... 23
DAFTAR PUSTAKA ... 24
DAFTAR TABEL
Halaman
1. Ciri tahapan perkembangan gonad ... 1
2. Hubungan parameter kematangan gonad berdasarkan umur ikan, bobot tubuh, bobot gonad dan GSI pada Carassius auratus ... 2
3. Komposisi larutan stok masing-masing spawnprim ... 7
4. Dosis masing-masing komponen perlakuan dan kontrol ... 7
5. Tingkat keberhasilan dan lama waktu ovulasi ... 11
6. Periode inkubasi berdasarkan temperatur ... 21
DAFTAR GAMBAR
Halaman
1. Tingkat ovulasi ikan komet pada perlakuan berbeda ... 12
2. Derajat pembuahan ikan komet pada perlakuan berbeda ... 12
3. Derajat penetasan ikan komet pada perlakuan berbeda ... 13
4. Tingkat kelangsungan hidup ikan komet pada perlakuan berbeda ... 13
5. Alur produksi 17α,20β-diOHprog di dalam folikel ovari ... 15
DAFTAR LAMPIRAN
Halaman
1. Data kualitas air berbagai wadah ... 28
2. Data tingkat keberhasilan dan lama waktu ovulasi ... 28
3. Jumlah total telur dalam gonad pada induk perlakuan ... 29
4. Tingkat ovulasi ikan perlakuan ... 29
5. Derajat pembuahan (FR) ikan perlakuan ... 29
6. Derajat penetasan (HR) ikan perlakuan ... 30
7. Tingkat kelangsungan hidup (SR) ikan perlakuan ... 30
8. Contoh perhitungan Uji Anova dan Uji Beda Nyata Duncan pada parameter derajat pembuahan (FR) 31 9. Contoh perhitungan Uji Anova dan Uji Beda Nyata Duncan pada parameter derajat penetasan (HR) 32 10. Contoh perhitungan Uji Anova dan Uji Beda Nyata Duncan pada parameter tingkat kelangsungan hidup (SR) ... 34
11. Perhitungan harga spawnprim ... 35
12. Daftar harga bahan dasar spawnprim ... 36
13. Proses pematangan oosit secara alami (Harvey dan Carolsfeld, 1993) 36 14. Bagan proses induksi hormonal pada pemijahan buatan (Harvey dan Carolsfeld, 1993) ... 37
I.
PENDAHULUAN
1.1 Latar Belakang
Nilai ekspor ikan hias Indonesia dalam 3 tahun terakhir tercatat sebesar US$7,3 juta pada tahun 2007, US$8,3 juta pada tahun 2008 dan US$10,0 juta pada tahun 2009. Walaupun nilai ini meningkat setiap tahunnya, namun dinilai masih belum cukup signifikan (Soen’an, 2010). Sementara itu, data Kementerian Kelautan dan Perikanan menyebutkan bahwa permintaan impor ikan AS dan Eropa dari Indonesia masing-masing mencapai US$ 900 juta dan US$ 350 juta dari total ekspor Indonesia di tahun 2010 sebesar US$ 2,9 Juta (Rosalina, 2011). Dari kondisi tersebut disimpulkan perlunya peningkatan kapasitas produksi untuk mengoptimalkan potensi maupun memenuhi permintaan yang ada. Salah satu aspek penting kegiatan produksi tersebut adalah pembenihan.
Saat ini, pembenihan skala kecil maupun besar telah menggunakan teknologi pembenihan buatan dengan bahan perangsang yang umum digunakan berupa ovaprim. Bahan ini cukup efektif digunakan untuk merangsang pemijahan sehingga dapat dihasilkan benih ikan tanpa bergantung pada musim pemijahan. Selain itu, penggunaan ovaprim lebih praktis dibandingkan dengan pembenihan buatan menggunakan teknik manipulasi lingkungan.
Pada prinsipnya, pembenihan buatan merupakan teknik manipulasi kinerja hormonal ikan dengan target menyingkat masa pematangan gonad menuju tahap pematangan akhir dan ovulasi. Effendie dalam Sularto (2002) mengutip ciri-ciri dari tiap tingkat perkembangan gonad Nikolsky (Tabel 1).
Tabel 1. Ciri tahapan perkembangan gonad
Tahap Ciri
1 Gonad masih muda, ukurannya sangat kecil.
2 Tahap istirahat, produik seksual belum berkembang, gonad masih kecil, oosit belum dapat dibedakan dengan mata biasa.
3 Tahap pemasakan, oosit dapat dibedakan dengan mata biasa, perkembangan gonad sedang berjalan dengan cepat
4 Tahap matang gonad, gonad mendapat bobot yang maksimal, oosit belum keluar bila perutnya ditekan.
5 Tahap reproduksi, oosit keluar bila perut ditekan perlahan.
6 Kondisi salin, oosit sudah dikeluarkan, lubang genital kemerah-merahan, ovari biasanya berisi beberapa oosit sisa.
2 Untuk melewati tahapan-tahapan pematangan tersebut, ikan membutuhkan proses fisiologis dalam jangka waktu tertentu. Ortega-Salas dan Reyes-Bustamante (2006) mengutip skala kematangan gonad Nikolsky yang mengaitkan hubungan antara umur ikan, bobot tubuh, bobot gonad, dan gonadosomatic index
(GSI), dengan lama waktu yang dibutuhkan untuk melewati tahap-tahap pematangan gonad pada Carassius auratus (Tabel 2).
Tabel 2. Hubungan parameter kematangan gonad berdasarkan umur ikan, bobot tubuh, bobot gonad dan GSI pada Carassius auratus
Umur (hari) Bobot tubuh
(gram)
Ovaprim merupakan produk sintetik yang terdiri dari campuran salmon Gonadotropin-Releasing Hormone analogue (sGnRHa [D-Arg6-Pro9-Net-sGnRHa]) dengan dopamin antagonis, domperidone (Abdullah, 2007). Pada kegiatan pembenihan, umumnya ovaprim digunakan sebagai bahan perangsang pematangan gonad dan pemijahan pada induk. Nandeesha et al. (1990) melaporkan, ovaprim yang disuntikkan secara intramuskular dengan dosis 0,5 ml/kg telah mampu menginduksi pembenihan pada Indian major carp. Berdasarkan skala kematangan gonad Nikolsky di atas (Tabel 1 dan Tabel 2), penyuntikan ovaprim dapat dilakukan pada induk matang gonad level 4, dengan tujuan induk mencapai kematangan pada level 5 (ovulasi). Dengan demikian, stimulus ovaprim mampu menyingkat interval waktu kematangan gonad level 4 hingga level 5 dari waktu normal 1-15 hari. Meskipun demikian, efektivitas ovaprim sebagai bahan pemicu ovulasi disertai pula dengan harga yang relatif tinggi.
Sesuai dengan kandungan bahan-bahan yang terdapat dalam ovaprim, maka dicari suatu bahan yang dapat menggantikan produk tersebut dengan efektivitas yang sama atau bahkan lebih baik, namun diharapkan harga bahan tersebut lebih rendah. Sebuah penelitian dilakukan oleh Sumantri (2006) untuk menguji kecepatan ovulasi pada ikan lele dumbo Clarias sp. yang disuntik
3 menggunakan ovaprim. Kesimpulan yang dihasilkan adalah pada dosis AI sebesar 250 mg/kg tidak dapat merangsang terjadinya ovulasi sebagaimana ovaprim. Penelitian mengenai AI tersebut dilanjutkan oleh Saleh (2009) terhadap ikan sumatra Puntius tetrazona. Hasil menunjukkan bahwa stimulus kontrol positif ovaprim berakibat ovulasi pada jam ke-8 setelah penyuntikan. Hasil ini masih lebih cepat dibandingkan dengan perlakuan AI pada dosis lebih rendah, yaitu 100 µg/ml, yang mampu menstimulus ovulasi pada kisaran 14 jam setelah penyuntikan.
Selanjutnya Permana (2009) membandingkan kembali efektivitas penambahan AI dan ovaprim sebagai stimulus ovulasi pada ikan sumatra Puntius tetrazona. Pada penelitian ini, Permana (2009) membuat kombinasi AI dosis 100 µg/ml dengan anti dopamin (AD) jenis domperidone pada dosis 10 mg/ml dan
Leutenizing Hormone Releasing Hormone analogue (LHRHa) dengan dosis bervariasi antara 0-20 µg/ml, yang disebut sebagai larutan spawnprim. Dari percobaan tersebut, disimpulkan bahwa penggunaan AI dan LHRHa pada dosis optimal 20 µg/ml terbukti mampu menstimulus ovulasi pada kisaran waktu 9-16 jam setelah penyuntikan. Sementara itu ovaprim masih mampu lebih cepat dalam menstimulus ovulasi yaitu pada kisaran waktu 8-14 jam setelah penyuntikan.
Berdasarkan penelitian-penelitian tersebut diketahui beberapa bahan yang berperan penting dalam mekanisme pematangan akhir, dan pada dosis tertentu mampu menyingkat proses ovulasi. Leutenizing Hormone Releasing Hormone
4 (Fujaya, 2004). Dengan demikian LHRHa memiliki fungsi seperti sGnRHa pada ovaprim.
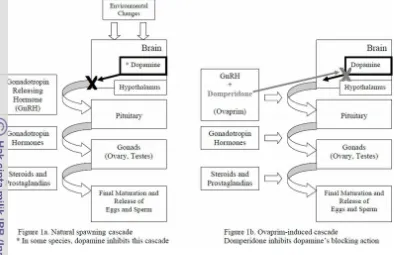
Sekresi gonadotropin oleh LHRH dihambat oleh suatu mekanisme yang dilakukan oleh senyawa dopamin. Abdullah (2007) menjelaskan, pada koki terdapat suatu faktor endogen diantaranya berupa GRIF (Gonadotropin Release-Inhibiting Factor) yang diproduksi oleh otak. Dopamin dalam hal ini berfungsi sebagai GRIF yang melengkapi alur pematangan gonad pada ikan. Bila kerja dopamin dihambat dengan antagonisnya (AD), maka peranan dopamin terhenti sehingga sekresi gonadotropin akan meningkat. Domperidone merupakan jenis AD yang umumnya digunakan dalam campuran ovaprim beserta pemberian LHRHa.
AI adalah suatu zat non-steroid yang dapat digunakan untuk menghambat aktivitas enzim aromatase (Basuki, 2007). Proses ini selanjutnya akan menghambat produksi estradiol-17β dan vitellogenesis sehingga akan mengirimkan sinyal balik bagi hipofisis untuk segera memproduksi GTH II yang berperan dalam proses pematangan (Sumantri, 2006). Basuki (2007) melaporkan bahwa dosis AI 2,5 mg/kg induk dan kehadiran jantan telah mampu merangsang pembenihan ikan koki hingga 100%.
Bahan-bahan tersebut berperan dalam proses pematangan akhir sehingga kombinasi ketiganya pada proporsi yang tepat diduga akan memercepat ovulasi induk matang gonad. Pada spawnprim dengan kadar LHRHa yang sama dengan ovaprim (20 µg/ml), dilaporkan bahwa campuran tersebut mampu memicu terjadinya pematangan gonad dan ovulasi pada ikan sumatra (Permana, 2009). Pengurangan LHRHa hingga dosis tertentu diharapkan dapat menurunkan biaya produksi, sementara perannya dalam mekanisme ovulasi dapat disubstitusi oleh peningkatan dosis AI. Oleh karena itu perlu ditentukan dosis masing-masing bahan sehingga hasil yang diperoleh tetap efektif.
1.2Tujuan
Penelitian ini bertujuan untuk menguji efektivitas proporsi larutan LHRHa, AD dan AI dalam spawnprim terhadap kecepatan ovulasi ikan komet
II. BAHAN DAN METODE
2.1 Persiapan Wadah
Wadah yang digunakan antara lain tandon penampungan air berdiameter 2 m sebanyak 1 buah; tandon pemeliharaan induk berdiameter 1 m sebanyak 2 buah; akuarium perlakuan ukuran 50 x 30 x 30 cm sebanyak 6 buah; akuarium ukuran 20 x 10 x 10 cm sebanyak 15 buah yang diletakkan berseri dalam akuarium ukuran 100 x 30 x 30 cm untuk penetasan telur serta pemeliharaan larva. Setelah dilakukan pengecekan terhadap kebocoran, wadah yang akan digunakan terlebih dahulu dibersihkan menggunakan sabun, kemudian dikeringkan di bawah panas matahari. Perlengkapan aerasi disetting sebelum pengisian air ke dalam bak. Selanjutnya bak pemeliharaan induk diisi air sekitar 10% volume total. Sedangkan wadah lainnya diisi air hingga mencapai 50% volume total. Air yang telah diisikan ke dalam wadah kemudian ditambahkan larutan Kalium Permanganat hingga berwarna kemerahan dan diaerasi selama 24 jam. Setelah itu air diganti dengan volume yang sama dengan sebelumnya.
Untuk menghindarkan telur dari serangan jamur, pada bak penetasan dan pemeliharaan larva ditambahkan methylen blue sebanyak 2 ppm. Selain itu, pada bak penetasan dan pemeliharaan larva ukuran 20 x 10 x 10 cm ditambahkan
shelter agar larva tidak lepas dari akuarium perlakuan masing-masing.
2.2 Pemeliharaan Ikan
6 2.3 Pembuatan Larutan Stok
Untuk membuat spawnprim, terlebih dahulu dibuat larutan stok yang merupakan bahan baku pencampuran.
2.3.1 Larutan Stok LHRHa
Sebanyak 5 ml etil alkohol dicampurkan ke dalam botol yang berisi 5 mg LHRHa lalu dikocok hingga larut. Setelah itu, larutan LHRHa diambil sebanyak 1 ml dan diencerkan kembali dengan etil alkohol hingga mencapai 10 ml lalu dimasukkan kedalam botol stok dan diberi label. Selanjutnya, LHRHa ini siap dibagikan kedalam botol-botol untuk bahan perlakuan sesuai dosis.
2.3.2 Larutan Stok AD
AD yang digunakan adalah domperidone 10 mg/tablet dengan target dosis 10 mg/ml. Sebanyak 20 tablet pertama digerus dan ditambahkan 16 ml akuabides (stok AD1), kemudian 20 tablet berikutnya digerus dan ditambahkan 14 ml akuabides (stok AD2). Kedua stok lalu dihomogenasi menggunakan stirer dalam gelas piala di atas hot plate selama sehari. Setelah itu, sebanyak 1 ml larutan hasil homogenasi diambil lalu dimasukkan ke dalam tube 1,5 ml untuk disentrifugasi pada kecepatan 10.000 rpm selama sekitar 5 menit. Setelah itu, supernatan yang terbentuk diambil dan dikumpulkan dalam botol gelap ukuran 10 ml serta diberi label.
2.3.3 Larutan stok AI
AI yang digunakan adalah serbuk imidazole produksi Wako Pure Chemical Industries, Ltd. Sebanyak 200 mg AI dilarutkan dalam 100 ml akuabides, larutannya diambil dan dimasukkan ke dalam botol gelap lalu diberi label.
2.4 Pembuatan Spawnprim
masing-7 masing campuran/perlakuan kemudian dimasukkan ke dalam botol dan disimpan di dalam lemari pendingin.
Tabel 3. Komposisi larutan stok masing-masing spawnprim
Spawnprim Stok AI (ml) Stok AD (ml) Stok LHRHa
Induk matang gonad yang digunakan berumur sekitar 5 bulan dan dipilih sebanyak 30 ekor. Induk betina matang gonad memiliki perut yang membesar dan lembek, dengan lubang genital berwarna kemerahan dan menonjol. Sedangkan induk jantan memiliki tubuh yang lebih ramping dan lubang genital yang tidak terlalu menonjol. Selanjutnya induk dipisahkan ke dalam masing-masing akuarium perlakuan dan diberok selama kurang lebih 24 jam.
2.6 Perlakuan
Penelitian terdiri dari 4 perlakuan spawnprim dan 2 kontrol (Tabel 4) dengan masing-masing 5 kali ulangan. Dosis suntik yang digunakan yaitu 0,5 ml/kg bobot induk.
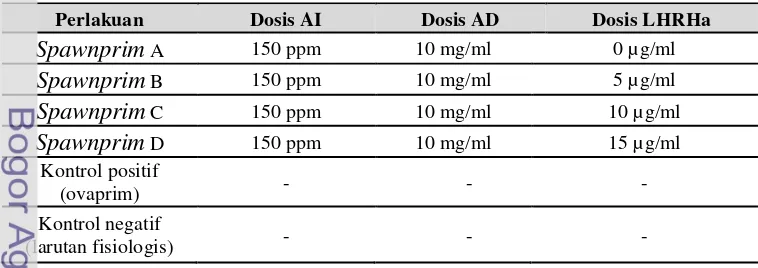
Tabel 4. Dosis masing-masing komponen perlakuan dan kontrol
Perlakuan Dosis AI Dosis AD Dosis LHRHa
Spawnprim A 150 ppm 10 mg/ml 0 µg/ml
8 secara intramuscular menggunakan alat suntik syringe ukuran 1 ml. Induk betina yang telah disuntik selanjutnya dimasukkan ke dalam masing-masing akuarium perlakuan untuk diamati ovulasinya 6 jam kemudian.
2.8 Pemijahan
Pengamatan induk betina dilakukan 6 jam setelah penyuntikan dengan cara mengurut perut ke arah genital. Induk betina yang telah ovulasi ditandai dengan keluarnya telur berwarna kuning kehijauan secara lancar. Induk betina yang belum ovulasi diamati kemudian setiap interval waktu 3 jam.
Induk yang ovulasi kemudian diurut dan telurnya ditampung dalam mangkok untuk dihitung. Untuk pembuahan menggunakan sperma, diambil sejumlah telur kemudian dipisahkan ke dalam mangkok lainnya. Selanjutnya sperma diurut dari induk jantan dan dicampur dengan larutan fisiologis NaCl 0,9%. Sperma dicampurkan ke dalam mangkok berisi telur untuk pembuahan lalu diaduk menggunakan bulu ayam. Telur yang sudah bercampur dengan sperma kemudian ditebar pada akuarium penetasan.
2.9 Pengamatan
Parameter pengamatan meliputi keberhasilan dan lama waktu ovulasi, jumlah telur yang diovulasi (ovulated eggs), tingkat ovulasi (ovulation rate), derajat pembuahan (fertilization rate), derajat penetasan (hatching rate) dan tingkat kelangsungan hidup (survival rate).
2.9.1 Keberhasilan dan Lama Waktu Ovulasi
Keberhasilan ovulasi ditandai dengan keluarnya telur dengan lancar ketika dilakukan stripping pada induk betina perlakuan. Stripping dilakukan pada tiap-tiap ulangan mulai jam ke-6 setelah penyuntikan, jika belum ovulasi maka
9 2.9.2 Jumlah Telur yang Diovulasikan
Induk yang telah ovulasi kemudian diambil telurnya dengan cara stripping
hingga tidak mengeluarkan telur lagi. Jumlah total telur yang dikeluarkan ditampung dalam mangkok untuk kemudian dihitung.
2.9.3 Tingkat Ovulasi
Tingkat ovulasi merupakan perbandingan jumlah telur yang diovulasikan dengan jumlah telur di dalam gonad. Sampel induk diambil untuk dilakukan pembedahan gonad. Sebelumnya sampel induk tersebut ditimbang dan dicatat bobot tubuhnya. Telur yang terdapat di dalam gonad lalu dihitung jumlah totalnya. Penghitungan jumlah telur berikutnya dilakukan dengan metode konversi terhadap bobot tubuh induk sampel.
Berikut ini rumus perhitungan tingkat ovulasi: Tingkat Ovulasi =
2.9.4 Derajat Pembuahan (Fertilization Rate)
Telur yang telah dicampur sperma pada akuarium penetasan kemudian diamati warnanya pada jam ke-12 setelah pencampuran dengan sperma. Telur yang berhasil dibuahi tampak bening kekuning-kuningan, sedangkan telur yang tidak dibuahi berwarna putih susu.
Selanjutnya derajat pembuahan dihitung dengan rumus:
Fertilization Rate (FR) =
sampel
2.9.5 Derajat Penetasan (Hatching Rate)
10 Selanjutnya derajat penetasan dihitung dengan rumus:
HR =
2.9.6 Tingkat Kelangsungan Hidup (Survival Rate)
Kandungan kuning telur pada larva umumnya habis pada hari ke-4, sehingga penentuan tingkat kelangsungan hidup larva dilakukan pada tersebut. Larva yang masih hidup dihitung jumlahnya dan dibandingkan dengan jumlah awal larva pada hari pertama.
Tingkat kelangsungan hidup pada hari ke-4 dihitung dengan rumus:
Survival Rate (SR)=
III. HASIL DAN PEMBAHASAN
3.1Hasil
3.1.1 Tingkat Keberhasilan dan Lama Waktu Ovulasi
Penyuntikan menggunakan spawnprim A, B, C dan D, dengan dosis 0,5 ml/kg ternyata mampu merangsang terjadinya ovulasi pada waktu yang sama, yaitu jam ke-6 (Tabel 5). Hasil ini menyamai pencapaian kontrol positif (ovaprim) pada penggunaan dosis yang sama dengan perlakuan, yang juga mampu merangsang terjadinya ovulasi pada jam ke-6. Tingkat keberhasilan ovulasi pada seluruh perlakuan mencapai persentase sebesar 100% dan tidak berbeda nyata dengan ovaprim. Sedangkan pada perlakuan menggunakan larutan fisiologis sebagai kontrol negatif dengan dosis yang sama, ternyata tidak didapati adanya ovulasi pada semua ulangan (Tabel 5).
Tabel 5. Tingkat keberhasilan dan lama waktu ovulasi
Perlakuan
Keterangan: ns = non signifikan
3.1.2 Tingkat Ovulasi
Dari sejumlah telur yang diovulasikan oleh induk kemudian dibandingkan dengan jumlah total telur di dalam gonad. Hasil penghitungan telur dalam gonad masing-masing perlakuan selengkapnya dapat dilihat pada Lampiran 3.
12 nilai perlakuan terbesar yaitu pada spawnprim C sebesar 13,88 ± 2,75,sedangkan nilai terkecil dihasilkan oleh spawnprim A sebesar 5,98 ± 2,83 (Gambar 1). Pada larutan fisiologis tidak didapatkan nilai karena induk tidak berhasil ovulasi.
3.1.3 Derajat Pembuahan
Telur yang telah diovulasikan kemudian dicampur sperma dari induk jantan sehingga terjadi pembuahan buatan. Jumlah telur yang dibuahi dibandingkan dengan jumlah telur yang diovulasikan sehingga menghasilkan derajat pembuahan. Nilai tertinggi dihasilkan oleh kontrol ovaprim yaitu 60,5 ± 21,29, tidak berbeda nyata dengan nilai tertinggi perlakuan yaitu pada spawnprim
D sebesar 59,07 ± 24,77 dan terendah pada spawnprim A sebesar 43,22 ± 11,94. (Gambar 2).
Gambar 1. Tingkat ovulasi ikan komet pada perlakuan berbeda. Sp. A: Spawnprim A; Sp. B: Spawnprim B; Sp.C: Spawnprim C; Sp. D: Spawnprim D; ov.: Ovaprim; larfis: Larutan Fisiologis NaCl 0,75%.
13 3.1.4 Derajat Penetasan
Jumlah telur yang menetas dibandingkan dengan jumlah telur dibuahi menghasilkan nilai derajat penetasan. Nilai tertinggi didapat oleh spawnprim A yaitu sebesar 52.62 ± 13,66, tidak berbeda nyata dengan kontrol ovaprim sebesar 38.25 ± 36,59, sedangkan nilai terendah pada spawnprim C sebesar 27.14 ± 9,03 (Gambar 3).
3.1.5 Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup setelah larva berumur 4 hari, nilai tertinggi dimiliki oleh spawnprim D sebesar 85,57 ± 2,91, tidak berbeda nyata dengan kontrol ovaprim sebesar 70,75 ± 21,38, sedangkan nilai terendah pada spawnprim
A sebesar 65,95 ± 26,44 (Gambar 4).
Perlakuan
Gambar 3. Derajat penetasan ikan komet pada perlakuan berbeda. Sp. A: Spawnprim A; Sp. B: Spawnprim B; Sp.C: Spawnprim C; Sp. D: Spawnprim D; ov.: Ovaprim; larfis: Larutan Fisiologis NaCl 0,75%.
14 3.2 Pembahasan
Pada Tabel 1 terlihat bahwa seluruh perlakuan spawnprim mampu memicu terjadinya ovulasi seperti halnya pada kontrol ovaprim. Hasil ini memperkuat penelitian Permana (2009) yang menunjukkan bahwa penggunaan spawnprim
dengan dosis perlakuan LHRHa bervariasi antara lain 5, 10, 15 dan 20 mg/l dengan kadar AI 100 mg/l telah mampu merangsang ovulasi ikan sumatera pada jam ke-11 hingga 15. Begitu pula dengan hasil percobaan mengenai spawnprim
yang dilakukan oleh Hidayat (2010), memperlihatkan bahwa dosis AI sebesar 100 mg/l serta komposisi LHRHa masing-masing perlakuan 0, 5, 10 dan 15 mg/l, telah mampu menginduksi ovulasi induk komet pada jam ke-6 dengan presentase keberhasilan sebesar 100%. Sementara itu, hasil serupa tidak ditemukan pada kontrol menggunakan larutan fisiologis, dimana dalam rentang waktu yang sama tidak terjadi ovulasi sama sekali. Artinya, pada penyuntikan menggunakan larutan fisiologis, proses pematangan akhir tetap berlangsung secara alamiah tanpa adanya akselerasi. Menurut Permana (2009), ketiadaan pengaruh tersebut disebabkan sifat larutan fisiologis yang isotonik terhadap cairan tubuh sehingga tidak berpengaruh pada sistem hormon dalam tubuh ikan. Sedangkan keberhasilan perlakuan spawnprim A, B, C dan D dalam merangsang ovulasi menunjukkan peran aktif komponen-komponen penyusunnya yaitu LHRHa, AI dan AD.
LHRHa secara tidak langsung menginduksi pematangan akhir melalui stimulus sekresi Luteinizing Hormone (LH). Proses tersebut dijelaskan oleh Matty (1985), dimana LHRHa yang diinjeksikan pada teleostei menimbulkan peningkatan sekresi plasma Gonadotropine Hormone (GTH) yang terdiri dari LH dan FSH (Follicle Stimulating Hormone). Sebagaimana dijelaskan dalam Basuki (2007), peningkatan LH selanjutnya berakibat pada peningkatan aktivitas 20β -HSD sehingga terjadi peningkatan produksi steroid 17α, 20β -dihydroxy-4-pregnene-3-one (17α,20β-diOHprog) dalam gonad. Sekresi steroid ini terjadi pada saat induk memasuki fase pematangan akhir (Broach, 2009). Setelah itu oosit memasuki tahap GVBD dan berakhir pada ovulasi. Nagahama (1987)
Perlakuan
15 mengilustrasikan pembentukan steroid 17α,20β-diOHprog seperti ditunjukkan pada Gambar 5.
Hubungan antara konsentrasi LH dan tingkat ovulasi yang dicapai dapat dilihat pada Gambar 2. Tingkat ovulasi perlakuan ternyata meningkat seiring dengan peningkatan konsentrasi LHRHa dalam spawnprim, mencapai puncaknya pada spawnprim C dan menurun pada spawnprim D. Spawnprim D dengan konsentrasi LHRHa tertinggi yaitu 15 mg/l hanya mampu mencapai tingkat ovulasi sebesar 7,55 ± 0,81 mg/l, sedangkan pada spawnprim B dan C masing-masing sebesar 9,09 ± 5,30 mg/l dan 13,88 ± 2,75 mg/l. Sementara itu, pada
spawnprim A dengan tingkat ovulasi sebesar 5,98 ± 2,83 ternyata belum cukup menyamai tingkat ovulasi ovaprim sebesar 29,44 ± 6,80 mg/l, dan spawnprim C dimana kadar LHRHa sebesar 10 mg/l. Namun spawnprim A mampu menyamai kinerja spawnprim B (kadar LHRHa 5 mg/l dan tingkat ovulasi 9,09 ± 5,30 mg/l) bahkan dengan spawnprim D yang memiliki kadar LHRHa tertinggi 15 mg/l (tingkat ovulasi sebesar 7,55 ± 0,81 mg/l).
Cholesterol
16 Kombinasi AI dan AD pada spawnprim A memperlihatkan bahwa pengaruh LHRHa cukup signifikan terhadap tingkat ovulasi yang dicapai. Pada
spawnprim B, kandungan LHRHa relatif sedikit sehingga pengaruh terhadap ovulasi tidak berbeda nyata dengan perlakuan tanpa LHRHa sama sekali. Perbedaan mulai terlihat pada spawnprim C dimana level LHRHa yang ditambahkan lebih tinggi sehingga dapat memberi hasil yang lebih baik. Penurunan tingkat ovulasi dijumpai pada spawnprim D dimana konsentrasi LHRHa dalam spawnprim lebih tinggi lagi dibandingkan pada spawnprim A, B dan C. Dalam hal ini muncul dugaan, bahwa pada kandungan AI yang relatif tinggi sebesar 150 mg/l, konsentrasi LHRHa pada spawnprim D telah melebihi batas optimum untuk menginduksi ovulasi. Kejadian ini mungkin dapat dijelaskan melalui pernyataan Jones (1987), yang menyebutkan bahwa lonjakan jumlah LH – yang distimulasi oleh pengaruh LHRH, dapat menyebabkan peradangan pada dinding folikel sehingga mempengaruhi kontraksi folikel dalam membantu proses ovulasi. Pengaruh ini diduga bertambah kuat dengan adanya aktivitas AI dalam jumlah yang tinggi (150 mg/l). Hal ini tidak terjadi pada ovaprim, yang memiliki dosis sGnRH yang tinggi –pada kisaran di bawah 1000 mg/l (Syndel Laboratories Ltd., 2008), namun tidak ada kandungan AI di dalamnya. Sedangkan sGnRH sendiri memiliki fungsi yang analog dengan LHRHa pada spawnprim. Sehingga dapat disimpulkan bahwa pada kadar penambahan AI sebesar 150 mg/l, komposisi LHRHa optimum adalah 10 mg/l. Dengan demikian, penambahan AI tersebut mampu menurunkan kebutuhan sGnRH pada ovaprim hingga mencapai 100 kali penyusutan.
Sedangkan AI bekerja menghambat pengaruh enzim aromatase yang mampu mengubah testosteron menjadi estradiol-17β. Testosteron dibutuhkan dalam proses pematangan oosit menuju fase Germinal Vesicle Breakdown
17 terdapat dalam cairan ovarium dan merupakan derivat dari 17α -hidroxyprogesterone (Fujaya, 2004). Lebih lanjut Nagahama (1987) menambahkan bahwa kadar testosteron meninggi sedangkan estradiol menurun secara signifikan pada saat periode maturasi. Penurunan estradiol tersebut diduga karena menurunnya aktivitas aromatase dalam sel granulosa. Penambahan AI sebagai inhibitor enzim aromatase dapat membantu meningkatkan jumlah testosteron dalam gonad sehingga terjadi percepatan GVBD pada oosit.
Pada parameter tingkat ovulasi, perlakuan dengan hasil terbaik terdapat pada spawnprim C dengan prosentase sebesar 13,88 ± 2,75. Spawnprim C mengandung komposisi LHRHa 10 mg/l, domperidone 10 mg/ml, serta AI sebesar 150 mg/l. Hasil yang didapat berbeda nyata dengan prosentase yang dicapai kontrol ovaprim yaitu sebesar 29,44 ± 6,80. Pada penelitian percepatan ovulasi ikan komet yang dilakukan oleh Hidayat (2010), didapat spawnprim dengan tingkat ovulasi terbaik sebesar 23,39% memiliki kandungan LHRHa 10 mg/l,
18 2010). Sedangkan kondisi media perlakuan sendiri cenderung stabil pada temperatur 25 C sehingga tidak ada rangsangan bagi ikan untuk memijah. Dengan demikian harus segera dilakukan artifisial striping pada ikan sesaat setelah terjadi ovulasi (Lampiran 14).
Sumantri (2006) menghubungkan tingginya dosis AI sebesar 250 mg/kg dengan aktivitas aromatase pada otak yang menimbulkan efek negatif terhadap kontrol hormon reproduksi. Atterwill dan Flack (1992) menyebutkan adanya suatu steroid gonad yang menghambat kinerja LH maupun FSH. Konsentrasi AI yang terlalu tinggi diduga berpengaruh pada aktivitas steroid tersebut serta menyebabkan terhambatnya oogenesis, perkembangan ovari dan atresia (Sumantri, 2006). Kondisi ini dapat dibandingkan dengan perlakuan menggunakan ovaprim dimana tingkat ovulasinya mencapai 29,44 ± 6,80 mg/l. Dalam ovaprim tidak terdapat kandungan AI sehingga kecil kemungkinan terjadi efek atresia. Selain itu pada penelitian yang dilakukan Permana (2009), kadar AI yang lebih rendah yaitu sebesar 100 mg/l dan dikombinasikan dengan AD, serta LHRH 5, 10, 15 dan 20 mg/l mampu memicu ovulasi induk ikan sumatera dengan tingkat ovulasi lebih baik yaitu mencapai 30% hingga 79%.
19 Gambar 6. Mekanisme dopamin dalam menghambat GnRH, dan anti dopamin (domperidone) meniadakan fungsi dopamin (Yanong et al., 2009)
20 Fertilitas telur akan menurun ketika mulai memasuki media air hingga akhirnya hilang sama sekali dimana akselerasinya berbeda-beda pada tiap ikan dan bergantung pada kondisi media itu sendiri. Sementara bila tidak segera dibuahi oleh sperma, telur dapat membusuk dan mati. Menurut Suzuki dalam
Ginzburg (1972), pada temperatur 18-21ºC, pergerakan sperma hanya mampu bertahan sekitar 3 menit. Selama itu pula sebuah sperma harus dapat melakukan penetrasi ke lubang mikrofil untuk dapat membuahi sel telur. Pembuahan yang melibatkan sebuah sel sperma membuahi sebuah sel telur dinamakan fertilisasi monospermi. Ginzburg (1972) menjelaskan, ciri ikan yang memiliki tipe fertilisasi monospermi yaitu pembuahannya dilakukan secara eksternal (di luar tubuh ikan). Sedangkan pembuahan internal (di dalam tubuh ikan) memungkinkan fertilisasi dilakukan secara monospermi atau polispermi (beberapa sperma membuahi satu sel telur). Ikan komet melakukan pembuahan di luar tubuh ikan sehingga tipe fertilisasinya tergolong monospermi.
Hasil fertilisasi spawnprim rata-rata berada di bawah 50% kecuali pada
spawnprim D mencapai 59,07%, tidak berbeda nyata dengan kontrol ovaprim yang mencapai fertilitas 60,5%. Hasil ini menunjukkan sekitar setengah dari total telur tidak terbuahi maupun rusak. Telur dapat tidak terbuahi apabila memiliki viabilitas yang rendah. Sedangkan telur yang rusak dapat terjadi apabila sperma terlalu pekat sehingga terjadi kompetisi yang ketat antar sel sperma untuk memasuki lubang mikrofil pada lapisan kortikuler telur. Adanya kompetisi tersebut pada akhirnya menimbulkan over-penetrasi sperma sehingga merusak proses morfogenesis dan menimbulkan kematian pada telur.
21 sebagai sumber energi. Sementara AI dapat mengurangi kandungan vitelogenin dengan cara mengalihkan proses vitelogenesis menuju proses pematangan akhir. Perkembangan embrio yang terhambat pada akhirnya dapat menurunkan derajat penetasan telur. Namun di samping itu, faktor lingkungan turut berperan dalam penetasan telur. Pengaruh ini tampak pada kecepatan penetasan telur seperti halnya pada goldfish yang telah memijah, telur menetas dalam 4-5 hari pada temperatur inkubasi berkisar pada 20oC.
Tabel 6 menjelaskan hubungan temperatur lingkungan terhadap kecepatan menetas telur pada ikan koki (Abe, 1983):
Tabel 6. Periode inkubasi berdasarkan temperatur
Temperatur
Parameter tingkat kelangsungan hidup berkaitan dengan daya tahan larva terhadap kondisi lingkungan di mana asupan energi larva diperoleh dari kuning telurnya. Proses pembentukan kuning telur (vitellogenesis) dipengaruhi oleh kinerja kandungan bahan dalam spawnprim. Persentase hasil yang tinggi dan tidak berbeda nyata pada seluruh perlakuan menunjukkan pengaruh positif dari komponen bahan-bahan yang terkandung di dalamnya. Walaupun pada perlakuan menggunakan AI terjadi pengalihan proses vitellogenesis menuju ke arah pematangan gonad sehingga kuning telur yang dihasilkan tidak mencapai ukuran maksimal (Sumantri, 2006), namun larva masih mampu bertahan hingga hari ke-4 setelah penetasan. Daya tahan larva tersebut turut didukung oleh kondisi lingkungan yang sesuai bagi pertumbuhan larva. Menurut Abe (1983) ikan komet merupakan spesies eurythermal dimana mampu hidup dalam temperatur yang berfluktuasi antara 0-35ºC. Temperatur pada akuarium pemeliharaan larva di tiap perlakuan masih berada pada rentang tersebut yaitu rata-rata berkisar pada 33ºC.
22 oksigen terlarut atau dissolve oxygen (DO) bagi cyprinid berkisar antara 6-7 mg/l, dapat turun hingga mencapai 3 mg/liter. Sedangkan pH ideal adalah netral atau cenderung basa, yaitu antara 7-8 (Huet & Timmermans 1970). Pada perlakuan didapat DO rata-rata sebesar 7,08 mg/l dan pH rata-rata 6,82. Pada kondisi media seperti ini, induk masih dapat berovulasi karena diketahui bahwa ikan komet memiliki ketahanan terhadap faktor lingkungan yang cukup baik dibandingkan dengan jenis ikan hias lainnya (Martawiguna, 2007)..
Pemilihan spawnprim untuk kegiatan produksi benih dapat dilakukan dengan membandingkan biaya per telur (Tabel 7). Asumsi yang digunakan adalah jumlah telur di dalam gonad masing-masing induk sebanyak 5000 butir. Biaya per telur adalah besarnya biaya yang dibutuhkan untuk menghasilkan satu telur dengan asumsi penyuntikan dilakukan terhadap seekor induk dengan volume penyuntikan 0,01 ml, sedangkan volume total adalah 10 ml/produk.
Biaya terendah terdapat pada spawnprim A yaitu Rp. 0,02/telur, disusul oleh spawnprim B dengan biaya Rp. 0,12/telur. Biaya per telur kedua produk ini masih di bawah biaya ovaprim yang mencapai Rp. 0,13/telur. Sedangkan
spawnprim C dan D mencapai biaya di atas ovaprim yaitu Rp. 0,15/telur dan Rp. 0,41/telur. Bila dibandingkan, spawnprim A lebih ekonomis dibanding produk lain. Namun bila mempertimbangkan tingkat ovulasi (produksi telur), maka
spawnprim A memiliki nilai paling rendah (tidak cukup efektif). Berbeda dengan
spawnprim C yang memiliki tingkat ovulasi tertinggi di antara perlakuan
spawnprim serta kisaran biayanya tidak terlalu jauh dengan ovaprim.. Pada
spawnprim B biaya per telur lebih rendah dibandingkan spawnprim C, hanya saja memiliki nilai simpangan baku yang lebih besar (Lampiran 4) sehingga tidak memberikan akurasi tingkat ovulasi yang lebih baik. Sementara spawnprim D memiliki biaya per telur yang terlalu tinggi dan tingkat ovulasinya relatif rendah. Tabel 7. Biaya per telur
IV. KESIMPULAN DAN SARAN
4.1 Kesimpulan
Penggunaan spawnprim telah mampu mempercepat ovulasi ikan komet. Dengan tingkat keberhasilan memijah yang sama namun harga produk lebih rendah dibanding ovaprim serta tingkat ovulasi paling baik di antara perlakuan uji lainnya, spawnprim C adalah jenis yang paling efektif dan menguntungkan.
4.2 Saran
Produk spawnprim pada penelitian ini dapat diujikan kembali pada jenis ikan yang berbeda, sehingga penggunaannya bisa lebih luas untuk ikan hias lain maupun ikan konsumsi. Sedangkan untuk aplikasi pada kegiatan pembenihan khususnya pada ikan komet, dapat digunakan produk spawnprim dengan formulasi perlakuan C.
Sementara itu, dapat juga dilakukan penelitian menggunakan spawnprim
DAFTAR PUSTAKA
Abdullah, N., 2007. Efektivitas pemberian ovaprim secara topikal pada proses ovulasi dan pemijahan induk ikan mas koki (Carassius auratus). [Tesis]. Sekolah Pascasarjana. Institut Pertanian Bogor. Bogor.
Abe, Y., 1983. Goldfish (Carassius auratus) culture, in: Kafuku, T., Ikenoue, H. (Eds.), Modern methods of aquaculture in Japan. Kodanisha Ltd. Tokyo and Elsevier Scientific Publishing Company Amsterdam, pp. 79-90.
Atterwill, C.K., Flack, J.D., 1992. Endocrine toxicology. Cambridge University Press, New York.
Basuki, F., 2007. Optimalisasi pematangan oosit dan ovulasi pada ikan mas koki (Carassius auratus) melalui penggunaan inhibitor aromatase. [Disertasi]. Sekolah Pascasarjana. Institut Pertanian Bogor. Bogor.
Broach, J., 2009. Effects of steroid and prostaglandin injections on hybridization success between female channel catfish and male blue catfish. [Thesis]. The Graduate Faculty of Auburn University, Auburn, Alabama.
Fujaya, Y., 2004. Fisiologi ikan: Dasar pengembangan teknik perikanan. Penerbit Rineka Jaya, Jakarta.
Ginzburg, A.S., 1972. Fertilization in fishes and the problem of polyspermy. Keter Press, Jerusalem.
Hakim, F.N., 2010. Efektivitas kombinasi aromatase inhibitor dan ovaprim dalam merangsang pemijahan ikan sumatra Puntius tetrazona. [Skripsi]. Program Studi Teknologi dan Manajemen Akuakultur, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor. Harvey, B., Caroslfeld, J., 1993. Induce breeding in tropical fish culture.
International Development Research Centre, Ottawa, Ontario, Canada.
Hidayat, R., 2010. Efektivitas spawnprim pada proses ovulasi dan pemijahan ikan komet Carassius auratus auratus. [Skripsi]. Program Studi Teknologi dan Manajemen Akuakultur, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor.
Huet, M., Timmermans J.A., 1970. Textbook of fish culture. Breeding and cultivation of fish. Editions Ch. De Wyngaert, Brussels.
25 Martawiguna, T. 2007. Kinerja sistem resirkulasi air terkendali (SRAT) pada pemijahan ikan hias air tawar. [Skripsi]. Departemen Teknik Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Bogor.
Matty, A.J., 1985. Fish endocrinology. Timber Press Portland, Oregon.
Nagahama, Y., 1987. Endocrine control of oocyte maturation, in: Jones, R.E., Norris, D.O. (Eds.), Hormones and Reproduction In Fishes, Amphibians, and Reptiles. Plenum Press, New York, pp. 171-202.
Nandeesha, M.C., Rao, K.G., Jayanna, R.N., Parker, N.C., Varghese, T.J., Keshavanath, P., Shetty, H.P.C., 1990. Induced spawning of indian major carps through single application of ovaprim-c, in: Hirano, R., I. Hanyu (Eds.), The Second Asian Fisheries. Forum. 991 p. Asian Fisheries Society, Manila, Philippines.
Ortega-Salas, A.A., Reyes-Bustamante, H., 2006. Initial sexual maturity and fecundity of the goldfish Carassius auratus (Perciformes: Cyprynidae) under semi-controlled conditions. Rev. Biol. Trop.
Permana, D., 2009. Efektivitas pencampuran LHRHa, anti dopamin, dan aromatase inhibitor dalam memacu terjadinya ovulasi pada ikan sumatera
Puntius tetrazona. [Skripsi]. Program Studi Teknologi dan Manajemen Akuakultur, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor.
Rosalina, 2011. Ekspor Ikan Indonesia Ke Jepang Akan Terhambat. Available at http://www.tempointeraktif.com [3 Mei 2011].
Saleh, R., 2009. Efektivitas kombinasi aromatase inhibitor, anti-dopamin, dan ovaprim dalam mempercepat pematangan akhir dan ovulasi ikan sumatra
Puntius tetrazona. [Skripsi]. Program Studi Teknologi dan Manajemen Akuakultur, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor.
Soen’an, H.P., 2010. Mendulang devisa dari ikan hias. Available at
26 Sumantri, D., 2006. Efektivitas ovaprim dan aromatase inhibitor dalam mempercepat pemijahan pada ikan lele dumbo Clarias sp. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor.
Syndel Laboratories Ltd., 2008. OvaprimTM. www.syndel.com/Default.aspx [12 Oktober 2010].
Wikipedia. 2010. Goldfish. http://en.wikipedia.org/wiki/Goldfish [29 September 2010].
28 Lampiran 1. Data kualitas air berbagai wadah
Lampiran 2. Data tingkat keberhasilan dan lama waktu ovulasi
Perlakuan N Bobot
29 Lampiran 3. Jumlah total telur dalam gonad pada induk perlakuan (butir)
Perlakuan 1 2 3 Rata-rata
Lampiran 4. Tingkat ovulasi ikan perlakuan (%)
Perlakuan 1 2 3 Rata-rata
Lampiran 5. Derajat pembuahan (FR) ikan perlakuan (%)
Perlakuan Ulangan Jumlah
30 Lampiran 6. Derajat penetasan (HR) ikan perlakuan (%)
Perlakuan Ulangan Jumlah telur
dibuahi
Lampiran 7. Tingkat kelangsungan hidup (SR) ikan perlakuan (%)
Perlakuan Ulangan Jumlah telur
31 Lampiran 8. Contoh perhitungan Uji Anova dan Uji Beda Nyata Duncan pada parameter derajat pembuahan (FR)
Model Fixed Effects 15.67305 3.69417 34.6239 50.7217
Random Effects 9.04412 19.4241 65.9214 408.89494
Test of Homogeneity of Variances
FR
Within Groups 2947.735 12 245.645
32 Lampiran 9. Contoh perhitungan Uji Anova dan Uji Beda Nyata Duncan pada parameter derajat penetasan (HR)
Model Fixed Effects 20.49588 4.83092 22.6827 43.7340
Random Effects 7.57045 13.7479 52.6688 203.84285
FR
Means for groups in homogeneous subsets are
33
Test of Homogeneity of Variances
HR
Levene Statistic df1 df2 Sig.
5.785 5 12 .006
ANOVA
HR
Sum of Squares Df Mean Square F Sig.
Between Groups 5158.048 5 1031.610 2.456 .094
Within Groups 5040.973 12 420.081
Total 10199.020 17
HR
Duncan
Perlaku
an N
Subset for alpha = 0.05
1 2
LF 3 .0000
C 3 27.1433 27.1433
D 3 34.8033 34.8033
OV 3 38.2467 38.2467
B 3 46.4333
A 3 52.6233
34 Lampiran 10. Contoh perhitungan Uji Anova dan Uji Beda Nyata Duncan pada parameter tingkat kelangsungan hidup (SR)
Descriptives
Model Fixed Effects 14.44762 3.40534 56.4532 71.2924
Random Effects 13.10737 30.1792 97.5664 961.24175
Test of Homogeneity of Variances
SR
Within Groups 2504.803 12 208.734
35 Lampiran 11. Perhitungan harga spawnprim
36
(1) (2) (3) (4) (5) (6)
D
LHRH 1 mg 0,15 150000
154681,67
10 ml 1
AD 400 mg 93,33 4666,67
30 ml 7
AI 200 mg 1,5 15
100 ml 0,75
Ovaprim - - - - 185.000,00
Lampiran 12. Daftar harga bahan dasar spawnprim
Bahan Harga (Rp. .../mg) LHRH-a 1.000.000,00
AI 10,00
AD 50,00
38 Lampiran 15. Foto aktivitas
Pemeliharaan induk Seleksi induk matang gonad
Pengukuran bobot
Pencampuran telur dan sperma
Inkubasi dan penetasan telur Striping
Penebaran telur