POTENSI MIKROB ENDOFIT DAN APLIKASINYA DENGAN
KOMPOS TANDAN KOSONG KELAPA SAWIT UNTUK
PENGENDALIAN PENYAKIT KUNING PADA LADA
ROPALIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Potensi Mikrob Endofit dan Aplikasinya dengan Kompos Tandan Kosong Kelapa Sawit untuk Pengendalian Penyakit Kuning pada Lada adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Ropalia
RINGKASAN
ROPALIA. Potensi Mikrob Endofit dan Aplikasinya dengan Kompos Tandan Kosong Kelapa Sawit untuk Pengendalian Penyakit Kuning pada Lada. Dibimbing oleh BONNY POERNOMO WAHYU SOEKARNO dan ABDUL MUNIF.
Penyakit kuning merupakan penyakit utama pada tanaman lada di Bangka. Kerugian pada pertanaman lada akibat penyakit ini dapat mencapai 41%. Penyakit ini relatif sulit dikendalikan karena patogen memiliki inang yang luas dan mampu bertahan di dalam tanah. Pengendalian dengan penggunaan pestisida sintetik, penggunaan kapur ke tanah, pembongkaran dan pembakaran tanaman terinfeksi sejauh ini kurang efektif. Mikrob endofit dilaporkan mampu menekan infeksi patogen. Pengendalian hayati dengan mikrob endofit dapat menjadi alternatif pengendalian penyakit kuning pada lada. Aplikasi mikrob endofit dapat disinergikan dengan bahan organik. Tandan kosong kelapa sawit (TKKS) merupakan bahan organik yang banyak tersedia dan telah diteliti mampu memperbaiki tanah. Penelitian ini bertujuan mendapatkan bakteri dan cendawan endofit yang berpotensi sebagai agens hayati dan mengetahui pengaruh aplikasinya dengan kompos TKKS terhadap penyakit kuning pada tanaman lada di lapangan.
Penelitian ini meliputi isolasi bakteri dan cendawan endofit dari akar tanaman lada varietas Merapin dan Lampung Daun Lebar yang sehat, seleksi patogenisitas, uji potensi bakteri dan cendawan endofit sebagai agens hayati terhadap Fusarium oxysporum Schlecht dan Meloidogyne sp. secara in vitro, uji bakteri dan cendawan endofit dengan kompos TKKS secara in vivo di lapangan, dan identifikasi bateri dan cendawan endofit terpilih.
Hasil isolasi mikrob endofit diperoleh 204 isolat yang terdiri atas 98 isolat cendawan endofit dan 106 bakteri endofit. Seleksi patogenisitas cendawan endofit pada kecambah benih padi diperoleh 61 isolat bersifat nonpatogen. Seleksi bakteri endofit pada reaksi hipersensitif diperoleh sebanyak 103 isolat bersifat nonpatogen. Berdasarkan uji antagonis terhadap F. oxysporum diperoleh 13 isolat cendawan endofit dan 12 isolat bakteri endofit yang menunjukkan aktivitas antagonisme. Ada empat isolat yang menunjukkan aktivitas antagonis yang tinggi yaitu isolat CMS8, CMI16, BMS21 dan BMI11. Hasil uji kultur filtrat mikrob endofit menunjukkan bahwa kultur filtrat isolat CMS8 dan BLI11 mampu membunuh juvenil Meloidogyne spp. sebesar 67.0% dan 55.6% berturut-turut secara in vitro pada 24 jam setelah perlakuan. Aplikasi kompos TKKS diperkaya bakteri dan cendawan endofit mampu meningkatkan populasi nematoda nonparasit, meningkatkan kelimpahan bakteri tanah, aktivitas enzim peroksidase, bahan organik, nitrogen total, dan kalium dapat ditukar. Aplikasi kompos TKKS diperkaya bakteri endofit BMS21 menunjukkan insidensi penyakit paling rendah yaitu 22% dibanding perlakuan lainnya dan kontrol. Identifikasi bakteri endofit isolat BSM21 merupakan Acinetobacter sp. dan isolat BMI11 merupakan
Microbacterium sp. Identifikasi cendawan endofit isolat CMS8 merupakan
Gliocladium sp. dan isolat CMI16 merupakan Sordaria sp.
sel, dan menghambat sintesis ATP pada mitokondria sel patogen. Enzim dapat merusak atau mendegradasi dinding sel patogen. Aplikasi kompos TKKS diperkaya mikrob endofit dapat meningkatkan aktivitas mikroba tanah yang dapat menekan patogen tanaman. Kompos diperkaya mikrob endofit juga dapat memperbaiki struktur tanah dan kimia tanah seperti ketersediaan hara yang dapat diserap oleh tanaman sehingga dapat meningkatan pertumbuhan tanaman dan ketahanan tanaman terhadap infeksi patogen.
SUMMARY
ROPALIA. Potency of Endophytic Microbes and Their Application with Palm Oil Empty Bunches Compost for Controling Yellowing Disease on Pepper. Supervised by BONNY POERNOMO WAHYU SOEKARNO and ABDUL eradication of infected plant are not effective to control the pathogen. Endophytic microbes was reported that able to suppress infection of plant pathogen. Biocontrol strategy with endophytic microbe can be an alternative controlling to yellowing disease on pepper. Application of endophytic microbes can be synergized with organic matter. Palm oil empty bunches was reported that are able to improve soil properties, are abundance of organic matter in Bangka. The objective of this study was to explore potential bacterial and fungal endophytes from roots pepper as a biocontrol agent and to investigate the influence of their application with palm oil empty bunches compost to suppress yellowing disease on pepper in the field experiment.
This study consist of isolation of endophytic bacteria and fungi from healty root of Merapin and Lampung Daun Lebar (LDL) varieties, pathogenicity test, antibiosis activity of endophytic bacteria and fungi against F. oxysporum dan
Meloidogyne sp. in vitro, application of endophytic bacteria and fungi with palm oil empty bunches compost on pepper in vivo, and identification of the potential endophytic bacteria and fungi.
Isolation of microbial endophytes resulted 204 isolates, 98 endophytic fungi and 106 endophytic bacteria. Endophytic fungi isolates were selected the pathogenicity using rice seedling and were obtained 61 nonpathogenic isolates. Endophytic bacteria isolates were selected using hypersensitive reaction and were obtained 103 nonpathogen isolates. There are 13 isolates of endophytic fungi isolates and 12 isolates of endophytic bacteria showed antagonistic activity against F. oxysporum. Two isolates of endophytic fungi CMS8 and CMI16 and two isolates of endophytic bacteria BMS21 and BMI11 showed hight antagonism able to kill juvenile of Meloidogyne spp. up to 67.0% compared with other under
in vitro condition. Application of palm oil empty bunches enrichment with endophytic bacteria BMS21, BMI11 and endophytic fungi CMS8, CMI16 were able to increase population of free living nematode, soil bacteria, peroxidase enzyme activity, organic matter, total nitrogen, and photassium. Application of palm oil empty bunches compost enrichment with endophytic bacteria BMS21 showed the lowest disease incidence of yellowing by 22% compared with other treatment and control. Identification of bacterial endophytes isolates BSM21 is
Acinetobacter sp. and BMI11 is Microbacterium sp. Identification of fungal endophyte isolate CMS8 is Gliocladium sp. and CMI16 is Sordaria sp.
of plant pathogen cell. Enzyme have a role in degradation of the plant pathogen cell wall. Application of palm oil empty bunches compost enrichment with endophytic microbes are able to increase soil microbe activity and its related to suppress the plant pathogen and to improve soil structure and soil chemistry properties and its related nutrient supply for promoting plant growth and plant resistance.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
i
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
POTENSI MIKROB ENDOFIT DAN APLIKASINYA DENGAN
KOMPOS TANDAN KOSONG KELAPA SAWIT UNTUK
PENGENDALIAN PENYAKIT KUNING PADA LADA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini ialah pengendalian hayati, dengan judul Potensi Mikrob Endofit dan Aplikasinya dengan Kompos Tandan Kosong Kelapa Sawit untuk Pengendalian Penyakit Kuning pada Lada.
Terima kasih penulis ucapkan kepada Dr Ir Bonny Poernomo Wahyu Soekarno, MS dan Dr Ir Abdul Munif, MScAgr selaku pembimbing, serta Dr Ir Elis Nina Herliyana, MSi sebagai penguji luar komisi yang telah banyak memberikan saran. Penghargaan penulis sampaikan juga kepada Dr Ratih Dewi Astuti, MSc dan Bapak Surono, SP, MSi beserta staf Laboratorium Biologi dan Kesehatan Tanah Balai Besar Penelitian Tanah, Cimanggu, Bapak Syafarudin, SP beserta staf Laboratorium Agroteknologi Universitas Bangka Belitung (UBB), Ibu Hartati, SSi beserta staf Laboratorium Biologi UBB, dan Ibu Yuliza Eka Fitri, ST beserta staf Laboratorium Kimia UBB yang telah membantu selama penelitian serta Bapak Subani yang telah memberi izin percobaan lapangan di kebun lada miliknya. Penulis juga mengucapkan terima kasih kepada Dikti sebagai sponsor pendidikan, PT. Timah Tbk yang telah membantu dana penelitian ini dan PT. Gunung Maras Lestari atas bantuan limbah tandan kosong kelapa sawit. Ungkapan terima kasih juga disampaikan kepada Ibunda Saunit, Adinda Royalaitani, Kakak Ani dan keluarga, serta seluruh keluarga yang telah memberikan dukungan dan segala bantuan, rekan-rekan fitopatologi 2012 serta nematologi atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
v
Patogen Penyebab Penyakit Kuning pada Lada 5
Pengendalian Penyakit Kuning pada Lada 7
Mikrob Endofit 8
Kompos dalam Pengendalian Hayati dan Kompos Tandan Kosong
Kelapa Sawit 9
Uji Fisiologis Bakteri Endofit sebagai Penambat Nitrogen, Pelarut
Fosfat dan Kalium 13
Uji Kultur Filtrat Bakteri dan Cendawan Endofit terhadap Nematoda
secara In Vitro 14
Pembuatan Kompos Tandan Kosong Kelapa Sawit Diperkaya Bakteri
dan Cendawan Endofit 15
Aplikasi Kompos Tandan Kosong Kelapa Sawit Diperkaya Bakteri
dan Cendawan Endofit di Lapangan 16
Identifikasi Cendawan dan Bakteri Endofit 17
Analisis Data 17
HASIL DAN PEMBAHASAN
Isolasi dan Seleksi Patogenisitas Cendawan dan Bakteri Endofit 18 Antagonisme Cendawan Endofit terhadap Fusarium oxysporum 19 Antagonisme Bakteri Endofit terhadap Fusarium oxysporum, Bakteri
Endofit sebagai Penambat Nitrogen, Pelarut Fosfat 21 Pengaruh Kultur Filtrat Bakteri dan Cendawan Endofit terhadap
Meloidogyne sp. 23
Pengaruh Aplikasi TKKS Diperkaya Bakteri dan Cendawan Endofit
terhadap Populasi Nematoda 23
Pengaruh Aplikasi TKKS Diperkaya Bakteri dan Cendawan Endofit
Pengaruh Aplikasi TKKS Diperkaya Bakteri dan Cendawan Endofit
terhadap Kimia Tanah 26
Pengaruh Aplikasi TKKS Diperkaya Bakteri dan Cendawan Endofit
terhadap Aktivitas Enzim Peroksidase dan Insidensi Penyakit 28
Identifikasi Cendawan dan Bakteri Endofit 29
SIMPULAN DAN SARAN
Simpulan 33
Saran 33
DAFTAR PUSTAKA 34
LAMPIRAN 43
vii
DAFTAR TABEL
1 Jumlah isolat cendawan dan bakteri endofit dari akar tanaman lada 18 2 Daya hambat cendawan endofit terhadap Fusarium oxysporum pada
metode dual culture 20
3 Daya hambat bakteri endofit terhadap pertumbuhan koloni Fusarium oxysporum pada metode dual culture, sebagai penambat nitrogen dan
pelarut fosfat 21
4 Pengaruh kultur filtrat bakteri dan cendawan endofit terhadap mortalitas
juvenil Meloidogyne sp. secara in vitro 23
5 Keragaman dan kelimpahan bakteri tanah sebelum aplikasi dan setelah tiga bulan aplikasi kompos TKKS diperkaya bakteri dan cendawan
endofit 25
6 Keragaman dan kelimpahan bakteri tanah sebelum aplikasi dan setelah tiga bulan aplikasi kompos TKKS diperkaya bakteri dan cendawan
endofit 26
7 Pengaruh perlakuan kompos TKKS diperkaya bakteri dan cendawan endofit terhadap pH, C/N, bahan organik, karbon organik, nitrogen total,
fosfat tersedia, dan kalium dapat ditukar 27
8 Karakteristik fisiologis dan biokimia isolat bakteri endofit BSM21 dan
BLI11 31
DAFTAR GAMBAR
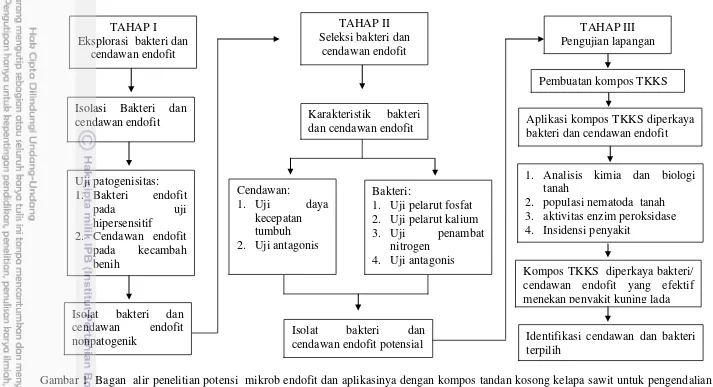
1 Diagram alir penelitian 4
2 Antagonisme cendawan endofit terhadap Fusarium oxysporum
menggunakan metode dual culture. Antagonisme cendawan endofit CMS8; A) permukaan koloni, B) bagian bawah koloni. Antagonisme cendawan endofit CMI16; C) Permukaan koloni, D) bagian bawah koloni. A1 dan B1) koloni cendawan CMS8, C1 dan D1) koloni cendawan endofit CMI16, dan A2-D2) koloni Fusarium oxysporum.
Perubahan warna pada media di sekitar koloni Fusarium oxysporum
(tanda panah) 20
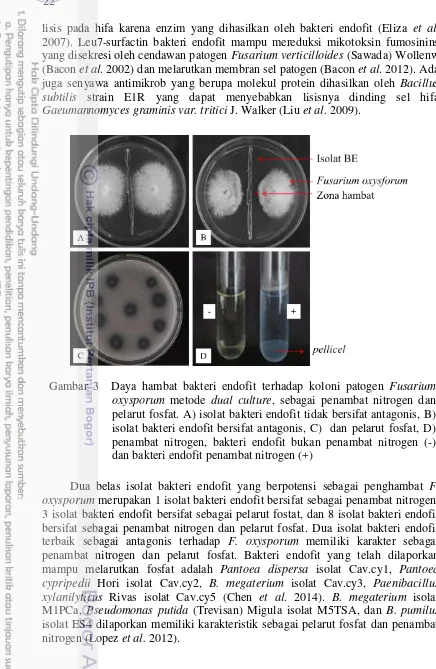
3 Daya hambat bakteri endofit terhadap koloni patogen Fusarium oxysporum metode dual culture, sebagai penambat nitrogen dan pelarut fosfat.A) isolat bakteri endofit tidak bersifat antagonis, B) isolat bakteri endofit bersifat antagonis, C) dan pelarut fosfat, D) penambat nitrogen, bakteri endofit bukan penambat nitrogen (-) dan bakteri endofit
penambat nitrogen (+) 22
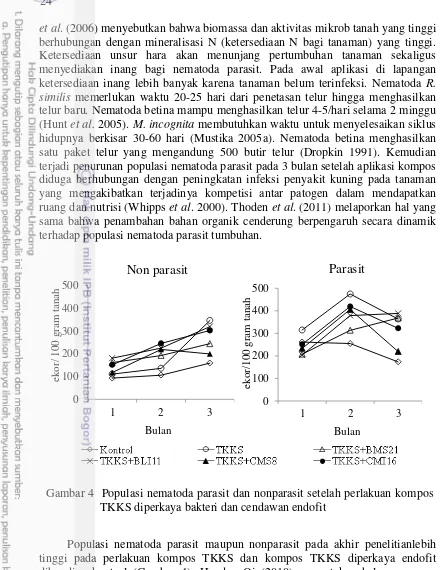
4 Populasi nematoda parasit dan nonparasit setelah perlakuan kompos
TKKS diperkaya bakteri dan cendawan endofit 24
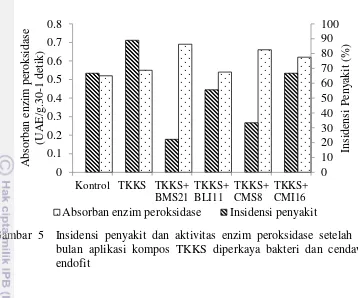
5 Insidensi penyakit dan aktivitas enzim peroksidase setelah tiga bulan aplikasi kompos TKKS diperkaya bakteri dan cendawan endofit 29 6 Morfologi mikroskopis isolat cendawan endofit. A) Mikroskopis
peritesium cendawan endofit isolat CMI11, dan C) askospora cendwan
endofit isolat CMI16 30
DAFTAR LAMPIRAN
1 Karakteristik bakteri endofit sebagai penambat nitrogen, pelarut
fosfat dan kalium 43
2 Analisis kimia tanah sebelum dan setelah perlakuan kompos TKKS
diperkaya bakteri dan cendawan endofit 44
3 Identifikasi isolat bakteri endofit BSM21 berdasarkan karakter
morfologi, fisiologi dan biokimia 45
4 Identifikasi isolat bakteri endofit BMI11 berdasarkan karakter
1
1
PENDAHULUAN
Latar Belakang
Indonesia merupakan pengekspor lada terbesar kedua di dunia setelah Vietnam. Sekitar 80-90% lada putih Indonesia berasal dari Provinsi Kepulauan Bangka Belitung (Ginting 2015). Beberapa tahun terakhir terjadi penurunan ekspor lada di Indonesia dan penurunan produksi lada khususnya di Bangka. Produksi lada pada tahun 2012 mencapai 34 379.41 ton, namun terjadi penurunan pada tahun 2013 menjadi 33 595.97 ton (BPS 2014). Salah satu faktor yang mempengaruhi penurunan produksi lada karena adanya infeksi penyakit kuning pada pertanaman lada. Penyakit kuning lada merupakan penyakit utama dan endemik pada pertanaman lada di Bangka. Penyakit ini adalah penyakit komplek yang disebabkan oleh beberapa patogen yaitu nematoda; Radopholus similis
(Cobb) Thorne, Meloidogyne incognita (Kofoid & White) Chitwood dan cendawan patogen; Fusarium solani (Mart) Sacc dan F. oxysporum serta kekurangan hara(Mustika 2005b). Infeksi nematoda menyebabkan nekrosis pada akar yang memudahkan infeksi oleh Fusarium sp. dan menyebabkan tanaman sensitif terhadap kekeringan dan kekurangan unsur hara. Munif dan Sulistiawati (2014) melaporkan bahwa penyakit ini merusak pertanaman lada di wilayah Bangka mencapai 41% sehingga sangat merugikan petani karena menurunkan hasil panen. Pada laporan yang sama, upaya pengendalian penyakit kuning yang dilakukan oleh petani lada di Bangka adalah menggunakan pestisida sintetik, memberikan kapur ke tanah, mencabut atau membakar tanaman terinfeksi. Cara pengendalian yang dilakukan kurang efektif karena pengunaan pestisida sintetik dapat membunuh mikrob tanah dan mencemari lingkungan. Selain itu, kedua nematoda patogen penyebab penyakit ini memiliki inang lain dan Fusarium sp. merupakan patogen tular tanah yang memiliki struktur bertahan berupa klamidospora.
Pengendalian hayati merupakan pengendalian yang ramah lingkungan dan berkelanjutan. Pengendalian hayati secara konseptual merupakan suatu teknik atau metode penekanan aktivitas patogen dalam menimbulkan penyakit yang melibatkan mikroorganisme baik secara langsung maupun tidak langsung. Salah satu metode pengendalian hayati secara langsung adalah pemanfaatan mikrob endofit dan secara tidak langsung dengan memanipulasi lingkungan di sekitar tanaman agar tidak sesuai dengan perkembangan patogen (Cook dan Baker 1996, Alabouvette et al. 2006).
2
kalium yang tinggi (Purnamayani et al. 2012) yang dapat berperan dalam peningkatan ketahanan tanaman terhadap infeksi oleh patogen. Kompos TKKS juga dilaporkan mengandung C/N yang tinggi; 42.85 dapat berperan sebagai sumber energi mikrob tanah (Panjaitan 2013). Zhang et al. (1998) melaporkan bahwa kompos yang diaplikasikan pada tanaman mentimun dapat meningkatkan induksi ketahanan tanaman terhadap infeksi Colletotrichum arbiculare Berk & Mont dan tanaman Arabidopsis thaliana (L.) Heynh. terhadap infeksi
Pseudomonas syringae pv. maculicola. Pemanfaatan TKKS sebagai bahan pembenah tanah dapat dilakukan dengan cara aplikasi langsung sebagai mulsa atau kompos TKKS (Darnoko dan Sutarta 2006).
Mikrob endofit memiliki potensi dalam menekan infeksi patogen melalui berbagai mekanisme (Hallmann et al. 1997). Cendawan endofit F. oxysporum
menginduksi ketahanan sistemik terhadap penetrasi R. similis pada tanaman pisang (Sikora et al. 2008). Cendawan endofit Arthrobotrys oligospora Fres isolat EAO-147 meningkatkan ketahanan biomolekul dan ketahanan terinduksi tanaman tomat terhadap infeksi M. incognita (Singh et al. 2013). Penggunan bakteri dan cendawan endofit mampu menekan perkembangan populasi nematoda parasit dan kejadian penyakit kuning pada tanaman lada (Harni dan Munif 2012). Cendawan endofit Penicillium citrinum Thom (Ting et al. 2012), Pseudomonas sp.,dan
Burkholderia sp. (Fishal et al. 2010) mampu menekan pertumbuhan patogen F. oxysporum.
Perumusan Masalah
Peyakit kuning pada lada menjadi masalah utama dalam budidaya lada di Bangka. Berbagai strategi pengendalian telah dikembangkan untuk mengendalikan penyakit ini, namun belum sepenuhnya dapat mengatasi masalah penyakit kuning di lapangan. Kompos TKKS dan mikrob endofit memiliki potensi sebagai salah satu strategi pengendalian penyakit tanaman. Pemanfaatan kompos TKKS dan mikrob endofit secara bersamaan sebagai suatu pendekatan strategi pengendalian hayati untuk penekanan penyakit kuning pada tanaman lada di wilayah Bangka belum pernah dilakukan.
Tujuan Penelitian
3 Hipotesis
Eksplorasi bakteri dan cendawan endofit asal akar lada dapat memperoleh isolat-isolat bakteri dan cendawan endofit yang potensial sebagai agens pengendalian hayati terhadap patogen penyebab penyakit kuning pada lada. Adanya aplikasi kompos TKKS yang diperkaya bakteri dan cendawan endofit mampu menekan penyakit kuning pada tanaman lada di Bangka.
Manfaat Penelitian
Penelitian ini diharapkan dapat memperoleh isolat-isolat bakteri dan cendawan endofit yang berpotensi sebagai agens pengendalian hayati terhadap patogen penyebab penyakit kuning pada lada dan menjadi sumber informasi tentang pemanfaatan kompos TKKS dan cendawan serta bakteri endofit sebagai salah satu strategi pengendalian hayati dalam upaya penekanan penyakit kuning pada pertanaman lada di Bangka yang ramah lingkungan.
Ruang Lingkup Penelitian
4
Gambar 1 Bagan alir penelitian potensi mikrob endofit dan aplikasinya dengan kompos tandan kosong kelapa sawit untuk pengendalian penyakit kuning pada lada cendawan endofit yang efektif menekan penyakit kuning lada
5
2
TINJAUAN PUSTAKA
Gejala Penyakit Kuning pada Lada
Penyakit kuning pada tanaman lada merupakan penyakit kompleks yang disebabkan oleh beberapa patogen yaitu R similis, M. incognita, F. oxysporum, dan F. solani serta kekurangan hara (Mustika 2005b). Tanaman sakit dapat mengalami kematian dan kebun yang telah terinfeksi sulit untuk ditanami kembali, sehingga mengakibatkan kerugian pada petani. Infeksi simultan oleh R. similis dan
M. incognita menimbulkan banyak luka pada akar sehingga memudahkan
Fusarium sp. untuk menginfeksi akar (Mustika 2005a).
Gejala pertama penyakit kuning yang tampak pada tanaman terinfeksi adalah pertumbuhan tanaman terhambat terutama pada musim penghujan. Kemudian, tajuk mengalami klorosis pada daun dan dahan secara bertahap tetapi tanaman tidak layu. Pada awal infeksi, daun tampak kaku mengantung pada dahan, semakin lama daun akan menekuk ke arah batang. Gejala tajuk menguning dan daun gugur terjadi setelah tanaman berbuah pertama kali tetapi malai lada dan dahan tidak cepat gugur seperti daun. Gejala pada akar, rambut-rambut akar mengalami nekrosis akibat infeksi R. similis dan membentuk puru akibat infeksi
M. incognita. Kerusakan pada jari-jari empulur yang lebar dapat menyebabkan akar tanaman mati. Tanaman lada tua juga dapat terinfeksi oleh nematoda dan mati dalam waktu yang relatif lebih pendek karena lignifikasi akar yang lambat. Nematoda dapat memencar secara aktif di dalam tanah. Area di sekitar tanaman yang terinfeksi terdapat tanaman yang tampak sehat tetapi akarnya telah terserang oleh nematoda. Oleh sebab itu, pertanaman yang terinfeksi akan meluas secara teratur, namun gejala tampak dengan berbagai tingkat klorosis yang berbeda (Mustika 2005b).
Patogen Penyebab Penyakit Kuning pada Lada
Radopholus similis
6
Nematoda betina memiliki panjang 0.52-0.88 mm, kepala membulat atau sedikit berlekuk dengan kontur tubuh. Kerangka kepala mengalami skloritisasi kuat, stilet dan esofagusnya tumbuh sempurna. Vulva berbentuk krucut dengan panjang sekitar 60 μm yang terdapat pada bagian tengah tubuh (CABI 2014). Nematoda jantan memiliki panjang rata-rata 0,58 mm, esofagus dan stiletnya tidak berkembang sempurna. Kepala nematoda jantan berbentuk membulat dan berlekuk yang sangat berbeda dengan betina. Nematoda jantan mempunyai bagian posterior dengan ciri-ciri, testis tunggal dan bursa meluas sampai dua per tiga dari ekor, panjang spikula 18-22 μm berbentuk slindris dan melengkung, ekor memanjang berbentuk krucut dan melengkung ke arah ventral serta memiliki bursa (Dropkin 1991).
Daur hidup R. similis dari telur ke telur generasi berikutnya membutuhkan waktu 20 sampai 25 hari pada suhu berkisar 24-32 oC. Nematoda betina menghasilkan 4–5 butir telur setiap hari selama 2 minggu. Telur menetas 8 sampai 10 hari dan stadia juvenil secara keseluruhan memerlukan waktu 10 sampai 13 hari. Nematoda betina dan larva merupakan stadium yang infektif, sedangkan jantan tidak bersifat parasit karena secara morfologi stilet mengalami degenerasi (Hunt et al. 2005). Ada empat stadia juvenil (J) yaitu J1 berkembang di dalam telur kemudian berganti kulit dan menetas menjadi J2, J2 berganti kulit menjadi J3, J3 berganti kulit menjadi J4 dan J4 berganti kulit menjadi nematoda dewasa. Meloidogyne incognita
Spesies jantan dan betina memiliki bentuk tubuh yang berbeda. Nematoda jantan memiliki bentuk tubuh memanjang seperti cacing, sedangkan nematoda betina pada saat dewasa memiliki bentuk tubuh seperti buah pear (Agrios 2005). Nematoda jantan dewasa memiliki ukuran panjang tubuh 1200-2000 μm,bentuk kepala tidak berlekuk dan stilet yang lebih panjang dibanding dengan betinanya yaitu 23-26 μm,ekor pendek dan membulat dengan bagian posterior terpilin. Nematoda jantan bergerak lambat di dalam tanah. Nematoda betina dewasa memiliki ukuran panjang 510-690 μm.Terdapat pola jelas pada striae yang berada di sekitar vulva dan anus yang disebut dengan pola perineal (perinneal pattern). Setiap spesies Meloidogyne memiliki variasi pola perineal yang menjadi ciri khusus untuk dapat diidentifikasi. Morfologi umum dari pola perineal jenis
Meloidogyne spp. dibagi menjadi dua, yaitu bagian dorsal dan ventral. Bagian dorsal terdiri dari lengkungan striae dorsal, punctuations (tonjolan berduri),
phasmid, ujung ekor, dan garis lateral, sedangkan bagian ventral terdiri dari striae
ventral, vulva, dan anus. (Caineiro dan Cofcewicz 2008).
7 tersebut. J2 mengalami pertumbuhan dan pergantian kulit menjadi J3, pergantian kulit menjadi J4,dan pergantian kulit menjadi nematoda jantan atau betina dewasa dengan siklus hidup 30-60 hari (Mustika 2005a). Nematoda jantan dewasa berbentuk memanjang seperti cacing dan hidup di dalam tanah, sedangkan nematoda betina yang berbentuk seperti buah pear akan tetap menetap pada daerah makanannya atau sel awal di dalam stele. Selama hidupnya, nematoda betina akan terus-menerus menghasilkan telur hingga mencapai 1000 butir telur. Keberadaan nematoda akan merangsang sel-sel untuk membelah, sehingga terbentuk puru pada akar tanaman (Hunt et al.2005). Proses pembentukan puru ditandai dengan adanya lima sampai tujuh sel di sekeliling nematoda yang menjadi sel raksasa (giant cell) (Agrios 2005). Pembengkakan pada akar memiliki ukuran berbeda-beda tergantung pada kepekaan tanaman. Akar yang membengkak berisi nematoda betina beserta kelompok telurnya.
Fusarium oxysporum
Fusariumo xysporum merupakan patogen tular tanah yang memiliki struktur bertahan di dalam tanah berupa klamidospora. Fusarium oxysporum menginfeksi tanaman melalui akar yang luka secara alami maupun karena patogen lain seperti oleh serangan nematoda. Setelah masuk ke dalam akar, patogen ini berkembang dalam jaringan vaskular dari akar menuju batang (Agrios 2005). Penyakit yang disebabkan oleh patogen ini dapat berkembang dengan baik dan meluas dengan cepat pada tanah alluvial yang asam, umumnya pada tanah geluh yang bertekstur ringan atau geluh berpasir (Djaenuddin 2011).
Daur hidup F. oxysporum terdiri atas fase patogenesis dan saprogenesis. Pada fase patogenesis, cendawan hidup sebagai parasit pada tanaman inang. Fase saprogenesis terjadi jika tidak ada tanaman inang, patogen hidup pada sisa tanaman di dalam tanah. Fusarium oxysporum dapat tumbuh dengan baik pada tanah dengan kisaran pH 4.5-6.0 dengan pH optimum untuk bersporulasi adalah 5, dan tidak dapat terjadi sporulasi pada pH di bawah 3.6 atau di atas 8.8. Suhu optimum untuk pertumbuhan patogen ini adalah 20-30 oC, maksimum pada 37oC dan minimum sekitar 5 oC (Djaenuddin 2011).
Pengendalian Penyakit Kuning pada Lada
Munif dan Sulistiawati (2014) melaporkan bahwa upaya pengendalian penyakit kuning yang pernah dilakukan oleh petani lada di wilayah Bangka adalah menggunakan pestisida sintetik, memberikan kapur ke tanah, mencabut atau membakar tanaman terinfeksi. Pengendalian penyakit kuning lada dapat dilakukan dengan menggunakan varietas lada yang tahan atau toleran terhadap penyakit kuning, penambahan organik pada pertanaman lada, pergiliran tanaman, penanaman tanaman perangkap, penggunaan pestisida nabati dan kimia, teknik budidaya yang baik, dan pengendalian hayati (Mustika 2005a).
Studi tentang pengendalian hayati terhadap penyakit kuning pada tanaman lada yang pernah dilaporkan adalah pemanfaatan bakteri dan cendawan endofit (Harni dan Munif 2012), penggunaan Plant Growth Promoting Bacteria (PGPR),
Trichoderma sp, tanaman Arachis pintoi Krapov. & W.C.Greg., (Taufik et al.
8
(Mustika 2005b), dan pemanfaatan cendawan nematofagus Arthrobotrys sp.,
Dactylaria sp., Dactylella sp. (Mustika dan Ahmad 2004). Wiratno et al. (2009) menyatakan bahwa ekstrak tanaman tembakau, cengkeh, sirih, dan jeringau (Acorus calamus L.) efektif membunuh M. incognita hingga 98% setelah 24 jam perlakuan. Bakteri endofit Bacillus megaterium de Bary dan Curtobacterium luteum (Komagata & Lizuka) Yamada & Komagata asal tanaman lada dapat menekan R. similis secara in vivo (Aravind et al. 2010). Dube dan Smart (1987) menyatakan bahwa perlakuan Paecilomyces lilacinus (Thom) Samson dan P. penetrans baik secara tunggal maupun kombinasi efektif menekan jumlah puru akar, jumlah massa telur dan penetasan telur M. incognita secara in vitro.
Mikrob endofit adalah mikroorganisme yang hidup di dalam jaringan tanaman tanpa menimbulkan gejala penyakit pada tanaman inangnya yang akan terlihat aktif pada kondisi tertentu (Schulz dan Boyle 2005). Mikrob endofit merupakan agen pengendali hayati yang saat ini banyak dipelajari. Beberapa kajian terhadap mikrob endofit terbukti memiliki potensi menekan infeksi atau pertumbuhan patogen. Mikrob endofit mengeluarkan senyawa metabolit sekunder yang bermanfaat bagi tanaman inang. Pemanfaatan mikrob endofit sebagai agen hayati memiliki beberapa keunggulan yaitu berperan sebagai agen biokontrol, mampu meningkatkan pertumbuhan tanaman dan ketersediaan beberapa mineral (Bacon dan Hinton 2007; Hallmann dan Berg 2006), menginduksi ketahanan tanaman (Hallmann 2001), dan meningkatkan toleransi terhadap cekaman abiotik seperti cekaman logam berat dan kekeringan (Arnold et al. 2003).
Mikrob endofit masuk ke dalam jaringan tanaman melalui 2 cara yaitu secara vertikal dan horizontal. Transmisi vertikal, endofit masuk dari generasi ke generasi tanaman melalui benih yang ditularkan oleh tanaman inang melalui biji (Saikkonen 2007). Horizontal melalui spora secara eksternal (Clay 1992; Rodriguez et al. 2009).
Mikrob endofit sangat penting untuk meningkatkan ketahanan tanaman dengan mempengaruhi kebugaran inang secara keseluruhan (Rodriquez et al.
2009). Mekanisme perlindungan mikrob endofit dapat secara langsung melalui produksi antibiotik dan sekresi enzim dan mekanisme tidak langsung melalui peningkatan pertahanan tanaman. Induksi ketahanan tanaman adalah fenomena terjadinya peningkatan ketahanan tanaman terhadap infeksi patogen akibat rangsangan. Endofit dalam jaringan tanaman menyebabkan terinduksinya metabolit sekunder yang mampu menghambat cendawan lain (Rayner 1991). Induksi ketahanan tanaman terhadap nematoda dapat melalui peningkatan asam salisilat, peroksidase, dan senyawa fenolik (Harni et al. 2012). Mekanisme pengendalian yang lain adalah kompetisi ruang dan nutrisi dengan patogen (Sikora
9
Beberapa studi telah membuktikan bahwa mikrob endofit mampu menekan insidensi maupun keparahan penyakit. Cendawan endofit Epichloë festucae
Leuchtm., Schardl & M.R. Siegel dan Neotyphodium sp. mampu menekan keparahan penyakit yang disebabkan oleh Laetisaria fuciformis (Berk) Burds hingga 80% (Bonos et al. 2005). Bakteri endofit Bacillus sp. mampu menekan populasi nematoda peluka akar Pratylenchus brachyurus Godfrey pada tanaman nilam sampai 75% (Harni et al. 2006). Bakteri endofit Bacillus mycoides Flügge isolat Bacj (Bargabus et al. 2002) dan Bacillus pumilis isolat 203-7 (Bargabus et al. 2004) mampu menekan bercak daun Cercospora pada sugar beets. Beberapa penelitian membuktikan bahwa bakteri endofit Bacillus cereus Frankland & Frankland yang ditemukan pada kapas (Gossypium hirsutum L.), jagung manis (Zea mays L.), dan tanaman jeruk (Citrus spp.) ternyata mampu menghasilkan kitinase untuk mendegradasi dinding sel cendawan patogen seperti Fusarium sambucinum (Fr.) Sacc. (Sadfi et al. 2001). Firmansah (2008) menyatakan bakteri endofit dapat mengolonisasi apoplas pada ruang antar sel (interselular), terutama jaringan korteks, jaringan pembuluh sehingga dapat menyebar secara sistemik ke seluruh jaringan tanaman.
Mikrob endofit membantu tanaman inang meningkatkan toleransi terhadap cekaman biotik dan abiotik (Redman et al. 2002; Rodriguez et al. 2009). Peran yang menguntungkan dengan adanya mikrob endofit pada tanaman yaitu meningkatkan ketahanan tanaman terhadap penyakit (Narisawa et al. 2002), dan stress lingkungan (Schulz 2006) seperti ketahanan terhadap stress mineral (Malinowski dan Belesky 2000), memacu pertumbuhan dan meningkatkan ketahanan tanaman terhadap kekeringan dan suhu tinggi (Lehtonen et al. 2005). Cendawan endofit kelompok dark sephtat endophytic (DSE) berperan meningkatkan toleransi tanaman terhadap cekaman kekeringan. Diduga akumulasi lipid pada hifa berfungsi sebagai cadangan karbon yang kaya akan energi untuk mempertahankan tanaman selama musim kemarau (Rodriquez et al. 2009).
Kompos dalam Pengendalian Hayati dan Kompos Tandan Kosong Kelapa Sawit
10
lada yang disebabkan oleh Phythopthora capsici Leonian dengan efektivitas penekanan hingga 94.5% (Hendra 2015).
Limbah padat kelapa sawit terdiri dari tandan buah kosong, serat, cangkang biji, batang pohon dan pelepah daun. Tandan kosong kelapa sawit (TKKS) merupakan limbah yang dihasilkan sebanyak 23% dari tandan buah segar (TBS). Salah satu potensi TKKS yang cukup besar adalah sebagai bahan pembenah tanah dan sumber hara bagi tanaman. Potensi ini didasarkan pada materi TKKS yang merupakan bahan organik dengan kandungan hara yang cukup tinggi. Kompos TKKS memiliki keunggulan yaitu memperbaiki sifat fisik, kimia dan biologi tanah; memperkaya unsur hara yang ada di dalam tanah dan kandungan kalium yang tinggi (Darnoko dan Sutarta 2006; Purnamayani et al. 2012). Kandungan hara dalam kompos TKKS umur 4-10 minggu memiliki kandungan N, K2O, C-Org, dan rasio C/N lebih tinggi serta pH dan kadar air yang lebih besar dari standar SNI. Hasil pengomposan 8 minggu menunjukkan hasil terbaik dengan rasio C/N yang lebih rendah, kandungan N-total, P, Mg, Fe, Mn, B dan Cu terbesar. Kompos TKKS juga memiliki nilai C/N ratio yang tinggi, 35.16 pada kompos umur 8 minggu (Yunindanova 2009) dan 42.85 (Panjaitan 2013).
11
3
BAHAN DAN METODE
Waktu dan Tempat
Penelitian telah dilaksanakan di Laboratorium Biologi Universitas Bangka Belitung (UBB), Laboratorium Agroteknologi UBB, Laboratorium Nematologi IPB, Laboratorium Biologi dan Kesehatan Tanah, Balai Penelitian Tanah, Cimanggu dan kebun petani lada di Bangka pada bulan Juli 2013 sampai Juli 2015.
Isolasi Mikrob
Isolasi mikrob endofit dilakukan dari akar tanaman lada sehat varietas Merapin dan Lampung daun lebar (LDL) yang berasal dari kebun lada yang tidak menunjukkan gejala penyakit kuning dan kebun lada yang menunjukkan gejala penyakit kuning di Desa Beruas, Kabupaten Bangka Tengah, Provinsi Kepulauan Bangka Belitung.
Isolasi Cendawan endofit
Isolasi cendawan endofit dilakukan menggacu pada metode Silva et al.
(2012) dan Amin et al. (2012) yang dimodifikasi pada konsentrasi NaOCl dan waktu sterilisasi permukaan jaringan. Sampel akar dicuci bersih dengan air mengalir. Akar dipotong 1-2 cm dan direndam dalam air mengalir selama 1-2 jam. Kemudian akar dikeringangin di atas tisu steril. Permukaaan akar disteril dengan NaOCl 2% selama 2-3 menit, alkohol 70% selama 1-2 menit, dan dibilas dengan akuades steril selama 1 menit sampai 3 kali. Akar dikeringangin di atas tisu steril. Bagian akar yang mengalami pencoklatan dibuang dan akar dipotong 5 mm dalam kondisi aseptik. Potongan akar ditumbuhkan pada media Malt Extract Agar
(MEA) sebanyak 5 potongan dalam cawan petri dan diinkubasi pada suhu ruang hingga tumbuh. Sebagai kontrol sterilisasi permukaan, potongan akar ditanam pada media MEA tetapi potongan tidak disertakan dalam inkubasi dan media MEA diinkubasi selama 3 hari pada suhu ruang. Keberhasilan sterilisasi permukaan akar jika media tidak ditumbuhi oleh cendawan atau bakteri kontaminan (Tondok 2012).
Isolasi Bakteri Endofit
Metode sterilisasi permukaan akar untuk isolasi bakteri endofitsamaseperti sterilisasi permukaan akar pada isolasi cendawan endofit. Akar ditimbang 1 g dan digerus sampai hancur dengan mortar steril. Ekstrak akar ditambahkan 9 mL akuades steril dandiencer berseri sampai 10-4. Sebanyak 100 µL suspensi dari pengenceran 10-4 ditumbuhkan pada media Tryptone Soya Agar (TSA) dengan metode sebar dan diinkubasi pada suhu ruang selama 48 jam. Koloni tunggal pada media TSA untuk dimurnikan dan diseleksi secara morfologi.
Isolasi Cendawan Patogen Fusarium oxysporum
12
suspensi tanah digoyang selama 60 menit pada kecepatan 125 rpm menggunakan
shaker. Suspensi diencerkan berseri hingga 10-3. Sebanyak 100 µL dari pengencenran 10-2 dan 10-3 ditumbuhkan pada media Potato Dextose Agar (PDA). Cendawan yang tumbuh dimurnikan dan diidentifikasi secara morfologi menggunakan kunci identifikasi Barnett dan Hunter (2006), Dugan (2006), dan Watanabe (2002).
Uji Patogenisitas
Uji Patogenisitas Cendawan Endofit pada Kecambah Benih
Cendawan endofit diuji patogenisitasnya menggunakan kecambah benih padi varietas Inpari 10 sebagai indikator. Sterilisasi permukaan benih padi mengacu pada metode Matic et al. (2014) yang dimodifikasi pada suhu dan waktu. Benih padi disteril permukaan dengan larutan klorok 2% selama 5 menit dan dibilas dengan akuades steril 3 kali. Selanjutnya, benih direndam dalam akuades steril dengan suhu 50 oC selama 20 menit. Benih dikeringanginkan di atas tisu steril dan ditumbuhkan dalam cawan petri yang telah ditumbuhi oleh cendawan endofit sebanyak 25 butir tiap petri. Benih diinkubasi selama 1 minggu pada suhu ruang. Kontrol menggunakan benih yang ditumbuhkan pada tisu steril yang dilembapkan dengan akuades steril. Pengamatan dilakukan dengan menghitung persentase kecambah benih normal. Isolat cendawan endofit yang menyebabkan kecambah abnormal dan gejala nekrotik merupakan isolat yang bersifat patogen. Isolat bersifat nonpatogen digunakan untuk pengujian antagonis terhadap
F.oxysporum.
Uji Patogenisitas Bakteri Endofit (Uji Hipersensitif)
Pengujian mengacu pada metode Huang et al. (1988) yang dimodifikasi pada media suspensi. Koloni bakteri berumur 36-48 jam disuspensikan dalam air steril. Sebanyak satu loop berdiameter 5 mm koloni bakteri disuspensikan dalam 2.5 mL air steril. Suspensi bakteri diinokulasikan pada daun tembakau dengan menyuntikan 0.5-1 ml suspensi bakteri pada bagian bawah permukaan daun tanpa menembus lapisan atas permukaan daun tembakau. Inkubasi dilakukan selam 24-48 jam. Kontrol negatif menggunakan air steril dan kontrol positif menggunakan suspensi bakteri patogen tumbuhan yaitu Xanthomonas oryzae pv. oryzae. Pengamatan dilakukan terhadap gejala daun tembakau. Reaksi hipersensitif positif yaitu ditandai adanya gejala nekrosis pada daun tembakau setelah diinokulasi. Isolat yang menunjukkan reaksi negatif merupakan isolat yang bersifat nonpatogen yang digunakan untuk pengujian antagonis terhadap F.oxysporum.
Uji Hemolisis Bakteri Endofit
13 Uji Antagonisme
Pengujian Antagonis Cendawan Endofit terhadap Fusarium oxysporum Pengujian antagonis cendawan endofit terhadap F. oxysporum menggunakan metode dual culture pada media PDA (Mariana dan Budi 2013). Isolat F. oxysporum dan cendawan endofit berumur satu minggu dipotong dengan pelubang gabus (corkborer) berdiameter 5 mm. Isolat cendawan endofit dan F. oxysporum
ditumbuhkan bersama pada media PDA dengan jarak 3 cm pada cawan petri berdiameter 9 cm. Sebagai kontrol, dua potongan isolat F. oxysporum
ditumbuhkan bersama dalam satu cawan.
Pengujian Antagonis Bakteri Endofit terhadap Fusarium oxysporum
Pengujian antagonis bakteri endofit terhadap F. oxysporum mengacu pada Safitri (2012) yang menggunakan metode dual culture pada media PDA. Koloni bakteri endofit berumur 48 jam digores pada bagian tengah cawan dengan jarak 4.5 cm dari tepi cawan dan potongan F. oxysporum ditumbuhkan dengan jarak 2.25 cm dari tepi cawan. Sebagai kontrol, isolat F. oxysporum ditumbuhkan tanpa goresan bakteri endofit.
Pengukuran jari-jari koloni F. oxysporum dilakukan setelah miselium F. oxysporum yang tumbuh ke arah tepi cawan mencapai tepi cawan. Penghitungan daya hambat cendawan endofit atau bakteri endofit terhadap miselium F. oxysporum menggunakan rumus (Alfizar et al. 2013):
DH = Daya hambat cendawan endofit atau bakteri endofit terhadap F. oxysporum
(%)
R1 = Jari-jari koloni F. oxysporum ke arah koloni cendawan endofit atau goresan bakteri endofit
R2 = Jari-jari koloni F. oxysporum ke arah tepi cawan
Uji Fisiologis Bakteri Endofit sebagai Penambat Nitrogen, Pelarut Fosfat dan Kalium
Penambat Nitrogen
James Nitrogen Free Malat Bromthymol Blue
(JNFB) 5.0 g asam malat, 0.6 g K2HPO4, 1.8 g
14
pellicle
Pelarut Fosfat
Pengujian pelarut fosfat mengacu pada metode Suliasih dan Rahmat (2007) menggunakan media agar pikovskaya. Komposisi 1 L media pikovskaya adalah 5 g Ca3(PO4)2, 0.5 g (NH4)2SO4, 0.2 g NaCl,0.1 g MgSO4.7H2O, 0.2 g KCl, 10 gglukosa, 0.5 g ekstrak yeast, MnSO4, FeSO4 dan 20 g agar. Koloni bakteri yang berumur 48 jam diambil menggunakan ujung tusuk bambu steril ditumbuhkan pada media pikovskaya dan diinkubasi selama 1 minggu. Isolat bakteri endofit yang dapat melarutkan fosfat dicirikan dengan terbentuknya zona bening di sekitar koloni bakteri.
Pelarut Kalium
Pengujian mengacu pada metode Prajapati dan Modi (2012) dan Sugumaran dan Janarthanam (2007) menggunakan media agar alexandrov. Komposisi 1 L media alexandrov adalah 10 glukosa, 0.5 g MgSO4.7H2O, 0.005 g FeCl3, 0.1 g CaCO3, 2 gCaPO4, 5 g kalium aluminium silikat, dan agar 20 g dengan pH 6.5. Metode pengujian dilakukan sama dengan pengujian bakteri pelarut fosfat. Isolat bakteri endofit yang mampu melarutkan kalium ditunjukkan dengan terbentuknya zona bening di sekitar koloni bakteri.
Uji Kultur Filtrat Cendawan dan Bakteri Endofit terhadap Nematoda secara In Vitro
Isolat cendawan endofit ditumbuhkan pada media PDA. Setelah berumur 1 minggu, isolat cendawan endofit ditumbuhkan pada media PDB dan digoyang selama 1 minggu menggunakan shaker. Isolat bakteri endofit ditumbuhkan pada media TSA, kemudian ditumbuhkan pada media TSB dan digoyang selama 48 jam menggunakan shaker. Kultur filtrat disentrifugasi dengan kecepatan 5000 rpm selama 20 menit.
Juvenil 2 Meloidogyne sp. diekstraksi dari jaringan akar tanaman pacar air terinfeksi dengan metode pengabutan selama 48 jam. Selanjutnya, sterilisasi permukaan kulit nematoda mengacu pada Harni et al. (2010) yang dimodifikasi. Sebelum sterilisasi permukaan nematoda dilakukan, saringan 500 mesh disteril dengan alkohol 70% sekitar 2 menit kemudian dibilas dengan air steril. Suspensi nematoda hasil ekstraksi dituang pada saringan, kemudian disterilkan menggunakan HgCl2 0.001% selama 30-60 detik dengan cara disemprot dan dibilas dengan air steril. Selanjutnya, suspensi nematoda disterilkan menggunakan streptomisin sulfat 0.1% selama 30-60 detik dan dibilas dengan air steril hingga bersih. Suspensi nematoda disimpan dalam botol steril.
15
Pembuatan Kompos Tandan Kosong Kelapa Sawit Diperkaya Bakteri dan Cendawan Endofit
Pengomposan TKKS mengacu pada metode Darnoko dan Sutarta (2006) yang dimodifikasi. TKKS dicacah dengan ukuran ±5 cm, dimasukkan ke dalam kantong plastik sampah hitam setinggi 0.5 m dan diikat longgar agar tetap terjadi sirkulasi udara. Kompos dibalik secara berkala dengan selang waktu 2 minggu di awal pengomposan supaya kematangan kompos merata. Pengomposan dilakukan selama 9 bulan dalam kondisi aerob.
Penggunaan dosis kompos TKKS yang digunakan mengacu pada Panjaitan (2013) yaitu 10 ton/ha. Dosis kompos TKKS untuk tiap tanaman sampel dengan jarak tanam 1.5 x 1.5 meter adalah 2.25 kg. Pengkayaan kompos TKKS dengan bakteri dan cendawan endofit mengacu pada Hasibuan et al. (2012) yang dimodifikasi pada kerapatan dan media suspensi bakteri dan cendawan endofit. Kompos TKKS ditimbang 2.25 kg, dimasukkan ke dalam kantong plastik hitam, dan diperkaya dengan 50 mL suspensi bakteri dan cendawan endofit dengan kerapatan 109. Kompos diinkubasi selama 1 minggu sebelum aplikasi ke lapangan.
Aplikasi Kompos TKKS Diperkaya Bakteri dan Cendawan Endofit di Lapangan
Percobaan aplikasi kompos TKKS diperkaya bakteri dan cendawan endofit dilakukan di kebun petani yang terinfeksi penyakit kuning menggunakan rancangan acak kelompok dengan tiga ulangan. Taraf perlakuan terdiri atas:
1. Tanpa Perlakuan (Kontrol) 2. Kompos TKKS (TKKS)
3. Kompos TKKS diperkaya bakteri endofit BMS21 (TKKS+BMS21) 4. Kompos TKKS diperkaya bakteri endofit BLI11 (TKKS+BLI11) 5. Kompos TKKS diperkaya cendawan endofit CMS8 (TKKS+CMS8) 6. Kompos TKKS diperkaya cendawan endofit CMI16 (TKKS+CMI16)
Pengamatan dilakukan terhadap populasi nematoda parasit dan non parasit tanah, kelimpahan dan keragaman bakteri tanah, kelimpahan dan keragaman cendawan tanah, kimia tanah, absorbansi aktivitas enzim peroksidase, dan insidensi penyakit.
16
saringan 500 mesh dengan akuades menggunakan sprayer. Suspensi nematoda dituang ke dalam cawan sirakus, diamati dan dihitung di bawah mikroskop stereo.
Analisis Tanah. Analisis kimia tanah dilakukan di Laboratorium Kimia dan Fisik Tanah Fakultas Tanah Universitas Brawijaya. Analisis kimia tanah dilakukan sebelum dan tiga bulan setelah perlakuan. Analisis kimia tanah meliputi pH, bahan organik, C organik, rasio C/N, nitrogen total, fosfat tersedia, dan kalium dapat ditukar (Kdd).
Analisis biologi tanah meliputi kelimpahan dan indeks keragaman mikrob tanah (bakteri dan cendawan) sebelum dan setelah aplikasi. Analisis biologi tanah dilakukan dengan mengisolasi mikrob tanah. Sampel tanah diambil sebanyak 10 gram dan dimasukkan ke dalam 90 mL akuades steril. Kemudian suspensi digoyang selama 60 menit pada kecepatan 125 rpm menggunakan shaker. Suspensi dilakukan pengenceran secara berseri hingga 10-3. Sebanyak 100 µL suspensi pada pengenceran 10-2 ditumbuhkan pada media PDA dan 10-3 ditumbuhkan pada media TSA dengancara disebar menggunakan segitiga batang penyebar. Isolasi bakteri tanah diinkubasi selama 48 jam dan cendawan tanah diinkubasi selama satu minggu.
Indeks keragaman Shannon (Nahar et al. 2006): H’ = -∑ (Pi ln Pi) H’= indeks keragaman
Pi = jumlah mikrob sejenis I = 1,……n
Insidensi Penyakit. Pengamatan insidensi penyakit dilakukan tiga bulan setelah aplikasi dengan menggunakan rumus:
17
Identifikasi Cendawan dan Bakteri Endofit
Cendawan endofit yang digunakan untuk memperkaya kompos TKKS diidentifikasi secara morfologi. Identifikasi secara makroskopis dilakukan dengan mengamati koloni meliputi warna, bentuk permukaan dan tepi koloni. Pengamatan secara mikroskopis dilakukan meliputi hifa, konidia atau spora, konidiofor dan percabangan konidiofor menggunakaan kunci identifikasi Barnett dan Hunter (2006), Watanabe (2002), dan Hanlin (2000). Identifikasi bakteri endofit dilakukan berdasarkan karakteristik fisiologi dan biokimia yang dilakukan di Laboratorium Bioteknologi Lingkungan, Yayasan Pusat Keanekaragaman Hayati dan Bioteknologi Lingkungan Indonesia.
Analisis Data
18
4
HASIL DAN PEMBAHASAN
Isolasi dan Seleksi Patogenisitas Cendawan dan Bakteri Endofit
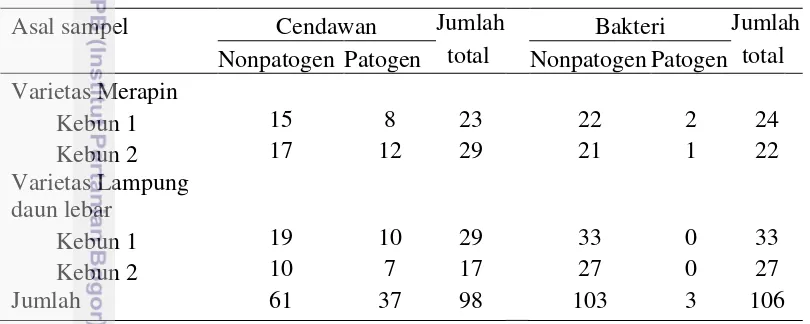
Hasil isolasi mikrob endofit dari akar lada diperoleh 89 isolat cendawan endofit dan 106 isolat bakteri endofit. Isolasi cendawan endofit dari varietas Merapin diperoleh 23 isolat berasal dari kebun yang tidak menunjukkan gejala sakit dan 29 isolat berasal dari kebun yang menunjukkan gejala sakit. Isolasi cendawan endofit dari varietas Lampung Daun Lebar diperoleh 29 isolat berasal dari kebun yang tidak menunjukkan gejala sakit dan 17 isolat berasal dari kebun yang menunjukkan gejala sakit. Isolasi bakteri endofit dari varietas Merapin diperoleh 24 isolat berasal dari kebun yang tidak menunjukkan gejala sakit dan 22 isolat berasal dari kebun yang menunjukkan gejala sakit. Isolasi bakteri endofit dari varietas Lampung Daun Lebar diperoleh 33 isolat berasal dari kebun yang tidak menunjukkan gejala sakit dan 27 isolat berasal dari kebun yang menunjukkan gejala sakit (Tabel 1).
Tabel 1 Jumlah isolat cendawan dan bakteri endofit dari akar tanaman lada
Asal sampel Cendawan Jumlah Bakteri Jumlah
Hasil seleksi patogenisitas diperoleh 61 isolat cendawan endofit yang bersifat nonpatogen dan 37 isolat cendawan endofit yang bersifat patogen. Enam puluh satu isolat cendawan endofit terdiri atas 15 isolat berasal dari varietas Merapin dengan kebun yang tidak menunjukkan gejala penyakit kuning, 17 isolat berasal dari varietas Merapin dengan kebun yang menunjukkan gejala penyakit kuning, 19 isolat berasal dari varietas Lampung Daun Lebar dengan kebun yang tidak menunjukkan gejala penyakit kuning, dan 10 isolat berasal dari varietas Lampung daun Lebar dengan kebun yang menunjukkan gejala penyakit kuning (Tabel 1).
19 dengan kebun yang tidak menunjukkan gejala penyakit kuning, dan 27 isolat berasal dari varietas Lampung daun Lebar dengan kebun yang menunjukkan gejala penyakit kuning (Tabel 1).
Secara umum, hasil isolasi menunjukkan bahwa jumlah isolat cendawan endofit lebih tinggi pada varietas Merapin dibanding LDL. Sebaliknya, jumlah isolat bakteri endofit lebih tinggi pada varietas LDL dibanding Merapin. Naik et al. (2007) juga menyatakan bahwa jenis endofit akan berbeda pada setiap inang. Jumlah kolonisasi endofit pada suatu tanaman sangat berhubungan dengan genotip inang, faktor biotik dan abiotik lingkungan serta genotip endofit (Bacon dan Hinton 2006). Jumlah isolat bakteri dan cendawan endofit berasal dari kebun lada yang tidak menunjukkan gejala penyakit kuning lebih tinggi dibanding jumlah isolat bakteri dan cendawan endofit dari kebun lada yang menunjukkan gejala penyakit kuning. Munif dan Kristiana (2012) menyatakan bahwa kelimpahan bakteri endofit lebih tinggi pada kebun sehat dibanding kebun yang sakit. Douanla-meli et al. (2013) menjelaskan bahwa rendahnya keragaman dan kekayaan spesies endofit pada daun jeruk yang mengalami klorosis (sakit) diduga karena kekurangan nutrisi dan cekaman kekeringan yang berpengaruh negatif terhadap proses fotosintesis. Kondisi ini berakibat terhadap ketersediaan nutrisi bagi endofit di dalam jaringan. Keragaman, kelimpahan dan kekayaan endofit sangat dipengaruhi oleh jenis inang (Loro et al. 2012), jaringan (Gazis dan terhadap F. oxysporum diperoleh 13 isolat yang bersifat antagonis dengan kemampuan daya hambat 7.8-50.0%. Terdapat 2 isolat cendawan endofit yang berpotensi dalam menghambat pertumbuhan F. oxysporum paling tinggi yaitu isolat CMS8 dan CMI16 dengan daya hambat sebesar 50.0 dan 47.8% secara berturut-turut (Tabel 2).
Mekanisme antagonis dua isolat cendawan endofit terhadap F. oxysporum
adalah kompetisi ruang dan nutrisi. Farida (1992) dan Whipps (2000) menyatakan bahwa cendawan nonpatogen yang memiliki kemampuan berkompetisi tumbuh lebih cepat dari cendawan patogen dalam memperoleh nutrisi, ruang atau infection sites. Kolonisasi ruang dan kompetisi nutrisi antara isolat cendawan endofit dan F. oxysporum terlihat bahwa koloni isolat cendawan endofit lebih cepat tumbuh dan memenuhi ruang cawan petri pada uji dual culture sehingga pertumbuhan patogen
F. oxysporum menjadi tertekan.
Octriana (2011) menyatakan bahwa kemampuan berkompetisi merupakan faktor penting dalam menentukan aktivitas cendawan antagonis. Adanya kemampuan ini menyebabkan patogen tidak punya ruang dan nutrisi untuk tempat hidupnya sehingga pertumbuhannya terhambat. Pada isolat CMS8 diduga terjadi lisis yang ditandai dengan adanya perubahan warna media pada area pertemuan antara miselium isolat cendawan endofit CMS8 dan patogen F. oxysporum
20
glukanase, protease dan xilanase (Mariana dan Budi 2013). Enzim-enzim ini akan mendegradasi senyawa-senyawa penyusun dinding sel patogen yang berkerja secara spesifik. Ada beberapa mekanisme antagonis cendawan endofit yang telah dilaporkan, diantaranya; antibiosis, lisis, hiperparasit/mikoparasit, dan kompetisi (Bailey et al. 2008; Purwantisari dan Hastuti 2009).
Tabel 2 Daya hambat cendawan endofit terhadap pertumbuhan koloni Fusarium oxysporum pada metode dual culture
Kode isolata Daya Hambat (%)b
CMS2 37.8 b
CMS5 36.7 b
CMS8 50.0 a
CMS9 10.0 ef
CMS10 14.4 def
CMS14 15.7 def
CMI16 47.8 d
CMI17 7.8 f
CMI24 24.4 c
CLS18 17.7 cde
CLS19 11.1 Ef
CLS21 16.7 Cde
CLI2 22.2 Cd
a
C: cendawan endofit, M: varietas Merapin, L: varietas Lampung Daun Lebar, S: kebun lada yang tidak menunjukkan gejala penyakit kuning, I: kebun lada yang menunjukkan gejala penyakit kuning; bangka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada uji duncan dengan taraf kepercayaan 95%
Gambar 2 Antagonisme cendawan endofit terhadap Fusarium oxysporum
menggunakan metode dual culture. Antagonisme cendawan endofit CMS8; A) permukaan koloni, B) bagian bawah koloni. Antagonisme cendawan endofit CMI16; C) permukaan koloni, D) bagian bawah koloni. A1 dan B1) koloni cendawan CMS8, C1 dan D1) koloni cendawan endofit CMI16, dan A2-D2) koloni
21 Antagonisme Bakteri Endofit terhadap Fusarium oxysporum, Bakteri Endofit
sebagai Penambat Nitrogen dan Pelarut Fosfat
Hasil uji antagonis 103 isolat bakteri endofit terhadap F. oxysporum
diperoleh 12 isolat yang bersifat antagonis dengan kisaran daya hambat 15.0-31.1%. Bakteri endofit isolat BLI11 merupakan isolat yang memiliki daya hambat terhadap F. oxysporum paling tinggi yaitu 31.1% dan diikuti oleh bakteri endofit isolat BSM21 sebesar 26.1% yang berbeda nyata dibanding isolat bakteri endofit lainnya (Tabel 3).
Tabel 3 Daya hambat bakteri endofit terhadap pertumbuhan koloni Fusarium oxysporum pada metode dual culture, sebagai penambat nitrogen dan pelarut fosfat
Kode isolata Daya hambat (%)b Penambat nitrogen Pelarut fosfat
BMS5 18.9 de - + tidak menunjukkan gejala penyakit kuning, I: kebun lada yang menunjukkan gejala penyakit kuning; bangka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada uji duncan dengan taraf kepercayaan 95%; +: bakteri endofit mampu menambat nitrogen atau melarut fosfat, -: bakteri endofit tidak mampu menembat nitrogen atau melarut fosfat
Mekanisme antagonis oleh bakteri endofit isolat BLI11dan BMS21 terhadap patogen F. oxysporum adalah antibiosis. Menurut Bailey et al. (2008) antibiosis merupakan kemampuan suatu organisme menghasilkan senyawa antimikrob sehingga menyebabkan terhambatnya pertumbuhan miselium cendawan patogen. Mekanisme antibiosis pada uji dual culture ditunjukkan dengan terbentuknya zona bening sebagai zona penghambatan terhadap pertumbuhan miselium cendawan (Purwantisari dan Hastuti 2009) dan adanya perubahan warna pada media kultur sebagai akibat dari senyawa antifungal yang dikeluarkan oleh endofit (Farida 1992). Senyawa antimikrob yang dihasilkan oleh bakteri endofit sangat beragam tergantung spesies endofit seperti bacilomicin D (n-C14 dan C15-iso) (Zhao et al.
22
lisis pada hifa karena enzim yang dihasilkan oleh bakteri endofit (Eliza et al. 2007). Leu7-surfactin bakteri endofit mampu mereduksi mikotoksin fumosinins yang disekresi oleh cendawan patogen Fusarium verticilloides (Sawada) Wollenw (Bacon et al. 2002) dan melarutkan membran sel patogen (Bacon et al. 2012). Ada juga senyawa antimikrob yang berupa molekul protein dihasilkan oleh Bacillus subtilis strain E1R yang dapat menyebabkan lisisnya dinding sel hifa
Gaeumannomyces graminis var. tritici J. Walker (Liu et al. 2009).
Dua belas isolat bakteri endofit yang berpotensi sebagai penghambat F. oxysporum merupakan 1 isolat bakteri endofit bersifat sebagai penambat nitrogen, 3 isolat bakteri endofit bersifat sebagai pelarut fostat, dan 8 isolat bakteri endofit bersifat sebagai penambat nitrogen dan pelarut fosfat. Dua isolat bakteri endofit terbaik sebagai antagonis terhadap F. oxysporum memiliki karakter sebagai penambat nitrogen dan pelarut fosfat. Bakteri endofit yang telah dilaporkan mampu melarutkan fosfat adalah Pantoea dispersa isolat Cav.cy1, Pantoea cypripedii Hori isolat Cav.cy2, B. megaterium isolat Cav.cy3, Paenibacillus xylanilyticus Rivas isolat Cav.cy5 (Chen et al. 2014). B. megaterium isolat M1PCa, Pseudomonas putida (Trevisan) Migula isolat M5TSA, dan B. pumilus
isolat ES4 dilaporkan memiliki karakteristik sebagai pelarut fosfat dan penambat nitrogen (Lopez et al. 2012).
23 Pengaruh Kultur Filtrat Bakteri dan Cendawan Endofit
terhadap Meloidogyne sp.
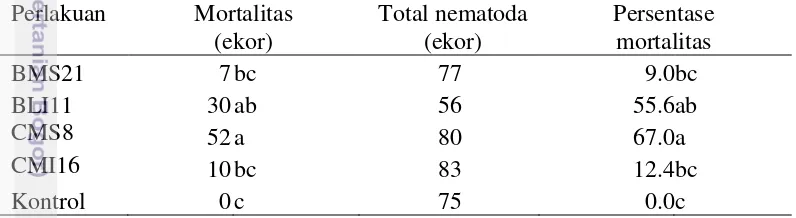
Pengaruh kultur filtrat dua isolat bakteri endofit dan dua isolat cendawan endofit terpilih terhadap mortalitas juvenil 2 Meloidogyne sp. yang di uji secara in vitro berbeda-beda yaitu berkisar 9.0-67.0% (Tabel 5). Tingkat kematian juvenil 2
Meloidogyne sp. paling tinggi terjadi pada filtrat kultur cendawan endofit CMS8 yaitu 67.0% kemudian diikuti oleh bakteri endofit BLI11 dengan 55.6%. Harni et al. (2010) menyatakan bahwa aktivitas nematisida bakteri endofit dapat disebabkan oleh kemampuan bakteri dalam menghasilkan enzim kitinase dan asam sianida (HCN) yang mampu membunuh larva dan menghambat penetasan telur. Park et al. (2004) menyebutkan bahwa cendawan endofit Paecilomyces lilacinus (Thom) Samson juga memiliki aktivitas nematisida dengan memproduksi kitinase, protease, fatty acid, dan leucinostatin. Leucinostatin dapat menghambat sintesis ATP pada mitokondria sehingga metabolisme nematoda akan terganggu. Kitinase dapat merusak kutikula nematoda yang merupakan penyusun utama kulit nematoda. Aktivitas degradasi kitin oleh bakteri endofit juga melepaskan senyawa amoniak yang bersifat racun bagi nematoda. HCN dan amoniak merupakan senyawa volatil yang mudah berdifusi ke dalam sel sehingga kedua senyawa ini dapat menghambat penetasan telur nematoda dengan mengganggu metabolisme sel nematoda.
Tabel 4 Pengaruh filrat kultur bakteri dan cendawan endofit terpilih terhadap mortalitas juvenil Meloidogyne sp. secara in vitro
Perlakuan Mortalitas
Pengaruh Aplikasi Kompos TKKS Diperkaya Bakteri dan Cendawan Endofit terhadap Populasi Nematoda
24
et al. (2006) menyebutkan bahwa biomassa dan aktivitas mikrob tanah yang tinggi berhubungan dengan mineralisasi N (ketersediaan N bagi tanaman) yang tinggi. Ketersediaan unsur hara akan menunjang pertumbuhan tanaman sekaligus menyediakan inang bagi nematoda parasit. Pada awal aplikasi di lapangan ketersediaan inang lebih banyak karena tanaman belum terinfeksi. Nematoda R. similis memerlukan waktu 20-25 hari dari penetasan telur hingga menghasilkan telur baru. Nematoda betina mampu menghasilkan telur 4-5/hari selama 2 minggu (Hunt et al. 2005). M. incognita membutuhkan waktu untuk menyelesaikan siklus hidupnya berkisar 30-60 hari (Mustika 2005a). Nematoda betina menghasilkan satu paket telur yang mengandung 500 butir telur (Dropkin 1991). Kemudian terjadi penurunan populasi nematoda parasit pada 3 bulan setelah aplikasi kompos diduga berhubungan dengan peningkatan infeksi penyakit kuning pada tanaman yang mengakibatkan terjadinya kompetisi antar patogen dalam mendapatkan ruang dan nutrisi (Whipps et al. 2000). Thoden et al. (2011) melaporkan hal yang sama bahwa penambahan bahan organik cenderung berpengaruh secara dinamik terhadap populasi nematoda parasit tumbuhan.
Populasi nematoda parasit maupun nonparasit pada akhir penelitianlebih tinggi pada perlakuan kompos TKKS dan kompos TKKS diperkaya endofit dibanding kontrol (Gambar 4). Hu dan Qi (2010) menyatakan hal yang sama bahwa kepadatan nematoda parasit ataupun nonparasit lebih tinggi pada perlakuan kompos dibanding pada pemupukan konvensional maupun kontrol. Hal ini diduga dengan adanya penambahan kompos memberikan kondisi lingkungan yang sesuai bagi perkembangan nematoda nonparasit dan pertumbuhan yang baik bagi tanaman inang bagi nematoda parasit. Nematoda nonparasit (free living) adalah nematoda yang hidup bebas di dalam tanah mendapatkan sumber energi dari tanah yang berperan sebagai nematoda pengurai bahan organik, pemakan bakteri, pemakan cendawan, dan predator. Adannya penambahan kompos ke tanah Gambar 4 Populasi nematoda parasit dan nonparasit setelah perlakuan kompos
25 meningkatkan biomassa mikrob tanah lainnya seperti cendawan dan bakteri tanah yang menjadi sumber energi bagi nematoda pemakan bakteri dan cendawan. Penambahan kompos ke dalam tanah meningkatkan secara signifikan nematoda pemakan cendawan (Steel et al. 2012). Steel et al. (2010) juga menyatakan bahwa pada kompos yang telah matang didominansi oleh nematoda pemakan bakteri, pemakan cendawan, dan predator sebesar 55.0%, 33.3%, dan 11.0% secara berturut-turut. Selain dapat meningkatkan sumber makanan bagi nematoda nonparasit, pemberian kompos ke dalam tanah akan meningkatkan kelembaban tanah, kapasitas pegang air tanah, kandungan bahan organik, memperbaiki pH, suhu, dan sifat kimia tanah yang dapat mempengaruhi pertumbuhan dan perkembangan nematoda (Porazinska et al. 1999).
Pengaruh Aplikasi Kompos TKKS Diperkaya Bakteri dan Cendawan Endofit terhadap Mikrob Tanah.
Secara umum, kelimpahan mikroba tanah dengan adanya perlakuan kompos TKKS maupun diperkaya endofit lebih tinggi dibandingkan dengan kontrol (Tabel 5 dan Tabel 6). Zhang et al. (2014) menyatakan hal yang sama, penambahan kompos jerami ataupun kompos jerami yang diperkaya dengan B. subtilis pada tanah meningkatkan biomassa mikrob tanah. Adanya penambahan kompos meningkatkan aktivitas mikrob di dalam tanah karena tersedianya cadangan karbon. Perlakuan kompos TKKS dan TKKS diperkaya endofit menunjukan respon yang berbeda terhadap bakteri dan cendawan endofit. Perez-Piqueres et al. (2006) menyatakan bahwa kompos dapat meningkatkan kelimpahan bakteri lebih tinggi 109 dibandingkan dengan kelimpahan cendawan 106.
Tabel 5 Keragaman dan kelimpahan bakteri tanah sebelum aplikasi dan setelah tiga bulan aplikasi kompos TKKS diperkaya bakteri dan cendawan endofit
Perlakuan
Indeks keragaman Kelimpahan (1 x 106 cfu) Sebelum
26
cendawan tanah, ini berhubungan dengan ketersediaan sumber energi bagi bakteri terutama bakteri tanah yang terlibat dalam aktivitas mineralisasi nitrogen (Steel et al. 2010).
Tabel 6 Keragaman dan kelimpahan bakteri tanah sebelum aplikasi dan setelah tiga bulan aplikasi kompos TKKS diperkaya bakteri dan cendawan endofit
Perlakuan
Indeks keragaman Kelimpahan (1 x 104 cfu) Sebelum
Perlakuan kompos TKKS dan TKKS diperkaya endofit meningkatkan keragaman cendawan tanah, tetapi menurunkan kelimpahan cendawan tanah (Tabel 6). Perlakuan kompos TKKS diperkaya bakteri endofit BSM21 memberikan pengaruh keragaman cendawan tanah paling tinggi dengan indeks keragaman Shanon 41.5±6.8 dibanding perlakuan lain dan kontrol. Hal ini diduga perlakuan kompos yang diperkaya bakteri endofit BSM21 mampu meningkatkan pertumbuhan cendawan tanah tanpa adanya perubahan yang signifikan pada kelimpahan cendawan tanah. Keragaman mikrob yang tinggi menunjukkan tidak adanya dominansi oleh spesies tertentu di dalam suatu ekosistem (Thoden et al. 1999). Biomasa cendawan tanah lebih tinggi pada saat awal pengomposan atau fase termofilik yaitu fase degradasi senyawa organik komplek seperti selulase, lignin dan protein yang didominansi oleh jenis tertentu. Senyawa-senyawa kompleks organik didegradasi oleh cendawan menjadi senyawa yang lebih sederhana seperti glukosa dan fruktosa menjadi sumber energi. Pada fase stabil atau fase kematangan kompos yang ditandai dengan penurunan suhu, biasannya cendawan antagonis mulai aktif (Hoitink et al. 1997).
Pengaruh Aplikasi Kompos TKKS Diperkaya Bakteri dan Cendawan Endofit terhadap Kimia Tanah.
27 Tabel 7 Pengaruh perlakuan kompos TKKS diperkaya bakteri dan cendawan endofit terhadap pH, C/N, bahan organik, karbon organik, nitrogen total, fosfat tersedia, dan kalium dapat ditukar
Zhang et al. (2014) juga menyebutkan bahwa perlakuan pada tanah masam dengan kompos ataupun kompos diperkaya bakteri Bacillus subtilis (Ehrenberg) Cohn dapat meningkatkan hara makro nitrogen dan fosfor dibandingkan dengan tanpa perlakuan kompos atau bakteri saja. Penambahan kompos ke tanah meningkatkan bahan organik dan ketersediaan N (Briar et al. 2011). Tu et al.
(2006) menjelaskan bahwa aplikasi bahan organik dapat meningkatkan aktivitas mikrob tanah, hal ini berhubungan dengan peningkatan ketersediaan N bagi tanaman (mineralisasi N). Bahan organik merupakan materi yang terdiri dari senyawa-senyawa komplek organik penyusun mahluk hidup yang mengandung rantai karbon seperti gula atau pati, protein, asam amino dan asam lemak. Senyawa-senyawa ini akan didegradasi oleh mikrob tanah menjadi senyawa yang lebih sederhana seperti glukosa dan fruktosa sebagai sumber energi. Senyawa-senyawa komplek yang mengandung nitrogen seperti protein atau Senyawa-senyawa komplek polipetida lainnya merupakan sumber energi bagi kelompok bakteri yang menghasilkan senyawa nitrogen anorganik yang dapat bermanfaat bagi tanaman (mineralisasi N). C organik yang menjadi sumber nutrisi bagi mikrob tanah meningkat sehingga aktivitas dan biomassa mikrob juga akan meningkat (Nahar et al. 2006).
Unsur N, P, dan K merupakan hara makro esensial bagi pertumbuhan dan perkembangan tanaman. Kekurangan hara makro esensial akan mengganggu metabolisme tanaman. Hal ini juga akan berakibat terganggunya pertahanan tanaman terhadap patogen. Nitrogen berfungsi sebagai unsur pembentuk asam amino, protein, dan enzim. Enzim-enzim ini termasuk untuk pertumbuhan dan perkembangan serta enzim dalam pertahanan tanaman terhadap infeksi oleh patogen maupun cekaman abiotik. Selain itu, unsur nitrogen juga penyusun klorofil, hormon sitokinin dan auksin. Fosfor merupakan hara yang berperan dalam reaksi-reaksi pada fase gelap fotosintesis, respirasi dan berbagai metabolisme lainnya serta bagian dari fosfolipida penyusun membran dan nukleotida (Lakitan 2008).