POTENSI BUAH MAKASAR (
Brucea javanica
) SEBAGAI
ANTIKANKER
RINA FAZILATUR RAHMI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Potensi Buah Makasar (Brucea javanica) sebagai Antikanker adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2013
Rina Fazilatur Rahmi
ABSTRAK
RINA FAZILATUR RAHMI. Potensi Buah Makasar (Brucea javanica) sebagai Antikanker. Dibimbing oleh GUSTINI SYAHBIRIN dan PURWANTININGSIH SUGITA.
Tumbuhan Brucea javanica atau buah makasar memiliki potensi antikanker. Penelitian ini bertujuan memperoleh fraksi buah makasar yang toksik terhadap larva udang Artemia salina dan mengidentifikasi senyawa yang dikandungnya. Hasil partisi ekstrak kasar metanol buah makasar meliputi ekstrak n-heksana, diklorometana, dan n-butanol + metanol 50%. Ekstrak diklorometana paling toksik dengan nilai konsentrasi mematikan 50% sebesar 4.2 ppm. Fraksionasi dengan kromatografi kolom menghasilkan 21 fraksi. Fraksi 3 yang memiliki noda tunggal dicirikan dengan spektrofotometer inframerah tertransformasi Fourier dan kromatograf gas-spektrometer massa untuk mengidentifikasi kandungan senyawanya. Diperoleh 3 senyawa dominan dalam fraksi 3 yang merupakan golongan alkaloid dan fenolik, yaitu vanilin, 1,3-diasetilindol, dan 1-(1H -indol-3-il)-3-metilbut-2-en-1-on.
Kata kunci: antikanker, Brucea javanica, buah makasar, larva udang
ABSTRACT
RINA FAZILATUR RAHMI. Potency of Makasar Fruit (Brucea javanica) as Anticancer. Supervised by GUSTINI SYAHBIRIN and PURWANTININGSIH SUGITA.
Brucea javanica or makasar fruit is a plant having anticancer potency. This research aimed to obtain toxic fraction of makasar fruit against Artemia salina
shrimp larvae and identify the compounds. Partition of the fruit’s crude methanol extract resulted n-hexane, dichloromethane, and n-butanol + methanol 50% extracts. Dichloromethane extract was the most toxic extract with 50% lethal concentration value of 4.2 ppm. Fractionation of the extract with column chromatography gave 21 fractions. Fraction 3 having single spot was characterized using Fourier transformed infrared spectrophotometer and gas chromatograph-mass spectrometer to identify the compounds. Three dominant compounds were obtained in fraction 3, which were alkaloid and phenolic group, namely vanillin, 1,3-diacetylindole, and 1-(1H -indol-3-yl)-3-methylbut-2-en-1-one.
POTENSI BUAH MAKASAR (
Brucea javanica
) SEBAGAI
ANTIKANKER
RINA FAZILATUR RAHMI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Potensi Buah Makasar (Brucea javanica) sebagai Antikanker Nama : Rina Fazilatur Rahmi
NIM : G44080065
Disetujui oleh
Dr Gustini Syahbirin, MS Pembimbing I
Prof Dr Purwantiningsih Sugita, MS Pembimbing II
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT karena telah memberikan limpahan rahmat dan nikmat-Nya sehingga penulis dapat menyelesaikan penelitian dan tulisan ini. Shalawat serta salam selalu penulis junjungkan kepada Nabi Muhammad SAW yang telah menjadi suri teladan yang baik bagi umatnya. Penelitian dilakukan sejak Juni 2012 hingga Januari 2013 di Laboratorium Kimia Organik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Hasil penelitian dilaporkan dalam bentuk tulisan ilmiah yang berjudul Potensi Buah Makasar (Brucea javanica) sebagai Antikanker.
Penulis mengucapkan terima kasih kepada Mama, Ayah, Ka Linda, dan Ikhwan atas semua limpahan kasih sayang dan bantuan moral serta materi untuk kelancaran kuliah dan tugas akhir, kepada Dr Gustini Syahbirin, MS sebagai pembimbing pertama dan Prof Dr Purwantiningsih Sugita, MS sebagai pembimbing kedua atas bimbingan dan arahan selama penelitian. Terima kasih juga penulis ucapkan kepada Prof Dr Ir Suminar S. Achmadi sebagai Kepala Laboratorium Kimia Organik dan dosen pembimbing akademik yang selalu mendengarkan curahan hati penulis, Budi Arifin, SSi, MSi atas dukungan dan segala bantuan sebagai Komisi Pendidikan, dosen, sekaligus kakak tingkat yang baik, dan Pak Sabur atas nasihat dan pengalaman laboratoriumnya. Ucapan spesial diperuntukkan kepada Dumas Flis Tang, SSi dan Fadli Ahmad Muntaqo, SSi atas bantuan belajar selama masa kuliah dan penelitian, kepada Laras dan Ka Indra, teman susah dan senang satu bimbingan. Tidak lupa kepada teman-teman Laboratorium Kimia Organik: Toriq, Dwi, Egi, Ami, Ani, Livia, Riva’i, Indra, Kartika, Christine, Erik, Ade, Anna, Ka Ugi, Ka Ridho, Ka Fijar, Ka Ugi, dan Ka Lita, kepada teman-teman Kimia Ceunah, khususnya Retno, Itoh, dan Uni, serta kepada teman-teman Pocut Baren dan Arfin apresiasi penulis sampaikan atas semangat, dukungan, dan doa yang diberikan.
Kritik dan saran diharapkan untuk kesempurnaan karya ilmiah ini. Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Maret 2013
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
BAHAN DAN METODE 1
Alat dan Bahan 1
Lingkup Kerja 2
HASIL DAN PEMBAHASAN 4
Ekstraksi 4
Toksisitas Ekstrak Buah Makasar 5 Fitokimia Ekstrak Aktif Buah Makasar 5 Fraksi Ekstrak Diklorometana Hasil Kromatografi Kolom 6 Identitas Fraksi 3 Berdasarkan Spektrum FTIR 7 Identitas Fraksi 3 Berdasarkan Kromatogram GC-MS 8
SIMPULAN DAN SARAN 10
Simpulan 10
Saran 10
DAFTAR PUSTAKA 11
LAMPIRAN 13
DAFTAR TABEL
1 Hasil partisi ekstrak buah makasar 4 2 Fitokimia ekstrak diklorometana buah makasar 6 3 Serapan FTIR gugus-gugus fungsi fraksi 3 8 4 Komponen dominan pada fraksi 3 9
DAFTAR GAMBAR
1 Profil kromatogram dan nilai Rf ekstrak diklorometana (a) dan fraksi 3 (b)
dengan eluen terbaik kloroform-aseton (12:1) (deteksi dengan lampu UV
254 nm) 7
2 Spektrum FTIR fraksi 3 8
3 Kromatogram GC-MS fraksi 3 9 4 Struktur senyawa vanilin (a), 1,3-diasetilindol (b), dan 1-(1H
-indol-3-il)-3-metilbut-2-en-1-on (c) 9
DAFTAR LAMPIRAN
1 Diagram alir penelitian 13
2 Rendemen hasil maserasi dan partisi buah makasar 14
3 Nilai probit 14
PENDAHULUAN
Tumbuhan buah makasar (Brucea javanica) yang memiliki nama sinonim
B. amarissima Desv. merupakan tumbuhan perdu tegak setinggi 3 m (LIPI 1999; NoorShahida et al. 2009). Tumbuhan ini termasuk dalam dunia Plantae, filum Magnoliophyta, kelas Magnoliopsida, ordo Sapindales, dan famili Simaroubaceae (Plantamor 2012), merupakan tumbuhan asli Cina, Indonesia, India, dan Vietnam. Buahnya berbentuk bulat telur dengan ukuran ±8 mm dan berwarna hitam jika telah matang, memiliki rambut halus ketika masih muda. Daunnya majemuk, menyirip ganjil, dengan jumlah anak daun 511. Helaian anak daun berbentuk lanset memanjang, memiliki panjang 510 cm dan lebar 24 cm. Bunga majemuk berkumpul dalam rangkaian berupa gerombolan padat (WHO 1999).
Biji dan daging buah makasar merupakan sumber senyawa kuasinoid (Li
et al. 2009). Senyawa ini memiliki banyak kegunaan, seperti antikanker, antimalaria, antileukemia, antituberkulosis, antivirus, insektisida, fungisida, herbisida, amebisida, sitotoksik, antiprotozoa, dan antiradang (Dayan et al. 1999; NoorShahida et al. 2009). Tumbuhan ini juga mengandung alkaloid (brukamarina dan yatanina), bruseosida A dan B, fenol (brusenol dan asam bruseolat), brusatol, brusein A, B, C, E, F, G, dan H, asam linoleat, asam stearat, asam palmitoleat, dan terpenoid (Wijayakusuma 2004; Kim et al. 2004). Dua macam kuasinoid baru (javanikolida C & D dan javanikosida BF) terkandung di dalam biji buah makasar. Senyawa kuasinoid tersebut mampu menghambat sel kanker payudara (Li et al. 2009). NoorShahida et al. (2009) menemukan brusein D dan E dalam ekstrak n-butanol buah makasar. Senyawa ini mampu menurunkan kadar glukosa dalam darah. Brusein D juga berpotensi antikanker (Sin et al. 2009).
Salah satu organisme yang dapat digunakan untuk uji toksisitas adalah larva udang. Metode uji letalitas larva udang (BSLT), merupakan uji umum yang mampu memperkirakan sitotoksitas ekstrak kasar tumbuhan. Larva udang Artemia salina dijadikan bioindikator karena cukup peka terhadap toksin. Hasil uji BSLT berkorelasi positif dengan uji pada sel tumor karena kecepatan pertumbuhan larva
A. salina berbanding lurus dengan kecepatan pertumbuhan sel tumor (Meyer et al. 1982). Apabila pertumbuhan larva A. salina mampu dihambat oleh ekstrak buah makasar, analoginya sel tumor juga dapat dihambat oleh ekstrak tersebut. Berdasarkan korelasi ini, penelitian dilakukan untuk memperoleh fraksi buah makasar yang toksik terhadap larva A. salina dan mengidentifikasi senyawa dalam fraksi tersebut yang berpotensi antikanker.
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini antara lain alat-alat kaca, neraca analitik, oven, penguap putar, pelat KLT plastik silika gel 60 F254 dari
2
(GC-MS). Bahan-bahan yang digunakan meliputi sampel buah makasar dari Pariaman (Padang), metanol, etil asetat, n-heksana, diklorometana, kloroform,
n-butanol, etanol, aseton, pereaksi Mayer, Wagner, Dragendorf, dan Liebermann-Buchard, kloroform-amonia, H2SO4, NaOH, FeCl3, silika gel 60 untuk kolom,
dimetil sulfoksida (DMSO), dan larva A. salina.
Lingkup Kerja
Metode penelitian meliputi penyiapan dan partisi ekstrak buah makasar, uji toksisitas ekstrak terhadap larva A. salina, uji fitokimia, pemilihan eluen terbaik, fraksionasi ekstrak aktif dengan kromatografi kolom, serta pencirian senyawa bioaktif dengan FTIR dan GC-MS (Lampiran 1).
Penyiapan dan Partisi Ekstrak Buah Makasar (NoorShahida et al. 2009) Sebanyak 1.5 kg sampel buah makasar dikeringanginkan, digiling, dan direndam dalam metanol selama 48 jam pada suhu ruang. Ekstrak metanol disaring dan filtratnya dipekatkan dengan penguap putar pada suhu 40 °C.
Sebanyak 70 g ekstrak tersebut dipartisi dengan etil asetat-air (3:1). Ekstrak air dipartisi lebih lanjut dengan n-butanol, sedangkan ekstrak etil asetat dipekatkan dengan penguap putar, dipartisi kembali dengan n-heksana-metanol 90% (1:1). Ekstrak n-heksana dipekatkan dengan penguap putar dan ditimbang, ekstrak metanol 90% dipartisi kembali dengan diklorometana-metanol 50% (1:1). Ekstrak diklorometana dipekatkan dengan penguap putar dan ditimbang. Ekstrak metanol 50% digabungkan dengan ekstrak n-butanol, lalu dipekatkan dan ditimbang. Ekstrak n-heksana, diklorometana, dan ekstrak n-butanol + metanol 50% diuji toksisitasnya dan ekstrak yang paling aktif diuji fitokimia.
Uji Toksisitas Ekstrak terhadap Larva A. salina (Meyer et al. 1982)
Penetasan Telur A. salina. Telur A. salina diperoleh dari toko ikan Terang di daerah Jembatan Merah, Bogor. Telur ditetaskan dalam wadah berisi air laut yang telah disaring dan diaerasi. Penetasan dilakukan selama 48 jam dengan kondisi cukup cahaya. Setelah 48 jam, larva dapat digunakan.
Uji Toksisitas. Ekstrak pekat dibuat dalam konsentrasi 1000 ppm. Ekstrak ditambahkan DMSO apabila sulit larut dalam air laut. Uji toksisitas dilakukan pada larutan kontrol (0 ppm) serta larutan uji 10, 100, 250, 500, dan 750 ppm yang dibuat dari larutan induk 1000 ppm.
Larutan induk 1000 ppm diambil sebanyak 20, 200, 500, 1000, dan 1500 µL, masing-masing dimasukkan ke dalam vial yang berisi 10 ekor larva A. salina
dan air laut sehingga total volume di dalamnya 2 mL. Pengerjaan dilakukan 4 kali ulangan. Vial ditutup dan didiamkan selama 24 jam. Setelah 24 jam, larva
A. salina yang mati diamati dan dihitung. Data yang diperoleh dianalisis probit untuk ditentukan konsentrasi mematikan 50% (LC50)-nya.
Uji Fitokimia Ekstrak Aktif (Harborne 1987)
Uji Alkaloid. Sebanyak 0.1 g ekstrak aktif ditambahkan 10 mL kloroform-amonia 10% dan disaring. Filtrat ditetesi dengan H2SO4 2 M, dikocok, kemudian
3
berwarna) diteteskan ke lempeng tetes dan ditambahkan beberapa tetes pereaksi Mayer, Wagner, dan Dragendorf. Uji positif alkaloid berturut-turut menghasilkan endapan berwarna putih kekuningan, cokelat, dan jingga.
Uji Triterpenoid dan Steroid. Sebanyak 0.1 g ekstrak aktif dilarutkan dengan kloroform-air (1:1), kemudian dikocok dan didiamkan hingga terbentuk 2 lapisan. Lapisan bawah disaring, filtratnya diteteskan ke lempeng tetes, dikeringkan, dan ditambahkan pereaksi Lieberman-Buchard. Jika terbentuk warna merah/ungu, maka ekstrak positif mengandung triterpenoid; jika terbentuk warna hijau/biru, maka ekstrak positif mengandung steroid.
Uji Flavonoid dan Fenol. Sebanyak 0.1 g ekstrak aktif dilarutkan dengan kloroform-air (1:1), kemudian dikocok dan didiamkan hingga terbentuk 2 lapisan. Lapisan atas dibagi 2 untuk uji flavonoid dan fenol. Uji flavonoid dilakukan dengan menambahkan 0.1 g logam Mg, 1 mL HCl pekat, dan 1 mL n-amil alkohol. Uji positif flavonoid apabila terbentuk warna kuning atau jingga. Uji fenol dilakukan dengan menambahkan FeCl3 1% dan akan positif fenol apabila
terbentuk warna hijau atau biru/ungu.
Uji Saponin dan Tanin. Sebanyak 0.1 g ekstrak aktif dilarutkan dengan kloroform-air (1:1), kemudian dikocok dan didiamkan hingga terbentuk 2 lapisan. Lapisan bawah disaring, residunya dimasukkan ke dalam gelas piala, kemudian ditambahkan 5 mL akuades. Larutan dipanaskan hingga mendidih selama 5 menit, lalu dimasukkan ke dalam 2 tabung reaksi. Larutan pada tabung pertama dikocok secara vertikal sampai terbentuk buih, kemudian didiamkan selama 10 menit. Larutan ditambahkan HCl 2 N, kemudian didiamkan. Apabila buih tidak berubah, maka positif terdapat saponin. Larutan pada tabung ke-2 ditambahkan FeCl3 1%.
Apabila warna menjadi biru atau hitam kehijauan, maka positif terdapat tanin.
Penentuan Eluen Terbaik (Houghton dan Raman 1998)
Pelat KLT yang digunakan ialah pelat plastik silika gel 60 F254 dari Merck.
Ekstrak aktif ditotolkan pada pelat KLT, lalu dimasukkan ke dalam bejana kromatografi berisi eluen pengembang yang telah dijenuhkan selama waktu tertentu. Ekstrak dielusi hingga eluen pengembang mencapai batas eluen. Mula-mula digunakan eluen tunggal, Mula-mulai dari eluen nonpolar hingga polar, meliputi
n-heksana, diklorometana, kloroform, etil asetat, n-butanol, etanol, aseton, dan metanol. Elusi selanjutnya dilakukan dengan campuran 2 eluen dengan nisbah tertentu. Noda yang dihasilkan diamati dengan lampu UV 254 nm. Eluen terbaik ialah yang dapat mengelusi sampel hingga menghasilkan noda yang banyak dan terpisah dengan baik.
Fraksionasi Ekstrak Aktif dengan Kromatografi Kolom (Rouessac dan Rouessac 1994)
Kolom yang digunakan berdiameter 2.5 cm, dengan fase diam silika gel 60 dari Merck dan fase gerak kloroform, aseton, dan metanol yang digunakan secara gradien dengan nisbah tertentu. Sebanyak 60 g fase diam dikemas dengan kloroform selama semalam. Ekstrak aktif ditimbang ±1 g, dimasukkan ke dalam kolom, kemudian dialiri dengan pelarut gradien secara kontinu. Eluat ditampung setiap 5 menit dengan laju alir ±1 tetes/detik, diuji KLT dengan eluen terbaik dan dideteksi dengan lampu UV 254 nm. Noda dengan nilai faktor retensi (Rf) dan
4
ada lagi noda yang tampak pada uji KLT. Fraksi-fraksi dipekatkan, lalu ditimbang bobotnya masing-masing. Fraksi aktif dengan noda tunggal dianalisis lebih lanjut.
Pencirian Fraksi Aktif dengan FTIR
Gugus fungsi pada fraksi aktif dicirikan dengan menggunakan FTIR Spectrum One Perkin Elmer pada bilangan gelombang 4004500 cm-1.
Pencirian Fraksi Aktif dengan GC-MS
Fraksi aktif diinjeksikan ke dalam GC-MS Shimadzu QP-5050A dengan kolom kapiler HP-5MS berukuran 0.25 mm 30 m 0.25 µm dan gas pembawa helium dengan laju alir 1.0 mL/menit. Suhu maksimum kolom 350 °C, suhu oven 70 °C dengan suhu maksimum 325 °C, dan waktu proses 44.67 menit. Suhu injektor split 290 °C dengan laju alir 47.9 mL/menit, tekanan 5.89 psi, dan volume injeksi 1 µL. Suhu detektor 250 °C, energi ionisasi 69.922 eV, dan kisaran bobot molekul 50800 m/z. Identifikasi senyawa dilakukan dengan membandingkan puncak spektrum massa dengan yang terdapat di dalam pustaka MS Wiley Library. Persen komposisi dihitung berdasarkan luas puncak kromatogram.
HASIL DAN PEMBAHASAN
Ekstraksi
Bagian tumbuhan buah makasar yang dipilih sebagai sampel adalah buahnya karena bagian tersebut sering digunakan sebagai obat disenteri ameba, malaria, wasir, dan keputihan oleh masyarakat Indonesia (Wijayakusuma 2004). Buah utuh diekstraksi dengan metode maserasi, yaitu ekstraksi tanpa pemanasan untuk mencegah rusaknya komponen kimia yang tidak tahan panas. Pelarut organik metanol digunakan karena mampu mengekstraksi berbagai komponen metabolit sekunder yang bersifat polar dan nonpolar. Kim et al. (2003), Syahputra (2008), Sayekti dan Widiyantoro (2009), serta Peteros dan Uy (2010) juga menggunakan metanol untuk mengekstraksi buah makasar dalam penelitiannya.
Partisi ekstrak buah makasar dilakukan dengan pelarut nonpolar hingga polar. Variasi kepolaran digunakan agar komponen dalam ekstrak dapat terdistribusi ke pelarut yang kepolarannya sesuai dengan kepolaran komponen. Partisi ini menghasilkan komponen yang larut dalam n-heksana, diklorometana, dan n-butanol + metanol 50% (Lampiran 1). Rendemen tertinggi diperoleh pada ekstrak n-heksana, yaitu 41.42% (Tabel 1). Tingginya rendemen tersebut karena tumbuhan ini banyak mengandung komponen nonpolar pada buahnya (Wijayakusuma et al. 1994).
Tabel 1 Hasil partisi ekstrak buah makasar
Pelarut Rendemen (% b/b)* Warna ekstrak pekat
n-Heksana 41.42 Kuning
Diklorometana 2.52 Hijau tua
n-Butanol + metanol 50% 14.68 Cokelat tua
5
Toksisitas Ekstrak Buah Makasar
Uji toksisitas dengan metode BSLT dilakukan terhadap ekstrak n-heksana, diklorometana, dan n-butanol + metanol 50%. Metode BSLT merupakan uji pendahuluan toksisitas suatu komponen aktif yang ditentukan berdasarkan nilai LC50. Telur A. salina diinkubasi terlebih dahulu selama 48 jam hingga menetas
dan sel larva telah optimum untuk digunakan dalam uji toksisitas. Larva A. salina
digunakan sebagai organisme uji karena pengerjaannya relatif murah, mudah, cepat, dan tidak memerlukan kondisi aseptis (Meyer et al. 1982).
LC50 ditentukan dari persamaan garis regresi linear antara log konsentrasi
ekstrak dan nilai probit. Nilai probit digunakan dalam toksikologi untuk menentukan toksisitas relatif bahan kimia terhadap organisme hidup dan responsnya dapat berupa kematian organisme tersebut. Nilai kematian dikonversi menjadi persentasenya, lalu dikonversi menjadi nilai probit (Lampiran 3). LC50
ekstrak n-heksana tidak dapat ditentukan karena sebagian besar larva A. salina
tidak mati setelah penambahan ekstrak sehingga dapat dikatakan ekstrak ini tidak toksik terhadap larva A. salina (Lampiran 4). Ekstrak diklorometana memiliki nilai LC50 4.1991 ppm. Setengah populasi larva A. salina telah mati pada
konsentrasi tersebut dan mati semua pada konsentrasi 100 ppm (Lampiran 5). LC50 ekstrak n-butanol + metanol 50% 25.3571 ppm, yang berarti setengah
populasi larva telah mati pada konsentrasi tersebut. Berbeda dengan ekstrak diklorometana, ekstrak n-butanol + metanol 50% dengan konsentrasi 100 ppm masih menyisakan 1 larva hidup. Ekstrak ini dapat mematikan seluruh populasi larva A. salina pada konsentrasi 250 ppm (Lampiran 6).
Ekstrak diklorometana dan ekstrak n-butanol + metanol 50% tergolong sangat toksik terhadap larva A. salina karena memiliki nilai LC50 < 1000 ppm
(Meyer et al. 1982). Ekstrak diklorometana lebih toksik lagi karena nilai LC50-nya
lebih kecil. Tingginya toksisitas ekstrak diklorometana juga dapat dilihat dari kemampuan ekstrak tersebut mematikan seluruh populasi larva pada 100 ppm, sementara ekstrak n-butanol + metanol 50% baru mematikan seluruh populasi larva pada 250 ppm. Oleh sebab itu, ekstrak diklorometana dipilih untuk difraksionasi lebih lanjut dengan kromatografi kolom.
Kematian larva A. salina memberikan informasi awal mengenai potensi ekstrak sebagai antikanker. Walaupun uji toksisitas ini tidak spesifik untuk antikanker, hasil uji menunjukkan korelasi yang signifikan antara konsentrasi ekstrak dan kematian larva A. salina (Mukhtar et al. 2007).
Fitokimia Ekstrak Aktif Buah Makasar
6
Tabel 2 Fitokimia ekstrak diklorometana buah makasar
Golongan metabolit sekunder Hasil
Alkaloid + menunjukkan intensitas warna atau endapan
Uji steroid memberikan hasil positif ditandai dengan terbentuknya warna hijau saat penambahan pereaksi Lieberman-Buchard. Triterpenoid tidak terdeteksi karena tidak terbentuk warna merah atau ungu. Hal ini dapat disebabkan triterpenoid tidak larut dalam diklorometana. Faktor lain seperti sedikitnya jumlah sampel yang digunakan dan perbedaan lokasi tumbuh juga menentukan keberadaan metabolit sekunder tersebut (Wagih etal. 2008).
Ekstrak diklorometana juga positif terhadap uji flavonoid, ditandai dengan terbentuknya warna kuning setelah penambahan Mg, HCl pekat, dan n-amil alkohol. Sari (2010) dan Roswiem et al. (2012) menyatakan bahwa flavonoid juga terdapat pada ekstrak air buah makasar. Ekstrak diklorometana berwarna hijau tua setelah penambahan FeCl3 yang mengindikasikan adanya fenol hidrokuinon.
Sementara itu, uji saponin dan tanin menunjukkan hasil negatif. Tidak terbentuk buih setelah pengocokan dan tidak terbentuk warna hijau setelah penambahan FeCl3 (Lampiran 7).
Fraksi Ekstrak Diklorometana Hasil Kromatografi Kolom
Eluen terbaik ditentukan sebelum fraksionasi ekstrak diklorometana dengan kromatografi kolom. Beberapa pelarut tunggal diujikan mulai dari pelarut nonpolar hingga polar (Lampiran 8). Pencampuran 2 eluen selanjutnya dilakukan berdasarkan noda yang terbentuk dengan eluen tunggal. Eluen yang sedikit menggerakkan komponen (agak tertahan), yaitu n-heksana, diklorometana, dan kloroform dicampurkan dengan eluen yang menggerakkan komponen hingga mendekati batas eluen (etil asetat, aseton, dan metanol). Eluen campuran yang diujikan meliputi diklorometana-metanol, diklorometana-etil asetat, n-heksana:etil asetat, dan kloroform-etil asetat (masing-masing dengan nisbah 1:9 hingga 9:1). Campuran diklorometana-aseton (1:1 hingga 20:1) juga diujikan (Li et al. 2009). Penggantian diklorometana dengan kloroform yang memiliki kepolaran hampir sama menghasilkan pola noda yang mirip (Lampiran 8).
7
khas seperti vanilin dan memiliki noda tunggal pada kisaran nilai Rf ekstrak
diklorometana (Gambar 1). Gambar 1(a) menunjukkan bahwa ekstrak diklorometana terpisah dengan baik menjadi 4 noda bagian atas dan 3 noda bagian bawah yang belum terpisah dengan sempurna menggunakan eluen terbaik kloroform-aseton (12:1). Gambar 1(b) menunjukkan fraksi 3 dengan noda tunggalnya yang berada pada kisaran nilai Rf ekstrak diklorometana.
Rf Rf
Gambar 1 Profil kromatogram dan nilai Rf ekstrak diklorometana (a) dan fraksi 3
(b) dengan eluen terbaik kloroform-aseton (12:1) (deteksi dengan lampu UV 254 nm)
Noda pada fraksi 3 memiliki nilai Rf 0.79, hampir sama dengan noda ke-3
pada ekstrak diklorometana. Kemiripan tersebut mengindikasikan fraksi 3 memiliki komponen yang sama dengan noda ke-3 ekstrak diklorometana. Fraksi yang berisi noda tunggal ini dicirikan dengan spektrofotometer FTIR dan GC-MS untuk mengidentifikasi senyawa aktif yang terkandung di dalamnya.
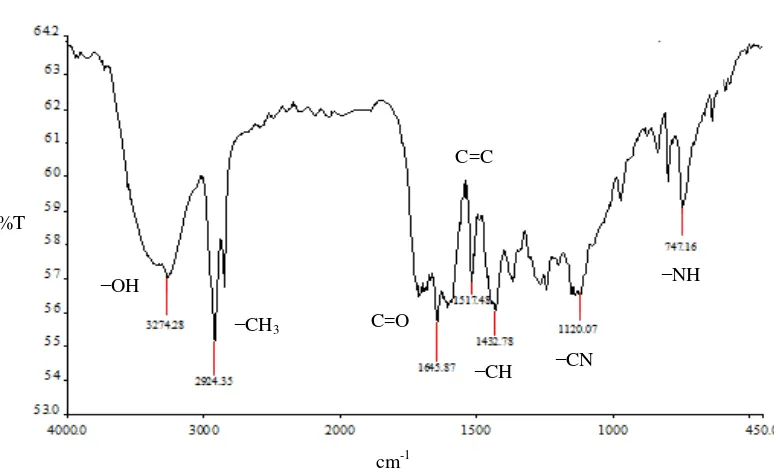
Identitas Fraksi 3 Berdasarkan Spektrum FTIR
Spektrum FTIR fraksi 3 (Gambar 2) menunjukkan gugus –OH yang berikatan hidrogen pada bilangan gelombang 3274.28 cm-1. Bentuk puncak tersebut tidak terlalu tajam dan lebar, kemungkinan dipengaruhi oleh gugus –NH yang berada di kisaran bilangan gelombang yang sama. Gugus –NH ini didukung oleh munculnya serapan energi pada bilangan gelombang 747.16 cm-1 untuk tekuk
8
%T
cm-1
Gambar 2 Spektrum FTIR fraksi 3
Tabel 3 Serapan FTIR gugus-gugus fungsi fraksi 3
Bilangan gelombang (cm-1) Literatur* Gugus dugaan
3274.28 36503200 Regang ̶ OH
2924.35 30002850 Regang ̶ CH alifatik
1645.87 16801630 Regang C=O
1517.48 16001475 Regang C=C aromatik
1432.78 ±1465 Tekuk ̶ CH
1120.07 13501000 Regang ̶ CN alifatik
747.16 Dekat dengan 800 Tekuk ̶ NH
*) Sumber: Pavia et al. (2001)
Analisis spektrum FTIR menunjukkan bahwa fraksi 3 diduga mengandung golongan alkaloid dan fenolik. Pendugaan tersebut diperkuat dengan hasil uji fitokimia yang positif pada kedua golongan senyawa tersebut.
Identitas Fraksi 3 Berdasarkan Kromatogram GC-MS
9
Intensitas c
a b
Waktu retensi (menit)
Gambar 3 Kromatogram GC-MS fraksi 3
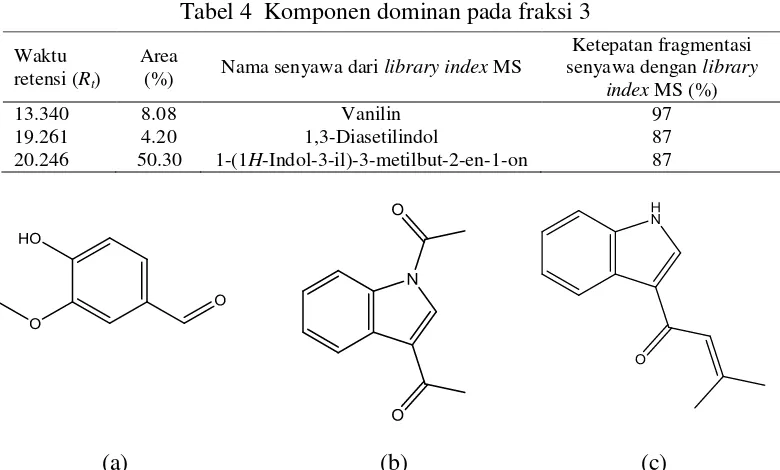
Tabel 4 Komponen dominan pada fraksi 3
Waktu retensi (Rt)
Area
(%) Nama senyawa dari library index MS
Ketepatan fragmentasi senyawa dengan library
index MS (%)
13.340 8.08 Vanilin 97
19.261 4.20 1,3-Diasetilindol 87
20.246 50.30 1-(1H-Indol-3-il)-3-metilbut-2-en-1-on 87
(a) (b) (c)
Gambar 4 Struktur senyawa vanilin (a), 1,3-diasetilindol (b), dan 1-(1H -indol-3-il)-3-metilbut-2-en-1-on (c)
Ketiga senyawa dominan tersebut diduga sebagai senyawa toksik dalam ekstrak diklorometana buah makasar. Toksisitasnya dapat dilihat dari nilai LC50
10
antimikrob karena mampu menghambat pertumbuhan Saccharomyces cerevisiae. Turunan vanilin memiliki aktivitas biologis sebagai antikanker, antiradang, antioksidan, antidiabetes, dan analgesik (Kumar et al. 2012). 1,3-Diasetilindol dan 1-(1H-indol-3-il)-3-metilbut-2-en-1-on merupakan senyawa alkaloid turunan indola. Alkaloid umumnya memiliki aktivitas antimikrob. Turunan indola memiliki berbagai aktivitas biologis, di antaranya sebagai antikanker dan antioksidan. Bioaktivitas ini terkait dengan substitusi gugus pada posisi ke-3 cincin pirola. Beberapa senyawa indola digunakan dalam pembuatan obat karena khasiat farmakologinya (Billes et al. 2009). Turunan alkaloid indola seperti kantin-6-on memiliki efek sitotoksik, antibakteri, serta dapat mengobati malaria, leukemia, dan karsinoma (Wagih et al. 2008).
Senyawa 1-(1H-indol-3-il)-3-metilbut-2-en-1-on paling dominan pada fraksi 3 dengan area 50.30%. Lampiran 11 menunjukkan spektrum massa senyawa tersebut dan analisis pola fragmentasinya. Puncak dasar dengan m/z 199 merupakan puncak ion molekul 1-(1H-indol-3-il)-3-metilbut-2-en-1-on. Fragmentasi 1 gugus –CH3 menghasilkan fragmen dengan m/z 184 dan 2 gugus
Ekstrak diklorometana buah makasar paling toksik terhadap larva A. salina, ditunjukkan dengan nilai LC50 terkecil, yaitu 4.2 ppm. Fraksionasi ekstrak
tersebut dengan kromatografi kolom menghasilkan fraksi aktif yang memiliki noda tunggal dengan nilai Rf 0.79. Spektrum FTIR menunjukkan dugaan
gugus-gugus fungsi senyawa alkaloid dan fenolik, sesuai dengan hasil iji fitokimia. Pencirian dengan GC-MS menghasilkan 3 senyawa dominan, yaitu vanilin, 1,3-diasetilindol, dan 1-(1H-indol-3-il)-3-metilbut-2-en-1-on yang berpotensi sebagai antikanker. Senyawa 1-(1H-indol-3-il)-3-metilbut-2-en-1-on paling dominan dengan area 50.30%.
Saran
11
DAFTAR PUSTAKA
Billes F, Podia PV, Mohammed-Ziegler I, Tosa M, Mikosch H, Dan-Florin I. 2009. Formyl- and acetylindols: vibrational spectroscopy of an expectably pharmacologically active compound family. Spectrochim Acta Part A. 74:1031-1045. doi:10.1016/jsaa.2009.08.044.
Dayan FE, Watson SB, Galindo JCG, Hernandez A, Dou J, McChesney JD, Duke SO. 1999. Phytotoxicity of quassinoids: physiological responses and structural requirements. Pest Biochem Physiol. 65:15-24. doi: pest.1999.2432.
Ganesya N. 2010. Aktivitas fraksi kloroform buah makasar (Brucea javanica (L.) Merr) sebagai inhibitor enzim -glukosidase [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Harborne JB. 1987. Metode Fitokimia. Padmawinata K, Soediro I, penerjemah; Niksolohin S, editor. Bandung (ID): ITB Pr. Terjemahan dari:
Phytochemical Method.
Houghton PJ, Raman A. 1998. Laboratory Handbook for the Fractionation of Natural Extract. London (UK): Chapman & Hall.
Kim IH, Suzuki R, Hitotsuyanagi Y, Takeya K. 2003. Three novel quassinoids, javanicolides A and B, and javanicoside A, from seeds of Brucea javanica.
Tetrahedron. 59:9985-9989. doi:10.1016/j.tet.2003.10.048.
Kim IH, Takashima S, Hitotsuyanagi Y, Hasuda T, Takeya K. 2004. New quassinoids, javanicolides C and D and javanicolides B-F, from seeds of
Brucea javanica. J Nat Prod. 67(5):863-868. doi:10.1021/np030484n. Kumar R, Sharma PK, Mishra PS. 2012. A review on the vanillin derivatives
showing various biological activities. Int J Pharm Tech Res. 4(1):266-279. [LIPI] Lembaga Ilmu Pengetahuan Indonesia. 1999. Koleksi Tumbuhan Obat
Kebun Raya Bogor. Vol ke-1 No 3. Hendrian, Hadiah JT, editor. Bogor (ID): UPT Balai Pengembangan Kebun Raya LIPI.
Li P, Chin YW, Chai HB, Tran NN, Soejarto DD, Kinghorn AD. 2009. Bioactivity-guided isolation of cytotoxic constituents of Brucea javanica
collected in Vietnam. J Bioorg Med Chem. 17(6):2219-2224. doi:10.1016/j.bmc.2008.10.076.
Meyer BN, Ferrigni NR, Putnam JE, Jacobsen LB, Nichols DE, McLaughlin JL. 1982. Brine shrimp: a convenient general bioassay for active plant constituents. J Med Plant Res. 45:31-34.
Mukhtar MA, Adnan AZ, Pitra MW. 2007. Uji sitotoksisitas minyak atsiri daun kamanggi (Ocimum basilicum I.) dengan metode brine shrimp lethality bioassay. J Sains Tek Far. 12(1).
NoorShahida A, Tin WW, Chee YC. 2009. Hypoglycemic effect of quassinoids from Brucea javanica (L.) Merr (Simaroubaceae) seeds. J Ethnopharmacol. 124:586-591. doi:10.1016/j.jep.2009.04.058.
Pavia DL, Lampman GM, Kriz GS. 2001. Introduction to Spectroscopy. Ed ke-3. Washington (US): Thomson Learning.
12
Plantamor. 2012. Buah makasar. [Internet]. [diunduh 2013 Mar 15]. Tersedia pada: http://www.plantamor.com/index.php?plant=229.
Roswiem AP, Kiranadi B, Bachtiar TSP, Ranasasmita R. 2012. Antihypertensive effect of Brucea javanica (L.) (Merr.) fruit extract. Makara J Sci. 16(2): 71-76.
Rouessac F, Rouessac A. 1994. Chemical Analysis Modern Instrumentation Methods and Techniques. Ed ke-2. West Sussex (UK): J Wiley.
Sari N. 2010. Potensi buah makasar (Brucea javanica (L.) Merr) sebagai inhibitor enzim -glukosidase [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Sayekti E, Widiyantoro A. 2009. Aktivitas anticacing senyawa bioaktif dari buah makasar (Brucea javanica L. (Merr)) terhadap Ascaris lumbricoides.
J Penel Univ Tanjungpura. 16(4).
Sin TL, Lin ZX, Yonghong L, Ming Z, Cheng CHK, Po SL. 2009. Brucein D induces apoptosis in pancreatic adenocarcinoma cell line PANC-1 through the activation of p38-mitogen activated protein kinase. J Can Lett. 281: 42-52. doi:10.1016/j.canlet.2009.02.017.
Syahputra E. 2008. Bioaktivitas sediaan buah Brucea Javanica sebagai insektisida nabati untuk serangga hama pertanian. Bul Littro. 19(1):57-67.
Wagih ME, Alam G, Wiryowidagdo S, Attia K. 2008. Improved production of the indole alkaloid canthin-6-one from cell suspension culture of Brucea javanica (L.) Merr. Ind J Sci Technol. 1(7).
[WHO] World Health Organization. 1999. WHO Monograph on Selected Medicinal Plants. Geneva (CH): WHO.
Wijayakusuma H, Dalimartha S, Wirian AS, Yaputra T, Wibowo B. 1994.
Tanaman Berkhasiat Obat di Indonesia. Ed ke-2. Jakarta (ID): Pustaka Kartini.
13
Lampiran 1 Diagram alir penelitian
Dikeringanginkan dan digiling Dimaserasi dengan metanol (48 jam, suhu kamar) Disaring dan dipekatkan
Dipartisi Dipekatkan
Dipartisi
Dipartisi
Dipekatkan Dipekatkan Dipekatkan
Dipartisi
Dipekatkan Dipekatkan
Uji letalitas larva udang (BSLT)
Uji fitokimia
Penentuan eluen terbaik
Fraksionasi dengan kromatografi kolom
Analisis FTIR dan GC-MS Ekstrak aktif buah makasar
Ekstrak etil asetat Ekstrak air Etil asetat-air (3:1)
n-Heksana-metanol 90%
(1:1) n-Butanol
Ekstrak n-heksana Ekstrak metanol 90% Ekstrak n-butanol
Ekstrak Diklorometana Ekstrak Metanol 50% Diklorometana-metanol 50%
(1:1)
Ekstrak metanol 50% + n-butanol Buah makasar
Ekstrak kasar
14
Lampiran 2 Rendemen hasil maserasi dan partisi buah makasar
Hasil maserasi
Rendemen ekstrak diklorometana (% b/b) =Bobot ekstrak diklorometana
15
Lampiran 4 Toksisitas ekstrak n-heksana terhadap larva A. salina
Konsentrasi (ppm)
Jumlah larva awal (ekor)
Jumlah larva
mati (ekor) Rerata % Kematian Nilai probit
16
Lampiran 5 Toksisitas ekstrak diklorometana terhadap larva A. salina
Konsentrasi (ppm)
Jumlah larva awal (ekor)
Jumlah larva
mati (ekor) Rerata % Kematian Nilai probit
0
17
Lampiran 6 Toksisitas ekstrak n-butanol + metanol 50% terhadap larva A. salina
Konsentrasi (ppm)
Jumlah larva awal (ekor)
Jumlah larva
mati (ekor) Rerata % Kematian Nilai probit
0
18
Lampiran 7 Fitokimia ekstrak diklorometana Golongan metabolit
sekunder Hasil uji
Alkaloid
(a)
(b)
Keterangan:
(a) Pereaksi alkaloid dari kiri: Mayer, Wagner, dan Dragendorf (b) Terbentuk endapan cokelat setelah ditambahkan pereaksi Wagner
Triterpenoid dan Steroid
Terbentuk warna hijau, tidak terbentuk warna merah atau ungu
Flavonoid
Terbentuk warna kuning
Fenol hidrokuinon
Terbentuk warna hijau
Saponin
Tidak terbentuk buih
Tanin
19
Lampiran 8 Hasil penentuan eluen terbaik ekstrak diklorometana
Eluen Tunggal
Penggunaan diklorometana bisa diganti dengan kloroform. Eluen terbaik yang diperoleh adalah kloroform-aseton (12:1)
20
Lampiran 9 Fraksi ekstrak diklorometana dengan kromatografi kolom
Fraksi ke- Jumlah noda Nilai Rf Bobot fraksi (g) Rendemen (% b/b)
Lampiran 10 Komponen dominan pada fraksi 3
Waktu
Nama senyawa dari library index MS
21
Lampiran 11 Spektrum MS senyawa 1-(1H-indol-3-il)-3-metilbut-2-en-1-on
Intensitas
m/z
m/z Struktur senyawa Fragmen yang hilang
199
-
184
77.1
22
lanjutan Lampiran 11
171
144
117
23
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 12 Juni 1989 dari Ayah Sjarbini dan Ibu Nurzaidah, SPd. Penulis merupakan anak kedua dari 3 bersaudara. Tahun 2008 penulis lulus dari Sekolah Menengah Analis Kimia Bogor (SMAKBo) dan pada tahun yang sama lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB dan diterima di Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum Kimia TPB pada tahun ajaran 2010/2011, 2011/2012, dan 2012/2013, asisten praktikum Kimia Fisik Layanan tahun ajaran 2011/2012, asisten praktikum Kimia Organik Layanan tahun ajaran 2011/2012, asisten praktikum Kimia Organik Kompetensi tahun ajaran 2011/2012, dan asisten praktikum Kimia Pangan Program Diploma 3 tahun ajaran 2012/2013. Penulis pernah mengajar mata kuliah Kimia Analitik Layanan di bimbingan belajar mahasiswa Katalis. Selain aktivitas akademik, penulis juga aktif di kegiatan organisasi sebagai staf Departemen Pengembangan Kimia dan Seni (PKS) Imasika dan Dewan Pengawas Imasika (DPI). Bulan JuliAgustus 2011 penulis melaksanakan praktik lapangan di Badan Tenaga Atom Nasional (BATAN) Jakarta dengan judul Penentuan Recovery Alfa dan Beta Total dengan Metode Sumber Tebal.
Penulis juga aktif mengikuti beberapa perlombaan tingkat mahasiswa. Beberapa prestasi yang diraih oleh penulis antara lain Juara II Lomba Penulisan Puisi SERSAN PULPEN BEM TPB IPB dengan judul Kasat Hati pada tahun 2009, Juara II Lomba Pekan Ilmiah FMIPA IPB bidang PKM Masyarakat dengan judul Introduksi Pembuatan Sabun Herbal Transparan di Majlis Ta’lim Desa Balumbang Jaya pada tahun 2010, proposal PKMP didanai oleh Dikti dengan judul Green Technology “Mix Chitosalt”: Inovasi Baru Mix Chitosan dan