INDUKSI DAN KARAKTER PERTUMBUHAN KALUS
TRIPLOID DARI KULTUR ENDOSPERMA
AVOKAD (
Persea americana
Mill.)
EDY SUKMARA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Induksi dan Karakter Pertumbuhan Kalus Triploid dari Kultur Endosperma Avokad (Persea americana
Mill.) benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor dan Puslit Biologi LIPI.
Bogor, Januari 2015
Edy Sukmara
RINGKASAN
EDY SUKMARA. Induksi dan Karakter Pertumbuhan Kalus Triploid dari Kultur Endosperma Avokad (Persea americana Mill.). Dibimbing oleh MARIA BINTANG dan LAZARUS AGUS SUKAMTO.
Buah avokad memiliki ukuran biji yang lebih dari seperempat volume daging buahnya, hal ini dapat menurunkan tingkat kepuasan konsumen. Salah satu inovasi dalam teknologi kultur jaringan dapat menjawab masalah tersebut dengan menghasilkan tanaman triploid. Kelebihan tanaman triploid adalah mampu tumbuh lebih cepat dan dapat menghasilkan buah tanpa biji. Tanaman triploid dapat dihasilkan dari persilangan tanaman diploid dan tanaman tetraploid, tetapi cara ini tidak praktis dan memerlukan waktu lama. Kultur in vitro endosperma avokad adalah cara alternatif untuk menghasilkan avokad triploid secara langsung. Penelitian ini merupakan tahap awal untuk mendapatkan tanaman avokad triploid, dan merupakan laporan ilmiah pertama tentang kultur endosperma avokad.
Diameter buah avokad dikelompokan menjadi empat kelompok, masing-masing: A=0,30-0,50 cm; B=0,51-1,00 cm; C=1,01-1,50 cm dan D=1,51-2,20 cm. Rancangan acak lengkap dengan pola faktorial antara faktor zat pengatur tumbuh (ZPT) dan diameter digunakan dalam penelitian ini. Media Murashige dan Skoog (MS) digunakan dengan tambahan ZPT picloram dan 2,4-D masing-masing dengan konsentrasi : 0,5; 1,0; 2,0; dan 4.0 dalam mg/l. Kultur endosperma avokad hanya dapat membentuk kalus apabila dalam kultur disertai dengan embrionya. Hasil penelitian menunjukan ukuran diameter buah avokad yang paling cepat membentuk kalus adalah kelompok B, dengan waktu tumbuh kalus tercepat 7,67 minggu setelah kultur (MSK). ZPT yang memiliki respon tumbuh kalus tercepat adalah picloram 2 mg/l yaitu 5,1 MSK. Interaksi antara ukuran diameter buah dan ZPT yang paling cepat untuk menumbuhkan kalus endosperma avokad adalah ukuran diameter buah kelompok A dan ZPT Picloram 2,0 mg/l. Pengaruh sitokinin yang diujikan terhadap induksi pertumbuhan dan diferensiasi kalus menunjukkan, secara berurutan dari yang memberikan pengaruh tinggi ke rendah adalah Thidiazuron, Benzyl Adenin, dan Kinetin, tetapi sampai 10 MSK diferensiasi kalus tidak terbentuk. Kalus endosperma avokad dibagi tiga bagian yaitu, atas, tengah dan bawah. Hasil pengukuran ploidi dengan flow cytometer menunjukkan kalus bagian tengah bersifat triploid,
SUMMARY
EDY SUKMARA. Induction and Growth Characteristics of Triploid Callus of Avocado (Persea americana Mill.) Endosperm Culture. Supervised by MARIA BINTANG an d LAZARUS AGUS SUKAMTO.
Avocado fruit has a seed size that is more than a quarter of the size of the volume of the flesh. This can reduce the level of consumer satisfaction. One of the innovations in the technology of tissue culture can answer these problems by producing triploid plants. The advantages of triploid plants are able to grow faster and can produce fruit without seeds. Triploid plants can be produced by crossing of diploid and tetraploid plants, but this is not practical and takes a long time. In vitro culture of endosperm avocado is an alternative way to produce triploid avocados directly. This study is an initial step to produce avocado triploid plants. It is the first scientific report on endosperm culture of avocados.
The diameter of avocado fruits were classified to four groups. These groups were A=0.30-0.50 cm, B=0.51-1.00 cm, C=1.01-1.50 cm and D=1.51-2.20 cm. The experiment was arranged in a completely randomized design. Treatments were a factorial combination of regulator (PGR) and fruits diameters. Murashige and Skoog (MS) medium was used with additional PGR of picloram and 2,4-D each at concentration : 0.5; 1.0; 2.0; and 4.0 mg/l. The avocado endosperm could produce callus only with the enclosure of avocados embryos. The most responsive diameter fruit size was B group , and the fastest callus growth occured 7,67 weeks after culture (WAC). The most responsive medium for endosperm callus induction were picloram 2 mg/l on 5,1 WAC. The fastest growing avocado endosperm callus was interaction of diameter A and picloram 2,0 mg/l. The most effective cytokinin to induce callus growth and differentiation was Thidiazuron, followed by Benzyl adenine, and Kinetin consecutively, but callus differentiation did not occurred. The ploidy level of endosperm callus was checked by using a flow cytometer, showing the middle layer of endosperm callus as triploid, whereas the upper and lower layers were diploid.
The aims of this study are to find out the suitable fruit diameter, enclosured embryo effect, and PGR to the avocado endosperm culture, as well as ploidy of the calli.
© Hak Cipta Milik IPB dan Puslit Biologi LIPI, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB dan Puslit Biologi LIPI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
INDUKSI DAN KARAKTER PERTUMBUHAN KALUS
TRIPLOID DARI KULTUR ENDOSPERMA
AVOKAD (
Persea americana
Mill.)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Induksi dan Karakter Pertumbuhan Kalus Triploid Pada Kultur Endosperma Avokad (Persea americana Mill.)
Nama : Edy Sukmara NIM : G 851110051
Disetujui oleh Komisi Pembimbing
Prof Dr drh Maria Bintang, MS Ketua
Prof Dr Ir Lazarus Agus Sukamto, MSc Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof Dr drh Maria Bintang, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 27 Oktober 2014
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Ilahi Rabi atas segala rahmat, berkah, dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Sholawat dan salam semoga selalu tercurah kepada Nabi Muhammad SAW, keluarga, sahabat dan para pengikutnya hingga akhir zaman.
Tema tesis ini tentang kultur in vitro jaringan endosperma avokad, karena dari berbagai eksplan yang dikultur saat ini, hanya eksplan endosperma yang dapat menghasilkan tanaman triploid, dan umumnya tanaman triploid tanpa biji. Langkah awal untuk mendapatkan avokad triploid adalah mengeksplorasi karakter kultur endosperma avokad secara in vitro. Penelitian ini bertujuan mendapatkan informasi ilmiah faktor-faktor yang mempengaruhi keberhasilan kultur endosperma avokad, yang nantinya diharapkan dapat menjadi referensi untuk penelitian khususnya tentang kultur endosperma avokad.
Terima kasih penulis ucapkan kepada Ibu Prof Dr drh Maria Bintang, MS dan Bapak Prof Dr Ir Lazarus Agus Sukamto, MSc selaku pembimbing, serta rekan-rekan di Laboratorium kultur jaringan dan laboratorium genetik Puslit Biologi LIPI Cibinong yang telah banyak memberi saran dan masukan yang sangat bermanfaat. Di samping itu, penghargaan penulis sampaikan kepada Bapak Syabar Suwardiman selaku Kepala SMA Bina Bangsa Sejahtera Bogor (periode 2008-2014) dan rekan-rekan guru yang selalu memberikan dorongan semangat untuk menyelesaikan penelitian ini. Ungkapan terima kasih juga disampaikan kepada Istri, anak-anak tercinta, ayah, ibu, serta seluruh keluarga, atas segala doa dan dorongan semangat untuk menyelesaikan penelitian ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2014
DAFTAR ISI
Penyertaan embrio terhadap induksi dan pertumbuhan kalus endosperma
9 Ukuran diameter buah terhadap pertumbuhan kalus
ZPT auksin terhadap pertumbuhan kalus
10 11 Interaksi diameter buah dan ZPT terhadap pertumbuhan kalus 12 ZPT sitokinin terhadap pertumbuhan dan diferensiasi kalus 13
DAFTAR TABEL
1 Pertumbuhan eksplan embrio, endosperma serta gabungan embrio dan endosperma terhadap pertumbuhan kalus 15 MSK.
9
berat basah kalus eksplan gabungan embrio+endosperma diukur setiap 2 minggu selama 10 minggu ( gram).
14 2 Perbedaan respon pertumbuhan kalus berdasarkan perbedaan
eksplan yang digunakan, pengamatan sampai 15 MSK
10 3
4 5
Kultur kalus endosperma avokad pada media dengan ZPT Kinetin 2 mg/l (K2), Thidiazuron 2 mg/l (T2) dan Benzyl adenin 2 mg/l (B2).
DAFTAR SINGKATAN
2,4-D : 2,4- Dichlorophenoxyacetic acid
BA : 6-Benzylaminopurin
Kinetin : 6-Furfurilaminopurin
LAF : laminar air flow
MS : Murashige and Skoog
MSK : minggu setelah kultur
PGR : plant growth regulator
PI : Propidium iodide
Picloram : 4-Amino-3,5,6- tri-chloropicolinic acid SPSS : Statistical Product and Service Solution TDZ/ Thidiazuron : N-Phenyl-N1-1,2,3,-thiadiazol-5-ylurea
WAC : weeks after culture
1
1 PENDAHULUAN
Latar Belakang
Avokad (Persea americana Mill.) merupakan buah bergizi tinggi dan banyak diminati, karena rasa yang enak, kandungan nilai nutrisi yang tinggi, dan beragam manfaatnya. Kandungan nutrisi alam avokad meliputi: karbohidrat, lemak, protein, serat, vitamin A, B, C, dan E, serta mengandung mineral besi, kalsium, fospor, natrium, kalium, folat, lutein, beta-sitosterol (Pieterse et al.
2003). Beberapa manfaat buah avokad untuk kesehatan antara lain: menurunkan resiko jantung koroner, meningkatkan kinerja mata, meningkatkan daya tahan terhadap penyakit, agen anti kolesterolemia (Pieterse et al. 2003). Kandungan gizi yang tinggi menyebabkan avokad sangat baik untuk kesehatan, akibatnya permintaan buah avokad terus meningkat.
Avokad umumnya memiliki biji yang besar, yaitu lebih dari seperempat volume daging buahnya. Hal ini dapat menurunkan tingkat kepuasan konsumen dalam mengkonsumsi buah avokad. Perakitan tanaman avokad triploid diharapkan akan menghasilkan buah avokad tanpa biji. Keuntungan yang didapat dari avokad tanpa biji adalah meningkatkan daya tarik konsumen (Pardal 2009). Keuntungan lain yang diperoleh dari tanaman triploid yaitu pertumbuhan vegetatif lebih vigor dibandingkan tanaman diploidnya (Thomas and Chaturvedi 2008).
Secara terminologi, yang dimaksud tanaman triploid adalah tanaman yang inti selnya memiliki tiga set kromosom. Ini berbeda dengan tanaman diploid (normal), yang memiliki dua set kromosom. Secara teknis tanaman triploid dapat dihasilkan melalui beberapa cara yaitu: persilangan tanaman diploid dengan tetraploid (hasil penggandaan kromosom), kultur endosperma, fusi protoplas haploid dengan diploid, kultur tepung sari, induksi radiasi sinar gamma, dan induksi kolkisin dan oryzalin. Diantara keenam teknik tersebut, kultur endosperma adalah metode yang lebih efisien untuk mendapatkan tanaman triploid (Sukamto 2013). Kultur in vitro endosperma avokad memerlukan waktu yang lebih singkat dibandingkan penyilangan antara tanaman tetraploid dengan diploid. Waktu juvenil avokad yang cukup lama, serta tingkat gugur bunga dan buah sangat tinggi mencapai lebih dari 98% (Sedgley 1980), merupakan kendala untuk mendapatkan avokad triploid dengan cara penyilangan. Salah satu tahapan untuk mendapatkan avokad triploid adalah induksi dan diferensiasi kalus endosperma avokad.
Salah satu inovasi baru dalam kultur jaringan adalah dengan memanfaatkan eksplan berbagai tanaman. Sampai saat ini, dari berbagai eksplan yang sudah dikultur, hanya eksplan endosperma yang dapat menghasilkan tanaman triploid (Sukamto 2013). Beberapa penelitian kultur in vitro endosperma telah menghasilkan tanaman triploid seperti: Citrus spp. (Gmitter et al. 1990),
Acacia nilotica (Garg et al. 1996), Mallotus philippensis (Sehgal and Abbas 1996), Actinidia spp. (Machno and Przywara 1997), Morus alba (Thomas et al. 2000), Azadirachta indica (Chaturvedi et al. 2003), Actinidia deliciosa
2
Menurut Sukamto (2010), keberhasilan kultur endosperma secara in vitro dipengaruhi oleh beberapa faktor, diantaranya umur endosperma, penyertaan embrio dalam kultur, pencoklatan (browning), dan umur kultur. Berdasarkan hal tersebut, metode penelitian ini juga dilakukan dengan pengujian faktor-faktor tersebut, khususnya dalam melakukan kultur in vitro endosperma avokad.
Setiap tanaman buah memiliki umur endosperma tertentu yang memilki endosperma. Beberapa penelitian melaporkan bahwa kultur endosperma ada yang berhasil tanpa penyertaan embrio pada buah Citrus grandis dan C.
sinesis (Wang and Chang 1978), pir (Zhao 1988), sedangkan pada penelitian lain kultur endosperma hanya berhasil jika ada penyertaan embrio pada kultur endosperma Croton, Ricinus, dan Putranjiva (Srivastava 1982). Adapun kultur endosperma cendana dapat tumbuh dengan atau tanpa penyertaan embrio (Lakhsmi 1987). Pada kultur in vitro endosperma avokad, belum ada informasi yang menjelaskan umur endosperma yang tepat serta penyertaan embrio untuk induksi kalus endospermanya.
Tanaman avokad di Indonesia umumnya masih sebagai tanaman pekarangan, khususnya di daerah Bogor, tanaman avokad belum ditanam dalam perkebunan yang luas. Hal ini menjadi kendala yang cukup berarti dalam mengumpulkan sampel endosperma buah avokad dalam jumlah banyak dengan umur tertentu. Selain itu, tingginya tingkat gugur buah pada avokad, menyebabkan penandaan umur pembungaan sering tidak bisa dilakukan, karena buahnya telah gugur lebih dahulu. Untuk itu dalam penelitian ini digunakan ukuran diameter buah yang merepresentasikan umur endosperma.
Pada penelitian ini digunakan media Murashige dan Skoog (MS), karena merupakan media yang banyak digunakan dalam kultur in vitro
endosperma (Hoshino et al. 2011). Senyawa 4-Amino-3,5,6- tri-chloropicolinic acid (picloram), digunakan dalam kultur in vitro embrio avokad (Witjaksono and Litz 1999), dan Zat Pengatur Tumbuh (ZPT) yang sama digunakan dalam penelitian. Alasan penggunaaan picloram karena ada persamaan eksplan yang digunakan dalam penelitian ini yaitu menggunakan embrio buah avokad. Adapun penggunaan asam 2,4- dichlorophenoxyacetic acid (2,4-D) sebagai pembanding dari ZPT yang digunakan, karena 2,4-D merupakan ZPT yang umum digunakan dalam menginduksi kalus endosperma tanaman dikotil (Suryowinoto 1996).
3
Dalam kultur jaringan, menginduksi terbentuknya kalus merupakan langkah yang penting. Setelah terbentuknya kalus, kemudian diberikan perlakuan atau rangsangan untuk berdiferensiasi membentuk akar atau tunas. Kalus avokad dapat diperoleh dengan menggunakan berbagai eksplan, misalnya : tunas muda, daun, ujung akar, buah, bagian bunga (Yassen 1993). Penelitian ini mencoba menginduksi kalus dari eksplan endosperma avokad. Kultur endosperma avokad memiliki potensi besar untuk diteliti, karena dapat dikembangkan untuk memperoleh tanaman avokad triploid.
Pengukuran ploidi kalus yang terbentuk dapat menggunakan flow cytometer. Pada dasarnya alat ini merupakan penghitung fluorosensi partikel, yang mengukur intensitas fluorosensi dalam inti, intensitas fluorosensi sebanding dengan kandungan inti yang terukur dalam DNA. Nilai puncak intensitas fluorosensi (nilai tengah -X), mencerminkan rata-rata kandungan inti dalam DNA. Pada tahap awal dilakukan pengukuran standar. Sampel uji berupa daun dan embrio yang akan memiliki nilai flourosensi tertentu, dan nilai ini ditetapkan sebagai nilai standar sampel diploid. Berdasarkan nilai standar sampel diploid, jika nilai hasil pengukuran kalus dari eksplan gabungan embrio dan endosperma 1,5 kali lipat dari kandungan inti sampel diploid, maka sampel kalus yang diukur tersebut tergolong triploid.
Perumusan Masalah
Penelitian kultur jaringan dengan menggunakan berbagai eksplan dari avokad telah banyak dilaporkan, namun kultur in vitro menggunakan eksplan endosperma avokad, belum ada laporan. Penelitian ini diarahkan untuk mengeksplorasi faktor-faktor yang menentukan keberhasilan kultur in vitro
endosperma avokad. Penelitian ini diharapkan bisa menjawab pengaruh dari penyertaan embrio, ukuran diameter buah avokad, ZPT dan konsentrasi terhadap respon kecepatan tumbuhnya kalus endosperma avokad. Kalus hasil kultur endosperma yang terbentuk diukur plodinya menggunakan flow diferensiasi kalus endosperma avokad secara in vitro.
4
Manfaat Penelitian
Penelitian tentang induksi dan karakter pertumbuhan kalus triploid endosperma avokad, merupakan tahapan awal untuk mendapatkan avokad triploid. Pengembangan dari penelitian ini, dapat menghasilkan buah avokad tanpa biji. Buah tanpa biji umumnya memiliki harga yang lebih mahal, dan memiliki daya saing lebih tinggi dibanding buah yang memiliki biji. Selain itu, penelitian ini dapat memberikan tambahan informasi ilmiah khususnya tentang kultur in vitro endosperma avokad.
2 METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan di laboratorium kultur jaringan dan laboratorium genetik Puslit Biologi LIPI Cibinong, mulai bulan Oktober 2012 sampai dengan bulan Desember 2013.
Bahan
Bahan tanaman yang digunakan dalam penelitian ini adalah buah avokad varietas ijo bulat, yang berasal dari daerah Cikembang, kabupaten Sukabumi, Jawa Barat. Ukuran diameter buah yang digunakan dalam penelitian ini aminopurin (BA) dan N-Phenyl-N1-1,2,3,-thiadiazol-5-ylurea (Thidiazuron/TDZ). Sebagai sumber karbon dalam media digunakan sukrosa dan sebagai bahan pemadat digunakan agar-agar. Pengaturan pH media menggunakan HCl 1N dan KOH 1N. Bahan-bahan desinfektan yang digunakan adalah alkohol 70% dan 95% serta larutan clorox atau sunclean (Natrium hipoklorit). Bahan untuk pengujian ploidi meliputi : buffer staining, larutan Propidium Iodida (PI), larutan RNAse.
Alat
Alat-alat yang digunakan diantaranya peralatan gelas (gelas ukur, labu ukur, gelas piala, erlenmeyer, cawan petri, pipet, alat pengaduk dan botol kultur), timbangan analitik, pH-meter, autoklaf, laminar air flow cabinet, peralatan diseksi (pinset, gunting, skalpel, dan mata pisau), bunsen, rak kultur dan lampu. Pengukuran ploidi menggunakan flow cytometer (Partec GmbH, Jerman).
Prosedur Percobaan
5
avokad dalam kultur in vitro. Tahap ini terdiri dari 4 faktor yang diamati, yaitu penyertaan embrio dalam kultur endosperma avokad, penentuan diameter buah avokad, pemilihan ZPT auksin dan konsentrasinya yang paling cepat menumbuhkan kalus, dan ZPT sitokinin terhadap pertambahan berat kalus endosperma dan diferensiasinya. Tahap kedua adalah pengukuran ploidi kalus endosperma yang terbentuk dengan menggunakan alat flow cytometer
Sterilisasi
Sterilisasi dilakukan terhadap alat, air dan media kultur, lingkungan kerja dan bahan tanaman. Alat- alat yang berasal dari logam ( pinset, scalpel, dan lain-lain) serta petridish dan botol kultur terlebih dahulu disterilisasi dengan autoklaf. Alat- alat dibungkus dengan kertas atau alumunium foil, kemudian di autoklaf pada suhu 121°C dan tekanan 15 psi selama 30 menit. Sterilisasi botol kultur dilakukan dengan pencucian terlebih dahulu dengan detergen, kemudian dibilas dengan menggunakan air bersih, selanjutnya dimasukkan ke dalam larutan clorox selama 24 jam, terakhir dibilas dengan air bersih. Sterilisasi untuk botol yang terkontaminasi, terlebih dahulu harus diautoklaf , dibersihkan dari media dan sisa eksplan yang ada di dalamnya, kemudian direndam detergen, dicuci dan dibilas air bersih. Setelah itu direndam dengan larutan clorox selama 24 jam, lalu botol dibilas dan dikeringkan. Sebelum digunakan dalam penanaman, alat tanam seperti scalpel dan pinset disterilisasi kembali dengan dicelup ke dalam alkohol 95% dan dibakar di atas api spiritus.
Air dan media kultur disterilisasi dalam autoklaf sebelum digunakan. Media kultur cair yang sudah disiapkan, dimasukkan ke dalam erlemeyer dan ditutup dengan alumunium foil, kemudian dimasukkan ke dalam autoklaf selama 30 menit pada suhu 121°C dan tekanan 15 psi. Sterilisasi lingkungan kerja dilakukan di lingkungan umum maupun lingkungan khusus. Kebersihan lingkungan umum dilakukan dengan membatasi keluar masuk orang, dan membersihkan ruangan secara teratur. Sebelum dan sesudahnya tempat kerja disemprot alkohol 70% dan dilap dengan kertas tissue. Laminar air flow (LAF)
cabinet dinyalakan lampu ultravioletnya selama 0,5-1 jam sebelum penanaman. Selama penanaman, lampu ultraviolet dimatikan, sedangkan peniup udara (blower) dan lampu neon dalam keadaan menyala.
Buah avokad dicuci dengan air mengalir sampai kotoran atau debu yang menempel pada permukaan buah hilang. Sterilisasi dilakukan dengan merendam buah dalam klorox 10% selama 10 menit, klorox 5% selama 5 menit, kemudian buah dibilas dengan aquades steril sebanyak tiga kali (Sunyoto, 2010). Sebelum dikultur buah dicelup dalam alkohol 95%, dan dibakar pada api bunsen, kemudian masuk tahap selanjutnya yaitu penanaman eksplan.
Pembuatan media
6
C10H14N2Na2O82H2O (Na-EDTA 3,72 g/l), dan FeSO4 7H2O 2,78 g/l, larutan
stok ZPT picloram , 2,4-D, BA, TDZ dan Kinetin, serta stok larutan vitamin ( tiamin HCl 0,01 g/l, niasin 0,05 g/l, piridoksin HCl 0,05 g/l, glisin 0,2 g/l).
Media MS dibuat dengan memasukkan larutan stok makro sebanyak 10 ml ke dalam gelas kimia yang telah diisi aquades sebanyak 400 ml. Larutan stok mikro dimasukkan sebanyak 10 ml. Larutan stok Fe-EDTA dimasukkan sebanyak 10 ml dan larutan stok vitamin 5 ml, kemudian ditambahkan myo-inositol sebanyak 0,1 g, gula pasir sebanyak 30 g, dan agar-agar sebanyak 7 gr. Larutan ini ditambah aquades menjadi 1000 ml. Media ini digunakan sebagai media formulasi dasar sebagai kontrol. Untuk perlakuan induksi kalus ditambahkan ZPT auksin picloram atau 2,4-D, dengan konsentrasi 0,5 mg/l, 1,0 mg/l, 2,0 mg/l dan 4,0 mg/l. Untuk merangsang diferensiasi kalus ditambahkan ZPT sitokinin (BA, TDZ, atau Kinetin) dengan konsentrasi 1,0 mg/l, 2,0 mg/l, dan 4,0 mg/l. Sebelum memasukkan agar-agar, terlebih dahulu pH larutan disesuaikan pH nya supaya berkisar pada pH 5,7- 5,8, kemudian ditambahkan aquades sampai mencapai volume 1 liter.
Penanaman
Buah avokad dibelah membujur, bagian embrio, endosperma atau gabungan keduanya diambil sebagai eksplan. Eksplan kemudian ditanam dalam media inisiasi kalus. Suhu ruangan yang sesuai inkubasi diatur pada suhu 25 0C. Eksplan ditanam di botol kultur, dan disimpan dalam plastik kontainer (tempat gelap) dan sebagian pada rak kultur (tempat terang). Subkultur dilakukan sebulan sekali pada media yang sama. Proses penanaman dilakukan dalam LAF cabinet.
Eksplan ditanam dalam media MS. ZPT yang diujikan masing-masing dengan picloram dan 2,4-D dengan variasi konsentrasi masing-masing 0,5; 1,0; 2,0; dan 4,0 mg/l. Kalus yang terbentuk pada tahap inisiasi kemudian diregenerasikan dalam media kultur MS yang mengandung ZPT sitokinin yaitu BA, Kinetin, dan TDZ dengan konsentrasi : 1,0; 2,0; dan 4,0 mg/l.
Pengamatan
Peubah yang diukur dalam penelitian ini meliputi : waktu pembentukan kalus, persentase terbentuknya kalus, dan pertambahan berat basah kalus.
Pengamatan dilakukan meliputi beberapa aspek yaitu :
1. Membandingkan respon pertumbuhan kalus pada kultur eksplan embrio, endosperma dan gabungan embrio dan endosperma avokad. Pengamatan dilakukan tiap minggu sampai minggu ke 15.
2. Pengaruh ukuran diameter buah avokad terhadap respon pertumbuhan kalus. Pengamatan dilakukan terhadap kecepatan munculnya kalus
3. Pengaruh Picloram dan 2,4-D dengan konsentrasi 0,5; 1,0; 2,0; dan 4,0 mg/l terhadap pertumbuhan kalus. Pengamatan dilakukan mulai minggu ke-1 sampai minggu ke-16. Parameter yang diamati yaitu waktu terbentuknya kalus, dan persentase terbentuknya kalus.
7
Pengujian ploidi
Kalus endosperma avokad yang terbentuk pada penelitian tahap pertama, digunakan pada penelitian tahap ke dua. Pada tahap ini dilakukan pengukuran ploidi kalus endosperma menggunakan flow cytometer. Persiapan pengukuran meliputi pembuatan larutan staining dan tahap persiapan sampel.
Pembuatan larutan staining sebagai berikut : sebanyak 2 ml buffer staining dicampurkan dengan 12 µl larutan stok PI dan 6 µl larutan stok RNAse. Adapun tahap persiapan sampel tanaman yaitu kurang lebih sebanyak 0,5 cm2 kalus atau dari standar (daun muda avokad) disimpan dalam cawan Petri ukuran 55 mm2 (partec kode 04-2005), kemudian ditambahkan 500 µl ekstrak buffer. Sampel uji dicacah menggunakan silet selama 30 sampai 60 detik, diinkubasi selama 30-90 detik dalam ekstrak buffer, setelah itu sampel disaring menggunakan partec 50 µl cell trics disposable filter. Ditambahkan 2 ml larutan staining (dengan PI dan RNAse) dalam tabung tes, kemudian sampel diinkubasi selama 30-60 menit dan dijaga supaya tidak terkena cahaya, setelah itu dilakukan pengukuran.
Pengukuran ploidi dilakukan sebanyak 22 kali, meliputi sampel embrio sebanyak 4 ulangan, endosperma 3 ulangan, daging buah 2 ulangan, daun 2 ulangan, dan kalus yang terbentuk sebanyak 11 ulangan. Penentuan sampel kalus diambil berdasarkan bagian lapisan dari kalus (dibagi tiga, yaitu kalus bagian atas, tengah dan bawah). Untuk mendapatkan hasil pengukuran yang optimal selalu digunakan standar. Untuk tanaman diploid digunakan embrio atau daun avokad sebagai standar, sedangkan untuk standar tanaman triploid digunakan jaringan endosperma avokad yang langsung diambil dari buah yang masih muda dengan ukuran diameter buah 1 cm.
Rancangan percobaan dan analisis data
8
Model umum rancangan yang digunakan adalah sebagai berikut :
Yijk : Hasil pengamatan terhadap pertumbuhan kalus pada pengaruh kombinasi ukuran diameter dan ZPT ke-i dan kelompok ke- k
µ : Nilai tengah umum (rata-rata populasi) Ai : Pengaruh diameter buah ke-i
Bj : Pengaruh ZPT ke-j
(AB)ij : Pengaruh interaksi kombinasi diameter buah dan ZPT
Untuk mengetahui pengaruh yang diberikan, dilakukan uji F. Jika sidik ragam memberikan hasil pengaruh berbeda nyata, selanjutnya dilakukan uji Duncan untuk mengetahui beda perlakuan. Pengolahan data dilakukan menggunakan Statistical Product and Service Solution (SPSS) versi 22.
3 HASIL DAN PEMBAHASAN
Perkembangan endosperma umumnya dimulai sebelum perkembangan embrio. Endosperma pada tanaman Angiospermae terbentuk dari hasil pembuahan ganda (double fertilization), yaitu penyatuan dua sel sperma dengan sel-sel yang berbeda dalam kantung embrio. Satu sel sperma membuahi sel telur untuk membentuk zigot diploid (2n). Sel sperma yang lain menyatu dengan kedua inti polar membentuk endosperma triploid (3n). Endosperma tersebut mengandung banyak zat-zat makanan untuk pertumbuhan embrio, hingga endosperma habis ketika embrio tumbuh maksimal pada tanaman tergolong Dikotil, termasuk tanaman avokad.
Pada permulaan pembentukan buah avokad, dengan bertambahnya ukuran diameter buah, volume endosperma lebih besar dari embrio, kemudian menurun dengan meningkatnya ukuran buah (Gambar 1). Pada buah kelompok A, volume endosperma lebih besar dibandingkan embrionya. Pada buah kelompok B, volume endosperma dan embrio hampir sama, sedangkan pada buah kelompok C dan D, volume endospermanya lebih kecil dibandingkan embrionya. Pada buah avokad, pada tahap awal (buah kelompok A), rasio (nisbah) volume endosperma dibandingkan embrio adalah yang terbesar, diikuti kelompok B, C, dan D secara berurutan. Peristiwa ini terjadi karena pertumbuhan embrio memerlukan nutrisi makanan yang disediakan oleh endosperma. Perubahan yang terjadi, buah kelompok A memiliki volume endosperma terbesar dan makin lama makin mengecil (kelompok D), kebalikannya terjadi pada embrio, pada tahap awal volume embrio kelompok A adalah terkecil, kemudian semakin membesar dan embrio terbesar terjadi pada kelompok D.
9
Gambar 1. Perubahan ukuran endosperma dan embrio pada avokad kelompok A, B, C dan D (ket. 1 = embrio; 2 = endosperma; 3 = nuselus ; 4 = daging buah)
Penyertaan embrio terhadap induksi dan pertumbuhan kalus endosperma
Eksplan yang digunakan adalah embrio, endosperma atau gabungan embrio dan endosperma. Eskplan endosperma tidak membentuk kalus (0%), tetapi membentuk kalus dengan penyertaan embrio (44,85%), sedangkan eksplan embrio sendiri (tanpa disertai endosperma) dapat membentuk kalus 27,77% (Tabel 1).
Tabel 1. Pertumbuhan eksplan embrio, endosperma serta gabungan embrio dan endosperma terhadap waktu pertumbuhan kalus dalam MSK.
Jenis eksplan
Eksplan endosperma avokad tidak dapat membentuk kalus, tetapi membentuk kalus jika disertai dengan embrionya. Hasil yang sama juga terjadi pada kultur endosperma tanaman Azadirachta indica (Chaturvedi et al. 2003) dan
10
Kultur gabungan endosperma dan embrio membentuk kalus tertinggi karena adanya endosperma dapat memberikan nutrisi tambahan yang dapat meningkatkan pertumbuhan kalus embrio. Eksplan embrio atau gabungan embrio dan endosperma avokad memerlukan waktu tumbuh kalus tercepat yang sama, yaitu masing-masing 4 MSK, sedangkan waktu terlama tumbuh kalus terjadi pada eksplan gabungan embrio dan endosperma, yaitu 11 MSK dibandingkan pada eksplan embrio, yaitu 9 MSK (Tabel 1). Ilustrasi pembentukan kalus dari ketiga macam eksplan (Gambar 2).
Gambar 2. Perbedaan respon pertumbuhan kalus berdasarkan perbedaan eksplan yang digunakan, pengamatan sampai 15 MSK (keterangan: A=endosperma, B=embrio, C=gabungan endosperma dan embrio dalam media yang mengandung picloram 0,5 mg/l, tanda elip menunjukan eksplan endosperma yang tidak membentuk kalus )
Ukuran diameter buah terhadap pertumbuhan kalus
Persentase tumbuh kalus meningkat dari kelompok A ke B dan C, kemudian menurun pada kelompok D. Persentase tertinggi dicapai kelompok C yaitu 55,55%. Hal ini ada kaitannya dengan nisbah volume endosperma dan embrio buah avokad, dimana kelompok A memiliki nisbah tertinggi, yaitu volume endosperma lebih besar dibandingkan volume embrio, sehingga respon tumbuh kalus paling kecil. Adapun nisbah endosperma dan embrio optimal terjadi pada kelompok C, sehingga memiliki persentase tumbuh kalus paling tinggi.
Umur endosperma saat dikultur, umumnya sangat berpengaruh terhadap respon pertumbuhannya secara in vitro. Eksplan endosperma yang terlalu muda, atau telah melewati fase meristematisnya, tidak respon bila dikultur. Tiga aspek utama yang harus diperhatikan dalam seleksi bahan eksplan, yaitu genotipe, umur, dan kondisi fisiologis tanaman tersebut (Pierik, 1997). Umur endosperma dalam penelitian ini, direpresentasikan dengan ukuran diameter buah, yaitu makin besar ukuran diameter, berarti makin tua umur endosperma. Umumnya makin muda endosperma, makin respon membentuk kalus bila dikultur.
C
B
11
Rerata respon tumbuh kalus tercepat diperoleh dari buah kelompok B yaitu 7,67 MSK diikuti oleh kelompok C dan D, sedangkan yang paling lambat adalah buah kelompok A yaitu 9,42 MSK. Hal ini ada kaitannya dengan umur endosperma, yaitu kelompok A memiliki endosperma yang terlalu muda, sehingga sel-selnya belum respon ketika dikultur, sedangkan umur optimal terdapat pada diameter buah kelompok B (Tabel 2). 2,0 mg/l, yaitu 5,1 MSK, sedangkan pada ZPT 2,4-D terjadi pada konsentrasi 0,5 mg/l, yaitu 7,4 MSK. Ini menunjukkan ZPT auksin picloram lebih cepat dibandingkan 2,4-D, dalam pembentukan kalus endosperma avokad. Respon tumbuh kalus terlama terjadi pada konsentrasi 4,0 mg/l baik pada picloram maupun 2,4-D (Tabel 3).
12 waktu yang diperlukan untuk tumbuhnya kalus endosperma avokad. Beyl and Sharma (1983) mendapatkan hasil yang sama, yaitu picloram lebih cepat menumbuhkan kalus dibandingkan 2,4-D pada tanaman Gasteria dan Haworthia, tetapi Fitch et al. (1983) mendapatkan hasil sebaliknya yaitu picloram lebih lambat menumbuhkan kalus dibandingkan 2,4-D pada tanaman tebu. Peristiwa ini menunjukkan penggunaan eksplan tanaman yang berbeda memberikan pengaruh yang berbeda pula walaupun ZPT yang digunakan sama.
Pada induksi kalus endosperma avokad, penggunaan ZPT 2,4-D memiliki respon lebih cepat pada konsentrasi terendah. Respon tumbuh kalus tercepat pada semua kelompok buah terjadi pada konsentrasi 2,4-D 0,5 mg/l, yang merupakan konsentrasi terendah dalam penelitian ini. Semakin tinggi konsentrasi 2,4-D, maka semakin lama respon tumbuh kalusnya. Hasil yang berbeda terjadi pada induksi kalus remah dari daun ramin (Gonystylus bancanus), dimana dari kisaran konsentrasi 3,0 mg/l sampai dengan 5,0 mg/l, respon tumbuh kalus tertinggi terjadi pada konsentrasi 2,4-D yang tertinggi yaitu 5 mg/l (Yelnititis 2012). Peristiwa ini menunjukkan, perbedaan jenis tanaman pada kultur in vitro, memerlukan konsentrasi optimal yang berbeda.
Interaksi diameter buah dan ZPT terhadap pertumbuhan kalus
Interaksi ukuran diameter buah dan ZPT auksin terhadap respon pertumbuhan kalus, menunjukkan kombinasi diameter dan ZPT yang cepat dalam menumbuhkan kalus adalah diameter buah kelompok A dan kelompok B masing-masing dengan picloram 2,0 mg/l. Respon tercepat tumbuh kalus dihasilkan oleh ZPT yang sama, yaitu picloram 2,0 mg/l, sedangkan berdasarkan ukuran diameter buah terdapat dua kelompok yang memiliki respon cepat dalam menumbuhkan kalus (lampiran 6).
13
picloram 2,0 mg/l (d1Z3), diameter buah kelompok B dengan picloram 2,0 mg/l (d2Z3), dan diameter buah kelompok B dengan picloram 1,0 mg/l (d2Z2), sedangkan kombinasi yang menumbuhkan waktu terlama adalah diameter buah kelompok C dengan picloram 4,0 mg/l d3Z4 (lampiran 6) .
Interaksi antara diameter buah dan ZPT 2,4-D dapat menumbuhkan kalus tercepat dalam waktu 7 MSK, yaitu diameter buah kelompok A dengan 2,4-D 0,5 mg/l (d1Z5) dan diameter buah kelompok C dan 2,4-D 0,5 mg/l (d3Z5). Waktu tumbuh kalus terlama terjadi pada diameter buah kelompok A dengan 2,4-D 2,0 mg/l (d1Z7) dan dengan 2,4-D 4,0 mg/l (d1Z8) .
Berdasarkan hasil interaksi antara diameter kelompok buah dan ZPT yang digunakan, disimpulkan bahwa untuk mendapatkan respon tumbuh kalus yang cepat dapat menggunakan kombinasi dengan peringkat sebagai berikut : picloram 2,0 mg/l dan diameter buah kelompok A, picloram 2,0 mg/l dan diameter buah kelompok B, 2,4-D 0,5 mg/l dengan diameter buah kelompok A, 2,4-D 0,5 mg/l dengan diameter buah kelompok C.
ZPT sitokinin terhadap pertumbuhan dan diferensiasi kalus.
ZPT sitokinin adalah senyawa yang dapat meningkatkan pembelahan sel pada jaringan tanaman. Pemberian sitokinin ke dalam medium kultur jaringan diperlukan untuk menginduksi pertumbuhan dan perkembangan eksplan. Senyawa ini dapat meningkatkan pembelahan sel dan proliferasi pucuk, bahkan apabila ketersediaan sitokinin dalam jaringan terbatas, maka pembelahan sel dalam jaringan yang dikulturkan akan terhambat
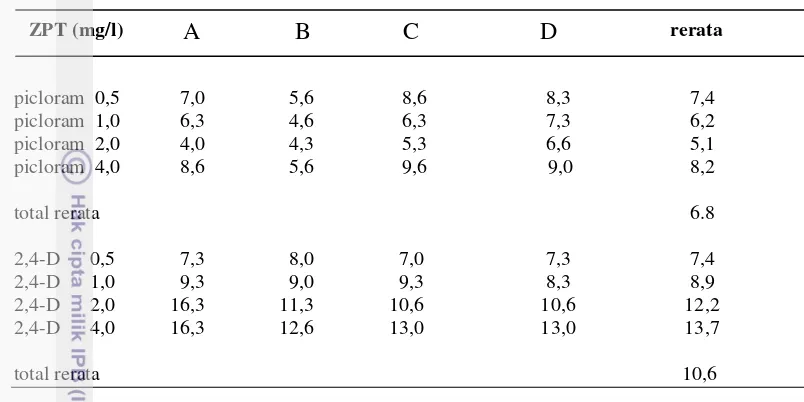
Untuk memperoleh diferensiasi kalus endosperma avokad yang tumbuh hasil induksi dengan ZPT picloram dan 2,4-D, kalus dikultur dalam media yang ditambahkan ZPT sitokinin. Sitokinin yang diujikan yaitu : kinetin, Benzyl adenin, dan thidiazuron, dengan masing-masing konsentrasi 1,0 mg/l, 2,0 mg/l, dan 4,0 mg/l. Pengujian kultur kalus dengan penambahan ZPT sitokinin sampai minggu kesepuluh tidak menghasilkan diferensiasi kalus, hanya menghasilkan pertambahan berat basah kalus saja. Rerata pertambahan berat kalus tertinggi dicapai oleh TDZ 2,0 mg/l yaitu 0,1410 gram dan berat terendah pada Kinetin 2 mg/l yaitu 0,0886 gram. Pada kelompok kinetin, rerata pertambahan berat kalus tertinggi terjadi pada kinetin 1,0 mg/l, dan terendah adalah kinetin 2,0 mg/l, sedangkan rerata pertambahan berat kalus untuk kelompok BA untuk ketiga konsentrasi yang diujikan mendapatkan hasil yang hampir sama. Hal ini sesuai dengan uji statistik konsentrasi BA terhadap pertambahan berat kalus yang tidak berbeda nyata. Adapun untuk kelompok TDZ rerata pertambahan berat kalus tertinggi dicapai oleh TDZ 2,0 mg/l dan terendah TDZ 1,0 mg/l (Tabel 4).
14 pertambahan berat kalus endosperma avokad, sejalan dengan penelitian lainnya. Huetteman and Preece (1993) menyebutkan TDZ paling aktif dalam menginduksi tunas dalam kultur jaringan beberapa tanaman dikotil. Menginduksi pertumbuhan tunas lebih baik dibandingkan sitokinin lainnya pada tanaman
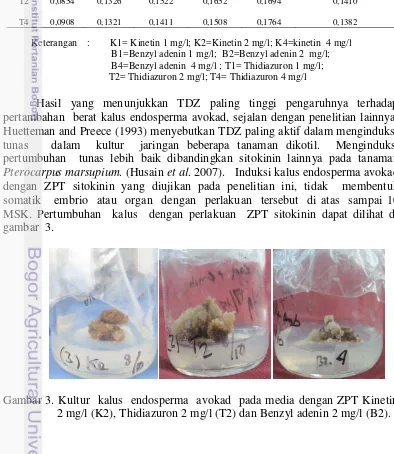
Pterocarpus marsupium. (Husain et al. 2007). Induksi kalus endosperma avokad dengan ZPT sitokinin yang diujikan pada penelitian ini, tidak membentuk somatik embrio atau organ dengan perlakuan tersebut di atas sampai 10 MSK. Pertumbuhan kalus dengan perlakuan ZPT sitokinin dapat dilihat di gambar 3.
15
Morfologi kalus
Struktur kalus dalam penelitian ini ada dua jenis, yaitu remah dan kompak. Kalus kompak terbentuk karena kalus mengalami lignifikasi sehinggga kalus tersebut mempunyai struktur keras dan kompak. Adapun kalus yang tumbuh terpisah-pisah menjadi bagian-bagian kecil dinamakan kalus remah. Berdasarkan warna, kalus endosperma avokad memiliki warna yang berbeda-beda, yaitu putih, kuning, krem dan hijau. Morfologi pembentukan kalus dari endosperma avokad dapat dilihat pada Gambar 4.
Gambar 4. Struktur dan warna kalus gabungan endosperma dan embrio avokad Keterangan : (A) struktur kalus remah (B) Struktur kalus kompak
(C) warna kalus kuning (D) warna kalus campuran krem dan putih
Setelah kalus endosperma avokad terbentuk, tahap selanjutnya adalah pembentukan embriogenesis somatik. Proses ini merupakan pembentukan embrio dari sel somatik tanpa melalui fusi gamet, sehingga tanaman yang terbentuk mempunyai sifat yang sama dengan tetuanya. Keuntungan dari embriogenesis somatik adalah embrio-embrio somatik yang dihasilkan bersifat bipolar, yakni memiliki ujung akar dan pucuk yang diperlukan bagi pertumbuhan tanaman lengkap. Pada penelitian ini belum diperoleh embrio somatik dari kultur kalus yang terbentuk, karena kalus yang dihasilkan, tidak memiliki ciri-ciri kalus embriogenik, dan sampai akhir kultur, tidak ada kalus yang mengalami diferensiasi. Kalus yang embriogenik dicirikan dengan warna kalus yang putih kekuningan dan mengkilat (Peterson and Smith, 1991). Shimizu et al.
(1997) menemukan kalus yang berwarna putih atau kekuningan dengan tekstur remah merupakan kalus yang kompeten membentuk embrio somatik.
Ploidi kalus endosperma avokad
Pada penelitian tahap ke dua, kalus yang terbentuk pada penelitian tahap satu diukur tingkat ploidinya menggunakan flow cytometer. Sebagai standar digunakan daun dan daging buah avokad yang bersifat diploid. Kalus endosperma avokad hanya dapat tumbuh dari penyertaan dengan embrio, maka kalus yang terbentuk berasal kedua jenis eksplan. Kalus tersebut dipisahkan secara horizontal menjadi tiga bagian, yaitu bagian atas, bagian tengah dan bagian bawah, diukur tingkat ploidinya menggunakan flow cytometer.
Hasilnya pengukuran menunjukkan kalus bagian atas (nilai tengah-x =237,27) dan bagian bawah (nilai tengah-x = 199,91) bersifat diploid, sedangkan
16
bagian tengah (nilai tengah-x=301,97; 296,86; dan 298,51) ketiganya bersifat triploid. Kalus yang triploid berarti berasal dari endosperma sedangkan yang diploid berasal dari embrio. Secara alami embrio adalah diploid, karena merupakan penggabungan dari sel gamet jantan dan sel gamet betina. Adapun endosperma, secara alami adalah triploid, karena terbentuk dari fertilisasi ganda, yaitu merupakan hasil penggabungan satu sel sperma dengan dua inti polar,
No. Nama sampel Nilai tengah-x CV% tingkat ploidi
1. Embrio 207,33 8,93 Diploid
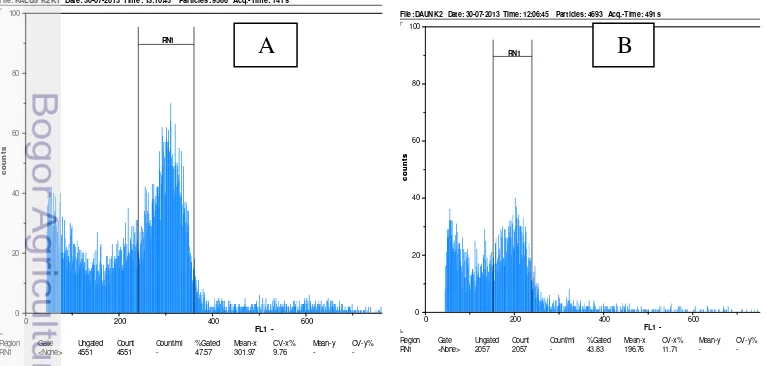
Hasil pengukuran flow cytometer menunjukkan kalus endosperma avokad yang diukur pada penelitian ini bersifat triploid dengan nilai tengah 301,97 sementara sebagai standar digunakan daun muda avokad dengan nilai tengah 196,76. Adapun embrio avokad bersifat diploid dengan nilai tengah 207,22. Berdasarkan hasil pengukuran ini dapat disimpulkan bahwa kalus endosperma avokad hasil kultur ini bersifat triploid (Gambar 5).
Gambar 5. Kurva hasil pengukuran kalus dan daun avokad dengan menggunakan flow
cytometer. ( Kurva A, kalus bagian tengah, nilai tengah-x= 301,97 (triploid). Kurva B= kurva standar daun avokad dengan nilai tengah-x = 196,76 (diploid)). File: KALUS K2 K1 Date: 30-07-2013 Time: 13:10:45 Particles: 9566 Acq.-Time: 141 s
Region Gate Ungated Count Count/ml %Gated Mean-x CV-x% Mean-y CV-y% RN1 <None> 4551 4551 - 47.57 301.97 9.76 - -
Region Gate Ungated Count Count/ml %Gated Mean-x CV-x% Mean-y CV-y% RN1 <None> 2057 2057 - 43.83 196.76 11.71 - -
17
4 SIMPULAN DAN SARAN
Simpulan
Kultur endosperma avokad hanya tumbuh jika dilakukan penyertaan embrionya. Ukuran diameter buah avokad dengan endosperma yang paling cepat tumbuh kalus jika di kultur adalah kelompok B (0,51-1,00 cm) dengan respon tumbuh kalus tercepat 7,67 MSK, sedangkan interaksi antara ukuran diameter buah dan ZPT yang paling cepat untuk menumbuhkan kalus endosperma avokad adalah ukuran diameter buah kelompok A dan ZPT Picloram 2,0 mg/l. Perlakuan picloram dan 2,4-D telah berhasil menginduksi kalus endosperma avokad. Picloram memiliki rerata respon lebih cepat menumbuhkan kalus dibandingkan 2,4-D. Respon tercepat tumbuh kalus adalah picloram 2,0 mg/l yaitu 5,1 MSK. Urutan ZPT yang memiliki pengaruh besar terhadap pertambahan berat basah kalus endosperma avokad secara berturut-turut adalah TDZ > BA > Kinetin, kalus tidak mengalami diferensiasi menjadi somatik embrio atau organ tanaman.
Pengukuran ploidi menggunakan flow cytometer, menunjukkan kalus bagian tengah yang berasal dari endosperma adalah triploid.
Saran
Penelitian tahap lanjutan perlu dilakukan yaitu mendapatkan media kultur optimal untuk membentuk somatik embrio atau organogenesis dari kalus endosperma avokad, yang dapat tumbuh menjadi planlet avokad yang triploid.
DAFTAR PUSTAKA
Beyl CA and Sharma GC. 1983. Picloram induced somatic embryogenesis in Gasteria and Haworthia. Plant Cell Tiss. Org. Cult. 2:123-32.
Chaturvedi R and Razdan MK, Bhojwani SS. 2003. An efficient protocol for the production of triploid plants from endosperm callus of Neem,
Azadirachta indica. A. Juss. J. Plant Physiol. 160: 557–564.
Dodds LH and Roberts LW. 1983. Exsperimen in Plant Tissue Culture. Cambridage University Press. London(GB). p: 178 – 181.
Fitch MM, Moore PH, Irvine JE. 1983. The use of picloram for maintenance of
regenerative callus lines in long-term tissue culture of sugarcane. Plant
Physiol (suppl) 72(1): 46
Garg L, Bhandari NN, Rani V, Bhojwani SS. 1996. Somatic embryogenesis and regeneration of triploid plants in endosperm cultures of Acacia nilotica. Plant Cell Rep. 15:855–858.
18
Góralski G, Popielarska M, Ślesak H, Siwińska D, Batycka M. 2005. Organogenesis in endosperm of Actinidia deliciosa cv. Hayward cultured
in Vitro. Acta Biol. crac ser bot. 47: 121–128.
Hanayanti O. 2011. Embriogenesis sel endosperma untuk perakitan tanaman triploid mangga (Mangifera indica L.) varietas Gedong gincu. [Tesis]. Bogor (ID) : Institut Pertanian Bogor
Hartman HT, Kester DE, Davis FTJr. 1990. Plant propagation : Principles and Practices. Englewood Clifts. New Jersey(US): Prentice-Hall International, Inc.
Hoshino Y, Miyashita T, Thomas TD. 2011. In vitro culture of endosperm and its application in plant breeding: approaches to polyploidy breeding. Scientia Horticulturae, 130(1): 1-8.
Huetteman CA and Preece JE (1993). Thidiazuron: a Potent cytokinin for woody plant tissue culture. Plant Cell Tiss. Org. Cult. 33: 105-109.
Miyashita T, Ohashi T, Shibata F, Araki H, Hoshino Y. 2009. Plant regeneration with maintenance of the endosperm ploidy level by endosperm culture in
Lonicera caerulea var. emphyllocalyx. Plant Cell Tiss. Org. Cult. 98: 291–301.
Murashige T and Skoog F. 1962. A Revised Medium for Rafid Growth and Bioassays with Tobacco Tissue Cultures. Physiol. Plant. 15: 473-497. Pardal JS. 2009. Rekayasa buah tanpa biji, Warta Penelitian dan Pengembangan
Pertanian. 31: 6
Peterson G and Smith R. l991. Effect of abscicic acid and callus size on regeneration of American and international rice varieties. Plant Cell Rep
10: 35-38.
Pierik RLM. 1971. Plant tissue culture as motivation for symposium In J.v. Bragt et al. (ed.). Effect of sterilisation on components in nutrient media. Wageningen(DE): Vennman and Zonen
Pieterse Z, Jerling J, Oostheuizen. 2003. Avocados (monounsaturated fatty acids), weight loss and serum lipids. South African Avocado Growers' Association Yearbook. 2003. 26:65-71.
Sedgley M. 1980. Anatomical investigation of abscissed avocado flowers and fruitlets. Australia (AU) :CSIRO
Sehgal CB and Abbas NS. 1996. Induction of triploid plantlets from the endosperm culture of Mallotus philippensis mull. Arg. Phytomorphol. 46: 283–289.
Shimizu K, Nagaike N, Yobuya T, Edachi T. 1997. Plant regeneration from suspension culture of Iris germica. Plant Cell Tiss. org. Cult. 50: 27-31. Srivastava PS. 1982. Endosperm culture. In Bhojwani MJ (ed.) Experimental
19
Sukamto LA. 2010. Kultur in vitro endosperma protokol yang efisien untuk mendapatkan tanaman triploid secara langsung. J. Agro Biogen 6 (2): 107-112.
Sukamto LA. 2011. Effect of Position and Plant Growth Regulators on Morphogenesis and Growth Rate of Coconut Endosperm In vitro.
Kasertsart J. (Nat. Sci) : 977-984
Sukamto LA. 2013. Teknologi Kultur Jaringan Endosperma untuk Mendapatkan Tanaman Buah dan Kayu Triploid. [Orasi Profesor Riset]. Jakarta (ID): LIPI Press
Sunyoto S, Purnomo, Makpul. 2010. Formula media kultur endosperma jeruk hasil persilangan antara klon siem dengan keprok dan jeruk besar. J. Hort. 20 (4) : 332-341.
Suryowinoto M. 1996. Pemuliaan tanaman secara in Vitro. Universitas Gajah Mada (ID) : Penerbit Kanisius. hlm. 114
Thomas TD, Bhatnagar AK, Bhojwani SS. 2000. Production of triploid plants of Mulberry (Morus alba L.) by endosperm culture. Plant Cell Rep. 19: 395–399.
Thomas TD and Chaturvedi R. 2008. Endosperm culture: A novel method for triploid plant. Plant Cell. Tiss. Org.Cult. 93(1):1-14.
Wang TY and Chang CJ. 1978. Triploid Citrus plantlet from endosperm culture. In Proc. symp. plant tissue culture. p. 463-467 China (CN) : Science Press, Peking.
Witjaksono and Litz RE. 1999. Induction and growth characteristic of embryogenic avocado culture. Plant cell tiss. org. cult. 58:19-29 (diakses tanggal 30 April 2013) dari Link.Springer.com
Yasseen MY. 1993. Morphogenesis of avocado in vitro, A Review. California Avocado Society. Yearbook 77:101-105.
Yelnititis. 2012. Pembentukan kalus remah dari eksplan daun Ramin (Gonystylus bancanus (Miq) Kurz.). Jurnal Pemuliaan Tanaman Hutan 6 (3): 181 – 194.
Zhao HX. 1988. Induction of endosperm plantlets of “Jinfeng” pear in vitro
20
21
Lampiran 1. Skema penelitian
Induksi dan karakter pertumbuhan kalus triploid dari kultur endosperma avokad ( Persea americana Mill.)
Penelitian tahap I
Uji penyertaan embrio
Uji diameter
buah Uji ZPT
Induksi kalus
Diferensiasi kalus
Kalus endosperma avokad Penelitian tahap II
22
Lampiran 2. Komposisi medium Murashige dan Skoog (MS) 1962
Stok Senyawa Per liter stok (g) Pemakaian
Stok(ml) Perliter medium(mg)
A NH4NO3 82,500 20,00 1.650,000
B KNO3 95,000 20,00 1.900,000
C KH2PO4 34,000 5,00 170,000
H3BO3 1,240 6,200
KI 0,166 0,830
Na2Mo4.H2O 0,050 0,250
CoCl2.6H2O 0,005 0,025
D CaCl2.2H2O 88,000 5,00 440,000
E MgSO4.7H2O 74,000 5,00 370,000
MnSO4.4H2O 4,460 22,300
ZnSO4.4H2O 1,720 8,600
CuSO4.5H2O 0,005 0,025
F Na2EDTA 7,460 37,300
FeSO4.7H2O 5,560 27,800
Myo-inositol 10,000 10,00 100,000
Glisin 0,200 2,000
Niasin 0,050 0,500
Piridoksin-HCl 0,050 0,500
Tiamin-HCl 0,010 0,100
Sukrosa 30.000,000
23
Lampiran 3. Pengolahan data statistik penelitian Analisis Ragam
Keterangan singkatan
Simbol ZPT(ppm)/Diameter (cm) Jumlah data (N)
z1 P 0,5 12
H1 : paling sedikit ada satu j dimana bj≠ 0 (faktor b berpengaruh terhadap respon)
Pengaruh interaksi diameter dan zpt
Hipotesis :
H0 : c1=...=c96=0 (faktor c tidak berpengaruh terhadap respon)
24
Keputusan : Tolak H0 jika nilai Sig< alpha (0.05) Kesimpulan :
Tolak H0, karena Nilai Sig (0.008) < alpha (0.05), artinya faktor diameter berpengaruh
terhadap respon pada taraf nyata 5%.
Tolak H0, karena Nilai Sig (0.000) < alpha (0.05), artinya faktor zpt berpengaruh
terhadap respon pada taraf nyata 5%.
Tolak H0, karena Nilai Sig (0.015) < alpha (0.05), artinya interaksi diameter dan zpt
berpengaruh terhadap respon pada taraf nyata 5%.
Lampiran 4. Uji Duncan pengaruh diameter
Respon
Keterangan : angka yang diikuti oleh huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata berdasarkan uji wilayah kepercayaan 5%.
25
Lampiran 6. Uji Duncan : Interaksi Diameter dan ZPT
26
Lampiran 7. Analisis ragam ZPT Sitokinin Kinetin (K)
Between-Subjects Factors
Dependent Variable: Pengaruh Kinetin terhadap pertumbuhan kalus Endosperma
27
Lampiran 8. Analisis ragam ZPT sitokinin BA Between-Subjects Factors
N
sitokinin
(B)
B1 5
B2 5
B4 5
Kelompok 1,00 3
2,00 3
3,00 3
4,00 3
5,00 3
Tests of Between-Subjects Effects
Dependent Variable: Pengaruh BA terhadap pertumbuhan kalus Endosperma
Source
Type III
Sum of Squares Df Mean Square F Sig.
Corrected Model ,035 6 ,006 26,459 ,000
Intercept ,244 1 ,244 1102,560 ,000
sitokinin (B) ,001 2 ,000 1,975 ,201
Kelompok ,034 4 ,009 38,701 ,000
Error ,002 8 ,000
Total ,280 15
Corrected Total ,037 14
28
Lampiran 9. Analisis Ragam ZPT sitokinin TDZ Between-Subjects Factors
Dependent Variable: Pengaruh TDZ terhadap pertumbuhan kalus Endosperma
29