PEMANFAATAN RUMPUT VETIVER (Chrysopogon
zizanioides, L.) DALAM PROSES REMEDIASI LOGAM BERAT
KADMIUM (Cd) DAN TEMBAGA (Cu)
DESY ARYANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pemanfaatan Rumput Vetiver (Chrysopogon zizanioides, L.) Dalam Proses Remediasi Logam Berat Kadmium (Cd) dan Tembaga (Cu) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
Desy Aryani
RINGKASAN
DESY ARYANI. Pemanfaatan Rumput Vetiver (Chrysopogon zizanioides, L.) Dalam Proses Remediasi Logam Berat Kadmium (Cd) dan Tembaga (Cu). Dibimbing oleh HEFNI EFFENDI dan NIKEN TUNJUNG MURTI PRATIWI.
Pencemaran air yang disebabkan oleh kegiatan industri yang menggunakan logam berat baik sebagai bahan baku, bahan tambahan maupun katalis, saat ini menjadi masalah serius di lingkungan. Kadar logam berat tertentu di perairan dibutuhkan dalam proses metabolisme, namun peningkatan kadar logam berat secara terus menerus dapat berubah menjadi racun bagi organisme melalui bioakumulasi dan biomagnifikasi serta dapat membahayakan kesehatan manusia. Salah satu logam berat yang banyak ditemukan di lingkungan perairan adalah kadmium (Cd) dan tembaga (Cu). Teknik yang dapat diaplikasikan dalam pengelolaan limbah logam yaitu dengan fitoremediasi. Salah satu tanaman yang dapat mengakumulasi logam berat adalah rumput vetiver (Chrysopogon zizanioides (L.). Tanaman ini memiliki sistem perakaran yang kuat, tumbuh pada berbagai kondisi iklim yang ekstrim, dan banyak digunakan dalam mengatasi pencemaran lingkungan.
Tujuan dari penelitian ini adalah untuk menganalisis efektivitas C. zizanioides (L.) dalam penurunan logam berat Cd dan Cu secara hidroponik serta mengkaji dampak yang ditimbulkan dari perbedaan logam berat Cd dan Cu terhadap karakteristik struktur organ akar dan daun C. zizanioides (L.). Penelitian ini dilakukan pada bulan Februari-Mei 2015 di Laboratorium Pusat Pengkajian Lingkungan Hidup (PPLH) IPB. Penelitian terdiri dari tiga percobaan dengan tiga ulangan, yaitu C. zizanioides (L.) tanpa kehadiran logam Cd dan Cu sebagai kontrol, C. zizanioides (L.) dengan kehadiran logam Cd (Cd1, Cd2.5, Cd5), dan C. zizanioides (L.) dengan kehadiran logam Cu (Cu2.5, Cu5, Cu7.5).
Hasil penelitian menunjukkan bahwa konsentrasi limbah logam berat Cd dan Cu di air menurun seiring meningkatnya waktu pemaparan selama periode pengamatan untuk seluruh konsentrasi. Konsentrasi di air untuk logam Cd (Cd1, Cd2.5, Cd5) pada awal pengamatan secara berturut-turut yaitu (1,007; 2,499; 5,008) mg L-1 menjadi (0,589; 1,311; 2,419) mg L-1, sedangkan, konsentrasi Cu (Cu2.5, Cu5, Cu7.5) di awal secara berturut-turut yaitu (2,501; 4,991; 7,467) mg L-1 menjadi (1,171; 1,852; 2,345) mg L-1. Total akumulasi logam baik Cd maupun Cu oleh C. zizanioides (L.) untuk masing-masing perlakuan menunjukkan akumulasi logam di akar lebih tinggi dibandingkan di daun. Berdasarkan hasil perhitungan BCF, diperoleh nilai berkisar 0,83 – 2,51. Nilai BCF paling tinggi untuk logam Cd, yaitu 2,51 (Cd2.5), sedangkan Cu yaitu 1,74 (Cu5). Nilai TF dari semua konsentrasi kedua logam yaitu kurang dari 1 yang berkisar antara 0,01-0,07. Removal efficiency rata-rata untuk C. zizanioides (L.) adalah 37.64% (Cd1), 48.46% (Cd2.5) dan 48.84% (Cd5), serta 32.55% (Cu2.5), 54.68% (Cu5), dan 52.59% (Cu7.5).
C. zizanioides (L.)efektif menghapus logam Cd dan Cu dalam waktu 4 minggu. Pertumbuhan rata-rata C. zizanioides (L.) lebih baik pada perlakuan Cu dibandingkan Cd.
SUMMARY
DESY ARYANI. Utilization of Vetiver Grass (Chrysopogon zizanioides, L.) in the Process Remediation of Heavy Metal Cadmium (Cd) and Copper (Cu). Supervised by HEFNI EFFENDI and NIKEN TUNJUNG MURTI PRATIWI.
Water pollution that caused by industrialization greatly contribute to environmental problem.the use of metals as raw materials, additives and catalysts greatly contribute to this problem. Normally, a particular quantity of heavy metals is needed in the water metabolic process. However, a simultaneous increase of heavy metal concentration through bioaccumulation and biomagnification could be toxic for organisms as well as perilious for human health. Some of heavy metals found in aquatic environments are cadmium (Cd) and copper (Cu). The technique that can be applied in the management of metal waste is phytoremediation. One of the plants that can accumulate heavy metals is vetiver grass (Chrysopogon zizanioides (L). Besides possessing strong root system, this plant is adaptive to extreme climate, and widely used to solve environment pollution.
This study is aimed to analyze the effectiveness of C. zizanioides (L.) to reduce the concentration of the heavy metals (Cd and Cu) in water using hydroponic system, as well as to assess the impact of differentt heavy metals Cd and Cu on the characteristics of the root and leaf structures of C. zizanioides (L.). The study was conducted in February-May 2015 at the Laboratory of Centre for Environmental Research (PPLH) IPB. Three experiments with three replications were conducted on this research C. zizanioides (L.) without metals Cd and Cu as control, C. zizanioides (L.) with metals Cd (Cd1, Cd2.5, Cd5), and C. zizanioides
(L.) with Cu (Cu2.5, Cu5, Cu7.5) respectively.
The results indicated that the concentration of heavy metal waste (Cd and Cu) in the water was decreasing along with the time exposure during the observation period. The concentration of metals Cd (Cd1, Cd2.5, Cd5) in the water at the beginning of the observation are correspondingly (1.007; 2.499; 5.008) mg L-1 into (0.589; 1.311; 2.419) mg L-1. While the concentration of Cu (Cu2.5, Cu5, Cu7.5) respectively are (2.501; 4.991; 7.467) mg L-1 into (1.171; 1.852; 2.345) mg L-1. The total accumulation of metals for both Cd and Cu by C. zizanioides (L.) for each treatment indicates that metal accumulation in roots was higher than in the leaves. Based on BCF calculation, the results were ranging from 0.83 to 2.51. The highest BCF value for Cd, is 2.51 (Cd2.5), whereas Cu is 1.74 (Cu5). The TF value of all concentrations for both metals is less than 1, which ranged from 0.01 to 0.07. The average removal efficiency for C. zizanioides (L.) is 37.64% (Cd1), 48.46% (Cd2.5) and 48.84% (Cd5) and 32.55% (Cu2.5), 54.68% (Cu5), and 52.59% (Cu7.5).
In conclusion, C. zizanioides (L.) effectively removes metals Cd and Cu within 4 weeks. The average growth of C. zizanioides (L.) is better under the Cu treatment than the Cd treatment.
©Hak Cipta Milik IPB, Tahun 2015 Hak Cipta Dilindingi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan IPB.
PEMANFAATAN RUMPUT VETIVER (Chrysopogon
zizanioides, L.) DALAM PROSES REMEDIASI LOGAM BERAT
KADMIUM (Cd) DAN TEMBAGA (Cu)
DESY ARYANI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pengelolaan Sumberdaya Perairan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis
Pemanfaatan Rumput Vetiver (Chrysopogon zizanioides, L.) Dalam Proses Remediasi Logam Berat Kadmium (Cd) dan Tembaga (Cu) Nama Desy Aryani
NRP C251130111
Disetujui oleh
Komisi pembimbing
Dr Ir Hefni Effendi, M Phil Ketua
Dr Ir Niken T. M. Pratiwi, M Si Anggota
Diketahui oleh
Ketua Program Studi
Pengelolaan Sumberdaya Perairan
Dr Ir Sigid Hariyadi, M Sc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, M ScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2015 ini ialah Pemanfaatan Rumput Vetiver (Chrysopogon zizanioides, L.) Dalam Proses Remediasi Logam Berat Kadmium (Cd) dan Tembaga (Cu).
Terima kasih penulis ucapkan kepada bapak Dr Ir Hefni Effendi, M Phil dan Dr Ir Niken T. M. Pratiwi, M.Si selaku komisi pembimbing yang telah meluangkan waktunya untuk menyampaikan ilmu dan saran-saran yang membangun dalam membimbing penulis. Selain itu penulis ucapkan terima kasih kepada:
1. Dr Ir Sigid Hariyadi, MSc selaku ketua program studi SDP periode 2014-2017 yang telah membantu penulis dalam kelancaran studi
2. Dr Ir Majariana Krisanti, MSi selaku penguji luar komisi pada ujian tesis yang telah memberikan masukan dan saran kepada penulis
3. Nani Suryani dan Dadang Sumarna, mamah dan bapak atas bantuan, dukungan yang diiringi rasa kasih sayang, serta doa terbaik yang selalu tercurah untuk penulis di mana pun berada
4. Pihak DIKTI yang telah memberikan beasiswa BPPDN 2013 untuk kelancaran studi penulis
5. PPLH IPB beserta staff yang memberikan fasilitas dan bantuan penelitian 6. Teman-teman seperjuangan SDP 2013, Sri Wahyuningsih, Iyat Hamiyati,
Mayanda Lia, Siti Fauziyyah Masykur dan Kongkret Crew serta pihak yang tidak dapat disebutkan satu per satu atas bantuan dan dukungannya dalam menyelesaikan laporan penelitian ini, penulis ucapkan terima kasih yang sebanyak-banyaknya, semoga Allah membalas semua kebaikan yang kalian berikan.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2015
DAFTAR ISI
Perumusan masalah 2
Tujuan dan manfaat 2
Hipotesis 3
METODE 3
Waktu dan tempat penelitian 3
Bahan dan alat 3
Rancangan penelitian 4
Persiapan C. zizanioides (L.) 5
Pembuatan larutan uji 5
Uji pendahuluan 5
Uji lanjutan. 6
Pengumpulan Data 6
Pengukuran logam Cd dan Cu pada organ akar dan daun
C. zizanioides (L)
6
Pengamatan struktur jaringan akar dan daun C. zizanioides (L.) 7
Pertumbuhan tinggi tanaman 7
Laju pertumbuhan spesifik (SGR) C. zizanioides (L.) 7
Pengukuran kualitas air 8
Analisis Data 8
Analisis deskriptif 8
Analisis statistik 8
HASIL DAN PEMBAHASAN 9
Hasil 9
Logam Cd dan Cu di air 9
Akumulasi logam Cd dan Cu di tanaman 9
Bioconcentration Factor (BCF) dan Translocation Factor (TF) 10
Removal Efficiency 11
Tinggi tanaman C. zizanioides (L.) 11
Laju pertumbuhan spesifik (SGR) C. zizanioides (L.) 12
DAFTAR TABEL
DAFTAR GAMBAR
DAFTAR LAMPIRAN
1 Parameter kualitas air 8
2 Konsentrasi logam Cd di air selama perlakuan 9
3 Konsentrasi logam Cu di air selama perlakuan 9
4 Akumulasi Cd (mg kg-1) dalam C. zizanioides (L.) selama perlakuan 10 5 Akumulasi Cu (mg kg-1) dalam C. zizanioides (L.) selama perlakuan 10 6 Nilai BCF dan TF logam Cd dan Cu pada tanaman C. zizanioides (L.) 11
7 Removal efficiency logam Cd dan Cu di air 11
1 Alur perumusan masalah penelitian 3
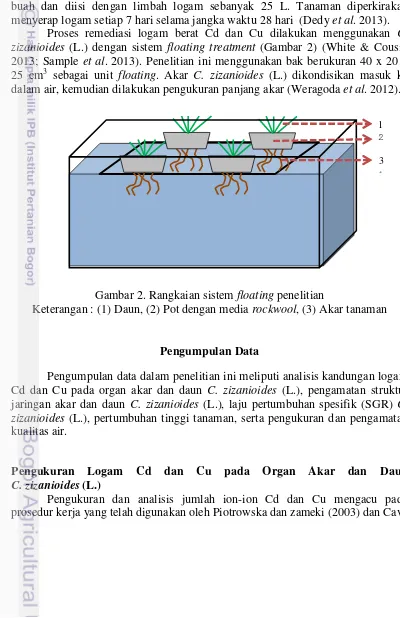
2 Rangkaian sistem floating penelitian 6
3 Grafik pertumbuhan tinggi tanaman pada perlakuan Cd dan Cu 12
4 Laju pertumbuhan spesifik (SGR) 12
5 Kualitas air pada perlakuan Cd dan Cu 13
1 Gambar pertumbuhan C. zizanioides, L selama periode pengamatan 24 2 Pengamatan struktur jaringan daun dan akar C. zizanioides (L.) pada
perlakuan kontrol
24
3 Pengamatan struktur jaringan daun dan akar C. zizanioides (L.) pada perlakuan pada logam Cd1
25
4 Pengamatan struktur jaringan daun dan akar C. zizanioides (L.) pada perlakuan pada logam Cd2.5
26
5 Pengamatan struktur jaringan daun dan akar C. zizanioides (L.) pada perlakuan pada logam Cd5
27
6 Pengamatan struktur jaringan daun dan akar C. zizanioides (L.) pada perlakuan pada logam Cu2.5
28
7 Pengamatan struktur jaringan daun dan akar C. zizanioides (L.) pada perlakuan pada logam Cu5
29
8 Pengamatan struktur jaringan daun dan akar C. zizanioides (L.) pada perlakuan pada logam Cu7.5
30
9 Uji ANOVA konsentrasi logam Cd di air 31
10 Uji ANOVA konsentrasi logam Cu di air 32
PENDAHULUAN
Latar Belakang
Pencemaran air yang disebabkan oleh kegiatan antropogenik, terutama kegiatan industri saat ini menjadi masalah serius di lingkungan. Meningkatnya pembangunan di berbagai bidang, khususnya pembangunan di bidang industri, diikuti dengan meningkatnya jumlah limbah yang dihasilkan, termasuk yang berbahaya dan beracun (B3) yang dapat membahayakan lingkungan hidup dan kesehatan manusia (PP RI No. 18 Tahun 1999). Salah satu limbah B3 yang banyak digunakan dalam kegiatan industri, baik sebagai bahan baku, bahan tambahan maupun katalis adalah logam berat.
Logam berat dengan kadar tertentu, di perairan dibutuhkan dalam proses metabolisme, namun peningkatan kadar logam berat secara terus menerus dapat berubah menjadi racun bagi organisme melalui bioakumulasi dan biomagnifikasi. Logam berat yang biasa berada di lingkungan, di antaranya merkuri (Hg), kadmium (Cd), tembaga (Cu), besi (Fe), kobalt (Co), timah (Sn), dan seng (Zn).
Kadmium (Cd) merupakan salah satu logam berat yang banyak ditemukan di lingkungan, berasal dari kegiatan yang bergerak di bidang industri electroplating, pembuatan plastik, pertambangan, pigmen cat, dan baterai. Keberadaan logam Cd menjadi perhatian besar di lingkungan karena toksisitasnya yang tinggi terhadap hewan dan manusia (Tudoreanu & Phillips 2004), serta sebarannya yang luas di lingkungan perairan (Muthukumaravel & Paulay 2007; Ghiasi et al. 2010). Cd dapat bersifat toksik dalam lingkungan perairan, khususnya terhadap ikan. Ikan dapat mengakumulasi Cd dengan berbagai cara
melalui insang, kulit dan saluran pencernaan (Vinodhini & Narayanan 2008; Akan et al. 2009). Penyimpanan Cd di dalam
tubuh ikan terletak di hati dan tulang yang diangkut oleh sistem peredaran darah ikan (Akan et al. 2009).
Logam lain yang ditemukan di lingkungan adalah tembaga (Cu). Cu banyak digunakan dalam pembuatan kabel listrik, atap, pigmen cat, pipa, dan industri kimia. FAO menyebutkan bahwa batas maksimum untuk irigasi adalah 200 µg/L dan untuk air minum tidak melebihi batas 1.3 mg L-1 (APHA 2012). Cu merupakan unsur esensial bagi tanaman dan hewan, namun dapat menjadi toksik apabila melebihi batas maksimum. Keberadaan Cu di lingkungan perairan dengan konsentrasi yang tinggi (sama dengan Cd) dapat menyebabkan racun bagi organisme air khusunya ikan. Kemampuan Cu adalah mampu menggabungkan dengan kontaminan lain seperti amonia, merkuri (Hg), dan seng (Zn) untuk menghasilkan zat aditif beracun terhadap ikan yang masuk dan terakumulasi di hati, lambung, dan usus.
2
kontaminan, serta memberikan keuntungan bagi kesehatan masyarakat (Terry et al. 2010)
Salah satu tanaman yang dapat mengakumulasi logam berat adalah rumput vetiver (Chrysopogon zizanioides (L.) (Truong 2000). Rumput vetiver dapat mencapai tinggi 1-2 m, tumbuh cepat, dan memiliki sistem perakaran yang kuat dengan panjang 3-4 m, tumbuh pada berbagai kondisi iklim yang ekstrim, dan banyak digunakan dalam mengatasi pencemaran lingkungan (Weragoda et al.
2012).
Perumusan Masalah
Berdasarkan latar belakang tersebut, dapat dibuat suatu perumusan masalah bahwa pertumbuhan industri khususnya yang bergerak dalam pembuatan electroplating, pembuatan plastik, pertambangan, pigmen cat, baterai, kabel listrik, atap, pipa, dan industri kimia akan terus bertambah seiring meningkatnya permintaan tersebut. Aktivitas produksi yang semakin meningkat juga diikuti dengan bertambahnya limbah cair ke dalam perairan. Kandungan logam Cd dan Cu yang terus berada di perairan tidak mudah terdegradasi, yang selanjutnya akan terakumulasi, baik pada sedimen, hewan, maupun tumbuhan.
Keberadaan logam berat di perairan dapat menjadi toksik dan berbahaya bagi kehidupan organisme di dalamnya. Sebagian besar teknologi atau pemulihan yang konvensional, baik secara kimia maupun fisika membutuhkan banyak biaya dan berdampak pada ekosistem. Bioremediasi merupakan suatu teknologi yang efektif dan ramah lingkungan. Pemanfaatan C. zizanioides (L.) dalam proses remediasi dapat dipertimbangkan, karena diduga tanaman ini mampu menjadi agen fitoremediasi atau mampu mengurangi konsentrasi logam berat di perairan. Penelitian yang dilakukan oleh Aksorn dan Benjamart (2013) menunjukkan bahwa C. zizanioides (L.) mampu mengakumulasi logam berat Pb antara 381 sampai 606 ppm dan mengakumulasi Zn lebih dari 10.000 ppm dalam jaringan akar.
Penggunaan C. zizanioides (L.) dapat dijadikan sebagai salah satu alternatif dalam pengolahan limbah cair yang dihasilkan dari kegiatan industri dengan kemampuannya meremediasi kandungan logam berat di lingkungan. Penelitian ini dirancang untuk menangani pencemaran logam berat, khusunya Cd dan Cu yang berada di lingkungan perairan dengan konsentrasi yang tinggi. Penelitian ini dilakukan untuk mengkaji kemampuan C. zizanioides (L.) dalam meremediasi logam Cd dan Cu di perairan. Alur dari perumusan masalah dalam penelitian ini dijelaskan pada Gambar 1.
Tujuan dan Manfaat Penelitian
3
dampak negatif logam berat Cd dan Cu pada suatu perairan yang berasal dari aktivitas industri. Keluaran dari hasil penelitian ini adalah untuk mendapatkan model instalasi pengolahan air limbah yang murah, efektif, dan efisien dalam kegiatan industri.
Hipotesis
Hipotesis yang diajukan adalah jika penggunaan C. zizanioides (L.) dapat menurunkan konsentrasi logam berat kadmium (Cd) dan tembaga (Cu) di perairan, maka tanaman ini dapat dijadikan sebagai fitoremediator pada perairan tercemar limbah logam berat.
Gambar 1. Alur perumusan masalah penelitian
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Februari-Mei 2015. Penelitian dilakukan di Laboratorium Pusat Pengkajian Lingkungan Hidup (PPLH) IPB. Analisis kualitas air dan struktur morfologi C. zizanioides (L.) dilakukan di Laboratorium PPLH. Analisis kandungan logam berat Cd dan Cu pada tanaman dan air dilakukan di Laboratorium Produktivitas dan Lingkungan Perairan (Proling), Departemen Manajemen Sumberdaya Perairan, FPIK, IPB. Analisis struktur anatomi C. zizanioides (L.) dilakukan di Laboratorium Biologi Mikro, Departemen Manajemen Sumberdaya Perairan, FPIK, IPB.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah akuades, C. zizanioides
(L.), CdCl2.2.5H2O, CuSO4.5H2O, HNO3 6 M, H2O2 30 %, dan nutrisi A&B Kegiatan Industri
Limbah
Logam Cd
Logam Cu
Fitoremediasi oleh C. zizanioides
(L)
Penurunan Konsentrasi
Logam Cd dan Cu
+
4
mix. Alat yang digunakan selama penelitian adalah AAS, bak berukuran 40 x 20 x 25 cm3,cawan petri, DO meter, gelas kimia, kaca objek, kaca penutup, labu ukur, lumpang porselin, mikroskop, kertas milipore, neraca analitik,oven, pH-meter, pipet tetes, plastik, pot, termometer, rockwool, dan sterofoam.
Rancangan Penelitian
Penelitian ini dilakukan dengan menggunakan metode eksperimental di laboratorium dengan rancangan percobaan menggunakan RAL in time. Berikut model linier yang digunakan:
yijk = μ + αi + δik + βj + (αβ)ij + εijk
Keterangan:
yijk : Nilai pengamatan pada perlakuan ke-i, waktu ke-j, ulangan ke-k; i=1,2,3 (Kontrol: tanpa logam; Cd : kehadiran logam Cd (Cd1, Cd2.5, Cd 5); Cu : kehadiran logam Cu (Cu2.5, Cu5, dan Cu7.5), j=1,2,...,5 (hari ke- 0, 7, 14, 21, 28), k=1,2,3
μ : Rataan umum
αi : Pengaruh perlakuan ke-i δik : Komponen galat (a) βj : Pengaruh waktu ke-j
(αβ)jk : Pengaruh interaksi perlakuan ke-i dan waktu ke-j
1. Pengaruh perlakuan terhadap respon Hipotesis:
H0 : αK = αS = αSB = 0 (tidak ada pengaruh perlakuan terhadap respon) H1 : minimal ada satu αj ≠ 0 (ada pengaruh perlakuan terhadap respon)
2. Pengaruh waktu pengamatan Hipotesis:
H0 : β0= β7= β14 = β ….= β35 = 0 (tidak ada pengaruh perlakuan terhadap respon)
H1 : minimal ada satu βk ≠ 0 (ada pengaruh waktu pengamatan terhadap respon)
3. Pengaruh interaksi perlakuan dan waktu pengamatan Hipotesis:
H0 : (αβ)K0 = (αβ)K6 = … = (αβ)SB35 = 0 (tidak ada pengaruh perlakuan dan waktu pengamatan)
H1 : minimal ada satu (αβ)jk ≠ 0 (ada pengaruh interaksi perlakuan dan waktu pengamatan)
Pengamatan dilakukan sebanyak tiga kali ulangan dengan tiga konsentrasi. Perlakuan konsentrasi yang diuji pada C. zizanioides (L.) adalah:
1. Perlakuan kontrol : C. zizanioides (L.) tanpa kehadiran logam Cd dan Cu 2. Perlakuan Cd : C. zizanioides (L.) dengan kehadiran logam Cd
5
Prosedur penelitian ini terdiri dari persiapan C. zizanioides (L.), pembuatan larutan uji, uji pendahuluan, dan uji lanjutan.
Persiapan C. zizanioides (L.)
Tanaman dipilih berdasarkan perkiraan umur yang sama, memiliki tinggi antara 10-15 cm kemudian ditimbang bobotnya. Akar tanaman disterilkan dalam larutan 0,3% hidrogen peroksida selama 20 menit, kemudian dibilas dengan akuades (Aibibu et al. 2010). Tanaman disimpan pada bak berukuran 40 x 20 x 25 cm3 dalam 25 L larutan nutrisi (A&B mix) dan diaklimasi selama 7 hari (Syahputra, 2005). Satu bak terdiri dari empat rumpun, masing-masing rumpun memiliki bobot basah sekitar 30 gram. Metode ini menggunakan sistem floating treatment (Sample et al. 2014; White & Cousin 2013). Media yang digunakan adalah rockwool, dengan mengkondisikan akar C. zizanioides (L.) masuk ke dalam air.
Pembuatan Larutan Uji
Penelitian ini menggunakan CdCl2.2.5H2O sebagai sumber Cd (Niu et al.
2012, Ahmadpour 2011) dan CuSO4.5H2O sebagai sumber Cu. Masing-masing logam dibuat dengan konsentrasi yang berbeda untuk setiap perlakuan yang meliputi: (i) kontrol, (ii) Cd 1 mg L-1, Cd 2,5 mg L-1, dan Cd 5 mg L-1 (Cd 1, Cd 2.5, Cd 5) dan (iii) Cu 2,5 mg L-1, Cu 5 mg L-1, dan Cu 7,5 mg L-1 (Cu 2.5, Cu 5, Cu 7.5). Konsentrasi tersebut ditentukan berdasarkan pada peneltian sebelumnya yang menggunakan eceng gondok dalam remediasi logam Cd dan Cu. Masing-masing konsentrasi berbeda untuk setiap perlakuan yaitu: kontrol, Cd 0,27 mg L-1, Cd 0,54 mg L-1, Cd 0,81 mg L-1, dan Cu 0,35 mg L-1, Cu 0,70 mg L-1, dan Cu 1,05 mg L-1 (Swain et al. 2014) Pembuatan larutan stok dengan konsentrasi yang dibutuhkan didapatkan dengan rumus pengenceran:
V1N1 = V2N2 Keterangan:
V1 : Volume air yang diencerkan V2 : Volume air setelah pengenceran
N1 : Konsentrasi larutan yang akan diencerkan N2 : Konsentrasi larutan setelah pengenceran
Penentuan perbedaan konsentrasi antara logam Cd dan Cu pada penelitian ini mengacu juga pada nilai baku mutu perairan tawar, namun digunakan konsentrasi yang lebih tinggi dari baku mutu. Hal ini dimaksudkan untuk melihat seberapa besar kemampuan tanaman C. zizanioides (L.) dalam menyerap logam tersebut di air.
Kadar logam Cd pada perairan tawar alami biasanya 0,0001-0,01 mg L-1, sedangkan logam Cu biasanya < 0,02 mg L-1 (Moore 1991). Kadar logam Cd untuk perairan laut yaitu 0,0001 mg L-1, sedangkan Cu berkisar antara 0.001-0.025 mg L-1 (McNeely et al. 1979). Menurut WHO, kadar logam Cd maksimum pada air yang diperuntukkan bagi air minum adalah 0,005 mg L-1, sedangkan Cu adalah 0,1 mg L-1 (Moore 1991).
Uji Pendahuluan
6
tanaman percobaan. Tanaman kontrol digunakan untuk melihat pengaruh media tumbuh terhadap semua variabel penelitian, sedangkan tanaman percobaan diberi perlakuan konsentrasi Cd dan Cu. Bak penelitian yang digunakan berjumlah tujuh buah dan diisi larutan nutrisi (A&B mix) yang telah ditambah logam (Gambar 2). Penelitian ini dilakukan selama tujuh hari.
Uji Lanjutan
Tahap selanjutnya setelah C. zizanioides (L.) mampu beradaptasi pada kondisi lingkungan dengan konsentrasi yang telah ditentukan, adalah penelitian lanjutan dengan tiga kali ulangan. Bak penelitian yang digunakan sebanyak 21 buah dan diisi dengan limbah logam sebanyak 25 L. Tanaman diperkirakan menyerap logam setiap 7 hari selama jangka waktu 28 hari (Dedy et al. 2013).
Proses remediasi logam berat Cd dan Cu dilakukan menggunakan C. zizanioides (L.) dengan sistem floating treatment (Gambar 2) (White & Cousin 2013; Sample et al. 2013). Penelitian ini menggunakan bak berukuran 40 x 20 x 25 cm3 sebagai unit floating. Akar C. zizanioides (L.) dikondisikan masuk ke dalam air, kemudian dilakukan pengukuran panjang akar (Weragoda et al. 2012).
Gambar 2. Rangkaian sistem floating penelitian
Keterangan : (1) Daun, (2) Pot dengan media rockwool, (3) Akar tanaman
Pengumpulan Data
Pengumpulan data dalam penelitian ini meliputi analisis kandungan logam Cd dan Cu pada organ akar dan daun C. zizanioides (L.), pengamatan struktur jaringan akar dan daun C. zizanioides (L.), laju pertumbuhan spesifik (SGR) C. zizanioides (L.), pertumbuhan tinggi tanaman, serta pengukuran dan pengamatan kualitas air.
Pengukuran Logam Cd dan Cu pada Organ Akar dan Daun
C. zizanioides (L.)
Pengukuran dan analisis jumlah ion-ion Cd dan Cu mengacu pada prosedur kerja yang telah digunakan oleh Piotrowska dan zameki (2003) dan Cave
2
1 1
7
et al. (2000). Pada umumnya peneliti-peneliti tersebut menyatakan bahwa cara basah lebih baik digunakan untuk analisis ion logam yang terkandung dalam bahan organik daripada cara kering.
Akar dan daun C. zizanioides (L.) dicuci dengan akuades hingga bersih, kemudian disimpan dalam kantong plastik. Bagian tersebut kemudian ditimbang dengan teliti pada petridish yang telah diketahui berat kosongnya. Bagian tanaman tersebut dipanaskan dalam oven selama 24 jam pada suhu 80o C, kemudian didinginkan. Bagian tanaman yang kering ditimbang kembali sehingga diketahui berat yang hilang sebagai jumlah air yang terkandung dalam akar dan daun. Sampel kering ini digerus pada lumpang porselin. Sampel yang telah digerus ditimbang kira-kira 0,5 gram dengan neraca analitik. Sampel tersebut dilarutkan dengan campuran 5 mL HNO3 6 M dan 5 mL H2O2 30 %, dipanaskan sampai semua bahan larut sempurna. Larutan didinginkan, kemudian ditambahkan dengan akuades dan pHnya diatur dengan HNO3 atau NaOH hingga mencapai nilai sekitar 2 – 3. Volume larutan diimpitkan hingga tanda batas dengan akuades dan dikocok hingga homogen. Larutan siap diukur dengan spektrofotometer serapan atom (AAS).
Perbandingan kandungan logam berat Cd dan Cu pada organ akar dan daun dengan logam berat di air dikalkulasi dengan bioconcentration factor (BCF) (Ghosh & Singh 2005), sedangkan perbandingan kandungan logam berat Cd dan Cu antara akar dengan daun dikalkulasi dengan translocation factor (TF) (Mellem
et al. 2012). Perhitungan BCF dan TF adalah sebagai berikut:
Faktor Biokonsentrasi (BCF) = [M] pada bagian akar tanaman (mg kg-1 BK) [M] pada lingkungan perairan (mg L-1)
Faktor Konsentrasi (TF) = [M] dalam daun (mg kg-1 BK) [M] dalam akar (mg kg-1 BK) Keterangan:
[M] : konsentrasi logam
Pengamatan Struktur Jaringan Akar dan Daun C. zizanioides (L.)
Akar dan daun C. zizanioides (L.) yang terpapar logam Cd dan Cu selama perlakuan dilihat jaringannya. Organ tersebut masing-masing disayat secara melintang dan diletakkan di atas kaca objek yang telah ditetesi air, kemudian ditutup dengan kaca penutup dan dilihat dengan menggunakan mikroskop pada perbesaran 10x10 (Dedy et al. 2013). Hasil pengamatan dibandingkan antara C. zizanioides (L.) yang terpapar selama 7 hari, 14 hari, 21 hari, dan 28 hari dengan kontrol.
Pertumbuhan Tinggi Tanaman
Pengukuran tinggi tanaman dilakukan satu minggu sekali selama 4 minggu pengamatan. Pengukuran dilakukan mulai pangkal batang sampai ujung daun tanaman tertinggi (Lestari et al, 2008).
8
Pengamatan laju pertumbuhan spesifik C. zizanioides (L.) ditentukan berdasarkan persamaan (Scherr et al. 2009; Kittiwongwattana & Supachai 2013): sebagai berikut.
SGR =�ln Xt−ln X0
t−t0 � x 100%
Keterangan:
SGR : laju pertumbuhan spesifik Xt : bobot rata-rata pada waktu ke-t Xt : bobot rata-rata pada waktu ke-t1
Pengukuran Kualitas Air
Pengukuran kualitas air dalam penelitian ini adalah dengan mengukur beberapa parameter kualitas air yaitu pengukuran suhu, pH, dan DO. Pengukuran dilakukan pada hari ke 0, 7, 14, 21, dan 28 hari. Cara pengukuran dilakukan sebagai berikut.
Tabel 1. Parameter kualitas air
No Parameter Satuan Alat ukur
Logam yang terhapus selama waktu pengamatan, dihitung dengan menggunakan rumus Removal efficiency sebagai berikut (Khan et al. 2009):
R = I−F
I x 100%
Keterangan:
R : Removal Efficiency (%)
I : Initial heavy metal concentration
F : Final heavy metal concentration
Analisis Data Analisis Deskriptif
Data berupa kualitas air disajikan dalam bentuk tabel untuk melihat perubahan atau kondisi selama penelitian. Jaringan tumbuhan disajikan dalam bentuk gambar untuk melihat perbandingan antara tanaman kontrol dan yang terpapar logam Cd dan Cu pada setiap pengamatan 7 hari, 14 hari, 21 hari, dan 28 hari.
Analisis Statistik
Data yang diperoleh ditabulasi dan dianalisis menggunakan program
9
menggunakan program SPSS 17. Jika analisis menunjukkan pengaruh nyata maka dilanjutkan uji Duncan dengan taraf kepercayaan 95%.
HASIL DAN PEMBAHASAN
Hasil Logam Cd dan Cu di Air
Tabel 2 menunjukkan penurunan konsentrasi logam Cd di air seiring meningkatnya waktu pemaparan. Penurunan secara drastis hampir terjadi pada semua perlakuan dari minggu ke-0 hingga minggu ke-1. Perlakuan Cd1 memiliki perbedaan yang signifikan dengan perlakuan Cd2,5 dan Cd5 (P <0.05). Berdasarkan waktu, minggu ke-0 berbeda nyata dengan waktu minggu ke-1 sampai minggu ke-4 (P <0.05). Perlakuan Cd1 dan Cd5 pada setiap periode pengamatan terus mengalami penurunan, namun pada perlakuan Cd2.5, konsentrasi mengalami fluktuasi. Dibandingkan dengan perlakuan lainnya, perlakuan Cd5 dari minggu ke-3 hingga minggu ke-4 tidak menunjukkan penurunan yang signifikan yaitu dari 2,465 mg L-1 menjadi 2,419 mg L-1.
Tabel 2. Konsentrasi logam Cd di air selama perlakuan Waktu
(minggu)
Konsentrasi (mg L-1)
Cd1a Cd2.5b Cd5b
0a 1,007±0,012 2,499±0,011 5,008±0,011 1b 0,690±0,182 1,216±0,204 2,791±0,229 2b 0,621±0,182 1,352±0,022 2,573±0,219 3b 0,611±0,175 1,272±0,056 2,465±0,127 4b 0,589±0,185 1,311±0,073 2,419±0,060 Simbol huruf superscript yang berbeda menunjukkan perbedaan yang nyata pada taraf uji 5%
Tabel 3. Konsentrasi logam Cu di air selama perlakuan Waktu
(minggu)
Konsentrasi (mg L-1)
Cu2,5a Cu5b Cu7,5b
0a 2,501±0,001 4,991±0,018 7,467±0,029 1b 2,148±0,057 2,850±0,098 4,857±0,522 2c 1,860±0,228 2,345±0,095 4,108±0,841 3d 1,567±0,218 1,999±0,271 2,850±0,099 4e 1,171±0,150 1,852±0,211 2,345±0,095 Simbol huruf superscript yang berbeda menunjukkan perbedaan yang nyata pada taraf uji 5%
Tabel 3 menunjukkan penurunan logam Cu di air seiring berjalannya waktu. Penurunan yang signifikan terjadi dari minggu ke-0 hingga minggu ke-1. Perlakuan Cu2,5 memiliki perbedaan yang signifikan dengan perlakuan Cu5dan Cu7,5 (P <0.05). Berdasarkan waktu, setiap waktu berbeda nyata (P <0.05). Perlakuan untuk semua konsentrasi Cu masih menunjukkan penuruan yang signifikan sampai minggu ke-3 terutama pada perlakuan Cu7.5, namun pada minggu ke-4, konsentrasi Cu tidak mengalami penurunan yang drastis dari konsentrasi sebelumnya.
10
C. zizanioides (L.) dapat mengakumulasi logam Cd dalam jumlah besar (Tabel 4). Penelitian lain menyebutkan bahwa tanaman ini dapat mengakumulasi Cd dan Pb dalam jumlah besar pada media tanah (Narain et al. 2012). Logam Cd diserap dalam bentuk ion Cd2+ oleh akar tanaman, kemudian ditranslokasikan ke daun. Pada penelitian ini, masing-masing perlakuan menunjukkan akumulasi logam Cd di akar lebih tinggi dibandingkan di daun. Akumulasi total logam Cd tercatat sebesar 7,03 mg kg-1 (Cd1); 35,63 mg kg-1 (Cd2,5); 54,44 mg kg-1 (Cd5).
Tabel 5 menunjukkan akumulasi logam Cu oleh C. zizanioides (L.). Akumulasi terbesar untuk masing-masing perlakuan lebih besar di akar dibandingkan di daun. Akumulasi total Cu diperoleh sebesar 20,10 mg kg-1 (Cu2,5); 33,27 mg kg-1 (Cu5); 42,54 mg kg-1 (Cu7,5).
Tabel 4. Akumulasi Cd (mg kg-1) dalam C. zizanioides (L.) selama perlakuan
Bagian
Tabel 5. Akumulasi Cu (mg kg-1) dalam C. zizanioides (L.) selama perlakuan
Bagian
Bioconcentration factor (BCF) dan translocation factor (TF)
Berdasarkan hasil perhitungan BCF, diperoleh nilai berkisar 0,83 – 2,51. Nilai BCF paling tinggi untuk logam Cd adalah 2,51 (Cd2.5), sedangkan Cu yaitu 1,74 (Cu5) (Tabel 6). Hal ini menunjukkan bahwa tanaman lebih banyak mengakumulasi Cd di akar dibandingkan Cu. Nilai BCF menunjukkan kemampuan suatu jenis tanaman dalam mengakumulasi logam dari lingkungan perairan, BCF > 1 adalah indikasi bahwa jenis tanaman tersebut potensial sebagai fitoremediator logam berat.
11
Tabel 6. Nilai BCF dan TF logam Cd dan Cu pada tanaman C. zizanioides (L.)
Perlakuan BCF TF
Tabel 7 menunjukkan removal efficiency Cd dan Cu oleh C. zizanioides
(L.). Secara umum, penurunan kadar Cd dan Cu di air berbanding lurus dengan akumulasi di akar dan daun C. zizanioides (L.). Removal efficiency untuk Cd adalah 37,64% (Cd1); 48,46% (Cd2.5) dan 48,84% (Cd5), dan untuk Cu adalah 32,55% (Cu2.5), 54,68% (Cu5), dan 52,59% (Cu7.5).
Tabel 7. Removal efficiency logam Cd dan Cu di air
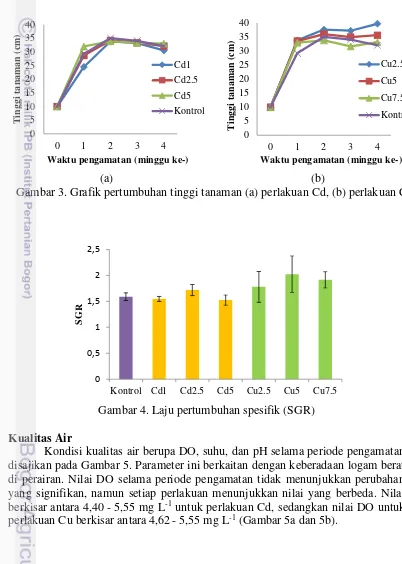
Tinggi tanaman C. zizanioides (L.)
Tinggi tanaman C. zizanioides (L.) pada berbagai perlakuan dapat dilihat pada Gambar 3 (a) dan (b). Secara keseluruhan, baik pada perlakuan Cd maupun Cu, penambahan tinggi tanaman yang signifikan terjadi antara minggu ke-0 hingga minggu ke-1. Hal ini membuktikan bahwa pada periode tersebut, unsur hara yang berada di lingkungan masih efektif digunakan oleh tanaman. Namun pada minggu berikutnya, pertambahan tinggi tanaman tidak menunjukkan hasil yang signifikan dikarenakan logam Cd dan Cu yang berada di lingkungan menjadi penyebab terhalangnya tanaman untuk tumbuh maksimal.
12
Meskipun demikian, akar tanaman ini masih dapat tumbuh dengan dicirikan serabut baru dari akar tersebut (Lampiran 1).
Laju pertumbuhan spesifik (SGR) C. zizanioides (L.)
Nilai SGR tertinggi adalah pada perlakuan Cu5 (2,02±0,35) dan terendah pada perlakuan Cd5 (1,52±0,10), sedangkan kontrol (1,59±0,07) (Gambar 4). Pertumbuhan tanaman dengan perlakuan Cu, rata-rata memperoleh hasil yang lebih tinggi jika dibandingkan perlakuan Cd. Hal ini diduga terjadi karena sebagian Cu digunakan untuk proses pertumbuhan tanaman.
Gambar 4. Laju pertumbuhan spesifik (SGR)
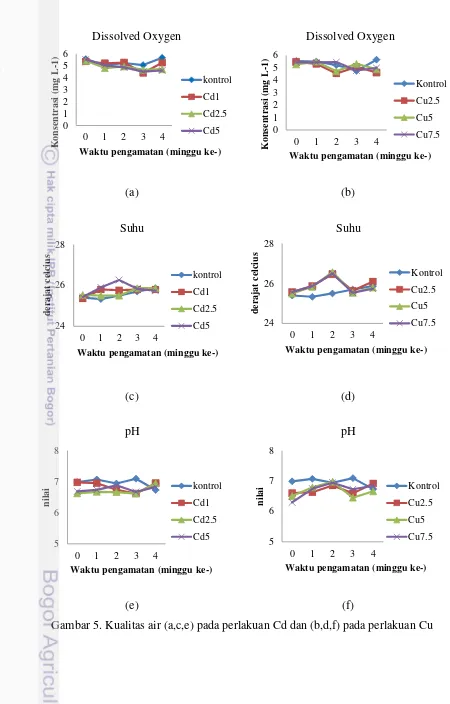
Kualitas Air
Kondisi kualitas air berupa DO, suhu, dan pH selama periode pengamatan disajikan pada Gambar 5. Parameter ini berkaitan dengan keberadaan logam berat di perairan. Nilai DO selama periode pengamatan tidak menunjukkan perubahan yang signifikan, namun setiap perlakuan menunjukkan nilai yang berbeda. Nilai berkisar antara 4,40- 5,55 mg L-1 untuk perlakuan Cd, sedangkan nilai DO untuk perlakuan Cu berkisar antara 4,62- 5,55 mg L-1 (Gambar 5a dan 5b).
0
Kontrol Cd1 Cd2.5 Cd5 Cu2.5 Cu5 Cu7.5
S
GR
(a) (b)
13
(a) (b)
(c) (d)
(e) (f)
14
Suhu air yang terukur selama periode pengamatan berkisar antara 25,40 °C – 26,26 °C pada perlakuan Cd, sedangkan pada perlakuan Cu berkisar antara 25,40 °C – 26,56 °C. Nilai suhu pada perlakuan kontrol terus meningkat selama periode pengamatan, sedangkan pada perlakuan Cd dan Cu, suhu mengalami fluktuasi (Gambar 5c dan 5d).
Nilai pH selama periode pengamatan berkisar antara 6.62-7.09 untuk kedua perlakuan. Nilai pH berfluktuatif selama periode pengamatan. Perlakuan Cd1 menunjukkan penuruan nilai pH dari minggu ke-0 hingga minggu ke-3, namun meningkat pada minggu ke-4, sedangkan pada perlakuan lainnya, nilai pH mengalami penaikan dan penurunan pada setiap minggunya (Gambar 5e dan 5f). Hal ini dapat terjadi karena faktor lingkungan
Pembahasan
Hasil analisis logam berat Cd dan Cu terhadap sampel air pada penelitian ini menunjukkan adanya penurunan konsentrasi selama periode pengamatan. Penurunan konsentrasi kedua logam yaitu sekitar 50% terjadi dari minggu ke-0 hingga minggu ke-1, sedangkan untuk minggu berikutnya kurang dari 5%. Hal ini menunjukkan bahwa C. zizanioides (L.) beradaptasi pada lingkungan yang baru dengan menyerap logam berat. Setiap tanaman memerlukan kondisi lingkungan yang sesuai untuk pertumbuhan dan perkembangannya, namun dengan adanya logam tersebut menjadi cekaman (stress) lingkungan bagi tanaman. Berdasarkan data pada Tabel 2 dan Tabel 3, C. zizanioides (L.) memerlukan waktu adaptasi lebih kurang satu minggu dalam penyesuaian fisiologis tubuhnya terhadap konsentrasi logam yang diberikan. Penyesuaian tersebut dicirikan dengan konsentrasi logam yang menurun cukup besar pada minggu pertama, sedangkan pada minggu berikutnya kurang dari minggu pertama, serta terus mengalami penurunan sampai minggu terakhir.
Nilai konsentrasi logam Cd di air pada perlakuan Cd1 dan Cd5 mengalami penurunan, namun berbeda untuk perlakuan Cd2.5 yang mengalami fluktuasi. Nilai konsentrasi logam yang berfluktuasi pada perlakuan Cd2.5 dapat disebabkan oleh faktor internal, yaitu kondisi tanaman itu sendiri, maupun faktor eksternal meliputi kondisi lingkungan yang tidak mendukung pada proses metabolisme tanaman.
Kondisi lingkungan, seperti DO, suhu, dan pH merupakan faktor pendukung keberadaan logam di air. Oksigen terlarut mempengaruhi kelarutan logam (Habashy dan Hassan 2010), kenaikan suhu dapat meningkatkan toksisitas logam (Sarjono, 2009), sedangkan kenaikan pH dapat menurunkan kelarutan logam (Palar, 2004). Hasil pengukuran parameter tersebut pada penelitian ini tidak menunjukkan perbedaan yang signifikan untuk setiap perlakuan (Gambar 5). Oleh karena itu, pada perlakuan Cd2.5 diduga kondisi tanaman C. zizanioides (L.) kurang mampu menyerap logam dalam jumlah besar. Keberadaan logam dengan konsentrasi yang terlalu tinggi di dalam tubuh tanaman ini akan dikeluarkan kembali ke lingkungan dengan maksud menyeimbangkan kondisi di dalam dan luar tanaman C. zizanioides (L.).
15
Perbedaan tersebut terlihat dari penurunan konsentrasi logam selama waktu penelitian. Pada perlakuan Cu 2,5, nilai konsentrasi menurun lebih kecil dibandingkan dengan perlakuan Cu5 dan Cu7,5 pada minggu pertama. Perbedaan penurunan konsentrasi tersebut berkaitan erat dengan kemampuan tanaman dalam mengakumulasi logam. Kondisi tersebut menunjukkan bahwa meskipun setiap tanaman dikondisikan sama, baik dari segi umur, tinggi, maupun bobot, namun setiap individu memiliki kemampuan yang berbeda dalam beradaptasi dengan lingkungan yang baru.
Nilai konsentrasi logam di air yang terus menurun seiring berjalannya waktu, berbanding lurus dengan total penyerapan logam oleh tanaman. Logam Cd dan Cu yang terakumulasi oleh C. zizanioides (L.) lebih tinggi di akar dibandingkan di daun. Penelitian lain menyebutkan bahwa akar mengakumulasi logam lebih besar dari jaringan lainnya seperti pada Typha spp., Juncus effusus, Phragmites australis, Schoenoplectus validus (D eng et al. 2004).
Akar C. zizanioides (L.) dapat mengenali logam Cd dan Cu sebagai unsur toksik. Hal ini sesuai dengan pernyataan Gupta dan Sinha (2008) yang menyebutkan bahwa akar tanaman dapat mengenali logam sebagai unsur toksik sehingga terjadi mekanisme inaktivasi seperti sekuestrasi unsur tersebut di vakuola atau pada dinding sel. Menurut Priyanto dan Prayitno (2004), tanaman mempunyai mekanisme detoksifikasi dengan cara menimbun logam di bagian akar. Penelitian ini menunjukkan bahwa logam lebih banyak terakumulasi di akar
C. zizanioides (L.).
Tingginya konsentrasi logam yang dipaparkan terhadap C. zizanioides (L.) juga mempengaruhi kemampuan tanaman dalam mengakumulasi logam. Akumulasi total untuk logam Cd adalah 7,03 mg kg-1 (Cd1); 35,63 mg kg -1 (Cd2,5); 54,44 mg kg-1 (Cd5), sedangkan untuk logam Cu adalah 20,10 mg kg-1
(Cu2,5); 33,27 mg kg-1 (Cu5); 42,54 mg kg-1 (Cu7,5). Roongtanakiat et al. (2003) melaporkan bahwa vetiver mampu mengakumulasi Cu dalam jumlah besar di daun (47 mg kg-1) dan di akar (66 mg kg-1). Penelitian ini menunjukkan bahwa semakin tinggi tingkat konsentrasi logam yang diberikan, semakin besar logam yang diakumulasi. Menurut Clemens et al. (2002), setiap tingkat konsentrasi logam yang diberikan pada tanaman mempengaruhi fungsi penyerapan dan selektivitas pada kegiatan transportasi, sehingga mempengaruhi tingkat akumulasi logam.
Perbandingan konsentrasi di akar dan di air dapat dilihat dari nilai BCF, sedangkan perbandingan besarnya akumulasi logam di akar dan di daun dilihat dari nilai TF. Nilai BCF untuk perlakuan Cd adalah 0,83 (Cd1), 2,51 (Cd2,5), dan 2,23 (Cd5), sehingga perbandingannya adalah Cd2,5>Cd5>Cd1. Nilai tersebut sesuai dengan data konsentrasi logam di air yang menunjukkan bahwa pada perlakuan Cd2,5, keberadaan logam berfluktuasi selama waktu penelitian, sedangkan logam pada perlakuan Cd1 dan Cd5 terus menurun seiring berjalannya waktu.
16
perlakuan menunjukkan perbedaan dalam mengakumulasi logam yang terkait dengan faktor internal tanaman itu sendiri.
Data lainnya yang menunjukkan perbedaan konsentrasi di setiap perlakuan Cd, adalah nilai TF sebesar 0,04 (Cd1), 0,01 (Cd2,5), dan 0,01 (Cd5). Perlakuan Cd1 memiliki nilai TF paling tinggi dibandingkan dengan perlakuan Cd2,5 dan Cd5. Hal ini menunjukkan bahwa sebagian besar logam ditranslokasikan ke daun lebih banyak dibandingkan kedua perlakuan lainnya, dan nilai tersebut memperkuat data BCF yang memiliki nilai terendah, karena logam yang tertahan di akar lebih sedikit. Logam yang ditranslokasikan ke daun lebih banyak menunjukkan bahwa C. zizanioides (L.) memanfaatkannya untuk proses pertumbuhan dan perkembangan.
Nilai BCF untuk logam Cu adalah 1,65 (Cu2,5), 1,74 (Cu5), dan 1,69 (Cu7,5), sehingga perbandingannya adalah Cu5>Cu7,5>Cu2,5. Hal ini berkaitan dengan banyaknya logam yang diserap oleh akar C. zizanioides (L.). Semakin tinggi konsentrasi logam di air, semakin besar logam yang diserap oleh C. zizanioides (L.). Namun pada konsentrasi yang lebih tinggi, yaitu pada perlakuan Cu7,5, logam tersebut sebagian ditraslokasikan ke daun, sehingga nilai BCF perlakuan Cu7,5 lebih kecil dari Cu5. Nilai BCF untuk setiap perlakuan Cu lebih besar dibandingkan dengan kontrol (0,83). Hal ini menunjukkan bahwa C. zizanioides (L.) membutuhkan Cu sebagai mikronutrien untuk pertumbuhannya. Menurut Boudet et al. (2011) dan Deng et al. (2004), logam Cu merupakan mikronutrien esensial. Hal ini terindikasikan dari kondisi tanaman meskipun pada perlakuan kontrol tidak ditambahkan logam Cu ke dalam air, tanaman tetap menyerap Cu dari nutrisi yang ditambahkan. Penyerapan logam tersebut sebagian ditranslokasikan ke daun, sehingga perlakuan kontrol memiliki nilai TF lebih besar dari perlakuan Cu yaitu sebesar 1,37, sedangkan untuk perlakuan Cu yaitu 0,04 (Cu2,5), 0,03 (Cu5), dan 0,07 (Cu7,5). Berdasarkan hal tersebut, nilai TF berbanding lurus dengan nilai BCF, yaitu serapan logam dengan perlakuan konsentrasi rendah lebih banyak disimpan di akar. Namun dengan perlakuan konsentrasi lebih dari 5 ppm, logam lebih banyak ditranslokasikan ke daun atau bagian tubuh lainnya Translokasi logam dari akar ke daun dibutuhkan untuk proses fitostabilisasi, sesuai dengan pernyataan Liong et al. (2009) bahwa mekanisme akumulasi logam oleh tanaman untuk konsentrasi tinggi dapat diakumulasi di akar sampai batas tertentu.
Akumulasi logam oleh C. zizanioides (L.) berbanding lurus dengan konsentrasi logam di air. Nilai removal efficiency Cd dan Cu menunjukkan persentase pemindahan logam dari air ke dalam tubuh C. zizanioides (L.) selama periode waktu tertentu. Persentase logam Cd pada penelitian ini selama 28 hari pengamatan adalah 37,64% (Cd1), 48,46% (Cd2.5) dan 48,84% (Cd5). Berdasarkan data tersebut terlihat bahwa semakin tinggi konsentrasi logam Cd di air, maka semakin besar persentase removal efficiency. Hal berbeda terjadi pada persentase Cu, yaitu sebesar 32,55% (Cu2.5), 54,68% (Cu5), dan 52,59% (Cu7.5), yang menunjukkan kecenderungan peningkatan persentase removal efficiency. Namun nilai persentase tersebut menurun pada tingkat konsentrasi yang lebih besar dari 5 ppm.
17
minggunya (Gambar 3). Sitompul dan Guritno (1995) menyebutkan bahwa tinggi tanaman merupakan ukuran pertumbuhan yang paling mudah dilihat dan setiap harinya akan mengalami perubahan. Tinggi C. zizanioides (L.) yang mencapai maksimum pada periode minggu ke-0 hingga minggu ke-1, menunjukkan bahwa serapan logam pada minggu pertama digunakan untuk proses metabolisme C. zizanioides (L.). Namun seiring berjalannya waktu, sebagian logam yang terserap tidak digunakan oleh C. zizanioides (L.) untuk proses tersebut. Logam Cd diserap dalam bentuk ion Cd2+ dan logam Cu diserap dalam bentuk ion Cu2+. Serapan tersebut kemudian ditranslokasikan ke daun.
Berkaitan dengan akumulasi total logam, baik di akar maupun di daun, C. zizanioides (L.) lebih banyak menyerap logam Cu dibandingkan Cd. Menurut Boudet et al. (2011) dan Deng et al. (2004), logam Cu merupakan mikronutrien esensial, sehingga adanya Cu yang dipaparkan terhadap C. zizanioides (L.) akan digunakan untuk proses pertumbuhan. Ditambahkan oleh Effendi (2003), Cu digunakan untuk penyusun plastocyanin yang berfungsi dalam transpor elektron dalam proses fotosintesis. Namun, Cu pada konsentrasi yang tinggi dapat menjadi toksik dan menghambat pertumbuhan tanaman (Li dan Xiong 2004; Syahputra 2005; Mangkoediharjo dan Samudro, 2010).
Laju pertumbuhan C. zizanioides (L.) dilihat dari nilai SGR. Perlakuan Cd yang menunjukkan laju pertumbuhan lebih tinggi dibandingkan dengan kontrol adalah perlakuan Cd2,5, sedangkan perlakuan Cd1 dan Cd5 memiliki laju pertumbuhan yang lebih rendah dari kontrol. Berdasarkan hasil analisis konsentrasi logam Cd di air dan tanaman, yang mempengaruhi terhadap laju pertumbuhan C. zizanioides (L.) adalah faktor internal tanaman itu sendiri. Alasan ini memperkuat dugaan terhadap nilai SGR. Laju pertumbuhan C. zizanioides (L.) pada perlakuan Cu lebih besar dibandingkan dengan kontrol. Nilai SGR paling besar terdapat pada perlakuan Cu 5. Hal ini berkaitan dengan data kandungan logam berat di C. zizanioides (L.) yang menunjukkan bahwa semakin besar kandungan Cu di air, akan semakin banyak yang diserap untuk proses pertumbuhan. Hal ini sesuai dengan pernyataan Mangkoediharjo dan Samudro (2010), bahwa logam berat yang diberikan pada tanaman dalam jumlah tertentu dapat membantu mempercepat pertumbuhan tanaman sebagai suatu respon positif. Pada perlakuan Cu7,5 nilai SGR lebih kecil dari perlakuan Cu5. Hal ini membuktikan bahwa kandungan Cu yang terlalu tinggi dapat menghambat pertumbuhan. Menurut Gerth (2000), logam berat dapat menghambat pertumbuhan akar dan daun serta menurunnya laju transpirasi. Secara keseluruhan, setiap individu C. zizanioides (L.) yang mendapat paparan logam dengan konsentrasi berbeda menunjukkan kemampuan dalam proses pertumbuhannya, yang dilihat dari tinggi tanaman yang terus bertambah selama periode pengamatan.
18
(Lampiran 2-8). Hal tersebut menunjukkan bahwa logam tidak disimpan pada bagian yang diamati. Menurut Haryati et al. (2012), logam dalam bentuk ion dapat larut dalam lemak dan mampu melakukan penetrasi pada membran sel, sehingga ion logam akan terakumulasi di dalam sel.
Pengukuran kualitas air berupa DO, suhu, dan pH merupakan data pendukung terhadap keberadaan logam di air pada penelitian ini. Pertama yaitu DO yang berkisar antara 4,40-5,55, menunjukkan batas normal di perairan. Apabila kandungan oksigen terlarut rendah, daya larut logam lebih rendah. Selanjutnya suhu, pada penelitian ini sedikit berfluktuasi, pada kisaran 25,40-26,56, dan kisaran tersebut masih tergolong pada batas normal. Kondisi normal ini memberikan pengaruh terhadap C. zizanioides (L.) yang terus mengalami pertumbuhan selama periode pengamatan. Menurut Habashy dan Hassan (2010), suhu merupakan faktor penting yang dapat mempengaruhi pertumbuhan dari organisme. Cepat lambatnya akumulasi logam oleh C. zizanioides (L.) selama periode pengamatan diduga juga dipengaruhi oleh adalah faktor suhu. Penelitian lain menyebutkan bahwa konsentrasi logam berat terakumulasi dengan meningkatnya suhu lingkungan, yang berakibat partikel logam berat bergerak lebih cepat sehingga lebih cepat terakumulasi (Kusumastanto, 2004). Nilai pH berkisar antara 6,62-7.09. Kisaran tersebut tergolong netral, sehingga kondisi ini merupakan kondisi yang normal untuk pertumbuhan C. zizanioides (L.). Penelitian yang dilakukan oleh Connell dan Miller (1995) menunjukkan hasil bahwa kenaikan pH di perairan akan diikuti dengan penurunan kelarutan logam berat, sehingga logam berat cenderung mengendap Sebaliknya, ketika pH air rendah, racun dari logam berat akan meningkat. Penelitian ini membuktikan bahwa kondisi pH yang netral tidak mengakibatkan kondisi logam di air mengendap dan tidak menyebabkan racun logam terhadap C. zizanioides (L.).
Berdasarkan data konsentrasi logam di air dan di tanaman selama pengamatan, penggunaan C. zizanioides (L.) dapat dijadikan sebagai fitoremediator logam berat Cd dan Cu. Menurut Minh dan Khoa (2009), fitoremediasi merupakan teknologi ramah lingkungan untuk penanganan polusi dan perbaikan lingkungan.
KESIMPULAN DAN SARAN
Keimpulan
Berdasarkan hasil penelitian, dapat diambil kesimpulan yaitu:
1. Penggunaan C. zizanioides (L.) mampu menurunkan konsentrasi logam berat Cd dan Cu di air selama 28 hari dengan efisiensi penyerapan logam dalam waktu 3 minggu.
19
Saran
Konsentrasi logam Cd dan Cu di air pada minggu ke-3 dan minggu ke-4 tidak menunjukkan penurunan yang signifikan, oleh karena itu saran yang dapat diberikan dari hasil penelitian ini adalah menggunakan tanaman C. zizanioides
(L.) untuk proses remediasi logam berat dengan tiga minggu pengamatan.
DAFTAR PUSTAKA
[APHA]. 2012. Standard Methods For the Examination of Water and Wastewater, 22nd edition.
[PPRI]. 2014. Peraturan Pemerintah Republik Indonesia Nomor : 20 Tahun 1990
Tentang Pengendalian Pencemaran Air http://www.pu.go.id/satminkal/itjen/lama/hukum /a/pp20-90.pdf.
Diakses pada tanggal 24 September 2014.
Ahmadpour P. 2011. Evaluation Of Four Plant Species For Phytoremediation Of Cadmium- And Copper-Contaminated Soil. [Thesis]. Submitted to the School of Graduate Studies, Universiti Putra Malaysia, in Fulfilment of the Requirements for the Degree of Master of Science.
Aibibu N, Yunguo L, Guangming Z, Xin W, Beibei C, Huaxio S, Li X. 2010. Cadmium accumulation in vetiveria zizanioides and its effects on growth, physiological and biochemical characters. Bioresource Technology 101(1): 6297–6303.
Aksorn E, Benjamart C. 2013. Bioaccumulation Of Heavy Metal Uptake By Two Different Vetiver Grass (Vetiveria zizanioides and Vetiveria nemoralis) species. African Journal of Agriculture Research. 8(24):3166-3171.
Akan JC, Abdulrahman FI, Sodipo OA, Akan U. 2009. Bioaccumulation of some heavy metals in six freshwater fishes caught from Lake Chad in Doron Buhari, Maiduguri, Borno State, Nigeria. Journal of Applied Sciences in Environmental Sanitation. 4(2): 103 – 114.
Baker A.J. 1981. Accumulator and excludersstrategic in the response of plants to heavy metals. Journal Plant Nutrition. 3: 1-4
Boudet LC, Escalante A, Von Haeften G, Moreno V, Gerpe M. 2011. Assessment of Heavy Metal Accumulation in Two Aquatic Macrophytes: a Field Study. J Braz Soc Ecotoxicol. 6: 57-64.
Cave MR, Owen B, Simon RNC, Jennifer MC, Malcolm SC, Douglas LM. 2001. Atomic Spectrometry Update: Environmental Analysis. Journal of analytical atomic spectrofotometry. 16(1) : 194-235.
20
Connel DW, G J Miller. 1995. Kimia dan Ekotoksikologi Pencemaran. UI-Press. 520 hal
Dedy IK, Adi S, Irwani. 2013. Studi Akumulasi Logam Tembaga (Cu) dan Efeknya terhadap Struktur Akar Mangrove (Rhizopora mucronata).
Journal of Marine Research. 4(2):8-15.
Deng H, Ye ZH, Wong MH. 2004. Accumulation of lead, zinc, copper and cadmium by 12 wetland plants species thriving in metal contaminated sites in China. Environ. Pollut. J.envpol. 132(1): 29–40.
Ebbs.S.D., Lasat M.M., Brady J., Cornish J.,Gordon R., Kochian L.V. 1997. Phytoextraction of cadmium and zinc from a contaminated soil. Journal Environ. Qral 26 (5).
Fry SC, Miller JC, Dumville JC. 2002. A proposed role for copper ions in cell wall loosening. Plant Soil. 247: 57–67.
Gabbrielli R, Mattioni C, Vergnano O. 1991. Accumulation mechanisms and heavy metal tolerance of a nickel hyperaccumulator. J Plant Nutr.
14:1067-1080.
Gerth, A. 2000. Phytoremediation of soil and sludge with special examination of heavy metal ontamination In: Wise DL, Trantolo DJ, Cichon EJ, Inyang HI, Stottmeister U (ed). : Bioremediation of Cotaminated Soils. Marcek Dekker Inc. New York. Basel. P. 787-809.
Ghiasi F, Mirzargar SS, Bdakhshan H. Shamsi S. 2010. Effects Of Low Concentrations Of Cadmium On The Level Of Lysozyme In Serum, Leukocyte Count And Phagocytic Index In Cyprinus Carpio Under The Wintering Conditions. Journal Of Fisheries And Aquatic Science. 5(8): 113 – 119.
Giyatmi WL, Solichatun, Sugiyarto 2008. Pertumbuhan, KandunganKlorofil, dan Laju Respirasi Tanaman Garut (Maranta arundinacea L.) setelah Pemberian Asam Giberelat (GA3) The growth, chlorophyll content and respiration rate of arrowroot (Maranta arundinacea L.) after Giberelic Acid (GA3) treatment. Bioteknologi. 5 (1): 1-9
Ghosh M and S.P. Singh. 2005. A comparative study of cadmium phytoextraction by accumulator and weed species. Environ. Pollut. 133: 365-371.
Gupta, A. K, Sinha, S. 2008. Decontamination and/or revegetation of fly ash dykes through naturally growing plants. Journal of Hazardous Materials 153 :1078-1084
Groppa MD, Zawoznik MS, Tomaro MS, Benavides MP. 2008. Inhibition of Root Growth and Polyamine Metabolism in Sunflower (Helianthus annuus) Seedlings under Cadmium and Copper Stress Biological Trace Element Research. 126: 246–256.
Habashy MM, MMS. Hassan. 2010. Effects of temperature and salinity on growth and reproduction of the freshwater prawn, Macrobrachium rosenbergii
21
Haryati M, Purnomo T, Kuntjoro S. 2012. Kemampuan Tanaman Genjer (Limnocharis Flava (L.) Buch.) Menyerap Logam Berat Timbal (Pb) Limbah Cair Kertas pada Biomassa dan Waktu Pemaparan Yang Berbeda. Lateral Bio. 1(3).
Jiang W, Liu D, Liu X. 2001. Effects of copper on root growth, cell division and nucleolus of Zea mays. Biol Plant. 44:105-109.
Khan S, Ahmad I, Shah, M T, Rehman Sh, Khaliq A. 2009. Use of constructed wetland for the removal of heavy metals from industrial wastewater.
Journal of Environmental Management. 90 : 3451–3457.
Kittiwongwattana C and Supachai V. 2013. Effects of nutrient media on vegetative growth of Lemna minor and Landoltia punctata during in vitro and ex vitro cultivation. Maejo Int. J. Sci. Technol. 7 (01): 60-69
Li T, Xiong. 2004. A novel Response of wild type duckweed (Lemna paucicostala Hegelm) to Heavy Metals. Environ. Toxicol. 19 (2): 95-102.
Mahmood T, Islam KR, Muhammad S. 2007. Toxic effects of heavy metal on early growth and tolerance of cereal crops. Pak J Bot. 39: 451-462
Mattjik AA, Sumertajaya IM. 2013. Perancangan Percobaan dengan Aplikasi SAS dan MINITAB Jilid I. Bogor: PT Penerbit IPB Press.
Mellem J, H. Baijnath and B. Odhav. 2012. Bioaccumulation of Cr, Hg, As, Pb, Cu and Ni with the ability for hyperaccumulation by Amaranthus dubius. Afr. J. Agric. Res. 7: 591-596.
Miettinen, J. K. 1977. Inorganic Trace Element as Water Pollutan to Healthand Aquatic Biota. Academy Press. New York.
Minh VV, Khoa LV. 2009. Phytoremediation of Cadmium and Lead Contaminated soil types by Vetiver grass. VNU of journal science. 25: 98-103.
Muthukumaravel K, Paulay MG. 2007. Toxic effect of cadmium on the electrophoretic protein patterns of gill and muscle of Oreochromis mossambicus. E-Journal of Chemistry. 14(2): 284 – 286.
Narain S, Ojha CSP, Mishra SK, Chaube UC, Sharma PK. 2011.Cadmium and Chromium Removal by Aquatic Plant. International Journal of environmental sciences 6(1): 1297-1304.
Niu Z X, Li XD, Sun LN, Sun TH. 2012. Changes Of Three Organic Acids In The Process Of Cd And Pb Phytoextraction By Helianthus annuus L. Plant Soil Environt. 58(11): 487–494.
Piotrowska CA, Czameki Z. 2003. Phytoextraction of heavymetals by hemp during anaerob sewage slugde management in the non-industrial site.
Journal Of Environment Studies. 12(1):779-784.
22
Prasad MNV. 1995. Cadmium Toxicity and tolerance in vascular plant.
Environmental Experimental Botany. 35 (4): 525–545.
Rai UN, Sinha S, Tripathi RD, Chandra. 1995. Wastewater treatability potential of some aquatic macrophytes: removal of heavy metals. Ecol. Eng. 5: 5– 12.
Roongtanakiat N, Nirunrach T, Chanyotha S, Hengchaovanich D. 2003. Uptake of heavy metals in landfill leachate by vetiver grass. Kasetsart J. (Nat. Sci.). 37: 168-175
Roongtanakiat N, Chairoj P. 2001a Uptake potential of some heavy metals by vetiver grass Kasetsart J. (Nat. Sci.). 35: 46-50.
Roongtanakiat N, Chairoj P. 2001b Vetiver grass for the remediation of soil contaminated with heavy metals Kasetsart J. (Nat. Sci.). 35: 433-440.
Salt DE. 2000. Phytoextraction: Present applications and future promise. Di dalam: Wise DL, Trantolo DJ, Cichon EJ., Inyang HI, dan Stottmeister U (Ed). Bioremediation of Cotaminated Soils Marcek Dekker Inc. New York; Basel. hlm 729-743.
Sample DJ, Wang CY, Fox LJ. 2013. Innovative Best Management Fact Sheet No.1 : Floating Treatment Weatlands. Available access www.ext.vt.edu. Diakses tanggal 3 Oktober 2014.
Scherr C, Meinhard S, Jörg S, Stephan B. 2009. Effects of potentised substances on growth rate of the water plant Lemna gibba L. Complementary Therapies in Medicine. 17 : 63-70 .
Setyaningsih L. 2007. Pemanfaatan Cendawan Mikoriza Arbuskula Dan Kompos Aktif Untuk Meningkatkan Pertumbuhan Semai Mindi (Melia azedarach Linn) Pada Media Tailing Tambang Emas Pongkor. Tesis. Bogor: Sekolah Pasca Sarjana Institut Pertanian Bogor
Singh SK, Juwarkar AA, Kumar S, Meshram J, Fan M. 2007. Effect of amendment on phytoextraction of arsenic by Vetiveria zizanioides from soil. Int. J.Environ. Sci. Tech. 4: 339-344.
Subhashini V, Swamy AVVS. 2013. Phytoremediation Of Cadmium And Chromium From Contaminated Soils Using Physalis Minima Linn.
American International Journal Of Research In Formal, Applied & Natural Sciences. 3(1):119-122.
Syahputra R. 2005. Fitoremediasi Logam Cu dan Zn dengan Tanaman Eceng Gondok (Eichornia crassipes (Mart.) Solms). Logika 2(2):57-67.
Swain G, Adhikari S, Mohanty P. 2014. Phytoremediation of Copper and Cadmium from Water Using Water Hyacinth, Eichhornia Crassipes. International Journal of Agricultural Science and Technology (IJAST). 2 (1) :1-7.
23
Truong P, Van TT, Pinners E, Booth D. 2011. Sistem Vetiver : Solusi yang Telah Terbukti dan Ramah Lingkungan. Eds Bahasa Indonesia. The Indonesian Vetiver Network.
Tudoreanu L, Phillips CJC. 2004. Modeling Cadmium Uptake And Accumulation In Plants. Advances in Agronomy. 84(1):121–157.
Vamerali T, Marchiol L, Bandiera M, Fellet G, Dickinson NM, Lucchini P, Mosca G, Zerbi G. 2012. Italian Journal of Agronomy 42 :323–330.
Vinodhini R, Narayanan M. 2008. Bioaccumulation Of Heavy Metals in Organs of Fresh Water Fish Cyprino carpio (Common Carp). International Journal of Environmental Science and Technology. 5(2): 179 – 182.
Weragoda SK, Jinadasa KBSN, Zhang DQ, Gersberg RM, Tan SK, Tanaka N, Jem NW. 2012. Tropical Application of Floating Treatment Wetlands. Springer.
White SA, Cousin MM. 2013. Floating Treatment Wetland Aided Remediation Of Nitrogen Andphosphorus From Simulated Stormwater Runoff.
Ecological Engineering. 61(1) :207– 215.
Wu L. 1990. Colonization and establisment of plant in contaminated environment.
Evolutionary Aspects. CRC Press, Boca Raton. 269–284.
Yang B, Shu, WS, Ye ZH, Lan CY, Wong MH. 2003. Growth and metal accumulation in vetiver and two Sesbania species on lead/zinc mine tailings. Chemosphere. 52: 1593-1600.
24
LAMPIRAN
Lampiran 1 Gambar pertumbuhan C. zizanioides, L selama periode pengamatan
Panjang daun C. zizanioides, L Panjang akar C. zizanioides, L
Lampiran 2 Pengamatan Struktur Jaringan Daun dan Akar C. zizanioides, L pada perlakuan kontrol
Daun Kontrol
Minggu ke-1 Minggu ke-2
25
Akar (Kontrol)
Minggu ke-1 Minggu ke 4
Lampiran 3 Pengamatan Struktur Jaringan Daun dan Akar C. zizanioides, L pada perlakuan logam Cd1
Daun (Cd1)
Minggu ke-1 Minggu ke-2
26
Akar (Cd1)
Minggu ke-1 Minggu ke 4
Lampiran 4 Pengamatan Struktur Jaringan Daun dan Akar C. zizanioides, L pada perlakuan logam Cd2.5
Daun (Cd2.5)
Minggu ke-1 Minggu ke-2
27
Akar (Cd2.5)
Minggu ke-1 Minggu ke 4
Lampiran 5 Pengamatan Struktur Jaringan Daun dan Akar C. zizanioides, L pada perlakuan logam Cd5
Daun (Cd5)
Minggu ke-1 Minggu ke-2
28
Akar (Cd5)
Minggu ke-1 Minggu ke 4
Lampiran 6 Pengamatan Struktur Jaringan Daun dan akar C. zizanioides, L pada perlakuan logam Cu2.5
Daun Cu (2.5)
Minggu ke-1 Minggu ke-2
29
Akar (Cu2.5)
Minggu ke-1 Minggu ke 4
Lampiran 7 Pengamatan Struktur Jaringan Daun dan Akar C. zizanioides, L pada perlakuan logam Cu5
Daun (Cu5)
Minggu ke-1 Minggu ke-2
30
Akar (Cu5)
Minggu ke-1 Minggu ke 4
Lampiran 8 Pengamatan Struktur Jaringan Daun dan Akar C. zizanioides, L pada perlakuan logam Cu7.5
Daun (Cu7.5)
Minggu ke-1 Minggu ke-2
31
Akar (Cu7.5)
Minggu ke-1 Minggu ke 4
Lampiran 9 Uji ANOVA konsentrasi logam Cd di air
Source SS df MS F Sig.
Perlakuan 786,591 2 393,295 3,963 ,030
Waktu 14668,095 4 3667,024 36,950 ,000
Perlakuan * Waktu 394,936 8 49,367 ,497 ,848
Error 2977,250 30 99,242
Total 203364,553 45
Uji lanjut Duncan untuk logam Cd Perlakuan
Perlakuan N Subset
1 2
Cd1 15 60,9264
Cd2,5 15 61,2392
Cd5 15 69,9477
Sig, ,932 1,000
Uji lanjut Duncan untuk logam Cd Waktu
Waktu N Subset
1 2
M4 9 53,1164
M3 9 53,6206
M2 9 55,7807
M1 9 57,6712
M0
9 100,000
0
32
Lampiran 10 Uji ANOVA konsentrasi logam Cu di air
Source SS df MS F Sig.
Perlakuan 2864,801 2 1432,400 49,102 ,000
Waktu 20580,097 4 5145,024 176,367 ,000
Perlakuan * Waktu 1130,905 8 141,363 4,846 ,001
Error 875,167 30 29,172
Total 202430,138 45
Uji lanjut Duncan untuk logam Cu Perlakuan
Perlakuan N Subset
1 2
Cu2.5 15 56,2529
Cu5 15 57,9301
Cu7.5 15 73,9548
Sig. ,402 1,000
Uji lanjut Duncan untuk logam Cu Waktu
Waktu
N Subset
1 2 3 4 5
M4 9 38,4409
M3 9 46,9728
M2 9 58,7945
M1 9 69,3548
M0 9 100,0000
Sig. 1,000 1,000 1,000 1,000 1,000
Lampiran 11 Uji ANOVA SGR
Source SS df MS F Sig.
Perlakuan 0,753 6 0,126 3,277 0,032
Waktu 0,536 14 0,038
Error 63,162 21
33
Uji lanjut SGR
Perlakuan N Subset
1 2
Kontrol 3 1,5022
Cd5 3 1,5255
Cd1 3 1,5465
Cd2.5 3 1,7190 1,7190
Cu2.5 3 1,7799 1,7799
Cu7.5 3 1,9167
Cu5 3 2,0257
34
RIWAYAT HIDUP
Penulis dilahirkan di Bandung tanggal 29 Desember 1989 dari ayah Dadang Sumarna dan Ibu Nani Suryani. Penulis adalah putri kedua dari empat bersaudara.
Pada tahun 2008 penulis lulus dari Sekolah Menengah Atas Negeri 6 Bandung. Gelar Sarjana Sains diraih pada tahun 2012 lulus dari jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Padjadjaran. Mendapat beasiswa dari Eka Tjipta Foundation (2008-2012).
Penulis pernah bekerja sebagai staff pengajar di sebuah bimbingan belajar ternama di Kota Bandung (2012-2013). Penulis pernah menjadi peserta program internasional Spring school (2015) dan mengikuti program student exchange ke Hokkaido University, Jepang (Oktober 2015-Maret 2016).