MANFAAT EKSTRAK DAUN SIRIH SEBAGAI
PENGHAMBAT KEJADIAN PENYAKIT ANTRAKNOSA
(Colletotrichum acutatum)
PADA CABAI SELAMA
PENYIMPANAN
DESI TRISNAWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Manfaat Ekstrak Daun Sirih sebagai Penghambat Kejadian Penyakit Antraknosa (Colletotrichum acutatum) pada Cabai Selama Penyimpanan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Desi Trisnawati
RINGKASAN
DESI TRISNAWATI. Manfaat Ekstrak Daun Sirih sebagai Penghambat Kejadian Penyakit Antraknosa (Colletotrichum acutatum) pada Cabai selama Penyimpanan. Dibimbing oleh LILIK PUJANTORO EN dan EFI TODING TONDOK.
Cabai merupakan komoditas sayuran yang sering dibutuhkan masyarakat dalam bentuk segar. Cabai termasuk produk yang tidak tahan lama dan memerlukan penanganan ekstra, sehingga tidak mengalami penurunan kualitas. Salah satu penyebab turunnya kualitas cabai adalah mikroorganisme, yaitu penyakit antraknosa yang disebabkan oleh Colletotrichum spp. Alternatif yang dapat dilakukan adalah dengan pemanfaatan bahan-bahan nabati sebagai fungisida. Penelitian ini bertujuan untuk menguji manfaat ekstrak daun sirih (EDS) yang berpotensi sebagai fungisida nabati dalam menghambat pertumbuhan
Colletotrichum acutatum pada cabai selama penyimpanan.
Penelitian dilaksanakan di Laboratorium Teknik Pengolahan Pangan dan Hasil Pertanian FATETA IPB, Laboratorium Teknik Lingkungan Biosistem FATETA IPB, dan Klinik Tanaman Departemen Proteksi Tanaman FAPERTA IPB. Proses penelitian ini dimulai dari persiapan bahan baku, pembuatan ekstrak daun sirih (EDS), pengujian pertumbuhan cendawan secara in-vitro pada media beracun, dan perlakuan pada cabai selama penyimpanan (uji in-vivo), serta pengujian kualitas fisik cabai.
Hasil penelitian menunjukkan bahwa metode perajangan merupakan metode ektraksi daun sirih terbaik diantara perlakuan lain, penggunaan konsentrasi ekstrak daun sirih 10% merupakan konsentrasi paling efektif dalam menghambat pertumbuhan Colletotrichum acutatum, perlakuan penyemprotan menggunakan ekstrak daun sirih 10% dapat menghambat terjadinya penyakit antraknosa paling baik, serta perlakuan pemberian ekstrak daun sirih pada cabai setelah panen tidak mengubah kualitas cabai secara signifikan, baik warna, aroma, kekerasan, maupun susut bobot.
SUMMARY
DESI TRISNAWATI. The Benefits of Piper betle Extract as Inhibitor of Antracnose (Colletotrichum acutatum) on Chili during Storage. Supervised by LILIK PUJANTORO EN and EFI TODING TONDOK.
Indonesian consumed chili as a condiment needed in fresh products. It is a perishable commodity so that it needs a treatment to prolong its self-life. One of the main causes of the quality change during storage is the microorganism fungus called Colletotrichum spp. which caused antracnose disease. In order to fix this problem, the researcher have an idea to use botanical fungicide. This research applies Piper betle extract as a potential botanical fungicide to decrease the growing of Colletotrichum acutatum on chili during storage.
This Study was conducted in Laboratorium Teknik Pengolahan Pangan dan Hasil Pertanian FATETA IPB, Laboratorium Teknik Lingkungan Biosistem FATETA IPB, and Klinik Tanaman Departemen Proteksi Tanaman FAPERTA IPB. The sequences of this research is started with the preparation of raw material, production of Piper betle extract, bioassay of betel extract by measuring the diameter of fungus growth through in vitro measurement, and counting the number of chili which still infected by the fungus after extract treatment during storage time (in vivo test), then identified the physical properties of chili.
The result shows that chopping was the best extraction method of raw material among other treatments, in-vitro test shows that the applying of 10%
Piper betle extract is the best concentration to hamper the growth of
Colletotrichum acutatum, and the in-vivo test shows that spraying was the best method to prevent antracnose disease during storage. This treatment was not affected the quality of chilli, such as color, aroma, texture, or weight loss.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Pascapanen
MANFAAT EKSTRAK DAUN SIRIH SEBAGAI
PENGHAMBAT KEJADIAN PENYAKIT ANTRAKNOSA
(Colletotrichum acutatum)
PADA CABAI SELAMA
PENYIMPANAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
66*93$39 9 ,49 )34/)96,9$/$#9 $9,#+49 '%,9
,8)$49,4/),-39 .9$9
*+9,8$+.,,9 +9
9
93%9/%3,74$9
$346'6%9-*#9
-+$3%9+$+$,9
/9/9 %*%)9
469
569/-/+9 46$9 ),-*-$93.,,9
0-/919641$3,-919
,*9'$,9 ,6/$9
%)4#6%9-*#9
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2015 ini ialah tentang penanganan pascapanen cabai merah, dengan judul manfaat ekstrak daun sirih sebagai penghambat kejadian penyakit antraknosa (Colletotrichum acutatum)
pada cabai selama penyimpanan.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Lilik Pujantoro EN, M.Agr dan Ibu Dr. Efi Toding Tondok, SP., M.ScAgr selaku pembimbing I dan II dalam bimbingannya selama ini. Terima kasih kepada Dirjen DIKTI (Program Beasiswa BPPDN) yang telah memberikan bantuan dana dari awal perkuliahan hingga selesai. Terima kasih kepada Bapak Prof. Dr. Ir. Sutrisno, M.Agr sebagai dosen penguji atas saran dan koreksi yang diberikan. Terimakasih kepada Kang Mista yang telah menyediakan buah cabai dari kampung Ciawi Jawa Barat. Terimakasih pula untuk Pak Ahmad, Mba Ita, Jul, Pak Sulyaden, dan Pak Baskara atas bantuannya di Lab selama penelitian. Disamping itu, penghargaan penulis sampaikan kepada kedua orang tua, Bapak Suhendro dan Ibu Solihati, Kakek dan Nenek, Om dan Tante, atas do’a dan dukungan selama ini. Serta rekan-rekan seperjuangan TPP 2013 Khania khususnya yang telah bekerjasama selama perkuliahan dan telah membantu dalam penelitian. Penulis bukanlah siapa-siapa tanpa doa, bantuan, dan kerjasama dari orang-orang yang ada di sekitar.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 7
Latar Belakang 7
Perumusan Masalah 8
Tujuan Penelitian 8
Hipotesis 8
2 TINJAUAN PUSTAKA 9
Cabai merah segar 9
Penyakit Antraknosa 10
Ekstrak Daun Sirih 11
3 METODE 12
Waktu dan Tempat Penelitian 12
Bahan 12
Alat 13
Prosedur Penelitian 13
Analisis Mutu Fisik Cabai (in vivo) 14
Analisis Data 16
4 HASIL DAN PEMBAHASAN 19
Penentuan Metode Ekstraksi 19
Penentuan Konsentrasi EDS 19
Aplikasi EDS 21
5 SIMPULAN DAN SARAN 29
Simpulan 29
Saran 29
DAFTAR PUSTAKA 29
LAMPIRAN 32
RIWAYAT HIDUP 41
DAFTAR TABEL
1. Persyaratan Mutu Cabai Merah Segar 9
DAFTAR GAMBAR
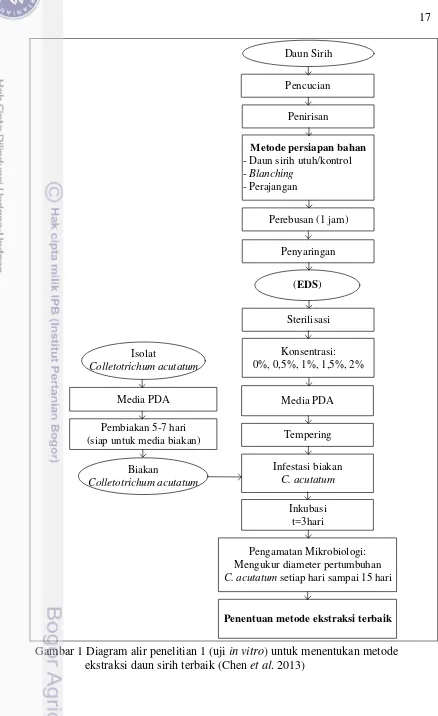
1. Diagram alir penelitian 1 (uji in vitro) untuk menentukan metode
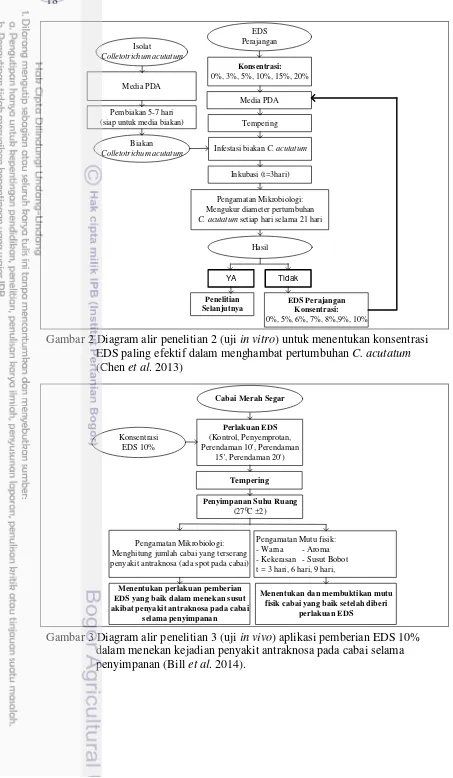
ekstraksi daun sirih terbaik (Chen et al. 2013) 17 2. Diagram alir penelitian 2 (uji in vitro) untuk menentukan konsentrasi
EDS paling efektif dalam menghambat pertumbuhan C. acutatum
(Chen et al. 2013) 18
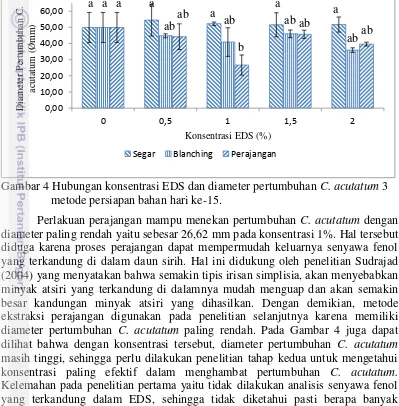
3. Diagram alir penelitian 3 (uji in vivo) aplikasi pemberian EDS 10% dalam menekan kejadian penyakit antraknosa pada cabai selama
penyimpanan (Bill et al. 2014). 18
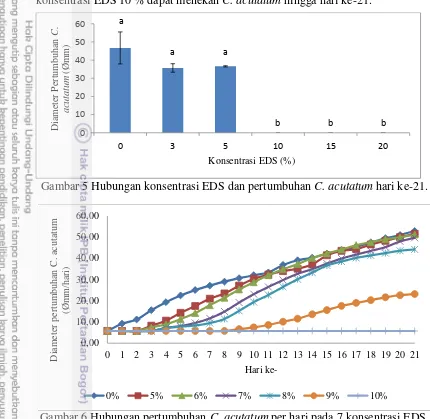
4. Hubungan konsentrasi EDS dan diameter pertumbuhan C. acutatum 3
metode persiapan bahan hari ke-15. 19
5. Hubungan konsentrasi EDS dan pertumbuhan C. acutatum hari ke-21. 20 6. Hubungan pertumbuhan C. acutatum per hari pada 7 konsentrasi EDS. 20 7. Hubungan konsentrasi EDS dan pertumbuhan C. acutatum hari ke-21. 21 8. Hubungan perlakuan cabai dan persentase kejadian antraknosa
hari ke-9. 21
9. Perubahan susut bobot cabai selama penyimpanan 22 10.Perubahan kekerasan cabai selama penyimpanan 23
11.Perubahan warna L cabai selama penyimpanan 24
12.Perubahan warna a* cabai selama penyimpanan 25
13.Perubahan warna b* cabai selama penyimpanan 25
14.Perubahan warna C* cabai selama penyimpanan 26
15.Perubahan warna 0hue cabai selama penyimpanan 26 16.Perubahan uji organoleptik warna cabai selama penyimpanan 27 17.Perubahan uji organoleptik aroma keseluruhan cabai selama
penyimpanan 28
18.Perubahan uji organoleptik aroma daun sirih selama penyimpanan. 28
DAFTAR LAMPIRAN
1.
Hasil sidik ragam masing-masing parameter setiap perlakuan 32 2. Perbandingan diameter C. acutatum pada masing-masing konsentrasiEDS 33
3. Perbandingan cabai pada masing-masing perlakuan hari ke-0 hingga
hari ke-9 34
4. Cabai terserang penyakit antraknosa 35
5. Penyimpanan cabai pada suhu ruang 36
6. Diagram warna 37
7. Fromulir Uji Organoleptik Cabai 38
7
1
PENDAHULUAN
Latar Belakang
Cabai merah merupakan komoditas sayuran yang tidak dapat ditinggalkan masyarakat dalam kehidupan sehari-hari. Semakin bervariasi menu makanan dan produk olahan yang berbahan dasar cabai menyebabkan kebutuhan akan buah cabai semakin meningkat. Data produksi dan konsumsi cabai pada tahun 2007-2011 menunjukkan tidak adanya kekurangan, bahkan hampir sepanjang tahun kebutuhan cabai dapat dipenuhi oleh produksi nasional (LPPM-IPB 2014). Surplus tingkat persediaan perkapita pada tahun 2007-2011 antara 5.04-6.30 kg/orang/tahun sementara kebutuhan total cabai sebesar 2.96-3.29 kg/orang/tahun. Akan tetapi cabai banyak diperlukan dalam bentuk segar dan jika disimpan pada suhu ruangan, cabai akan menjadi cepat busuk dan rusak sehingga umur simpan cabai tidak tahan lama. Faktor serangan mikroorganisme kemungkinan besar juga akan menurunkan kualitas dan jumlah cabai. Menurut Than et al. (2008) penyakit antraknosa akan menurunkan produksi sebesar 50%, menurut Hidayat et al. (2004) menurunkan produktivitas sebesar 45% – 60%. Hal ini menyebabkan jumlah cabai menurun sehingga harga cabai meningkat di tingkat konsumen dari harga Rp. 28 000/kg (petani) menjadi Rp. 75 000 – Rp. 80 000 /kg (konsumen) (LPPM-IPB 2014).
Kehilangan cabai yang disebabkan oleh antraknosa kemungkinan besar dapat dimulai sejak produk terinfeksi patogen dari lahan pertanian sebelum dipanen dan tebawa hingga periode pascapanen (bersifat laten). Beberapa penyakit yang dominan menyerang cabai adalah penyakit antraknosa, hawar Phytophthora, layu bakteri dan virus (Yoon 2003). Penyakit antraknosa merupakan salah satu penyakit penting yang sering menyerang tanaman cabai dan tersebar luas di semua daerah penanaman cabai di seluruh dunia yang disebabkan oleh Colletotrichum spp. yang digolongkan menjadi enam spesies utama yaitu C. gloeosporioides, C. acutatum, C. dematium, C. capsici dan C. coccodes (Kim et al. 1999). C. gloeosporioides dan C. acutatum menyebabkan kerusakan pada buah dan kehilangan hasil paling besar (Yoon 2003). Di Indonesia, patogen antraknosa yang paling banyak dijumpai menyerang tanaman cabai adalah C. acutatum C. capsici dan C. gloeosporioides (Than et al. 2008). Perlu adanya penanganan cukup ekstra pada cabai agar tidak menyebabkan penurunan kualitas akibat serangan penyakit antraknosa sehingga cabai dapat disimpan dalam waktu lama, dengan tujuan dapat menguntungkan petani dalam memenuhi permintaan masyarakat saat tidak musim panen.
8
digunakan saat di lahan pertanian, akan tetapi jika digunakan secara terus menerus akan mengakibatkan perkembangan resistensi patogen serta residu yang dapat merusak lingkungan, dan berbahaya bagi konsumen (Bhanu et al. 2010).
Dari uraian tersebut, dirasa perlu dicari alternatif pengendalian penyakit antaraknosa pasca panen cabai dengan menggunakan fungisida seperti yang dilakukan di lahan pertanian dengan memanfaatkan bahan-bahan nabati yang tidak berbahaya dan memiliki kandungan senyawa fenolik yang berfungsi untuk menghambat pertumbuhan dan perkembangan penyakit antraknosa selama penyimpanan cabai. Salah satu tanaman yang mengandung senyawa fenolik adalah daun sirih. Daun sirih memiliki sifat anticendawan, antiaflatoxigenic, dan antioksidan dengan komponen minyak atsiri yaitu eugenol 63,39%, acetyleugenol 14,05% (Bhanu et al. 2010), senyawa fenol 13% (Nisa et al. 2014) yang dapat menghambat pertumbuhan patogen. Untuk mendapatkan ekstrak yang memiliki sifat anticendawan, perlu dilakukan proses ekstraksi daun sirih yang tepat dan mudah diaplikasikan. Pada penelitian ini akan dilakukan proses perajangan dan
blanching dan daun sirih utuh sebagai kontrol. Perlakuan tersebut bertujuan untuk mempermudah keluarnya senyawa fenol yang terkandung didalam daun sirih.
Perumusan Masalah
Kehilangan pascapanen pada produk cabai akan menyebabkan harga cabai meningkat di tingkat konsumen. Kehilangan tersebut terjadi akibat penanganan cabai yang dilakukan petani/pedagang dengan menyimpan atau menumpuk cabai di kondisi ruangan yang akan menyebabkan cabai cepat busuk. Cabai yang busuk disebabkan oleh penyebaran penyakit antraknosa. Penyakit ini akan menurunkan produksi cabai sehingga diperlukan alternatif pengendalian penyakit antaraknosa pascapanen cabai dengan menggunakan fungisida nabati yang terbuat dari daun sirih.
Tujuan Penelitian
Penelitian ini bertujuan untuk 1) menentukan metode ekstraksi persiapan bahan/daun sirih yang baik dalam menghambat pertumbuhan Colletotrichum acutatum, 2) menentukan konsentrasi Ekstrak Daun Sirih (EDS) yang paling efektif dalam menghambat pertumbuhan Colletotrichum acutatum, 3) menentukan teknik aplikasi Ekstrak Daun Sirih (EDS) yang dapat menekan terjadinya penyakit antraknosa pada cabai selama penyimpanan, serta 4) analisis dampak penggunaan Ekstrak Daun Sirih (EDS) terhadap mutu fisik cabai selama penyimpanan.
Hipotesis
9
2
TINJAUAN PUSTAKA
Cabai merah segar
Cabai merah dapat berguna sebagai penyedap masakan dan pembangkit selera makan, cabai merah juga mengandung zat-zat gizi yang sangat diperlukan untuk kesehatan manusia. Cabai merah mengandung protein, lemak, karbohidrat, kalsium, fosfor, besi, vitamin-vitamin, dan mengandung senyawa alkaloid, seperti capsaicin, flavonoid dan minyak esensial. Cabai yang rendah sodium dan bebas kolesterol, kaya akan vitamin A dan C, dan merupakan sumber potasium yang baik, asam folat dan vitamin E. cabai hijau mengandung lebih banyak vitamin C dan cabai merah segar mengandung vitamin A. Capsaicinoid adalah alkaloid yang membuat pedas cabai panas sedangkan karotenoid memberikan nilai gizi yang tinggi dan warna untuk cabai (Than et al. 2008). Cabai segar adalah buah cabai yang dipetik pada tingkat ketuaan optimal (keadaan buah pada stadia buah cabai yang telah matang fisiologis tepat untuk dipanen) dan belum diproses. Cabai merah dinyatakan tua apabila buah sudah matang dimana warna sudah merah. Panen pertama dilakukan setelah pertanaman berbuah merah lebih dari 60% (SNI 1998).
Penanganan pascapanen pada cabai merah meliputi panen, sortasi, pengkelasan mutu (grading), pengemasan, transportasi dan penyimpanan. Tujuan utama dari penanganan pascapanen adalah mengurangi kehilangan dan kerusakan produk, dimana besarnya kehilangan produk sangat bervariasi tergantung pada komoditas dan tempat produksinya (Nurdjannah 2014). Rahman et al. (2012) menyatakan bahwa kehilangan pascapanen produk rempah pada negara berkembang mencapai 20–50%, sedangkan pada negara yang maju mencapai 5%–25%. Syarat mutu cabai merah segar dapat dilihat pada Tabel 1.
Tabel 1 Persyaratan Mutu Cabai Merah Segar
10
Penanganan pascapanen yang kurang hati-hati akan menyebabkan timbulnya faktor predisposisi yang kemudian akan memudahkan terjadinya kerusakan produk, Jadi dapat dikatakan bahwa penyakit pascapanen sangat berperan penting dalam penyebab penurunan kualitas dan tingginya kerusakan produk. Hal ini mengingat penyakit pascapanen terjadi disemua proses sejak dilahan, panen, pascapanen, hingga ke konsumen (Soesanto 2006).
Penyakit Antraknosa
Organisme penganggu tanaman (OPT) merupakan faktor pembatas produksi tanaman di Indonesia baik tanaman pangan, hortikultura maupun perkebunan. Organisme pengganggu tanaman secara garis besar dibagi menjadi tiga yaitu hama, penyakit dan gulma. Hama menimbulkan gangguan tanaman secara fisik, dapat disebabkan oleh serangga, tungau, vertebrata, moluska. Sedangkan penyakit menimbulkan gangguan fisiologis pada tanaman, disebabkan oleh cendawan, bakteri, fitoplasma, virus, viroid, nematoda dan tumbuhan tingkat tinggi (Wiyono 2007).
Antraknosa, berasal dari kata Yunani yang berarti 'batu arang', adalah nama umum untuk penyakit tanaman ditandai dengan gejala buah menunjukkan noda sangat gelap, lesi cekung jaringan nekrotik, dengan cincin konsentris acervuli berwarna merah muda, untuk masa konidia berwarna orange, dan mengandung spora (Than et al. 2008) (Maja et al. 2013). Umumnya, penyakit antraknosa yang disebabkan oleh spesies Colletotrichum termasuk kerajaan Fungi, Filum
Ascomycota, Kelas Sordariomycetes, orde Phyllachorales, dan famili
Phyllachoraceae. Kerusakan pra dan pasca panen cabai yang diakibatkan oleh spesies Colletotricum penyebab penyakit antraknosa ditandai dengan gejala yaitu
buah menjadi busuk dengan warna seperti terekspos sinar matahari (terbakar) yang diikuti busuk basah berwarna hitam, karena penuh dengan rambut hitam
(setae), cendawan ini pada umumnya menyerang buah cabai menjelang masak
(buah berwarna kemerahan) (Than et al. 2008) tetapi juga dapat terjadi pada saat perkembangan buah, pada batang dan daun (Maja et al. 2013).
Cepat lambatnya perkembangan penyakit pada suatu tanaman tergantung pada inang, patogen, lingkungan, dan waktu. Lingkungan merupakan faktor utama perkembangan penyakit, Pengaruh suhu berinteraksi dengan faktor - faktor lain seperti kelembaban, pencahayaan, mikrobiologi kempetitif, iklim dan kondisi tanaman basah. Umumnya perkembangan penyakit terjadi selama cuaca basah yang hangat pada suhu 27 0C dan kelembaban rata-rata 80% (Than et al. 2008). Pada konsep segitiga penyakit, iklim merupakan faktor lingkungan yang berpengaruh terhadap proses timbulnya penyakit. Pengaruh faktor iklim terhadap patogen bisa terhadap siklus hidup patogen, virulensi (daya infeksi), penularan, dan reproduksi patogen. Serangan antraknosa cabai (Colletotrichum sp.) pada tahun-tahun terakhir ini berkembang pada musim hujan dan suhu yang hangat (Wiyono 2007).
11 cadangan makanan di endosperm dan embrio. Proses infeksi awal yang diakibatkan oleh spesies Colletotrichum yaitu perkembangan konidia pada permukaan tanaman, perkecambahan konidia, produksi appresoria perekat, penetrasi epidermis tanaman, pertumbuhan dan kolonisasi jaringan tanaman dan produksi acervuli dan sporulasi (Than et al. 2008).
Ketahanan terhadap penyakit dapat dikelompokkan ke dalam ketahanan struktural dan ketahanan fungsional. ketahanan struktural seperti tebal tipisnya epidermis, adanya lignin pada dinding sel, adanya lapisan lilin pada permukaan buah. Sedangkan ketahanan fungsional berupa meningkatnya aktivitas enzim tertentu atau terbentuknya ketahanan zat toksik tertentu seperti fitoaleksin yang dapat mematikan patogen. Salah satu senyawa kimia yang dapat menghambat serangan patogen seperti C. acutatum adalah senyawa fenolik yang dapat dioksidasi oleh peroksidase. Peningkatan aktivitas enzim peroksidase akan meningkatkan produk toksin bagi patogen, oleh karena itu menghasilkan tingkat ketahanan lebih tinggi terhadap infeksi (Syukur et al. 2009).
Ekstrak Daun Sirih
Penggunaan bahan-bahan yang berasal dari tumbuhan dapat digunakan sebagai salah satu alternatif pestisida nabati atau bioinsektisida. Pestisida nabati mengandung senyawa bioaktif sepeti alkaloid, terpenoid, fenolik dan zat-zat kimia sekunder lainnya yang dapat berpengaruh terhadap sistem saraf atau otot, keseimbangan hormon, reproduksi, perilaku seperti penolak, penarik, anti-makan (anti-feeding) dan sistem pernafasan. Famili tumbuhan yang dianggap merupakan sumber potensial insektisida nabati adalah Meliacea, Annonaceae, Astraceae, Piperaceae dan Rutaceae. Daun sirih (Piper betle L.) termasuk dalam famili
piperaceae (sirih-sirihan) yang mengandung minyak atsiri dan senyawa alkaloid (Handayani et al. 2013).
Daun sirih merupakan tanaman tropis yang tumbuh di Malaysia, Taiwan, dan negara-negara Asia Tenggara lainnya. kandungan yang terdapat dalam daun sirih yaitu eugenol dan hydroxychavicol yang bersifat menghasilkan aromatik yang khas. Ekstrak daun sirih pada konsentrasi 50% dapat menghambat superoksida radikal, dan radikal hidroksil serta menghambat asam arakhidonat dan diinduksi agregasi platelet induksi kolagen penyebab bau mulut (Daniel et al. 2003). Daun sirih menjadi tanaman biodegradable di alam dapat digunakan sebagai alternatif bahan pengawet sintetis dan fumigants terhadap biodeterioration dari makanan. Banyak formulasi antimikroba yang berisi minyak atsiri. Komponen lain yang terdapat dalam daun sirih yaitu acetyleugenol, kelompok OH dari eugenol dapat membentuk ikatan hidrogen dengan kondisi aktif dari enzym sasaran dan meningkatkan aktivitas enzym dengan denaturasi enzym yang bertanggungjawab untuk sekresi toksin (Bhanu et al. 2010).
12
blanching dan daun sirih utuh sebagai kontrol. Perlakuan tersebut bertujuan untuk mempermudah keluarnya senyawa fenol yang terkandung didalam daun sirih.
Minyak atsiri merupakan minyak yang mudah menguap (volatile oils) berwujud cair yang diperoleh dari berbagai tanaman akar, kulit batang, daun, buah, biji, atau bunga dengan cara destilasi uap, ekstraksi atau ditekan (Kan et al.
2006). Manfaat minyak atsiri digunakan untuk bakterisida, membasmi virus, fungisida, antiparasitical, insektisida, obat, aplikasi kosmetik, dan farmasi, industri kesehatan, pertanian, dan makanan (Reina et al. 2010).
Hasil penelitian Nurhayati (2007), tanaman sirih, kulit jeruk, biji jarak, brotowali, daun nimba, biji nimba, laos, dan gadung dapat dimanfaatkan sebagai pestisida nabati untuk mengendalikan Collectotricum capsici pada cabai, media dengan ekstrak daun sirih merupakan yang terbaik dalam menekan pertumbuhan dan perkembangan C. capsici. Daun sirih memiliki sifat anticendawan antiaflatoxigenic dan antioksidan dengan komponen minyak atsiri yaitu eugenol 63,39%, acetyleugenol 14, 05% (Bhanu et al. 2010), merupakan komponen minyak atsiri yang dapat menghambat pertumbuhan patogen. Kadar senyawa fenol yang dihasikan yaitu 13% (Nisa et al. 2014), konsentrasi ekstrak daun sirih dapat menghambat pertumbuhan Aspergillus sp (Bhanu et al. 2010). Pemberian ekstrak daun sirih dengan konsentrasi 40% efektif dapat menghambat pertumbuhan diameter koloni Rhizoctonia sp. (Achmad dan Suryana 2009). Dengan demikian perlu diteliti penggunaan ekstrak daun sirih yang efektif terhadap pertumbuhan Colletotrichum acutatum pada cabaiselama penyimpanan.
3
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Februari 2015 hingga Mei 2015, di Laboratorium Teknik Pengolahan Pangan dan Hasil Pertanian FATETA IPB, Laboratorium Teknik Lingkungan Biosistem FATETA IPB, dan Klinik Tanaman Departemen Proteksi Tanaman FAPERTA IPB.
Bahan
Daun sirih yang digunakan dalam penelitian ini diperoleh dari penanaman daun sirih di provinsi Lampung, dengan kriteria daun sirih segar berwarna hijau, tingkat ketuaan sedang (daun terletak dibagian tengah tangkai tanaman), berdaun utuh (tidak termakan ulat ataupun serangga). Daun sirih dipetik pada pagi hari kemudian dikemas dengan menggunakan kardus dan ditransportasikan menuju laboratorium selama 15 jam.
Media PDA yang digunakan dalam penelitian ini adalah dengan membuat media yang terbuat dari media PDB (Potato Dextrose Broth) sebanyak 24 gram, agar 15 gram dan aquadest 1000 ml kemudian dilakukan pemanasan dan didapat media PDA cair dan dilakukan sterilisasi menggunakan autoklaf pada suhu 121
0
13 Isolat cendawan yang digunakan pada penelitian ini adalah Colletotrichum acutatum dengan kode isolat Ca. SMG 136 III yang didapat dari Klinik Tanaman Departemen Proteksi Tanaman FAPERTA IPB yang diremajakan untuk digunakan pada pengujian–pengujian selanjutnya.
Buah cabai yang digunakan dalam penelitian ini adalah buah cabai merah keriting yang diperoleh dari penanaman cabai rakyat di Jawa Barat dengan kriteria cabai matang, berwarna merah seragam, panen pertama dilakukan setelah pertanaman berbuah merah lebih dari 60%, sehat (tidak ada gejala serangan patogen). Cabai dipanen pada pagi hari kemudian dikemas menggunakan plastik dan ditransportasikan menuju laboratorium selama 2 jam perjalanan. Cabai di sortasi saat di lahan dan sebelum perlakuan (setelah transportasi). Diagram alir penelitian dapat dilihat pada Gambar 4.
Alat
Peralatan yang digunakan dalam penelitian ini adalah pisau, pinset, penggaris, timbangan digital, cawan petri, erlenmeyer, lemari asam, autoklaf, jangka sorong, mikroskop, rheometer tipe CR-300DX, perangkat image prosessing.
Prosedur Penelitian
Penelitian I: Penentuan Metoda Ekstraksi
Penelitian ini bertujuan untuk menentukan metode persiapan bahan (daun sirih) terbaik dengan menggunakan uji in-vitro. Ekstraksi dilakukan dengan menggunakan metode pemanasan/perebusan. Daun sirih dilakukan pencucian dan penirisan agar daun sirih bersih dari kotoran dan kontaminan lain. Perlakuan yang dijadikan sebagai faktor pada penelitian ini adalah persiapan bahan daun sirih sebelum dilakukan perebusan, yaitu perlakuan daun sirih segar/kontrol, perlakuan daun sirih yang dilakukan blanching dan perlakuan daun sirih perajangan. Masing-masing dilakukan perebusan dengan perbandingan daun sirih dan air adalah 1:1 selama 1 jam (Achmad dan Suryana 2009) kemudian dilakukan penyaringan untuk mendapatkan hasil Ekstrak Daun Sirih (EDS). Hasil masing-masing EDS dilakukan pengujian menggunakan metode in vitro/bioassay dengan menginfestasi biakan C. acutatum pada media beracun (media PDA yang ditambah dengan EDS). Penentuan konsentrasi EDS dilakukan dengan rumus sebagai berikut :
EDS (%) =
x 100% ... (1) e = volume ekstrak daun sirih (EDS) yang diambil dari EDS hasil ekstraksi
(ml)
a = volume media yang ditambahkan (ml)
14
bioassay/in vitro diamati setiap hari selama 21 hari dengan mengukur diameter penghambatan pertumbuhan C. acutatum. Pengukuran diameter cendawan dilakukan dengan menggunakan jangka sorong dengan mencatat diameter pertumbuhan C. acutatum pada cawan petri dengan satuan mm (Chen et al. 2013). Hasil penentuan metode ekstraksi daun sirih terbaik digunakan pada penelitian kedua. Diagram alir penelitian pertama disajikan pada Gambar 1.
Penelitian II: Penentuan Konsentrasi EDS
Hasil penelitian pertama digunakan pada penelitian kedua yang bertujuan untuk menentukan konsentrasi EDS paling efektif dalam menghambat pertumbuhan C. acutatum. Faktor utama pada penelitian ini adalah perbandingan konsentrasi EDS yaitu 0% (kontrol), 3%, 5%, 10%, 15%, 20%. Masing-masing konsentrasi media beracun diinfestasi C. acutatum dan diinkubasi selama tiga hari dan dilakukan pengamatan pertumbuhan C. acutatum setiap hari hingga hari ke-21. Pada tahap ini dicari konsentrasi yang dianggap paling efektif, yaitu dilakukan penelitian lanjutan dengan konsentrasi yang lebih kecil sebagai faktor yaitu konsentrasi 0%/kontrol, 5%, 6%, 7%, 8%, 9%, dan 10%. Perlakuan masing-masing diulang sebanyak 5 kali ulangan. Metode pengamatan pertumbuhan C. acutatum dilakukan seperti pada penelitian pertama. Hasil penentuan metode persiapan terbaik digunakan pada penelitian ketiga. Diagram alir penelitian kedua disajikan pada Gambar 2.
Penelitian III: Aplikasi EDS
Hasil penelitian tahap dua digunakan pada penelitian ketiga yang bertujuan untuk aplikasi penggunaan konsentrasi EDS terpilih terhadap buah cabai setelah panen. Cabai hasil sortasi dilakukan pencucian agar daun sirih bersih dari kotoran dan kontaminan lain serta bebas dari pestisida, kemudian dilakukan penirisan. Cabai yang sudah bersih dilakukan perlakuan pemberian EDS yang dijadikan sebagai faktor, yaitu tanpa pemberian daun sirih/kontrol, penyemprotan, perendaman 10 menit, perendaman 15 menit, dan perendaman 20 menit. Kemudian dilakukan penirisan lalu penyimpanan pada suhu ruangan (27 0C ±2). Dilakukan pengamatan mikrobiologi dan mutu fisik cabai sebagai pembuktian dampak penggunaan EDS. Perlakuan masing-masing diulang sebanyak 3 kali ulangan. Diagram alir penelitian ketiga disajikan pada gambar 3.
Analisis Mutu Fisik Cabai (in vivo)
Perkembangan Antraknosa selama Penyimpanan
Pengamatan untuk aplikasi pengujian EDS terhadap cabai dilakukan secara in vivo diamati setiap hari. Populasi cabai sebanyak 50 cabai diamati dengan melihat ada tidaknya spot pada cabai secara cermat dan dihitung setiap hari jumlah cabai yang terserang antraknosa (sampai hari ke-9). Adanya spot menunjukkan bahwa cabai tersebut terserang penyakit antraknosa. Setiap perlakuan dilakukan pengulangan sebanyak 3 kali ulangan dan dihitung persentase cabai yang terserang antraknosa dengan rumus menurut Bill et al. 2014:
15 Warna
Cabai dianalisis mutu bahan secara destruktif sebelum dan sesudah diberi perlakuan EDS dan semua sample dipastikan seragam. Parameter yang diukur adalah warna, kekerasan dan berat awal sampel. Parameter warna dilakukan dengan menggunakan metode image prosessing yaitu cabai diletakkan pada ruang yang telah diatur pencahayaannya kemudian diambil gambar dengan menggunakan kamera CCD. Hasil gambar ditransformasikan menggunakan
software photoshop untuk mendapatkan nilai L, a, b. Nilai L merupakan atribut nilai yang menunjukkan tingkat kecerahan suatu obyek, dengan kisaran 0-100. Nilai L yang mendekati nol menunjukkan obyek memiliki kecerahan rendah (gelap), nilai L yang mendekati 100 menunjukkan obyek memiliki kecerahan tinggi (terang). Nilai a* menyatakan spektrum warna dari merah ke hijau (nilai +60 – 0 menunjukkan warna merah, nilai 0 – (-60) menunjukkan warna hijau). Nilai b* menunjukkan derajad kekuningan atau kebiruan suatu obyek. Semakin positif nilai b* (+60 – 0) menunjukkan derajat kekuningan yang tinggi dan semakin negatif nilai b* (0 – (-60)) menunjukkan derajat kebiruan yang tinggi (Liyanage 2008). Hasil pengukuran nilai a dan b dikonversi ke dalam satuan kromatis C* dan derajat hue (°hue). Nilai C menunjukkan intensitas suatu warna sedangkan nilai °hue menunjukkan warna dominan dalam campuran beberapa warna. Untuk memperoleh nilai C* dan °hue digunakan rumus menurut Petzold et al.(2014) adalah sebagai berikut:
√ ... (3)
... (4) Tingkat Kekerasan
Parameter kekerasan dianalisis dengan menggunakan Rheometer. Sebelum dilakukan pengukuran, pada alat Rheometer model CR-300DX. Pilih plunger yang sesuai dengan sample lalu pilih beban maksimum dan kecepatan turun benda kemudian letakkan sample pada plunger. Operasikan plunger dengan kecepatan tetap menekan sample hingga patah/rusak/pecah, lalu catat nilai kekerasan (kgf). Berikut ini adalah pengaturan awal untuk penggunaan Rheometer untuk cabai pada penelitian ini :
Parameter susut bobot diukur dengan menggunakan timbangan digital, sample yang akan digunakan dipastikan seragam, sample ditimbang dengan menggunakan alat timbangan digital, setiap angka yang didapat akan dicatat (gram) dan akan dihitung susut bobot dari sample ditiap pengamatan selama penyimpanan. Persamaan yang digunakan untuk mengukur susut bobot tersebut adalah sebagai berikut:
... (5) Dimana: a = berat awal cabai (gram)
16
Uji Sensori
Parameter aroma dan warna secara subjektif dianalisis menggunakan uji sensori menggunakan 15 orang panelis. Skala penilaian yang diamati adalah warna cabai keseluruhan, aroma cabai keseluruhan, aroma daun sirih menggunakan metode garis (Stone et al. 1974). Formulir penilaian uji sensori disajikan pada Lampiran 7. Skala penilaian uji sensori dapat dilihat pada Tabel 2.
Tabel 2 Skala penilaian uji sensori Skala Penilaian Warna keseluruhan
cabai
Aroma keseluruhan cabai
Aroma daun sirih
0 >x≤ 20 tidak suka tidak suka lemah 20 >x≤ 40 agak tidak suka agak tidak suka agak lemah
40 >x≤ 60 netral netral netral
60 >x≤ 80 agak suka agak suka agak kuat
80 >x≤ 100 suka suka kuat
Analisis Data
Analisis data dilakukan dengan menggunakan Rancangan Acak Lengkap (RAL) 3 ulangan dan dianalisis menggunakan Analysis of Variance (ANOVA) dan di uji lanjut Tukey menggunakan software Minitab16. Huruf yang sama pada hasil uji lanjut menunjukkan tidak ada perbedaan signifikan
Model matematika yang digunakan adalah sebagai berikut:
Yij µ + αi+ βj+ Ɛ ij ... (6)
Keterangan:
Yij : Pengamatan pada kombinasi perlakuan ke-i perlakuan ke-j
µ : Rataan umum
αi : Pengaruh perlakuan ke-i
βj : Pengaruh perlakuan ke-j
17
Isolat
Colletotrichum acutatum
Media PDA
Pembiakan 5-7 hari (siap untuk media biakan)
Biakan
Colletotrichum acutatum
Pengamatan Mikrobiologi:
Mengukur diameter pertumbuhan
C. acutatum setiap hari sampai 15 hari Daun Sirih
Pencucian
Penirisan
Metode persiapan bahan
- Daun sirih utuh/kontrol - Blanching
- Perajangan
Perebusan (1 jam)
Konsentrasi: 0%, 0,5%, 1%, 1,5%, 2%
Media PDA
Tempering
Infestasi biakan
C. acutatum
Inkubasi t=3hari
Penentuan metode ekstraksi terbaik
(EDS) Penyaringan
Sterilisasi
18
C. acutatum setiap hari selama 21 hari
Hasil
Gambar 2 Diagram alir penelitian 2 (uji in vitro) untuk menentukan konsentrasi EDS paling efektif dalam menghambat pertumbuhan C. acutatum
(Chen et al. 2013) Menghitung jumlah cabai yang terserang penyakit antraknosa (ada spot pada cabai)
Menentukan perlakuan pemberian EDS yang baik dalam menekan susut akibat penyakit antraknosa pada cabai
selama penyimpanan
Menentukan dan membuktikan mutu fisik cabai yang baik setelah diberi
perlakuan EDS
19
4
HASIL DAN PEMBAHASAN
Penentuan Metode Ekstraksi
Penelitian pertama bertujuan untuk menentukan metode ekstraksi daun sirih yang baik dalam menghambat pertumbuhan C. acutatum. Hasil analisis sidik ragam penelitian pertama pada Gambar 4 menunjukkan adanya perbedaan nyata antara daun sirih utuh dengan perlakuan perajangan pada hari ke-15.
Gambar 4 Hubungan konsentrasi EDS dan diameter pertumbuhan C. acutatum 3 metode persiapan bahan hari ke-15.
Perlakuan perajangan mampu menekan pertumbuhan C. acutatum dengan diameter paling rendah yaitu sebesar 26,62 mm pada konsentrasi 1%. Hal tersebut diduga karena proses perajangan dapat mempermudah keluarnya senyawa fenol yang terkandung di dalam daun sirih. Hal ini didukung oleh penelitian Sudrajad (2004) yang menyatakan bahwa semakin tipis irisan simplisia, akan menyebabkan minyak atsiri yang terkandung di dalamnya mudah menguap dan akan semakin besar kandungan minyak atsiri yang dihasilkan. Dengan demikian, metode ekstraksi perajangan digunakan pada penelitian selanjutnya karena memiliki diameter pertumbuhan C. acutatum paling rendah. Pada Gambar 4 juga dapat dilihat bahwa dengan konsentrasi tersebut, diameter pertumbuhan C. acutatum
masih tinggi, sehingga perlu dilakukan penelitian tahap kedua untuk mengetahui konsentrasi paling efektif dalam menghambat pertumbuhan C. acutatum.
Kelemahan pada penelitian pertama yaitu tidak dilakukan analisis senyawa fenol yang terkandung dalam EDS, sehingga tidak diketahui pasti berapa banyak kandungan senyawa fenol pada masing-masing perlakuan.
Penentuan Konsentrasi EDS
20
menghambat pertumbuhan C. acutatum sampai hari ke-8, sedangkan pada konsentrasi EDS 10 % dapat menekan C. acutatum hingga hari ke-21.
Gambar 5 Hubungan konsentrasi EDS dan pertumbuhan C. acutatum hari ke-21.
Gambar 6 Hubungan pertumbuhan C. acutatum per hari pada 7 konsentrasi EDS. Semakin tinggi konsentrasi EDS yang diuji maka semakin rendah diameter pertumbuhan koloni C. acutatum, sehingga dapat dinyatakan bahwa semua konsentrasi EDS memiliki aktivitas fungistatis yang lebih baik terhadap pertumbuhan C. acutatum jika dibandingkan dengan tanpa EDS. Hal ini dapat disebabkan karena EDS mengandung senyawa fenol yang bersifat anticendawan dalam menghambat pertumbuhan C. acutatum. Achmad dan Suryana (2009) menyatakan bahwa adanya penghambatan terhadap cendawan Rhizoctonia sp.
21 Hasil analisis sidik ragam pada gambar 7 menunjukkan bahwa diameter pertumbuhan pada perlakuan konsentrasi EDS 9% dan 10% berbeda nyata dengan konsentrasi 0, 5%, 6%, 7%, 8%. Dengan demikian, konsentrasi EDS 10% akan digunakan pada penelitian tahap ketiga karena C. acutatum tidak tumbuh hingga hari ke-21. Tujuan penelitian tahap ketiga adalah untuk mengetahui metode aplikasi pemberian EDS 10% dalam menekan kejadian penyakit antraknosa pada cabai selama penyimpanan. Hasil perbandingan diameter C. acutatum pada masing-masing perlakuan konsentrasi EDS lebih jelasnya dapat dilihat pada Lampiran 2.
Gambar 7 Hubungan konsentrasi EDS dan pertumbuhan C. acutatum hari ke-21.
Aplikasi EDS
Perkembangan antraknosa selama penyimpanan
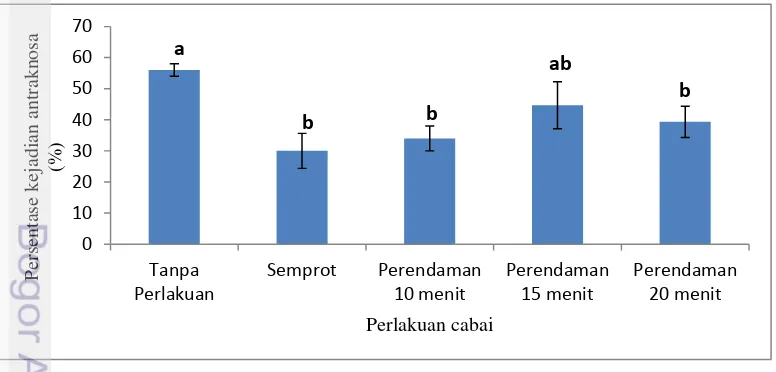
Penelitian tahap ketiga disajikan pada Gambar 8, dapat dilihat bahwa pemberian EDS 10% pada cabai mampu menekan pertumbuhan C. acutatum
selama penyimpanan. Hasil analisis sidik ragam menunjukkan adanya pengaruh nyata antara kontrol dengan perlakuan semprot dan perendaman, akan tetapi tidak ada perbedaan yang signifikan antar perlakuan.
Gambar 8 Hubungan perlakuan cabai dan persentase kejadian antraknosa
22
Hal tersebut diduga berkaitan dengan ketebalan lapisan lilin pada permukaan buah yang menyebabkan EDS berbasis air tidak meresap ke dalam cabai dan hanya melapisi bagian luar cabai, sehingga perlakuan semprot dan perendaman tidak menunjukkan adanya perbedaan yang signifikan. Menurut Syukur et al. (2009), salah satu senyawa kimia yang dapat menghambat serangan patogen seperti C. acutatum adalah senyawa fenolik yang dapat dioksidasi oleh peroksidase. Peningkatan aktivitas enzim peroksidase akan meningkatkan produk toksin bagi patogen yang berpotensi dapat mencegah perkecambahan cendawan (Petkovsek et al. 2013), oleh karena itu dapat menghasilkan tingkat ketahanan lebih tinggi terhadap infeksi patogen. Gambar cabai terserang antraknosa dapat dilihat pada Lampiran 4.
EDS yang diaplikasikan pada media cabai belum menunjukkan penghambatan kejadian penyakit yang efektif dibanding dengan menggunakan media PDA, hal tersebut diduga karena sifat dari penyakit antraknosa yang bersifat laten, sehingga perlu konsentrasi yang lebih tinggi dan bersifat sistemik untuk menghambat serangan patogen penyakit antraknosa. Sama hal nya dengan penelitian Maqbool et al. (2011) menyatakan bahwa minyak esensial dari sereh dan kayu manis memiliki efek terbesar dalam menghambat pertumbuhan C. musae dan C. gloeosporioides penyebab antraknosa secara in vitro. Namun kurang efektif bila diaplikasikan pada pepaya secara in vivo. Hal tersebut diduga karena minyak esensial dapat mengubah kapasitas jaring epidermis buah dalam mempertahankan spora berkecambah. Selain itu, faktor lingkungan seperti suhu dan kelembaban juga diduga menjadi faktor utama belum efektifnya EDS dalam menghambat terjadinya penyebaran penyakit antraknosa dibanding dengan metode in-vitro. Lingkungan penyimpanan cabai pada suhu ruang dapat dilihat pada Lampiran 5
Perubahan susut bobot
Penelitian tahap ketiga dilakukan pengamatan mutu fisik cabai. Tujuan dilakukan pengukuran susut bobot adalah untuk mengetahui susut yang terjadi setelah dilakuakan perlakuan pemberian EDS dengan membandingkan bobot awal sebelum dan sesudah dilakukan perlakuan pemberian EDS pada cabai selama penyimpanan. Hasil analisis susut bobot disajikan pada Gambar 9.
Gambar 9 Perubahan susut bobot cabai selama penyimpanan
23 Setelah dilakukan penyemprotan maupun perendaman, cabai disimpan pada suhu ruang dan dapat bertahan hingga hari ke-9. Semakin lama cabai disimpan maka susut bobot cabai semakin tinggi. Hasil analisis sidik ragam dapat dilihat pada Lampiran 1 yang menunjukkan bahwa adanya perbedaan yang nyata antara susut bobot cabai sebelum disimpan dengan setelah disimpan hingga hari ke-9, akan tetapi tidak terdapat perbedaan yang signifikan pada setiap perlakuan. Hal tersebut terjadi karena cabai yang licin tidak dapat menyerap EDS dan menyebabkan penambahan bobot ataupun penurunan bobot yang signifikan. Faktor yang mempengaruhi susut bobot cabai yaitu faktor lingkungan salah satunya adalah suhu penyimpanan. Suhu ruang dapat menyebabkan cabai masih melakukan respirasi. Menurut Nurdjannah (2014) menyatakan bahwa perubahan susut bobot pada cabai disebabkan oleh proses respirasi dan transpirasi yang mengakibatkan kehilangan substrat dan air yang ditandai dengan layu sehingga permukaan cabai menjadi mengkerut.
Perubahan tingkat kekerasan
Pengukuran tingkat kekerasan dilakukan sebagai indikasi terjadinya kerusakan cabai atau penurunan mutu cabai, dimana semakin menurun nilai tekannya, mutu cabai sudah semakin menurun. Sebelum dilakukan perlakuan, cabai memiliki tingkat kekerasan rata-rata 0,43 kgf (Lampiran 1). Setelah dilakukan perlakuan pemberian EDS, tingkat kekerasan cabai mengalami penurunan dan yang paling menurun yaitu pada perlakuan semprot, yaitu rata-rata sebesar 0,36 kgf. Hal tersebut terjadi karena adanya tekanan air yang disemprotkan pada cabai, sehingga permukaan cabai menjadi melunak akibat dinding sel yang rusak akibat penyemprotan. Gambar 10 menunjukkan adanya penurunan tingkat kekerasan setelah dilakukan penyimpanan.
Gambar 10 Perubahan kekerasan cabai selama penyimpanan
24
adalah enam hari, sedangkan hari selanjutnya cabai mulai kering dan liat, lebih jelasnya dapat dilihat pada Lampiran 3 bahwa cabai mulai kering pada hari ke-9. Perubahan mutu warna
Warna dapat dijadikan sebagai parameter utama yang digunakan konsumen dalam memilih cabai. Pada penelitian ini dilakukan pengamatan warna secara visual/subjektif dan secara objektif. Pengamatan warna secara objektif yaitu dengan menggunakan metode image prosessing dengan software Adobe Photoshop (derajat warna L, a, b). Menurut Sutrisno et al. (2009) tingkat kecerahan (nilai L) mempunyai nilai dari 0 (hitam) sampai 100 (putih), tingkat kehijauan (nilai a*) dimana nilai positif (+) menyatakan warna merah, nilai 0 menyatakan warna abu-abu dan nilai negatif (-) menyatakan warna hijau, serta tingkat kekuningan (nilai b*), dimana nilai positif (+) menyatakan warna kuning, nilai 0 menyatakan warna abu-abu dan nilai negatif (-) menyatakan nilai biru.
Penelitian ini melihat tentang perubahan kualitas warna dari cabai akibat pemberian EDS. Hasil analisis sidik ragam pada Lampiran 1 menunjukkan bahwa tidak adanya perbedaan yang nyata dari setiap perlakuan di setiap hari penyimpanan karena memiliki P-V ≥ 5%. Pada perlakuan kontrol nilai L rata-rata adalah 44,61, sedangkan pada perlakuan semprot dan perendaman 10 menit mengalami penurunan nilai (semprot rata-rata 44,30 dan perendaman 10 menit rata-rata 41,44), dan pada perlakuan perendaman 15 menit dan perendaman 20 menit mengalami kenaikan nilai (perendaman 15 menit rata-rata 47,42 dan perendaman 20 menit rata-rata 45,33). Hal tersebut terjadi karena adanya perlakuan menggunakan EDS yang berwarna hijau pekat selama 15 menit dan 20 menit sehingga warna cabai menjadi lebih gelap. Setelah dilakukan penyimpanan derajat warna L pada cabai mengalami penurunan yang artinya semakin hitam. Perubahan warna L setiap harinya dapat dilihat pada Gambar 11.
Gambar 11 Perubahan warna L cabai selama penyimpanan
25 kontrol adalah 39,92, sedangkan pada perlakuan semprot dan perendaman 10 menit nilai a* rata-rata lebih rendah dibanding kontrol (semprot rata-rata 39,62 dan perendaman 10 menit rata-rata 38,93). Akan tetapi pada perlakuan perendaman 15 menit dan perendaman 20 menit memiliki nilai lebih tinggi dibanding kontrol (perendaman 15 menit rata-rata 41,70 dan perendaman 20 menit rata-rata 41,72). Setelah dilakukan penyimpanan, nilai a* semakin menurun yang artinya warna merah semakin menuju kearah jingga (lebih jelasnya dapat dilihat pada Lampiran 6). Perubahan warna a* setiap harinya dapat dilihat pada Gambar 12.
Gambar 12 Perubahan warna a* cabai selama penyimpanan
Nilai b* merupakan atribut nilai yang menunjukkan derajat kekuningan atau kebiruan suatu komoditas. Perubahan warna b* setiap harinya dapat dilihat pada Gambar 13.
Gambar 13 Perubahan warna b* cabai selama penyimpanan
Hasil analisis sidik ragam pada Lampiran 1 menunjukkan bahwa tidak adanya perbedaan yang nyata dari setiap perlakuan disetiap hari penyimpanan karena memiliki P-V ≥ 5%. Pada hari ke-0, nilai b pada perlakuan kontrol berkisar antara 32,46, sedangkan pada perlakuan semprot, perendaman 15 menit dan perendaman 20 menit mengalami kenaikan nilai (semprot rata-rata 33,77,
26
perendaman 15 menit rata-rata 35,11, perendaman 20 menit rata-rata 35,37), dan pada perlakuan perendaman 10 menit mengalami penurunan nilai yaitu rata-rata 31,60. Setelah dilakukan penyimpanan, nilai b* semakin menurun yang artinya warna kuning semakin menuju kearah biru.
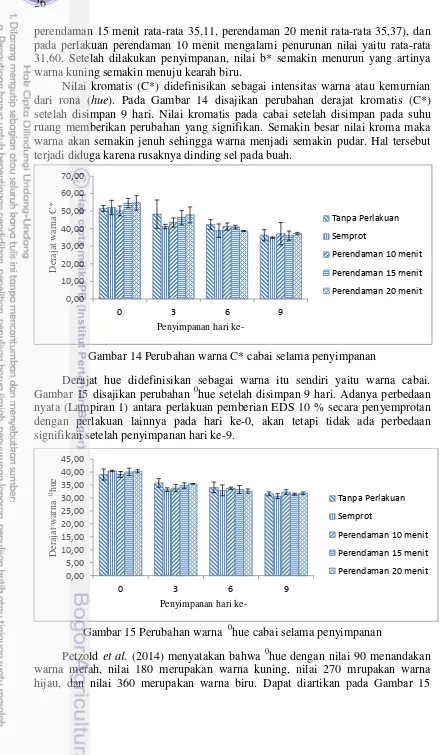
Nilai kromatis (C*) didefinisikan sebagai intensitas warna atau kemurnian dari rona (hue). Pada Gambar 14 disajikan perubahan derajat kromatis (C*) setelah disimpan 9 hari. Nilai kromatis pada cabai setelah disimpan pada suhu ruang memberikan perubahan yang signifikan. Semakin besar nilai kroma maka warna akan semakin jenuh sehingga warna menjadi semakin pudar. Hal tersebut terjadi diduga karena rusaknya dinding sel pada buah.
Gambar 14 Perubahan warna C* cabai selama penyimpanan
Derajat hue didefinisikan sebagai warna itu sendiri yaitu warna cabai. Gambar 15 disajikan perubahan 0hue setelah disimpan 9 hari. Adanya perbedaan nyata (Lampiran 1) antara perlakuan pemberian EDS 10 % secara penyemprotan dengan perlakuan lainnya pada hari ke-0, akan tetapi tidak ada perbedaan signifikan setelah penyimpanan hari ke-9.
Gambar 15 Perubahan warna 0hue cabai selama penyimpanan
27 bahwa nilai 0hue hingga hari ke-9 semakin menurun, sehingga warna cabai semakin mendekati nol yang artinya warna merah mendekati hitam dan dapat dibuktikan dengan gambar pada Lampiran 3.
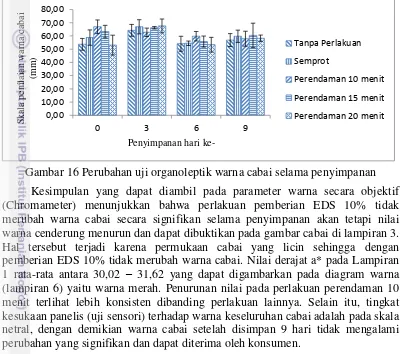
Pengujian warna secara subjektif dilakukan dengan menggunakan metode uji sensori dengan 15 panelis. Gambar 16 menunjukkan bahwa tingkat kesukaan panelis terhadap warna cabai adalah netral, setelah dilakukan penyimpanan menunjukkan tidak adanya perbedaan secara signifikan, yang artinya tigkat kesukaan panelis adalah netral.
Gambar 16 Perubahan uji organoleptik warna cabai selama penyimpanan Kesimpulan yang dapat diambil pada parameter warna secara objektif (Chromameter) menunjukkan bahwa perlakuan pemberian EDS 10% tidak merubah warna cabai secara signifikan selama penyimpanan akan tetapi nilai warna cenderung menurun dan dapat dibuktikan pada gambar cabai di lampiran 3. Hal tersebut terjadi karena permukaan cabai yang licin sehingga dengan pemberian EDS 10% tidak merubah warna cabai. Nilai derajat a* pada Lampiran 1 rata-rata antara 30,02 – 31,62 yang dapat digambarkan pada diagram warna (lampiran 6) yaitu warna merah. Penurunan nilai pada perlakuan perendaman 10 menit terlihat lebih konsisten dibanding perlakuan lainnya. Selain itu, tingkat kesukaan panelis (uji sensori) terhadap warna keseluruhan cabai adalah pada skala netral, dengan demikian warna cabai setelah disimpan 9 hari tidak mengalami perubahan yang signifikan dan dapat diterima oleh konsumen.
Perubahan mutu aroma
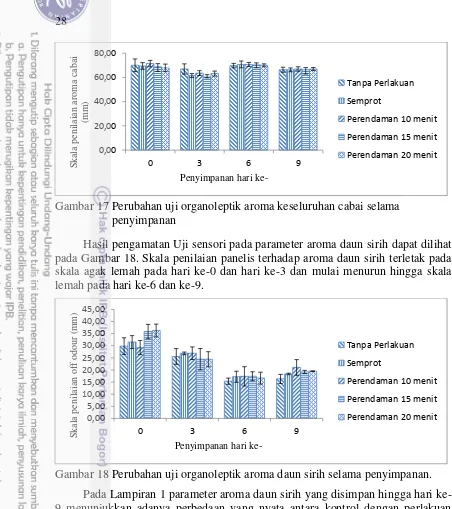
Uji Organoleptik juga dilakukan untuk melihat tingkat kesukaan panelis terhadap aroma keseluruhan cabai baik sebelum diberi perlakuan maupun sesudah diberi perlakuan. Hasil sidik ragam (Lampiran 1) menunjukkan tidak ada perbedaan yang signifikan, selama disimpan selama 9 hari, panelis masih menunjukkan tingkat kesukaan pada skala suka (Gambar 17). Dengan demikian pemberian EDS 10% tidak merubah aroma keseluruhan cabai secara signifikan hingga hari ke-9 dengan tingkat kesukaan panelis pada skala suka.
28
Gambar 17 Perubahan uji organoleptik aroma keseluruhan cabai selama penyimpanan
Hasil pengamatan Uji sensori pada parameter aroma daun sirih dapat dilihat pada Gambar 18. Skala penilaian panelis terhadap aroma daun sirih terletak pada skala agak lemah pada hari ke-0 dan hari ke-3 dan mulai menurun hingga skala lemah pada hari ke-6 dan ke-9.
Gambar 18 Perubahan uji organoleptik aroma daun sirih selama penyimpanan. Pada Lampiran 1 parameter aroma daun sirih yang disimpan hingga hari ke-9 menunjukkan adanya perbedaan yang nyata antara kontrol dengan perlakuan perendaman 10 menit. Gambar 18 menunjukkan bahwa aroma daun sirih dari cabai mulai menurun, yang artinya aroma daun sirih mulai hilang. Hal tersebut terjadi karena sifat dari ekstrak daun sirih yang mengandung minyak atsiri yang bersifat mudah menguap, sehingga aroma daun sirih akan hilang setelah disimpan pada suhu ruang. Selain itu, pada perlakuan perendaman 10 menit cenderung memiliki nilai paling tinggi dan konsisten penurunannya dibanding perlakuan lain, hal tersebut dapat diartikan bahwa pada perlakuan cabai tersebut memiliki aroma daun sirih paling kuat sehingga dapat melindungi cabai dari serangan antraknosa dan dapat dibuktikan pada Gambar 8 bahwa perendaman 10 menit memiliki persentase kejadian terserang antraknosa yang rendah pula.
29
5
SIMPULAN DAN SARAN
Simpulan
Berdasarkan penelitian yang telah dilakukan dapat disimpulkan bahwa 1) metode perajangan merupakan metode ektraksi daun sirih terbaik diantara perlakuan lain dalam menghasilkan senyawa fenol untuk menghambat pertumbuhan Colletotrichum acutatum dengan diameter paling rendah yaitu sebesar 26,62 mm pada konsentrasi 1%, 2) penggunaan konsentrasi ekstrak daun sirih 10% merupakan konsentrasi paling efektif dalam menghambat pertumbuhan
Colletotrichum acutatum, 3)perlakuan penyemprotan menggunakan ekstrak daun sirih 10% pada cabai dapat menekan terjadinya penyakit antraknosa paling rendah yaitu sebanyak 30% pada cabai selama penyimpanan, serta 4) perlakuan pemberian ekstrak daun sirih pada cabai setelah panen tidak merubah mutu cabai secara signifikan baik warna, aroma, kekerasan dan susut bobot, 5) perendaman 10 menit memiliki nilai warna dan aroma daun sirih yang penurunan nilainya cenderung konsisten dibanding perlakuan lain sehingga dapat menekan kejadian penyakit antraknosa dengan persentase kejadian antraknosa yang rendah dibanding kontrol, perendaman 15 menit dan perendaman 20 menit.
Saran
. Berdasarkan penelitian yang telah dilakukan maka penulis memberikan saran untuk 1) melakukan penelitian lebih lanjut mengenai kandungan senyawa fenol yang terkandung dalam EDS pada masing-masing metode persiapan bahan, 2) melakukan penelitian lebih lanjut tentang metode penggunaan ekstrak daun sirih yang dapat menekan pertumbuhan cendawan pascapanen cabai dengan menggunakan bahan perekat yang dapat menempel pada cabai, 3) aplikasi pemberian EDS dengan metode penyemprotan harus dilakukan secara merata.
DAFTAR PUSTAKA
Achmad, Suryana I. 2009. Pengujian aktivitas ekstrak daun sirih (Piper betle
Linn.) terhadap Rhizoctonia sp. secara In Vitro. Bul Littro 20 (1):92–98. Badan Pusat Statistik. 2015. Produktivitas Cabai 2010–2014.
Bangun AP, Sarwono B. 2002. Khasiat dan Manfaat Mengkudu. Aggromedia Pustaka. Jakarta.
Bhanu P, Ravindra S, Priyanka S, Ashok K. 2010. Efficacy of Chemically Characterized Piper betle L. Essential Oil Against Fungal and Aflatoxin Contamination of some Edible Commodities and its Antioxidant Activity. J Food Microbiology. 142(2010):114–119.
30
components in avocado (Persea americana Mill.) against anthracnose during post-harvest storage. J Crop Protection. 64(2014):159-167.
Chen F, Long X, Yu M, Liu Z, Liu L. 2013. Phenolics and antifungal activities analysis in industrial crop jarusalem artichoke (Helianthus tuberosus L.) leaves. J Industrial Crops and Products. 47(2013):339-345.
Daniel L, Chiu-Po C, Ying-Jan W,Tong-Mei W, Bor-Ru Lin, Chun-HH, Jang-J L, Hsin-Ming C, Jiiang-Huei J, And Mei-Chi C. 2003. Antioxidative and antiplatelet effects of aqueous inflorescence Piper betle Extract. J Agriculture and Food Chemistry. 512083-2088 2083.
Handayani I, Hasanudin, Anwar. 2013. Efektivitas ekstrak daun sirih (piper batle
L.) sebagai bioinsektisida terhadap kematian nyamuk Aedes aegypti. Jurnal. Hidayat I, Sulastrini M, Kusandriani I, Permadi AH. 2004. Lasio sebagai
komponen tanggap buah 20 galur dan atau varietas cabai terhadap inokulasi
Colletotrichum capsici dan Colletotrichum gloeosporioides. J Hortikultura 14(3):161-162.
Kan, Yuksel, Uçan, Uçkun Sait, Kartal M, Altun, ML, Aslan S, Sayar E, Ceyhan T. 2006. GC-MS analysis and antibacterial activity of cultivated Satureja cuneifolia ten. essential oil. J Chemitry Turkey 30 253–259.
Kim KD, Oh BJ, Yang J. 1999. Differential interaction of a Colletotrichum gloeosporioides isolate with green and red pepper fruits. J Phytoparasitica 27(2):1–10.
Lembaga Penelitian dan Pengabdian Kepada Masyarakat. 2014. Analisis Permintaan dan Penawaran Komoditas Cabai di Indonesia. Disampaikan ke Sekretariat Direktorat Jendral Pengolahan dan Pemasaran Hasil Pertanian Kementrian Pertanian RI.
Liyanage C, De Silva. 2008. Food classification using colour imaging. Massey University, New Zealand.
Maja MP, Valentina S, Jerneja J, Vlasta C, Robert V, Alenka M, Vranci S. 2013. Phenolic compounds as defence response of pepper fruits to Colletotrichum coccodes. J Physiological and Molecular Plant Pathology. 84(2013):138-145.
Maqbool M, Ali A, Alderson PG, Mohamed MTM, Siddiqui Y, Zahid N. 2011. Postharvest application of gum arabic and essential oils for controlling anthracnose and quality of banana and papaya during cold storage. J Postharvest Biology and Technology. 62 (2011):71–76
Nisa GK, Nugroho WA, Hendriawan Y. 2014. Ekstraksi Daun Sirih Merah (Piper
crocotum) dengan metode Microwave Assisted Ekstraction (MAE). J Bioproses Komoditas Tropis. 2(1)
Nurhayati. 2007. Pertumbuhan Colletotrichum capsici penyebab antraknosa buah cabai pada berbagai media yang mengandung ekstrak tanaman. J Rafflesia 9(1):ISSN:1411–2434.
31 Petkovsek MM, Schmitzer V, Jakopic J, Cunja V, Veberic R, Munda A, Stampar F. 2013. Phenolic compounds as defence response of pepper fruits to
Colletotrichum coccodes. J Physiological and Molecular Plant Pathology. 84(2013):138-145.
Petzold G, Caro M, Moreno J. 2014. Influence of blanching, freezing and frozen storage on physicochemical properties of broad beans (Vicia faba L). J Refrigeration 40(2014):429-434.
Rahman MM, Miaruddin MD, Golam FC, Khan HH, Matin MA. 2012. Effect of different packaging systems and chlorination on the quality and shelf life of green chili. J Agri Res. 37(4):729-736 ISSN 0258-7122.
Reina M, Diaz CE, Fraga BM. 2010. Natural product-based biopepticides for insect control. Instituto de Ciencias Agrarias-CCMA. Madrid. Spain.
Standar Nasional Indonesia. 1998. Cabai Merah Segar. SNI No. 01-4480-1998. Stone H, Sidel J, Oliver S, Woolsey A, Singleton RC. 1974. Sensory evaluation
by quantitative descriptive analysis. Institute of Food Technologists. Chicago. Originally published in food Technology 8, 24-32.
Sudrajat H. 2004. Pengaruh ketebalan irisan dan lama perebusan (blanching) terhadap gambaran mikroskopis dan kadar minyak atsiri simplisia dringo (Acorus calamus L.). Media Litbang Kesehatan Volume XIV No 4 Balai Penelitian Tanaman Obat, Puslitbang Farmasi dan Obat Tradisional.
Sutrisno, Purwanto YA, Rakhelia E, Sugiyono. 2009. Perubahan Kualitas Buah Manggis (Garcinia mangosiana L.) setelah Proses Transportasi dan Penyimpanan Dingin. Prosiding Bidang Teknik Sumberdaya Alam Pertanian ISSN 2081-7152.
Soesanto L. 2006. Penyakit pascapanen sebuah pengantar. Penerbit Kanisius. Cetakan ke-5. ISBN: 979-21-1255-3.
Syukur M, Sujiprihati S, Koswara J, Widodo. 2009. Pewarisan ketahanan cabai (Capsicum annuum L.) terhadap antraknosa yang disebabkan oleh
Colletotrichum acutatum. Bul Agron. 37(3):233-239.
Than PP, Prihastuti H, Phoulivong S. 2008. Chilli Anthracnose Disease Caused by
Colletotrichum species. J Zhejiang University SCIENCE B. ISSN 1673-1581. ISSN 1862-1783.
Wiyono S. 2007. Perubahan Iklim dan Ledakan Hama dan Penyakit Tanaman. Seminar sehari. Jakarta.
32
LAMPIRAN
Lampiran 1 Hasil sidik ragam masing-masing parameter setiap perlakuan Parameter/
Perlakuan
Kontrol Penyemprotan Perendaman 10 menit Perendaman 15 menit Perendaman 20 menit
Awal Akhir Awal Akhir Awal Akhir Awal Akhir Awal Akhir
29,80±3,44 ab 16,26±1,88 c 31,47±2,67
ab 18,32±0,33 c 29,23±2,94 b 21,01±3,23 c 35,82±2,97 ab 19,13±0,63 c 36,24±2,66 a 19,45±0,16 c
33 Lampiran 2 Perbandingan diameter C. acutatum pada masing-masing konsentrasi EDS
EDS 0% EDS 3% EDS 5% EDS 6% EDS 7%
34
Lampiran 3 Perbandingan cabai pada masing-masing perlakuan hari ke-0 hingga hari ke-9
Kontor hari ke-0 Kontor hari ke-3 Kontor hari ke-6 Kontor hari ke-9
Semprot hari ke-0 Semprot hari ke-3 Semprot hari ke-6 Semprot hari ke-9
’ -0 ’ -3 ’ -6 ’ -9
5’ -0 5’ -3 Perendaman 5’ -6 5’ -9
35 Lampiran 4 Cabai terserang penyakit antraknosa hari ke-3
36
Lampiran 5 Penyimpanan cabai pada suhu ruang
37
38
Lampiran 7 Fromulir Uji Organoleptik Cabai
Nama :
Tanggal pengujian :
Produk : cabai merah segar Instruksi:
Berilah tanda garis vertikal pada garis yang tersedia! 1. Aroma
a. Aroma Keseluruhan Cabai Kode Sample
0 100
39 b. Aroma daun sirih Kode Sample
0 100
40
c. Warna Cabai Keseluruhan Kode Sample
0 100
41
RIWAYAT HIDUP
Penulis dilahirkan di Talangpadang 26 Desember 1987 dari pasangan Suhendro dan Solihati. Penulis adalah anak tunggal. Tahun 2006 penulis lulus dari SMA Negeri 1 Talangpadang dan pada tahun yang sama penulis melanjutkan studi pada program studi Teknologi Pangan, Fakultas Teknik, di Universitas Pasundan Bandung. Tahun 2011 penulis lulus dengan gelar Sarjana Teknik.
Selama mengikuti perkuliahan, penulis pernah aktif sebagai anggota Himpunan Teknologi Pangan periode 2007 - 2008 dan anggota Himpunan Mahasiswa Peduli Pangan Indonesia periode 2008-2009. Selain itu penulis juga menjabat sebagai kepala produksi pada program Wirausaha Muda Pemula yang merupakan program kerja program studi Teknologi Pangan yang bekerja sama dengan Badan Ketahanan Pangan Daerah Bandung dalam diversifikasi produk pangan non beras dan non terigu yang dimulai tahun 2009 sampai 2011.
Tahun 2011 penulis mulai bekerja di CV. Wijayakusuma Jakarta yang bergerak di bidang Suplayer bahan pangan sebagai staf QC dan bertahan hingga 3 bulan kerja, kemudian penulis berpindah ke Yayasan Al-A M ’ Anwar yang bergerak di bidang pendidikan sebagai penyelenggara Universitas M ’ A w B dan menjabat sebagai Staf Keuangan dari tahun 2012 hingga sekarang.