MEKANISME PENGHAMBATAN BAKTERI PROBIOTIK TERHADAP PERTUMBUHAN Vibrio lrnrveyi PADA LARVA
UDANG WINDU (Penneus monodon)
EVA AYUZAR
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PE
ATAAN MENGENAI TESIS DAIO
SUNUBER INFO
SI
Dengan ini saya menyatakan bahwa tesis Mekanisme Penghambatan Bakteri Probiotik terhadap Pertumbuhan Vibrio harveyi pada larva udang windu (Penaeus monodon) adalah benar hasil karya saya sendiri dan merupakan bagian dari penelitian hibah bersaing dengan judul "Bakteri Probiotik dalam Budidaya Udang: Seleksi, Mekanisme Aksi, Karakterisasi dan Aplikasinya sebagai Agen Biokontrol". Sumber inforrnasi yang berasal atau d i t i p dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Bogor, Januari 2008
ABSTRAK
EVA AWZAR. Mekanisme Penghambatan Bakteri Probiotik terhadap Pertumbuhan Vibrio harveyi pada Larva Udang Windu (Penaeus monodon). Dibimbmg oleh S W N D A dan W I D A N M I .
ABSTRACT
EVA AYUZAR. Inhibitory mechanism of probiotic bacteria on the growth of Vibrio harveyi in tiger shrimp (Penaeus monodon) larvae. Under the guidance of SUKENDA, and WIDANARNI.
ME
ISME PENGWAMBATAN BAKTERI
PROBIOTIK TERHADAP PERTUMB
N
Vibrio harveyi
PADA LARVA
UDANG
W I m U
(Penaeus monodon)
EVA AUUZAR
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains padr Program Studi Ilmu Perairan
SEKOLAH PASGASARJANA
HNSTkTUT PERTANHAN BOGOR
: Mekanisme Penghambatan Bakteri Probiotik terhadap Pertumbuhan Vibrio haweyi pada Larva Udang Windu (Penaeus monodon)
Nama : EVA AYUZAR
NRP : C151040171
Program Studi :
LLMU
PERAIRANDisetujui, Komisi Pembimbing
Dr. Widanarni Anggota
Ketua Program Studi Dekan Sekolah Pascasariana IPB Ilmu peraGan
"
$
Prof. Dr.Ir.
Enang Harris, MI
airil Anwar Notodiputro, MS
Puji dan syukur penulis panjatkan kepada Allah SWT, karena hanya atas
rahmat dan karunia serta ridho-Nyalah tesis yang berjudul "Mekanisme
Penghambatan Bakteri Probiotik terhadap Pertunbuhan Vibrio haweyi pada
Larva Udang Windu (Penaeus monodon)" dapat diselesaikan.
Pelaksanaan penelitian dan penulisan tesis ini tidak terlepas dari bantuan
dan bimbimgan berbagai pihak. Pada kesempatan ini, penulis menyampaikan
terima kasih yang sebesar-besarnya kepada:
1. Bapak Dr. Sukenda dan Ibu Dr. Widanani selaku komisi pembimbing atas
pengarahan dan bimbingan yang telah diberikan selama penelitian d m
penulisan tesis ini sehingga dapat penulis selesaikan dengan baik.
2. Bapak Rektor Universitas Mallikusaleh, Bapak Dekan Fakultas Pertanian
beserta jajarannya, Bapak Ketua Jurusan Budidaya Perairan, yang telah
memberikan kesempatan dan mengijinkan penulis untuk mengikuti program
pascasarjana di Sekolah Pascasarjana Institut Pertanian Bogor.
3. Ketua Program Studi Ilmu Perairan, Ketua d m Staf Laboratorium Kesehatan
Ikan dan Laboratorium Lingkungan Budidaya Perairan, Fakultas Perikanan
dan Ilmu Kelautan, Institut Pertanian Bogor yang telah membantu dalam
penyediakan fasilitas hingga terlaksananya penelitian ini.
4. Ayahanda Azarman Arief dan Ibunda Zuraida 2, Mertua Cut Nursinah serta
semua adik-adikku yang telah banyak memberikan bantuan baik materi
maupun moral serta suami Dedi Nurdiansyah dan anakku Salsa Zurdiva h a
tercinta yang selama ini telah banyak berkorban dan bersabar, hingga penulis
mampu menyelesaikan studi ini dengan baik.
5. Rekan-rekan angkatan 2004,2005 dan 2006 Program Studi Ilmu Perairan dan
Staf Perpustakaan Budidaya Perairan atas segala bantuan dan kerjasamanya.
Akhirnya semoga tesis ini dapat bermanfaat bagi semuanya. Amin
.
Bogor, Januari 2008
RIWAYAT NIDUP
Penulis dilahirkan di Kutacane, Aceh Tenggara pada tanggal 23 Juli 1980
dari ayah Azarman Arief dan ibu Zuraida Z. Penulis merupakan anak pertama dari
lima bersaudara. Sejak tahun 2006 penulis telah berkeluarga dengan suami
bemama Dedi Nurdiansyah dan dikaruniai seorang anak beinama Salsa Zurdiva
h a .
Penulis lulus SMA pada tahun 1998 dan melanjutkan program sarjana (Sl)
di Universitas Riau, selesai pada tahun 2003. Pada bulan Agustus 2004, penulis
melanjutkan kuliah ke sekolah Pascasarjana Institut Pertanian Bogor Program
Studi Ilmu Perairan.
Tahun 2006 penulis diangkat sebagai tenaga pengajar di Jurusan Budidaya
DAFTAR IS1
Walaman
...
DAFTBR IS1 i
DAFTAR G AR
...
...
11. .
...
DAFTAR LAMPIRAN III PENDAWULUAN...
1Latar Belakang
...
1...
Tujuan 2...
TINJAUAN PUSTAKA 3...
Bakteri Vibrio haweyi dan Penyakit Udang Berpendar 3 Bakteri Probiotik sebagai Biokontrol pada Larva Udang...
4Mekanisme Kerja dan Seleksi Bakteri Probiotik
. . .
...
6Resistensi A n t ~ b ~ o t ~ k
...
7
...
lllETODE PENELITIAN Waktu dan Tempat...
...
Metode dan Disain Penelitian Sumber Isolat Bakteri Probiotik...
...
Uji In Vivo Bakteri Probiotik pada Larva Udang Pembuatan Mutan Bakteri Probiotik.
Resisten Rifampisin @@)...
Pertumbuhan Bakteri ProbiotikRfR
...
Daya Hambat Bakteri Probiotik Rf?erhadap V: haweyi pada Larva Udang...
Identifikasi Isolat Probiotik...
...
Parameter yang Diamati a.Tingkat Kelangsungan Hidup Larva Udang...
b.Pertumbuhan Larva Udang...
c.Populasi Bakteri. .
.
.
...
Anal~s~s Statlstlk...
WASIL DAN PEMBAHASAN...
13Sumber Isolat Bakteri Probiotik
...
13Uji In Vivo Bakteri Probiotik pada Larva Udang
...
15penggunaan ~enanda
RfR
pads ~ a k t e r i Probiotik...
18Pertun~buhan Bakteri Probiotik
RfR
...
18Daya Hambat Bakteri Probiotik
RfR
terhadap V.
haweyi pada Larva Udang...
20Identifikasi Isolat Probiotik
...
26DAFTAR G AR
Nalaman
1. Penampilan koloni isolat 1Ub pada media
SWC
...
...
2. Penampilan koloni isolat SKT-b pada media
TCBS (A)
danSWC
(B)...
3. Penampitan kokcni isolat Ua pada me&aTCBS
(A)
dmSWC
(9)4. Penampilan koloni isolat V. harveyi pada media
TCBS
diruang terang(A)
d i g gelap(B)
...
5. Kelangsungan hidup larva udang windu pada uji in vivo bakteri probiotik.. 6. Pertumbuhan panjang larva udang windu pada uji in vivo bakteri probiotik 7 Pertumbuhan bobot larva udang windu pada uji in vivo bakteri probiotik...
....
8. Perbandingan pertumbuhan bakteri probiotik mutan dengan tipe liarnya 9. Kelangsungan hidup larva udang pada uji daya hambat bakteriprobiotik terhadap i? harveyi
...
10. Populasi bakteri probiotik, V. harveyi, dan total bakteri pada larva udang...
mati pada uji daya hambat bakteri probiotik terhadapV.
harveyi1 1. Populasi bakteri probiotik, V. harveyi, dan total bakteri pada larva udang hidup pada uji daya hambat bakteri probiotik terhadap V. harveyi
...
12. Populasi bakteri probiotik, i? harveyi, dan total bakteri pada airpemeliharam pada uji daya hambat bakteri probiotik terhadap V. harveyi
..
13. Perhmbuhan panjang larva udang pada uji daya hambat bakteri probiotikterhadap K harveyi
...
14. Perhmbuhan bobot larva udang pada uji daya hambat bakteri probiotikDAFTAR L M P I R A N
1. Komposisi media SWC-agar (Seawater Complete agar), SWC-cair dan TCBS-agar (Thiosulphate Cihate Bile-Salt sucrose agar)
...
...
2. Peclbuatu: larutu: Stck Sfampisin
3. Kelangs~mgan hidup larva udang windu pada uji in vivo bakteri Probiotik
...
4. Pertumbuhan panjang larva udang windu pada uji in vivo bakteri probiotik.5.
Pertumbuhan bobot larva udang windu pada uji in vivo bakteri probiotik....
6.
Kelangsungan hidup larva udang pada uji daya hambat bakteri probiotikterhadap V. haweyi
...
7 .
Pertumbuhan panjang larva udang pada uji daya hambat bakteri probiotikterhadap V. haweyi
...
8. Pertumbuhan bobot larva udang pada uji daya hambat bakteri probiotikPEND UAN
Latar Belakang
Serangan penyakit dan penurunan kualitas lingkungan budidaya
merupakan masalah yang timbul dalam usaha pembenihan udang. Salah satu
penyakit udang yang membahayakan adalah penyakit udang berpendar atau
luminescent vibriosis yang disebabkan oleh Ebrio harveyi. V. harveyi dapat
menyerang udang pada berbagai stadia mulai dari nauplius, zoea, mysis dan post
larva di pembenihan hingga udang dewasa di tambak pembesaran (Saulnier et al.
2000).
Salah satu alternatif untuk menanggulangi permasalahan penyakit vibriosis
adalah dengan menggunakan bakteri probiotik sebagai biokontrol yang dapat
menghambat pertumbuhan V. harveyi. Bakteri probiotik yang digunakan sebagai
biokontrol dapat diisolasi dari tambak atau pembenihan udang (Tjahjadi et al.
1994; Hary'anti et al. 2000), air dan sediien laut (Muliani et al. 2003) atau
invertebrata laut seperti sponge (Suryati et al. 2004) serta terumbu karang
(Proksch, 2000).
Tiga isolat bakteri kandidat probiotik koleksi Laboratorium Kesel~atan
Ikan, Departemen Budidaya Perairan, IPB yakni 1Ub (Tepu, 2006), SKT-b
(Widanami et al. 2003) dan Ua (Rajab, 2006) telah diuji mampu menghambat pertumbuhan V. harveyi secara in vitro dan dapat meningkatkan kelangsungan hidup larva udang pada uji in vivo.
Untuk mempelajari mekanisme aksi bakteri probiotik tersebut dalam
menghambat pertumbuhan V. harveyi pada larva udang dilakukan dengan memberikan penanda molekuler pada bakteri probiotik dan patogen, sehingga
keberadaan bakteri tersebut pada larva udang dapat diamati. Penanda resistensi
terhadap antibiotik rifampisin
(RfR)
merupakan suatu pilihan karena bakteri asallaut pada umumnya sensitif terhadap rifampisin (Tjahjadi et al. 1994). Selain itu
mutan spontan resisten rifampisin bersifat stabil pada media tanpa penambahan
antibiotik (Hala et al. 2002) sehingga dapat digunakan 14i tantang pada jangka
dari bakteri lain yang sebelumnya telah terdapat pada larva udang atau air media
pemeliharaannya.
Tujuan
Penelitian ini bertujuan untuk mempelajari mekanisme penghambatan
bakteri probiotik terhadap pertumbuhan V. hurveyi pada larva udang windu
TINJAUAN PUSTAKA
Bakteri Vibrio Itarveyi dan penyakit udang berpendar
V. h a m y i pada umumya bersifat patogen oportunistik, yaitu organisme
yang dalam keadaan normal ada dalam lingkungan pemeliharaan dan berkembang
dari sifat saprofitik menjadi patogenik apabila kondisi lingkungan dan inang
memburuk. Pada saat terjadinya wabah, populasi bakteri ini dapat m e ~ n g k a t
menjadi ribuan kali dalam wadahhak pemeliharaan larva, dan ha1 ini terjadi
setelah usaha budidaya udang windu berkembang secara intensif (Lavilla-Pitogo
et al. 1990). Menurut Saulnier et al. (2000) beberapa galur V. harveyi merupakan
patogen dan penyebab utama penyakit vibriosis pada udang windu. Kesimpulan
tersebut diambil berdasarkan studi virulensi dari beberapa galur V. harveyi yang
diisolasi dari larva sekarat dan diinfeksi kembali pada udang sehat. Beberapa dari
galur tersebut dapat menyebabkan kematian total larva udang dengan dosis yang
sangat rendah (10 CFUIml).
Pada sistem budidaya udang, V. harveyi dapat ditemukan di hatchery,
dapat diisolasi dari air laut yang masuk, induk, larva dan air tanki pembesaran
larva (Otta et al. 2001; Prayitno et al. 1995). V. harveyi juga dapat diisolasi dari
tambak pembesaran udang (Karunasagar et al. 1994).
Ciri-ciri morfologi clan fisiologi
I.:
harveyi pada medium nutrien agardengan NaCl 1.5% dan seawater complete-agar (SWC-agar) adalah: bentuk
koloni bulat dengan elevasi cembung, berwarna krem, berdiameter 2-3 mm
setelah inbubasi 24 jam pada suhu 2 8 ' ~ . Pada medium selektif
untuk
genusVibrio, yaitu TCBS-agar (Tiosu&te Citrate Bile-Salt Sucrose), koloni V. harveyi
benvama hijau dan berpendar bila diamati di ruang gelap (Lavilla-Pitogo et al.
1990).
Kemampuan berpendar atau lztminescent merupakan hasil aktivitas enzim
luciferase yang dapat berfimgsi sebagai katalisator dalam proses oksidasi reduksi.
Proses oksidasi melibatkan flavin mononukleotida dan aldehid alifatik rantai
panjang sebagai substratnya. Senyawa-senyawa tersebut masing-masing diubah
menjadi flavin mononukleotida dan asam lemak disertai dengan pelepasan emisi
fungsi perpendaran ini disandikan dalam suatu operon yang disebut dengan
operon lux (Meighen, 1991; Ruby, 1996). V. harveyi juga diietahui memiliki
aktivitas enzim kitinase, protease, dan lipase (Baumann et al. 1994). Enzim
kitinase memungkinkan V. harveyi untuk menguraikan kitin dan berkolonisasi di
dalam tubuh larva udang windu.
Kematian yang disebabkan vibriosis terjadi apabila udang mengalami stres
akibat kualitas air buruk, kepadatan tinggi, temperatur tinggi dan pergantian air
yang rendah (Brock and Lightner 1990). Berdasarkan hasil penelitian Lavilla-
Pitago (1990), kematian larva terjadi setelah 48 jam pasca infeksi bakteri V.
haweyi dan V. splendidus.
Jenis Vibrio lain yang menyebabkan vibriosis adalah Vibrio vulnificus,
Vibrio parahaemalyticus ( Nash et al. 1992 dan Lavilla-Pitogo et al. 1990), V. anguillarum, V. campbelli, dan V. splendidus (Chen, 1992). Akibat meningkatnya
jurnlah kasus vibriosis yang terjadi, maka diperlukan serangkaian penelitian untuk
mengetahui sifat virulensi dari V. harveyi agar penyakit ini dapat diatasi (Austin et
al. 2003).
Bakteri Probiotik sebagai Biokontrol pada Larva Udang
Menurut Fuller (1992), probiotik adalah mikrob hidup yang ditambahkan
ke dalam pakan yang dapat memberi pengaruh mengmtungkan bagi hewan inang
dengan cara memperbaiki keseimbangan mikrob ususnya. Pada hewan akuatik,
selain saluran pencemaan, air di sekeliling organisme tersebut juga memegang
peranan penting. Sehingga probiotik untuk hewan akuatik adalah agen mikrob hidup yang memberikan pengaruh menguntungkan pada inang dengan
memodifikasi komonitas mikrob atau berasosiasi dengan inang, menjamin
perbaikan dalam penggunaan pakan atau memperbaiki nilai nutrisinya,
meinperbaiki respon inang terhadap penyakit, atau memperbaiki kualitas
lingkungan ambangnya (Verschuere et al. 2000).
Biokontrol menurut Gomez-Gil et al. (2000) adalah penggunaan musuh
alamiah untuk mengurangi kemsakan yang disebabkan oleh organisme berbahaya
sampai tingkat yang dapat ditolerir, atau lebih tepat lagi pengaturan populasi
mikrob di dalam saluran pencemaan hewan sampai batas tertentu memberi
ketahanan atau perlindungan terhadap penyakit. Demikian pula pada populasi
alamiah hewan akuatik, mikrobiota di dalam saluran pencernaan dapat
mencerminkan lingkungan akuatik tersebut. Namun demikian, pada pemeliharaan
larva dengan kepadatan tinggi di dalam wadah budidaya, keseimbangan dapat
berubah karena penggunaan air yang sudall didesinfeksi, mikroalga, nauplii,
artemia, rotifer dan berbagai antibiotik pembunuh bakteri. Akibatnya, komunitas
mikrob pelindung tidak dapat berkembang baik di lingkungannya maupun di
dalam sistem saluran pencemaan larva. Pascalarva yang dipelihara di dalam
lingkungan yang relatif steril di suatu pembenihan tidak dapat tumbuh dengau
baik dan memperlihatkan daya hidup yang rendah bila terpapar pada kompleks
populasi mikrob di petak pendederan atau pembesaran. Pascalarva tersebut &an
mudah terserang penyakit bila terkena stress lingkungan atau terinfeksi oleh
bakteri yang potensial bersifat patogen. Menumt Gomez-Gil et al. (2000), konsep
probiotik sebagai biokontrol, yaih pemanfaatan organisme yang antagonis dalam
membatasi atau menyerangi hana pada budidaya. Dalam hal ini mikroorganisme
probiotik tidak hanya sebagai nlusuh alami patogen, tetapi juga dengan
mengurangi kerusakan yang disebabkan oleh patogen, umumnya dengan
kompetisi, yang paling banyak dengan menghasilkan substansi yang menghambat
perttunbuhan mikroorganisme yang paling berbahaya.
Pemanfaatan beberapa bakteri yang berada dalam wadah budidaya dan
tubuh organisme seperti udang maupun ikan sebagai probiotik telah dilakukan dan
mampu menunjukkan pengaruh positif terhadap pertumbuhan dan kesehatan
melalui peningkatan keseimbangan mikrobial dalam tubuh (Gullian et al. 2004;
Villamil et al. 2003; Vine et al. 2004).
Pemberian probiotik pada usaha budidaya udang windu dapat
meningkatkan kelangsungan hidup dan dapat menekan pertumbuhan bakteri
patogen sehingga didapat kualitas dan produksi udang windu yang lebih baik
(Haryanti et al. 2000; Haryanti dan Sugama, 2002; Moriarty, 1999 dan Rengpipat
Mekanisme Kerja dan Seleksi Bakteri Probiotik
Menurut Verschuere et al. (2000), mekanisme kerja probiotik dapat dibagi
menjadi beberapa cara, yaitu: (1) memproduksi senyawa inhibitor seperti
antibiotik, bacteriocins, siderophores, lysozymes, proteases, hidrogen peroksida
ataupun asam organik yang dapat merubah pH, (2) kompetisi terhadap senyawa
kimia atau sumber energi (n~ttrisi), seperti besi ataupun nutrien yang diambil dari
inang; (3) kompetisi terhadap tempat pelekatan pada tubuh inang; (4)
meningkatkan respon imun (kekebalan) pada inang; (5) memperbaiki kualitas air;
(6) interaksi dengan fitoplankton.
Probiotik yang bekerja di dalam tubuh inang l-iarus mampu bertahan hidup
dalam mukosa usus inang dan berkembang biak dengan cepat agar tidak terbawa
keluar bersama sisa metabolisme inang (Vine et al. 2004). Meskipun secara in
vitro probiotik terbukti mampu menekan atau menghambat perttunbuhan bakteri
patogen, namm apabila probiotik tersebut tidak dapat bertahan hidup dalam
mukosa usus kemungkinan besar probiotik yang menghambat perttunbuhan
b'akteri patogen tidak ditemukan pada uji in vivo (Vine et al. 2004).
Menurut Gomnez-Gil et al. (2000), seleksi bakteri probiotik biasanya
merupakan proses empiris didasarkan pada sediiit bukti ilmiah. Banyak
kegagalan dalam penelitian bakteri probiotik yang terjadi karena salah memilih
mikroorganisme. Tahapan seleksi memang sudah ditentukan, akan tetapi tahapan
ini masih perlu disesuaikan berdasarkan spesies inang dan lingkungan, sehingga
perlu pemahaman mekanisme kerja probiotik dalam menentukan kriteria seleksi
bakteri probiotik potensial.
Menurut Gomez-Gil et al. (2000), metode seleksi bakteri probiotik untuk
kegiatan pemeliharaan larva hewan akuatik dapat mencakup beberapa tahap
berikut: (1) pengumpulan informasi dasar yang didapat dari studi pustaka maupun
di lapangan, meliputi infomasi tentang mikroba serta hubungan antara inang
dengan lingkungannya; (2) penapisan mikroba, yaitu proses pemisahan mikroba
dari campnrannya berdasarkan kriteria tertentu seperti bakteri probiotik hams
menguntungkan inangnya, mampu bertahan hidup dalam usus, dapat disiapkan
sebagai produk sel hidup pada skala industri, dan dapat terjaga stabilitas serta
pengujian isolat dalam menghambat mikroba patogen secara in vitro dan in vivo;
(4) pengujian patogenitas isolat terhadap inang; (5) pengujian skala laboratorium
termasuk melihat pengaruh kandidat probiotik secara in vivo terhadap variabel
imonologi, dan uji tantang dengan patogen; (6) analisa ekonomi biaya-laba.
Resistensi Antibiotik
Sifat resistansi terhadap antibiotik diperlukan oleh suatu mikroorganisme
untuk mempertahankan kelangsungan hidupnya di alam. Sifat resistensi terhadap
suatu jenis antibiotik dari suatu bakteri perlu diketahui sebelum ditetapkan jenis
antibiotik yang akan digunakan sebagai penanda terhadap bakteri tersebut. Hal ini
akan memudahkan untuk menyeleksi bakteri tersebut dari bakteri yang secara
alami sensitif terhadap antibiotik yang digunakan.
Menurut Chythanya et al. (1999) beberapa organisme secara alami resisten
terhadap beberapa antibiotik. Hal ini disebabkan oleh beberapa faktor antara lain:
(1) organisme tidak mempunyai dinding sel sehingga &an resisten terhadap jenis
antibiotik yang merusak pada dinding sel seperti kelompok penisilin; (2)
organisme mungkin tidak permeabel terhadap beberapa antibiotik; (3) rnikroorganisme mempunyai kemampuan untuk menginaktifkan beberapa
antibiotik; (4) mikroorganisme mempunyai sistem metabolisme yang dapat
memblokir antibiotik tertentu sehingga resisten terhadap antibiotik tersebut; (5)
mikroorganisme mempunyai kemampuan unhk memompa antibiotik tertentu
keluar dari dinding sel sehingga resisten terhadap antibiotik tersebut.
Rifampisin merupakan antibiotik bakterisidal yang dapat mematilcan
kebanyakan gram positif dan beberapa jenis bakteri
gram
negatif. Antibiotik inibekerja dengan menghambat sintesa RNA polimerase dari bakteri (Madigan et al. 1997).
V. harveyi dan bakteri-bakteri alami lainnya pada umurnnya telah resisten
terhadap amoksilin (200 pglml), tetrasiMin (5 pdml), ampisilin (50 pg/ml), dan
kanamisin (50 pdml). Meskipun demikian,
V:
harveyi dan bakteri laut umumnyasensitif terhadap antibiotik rifampisin (Tjahyadi 1994). Oleh karena itu penanda
membedakan bakteri yang diinokulasi dengan bakteri yang sebelumnya telah ada
pada larva udang.
Untuk memperoleh V. harveyi yang resisten rifampisin dilakukan dengan
cara menyebarkan suspensi biakan V. harveyi pada media SWC yang diberi rifampisin (50 pglml). Koloni yang turnbull kemudian disubkulturkan untuk
RlETODE PENELITIAN
Waktu dan Tempat
Penelitian dilakukan di Laboratorium Kesehatan Ikan, Departemen
Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian
Bogor. Peneiitian beriangsung selama 6 buian muiai dari buian Januari sampai
Juli 2007.
Metode dan Disain Penelitian
Penelitian dilakukan menggunakan metode eksperimental laboratorium.
Ada lima tahapan yang dilakukan, yaitu tahap pertarna: Uji in vivo bakteri
probiotik pada larva udang. Tahap kedua: Pembuatan mutan bakteri probiotik
resisten rifampisin @). Tahap ketiga: Pertumbuhan bakteri probiotik
@.
TahapKeempat: Uji daya hambat bakteri probiotik
RfR
terhadap V. harveyi pada larvaudang. Tahap kelima: Identifikasi bakteri probiotik. Penelitian dirancang
menggunakan Rancangan Acak Lengkap dengan 3 ulangan dan dianalisis keragamannya menggunakan ANOVA.
Sumber Isolat Bakteri Probiotik
Isolat yang digunakan dalam penelitian ini adalah IUb (Tepu, 2006), Ua
(Rajab, 2006) dan SKT-b (Widanarni et al. 2003). Ketiga isolat tersebut telah diuji
mampu menghambat pertumbuhan V. harveyi patogen pada uji in vitro serta dapat meningkatkan kelangsungan hidup larva udang windu.
Uji In Vivo Bakteri Probiotik pada Larva Udang
Tiga isolat bakteri probiotik dengan konsentrasi akhir lo6 CFUIml
dimasukkan dalam wadah pemeliharaan udang sehari setelall larva ~tdang
dimasukkan. Larva udang dipelihara dalam toples yang diisi air laut steril 2 liter
dengan kepadatan 10 ekorll. Setelah kokuitivasi dengan larva udang selama 6
jam, V. hnrveyi MR5339
@
biroasukken dengan konsentxasi lo6 CFUIml.Percobaan dilakukan dengan tiga ulangan termasuk kontrol positif (V. harveyi
MR5339
RfR
maupun isolat probiotik). Pergantian air dan penyiponan dilakukansetiap hari sebanyak 10% dari volume total wadah pemeliiaraan. Pengamatan
dilakukan selama 10 hari, dan larva yang mati d i t u n g setiap hari. Pada akhir
percobaan dihitung tingkat kelangsungan hidup dan pertumbuhan larva.
Pernbuatan Mutan Bakteri Probiotik Resisten Efampisin (@)
Isolat bakteri probiotik diuji sensitivitasnya terhadap antibiotik rifampisin
dengan cara menumbuhkan isolat tersebut pada media agar seawater complete (SWC) (Lampiran 1) dengan suplementasi rifampisin 50 pg/ml (SWC
+
RQ
(Lampiran 2). Setelah diinkubasi pada suhu ruang selama 24 jam, respon
resistensi dietahui dengan mengamati tumbuhnya koloni pada media tersebut.
Pembuatan bakteri probiotik
RfR
dilakukan melalui mutasi spontan denganmenyebar 1 ml suspensi bakteri probiotik sensitif rifampisin pada media SWC
yang mengandung rifampisin 50 pg/ml. Koloni yang tumbuh pada media tersebut
merupakan mutan bakteri probiotik
RfR.
P e h m b u h a n Bakieri Probiotik
RfR
BaMeli probiotik tipe liar dan mutannya masing-masing d i t u m b ~ ~ a n
pada media SWC-cair dalam shaker bergoyang pada suhu ruang. Konsentrasi
setiap biakan diperoleh dengan mengukur kekeruhan suspensi biakan dengan
metode turbidimetrik. Pengamatan dilakukan setiap jam selama 24 jam dan
dibandingkan antara tipe liar dengan mutannya.
Daya Narnbat Bakteri Probiotik
@
terhadap V. harveyi pada Larva Udang Tiga isolat mutan bakteri probiotikRfR
diuji kembali efektivitasnya daliunmenghambat pertumbuhan I/: hatveyi patogen pada larva udang. Pengujian dilakukan sama seperti tipe liarnya, namun selain terhadap kelangsungan hidup
dan pertumbuhan, pengamatan juga dilakukan terhadap populasi baMeri probiotik
dan I/: harveyi serta total bakteri baik pada air pemeliharaan maupun larva udang. Pengamatan dilakukan menggunakan media TCBS
+
Rf untuk isolat Vibrio dan SWC+
Rf untuk isolat non Vibrio. Pengujian dilakukan selama 12 liari, denganArtemia dengan frekuensi pemberian pakan 5 kali sehari, yaitu setiap puku106.00, 10.00, 14.00, 18.00, dan 21.00.
Identifikasi Isolat Probiotik
Untuk menentukan identitas isolat probiotik, dilakukan analisis sekuens
gen 16s-rlWA yang meliputi beherapa tahapan sesuai dengan metoda yang
diiemukakan oleh Marchesi et al. (1998) dan telalx dimodifikasi oleh Suwanto et al. (2002) yaitu meliputi ekstraksi DNA, arnplikasi gen 16s-rRNA dengan PCR,
dan sekuensing dengan mesin sequenser.
Parameter yang Diamati
a. Tingkat Kelangsungan Hidup Lawa Udang
Tingkat kelangsungan hidup larva ~ ~ d a n g , dihitung dengan menggunakan
Keterangan :
SR = Tigkat kelangsungan hidup (%)
Nt = Jumlah udang yang hidup pada akhir pengarnatan (ekor) No = Jumlah udang pada awal percobaan (ekor)
b. Perturnbuhan Larva Udang
Pertumbuhan bobot d a i panjang total diarnati pada awal dan akhir
percobaan. Pertumbuhan larva udang windu dihitung berdasarkan pertambahan
bobot dan panjang, dengan nunus berikut:
a =
{I!
- l)i4 OO%} dan a ={I!
- lIXl OO%}Keterangan:
a : Laju pelhunbuhan udang (%)
t : Lama waktu pemeliharaan udang (hari)
c. Populasi Bakteri
Populasi bakteri yang d i t u n g meliputi jumlah bakteri V. harveyi, bakteri
probiotik dan total baktei-i baik pada air pemeliharaan, udang hidup maupun
udang mati. Pengamatan populasi bakteri baik pada
air
pemeliiaan maupunpada larva udang hidup dilakukan setiap 2 hari sekali selama pengarnatan,
sedangkan untuk pengamatan udang mati diiakukan setiap 6 jam sekaii. Jumiah
bakteri dihitung berdasarkan rata-rata jumlah koloni yang tumbuh dikalikan
dengan faktor pengenceran.
Analisis Statistik
Desain dari percobaan ini m e ~ p a h n model eksperimen laboratorium
dengan menggunakan rancangan acak lengkap (RAL) yang terdiri dari 5
perlakuan dan 3 ulangan baik pada percobaan menggunakan bakteri liar, maupun
bakteri mutan.
Bakteri tipe liar :
Perlakuan A : V. haweyi MR 5339
RfR
+
UaPerlakuan B : V. hmveyi MR 5339
fl
i- 1UbPerlakuan C : V. harveyi M R 5339
RfR+
SKT-b Perlakuan D : V. haweyi M R 5339RfR
Perlakuan E : Kontrol
Balkteri mutan :
Perlakuan A : V. harveyi MR 5339
RfR
+
U,
RfR
Perlakuan B : V. haweyi MR 5339
fl
+
1UbRfR
Perlakuan C : V. harveyi M R 5339fl
+
SKT-bR ~ R
Perlakuan D : V. harveyi MR 5339
RfR
HASIL DAN PEMBAHASAN
Sumber Isolat Bakteri Probiotik
Isolat probiotik yang digunakan dalam penelitian ini adalah lUb, SKT-b,
dan Ua. Isolat 1Ub diisolasi dari nauplius udang vaname di hatchery PT Biru Laut
Khatulistiwa (BLK), Kalianda, Lampung Selatan, Lampung. Isolat tersebut
merupakan isolat terbaik yang dapat menekan pertumbuhan V. harveyi pada uji in
viho dengan metode kultur bersama (Tepu, 2006)
.
Penampilan koloni isolat 1Ubpada media SWC benvarna orange cerah (Gambar I), sedangkan pada media
TCBS (media selektif untuk Vibrio) tidak tumbuh sehingga termasuk kelompok
[image:24.595.163.450.303.508.2]bakteri non-Vibrio.
Gambar 1. Penampilan koloni isolat 1Ub pada media SWC
Isolat SKT-b diisolasi dari fitoplankton Skeletonema @akan alami udang
windu) di hatchery Proyek Udang Nasional (PUN), Labuan, Banten. Isolat
tersebut merupakan isolat terbaik yang dapat menekan pertumbuhan V. harveyi
pada uji in vitro dengan metode kultur bersama (Widanarni et al. 2003). Penampilan koloni isolat SKT-b benvarna putih kektmingan dan bersifat
menyebar pada media SWC serta benvarna kuning pada media TCBS (Gambar 2),
A B
Gambar 2. Penampilan koloni isolat SKT-b pada media TCBS (A) dan SWC (B)
Isolat Ua diisolasi dari saluran pencemaan udang vaname di tambak
intensif Pinang Gading, Bakauheni, Lampung Selatan, Lampung. Isolat tersebut
merupakan isolat terbaik yang dapat menghambat pertumbuhan V. harveyi pada
uji in vitro dengan metode Kirby Baeuer, yakni dengan mengukur zona hambat
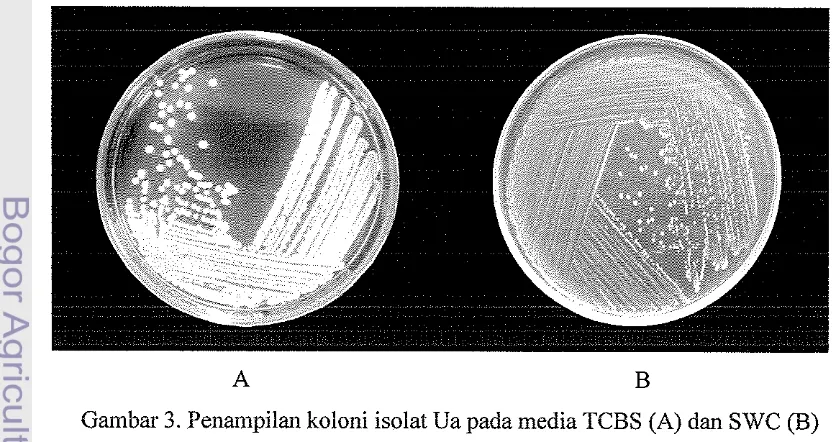
yang dihasilkannya (Rajab, 2006). Penampilan koloni isolat Ua berwarna putih
kekuningan pada media SWC dan benvama kuning pada media TCBS (Gambar
3), sehingga termasuk kelompok bakteri Vibrio.
A B
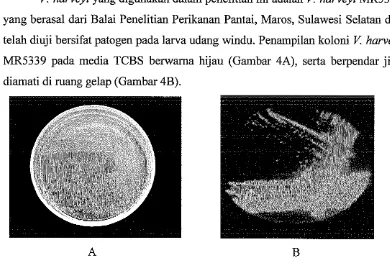
[image:25.595.86.503.483.704.2]V. harveyi yang digunakan dalam penelitian ini adalah V. harveyi MR5339
yang berasal dari Balai Penelitian Perikanan Pantai, Maros, Sulawesi Selatan dan
telah diuji bersifat patogen pada larva udang windu. Penampilan koloni V. harveyi
MR5339 pada media TCBS b e m a hijau (Gambar 4A), serta berpendar jika
[image:26.595.108.498.88.353.2]diamati di ruang gelap (Gambar 4B).
Gambar 4. Penampilan koloni isolat V. harveyi pada media TCBS di ruang terang (A) di mang gelap (B)
Uji In Vivo Bakteri Probiotik pada Larva Udang
Ketiga isolat bakteri probiotik telah diuji efektivitasnya dalam
meningkatkan kelangsungan hidup dan pertumbuhan larva udang windu. Hasil uji
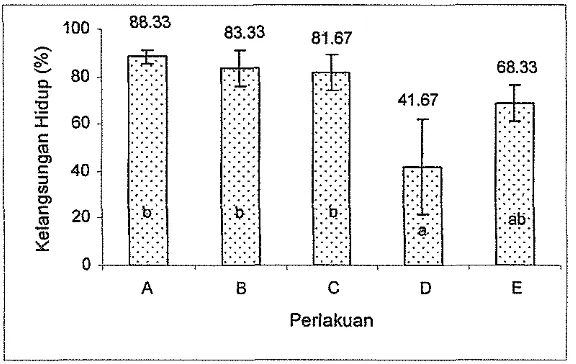
tersebut menunjukkan bahwa kelangsungan hidup larva yang diberi bakteri
probiotik lUb, SKT-b dan Ua secara berturut-turut adalah 88,33%, 83,33%, dan
81,67% pasca uji tantang dengan V. harveyi. Sedangkan perlakuan kontrol positif
dengan inokulasi V: harveyi saja sebesar 41,67% dan kontrol negatif tanpa bakteri
sebesar 68,33% (Gambar 5) dan Lampiran 3. Peningkatan nilai kelangsungan
hidup larva udang diduga karena adanya penghanlbatan pertumbuhan V. harveyi
pada larva udang oleh bakteri probiotik. Isolat-isolat tersebut diduga juga dapat
meningkatkan kebugaran larva udang. Hal ini terlihat dari nilai kelangsungan
A B C D E
Perlakuan
Keterangan :
A = 1 ~ b
+
MR 5339RfR
B=SKT-b+MR5339RP C=Ua+MR5339RPD = Kontrol positif (MR 5339 RP) E = Kontrol negatif (tanpa penambahan bakteri)
Gambar 5. Kelangsungan hidup larva udang windu pada uji in vivo bakteri probiotik
Haryanti et al. (2000) melaporkan bahwa penambahan bakteri strain BY-9
dengan kosentrasi lo6 CFUIm! pada air pemeliharaan ! m a udang windu
menghasilkan tingkat kelangsungan hidup 59,3%, sedangkan pada kontrol 14,7%.
Rengpipat et al. (1998b) menggunakan probiotik Bacillus S11 ~nenunjukkan bal~wa setelah diberi perlakuan probiotik selama 100 hari dan kemudian diuji
tantang dengan
K
harveyi selama 10 hari, nilai kelangsungan hidup udang windu mencapai 100% sedangkan pada kontrol26%.Untuk mengetahui pertumbuhan larva udang windu selama penelitian,
maka dilakukan pengukuran panjang dan bobot larva pada awal dan akhir
penelitian (Lampiran 4 dan 5). Berdasarkan analisis ragarn, tidak terdapat
perbedaan yang nyata antar perlakuan, tetapi secara signifikan semua perlakuan
berbeda nyata dengan kontrol (p<0,05) baik pertumbuhan bobot maupun
pertumbul~an panjang.
Pada Gambar 6 terlihat larva udang yang diberi probiotik memiliki nilai
prtumbuhan panjang lebih besar (3.21 - 3.56%) dibanding perlakuan tanpa
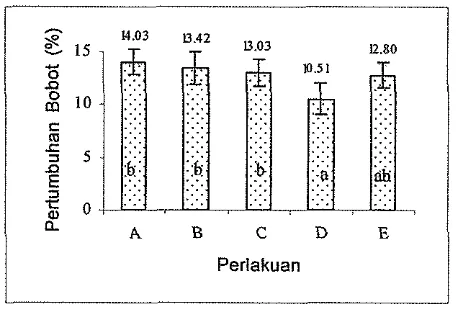
probiotik (2.77 - 2.99%). Demikian pula untuk pertumbuhan bobot (Gambar 7)
[image:27.599.170.458.84.266.2]bobot lebih besar (13.03 - 14.03%) dibanding perlakuan tanpa pemberian
probiotik (10.51 - 12.80%). Hal ini menunjukkan bahwa penambahan balcteri
probiotik dapat meningkatkan pertumbuhan panja~g dan bobot pada larva udang
windu.
Perlakuan
I
Keterangan :
[image:28.602.217.451.167.317.2] [image:28.602.220.448.446.601.2]~ = l ~ b + ~ ~ 5 3 3 9 f l ~ = s ~ ~ - b + M R 5 3 3 9 @ C = ~ a + M R 5 3 3 9 R f R D = Kontrol positif (MR 5339 RP) E = Kontrol negatif (tanpa penambahan bakteri)
Gambar 6. Pe~tumbuhan panjang larva udang wiiidu pada uji in vivo bakteri probiotik
A B C D E
Perlakuan
Keterangan :
~ = l U b + M R 5 3 3 9 ~ P 8 = ~ ~ ~ - b + M R 5 3 3 9 R f R ~ = U a + ~ ~ 5 3 3 9 R f R
D = Kontrol positif (MR 5339
RP)
E = Kontrol negatif ( tanpa penarnbal~an bakeri)Penggunaan Penanda pada Bakteri Probiotik
Dengan menumbuhkan kurang lebih lo8 CFUIml bakteri probiotik tipe liar
sensitif rifampisin pada media SWC-agar yang mengandung rifampisin 50 pglml,
diperoleh mutan resisten rifampisin sebanyak 48 - 110 koloni. Morfologi koloni
maupun pertumbuhan mutan sama seperti tipe liarnya. Sebelum digunakan pada
uji mekanisme penghambatan probiotik pada larva udang, maka mutan
e m g
telah diperoleh ini diuji pertumbuhannya dan dibandingkan dengan tipe liarnya.
Menurut Herrera et al. (2003), resistensi terhadap antibiotik rifampisin terjadi karena adanya perubahan sub unit 0-RNA polimerase yang dikode oleh
gen rpo B. Penelitian Herrera et al. (2003) menggunakan 169 isolat Mycobacterium tuberculosis resisten rifampisin menunjukkan bahwa 95,3% galur resisten rifampisin karena adanya mutasi pada daerah 81-bp dari gen rpo B, sedangkan 4,7% tidak terdeteksi adanya mutasi pada daerah tersebut, diduga
strain tersebut menggunakan mekanisme resistensi yang belum diketahui. Lebih
jauh lagi dijelaskan bahwa mutasi pada daerah 81-bp dapat te rjadi karena adanya
perubahan satu, dua, atau tiga nukleotida, atau karena terjadi delesi dan insersi.
Madigan et al. (1997) juga menjelaskan bahwa secara alami bakteri dapat bersifat
resisten terhadap suatu antibiotik. Sifat resisten tersebut diperlukan oleh suatu
mikroorganisme untuk mempertahankan kehidupannya di dam. Menurut
Clzythanya et al. (1999), secara aiami beberapa jenis mikroorganisme memiliki gen penyandi antibiotik yang dapat melindungi dirinya dari serangan antibiotik
dari luar.
Pertumbuhan Bakteri Probiotik
l@
Hasil uji pertumbuhan bakteri probiotik baik tipe liar maupun yang diberi
penanda resisten rifampisin (Rf-R) dapat diliiat pada Gambar 8. Berdasarkan
basil tersebut dapat dilihat bahwa pertumbuhan 3 strain bakteri probiotik (IUb,
SKT-b, dan Ua) baik tipe liar maupun mutannya memiliki laju pertumbuhan yang
relatif sama. Pertumbuhan tertinggi ketiga strain bakteri probiotik tersebut dicapai
pada jam ke 10 - 14, dan akan menurun setelabnya. Hal ini berarti terjadinya
penanda untuk memonitor keberadaan bakteri tersebut pada larva udang dan
media pemeliharaan.
Menurut Hala (1999); Widanarni et al. (2004), 1.: hanteyi mutan Rf-R juga memiliki kemarnpuan bertahan hidup yang sauna dengan tipe liarnya.
?
I
harveyi mutan
fl
tersebut telah digumkan pada uji patogenitas.1 ---club
i
0 2 4 6 8 10 12 14 16 16 20 Z2 24
I
Inkubasi (jam ke-)I A I
I
!
0 2 4 a a 1012il , 8 4 8 2 7 2 2 2 4
I n k h s i (jam Ke-)
Inkubasi (jam ke-) I
Daya Harnbat Bakteri Probiotik terhadap V. hnrveyi pada Lama Udang Tiga isolat mutan balcteri probiotik diuji efektivitasnya dalam menghambat
serangan V. haweyi MR5339
Ri?
pada larva udang windu. Pengamatan dilakukanterhadap kelangsungan hidup larva, pertumbuhan panjang dan bobot larva serta
populasi balcteri probiotik, V. harveyi MR.5339
Ri?
dan total bakteri baik pada airpemeliharaan, udang hidup maupun udang mati.
Hasil pengujian menunjukkan bahwa ketiga isolat mutan probiotik tersebut
secara signifikan (p<0,05) dapat meningkatkan kelangsungan hidup larva udang (Gambar 9) seperti tipe liarnya (Gambar 5). Kelangsungan hidup larva pada
perlakuan dengan penambahan lUb, SKT-b, dan Ua berturut-turut adalah
86,67%, 88,33%, 83,33%, sedangkan perlakuan yang hanya diinokulasi dengan V.
harveyi MR5339
Ri?
tanpa probiotik, nilai kelangsungan hidupnya hanyamencapai 5 1,67%.
A B C D E
Perlakuan
Keterangan :
A = 1Ub
@+MR
5339& B = SKT-b @+MR 5339~fR C = Ua &+MR 5339~fRD = Kontrol positif (MR 5 3 3 9 p ) E = Kontrol negatif ( tanpa penambahan bakteri)
Ganibar 9. Kelangsuigan hidup larva udang pada uji daya hambat bakteri probiotik terhadap V. harveyi
Peningkatan nilai kelangsungan hidup larva udang terjadi karena adanya
penghambatan pertumbuhan V. hmveyi pada larva udaig oleh bakteri probiotik,
Hal
u~
ditunjukkan oleh lebih tingginya jumlah sel V. haweyi MR5339Ri?
padapenambahan probiotik, baik pada larva mati (Gambar lo), larva hidup (Gambar
1 I), maupun air pemeliharaan (Gambar 12).
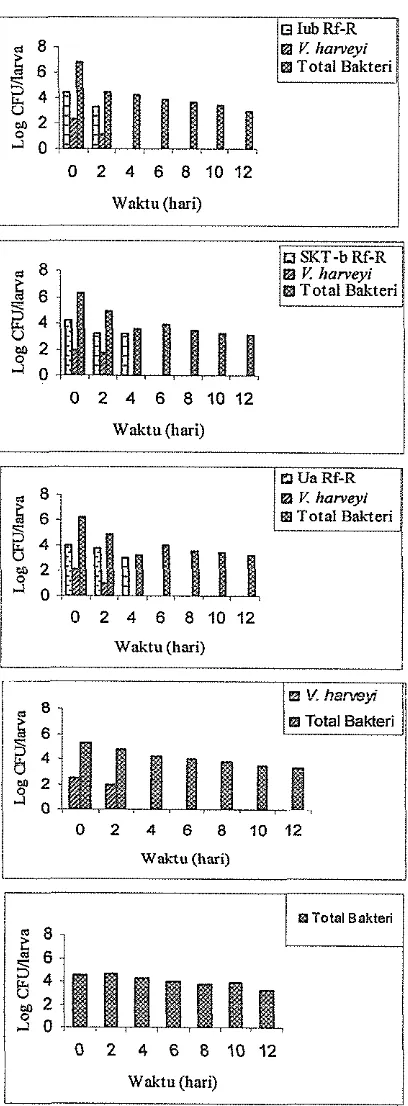
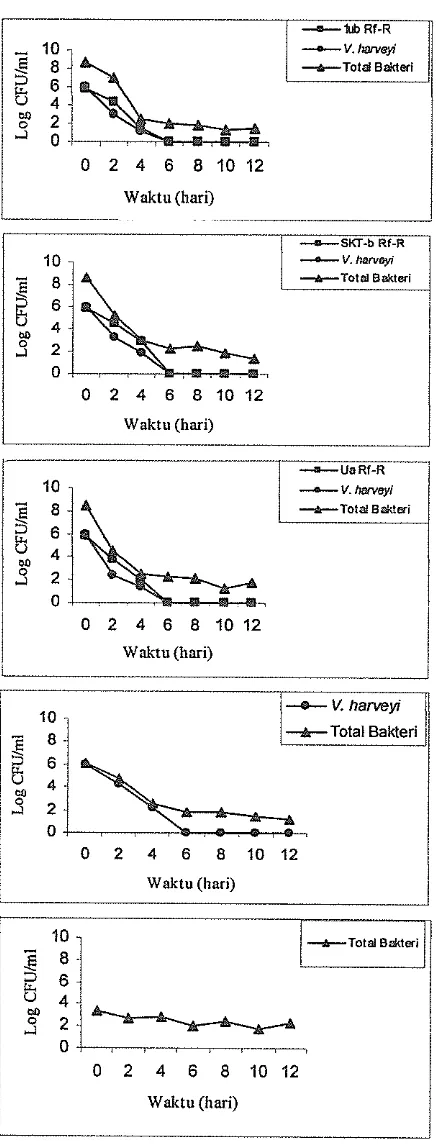
Jumlah sel V. harveyi MR5339
RfR
pada larva mati (Gambar 10) berkisarantara lo2 - lo4 CFUAarva, diduga kisaran angka tersebut menunjukkan jumlah
sel V. harveyi yang dapat menyebabkan kematian pada larva udang. Banyaknya
julnlah larva yang mati setiap hari pada perlakuan tanpa penambahan probiotik
juga menunjukkan tidak adanya aktivitas penghambatan V. harveyi oleh bakteri
probiotik. Pada penelitian Widanami (2004), Muliani et al. (2003) dan Hala et al.
(2002), jumlah K harveyi yang ditemukan pada larva yang mati berkisar antara
10' - 1
o4
CFUIlarva.Pada Gambar 11 terlihat bahwa jumlah sel V. harveyi MR5339
RfR
padalarva hidup untuk perlakuan dengan penambahan probiotik berkisar 10' - lo2
CFUllarva, dan sudah tidak terdeteksi iagi pada hari ke-4, sedangkan pada
perlakuan tanpa probiotik jurnlah sel V. harveyi berkisar antara lo2 - lo3 CFUIlarva atau mendekati jumlah sel V. harveyi pada larva mati. Hal ini
meiiunjukkan bahwa peningkatan nilai kelangsungan hidup pada perlakuan
dengan penambahan bakteri probiotik karena adanya kompetisi dari bakteri
probiotik yang mencegah tercapainya jumlah (quorum) V. harveyi yang dibutuhkan untuk mengekspresikan faktor-faktor virulensinya yang kemudian
dapat membunuh larva udang. Penghambatan perhimbuhan K harveyi oleh
bakteri probiotik dapat berupa kompetisi pelekatan atau sumber nutrien atau
produksi senyawa antimikrob (Verschuere et al. 2000).
Pada Gambar 12 terlihat p e n m a n jumlah sel V. harveyi MR5339
I@
pada air pemeliharaan hingga lo2
-
lo4 CFUIml pada hari kedua, dan sudah tidakterdeteksi lagi pada hari ke-6. Adanya penghambatan bakteri probiotik
menyebabkan jumlah sel V. harveyi MR5339
RfR
pada perlakuan dengan1
1 2 3 4 Waktu( hari )i
,
-I
Zr
:T22m
1
m
j
2
..I 0
1 2 3 4
WaMu (hari)
Gmbar 10. Populasi bakteri probiotik, I! hapveyi, dan totai bakteri pada larva udang mati pada uji daya hambat bakteri probiotik terhadap I!
Waktu (hnri)
2
fll SKT-b Rf-R
Ei3 K harveyi
&3 Total Bnkteri
1
--
I
K harvq~i
Total BRkteri
1
I
Q Total Bakteri
0 2 4 6 8 1 0 1 2
i
waku (hari)/
0 2 4 6 8 1 0 1 2!
Wnktu (hari) [image:34.599.214.418.77.630.2]I
0 2 4 6 8 1 0 1 2
Waktu (hari)
---
-UaRf-R I-'
-
88
68
- 4
S 2
0
0 2 4 6 8 1 0 1 2
1
Waktu (hari)1
0 2 4 6 8 1 0 1 2 I- P C - -
-! 0 2 4 6 8 1 0 1 2
[image:35.595.201.419.75.649.2]Waktu (hari)
Populasi total bakteri dari seluruh perlakuan memiliki pola yang sama,
baik pada larva udang hidup, larva udang mati maupun
air
pemeliharaan (Gambar10, 11, dan 12), yang mana jumlah populasinya mengalami penurunan hingga
akhir penelitian, dan populasinya mendekati total bakteri pada udang kontrol.
Adanya penurunan ini diduga bersamaan dengan berkurangnya populasi bakteri
probiotik maupun V. harveyi ~ ~ 5 3 3 9 e yang diinokulasikan sehingga populasi
bakteri kembali mendekati populasi bakteri alaminya.
Pemberian bakteri probiotik selain dapat menekan pestumbuhan bakteri
patogen juga dapat meningkatkan laju pertumbuhan hewan akuatik. Peranan
bakteri probiotik dalam meningkatkan laju pertumbuhan hewan akuatik
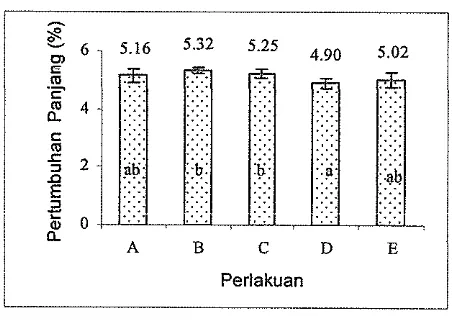
dilaporkan oleh Rengpipat et al. 1998 dan Douillet and Langdon 1994. Pada Gambar 13 dan Lampiran 7 terlihat larva udang yang diberi probiotik memiliki
nilai pertumbuhan panjang lebih besar (5.16 - 5.32%) dibanding perlakuan tanpa
probiotik (4.90 - 5.02%). Demikian pula untuk pestumbuhan bobot (Gambar 14)
menunjukkan bahwa larva yang diberi probiotik menghasilkan pertumbuhan
bobot lebih besar (1 1.27 - 11.99 YO) dibanding perlakuan tanpa pemberian
probiotik (9.35 - 10.63%) (Lampiran 8). Hal ini menunjukkan bahwa penambahan
bakteri probiotik dapat meningkatkan pertumbuhan panjang dan bobot pada larva
udang windu. Diduga pada perlakuan tanpa penambahan probiotik, larva udang
menggunakan sebagian energi pertumbuhannya untuk mengatasi serangan V. harveyi, sehingga pertumbuhan panjang dan bobotnya lebih rendah dibanding
perlakuan dengan penambahan bakteri probiotik sedangkan pada perlakuan
dengan penambahan probiotik, bakteri probiotik bekerja mengeliminir populasi !?
harveyi, sehingga larva udang dapat memanfaatkan energi yang tersedia lebih banyak untuk pertumbuhmnya. Selain itu juga kemungkinan bakteri probiotik
yang diberikan mengandung makro dan mikro nutrien yang dibutuhkan larva
udang dan dapat memberi kontribusi enzim untuk pencemaan yang menyebabkan
udang dapat mencema pakan lebih baik, sehingga nutrisi yang diserap oleh t~tbuh
udang juga lebih banyak, yang akbimya akan mernberikan pertumbuhan yang
i
aA B C D E
1
PerlakuanI
Keterangan:
A = IU~&+MR 5339RfR B = SKT-~R~R+MR 5 3 3 9 e C = Ua @+MR 5339RfR D = Kontrol positif (MR 5 3 3 9 ~ p ) E = Kontrol negatif (tanpa penambahan bakteri)
Gambar 13. Pertumbuhan panjang larva udang pada uji daya hambat bakteri probiotik terhadap V. harveyi
A B C D
Perlakuan
Keterangan:
A = l ~ b R f R + MR 5339@ B = S K T - ~ R ~ + M R 5339RfR C = u~R~R+MR 5 3 3 9 p
[image:37.595.214.440.78.240.2]D = Kontrol positif (MR 5339Rp) E = Kontrol negatif ( tanpa penambahan bakteri)
Gambar 14. Pertumbuhan bobot larva udang pada uji daya hambat bakteri probiotik terhadap V. harveyi
Identifikasi Bakteri Probiotik
Hasil analisis sekuen sebagian gen 16-rRNA menunjukkan bahwa isolat
SKT-b termasuk spesies Vibrio alginolyticus dengan indeks kemiripan 88%, 1Ub
sedangkan Ua tennasuk spesies Vibrio alginolyticzis dengan indeks kerniripan 98%.
Gomez-Gil et al. (2002) menyatakan V. alginolyiicus C7b yang d i i l t u r
bersama microalga Chaetoceros muellasi dapat meningkatkan pertumbuhan
udang. Gullian et al. (2004) menggunakan
V.
alginolpicus sebagai probiotik padaudang vaname dapat meningkatkan irnunitas udang uji, sedangkan isolat Vib~io
lainya (Vibrio P62) yang diisolasi dari hepatopankreas udang sehat potensial
sebagai probiotik. Selanjutnya Austin et al. (1995) melaporkan bahwa V.
alginolyiicus efektif sebagai probiotik udang karena dapat mengurangi serangan
penyakit yang disebabkan oleh V. anguillarum dan V. ordaIii. Muliani et al.
(2003) melaporkan ballwa isolat BL542 yang kemudian diidentifikasi sebagai
Pseudoalteromonas sp. efektif menghambat pertumbuhan V. harveyi MR5339
secara in vivo pada larva udang windu karena senyawa antimikrob yang
dihasilkannya. Hala et 01. (2002) juga melaporkan bahwa V: metschnikovii yang
diisolasi dari larva udang windu potensial digunakan sebagai probiotik karena
KESIMPULAN
Kesimputan
1. Isolat probiotik lUb, SKT-b dan Ua efektif menghambat pertumbuhan V.
harveyi dan dapat meningkatkan kelangsungan hidup larva udang windu.
2. Peningkatan kelangsungan larva udang tersebut terjadi karena adanya
penghambatan pertumbuhan
I.:
harveyi oleh bakteri probiotik yangkemungkimn karena adanya kompetisi nutrisi atau kompetisi tempat
pelekatan.
3. Penanda molekuler resisten rifampisin efektif digunakan untuk memonitor keberadaan bakteri probiotik pada larva udang dan media
DAFTAR PUSTAKA
Austin BLF, Stucken PA, Robertson W, Griffith DRW. 1995. A probiotic strain of Vibrio alginolyticus effective in reducing diseases caused by Aeromonas salmonicida, Vibrio anguillarum and Vibrio ordalii. J. Fish Diseases, 18:93-96.
Austin B, Pride AC, Rhodie GA. 2003. Association of a bacteriophage with virulence in Vibrio harveyi. Fish Disease 26: 55-58.
Baumann P, Ftuniss AL, Lee
JV.
1994. Facultative anaerobic g a m negative rods. Di dalam: Holt JG, Krieg NR, Sneath PHA, Staley JT, Wilkins ST, editor. Bergey's Manual of Determinative Bacteriology. Ed ke-9. Baltimore: The Williams and Wilkins. hlrn 175-289.Brock JA, Lightner DV. 1990. Chapter 3: Disease of Crustacea. In: 0. Kinne(ed). Disease of marine animals vol. 3, Biologische Anstalt Helgoland, Hamburg. pp. 245-424.
Chen D. 1992. An overview of the disease situation, diagnostic techniques, treatments and preventatives used on shrimp f m s in China. The Oceanic Institute, Hawaii. pp. 47-55.
Chytanya R, Nayak D.K, Venugopal M.N. 1999. Antibiotic resistence in aquaculture. News from around the world. Infofish International, 6:30-32.
Douillet PA, Langdon CJ. 1994. Use of a probiotic for the culture of larvae of the Pacific Oyster ( Crassoshea gigas). Aquaculture, 119:25-40.
Fuller R. 1992. History and Development of Probiotics. Di dalam: Fuller R, editor. Probiotics the Scientific Basis. London: Chapman and Hall. hlm 1-8.
Gomez-Gil B, Roque A, Tumbull JF. 2000. The use and selection of probiotic bacteria for use in the culture of larval aquatic organisms. Aquaculture,
191 :259-270.
Gullian M, Thompson F, Rodriguez J. 2004. Selection of probiotic bacterial and study of their immunostimulatory effect in Penaeus vanamei. Aquaculture, 233:l-14.
Hala Y. 1999. Penggunaan gen penanda molekuler untuk deteksi pelekatan clan kolonisasi K harveyi pada larva udang windu (Penaeus monodon). [Disertasi]. Bogor. lnstitut Pertmian Bogor.
Haryanti, Sugama k, Tsumura S, Nishijirna T. 2000. Potentiality of bacteria isolated fiom seawater as biological control agent for vibriosis in black tiger shrimp Penaeus monodon larvae. International Symposium on Marine Biotechnology (ISMB 2000). Center for Coastal an Marine Resources Studies, IPB, Bogor, Indonesia, 29-31 May 2000,182-189.
Haryanti, Sugama K. 2002. Prospek pemanfaatan bakteri probiotik Alteromonas BY-9 dibanding Oxytetracycline dalam pemeliharaan larva udang windu (Penaeus monodon). Di dalam: Jumal Ilmu-Ilmu Perairm dan Perikanan Indonesia,M(l): 19-27.
Herrera L, Jimenez S, Valverde A, Garcia-Aranda MA, Saez-Nieto A. 2003. Moleculer analysis of rifampisin-resistant Mycobacterium tuberculosis isolated in Spain (1996-2001). Description of new mutations in the rpo B gene and review of the literature. Int J Antimicrob Agents 21:403-408.
Karunasagar I, Pai R, Malathi GR, Karunasagar I. 1994. Mass Mortality of Penaeus monodon larvae due to antibiotic-resistant Vibrio harveyi infection. Aquaculture, 128:203-209.
Otta SK, Kanmasagar I. 1996. Biofilm formation by Vibrio harveyi on surfaces. Aquaculture, 140 : 241 -245.
Lavilla-Pitogo CR, Baticados MCL, Cruz-Lacierda ER, DE la Pena LD. 1990. Occurence of luminous bacterial diseases of Penaeus monodon larvae in the Philiphines. Aquaculture, 91 : 1-13.
Madigan MT, Martinto JM, Parker J. 1997. Brock Biology of Microorganisms. Ed ke-8. New Jersey : Prentice- Hall.
Marchesi JR et al. 1998. Design and evaluation of useful bacteiium-spesific PCR primers
that
amplify genes coding for bacterial 16 rRNA. J. Appl. Environ. Microbial 62: 2501-2507.Meighen EA. 1991. Moleculer biology of bacterial bioluminescence. Microbial Rev 55; 123-142.
Moiiarty DJW. 1999. Diseases Control in Shrimp Aquaculture with Probiotic Bacterial. Di dalam: Bell Cr, Brylinsky M, Jolmson-Green P (editor). 1999. Microbial Biosystem: New Frontiers. Proceedings of the 8" International Symposium on Microbial Ecology. Atlantic Canada Society for Microbial Ecology, Halifax, Canada.
Muliani, A. Suwanto, dan Y. Hala. 2003. Isolasi dan karakterisasi bakteri asal laut Sulawesi untuk biokontrol penyakit Vibriosis pada larva udang windu (
Penaeus monodon). Hayati, 105-11.
Arthur
(eds). Diseases in Aquaculture 1. Fish Health Section, Asian Fisheries Society, Manila, Philiphines.Prayitno, S.B. J.W. Latchford. 1995. Experimental infections of crustaceans with luminous bacterial related to Photobacterium and Vibrio. Effect of saliity and pI.1 on infectiosity. Aquaculture, 132: 105-1 12.
Proksch P. 2000. Bioactive natural products from marine invertebrates and associated microorganisms. Proc. Int. Symposium on Marine Biotechnology. Jakarta.
Rajab F. 2006. Isolasi dan seleksi bakteri probiotik dari lingkungan tambak dan hatchery untuk pengendalian penyakit Vibriosis pada Larva Udang W i d u (
Penaeus monodon).
Rengpipat SS, Rukpratanporn S, Piyatiratitivorakul S, Menasveta P. 1998a. Probiotic in aquaculture: a case study of probiotic for larvae of black tiger shrimp (Penaeus monodon). Di dalam: Flagel TW, editor. Advances in Shrimp Biotechnology. Proceedings to the special session n shrimp biotechnology, 5'' Asian Fisheries Forum; Chiengmai, Thailand. Bangkok: National Center for Genetic Engineering and Biotechnology. hlm 176-1 8 1. Rengpipat SS, Piyatiratitivorakul S, Menasveta P. 1998b. Effects of a probiotic
bacterium on black tiger shrimp Penaeus monodon survival and growth. Aquaculture, 167:301-313.
Ruby EG. 1996. Lesson from a cooperative bacterial-animal association: the Vibrio fisheri- Euprymna scolopes light organ symbiosis. Annu Rev Microbiol50:591-624.
Saulnier D. H&er P, Goarant C, Levy P, Ansquer D. 2000. Experimental infection models for shrimp vibriosis studies : a review. Aquaculture,
191:133-144.
Suwanto A, Yogiara, Suyanto D, Tan I, Puspitasari E. 2002. Compilation of Praticial Manual. Biotrop Trainiig Course in Microbial Biodiversity.
Suryati E, Parenrengi A, Muliani. 2004. Analisis toksisitas dan penanggulangan penyakit udang windu Penaeus nzonodon Fabricus menggunakan bioaktif sponge. Prosiding Pengendalian Penyakit pada ikan dan udang berbasis imunisasi dan biosecurity, Punvokerto, 18-19 Mei 2004.
Tjahjadi MR, Angka SL, Suwanto A. 1994. Isolation and evaluation of marine bacteria for biocontrol of luminous bacterial diseases in tiger shrimp larvae (Penaeus monodon Fab.). Aspac J Mol Biol Biotechnol2:234-352.
Verschuera L, Rombaut G, Sorgeloos P, Verstraete W. 2000. Probiotic bacterial as biological control agents in aquaculture. Microbiol Mol Biol Rev 64: 655- 671.
Vi1a.mil L, Figueras A, Planas M, Novoa B. 2003. Control of Vibrio alginolyticz~s in Artemia culture by treatment with bacterial probiotics. Aquacultme, 219:43-56.
Vine NG, Leukes WD, Kalser H, Daya S, Baxter J, Hecht T. 2004. Competitions for attachment of aquaculture candidate probiotic and pathogenic bacteria on fish intestinal mucus. Journal of Fish Disease 27: 3 19-326.
Widanarni, Suwanto A, Sukenda, Lay BW. 2003a. Potency of Vibrio isolates for biocontrol of vibriosis in tiger shrimp (Penaeus monodon) larvae. Biotropia 20~11-23.
Widanami. 2004. Penapisan bakteri probiotik untuk biokontrol vibriosis pada larva udang windu: kontruksi penanda molekuler dan esai pelekatan. [Disertasi]. Program Pascasarjana, Institut Pertanian Bogor. Bogor.
Widanami, D. Meha, S. Nuryati, Sukenda dan A.Suwanto. 2004. Uji patogenisitas
Lampiran 1. Komposisi media SWC-agar (Seawater Complete agar), SWC- cair dan TCBS-agar (Tlriosulphate Citrate Bile-Salt sucrose agar)
1. SWC-agar (Seawater Complete agar)
*% Bacto Peptone 5 g
d:a
Yeast Extract 1 g*:
* Bacto Agar 20 g
Q Glycerol 3 ml
+3 Air Laut 750 ml
*:
* Aquades 250 ml
2. SWC-cair (Seawater Complete-broth)
*:
* Bacto Peptone 5 g
+:
* Yeast Extract 1 i%
Q Glycerol 3 ml
43 Air Laut 750 ml +:
* Aquades 250 rnl
3. TCBS-agar (Thiosulphate Citrate Bile-Salt sucrose agar)
*:
* TCBS agar 89 g
Larnpiran 2. Pembuatan larutan stok rifampisin
1. 10 mg rifampisin Oif) diiasukkan ke dalam tabung eppendorf 1,5 ml.
2. 50 p1 ddHzO ditambahkan ke dalam tabung untuk mempermudah pelarutan Rf.
3. 950 p! alkohol sbsolut ditaiibahkan kexudias di~oitex kngpa iercainp-a sehingga diperoleh konsentrasi larutan stok rifampisin 10 mg/ml.
4. Dosis Rf yang digunakan adalah 50 pg/ml media.
5. Lamtan stok Rf disimpan pada suhu mang dengan kondisi gelap atau
Larnpiran 3. Kelangsungan hidup larva udang windu pada uji in vivo bakteri probiotik
Lampiran 5. Perhimbuhan bobot larva udang windu pada uji in vivo bakteri probiotik
MEKANISME PENGHAMBATAN BAKTERI PROBIOTIK TERHADAP PERTUMBUHAN Vibrio lrnrveyi PADA LARVA
UDANG WINDU (Penneus monodon)
EVA AYUZAR
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PE
ATAAN MENGENAI TESIS DAIO
SUNUBER INFO
SI
Dengan ini saya menyatakan bahwa tesis Mekanisme Penghambatan Bakteri Probiotik terhadap Pertumbuhan Vibrio harveyi pada larva udang windu (Penaeus monodon) adalah benar hasil karya saya sendiri dan merupakan bagian dari penelitian hibah bersaing dengan judul "Bakteri Probiotik dalam Budidaya Udang: Seleksi, Mekanisme Aksi, Karakterisasi dan Aplikasinya sebagai Agen Biokontrol". Sumber inforrnasi yang berasal atau d i t i p dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Bogor, Januari 2008
ABSTRAK
EVA AWZAR. Mekanisme Penghambatan Bakteri Probiotik terhadap Pertumbuhan Vibrio harveyi pada Larva Udang Windu (Penaeus monodon). Dibimbmg oleh S W N D A dan W I D A N M I .
ABSTRACT
EVA AYUZAR. Inhibitory mechanism of probiotic bacteria on the growth of Vibrio harveyi in tiger shrimp (Penaeus monodon) larvae. Under the guidance of SUKENDA, and WIDANARNI.
PEND UAN
Latar Belakang
Serangan penyakit dan penurunan kualitas lingkungan budidaya
merupakan masalah yang timbul dalam usaha pembenihan udang. Salah satu
penyakit udang yang membahayakan adalah penyakit udang berpendar atau
luminescent vibriosis yang disebabkan oleh Ebrio harveyi. V. harveyi dapat
menyerang udang pada berbagai stadia mulai dari nauplius, zoea, mysis dan post
larva di pembenihan hingga udang dewasa di tambak pembesaran (Saulnier et al.
2000).
Salah satu alternatif untuk menanggulangi permasalahan penyakit vibriosis
adalah dengan menggunakan bakteri probiotik sebagai biokontrol yang dapat
menghambat pertumbuhan V. harveyi. Bakteri probiotik yang digunakan sebagai
biokontrol dapat diisolasi dari tambak atau pembenihan udang (Tjahjadi et al.
1994; Hary'anti et al. 2000), air dan sediien laut (Muliani et al. 2003) atau
invertebrata laut seperti sponge (Suryati et al. 2004) serta terumbu karang
(Proksch, 2000).
Tiga isolat bakteri kandidat probiotik koleksi Laboratorium Kesel~atan
Ikan, Departemen Budidaya Perairan, IPB yakni 1Ub (Tepu, 2006), SKT-b
(Widanami et al. 2003) dan Ua (Rajab, 2006) telah diuji mampu menghambat pertumbuhan V. harveyi secara in vitro dan dapat meningkatkan kelangsungan hidup larva udang pada uji in vivo.
Untuk mempelajari mekanisme aksi bakteri probiotik tersebut dalam
menghambat pertumbuhan V. harveyi pada larva udang dilakukan dengan memberikan penanda molekuler pada bakteri probiotik dan patogen, sehingga
keberadaan bakteri tersebut pada larva udang dapat diamati. Penanda resistensi
terhadap antibiotik rifampisin
(RfR)
merupakan suatu pilihan karena bakteri asallaut pada umumnya sensitif terhadap rifampisin (Tjahjadi et al. 1994). Selain itu
mutan spontan resisten rifampisin bersifat stabil pada media tanpa penambahan
antibiotik (Hala et al. 2002) sehingga dapat digunakan 14i tantang pada jangka
dari bakteri lain yang sebelumnya telah terdapat pada larva udang atau air media
pemeliharaannya.
Tujuan
Penelitian ini bertujuan untuk mempelajari mekanisme penghambatan
bakteri probiotik terhadap pertumbuhan V. hurveyi pada larva udang windu
TINJAUAN PUSTAKA
Bakteri Vibrio Itarveyi dan penyakit udang berpendar
V. h a m y i pada umumya bersifat patogen oportunistik, yaitu organisme
yang dalam keadaan normal ada dalam lingkungan pemeliharaan dan berkembang
dari sifat saprofitik menjadi patogenik apabila kondisi lingkungan dan inang
memburuk. Pada saat terjadinya wabah, populasi bakteri ini dapat m e ~ n g k a t
menjadi ribuan kali dalam wadahhak pemeliharaan larva, dan ha1 ini terjadi
setelah usaha budidaya udang windu berkembang secara intensif (Lavilla-Pitogo
et al. 1990). Menurut Saulnier et al. (2000) beberapa galur V. harveyi merupakan
patogen dan penyebab utama penyakit vibriosis pada udang windu. Kesimpulan
tersebut diambil berdasarkan studi virulensi dari beberapa galur V. harveyi yang
diisolasi dari larva sekarat dan diinfeksi kembali pada udang sehat. Beberapa dari
galur tersebut dapat menyebabkan kematian total larva udang dengan dosis yang
sangat rendah (10 CFUIml).
Pada sistem budidaya udang, V. harveyi dapat ditemukan di hatchery,
dapat diisolasi dari air laut yang masuk, induk, larva dan air tanki pembesaran
larva (Otta et al. 2001; Prayitno et al. 1995). V. harveyi juga dapat diisolasi dari
tambak pembesaran udang (Karunasagar et al. 1994).
Ciri-ciri morfologi clan fisiologi
I.:
harveyi pada medium nutrien agardengan NaCl 1.5% dan seawater complete-agar (SWC-agar) adalah: bentuk
koloni bulat dengan elevasi cembung, berwarna krem, berdiameter 2-3 mm
setelah inbubasi 24 jam pada suhu 2 8 ' ~ . Pada medium selektif
untuk
genusVibrio, yaitu TCBS-agar (Tiosu&te Citrate Bile-Salt Sucrose), koloni V. harveyi
benvama hijau dan berpendar bila diamati di ruang gelap (Lavilla-Pitogo et al.
1990).
Kemampuan berpendar atau lztminescent merupakan hasil aktivitas enzim
luciferase yang dapat berfimgsi sebagai katalisator dalam proses oksidasi reduksi.
Proses oksidasi melibatkan flavin mononukleotida dan aldehid alifatik rantai
panjang sebagai substratnya. Senyawa-senyawa tersebut masing-masing diubah
menjadi flavin mononukleotida dan asam lemak disertai dengan pelepasan emisi
fungsi perpendaran ini disandikan dalam suatu operon yang disebut dengan
operon lux (Meighen, 1991; Ruby, 1996). V. harveyi juga diietahui memiliki
aktivitas enzim kitinase, protease, dan lipase (Baumann et al. 1994). Enzim
kitinase memungkinkan V. harveyi untuk menguraikan kitin dan berkolonisasi di
dalam tubuh larva udang windu.
Kematian yang disebabkan vibriosis terjadi apabila udang mengalami stres
akibat kualitas air buruk, kepadatan tinggi, temperatur tinggi dan pergantian air
yang rendah (Brock and Lightner 1990). Berdasarkan hasil penelitian Lavilla-
Pitago (1990), kematian larva terjadi setelah 48 jam pasca infeksi bakteri V.
haweyi dan V. splendidus.
Jenis Vibrio lain yang menyebabkan vibriosis adalah Vibrio vulnificus,
Vibrio parahaemalyticus ( Nash et al. 1992 dan Lavilla-Pitogo et al. 1990), V. anguillarum, V. campbelli, dan V. splendidus (Chen, 1992). Akibat meningkatnya
jurnlah kasus vibriosis yang terjadi, maka diperlukan serangkaian penelitian untuk
mengetahui sifat virulensi dari V. harveyi agar penyakit ini dapat diatasi (Austin et
al. 2003).
Bakteri Probiotik sebagai Biokontrol pada Larva Udang
Menurut Fuller (1992), probiotik adalah mikrob hidup yang ditambahkan
ke dalam pakan yang dapat memberi pengaruh mengmtungkan bagi hewan inang
dengan cara memperbaiki keseimbangan mikrob ususnya. Pada hewan akuatik,
selain saluran pencemaan, air di sekeliling organisme tersebut juga memegang
peranan penting. Sehingga probiotik untuk hewan akuatik adalah agen mikrob hidup yang memberikan pengaruh menguntungkan pada inang dengan
memodifikasi komonitas mikrob atau berasosiasi dengan inang, menjamin
perbaikan dalam penggunaan pakan atau memperbaiki nilai nutrisinya,
meinperbaiki respon inang terhadap penyakit, atau memperbaiki kualitas
lingkungan ambangnya (Verschuere et al. 2000).
Biokontrol menurut Gomez-Gil et al. (2000) adalah penggunaan musuh
alamiah untuk mengurangi kemsakan yang disebabkan oleh organisme berbahaya
sampai tingkat yang dapat ditolerir, atau lebih tepat lagi pengaturan populasi
mikrob di dalam saluran pencemaan hewan sampai batas tertentu memberi
ketahanan atau perlindungan terhadap penyakit. Demikian pula pada populasi
alamiah hewan akuatik, mikrobiota di dalam saluran pencernaan dapat
mencerminkan lingkungan akuatik tersebut. Namun demikian, pada pemeliharaan
larva dengan kepadatan tinggi di dalam wadah budidaya, keseimbangan dapat
berubah karena penggunaan air yang sudall didesinfeksi, mikroalga, nauplii,
artemia, rotifer dan berbagai antibiotik pembunuh bakteri. Akibatnya, komunitas
mikrob pelindung tidak dapat berkembang baik di lingkungannya maupun di
dalam sistem saluran pencemaan larva. Pascalarva yang dipelihara di dalam
lingkungan yang relati