IDENTIFIKASI DAN EVALUASI KEMURNIAN GENETIK
BENIH PADI HIBRIDA MENGGUNAKAN MARKA
MIKROSATELIT
INDRIA WAHYU MULSANTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Identifikasi dan Evaluasi Kemurnian Genetik Benih Padi Hibrida Menggunakan Marka Mikrosatelit adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tugas akhir ini.
ABSTRACT
INDRIA WAHYU MULSANTI. Identification and Seed Genetic Purity Assessment of Hybrid Rice Using Microsatellite Marker. Supervised by MEMEN SURAHMAN and SRI WAHYUNI.
Ensuring the genetic purity of hybrid seed is a prerequisite for successful production of hybrid rice. Hybrid seed often contaminated by crosses derived pollen from other varieties or the occurrence of selfing resulting from impurity parental line (Cytoplasmic Male Sterile). The objective of this study was to identify informative microsatellite marker (SSR) capable to distinguish hybrid rice parental lines and their utilization in seed purity assessment and to characterize the morphology of F1 hybrid rice to complement description of varieties. This study divided in two main activities: 1) identification of informative SSR markers capable of distinguishing hybrid rice parental line and 2) seed purity assessment based on SSR marker and morphological characteristics. Parental lines of five hybrids rice were used to identify the informative SSR marker and two hybrids (Hipa 6 and Hipa 7) used for purity assessment. Seven out of sixteen SSR markers produced polymorphic band and six markers capable to distinguish parental line of five hybrid rice. Microsatellite marker RM346 was specific used for testing genetic purity of Hipa 6 and RM206 for Hipa 7. This study showed that SSR markers were more reliable for assessing genetic purity compare to morphological characteristic.
RINGKASAN
INDRIA WAHYU MULSANTI. Identifikasi dan Evaluasi Kemurnian Genetik Benih Padi Hibrida Menggunakan Marka Mikrosatelit. Di bawah bimbingan MEMEN SURAHMAN and SRI WAHYUNI.
Benih dikatakan mempunyai mutu genetik yang baik apabila benih tersebut asli (true to type), sesuai dengan varietas yang dimaksud. Uji kemurnian benih merupakan tahapan yang harus dilakukan untuk mengendalikan mutu genetik dari suatu lot benih. Kemurnian genetik benih F1 merupakan hal yang sangat penting pada produksi benih padi hibrida. Adanya campuran pada benih padi hibrida dapat menyebabkan penurunan produksi dan buruknya pertanaman di lapang.
Di Indonesia, uji kemurnian benih menggunakan SSR belum banyak dilakukan pada padi khususnya padi hibrida. Marka SSR akan sangat bermanfat untuk mengetahui apakah benih padi hibrida betul hasil persilangan antar dua galur tetua pembentuknya. Oleh karena itu identifikasi marka-marka polimorfis dari galur-galur tetua perlu dilakukan
Penelitian ini bertujuan untuk: 1) Mendapatkan marka SSR spesifik yang dapat digunakan untuk mengidentifikasi galur tetua beberapa varietas padi hibrida, serta melihat tingkat polimorfisme dari marka tersebut; 2) Mempelajari sterilitas malai beberapa galur mandul jantan; 3) Membandingkan uji kemurnian benih dengan SSR dan grow out test; 4) Mendapatkan karakter kualitatif dan kuantitatif dari dua varietas padi hibrida (Hipa 6 dan Hipa 7) untuk melengkapi deskripsi varietas.
Penelitian dibagi menjadi dua kegiatan utama, yang pertama adalah identifikasi marka molekuler polimorfis dan yang kedua adalah uji kemurnia benih hibrida dan karakterisasi morfologi tanaman. Selain itu untuk mengetahui persentase tingkat sterilitas galur mandul jantan yang digunakan, maka dilakukan uji sterilitas galur mandul jantan. Galur tetua dari lima varietas hibrida (Hipa 6, Hipa 7, Hipa 8, Hipa 9 dan Hipa 10) digunakan untuk identifikasi marka SSR, sedangkan untuk uji kemurnian benih digunakan dua varietas hibrida yaitu Hipa 6 dan Hipa 7. Identifikasi marka molekuler polimorfis menggunakan 16 marka SSR yang dipilih dari linkage map (http://www.gramene.org).
Penanaman F1 hibrida di lapang dirancang sesuai dengan panduan pengujian individual (PPI) kebaruan, keunikan, keseragaman dan kestabilan tanaman padi. Empat puluh individu tanaman ditentukan secara acak sebagai tanaman contoh untuk masing-masing hibrida (Hipa 6 dan Hipa 7). Setiap individu tanaman contoh tersebut diambil sampel daunnya untuk dilakukan uji kemurnian genetik secara molekuler. Pengamatan morfologi untuk pengujian kemurnian benih di lapang juga dilakukan pada tanaman contoh yang sama.
Penentuan tingkat kemurnian di lapang dilakukan berdasarkan karakter morfologi dari setiap individu tanaman pada berbagai tahap pertumbuhan tanaman. Pengamatan meliputi : 1) kemurnian (campuran varietas lain), 2) karakter kualitatif, 3) karakter kuantitatif tanaman. Pengamatan karakter tanaman dilakukan untuk mengindentifikasi adanya varietas campuran dan melengkapi deskripsi varietas yang sudah ada. Uji sterilitas galur mandul jantan menggunakan IR62829A, IR58025A, dan IR68897A.
membedakan antar tetua dari varietas hibida yang diuji. Lima marka memiliki tingkat polomorfisme yang sangat informatif (tinggi), satu marka sedang dan satu marka memiliki nilai polimorfisme rendah.
Marka mikrosatelit RM346 dapat digunakan untuk pengujian kemurnian benih Hipa 6 dan marka RM206 untuk Hipa 7. Uji kemurnian benih dengan menggunakan maka SSR dapat mendeteksi campuran yang sangat mirip secara morfologi dan membedakannya secara jelas dalam hasil elektroforesis. Beberapa tanaman yang terserang hama penyakit dan berakibat pada perubahan penampilan fisik dan menimbulkan kerancuan pada grow-out test, dapat dengan jelas dikenali kebenarannya menggunakan uji kemurnian dengan SSR. Penilaian secara morfologi sangat subjektif terbukti dengan tanaman-tanaman yang dinilai sebagai campuran ternyata merupakan tanaman-tanaman hibrida pada uji SSR. Penggunaan marka SSR lebih akurat dalam mengidentifikasi tanaman campuran karena tidak dipengaruhi lingkungan. Pada populasi galur mandul jantan yang digunakan, masih ditemukan adanya malai dengan gabah isi, tetapi secara keseluruhan tingkat sterilitas malainya masih tergolong tinggi (>95%).
Terdapat beberapa karakter yang dapat dijadikan penciri tambahan pada Hipa 6 dan Hipa 7 yang belum ada pada deskripsi varietas. Karakter tersebut adalah warna koleoptil, bentuk dan ukuran lidah daun, warna putik, warna dan ukuran lemma steril, warna dan ukuran bulu pada ujung gabah, karakter malai terhadap batang, perlaku cabang sekunder, warna lemma dan reaksi lemma terhadap pewarnaan phenol.
Informasi yang diperoleh dari penelitian ini diharapkan dapat berguna dalam verifikasi varietas dan pelaksanaan uji kemurnian benih di laboratorium yang cepat, akurat dan memiliki tingkat reprodusibilitas yang tinggi. Karakter morfologi tambahan yang didapatkan dalam penelitian ini dapat menjadi masukan bagi petugas pemeriksa untuk penilaian karakter tanaman di lapang.
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
IDENTIFIKASI DAN EVALUASI KEMURNIAN GENETIK
BENIH PADI HIBRIDA MENGGUNAKAN MARKA
MIKROSATELIT
INDRIA WAHYU MULSANTI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Agronomi dan Hortikultura Mayor Ilmu dan Teknologi Benih
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Identifikasi dan Evaluasi Kemurnian Genetik Benih Padi Hibrida Menggunakan Marka Mikrosatelit
Nama : Indria Wahyu Mulsanti NIM : A251090051
Disetujui Komisi Pembimbing
Dr. Ir. Memen Surahman, M.Sc.Agr. Ir. Sri Wahyuni, M.Sc. Agr.
Ketua Anggota
Diketahui
Ketua Mayor Dekan Sekolah Pascasarjana Ilmu dan Teknologi Benih
Prof. Dr. Ir. Satriyas Ilyas, MS. Dr. Ir. Dahrul Syah, M.Sc. Agr.
PRAKATA
Puji syukur ke hadirat Allah SWT yang memberikan rahmat dan hidayah sehingga penulis dapat menyelesaikan tugas akhir dengan judul Identifikasi dan Evaluasi Kemurnian Genetik Benih Padi Hibrida Menggunakan Marka Mikrosatelit. Penulisan tugas akhir ini dilakukan sebagai salah satu syarat untuk memperoleh gelar Magister Sains, Sekolah Pascasarjana IPB.
Terimakasih penulis sampaikan kepada Dr. Memen Surahman MSc. Agr. dan Ir. Sri Wahyuni MSc. Agr. selaku komisi pembimbing yang dengan ikhlas memberikan masukan, arahan, bimbingan, dorongan dan motivasi dalam
penyusunan tugas akhir ini. Penulis sampaikan penghargaan kepada Dr. Dra. Tatiek Kartika Suharsi, MS. selaku penguji luar komisi pada ujian tesis.
Terimakasih kepada Badan Litbang Pertanian atas dukungan dana beasiswa program master yang diberikan pada penulis. Terimakasih juga penulis sampaikan kepada Dr. Satoto atas pemberian materi penelitian. Penulis juga menyampaikan terima kasih kepada Dr. Dwinita Wingkan Utami atas masukan dan bimbingan serta Dr. Joko Prasetiono atas bantuannya selama pelaksanaan penelitian di laboratorium biologi molekuler BB Biogen. Terimakasih penulis sampaikan pada Indrastuti Apri Rumanti atas masukan, bantuan, dukungan dan motivasi yang diberikan pada penulis selama pelaksanaan penelitian hingga penyusunan tugas akhir. Teman-teman teknisi Lilis, Ahmad , dan Kholil atas bantuannya selama penelitian di lapang. Teman-teman seperjuangan di ITB 2009, PBT 2009, PMP 2009 untuk persahabatannya.
Rasa hormat dan terimakasih penulis sampaikan kepada ayahanda Suwardjo (alm) dan Ibunda Sudari tercinta atas limpahan doa dan kasihsayang yang telah menguatkan penulis dalam melaksanakan penelitian dan penulisan tesis ini. Juga kepada seluruh kakak dan keponakan atas semangat dan doanya. Semoga karya ilmiah ini bermanfaat dan dapat memberikan sumbangan bagi kemajuan ilmu pengetahuan dan teknologi di bidang pertanian.
RIWAYAT HIDUP
DAFTAR ISI
DAFTAR TABEL
Halaman
1 Lima varietas hibrida yang digunakan beserta galur tetuanya.. 15 2 Marka SSR dan susunan basa primer yang digunakan dalam
penelitian……….
16
3 Nama lokus, sekuen basa berulang, kisaran basa dan jumlah
alel dari 16 marka SSR yang digunakan………... 23 4 Marka SSR polimorfis dan tingkat polimorfisme (PIC)…….….. 25 5 Jarak genetik galur tetua dari lima varietas hibrida………. 25 6 Marka SSR polimorfis untuk tetua hibrida yang digunakan…… 27 7 Status sterilitas malai beberapa galur mandul jantan padi……. 31 8 Rata-rata persentase fertilitas beberapa galur mandul jantan
padi………..
32
9 Identifikasi tanaman campuran pada uji kemurnian genetik menggunakan SSR dan grow out test pada Hipa 6...
35
10 Penyimpangan karakter pada tanaman sampel yang
dinyatakan sebagai campuran pada grow out test Hipa 6... 36 11 Identifikasi tanaman campuran pada uji kemurnian genetik
menggunakan SSR dan grow out test pada Hipa 7... 39 12 Penyimpangan karakter pada tanaman sampel yang
dinyatakan sebagai campuran pada grow out test Hipa 7... 39 13 Deskripsi beberapa karakter kualitatif padi hibrida Hipa 6 dan
Hipa 7………. 44 14 Deskripsi beberapa karakter kuantitatif padi hibrida Hipa 6
DAFTAR GAMBAR
Halaman 1 Diagram alir penelitian ... 5 2 Hubungan antara tiga galur komponen utama pembentuk
padi hibrida ………..………. 8 3 Dendogram analisis UPGMA delapan tetua hibrida padi
berdasarkan kemiripan genetik dengan menggunakan tujuh
marka SSR polimorfis... 26 4 Penampilan pita DNA menggunakan marka SSR RM164….… 28 5 Penampilan pita polimorfis dari tetua hibrida untuk marka
SSR RM346 (a) , RM570 (b) dan RM206 (c)(d)………. 29 6 Penampilan pita polimorfis dari tetua hibrida untuk marka
SSR RM263 (a) dan RM276 (b)………. 30 7 Hasil uji kemurnian benih Hipa 6 dengan menggunakan
RM346 pada media elektroforesis gel agarose 3 %... 34 8 Hasil uji kemurnian benih Hipa 6 dengan menggunakan
RM346 pada media elektroforesis gel polyakrilamid………….. 34 9 Identifikasi tanaman nomor 1 dengan Hipa 6 (a); Tanaman
nomor 37 dan Hipa 6 (b). Tanaman nomor 1 dan 37 yang diidentifikasi sebagai campuran ternyata bukan campuran
menurut uji laboratorium………..……….. 36 10 Identifikasi tanaman nomor 19 (kiri) dan Hipa 6 (kanan).
Tanaman 19 diidentifikasi sebagai campuran pada uji
kemurnian di laboratorium dan di lapang ……….. 37 11 Uji kemurnian benih Hipa 7 dengan menggunakan marka
RM206 pada gel agarose 3%... 37 12 Uji kemurnian benih Hipa 7 dengan menggunakan marka
RM206 pada gel polyakrilamid……….. 38 13 Indentifikasi tanaman campuran nomor 14 (kiri) dan Hipa 7
(a), perbandingan ukuran dan lebar daun antara campuran
dengan Hipa 7 (b)……… 40 14 Campuran dari tanaman parsial steril atau parsial fertil, malai
1, 2 fertil dan malai 3 steril (hampa). Malai 1,2,3 diambil dari satu rumpun tanaman yang sama. Malai no 4 adalah galur
Halaman 15 Gabah pada Hipa 6 (kiri) dan Hipa 7 (kanan)………. 43 16 Telinga daun pada Hipa 6 (kiri) dan Hipa 7 (kanan)………….. 43 17 Karakter warna daun Hipa 6 (a) dan Hipa 7 (b) karakter
DAFTAR LAMPIRAN
Halaman 1. Pengamatan karakteristik tanaman………... 58 2. Angka (kode) untuk stadia pertumbuhan………. 59 3. Karakter kualitatif tanaman padi………. 60 4. Karakter kuantitatif tanaman……… 65 5. Deskripsi varietas Hipa 6 Jete... 66 6 Deskripsi varietas Hipa 7... 67 7 Deskripsi varietas Hipa 8... 68 8 Deskripsi varietas Hipa 9... 69 9 Deskripsi varietas Hipa 10... 70 10 Nilai kemiripan genetik delapan galur tetua hibrida……… 71 11 Gambar beberapa karakter kualitatif pada Hipa 6 dan Hipa 7.. 72 12 Prosedur baku pembuatan larutan kimia untuk ekstraksi DNA 75 13 Prosedur baku pembuatan larutan kimia untuk elektroforesis
horizontal………. 79
14 Prosedur baku pembuatan larutan kimia untuk elektroforesis
vertikal……… 81
PENDAHULUAN
Latar Belakang
Peningkatan produksi padi merupakan bagian dari upaya dalam meningkatkan produksi pertanian khususnya tanaman pangan. Salah satu alternatif peningkatan produksi padi adalah dengan pengembangan padi hibrida. Padi hibrida dikembangkan dengan memanfaatkan fenomena heterosis sehingga F1 hibrida menunjukkan produktivitas yang lebih tinggi dibandingkan tetua
pembentuknya (Satoto & Suprihatno 2008).
Padi hibrida di Indonesia dirakit melalui metode tiga galur yang melibatkan tiga galur tetua, yaitu: galur mandul jantan (GMJ), pelestari dan pemulih kesuburan (restorer) (Satoto & Suprihatno 2008). Kelemahan metode tersebut berupa prosedur produksi benih yang rumit sehingga hasil benih berfluktuatif. Rata-rata efisiensi dalam produksi benih (seed yield) padi hibrida publik di Indonesia pada tahun 2008-2009 berkisar antara 0,5-1,9 t/ha (Mulya et al.2010), sedangkan di China telah mencapai 2,5-2,7 t/ha (Mao & Virmani 2003). Rendahnya tingkat persilangan alami (outcrossing) dari GMJ diduga merupakan salah satu penyebab rendahnya hasil benih pada produksi benih hibrida.
Keberhasilan pengembangan padi hibrida tidak hanya ditentukan oleh ketersedian benih yang cukup secara kuantitas tetapi juga harus memperhatikan mutu dari benih tersebut. Mutu benih mencakup mutu genetik, mutu fisik dan mutu fisiologis (Sadjad 1993). Benih dikatakan mempunyai mutu genetik yang baik apabila benih tersebut asli (true to type), sesuai dengan varietas yang dimaksud. Uji kemurnian benih merupakan tahapan yang harus dilakukan untuk mengontrol mutu genetik dari suatu lot benih.
Kemurnian genetik benih F1 merupakan hal yang sangat penting pada
produksi benih padi hibrida (Yuan et al 2003). Kontaminasi kemurnian genetik benih F1 hibrida dapat disebabkan oleh persilangan yang berasal dari pollen
varietas lain, terjadinya selfing akibat tetua GMJ yang tidak murni sehingga fertil atau parsial fertil, serta adanya kontaminasi secara mekanis saat panen dan pengolahan benih.
2
observasi visual saja mengakibatkan lot benih tidak lulus dalam setifikasi benih di laboratorium walaupun pertanaman telah lulus dalam sertifikasi di lapang. Salah satu penyebabnya adalah efektifitas pengawasan mutu benih yang rendah yang terkait dengan kelemahan dalam penerapan prinsip-prinsip sertifikasi benih.
Sertifikasi benih yang dianut di Indonesia berbasis Organisation for Economic Co-operation and Development(OECD) Seed Scheme (OECD 2004). Beberapa prinsip dalam sertifikasi tersebut antara lain : (i) varietas yang disertifikasi harus memenuhi syarat DUS (distinct, uniform and stable) yang teruji secara formal dengan metode baku (UPOV 2002), (ii) memiliki nilai agronomis (VCU, value for cultivation and use) (iii) adanya daftar varietas yang layak untuk disertifikasi (list of eligible varieties for certification) dan (iv) pelaksanaan check-plot dalam produksi benih. Undang Undang No 12 tahun 1992 dan Permentan No. 39 tahun 2006 mewajibkan benih yang diperjualbelikan harus lulus dalam sertifikasi. Namun dalam pelepasan varietas tidak diwajibkan bahwa varietas yang akan dilepas harus lulus dalam uji DUS (Permentan No.37 tahun 2006), kecuali untuk varietas yang akan dilindungi (Undang-Undang no.29 tahun 2000 tentang Perlindungan Varietas Tanaman). Penyimpangan dalam prinsip sertifikasi tersebut dapat mengakibatkan terjadinya permasalahan dalam sertifikasi benih di Indonesia. Sebagai contoh pertanaman lulus dalam pemeriksaan lapangan tetapi tidak lulus dalam uji laboratorium karena keragaman bentuk gabah yang diidentifikasi sebagai campuran varietas lain (CVL). Keragaman bentuk gabah belum tentu merupakan CVL tetapi dapat saja merupakan sifat genetik dari varietas termaksud, mengingat tidak adanya keharusan uji DUS dalam pelepasan varietas.
Beberapa varietas yang telah dilepas saat ini memiliki kemiripan bentuk gabah yang cukup tinggi (Wahyuni et al. 2008). Selain itu dalam satu varietas yang sama terdapat variasi fisik pada bentuk gabah, dimana bentuk gabah pada pangkal malai tidak persis sama dengan bentuk gabah pada ujung malai. Bentuk gabah yang berbeda belum tentu berasal dari varietas yang berbeda dan bentuk gabah yang sama tidak dapat dipastikan sebagai varietas yang sama. Oleh karena itu kelulusan uji kemurnian benih di laboratorium hendaknya tidak hanya berdasarkan pada pengamatan visual pada bentuk gabah saja.
3
pertanaman dari benih otentik-nya. Metode grow out test membutuhkan waktu yang lama karena harus melalui satu siklus tanaman. Sementara itu industri perbenihan memerlukan metode pengujian kemurnian benih yang cepat dan akurat, serta memiliki tingkat reprodusibilitas yang tinggi.
Beberapa metode referensi untuk verifikasi varietas melalui metode elektroforesis telah ditetapkan oleh International Seed Testing Asociation (ISTA). Metode standar untuk pengujian kemurnian genetik benih gandum adalah dengan PAGE (Polyachryalamide Gel Electrophoresis) dan pada jagung hibrida digunakan metode verifikasi dengan UTIELF (Ulthra-thin Layer Isoelectric Focusing) (ISTA 2008). Namun pengujian untuk kemurnian dan verifikasi padi hibrida masih belum ditetapkan oleh ISTA.
Pemanfaatan bioteknologi secara biomolekuler (DNA, protein, enzim) tidak hanya digunakan pada cara-cara perbanyakan benih dan pemuliaan tanaman tetapi juga dapat diterapkan untuk evaluasi kemurnian genetik. Melalui metode elektroforesis diharapkan dapat dilakukan pengujian yang lebih cepat dan akurat dalam mengidentifikasi suatu varietas. Berbagai metode menggunakan marka molekuler telah banyak diterapkan untuk pengujian varietas, salah satunya adalah marka mikrosatelit atau marka SSRs (Simple Sequence Repeats).
Berbagai studi genetika menunjukkan beberapa keunggulan dari marka SSR diantaranya adalah memiliki tingkat polimorfik tinggi, bersifat kodominan, akurasi yang tinggi dan berlimpah dalam genom. Marka ini banyak digunakan untuk studi genetik populasi (Rajesh et al. 2008), pemetaan genetik (Jiang et al. 2010; Stafne et al. 2005) pemuliaan tanaman dan perlindungan varietas tanaman (Moeljoprawiro 2007). Sejumlah penelitian telah dilakukan untuk mengetahui tingkat perbedaan genetik pada tanaman dengan menggunakan marka SSR. Marka SSR dapat digunakan untuk mengidentifikasi dan verifikasi suatu varietas tanaman (Meesang et al. 2001) serta uji kemurnian pada tomat hibrida (Liu et al. 2006), jagung hibrida (Pabedon 2005) dan padi hibrida (Xin et al. 2005).
4
Tujuan Penelitian Penelitian ini bertujuan untuk :
1. Mendapatkan marka mikrosatelit (SSR) spesifik yang dapat digunakan untuk identifikasi galur tetua beberapa varietas padi hibrida, serta melihat tingkat polimorfisme dari marka tersebut.
2. Mempelajari sterilitas malai beberapa galur mandul jantan.
3. Membandingkan uji kemurnian benih dengan menggunakan SSR dan grow out test.
4. Mendapatkan karakter kualitatif dan kuantitatif dari dua varietas padi hibrida (Hipa 6 dan Hipa 7) untuk melengkapi deskripsi varietas.
Manfaat Penelitian
Gambar 1. DDiagram alirr penelitian
TINJAUAN PUSTAKA
Padi Hibrida
Padi hibrida adalah satu jenis padi yang merupakan keturunan pertama dari persilangan antar dua varietas yang berbeda. Pengembangan hibrida didasari oleh gejala heterosis atau vigor hibrida. Heterosis merupakan fenomena biologis yang menunjukan keunggulan hasil persilangan F1 melebihi kedua
tetuanya. Pada generasi lebih lanjut yaitu pada F2 akan terjadi segregasi
sehingga manfaat heterosis hilang dan tidak didapatkan individu yang sama dengan penampilan hibrida F1 (Virmani et al. 1997).
Keunggulan berupa gejala heterosis tersebut dapat berupa hasil, vigor tanaman, ketahanan terhadap kondisi suboptimum, daya adaptasi maupun karakter lainnya (Yuan 2003; Virmani 1994). Heterosis yang tinggi dari suatu kombinasi hibrida akan didapatkan dari pasangan tetua yang memiliki komposisi genetik tertentu. Berdasarkan penampilan hibrida F1, terdapat tiga kriteria
heterosis: (1) mid-parent heterosis yaitu perbandingan rata-rata F1 dengan
nilai rata-rata kedua tetua; (2) heterobeltiosis yaitu perbandingan nilai rata-rata F1
dengan nilai rata-rata tetua tertinggi; (3) standar heterosis yaitu perbandingan rata-rata F1 dengan varietas pembanding (check variety) (Virmani et al. 1997).
Beberapa pertimbangan untuk mengembangkan padi hibrida adalah : (1) tingkat produktivitas galur-galur non hibrida tidak bisa ditingkatkan lagi sekalipun telah diupayakan secara optimal, (2) semakin terbatasnya ketersediaan lahan dan input energi dalam mendukung sarana produksi padi, (3) permintaan terhadap padi cenderung meningkat dengan meningkatnya jumlah penduduk, (4) galur padi hibrida telah mampu meningkatkan potensi hasil
sebesar 15-20% lebih tinggi dari galur padi inbrida yang ditanam petani, (5) beberapa padi hibrida telah menunjukan toleransi yang lebih baik terhadap
kondisi kekeringan dan salinitas (Virmani et al. 1997).
9
Padi hibrida merupakan generasi F1 hasil persilangan antara galur mandul
jantan sebagai tetua betina dengan galur pemulih kesuburan sebagai tetua jantan, sehingga sifat-sifat dari varietas padi hibrida ditentukan oleh sifat-sifat dari kedua tetuanya. Tetua-tetua yang superior dapat meningkatkan penampilan agronomis dan bobot hasil hibrida turunan dari berbagai kombinasi persilangan antara galur mandul jantan dan galur pemulih kesuburan (You et al. 2006).
Secara alami kondisi susunan genetik dari padi adalah homozigot-homogen, sedangkan kondisi tanaman hibrida adalah heterozigot-homogen. Yang dimaksud dengan heterozigot-homogen adalah dalam individu tanaman yang sama kontruksi gen bersifat heterozigot, sedangkan antar individu tanaman dalam populasi yang sama bersifat homogen (Satoto & Suprihatno 2008).
Uji Kemurnian Benih
Standar mutu yang harus dipenuhi telah ditetapkan untuk mendapatkan benih dengan jaminan mutu. Standar mutu tersebut mencakup persiapan sumber benih, kegiatan di lapang sampai dengan benih siap dipasarkan. Persyaratan mutu yang harus dipenuhi di lapangan mencakup persentase campuran varietas lain yang diperbolehkan, isolasi jarak dan isolasi waktu. Persyaratan mutu di laboratorium mencakup kadar air benih, kemurnian fisik benih (benih murni, kotoran benih, biji benih tanaman lain, biji benih gulma) dan daya berkecambah (SNI 2003).
10
Perbandingan dengan contoh autentik dari varietas dimaksud biasanya dilakukan untuk memudahkan analis dalam mengidentifikasi suatu varietas. Pada beberapa tanaman sangat sulit membedakan dengan pasti dari dua spesies berbeda yang berasal dari genus yang sama. Sebagai contoh dua spesies ryegrass, Lolium perenne dan L. multiforum hanya dapat dibedakan melalui persentase bulu pada bagian belakang benih. Akan tetapi bulu pada benih rontok/hilang saat prosesing benih (perontokan dan pembersihan) dan menjadikan benih dari dua spesies yang berbeda tersebut tidak dapat dibedakan. Bila hal ini terjadi maka benih murni diidentifikasi sebagi genus bukan berdasarkan spesies tertentu.
Uji kemurnian benih di laboratorium lebih mengarah pada kemurnian fisik bukan pada kemurnian genetik karena penilaian hanya dilakukan berdasarkan penilaian visual saja. Pada beberapa spesies tanaman yang memiliki kemiripan antar varietas yang cukup besar, uji kemurnian berdasarkan penilaian visual akan sangat riskan. Saat ini terdapat beberapa metode untuk verifikasi varietas di laboratorium, salah satu diantaranya adalah dengan uji pewarnan phenol untuk gandum Triticum aestivum (ISTA 2008). Uji pewarnaan phenol ini belum bisa diaplikasikan secara luas karena hanya berlaku untuk beberapa varietas saja. Pada padi pengujian phenol tingkat keterulangannya sangat rendah dan sangat bervariasi antar individu biji (Wahyuni et al. 2008) sehingga tidak dapat digunakan untuk uji kemurnian benih padi.
11
Marka Molekuler
Potensi penggunaan marka sebagai alat untuk melakukan karakterisasi genetik tanaman telah dikenal sejak lama. Marka bisa dikategorikan sebagai marka morfologi, sitologi dan yang terbaru adalah marka molekuler (Moritz & Hilis 1996). Dengan berkembangnya teknologi biomolekuler maka kegiatan identifikasi varietas dan estimasi kemurnian genetik benih dapat dilakukan dengan menggunakan marka molekuler.
Marka molekuler seringkali dikenal sebagai sidik jari DNA karena mengacu pada pita polimorfisme berupa fragmen DNA. Keunggulan utama penanda molekuler adalah (a) keakuratan tinggi dan tidak dipengaruhi lingkungan yang mempengaruhi ekspresi gen, (b) dapat diuji pada semua tingkat perkembangan tanaman, (c) pada pengujian hama dan penyakit tidak tergantung pada organisme pengganggu (d) penggunaannya pada kegiatan seleksi pemuliaan tanaman dapat mempercepat proses seleksi dan lebih hemat pada pengujian selanjutnya di lapangan (Kasim & Azrai 2004).
Beberapa prinsip dasar dan metodologi dari marka molekuler yaitu : (a) marka yang berdasarkan pada hibridisasi DNA, (b) marka yang berdasarkan pada reaksi rantai polimerase (Polymerase Chain Reaction /PCR), (c) marka molekuler berdasarkan PCR yang dilanjutkan hibridisasi, dan (d) sekuensing DNA berdasarkan marka (Gupta et al. 2002). Marka DNA berbasis Polymerase Chain Reaction (PCR) menjadi teknologi pilihan karena menjanjikan efisiensi dan kepastian/akurasi dalam identifikasi. Contoh marka DNA adalah: RAPD (Random Amplified Polymorphic DNA), AFLP (Amplified Fragment Length Polymorphism), SSR (Simple Sequence Repeats), ISSR (Inter Simple Sequence Repeats), RAF (Randomly Amplified DNA Fingerprinting).
Marka SSR (Marka Mikrosatelit)
12
70% (Flavel 1980) kedelai mencapai 60% (Walbot & Goldberg 1979), dan pada padi mencapai 50% (McCouch et al. 1988).
Terdapat tiga kelas pengulangan fraksi DNA pada individu eukariot, yaitu fraksi sangat berulang (highly repeated fraction), fraksi berulang secara moderat (moderatly repeated fraction), dan fraksi tidak berulang (nonrepeated fraction). Fraksi sekuen sangat berulang terdiri atas (1) satelit DNA, (2) minisatelit DNA dan (3) mikrosatelit DNA. Pengulangan sekuennya tersusun secara tandem. Satelit DNA biasanya jarang ditemukan dalam lokus genom karena perulangannya yang sangat tinggi (biasanya antara 1000 sampai 100 000 kopi) bentuknya sangat panjang, sering berada pada bagian heterokromatin dengan panjang fragmen berulang 2 sampai beberapa ribu pasang basa tetapi umumnya ditentukan 100-300 pasang basa. Minisatelit DNA biasanya banyak terdapat dalam genom, rata-rata sekuen berulang sekitar 10-60 bp dan menunjukan derajat pengulangan yang lebih rendah (Weising et al. 1995). Mikrosatelit DNA juga disebut sebagai fragmen berulang sederhana atau perulangan tandem sederhana, terdiri atas sekuen-sekuen pendek 2-5 bp dan rata-rata pengulangannya maksimum 100 kali (Karp 1998) pengulangannya berurutan dimana jumlah dari nukletidanya bervariasi (Rafalski et al. 1996).
Variasi jumlah pengulangan untuk suatu batasan lokus diantara genotip yang berbeda dengan mudah dapat dideteksi dengan teknik PCR (Hamada et al. 1982). Teknik PCR pada mikrosatelit hanya menggunakan DNA dalam jumlah sedikit dengan daerah amplifikasi yang kecil 100-300 bp dari genom. Selain itu marka mikrosatelit dapat diaplikasikan tanpa merusak bahan tanaman karena sample yang dibutuhkan untuk ekstraksi DNA sangat sedikit, selain itu dapat menggunakan bagian tanaman lain seperti biji atau serbuk sari (Senior et al. 1996). Produk amplifikasi hasil PCR tersebut dapat dideteksi menggunakan elektroforesis pada suatu gel dengan standar sekuen. Bila nol alel teramati maka kondisi alel tidak teramplifikasi selama PCR (Rohrer et al. 1994).
13
karakter yang diinginkan; (c) studi genetik populasi dan analisis diversitas genetik (Powell et al. 1996).
Mikrosatelit telah banyak digunakan untuk keperluan pemuliaan (USDA-ARS 2003), analisis genetik, dan untuk perlindungan varietas tanaman (Cooke & Reeves 2003). Sejumlah penelitian telah dilakukan yang bertujuan untuk mengembangkan metode pengujian rutin untuk identifikasi varietas dan metode cepat untuk mengetahui kualitas dan kemurnian varietas yang bersegregasi. Identifikasi varietas dengan menggunakan mikrosatelit marka DNA (digunakan 19 marka SRR) yang dilakukan pada benih kedelai berhasil membedakan 11 varietas dan 133 asesi. Metode ini juga dapat membedakan dua varietas yang tidak dapat dibedakan melalui metode di lapangan dan di laboratorium (Meesang et al. 2001). Marka SSR juga efektif dalam identifikasi varietas dan uji kemurnian pada 5 hibrida padi beserta galur tetuanya ( Ye-yun et al 2005). Pada pengujian kemurnian genetik pada F1 tomat hibrida ”Hezuo906” digunakan
BAHAN DAN METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Juni 2010 sampai dengan Mei 2011 di Kebun Percobaan Pusakanagara, Laboratorium Mutu Benih Balai Besar Penelitian Tanaman Padi, Sukamandi dan Laboratorium Molekuler Balai Besar Bioteknologi dan Sumber Daya Genetik, Bogor.
Bahan Penelitian Bahan Tanaman
Galur tetua dari lima varietas hibrida digunakan untuk identifikasi marka SSR (Tabel 1), sedangkan untuk uji kemurnian benih digunakan dua varietas hibrida yaitu Hipa 6 dan Hipa 7.
Tabel 1 Lima varietas hibrida yang digunakan beserta galur tetuanya No Varietas Hibrida Galur Mandul Jantan Restorer
1 Hipa 6 IR 62829 A B 8094 F 2 Hipa 7 IR 58025 A IR 40750 3 Hipa 8 IR 58025 A BP 51-1 4 Hipa 9 IR 58025 A S4325 A 5 Hipa 10 IR 68897 A BIO-9
Bahan Kimia
Bahan Kimia yang digunakan terdiri atas NaCl 5M, Tris HCl 1M, EDTA 0.5 M, SDS, Chisam ( Chloroform Isoamil Alkohol) 24:1, Natrium Asetat, Etanol 95%, Ethanol 70%,TE buffer, RNAse, CTAB 10%, Tris base, Glacical acetid acid, EDTA 0.5M, Agarose gel, TaqDNA polymerase, buffer PCR, MgCl2, dNTPs mix,
16 pasang primer, Etidium Bromide, Tris, EDTA, Boricacid, Bisacrylamid (40%), APS 10%, TEMED, ddH2O. Marka SSR yang digunakan pada penelitian ini
16
Tabel 2 Marka SSR dan susunan basa primer yang digunakan dalam penelitian Kode
Lokus Susuna basa primer
Posisi di kromosom
Suhu Anealing
(˚C) RM 104 F- GAAGAGGAGAGAAAGATGTGTGTCG 1 55
R- TCAACAGACACACCGCCACCGC
RM 154 F- ACCCTCTCCGCCTCGCCTCCTC 2 61
R- CTCCTCCTCCTGCGACCGCTCC
RM 164 F- TCTTGCCCGTCACTGCAGATATCC 5 55
R- GCAGCCCTAATGCTACAATTCTTC RM 206 F- CCCATGCGTTTAACTATTCT 5 55
R- CGTTCCATCGATCCGTATGG
RM 209 F- ATATGAGTTGCTGTCGTGCG 11 55
R- CAACTTGCATCCTCCCCTCC
RM 215 F- CAAAATGGAGCAGCAAGAGC 9 55
R- TGAGCA CCTCCTTCTCTGTAG
RM 219 F- CGTCGGATGATGTAAAGCCT 9 55
R- CATATCGGCATTCGCCTG
RM 250 F- GGTTCAAACCAAGCTGATCA 2 55
R- GATGAAGGCCTTCCACGCAG
RM 263 F- CCCAGGCTAGCTCATGAACC 2 55
R- GCTACGTTTGAGCTACCACG
RM 276 F- CTCAACGTTGACACCTCGTG 6 55
R- TCCTCCATCGAGCAGTATCA
RM 335 F- GTACACACCCACATCGAGAAG 4 55
R- GCTCTATGCGAGTATCCATGG
RM 346 F- CGAGAGAGCCCATAACTACG 7 55
R- ACAAGACGACGAGGAGGGAC
RM 464 F- AACGGGCACATTCTGTCTTC 9 55
R- TGGAAGACCTGATCGTTTCC
RM 475 F- CCTCACGATTTTCCTCCAAC 2 55
R- ACGGTGGGATTAGACTGTGC
RM 551 F- AGCCCAGACTAGCATGATTG 4 55
R- GAAGGCGAGAAGGATCACAG
RM 570 F- GTTCTTCAACTCCCAGTGCG 3 55 R- TGACGATGTGGAAGAGCAAG
17
Identifikasi Marka Molekuler
Pengujian SSR dilakukan pada tahap pertama penelitian, kegiatan ini dilakukan guna mengidentifikasi marka SSR polimorfik untuk tetua dari lima varietas hibrida yang digunakan. Identifikasi marka molekuler dilakukan di laboratorium biologi molekuler dengan kegiatan-kegiatan yang mencakup : ekstraksi DNA, amplifikasi PCR, elektroforesis dan visualisasi pita DNA.
Ekstraksi DNA
Sampel daun muda digerus menggunakan mortar dengan bantuan nitrogen cair sampai berbentuk bubuk. Sampel dimasukan dalam tabung mikro ukuran 1500 µl, kemudian ditambahkan ml 500 µl buffer ekstraksi. Tabung mikro yang berisi sampel dan buffer ekstrak dipanaskan menggunakan waterbath suhu 65˚C selama 60 menit sambil dilakukan pengocokan setiap 10 menit. Setelah itu sampel diangkat dan didiamkan pada suhu ruang selama 10 menit. Sampel ditambahkan Choloform:Isoamilalkohol (Chisam) dengan perbandingan 24:1 sebanyak 500 µl. Setelah itu sampel dicampur dengan cara divortex selama selama 5 menit, kemudian disentrifius selama 15 menit dengan kecepatan 1200 rpm. Bila sampel belum tercampur dengan baik dapat disentrifius sekali lagi.
Supernatan yang terbentuk diambil secara hati-hati dan dipindahkan ke tabung mikro yang baru. Supernatan ditambahkan dengan 2/3 x volume Isopropanol atau 2,5 x volume Etanol absolute yang sebelumnya telah ditaruh terlebih dahulu dalam freezer untuk presipitasi DNA. Sebanyak 100 µl Natrium asetat ditambahkan dan kemudian dicampur dengan cara membolak-balikan tabung secara perlahan. Sampel disentrifius pada kecepatan 1200 rpm selama 10 menit untuk mengendapkan DNA. Cairan yang ada dibuang dan kemudian endapan DNA yang terbentuk dicuci dengan cara menambahkan ethanol 70% yang kemudian disentrifius selama 5 menit. Pencucian dilakukan sebanyak dua kali. Cairan yang ada dibuang dan endapan DNA dikeringkan dengan mesin vacum. Selanjutnya endapan DNA dilarutkan kembali dengan 50-100 µl buffer TE dan ditambahkan RNAse 5 µl. Sampel diinkubasi selama 1 hari pada suhu ruang atau 1 jam pada suhu 37˚C.
18
menyamakan konsentrasi contoh kerja. Konsentrasi contoh kerja yang digunakan adalah 10 ng/µl.
Amplifikasi PCR, Elektroforesis dan Visualisasi Pita DNA
Sebanyak 3 µl DNA dari hasil pengenceran digunakan untuk setiap reaksi PCR. PCR mix dibuat terlebih dahulu untuk memudahkan dalam proses PCR. Larutan yang digunakan untuk PCR :
Buffer PCR (10 x) : 2 µl MgCl2 (25 mM) : 2,4 µl
dNTPs mix (10 mM) : 0,4 µl Primer R (10 pmol) : 0,2 µl Primer F (10 pmol) : 0,2 µl TaqDNA polymerase (5 µ/µl) : 0,2 µl
DNA : 3 µl
ddH2O : 10,4 µl
Total 20 µl
Profil reaksi PCR yang digunakan:
Denaturasi awal : 94˚C selama 5 menit Denaturasi : 94˚C selama 1 menit Annealing : 53˚C selama 30 detik Extention : 72˚C selama 1 menit Extention tambahan : 72˚C selama 5 menit siklus 35 kali
Elektroforesis hasil PCR, dilakukan dengan gel agarose 3 % dan 1 x buffer TAE. Sebanyak 6 µl produk PCR ditambahkan dengan 4 µl loading dye dan dicampur sempurna kemudian dimasukan ke dalam sumur gel. Sample DNA produk PCR di-running dengan voltase 87-88 volt selama 30-45 menit. Setelah itu gel agarose di-staining pada larutan ethidium bromide (10mg/l) selama 20 - 30 menit dan kemudian dicuci dengan air selama 5 menit. Gel Agarose kemudian divisualisasi dengan chemodoc gel system.
19
Larutan akrilamid 8% didapatkan dengan mencampur bisakrilamid 40%, TBE dan dH2O. Pembuatan gel dilakukan dengan mencampurkan akrilamid 8%
yang kemudain distirer sambil ditambahkan APS dan TEMED. Segera setelah tercampur larutan tersebut dituangkan dengan cepat dan hati-hati pada rongga antara kedua lempeng kaca, jangan sampai terbentuk gelembung. Setelah itu comb dipasang untuk membentuk sumur-sumur. Larutan polyakrilamid didiamkan selama selama ± 1 jam sampai larutan membentuk gel.
Lempengan berisi gel diletakan pada alat elektroforesis vertikal. Comb dilepaskan secara berlahan agar tidak merusak sumur-sumur yang terbentuk pada gel. Tangki elektroforesis diisi dengan buffer TBE 1x. Permukaan buffer yang diisikan kira-kira berjarak 1cm dari garis atas gel. Kotak tangki bagian bawah juga diisi buffer TBE 1x. Mesin elektroforesis ditutup dari bagian atas dan setelah itu baru alat dinyalakan. Elektroforesis dilakukan dengan arus konstan 100 volt selama 90 menit.
Analisis Marka Mikrosatelit (SSR)
Skoring
Setiap pita yang muncul pada gel merepresentasikan alel. Profil DNA merupakan data alel yang teramati dengan ketentuan adanya pita DNA berdasarkan ukuran produk PCR pada satu lokus yang sama dari beberapa contoh yang digunakan. Alel-alel tersebut diterjemahkan menjadi data biner. Setiap alel dianggap mewakili satu karakter dan diberi nilai berdasarkan ada tidaknya suatu alel. Nilai 1 diberikan apabila alel ada dan nilai 0 bila tidak ada alel. Analisa data molekular dilakukan berdasarkan hasil skoring pita DNA yang muncul pada gel. Penilaian muncul tidaknya pita genetik dilakukan secara manual. Pada marka SSR setiap pita DNA yang terbentuk menunjukan posisi alel pada lokus, dimana 1 marka SSR merupakan satu lokus.
Analisis Tingkat Polimorfisme (Polimorphic Information Content = PIC)
20
untuk masing-masing marka mikrosatelit (Smith et al. 1997). Nilai PIC diukur dengan menggunakan software online (www.genomics.liv.ac.uk/animal/ Pic1.html)
Profil Hasil Karakterisasi Marka Mikrosatelit
Keragaman alelik adalah keragaman yang diukur atau diduga dari keragaman aleliknya, yaitu banyaknya alel per lokus dan banyaknya lokus polimorfik (Boer 2007). Adapun parameter yang dapat dihitung adalah :
Jumlah Rata-rata Alel per Lokus, A. Jumlah rata-rata alel per lokus adalah porporsi jumlah total alel pada semua lokus terhadap jumlah lokus monomorfik dan polimorfik, sebagai berikut :
Jumlah total semua alel pada semua lokus Jumlah lokus monomorfik dan polimorfik
Persentase Lokus Polimorfik, P. Persentase lokus polimorfik adalah proporsi jumlah lokus polimorfik terhadap jumlah lokus monomorfik dan polimorfik, sebagai berikut :
Jumlah lokus polimorfik
Jumlah lokus monomorfik dan polimorfik
Jumlah Rata-rata Alel per Lokus Polimorfik, AP. Jumlah rata-rata alel per lokus polimorfik adalah proporsi dari jumlah total alel pada semua lokus terhadap jumlah lokus polimorfik, sebagai berikut ;
Jumlah total alel pada semua lokus Jumlah lokus polimorfik
Analisis Kemiripan Individu
21
pembuatan dendogram kekerabatan menggunakan metode UPGMA (Unweighted Pair Group Methode Arithmetic) melalui program NTSYS (Numerical Taxonomy and Multivariate System) versi 2.02. Dendogram dikonstruksi untuk 8 inbrida (tetua). Analisis jarak genetik diperoleh dengan formula: S = 1 – GS, dimana S = Jarak genetik dan GS = kemiripan genetik.
Uji Sterilitas Malai Galur Mandul Jantan
Pengujian sterilitas malai dilakukan untuk mengetahui persentase tingkat sterilitas galur mandul jantan yang digunakan. Galur mandul jantan yang diuji adalah IR62829A, IR58025A, dan IR68897A. Penanaman dilakukan di rumah kaca dengan menggunakan 75 tanaman untuk masing-masing galur mandul jantan. Dua malai utama dari masing-masing individu tanaman disungkup dengan kantung kertas sebelum masa antesis. Pengamatan dilakukan menjelang fase generatif akhir. Selanjutnya dilakukan perhitungan jumlah gabah bernas (fertil) dan gabah hampa (steril) dari satu malai. Selain itu juga dihitung persentase individu tanaman yang menghasilkan gabah isi dari keseluruhan tanaman yang diuji.
Uji Kemurnian Benih Hibrida dan Karakterisasi Morfologi Tanaman
Uji Kemurnian Benih
Penanaman hibrida di lapang dilakukan untuk pengujian kemurnian benih. Varietas yang digunakan adalah Hipa 6 dan Hipa 7. Penanaman dimulai pada bulan Juli 2010 sampai dengan November 2010 di kebun percobaan Pusakanagara Balai Besar Penelitian Tanaman Padi. Pemeriksaan lahan dan pengolahan tanah sempurna dilakukan pada petak yang akan ditanam untuk menghindari adanya tanaman sisa yang berasal dari pertanaman sebelumnya. Persemaian dilakukan terpisah pada petak persemaian, bibit dipindahkan ke petak percobaan pada umur 15 hari. Penanaman dilakuan satu bibit /lubang dengan jarak tanam 25 cm X 25 cm. Penyulaman dilakukan 1 minggu setelah tanam.
22
diberikan pada saat tanaman berumur 40 HST. Pengendalian hama dan penyakit dilakukan saat munculnya gejala serangan hama dan penyakit.
Empat puluh individu tanaman ditentukan secara acak sebagai tanaman contoh untuk masing-masing hibrida. Setiap individu tanaman contoh tersebut diambil sampel daunnya pada umur lima minggu untuk dilakukan pengujian kemurnian genetik dengan marka molekuler. Pengamatan morfologi untuk pengujian kemurnian benih di lapang juga dilakukan pada tanaman contoh yang sama.
Uji Kemurnian Genetik dengan Marka Mikrosatelit
Setelah didapatkan marka SSR yang polimorfik selanjutnya dilakukan uji kemurnian genetik benih F1 hibrida dengan menggunakan 2 varietas Hibrida (Hipa 6 dan Hipa 7). Sebanyak 40 sampel diambil dari petak pertanaman tiap hibrida. Sampel diambil dari daun muda setiap individu tanaman yang telah diberi kode pada petak yang ada di lapangan. Sampel kemudian diekstrak DNA-nya, dan selanjutnya dilakukan amplifikasi PCR menggunakan marka SSR polimorfis yang telah teridentifikasi.
Pendugaan persentase tingkat kemurnian hibrida dilakukan dengan menghitung jumlah pita yang sesuai dengan pola persilangan masing-masing hibrida. Hasil dari uji kemurnian genetik benih F1 hibrida, selanjutnya dibandingkan dengan uji kemurnian di lapang (grow out test).
Uji Kemurnian di Lapang (grow out test) dan Karakterisasi Morfologi Tanaman
HASIL DAN PEMBAHASAN
Profil Hasil Karakterisasi Marka SSR
Saat ini marka SSR (penanda mikrosatelit) telah digunakan secara luas dalam analisis yang berbasis molekuler. Marka tersebut merupakan salah satu penciri genetik yang ideal untuk analisa genom karena jumlahnya yang cukup banyak dalam genom (Hoetzel 1998), selain itu marka SSR bersifat kodominan dan dapat mendeteksi variasi alel yang tinggi (Wu & Tanskley 1993; Panaud et al 1996). Marka SSR telah banyak digunakan pada berbagai studi keragaman genetik (Blair et al. 1999), identifikasi varietas tanaman (Moeljopawiro 2007; Pabedon et al. 2005 ) dan uji kemurnian benih hibrida (Tamilkumar et al 2009; Liu et al 2007). Informasi detail dari marka SSR yang digunakan pada penelitian ini dapat dilihat pada Table 3.
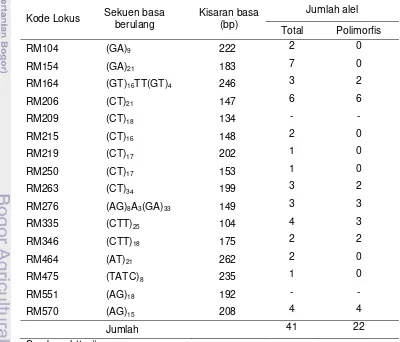
Tabel 3 Nama lokus, sekuen basa berulang, kisaran basa dan jumlah alel dari 16 marka SSR yang digunakan
Kode Lokus Sekuen basa berulang
Kisaran basa (bp)
Jumlah alel
Total Polimorfis
RM104 (GA)9 222 2 0
RM154 (GA)21 183 7 0
RM164 (GT)16TT(GT)4 246 3 2
RM206 (CT)21 147 6 6
RM209 (CT)18 134 - -
RM215 (CT)16 148 2 0
RM219 (CT)17 202 1 0
RM250 (CT)17 153 1 0
RM263 (CT)34 199 3 2
RM276 (AG)8A3(GA)33 149 3 3
RM335 (CTT)25 104 4 3
RM346 (CTT)18 175 2 2
RM464 (AT)21 262 2 0
RM475 (TATC)8 235 1 0
RM551 (AG)18 192 - -
RM570 (AG)15 208 4 4
Jumlah 41 22
24
Hasil penelitian menunjukkan bahwa dari 16 pasang primer yang digunakan dua primer tidak menghasilkan pita pada gel elektroforesis. Tidak munculnya pita dapat terjadi akibat optimasi yang tidak sesuai sehingga tidak terjadi amplifikasi saat proses PCR. Sebanyak total 41 alel dihasilkan dari 14 primer yang teramplifikasi, dengan rata-rata jumlah alel 2.92 per lokus. Persentase lokus polimorfik adalah 50% dimana terdapat 7 primer yang bersifat polimorfis dengan jumlah alel yang polimorfis sebanyak 22. Rata-rata jumlah alel per lokus polimorfik adalah 5.86.
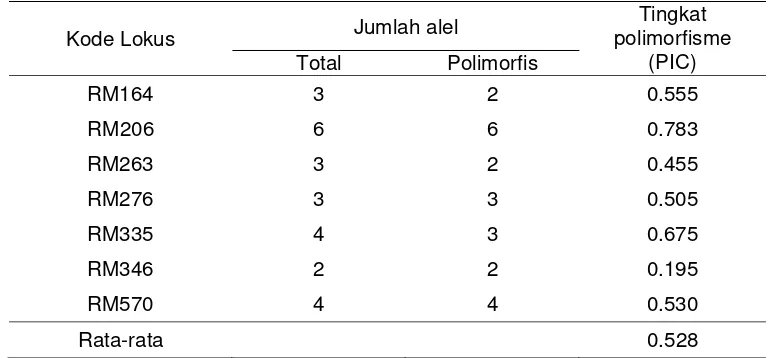
Tingkat Polimorfisme (Polymorphism Information Content, PIC) Galur Tetua Tingkat polimorfisme (PIC) diperlukan untuk memilih marka yang dapat membedakan antar galur/tetua yang digunakan. Kuantifikasi PIC adalah jumlah alel yang dapat dihasilkan oleh suatu marka dan frekuensi dari tiap alel dalam set genotipe yang diuji. Nilai polimorfisme ditentukan oleh frekuensi kemunculan alelnya (DeVicente & Fulton 2003). Marka yang menghasilkan alel lebih sedikit memiliki kemampuan yang lebih kecil untuk membedakan sampel yang diuji. Nilai PIC yang tinggi ditunjukan pada marka yang menghasilkan banyak alel. Nilai PIC merupakan standar yang baik untuk mengevaluasi marka genetik (Emrani et al 2011).
25
Tabel 4 Marka SSR polimorfis dan tingkat polimorfisme (PIC) Kode Lokus Jumlah alel
Tingkat polimorfisme
(PIC) Total Polimorfis
RM164 3 2 0.555
RM206 6 6 0.783
RM263 3 2 0.455
RM276 3 3 0.505
RM335 4 3 0.675
RM346 2 2 0.195
RM570 4 4 0.530
Rata-rata 0.528
Hasil karakterisasi berdasarkan marka SSR, menunjukan koefisien kemiripan genetik dari persilangan galur tetua hibrida berkisar antara 0.56 – 0.88 atau pada jarak genetik 0.12 - 0.44 (Tabel 5). Semakin besar nilai koefisien kemiripan genetik antara dua galur berarti semakin besar kemiripan genetiknya. Tabel 5 Jarak genetik galur tetua dari lima varietas hibrida
Varietas
Hibrida Tetua Kemiripan genetik Jarak genetik Hipa 6 IR 62829 A x B 8094 F 0.56 0.44 Hipa 7 IR 58025 A x IR 40750 0.80 0.20 Hipa 8 IR 58025 A x BP 51-1 0.88 0.12 Hipa 9 IR 58025 A x S4325 A 0.72 0.28 Hipa 10 IR 68897 A x Bio-9 0.76 0.24
27
Jarak genetik yang lebih dekat belum tentu menghasilkan hasil persilangan yang lebih tinggi. Hasil penelitian Zainal & Amirhusin (2005) pada galur-galur tetua padi hibrida menunjukan bahwa jarak genetik yang lebih dekat belum tentu menghasilkan turunan dengan tingkat produktivitas yang lebih tinggi. Efek heterosis pada padi juga dikendalikan oleh banyak gen, sehingga heterosis tidak cukup diterangkan hanya melalui jarak genetik. Nilai jarak genetik belum secara tegas memprediksi bobot biji, nilai daya gabung khusus dan heterosis (Pabedon et al. 2009)
Penentuan jarak genetik antar tetua juga dipengaruhi oleh jenis dan jumlah marka genetik yang digunakan. Semakin banyak jumlah populasi dan marka yang diuji maka hasil yang didapatkan akan semakin akurat (Tsegaye et al. 1996). Pada penelitian kali ini pengelompokan keseragaman genetik hanya menggambarkan jarak genetik dari delapan tetua hibrida dengan tujuh marka SSR polimorfis. Bila digunakan marka yang lebih banyak dan berbeda dapat saja dihasilkan pengelompokan genetik yang berbeda.
Marka SSR Spesifik yang Dapat Membedakan Tetua Hibrida
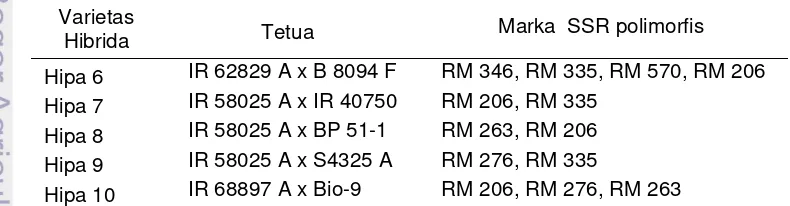
Sidik jari DNA berdasarkan PCR telah menjadi metode yang sering digunakan untuk karakterisasi plasma nutfah, studi penyebaran dan uji kemurnian varietas. Sejumlah marka DNA saat ini telah tersedia untuk dapat digunakan sebagai sidik jari, maupun untuk marker assisted selection (MAS). Marka mikrosatelit merupakan marka yang sering digunakan karena melimpah, bersifat kodominan dan selain itu juga mudah digunakan ( McCouch et al. 2002). Melalui penelitian ini telah didapatkan beberapa marka SSR yang memiliki potensi untuk membedakan antara tetua padi hibrida (Tabel 6).
Tabel 6 Marka SSR polimorfis untuk tetua hibrida yang digunakan Varietas
Hibrida Tetua Marka SSR polimorfis Hipa 6 IR 62829 A x B 8094 F RM 346, RM 335, RM 570, RM 206 Hipa 7 IR 58025 A x IR 40750 RM 206, RM 335
Hipa 8 IR 58025 A x BP 51-1 RM 263, RM 206 Hipa 9 IR 58025 A x S4325 A RM 276, RM 335
28
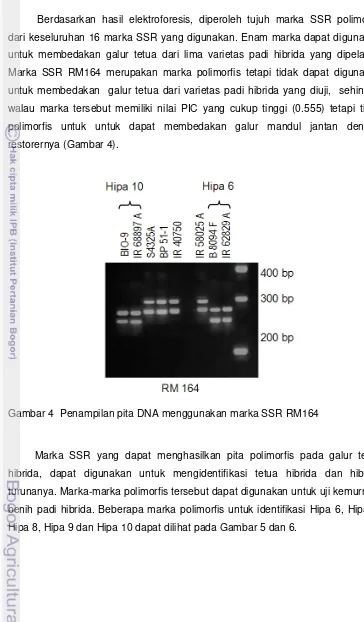
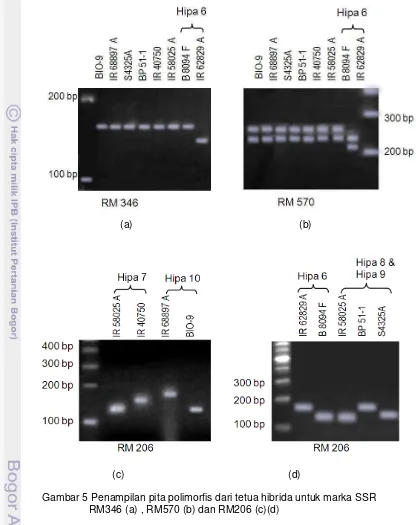
Berdasarkan hasil elektroforesis, diperoleh tujuh marka SSR polimorfis dari keseluruhan 16 marka SSR yang digunakan. Enam marka dapat digunakan untuk membedakan galur tetua dari lima varietas padi hibrida yang dipelajari. Marka SSR RM164 merupakan marka polimorfis tetapi tidak dapat digunakan untuk membedakan galur tetua dari varietas padi hibrida yang diuji, sehingga walau marka tersebut memiliki nilai PIC yang cukup tinggi (0.555) tetapi tidak polimorfis untuk untuk dapat membedakan galur mandul jantan dengan restorernya (Gambar 4).
Gambar 4 Penampilan pita DNA menggunakan marka SSR RM164
29
(a) (b)
(c) (d) Gambar 5 Penampilan pita polimorfis dari tetua hibrida untuk marka SSR
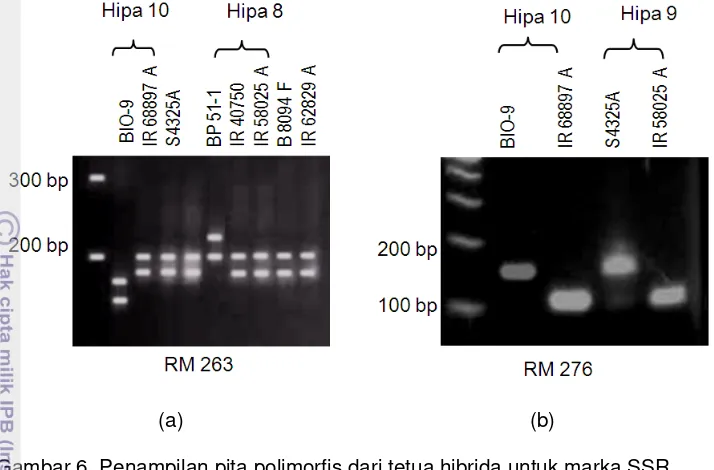
30
(a) (b) Gambar 6 Penampilan pita polimorfis dari tetua hibrida untuk marka SSR
RM263 (a) dan RM276 (b)
Sterilitas Galur Mandul Jantan
Adanya campuran pada benih hibrida akan dapat menurunkan produksi. Setiap adanya campuran sebesar 1 % pada benih galur mandul jantan akan dapat mengakibatkan penurunan produksi sebesar 100 kg/ha (Mao et al.1996). Peraturan perbenihan di India mensyaratkan kemurnian benih untuk padi hibrida adalah 98% (Verma 1996), sedangkan di China tingkat kemurnian benih untuk padi hibrida yang diperbolehkan minimal adalah 96 % (Yan 2000). Di Indonesia, sertifikasi benih hibrida mensyaratkan kemurnian benih 98 % dan campuran varietas lain yang diperbolehkan maksimal 0.5 % (Direktorat Perbenihan 2009). Untuk dapat menjamin kemurnian dari benih hibrida yang dihasilkan diperlukan tingkat kemurnian dari tetua hibrida yang cukup tinggi, tingkat kemurnian yang sebaiknya dimiliki oleh galur tetua adalah sekitar 99 % (Yashitola et al 2004; Direktorat Perbenihan 2009).
31
oleh terjadinya selfing yang diakibatkan dari tetua galur mandul jantan yang fertil. Kontaminasi pada galur pelestari atau mandul jantan dapat berakibat pada penurunan hasil dan buruknya pertanaman di lapang.
Kemungkinan adanya campuran pada proses produksi benih padi hibrida, diminimalkan dengan melakukan isolasi dan rouging mulai dari produksi tetua hingga produksi benih F1 hibridanya. Uji sterilitas malai dilakukan untuk melihat
kemungkinan terjadinya kontaminasi yang diakibatkan dari tetua mandul jantan yang tidak steril. Malai galur mandul jantan dari hibrida yang diuji disungkup dengan menggunakan kantung kertas dan diamati tingkat sterilitasnya (Tabel 7). Tingkat sterilitas malai dibagi menjadi beberapa tingkatan yaitu steril seluruhnya (100 %), tingkat sterilitas tinggi (99,0-99,9 %), steril (95,0-98,9), parsial steril (70,0-94,9%) dan parsial fertil s/d fertil (<70%) (IRRI 2011). Rata-rata persentase sterilitas malai dari ketiga galur mandul jantan masih termasuk dalam kategori steril karena masih diatas 95 %. Galur mandul jantan dikategorikan sebagal galur yang steril bila memiliki tingkat sterilitas lebih besar 95%, bila tingkat sterilitasnya lebih kecil dari itu maka dianggap sebagai galur yang tidak stabil.
Tabel 7 Status sterilitas malai beberapa galur mandul jantan padi Galur Mandul
Jantan
Jumlah sampel
Sterilitas malai (%) Rata-rata* Kisaran IR58025A 75 98.7 ± 1,59 86.3 – 100,0 IR62829A 75 99.8 ± 0,64 95.9 – 100,0 IR68897A 75 99.9 ± 0,37 97.5 – 100,0
Keterangan : *) x ± sd
Gabah isi masih ditemukan pada beberapa malai dari tiap mandul jantan yang diuji. Gabah isi menunjukkan bahwa peluang terjadinya penyerbukan sendiri masih ada. Tanaman digolongakan sebagai tanaman fertil bila masih ditemukan adanya gabah isi pada malai yang dihasilkan. Pada populasi tanaman yang diamati, galur mandul jantan IR58025A , IR62829A dan IR68897A menunjukkan tanaman fertil berturut-turut sebesar 4%, 8%, 2.7% (Tabel 8).
32
yang menghasilkan gabah isi per malai hingga 13.6 %. Untuk IR62829A dan IR68897A rata-rata persentase gabah isi per malai yang dihasilkan cukup rendah, yaitu masih di bawah 3%. Kisaran gabah isi per malai nya pun masih dibawah IR58025A .
Tabel 8 Rata-rata persentase fertilitas beberapa galur mandul jantan padi. Galur Mandul
Jantan
Tanaman Fertil (%)
Gabah isi/malai* (%)
Kisaran gabah isi/malai*
(%)
IR58025A 4.0 5.5 0.6-13.6
IR62829A 8.0 2.1 1.1- 4.1 IR68897A 2.7 2.3 2.1- 2.4
Ket : *)persentase gabah isi hanya dihitung dari malai fertil yang ditemukan
Tanaman dianggap sebagai tanaman fertil bila terdapat gabah isi pada malai yang dihasilkan. Galur mandul jantan yang digunakan dalam produksi benih padi hibrida seharusnya menghasilkan 100% malai yang mandul pada satu rumpun tanaman. Adanya gabah isi berpotensi menghasilkan gabah isi pada galur mandul jantan generasi berikutnya dan menyebabkan kontaminasi pada proses produksi benih F1 hibrida. Dalam kegiatan produksi benih, kegiatan
pemurnian perlu dilakukan untuk mendapatkan galur mandul jantan yang baik dimana tingkat sterilitasnya mencapai 100%. Pada kegiatan pemurnian dilakukan quality control pada galur mandul jantan. Proses quality control yang dimaksud adalah dilakukan penyungkupan minimal pada dua malai kemudian diamati gabah isi per malainya. Individu tanaman yang masih menghasilkan gabah isi, tidak digunakan untuk kegiatan produksi benih. Untuk mempertahankan kemurnian dari galur mandul jantan, metode terbaik yang digunakan adalah dengan melakukan silang balik berkelanjutan yang dilakukan secara manual (Youssef 2011).
Uji Kemurnian Genetik Benih Padi Hibrida
33
perusahaan penghasil varietas karena dapat menyediakan identifikasi atau bukti yang diakui secara hukum. Oleh karena itu diperlukan marka-marka yang dapat mengidentifikasi kebenaran dan kemurnian dari suatu varietas. Identifikasi kebenaran suatu genotipe tanaman dengan menggunakan marka yang tidak terpaut merupakan salah satu metode yang dapat digunakan untuk menilai kemurnian benih hibrida dan satu penanda yang polimorfik sudah cukup untuk pengujian kemurnian benih (Yashitola 2002)
Sifat marka SSR yang polimorfis dapat mendeteksi individu yang heterozigot, karena sifatnya itu maka marka SSR dapat digunakan untuk pengujian kemurnian genetik benih padi hibrida. Saat alel polimorfis dapat terditeksi antara tetua hibrida yaitu galur mandul jantan (A) dan restorernya (R), maka diharapkan kedua alel tersebut akan muncul pada pada individu F1
hibridanya. Pada penelitian ini uji kemurnian benih dilakukan menggunakan dua hibrida yaitu Hipa 6 dan Hipa 7. Pengujian dilakukan pada sampel individu tanaman muda yang diambil dari petak pertanaman di lapang. Marka RM346 digunakan untuk uji kemurnian genetik Hipa 6 dan RM206 untuk Hipa 7. Marka tersebut digunakan karena sifatnya yang polimorfis untuk tetua hibrida Hipa 6 dan Hipa 7.
Terdapat beberapa marka yang polimorfis yang dapat membedakan galur tetua Hipa 6, dan untuk uji kemurnian benih dipilih marka RM346. Pemilihan marka RM346 dikarenakan polimorfisme cukup jelas terlihat pada tetua (antara GMJ dan restorer-nya) (Gambar 5a) dibandingkan marka yang lain (RM570 dan RM206). Marka tersebut menghasilkan satu pita pada masing-masing tetua sehingga akan lebih mudah membedakannya pada uji kemurnian benih. Marka RM 206 dipilih untuk uji kemurnian benih Hipa 7, karena marka tersebut merupakan marka yang polimorfis dan merupakan marka yang spesifik untuk Hipa 7. Marka RM335 tidak digunakan untuk uji kemurnian benih karena walaupun polimorfis antara tetua Hipa 6 dan Hipa 7, tetapi marka tersebut tidak dapat membedakan antara Hipa 6 dan Hipa 7. Galur mandul jantan dan restorer dari Hipa 6 dan Hipa 7 teramplifikasi pada jarak yang sama.
35
campuran varietas lain pada tanaman nomor 1, 2, 3, 12, 19 ,37 dan 38 (Tabel 9). Terdapat perbedaan antara hasil uji laboratorium dengan marka SSR dengan identifikasi varietas campuran berdasarkan pengamatan morfologi di lapang. Tabel 9 Identifikasi tanaman campuran pada uji kemurnian genetik menggunakan
SSR dan grow out test pada Hipa 6
Uji Kemurnian Jumlah sampel
Tanaman campuran
(%)
Nomor sampel SSR 40 17,5 2, 3, 12, 19, 21, 33, 38 Grow out test 40 17,5 1, 2, 3, 12, 19, 37, 38
Persentase tanaman campuran pengujian SSR dengan grow out test memiliki nilai yang sama yaitu 17,5%. Sebagian besar individu yang dikenali sebagai campuran, sama antara SSR dan grow out test. Individu tanaman tersebut adalah sampel nomor 2, 3, 12, 19 dan 38. Hasil berbeda didapatkan pada beberapa nomor sampel yaitu pada tanaman nomor 1, 37, 21 dan 33.
Individu nomor 1 dan 37 (Gambar 9) yang diidentifikasi sebagai campuran di lapang ternyata bukan merupakan campuran pada hasil pengujian dengan marka SSR RM346. Individu tersebut memiliki dua pita polimorfis yang menandakan tetua Hipa 6 (Gambar 7 dan 8). Pada pengamatan grow out test individu 1 dan 37 dikategorikan sebagai tanaman campuran karena memiliki jumlah anakan yang lebih sedikit, tinggi tanaman yang lebih rendah dan warna daun yag sedikit lebih gelap dibandingkan tanaman Hipa 6. Sedikitnya jumlah anakan menyebabkan tampilan tanaman terlihat lebih kompak sehingga tanaman dianggap sebagai campuran. Rincian mengenai penyimpangan karekter pada tanaman-tanaman yang dikategorikan sebagai campuran dapat dilihat pada Tabel 10
36
digunakan pada penelitian ini. Sehingga dapat saja tanaman nomor 21 dan 33 yang menurut hasil SSR pitanya identik dengan restorer Hipa 6 adalah tanaman varietas lain yang pitanya tidak dapat dibedakan dengan restorer bila menggunakan marka RM346.
Tabel 10 Penyimpangan karakter pada tanaman sampel yang dinyatakan sebagai campuran pada grow out test Hipa 6
Nomor
sampel Penyimpangan karakter
1 Tanaman lebih pendek, anakan lebih sedikit, tanaman lebih kompak
2 Terdapat malai hampa, lebih rentan terhadap hama
3 Warna merah pada ujung gabah, tanaman sedikit lebih menyebar 12 Umur berbeda lebih dalam, warna daun lebih tua
19 Tanaman lebih tinggi, anakan sedikit, warna daun lebih muda, umur lebih dalam
37 Tanaman lebih pendek, anakan lebih sedikit, tanaman lebih kompak
38 Tanaman lebih pendek dan kompak, lebih rentan terhadap hama dan penyakit
(a) (b)
Beberapa tanaman lain memperlihatkan penyimpangan karakter yang cukup jelas seperti pada tanaman nomor 19. Tanaman tersebut memiliki jumlah
Gambar 9 Identifikasi tanaman nomor 1 dan Hipa 6 (a); Tanaman nomor 37 dan Hipa 6 (b). Tanaman nomor 1 dan 37 yang diidentifikasi sebagai campuran ternyata bukan campuran menurut uji laboratorium
37
anakan yang jauh lebih sedikit, perbedaan tinggi tanaman dan warna daun. serta umur berbunga yang jauh lebih dalam. Tanaman nomor 3 tidak menunjukkan tampilan yang berbeda jauh pada pertumbuhan tanaman. Perbedaan baru terlihat pada pengamatan generatif akhir dimana terdapat warna merah pada ujung gabah.
Polimorfisme antar tetua HIPA 7 yang dihasilkan oleh marka RM206 pada gel agarose 3% berjarak cukup dekat sehingga pita heterozigot sulit dilihat sebagai dua pita yang terpisah. Identifikasi pita homozigot dilakukan dengan melihat pendaran yang lebih tipis dan diidentifikasi sebagai pita homozigot. Individu-individu tanaman yang bukan hibrida diindikasikan oleh tanaman nomor 4, 14,15, 23 dan agak meragukan pada no 29 (Gambar 11).
22 23 23 24 25 26 27 28 29 30 3132 33 34 35 36 37 38 39 40 A R L
L 1 2 3 4 5 6 7 8 9 10 11 12 1314141516 17 18 19 20 21
Gambar 11 Uji kemurnian benih Hipa 7 dengan menggunakan marka RM206 pada gel agarose 3 %.
Gambar 10 Identifikasi tanaman nomor 19 (kiri) dan Hipa 6 (kanan). Tanaman 19 diidentifikasi sebagai campuran pada uji kemurnian di laboratorium dan di lapang
39
yang ada pada pertanaman. Penyimpangan karakter dari tanaman-tanaman yang dinilai sebagai campuran pada grow-out test dapat dilihat pada Tabel 12 Tabel 11 Identifikasi tanaman campuran pada uji kemurnian dengan SSR dan
grow out test pada Hipa 7
Uji Kemurnian Jumlah sample
Tanaman campuran
(%)
Nomor sampel SSR 40 12,5 4, 14, 15, 23, 29 Grow out test 40 17,5 1, 4, 14, 15, 23, 29, 34
Beberapa tanaman campuran memiliki penyimpangan morfologi yang cukup jelas dan dengan mudah dapat diidentifikasi. Tanaman nomor 14 memiliki ukuran tinggi tanaman dan lebar daun yang jelas berbeda dibandingkan Hipa 7 (Gambar 13). Pada beberapa tanaman yang diidentifikasi memiliki pita identik dengan galur mandul jantan memiliki malai-malai yang hampa pada rumpun tanamannya. tanaman tersebut adalah individu nomor 4, 15 dan 29
Tabel 12 Penyimpangan karakter pada tanaman sampel yang dinyatakan sebagai campuran pada grow out test Hipa 7
Nomor
sampel Penyimpangan karakter
1 Tanaman lebih kompak, umur berbunga lebih dalam 4 Biji hampa, parsial streril
14 Tanaman lebih tinggi, daun lebar, diameter batang lebih tebal 15 Terdapat malai steril, tanaman lebih kompak, (regestan) 23 Umur berbunga lebih dalam, tanaman lebih kompak, 29 Tanaman lebih kompak, anakan lebih sedikit, 34 Tanaman lebih kompak, anakan lebih sedikit,
40
(a) (b)
Hasil uji kemurnian varietas pada Hipa 6 dan Hipa 7 menunjukkan bahwa penilaian secara morfologi bersifat subjektif dan sangat dipengaruhi pada kondisi lingkungan. Penampilan bentuk tanaman dikendalikan oleh sifat genetik tanaman
CVL Hipa 7
Gambar 13 Indentifikasi tanaman campuran nomor 14 (kiri) dan Hipa 7 (a), perbandingan ukuran dan lebar daun antara campuran dengan Hipa 7 (b)
Hipa 7 CVL
Gambar 14. Campuran dari tanaman parsial steril atau parsial fertil, malai 1, 2 fertil dan malai 3 steril (hampa). Malai 1,2,3 diambil dari satu rumpun tanaman yang sama. Malai no 4 adalah galur mandul jantan.