44
Lampiran 2. Gambar buah dan serbuk simplisia markisa ungu (Passiflora edulis Sims)
Buah markisa ungu
45 Lampiran 2. (Lanjutan)
46
Lampiran 3. Hasil pemeriksaan mikroskopik penampang melintang dan serbuk simplisia kulit buah markisa ungu (Passiflora edulis sims).
1
5 4
3 2
6
9 7
8
47 Lampiran 4. Bagan kerja penelitian
Dicuci dari pengotor sampai bersih Ditiriskan
Ditimbang berat basahnya Dipotong kecil
Dikeringkan
Ditimbang berat keringnya
Dihaluskan dengan blender Disimpan
Kulit buah markisa ungu
Simplisia
Karakterisasi Skrining Fitokimia Pembuatan ekstrak etanol dan fraksi-fraksi
•Makroskopik
•Mikroskopik
•Penetapan kadar air
•Penetapan kadar sari yang larut air
•Penetapan kadar sari yang larut etanol
•Penetapan kadar abu total
•Penetapan kadar abu yang tidak larut asam
Senyawa golongan:
• Alkaloid
• Glikosida
• Glikosida antrakinon
48
Lampiran 5. Bagan pembuatan ekstrak etanol kulit buah markisa ungu (Passiflora edulis Sims)
dimasukkan ke dalam bejana tertutup
direndam dalam cairan penyari etanol selama 3 jam
dimasukkan massa ke dalam perkolator
ditutup mulut perkolator, dibiarkan selama 24 jam
dibuka kran perkolator, dibiarkan cairan perkolat menetes dengan kecepatan 1 ml per menit
ditampung ke dalam botol bening dihentikan perkolator apabila 500 mg cairan perkolat terakhir
diuapkan di atas penangas air tidak meninggalkan sisa
dipekatkan denganrotaryevaporator
Lampiran 6. Bagan pembuatan fraksi n-heksan, fraksi etilasetat dan fraksi airkulit buah markisa ungu (passiflora edulis sims)
Perkolat
49
ditambahkan 10 ml akuades dihomogenkan
dimasukkan dalam corong pisah ditambah dengan 40 ml n- heksan dikocok dan didiamkan sampai terbentuk dua lapisan dan dipisahkan
dilakukan fraksinasi hingga diperoleh fraksi n-heksan yang jernih
ditambah dengan 50 ml dikumpulkan
etilasetat dipekatkan dengan
rotary evaporator dikocok dan didiamkan
sampai terbentuk dua lapisan dan dipisahkan dilakukan fraksinasi hingga diperoleh fraksi etilasetat yang jernih
dikumpulkan
dipekatkan dengan rotary evaporator
Lampiran 7. Bagan pengujian aktivitas antibakteri
Ekstrak etanol kulit buah markisa ungu(30g)
Fraksi n-heksan Fraksi sisa
Fraksi n-heksan pekat (4,1354 g)
Fraksi etilasetat Fraksi sisa
Fraksi etilasetat pekat (5,5132 g) Fraksi sisa
pekat (17,3514 g)
50
←diambil dengan jarum ose steril
←ditanam pada media Nutrient Agar miring
←diinkubasi pada suhu 37oC selama 24 jam
←disuspensikan dalam 10 ml media Nutrient Broth steril
←diukur kekeruhan suspensi bakteri menggunakan spektrofotometer pada panjang gelombang 580 nm sampai diperoleh nilai transmitan 25%
←dimasukkan 0,1 ml inokulum ke dalam cawan petri
←ditambahkan 15 ml media Nutrient Agar ke dalam cawan petri
←dihomogenkan dan dibiarkan hingga memadat
←diletakkan pencadang kertas yang telah direndam ke dalam larutan uji ekstrak /fraksi
dengan berbagai konsentrasi dan pelarut DMSO sebagai blanko
←diinkubasi pada suhu 37oC selama 18 - 24 jam
←diukur diameter daerah hambatan di sekitar pencadang kertas dengan menggunakan jangka sorong
Lampiran 8.Perhitungan karakterisasi simplisia kulit buah markisa ungu Stok kultur bakteri
Inokulum bakteri
Media Padat
51 1. Penetapan kadar air
Kadar air
=
Volume air (ml)Berat sampel (g)
×
100%a. Berat sampel I = 5,01 g
Volume air = 0,45 ml
Kadar air = 0,45
5,01
×
100%= 8,98% b. Berat sampel II = 5,006 gVolume air = 0,4 ml
Kadar air = 0,4
5,006
×
100%= 7,99%c. Berat sampel III = 5,017 g
Volume air = 0,45 ml
Kadar air = 0,45
5,017
×
100%= 8,64%Kadar air rata-rata = 8,98% + 7,99% + 8,96%
52 Lampiran 8.(Lanjutan)
2. Penetapan kadar sari larut air Kadar sari larut air
=
Berat sari (g)Berat sampel (g)
×
100
20
×
100%a. Berat sampel I = 5,0032 g
Berat sari = 0, 3067 g
Kadar sari larut air =0,3067
5,0032
×
100
20
×
100%= 30,65 % b. Berat sampel II = 5,0016 gBerat sari = 0,3304 g
Kadar sari larut air = 0,3304
5,0016
×
100
20
×
100%= 33,02 % c. Berat sampel III = 5,0013 gBerat sari = 0,3144 g
Kadar sari larut air = 0,3144
5,0013
×
100
20
×
100%= 31,42 %Kadar sari larut air rata-rata = 30,65% + 33,02% + 31,42%
53 Lampiran 8.(Lanjutan)
3. Penetapan kadar sari larut etanol Kadar sari larut etanol
=
Berat sari (g)Berat sampel (g)
×
100
20
×
100%a. Berat sampel I = 5,0007 g
Berat sari = 0, 1302 g
Kadar sari larut etanol =0,1302
5,0007
×
100
20
×
100%= 13,01 %b. Berat sampel II = 5,0014 g
Berat sari = 0,1299 g
Kadar sari larut etanol = 0,1299
5,0014
×
100
20
×
100%= 12,98 %c. Berat sampel III = 5,0012 g
Berat sari = 0,1308 g
Kadar sari larut etanol = 0,1308
5,0014
×
100
20
×
100%= 13,07 %Kadar sari larut etanol rata-rata = 13,01% + 12,98% + 13,07% 3
54 Lampiran 8.(Lanjutan)
4. Penetapan kadar abu total Kadar abu total
=
Berat abu (g)Berat sampel (g)
×
100%a. Berat sampel I = 2,0005 g
Berat abu = 0,1578 g
Kadar abu total = 0,1578
2,0005
×
100%= 7,88%b. Berat sampel II = 2,0011g
Berat abu = 01489 g
Kadar abu total = 0,1489
2,0011
×100%
= 7,44%c. Berat sampel III = 2,0013 g
Berat abu = 0,1673 g
Kadar abu total = 0,1673
2,0013
×
100%= 8,35%Kadar abu total rata-rata = 7,88% + 7,44% + 8,35%
55 Lampiran 8.(Lanjutan)
5. Penetapan kadar abu tidak larut asam Kadar abu tidak larut asam
=
Berat abu (g)Berat sampel (g)
×
100%a. Berat sampel I = 2,0005 g
Berat abu = 0,0163 g
Kadar abu total = 0,0163
2,0005
×
100%= 0,81%b. Berat sampel II = 2,0011g
Berat abu = 0,0159 g
Kadar abu total = 0,0159
2,0011
×100%
= 0,79%c. Berat sampel III = 2,0013 g
Berat abu = 0,0163 g
Kadar abu total = 0,0172
2,0013
×
100%= 0,85%Kadar abu total rata-rata = 0,81+0,79+0,85
56
Lampiran 9.Data hasil uji aktivitas antibakteri ekstrak etanol kulit buah markisa ungu terhadap bakteri Staphylococcus aureus dan bakteri Escherichia coli.
No. Konsentrasi (mg/ml)
Diameter Daerah Hambatan (mm) Staphylococcus aureus Escherichia coli
D1 D2 D3 D* D1 D2 D3 D*
1. 500 16,9 16,8 16,9 16,86 16,7 16,6 16,8 16,7 2. 400 15,8 15,7 15,9 15,8 15,8 15,6 15,6 15,66 3. 300 14,6 14,6 14,8 14,66 14,5 14,4 14,6 14,5 4. 200 13,3 13,5 13,6 13,46 13,5 13,6 13,4 13,5 5. 100 12,5 12,6 12,4 12,5 12,5 12,4 12,4 12,43 6. 75 10,5 10,6 10,5 10,53 10,3 10,4 10,4 10,36
7. 50 7,1 7,2 7,4 7,23 8,4 8,6 8,3 8,43
8. 25 - - - -
9. 12,5 - - - -
10 6,25 - - - -
10. Blanko - - - -
Keterangan :
D = Diameter daerah hambatan 1,2,3 = Perlakuan
* = Rata-rata
57
Lampiran 10. Data hasil uji aktivitasantibakteri fraksi n-heksan kulit buah markisa ungu terhadap bakteri Staphylococcus aureus dan bakteri Escherichia coli.
No. Konsentrasi (mg/ml)
Diameter Daerah Hambatan (mm) Staphylococcus aureus Escherichia coli
D1 D2 D3 D* D1 D2 D3 D*
1. 500 - - - -
2. 400 - - - -
3. 300 - - - -
4. 200 - - - -
5. 100 - - - -
6. 75 - - - -
7. 50 - - - -
8. 25 - - - -
9. 12,5 - - - -
10 6,25 - - - -
10. Blanko - - - -
Keterangan :
D = Diameter daerah hambatan 1,2,3 = Perlakuan
* = Rata-rata
58
Lampiran 11.Data hasiluji aktivitas antibakterifraksi etilasetat kulit buah markisa ungu terhadap bakteri Staphylococcus aureus dan bakteri Escherichia coli.
No. Konsentrasi (mg/ml)
Diameter Daerah Hambatan (mm) Staphylococcus aureus Escherichia coli
D1 D2 D3 D* D1 D2 D3 D*
1. 500 20,7 20,4 20,3 20,46 20,2 20,5 20,6 20,43 2. 400 19,3 19,2 19,4 19,3 19,4 19,7 19,5 19,53 3. 300 18,2 18,2 18,3 18,23 18,3 18,6 18,4 18,43 4. 200 16,3 16,4 16,5 16,4 16,7 17,1 16,8 16,86 5. 100 14,2 14,3 14,1 14,2 14,2 14,3 14,2 14,23 6. 75 12,5 12,1 12,4 12,33 12,5 12,4 12,2 12,36 7. 50 11,6 11,3 11,4 11,43 10,9 11,2 11,0 11,03 8. 25 10,4 10,2 10,3 10,3 9,6 9,5 9,4 9,5 9. 12,5 7,5 7,2 7,3 7,33 7,2 7,4 7,2 7,26
10 6,25 - - - -
10. Blanko - - - -
Keterangan :
D = Diameter daerah hambatan 1,2,3 = Perlakuan
* = Rata-rata
59
Lampiran 12. Data hasil uji aktivitas antibakteri fraksi air kulit buah markisa ungu terhadap bakteri Staphylococcus aureus dan bakteri Escherichia coli.
No. Konsentrasi (mg/ml)
Diameter Daerah Hambatan (mm) Staphylococcus aureus Escherichia coli
D1 D2 D3 D* D1 D2 D3 D*
1. 500 13,5 13,4 13,4 13,43 12,3 12,4 12,3 12,33 2. 400 12,6 12,4 12,3 12,43 11,6 11,5 11,5 11,53 3. 300 10,8 10,7 10,6 10,7 10,3 10,4 10,4 10,36
4. 200 9,7 9,6 9,5 9,6 9,1 9,3 9,2 9,2
5. 100 8,5 8,5 8,4 8,46 - - - -
6. 75 - - - -
7. 50 - - - -
8. 25 - - - -
9. 12,5 - - - -
10 6,25 - - - -
10. Blanko - - - -
Keterangan :
D = Diameter daerah hambatan 1,2,3 = Perlakuan
* = Rata-rata
60
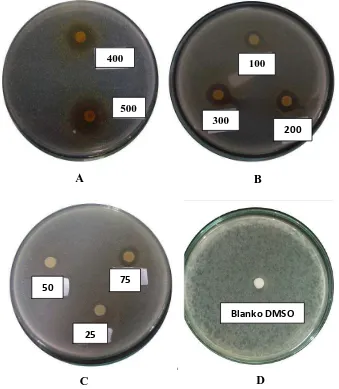
Lampiran 13.Gambar hasil uji aktivitas antibakteri ekstrak etanol kulit buah markisa ungu terhadap bakteri Staphylococcus aureus
Keterangan:
A = Konsentrasi 500 mg/ml, 400 mg/ml
B = Konsentrasi 300 mg/ml, 200 mg/ml, 100 mg/ml C = Konsentrasi 75 mg/ml, 50 mg/ml, 25 mg/ml D = Blanko Dimetilsulfoksida
400
500
300
100
200
Blanko DMSO 25
75 50
A
C D
61
Lampiran 14.Gambar hasil uji aktivitas antibakteri ekstrak etanol kulit buah markisa ungu terhadap bakteri Escherichia Coli
Keterangan:
A = Konsentrasi 500 mg/ml, 400 mg/ml
B = Konsentrasi 300 mg/ml, 200 mg/ml, 100 mg/ml C = Konsentrasi 75 mg/ml, 50 mg/ml, 25 mg/ml D = Blanko Dimetilsulfoksida
100 400
500
300
200
25
75 50
Blanko DMSO
D
A B
62
Lampiran 15. Gambar hasil uji aktivitas antibakteri fraksi n-heksan kulit buah markisa ungu terhadap bakteri Staphylococcus aureus
Keterangan:
A = Konsentrasi 500 mg/ml, 400 mg/ml
B = Konsentrasi 300 mg/ml, 200 mg/ml, 100 mg/ml C = Blanko Dimetilsulfoksida
400
500
100 300 200
Blanko DMSO
C
63
Lampiran 16. Gambar hasil uji aktivitas antibakteri fraksi n-heksan kulit buah markisa ungu terhadap bakteri Escherichia coli
Keterangan:
A = Konsentrasi 500 mg/ml, 400 mg/ml
B = Konsentrasi 300 mg/ml, 200 mg/ml, 100 mg/ml C = Blanko Dimetilsulfoksida
400
500
100 300 200
Blanko DMSO
C A
64
Lampiran 17. Gambar hasil uji aktivitas antibakteri fraksi etilasetat kulit buah markisa ungu terhadap bakteri Staphylococcus aureus
Keterangan:
A = Konsentrasi 500 mg/ml, 400 mg/ml, 300 mg/ml B = Konsentrasi 200 mg/ml, 100 mg/ml, 75 mg/ml
C = Konsentrasi, 50 mg/ml, 25 mg/ml, blanko dimetilsulfoksida D = Konsentrasi 12,5 mg/ml, 6,25 mg/ml
400 500
300
100 200
75
25 50
Blanko DMSO 6,25
12,5
D
A B
65
Lampiran 18. Gambar hasil uji aktivitas antibakteri fraksi etilasetat kulit buah markisa ungu terhadap bakteri Escherichia coli
Keterangan:
A = Konsentrasi 500 mg/ml, 400 mg/ml, 300 mg/ml B = Konsentrasi 200 mg/ml, 100 mg/ml, 75 mg/ml
C = Konsentrasi, 50 mg/ml, 25 mg/ml, blanko dimetilsulfoksida D = Konsentrasi 12,5 mg/ml, 6,25 mg/ml
400 500
300
100 200
75
25 50
Blanko DMSO 6,25
12,5
D
A B
66
Lampiran 19. Gambar hasil uji aktivitas antibakteri fraksi air kulit buah markisa ungu terhadap bakteri Staphylococcus aureus
Keterangan:
A = Konsentrasi 500 mg/ml, 400 mg/ml
B = Konsentrasi 300 mg/ml, 200 mg/ml, 100 mg/ml C = Blanko Dimetilsulfoksida
400
500
300
100 200
Blanko DMSO
C A
67
Lampiran 20. Gambar hasil uji aktivitas antibakteri fraksi air kulit buah markisa ungu terhadap bakteri Escherichia coli
Keterangan:
A = Konsentrasi 500 mg/ml, 400 mg/ml
B = Konsentrasi 300 mg/ml, 200 mg/ml, 100 mg/ml C = Blanko Dimetilsulfoksida
Blanko DMSO
300
100 200
400
500
C
68
Lampiran 21. Perhitungan pembuatan variasi konsentrasi larutan uji
1. Larutan iduk konsentrasi 500 mg/ml 5 gram ekstrak
10 ml pelarut DMSO= 500 mg/ml
• Konsentrasi 500 mg/ml dibuat dengan melarutkan 5 gram ekstrak dalam 10 ml DMSO
2. Konsentrasi 400 mg/ml 400 mg/ml
500 mg/ml x 1 ml = 0,8 ml larutan uji konsentrasi 500 mg/ml
• Konsentrasi 400 mg/ml dibuat dari 0,8 ml larutan uji konsentrasi 500 mg/ ml dan dicukupkan dengan 0,2 ml pelarut DMSO.
3. Konsentrasi 300 mg/ml 300 mg/ml
500 mg/ml x 1 ml = 0,6 ml larutan uji konsentrasi 500 mg/ml
• Konsentrasi 300 mg/ml dibuat dari 0,6 ml larutan uji konsentrasi 500 mg/ ml dan dicukupkan dengan 0,4 ml pelarut DMSO.
4. Konsentrasi 200 mg/ml 200 mg/ml
500 mg/ml x 1 ml = 0,4 ml larutan uji konsentrasi 500 mg/ml
• Konsentrasi 200 mg/ml dibuat dari 0,4 ml larutan uji konsentrasi 500 mg/ ml dan dicukupkan dengan 0,6 ml pelarut DMSO.
5. Konsentrasi 100 mg/ml 100 mg/ml
500 mg/ml x 1 ml = 0,2 ml larutan uji konsentrasi 500 mg/ml
69 6. Konsentrasi 75 mg/ml
75 mg/ml
500 mg/mlx 1 ml = 0,15 ml larutan uji konsentrasi 500mg/ml
• Konsentrasi 75 mg/ml dibuat dari 0,15 ml larutan uji konsentrasi 500 mg/ mldicukupkan dengan 0,85 ml pelarut DMSO.
7. Konsentrasi 50 mg/ml 50 mg/ml
500 mg/mlx 1 ml = 0,1 ml larutan uji konsentrasi 500 mg/ml
• Konsentrasi 50 mg/ml dibuat dari 0,1 ml larutan uji konsentrasi 500 mg/ ml dan dicukupkan dengan 0,9 ml pelarut DMSO.
8. Konsentrasi 25 mg/ml 25 mg/ml
500 mg/mlx 1 ml = 0,05 ml larutan uji konsentrasi 500 mg/ml
• Konsentrasi 25 mg/ml dibuat dari 0,05 ml larutan uji konsentrasi 500 mg/ ml dan dicukupkan dengan 0,95 ml pelarut DMSO.
9. Konsentrasi 12,5 mg/ml 12,5 mg/ml
500 mg/ml x 1 ml = 0,025 ml larutan uji konsentrasi 500 mg/ml
• Konsentrasi 12,5 mg/ml dibuat dari 0,025 ml larutan uji konsentrasi 500 mg/ ml dan dicukupkan dengan 0,975 ml pelarut DMSO.
10. Konsentrasi 6,25 mg/ml 6,25 mg/ml
500 mg/ml x 1 ml = 0,0125 ml larutan uji konsentrasi 500 mg/ml
40
DAFTAR PUSTAKA
Akanbi, B.O., Bodunrin, O.D., Olayanju, S.(2011). Phytochemical Screening and Antibacterial Activity Of Passiflora edulis.Hygeia Journal for drugs and medicines. 3(1):46-49
Depkes RI. (1999). Inventaris Tumbuhan Obat Indonesia. Jilid V. Jakarta: Departemen Kesehatan Republik Indonesia . Halaman 141.
Depkes RI. (1995). Materia Medika Indonesia. Jilid VI. Cetakan Keenam. Jakarta: Direktorat Jenderal Pengawasan Obat dan Makanan Departemen Kesehatan Republik Indonesia. Halaman 297-307, 321, 325.
Dey, P.M. (2012). Methods in Plant Biochemistry. Volume I. USA: Academic Press. Halaman 81-82.
Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman. 9, 649, 696.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 891 - 898, 1035.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 1, 10-11. Dwidjoseputro. (1978). Dasar- Dasar Mikrobiologi. Jakarta : Penerbit Djambatan.
Halaman 15-17.
Engelkirk, P.G. (2010). Burton’s Microbiology for the Health Sciences. Edisi sembilan. North America: Lippincott Williams & Wilkins. Halaman 299. Farnsworth, N.R. (1966). Biological and Phytochemical Screening of Plants.
Journal of Pharmaceutical Sciences. 55(3): 263-264.
Harborne, J.B. (1987). Metode Fitokimia Penuntun Cara Modern Menganalisis Tumbuhan. Penerjemah: Kosasih Padmawinata dan Iwang Soediro. Edisi Ketiga. Bandung: ITB Press. Halaman. 147.
Hermanto, C., Indriani, N.L., Hadiati, S. (2013). Keragaman dan Kekayaan Buah Tropika Nusantara. Jakarta: IAARD Press. Halaman 88-89.
Holt, G.J., Kneg, N.R., Sneath, A.H., Starley, T.J, Witirams, T.S. (1988). 9th edition. Bergey’s Manual Od Determinative Bacteriology. London: Williams & Wilkins Company. Halaman 187.
41
Kuntaman.,Wasito,E.B., Mertamiasih, M., Harsono, S., Alimsardjono., L. Jakarta: Penerbit Salemba Medica. Halaman 357.
Kannan, S., Devi, B.P., Jayakar.B.(2010). Antibacterial Evaluation Of The Methanolic Extract Of Passiflora Edulis. Researcher. 3(5): 9-12.
Karsinah, R.C. Hutabarat, dan A. Mansyur (2010). Markisa Asam. Jurnal Iptek Hortikultura. Balai Penelitian Tanaman Buah Tropika. No.6-Agustus 2010. Halaman 30.
Lay, B.W. (1994). Analisis Mikroba di Laboratorium. Jakarta: Raja Grafindo Persada. Halaman. 33.
Mursito. (2001). Ramuan Tradisional Untuk Kesehatan Anak. Jakarta: Penebar Swadaya. Halaman.2.
Marliana, E dan Saleh, C. (2011). Uji Fitokimia dan Aktivitas Antibakteri Ekstrak Kasar Etanol, Fraksi n-Heksana, Etilasetat dan Metanol dari Buah Labu Air (Lagenari siceraria (Molina) Standl. Jurnal Kimia Mulawarman 8(2): 63-69.
Naufalin, R., Jenie, B.S., Kusnandar, F., Sudarwanto, M., Rukmini, H. (2005). Aktivitas Antibakteri Ekstrak Bunga Kecombrang Terhadap Bakteri Patogen dan Perusak Pangan. Jurnal Teknologi dan Industri Pangan. 16(2): 119 – 125
Odugbemi, T. (2008). A Textbook of Medicinal Plants from Nigeria. Nigeria: University of Lagos Press. Halaman 219-220.
Oxoid. (1982). The Oxoid Manual, Edisi ke-5. England: Basingstoke. Halaman. 223-224
Pelczar, M. J dan E. C. S. Chan. (1986). Dasar- Dasar Mikrobiologi. Terjemahan: R. S.Hadioetomo, T. Imas, S. S. Tjitrosomo, dan S. L. Angka. Jakarta :Penerbit UI Press. Halaman 132-133.
Robinson, T. (1995). Kandungan Organik Tumbuhan Tinggi. ITB, Bandung, Indonesia. Halaman 191-193.
Rukmana, R.(2003). Usaha Tani Markisa. Yogyakarta: Kanisius. Halaman 21-23. Staf Pengajar FK Universitas Indonesia. (1993). Buku Ajar Mikrobiologi
Kedokteran. Jakarta: 18-20.
42
Supardi, I dan Sukamto. (1999). Mikrobiologi dalam Pengolahan dan Keamanan Pangan. Bandung : Penerbit Alumni. Hal. 138-141; 175-177; 182-184. Tim Mikrobiologi FK Brawijaya. (2003). Bakteriologi Medik. Cetakan Pertama.
Malang: Bayu Media Publishing. Halaman 201, 217.
Venn, R.F. (2008). Principles and Practices of Bioanalysis. Edisi kedua. Prancis: Taylor and Francis Group Ltd. Halaman 23-25.
Volk, W.A. (1992). Basic Microbiology. Edisi ketujuh. New York: Harper Collins Publishers. Halaman 45-46.
Volk, W.A., dan Wheeler, M.F. (1993). Mikrobiologi Dasar. Jilid I. Alih Bahasa: Markam. Jakarta: Erlangga. Halaman 33-40; 218-219.
17
METODE PENELITIAN
Penelitian dilakukan dengan metode eksperimental dengan meliputi pengumpulan sampel dan pembuatan simplisia, pemeriksaan karakteristik simplisia, skrining fitokimia, pembuatan ekstrak etanol kulit buah markisa dengan cara perkolasi kemudian difraksinasi berturut-turut dengan pelarut n-heksan dan etilasetat kemudian dilakukan pengujian aktivitas antibakteri terhadap bakteri Staphylococcus aureus dan Escherichia coli. Penelitian ini dilakukan di Laboratorium Mikrobiologi Fakultas Farmasi USU Medan dan Laboratorium Farmakognosi Fakultas Farmasi USU Medan pada bulan maret 2015 sampai mei 2015.
3.1 Alat dan Bahan 3.1.1 Alat
Alat- alat yang digunakan dalam penelitian ini adalah alat- alat gelas, alat tanur, autoklaf (Fisons), aluminium foil, blender (Philips), cakram kertas, cawan petri, inkubator (Fiber Scientific), jangka sorong, lampu bunsen, lemari pendingin (Toshiba), Laminar Air Flow Cabinet (Astec HLF I200L), oven (Memmert), pipet mikro (Eppendorf), pinset, rotary evaporator (Haake D), spektrofotometervisible (Dynamica Halo Vis-10) dan timbangan analitik (Mettler Toledo)
3.1.2 Bahan
18
anhidrida, asam klorida pekat, asam nitrat pekat, asam sulfat pekat, benzen, besi (III) klorida, bismut (III) nitrat, dimetil sulfoksida (DMSO), etanol, etilasetat, iodium, isopropanol, kalium iodida, kloroform,kristal natrium hidroksida, metanol n-heksan, natrium klorida, raksa (II) klorida, timbal (II) asetat, serbuk magnesium, kloralhidrat. Bakteri yang digunakan adalah bakteri Staphylococcus aureus ATCC 25923dan Escherichia coli ATCC 25922.
3.2. Penyiapan Bahan
Penyiapan bahan tumbuhan meliputi pengambilan bahan tumbuhan, identifikasi bahan tumbuhan dan pembuatan simplisia kulit buah markisa ungu (Passiflora edulis Sims).
3.2.1 Pengambilan bahan tanaman
Pengambilan bahan tumbuhan dilakukan secara purposif yaitu tanpa membandingkan dengan tumbuhan yang sama dari daerah lain. Bahan tumbuhan yang digunakan adalah kulit dari buah markisa ungu yang telah matang yang diperoleh dari Pasar Sei Kambing, Kecamatan Medan Petisah, Kota Madya Medan, Provinsi Sumatera Utara.
3.2.2 Identifikasi tanaman
Identifikasi bahan tumbuhan dilakukan di “Herbarium Bogoriense”, Pusat Penelitian dan Pengembangan Biologi-LIPI, Cibinong Bogor.
3.2.3 Pembuatan simplisia
19
cara diangin-anginkan terlebih dahulu, kemudian ditimbang berat basahnya dan dipotong menjadi ukuran yang lebih kecil lalu dikeringkan di dalam lemari pengering sampai simplisia menjadi kering . Simplisia kering kemudian diblender hingga menjadi serbuk dan disimpan dalam wadah plastik yang tertutup rapat.
3.3 Pembuatan Pereaksi 3.3.1 Pereaksi Mayer
Campurkan 60 ml larutan raksa(II) klorida P 2,266 % b/v dan 10 ml larutan kalium iodida P 50% b/v, tambahkan air secukupnya hingga 100 ml (Depkes RI, 1995).
3.3.2 Pereaksi Dragendorff
Campur 20 ml larutan bismut nitrat P 40% b/v dalam asam nitrat p dengan 50 ml larutan kalium iodida p 54,4 % b/v diamkan sampai memisah sempurna. Diambil larutan jernih dan encerkan dengan air secukupnya hingga 100 ml (Depkes RI, 1995)
3.3.3 Pereaksi Bouchardat
Larutkan 2 g iodium P dan 4 g kalium iodida P dalam air secukupnya hingga 100 ml (Depkes RI, 1995).
3.3.4 Pereaksi Molish
Larutan a naftol P 3% b/v dalam asan nitrat 0,5 N (Depkes RI, 1995). 3.3.5 Pereaksi Liebermann-Burchard
Campurkan 5 bagian volume asam sulfat P dengan 50 bagian Volume etanol 95% P. Tambahkan hati-hati 5 bagian volume asam asetat anhidrida ke dalam campuran tersebut, dinginkan (Depkes RI, 1995).
20
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling sampai 100 ml (Depkes RI, 1995).
3.3.7 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat P dilarutkan dalam air suling bebas CO2 hingga 100 ml (Depkes RI, 1995).
3.3.8 Pereaksi asam klorida 2 N
Larutan asam klorida P 7,293% b/v (Depkes RI, 1995). 3.3.9 Pereaksi natrium hidroksida 2 N
Sebanyak 8,001 g natrium hidroksida ditimbang, kemudian dilarutkan dalam air suling hingga 100 ml (Depkes RI, 1995).
3.3.10 Larutan asam sulfat 2 N
Larutan asam sulfat pekat sebanyak 9,8 ml ditambahan air suling sampai 100 ml (Depkes RI, 1995).
3.3.11 Larutan kloralhidrat
Sebanyak 50 g kristal kloralhidrat ditimbang lalu dilarutkan dalam 20 ml air suling (Depkes RI, 1995).
3.4 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total dan penetapan kadar abu yang tidak larut dalam asam.
21
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk, ukuran, bau, rasa dan warna dari kulit buah markisa ungu.
3.4.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia kulit buah markisa ungu. Serbuk simplisia ditaburkan diatas kaca objek yang telah ditetesi dengan kloralhidrat dan ditutup dengan kaca penutup, kemudian dilihat dibawah mikroskop, kemudian diamati bentuk-bentuk mikroskopis dari simplisia dengan berbagai pembesaran pada mikroskop.
3.4.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluena). Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml. Dalam labu yang berisi toluen jenuh tersebut dimasukkan 5 g serbuk simplisia yang telah ditimbang seksama, dipanaskan hati-hati selama 15 menit, setelah toluen mendidih, kecepatan tetesan diatur lebih kurang 2 tetes tiap detik, hingga sebagian air tersuling, kemudian naikkan kecepatan penyulingan hingga 4 tetes tiap detik, setelah semua air tersuling, bagian dalam pendingin dibilas dengan toluen. Penyulingan dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin sampai suhu kamar. Setelah air dan toluen memisah sempurna, volume dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa (WHO, 1998).
22
Sebanyak 5 g serbuk simplisia, dimaserasi selama 24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air suling sampai 1 liter) dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam, lalu disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah ditara dan sisa dipanaskan pada suhu 105oC sampai diperoleh bobot tetap. Kadar sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995). 3.4.5 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 g serbuk simplisia, dimaserasi selama 24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam, kemudian disaring cepat untuk menghindari penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC sampai diperoleh bobot tetap. Kadar sari yang larut dalam etanol 96% dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.4.6 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.4.7 Penetapan kadar abu tidak larut dalam asam
23
asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring, dipijarkan, kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.5 Skrining Fitokimia 3.5.1 Pemeriksaan alkaloida
Serbuk simplisia ditimbang 0,5 g kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan diatas penangas air selama 2 menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk uji alkaloida sebagai berikut:
a. Filtrat 3 tetes ditambah 2 tetes larutan pereaksi Mayer, maka akan terbentuk endapan menggumpal berwarna putih atau putih kekuningan.
b. Filtrat 3 tetes ditambah 2 tetes larutan pereaksi Bouchardat, maka akan terbentuk endapan berwarna coklat.
c. Filtrat 3 tetes ditambah 2 tetes larutan pereaksi Dragendorff, maka akan terbentuk endapan warna merah atau jingga.
Alkaloida positif jika endapan atau kekeruhan paling sedikit dua dari tiga percobaan diatas (Depkes RI, 1995).
3.5.2 Pemeriksaan flavonoida
24
jika terjadi warna merah atau kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.5.3 Pemeriksaan glikosida
Sebanyak 3 g serbuk simplisia ditimbang, lalu disari dengan 30 ml campuran dari 7 bagian etanol 95% dan 3 bagian air suling, kemudian direfluks selama 10 menit, didinginkan, lalu disaring. Diambil 20 ml filtrat, ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran 2 bagian isopropanol dan 3 bagian kloroform, perlakuan ini diulangi sebanyak 3 kali menghasilkan 2 lapisan. Dikumpulkan masing-masing sari (sari air dan sari pelarut organik). Sari pelarut organik dikumpulkan dan ditambahkan Na2SO4 anhidrat, disaring kemudian
diuapkan pada temperatur tidak lebih dari 50oC, sisanya dilarutkan dalam 2 ml metanol. Larutan sari air digunakan untuk percobaan berikut: sepersepuluh ml larutan percobaan dimasukkan dalam tabung reaksi, kemudian diuapkan di atas penangas air. Pada larutan ditambahkan 2 ml air dan 5 tetes larutan pereaksi Molish, lalu ditambahkan dengan hati-hati 2 ml asam sulfat pekat, terbentuk cincin ungu pada batas kedua cairan, menunjukkan adanya ikatan gula (glikon) (Depkes RI, 1995).
3.5.4 Pemeriksaan glikosida antrakinon
25 senyawa antrakinon (Depkes RI, 1995). 3.5.5 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1 %. Jika terjadi warna biru atau kehitaman menunjukkan adanya tanin (Farnsworth, 1966). 3.5.6 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukan ke dalam tabung reaksi, lalu ditambahkan 10 ml air panas, dinginkan kemudian dikocok kuat-kuat selama 10 detik. Jika terbentuk busa setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N menunjukan adanya saponin (Depkes RI, 1995).
3.5.7 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml eter selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan 20 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat (pereaksi Liebermann-Burchard), diteteskan pada saat akan mereaksikan sampel uji. Timbulnya warna biru atau biru hijau menunjukan adanya steroid, sedangkan warna merah, merah muda atau ungu menunjukkan adanya triterpenoid (Harborne, 1987).
3.6 Pembuatan Ekstrak
26
jam. Massa dipindahkan sedikit demi sedikit ke dalam perkolator sambil tiap kali ditekan dengan hati- hati, kemudian cairan penyari dituangkan secukupnya sampai cairan mulai menetes dan di atas simplisia masih terdapat selapis cairan penyari, perkolator ditutup dan dibiarkan 24 jam. Cairan dibiarkan menetes dengan kecepatan 1 ml tiap menit, cairan penyari ditambahkan berulang- ulang secukupnya dengan memasang botol cairan penyari diatas perkolator dan diatur kecepatan penetesan cairan penyari sama dengan kecepatan tetes perkolat, sehingga selalu terdapat selapis cairan penyari di atas simplisia. Perkolasi dihentikan jika 500 mg perkolat yang keluar terakhir diuapkan, tidak meninggalkan sisa.
Ekstrak yang diperoleh digabung dan disaring, lalu pelarut diuapkan pada tekanan rendah dengan suhu tidak lebih dari 40oC menggunakan Rotary evaporator, sehingga didapat ekstrak kental. Ekstrak kental yang diperoleh dikeringbekukan dengan freeze dryer (Ditjen POM, 1979).
3.6.1 Pembuatan fraksi n-heksan, fraksi etilasetat dan fraksi air
Sebanyak 10 g ekstrak etanol ditambahkan 10 ml aquadest lalu ditambahkan 40 ml n-heksan, dikocok dalam corong pisah dan dibiarkan sampai memisah, kemudian dipisahkan, selanjutnya difraksinasi kembali dengan menggunakan pelarut
n-heksan hingga diperoleh fraksi n-heksan yang jernih (tidak memberikan reaksi
positif dengan penambahan pereaksi Lieberman-Burchard), kemudian fraksi air ditambahkan 50 ml etilasetat, dikocok dan dibiarkan memisah. Lapisan etilasetat dipisahkan dan fraksinasi dilanjutkan sampai diperoleh fraksi etilasetat yang jernih (tidak memberikan hasil positif dengan penambahan pereaksi FeCl
3). Kumpulan hasil
27
rotary evaporato r pada temperatur ± 40°C sampai diperoleh ekstrak kental,
kemudian dikeringkan dengan freeze dryer pada suhu -40°C selama ± 24 jam.
3.7 Pembuatan Media 3.7.1 Media nutrient agar Komposisi:
− Lab-lemco powder 1 g
− Yeast extract 2g
− Peptone 5 g
− Sodium chloride 5 g
− Agar 15 g Cara Pembuatan:
Sebanyak 28 g media nutrient agar (NA) yang sudah jadi ditimbang, disuspensikan ke dalam air suling 1000 ml, lalu dipanaskan sampai larut sempurna. Media kemudian dimasukkan dalam labu dan disterilkan di dalam autoklaf pada suhu 121°C selama 15 menit (Oxoid, 1982).
3.7.2 Media nutrient broth Komposisi:
− Lab-lemco powder 1 g
− Yeast extract 2 g
− Peptone 5 g
− Sodium chloride 5 g Cara Pembuatan:
28
disuspensikan ke dalam air suling 1000 ml, lalu dipanaskan sampai larut sempurna. Media kemudian dimasukkan dalam labu dan disterilkan di dalam autoklaf pada suhu 121°C selama 15 menit (Oxoid, 1982).
3.8 Sterilisasi Alat
Alat-alat yang digunakan dalam uji aktivitas antibakteri ini, disterilkan terlebih dahulu sebelum dipakai. Alat-alat gelas disterilkan di dalam oven pada suhu 170°C selama 1 jam. Media disterilkan di autoklaf pada suhu 121°C selama 15 menit. Jarum ose dan pinset dipijar dengan lampu Bunsen (Lay,1994).
3.9 Pembuatan Stok Kultur Bakteri
Koloni bakteri diambil dengan menggunakan jarum ose steril, lalu ditanam pada media nutrient agar miring dengan cara menggores, kemudian diinkubasi dalam inkubator pada suhu 36-37°C selama 18-24 jam (Ditjen POM, 1995).
3.10 Penyiapan Inokulum Bakteri
Koloni bakteri diambil dari stok kultur dengan jarum ose steril lalu disuspensikan dalam tabung reaksi yang berisi 10 ml media nutrient broth, kemudian diukur kekeruhan larutan pada panjang gelombang 580 nm sampai diperoleh transmitan 25% yang setara dengan 106 CFU (Colony Forming Units) (Ditjen POM, 1995).
3.11 Pembuatan Larutan Uji Ekstrak Etanol Kulit Buah Markisa Ungu Dengan Berbagai Konsentrasi
29
diperoleh konsentrasi ekstrak 500 mg/ml. Selanjutnya dibuat pengenceran sampai diperoleh ekstrak dengan konsentrasi 400 mg/ml, 300 mg/ml, 200 mg/ml, 100 mg/ml , 75 mg/ml, 50 mg/ml, 25 mg/ml, 12,5 mg/ml dan 6,25 mg/ml.
3.12 Metode Pengujian Efek Antibakteri Secara In Vitro
30 BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Pusat Penelitian Biologi- LIPI Bogor, menunjukkan bahwa tumbuhan yang diteliti adalah Passiflora edulis Sims, suku Passifloraceae.
4.2 Hasil Pemeriksaan Karakterisasi Simplisia
Hasil pemeriksaan makroskopik simplisia kulit buah markisa ungu yaitu berwarna coklat ungu kehitaman, berbau khas, dan rasa pahit disertai kelat. Hasil pemeriksaan mikroskopik serbuk simplisia menunjukan adanya berkas pembuluh, jaringan parenkim, sel batu dan serabut sklerenkim. Hasil pemeriksaan dapat dilihat pada Lampiran 3, halaman 46.
[image:44.595.114.512.525.624.2]Hasil pemeriksaan karakterisasi serbuk simplisia kulit buah markisa ungu dapat dilihat pada Tabel 4.1.
Tabel 4.1 Hasil pemeriksaan karakterisasi serbuk kulit buah markisa ungu
No. Parameter Hasil (%)
1. Kadar air 8,64
2. Kadar sari larut air 31,69
3. Kadar sari larut etanol 13,02
4. Kadar abu total 7,89
5. Kadar abu tidak larut asam 0,816
31
penetapan kadar air diperoleh kurang dari 10% adalah 8,64%. Kadar air yang melebihi 10% dapat menjadi media yang baik untuk pertumbuhan mikroba, keberadaan jamur atau serangga, sehingga mutu simplisia menurun (WHO, 1998).
Penetapan kadar sari simplisia kulit buah markisa ungu dilakukan menggunakan dua pelarut, yaitu air dan etanol. Penetapan kadar sari larut air adalah untuk mengetahui kadar senyawa kimia bersifat polar yang terkandung di dalam simplisia, sedangkan kadar sari larut dalam etanol dilakukan untuk mengetahui kadar senyawa larut dalam etanol, baik senyawa polar maupun senyawa non polar. Hasil penetapan kadar sari kulit buah markisa ungu menunjukkan kadar sari yang larut dalam air sebesar 31,69%, sedangkan kadar sari yang larut dalam etanol sebesar 13,02%.
Penetapan kadar abu total dilakukan untuk mengetahui kadar senyawa anorganik dalam simplisia misalnya Mg, Ca, Na dan Pb, sedangkan penetapan kadar abu tidak larut dalam asam untuk mengetahui kadar senyawa yang tidak larut dalam asam misalnya silika. Penetapan kadar abu pada simplisia kulit buah markisa ungu menunjukkan kadar abu total sebesar 7,89% dan kadar abu tidak larut dalam asam sebesar 0,816%.
32 4.3. Hasil Ekstraksi dan Fraksinasi
Hasil ekstraksi 500 g simplisia kulit buah markisa ungu dengan cara perkolasi menggunakan pelarut etanol 96% diperoleh ekstrak etanol kulit buah markisa ungu sebanyak 72,0315 g. Kemudian dilakukan ekstraksi cair-cair menggunakan pelarut heksan dan air, dari 30 g ekstrak diperoleh fraksi n-heksan 4,1354 g, selanjutnya fraksi sisa di fraksinasi dengan etilasetat sehingga diperoleh fraksi etilasetat 5,5132 g dan fraksi sisa di peroleh sebanyak 17,3514 g. Ekstrak etanol, fraksi n-heksan, fraksi etilasetat dan fraksi sisa yang diperoleh, dilakukan skrining fitokimia dan kemudian diuji aktivitas antibakteri terhadap bakteri Staphylococcus aureus dan Escherichia coli. Bagan kerja ekstraksi dan fraksinasi dapat dilihat pada lampiran 5 dan 6, halaman 52 dan 53.
4.4 Hasil Skrining Fitokimia
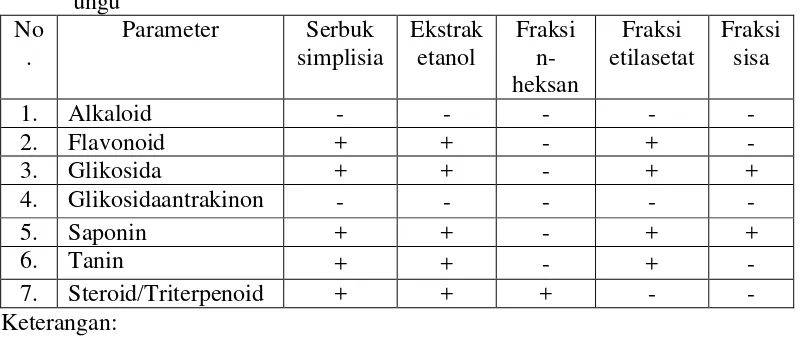
[image:46.595.113.514.529.698.2]Hasil skrining fitokimia serbuk simplisia, ekstrak etanol, fraksi n-heksan fraksi etilasetat dan fraksi sisa kulit buah markisa ungu dapat dilihat pada Tabel 4.2 di bawah ini
Tabel 4.2 Hasil skrining fitokimia serbuk simplisia dan ekstrak kulit buah markisa ungu
No .
Parameter Serbuk simplisia Ekstrak etanol Fraksi n-heksan Fraksi etilasetat Fraksi sisa
1. Alkaloid - - - - -
2. Flavonoid + + - + -
3. Glikosida + + - + +
4. Glikosidaantrakinon - - - - -
5. Saponin + + - + +
6. Tanin + + - + -
7. Steroid/Triterpenoid + + + - -
Keterangan:
33
Hasil skrining fitokimia kulit buah markisa ungu berupa serbuk simplisia dan ekstrak etanol menunjukkan hasil postitif pada senyawa yaitu flavonoid, glikosida, saponin, tanin dan triterpenoid. Fraksi n-heksan hanya menunjukkan hasil positif terhadap senyawa non polar yaitu triterpenoid. Pada fraksi etilasetat mengandung senyawaseperti flavonoid, glikosida, saponin dan tanin, sedangkan pada fraksi sisa tersisa senyawa glikosida dan saponin.
Senyawa flavonoida, saponin dan steroida/triterpenoid merupakan senyawa kimia yang memiliki potensi sebagai antibakteri dan antivirus (Robinson,1995). Senyawa yang bersifat antibakteri bekerja menghambat pertumbuhan bakteri melalui berbagai cara perusakan pada bagian-bagian pada anatomi bakteri. Senyawa fenol dan turunannya (flavonoid) merupakan salah satu antibakteri yang bekerja dengan mengganggu fungsi membran sitoplasma(Harborne, 1987). Saponin menurunkan tegangan permukaan sehingga mengakibatkan naiknya permeabilitas atau kebocoran sel(Robinson, 1995). Steroid/triterpenoid juga memiliki potensi sebagai senyawa antibakteri, yaitu dengan mekanisme penghambatan terhadap sintesis protein (Siregar, dkk., 2012).
4.5 Hasil Uji Aktivitas Antibakteri Ekstrak Etanol , Fraksi n-heksan , Fraksi Etilasetat dan Fraksi sisa Kulit Buah Markisa Ungu
Aktivitas suatu zat antimikroba dalam menghambat pertumbuhan atau membunuh mikroorganisme tergantung pada konsentrasi dan jenis bahan antimikroba tersebut (Tim Mikrobiologi FK Brawijaya, 2003).
34
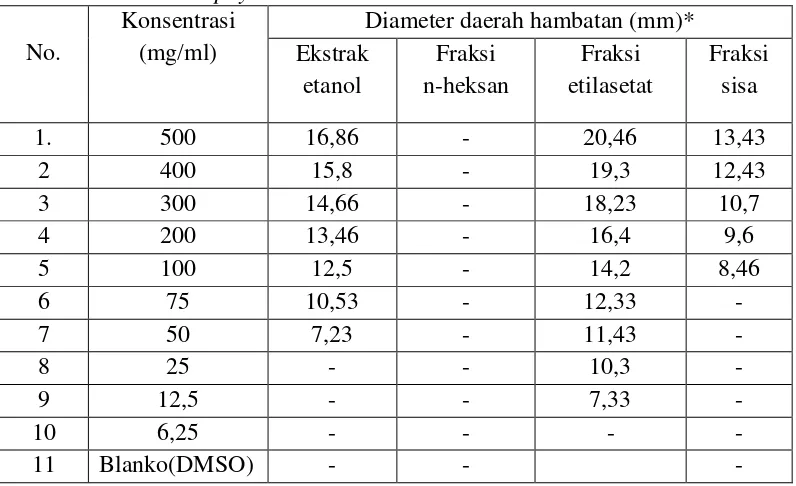
Tabel 4.3 Hasil pengukuran diameter rata-rata daerah hambatan pertumbuhan bakteri Staphylococcus aureus
No.
Konsentrasi (mg/ml)
Diameter daerah hambatan (mm)* Ekstrak etanol Fraksi n-heksan Fraksi etilasetat Fraksi sisa
1. 500 16,86 - 20,46 13,43
2 400 15,8 - 19,3 12,43
3 300 14,66 - 18,23 10,7
4 200 13,46 - 16,4 9,6
5 100 12,5 - 14,2 8,46
6 75 10,53 - 12,33 -
7 50 7,23 - 11,43 -
8 25 - - 10,3 -
9 12,5 - - 7,33 -
10 6,25 - - - -
11 Blanko(DMSO) - - -
Tabel 4.4 Hasil pengukuran diameter rata-rata daerah hambatan pertumbuhan bakteri Escherichia coli
No. Konsentrasi (mg/ml)
Diameter daerah hambatan (mm)* Ekstrak
etanol
Fraksi n-Heksan
Fraksi etilasetat
Fraksi sisa
1. 500 16,7 - 20,43 12,33
2 400 15,66 - 19,53 11,53
3 300 14,5 - 18,43 10,36
4 200 13,5 - 16,86 9,2
5 100 12,43 - 14,23 -
6 75 10,36 - 12,36 -
7 50 8,43 - 11,03 -
8 25 - - 9,5 -
9 12,5 - - 7,26 -
10 6,25 - - - -
11 Blanko(DMSO) - - - -
Keterangan :
(mm*) = Diameter rata- rata daerah hambatan pertumbuhan bakteri tiga kali pengulangan
[image:48.595.114.512.110.353.2]35
Berdasarkan pada hasil pengukuran yang terlihat pada tabel, bahwa konsentrasi ekstrak yang dapat memenuhi persyaratan yang ditetapkan oleh Ditjen POM (1995), adalah konsentrasi ekstrak dengan batas daerah hambatan yang efektif lebih kurang 14 - 16 mm.Berdasarkan hasil pengukuran diameter daerah hambatan memperlihatkan bahwa fraksi etilasetat kulit buah markisa ungu memberikan aktivitas antibakteri yang terkuat dalam menghambat pertumbuhan Staphylococcus aureus yaitupada konsentrasi 100 mg/ml dengan diameter hambat efektif 14,2 mmdan KHM pada konsentrasi 12,5 mg/ml dengan diameter hambat 7,33 mm. Fraksi etilasetat terhadap bakteri Escherichia coli memberikan aktivitas antibakteri pada konsentrasi 100 mg/ml dengan diameter hambat efektif 14,23 mm dan KHM pada konsentrasi 12,5 mg/ml dengan diameter hambat 7,26.
Hasil pengujian aktivitas antibakteri ekstrak etanol memberikan hasil efektif terhadap bakteri Staphylococcus aureus dan Escherichia coli pada konsentrasi 300 mg/ml dengan nilai masing masing diameter hambat efektif adalah 14,66 mm dan 14,5 mm. KHM ekstrak etanol terhadap bakteri Staphylococcus aureus dan Escherichia coli pada kosentrasi 50 mg/ml dengan masing-masing diameter hambat 7,23 mm dan 8,43 mm.
36
bakteri Staphylococcus aureus pada konsentrasi 100 mg/ml dengan diameter hambat 8,46 mm sedangkan Escherichia colipada konsentrasi 200 mg/ml dengan dimeter hambat 9,2 mm. Fraksi n-heksan tidak menunjukkan aktivitas antibakteri pada konsentrasi tertinggi 500 mg/ml.
Aktivitas antibakteri yang didapatkan dari fraksi etilasetat merupakan aktivitas antibakteri terkuat dalam menghambat pertumbuhan bakteri Staphylococcus aureus danEscherichia coli. Hal ini dikarenakan kandungan senyawa metabolit sekunder yang terdapat dalam fraksi etilasetat kulit buah markisa ungu adalah senyawa yang memiliki aktivitas antibakteri yang kuat yaitu glikosida, flavonoid, tanin dan saponin.
Tanin adalah senyawa fenol yang tersebar luas pada tumbuhan berpembuluh. Senyawa fenol dan turunannya (flavonoid) merupakan salah satu antibakteri yang bekerja dengan mengganggu fungsi membran sitoplasma. Pada konsentrasi rendah dapat merusak membran sitoplasma yang menyebabkan bocornya metabolit penting yang menginaktifkan sistem enzim bakteri, sedangkan pada konsentrasi tinggi mampu merusak membran sitoplasma dan mengendapkan protein sel (Harborne, 1987; Volk dan Wheller, 1993).
Saponin digunakan sebagai antimikroba pada beberapa tahun terakhir. Mekanisme kerja saponin sebagai antibakteri adalah menurunkan tegangan permukaan sehingga mengakibatkan naiknya permeabilitas atau kebocoran sel dan mengakibatkan senyawa intraseluler akan keluar (Robinson, 1995).
37
banyak dibandingkan dengan fraksi etilasetat namun menghasilkan zona hambatan yang lebih kecil dibandingkan dengan zona hambatan fraksi etilasetat. Menurut Marliana (2011), hal ini mungkin disebabkan karena adanya kerja yang tidak sinergis antara senyawa metabolit sekunder dalam ekstrak etanol dalam peranannya sebagai antibakteri. Hal tersebut juga dapat disebabkan oleh kuantitas dari senyawa metabolit sekunder yang bersifat antibakteri kuat di dalam ektrak etanol lebih sedikit dibandingkan fraksi etilasetat.
Hasil uji aktivitas antibakteri fraksi sisa lebih rendah dibandingan fraksi etilasetat dan ektrak etanol. Hal ini disebabkan oleh kandungan senyawa yang terdapat dalam fraksi sisa yang merupakan fraksi sisa sangat sedikit karena senyawa metabolit sekunder yang memiliki aktivitas antibakteri kuat telah ditarik oleh pelarut etilasetat sehingga hanya tersisa beberapa senyawa metabolit sekunder dengan kuantitas yang sedikit.
Hasil uji aktivitas antibakteri fraksi n-heksan tidak menunjukan aktivitas anati bakteri terhadap bakteri Staphylococcus aureus,danEscherichia coli. Hal ini disebabkan karena dari hasil skrining fitokimia fraksi n-heksan hanya memiliki senyawa steroid/triterpenoid, walaupun steroid/triterpenoid memiliki sifat antibakteri namun jumlahnya tidak mencukupi untuk menghasilkan daya antibakteri sehingga pada pengujian antibakteri tidak memberikan hasil.
38
39 BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang dilakukan terhadap kulit buah markisa ungu (Passiflora edulis Sims) di peroleh kesimpulan :
1. Hasil karakterisasi simplisia kulit buah markisa ungu diperoleh kadar air 8,64%, kadar sari larut air 31,69%, kadar sari larut etanol 13,02%, kadar abu total 7,89% dan kadar abu tidak larut dalam asam 0,816%.
2. Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol menunjukkan hasil positif pada kandungan flavonoid, glikosida, saponin, tanin dan steroid/triterpenoid. Fraksi n-heksan hanya mengandung steroid/triterpenoid saja dan pada fraksi etilasetat mengandung flavonoid, glikosida, saponin dan tanin. Sedangkan pada fraksi sisa mengandung glikosida dan saponin.
3. Ekstrak etanol, fraksi etilasetat dan fraksi sisa kulit buah markisa ungu (Passiflora edulis Sims) memberikan aktivitas antibakteri terhadap bakteri Staphylococcus aureus dan Escherichia coli, sedangkan fraksi n-heksan tidak menunjukkan aktivitas antibakteri.
5.2 Saran
5 BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tanaman 2.1.1 Morfologi tanaman
Tanaman markisa merupakan tumbuhan semak yang hidup menahun dan bersifat merambat hingga sepanjang 20 m atau lebih. Batang Tanaman sedikit berkayu, bersulur dan memiliki bayak percabangan yang terkadang tumbuh tumpang tindih. Pada tanaman muda, cabang berwarna hijau dan setelah tua menjadi hijau kecoklatan. Daun tanaman sangat rimbun tumbuh secara bergantian pada batang atau cabang. Bentuk daun menjari, bergerigi, berwarna hijau, mengkilap dengan panjang tangkai 2-3 cm, panjang daun 9-12 cm dan lebar 7-9 cm (Rukmana, 2003).
6
buah (juice) yang masam manis dan beraroma harum semerbak.(Hermanto, dkk., 2013).
2.1.2 Habitat
Markisa ungu adalah tanaman yang berasal dari Brazil bagian selatan yaitu dari Paraguay hingga Argentina bagian utara. Di Indonesia, markisa ungu di tanam didaerah dataran tinggi tropis dan didaerah subtropis pada ketinggian 700 sampai 2000 m diatas permukaan laut dengan suhu 18 sampai 25oC. Daerah penghasil markisa ungu masih terpusat di beberapa kabupaten di provinsi Sumatera Utara (Kabupaten Karo, Simalungun, Dairi, Tapanuli Utara) dan provinsi Sulawesi Selatan(Kabupaten Gowa, Sinjai, Tator, Enrekang Dan Polmas) (Karsinah, dkk., 2010).
2.1.3 Sistematika tanaman
Menurut Depkes RI (1999), sistematika tanaman markisa ungu sebagai berikut:
Kindom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledoneae Bangsa : Malpighiales Suku : Passifloraceae Marga : Passiflora
Jenis : Passiflora edulis Sims. 2.1.4 Nama asing
7
passievrucht (Belanda), dan buah susu (Malaysia) (Rukmana, 2003). 2.1.5 Nama daerah
Tanaman markisa ungu di Indonesia memiliki berbagai macam nama daerah seperti buah monyet (Sunda), markisah (melayu), dan buwah negri (jawa) dan areuypasi (jawa) (Depkes RI, 1999).
2.1.6 Manfaat markisa ungu
Markisa banyak mengandung fitokimia yang mampu membunuh sel kanker, kaya vitamin B dan potassium. Markisa berkhasiat menyembuhkan gejala alergi kronis, memulihkan penyakit liver dan ginjal, meningkatkan kekebalan tubuh dan kekuatan antibodi dalam darah. Markisa juga mampu menyaring, memisahkan, dan membuang racun dari dalam tubuh. Markisa juga dapat meningkatkan kesegaran kulit tubuh dan merangsang pertumbuhan sel muda pada kulit wajah. Markisa mengandung vitamin C dosis tinggi dan antioksidan (Hermanto, dkk., 2013).
2.1.7 Kandungan kimia
Markisa ungu mengandung berbagai macam senyawa metabolit sekunder. Daun markisa ungu mengandung tanin, glikosida, flavonoid, saponin dan alkaloid. Batang tanaman markisa ungu mengandung glikosida, flavonoid, saponin dan alkaloid. Buah mengandung tanin, glikosida, flavonoid dan alkaloid (Akanbi, dkk., 2011).
2.2 Ekstraksi
8
pemilihan pelarut dengan cara ekstraksi yang tepat (Ditjen POM, 1995). Ekstrak adalah sediaan kering, kental atau cair dibuat dengan menyari simplisia nabati atau hewani menurut cara dan pelarut yang cocok, di luar pengaruh cahaya matahari langsung (Ditjen POM, 1979).
Menurut Ditjen POM (2000), beberapa metode ekstraksi dengan menggunakan pelarut yaitu:
a. Cara dingin
1. Maserasi adalah proses penyarian simplisia dengan cara perendaman menggunakan pelarut dengan sesekali pengadukan pada suhu kamar. Penambahan pelarut setelah dilakukan penyaringan terhadap maserat pertama dan seterusnya disebut remaserasi.
2. Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap pengembangan bahan, tahap maserasi antara dan tahap perkolasi sebenarnya (penetesan/ penampungan ekstrak). b. Cara panas
1. Refluks adalah proses penyarian simplisia dengan menggunakan alat pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
2. Digesti adalah proses penyarian dengan pengadukan kontinu pada temperatur lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada temperatur 40-50oC.
9
dengan pelarut relatif konstan dengan adanya pendingin balik.
4. Infudansi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90oC selama 15 menit.
5. Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90oC selama 30 menit.
2.3 Fraksinasi (Ekstraksi Cair-Cair)
Proses pemisahan selanjutnya masih menggunakan prinsip ekstraksi yang dikenal dengan ekstraksi cair-cair atau yang biasa dikenal dengan nama fraksinasi. Fraksinasi adalah suatu metode pemisahan senyawa organik berdasarkan kelarutan senyawa-senyawa tersebut dalam dua pelarut yang tidak saling bercampur, biasanya antara pelarut air dan pelarut organik (Dey, 2012).
Teknik pemisahan ekstraksi cair-cair ini biasanya dilakukan dengan menggunakan corong pisah. Kedua pelarut yang saling tidak bercampur tersebut dimasukkan ke dalam corong pisah, kemudian digojok dan didiamkan. Solut atau senyawa organik akan terdistribusi ke dalam fasenya masing-masing bergantung pada kelarutannya terhadap fase tersebut dan kemudian akan terbentuk dua lapisan, yaitu lapisan atas dan lapisan bawah yang dapat dipisahkan dengan membuka kunci pipa corong pisah (Odugbemi, 2008).
10
semipolar seperti etilasetat atau diklorometana (Venn, 2008).
Aglikon pada umumnya terekstraksi pada fraksi non-polar seperti terpenoid dan steroid sedangkan flavonoid, glikosida, saponin dan gula ester ditemukan pada fraksi yang lebih polar dan fraksi air. Petroleum eter dan n -heksana juga dapat digunakan untuk menghilangkan lipid, wax dan senyawa lemak (Dey, 2012).
Pelarut yang dapat digunakan untuk ekstraksi ini cukup banyak, namun ternyata ada banyak pelarut yang tidak memenuhi syarat. Pertama, pelarut harus tidak bercampur dengan air, mempunyai titik didih yang rendah (jika digunakan untuk evaporasi) dan sebaiknya memiliki densitas yang lebih rendah daripada air (untuk membentuk lapisan atas sehingga pemisahan lebih mudah dilakukan). Kedua, pelarut harus aman dan tidak merusak lingkungan jika digunakanPraktisnya, hanya ada beberapa pelarut saja yang biasa digunakan seperti n-heksana, metil tertier butil eter (MTBE) dan etilasetat (Venn, 2008).
2.4 Bakteri
2.4.1 Uraian umum
Nama bakteri berasal dari kata “bakterion” bahasa Yunani yang berarti tongkat atau batang, sekarang nama itu dipakai untuk menyebut sekelompok mikroorganisme yang bersel satu, berbiak dengan pembelahan diri serta demikian kecilnya sehingga hanya tampak dengan mikroskop (Dwidjoseputro, 1978).
Pertumbuhan dan perkembangan bakteri dipengaruhi oleh : 1. Zat makanan (nutrisi)
11
dan kobalt), vitamin dan air untuk fungsi metabolik dan pertumbuhannya (Pelczar, dkk.,1986).
2. Keasaman dan kebasaan (pH)
Kebanyakan bakteri patogen mempunyai pH optimum pertumbuhan antara 7,2-7,6 (Staf Pengajar FK Universitas Indonesia, 1993).
3. Temperatur
Proses pertumbuhan bakteri tergantung pada reaksi kimiawi dan laju reaksi kimia yang dipengaruhi oleh temperatur. Berdasarkan ini maka bakteri dapat diklasifikasikan sebagai berikut:
a. Bakteri psikofil, yaitu bakteri yang dapat hidup pada temperatur 0-30oC, dengan temperatur optimum umtuk pertumbuhannya adalah 10-20 oC.
b. Bakteri mesofil, yaitu bakteri yang dapat hidup pada temperatur 5-60 oC, temperatur optimum adalah 25-40 oC.
c. Bakteri termofil, yaitu bakteri yang dapat hidup pada temperatur optimum adalah 55-65 oC (Pelczar, dkk.,1986).
4. Oksigen
Pembagian bakteri berdasarkan kebutuhan oksigen adalah:
a. Aerobik, yaitubakteri yangmembutuhkan oksigen dalam pertumbuhannya. b. Anaerobik, yaitu bakteri yang dapat tumbuh tanpa oksigen.
c. Anaerobik fakultatif, yaitu bakteri yang dapat tumbuh dengan oksigen ataupun tanpa oksigen.
d. Mikroaerofilik, yaitu bakteri yang dapat tumbuh baik dengan adanya sedikit oksigen (Staf Pengajar FK Universitas Indonesia, 1993).
12
Medium yang baik bagi pertumbuhan bakteri adalah medium isotonis terhadap isi sel bakteri (Pelczar,dkk.,1986).
6. Kelembapan
Secara umum bakteri tumbuh dan berkembang biak dengan baik pada lingkungan yang lembap. Kebutuhan akan air tergantung dari jenis bakterinya (Pelczar, dkk.,1986).
2.4.2 Staphylococcus aureus
Staphylococcus aureus termasuk dalam suku Micrococcaceae, merupakan bakteri gram positif, berbentuk bulat (kokus) dengan diameter sekitar 1 μm, tidak membentuk spora dan termasuk anaerob fakultatif. Staphylococcus aureus adalah bakteri mesofil dengan suhu pertumbuhan optimum 37oC. Staphylococcus aureushidup sebagai saprofit di dalam saluran-saluran pengeluaran lendir dari tubuh manusia dan hewan seperti hidung, mulut,.Keracunan makanan oleh enterotoksin Staphylococcus aureus dapat menimbulkan berbagai gejala. Gejala-gejala tersebut yaitu meliputi muntah, diare, mual, kejang dan serta sakit kepala. (Supardi dan Sukamto, 1999).
Menurut Holt (1988), sistematika dari Staphylococcus aureus yaitu: Divisi : Schizophyta
Kelas : Schizomycetes Ordo :Eubacteriales Suku : Micrococcaceae Genus : Staphylococcus
13
Bakteri Escherichia coli umumnya merupakan flora normal saluran pencernaan tubuh manusia dan hewan. Escherichia coli merupakan bakteri gram negatif berbentuk batang, tidak berkapsul, umumnya mempunyai fimbria dan bersifat motile. Sel Escherichia coli mempunyai ukuran panjang 2,0-6,0 μm dan lebar 1,1-1,5 μm, tersusun tunggal, berpasangan dengan flagella peritikus (Supardi dan Sukamto, 1999).
Escherichia coli dapat memproduksi enterotoksin. Organ sasaran enterotoksin Escherichia coli adalah usus kecil dan hasilnya berupa diare sebagai akibat dari pengeluaran cairan dan elektrolit (Tim Mikrobiologi FK Brawijaya, 2003).
Menurut Holt (1988) sistematika dari Escherichia coli adalah sebagai berikut:
Divisi : Schizophyta Kelas : Schizomycetes Ordo :Eubacteriales Suku : Enterobacteriaceae Genus : Escherichia
Spesies : Escherichia coli
2.5 Morfologi Bakteri
Berdasarkan morfologinya bakteri dapat dibedakan atas tiga bagian yaitu: a. Bentuk basil
14
- Monobasil yaitu basil yang terlepas satu sama lain dengan kedua ujung tumpul. - Diplobasil yaitu basil yang bergandeng dua dan kedua ujungnya tumpul.
- Streptobasil yaitu basil yang bergandengan panjang dengan kedua ujung tajam. Adapun contoh bakteri dengan bentuk basil yaitu Eschericia coli, Bacillus anthracis, Salmonella typhimurium, Shigella dysentriae (Pelczar, dkk.,1986). b. Bentuk kokus
Kokus adalah bakteri yang bentuknya seperti bola-bola kecil, ada yang hidup sendiri dan ada yang berpasang-pasangan. Bentuk kokus ini dapat dibedakan atas:
- Diplokokus yaitu kokus yang bergandeng dua. - Tetrakokus yaitu kokus yang mengelompok empat.
- Stafilokokus yaitu kokus yang mengelompok dan membentuk anggur. - Streptokokus yaitu kokus yang bergandengan panjang menyerupai rantai. - Sarsina yaitu kokus yang mengelompok seperti kubus.
Contoh bakteri dengan bentuk kokus yaitu Staphylococcus aureus, Sarcina luten, Diplococcus pneumoniae, Streptococcus lactis (Volk dan Wheeler, 1993).
c. Bentuk spiral
Bakteri dalam bentuk spiral apat dibedakan sebagai berikut: - Spiral yaitu menyerupai spiral atau lilitan.
- Vibrio yaitu bentuk batang yang melengkung berupa koma.
15
Ada empat macam fase pertumbuhan mikroorganisme, yaitu fase lag, fase log (fase esksponensial), fase stasioner dan fase kematian.
- Fase lag
Fase lag merupakan fase adaptasi, yaitu fase penyesuaian mikroorganisme pada suatu lingkungan baru. Waktu penyesuaian ini umumnya berlangsung selama 2 jam. Kuman belum berkembang biak dalam fase ini, tetapi aktivitas metabolismenya sangat tinggi. Fase ini
merupakan persiapan untuk fase berikutnya (Staf Pengajar FK Universitas Indonesia, 1993).
- Fase log (fase esksponensial)
Fase ini merupakan fase dimana mikroorganisme tumbuh dan membelah pada kecepatan maksimum, tergantung pada genetika mikroorganisme, sifat media, dan kondisi pertumbuhan. Sel baru terbentuk dengan laju konstan dan massa yang bertambah secara eksponensial. Hal yang dapat menghambat laju pertumbuhan adalah bila satu atau lebih nutrisi dalam kultur habis, sehingga hasil metabolisme yang bersifat racun akan tertimbun dan menghambat pertumbuhan bakteri. Hasil metabolisme bakteri yang bersifat racun dapat menganggu pewrtumbuhan bakteri (Pratiwi, 2008).
- Fase stationer
Pada fase ini kuman mulai ada yang mati dan pembelahan pun terhambat seiring dengan meningkatnya jumlah kuman, meningkat juga jumlah hasil metabolisme yang toksis. Pada suatu saat terjadi jumlah kuman yang hidup tetap sama (Staf Pengajar FK Universitas Indonesia, 1993).
16
Pada fase ini jumlah sel yang mati meningkat. Konsentrasi produk buangan yang bersifat toksis meningkat dan ketersediaan makanan untuk bakteri menurun. Jumlah bakteri yang mati meningkat dengan cepat. (Engelkirk, 2010).
2.7 Pengukuran Aktivitas Antibakteri
Penentuan kepekaan bakteri terhadap antibakteri tertentu dapat dilakukan dengan salah satu dari dua metode pokok yaitu metode dilusi dan metode difusi. a. Metode Dilusi
Metode ini digunakan untuk mengukur kadar hambat minimum (KHM) dan kadar bunuh minimum (KBM). Cara yang dilakukan yaitu dengan membuat seri pengenceran agen antimikroba pada media yang telah ditambahkan dengan mikroba uji. Larutan uji agen antimkroba pada kadar terkecil yang terlihat jernih tanpa adanya pertumbuhan mikroba uji ditetapkan sebagai KHM. Larutan yang ditetapkan sebagai KHM tersebut selanjutnya dikultur ulang pada media tanpa penambahan mikroba uji ataupun agen antimikroba, dan diinkubasi selama 18-24 jam. Media yang tetap terlihat jernih ditetapkan sebagai KBM (Pratiwi, 2008). b. Metode Difusi Agar
Metode yang paling sering digunakan yaitu metode difusi agar. Obat dengan jumlah tertentu ditempatkan pada permukaan media padat yang sebelumnya telah diinokulasi bakteri uji pada permukaannya dan kemudian diinkubasi. Diameter zona hambatan sekitar pencadang digunakan untuk mengukur kekuatan hambatan obat terhadap organisme uji. Metode ini dipengaruhi oleh beberapa faktor fisika dan kimia, misalnya sifat medium, kemampuan difusi, ukuran molekular dan stabilitas obat (Jawetz, dkk., 2001).
1 BAB I PENDAHULUAN
1.1 Latar Belakang
Indonesia sebagai negara tropis memiliki beraneka ragam tumbuhan yang dapat dimanfaatkan sebanyak-banyaknya untuk kepentingan manusia. Masyarakat Indonesia mengenal dan menggunakan tumbuhan berkhasiat obat sebagai salah satu upaya untuk menanggulangi berbagai masalah kesehatan, jauh sebelum pelayanan kesehatan formal dan obat-obatan modern menyentuh lapisan masyarakat. Penggunaan obat tradisional di Indonesia merupakan bagian dari budaya bangsa dan banyak dimanfaatkan oleh masyarakat, namun demikian pada umumnya efektivitas dan keamanannya belum sepenuhnya didukung oleh penelitian. Sumber daya alam bahan obat dan obat tradisional merupakan aset nasional yang perlu digali, diteliti, dikembangkan dan dioptimalkan pemanfaatannya (Mursito, 2001).
2
Markisa ungu mengandung berbagai macam senyawa metabolit sekunder. Daun markisa ungu mengandung semyawa glikosida, tanin, flavonoid, saponin dan alkaloid. Batang tanaman markisa ungu mengandung glikosida, flavonoid, saponin dan alkaloid, sedangkan buah mengandung glikosida, tanin, flavonoid dan alkaloid (Akanbi, dkk., 2011). Menurut Robinson (1995), senyawa saponin, flavonoid, tanin dan alkaloid memiliki aktivitas sebagai antibakteri. Beberapa senyawa antibakteri tersebut terdapat di dalam tanaman markisa ungu (Passiflora edulis Sims). Pada penelitian sebelumnya, ekstrak metanol daun tanaman markisa ungu memiliki aktivitas antibakteri terhadap beberapa bakteri seperti Staphylococcus aureus, Staphylococcus faecalis, Bacillus subtilis, Escherichia
coli, Proteus vulgaris dan Salmonella typhi (Kannan, dkk., 2010).
Sumatera Utara merupakan salah satu daerah sentral produksi markisa ungu (Passiflora edulis Sims) di Indonesia (Karsinah, dkk., 2010). Pengolahan buah markisa menjadi produk minuman (sari markisa) menghasilkan kulit buah markisa yang belum dimanfaatkan. Pemanfaatan kulit buah markisa ungu (Passiflora edulis Sims) perlu dikaji agar dapat berguna antara lain sebagai bahan baku sediaan obat antibakteri.
3
dkk., 2001). Bakteri Escherichia coli merupakan bakteri normal yang terdapat pada usus besar. Bakteri ini masuk ke dalam usus halus akan bersifat patogen dan dapat menyebabkan diare .(Tim Mikrobiologi FK Brawijaya, 2003).
Penelitian ini meliputi pemeriksaan karakterisasi simplisia, skrining fitokimia dan menguji aktivitas antibakteri dari ekstrak etanol dan fraksi-fraksi kulit buah markisa ungu (Passiflora edulis Sims) terhadap bakteri Gram positif Staphylococcus aureus dan bakteri Gram negatif Escherichia coli.
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas dapat dirumuskan permasalahan sebagai berikut :
1. Bagaimana karakteristik dari simplisia kulit buah markisa ungu (Passiflora edulis Sims) ?
2. Golongan senyawa kimia apa yang terdapat pada simplisia, ekstrak etanol dan fraksi kulit buah markisa ungu (Passiflora edulis Sims) ?
3. Apakah ekstrak etanol, fraksi n-heksan, fraksi etilasetat dan fraksi air dari kulit buah markisa ungu (Passiflora edulis Sims) mempunyai aktivitas antibakteri terhadap bakteri Staphylococcus aureus,dan Escherichia coli ?
1.3 Hipotesis
Hipotesis dari penelitian ini adalah sebagai berikut:
4
2. Simplisia kulit buah markisa ungu (Passiflora edulis Sims) mengandung senyawa tanin, glikosida, glikosida antrakinon, flavonoid, saponin, alkaloid dan steroid/triterpenoid.
3. Ekstrak etanol, fraksi n-heksan, fraksi etilasetat dan fraksi air dari kulit buah markisa ungu (Passiflora edulis Sims) mempunyai aktivitas antibakteri terhadap pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli.
1.4 Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut:
1. Untuk mengetahui karakteristik dari simplisia kulit buah markisa ungu (Passiflora edulis Sims).
2. Untuk mengetahui golongan senyawa kimia yang terdapat simplisia, ekstrak etanol dan fraksi kulit buah markisa ungu (Passiflora edulis Sims). 3. Untuk mengetahui aktivitas antibakteri ekstrak etanol, fraksi n-heksan, fraksi etilasetat dan fraksi air kulit buah markisa ungu (Passiflora edulis Sims) terhadap bakteri Staphylococcus aureus dan Escherichia coli.
1.5 Manfaat
Manfaat dari penelitian ini adalah
1. Hasil penelitian ini diharapkan dapat memberikan informasi tentang karakteristik simplisia dan golongan senyawa kimia pada simplisia kulit buah markisa ungu (Passiflora edulis Sims).
vi
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOLDAN FRAKSI - FRAKSI KULIT BUAH MARKISA UNGU
(Passiflora edulis Sims) TERHADAP BAKTERI Staphylococcus aureus dan Escherichia coli
ABSTRAK
Sumatera Utara merupakan salah satu daerah sentral produksi markisa ungu di Indonesia. Pengolahan buah markisa menjadi produk minuman (sari markisa) menghasilkan kulit buah markisa yang belum dimanfaatkan. Pemanfaatan kulit buah markisa perlu dikaji agar dapat berguna antara lain sebagai bahan baku sediaan obat antibakteri. Penelitian i