ABSTRAK
JEANNI INDAH NOERMALA. Pemberian prebiotik, probiotik, dan sinbiotik untuk pengendalian ko-infeksi bakteri Vibrio harveyi dan IMNV (Infectious Myonecrosis Virus) pada udang vaname Litopenaeus vannamei. Dibimbing oleh WIDANARNI dan SUKENDA.
Penelitian ini bertujuan untuk menguji pengaruh pemberian prebiotik, probiotik, dan sinbiotik terhadap sintasan dan respon imun udang vaname dengan ko-infeksi bakteri Vibrio harveyi dan virus IMNV. Udang yang digunakan memiliki bobot 2,04±0,20 gram/ekor, dipelihara sebanyak 20 ekor dalam akuarium yang berukuran 60 x 30 x 35 cm. Penelitian dilakukan dengan 5 perlakuan yaitu K (+) (tanpa pemberian prebiotik, probiotik dan sinbiotik dengan ko-infeksi), K (-) (tanpa pemberian prebiotik, probiotik dan sinbiotik tanpa ko-infeksi), P1 (pemberian prebiotik dengan infeksi), P2 (pemberian probiotik dengan ko-infeksi), dan P3 (pemberian sinbiotik dengan ko-infeksi). Hasil penelitian menunjukkan bahwa pemberian prebiotik, probiotik dan sinbiotik memberikan pengaruh yang lebih baik dibanding perlakuan K(+). Perlakuan prebiotik, probiotik, dan sinbiotik memiliki nilai sintasan yang lebih tinggi (70,83%-79,17%) dibandingkan dengan perlakuan K(+) (50,00%), serta memiliki respon imun yang lebih baik.
Kata kunci : udang vaname, prebiotik, probiotik, sinbiotik, IMNV, Vibrio harveyi ---
ABSTRACT
JEANNI INDAH NOERMALA. The application of prebiotic, probiotic, and sinbiotic for control of Vibrio harveyi bacteria and IMNV (infectious myonecrosis virus) co-infection to white shrimp Litopenaeus vannamei. Supervised by WIDANARNI dan SUKENDA.
This study aimed to examine the influence of prebiotic, probiotic, and sinbiotic against survival and immune response of white shrimp challenged with co-infection of Vibrio harveyi and the IMNV virus. Shrimp that with a body weigth of 2,04±0.20 g/animal, was kept at 20 shrimps per aquarium with size 60 x 30 x 35 cm. The study was conducted with five treatments consisted of K (+) (without the addition of prebiotic, probiotic and sinbiotic with co-infection), K (-) (without the addition of prebiotic, probiotic and sinbiotic and without co-infection), P1 (the addition of prebiotik with infection), P2 (the addition of probiotic with co-infection), and P3 (the addition of sinbiotik with co-infection). The results showed that prebiotic, probiotic and sinbiotic treatment have better influence than the K (+) treatment. The survival of prebiotic, probiotic, and sinbiotic treatment were higher (70,83%-79,17%) than K(+) treatment (50,00%) and a better immune response were also observed.
I. PENDAHULUAN
Udang vaname (Litopenaeus vannamei) merupakan salah satu komoditas ekspor yang bernilai cukup tinggi pada sektor perikanan. Kementerian Kelautan dan Perikanan dalam Antara (2010) menargetkan produksi udang pada 2014
sebesar 699 ribu ton, terdiri atas 188 ribu ton udang windu dan 511 ribu ton udang vaname. Permintaan konsumen dunia terhadap udang rata-rata naik 11,5% per tahun. Hingga saat ini komoditas udang vaname masih merupakan pilihan utama untuk dibudidayakan oleh petambak. Negara produsen udang yang menjadi pesaing baru Indonesia dalam ekspor udang juga terus bermunculan. Hal ini dikarenakan udang vaname mempunyai harga pasar yang baik yaitu US$ 7 per kg, naik 40% dibanding tahun lalu (Bisnis Indonesia 2012). Untuk memenuhi permintaan yang terus meningkat tersebut perlu dilakukan budidaya udang vaname secara intensif.
Penyakit yang sering menjadi masalah utama dalam budidaya udang terutama vaname salah satunya adalah penyakit IMN (Infectious Myonecrosis) yang disebabkan oleh infeksi virus IMNV (Infectious Myonecrosis Virus) (Costa et al. 2009). Gejala klinis yang umum terjadi pada udang yang terserang IMNV adalah munculnya warna putih pada distal abdomen dan kehilangan transparansi pada permukaan tubuhnya. Mortalitas udang yang disebabkan oleh IMNV mencapai 40%-60% di tambak (Tang et al. 2005).
Selain IMNV, penyakit yang sering menyerang udang vaname adalah penyakit bakterial yang disebabkan oleh Vibrio harveyi. Bakteri V. harveyi adalah
salah satu agen penyakit vibriosis yang menyebabkan penyakit udang berpendar serta merupakan patogen oportunistik yang umum dijumpai di lingkungan pemeliharaan dan bersimbiosis dengan udang atau ikan air laut. Jika kondisi udang menurun maka bakteri ini akan bersifat patogen (Lavilla-Pitogo et al. 1990). Berdasarkan hasil penelitian Widagdo (2011), udang vaname yang diinfeksi V. harveyi dengan dosis 106 CFU/mL memiliki nilai sintasan 31,67%.
2 lebih banyak pada budidaya udang vaname. Ko-infeksi pada udang di tambak banyak menyerang stadia awal dan ukuran juvenil (Phuoc et al. 2009). Hasan (2011) melaporkan bahwa ko-infeksi virus IMNV dengan V. harveyi pada dosis 108 CFU/mL memperlihatkan adanya mortalitas kumulatif mencapai 54% dengan awal mortalitas yang lebih cepat dan nilai yang lebih tinggi dibandingkan infeksi tunggal IMNV dengan nilai mortalitas kumulatif sebesar 38% selama pengamatan 14 hari.
Penanggulangan penyakit pada udang sering kali dilakukan dengan pemberian antibiotik. Akan tetapi, penggunaan antibiotik yang terus menerus dikhawatirkan akan menyebabkan timbulnya strain baru bakteri yang tahan terhadap antibiotik tersebut dan menyebabkan pencemaran lingkungan. Penggunaan prebiotik, probiotik dan sinbiotik saat ini merupakan alternatif dalam mengatasi permasalahan serangan penyakit yang sering timbul. Probiotik merupakan jenis mikroba hidup yang memberikan pengaruh menguntungkan pada inang yaitu melalui peningkatan sistem imun, memperbaiki kualitas lingkungan hidup inang, dan memperbaiki nilai nutrisi pakan (Verschuere et al. 2000). Bakteri probiotik Vibrio SKT-b memiliki kemampuan untuk menghambat pertumbuhan bakteri patogen V. harveyi dalam uji in vitro dan in vivo (Widanarni et al. 2003). Prebiotik merupakan bahan pangan dengan kandungan oligosakarida yang tidak dapat dicerna oleh inang tetapi memberikan efek menguntungkan bagi inang dengan cara merangsang pertumbuhan mikroflora normal di dalam saluran pencernaan inang. Sinbiotik merupakan kombinasi seimbang dari probiotik dan prebiotik dalam mendukung kelangsungan hidup dan pertumbuhan bakteri yang menguntungkan dalam saluran pencernaan makhluk hidup (Schrezenmeir & Vrese 2001). Namun, saat ini belum ada informasi mengenai penggunaan prebiotik,
probiotik, dan sinbiotik untuk menangani ko-infeksi V. harveyi dan IMNV.
II. BAHAN DAN METODE
2.1 Persiapan Prebiotik
Prebiotik yang digunakan berasal dari tepung ubi jalar varietas sukuh. Metode yang dilakukan pada persiapan prebiotik berdasarkan metode yang
dilakukan Marlis (2008). Proses pembuatan tepung ubi jalar yaitu ubi jalar segar dibersihkan dan dikupas, kemudian diiris dengan menggunakan slicer dengan ketebalan ± 1 mm. Setelah itu, irisan ubi jalar dikeringkan dalam oven pada suhu 55 oC selama 5 jam dan digiling dengan willey mill. Selanjutnya diayak dengan ukuran ayakan 60 mesh. Tepung ubi jalar selanjutnya dicampur air dengan perbandingan 1:1 (w/v) dan dikukus selama 30 menit pada suhu 100 oC. Setelah itu tepung ubi jalar dikeringkan menggunakan oven pada suhu 55 oC selama 18 jam. Selanjutnya, tepung ubi tersebut digiling dan disaring menggunakan ayakan.
Tahap selanjutnya yaitu ekstraksi oligosakarida. Tepung ubi jalar yang sudah kering tersebut disuspensikan ke dalam etanol 70% dengan perbandingan 1:10. Kemudian dihomogenisasi menggunakan magnetic stirer selama 15 jam dan dilakukan penyaringan dengan menggunakan kertas saring steril dan disentrifuse selama 15 menit dengan kecepatan 5.000 rpm. Filtrat yang telah diperoleh dipekatkan menggunakan evaporator vakum pada suhu 40 oC.
Sebelum filtrat ubi jalar tersebut digunakan, dilakukan pengukuran total padatan terlarut (TPT) terlebih dahulu. Hasil dari pemekatan ekstraksi ubi jalar tersebut diencerkan dengan menggunakan akuades steril hingga mencapai kadar TPT sebesar 5% (Marlis 2008). Cawan porselin dimasukkan ke dalam oven
selama 1 jam dengan suhu 100 oC, kemudian cawan tersebut didinginkan dalam desikator dan ditimbang (a gram). Setelah itu, sebanyak 1 mL ekstrak oligosakarida hasil ekstraksi dari ubi jalar ditempatkan pada cawan porselin tersebut, kemudian ditimbang (b gram). Cawan porselin berisi ekstrak oligosakarida tersebut dimasukkan ke dalam oven dengan suhu 100oC selama 24 jam. Setelah itu cawan didinginkan dalam desikator selama 10 menit, kemudian cawan tersebut ditimbang (c gram). Total padatan terlarut dihitung dengan rumus:
4
2.2 Persiapan Probiotik
Pada penelitian ini bakteri probiotik yang digunakan adalah bakteri Vibrio
SKT-b yang telah diuji dapat menghambat pertumbuhan V. harveyi secara in vitro
dan in vivo serta telah diidentifikasi sebagai bakteri Vibrio alginolyticus (Widanarni
et al. 2003). Media yang digunakan untuk persiapan probiotik adalah SWC (Sea
Water Complete). Terlebih dahulu media SWC dan PBS (Phosphate Buffer Saline) disiapkan (Lampiran 1). Tahap selanjutnya yaitu media SWC cair steril sebanyak 25 mL diinokulasikan satu ose isolat bakteri Vibrio SKT-b yang berumur 24 jam yang dilakukan secara aseptik. Selanjutnya hasil inokulasi tersebut diinkubasi dalam waterbath shaker pada suhu 29-30 oC dengan kecepatan 140 rpm selama 24 jam. Setelah itu, suspensi bakteri dipindahkan ke dalam tabung corning 25 mL kemudian disentrifuse selama 10 menit dengan kecepatan 5.000 rpm untuk memisahkan pellet dengan supernatan. Padatan sel bakteri (pellet) yang diperoleh kemudian dicuci sebanyak 2 kali dengan larutan PBS 25 mL, dihomogenisasi dengan vortex dan disentrifuse selama 10 menit dengan kecepatan 5.000 rpm dan supernatan dibuang. Setelah itu, ditambahkan kembali larutan PBS sebanyak 10 mL dan dihomogenisasi dengan vortex. Hasil dari vortex ini adalah probiotik yang akan dicampurkan ke dalam pakan.
2.3 Pengujian Prebiotik, Probiotik, dan Sinbiotik secara In Vivo 2.3.1 Persiapan Wadah
Wadah yang digunakan dalam penelitian ini adalah 15 akuarium berukuran 60 cm x 30 cm x 35 cm. Sebelum digunakan, akuarium dicuci terlebih dahulu menggunakan deterjen dan dikeringkan. Kemudian akuarium didesinfeksi
5
2.3.2 Persiapan Hewan Uji
Hewan uji yang digunakan dalam penelitian ini adalah udang vaname stadia PL (Post Larvae) 38 yang berasal dari Labuan, Banten. Sebelum perlakuan, benur dipelihara sampai memiliki bobot 2 g/ekor. Pemeliharaan udang dilakukan selama 30 hari untuk pengujian nilai sintasan dan respon imun dengan kepadatan 20 ekor/akuarium atau 100 ekor/m2.
2.3.3 Persiapan Pakan Uji
Pakan yang digunakan selama penelitian ini adalah pelet komersil dengan
kandungan protein 40% dan diberikan sebanyak 4 kali sehari. Dosis probiotik yang digunakan sebesar 1% (v/w) dari jumlah pakan yang akan diberikan (Wang 2007). Sedangkan dosis prebiotik yang digunakan sebesar 2% (v/w) dari jumlah pakan yang akan diberikan (Mahious et al. 2006). Untuk pembuatan sinbiotik dilakukan dengan cara mengkombinasikan probiotik dan prebiotik pada pakan yang akan diberikan dengan menambahkan kuning telur sebanyak 2% (v/w) dari total pakan yang berfungsi sebagai perekat (Wang 2007). Sebelum diberikan ke udang, pakan dikeringudarakan terlebih dahulu selama 10-15 menit untuk mengurangi kelembaban.
2.3.4 Persiapan Ko-infeksi Bakteri dan Virus
Uji tantang yang dilakukan dalam penelitian ini adalah ko-infeksi bakteri V. harveyi dan IMNV. Infeksi V. harveyi dilakukan dengan metode perendaman (imersi). Setelah itu udang diinfeksi IMNV dengan metode injeksi. Udang vaname positif IMNV didapatkan dari Balai Pengembangan Budidaya Air Payau (BPBAP) Situbondo, Jawa Timur. Pembuatan ekstrak IMNV yang akan digunakan untuk injeksi berdasarkan prosedur yang dilakukan Escobedo et al. (2006). Adapun prosedur pembuatan ekstrak IMNV yaitu daging udang positif IMNV dicacah (tanpa hepatopankreas, usus, dan karapas) dan kemudian dilarutkan dalam PBS dengan perbandingan daging udang dan PBS adalah 1:10.
6 diinjeksi dengan IMNV pada bagian punggung antara segmen 3 dan 4 sebanyak 100 µL (Tang et al. 2005).
Setelah itu dilakukan kultur bakteri V. harveyi yang digunakan untuk infeksi secara imersi. Kepadatan bakteri V. harveyi yang digunakan adalah 106 CFU/mL dan imersi dilakukan selama 30 menit di dalam wadah terpisah yaitu 20 ekor udang/2 L (Widagdo 2011). Pengamatan dilakukan selama 14 hari setelah dilakukan koinfeksi.
2.3.5 Pengujian Pakan Uji pada Udang Vaname
Pengujian ini terdiri dari 5 perlakuan dengan 3 kali ulangan. Rancangan perlakuan penelitian dapat dilihat pada Tabel 1.
Tabel 1 Rancangan perlakuan pemberian prebiotik, probiotik, dan sinbiotik dengan ko-infeksi V. harveyi dan IMNV.
Pemberian pakan dilakukan empat kali dalam sehari pada pukul 07.00, 11.00, 15.00, dan 19.00 WIB. Jumlah pakan yang diberikan didasarkan pada Feeding Rate (FR) menurut SNI 01-7246-2006 yaitu 15% menurun hingga 10%. Pengelolaan kualitas air dilakukan dengan penyiponan dan pergantian air setiap pagi hari sebanyak 10% dari total volume akuarium.
Pemeliharaan udang dengan perlakuan prebiotik, probiotik dan sinbiotik dilakukan selama 30 hari, kemudian dilakukan uji tantang dengan ko-infeksi V. harveyi dan IMNV. Kemudian udang ditempatkan kembali ke dalam akuarium pemeliharaan. Pemeliharaan pasca uji tantang dan pengamatan dilakukan selama 14 hari. Parameter yang diamati selama perlakuan dan pasca uji tantang adalah sintasan, laju pertumbuhan harian (LPH), rasio konversi pakan (FCR), total hemosit, diferensial hemosit, total bakteri dan total bakteri SKT-b, gejala klinis, dan kualitas air.
Perlakuan Keterangan
K (+) Pemberian pakan komersil tanpa penambahan prebiotik, probiotik, dan sinbiotik dengan ko-infeksi V. harveyi dan IMNV.
K (-) Pemberian pakan komersil tanpa penambahan prebiotik, probiotik, dan sinbiotik tanpa ko-infeksi V. harveyi dan IMNV.
P1 Pemberian pakan komersil dengan penambahan prebiotik dengan ko-infeksi V. harveyi dan IMNV.
P2 Pemberian pakan komersil dengan penambahan probiotik dengan ko-infeksi V. harveyi dan IMNV.
7
2.4 Parameter Uji 2.4.1 Sintasan
Sintasan atau kelangsungan hidup merupakan presentase ikan yang hidup, dengan rumus sebagai berikut (Effendi 2004) :
Sintasan (%)
Keterangan :
Nt = jumlah individu pada akhir perlakuan (hari ke-t)
No = jumlah individu pada awal perlakuan (hari ke-0)
2.4.2 Laju Pertumbuhan Harian
Bobot udang diukur setiap 10 hari sekali selama pemeliharaan, dan laju pertumbuhan harian dihitung sebagai berikut (Huisman, 1987):
% 100 1 x Wo
Wt t
LPH t 1 x
Keterangan :
LPH = Laju pertumbuhan harian (%)
Wt = Bobot rata-rata pada akhir perlakuan (g) Wo = Bobot rata-rata pada awal perlakuan (g) t = Periode pemeliharaan (hari)
2.4.3 Rasio Konversi Pakan
Rasio konversi pakan atau Feeding Conversi Ratio (FCR) selama pemeliharaan dihitung menggunakan rumus (Zonneveld et al. 1991) :
Keterangan :
FCR = Konversi pakan F = Jumlah pakan (g)
Bt = Biomassa udang pada saat akhir perlakuan (g) Bm = Biomassa udang yang mati saat perlakuan (g) Bo = Biomassa udang pada saat awal perlakuan (g)
% 100
8
2.4.4 Total Hemosit
Pengamatan terhadap total hemosit dilakukan pada akhir perlakuan probiotik, prebiotik dan sinbiotik (hari ke-29) serta pasca ko-infeksi V. harveyi dan IMNV (hari ke-44). Penghitungan total hemosit yaitu dengan cara haemolymph diambil sebanyak 0,1 mL per ekor udang tiap ulangan dari pangkal kaki renang pertama dengan menggunakan syringe 1 mL yang sudah berisi 0,3 mL antikoagulan Na-sitrat 3,8%. Kemudian campuran tersebut dihomogenkan, tetesan pertama dibuang sedangkan tetesan selanjutnya diteteskan pada
haemositometer dan diamati di bawah mikroskop.
2.4.5 Diferensial Hemosit
Pembuatan preparasi untuk diferensial hemosit dilakukan pada akhir perlakuan probiotik, prebiotik dan sinbiotik (hari ke-29) serta pasca ko-infeksi V. harveyi dan IMNV (hari ke-44). Tahap pertama yaitu haemolymph yang telah diambil dari udang uji diteteskan pada gelas objek dan dibuat ulasan, kemudian dikeringkan. Setelah itu difiksasi dengan methanol 100% selama 5 menit dan dikeringkan di udara kembali. Tahap selanjutnya yaitu preparat tersebut diwarnai dengan larutan giemsa 10% selama 15 menit dan dikeringkan di udara. Kemudian dicuci dalam air mengalir selama 30 detik dan dibiarkan kering. Jumlah hemosit dihitung hingga 100 sel dan ditentukan persentase tiap jenisnya (hialin dan granular). Persentase tiap jenis sel hemosit dihitung dengan rumus:
% jenis sel hemosit = x 100%
2.4.6 Total Bakteri dan Total SKT-b
Pengamatan total bakteri dilakukan pada akhir perlakuan (pada hari ke-30) dan pasca uji tantang (hari ke-32 dan hari ke-45). Perhitungan total bakteri ini berdasarkan jumlah bakteri dalam usus udang. Usus diambil dan ditimbang bobotnya, lalu dimasukkan ke dalam larutan PBS dengan perbandingan 1:10. Setelah itu usus digerus sampai homogen dengan larutan PBS, lalu diambil sebanyak 0,1 mL dan dilakukan pengenceran bertingkat sampai pengenceran 10-7.
Kemudian hasil pengenceran tersebut dituang dalam cawan petri dengan metode agar tuang pada media SWC dan TCBS yang mengandung rifampisin 50 µg/ml
9 jam. Pada media SWC semua bakteri akan tumbuh, sedangkan pada media TCBS + Rf hanya bakteri Vibrio SKT-b yang akan tumbuh karena telah dibuat resisten terhadap antibiotik rifampisin (Ayuzar 2008).
2.4.7 Gejala Klinis
Pengamatan gejala klinis dilakukan dengan melihat perubahan atau kelainan pada anatomi makro udang. Gejala klinis yang diamati ialah terbentuknya otot berwarna putih pada bagian ruas tubuh udang, dan warna kemerahan pada bagian ekor. Pengamatan gejala klinis ini dilakukan pada awal
dan akhir uji tantang.
2.4.8 Kualitas Air
Kualitas air diukur pada awal dan akhir perlakuan prebiotik, probiotik, dan sinbiotik. Pengamatan kualitas air dilakukan pada air stok awal dan air media pemeliharaan masing-masing perlakuan. Parameter kualitas air yang diukur adalah suhu, pH, DO, salinitas, dan TAN.
2.5 Analisis Data
III. HASIL DAN PEMBAHASAN
3.1 Hasil 3.1.1 Sintasan
Penghitungan nilai sintasan dilakukan pada akhir perlakuan prebiotik, probiotik, dan sinbiotik serta pasca uji tantang dengan ko-infeksi V. harveyi dan IMNV. Nilai sintasan pada tahap perlakuan dan pasca uji tantang dapat dilihat pada Gambar 1.
(a) (b) Keterangan :
K (+) (kontrol +), K (-) (kontrol -), P1 (prebiotik), P2 (probiotik), dan P3 (sinbiotik)
Gambar 1 Nilai sintasan udang vaname pada akhir perlakuan prebiotik, probiotik, dan sinbiotik (a); Nilai sintasan udang vaname pada pasca uji tantang dengan ko-infeksi V. harveyi dan IMNV (b).
Berdasarkan Gambar 1a, pada akhir perlakuan prebiotik, probiotik, dan sinbiotik menunjukkan bahwa nilai sintasan tertinggi terdapat pada perlakuan probiotik yaitu 88,33%, kemudian perlakuan sinbiotik yaitu 85,00%, perlakuan kontrol dengan 81,67%, dan sintasan terendah terdapat pada perlakuan prebiotik yaitu 76,67%. Sedangkan pada pasca uji tantang (1b) perlakuan probiotik memiliki nilai sintasan tertinggi yaitu 79,17%, disusul kemudian perlakuan prebiotik dan K(-) yaitu 75,00%, perlakuan sinbiotik yaitu 70,83%, dan sintasan terendah terdapat pada perlakuan K(+) yaitu 50,00%.
3.1.2 Laju Pertumbuhan Harian
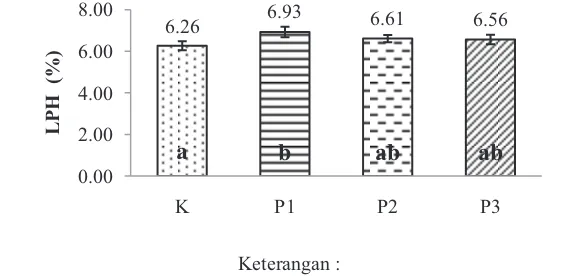
Penghitungan laju pertumbuhan harian (LPH) udang vaname pada penelitian ini dilakukan setelah 30 hari perlakuan prebiotik, probiotik, dan sinbiotik yang dapat dilihat pada Gambar 2.
81.67 76.67 88.33 85
0 10 20 30 40 50 60 70 80 90 100
K P1 P2 P3
Sintasan
(%
) 50.00 75.00 75.00
79.17 70.83 0 20 40 60 80 100
K + K - P1 P2 P3
Sin
ta
sa
n
11
Keterangan :
K (kontrol), P1 (prebiotik), P2 (probiotik), dan P3 (sinbiotik)
Gambar 2 Laju Pertumbuhan Harian (LPH) udang vaname selama perlakuan prebiotik, probiotik, dan sinbiotik.
Berdasarkan pada Gambar 2, dapat dilihat bahwa laju pertumbuhan harian (LPH) pada perlakuan prebiotik memiliki nilai LPH yang tinggi yaitu 6,93% dan menunjukkan hasil yang tidak berbeda nyata dengan perlakuan probiotik dan sinbiotik, namun berbeda nyata dengan perlakuan kontrol (P<0,05; Lampiran 2).
3.1.3 Rasio Konversi Pakan
Pengaruh pemberian prebiotik, probiotik, dan sinbiotik melalui pakan terhadap konversi pakan (FCR) dapat dilihat pada Gambar 3.
Keterangan :
K (kontrol), P1 (prebiotik), P2 (probiotik), dan P3 (sinbiotik)
Gambar 3 Nilai rasio konversi pakan (FCR) udang vaname selama perlakuan prebiotik, probiotik, dan sinbiotik.
Berdasarkan pada Gambar 3, dapat dapat dilihat bahwa nilai rasio konversi pakan (FCR) pada perlakuan probiotik memiliki nilai FCR yang terendah yaitu 1.46. Sedangkan nilai FCR tertinggi terdapat pada perlakuan kontrol yaitu 2,30. Hasil uji statistik menunjukan bahwa perlakuan probiotik tidak berbeda nyata dengan perlakuan prebiotik dan sinbiotik, namun berbeda nyata dengan perlakuan kontrol (P<0,05; Lampiran 3).
6.26 6.93 6.61 6.56
0.00 2.00 4.00 6.00 8.00
K P1 P2 P3
L PH ( %) 2.30 1.86 1.46 1.68 0.00 0.50 1.00 1.50 2.00 2.50 3.00
K P1 P2 P3
F
C
R
b ab ab
a
b b b
12
3.1.4 Total Hemosit
Penghitungan total hemosit dilakukan pada akhir perlakuan prebiotik, probiotik, dan sinbiotik serta pada pasca uji tantang dengan koinfeksi V. harveyi dan IMNV. Nilai total hemosit dapat dilihat pada Gambar 4.
(a) (b)
Keterangan :
K (+) (kontrol +), K (-) (kontrol -), P1 (prebiotik), P2 (probiotik), dan P3 (sinbiotik)
Gambar 4 Total hemosit udang vaname pada akhir perlakuan prebiotik, probiotik, dan sinbiotik (a); Total hemosit udang vaname pada pasca uji tantang dengan ko-infeksi V. harveyi dan IMNV (b)
Berdasarkan Gambar 4a dapat dilihat bahwa perlakuan probiotik memiliki nilai total hemosit yang tinggi yaitu 10,74x107 sel/mL pada akhir perlakuan dan menunjukkan hasil yang tidak berbeda nyata dengan perlakuan prebiotik dan sinbiotik, namun berbeda nyata dengan kontrol (P<0,05; Lampiran 4). Pasca uji tantang (4b) perlakuan probiotik juga memiliki total hemosit yang tinggi yaitu 6,31x107 sel/mL, dan menunjukkan hasil yang tidak berbeda nyata dengan perlakuan prebiotik dan sinbiotik, namun berbeda nyata dengan perlakuan K(+) dan K(-) (P<0,05; Lampiran 5).
3.1.5 Diferensial Hemosit
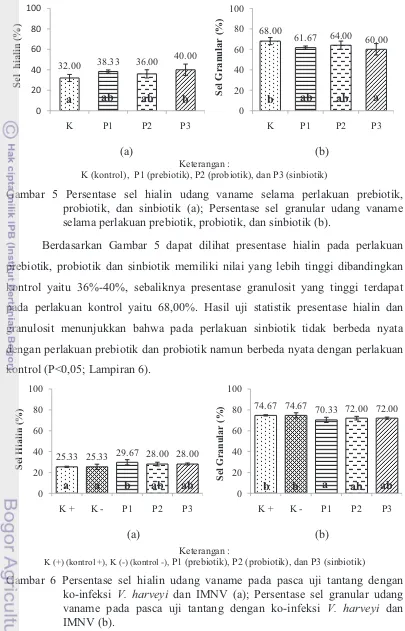
Diferensial hemosit terdiri dari sel hialin, semi granular, dan granular. Umumnya sel semi granular perhitungannya dikategorikan ke dalam sel granular. Hal ini dikarenakan teknis pengamatannya sulit dibedakan antara sel granular dan sel semi granular. Hasil penghitungan jumlah sel hialin dan granular dapat dilihat
pada Gambar 5 dan 6.
7.27
9.56 10.74 10.03
0 2 4 6 8 10 12
K P1 P2 P3
H em o sit ( x 1 0 7sel/m L ) 4.24 5.65
6.02 6.31 6.06
0 2 4 6 8 10 12
K + K - P1 P2 P3
H em o sit ( x 1 0 7sel/m L )
b ab a ab bc c bc
13 (a) (b)
Keterangan :
K (kontrol), P1 (prebiotik), P2 (probiotik), dan P3 (sinbiotik)
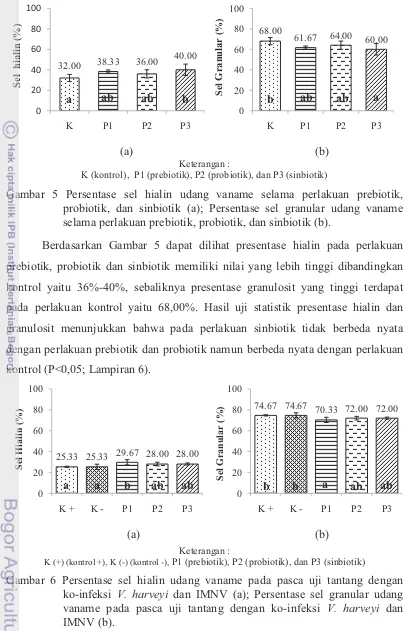
Gambar 5 Persentase sel hialin udang vaname selama perlakuan prebiotik, probiotik, dan sinbiotik (a); Persentase sel granular udang vaname selama perlakuan prebiotik, probiotik, dan sinbiotik (b).
Berdasarkan Gambar 5 dapat dilihat presentase hialin pada perlakuan
prebiotik, probiotik dan sinbiotik memiliki nilai yang lebih tinggi dibandingkan kontrol yaitu 36%-40%, sebaliknya presentase granulosit yang tinggi terdapat pada perlakuan kontrol yaitu 68,00%. Hasil uji statistik presentase hialin dan granulosit menunjukkan bahwa pada perlakuan sinbiotik tidak berbeda nyata dengan perlakuan prebiotik dan probiotik namun berbeda nyata dengan perlakuan kontrol (P<0,05; Lampiran 6).
(a) (b)
Keterangan :
K (+) (kontrol +), K (-) (kontrol -), P1 (prebiotik), P2 (probiotik), dan P3 (sinbiotik)
Gambar 6 Persentase sel hialin udang vaname pada pasca uji tantang dengan ko-infeksi V. harveyi dan IMNV (a); Persentase sel granular udang vaname pada pasca uji tantang dengan ko-infeksi V. harveyi dan IMNV (b).
Berdasarkan Gambar 6, dapat dilihat bahwa pada pasca uji tantang presentase hialin yang tinggi juga terdapat pada perlakuan prebiotik yaitu 29,67%,
32.00 38.33 36.00
40.00 0 20 40 60 80 100
K P1 P2 P3
Sel
hi
al
in
(%) 68.00 61.67 64.00 60.00
0 20 40 60 80 100
K P1 P2 P3
Sel
G
ranul
ar
(%)
25.33 25.33 29.67 28.00 28.00
0 20 40 60 80 100
K + K - P1 P2 P3
Sel
H
ia
lin
(
%) 74.67 74.67 70.33 72.00 72.00
0 20 40 60 80 100
K + K - P1 P2 P3
Sel G ra nu la r (%)
a ab ab b b ab ab a
14 sebaliknya presentase granulosit yang tinggi terdapat pada perlakuan kontrol yaitu 74,67%. Hasil uji statistik presentase hialin dan granulosit menunjukkan bahwa pada perlakuan prebiotik tidak berbeda nyata dengan perlakuan probiotik dan sinbiotik namun berbeda nyata dengan perlakuan K(+) dan K(-) (P<0,05;
Lampiran 7).
3.1.6 Total Bakteri dan Total SKT-b
Penghitungan total bakteri pada udang vaname dilakukan pada akhir perlakuan dan pada pasca uji tantang dengan ko-infeksi V. harveyi dan IMNV. Total bakteri dapat dilihat pada Gambar 7.
(a) (b) Keterangan :
K (+) (kontrol +), K (-) (kontrol -), P1 (prebiotik), P2 (probiotik), dan P3 (sinbiotik)
Gambar 7 Total bakteri di dalam usus udang vaname pada akhir perlakuan prebiotik, probiotik, dan sinbiotik (a); Total bakteri di dalam usus udang vaname pada pasca uji tantang dengan ko-infeksi V. harveyi dan IMNV (b).
Berdasarkan pada Gambar 7a dapat dilihat bahwa total bakteri pada perlakuan prebiotik, probiotik, dan sinbiotik memiliki total bakteri yang tinggi (5,36-5,99x1011 CFU/g) dan menunjukan hasil yang berbeda nyata dengan perlakuan kontrol (2,61x1011 CFU/g) (P<0,05; Lampiran 8). Pasca uji tantang (7b) total bakteri berkisar 5,20-8,50x1011 CFU/g dan hasil tersebut tidak berbeda nyata antar perlakuan (P>0,05; Lampiran 9).
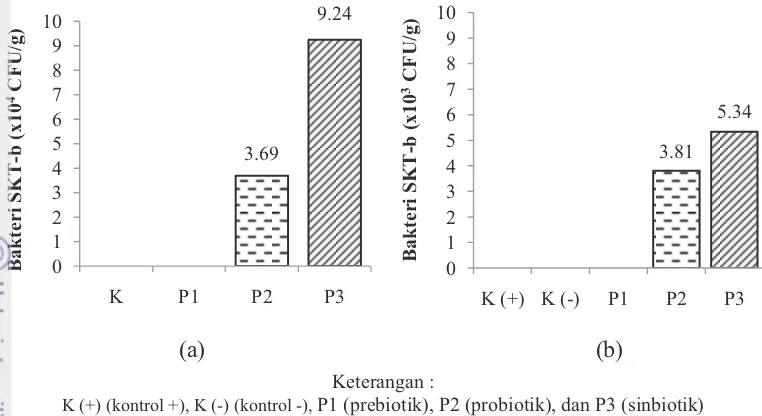
Bakteri Vibrio SKT-b dalam penelitian ini berperan sebagai probiotik. Total bakteri SKT-b pada penelitian ini dapat dilihat pada Gambar 8.
2.61 5.36 5.75 5.99 0.00 2.00 4.00 6.00 8.00 10.00
K P1 P2 P3
T o ta l ba k ter i (x 1 0 11 CF U /g ) 8.50 5.20 5.25 6.45 7.24 0.00 2.00 4.00 6.00 8.00 10.00
K + K - P1 P2 P3
T o ta l ba k ter i (x 1 0 11 CF U /g )
15 (a) (b)
Keterangan :
K (+) (kontrol +), K (-) (kontrol -), P1 (prebiotik), P2 (probiotik), dan P3 (sinbiotik)
Gambar 8 Total bakteri SKT-b di dalam usus udang vaname pada akhir perlakuan prebiotik, probiotik, dan sinbiotik (a); Total bakteri SKT-b di dalam usus udang vaname pada pasca uji tantang dengan ko-infeksi V. harveyi dan IMNV (b).
Berdasarkan Gambar 8a, dapat dilihat bahwa total bakteri SKT-b pada perlakuan sinbiotik lebih tinggi yaitu 9,24x104 CFU/g dibandingkan pada perlakuan probiotik yaitu 3,69 x104 CFU/g, sedangkan pada perlakuan kontrol dan prebiotik tidak terdapat bakteri SKT-b. Total bakteri SKT-b mengalami penurunan pada pasca uji tantang. Total bakteri SKT-b pada perlakuan sinbiotik lebih tinggi yaitu 5,34x103 CFU/g dibandingkan pada perlakuan probiotik yaitu 3,81x103 CFU/g, sedangkan sedangkan pada perlakuan kontrol dan prebiotik tidak terdapat bakteri SKT-b.
3.1.7 Gejala Klinis
Pengamatan gejala klinis pada penelitian ini dilakukan setelah udang vaname diinfeksi V. harveyi dan IMNV yang dapat dilihat pada Gambar 9.
(a) (b) Gambar 9 Gejala klinis pada udang vaname setelah di koinfeksi: Udang normal
(a); Nekrosis pada ruas tubuh dan warna kemerahan pada ekor (b).
3.69 9.24 0 1 2 3 4 5 6 7 8 9 10
K P1 P2 P3
B a k ter i SK T -b (x 1 0 4CF U /g ) 3.81 5.34 0 1 2 3 4 5 6 7 8 9 10
K (+) K (-) P1 P2 P3
16 Berdasarkan Gambar 9, ko-infeksi V. harveyi dan IMNV menunjukkan gejala klinis seperti timbulnya nekrosis pada ruas permukaan tubuh, kehilangan transparansi pada permukaan tubuhnya, usus udang tidak terisi penuh, dan ketika udang mengalami kematian seluruh tubuh udang akan berwarna putih susu yang
diawali dari pangkal ekor dan akhirnya udang akan bewarna kemerahan.
3.1.8 Kualitas Air
Kualitas air pada penelitian ini diukur pada awal dan akhir perlakuan prebiotik, probiotik, dan sinbiotik. Parameter kualitas air yang diukur meliputi suhu, pH, DO, salinitas, dan TAN. Berikut nilai kualitas air media pemeliharaan udang vaname pada berbagai perlakuan yang disajikan pada Tabel 2.
Tabel 2 Nilai kualitas air media pemeliharaan udang vaname pada berbagai perlakuan
Perlakuan Parameter
Suhu (oC) pH DO (ppm) Salinitas (ppt) TAN (ppm) Tandon (awal) 27,7 – 28,5 7,8 – 8,3 5,6 – 7,5 27,4 - 27,9 0,286 – 0,429 Kontrol + 28,8 – 28,9 7,5 – 7,6 6,4 – 7,3 30,2 – 30,9 0,235 – 0,614 Kontrol - 28,2 – 29,0 7,7 - 7,9 6,7 – 6,8 30,6 – 30,8 0,524 – 0,571 Prebiotik 28,4 7,6 – 8,0 5,9 -7,2 30,7 – 30,9 0,184 – 0,656 Probiotik 28,4 7,5 – 7,6 6,3 – 7,8 30,2 – 30,7 0,509 – 0,783 Sinbiotik 28,4 – 28,5 7,5 – 7,7 4,9 – 5,4 30,7 – 30,8 0,346 – 0,491 SNI 01-7246-2006 28,5 – 31,5 7,5 – 8,5 > 3,5 15 – 35 < 1
Nilai kualitas air media pemeliharaan udang vaname (Tabel 2) sesuai
dengan SNI 01-7246-2006 sehingga diasumsikan perubahan kelangsungan hidup, pertumbuhan, dan respon imun pada perlakuan prebiotik, probiotik, dan sinbiotik bukan diakibatkan oleh kualitas air media pemeliharaan.
3.2 Pembahasan
17 V. harveyi dan IMNV dibandingkan dengan perlakuan lainnya diduga dengan penambahan probiotik Vibrio SKT-b mampu menekan populasi V. harveyi dan memiliki sistem imun yang lebih baik sehingga mampu bertahan dari serangan IMNV. Hal tersebut didukung oleh hasil penelitian Widanarni et al. (2003),
probiotik Vibrio SKT-b memiliki kemampuan untuk menghambat pertumbuhan bakteri patogen V. harveyi dalam uji in vitro dan in vivo. Selanjutnya Syahailatua (2009) menyatakan, bahwa probiotik Vibrio SKT-b dapat meningkatkan respon imun udang vaname.
Perlakuan sinbiotik juga memiliki nilai sintasan yang tinggi pada akhir perlakuan prebiotik, probiotik, dan sinbiotik. Sinbiotik merupakan kombinasi seimbang dari probiotik dan prebiotik dalam mendukung kelangsungan hidup dan pertumbuhan bakteri yang menguntungkan dalam saluran pencernaan makhluk hidup (Schrezenmeir & Vrese 2001). Setelah diinfeksi V. harveyi dan IMNV, nilai sintasan pada perlakuan sinbiotik relatif lebih rendah dibandingkan perlakuan probiotik dan prebiotik saja. Hal ini diduga pemberian prebiotik 2% yang dikombinasikan dengan probiotik 1% bukan merupakan kombinasi yang seimbang sehingga menyebabkan nilai sintasan pada perlakuan sinbiotik lebih rendah dibandingkan dengan perlakuan probiotik dan prebiotik. Hal yang sama juga diperoleh Li et al. (2009) yang menyatakan bahwa pemberian bakteri Bacillus OJ (PB) dengan dosis 1010 CFU/g yang dikombinasikan dengan 0,2% isomaltooligisakarida (IMO) menghasilkan nilai sintasan dan respon imun yang lebih rendah dibandingkan dengan pemberian PB dengan dosis 108 CFU/g dan 0,2% IMO. Lee & Seppo (2009) menyatakan bahwa prebiotik bukan merupakan
18 di dalam usus dan mampu meningkatkan respon imun. Bakteri-bakteri baik di dalam usus seperti Bifidobacterium dapat menghasilkan antibiotik alami.
Menurut Effendi (2004), pertumbuhan merupakan pertambahan ukuran baik bobot maupun panjang dalam suatu periode atau waktu tertentu. Laju
pertumbuhan harian (LPH) pada perlakuan prebiotik memiliki nilai LPH yang tinggi dan menunjukkan hasil yang tidak berbeda nyata dengan perlakuan probiotik dan sinbiotik, namun berbeda nyata dengan perlakuan kontrol. Tingginya nilai LPH pada perlakuan prebiotik dibandingkan dengan perlakuan kontrol diduga prebiotik berperan memberikan nutrisi untuk pertumbuhan bakteri-bakteri baik di dalam usus sehingga pakan dapat dimanfaatkan dengan baik untuk pertumbuhan. Hal tersebut didukung oleh Manning & Gibson (2004) yang menyatakan bahwa prebiotik mampu secara selektif menstimulasi pertumbuhan dan aktivitas metabolik bakteri potensial yang menguntungkan.
Rasio konversi pakan (FCR) merupakan suatu ukuran yang menyatakan jumlah pakan yang dibutuhkan untuk menghasilkan 1 kg daging. Semakin besar nilai FCR, maka semakin banyak pakan yang dibutuhkan untuk memproduksi 1 kg daging (Effendi 2004). Perlakuan prebiotik, probiotik, dan sinbiotik memberikan nilai FCR yang lebih baik dibandingkan dengan perlakuan kontrol. Hal ini menunjukkan bahwa prebiotik probiotik, dan sinbiotik mampu meningkatkan pemanfaatan pakan yang lebih efektif, sehingga penggunaan pakan lebih efisien dan memberikan respon lebih baik pada nilai FCR. Hal yang sama juga diperoleh dalam penelitian Widagdo (2011), perlakuan prebiotik, probiotik, dan sinbiotik memiliki nilai FCR yang lebih baik (berturut-turut yaitu 1,26, 1,43,
19 juga dengan sinbiotik, prebiotik yang ditambahkan bersama probiotik memberikan nilai rasio konversi pakan yang lebih baik dibandingkan dengan perlakuan kontrol.
Hemosit memainkan peran penting pada pertahanan tubuh krustasea yaitu
dapat menghilangkan partikel asing yang masuk ke tubuh udang, meliputi tahap pengenalan, fagositosis, melanisasi, sitotoksis dan komunikasi sel (Johanssan et al. 2000). Hasil pengamatan nilai hemosit pada akhir perlakuan prebiotik, probiotik, dan sinbiotik diketahui bahwa perlakuan probiotik memiliki nilai total hemosit yang tinggi dan menunjukkan hasil yang tidak berbeda nyata dengan perlakuan prebiotik dan sinbiotik, namun berbeda nyata dengan kontrol. Pasca uji tantang perlakuan probiotik juga memiliki nilai hemosit yang tinggi dan menunjukkan hasil yang tidak berbeda nyata dengan perlakuan prebiotik dan sinbiotik, namun berbeda nyata dengan perlakuan K(+) dan K(-). Peningkatan nilai hemosit pada perlakuan prebiotik, probiotik, dan sinbiotik dalam penelitian ini menunjukkan bahwa prebiotik, probiotik, dan sinbiotik mampu berperan dalam mentimulasi respon imun udang dibandingkan dengan K(+). Total hemosit dapat mempengaruhi kemampuan inang untuk bereaksi melawan bahan asing dan berbagai respons terhadap infeksi (Johanssan et al. 2000). Pasca uji tantang terjadi penurunan total hemosit. Hal tersebut sesuai dengan Costa et al. (2009), pada infeksi IMNV dapat menyebabkan penurunan total hemosit hingga 30%. Diduga aktivitas antimikrobial pada hemosit tidak mampu meningkat ketika ada infeksi bakteri V. harveyi.
Hemosit memiliki tiga tipe sel yaitu hialin, semi granulosit, dan sel
20 pada akhir perlakuan prebiotik, probiotik, dan sinbiotik diketahui bahwa perlakuan sinbiotik tidak berbeda nyata dengan perlakuan prebiotik dan probiotik namun berbeda nyata dengan perlakuan kontrol. Pada pasca uji tantang, presentase hialin dan granulosit pada perlakuan prebiotik menunjukkan hasil yang
tidak berbeda nyata dengan perlakuan probiotik dan sinbiotik namun berbeda nyata dengan perlakuan K(+) dan K(-). Presentase hialin dan granular pada pasca uji tantang mengalami penurunan pada semua perlakuan.
Sel hialin memiliki fungsi dalam imunitas sebagai fagositosis. Fagositosis merupakan pertahanan non spesifik yang secara umum mampu melindungi adanya serangan penyakit (Johansson et al. 2000). Peningkatan sel hialin sebelum uji tantang menyebabkan kemampuan fagositosis dari sel ini juga meningkat sehingga ketika diuji tantang diduga udang dapat bertahan dari serangan mikroorganisme. Penurunan sel hialin pasca uji tantang merupakan implikasi dari peningkatan sel-sel granulosit. Sel granulosit berfungsi dalam menyimpan dan melepaskan sistem proPO (Johansson et al. 2000). Penurunan hialin dan granulosit pada pasca uji tantang merupakan respon terhadap infeksi.
(a) (b)
Gambar 10 Penampakan sel hialin pada udang vaname (a); Penampakan sel granular pada udang vaname (b).
Keberhasilan probiotik, prebiotik, dan sinbiotik dalam meningkatkan populasi bakteri di dalam saluran pencernaan udang vaname digambarkan dengan jumlah total bakteri di usus. Hasil pengamatan total bakteri pada akhir perlakuan prebiotik, probiotik, dan sinbiotik menunjukkan bahwa pada perlakuan prebiotik, probiotik, dan sinbiotik menunjukkan total bakteri yang lebih tinggi dan menunjukan hasil yang berbeda nyata dengan perlakuan kontrol. Sedangkan pada pasca uji tantang total bakteri menunjukkan hasil yang tidak berbeda nyata antar
21 perlakuan. Tingginya total bakteri pada perlakuan prebiotik, probiotik, dan sinbiotik pada akhir perlakuan diduga prebiotik mampu menstimulasi pertumbuhan bakteri di dalam usus. Penambahan bakteri Vibrio SKT-b sebagai probiotik juga dapat meningkatkan populasi bakteri di dalam usus. Waspodo
(2002) menyatakan dengan menggunakan bakteri probiotik dan menyediakan nutrisi sesuai untuk bakteri probiotik dapat membuat bakteri baik dalam usus berkembang lebih pesat.
Bakteri Vibrio SKT-b dalam penelitian ini berperan sebagai probiotik. Bakteri probiotik Vibrio SKT-b memiliki kemampuan untuk menghambat pertumbuhan bakteri patogen V. harveyi dalam uji in vitro dan in vivo (Widanarni et al. 2003). Perlakuan sinbiotik memiliki jumlah bakteri SKT-b yang lebih tinggi dibandingkan dengan perlakuan probiotik baik pada akhir perlakuan maupun pasca uji tantang, sedangkan pada perlakuan kontrol dan prebiotik tidak ditemukan bakteri SKT-b baik pada akhir perlakuan maupun pasca uji tantang. Pemberian prebiotik, probiotik, dan sinbiotik hanya dilakukan selama perlakuan 30 hari, sedangkan pasca uji tantang tidak diberikan lagi. Hal ini membuktikan bahwa bakteri Vibrio SKT-b pada perlakuan probiotik dan sinbiotik masih ada di dalam tubuh udang sampai pasca uji tantang.
Pengamatan gejala klinis pada penelitian ini dilakukan setelah udang vaname diinfeksi V. harveyi dan IMNV. Ko-infeksi V. harveyi dan IMNV menunjukkan gejala klinis seperti timbulnya nekrosis pada ruas permukaan tubuh, kehilangan transparansi pada permukaan tubuhnya, usus udang tidak terisi penuh, dan ketika udang mengalami kematian seluruh tubuh udang akan berwarna putih
IV. KESIMPULAN DAN SARAN
4.1 Kesimpulan
Hasil penelitian menunjukkan bahwa pemberian prebiotik, probiotik, dan sinbiotik menghasilkan nilai sintasan, pertumbuhan, dan respon imun yang lebih baik dibandingkan perlakuan kontrol (+). Perlakuan probiotik memiliki nilai sintasan tertinggi yaitu 79,17%, disusul kemudian perlakuan prebiotik yaitu 75,00%, perlakuan sinbiotik yaitu 70,83%, dan sintasan terendah terdapat pada perlakuan K(+) yaitu 50,00%.
4.2 Saran
PEMBERIAN PREBIOTIK, PROBIOTIK, DAN SINBIOTIK
UNTUK PENGENDALIAN KO-INFEKSI BAKTERI
Vibrio
harveyi
DAN IMNV (
INFECTIOUS MYONECROSIS VIRUS
)
PADA UDANG VANAME
Litopenaeus vannamei
JEANNI INDAH NOERMALA
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
PEMBERIAN PREBIOTIK, PROBIOTIK, DAN SINBIOTIK
UNTUK PENGENDALIAN KO-INFEKSI BAKTERI
Vibrio
harveyi
DAN IMNV (
INFECTIOUS MYONECROSIS VIRUS
)
PADA UDANG VANAME
Litopenaeus vannamei
Adalah benar merupakan hasil karya yang belum pernah diajukan dalam bentuk apa pun pada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Desember 2012
ABSTRAK
JEANNI INDAH NOERMALA. Pemberian prebiotik, probiotik, dan sinbiotik untuk pengendalian ko-infeksi bakteri Vibrio harveyi dan IMNV (Infectious Myonecrosis Virus) pada udang vaname Litopenaeus vannamei. Dibimbing oleh WIDANARNI dan SUKENDA.
Penelitian ini bertujuan untuk menguji pengaruh pemberian prebiotik, probiotik, dan sinbiotik terhadap sintasan dan respon imun udang vaname dengan ko-infeksi bakteri Vibrio harveyi dan virus IMNV. Udang yang digunakan memiliki bobot 2,04±0,20 gram/ekor, dipelihara sebanyak 20 ekor dalam akuarium yang berukuran 60 x 30 x 35 cm. Penelitian dilakukan dengan 5 perlakuan yaitu K (+) (tanpa pemberian prebiotik, probiotik dan sinbiotik dengan ko-infeksi), K (-) (tanpa pemberian prebiotik, probiotik dan sinbiotik tanpa ko-infeksi), P1 (pemberian prebiotik dengan infeksi), P2 (pemberian probiotik dengan ko-infeksi), dan P3 (pemberian sinbiotik dengan ko-infeksi). Hasil penelitian menunjukkan bahwa pemberian prebiotik, probiotik dan sinbiotik memberikan pengaruh yang lebih baik dibanding perlakuan K(+). Perlakuan prebiotik, probiotik, dan sinbiotik memiliki nilai sintasan yang lebih tinggi (70,83%-79,17%) dibandingkan dengan perlakuan K(+) (50,00%), serta memiliki respon imun yang lebih baik.
Kata kunci : udang vaname, prebiotik, probiotik, sinbiotik, IMNV, Vibrio harveyi ---
ABSTRACT
JEANNI INDAH NOERMALA. The application of prebiotic, probiotic, and sinbiotic for control of Vibrio harveyi bacteria and IMNV (infectious myonecrosis virus) co-infection to white shrimp Litopenaeus vannamei. Supervised by WIDANARNI dan SUKENDA.
This study aimed to examine the influence of prebiotic, probiotic, and sinbiotic against survival and immune response of white shrimp challenged with co-infection of Vibrio harveyi and the IMNV virus. Shrimp that with a body weigth of 2,04±0.20 g/animal, was kept at 20 shrimps per aquarium with size 60 x 30 x 35 cm. The study was conducted with five treatments consisted of K (+) (without the addition of prebiotic, probiotic and sinbiotic with co-infection), K (-) (without the addition of prebiotic, probiotic and sinbiotic and without co-infection), P1 (the addition of prebiotik with infection), P2 (the addition of probiotic with co-infection), and P3 (the addition of sinbiotik with co-infection). The results showed that prebiotic, probiotic and sinbiotic treatment have better influence than the K (+) treatment. The survival of prebiotic, probiotic, and sinbiotic treatment were higher (70,83%-79,17%) than K(+) treatment (50,00%) and a better immune response were also observed.
PEMBERIAN PREBIOTIK, PROBIOTIK, DAN SINBIOTIK
UNTUK PENGENDALIAN KO-INFEKSI BAKTERI
Vibrio
harveyi
DAN IMNV (
INFECTIOUS MYONECROSIS VIRUS
)
PADA UDANG VANAME
Litopenaeus vannamei
JEANNI INDAH NOERMALA
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi dan Manajemen Perikanan Budidaya
Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan,
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Pemberian prebiotik, probiotik, dan sinbiotik untuk pengendalian ko-infeksi bakteri Vibrio harveyi dan IMNV (Infectious Myonecrosis Virus) pada udang vaname Litopenaeus vannamei
Nama Mahasiswa : Jeanni Indah Noermala Nomor Pokok : C14080024
Disetujui
Pembimbing I Pembimbing II
Dr. Ir. Widanarni, M. Si. Dr. Ir. Sukenda, M. Sc. NIP. 19670927 199403 2 001 NIP. 19671013 199302 1 001
Diketahui
Ketua Departemen Budidaya Perairan
Dr. Ir. Sukenda, M. Sc. NIP. 19671013 199302 1 001
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat dan karunia-Nya sehingga penyusunan skripsi dengan judul “Pemberian prebiotik, probiotik, dan sinbiotik untuk pengendalian ko-infeksi bakteri Vibrio
harveyi dan IMNV (Infectious Myonecrosis Virus) pada udang vaname Litopenaeus vannamei” dapat diselesaikan. Penelitian ini dilaksanakan pada bulan Maret hingga bulan Juli 2012 bertempat di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan terimakasih kepada Dr. Ir. Widanarni, M.Si. dan Dr. Ir. Sukenda, M.Sc. selaku dosen pembimbing dan Julie Ekasari, M.Sc. selaku Dosen Penguji. Ucapan terimakasih disampaikan juga kepada kedua orang tua, Bapak Achmad Ibrahim dan Ibu Agustinah atas dukungan dan bimbingannya, serta kepada Gunawan, M. Iqbal, dan Putri Indah Coralina. Terimakasih juga kepada Bapak Ranta, Kang Adna dan Kak Rahman atas bimbingannya di Laboratorium, Bapak Maryanta, Ibu Yuli, Ibu Ovie, dan Bapak Asep yang telah membantu dalam mengurus administrasi selama studi. Ucapan terimakasih juga disampaikan kepada seluruh keluarga besar BDP PATMO, khususnya Titi, Retno, Adith, Pika, Iday, Ojan, Asbul, Yoga, Dendi, Daus, Aqil, Ima, Oci, Edwina, Anggih, Dina, Kak Hendar, teman-teman BDP 46, Izza, Ayu, teman-teman Kost Assyifa dan semua pihak yang telah memberikan dukungannya kepada penulis dalam menyelesaikan skripsi ini.
Bogor, Desember 2012
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 25 Januari 1990 dari Bapak Achmad Ibrahim dan Ibu Agustinah. Penulis merupakan anak ketiga dari empat bersaudara. Penulis menyelesaikan pendidikan akademik di SMAN 3 Depok dan
diterima di IPB melalui jalur USMI (Undangan Seleksi Masuk IPB) tahun 2008 pada program Studi Teknologi dan Manajemen Perikanan Budidaya, Departemen
Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama masa perkuliahan, penulis aktif mengikuti berbagai kegiatan di organisasi Himpunan Mahasiswa Akuakultur (HIMAKUA) pada tahun kepengurusan 2010-2011 sebagai anggota aktif. Penulis pernah menjadi asisten praktikum pada mata kuliah Manajemen Kesehatan Organisme Akuatik (2012), Dasar-dasar Mikrobiologi Akuatik (2012), dan Penyakit Organisme Akuatik (2012). Penulis juga pernah magang di Balai Budidaya Air Tawar Sukabumi (2009), Balai Besar Pengembangan Budidaya Laut Lampung (2010), Balai Pengembangan Perikanan Budidaya Air Tawar Subang (2010) dan di PT. Central Pertiwi Bahari Rembang dan Situbondo (2011). Penulis merupakan salah satu anggota penerima dana DIKTI pada PKM-P (2012) yang berjudul “Pemberian probiotik pada udang vaname Litopenaeus vannamei dengan ko-infeksi bakteri Vibrio harveyi dan IMNV (Infectious Myonecrosis Virus).
Tugas akhir dalam menyelesaikan pendidikan tinggi di Institut Pertanian Bogor untuk mendapatkan gelar Sarjana Perikanan berjudul Pemberian prebiotik, probiotik, dan sinbiotik untuk pengendalian ko-infeksi bakteri Vibrio harveyi dan IMNV (Infectious Myonecrosis Virus) pada udang vaname
DAFTAR ISI
Halaman
DAFTAR TABEL ... ii
DAFTAR GAMBAR ... iii
DAFTAR LAMPIRAN ... iv
I. PENDAHULUAN ...1
II. BAHAN DAN METODE ...3 2.1 Persiapan Prebiotik ... 3 2.2 Persiapan Probiotik ... 4 2.3 Pengujian Prebiotik, Probiotik, dan Sinbiotik secara In Vivo ... 4 2.3.1 Persiapan Wadah ... 4 2.3.2Persiapan Hewan Uji ... 5 2.3.3 Persiapan Pakan Uji ... 5 2.3.4 Persiapan Ko-infeksi Bakteri dan Virus ... 5 2.3.5Pengujian Pakan Uji pada Udang Vaname ... 6 2.4 Parameter Uji ... 7 2.4.1 Sintasan ... 7 2.4.2 Laju Pertumbuhan Harian ... 7 2.4.3 Rasio Konversi Pakan ... 7 2.4.4Total Hemosit ... 8 2.4.5 Diferensial Hemosit ... 8 2.4.6 Total Bakteri dan Total SKT-b ... 8 2.4.7Gejala Klinis ... 9 2.4.8 Kualitas Air ... 9 2.5 Analisis Data ... 9
III. HASIL DAN PEMBAHASAN ...10 3.1 Hasil ... 10
3.1.1 Sintasan ... 10 3.1.2 Laju Pertumbuhan Harian ... 10 3.1.3 Rasio Konversi Pakan ... 11 3.1.4 Total Hemosit ... 12 3.1.5 Diferensial Hemosit ... 12 3.1.6 Total Bakteri dan Total SKT-b ... 14 3.1.7 Gejala Klinis ... 15 3.1.8 Kualitas Air ... 16 3.2 Pembahasan ... 16
IV. KESIMPULAN DAN SARAN ...22 4.1 Kesimpulan ... 22 4.2 Saran ... 22
DAFTAR PUSTAKA ...23
ii
DAFTAR TABEL
Halaman
1. Rancangan perlakuan pemberian prebiotik, probiotik, dan sinbiotik dengan ko-infeksi V. harveyi dan IMNV. ... 6
iii
DAFTAR GAMBAR
Halaman
1. Nilai sintasan udang vaname pada akhir perlakuan prebiotik, probiotik, dan sinbiotik (a); Nilai sintasan udang vaname pada pasca uji tantang dengan ko-infeksi V. harveyi dan IMNV (b). ...10 2. Laju Pertumbuhan Harian (LPH) udang vaname selama perlakuan ...11 3. Nilai rasio konversi pakan (FCR) udang vaname selama perlakuan
prebiotik, probiotik, dan sinbiotik. ...11 4. Total hemosit udang vaname pada akhir perlakuan prebiotik, probiotik,
dan sinbiotik (a); Total hemosit udang vaname pada pasca uji tantang dengan ko-infeksi V. harveyi dan IMNV (b) ...12 5. Persentase sel hialin udang vaname selama perlakuan prebiotik, probiotik,
dan sinbiotik (a); Persentase sel granular udang vaname selama perlakuan prebiotik, probiotik, dan sinbiotik (b). ...13 6. Persentase sel hialin udang vaname pada pasca uji tantang dengan
ko-infeksi V. harveyi dan IMNV (a); Persentase sel granular udang vaname pada pasca uji tantang dengan ko-infeksi V. harveyi dan IMNV (b). ...13 7. Total bakteri di dalam usus udang vaname pada akhir perlakuan prebiotik,
probiotik, dan sinbiotik (a); Total bakteri di dalam usus udang vaname pada pasca uji tantang dengan ko-infeksi V. harveyi dan IMNV (b). ...14 8. Total bakteri SKT-b di dalam usus udang vaname pada akhir perlakuan
prebiotik, probiotik, dan sinbiotik (a); Total bakteri SKT-b di dalam usus udang vaname pada pasca uji tantang dengan ko-infeksi V. harveyi dan IMNV (b). ...15 9. Gejala klinis pada udang vaname setelah di koinfeksi: Udang normal (a);
iv
DAFTAR LAMPIRAN
Halaman
1. Prosedur pembuatan media Sea Water Complete (SWC) dan larutan Phosphate Buffer Saline (PBS) ... 27
2. Analisis statistik terhadap nilai Laju Pertumbuhan Harian (LPH) udang vaname pada akhir perlakuan. ... 28
3. Analisis statistik terhadap nilai rasio konversi pakan (FCR) udang vaname pada akhir perlakuan. ... 28
4. Analisis statistik terhadap total hemosit udang vaname pada akhir perlakuan. ... 28
5. Analisis statistik terhadap total hemosit udang vaname pada pasca uji tantang yang diko-infeksi V. harveyi dan IMNV. ... 29
6. Analisis statistik terhadap diferensial hemosit udang vaname pada akhir perlakuan. ... 29
7. Analisis statistik terhadap diferensial hemosit udang vaname pada pasca uji tantang yang diko-infeksi V. harveyi dan IMNV. ... 30
8. Analisis statistik terhadap total bakteri udang vaname akhir perlakuan. ... 31
I. PENDAHULUAN
Udang vaname (Litopenaeus vannamei) merupakan salah satu komoditas ekspor yang bernilai cukup tinggi pada sektor perikanan. Kementerian Kelautan dan Perikanan dalam Antara (2010) menargetkan produksi udang pada 2014
sebesar 699 ribu ton, terdiri atas 188 ribu ton udang windu dan 511 ribu ton udang vaname. Permintaan konsumen dunia terhadap udang rata-rata naik 11,5% per tahun. Hingga saat ini komoditas udang vaname masih merupakan pilihan utama untuk dibudidayakan oleh petambak. Negara produsen udang yang menjadi pesaing baru Indonesia dalam ekspor udang juga terus bermunculan. Hal ini dikarenakan udang vaname mempunyai harga pasar yang baik yaitu US$ 7 per kg, naik 40% dibanding tahun lalu (Bisnis Indonesia 2012). Untuk memenuhi permintaan yang terus meningkat tersebut perlu dilakukan budidaya udang vaname secara intensif.
Penyakit yang sering menjadi masalah utama dalam budidaya udang terutama vaname salah satunya adalah penyakit IMN (Infectious Myonecrosis) yang disebabkan oleh infeksi virus IMNV (Infectious Myonecrosis Virus) (Costa et al. 2009). Gejala klinis yang umum terjadi pada udang yang terserang IMNV adalah munculnya warna putih pada distal abdomen dan kehilangan transparansi pada permukaan tubuhnya. Mortalitas udang yang disebabkan oleh IMNV mencapai 40%-60% di tambak (Tang et al. 2005).
Selain IMNV, penyakit yang sering menyerang udang vaname adalah penyakit bakterial yang disebabkan oleh Vibrio harveyi. Bakteri V. harveyi adalah
salah satu agen penyakit vibriosis yang menyebabkan penyakit udang berpendar serta merupakan patogen oportunistik yang umum dijumpai di lingkungan pemeliharaan dan bersimbiosis dengan udang atau ikan air laut. Jika kondisi udang menurun maka bakteri ini akan bersifat patogen (Lavilla-Pitogo et al. 1990). Berdasarkan hasil penelitian Widagdo (2011), udang vaname yang diinfeksi V. harveyi dengan dosis 106 CFU/mL memiliki nilai sintasan 31,67%.
2 lebih banyak pada budidaya udang vaname. Ko-infeksi pada udang di tambak banyak menyerang stadia awal dan ukuran juvenil (Phuoc et al. 2009). Hasan (2011) melaporkan bahwa ko-infeksi virus IMNV dengan V. harveyi pada dosis 108 CFU/mL memperlihatkan adanya mortalitas kumulatif mencapai 54% dengan awal mortalitas yang lebih cepat dan nilai yang lebih tinggi dibandingkan infeksi tunggal IMNV dengan nilai mortalitas kumulatif sebesar 38% selama pengamatan 14 hari.
Penanggulangan penyakit pada udang sering kali dilakukan dengan pemberian antibiotik. Akan tetapi, penggunaan antibiotik yang terus menerus dikhawatirkan akan menyebabkan timbulnya strain baru bakteri yang tahan terhadap antibiotik tersebut dan menyebabkan pencemaran lingkungan. Penggunaan prebiotik, probiotik dan sinbiotik saat ini merupakan alternatif dalam mengatasi permasalahan serangan penyakit yang sering timbul. Probiotik merupakan jenis mikroba hidup yang memberikan pengaruh menguntungkan pada inang yaitu melalui peningkatan sistem imun, memperbaiki kualitas lingkungan hidup inang, dan memperbaiki nilai nutrisi pakan (Verschuere et al. 2000). Bakteri probiotik Vibrio SKT-b memiliki kemampuan untuk menghambat pertumbuhan bakteri patogen V. harveyi dalam uji in vitro dan in vivo (Widanarni et al. 2003). Prebiotik merupakan bahan pangan dengan kandungan oligosakarida yang tidak dapat dicerna oleh inang tetapi memberikan efek menguntungkan bagi inang dengan cara merangsang pertumbuhan mikroflora normal di dalam saluran pencernaan inang. Sinbiotik merupakan kombinasi seimbang dari probiotik dan prebiotik dalam mendukung kelangsungan hidup dan pertumbuhan bakteri yang menguntungkan dalam saluran pencernaan makhluk hidup (Schrezenmeir & Vrese 2001). Namun, saat ini belum ada informasi mengenai penggunaan prebiotik,
probiotik, dan sinbiotik untuk menangani ko-infeksi V. harveyi dan IMNV.
II. BAHAN DAN METODE
2.1 Persiapan Prebiotik
Prebiotik yang digunakan berasal dari tepung ubi jalar varietas sukuh. Metode yang dilakukan pada persiapan prebiotik berdasarkan metode yang
dilakukan Marlis (2008). Proses pembuatan tepung ubi jalar yaitu ubi jalar segar dibersihkan dan dikupas, kemudian diiris dengan menggunakan slicer dengan ketebalan ± 1 mm. Setelah itu, irisan ubi jalar dikeringkan dalam oven pada suhu 55 oC selama 5 jam dan digiling dengan willey mill. Selanjutnya diayak dengan ukuran ayakan 60 mesh. Tepung ubi jalar selanjutnya dicampur air dengan perbandingan 1:1 (w/v) dan dikukus selama 30 menit pada suhu 100 oC. Setelah itu tepung ubi jalar dikeringkan menggunakan oven pada suhu 55 oC selama 18 jam. Selanjutnya, tepung ubi tersebut digiling dan disaring menggunakan ayakan.
Tahap selanjutnya yaitu ekstraksi oligosakarida. Tepung ubi jalar yang sudah kering tersebut disuspensikan ke dalam etanol 70% dengan perbandingan 1:10. Kemudian dihomogenisasi menggunakan magnetic stirer selama 15 jam dan dilakukan penyaringan dengan menggunakan kertas saring steril dan disentrifuse selama 15 menit dengan kecepatan 5.000 rpm. Filtrat yang telah diperoleh dipekatkan menggunakan evaporator vakum pada suhu 40 oC.
Sebelum filtrat ubi jalar tersebut digunakan, dilakukan pengukuran total padatan terlarut (TPT) terlebih dahulu. Hasil dari pemekatan ekstraksi ubi jalar tersebut diencerkan dengan menggunakan akuades steril hingga mencapai kadar TPT sebesar 5% (Marlis 2008). Cawan porselin dimasukkan ke dalam oven
selama 1 jam dengan suhu 100 oC, kemudian cawan tersebut didinginkan dalam desikator dan ditimbang (a gram). Setelah itu, sebanyak 1 mL ekstrak oligosakarida hasil ekstraksi dari ubi jalar ditempatkan pada cawan porselin tersebut, kemudian ditimbang (b gram). Cawan porselin berisi ekstrak oligosakarida tersebut dimasukkan ke dalam oven dengan suhu 100oC selama 24 jam. Setelah itu cawan didinginkan dalam desikator selama 10 menit, kemudian cawan tersebut ditimbang (c gram). Total padatan terlarut dihitung dengan rumus:
4
2.2 Persiapan Probiotik
Pada penelitian ini bakteri probiotik yang digunakan adalah bakteri Vibrio
SKT-b yang telah diuji dapat menghambat pertumbuhan V. harveyi secara in vitro
dan in vivo serta telah diidentifikasi sebagai bakteri Vibrio alginolyticus (Widanarni
et al. 2003). Media yang digunakan untuk persiapan probiotik adalah SWC (Sea
Water Complete). Terlebih dahulu media SWC dan PBS (Phosphate Buffer Saline) disiapkan (Lampiran 1). Tahap selanjutnya yaitu media SWC cair steril sebanyak 25 mL diinokulasikan satu ose isolat bakteri Vibrio SKT-b yang berumur 24 jam yang dilakukan secara aseptik. Selanjutnya hasil inokulasi tersebut diinkubasi dalam waterbath shaker pada suhu 29-30 oC dengan kecepatan 140 rpm selama 24 jam. Setelah itu, suspensi bakteri dipindahkan ke dalam tabung corning 25 mL kemudian disentrifuse selama 10 menit dengan kecepatan 5.000 rpm untuk memisahkan pellet dengan supernatan. Padatan sel bakteri (pellet) yang diperoleh kemudian dicuci sebanyak 2 kali dengan larutan PBS 25 mL, dihomogenisasi dengan vortex dan disentrifuse selama 10 menit dengan kecepatan 5.000 rpm dan supernatan dibuang. Setelah itu, ditambahkan kembali larutan PBS sebanyak 10 mL dan dihomogenisasi dengan vortex. Hasil dari vortex ini adalah probiotik yang akan dicampurkan ke dalam pakan.
2.3 Pengujian Prebiotik, Probiotik, dan Sinbiotik secara In Vivo 2.3.1 Persiapan Wadah
Wadah yang digunakan dalam penelitian ini adalah 15 akuarium berukuran 60 cm x 30 cm x 35 cm. Sebelum digunakan, akuarium dicuci terlebih dahulu menggunakan deterjen dan dikeringkan. Kemudian akuarium didesinfeksi
5
2.3.2 Persiapan Hewan Uji
Hewan uji yang digunakan dalam penelitian ini adalah udang vaname stadia PL (Post Larvae) 38 yang berasal dari Labuan, Banten. Sebelum perlakuan, benur dipelihara sampai memiliki bobot 2 g/ekor. Pemeliharaan udang dilakukan selama 30 hari untuk pengujian nilai sintasan dan respon imun dengan kepadatan 20 ekor/akuarium atau 100 ekor/m2.
2.3.3 Persiapan Pakan Uji
Pakan yang digunakan selama penelitian ini adalah pelet komersil dengan
kandungan protein 40% dan diberikan sebanyak 4 kali sehari. Dosis probiotik yang digunakan sebesar 1% (v/w) dari jumlah pakan yang akan diberikan (Wang 2007). Sedangkan dosis prebiotik yang digunakan sebesar 2% (v/w) dari jumlah pakan yang akan diberikan (Mahious et al. 2006). Untuk pembuatan sinbiotik dilakukan dengan cara mengkombinasikan probiotik dan prebiotik pada pakan yang akan diberikan dengan menambahkan kuning telur sebanyak 2% (v/w) dari total pakan yang berfungsi sebagai perekat (Wang 2007). Sebelum diberikan ke udang, pakan dikeringudarakan terlebih dahulu selama 10-15 menit untuk mengurangi kelembaban.
2.3.4 Persiapan Ko-infeksi Bakteri dan Virus
Uji tantang yang dilakukan dalam penelitian ini adalah ko-infeksi bakteri V. harveyi dan IMNV. Infeksi V. harveyi dilakukan dengan metode perendaman (imersi). Setelah itu udang diinfeksi IMNV dengan metode injeksi. Udang vaname positif IMNV didapatkan dari Balai Pengembangan Budidaya Air Payau (BPBAP) Situbondo, Jawa Timur. Pembuatan ekstrak IMNV yang akan digunakan untuk injeksi berdasarkan prosedur yang dilakukan Escobedo et al. (2006). Adapun prosedur pembuatan ekstrak IMNV yaitu daging udang positif IMNV dicacah (tanpa hepatopankreas, usus, dan karapas) dan kemudian dilarutkan dalam PBS dengan perbandingan daging udang dan PBS adalah 1:10.
6 diinjeksi dengan IMNV pada bagian punggung antara segmen 3 dan 4 sebanyak 100 µL (Tang et al. 2005).
Setelah itu dilakukan kultur bakteri V. harveyi yang digunakan untuk infeksi secara imersi. Kepadatan bakteri V. harveyi yang digunakan adalah 106 CFU/mL dan imersi dilakukan selama 30 menit di dalam wadah terpisah yaitu 20 ekor udang/2 L (Widagdo 2011). Pengamatan dilakukan selama 14 hari setelah dilakukan koinfeksi.
2.3.5 Pengujian Pakan Uji pada Udang Vaname
Pengujian ini terdiri dari 5 perlakuan dengan 3 kali ulangan. Rancangan perlakuan penelitian dapat dilihat pada Tabel 1.
Tabel 1 Rancangan perlakuan pemberian prebiotik, probiotik, dan sinbiotik dengan ko-infeksi V. harveyi dan IMNV.
Pemberian pakan dilakukan empat kali dalam sehari pada pukul 07.00, 11.00, 15.00, dan 19.00 WIB. Jumlah pakan yang diberikan didasarkan pada Feeding Rate (FR) menurut SNI 01-7246-2006 yaitu 15% menurun hingga 10%. Pengelolaan kualitas air dilakukan dengan penyiponan dan pergantian air setiap pagi hari sebanyak 10% dari total volume akuarium.
Pemeliharaan udang dengan perlakuan prebiotik, probiotik dan sinbiotik dilakukan selama 30 hari, kemudian dilakukan uji tantang dengan ko-infeksi V. harveyi dan IMNV. Kemudian udang ditempatkan kembali ke dalam akuarium pemeliharaan. Pemeliharaan pasca uji tantang dan pengamatan dilakukan selama 14 hari. Parameter yang diamati selama perlakuan dan pasca uji tantang adalah sintasan, laju pertumbuhan harian (LPH), rasio konversi pakan (FCR), total hemosit, diferensial hemosit, total bakteri dan total bakteri SKT-b, gejala klinis, dan kualitas air.
Perlakuan Keterangan
K (+) Pemberian pakan komersil tanpa penambahan prebiotik, probiotik, dan sinbiotik dengan ko-infeksi V. harveyi dan IMNV.
K (-) Pemberian pakan komersil tanpa penambahan prebiotik, probiotik, dan sinbiotik tanpa ko-infeksi V. harveyi dan IMNV.
P1 Pemberian pakan komersil dengan penambahan prebiotik dengan ko-infeksi V. harveyi dan IMNV.
P2 Pemberian pakan komersil dengan penambahan probiotik dengan ko-infeksi V. harveyi dan IMNV.
7
2.4 Parameter Uji 2.4.1 Sintasan
Sintasan atau kelangsungan hidup merupakan presentase ikan yang hidup, dengan rumus sebagai berikut (Effendi 2004) :
Sintasan (%)
Keterangan :
Nt = jumlah individu pada akhir perlakuan (hari ke-t)
No = jumlah individu pada awal perlakuan (hari ke-0)
2.4.2 Laju Pertumbuhan Harian
Bobot udang diukur setiap 10 hari sekali selama pemeliharaan, dan laju pertumbuhan harian dihitung sebagai berikut (Huisman, 1987):
% 100 1 x Wo
Wt t
LPH t 1 x
Keterangan :
LPH = Laju pertumbuhan harian (%)
Wt = Bobot rata-rata pada akhir perlakuan (g) Wo = Bobot rata-rata pada awal perlakuan (g) t = Periode pemeliharaan (hari)
2.4.3 Rasio Konversi Pakan
Rasio konversi pakan atau Feeding Conversi Ratio (FCR) selama pemeliharaan dihitung menggunakan rumus (Zonneveld et al. 1991) :
Keterangan :
FCR = Konversi pakan F = Jumlah pakan (g)
Bt = Biomassa udang pada saat akhir perlakuan (g) Bm = Biomassa udang yang mati saat perlakuan (g) Bo = Biomassa udang pada saat awal perlakuan (g)
% 100
8
2.4.4 Total Hemosit
Pengamatan terhadap total hemosit dilakukan pada akhir perlakuan probiotik, prebiotik dan sinbiotik (hari ke-29) serta pasca ko-infeksi V. harveyi dan IMNV (hari ke-44). Penghitungan total hemosit yaitu dengan cara haemolymph diambil sebanyak 0,1 mL per ekor udang tiap ulangan dari pangkal kaki renang pertama dengan menggunakan syringe 1 mL yang sudah berisi 0,3 mL antikoagulan Na-sitrat 3,8%. Kemudian campuran tersebut dihomogenkan, tetesan pertama dibuang sedangkan tetesan selanjutnya diteteskan pada
haemositometer dan diamati di bawah mikroskop.
2.4.5 Diferensial Hemosit
Pembuatan preparasi untuk diferensial hemosit dilakukan pada akhir perlakuan probiotik, prebiotik dan sinbiotik (hari ke-29) serta pasca ko-infeksi V. harveyi dan IMNV (hari ke-44). Tahap pertama yaitu haemolymph yang telah diambil dari udang uji diteteskan pada gelas objek dan dibuat ulasan, kemudian dikeringkan. Setelah itu difiksasi dengan methanol 100% selama 5 menit dan dikeringkan di udara kembali. Tahap selanjutnya yaitu preparat tersebut diwarnai dengan larutan giemsa 10% selama 15 menit dan dikeringkan di udara. Kemudian dicuci dalam air mengalir selama 30 detik dan dibiarkan kering. Jumlah hemosit dihitung hingga 100 sel dan ditentukan persentase tiap jenisnya (hialin dan granular). Persentase tiap jenis sel hemosit dihitung dengan rumus:
% jenis sel hemosit = x 100%
2.4.6 Total Bakteri dan Total SKT-b
Pengamatan total bakteri dilakukan pada akhir perlakuan (pada hari ke-30) dan pasca uji tantang (hari ke-32 dan hari ke-45). Perhitungan total bakteri ini berdasarkan jumlah bakteri dalam usus udang. Usus diambil dan ditimbang bobotnya, lalu dimasukkan ke dalam larutan PBS dengan perbandingan 1:10. Setelah itu usus digerus sampai homogen dengan larutan PBS, lalu diambil sebanyak 0,1 mL dan dilakukan pengenceran bertingkat sampai pengenceran 10-7.
Kemudian hasil pengenceran tersebut dituang dalam cawan petri dengan metode agar tuang pada media SWC dan TCBS yang mengandung rifampisin 50 µg/ml
9 jam. Pada media SWC semua bakteri akan tumbuh, sedangkan pada media TCBS + Rf hanya bakteri Vibrio SKT-b yang akan tumbuh karena telah dibuat resisten terhadap antibiotik rifampisin (Ayuzar 2008).
2.4.7 Gejala Klinis
Pengamatan gejala klinis dilakukan dengan melihat perubahan atau kelainan pada anatomi makro udang. Gejala klinis yang diamati ialah terbentuknya otot berwarna putih pada bagian ruas tubuh udang, dan warna kemerahan pada bagian ekor. Pengamatan gejala klinis ini dilakukan pada awal
dan akhir uji tantang.
2.4.8 Kualitas Air
Kualitas air diukur pada awal dan akhir perlakuan prebiotik, probiotik, dan sinbiotik. Pengamatan kualitas air dilakukan pada air stok awal dan air media pemeliharaan masing-masing perlakuan. Parameter kualitas air yang diukur adalah suhu, pH, DO, salinitas, dan TAN.
2.5 Analisis Data
III. HASIL DAN PEMBAHASAN
3.1 Hasil 3.1.1 Sintasan
Penghitungan nilai sintasan dilakukan pada akhir perlakuan prebiotik, probiotik, dan sinbiotik serta pasca uji tantang dengan ko-infeksi V. harveyi dan IMNV.