ABSTRAK
NURLITA CHRISTYANINGSIH. Pemberian sinbiotik dengan dosis prebiotik berbeda untuk pencegahan infeksi IMNV (Infectious Myonecrosis Virus) pada pemeliharaan udang vaname Litopenaeus vannamei. Dibimbing oleh
WIDANARNI dan SUKENDA.
Udang vaname merupakan salah satu komoditas unggulan karena permintaannya yang selalu meningkat. Namun sampai saat ini serangan penyakit IMN (Infectious Myonecrosis) masih banyak menyerang udang vaname. Penelitian ini dilakukan untuk menguji efektivitas pemberian sinbiotik dengan dosis prebiotik berbeda terhadap sintasan dan respon imun udang vaname yang diinfeksi IMNV. Probiotik dan prebiotik yang digunakan adalah bakteri SKT-b (Vibrio alginolyticus) dan oligosakarida hasil ekstraksi tepung ubi jalar varietas sukuh. Udang vaname dengan bobot rata-rata 0,647±0,049 g/ekor sebanyak 40 ekor dipelihara dalam akuarium dengan volume air laut 45 liter selama 30 hari dengan perlakuan yaitu K (tanpa pemberian sinbiotik), P1(pemberian probiotik + prebiotik 1%), P2 (pemberian probiotik + prebiotik 2%), dan P3 (pemberian probiotik + prebiotik 3%). Setelah 30 hari perlakuan kontrol dibagi menjadi dua yaitu K- dan K+, P1, P2, dan P3 diinfeksi dengan IMNV melalui injeksi, kecuali K- yang diinjeksi dengan PBS. Hasil penelitian menunjukkan bahwa pemberian sinbiotik dalam pakan dengan dosis probiotik + prebiotik 3% dan diinfeksi IMNV mampu memberikan pengaruh yang lebih baik dibanding perlakuan lainnya dengan nilai sintasan sebesar 43,33% dan respon imun yang lebih baik.
ABSTRACT
NURLITA CHRISTYANINGSIH. The administration of sinbiotic with the different doses of prebiotic for prevention of IMNV (Infectious Myonecrosis Virus) in white shrimp Litopenaeus vannamei culture. Supervised by
WIDANARNI and SUKENDA.
White shrimp is one of the important commodity because of the increasing of demand. However, losses due to IMN disease still remain an important concern till now. This study aims to evaluate of effectiveness the giving with the different doses of survival rate dan immune response white shrimp infected by IMNV. SKT-b (Vibrio alginolyticus) and oligosaccharides, extracted from sweet potato (sukuh variety), was used as probiotic and prebiotic. White shrimp with an average body weight of 0.647±0.049 g/shrimps, with amount 40 shrimps in an aquarium with a volume of 45 L. Shrimps cultured in 30 days, consisted four treatment, control (without sinbiotic), P1(probiotic + prebiotic 1%), P2 (probiotic + prebiotic 2%), and P3 (probiotic + prebiotic 3%). After 30 days of shrimps culture, this study consisted of five treatments, negative and positive control, P1, P2, and P3, then were infected by injection of IMNV, except negative control were injected by PBS. The results showed that sinbiotic application with probiotic + prebiotic 3% dose and infected by IMNV give a better effect than other treatments, with survival rate 43,33% dan give a better immune response.
1
I.
PENDAHULUAN
Udang vaname (Litopenaeus vannamei) merupakan salah satu komoditas perikanan yang bernilai ekonomis tinggi. Setiap tahun permintaan pasar akan udang vaname selalu mengalami peningkatan, sehingga Kementerian Kelautan dan Perikanan (KKP) menargetkan produksi udang nasional sebesar 699.000 ton pada tahun 2014 atau meningkat sebesar 74,75% selama periode 2010-2014 (KKP 2010). Produksi udang vaname sendiri meningkat sejak tahun 2005 dari 280.629 ton menjadi 400.300 ton di tahun 2010, namun pada tahun 2009 mengalami penurunan dari produksi sebelumnya sebesar 61.490 ton (KKP 2010). Penurunan produksi ini salah satunya disebabkan oleh adanya serangan penyakit IMN (Infectious Myonecrosis), yang sampai saat ini masih sering menyerang budidaya udang di tambak dan menjadi masalah bagi para pembudidaya.
Penyakit IMN akibat infeksi IMNV (Infectious Myonecrosis Virus) pertama kali ditemukan di Brazil tahun 2002 dan menyebabkan dampak kerugian ekonomi yang signifikan (Costa et al. 2009). Wabah IMNV menyebar ke Indonesia dengan gejala klinis mirip dengan wabah di Brazil pada tahun 2006 (Senapin et al. 2007). Serangan penyakit IMN pertama kali terdeteksi di Indonesia pada Mei-Juni 2006. Penyakit IMN ini menyebabkan kematian 10-30% pada budidaya udang di tambak (Taukhid dan Nur’aini 2009). Gejala klinis penyakit IMN yaitu hilangnya transparansi pada jaringan otot akibat nekrosis. Pada stadia infeksi lanjutan, warna putih pada abdomen dan ekor akibat nekrosis akan berubah menjadi merah dan dapat menyebabkan mortalitas mencapai 70% (Tang
et al. 2008). Sampai tahun 2009, penyakit IMN terdeteksi di Jawa Timur, Bali,
dan Nusa Tenggara Barat (Taukhid dan Nur’aini 2009).
2
probiotik dan prebiotik dalam mendukung sintasan serta pertumbuhan bakteri yang menguntungkan dalam saluran pencernaan mahluk hidup.
Probiotik didefinisikan sebagai kultur hidup satu jenis mikroba atau lebih yang memberikan pengaruh menguntungkan bagi inang melalui peningkatan sistem imun, memperbaiki kualitas lingkungan hidup inang, dan memperbaiki nilai nutrisi pakan (Verschuere et al. 2000). Probiotik yang digunakan dalam penelitian ini adalah probiotik SKT-b. Probiotik SKT-b merupakan bakteri Vibrio alginolyticus yang memiliki kemampuan untuk menghambat pertumbuhan bakteri patogen Vibrio harveyi dalam uji in vitro dan in vivo (Widanarni et al. 2003). Probiotik V. alginolyticus SKT-b juga mampu meningkatkan sistem imun pada udang vaname setelah diinfeksi dengan V. harveyi (Syaihalatua 2009).
Prebiotik merupakan bahan pangan yang tidak dapat dicerna oleh inang tetapi memberikan efek menguntungkan bagi inang dengan cara merangsang pertumbuhan mikroflora normal di dalam saluran pencernaan inang (Schrezenmeir dan Vrese 2001). Prebiotik yang digunakan dalam penelitian ini adalah oligosakarida yang diperoleh dari ekstraksi tepung ubi jalar varietas Sukuh
Ipomoea batatas L.
Penambahan sinbiotik dalam pakan terbukti mampu meningkatkan sintasan dan respon imun pada ikan dan udang. Pemberian probiotik Bacillus OJ (PB) 108 CFU/g pakandan prebiotik isomaltooligosaccharides (IMO) 0,2% pada udang vaname yang diinfeksi WSSV (White Spote Syndrome Virus) terbukti memberikan nilai sintasan yang lebih tinggi (>80%) dan respon imun yang lebih baik dibanding perlakuan IMO saja, PB saja, atau IMO 0,2%+PB 1010 CFU/g (Li
et al. 2009). Pemberian probiotik SKT-b dan prebiotik oligosakarida dari ubi jalar telah diteliti mampu meningkatkan sintasan dan memperbaiki respon imun udang vaname terhadap infeksi Vibrio harveyi (Widagdo 2011) dan IMNV (Septiani 2011; Damayanti 2011), namun belum diketahui perbandingan yang tepat antara dosis probiotik SKT-b dan prebiotik dari ubi jalar.
3
II. BAHAN DAN METODE
2.1 Persiapan Prebiotik/Ekstraksi Oligosakarida
Proses ekstraksi oligosakarida/prebiotik mengacu pada metode Muchtadi (1989). Sebanyak 500 g tepung ubi jalar varietas sukuh Ipomoea batatas L. dicampur air dengan perbandingan 1:1 (w/v) dan dikukus pada suhu 100 oC selama 30 menit. Kemudian dikeringkan dalam oven pada suhu 55 oC selama 18 jam. Selanjutnya, digiling dan disaring dengan ayakan hingga tepung kukus ubi jalar varietas sukuh dapat terkumpul. Pada proses ekstraksi, sebanyak 10 g tepung kukus ubi jalar varietas sukuh disuspensikan ke dalam 100 mL etanol 70% dan diinkubasi dalam thermoshaker selama 15 jam dengan kecepatan 120 rpm pada suhu ruang. Kemudian dilakukan penyaringan menggunakan kertas saring steril. Filtrat yang diperoleh dipekatkan dengan evaporator vakum pada suhu 40 oC. Setelah itu hasil ekstraksi di frezee dry hingga diperoleh padatan ekstrak oligosakarida. Hasil ekstraksi ini diencerkan dengan akuades dengan perbandingan 1:1 (w/v).
2.2 Persiapan Probiotik
Pertama dilakukan kultur bakteri probiotik SKT-b pada media Sea Water Complete (SWC-agar miring) (5 g bactopeptone, 1 g yeast extract, 3 ml gliserol, 15 g agar, 750 ml air laut, dan 250 ml akuades) dan diinkubasi selama 24 jam pada suhu ruang. Kemudian bakteri probiotik SKT-b tersebut diinokulasikan ke dalam media SWC cair dan diinkubasi dalam waterbath shaker pada suhu 29-30 o
C dengan kecepatan 140 rpm selama 16 jam. Setelah itu, suspensi bakteri dipindahkan ke dalam eppendorf untuk masing-masing perlakuan kemudian disentrifuse selama 5 menit dengan kecepatan 10.000 rpm untuk memisahkan padatan sel bakteri dengan supernatan. Supernatan dibuang dan diperoleh padatan sel bakteri probiotik yang akan dicampurkan dengan prebiotik dan pakan.
2.3 Pengujian Sinbiotik secara In Vivo
2.3.1 Persiapan Wadah
4
dengan deterjen dan dikeringkan. Kemudian didesinfeksi dengan klorin 100 ppm dan dibiarkan selama 24 jam. Setelah itu akuarium dibilas dengan air tawar hingga bersih, kemudian sebanyak 45 L air laut dimasukkan pada setiap akuarium. Media pemeliharaan menggunakan air laut yang berasal dari Ancol. Air laut terlebih dahulu ditampung dalam tandon dan didesinfeksi dengan klorin 30 ppm dan dinetralkan dengan Na-Thiosulfat 15 ppm. Setiap akuarium dilengkapi dengan aerasi dan shelter sebagai tempat udang berlindung saat molting. Pada semua ulangan setiap perlakuan dirangkai dalam satu sistem resirkulasi (Lampiran 1). Bagian tepi setiap akuarium ditutup dengan plastik hitam untuk menghindari pengaruh luar yang dapat mengakibatkan udang stress, serta bagian atas akuarium ditutup dengan waring untuk menghindari udang lompat keluar akuarium.
2.3.2 Persiapan Hewan Uji
Hewan uji yang digunakan dalam penelitian ini adalah benur udang vaname stadia PL 41 yang berasal dari Labuan, Banten. Sebelum diberi perlakuan, benur dipelihara selama 12 hari dalam tandon 1 m3. Selama pemeliharaan udang diberi pakan komersil 5 kali sehari pukul 06.00, 10.00, 14.00, 18.00, dan 22.00 WIB. Pemeliharaan dilakukan dengan sistem resirkulasi menggunakan top filter, dilakukan penyiponan terhadap sisa pakan dan feses pada pagi dan sore hari.
2.3.3 Persiapan Pakan Uji
Pembuatan sinbiotik dilakukan dengan mengkombinasikan probiotik dan prebiotik pada pakan yang akan diberikan. Dosis probiotik yang digunakan sebesar 1% (w/w) dari jumlah pakan yang akan diberikan (Wang 2007). Dosis prebiotik yang digunakan dalam penelitian ini sebesar 1%, 2%, dan 3% (v/w) dari jumlah pakan yang akan diberikan. Pencampuran dilakukan dengan menambahkan gelatin sebanyak 3% (Pearce et al. 2002) dari total pakan yang berfungsi sebagai perekat, termasuk pada perlakuan kontrol. Setelah selesai dilakukan pencampuran dan sebelum diberikan ke udang, pakan dikeringanginkan terlebih dahulu selama 15 menit untuk mengurangi kelembaban.
2.3.4 Perlakuan Pakan Uji pada Udang Vaname
5
Tabel 1. Perlakuan pemberian pakan sinbiotik dengan dosis prebiotik berbeda pada pakan udang vaname L. vannamei dan infeksi dengan IMNV.
Perlakuan Keterangan
Perlakuan 1 Pemberian pakan komersil tanpa penambahan sinbiotik dan tanpa infeksi IMNV (kontrol -)
Perlakuan 2 Pemberian pakan komersil tanpa penambahan sinbiotik kemudian diinfeksi IMNV (kontrol +)
Perlakuan 3 Pemberian pakan komersil dengan penambahan probiotik dan prebiotik 1% kemudian diinfeksi IMNV (P1)
Perlakuan 4 Pemberian pakan komersil dengan penambahan probiotik dan prebiotik 2% kemudian diinfeksi IMNV (P2)
Perlakuan 5 Pemberian pakan komersil dengan penambahan probiotik dan prebiotik 3% kemudian diinfeksi IMNV (P3)
Pemeliharaan udang dengan pemberian perlakuan sinbiotik dilakukan selama 30 hari. Udang uji sebanyak 40 ekor dengan bobot rata-rata 0,647±0,049 g/ekor dipelihara dalam akuarium dengan volume air laut 45 L. Pemberian pakan dilakukan lima kali dalam sehari pada pukul 06.00, 10.00, 14.00, 18.00, dan 22.00 WIB. Pemberian pakan sinbiotik diberikan satu kali pada pukul 10.00 dan pada waktu pemberian pakan yang lain diberikan pelet komersil secara at-satiation
serta dilakukan penyiponan terhadap sisa pakan dan feses.
2.4 Prosedur Uji Tantang
Uji tantang yang dilakukan adalah infeksi IMNV melalui injeksi. Udang vaname positif IMNV didapatkan dari Balai Pengembangan Budidaya Air Payau (BPBAP) Situbondo, Jawa Timur yang diekstrak berdasarkan prosedur yang dilakukan Escobedo et al. (2006) untuk didapatkan stok virus IMNV.
6
filter yang diperoleh merupakan stok ekstrak virus IMNV dan disimpan pada suhu -70 oC.
Injeksi dengan IMNV dilakukan pada bagian punggung (antara segmen 3 dan 4) sebanyak 100 µL/ekor (Tang et al. 2005). Setelah pemeliharaan dilakukan uji tantang selama 12 hari dengan padat tebar 15 ekor/akuarium, dilakukan pengamatan terhadap sintasan dan gejala klinis. Udang uji kontrol negatif diinjeksi dengan PBS (Phosphate Buffer Saline) sebanyak 100 µL/ekor.
2.5 Parameter Pengamatan 2.5.1 Sintasan
Sintasan atau Survival Rate (SR) udang dalam penelitian ini dihitung pada akhir perlakuan sinbiotik dan setelah uji tantang dengan IMNV. Sintasan dihitung berdasarkan rumus berikut (Goddard 1996) :
SR = 100%
No Nt
x
Keterangan : SR = Sintasan (%)
Nt = Jumlah udang pada akhir pemeliharaan (ekor) No = Jumlah udang pada awal pemeliharaan (ekor)
2.5.2 Laju Pertumbuhan Harian
Laju pertumbuhan spesifik atau Spesific Growth Rate (SGR) dalam penelitian ini dihitung pada akhir perlakuan sinbiotik dengan menggunakan rumus berikut ini (Huisman 1987):
� =
1
x
100
%
Wo
Wt
t
Keterangan :
SGR = Laju pertumbuhan harian (%/hari)
7 2.5.3 Rasio Konversi Pakan
Rasio konversi pakan atau Feed Convertion Ratio (FCR) dalam penelitian ini dihitung pada akhir perlakuan sinbiotik menggunakan rumus berikut (Zonneveld et al. 1991):
FCR=
Bo Bm Bt
F
Keterangan :
FCR = Rasio konversi pakan F = Jumlah pakan (g)
Bt = Biomassa udang pada saat akhir perlakuan (g) Bm = Biomassa udang yang mati saat perlakuan (g) Bo = Biomassa udang pada saat awal perlakuan (g)
2.5.4 Total Haemocyte Count (THC)
Perhitungan terhadap nilai THC dilakukan pada akhir perlakuan sinbiotik dan setelah uji tantang dengan IMNV, dengan sampel 1 ekor udang setiap ulangan pada masing-masing perlakuan. Prosedur penghitungan THC mengacu pada metode Blaxhall dan Daishley (1973). Hemolim diambil sebanyak 0,1 mL dari pangkal kaki renang pertama dengan syringe 1 mL yang sudah berisi 0,3 mL antikoagulan Na-sitrat 3,8%. Kemudian dilakukan perhitungan THC dengan
haemasitometer dibawah mikroskop dengan perbesaran 400 kali. THC diamati dan dihitung jumlah selnya per mL di bawah mikroskop.
2.5.5 Aktivitas PO (Phenoloxydase)
Pengukuran terhadap PO dilakukan pada akhir perlakuan sinbiotik dan setelah uji tantang dengan IMNV dengan sampel 1 ekor udang setiap ulangan pada masing-masing perlakuan. Pengukuran PO dilakukan berdasarkan prosedur yang dikemukan oleh Liu dan Chen (2004). Aktivitas PO diukur berdasarkan formasi dopachrome yang dihasilkan oleh L-DOPA. Sebanyak 1 mL campuran hemolimdan antikoagulan disentrifuse pada kecepatan 1.500 rpm pada suhu 4 oC selama 10 menit. Supernatan dikeluarkan dan pellet disuspensikan kembali secara perlahan-lahan dengan 1 mL larutan cacodylate-citrate buffer (0,01 M sodium cacodylate, 0,45 M sodium chloride, 0,10 M trisodium citrate, pH 7) kemudian
8 cacodylate-citrate buffer (0,01 M sodium cacodylate, 0,45 M sodium chloride, 0,10 M trisodium citrate, pH 7).
Suspensi sel sebanyak 100 μL kemudian diinkubasi dengan 50 μL trypsin
(1 mg/mL cacodylate buffer) sebagai aktivator pada suhu 25-26 oC selama 10
menit. Kemudian ditambahkan 50 μL L-DOPA (3 mg/mL cacodylate buffer)
diinkubasi pada suhu ruang selama 5 menit, lalu ditambahkan 800 μL cacodylate buffer. Densitas optikal (OD) diukur dengan menggunakan spektrofotometer dengan panjang gelombang 490 nm.
Larutan standar dibuat dengan campuran 100 μL suspensi hemolim, 50 μL
cacodylate buffer (pengganti trypsin), dan 50 μL L-DOPA digunakan untuk mengukur background aktivitas PO pada semua larutan uji. Densitas optikal (OD) dari aktivitas PO pada semua kondisi uji dinyatakan sebagai formasi dopachrome dalam 50 μL hemolim.
2.5.6 Gejala Klinis
Pengamatan gejala klinis dilakukan setelah dilakukan infeksi IMNV dengan melihat perubahan atau kelainan pada anatomi makro udang. Gejala klinis yang diamati antara lain terbentuknya otot berwarna putih pada bagian ruas tubuh udang serta warna kemerahan pada bagian ekor.
2.5.7 Pengamatan Kualitas Air
Pengamatan kualitas air dilakukan pada air stok awal dan air media pemeliharaan masing-masing perlakuan pada minggu ke-2, dan minggu ke-4 perlakuan. Parameter kualitas air yang diukur adalah suhu, salinitas, pH, DO, dan amoniak. Satuan dan alat pengukuran kualitas air disajikan pada Tabel 2.
Tabel 2. Satuan dan alat ukur kualitas air pada parameter suhu, salinitas, pH, DO, dan amoniak.
Kualitas Air Satuan Alat
Suhu oC Termometer
Salinitas ppt Refraktometer
pH - pH-meter
DO mg/L DO-meter
9 2.6 Analisis Data
Penelitian ini menggunakan rancangan percobaan berupa Rancangan Acak Lengkap dengan lima perlakuan dan empat ulangan. Data yang diperoleh diolah dengan Microsoft Excel 2007 dan dianalisis dengan menggunakan analisis ragam dengan tingkat kepercayaan 95%. Kemudian dilakukan uji lanjut dengan uji
Duncan’s Multiple Range dengan menggunakan program komputer SPSS 17.0
10
III. HASIL DAN PEMBAHASAN
3.1 Hasil 3.1.1 Sintasan
Sintasan pada penelitian ini dibagi dalam dua tahap, yakni setelah 30 hari perlakuan sinbiotik dan setelah uji tantang dengan IMNV selama 12 hari. Nilai sintasan saat perlakuan sinbiotik dan uji tantang disajikan pada Gambar 1.
a) b)
Keterangan :
*Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05) **K (Kontrol), K- (Kontrol -), K+ (Kontrol +), P1 (Probiotik+Prebiotik 1%), P2
(Probiotik+Prebiotik 2%), P3 (Probiotik+Prebiotik 3%)
Gambar 1. Sintasan udang vaname setelah 30 hari perlakuan sinbiotik (sebelum uji tantang) (a), dan setelah uji tantang dengan IMNV (Infectious Myonecrosis Virus) (b)
Sintasan setelah 30 hari perlakuan sinbiotik berkisar antara 66,25% - 69,38%. Berdasarkan uji statistik diperoleh hasil yang tidak berbeda nyata (p>0,05; Lampiran 2) antar perlakuan pada sintasan udang vaname pada perlakuan sinbiotik maupun kontrol.
Setelah dilakukan infeksi IMNV melalui injeksi, sintasan tertinggi ditunjukkan oleh perlakuan K- sebesar 93,33%. Pada perlakuan sinbiotik, perlakuan P3 dengan penambahan prebiotik 3% menunjukkan sintasan tertinggi sebesar 43,33% dibandingkan dengan perlakuan K+. Berdasarkan hasil uji lanjut
66,25 66,88 67,5 69,38
0 10 20 30 40 50 60 70 80 90 100
K P 1 P 2 P 3
K e lan gs u n gan H id u p (% )
Sebelum Uji Tantang
a
a
a
a
93,33 20 26,67 38,33 43,33 0 10 20 30 40 50 60 70 80 90 100
K - K + P 1 P 2 P 3
K e lan gs u n gan H id u p (% )
Setelah Uji Tantang
11
dengan Uji Duncan perlakuan P3 tidak berbeda nyata (p>0,05) terhadap P2 namun berbeda nyata (p<0,05; Lampiran 3) terhadap K+.
3.1.2Laju Pertumbuhan Harian
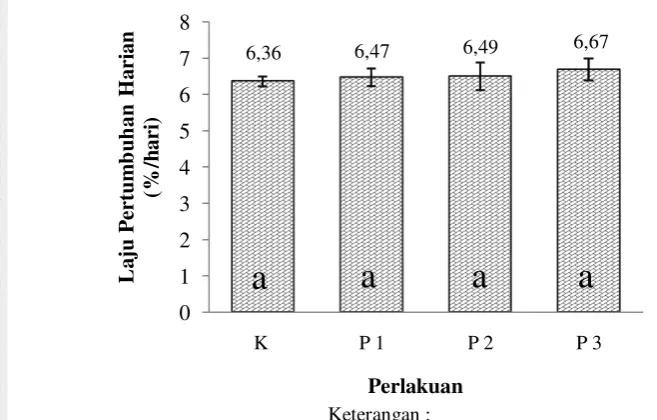
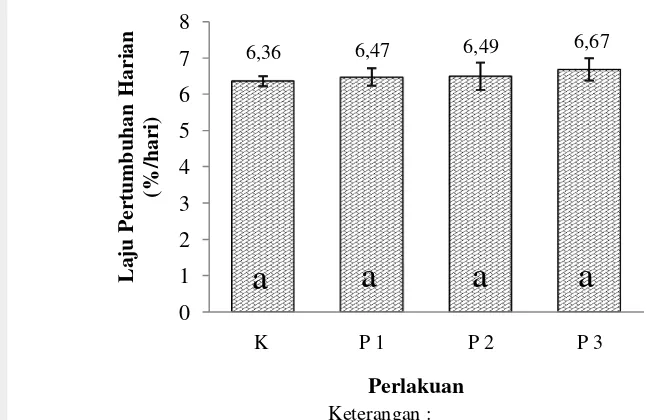
Laju pertumbuhan harian dihitung setelah 30 hari perlakuan sinbiotik pada masing-masing perlakuan. Pengaruh pemberian sinbiotik terhadap laju pertumbukan harian udang vaname pada masing-masing perlakuan disajikan pada Gambar 2.
Keterangan :
*Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05) **K (Kontrol), P1 (Probiotik+Prebiotik 1%), P2 (Probiotik+Prebiotik 2%), P3
(Probiotik+Prebiotik 3%)
Gambar 2. Laju pertumbuhan harian udang vaname pada masing-masing perlakuan setelah 30 hari perlakuan sinbiotik (sebelum diinfeksi dengan IMNV)
Seperti terlihat pada Gambar 2 laju pertumbuhan harian berkisar antara 6,36-6,67%. Berdasarkan hasil uji lanjut dengan menggunakan uji statistik menunjukkan hasil yang tidak berbeda nyata (p>0,05; Lampiran 4) antar perlakuan baik kontrol maupun perlakuan sinbiotik.
3.1.3 Rasio Konversi Pakan
Rasio konversi pakan dihitung setelah 30 hari perlakuan sinbiotik pada masing-masing perlakuan. Pengaruh pemberian sinbiotik terhadap rasio konversi pakan udang vaname pada masing-masing perlakuan disajikan pada Gambar 3.
6,36 6,47 6,49 6,67
0 1 2 3 4 5 6 7 8
K P 1 P 2 P 3
L a ju P er tu m b u h an H a ri a n (% /h a ri ) Perlakuan
12 Keterangan :
*Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05) **K (Kontrol), P1 (Probiotik+Prebiotik 1%), P2 (Probiotik+Prebiotik 2%), P3
(Probiotik+Prebiotik 3%)
Gambar 3. Rasio konversi pakan pada masing-masing perlakuan selama 30 hari perlakuan sinbiotik (sebelum diinfeksi dengan IMNV)
Seperti terlihat pada Gambar 3 rasio konversi pakan berkisar antara 1,26 – 1,57. Berdasarkan hasil uji statistik menunjukkan hasil yang tidak berbeda nyata (p>0,05; Lampiran 5) antar perlakuan baik kontrol maupun perlakuan sinbiotik.
3.1.4 Total Haemocyte Count (THC)
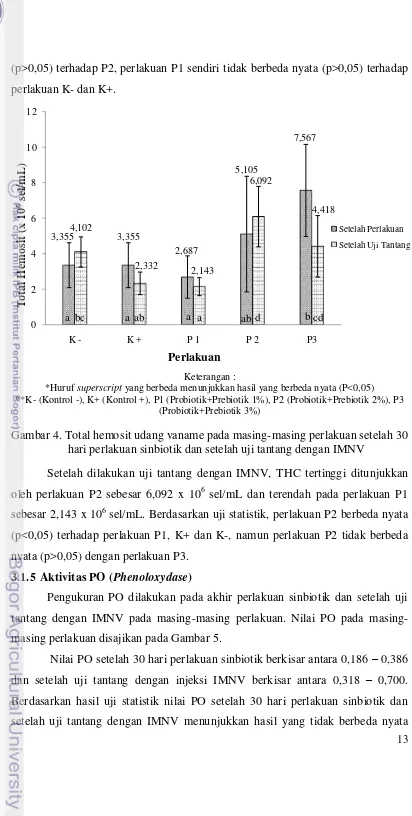
Pengukuran THC pada masing-masing perlakuan dilakukan pada akhir perlakuan sinbiotik dan setelah uji tantang dengan IMNV. Hasil pengukuran THC pada masing-masing perlakuan disajikan pada Gambar 4. Secara keseluruhan setelah 30 hari perlakuan sinbiotik maupun setelah uji tantang dengan IMNV perlakuan P3 menunjukkan nilai THC yang lebih tinggi dibandingkan dengan perlakuan yang lainnya. Setelah dilakukan uji statistik P3 tidak berbeda nyata (p>0,05; Lampiran 6) terhadap P2 namun berbeda nyata (p<0,05) terhadap perlakuan P1, K-, dan K+.
Setelah 30 hari perlakuan sinbiotik THC tertinggi ditunjukkan oleh perlakuan P3 sebesar 7,567 x 106 sel/mL dan terendah pada perlakuan P1 sebesar 2,687 x 106 sel/mL. Berdasarkan uji statistik, perlakuan P3 berbeda nyata (p<0,05) terhadap perlakuan P1, K-, dan K+, namun perlakuan P3 tidak berbeda nyata
1,57 1,43 1,24 1,26 0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6 1,8 2,0 2,2
K P 1 P 2 P 3
R as io K o n v e r si P ak an Perlakuan
13
(p>0,05) terhadap P2, perlakuan P1 sendiri tidak berbeda nyata (p>0,05) terhadap perlakuan K- dan K+.
Keterangan :
*Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05) **K- (Kontrol -), K+ (Kontrol +), P1 (Probiotik+Prebiotik 1%), P2 (Probiotik+Prebiotik 2%), P3
(Probiotik+Prebiotik 3%)
Gambar 4. Total hemosit udang vaname pada masing-masing perlakuan setelah 30 hari perlakuan sinbiotik dan setelah uji tantang dengan IMNV
Setelah dilakukan uji tantang dengan IMNV, THC tertinggi ditunjukkan oleh perlakuan P2 sebesar 6,092 x 106 sel/mL dan terendah pada perlakuan P1 sebesar 2,143 x 106 sel/mL. Berdasarkan uji statistik, perlakuan P2 berbeda nyata (p<0,05) terhadap perlakuan P1, K+ dan K-, namun perlakuan P2 tidak berbeda nyata (p>0,05) dengan perlakuan P3.
3.1.5 Aktivitas PO (Phenoloxydase)
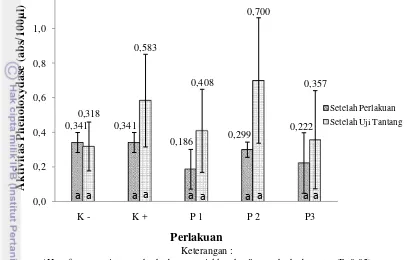
Pengukuran PO dilakukan pada akhir perlakuan sinbiotik dan setelah uji tantang dengan IMNV pada masing perlakuan. Nilai PO pada masing-masing perlakuan disajikan pada Gambar 5.
Nilai PO setelah 30 hari perlakuan sinbiotik berkisar antara 0,186 – 0,386 dan setelah uji tantang dengan injeksi IMNV berkisar antara 0,318 – 0,700. Berdasarkan hasil uji statistik nilai PO setelah 30 hari perlakuan sinbiotik dan setelah uji tantang dengan IMNV menunjukkan hasil yang tidak berbeda nyata
3,355 3,355 2,687 5,105 7,567 4,102 2,332 2,143 6,092 4,418 0 2 4 6 8 10 12
K - K + P 1 P 2 P3
T ot al Hem os it ( x 10 6se l/m L ) Perlakuan Setelah Perlakuan
Setelah Uji Tantang
14
(p>0,05; Lampiran 7) pada semua perlakuan baik perlakuan sinbiotik maupun kontrol.
Keterangan :
*Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05) **K- (Kontrol -), K+ (Kontrol +), P1 (Probiotik+Prebiotik 1%), P2 (Probiotik+Prebiotik 2%), P3
(Probiotik+Prebiotik 3%)
Gambar 5. Aktivitas enzim phenoloxydase udang vaname pada masing-masing perlakuan setelah 30 hari perlakuan sinbiotik dan setelah uji tantang dengan IMNV
3.1.6 Gejala Klinis
Gejala klinis yang diamati adalah pada perubahan makro anatomi yang tampak pada tubuh udang setelah dilakukan infeksi IMNV. Gejala klinis yang diamati selama uji tantang disajikan pada Gambar 6.
Gambar 6. Perubahan makro anatomi tubuh udang vaname setelah infeksi IMNV: Udang normal (a), ekor udang memerah (b), terjadi nekrosis pada otot-otot tubuh udang (c)
0,341 0,341 0,186 0,299 0,222 0,318 0,583 0,408 0,700 0,357 0,0 0,2 0,4 0,6 0,8 1,0 1,2
K - K + P 1 P 2 P3
Ak ti vi tas P h en o lox yd as e (ab s/ 10 0 µ l) Perlakuan Setelah Perlakuan Setelah Uji Tantang
a
a a a a a a a a a
b
15 3.1.7 Kualitas Air
Kualitas air selama masa pemeliharaan udang vaname diukur pada awal, tengah, akhir masa pemeliharaan, dan akhir uji tantang. Parameter kualitas air yang diamati meliputi pH, salinitas, temperatur, kandungan oksigen terlarut (DO), dan amoniak selama pemeliharaan (Tabel 3).
Tabel 3. Kualitas air pada media pemeliharaan udang vaname selama perlakuan sinbiotik meliputi pH, salinitas, suhu, DO, dan amoniak pada masing-masing perlakuan
Kualitas Air Perlakuan Literatur
K - K + P 1 P 2 P 3
pH 7 - 8 7-7,9 7-7,8 7-7,9 7- 7,8 7,5–8,5a
Salinitas (ppt) 31–35 32-35,7 32-34,7 3-33,7 31-35, 8 15–35a
Suhu (oC) 28,5–29 28- 29 29-29,5 28-28,5 29 28,5–31,5a
DO (mg/L) 6,5-7,2 6,3-7,8 6-7,9 6,4-7,3 5,9-7,4 > 3,5a
Amoniak (mg/L) < 0,140 < 0,140 < 0,140 < 0,140 < 0,140 < 0,1 b
Keterangan : a) SNI (2006); b) Chien (1992)
3.2 Pembahasan
16
memberikan kenaikan sintasan sebesar 5% pada udang uji setelah dilakukan infeksi IMNV bila dibandingkan dengan pemberian prebiotik 2%, meskipun setelah dilakukan uji statistik pada kedua perlakuan ini tidak berbeda nyata (Gambar 1b). Kenaikan sintasan sebesar 5% ini membutuhkan penambahan prebiotik sebesar 1%, hal ini berarti dibutuhkan biaya tambahan untuk penambahan 1% prebiotik tersebut.
Pemberian sinbiotik dengan dosis prebiotik 3% mampu meningkatkan ketahanan udang terhadap infeksi IMNV. Ketahanan udang uji diduga karena adanya pengaruh dari penambahan bakteri probiotik SKT-b (V. alginolyticus). Seperti yang diungkapkan oleh Gullian et al. (2004), penggunaan V. alginolyticus
mampu meningkatkan pertumbuhan serta respon imunitas pada udang vaname. Peningkatan respon imunitas dapat terlihat dari nilai THC udang uji (Gambar 4). Respon imunitas tersebut meningkat diduga karena adanya pemberian prebiotik dengan dosis yang semakin meningkat sehingga memberikan pengaruh terhadap bakteri probiotik yang diberikan ke udang uji. Prebiotik memberikan pengaruh tidak langsung terhadap mekanisme penghambatan patogen, karena prebiotik dimanfaatkan oleh probiotik dan dapat meningkatkan pertumbuhan probiotik (Rastall et al. 2005).
17
penelitian ini berkisar antara 1,24 – 1,57 (Gambar 3) dan tidak berbeda nyata pada semua perlakuan baik kontrol maupun pemberian sinbiotik. Rasio konversi pakan (FCR) merupakan suatu ukuran yang menyatakan jumlah pakan yang dibutuhkan untuk menghasilkan 1 kg daging. Semakin besar nilai FCR, maka semakin banyak pakan yang dibutuhkan untuk memproduksi 1 kg daging (Effendi 2004).
Krustasea tidak memiliki respon imun spesifik (adaptive) dan bergantung pada berbagai respon imun nonspesifik (innate). Meskipun dianggap demikian, respon imun nonspesifik mampu dengan cepat dan efisien mengenali dan menghancurkan material asing, termasuk patogen (Witteveldt et al. 2003). Respon imun pada krustasea dapat dikenali dari parameter total hemosit serta enzim
phenoloxydase yang berperan dalam sistem pertahanan tubuh. Bachere (2000), menyatakan bahwa proses imun pertama pada krustase adalah pengenalan mikroorganisme penyerang yang dimediasi oleh hemosit dan plasma protein. Hasil penelitian menunjukkan bahwa pemberian sinbiotik selama 30 hari berturut-turut melalui pakan memberikan pengaruh nyata terhadap peningkatan nilai THC pada perlakuan P2 dan P3 terhadap perlakuan P1, K+, dan K- (Gambar 4). Disampaikan oleh Johansson et al. (2000), hemosit krustase, dan invertebrata lain, memainkan peranan penting dalam sistem pertahanan tubuh terhadap patogen seperti virus, bakteri, fungi, protozoa, dan metazoa.
18
terhadap nilai THC yang berbeda-beda pada setiap perlakuan setelah 30 hari pemberian sinbiotik dan setelah dilakukan infeksi IMNV. Jumlah hemosit dapat sangat bervariasi berdasarkan spesies, respon terhadap infeksi, stres lingkungan, aktivitas endokrin selama siklus molting (Johansson et al. 2000), jumlah hemosit juga dipengaruhi oleh seks, fase perkembangan, status reproduksi dan nutrisi (Song et al. 2003).
Phenoloxydase (PO) merupakan suatu enzim yang bertanggung jawab terhadap proses melanisasi pada krustase sebagai respon terhadap penyerang asing (Sritunyalucksana dan Soderhall 2000). Enzim phenoloxydase (PO) bertanggung jawab terhadap proses melanisasi pada artropoda. Enzim phenoloxydase (PO) terdapat dalam hemolim sebagai inactive proenzym yang disebut proPO. Transformasi proPO menjadi PO melibatkan beberapa reaksi dikenal sebagai
proPO activating system (sistem aktivasi proPO) (Rodriguez & Le Moullac 2000). Nilai PO setelah 30 hari perlakuan sinbiotik dan setelah dilakukan infeksi IMNV tidak berbeda nyata pada semua perlakuan (Gambar 5). Nilai PO pada setiap ulangan perlakuan cukup bervariasi, hal ini diduga disebabkan karena tingkat infeksi yang berbeda pada setiap sampel udang uji yang diamati, dimana udang uji yang diamati diambil secara acak.
19
Pengamatan terhadap gejala klinis dilakukan selama 12 hari setelah dilakukan infeksi IMNV untuk mengetahui perkembangan infeksi terhadap udang uji. Berdasarkan hasil pengamatan yang dilakukan diketahui bahwa terjadi perubahan makro anatomi pada tubuh udang uji setelah uji tantang (Gambar 6). Perubahan awal yang terjadi adalah munculnya nekrosis pada bagian abdomen udang. Selain itu gejala klinis juga ditunjukkan dengan terbentuknya otot putih pada ruas-ruas tubuhnya, muncul warna kemerahan pada ekor udang, serta warna tubuh udang seperti udang rebus. Seperti yang disampaikan sebelumnya oleh Senapin et al. (2007), ciri-ciri umum udang yang terinfeksi IMNV meliputi nekrosis pada otot, terutama pada segmen abdominal dan ekor, timbulnya perubahan warna pada otot menjadi putih hingga warna seperti udang rebus. Kematian biasanya terjadi pada saat gejala klinis sudah parah seperti ekor merah dan sebagian atau seluruh tubuh udang memutih.
20
IV. KESIMPULAN
PEMBERIAN SINBIOTIK DENGAN DOSIS PREBIOTIK
BERBEDA UNTUK PENCEGAHAN INFEKSI IMNV
(
INFECTIOUS MYONECROSIS VIRUS
) PADA
PEMELIHARAAN UDANG VANAME
Litopenaeus vannamei
NURLITA CHRISTYANINGSIH
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul
PEMBERIAN SINBIOTIK DENGAN DOSIS PREBIOTIK BERBEDA UNTUK PENCEGAHAN INFEKSI IMNV (INFECTIOUS MYONECROSIS
VIRUS) PADA PEMELIHARAAN UDANG VANAME Litopenaeus
vannamei
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Januari 2013
ABSTRAK
NURLITA CHRISTYANINGSIH. Pemberian sinbiotik dengan dosis prebiotik berbeda untuk pencegahan infeksi IMNV (Infectious Myonecrosis Virus) pada pemeliharaan udang vaname Litopenaeus vannamei. Dibimbing oleh
WIDANARNI dan SUKENDA.
Udang vaname merupakan salah satu komoditas unggulan karena permintaannya yang selalu meningkat. Namun sampai saat ini serangan penyakit IMN (Infectious Myonecrosis) masih banyak menyerang udang vaname. Penelitian ini dilakukan untuk menguji efektivitas pemberian sinbiotik dengan dosis prebiotik berbeda terhadap sintasan dan respon imun udang vaname yang diinfeksi IMNV. Probiotik dan prebiotik yang digunakan adalah bakteri SKT-b (Vibrio alginolyticus) dan oligosakarida hasil ekstraksi tepung ubi jalar varietas sukuh. Udang vaname dengan bobot rata-rata 0,647±0,049 g/ekor sebanyak 40 ekor dipelihara dalam akuarium dengan volume air laut 45 liter selama 30 hari dengan perlakuan yaitu K (tanpa pemberian sinbiotik), P1(pemberian probiotik + prebiotik 1%), P2 (pemberian probiotik + prebiotik 2%), dan P3 (pemberian probiotik + prebiotik 3%). Setelah 30 hari perlakuan kontrol dibagi menjadi dua yaitu K- dan K+, P1, P2, dan P3 diinfeksi dengan IMNV melalui injeksi, kecuali K- yang diinjeksi dengan PBS. Hasil penelitian menunjukkan bahwa pemberian sinbiotik dalam pakan dengan dosis probiotik + prebiotik 3% dan diinfeksi IMNV mampu memberikan pengaruh yang lebih baik dibanding perlakuan lainnya dengan nilai sintasan sebesar 43,33% dan respon imun yang lebih baik.
ABSTRACT
NURLITA CHRISTYANINGSIH. The administration of sinbiotic with the different doses of prebiotic for prevention of IMNV (Infectious Myonecrosis Virus) in white shrimp Litopenaeus vannamei culture. Supervised by
WIDANARNI and SUKENDA.
White shrimp is one of the important commodity because of the increasing of demand. However, losses due to IMN disease still remain an important concern till now. This study aims to evaluate of effectiveness the giving with the different doses of survival rate dan immune response white shrimp infected by IMNV. SKT-b (Vibrio alginolyticus) and oligosaccharides, extracted from sweet potato (sukuh variety), was used as probiotic and prebiotic. White shrimp with an average body weight of 0.647±0.049 g/shrimps, with amount 40 shrimps in an aquarium with a volume of 45 L. Shrimps cultured in 30 days, consisted four treatment, control (without sinbiotic), P1(probiotic + prebiotic 1%), P2 (probiotic + prebiotic 2%), and P3 (probiotic + prebiotic 3%). After 30 days of shrimps culture, this study consisted of five treatments, negative and positive control, P1, P2, and P3, then were infected by injection of IMNV, except negative control were injected by PBS. The results showed that sinbiotic application with probiotic + prebiotic 3% dose and infected by IMNV give a better effect than other treatments, with survival rate 43,33% dan give a better immune response.
PEMBERIAN SINBIOTIK DENGAN DOSIS PREBIOTIK
BERBEDA UNTUK PENCEGAHAN INFEKSI IMNV
(
INFECTIOUS MYONECROSIS VIRUS
) PADA
PEMELIHARAAN UDANG VANAME
Litopenaeus vannamei
NURLITA CHRISTYANINGSIH
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi & Manajemen Perikanan Budidaya
Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan,
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : Pemberian sinbiotik dengan dosis prebiotik berbeda untuk pencegahan infeksi IMNV (Infectious Myonecrosis Virus) pada pemeliharaan udang vaname Litopenaeus vannamei
Nama Mahasiswa : Nurlita Christyaningsih Nomor Pokok : C14080079
Disetujui
Dosen Pembimbing I Dosen Pembimbing II
Dr. Widanarni Dr. Sukenda
NIP. 19670927 199403 2 001 NIP. 19671013 199302 1 001
Mengetahui:
Ketua Departemen Budidaya Perairan
Dr. Sukenda NIP. 19671013 199302 1 001
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penelitian dan penulisan skripsi ini dapat diselesaikan dengan baik. Penelitian dilaksanakan sejak bulan Juni-Agustus 2012 di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu
Kelautan, Institut Pertanian Bogor, dengan judul “Pemberian sinbiotik dengan dosis prebiotik berbeda untuk pencegahan infeksi IMNV (Infectious Myonecrosis Virus) pada pemeliharaan udang vaname Litopenaeus vannamei”. Ucapan terima kasih penulis tujukan kepada :
1. Orang tua tercinta, H. Purnomo S.Pd dan Surati, serta adik tersayang Erfa Dwi
Jayanti yang selalu memberikan do’a, dukungan moril maupun materi, serta kasih sayangnya.
2. Dr. Widanarni dan Dr. Sukenda selaku dosen pembimbing atas arahan dan masukan yang telah diberikan dalam pelaksanaan penelitian dan penyusunan skripsi ini.
3. Dr. Munti Yuhana selaku Dosen Pembimbing Akademik.
4. Kak Rahman, M.Si dan para laboran Pak Ranta, Pak Wasjan, Pak Jajang, Kang Abe, Kang Dama, Mba Retno dan para staff pegawai BDP yang telah membantu dalam menunjang penelitian dan penyelesaian skripsi ini.
5. Mba Wida Lesmanawati S.Pi sebagai rekan dalam penelitian.
6. Teman-teman LKI’ers (Dendi Hidayatullah, Wahyu Afrilasari, Titi Nur Chayati, Jeanni Indah Noermala, Retno Astrini, Deasy Angela, dan Nora Putri Sari) yang telah banyak membantu dan memberi semangat.
7. Teman-teman terdekat Fatima Rosniar, Ivan Daniel Napitupulu, Heru Ahen Priatna, Ernitha Merliana, Yoga Ardimas serta teman-teman BDP ’45 atas
do’a, motivasi, dan dukungannya selama ini.
Semoga skripsi ini bermanfaat bagi pembaca dan perkembangan pengetahuan di bidang perikanan budidaya.
Bogor, Januari 2013
DAFTAR RIWAYAT HIDUP
Penulis merupakan anak pertama dari dua bersaudara yang dilahirkan di Klaten, 9 Juni 1990 dari pasangan H. Purnomo S.Pd dan Surati. Pendidikan formal yang dilalui penulis adalah SMA N 3 Depok dan lulus pada tahun 2008. Pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur tes SNMPTN memilih Mayor Teknologi dan Manajemen Perikanan Budidaya, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis pernah praktek kerja lapangan di PT. Global Gen Indonesia, Situbondo, Jawa Timur dengan komoditas udang vaname. Selain itu penulis juga pernah aktif sebagai staf divisi Produksi Himakua (Himpunan Mahasiswa Akuakultur) 2009/2010 dan ketua divisi KKM (Komunikasi dan Kesejahteraan Mahasiswa) Himakua 2010/2011, asisten mata kuliah Manajemen Kesehatan Organisme Akuakultur jenjang S1 2010/2011, Farmakologi Hewan Air jenjang D3 2012/2013, Penyakit dan Parasit Ikan jenjang D3 2012/2013, Penyakit Organisme Akuatik jenjang S1 2012/2013, dan Mikrobiologi Akuakultur jenjang S2 2012/2013.
Penulis melakukan penelitian dan menyusun skripsi sebagai salah satu syarat memperoleh gelar sarjana dalm bidang perikanan yang berjudul
DAFTAR ISI
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
I. PENDAHULUAN ... 1
II. BAHAN DAN METODE ... 3 2.1 Persiapan Prebiotik/Ekstraksi Oligosakarida ... 3 2.2 Persiapan Probiotik ... 3 2.3 Pengujian Sinbiotik secara In Vivo ... 3 2.3.1 Persiapan Wadah ... 3 2.3.2 Persiapan Hewan Uji ... 4 2.3.3 Persiapan Pakan Uji ... 4 2.3.4 Perlakuan Pakan Uji pada Udang Vaname ... 4 2.4 Prosedur Uji Tantang ... 5 2.5 Parameter Pengamatan... 6 2.5.1 Sintasan... 6 2.5.2 Laju Pertumbuhan Harian ... 6 2.5.3 Rasio Konversi Pakan ... 7 2.5.4 Total Haemocyte Count (THC) ... 7 2.5.5 Aktivitas PO (Phenoloxydase) ... 7 2.5.6 Gejala Klinis ... 8 2.5.7 Pengamatan Kualitas Air... 8 2.6 Analisis Data ... 9
III. HASIL DAN PEMBAHASAN ... 10 3.1 Hasil ... 10 3.1.1 Sintasan ... 10 3.1.2 Laju Pertumbuhan Harian ... 11 3.1.4 Total Haemocyte Count (THC) ... 12 3.1.5 Aktivitas PO (Phenoloxydase) ... 13 3.1.6 Gejala Klinis ... 14 3.1.7 Kualitas Air ... 15 3.2 Pembahasan ... 15
IV. KESIMPULAN ... 20
DAFTAR PUSTAKA ... 21
x
DAFTAR TABEL
Halaman 1. Perlakuan pemberian pakan sinbiotik dengan dosis prebiotik berbeda pada
pakan udang vaname L. vannamei dan infeksi dengan IMNV. ... 5 2. Satuan dan alat ukur kualitas air pada parameter suhu, salinitas, pH, DO,
dan amonia. ... 8 3. Kualitas air pada media pemeliharaan udang vaname selama perlakuan
xi
DAFTAR GAMBAR
Halaman 1. Sintasan udang vaname setelah 30 hari perlakuan sinbiotik (sebelum uji
tantang) (a), dan setelah uji tantang dengan IMNV (Infectious Myonecrosis Virus) (b) ... 10 2. Laju pertumbuhan harian udang vaname pada masing-masing perlakuan
setelah 30 hari perlakuan sinbiotik (sebelum diinfeksi dengan IMNV) ... 11 3. Rasio konversi pakan pada masing-masing perlakuan selama 30 hari
perlakuan sinbiotik (sebelum diinfeksi dengan IMNV) ... 12 4. Total hemosit udang vaname pada masing-masing perlakuan setelah 30
hari perlakuan sinbiotik dan setelah uji tantang dengan IMNV ... 13 5. Aktivitas enzim phenoloxydase udang vaname pada masing-masing
perlakuan setelah 30 hari perlakuan sinbiotik dan setelah uji tantang dengan IMNV ... 14 6. Perubahan makro anatomi tubuh udang vaname setelah infeksi IMNV:
xii
DAFTAR LAMPIRAN
Halaman 1. Rancangan sistem resirkulasi selama pemeliharaan udang vaname L.
vannamei pada masing-masing perlakuan selama 30 hari perlakuan sinbiotik dan infeksi dengan IMNV ... 26 2. Analisis statistik terhadap sintasan udang vaname L. vannamei setelah
30 hari perlakuan sinbiotik (sebelum infeksi dengan IMNV) ... 26 3. Analisis statistik terhadap sintasan udang vaname L. vannamei setelah
infeksi IMNV ... 26 4. Analisis statistik terhadap laju pertumbuhan harian udang vaname L.
vannamei setelah 30 hari perlakuan sinbiotik (sebelum infeksi dengan IMNV) ... 27 5. Analisis statistik terhadap rasio konversi pakan udang vaname L.
vannamei setelah 30 hari perlakuan sinbiotik (sebelum infeksi dengan IMNV) ... 27 6. Analisis statistik terhadap Total Haemocyte Count (THC) udang
vaname L. vannamei setelah 30 hari perlakuan sinbiotik dan setelah infeksi IMNV ... 27 7. Analisis statistik terhadap aktivitas enzim Phenoloxydase udang
1
I.
PENDAHULUAN
Udang vaname (Litopenaeus vannamei) merupakan salah satu komoditas perikanan yang bernilai ekonomis tinggi. Setiap tahun permintaan pasar akan udang vaname selalu mengalami peningkatan, sehingga Kementerian Kelautan dan Perikanan (KKP) menargetkan produksi udang nasional sebesar 699.000 ton pada tahun 2014 atau meningkat sebesar 74,75% selama periode 2010-2014 (KKP 2010). Produksi udang vaname sendiri meningkat sejak tahun 2005 dari 280.629 ton menjadi 400.300 ton di tahun 2010, namun pada tahun 2009 mengalami penurunan dari produksi sebelumnya sebesar 61.490 ton (KKP 2010). Penurunan produksi ini salah satunya disebabkan oleh adanya serangan penyakit IMN (Infectious Myonecrosis), yang sampai saat ini masih sering menyerang budidaya udang di tambak dan menjadi masalah bagi para pembudidaya.
Penyakit IMN akibat infeksi IMNV (Infectious Myonecrosis Virus) pertama kali ditemukan di Brazil tahun 2002 dan menyebabkan dampak kerugian ekonomi yang signifikan (Costa et al. 2009). Wabah IMNV menyebar ke Indonesia dengan gejala klinis mirip dengan wabah di Brazil pada tahun 2006 (Senapin et al. 2007). Serangan penyakit IMN pertama kali terdeteksi di Indonesia pada Mei-Juni 2006. Penyakit IMN ini menyebabkan kematian 10-30% pada budidaya udang di tambak (Taukhid dan Nur’aini 2009). Gejala klinis penyakit IMN yaitu hilangnya transparansi pada jaringan otot akibat nekrosis. Pada stadia infeksi lanjutan, warna putih pada abdomen dan ekor akibat nekrosis akan berubah menjadi merah dan dapat menyebabkan mortalitas mencapai 70% (Tang
et al. 2008). Sampai tahun 2009, penyakit IMN terdeteksi di Jawa Timur, Bali,
dan Nusa Tenggara Barat (Taukhid dan Nur’aini 2009).
2
probiotik dan prebiotik dalam mendukung sintasan serta pertumbuhan bakteri yang menguntungkan dalam saluran pencernaan mahluk hidup.
Probiotik didefinisikan sebagai kultur hidup satu jenis mikroba atau lebih yang memberikan pengaruh menguntungkan bagi inang melalui peningkatan sistem imun, memperbaiki kualitas lingkungan hidup inang, dan memperbaiki nilai nutrisi pakan (Verschuere et al. 2000). Probiotik yang digunakan dalam penelitian ini adalah probiotik SKT-b. Probiotik SKT-b merupakan bakteri Vibrio alginolyticus yang memiliki kemampuan untuk menghambat pertumbuhan bakteri patogen Vibrio harveyi dalam uji in vitro dan in vivo (Widanarni et al. 2003). Probiotik V. alginolyticus SKT-b juga mampu meningkatkan sistem imun pada udang vaname setelah diinfeksi dengan V. harveyi (Syaihalatua 2009).
Prebiotik merupakan bahan pangan yang tidak dapat dicerna oleh inang tetapi memberikan efek menguntungkan bagi inang dengan cara merangsang pertumbuhan mikroflora normal di dalam saluran pencernaan inang (Schrezenmeir dan Vrese 2001). Prebiotik yang digunakan dalam penelitian ini adalah oligosakarida yang diperoleh dari ekstraksi tepung ubi jalar varietas Sukuh
Ipomoea batatas L.
Penambahan sinbiotik dalam pakan terbukti mampu meningkatkan sintasan dan respon imun pada ikan dan udang. Pemberian probiotik Bacillus OJ (PB) 108 CFU/g pakandan prebiotik isomaltooligosaccharides (IMO) 0,2% pada udang vaname yang diinfeksi WSSV (White Spote Syndrome Virus) terbukti memberikan nilai sintasan yang lebih tinggi (>80%) dan respon imun yang lebih baik dibanding perlakuan IMO saja, PB saja, atau IMO 0,2%+PB 1010 CFU/g (Li
et al. 2009). Pemberian probiotik SKT-b dan prebiotik oligosakarida dari ubi jalar telah diteliti mampu meningkatkan sintasan dan memperbaiki respon imun udang vaname terhadap infeksi Vibrio harveyi (Widagdo 2011) dan IMNV (Septiani 2011; Damayanti 2011), namun belum diketahui perbandingan yang tepat antara dosis probiotik SKT-b dan prebiotik dari ubi jalar.
3
II. BAHAN DAN METODE
2.1 Persiapan Prebiotik/Ekstraksi Oligosakarida
Proses ekstraksi oligosakarida/prebiotik mengacu pada metode Muchtadi (1989). Sebanyak 500 g tepung ubi jalar varietas sukuh Ipomoea batatas L. dicampur air dengan perbandingan 1:1 (w/v) dan dikukus pada suhu 100 oC selama 30 menit. Kemudian dikeringkan dalam oven pada suhu 55 oC selama 18 jam. Selanjutnya, digiling dan disaring dengan ayakan hingga tepung kukus ubi jalar varietas sukuh dapat terkumpul. Pada proses ekstraksi, sebanyak 10 g tepung kukus ubi jalar varietas sukuh disuspensikan ke dalam 100 mL etanol 70% dan diinkubasi dalam thermoshaker selama 15 jam dengan kecepatan 120 rpm pada suhu ruang. Kemudian dilakukan penyaringan menggunakan kertas saring steril. Filtrat yang diperoleh dipekatkan dengan evaporator vakum pada suhu 40 oC. Setelah itu hasil ekstraksi di frezee dry hingga diperoleh padatan ekstrak oligosakarida. Hasil ekstraksi ini diencerkan dengan akuades dengan perbandingan 1:1 (w/v).
2.2 Persiapan Probiotik
Pertama dilakukan kultur bakteri probiotik SKT-b pada media Sea Water Complete (SWC-agar miring) (5 g bactopeptone, 1 g yeast extract, 3 ml gliserol, 15 g agar, 750 ml air laut, dan 250 ml akuades) dan diinkubasi selama 24 jam pada suhu ruang. Kemudian bakteri probiotik SKT-b tersebut diinokulasikan ke dalam media SWC cair dan diinkubasi dalam waterbath shaker pada suhu 29-30 o
C dengan kecepatan 140 rpm selama 16 jam. Setelah itu, suspensi bakteri dipindahkan ke dalam eppendorf untuk masing-masing perlakuan kemudian disentrifuse selama 5 menit dengan kecepatan 10.000 rpm untuk memisahkan padatan sel bakteri dengan supernatan. Supernatan dibuang dan diperoleh padatan sel bakteri probiotik yang akan dicampurkan dengan prebiotik dan pakan.
2.3 Pengujian Sinbiotik secara In Vivo
2.3.1 Persiapan Wadah
4
dengan deterjen dan dikeringkan. Kemudian didesinfeksi dengan klorin 100 ppm dan dibiarkan selama 24 jam. Setelah itu akuarium dibilas dengan air tawar hingga bersih, kemudian sebanyak 45 L air laut dimasukkan pada setiap akuarium. Media pemeliharaan menggunakan air laut yang berasal dari Ancol. Air laut terlebih dahulu ditampung dalam tandon dan didesinfeksi dengan klorin 30 ppm dan dinetralkan dengan Na-Thiosulfat 15 ppm. Setiap akuarium dilengkapi dengan aerasi dan shelter sebagai tempat udang berlindung saat molting. Pada semua ulangan setiap perlakuan dirangkai dalam satu sistem resirkulasi (Lampiran 1). Bagian tepi setiap akuarium ditutup dengan plastik hitam untuk menghindari pengaruh luar yang dapat mengakibatkan udang stress, serta bagian atas akuarium ditutup dengan waring untuk menghindari udang lompat keluar akuarium.
2.3.2 Persiapan Hewan Uji
Hewan uji yang digunakan dalam penelitian ini adalah benur udang vaname stadia PL 41 yang berasal dari Labuan, Banten. Sebelum diberi perlakuan, benur dipelihara selama 12 hari dalam tandon 1 m3. Selama pemeliharaan udang diberi pakan komersil 5 kali sehari pukul 06.00, 10.00, 14.00, 18.00, dan 22.00 WIB. Pemeliharaan dilakukan dengan sistem resirkulasi menggunakan top filter, dilakukan penyiponan terhadap sisa pakan dan feses pada pagi dan sore hari.
2.3.3 Persiapan Pakan Uji
Pembuatan sinbiotik dilakukan dengan mengkombinasikan probiotik dan prebiotik pada pakan yang akan diberikan. Dosis probiotik yang digunakan sebesar 1% (w/w) dari jumlah pakan yang akan diberikan (Wang 2007). Dosis prebiotik yang digunakan dalam penelitian ini sebesar 1%, 2%, dan 3% (v/w) dari jumlah pakan yang akan diberikan. Pencampuran dilakukan dengan menambahkan gelatin sebanyak 3% (Pearce et al. 2002) dari total pakan yang berfungsi sebagai perekat, termasuk pada perlakuan kontrol. Setelah selesai dilakukan pencampuran dan sebelum diberikan ke udang, pakan dikeringanginkan terlebih dahulu selama 15 menit untuk mengurangi kelembaban.
2.3.4 Perlakuan Pakan Uji pada Udang Vaname
5
Tabel 1. Perlakuan pemberian pakan sinbiotik dengan dosis prebiotik berbeda pada pakan udang vaname L. vannamei dan infeksi dengan IMNV.
Perlakuan Keterangan
Perlakuan 1 Pemberian pakan komersil tanpa penambahan sinbiotik dan tanpa infeksi IMNV (kontrol -)
Perlakuan 2 Pemberian pakan komersil tanpa penambahan sinbiotik kemudian diinfeksi IMNV (kontrol +)
Perlakuan 3 Pemberian pakan komersil dengan penambahan probiotik dan prebiotik 1% kemudian diinfeksi IMNV (P1)
Perlakuan 4 Pemberian pakan komersil dengan penambahan probiotik dan prebiotik 2% kemudian diinfeksi IMNV (P2)
Perlakuan 5 Pemberian pakan komersil dengan penambahan probiotik dan prebiotik 3% kemudian diinfeksi IMNV (P3)
Pemeliharaan udang dengan pemberian perlakuan sinbiotik dilakukan selama 30 hari. Udang uji sebanyak 40 ekor dengan bobot rata-rata 0,647±0,049 g/ekor dipelihara dalam akuarium dengan volume air laut 45 L. Pemberian pakan dilakukan lima kali dalam sehari pada pukul 06.00, 10.00, 14.00, 18.00, dan 22.00 WIB. Pemberian pakan sinbiotik diberikan satu kali pada pukul 10.00 dan pada waktu pemberian pakan yang lain diberikan pelet komersil secara at-satiation
serta dilakukan penyiponan terhadap sisa pakan dan feses.
2.4 Prosedur Uji Tantang
Uji tantang yang dilakukan adalah infeksi IMNV melalui injeksi. Udang vaname positif IMNV didapatkan dari Balai Pengembangan Budidaya Air Payau (BPBAP) Situbondo, Jawa Timur yang diekstrak berdasarkan prosedur yang dilakukan Escobedo et al. (2006) untuk didapatkan stok virus IMNV.
6
filter yang diperoleh merupakan stok ekstrak virus IMNV dan disimpan pada suhu -70 oC.
Injeksi dengan IMNV dilakukan pada bagian punggung (antara segmen 3 dan 4) sebanyak 100 µL/ekor (Tang et al. 2005). Setelah pemeliharaan dilakukan uji tantang selama 12 hari dengan padat tebar 15 ekor/akuarium, dilakukan pengamatan terhadap sintasan dan gejala klinis. Udang uji kontrol negatif diinjeksi dengan PBS (Phosphate Buffer Saline) sebanyak 100 µL/ekor.
2.5 Parameter Pengamatan 2.5.1 Sintasan
Sintasan atau Survival Rate (SR) udang dalam penelitian ini dihitung pada akhir perlakuan sinbiotik dan setelah uji tantang dengan IMNV. Sintasan dihitung berdasarkan rumus berikut (Goddard 1996) :
SR = 100%
No Nt
x
Keterangan : SR = Sintasan (%)
Nt = Jumlah udang pada akhir pemeliharaan (ekor) No = Jumlah udang pada awal pemeliharaan (ekor)
2.5.2 Laju Pertumbuhan Harian
Laju pertumbuhan spesifik atau Spesific Growth Rate (SGR) dalam penelitian ini dihitung pada akhir perlakuan sinbiotik dengan menggunakan rumus berikut ini (Huisman 1987):
� =
1
x
100
%
Wo
Wt
t
Keterangan :
SGR = Laju pertumbuhan harian (%/hari)
7 2.5.3 Rasio Konversi Pakan
Rasio konversi pakan atau Feed Convertion Ratio (FCR) dalam penelitian ini dihitung pada akhir perlakuan sinbiotik menggunakan rumus berikut (Zonneveld et al. 1991):
FCR=
Bo Bm Bt
F
Keterangan :
FCR = Rasio konversi pakan F = Jumlah pakan (g)
Bt = Biomassa udang pada saat akhir perlakuan (g) Bm = Biomassa udang yang mati saat perlakuan (g) Bo = Biomassa udang pada saat awal perlakuan (g)
2.5.4 Total Haemocyte Count (THC)
Perhitungan terhadap nilai THC dilakukan pada akhir perlakuan sinbiotik dan setelah uji tantang dengan IMNV, dengan sampel 1 ekor udang setiap ulangan pada masing-masing perlakuan. Prosedur penghitungan THC mengacu pada metode Blaxhall dan Daishley (1973). Hemolim diambil sebanyak 0,1 mL dari pangkal kaki renang pertama dengan syringe 1 mL yang sudah berisi 0,3 mL antikoagulan Na-sitrat 3,8%. Kemudian dilakukan perhitungan THC dengan
haemasitometer dibawah mikroskop dengan perbesaran 400 kali. THC diamati dan dihitung jumlah selnya per mL di bawah mikroskop.
2.5.5 Aktivitas PO (Phenoloxydase)
Pengukuran terhadap PO dilakukan pada akhir perlakuan sinbiotik dan setelah uji tantang dengan IMNV dengan sampel 1 ekor udang setiap ulangan pada masing-masing perlakuan. Pengukuran PO dilakukan berdasarkan prosedur yang dikemukan oleh Liu dan Chen (2004). Aktivitas PO diukur berdasarkan formasi dopachrome yang dihasilkan oleh L-DOPA. Sebanyak 1 mL campuran hemolimdan antikoagulan disentrifuse pada kecepatan 1.500 rpm pada suhu 4 oC selama 10 menit. Supernatan dikeluarkan dan pellet disuspensikan kembali secara perlahan-lahan dengan 1 mL larutan cacodylate-citrate buffer (0,01 M sodium cacodylate, 0,45 M sodium chloride, 0,10 M trisodium citrate, pH 7) kemudian
8 cacodylate-citrate buffer (0,01 M sodium cacodylate, 0,45 M sodium chloride, 0,10 M trisodium citrate, pH 7).
Suspensi sel sebanyak 100 μL kemudian diinkubasi dengan 50 μL trypsin
(1 mg/mL cacodylate buffer) sebagai aktivator pada suhu 25-26 oC selama 10
menit. Kemudian ditambahkan 50 μL L-DOPA (3 mg/mL cacodylate buffer)
diinkubasi pada suhu ruang selama 5 menit, lalu ditambahkan 800 μL cacodylate buffer. Densitas optikal (OD) diukur dengan menggunakan spektrofotometer dengan panjang gelombang 490 nm.
Larutan standar dibuat dengan campuran 100 μL suspensi hemolim, 50 μL
cacodylate buffer (pengganti trypsin), dan 50 μL L-DOPA digunakan untuk mengukur background aktivitas PO pada semua larutan uji. Densitas optikal (OD) dari aktivitas PO pada semua kondisi uji dinyatakan sebagai formasi dopachrome dalam 50 μL hemolim.
2.5.6 Gejala Klinis
Pengamatan gejala klinis dilakukan setelah dilakukan infeksi IMNV dengan melihat perubahan atau kelainan pada anatomi makro udang. Gejala klinis yang diamati antara lain terbentuknya otot berwarna putih pada bagian ruas tubuh udang serta warna kemerahan pada bagian ekor.
2.5.7 Pengamatan Kualitas Air
Pengamatan kualitas air dilakukan pada air stok awal dan air media pemeliharaan masing-masing perlakuan pada minggu ke-2, dan minggu ke-4 perlakuan. Parameter kualitas air yang diukur adalah suhu, salinitas, pH, DO, dan amoniak. Satuan dan alat pengukuran kualitas air disajikan pada Tabel 2.
Tabel 2. Satuan dan alat ukur kualitas air pada parameter suhu, salinitas, pH, DO, dan amoniak.
Kualitas Air Satuan Alat
Suhu oC Termometer
Salinitas ppt Refraktometer
pH - pH-meter
DO mg/L DO-meter
9 2.6 Analisis Data
Penelitian ini menggunakan rancangan percobaan berupa Rancangan Acak Lengkap dengan lima perlakuan dan empat ulangan. Data yang diperoleh diolah dengan Microsoft Excel 2007 dan dianalisis dengan menggunakan analisis ragam dengan tingkat kepercayaan 95%. Kemudian dilakukan uji lanjut dengan uji
Duncan’s Multiple Range dengan menggunakan program komputer SPSS 17.0
10
III. HASIL DAN PEMBAHASAN
3.1 Hasil 3.1.1 Sintasan
Sintasan pada penelitian ini dibagi dalam dua tahap, yakni setelah 30 hari perlakuan sinbiotik dan setelah uji tantang dengan IMNV selama 12 hari. Nilai sintasan saat perlakuan sinbiotik dan uji tantang disajikan pada Gambar 1.
a) b)
Keterangan :
*Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05) **K (Kontrol), K- (Kontrol -), K+ (Kontrol +), P1 (Probiotik+Prebiotik 1%), P2
(Probiotik+Prebiotik 2%), P3 (Probiotik+Prebiotik 3%)
Gambar 1. Sintasan udang vaname setelah 30 hari perlakuan sinbiotik (sebelum uji tantang) (a), dan setelah uji tantang dengan IMNV (Infectious Myonecrosis Virus) (b)
Sintasan setelah 30 hari perlakuan sinbiotik berkisar antara 66,25% - 69,38%. Berdasarkan uji statistik diperoleh hasil yang tidak berbeda nyata (p>0,05; Lampiran 2) antar perlakuan pada sintasan udang vaname pada perlakuan sinbiotik maupun kontrol.
Setelah dilakukan infeksi IMNV melalui injeksi, sintasan tertinggi ditunjukkan oleh perlakuan K- sebesar 93,33%. Pada perlakuan sinbiotik, perlakuan P3 dengan penambahan prebiotik 3% menunjukkan sintasan tertinggi sebesar 43,33% dibandingkan dengan perlakuan K+. Berdasarkan hasil uji lanjut
66,25 66,88 67,5 69,38
0 10 20 30 40 50 60 70 80 90 100
K P 1 P 2 P 3
K e lan gs u n gan H id u p (% )
Sebelum Uji Tantang
a
a
a
a
93,33 20 26,67 38,33 43,33 0 10 20 30 40 50 60 70 80 90 100
K - K + P 1 P 2 P 3
K e lan gs u n gan H id u p (% )
Setelah Uji Tantang
11
dengan Uji Duncan perlakuan P3 tidak berbeda nyata (p>0,05) terhadap P2 namun berbeda nyata (p<0,05; Lampiran 3) terhadap K+.
3.1.2Laju Pertumbuhan Harian
[image:45.595.122.451.228.438.2]Laju pertumbuhan harian dihitung setelah 30 hari perlakuan sinbiotik pada masing-masing perlakuan. Pengaruh pemberian sinbiotik terhadap laju pertumbukan harian udang vaname pada masing-masing perlakuan disajikan pada Gambar 2.
Keterangan :
*Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05) **K (Kontrol), P1 (Probiotik+Prebiotik 1%), P2 (Probiotik+Prebiotik 2%), P3
(Probiotik+Prebiotik 3%)
Gambar 2. Laju pertumbuhan harian udang vaname pada masing-masing perlakuan setelah 30 hari perlakuan sinbiotik (sebelum diinfeksi dengan IMNV)
Seperti terlihat pada Gambar 2 laju pertumbuhan harian berkisar antara 6,36-6,67%. Berdasarkan hasil uji lanjut dengan menggunakan uji statistik menunjukkan hasil yang tidak berbeda nyata (p>0,05; Lampiran 4) antar perlakuan baik kontrol maupun perlakuan sinbiotik.
3.1.3 Rasio Konversi Pakan
Rasio konversi pakan dihitung setelah 30 hari perlakuan sinbiotik pada masing-masing perlakuan. Pengaruh pemberian sinbiotik terhadap rasio konversi pakan udang vaname pada masing-masing perlakuan disajikan pada Gambar 3.
6,36 6,47 6,49 6,67
0 1 2 3 4 5 6 7 8
K P 1 P 2 P 3
L a ju P er tu m b u h an H a ri a n (% /h a ri ) Perlakuan
12 Keterangan :
*Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05) **K (Kontrol), P1 (Probiotik+Prebiotik 1%), P2 (Probiotik+Prebiotik 2%), P3
(Probiotik+Prebiotik 3%)
Gambar 3. Rasio konversi pakan pada masing-masing perlakuan selama 30 hari perlakuan sinbiotik (sebelum diinfeksi dengan IMNV)
Seperti terlihat pada Gambar 3 rasio konversi pakan berkisar antara 1,26 – 1,57. Berdasarkan hasil uji statistik menunjukkan hasil yang tidak berbeda nyata (p>0,05; Lampiran 5) antar perlakuan baik kontrol maupun perlakuan sinbiotik.
3.1.4 Total Haemocyte Count (THC)
Pengukuran THC pada masing-masing perlakuan dilakukan pada akhir perlakuan sinbiotik dan setelah uji tantang dengan IMNV. Hasil pengukuran THC pada masing-masing perlakuan disajikan pada Gambar 4. Secara keseluruhan setelah 30 hari perlakuan sinbiotik maupun setelah uji tantang dengan IMNV perlakuan P3 menunjukkan nilai THC yang lebih tinggi dibandingkan dengan perlakuan yang lainnya. Setelah dilakukan uji statistik P3 tidak berbeda nyata (p>0,05; Lampiran 6) terhadap P2 namun berbeda nyata (p<0,05) terhadap perlakuan P1, K-, dan K+.
Setelah 30 hari perlakuan sinbiotik THC tertinggi ditunjukkan oleh perlakuan P3 sebesar 7,567 x 106 sel/mL dan terendah pada perlakuan P1 sebesar 2,687 x 106 sel/mL. Berdasarkan uji statistik, perlakuan P3 berbeda nyata (p<0,05) terhadap perlakuan P1, K-, dan K+, namun perlakuan P3 tidak berbeda nyata
1,57 1,43 1,24 1,26 0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6 1,8 2,0 2,2
K P 1 P 2 P 3
R as io K o n v e r si P ak an Perlakuan
[image:46.595.154.449.87.320.2]13
(p>0,05) terhadap P2, perlakuan P1 sendiri tidak berbeda nyata (p>0,05) terhadap perlakuan K- dan K+.
Keterangan :
*Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05) **K- (Kontrol -), K+ (Kontrol +), P1 (Probiotik+Prebiotik 1%), P2 (Probiotik+Prebiotik 2%), P3
[image:47.595.102.514.24.840.2](Probiotik+Prebiotik 3%)
Gambar 4. Total hemosit udang vaname pada masing-masing perlakuan setelah 30 hari perlakuan sinbiotik dan setelah uji tantang dengan IMNV
Setelah dilakukan uji tantang dengan IMNV, THC tertinggi ditunjukkan oleh perlakuan P2 sebesar 6,092 x 106 sel/mL dan terendah pada perlakuan P1 sebesar 2,143 x 106 sel/mL. Berdasarkan uji statistik, perlakuan P2 berbeda nyata (p<0,05) terhadap perlakuan P1, K+ dan K-, namun perlakuan P2 tidak berbeda nyata (p>0,05) dengan perlakuan P3.
3.1.5 Aktivitas PO (Phenoloxydase)
Pengukuran PO dilakukan pada akhir perlakuan sinbiotik dan setelah uji tantang dengan IMNV pada masing perlakuan. Nilai PO pada masing-masing perlakuan disajikan pada Gambar 5.
Nilai PO setelah 30 hari perlakuan sinbiotik berkisar antara 0,186 – 0,386 dan setelah uji tantang dengan injeksi IMNV berkisar antara 0,318 – 0,700. Berdasarkan hasil uji statistik nilai PO setelah 30 hari perlakuan sinbiotik dan setelah uji tantang dengan IMNV menunjukkan hasil yang tidak berbeda nyata
3,355 3,355 2,687 5,105 7,567 4,102 2,332 2,143 6,092 4,418 0 2 4 6 8 10 12
K - K + P 1 P 2 P3
T ot al Hem os it ( x 10 6se l/m L ) Perlakuan Setelah Perlakuan
Setelah Uji Tantang
14
(p>0,05; Lampiran 7) pada semua perlakuan baik perlakuan sinbiotik maupun kontrol.
Keterangan :
*Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05) **K- (Kontrol -), K+ (Kontrol +), P1 (Probiotik+Prebiotik 1%), P2 (Probiotik+Prebiotik 2%), P3
(Probiotik+Prebiotik 3%)
Gambar 5. Aktivitas enzim phenoloxydase udang vaname pada masing-masing perlakuan setelah 30 hari perlakuan sinbiotik dan setelah uji tantang dengan IMNV
3.1.6 Gejala Klinis
Gejala klinis yang diamati adalah pada perubahan makro anatomi yang tampak pada tubuh udang setelah dilakukan infeksi IMNV. Gejala klinis yang diamati selama uji tantang disajikan pada Gambar 6.
[image:48.595.94.510.73.820.2]
Gambar 6. Perubahan makro anatomi tubuh udang vaname setelah infeksi IMNV: Udang normal (a), ekor udang memerah (b), terjadi nekrosis pada otot-otot tubuh udang (c)
0,341 0,341 0,186 0,299 0,222 0,318 0,583 0,408 0,700 0,357 0,0 0,2 0,4 0,6 0,8 1,0 1,2
K - K + P 1 P 2 P3
Ak ti vi tas P h en o lox yd as e (ab s/ 10 0 µ l) Perlakuan Setelah Perlakuan Setelah Uji Tantang
a
a a a a a a a a a
b
[image:48.595.105.512.142.402.2]15 3.1.7 Kualitas Air
Kualitas air selama masa pemeliharaan udang vaname diukur pada awal, tengah, akhir masa pemeliharaan, dan akhir uji tantang. Parameter kualitas air yang diamati meliputi pH, salinitas, temperatur, kandungan oksigen terlarut (DO), dan amoniak selama pemeliharaan (Tabel 3).
Tabel 3. Kualitas air pada media pemeliharaan udang vaname selama perlakuan sinbiotik meliputi pH, salinitas, suhu, DO, dan amoniak pada masing-masing perlakuan
Kualitas Air Perlakuan Literatur
K - K + P 1 P 2 P 3
pH 7 - 8 7-7,9 7-7,8 7-7,9 7- 7,8 7,5–8,5a
Salinitas (ppt) 31–35 32-35,7 32-34,7 3-33,7 31-35, 8 15–35a
Suhu (oC) 28,5–29 28- 29 29-29,5 28-28,5 29 28,5–31,5a
DO (mg/L) 6,5-7,2 6,3-7,8 6-7,9 6,4-7,3 5,9-7,4 > 3,5a
Amoniak (mg/L) < 0,140 < 0,140 < 0,140 < 0,140 < 0,140 < 0,1 b
Keterangan : a) SNI (2006); b) Chien (1992)
3.2 Pembahasan
16
memberikan kenaikan sintasan sebesar 5% pada udang uji setelah dilakukan infeksi IMNV bila dibandingkan