KONVERSI LIGNOSELULOSA TANDAN KOSONG KELAPA
SAWIT MENJADI GULA PEREDUKSI MENGGUNAKAN
ENZIM XILANASE DAN SELULASE KOMERSIAL
FAIZAL GAYANG
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
FAIZAL GAYANG. Konversi Lignoselulosa Tandan Kosong Kelapa Sawit
Menjadi Gula Pereduksi Menggunakan Enzim Xilanase dan Selulase Komersial.
Dibimbing oleh MARIA BINTANG dan NUR RICHANA.
Tandan Kosong Kelapa Sawit (TKKS) memiliki potensi untuk dihidrolisis
menjadi gula pereduksi. Penelitian ini bertujuan mengetahui konsentrasi dan
waktu terbaik hidrolisis enzimatis TKKS menggunakan xilanase dan selulase
komersial. Tahapan penelitian dimulai dari penggilingan TKKS, delignifikasi
TKKS, analisis proksimat, hidrolisis kimiawi, detoksifikasi dan dekolorisasi, dan
diakhiri hidrolisis enzimatis menggunakan enzim xilanase dan selulase komersial.
Hidrolisis enzimatis TKKS menggunakan dua enzim berbeda, yaitu xilanase dan
selulase dengan masing-masing konsentrasi 0.25% dan 0.5% serta waktu
hidrolisis selama 48 jam dan 96 jam. Kadar gula pereduksi terbesar yang
dihasilkan selama hidrolisis 48 jam dengan xilanase dan hidrolisis 96 jam dengan
selulase adalah 50.5 mg/L dan 56.7 mg/L. Hidrolisis dengan 0.5% selulase dan
netralisasi dengan HCl 1% maupun CH3COOH 1% menghasilkan gula pereduksi
lebih besar dibandingkan hidrolisis dengan konsentrasi 0.25% selulase,
masing-masing sebesar 56.7 mg/L dan 21.04 mg/L. Hidrolisis dengan 0.5% xilanase juga
menghasilkan gula pereduksi yang lebih besar dibandingkan hidrolisis dengan
konsentrasi 0.25% xilanase, masing-masing sebesar 50.5 mg/L dan 28.47 mg/L.
ABSTRACT
FAIZAL GAYANG. Conversion Lignocellulose of Oil Palm Empty Fruit
Bunches To Reducing Sugar Using of Xylanase and Cellulase. Under the
direction of MARIA BINTANG and NUR RICHANA.
Oil palm empty fruit bunches (OPEFB) has the potential to hydrolized into
reducing sugar. This research aimed to know best concentration and time of
enzymatic hydrolysis using commercial xylanase and cellulase. OPEFB was
milled, delignification of OPEFB, proximat analysis, chemical hydrolysis,
detoxification and decolorization, and enzymatic hydrolysis by commercial
xylanase and cellulase were done. Enzymatic Hydrolysis of OPEFB was used 2
different enzymes, xylanase and cellulase, which 2 different concentrations were
used, 0.25% and 0.5% as well as hydrolysis time for 48 hours and 96 hours. After
48 hours hydrolysis by xylanase showed reducing sugar level 50.5 mg/L, and after
96 hours hydrolysis by cellulase showed 56.7 mg/L. Combination hydrolysis by
0.5% cellulase and netralization by HCl 1% and CH3COOH 1% showed reducing
sugar level 56.7 mg/L and 21.04 mg/L respectively, larger than hydrolysis by
0.25% cellulase. Combination Hydrolysis by 0.5% xylanase and netralization by
1% HCl and 1% CH3COOH showed reducing sugar level 50.5 mg/L and 28.47
mg/L respectively, larger than hydrolysis by 0.25% xylanase.
KONVERSI LIGNOSELULOSA TANDAN KOSONG KELAPA
SAWIT MENJADI GULA PEREDUKSI MENGGUNAKAN
ENZIM XILANASE DAN SELULASE KOMERSIAL
FAIZAL GAYANG
G84080036
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Konversi Lignoselulosa Tandan Kosong Kelapa Sawit menjadi
Gula Pereduksi Menggunakan Enzim Xilanase dan Selulase
Komersial
Nama
: Faizal Gayang
NIM
: G84080036
Disetujui
Komisi Pembimbing
Prof. Dr. drh. Maria Bintang, M.S Prof(Ris). Dr. Ir. Nur Richana, M.Si
Ketua
Anggota
Diketahui,
Dr. Ir. I Made Artika, M.App.sc
Ketua Departemen Biokimia
PRAKATA
Puji dan syukur penulis haturkan kehadirat Allah SWT atas segala
limpahan rahmat dan hidayah-Nya serta Shalawat dan salam juga tercurahkan
pada Rasulallah SAW sehingga penulis dapat menyelesaikan penelitian yang
berjudul Konversi Lignoselulosa Tandan Kosong Kelapa Sawit menjadi Gula
Pereduksi Menggunakan Enzim Xilanase dan Selulase Komersial. Penelitian
dilaksanakan mulai bulan April 2012 hingga September 2012 di Laboratorium
Analisis Kimia, Balai Besar Penelitian dan Pengembangan Pascapanen, Jl.
Tentara Pelajar No.12A, Cimanggu, Bogor.
Penulis sampaikan terima kasih kepada semua pihak yang telah membantu
penyusunan hasil penelitian ini secara langsung maupun tidak langsung. Ucapan
terima kasih penulis sampaikan kepada Prof. Dr. drh. Maria Bintang, MS, sebagai
ketua pembimbing dan Prof(Ris). Dr. Ir. Nur Richana, M.Si sebagai anggota
pembimbing yang telah memberikan saran, kritik, dan bimbingannya serta kedua
orang tua dan keluarga yang selalu memberikan doa, dukungan, motivasi, dan
semangat bagi penulis untuk menyelesaikan penelitian ini. Tidak lupa pula ucapan
terima kasih kepada ibu Pia, ibu Dini, teh Dewi, teh Citra, pak Yudhi, pak Tri,
serta segenap staf di Laboratorium Analisis Kimia, Balai Besar Penelitian dan
Pengembangan Pascapanen atas peran, bantuan, dan kerjasamanya dalam
menyelesaikan penelitian ini.
Penulis juga menyampaikan rasa terima kasih kepada Lega Krisda
Febriyanti, S.Pt yang selalu memberikan masukan dan dukungan, dan rekan
selama penelitian, kak Ihsan, Didit, Yusuf, Adit, Daviq, Restu, Naso, Yayuk,
Selvi, Sisca serta rekan-rekan Biokimia 45 dan 46 atas segala doa, pengalaman,
dan motivasinya yang telah diberikan kepada penulis. Semoga penelitian ini dapat
memberikan informasi dan manfaat bagi yang memerlukan.
.
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 7 Oktober 1990 dari ayah Yusuf
Pangloli dan ibu Gayatri Sapta Murthi. Penulis merupakan anak pertama dari dua
bersaudara. Pendidikan penulis dimulai dari SDN 011 Cipinang Melayu, Jakarta
dan melanjutkan pendidikan ke SMPN 109 Jakarta Timur. Penulis lulus tahun
2008 dari SMAN 61 Jakarta Timur dan pada tahun yang sama lulus seleksi masuk
IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih mayor
Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum
Biologi Dasar tahun 2010-2012 untuk mahasiswa Tingkat Persiapan Bersama,
pengajar Kimia di salah satu bimbel IPB tahun 2011. Penulis pernah melakukan
Praktik Lapangan (PL) di Balai Besar Pasca Panen Jalan Tentara Pelajar No.12,
Bogor selama periode Juli 2011 hingga Agustus 2011 dengan judul “
Delignifikasi
Tandan Kosong Kelapa Sawit menggunakan NaOCl
”.
Beberapa organisasi yang diikuti penulis selama perkuliahan, yaitu
Sekretaris Komisi I DPM TPB IPB 2008-2009, Anggota Uni Konservasi Fauna
(UKF) tahun 2008-2009, Staf Divisi HRD Himpunan Profesi Mahasiswa
Biokimia (CREBs) tahun 2009-2010 dan Ketua Divisi Bioanalisis Himpunan
Profesi Mahasiswa Biokimia (CREBs). Penulis juga pernah mengikuti berbagai
kepanitiaan seperti Seminar Kesehatan dan Keselamatan Kerja tahun 2010,
Lomba Karya Ilmiah Populer tahun 2009-2010, Masa Pengenalan Departemen
tahun 2010, Biokimia Expo tahun 2010, Seminar Kesehatan Biokimia tahun 2011,
dan Workshop Database Jamu Biofarmaka tahun 2012.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
DAFTAR TABEL ... viii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Tandan Kosong Kelapa Sawit ... 2
Selulosa, Hemiselulosa, dan Lignin ... 2
Delignifikasi ... 4
Hidrolisis Kimiawi ... 5
Hidrolisis Enzimatis ... 6
BAHAN DAN METODE
Alat dan Bahan ... 7
Metode ... 7
HASIL DAN PEMBAHASAN
Bobot TKKS dari Hasil Penggilingan ... 8
Hasil Delignifikasi TKKS ... 9
Hidrolisis Kimiawi ... 10
Detoksifikasi dan Dekolorisasi ... 11
Hidrolisis Enzimatis ... 13
SIMPULAN DAN SARAN
Simpulan ... 15
Saran ... 16
DAFTAR PUSTAKA ... 16
DAFTAR TABEL
Halaman
1 Komposisi kimiawi TKKS (Richana et al. 2011) ... 2
2 Bobot TKKS setelah penggilingan dan pengayakan ... 9
3 Persentase kehilangan bobot TKKS setelah delignifikasi ... 9
4 Analisis proksimat serbuk 80 mesh TKKS ... 10
DAFTAR GAMBAR
Halaman
1 Tandan kosong kelapa sawit ... 2
2 Struktur umum selulosa... 3
3 Gula penyusun hemiselulosa ... 4
4 Prekursor lignin ... 4
5 Skema delignifikasi lignoselulosa ... 5
6 Hubungan waktu hidrolisis kimiawi dengan [gula pereduksi] ... 11
7 Hubungan lama kontak arang aktif 5% dengan [gula pereduksi] ... 12
8 Hubungan waktu hidrolisis selulase dengan [gula pereduksi] ... 13
9 Hubungan waktu hidrolisis xilanase dengan [gula pereduksi] ... 15
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 19
2 Dokumentasi selama penelitian... 20
3 Absorban standar glukosa untuk hidrolisis kimiawi ... 21
4 Absorban standar glukosa untuk detoksifikasi dan dekolorisasi... 22
5 Absorban standar glukosa untuk hidrolisis enzimatis selama 2 hari... 23
PENDAHULUAN
Penggunaan sumber energi terbarukan berupa bahan bakar nabati (BBN) atau bioenergi sudah perlu ditingkatkan. Hal ini mengingat sumber bahan bakar yang berasal dari fosil sudah semakin menipis dan harganya di dunia cukup melambung tinggi beberapa tahun terakhir. Atas dasar alasan ini, pemerintah Indonesia melalui Inpres No 1/2006 dan Perpres No 5/2006 mengenai kebijakan energi nasional, mencanangkan pergantian bahan bakar fosil secara bertahap dengan bahan bakar nabati. BBN cair meliputi biodiesel untuk menggantikan solar dan bioetanol sebagai pengganti bensin, yang keduanya merupakan bahan bakar yang ramah lingkungan.
Salah satu cara yang pernah dilakukan pemerintah Indonesia untuk menggantikan bensin dan solar adalah menciptakan bioetanol dari singkong. Singkong tumbuh subur di Indonesia dan harganya cukup murah. Produktivitas singkong di Indonesia dapat mencapai 102 ton/ha (Hartojo 2005). Namun seiring berjalannya waktu, solusi tersebut mengundang pro dan kontra. Alasannya adalah singkong sebagai salah satu produk diversifikasi pangan Indonesia, sehingga dikhawatirkan akan terjadi persaingan antara kebutuhan singkong sebagai pangan dan sumber bahan bakar. Akibat persaingan kebutuhan tersebut, maka perlu ditinjau kembali penggunaan bahan pangan sebagai sumber bahan bakar nabati.
Alternatif bahan non pangan yang cukup potensial untuk dikembangkan sebagai sumber bahan bakar nabati adalah tandan kosong kelapa sawit (TKKS). Setiap tahun lahan sawit di Indonesia bertambah luas. Hal ini mengakibatkan jumlah produksi minyak sawit Indonesia mengalami kenaikan tiap tahunnya, bahkan Indonesia memperkirakan 15 juta ton/tahun, minyak sawit akan diproduksi pada tahun 2012 (Ditjen Perkebunan 2010). Namun sampai saat ini, minyak sawit Indonesia sebagian besar diekspor dalam bentuk crude palm oil (CPO). Proses produksi CPO akan menghasilkan limbah padat berupa tandan kosong kelapa sawit (TKKS) dengan rata-rata 10 juta ton/tahun yang sampai saat ini belum dimanfaatkan secara optimal dan sering menimbulkan pencemaran lingkungan. Saat ini TKKS terbatas pemanfaatannya hanya sebagai pupuk, bahan baku matras dan media tumbuh bagi tanaman dan jamur (Irawati 2006). Oleh karena itu, perlu diupayakan
pemanfaatan limbah TKKS menjadi produk yang lebih berdaya guna. Tandan kosong kelapa sawit merupakan limbah padat terbesar pada industri kelapa sawit, yaitu mencapai 22-25% dari bobot tandan buah segar (Pusat Penelitian Kelapa Sawit 2008). Pada tahun 2004, jumlah TKKS yang dihasilkan sebanyak 12.4 juta ton dengan asumsi bahwa 1 Ha kebun menghasilkan 20 ton tandan buah segar (TBS) (Ditjen Perkebunan 2010). Menurut Syafwina et al. (2002), TKKS mengandung 41.3% - 46.5% selulosa, 25.3% - 33.8% hemiselulosa, dan 27.6% - 32.5% lignin.
Kandungan selulosa dan hemiselulosa dalam TKKS berpotensi untuk digunakan sebagai sumber gula pereduksi melalui hidrolisis kimiawi atau enzimatis. Larutan gula yang dihasilkan dapat dikonversi menjadi berbagai produk seperti alkohol, aseton, butanol, dan produk yang mempunyai nilai ekonomis lebih tinggi (Darnoko et al. 2001). Pemanfaatan limbah kelapa sawit dengan cara hidrolisis diharapkan dapat memberikan nilai tambah ekonomis yang cukup besar.
Kendala yang dihadapi dalam hidrolisis serbuk TKKS dengan cara enzimatis dan kimiawi adalah adanya kandungan lignin dalam serbuk dan rendahnya laju hidrolisis. Kadar lignin yang tinggi memperkecil aksesibilitas enzim terhadap substrat dan akhirnya mengakibatkan laju hidrolisis enzimatis yang rendah. Laju hidrolisis enzimatis yang cukup rendah juga akan mempengaruhi rendemen gula pereduksi yang dihasilkan, sehingga perlu dilakukan optimasi hidrolisis enzimatis
2
waktu yang terbaik dari hidrolisis enzimatis serta dapat dijadikan acuan untuk pengembangan bioetanol dalam industri sawit.
TINJAUAN PUSTAKA
Tandan Kosong Kelapa sawit Kelapa sawit adalah tanaman perkebunan berupa pohon berbatang lurus dari famili
palmae. Tanaman tropis ini dikenal sebagai penghasil minyak goreng. Menurut Setyamidjaja (2006), tanaman kelapa sawit diperkirakan berasal dari Guinea, pantai barat Afrika yang kemudian menyebar sampai ke Indonesia. Benih kelapa sawit pertama kali ditanam di Indonesia tahun 1848. Kebun Raya Bogor merupakan tempat pertama yang ditanami kelapa sawit dan kemudian mengalami penyebaran di tepi-tepi jalan daerah Deli, Sumatera Utara. Pelopor perkebunan pertama kali kelapa sawit oleh Adrien Hallet berkebangsaan Belgia pada tahun 1911 di Sumatera Utara. Tanaman ini memiliki nama latin Elaeis guineensis JACQ
dengan taksonomi sebagai berikut, Divisi Spermatophyta, Sub divisi Angiospermae, Kelas Dicotyledonae, Famili Palmae, Subfamili Cocoidae, dan Genus Elaeis (Setyamidjaja 2006).
Tanaman mulai berbunga pada umur sekitar dua tahun. Dalam keadaan normal menghasilkan sekitar 20-22 tandan buah per tahun dan semakin tua produktivitasnya menurun menjadi 12-14 tandan per tahun. Pada awal tahun, tanaman kelapa sawit berbuah berat tandannya sekitar 3-6 kg. Tanaman semakin tua, berat tandan bertambah antara 25-35 kg per tandan (Pusat Penelitian Kelapa Sawit 2008). Kelapa sawit dapat tumbuh dan berbuah baik pada ketinggian 0-500 meter di atas permukaan laut. Curah hujan yang baik berkisar antara 2000-2500 mm/tahun dengan penyebaran hujan merata sepanjang tahun sehingga tidak mengalami defisit air. Suhu harian optimal berkisar antara 24-280C, kelembaban 80% dan membutuhkan penyinaran matahari 5-7 jam/hari. Data curah hujan bulanan dan jumlah hari hujan sangat dibutuhkan karena berhubungan dengan sifat kelapa sawit yang berbuah sepanjang tahun. Fluktuasi curah hujan tiap bulan mempengaruhi secara langsung fluktuasi hasil. Kelapa sawit juga membutuhkan kondisi tanah yang datar hingga berombak dengan kemiringan lereng 0-15% dan memiliki drainase yang baik (Pusat Penelitian Kelapa Sawit 2008).
Gambar 1 Tandan kosong kelapa sawit (Richana et al. 2011)
Tandan buah segar kelapa sawit mengandung 25-34 persen tandan kosong (Syafwina et al. 2002), sedangkan menurut Pusat Penelitian Kelapa Sawit (2008), tandan buah segar terdiri dari 65-70 persen buah segar dan sisanya, yaitu sebesar 30-35 persen berupa tandan kosong. Penampakan tandan kosong kelapa sawit dapat dilihat pada Gambar 1.
Tandan kosong kelapa sawit merupakan limbah utama dari industri pengolahan kelapa sawit menjadi minyak sawit. Persentase serat dan cangkang biji masing-masing sebesar 13 persen dan 5.5 persen dari tandan buah segar (Pusat Penelitian Kelapa Sawit 2008). Komponen utama dari limbah padat kelapa sawit adalah selulosa dan lignin sehingga limbah ini juga disebut limbah lignoselulosa (Pusat Penelitian Kelapa Sawit 2008).
Tandan kosong kelapa sawit memiliki tiga komponen utama yaitu selulosa, hemiselulosa, dan lignin. Limbah TKKS memiliki kandungan holoselulosa (selulosa dan hemiselulosa) yaitu sekitar 70% dan kandungan lignin sekitar 17% (Purwito dan Firmanti 2005). Hasil penelitian Richana et al.
(2011) menunjukkan hasil yang tidak berbeda, yaitu TKKS memiliki kandungan selulosa 50.29%, hemiselulosa 25.54%, dan lignin 24.15%. Komposisi kimiawi tandan kosong kelapa sawit dapat dilihat pada Tabel 1. Tabel 1 Komposisi kimiawi tandan kosong kelapa sawit
Komponen Persentase
(bobot kering) Abu
Air
3.09 8.93
Lignin 24.15
Selulosa 50.29
Hemiselulosa 25.54
3
Selulosa, Hemiselulosa, dan Lignin Selulosa adalah homopolimer linier dari
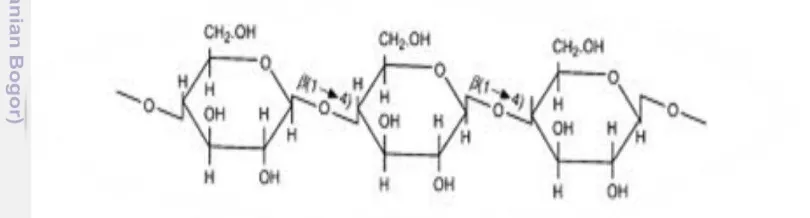
glukosa anhidrida dengan ikatan β
-1,4-glikosida dan rumus empiris (C6H10O5)n
dengan n adalah banyaknya satuan glukosa berkisar antara 1000-10000 (Howard et al.
2003). Selulosa merupakan jenis polisakarida yang paling melimpah pada hampir setiap struktur tanaman terutama sebagai penyusun utama serat dan dinding sel tanaman. Kandungan selulosa kayu berkisar antara 48-50% dan tandan kosong kelapa sawit sekitar 45% (Syafwina et al. 2002). Menurut Fengel dan Wegener (2002), secara ilmiah molekul selulosa tersusun dari fibril yang terdiri dari beberapa molekul selulosa paralel yang dihubungkan dengan ikatan hidrogen. Selulosa memiliki dua jenis ikatan hidrogen pada strukturnya, yaitu ikatan hidrogen intramolekuler yang akan mempertahankan kekakuan rantai selulosa dan ikatan intermolekuler yang menyebabkan rantai selulosa membentuk suatu mikrofibril (Fengel dan Wegener 2002). Struktur umum selulosa ditunjukkan pada Gambar 2.
Mikrofibril terdiri dari bagian kristalin dan bagian amorf. Susunan bagian kristalin lebih teratur dan rapat sehingga sukar bereaksi dengan pereaksi tertentu. Pada bagian kristalin, pengikatan antar molekul selulosa terutama terjadi karena ikatan hidrogen. Ikatan kimia hidrogen antara molekul selulosa yang berdekatan berfungsi untuk memperkuat struktur mikrofibril. Akibat yang ditimbulkan, bagian kristalin tidak larut dalam air dan bersifat sangat stabil (Fengel dan Wegener 2002). Bagian kristal selulosa banyak mengandung jembatan hidrogen antar molekul dan bagian ini jumlahnya lebih dominan, yaitu 85 persen dari selulosa. Bagian amorf hanya sedikit atau bahkan tidak mengandung jembatan hidrogen sama sekali dan jumlahnya hanya 15 persen dari selulosa. Stabil dan kokohnya struktur kristal menyebabkan selulosa sukar untuk dihidrolisa, alasan ini yang menjadi salah satu hambatan dalam melakukan hidrolisis selulosa (Taherzadeh dan Karimi 2008).
Gambar 2 Struktur umum selulosa (Goldstein 2000) Hemiselulosa selalu digambarkan sebagai
polisakarida yang membangun dinding sel tanaman yang bergabung dengan selulosa dalam jaringan lignin. Gabungan hemiselulosa dengan selulosa dan lignin menghasilkan dinding sel yang kokoh dan bersifat lentur (Gong dan Tsao 2001). Hemiselulosa merupakan suatu rantai yang amorf dari campuran gula, biasanya berupa arabinosa, galaktosa, glukosa, mannosa dan xilosa. Rantai hemiselulosa lebih mudah dihidrolisis menjadi komponen gula penyusunnya dibandingkan dengan selulosa.
Molekul hemiselulosa lebih mudah menyerap air, bersifat plastis dan mempunyai kontrol antar molekul yang lebih luas dibandingkan dengan selulosa, sehingga dapat memperbaiki ikatan antar serat pada
4
Gambar 3 Gula penyusun hemiselulosa (Gong dan Tsao2001) Lignin merupakan fraksi non karbohidrat
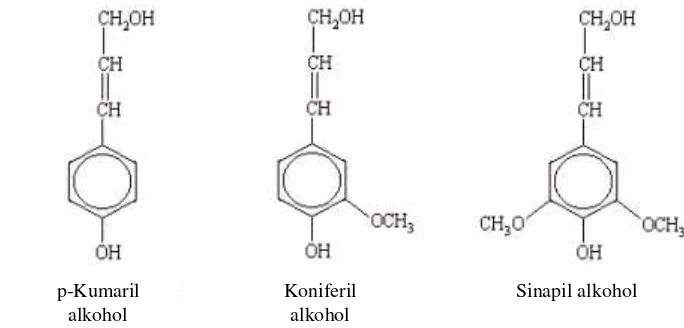
yang bersifat kompleks dan sulit dikarakterisasi. Pada dasarnya lignin merupakan polimer aromatik heterogen dengan sistem jaringan yang bercabang serta tidak memiliki bentuk yang tetap. Satuan penyusun lignin yaitu fenil propana yang tersubtitusi pada dua atau tiga posisi dalam cincin benzennya serta dihubungkan dengan ikatan-ikatan karbon dan eter yang relatif stabil (Fengel dan Wegener 2002). Lignin umumnya tidak pernah ditemui dalam bentuk
sederhana di antara polisakarida dinding sel, tetapi selalu berikatan dengan polisakarida tersebut. Samsuri et al. (2007), menyatakan bahwa pada jaringan tanaman, lignin berfungsi sebagai bahan pengawet dan bersifat mempererat masing-masing serat. Selain itu berfungsi sebagai dinding sel menjadi keras dan kaku. Bersama-sama dengan hemiselulosa membetuk suatu lapisan pelindung terhadap mikroba asing (Zhang dan Lynd 2004).
Gambar 4 Prekursor lignin (Fengel dan Wegener 2002) Delignifikasi
Konversi limbah lignoselulosa hingga menjadi bioetanol melalui empat proses utama, yaitu perlakuan pendahuluan, hidrolisis, fermentasi, dan terakhir pemisahan serta pemurnian produk etanol. Perlakuan pendahuluan biomassa lignoselulosa harus dilakukan untuk mendapatkan hasil yang tinggi. Nilai biokonversi yang tinggi penting bagi pengembangan teknologi dalam skala
komersial (Mosier et al. 2005). Oleh sebab itu, proses perlakuan pendahuluan dan hidrolisis merupakan tahapan yang sangat penting sehingga dapat mempengaruhi jumlah gula pereduksi yang dihasilkan.
Perlakuan pendahuluan atau delignifikasi merupakan tahapan yang banyak menghabiskan biaya dan berpengaruh besar terhadap biaya total proses. Delignifikasi yang
Glukosa Galaktosa Mannosa
Xilosa Arabinosa Asam
Glukoronat
p-Kumaril alkohol
Koniferil alkohol
5
baik dapat mengurangi jumlah enzim yang digunakan dalam hidrolisis (Mosier et al.
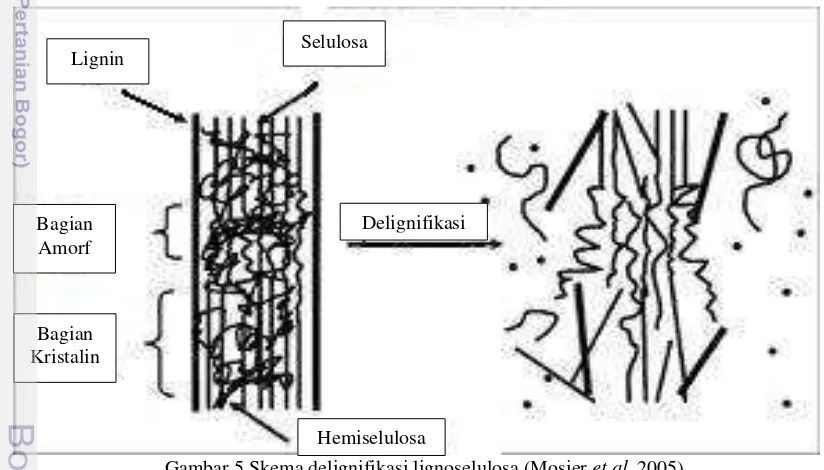
2005). Metode delignifikasi yang tepat dapat menghasilkan kadar gula yang tinggi sehingga biaya produksi biofuel yang efisien dapat dicapai. Gula pereduksi yang diperoleh tanpa delignifikasi kurang dari 20% sedangkan dengan delignifikasi dapat mencapai hingga 90% (Richana et al. 2011). Hambatan hidrolisis selulosa, baik secara kimiawi maupun enzimatis adalah adanya struktur kristalin selulosa dan asosiasi antara selulosa dengan molekul lignin dan hemiselulosa. (Tsao et al. 1978). Masalah tersebut dapat diatasi melalui delignifikasi terhadap bahan yang akan digunakan pada hidrolisis. Delignifikasi bertujuan untuk membuka kristalin selulosa agar selulosa lebih mudah dihidrolisis dengan enzim yang memecah polimer polisakarida dan monomer gula serta menghilangkan kandungan lignin (Richana et al. 2007). Menurut Gong dan Tsao (2001), delignifikasi dilakukan untuk meningkatkan jumlah dan kecepatan hidrolisis lignoselulosa.
Delignifikasi menyediakan akses yang lebih mudah untuk kerja enzim sehingga hasil glukosa dan xilosa dapat meningkat.
Berbagai macam cara dapat dilakukan untuk delignifikasi. Salah satunya adalah menggunakan bahan kimia. Pemilihan bahan kimia yang digunakan berdasarkan bahan sampel yang dipakai, ketahanan alat terhadap reaksi kimia yang ditimbulkan pereaksi, dan sebagainya. Metode delignifikasi secara kimiawi yang biasa dilakukan menggunakan pereaksi alkali. Alkali ini berfungsi melarutkan lignin dan hemiselulosa serta dapat bertindak sebagai swelling agent untuk selulosa. Silverstein et al. (2007) mempelajari keefektifan delignifikasi menggunakan H2SO4, NaOH, H3O, dan O3. Hasil
penelitiannya menunjukkan delignifikasi dengan NaOH meningkatkan level delignifikasi hingga 65% (2% NaOH, 90 menit, 1210C). Selain natrium hidroksida, pereaksi kimia yang dapat digunakan untuk delignifikasi lignoselulosa adalah natrium hipoklorit (Richana et al. 2011).
Gambar 5 Skema delignifikasi lignoselulosa (Mosier et al. 2005) Hidrolisis Kimiawi
Hidrolisis kimiawi lignoselulosa dapat dilakukan dengan pereaksi asam maupun basa. Asam yang digunakan untuk menghidrolisis lignoselulosa adalah asam sulfat, asam klorida, atau asam fosfat. Kelemahan dalam menggunakan pereaksi asam adalah asam dapat menghidrolisis lignoselulosa secara acak, tanpa pola tertentu dalam pemutusan ikatan glikosidik pada selulosa (Taherzadeh dan Karimi 2008).
Kelemahan yang lain dalam penggunaan asam yang pekat adalah masalah korosif yang ditimbulkan dan dapat meninggalkan masalah pencemaran lingkungan (Sun dan Cheng 2002). Masalah terakhir yang ditimbulkan oleh penggunaan asam pada hidrolisis adalah produk yang dihasilkan berupa senyawa furfural dan hidroksi metil furfural, kedua senyawa ini dketahui sebagai inhibitor bagi beberapa genus bakteri fermentasi gula
Lignin Selulosa
Hemiselulosa Delignifikasi Bagian
Amorf
6
pereduksi (Taherzadeh dan Karimi 2007a). Selain pereaksi asam, beberapa basa dapat digunakan untuk hidrolisis biomassa lignoselulosa. Pengaruh hidrolisis alkali tergantung seberapa banyak persentase lignin di dalam lignoselulosa (Zhao et al. 2007). Beberapa jurnal menyebutkan mekanisme hidrolisis alkali berawal dari saponifikasi ikatan ester hemiselulosa dengan komponen lignin maupun hemiselulosa lain yang terjadi secara intermolekuler. Porositas lignoselulosa semakin meningkat dengan adanya pemutusan ikatan silang tersebut (Tarkow dan Feist 2006). Perlakuan dengan NaOH encer menyebabkan pemekaran (swelling) selulosa. Pemekaran selulosa akan meningkatkan luas permukaan lignoselulosa, menurunkan derajat polimerisasi, mengurangi area kristalinitas, terjadi pemisahan ikatan antara lignin dan karbohidrat, dan mengacaukan struktur lignin (Zhao et al. 2007). Beberapa penelitian dilakukan oleh Millet et al. (1999) menyatakan bahwa perlakuan NaOH pada kayu keras (hardwood) dapat meningkatkan daya cerna enzim terhadap selulosa dari 14% menjadi 55%, diikuti pengurangan kadar lignin didalam lignoselulosa dari kisaran 24-55% menjadi 20%. Namun, hidrolisis NaOH encer pada kayu lunak (softwood) tidak memiliki pengaruh jika kadar lignin di dalam lignoselulosa lebih besar dari 26%.
Hidrolisis Enzimatis
Hidrolisis enzimatis dari selulosa merupakan salah satu biokonversi lignoselulosa yang sangat potensial. Namun proses ini memiliki kendala dengan adanya ikatan silang antara matriks selulosa dengan hemiselulosa dan ikatan ester antara hemiselulosa dan lignin sehingga rendemen gula pereduksi yang diperoleh sangat rendah. Perlakuan pendahuluan atau delignifikasi untuk melemahkan ikatan tersebut sangat dibutuhkan untuk menghasilkan rendemen gula pereduksi yang lebih tinggi. Berbagai metode telah dicoba untuk meningkatkan laju hidrolisis enzimatis lignoselulosa.
Penelitian yang dilakukan oleh Loebis (2008) menunjukkan hidrolisis enzimatis tandan kosong kelapa sawit optimum dengan enzim selulase yang dihasilkan isolat
Trichoderma sp. dan fermentasi oleh isolat
Saccharomyces cereviseae secara simultan. Hasil hidrolisis pada kondisi ini menghasilkan gula pereduksi 1.46 g/L dan etanol 0.33%. Berbagai faktor dapat mempengaruhi hidrolisis enzimatis selulosa antara lain substrat, aktivitas enzim selulase, dan kondisi
reaksi hidrolisis (temperatur, pH, dan waktu hidrolisis). Upaya untuk meningkatkan hasil gula pereduksi dan laju hidrolisis enzim, mulai memfokuskan pada optimasi hidrolisis enzimatis dan peningkatan aktivitas enzim selulase.
Selulase dan hemiselulase telah diterapkan dalam berbagai aplikasi dan memiliki potensial bioteknologi untuk dikembangkan dalam berbagai industri diantaranya bahan kimia, bahan bakar, pembuatan bir dan wine, pakan ternak, tekstil dan pakaian, serta pulp dan kertas (Sun dan Cheng 2002). Saat ini diperkirakan 20% dari total penjualan enzim di dunia yang bernilai lebih dari 1 miliar US$ terdiri atas enzim selulase, hemiselulase dan pektinase serta diperkirakan penjualan enzim akan terus meningkat hingga 2 miliar US$ pada tahun 2005 (Bhat 2000).
Selulase spesifik terhadap substrat selulosa, terdiri atas kompleks protein enzim yang akan menghidrolisis ikatan glikosidik. Hidrolisis selulosa menggunakan enzim selulase merupakan sebuah rangkaian proses enzimatis yang sinergis antara endoglukanase,
eksoglukanase dan β-glukosidase. Ketiga
enzim ini disebut selulase atau enzim selulolitik (Rabinovich et al. 2002). Penelitian yang dilakukan oleh Richana et al. (2011) menyatakan bahwa hasil aktivitas enzim optimum untuk selulase komersial adalah 7.72 x104 U/mL dengan optimasi pada pH 5. Hasil yang berbeda ditunjukkan oleh Resita (2006) dengan melaporkan aktivitas enzim optimum untuk selulase dari Trichoderma viride adalah 2.614 IU/mL dengan optimasi pada pH 5. Selain itu juga telah dilakukan optimasi suhu untuk selulase pada suhu 600C dengan perolehan aktivitas enzim 8.74 x104 U/mL (Richana et al. 2011).
Xilanase merupakan enzim ekstraseluler yang dapat menghidrolisis xilan menjadi xilo-oligosakarida dan xilosa. Xilanase dapat dihasilkan oleh mikroba melalui proses fermentasi. Aplikasi xilanase untuk industri diantaranya adalah industri pangan, pakan, dan pemutih bubur kertas/pulp. Penggantian penggunaan klor dengan enzim xilanase untuk pemutihan pulp telah memberikan peluang untuk aplikasi bioteknologi dan sekarang telah digunakan pada beberapa pabrik kertas (Beg
et al. 2000).
7
pulp telah mulai dipasarkan. Namun demikian semua enzim komersial ini masih belum memenuhi kriteria ideal yang dibutuhkan untuk aktivitas enzimatis yang diperlukan, yaitu akitvitas optimum pada pH 10 dan suhu lebih dari 900C (Kulkarni dan Rao 1999). Optimasi enzim xilanase komersial pernah dilakukan terhadap pH dan suhu. Richana et al. (2011) menyatakan xilanase memiliki aktivitas optimum pada pH 6 dan suhu 500C.
BAHAN DAN METODE
Alat dan Bahan
Bahan-bahan yang digunakan pada penelitian ini adalah tandan kosong kelapa sawit yang berasal dari Palembang, larutan NaOCl 10%, akuades, larutan H2SO4 0.25 N,
NaOH 1.25 N, aseton, NaOH 4% (hidrolisis kimiawi), arang aktif teknis, HCL 1% dan CH3COOH 1% (netralisasi), pereaksi DNS
merupakan campuran larutan asam 3,5 dinitrosalisilat dan NaOH dilarutkan dalam aquades (larutan A) dan natrium kalium tartarat dilarutkan dalam aquades (larutan B), glukosa standar 10 ppm, 25 ppm, 50 ppm, 100 ppm, 200 ppm, 300 ppm, 400 ppm, 500 ppm, enzim xilanase (Novozymes) 0.25% dan 0.5% pH 6 T 50oC, dan enzim selulase (Celluclast) 0.25% dan 0.5% pH 5 T 60oC.
Peralatan yang digunakan selama penelitian adalah pengering oven, penepung halus, pengayak berukuran 60 dan 80 mesh, saringan berukuran 80 mesh (lazim disebut saringan santan), kain saring, pengaduk kayu, sudip, timbangan analitik, ember, eksikator, cawan platina, penangas Bunsen, gegep, tanur listrik, labu Erlenmeyer 500 mL, autoklaf, kertas saring, labu Erlenmeyer 250 mL, pipet tetes, pipet Mohr, bulp, tabung sentrifus, sentrifus, kuvet, spektofotometer UV-VIS, tabung reaksi, stirer dan vorteks.
Metode Penelitian
Tandan Kosong Kelapa Sawit (TKKS) dikumpulkan dan dijemur di bawah sinar matahari hingga kering. Tandan kosong sawit yang kering dihaluskan dengan penepung halus sampai ukuran yang lebih halus. Setelah TKKS cukup halus, dilakukan pengayakan dengan ukuran 60 dan 80 mesh sehingga TKKS berbentuk serbuk (Richana et al. 2011).
Delignifikasi TKKS
Sebanyak 1 kg Serbuk TKKS dilarutkan dalam 10 L NaOCl 10%. Sebelumnya larutan
NaOCl diencerkan dengan air, perbandingan masing-masing 1:4. Campuran keduanya direndam selama 12 jam. Perendaman dilakukan pada suhu ruang. Hasil rendaman dengan NaOCl dibilas dengan air sampai bersih dan disaring dengan saringan santan dan kain saring selanjutnya dikeringkan dengan oven pada suhu 40-500C selama 1 jam. Hasil rendaman yang telah kering ditimbang. TKKS dengan penyusutan bobot yang terbaik digunakan untuk analisis selanjutnya. Analisis proksimat meliputi kadar air, kadar abu dan kadar serat dilakukan sebelum maupun sesudah delignifikasi (Modifikasi Richana et al. 2007).
Sebanyak 2 gram contoh ditimbang dalam cawan porselin yang sudah diketahui bobotnya. Cawan yang telah berisi contoh dimasukkan kedalam oven yang bersuhu 1050C selama 3 jam. Setelah 3 jam, cawan didinginkan dalam eksikator dan timbang kembali bobot contoh setelah mengalami pengeringan (AOAC 1995).
Kadar air =
W = Bobot contoh sebelum dikeringkan (gram).
W1 = Kehilangan bobot setelah dikeringkan
(gram).
Penentuan Kadar Abu
Sebanyak 2 gram contoh ditimbang dalam cawan porselin yang telah diketahui bobotnya (A), kemudian dijadikan arang dengan pemanas Bunsen hingga tidak mengeluarkan asap. Cawan porselin berisi contoh yang diarangkan kemudian dimasukkan ke dalam tanur bersuhu 6000C selama 2 jam untuk mengubah arang menjadi abu (B). Cawan berisi abu didinginkan dalam eksikator dan ditimbang kembali (AOAC 1995).
Kadar abu = A = Bobot bahan awal.
B = Bobot residu abu. Penentuan Kadar Serat
Sebanyak 2 gram contoh ditimbang dan dimasukkan ke dalam labu Erlemeyer 500 mL. Selanjutnya ditambahkan 100 mL H2SO4
0.25 N. Hidrolisis dilakukan dalam autoklaf (105oC, 1 atm) selama 15 menit, setelah dingin ditambahkan NaOH 1.25 N sebanyak 50 mL. Hidrolisis dilakukan kembali dengan Penggilingan TKKS
8
cara yang sama kemudian contoh disaring dengan kertas saring kasar. Kertas saring dicuci dengan 25 mL air panas, 25 mL H2SO4
0.25 N lalu 25 mL air panas dan aseton 25 mL. Kertas saring dikeringkan dalam oven suhu 105oC selama 2 jam (AOAC 1995).
Kadar serat kasar = A = Bobot kertas saring.
B = Bobot bahan awal.
C = Bobot residu serat dengan kertas saring. Hidrolisis Kimiawi TKKS
Sebanyak 5 gram serbuk TKKS 80 mesh ditimbang dan dilarutkan ke dalam 100 mL NaOH 4%. Campuran larutan didiamkan dalam suhu kamar selama 24 jam. Setelah 24 jam campuran larutan di autoklaf (121oC, 1 atm) dengan gradasi waktu 30, 60, dan 90 menit. Selanjutnya campuran larutan untuk analisis gula pereduksi dan hidrolisis enzimatis dibuat terpisah. Larutan untuk hidrolisis enzimatis, dipisahkan antara cairan dan endapan serbuknya menggunakan kertas saring kasar. Cairan yang telah disaring dinetralisasi dengan HCL 1% dan CH3COOH
1% hingga kisaran pH 5-6 kemudian dilakukan sentrifugasi untuk memisahkan garam yang terbentuk akibat reaksi dengan cairan yang telah dinetralisasi. Endapan yang telah disaring dimasukkan kembali ke dalam cairan yang telah dinetralisasi (Modifikasi Richana et al. 2011)
Detoksifikasi dan Dekolorisasi Hidrolisat Kimiawi
Detoksifikasi dilakukan setelah hidrolisis kimiawi dan netralisasi sampai pH yang diinginkan. Penambahan arang aktif konsentrasi 5% pada hidrolisat dengan waktu hidrolisis terbaik dilakukan selama 30, 60, dan 90 menit pada suhu 400C kemudian dilakukan pengadukan pada kecepatan 150 rpm sehingga diharapkan kandungan toksik yang dihasilkan selama hidrolisis kimiawi dapat diserap dengan baik dan intensitas warna larutan pada hidrolisat dapat dideteksi oleh spektrofotometer. Arang aktif yang digunakan merupakan arang aktif teknis. Sebelum dipakai, arang aktif dipanaskan terlebih dahulu pada oven bersuhu 600C, lalu didinginkan selama 3 menit dan arang aktif sudah siap dipakai (Saud 2011).
Hidrolisis Enzimatis TKKS
Perlakuan Xilanase. Larutan yang telah mengalami hidrolisis kimiawi dan netralisasi
ditambahkan enzim xilanase (Novozymes) dengan konsentrasi 0.25% dan 0.5%. Kondisi optimum xilanase dilakukan pada suhu 50oC dan pH 6. Selanjutnya dilakukan pengukuran kadar gula pereduksi dengan metode DNS. Pengamatan gula pereduksi dilakukan setelah hidrolisis (2 dan 4 hari).
Perlakuan Selulase. Larutan yang telah mengalami hidrolisis kimiawi dan netralisasi ditambahkan enzim selulase (Celluclast) dengan konsentrasi 0.25% dan 0.5%. Kondisi optimum selulase dilakukan pada suhu 60oC dan pH 5. Selanjutnya dilakukan pengukuran kadar gula pereduksi dengan metode DNS. Pengamatan gula pereduksi dilakukan setelah hidrolisis (2 dan 4 hari).
Pengukuran Gula Pereduksi
Pengukuran gula pereduksi berdasarkan metode Dinitro Salicylic Acid/ DNS. Sampel yang telah jernih dimasukkan sebanyak 1 mL ke dalam tabung reaksi, ditambah 3 mL pereaksi DNS, dikocok hingga homogen menggunakan vortex dan dimasukkan dalam air mendidih selama 15 menit kemudian didinginkan sampai suhu ruang. Bila terlalu
pekat sampel dapat diencerkan agar dapat
terukur pada panjang gelombang 540 nm. Pengukuran blanko menggunakan akuades. Kurva standar dibuat dengan menggunakan larutan glukosa standar 10, 25, 50, 100, 200, 300, 400, 500 ppm. Setelah dapat data hasil pengukuran, dilakukan penghitungan kadar gula pereduksinya.
A rata-rata =
= Y
A1 = Absorban ulangan pertama
A2 = Absorban ulangan kedua
Selanjutnya absorban rata-rata dimasukkan ke dalam persamaan garis dari data kurva standar.
Y = aX( ⁄ b
Y = Absorban rata-rata
X = Konsentrasi gula pereduksi (mg/L)
HASIL DAN PEMBAHASAN
9
yang menjadi serbuk. Efisiensi dalam penggunaan substrat merupakan salah satu pertimbangan penting bagi pengembangan
pilot project.Tertera pada tabel 2, ukuran 80 mesh menghasilkan rendemen yang lebih besar dibandingkan ukuran 60 mesh. Hal ini dikarenakan semakin kecil ukuran mesh yang digunakan akan semakin memudahkan partikel TKKS untuk lolos dalam pengayakan, sedangkan bagian yang besar pada TKKS akan tertinggal dalam proses pengayakan (Richana et al. 2011).
Alasan pemilihan bobot serbuk antara 60-80 mesh agar rendemen serat yang dihasilkan lebih banyak. Hal ini didukung oleh pernyataan Hirsham (2008) bahwa ukuran serbuk yang cukup kasar (sekitar 20-40 mesh) membutuhkan variasi metode delignifikasi. Kedua ukuran baik 60 dan 80 mesh yang akan dipakai untuk proses selanjutnya, yaitu delignifikasi. Hasil rendemen setelah penggilingan berdasarkan ukuran mesh seperti tertera pada Tabel 2.
Tabel 2 Bobot TKKS setelah penggilingan dan pengayakan Ukuran TKKS Bobot Bersih (Kg) % Rendemen
80 mesh 12.06 60.3
60 mesh 7.78 38.9
Hasil Delignifikasi TKKS
Delignifikasi merupakan proses penghilangan lignin dari TKKS agar hidrolisis lignoselulosa berlangsung dengan sempurna. Metode delignifikasi dapat digolongkan ke dalam 4 jenis, yaitu delignifikasi secara fisik, delignifikasi secara kimia fisik, delignifikasi secara kimia, dan delignifikasi secara biologi (Taherzadeh dan Karimi 2008). Salah satu metode delignifikasi yang telah dilakukan adalah penambahan pelarut natrium hipoklorit (NaOCl).
Konsentrasi NaOCl yang digunakan dalam penelitian ini adalah 10%, konsentrasi ini ditentukan berdasarkan banyaknya lignin yang dapat diurai. Hal ini didasarkan penelitian Widyani (2002) yang berkaitan dengan penentuan konsentrasi NaOCl untuk delignifikasi. Penelitian yang dilakukan Widyani (2002) menyimpulkan bahwa semakin tinggi konsentrasi NaOCl maka semakin banyak pula lignin yang mampu diurai, konsentrasi maksimum yang digunakan adalah 10% karena jika konsentrasi NaOCl yang digunakan lebih dari 10% akan merusak xilan yang berstruktur amorf.
Delignifikasi menyebabkan perubahan
warna dan bobot serbuk TKKS. Warna serbuk TKKS lebih cerah dibandingkan serbuk TKKS sebelum delignifikasi. Pemudaran warna coklat pada serbuk TKKS menjadi lebih cerah diakibatkan pelarutan lignin oleh NaOCl. Pelarut NaOCl mengandung ion-ion hipoklorit yang menyebabkan renggangnya ikatan-ikatan karbon dalam struktur lignin.
Berdasarkan hasil perhitungan kehilangan bobot rata-rata pada ukuran 60 mesh mencapai 26.91% dan ukuran 80 mesh mencapai 64%. Persentase kehilangan bobot dihitung berdasarkan perbandingan bobot serbuk setelah delignifikasi dan bobot serbuk sebelum delignifikasi. Ukuran 80 mesh lebih banyak mengalami kehilangan bobot setelah delignifikasi karena luas permukaan yang lebih besar untuk kontak dengan NaOCl, sehingga kemungkinan NaOCl untuk merusak struktur lignin lebih besar dibandingkan ukuran 60 mesh. Bobot yang hilang (%) dapat mengindikasikan adanya kehilangan lignin, hal ini sesuai dengan penelitian Richana et al. (2011) yang menyatakan bahwa semakin besar bobot TKKS yang hilang, maka kemungkinan besar bobot yang hilang merupakan lignin dan bobot yang tersisa merupakan selulosa dan hemiselulosa. Data hasil delignifikasi secara keseluruhan tersaji pada Tabel 3.
Tabel 3 Persentase kehilangan bobot TKKS setelah delignifikasi Ukuran (Mesh) Bobot sebelum delignifik asi (g) Bobot setelah delignifi kasi (g) Kehilan gan bobot (%)
80 1000 360 64
60 1000 730.9 26.91
10
yang akan mengalami perubahan selama proses delignifikasi adalah luas permukaan yang dapat kontak dengan enzim, kristalinitas pada serat selulosa, kadar lignin, dan kadar hemiselulosa (Taherzadeh dan karimi 2008).
TKKS yang telah direndam dalam NaOCl 10% diletakkan dalam wadah ember dan didiamkan selama 12 jam pada suhu ruang. Lamanya perendaman dimodifikasi dari penelitian yang dilakukan oleh Richana et al.
(2007), yaitu sekitar 5 jam pada suhu 280C. Proses ini disebut maserasi dan dilakukan hanya 1 kali. Alasan dilakukannya modifikasi perendaman agar hemiselulosa, lignin, dan selulosa larut lebih banyak sedangkan gula reduksi terutama xilan tertinggal dan tidak larut. Sifatnya yang tidak larut dalam NaOCl disebabkan sifat xilan yang tahan terhadap kondisi delignifikasi. Suhu yang digunakan dalam perendaman adalah suhu ruang sekitar 280C, suhu yang sangat baik untuk perendaman serbuk TKKS, karena semakin tinggi suhu yang digunakan dapat merusak struktur hemiselulosa tersebut (Richana et al. 2011).
Serbuk TKKS sebelum mengalami proses delignifikasi dan sesudahnya dianalisis kadar air, abu, dan serat melalui metode AOAC (1995). Analisis ini diperlukan untuk mengetahui komposisi kimia dari bahan lignoselulosa yang akan dihidrolisis secara kimia maupun enzimatis. Selain itu data proksimat juga dapat dibandingkan dengan penelitian yang sebelumnya telah dilakukan. Analisis proksimat dilakukan pada serbuk TKKS yang berukuran 80 mesh karena mengalami kehilangan bobot (%) lebih besar dibandingkan serbuk 60 mesh, yaitu 64%. Tabel 4 Analisis proksimat serbuk TKKS 80 mesh
Komposisi Air (%) Abu (%)
Serat (%) Sebelum
delignifikasi
10.72 4.21 51.51 Setelah
delignifikasi
5.24 2.89 34.85
Penelitian yang telah dilakukan sebelumnya oleh Darnoko et al. (2001) menggunakan pelarut NaOH menyatakan bahwa setelah proses delignifikasi kandungan hemiselulosa dan lignin akan menurun. Persentase berkurangnya lignin sebanyak 10-15% dalam lignoselulosa sudah dikategorikan baik (Darnoko et al. 2001). Proses berkurangnya lignin lebih cepat dibandingkan
hemiselulosa disebabkan pelarut NaOH akan menyerang lignin terlebih dahulu dan kemudian hemiselulosa. Komponen kimia TKKS yang paling penting untuk pembuatan bioetanol adalah selulosa. Semakin tinggi kandungan selulosa pada bahan akan semakin baik untuk bahan baku pembuatan bioetanol. Kandungan selulosa setelah delignifikasi lebih tinggi dibandingkan sebelum delignifikasi, kemungkinan disebabkan penurunan komponen lain selain selulosa akibat degradasi oleh pelarut (Taherzadeh dan Karimi 2008).
Kadar abu contoh mengalami penurunan hingga 2.89%, sedangkan kadar serat mengalami penurunan menjadi 34.85%. Kadar abu contoh berkurang disebabkan hilangnya bobot TKKS dari bobot awalnya (Tabel 4). Kemungkinan kadar serat mengalami penurunan disebabkan kandungan lignin dan hemiselulosa terdegradasi selama delignifikasi. Namun persentase kandungan selulosa, hemiselulosa dan lignin terhadap kandungan serat tidak dilakukan. Kadar serat yang mencapai 35% diharapkan akan meningkatkan rendemen selulosa dan xilan yang dihasilkan. Kadar air merupakan parameter penting dalam delignifikasi dan air dapat menganggu aktivitas enzim dan aksesibilitas enzim terhadap substrat, sehingga air perlu disingkirkan dalam bahan lignoselulosa. Kadar air pada serbuk 80 mesh TKKS sebelum mengalami delignifikasi sebesar 10.72%. Namun setelah mengalami delignifikasi, kadar air contoh mengalami penurunan hingga 5.24%. Penurunan kadar air dapat disebabkan ikatan antara hemiselulosa dengan lignin menjadi renggang setelah mengalami delignifikasi sehingga hemiselulosa tidak dapat kembali mengikat air.
Hidrolisis Kimiawi TKKS
11
juga pernah ditemukan didalamnya (Darnoko
et al. 2001).
Perbedaan senyawa yang digunakan untuk hidrolisis kimiawi memberikan efek dan pengaruh yang berbeda terhadap lignoselulosa yang terdapat dalam TKKS. Umumnya senyawa yang digunakan adalah asam dan basa. Penggunaan hidrolisis dengan asam sudah lebih dulu dilakukan dibandingkan senyawa basa. Menurut Taherzadeh dan Karimi (2007), keuntungan menggunakan asam sulfat pekat adalah tingkat konversi selulosa menjadi glukosa yang tinggi, namun biayanya cukup mahal. Hidrolisis dengan asam encer memberikan hasil yang rendah dan banyak mengandung produk sampingan yang dapat menghambat aktivitas mikroba maupun khamir selama fermentasi. Selain biaya mahal dan konversi yang rendah, penggunaan asam terlalu pekat dapat menimbulkan masalah pencemaran lingkungan melalui limbah cairannya. Salah satu solusi yang pernah dilakukan adalah hidrolisis TKKS menggunakan senyawa basa.
Ketika lignoselulosa dihidrolisis dengan basa encer (NaOH 4%) pada suhu tinggi yang konstan menyebabkan degradasi ikatan ester antara lignin dan hemiselulosa serta terjadi pelemahan ikatan silang antara matriks
selulosa dan hemiselulosa. Selanjutnya terjadi perusakan striktur lignin dan derajat kristalinitas pada selulosa semakin berkurang sehingga memperbesar area selulosa yang akan dihidrolisis dengan enzim.
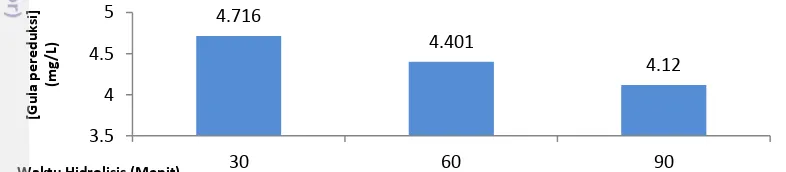
Berdasarkan uji gula pereduksi setelah hidrolisis lignoselulosa dengan NaOH 4% (Gambar 6), waktu hidrolisis selama 30 menit merupakan waktu optimum untuk menghasilkan gula pereduksi sebesar 4.716 mg/L dari bobot TKKS 5 gram, sedangkan hidrolisis menggunakan NaOH 4% selama 60 menit dan 90 menit masing-masing hanya menghasilkan gula pereduksi 4.401 mg/L dan 4.120 mg/L.. Adanya penurunan konsentrasi gula pereduksi yang dihasilkan jika waktu hidrolisis semakin lama dilakukan (lihat Gambar 6). Kemungkinan penyebabnya adalah terjadinya reaksi browning non enzimatis (Lievonen et al. 2002). Ciri-ciri reaksi browning non enzimatis ditandai dengan terlihatnya efek pencoklatan pada warna sampel. Reaksi browning ini terjadi karena semakin lama dipanaskan dengan suhu tinggi yang konstan, gula pereduksi berubah bentuknya teroksidasi dan mengurangi pembentukan gula pereduksi (Lievonen et al. 2002).
Gambar 6 Hubungan waktu hidrolisis kimiawi dengan konsentrasi gula pereduksi pada suhu 1210C
Detoksifikasi dan Dekolorisasi Hidrolisis kimiawi dan netralisasi pada hidrolisat memicu munculnya inhibitor aktifitas enzim maupun mikroorganisme yang akan melakukan fermentasi. Inhibitor yang ditemukan biasanya senyawa furfural atau hidroksi metil furfural. Tujuan detoksifikasi pada penelitian ini adalah mengurangi senyawa inhibitor bagi khamir Saccharomyces
yang akan mengambat fermentasi menjadi bioetanol, sedangkan tujuan dekolorisasi adalah mengurangi intensitas warna yang dihasilkan setelah hidrolisis kimiawi TKKS sehingga pembacaan absorban pada spektrofotometer lebih tepat dan akurat.
Identifikasi senyawa toksik dalam hidrolisat dan menentukan metode detoksifikasi yang dilakukan merupakan tahapan yang penting untuk meningkatkan efisiensi dari hidrolisis enzimatis dan fermentasi. Berbagai metode detoksifikasi telah banyak dikenal dan dilakukan untuk mengurangi konsentrasi toksik di dalam hidrolisat. Namun, efisiensi pada metode yang digunakan tergantung komposisi hidrolisat menurut bahan baku yang digunakan dan pada kondisi hidrolisisnya (Saud 2011).
Salah satu detoksifikasi yang sering dilakukan adalah metode penjerapan dengan arang aktif. Menurut Saud (2011), mekanisme
4.716 4.401 4.12 3.5 4 4.5 5
30 60 90
[G ul a pe re duksi ] (m g /L)
12
penjerapan arang aktif dapat diterangkan sebagai berikut, molekul adsorbat berdifusi melalui suatu lapisan batas ke permukaan luar, sebagian besar berdifusi lanjut di dalam pori-pori adsorben, biasanya disebut difusi internal. Proses adsorpsi pada arang aktif terjadi melalui 3 tahap dasar, yaitu zat terjerap pada bagian luar, zat bergerak menuju pori-pori arang aktif dan zat terjerap ke bagian dinding dalam dari arang aktif.
Hidrolisat yang telah mengalami proses netralisasi dengan HCl 1% dan CH3COOH
1% dilakukan detoksifikasi dan dekolorisasi. Pada penelitian ini dilakukan uji gula pereduksi antara hidrolisat yang mengalami detoksifikasi dan hidrolisat yang tidak mengalami detoksifikasi. Selanjutnya dilakukan analisa pengaruh lama waktu kontak arang aktif terhadap konsentrasi gula
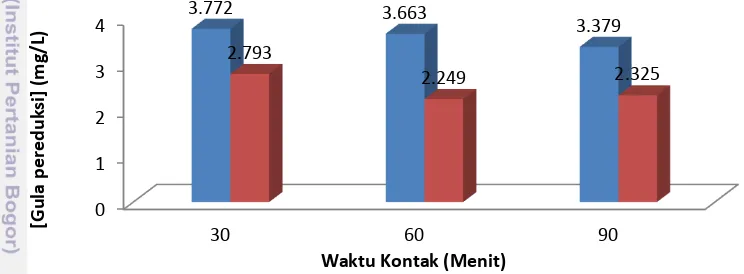
pereduksi yang ada di dalam hidrolisat setelah proses detoksifikasi dan pengaruh detoksifikasi terhadap konsentrasi gula pereduksi. Berdasarkan uji gula pereduksi, hidrolisat yang mengalami detoksifikasi arang aktif 5% memiliki konsentrasi yang lebih kecil dibandingkan hidrolisat yang tidak mengalami detoksifikasi. Pada Gambar 8 menunjukkan, konsentrasi arang aktif sebesar 5% menyebabkan gula pereduksi berkurang akibat dijerat oleh arang aktif. Hal ini dikarenakan semakin besar konsentrasi arang aktif yang digunakan maka luas permukaan yang dapat menjerap gula pereduksi semakin besar. Ukuran molekul gula pereduksi yang lebih kecil dari ukuran pori arang aktif menyebabkan gula pereduksi dapat terjerap oleh gaya kapiler yang dimiliki arang aktif.
Gambar 7 Hubungan lama kontak arang aktif 5% dengan konsentrasi gula pereduksi pada suhu 400C
Keterangan : : Tanpa Arang Aktif 5% ; : Arang Aktif 5%
Hasil analisa terhadap lama waktu kontak menunjukkan semakin lama waktu kontak arang aktif menyebabkan penurunan konsentrasi gula pereduksi di dalam hidrolisat (Gambar 7). Hidrolisat yang kontak dengan arang aktif 5% selama 30 menit memiliki gula pereduksi terbesar dibandingkan hidrolisat lainnya yang mengalami detoksifikasi, yaitu sebesar 2.793 mg/L. Namun pada perlakuan lama waktu kontak 90 menit konsentrasi arang aktif terjadi peningkatan konsentrasi gula pereduksi di dalam hidrolisat dibandingkan waktu kontak 60 menit. Kemungkinan terjadi kenaikan gula pereduksi pada perlakuan 90 menit karena kondisi arang aktif yang telah jenuh sehingga tidak dapat mengadsorpsi lebih banyak lagi gula pereduksi.
Hasil penelitian ini serupa dengan hasil penelitian yang dilakukan Saud (2011)
mengenai detoksifikasi hidrolisat asam dari ubi kayu menggunakan arang aktif untuk produksi bioetanol. Saud (2011) dalam penelitiannya menggunakan dua metode detoksifikasi, yaitu metode overliming menggunakan Ca(OH)2 yang selanjutnya
dilakukan detoksifikasi dengan penjerapan arang aktif. Hasilnya menunjukkan penurunan gula pereduksi sebesar 6.23% dengan metode overliming (sebelum perlakuan 218.09 g/L dan sesudah perlakuan 204.50 g/L), kemudian gula pereduksi semakin menurun menjadi 145.51 g/L dengan persentase penurunan 33.3% setelah dilanjutkan detoksifikasi dengan penjerapan arang aktif 5% dengan waktu kontak terbaik 30 menit. Selain konsentrasi gula pereduksi yang menurun, konsentrasi furfural dan hidroksi metil
0 1 2 3 4
30 60 90
3.772 3.663
3.379
2.793
2.249 2.325
[G u la p e re d u k si] (m g/ L)
13
furfural (HMF), juga menurun dengan kedua detoksfikasi tersebut.
Selain dilakukan detoksifikasi pada hidrolisat, metode dekolorisasi juga dapat dilakukan. Kedua metode ini dapat dijadikan sebuah kesatuan sistem dalam menganalisa gula pereduksi. Metode dekolorisasi dilakukan karena saat pembacaan awal gula pereduksi pada hidrolisat dengan spektrofotometri sangat tinggi, sehingga data yang didapat tidak akurat. Ketika hidrolisis kimiawi selesai, intensitas warna hidrolisat coklat gelap akibat reaksi browning, akibatnya cahaya yang diserap sangat pekat dan cahaya yang diteruskanoleh kuvet sangat kecil. Setelah dekolorisasi, intensitas warna hidrolisat menjadi lebih cerah sehingga pembacaan larutan akan lebih tepat.
Hidrolisis Enzimatis TKKS
Hidrolisis enzimatis merupakan salah satu tahapan konversi selulosa maupun hemiselulosa menjadi gula pereduksi dengan menggunakan enzim. Enzim yang digunakan dapat diisolasi dari bakteri atau khamir dan enzim murni komersial yang diproduksi massal oleh pabrik. Penelitian ini menggunakan dua jenis enzim yang berbeda untuk dapat menghidrolisis holoselulosa yang terdapat dalam TKKS.
Pertama, enzim selulase digunakan untuk menghidrolisis selulosa menjadi glukosa. Struktur yang rapat pada selulosa, bagian
kristalin selulosa resisten terhadap aksi individual selulase, sehingga perlu dilakukan perlakuan pendahuluan dengan suhu yang tinggi dan hidrolisis dengan kimiawi. Rangkaian proses hidrolisis selulosa dengan selulase terdiri dari adsorpsi selulase pada permukaan selulosa, biodegradasi selulosa menjadi gula pereduksi, dan desorpsi selulase. Degradasi selulosa menjadi glukosa, umumnya merupakan proses sinergis antara endoglukanase, eksoglukanase dan β-glukosidase yang ketiganya merupakan bagian dari selulase (Rabinovich et al. 2002).
Endoglukanase menyerang bagian yang sedikit kristalin pada serat selulosa. Selanjutnya eksoglukanase memotong rantai utama selulosa dengan menghasilkan beberapa unit selobiosa. Terakhir selobiosa didegradasi menjadi unit yang lebih kecil
yaitu glukosa oleh enzim β-glukosidase
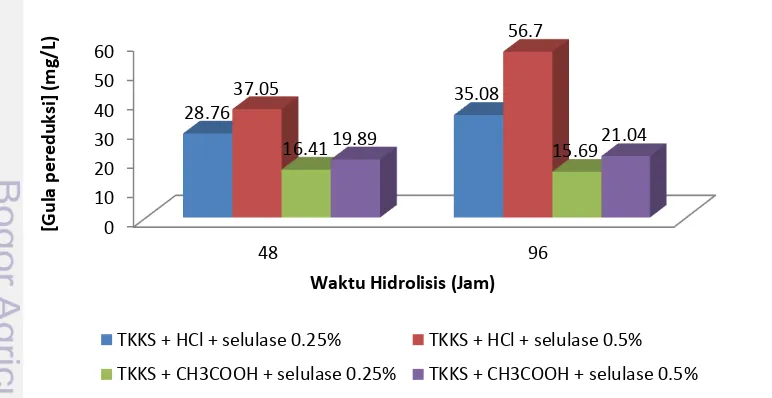
(Taherzadeh dan Karimi 2007b). Hasil análisis gula pereduksi melalui hidrolisis selulase menggambarkan bahwa semakin lama waktu hidrolisis yang dilakukan maka semakin banyak gula pereduksi yang dihasilkan (Gambar 8). Hasil ini serupa dengan hasil penelitian Richana et al. (2011) yang menyatakan bahwa perlakuan basa, autoklaf, dan enzim pada holoselulosa selama 6 hari menghasilkan 20.56% gula pereduksi. Selama 6 hari hidrolisis juga terjadi peningkatan gula pereduksi.
Gambar 8 Hubungan waktu hidrolisis dengan konsentrasi gula pereduksi melalui hidrolisis selulase
Pada penelitian ini, sebelum hidrolisis enzim dilakukan netralisasi menggunakan dua
jenis asam dengan konsentrasi sebesar 1%. Netralisasi dilakukan hingga mencapai
0 10 20 30 40 50 60 48 96 28.76 35.08 37.05 56.7
16.41 19.89 15.69
21.04 [Gu la p e re d u ksi ] (m g /L)
Waktu Hidrolisis (Jam)
TKKS + HCl + selulase 0.25% TKKS + HCl + selulase 0.5%
14
kondisi pH optimum enzim selulase, yaitu pH 5. Selama 96 jam hidrolisis, netralisasi menggunakan asam klorida (HCl) 1% akan menghasilkan lebih banyak gula pereduksi jika dibandingkan netralisasi menggunakan asam asetat (CH3COOH) 1%. Perbedaan gula
pereduksi yang dihasilkan dari dua perlakuan tersebut dapat disebabkan kemampuan asam kuat (HCl) yang lebih kuat untuk memutus ikatan antara selulosa dan hemiselulosa dan mengkonversikannya menjadi gula pereduksi walaupun dilakukan pada temperatur yang rendah. Selain itu asam kuat memiliki kemampuan lebih baik untuk menurunkan derajat krisatalinitas selulosa sehingga memberikan akses enzim lebih besar untuk menghidrolisis (Taherzadeh dan Karimi 2007a).
Penambahan selulase dengan konsentrasi yang berbeda juga dianalisis pada penelitian ini. Penambahan dengan konsentrasi 0.5% selulase lebih banyak menghasilkan gula pereduksi jika dibandingkan dengan penambahan 0.25% baik pada netralisasi menggunakan HCl atau CH3COOH. Menurut
Sun dan Cheng (2002), penambahan jumlah dosis selulase ke dalam proses hidrolisis dapat meningkatkan hasil dan laju hidrolisis, namun juga bisa meningkatkan biaya selama proses. Gula pereduksi terbesar yang dihasilkan melalui hidrolisis enzim selulase, yaitu 56.7 mg/L (Gambar 9) lebih banyak dibandingkan hasil hidrolisis kimiawi yang hanya 4.716 mg/L (Gambar 6). Hal ini berkaitan dengan teori lock and key pada enzim. Enzim akan bekerja pada kondisi spesifik, yaitu substrat yang sesuai, pH dan suhu optimum. Selulase yang diproduksi oleh Novozyme bekerja pada substrat selulosa, pH 5 dan suhu 600C. Selanjutnya selulosa akan dihidrolisis menjadi glukosa yang merupakan gula pereduksi.
Enzim kedua yang digunakan pada penelitian ini adalah xilanase. Xilanase merupakan enzim yang memiliki kemampuan menghidrolisis hemiselulosa dalam hal ini berupa xilan menjadi monomer gula, yaitu xilosa. Xilanase dapat diklasifikasikan berdasarkan substrat yang dihidrolisis, yaitu β-xilosidase, eksoxilanase, dan endoxilanase (Richana et al. 2007).
β-xilosidase, yaitu xilanase yang mampu menghidrolisis xilo-oligosakarida rantai pendek xilosa. Aktivitas enzim akan menurun dengan meningkatnya rantai xilo-oligosakarida (Richana et al. 2007). Eksoxilanase mampu memutus rantai polimer xilosa (xilan) pada ujung reduksi, sehingga menghasilkan xilosa sebagai produk utama
dan sejumlah oligosakarida rantai pendek.
Endoxilanase mampu memutus ikatan β- 1,4
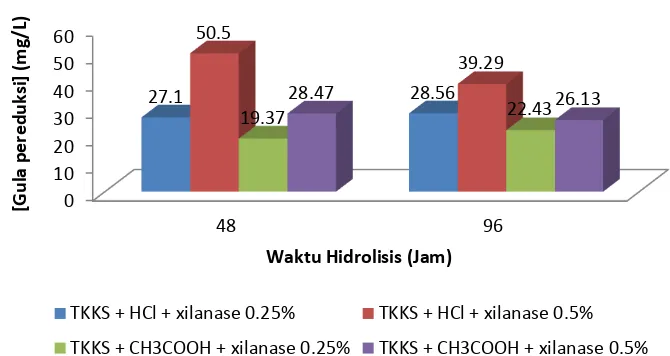
pada bagian dalam rantai xilan secara teratur. Berdasarkan Gambar 9, terdapat beberapa perbedaan hasil gula pereduksi terhadap lamanya hidrolisis. Hidrolisis melalui penambahan 0.25% xilanase dan netralisasi menggunakan HCL 1% atau CH3COOH 1%
selama 96 jam mengalami peningkatan gula pereduksi. Lain halnya terjadi pada hidrolisis dengan penambahan 0.5% xilanase dan netralisasi menggunakan HCL 1% atau CH3COOH 1% selama 96 jam mengalami
penurunan gula pereduksi. Terkait penurunan gula pereduksi adanya kemungkinan produk hasil hidrolisis menghambat aktifitas enzim itu sendiri. Dalam hal ini, produk hidrolisis enzim, yaitu xilosa dapat menghambat aktifitas selulase yang mengakibatkan gula pereduksi menurun (Sun dan Cheng 2002). Beberapa metode telah dikembangkan untuk mengurangi produk yang menghambat kerja enzim, salah satunya melalui simultaneous saccharification and fermentation (SSF). Mengenai prosesnya, gula pereduksi yang dihasilkan selama hidrolisis selulosa maupun hemiselulosa akan langsung dilanjutkan fermentasi dalam suatu batch yang sama dan menghasilkan etanol pada proses akhirnya (Sun dan Cheng 2002).
Keuntungan yang diperoleh dengan menggunakan SSF adalah meningkatkan laju hidrolisis melalui konversi gula pereduksi yang secara simultan, sedikit enzim yang digunakan, hasil hidrolisis dan fermentasi menjadi tinggi, pengerjaan waktu yang lebih singkat, dan penggunaan batch yang lebih efisien karena hanya menggunakan single batch (Sun dan Cheng 2002). Metode lain yang dapat digunakan adalah penggunaan enzim xilanase dan selulase secara bersamaan. Berdasarkan penelitian yang dilakukan Richana et al. (2011), kadar gula hasil reduksi hasil hidrolisis kimia (NaOH) dilanjutkan hidrolisis enzimatis dengan cara simultan yang dihasilkan setelah 6 hari hidrolisis sebesar 14.42%. Hasil tersebut lebih tinggi dibandingkan hidrolisis enzimatis secara bertahap, kadar gula pereduksi yang dihasilkan selama 6 hari hanya sebesar 4.66%. Adanya potensi yang lebih baik jika TKKS dihidrolisis enzimatis secara bersamaan untuk penelitian selanjutnya.
Pada penelitian ini, sebelum dilakukan hidrolisis dengan xilanase, sampel diberi perlakuan netralisasi dengan senyawa asam, yaitu HCl 1% dan CH3COOH 1%. Tujuannya
15
hingga pH optimum untuk xilanase dikisaran 5.5 - 6.0. Sama seperti hidrolisis selulase (Gambar 8), hidrolisis holoselulosa dengan xilanase (Gambar 9) juga memberikan gula pereduksi lebih tinggi dibandingkan hidrolisis kimiawi. Hidrolisis dengan xilanase ditemui pada 0.5% xilanase dan netralisasi HCl 1% menghasilkan 50.5 mg/L gula pereduksi lebih tinggi dibandingkan hidrolisis kimiawi yang
hanya menghasilkan 4.716 mg/L gula pereduksi. Alasannya enzim secara spesifik mampu mengubah substrat yang dikenali menjadi sebuah produk. Bukan hanya substrat, laju hidrolisis enzim juga dapat diperbaiki melalui optimasi pada pH dan suhu. Enzim xilanase yang digunakan pada penelitian ini diproduksi oleh Novozyme yang optimum pada pH 6 dan suhu 50oC.
Gambar 9 Hubungan waktu hidrolisis dengan konsentrasi gula pereduksi melalui hidrolisis xilanase
SIMPULAN DAN SARAN
Simpulan
Konsentrasi enzim xilanase dan selulase dapat mempengaruhi rendemen gula pereduksi dari TKKS. Semakin besar konsentrasi enzim yang digunakan maka semakin besar gula pereduksi yang dihasilkan. Rendemen gula pereduksi terbesar yang dihasilkan dengan penambahan 0.5 % xilanase dan 0.5% selulase, masing-masing sebesar 50.5 mg/L dan 56.7 mg/L. Waktu hidrolisis enzim memberikan pengaruh yang berbeda terhadap gula pereduksi dari TKKS. Waktu hidrolisis terbaik menggunakan enzim selulase selama 96 jam dengan gula pereduksi sebesar 56.7 mg/L, sedangkan waktu hidrolisis menggunakan enzim xilanase lebih singkat, yaitu selama 48 jam dengan gula pereduksi sebesar 50.5 mg/L.
Saran
Perlu dilakukan analisis kadar lignin, selulosa dan hemiselulosa sebelum dan setelah delignifikasi. Perlu dilakukan analisis hidroksi metil furfural dan furfural untuk memperkuat hasil detoksifikasi. Selanjutnya perlu dilakukan hidrolisis enzimatis TKKS
menggunakan enzim selulase dan xilanase secara bersamaan.
DAFTAR PUSTAKA
AOAC. 1995. Official Method of Analysis.Association of Official AnaliticalChemists.Washington D.C. Beg QK, Kapoor M, Mahajan L, Hoondal GS.
2000. Microbial Xylanases and Their Industrial Applications. Biotechnol. 56: 326-338.
Bhat MK. 2000. Cellulases and Related Enzymes in Biotechnology. Biotechnol Adv. 18:355-383.
Bintang M. 2010. Biokimia: Teknik Penelitian. Jakarta: Erlangga..
Darnoko D, Herawan T, Guritno P. 2001. Teknologi Produksi Biodiesel dan Prospek Pengembangannya di Indonesia. Warta PPKS 9 (1): 17-27. Ditjen Perkebunan. 2010. Prospek
Perkebunan dan Industri Minyak
0 10 20 30 40 50 60 48 96
27.1 28.56
50.5
39.29
19.37 22.43
28.47 26.13
[Gu la p e re d u ksi ] (m g /L)
Waktu Hidrolisis (Jam)
TKKS + HCl + xilanase 0.25% TKKS + HCl + xilanase 0.5%
16
Kelapa Sawit di Indonesia. Tangerang: PT. Bisinfocus Data Pratama.
Fengel D, Wegener G. 2002. Wood Chemistry. New York: Walter De Gruter. Goldstein IS. 2000. Chemicals from Lignocellulose. Bioeng. Symp : 293- 301.
Gong CS, Tsao GT. 2001. Cellulose and Biosynthesis Regulation. Annual Report on Fermentation Process. New York: Academic Press.
Hartojo K. 2005. Pemberdayaan Ubi Kayu Mendukung Ketahanan Pangan Nasional dan Pengembangan Agribisnis Kerakyatan. Penelitian Tanaman Kacang-kacangan dan Umbi-umbian. Jakarta: Badan Penelitian dan Pengembangan Pertanian
Hirsham FM, Eid MA. 2008. Lignocellulosic Biomass Conversion Technologies to Biofuels, Potential in Egypt. Annual Report on UNIDO. IMC Press, Kairo. Howard RL, Abotsi E, van Rensburg JEL,
Howard S. 2003. Lignocellulose Biotechnology: Issues of Bioconversion and Enzyme Production. J. Biotechnol. 2(12): 602-619.
Irawati D. 2006. Pemanfaatan Serbuk Kayu Untuk Produksi Etanol. [Tesis]. Bogor. Sekolah Pascasarjana, Institut Pertanian Bogor.
Kulkarni N, Rao M. 1999. Appication of Xylanase from alkaliphilic thermophilic
Bacillus sp. for pulp. Biotechnol. 51: 167-173.
Lievonen SM, Laaksonen TJ, Ross YH. 2002. Non enzymatic browning in the vicinity of glass transition: Effects of fructose, glucose, and xylose as reducing sugar.
Journal of Agriculture and Food Chemistry. 50: 7034-7041
Loebis EH. 2008. Optimasi Proses Hidrolisis Kimiawi dan Enzimatis TKKS Menjadi Glukosa Untuk Produksi Etanol. [Tesis]. Bogor. Sekolah Pascasarjana, Institut Pertanian Bogor.
Millet MA, Baker AJ, Scatter LD, 1999. Physical and chemical pretreatment for enhancing cellulose saccharification.
Bioeng. Symp. 6: 125 - 153.
Mosier N, Wyman C, Dale B, Elander R, Lee YY, Holtzapple MT, Ladisch M. 2005. Features of Promising Technologies for
Pretreatment of Lignocellulosic Biomass. Bioresource Technology 96(6): 673 - 686.
Purwito dan Firmanti A. 2005. Pemanfaatan Limbah Sawit Untuk Bahan Pencegah Serangan Rayap Tanah. Pusat Penelitian dan Pengembangan Perkebunan. 89 hal. Pusat Penelitian Kelapa Sawit. 2008. Aplikasi
Kompos TKS Pada Kelapa Sawit TM. Publikasi Pusat Penelitian Kelapa Sawit. Medan.
Rabinovich ML, Melnik MS, Bolobova AV. 2002. Microbial Cellulases. Microbiol. 38(4): 305-321.
Richana N, Irawadi TT, Nur MA, Sailah I, Syamsu K, Arkenan Y. 2007. Ekstraksi xilan dari tongkol jagung. J. Pascapanen. 4(1). 38 - 43.
Richana N, Prastowo B, Purwantana B, Nuralamsyah A. 2011. Diversifikasi Tandan Kosong Kelapa Sawit Untuk Biofuel Generasi 2 dan Reduksi 3 MCPD. Pusat Penelitian dan Pengembangan Perkebunan. 106 hal.
Samsuri M, Gozan M, Prasetya B, Nasikin M. 2007. Sakarifikasi dan Fermentasi Bagas Menjadi Etanol Menggunakan Enzim Selulase dan Selobiase. J. Teknologi FTUI. 11(1): 17-24
Saud RJ. 2011. Detoksifikasi Hidrolisat Asam dari Ubi Kayu dengan Metode Arang Aktif Untuk Produksi Bioetanol. [Tesis]. Bogor. Sekolah Pascasarjana, Institut Pertanian Bogor.
Setyamidjaja D. 2006. Kelapa Sawit. Yogyakarta: Kanisius.
Silverstein RA, Chen Y, Sharma RR, Boyette MD, Osborne J. 2007. A Comparison of Chemical Pretreatment Methods for Improving Saccharification of Cotton Stalks. Bioresource Technol. 99: 3729-3736.
Sun Y, Cheng J. 2002. Hydrolysis of Lignocellulosic Materials for Ethanol Production. Bioresource Tech. 83: 1-11. Syafwina, Honda Y, Watanabe T, Kuwahara
M. 2002. Pretreatment of Oil Palm Empty Fruit Bunch by White Rot Fungi for Enzymatic Saccharification. Wood Res. 89: 19-20.
17
Acid based Hydrolysis Process.
Bioresources. 2(3): 472-499.
Taherzadeh MJ, Karimi K. 2007b. Process for Ethanol from Lignocellulosic Materials : Enzyme based Hydrolysis Process.
Bioresources. 2(4): 707-738.
Taherzadeh MJ, Karimi K. 2008. Pretreatment of Lignocellulosic Wastes to Improve Ethanol and Biogas Production.
International Journal of Molecular Sciences. 9: 1621-1651.
Tarkow H, Feist WC. 2006. A Mechanism for Improving the Digestibility of Lignocellulosic Materials with Dilute Alkali and Liquid NH3. Advance
Chemistry Series 95. American Chemical Society, pp.197 - 218.
Widyani IGA. 2002. Ekstraksi Xilan dari Tongkol Jagung dan Kulit Ari Kedelai. [Skripsi]. Bogor. Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Zhang YHP, Lynd LR. 2004. Toward an
Aggregated Understanding of Enzymatic Hydrolysis of Cellulose. Biotechnology and Bioengineering. 88 :797-824. Zhao X, Zhang L, Liu D. 2007. Comparative
19
Penjemuran, Penggilingan, Pengayakan TKKS
Delignifikasi TKKS (Modifikasi Richana et al. 2007)
Hidrolisis Kimiawi dan Pengukuran
Gula Reduksi (Metode DNS)
Hidrolisis Kimiawi (Modifikasi Richana et al. 2011)
dan Pengukuran Gula Reduksi (Metode DNS)
Dekolorisasi dan Detoksifikasi Hidrolisat Kimiawi
(Saud 2011)
Hidrolisis Enzimatis dan Pengukuran Gula Reduksi
(Metode DNS)
Lampiran 1 Diagram alir penelitian
Analisis Proksimat (AOAC 1995)
20
Lampiran 2 Dokumentasi Selama Penelitian
TKKS Penggilingan TKKS
TKKS Setelah Delignifikasi
Hidrolisis Kimiawi
21
<