IDENTIFIKASI SENYAWA KIMIA ANTIFUNGAL DARI
BAKTERI ENDOFIT ASAL
Taxus sumatrana
TIWIT WIDOWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Identifikasi Senyawa Kimia Antifungal dari Bakteri Endofit asal Taxus sumatrana adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor dan LIPI.
Bogor, April 2013
Tiwit Widowati
TIWIT WIDOWATI. Identifikasi Senyawa Kimia Antifungal dari Bakteri Endofit asal Taxus sumatrana. Dibimbing oleh UTUT WIDYASTUTI dan PARTOMUAN SIMANJUNTAK
Pada beberapa dekade terakhir, telah terjadi peningkatan infeksi jamur yang disebabkan oleh resistensi beberapa spesies jamur terhadap fungisida yang digunakan dalam pengobatan. Penggunaan antifungal dalam pengobatan infeksi jamur harus mempertimbangkan toksisitas, efektivitas, biaya dan frekuensi penggunaan yang dapat menyebabkan munculnya galur yang resisten. Salah satu pendekatan dalam pengembangan obat antifungal adalah penggunaan tumbuhan sebagai sumber obat-obatan (Abad et al. 2007).
Tumbuhan merupakan inang bagi keberadaan mikroba endofit yang berpotensi sebagai penghasil senyawa aktif dengan struktur molekul dan aktivitas biologi yang beragam. Salah satu spesies tumbuhan yang dikenal sebagai inang mikroba endofit adalah Taxus. Kapang Paecilomyces sp. yang diisolasi dari Taxus mairei menghasilkan metabolit berupa brefeldin A yang mempunyai beberapa aktivitas seperti antifungal, antiviral dan antikanker (Wang et al. 2002). Selanjutnya dilaporkan juga oleh Tayung et al. (2007) bahwa bakteri Pseudomonas flourescens yang diisolasi dari rhizosphere Taxus batacca, menghasilkan senyawa aktif antimikroba.
Adanya beberapa senyawa aktif dari mikroba endofit Taxus, memberikan peluang untuk mengeksplorasi mikroba endofitik dari tanaman Taxus Indonesia sebagai penghasil senyawa aktif. Taxus sumatrana yang dikenal dengan nama Sumatran Yew (Cemara Sumatra) merupakan salah satu jenis pohon berdaun jarum yang tumbuh secara alami di Indonesia.
T. sumatrana diketahui mempunyai beberapa senyawa aktif, diantaranya taksol, cepalomanin, 7-epi-10-deasetil taksol, 7-epi-10-deasetil cepalomanin, baccatin III, hidroksil baccatin III, 10-deasetil-13-okso-baccatin III dan 19-hidroksi-13-okso baccatin III (Kitagawa et al. 1995). Shen et al. (2003) melaporkan telah mengisolasi senyawa diterpenoid taksan baru yaitu tasumatrol A dan B dari ekstrak daun dan ranting T. sumatrana. Namun potensi mikroba endofit khususnya bakteri endofit dari T. sumatrana sebagai penghasil senyawa kimia antifungal belum banyak diketahui.
Penelitian ini bertujuan untuk mengidentifikasi senyawa kimia antifungal terhadap Candida albicans yang dihasilkan bakteri endofit dari tanaman T. sumatrana dan karakterisasi bakteri terseleksi. Hasil penelitian ini diharapkan akan mendapatkan senyawa yang memiliki nilai farmakologis tinggi dan menambah informasi ilmiah senyawa kimia yang mempunyai aktivitas antifungal dari bakteri endofit T. sumatrana.
Isolasi bakteri endofit dilakukan dari batang dan daun T. sumatrana menurut metode Tomita (2003). Seleksi isolat yang berpotensi sebagai penghasil senyawa kimia antifungal terhadap C. albicans dilakukan dengan metode inokulasi titik dan difusi. Hasil isolasi bakteri endofit diperoleh adanya 16 isolat. Dari 16 isolat, diperoleh 1 isolat berpotensi sebagai antifungal yaitu isolat Tx 4
gerak n-heksana:etil asetat. Ekstrak difraksinasi dengan kromatografi kolom menggunakan pelarut n-heksana:etil asetat secara gradien dengan variasi nilai pembanding. Selanjutnya dilakukan penyederhanaan fraksi dengan KLT. Fraksi gabungan yang diperoleh, diuji antagonistik dengan C. albicans. Fraksi yang mempunyai aktivitas antifungal, dilanjutkan dengan KLT preparatif.
Fraksi hasil KLT preparatif yang menunjukkan aktivitas antifungal, dianalisis senyawa kimia menggunakan spektofotometri IR dan GC-MS. Analisis spektrum infra merah untuk fraksi aktif memberikan bilangan gelombang pada daerah 1740.64 cm-1 yang mencirikan adanya gugus karbonil dan bilangan gelombang 2919.06 cm-1 menandakan gugus aromatik serta gugus alkena pada bilangan gelombang 1521,73 cm-1 dan gugus karboksil pada bilangan gelombang 1081,03 cm-1. Senyawa aktif yang teridentifikasi diduga sebagai asam 1,2 bensenadikarboksilat diisoktil ester.
Identifikasi isolat Tx 4 dilakukan secara morfologi berdasarkan pewarnaan gram (Somasegaran and Hoben 1985) dan molekuler berdasarkan analisis sekuen gen 16S rRNA (Song et al. 2004). Hasil identifikasi morfologi menunjukkan bahwa isolat Tx 4 berbentuk batang dan bersifat gram positif. Hasil sekuen gen 16S rRNA selanjutnya dianalisis dengan program BLAST-N untuk mengetahui kesesuaian sekuen isolat Tx 4 dengan sekuen pembanding yang terdapat pada gene bank. Berdasarkan analisis BLAST, isolat Tx 4 memiliki presentase kemiripan 100% dengan Bacillus amyloliquefaciens NBRC 101586.
TIWIT WIDOWATI. Identification of Antifungal Compound from Endophytic Bacteria of Taxus sumatrana. Supervised by UTUT WIDYASTUTI and PARTOMUAN SIMANJUNTAK
In recent decades, there has been an increase in fungal infection caused by resistance of some species of fungus to fungicides used in medicinal treatment. The use of antifungal in the treatment of fungal infections should considering the toxicity, efficacy, cost and frequent use had led to emergence of resistant strains. One approach to developing antifungal drugs is use of plants as sources of medicine (Abad et al. 2007).
Plants are host for the presence of endophytic microbes. Some of these endophytes produce bioactive compound that are involved in the host-microbes relationship. Taxus is one of the hosts plant for endophytic microbes. An endophytic fungus Paecilomyces sp. was isolated from Taxus mairei, produce metabolites brefeldin A, which has several activities such as antifungal, antiviral and anticancer drugs (Wang et al. 2002). Tayung et al (2007) also reported that a bacterium Pseudomonas fluorescens was isolated from Taxus batacca rhizosphere, produce antimicrobial compounds.
Many endophytic microbes associated with Taxus have been demonstrated to produce biactive compound that was an opportunity to explore endophytic microbes of Taxus from Indonesia. Taxus sumatrana was known as the Sumatran Yew that was a needle tree, grown naturally in Indonesia.
T. sumatrana was recognized for producing a number of active compounds such as taxol, cephalomannine, 7-epi-10-deacetyltaxol, 7-epi-10-deacetylcephalomannine, baccatin III, 19-hydroxybaccatin III and 10-deacetyl-13-oxobaccatin III taxol, cepalomanin, 7-epi-10-deasetil. Shen et al. (2003) reported, two new taxane diterpenoid, tasumatrol A and B, have been isolated from extract of the leaves and twigs of Taiwanese T. sumatrana. However, the potential of endophytic microbes especially endophytic bacteria from T. sumatrana for producing antifungal compounds is still limited.
The aim of this studies were to identify antifungal compound against Candida albicans which produced by endophytes bacteria of T. sumatrana and characterize the selected isolates. The results of this study were expected to receive pharmacological compound which have high value and increase scientific information of antifungal compound from endophytic bacteria of T. sumatrana.
Endophytic bacteria were isolated from the stems and leaves of T. sumatrana (Tomita 2003). Selection of isolates was done by paper disk diffusion and point inoculation method. Sixteen isolates were found at isolation of endophytic bacteria. Among 16 isolates, isolate Tx 4 showed antagonistic activity against C. albicans.
analyzed by preparative TLC.
Fractions which showing antifungal activity, were analyzed by Infra Red Spectrophotometry (IR) and Gas Chromatography - Mass Spectrometry (GC-MS). The IR results were wavenumber 1740.64 cm-1 (carbonyl group), 2919.06 cm-1 (aromatic group), 1521.73 cm-1 (alkene group) and 1081,03 cm-1 (carboxyl group). Identification by GC-MS estimated that bioactive compounds contain of 1,2-benzenedicarboxylic acid, diisooctyl ester.
Identification of Tx 4 isolate was done base on morphology and molecular. The results of morphology identification showed that Tx 4 isolate is rod-shaped and positive Gram. The results of 16S rRNA gene sequences were compared to available databases using the BLAST-N program. Based on BLAST analysis, Tx 4 isolate had 100% similarity with Bacillus amyloliquefaciens NBRC 101586.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB dan LIPI
BAKTERI ENDOFIT ASAL
Taxus sumatrana
TIWIT WIDOWATI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Pascasarjana Institut Pertanian Bogor
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji syukur penulis panjatkan kepada Allah Subhanallahu Wata’ala atas limpahan berkat, rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan tesis yang berjudul Identifikasi Senyawa Kimia Antifungal dari Bakteri Endofit asal Taxus sumatrana. Tesis ini merupakan hasil penelitian yang dilakukan di Laboratorium Mikroba Simbiotik Tanaman dan Laboratorium Kimia Bahan Alam, Pusat Penelitian Bioteknologi-LIPI.
Pada kesempatan ini, penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Dr. Ir. Utut Widyastuti, MS dan Prof. (ris) Dr. Partomuan Simanjuntak, M.Sc. selaku dosen pembimbing yang telah memberikan bimbingan dan arahan selama penelitian hingga penyusunan tesis ini.
2. Dra. Harmastini Sukiman, M.Agr. yang telah memberikan kesempatan dan dukungan sehingga penulis dapat mengikuti program pendidikan pascasarjana. 3. Ka Ike, Ella, Nana dan Ise atas bantuan dan dukungannya selama penelitian di Laboratorium Mikroba Simbiotik Tanaman. Om Bustan, Fauzi dan Yadi atas bantuannya selama penelitian di Laboratorium Kimia Bahan Alam.
4. Teman-teman BTK 2009
Ungkapan terima kasih juga disampaikan kepada Ibu, Mas Awang dan Ainun tersayang, Bulik Tri, Mas Anang, Mas Puguh dan Titin atas segala doa, dukungan dan kasih sayangnya.
Penulis menyadari akan keterbatasan yang dimiliki, maka masukan berupa saran dan kritik guna penyempurnaan penulisan tesis ini sangat diharapkan. Penulis berharap semoga tesis ini dapat bermanfaat bagi para pembaca dan terutama pengembangan ilmu penulis.
Bogor, April 2013
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Taxus sumatrana 3
Mikroba Endofit 4
Jamur Patogen Candida albicans 5
Antifungal 6
Ekstraksi 6
Kromatografi 7
Identifikasi Senyawa Kimia 9
Identifikasi Mikroba 10
3 METODE 12
Bahan 12
Alat 12
Metode Penelitian 12
Isolasi dan Seleksi Bakteri Endofit asal Taxus sumatrana 12 Isolasi dan Pemurnian Senyawa Aktif Antifungal 13
Identifikasi Senyawa Kimia 15
Identifikasi Mikroba 15
4 HASIL DAN PEMBAHASAN 17
Isolasi dan Seleksi Bakteri Endofit asal Taxus sumatrana 17 Isolasi dan Pemurnian Senyawa Aktif Antifungal 29
Identifikasi Senyawa Kimia Antifungal 34
Identifikasi Mikroba 37
5 SIMPULAN DAN SARAN 30
DAFTAR PUSTAKA 31
LAMPIRAN 37
1 Variasi eluen dalam fraksinasi ekstrak n-heksana 14
2 Hasil isolasi bakteri endofit dari daun dan ranting Taxus sumatrana 17
3 Penggabungan fraksi n-heksana hasil kromatografi kolom 20
4 Hasil interpretasi spektrum infra merah senyawa fraksi VII-1 (Skoog et al. 2007)
23
5 Hasil BLAST berdasarkan sekuen gen 16S rRNA 27
DAFTAR GAMBAR
1 Pohon dan daun Taxus sumatrana 3
2 Hasil uji antagonistik isolat Tx 4 dengan metode inokulasi titik dan difusi agar
18
3 Aktivitas penghambatan isolat Tx 4 terhadap Candida albicans 19
4 Hasil KLT ekstrak n-heksana dengan fase gerak n-heksana:etil asetat (2:1)
20
5 Hasil KLT fraksi gabungan dari isolat Tx 4 21
6 Hasil uji antagonis fraksi-fraksi gabungan dari ekstrak isolat Tx 4 21
7 Kromatogram hasil KLT preparatif fraksi VII dari isolat Tx 4 22
8 Hasil uji antagonis fraksi VII dari isolat Tx 4 terhadap Candida albicans
22
9 Hasil spektra IR dari fraksi VII-1 23
10 Hasil spektra MS untuk fraksi VII-1 24
11 Struktur kimia asam 1,2 bensenadikarboksilat diisooktil ester dari isolat Tx 4
25
12 Morfologi koloni dan hasil pewarnaan Gram isolat Tx 4 26
13 Hasil PCR gen 16S rRNA isolat Tx 4 26
14 Pohon filogenetik hasil gen 16S rRNA isolat Tx 4 dengan gene bank 28
DAFTAR LAMPIRAN
1 Kondisi alat GC-MS 36
2 Hasil pengujian bakteri endofit asal Taxus sumatrana 37
3 Hasil sekuensing gen 16S rRNA isolat Tx 4 38
4 Hasil BLAST isolat Tx 4 39
Latar Belakang
Pada beberapa dekade terakhir, telah terjadi peningkatan penyakit yang disebabkan oleh infeksi jamur. Hal ini sering terjadi pada orang yang mengalami kegagalan sistem imun, seperti penderita AIDS, kanker atau pasien transplantasi organ yang berisiko terinfeksi patogen Aspergillus spp, Cryptococcus spp dan Candida spp (Strobel and Daisy 2003).
Beberapa antibiotik dari golongan poliene, azole dan alilamin digunakan sebagai antifungal untuk menghambat pertumbuhan beberapa jenis jamur (Ghannoum and Rice 1998). Penggunaan antifungal dalam pengobatan infeksi jamur harus mempertimbangkan toksisitas, efektivitas, biaya dan frekuensi penggunaan yang dapat menyebabkan munculnya galur yang resisten.
Munculnya infeksi jamur dan galur yang memiliki sifat resisten terhadap antibiotika yang digunakan dalam pengobatan, memicu pengembangan obat antifungal yang tepat dan mempunyai efek samping yang rendah. Salah satu pendekatan yang bisa dilakukan adalah penggunaan tumbuhan sebagai sumber obat-obatan (Abad et al. 2007). Bagian tumbuhan berupa batang, daun, bunga, buah dan akar dapat dimanfaatkan sebagai bahan baku obat. Penggunaan produk alami, baik senyawa murni atau ekstrak dari tumbuhan, memberikan peluang yang sangat besar sebagai obat baru yang mengarah pada keragaman senyawa kimia. Eksplotasi yang tinggi terhadap penggunaan tanaman obat dapat menyebabkan populasinya menurun secara drastis (Henti et al. 2010). Oleh karena itu, perlu dicari sumber senyawa aktif lainnya, tanpa harus mengeksplotasi tumbuhan dan merusak ekosistem.
Mikroba endofit dipandang sebagai sumber senyawa aktif yang menempati lingkungan yang unik dan spesifik. Mikroba endofit adalah mikroba yang hidup di dalam jaringan tanaman dan mampu hidup dengan membentuk koloni dalam jaringan tanpa membahayakan tanaman inang (Strobel and Daisy 2003). Mikroba endofit hidup secara sinergis dengan tanaman inang dimana mikroba mendapatkan nutrisi yang dihasilkan tanaman inang, sedangkan mikroba menghasilkan senyawa aktif berupa metabolit sekunder yang akan menjaga inang dari serangan penyakit (Taechowishan et al. 2005). Senyawa aktif yang dihasilkan mikroba endofit diketahui berpotensi sebagai sumber senyawa antimikroba (Ezra et al. 2004).
Carusso et al. (2000) melaporkan bahwa endofit aktinomiset yang diisolasi dari kayu Taxus batacca menghasilkan paclitaxel dan turunan taxane. Selanjutnya dilaporkan juga oleh Tayung et al. (2007) bahwa bakteri Pseudomonas flourescens yang diisolasi dari rizosfer Taxus batacca, menghasilkan senyawa aktif antimikroba.
Adanya beberapa senyawa aktif dari mikroba endofit Taxus, memberikan peluang untuk mengembangkan mikroba endofit dari tanaman Taxus Indonesia sebagai penghasil senyawa aktif. Taxus sumatrana yang dikenal dengan nama Sumatran Yew (Cemara Sumatra) merupakan salah satu jenis pohon berdaun jarum yang tumbuh secara alami di Indonesia
Taxus sumatrana diketahui mempunyai beberapa senyawa aktif. Kitagawa et al. (1995) melaporkan telah berhasil mengisolasi dan menentukan beberapa senyawa terpenoid taksol dari Taxus sumatrana. Senyawa tersebut adalah taksol, cepalomanin, 7-epi-10-deasetil taksol, 7-epi-10-deasetil cepalomanin, baccatin III, 19-hidroksil baccatin III, 10-deasetil-13-okso-baccatin III dan 19-hidroksi-13-okso baccatin III. Shen et al. (2003) melaporkan telah mengisolasi senyawa diterpenoid taksan baru yaitu tasumatrol A dan B dari ekstrak daun dan ranting Taxus sumatrana.
Eksplorasi terhadap Taxus sumatrana dapat dilakukan lebih lanjut dengan memanfaatkan mikroba endofit yang bersimbiosis dengan tumbuhan tersebut sebagai sumber senyawa aktif baru. Mikroba endofit, khususnya bakteri dari Taxus sumatrana diharapkan dapat menghasilkan senyawa kimia antifungal yang nantinya bermanfaat bagi manusia dalam bidang kesehatan dan farmasi.
Tujuan
Penelitian ini bertujuan untuk mengidentifikasi senyawa kimia antifungal terhadap Candida albicans yang dihasilkan oleh bakteri endofit dari tanaman Taxus sumatrana.
Manfaat Penelitian
2 TINJAUAN PUSTAKA
Taxus sumatrana
Taxus sumatrana atau dikenal dengan Sumatran yew (Cemara Sumatra) merupakan salah satu jenis Taxus yang tumbuh alami di Indonesia. Tanaman tersebut dapat berbentuk semak sampai pohon dengan tinggi bisa mencapai 30 m (Gambar 1). Daunnya berbentuk elips, berwarna hijau zaitun dengan ukuran panjang 1,8 – 3,0 cm, lebar 2,0 – 2,5 mm dan tebal 200 – 275 µm. Warna kulit batang merah keabu-abuan dengan tebal kulit 0,5 – 0,8 cm. Bunga jantan biasanya tidak terlihat sedangkan bunga betina berbentuk subsilindris dengan panjang 2 mm dan lebar 1 mm. Buah berbentuk kerucut dengan panjang 4 mm dan lebar 2 mm, mengerucut dari tengah ke atas (Spjut 2003).
Taxus sumatrana mempunyai klasifikasi sebagai berikut (CITES 2004): Divisi : Coniferophyta
Kelas : Pinopsidae Bangsa : Taxales Suku : Taxaceae Marga : Taxus
Jenis : Taxus sumatrana (Miquel) de Laubenfels
Gambar 1 Pohon dan daun Taxus sumatrana (Sumber: koleksi pribadi, 2011)
kemoterapi berbagai jenis kanker. Tingginya tingkat eksploitasi untuk memperoleh bahan aktif taksol dari penebangan pohon dan pengulitan batang menyebabkan populasi Taxus menurun. Produksi satu kg paclitaxel membutuhkan 6,7 ton kulit batang pohon Taxus atau setara dengan 2.000-3000 pohon. Pasokan produksi taksol dipengaruhi oleh rusaknya kulit kayu, pertumbuhan Taxus yang lambat dan terbatas di lingkungan tertentu (Jennewein & Croteau 2001).
Sejak tahun 2005 genus Taxus telah dimasukkan ke dalam Appendix II CITES. Hal ini berimplikasi pada pelarangan perdagangan semua bagian pohon dan turunannya, kecuali biji dan produk akhir farmasi siap konsumsi (CITES 2007). Pemenuhan bahan baku dalam pembuatan taksol bertumpu pada pembangunan hutan tanaman dan pemanfaatan bioteknologi dalam sintesis senyawa taksol berupa kultur suspensi sel (Khosroushahi et al. 2006), kultur rambut akar (Furmanova & Sykwoloska-Baranek 2000) dan peningkatan produksi taksol yang dihasilkan oleh mikroba endofit (Strobel & Daisy 2003). Hal ini disebabkan kandungan paclitaxel yang diperoleh dari ekstrak kayu T. brevifolia hanya sebesar 0,01%, sedangkan dari kultur rambut akar Taxus x media var Hicksii diperoleh 0,6% (Furmanova & Sykwoloska-Baranek 2000). Produksi taksol juga dapat ditingkatkan dengan kultur suspensi sel yang ditambah beberapa hormon seperti metal jasmonat dan asam salisilat (Furmanova & Sykwoloska-Baranek 2000).
Mikroba Endofit
Mikroba endofit adalah mikroba yang hidup di dalam jaringan tanaman dan mampu hidup dengan membentuk koloni dalam jaringan tanpa membahayakan tanaman inang (Strobel & Daisy 2003). Mikroba ini juga tidak menyebabkan kerusakan pada tanaman inang (Mitchell et al. 2010). Menurut Hung & Annapurna (2004), mikroba endofit terdapat di jaringan tanaman seperti bunga, buah, batang, daun, akar dan biji serta merupakan pelindung bagi tanaman inang dari stress lingkungan dan kompetisi mikroba.
Mikroba ini hidup bersimbiosis saling menguntungkan dengan tanaman inang, dimana mikroba endofit mendapatkan nutrisi dari hasil metabolisme tanaman, sedangkan mikroba menghasilkan senyawa aktif berupa metabolit sekunder yang akan menjaga inang dari serangan penyakit (Taechowishan et al. 2005).
Mikroba endofit dapat menunjang pertumbuhan tanaman inang dengan cara mensekresi hormon pertumbuhan, melarutkan fosfat, produksi siderofor dan memfiksasi nitrogen (Bandara et al. 2006). Pengaruh lain infeksi endofitik terhadap tanaman inang berupa pengaturan osmotik dan stomata, modifikasi morfologi akar, perubahan akumulasi dan metabolisme nitrogen serta meningkatkan penyerapan mineral. Mikroba endofit juga berpotensi sebagai agen biokontrol terhadap fitopatogen dan serangga (Lacava et al. 2007).
diisolasi dari xilem getah pohon chesnut menunjukkan efek antifungi terhadap Cryphonectria, parasit pada pohon tersebut (Figueiredo et al. 2009).
Mikroba endofit diketahui menghasilkan senyawa aktif yang berpotensi sebagai senyawa antimikroba (Ezra et al. 2004). Salah satu mikroba endofit Streptomyces sp. yang diisolasi dari tanaman obat Lolium perenne menghasilkan antibiotik methylalbonoursin, yang merupakan sebuah diketopiperazine (Castillo et al. 2002). Selanjutnya kapang endofit Muscodor albus dari Cinnamomum zeylanicum diketahui menghasilkan campuran senyawa organik volatil dan mempunyai aktivitas antimikroba dengan spektrum yang luas (Ezra et al. 2004).
Jamur Patogen Candida albicans
Salah satu jamur patogen penyebab penyakit infeksi pada manusia adalah Candida albicans. Candida albicans adalah jamur patogen dari golongan deuteromycota, yang dapat tumbuh pada pH optimum 5,1-6,9 dan pada suhu
optimum 28-37oC. Jamur ini merupakan organisme anaerob fakultatif yang mampu melakukan metabolisme sel, baik dalam suasana anaerob maupun aerob. Beberapa karakteristik dari spesies ini adalah berbentuk bulat atau lonjong dengan ukuran 2-5 µ x 3-6 µ dan dapat memproduksi pseudohifa. Jamur ini merupakan penyebab kandidiasis pada kulit, mukosa dan organ dalam manusia (Moore-Landecker 1996). Selain itu, penampakan mikroba dapat berubah dari berwarna putih dan rata menjadi kerut tidak beraturan dan tidak tembus cahaya. Jamur ini memiliki kemampuan untuk menempel pada sel inang dan melakukan kolonisasi (Naglik et al. 2003).
Candida albicans merupakan jamur dimorfik karena kemampuannya untuk tumbuh dalam bentuk yang berbeda yaitu sebagai sel tunas yang akan berkembang menjadi blastospora dan menghasilkan kecambah yang akan membentuk hifa semu. Hifa semu terbentuk dengan banyak kelompok blastospora berbentuk bulat atau lonjong. Perbedaan bentuk ini tergantung pada faktor eksternal yang mempengaruhinya antara lain ketersedian nutrisi.
Antifungal
Antifungal merupakan senyawa yang dihasilkan oleh mikroorganisme yang dapat menghambat atau mematikan pertumbuhan fungi. Antifungal termasuk dalam antimikroba yang mempunyai sifat toksik selektif yang berarti hanya membunuh mikroba yang menyebabkan penyakit tanpa mengganggu inangnya (Madigan et al. 2006)
Berdasarkan aktivitasnya senyawa antifungal dibedakan menjadi dua jenis, yaitu fungistatik dan fungisida. Fungistatik adalah agen antifungal yang bersifat menghambat pertumbuhan fungi tanpa mematikan, sedangkan fungisida merupakan agen antifungal yang memiliki aktivitas mematikan fungi.
Mekanisme kerja dari senyawa antimikroba diantaranya adalah menghambat sintesis dinding sel, merubah permeabilitas membran sel, menghambat sintesis protein dan asam nukleat serta mengganggu metabolisme sel.
Aktivitas antimikroba dapat ditentukan berdasarkan konsentrasi hambat minimum (MIC), yaitu konsentrasi terkecil dari senyawa antimikroba yang dapat menghambat pertumbuhan mikroba uji (Madigan et al. 2006). Untuk menentukan konsentrasi hambat minimum (MIC) dapat dilakukan dengan 2 cara yaitu a) Metode Difusi dan b) Metode Dilusi.
a. Metode Difusi
Metode ini dilakukan dengan menggunakan cawan petri berisi media padat yang diinokulasi dengan mikroba uji. Beberapa senyawa antimikroba ditambahkan pada paper disk, kemudian diletakkan pada permukaan agar-agar dan diinkubasi selama 18-24 jam. Selama inkubasi, senyawa antimikroba akan berdifusi dari paper disk ke dalam agar-agar. Hasil pengamatan yang akan diperoleh berupa ada atau tidaknya daerah bening yang terbentuk di sekeliling kertas cakram yang menunjukkan daerah hambatan pertumbuhan bakteri. Zona hambat yang terbentuk ditentukan berdasarkan jumlah bahan antimikroba yang ditambahkan pada paper disk, kelarutan senyawa, koefisien difusi dan efektivitas senyawa.
b. Metode Dilusi
Metode ini dilakukan dengan cara mencampurkan senyawa antimikroba dengan berbagai konsentrasi ke dalam tabung berisi media cair yang telah diinokulasi dengan mikroba uji. Konsentrasi senyawa antimikroba dibuat dengan cara pengenceran kelipatan dua dalam tabung berisi media cair. Setelah diinkubasi, tabung diamati untuk melihat pertumbuhan mikroba (kekeruhan) di dalam media. Aktivitas senyawa antimikroba ditentukan sebagai konsentrasi hambatan minimum (MIC). Nilai MIC dipengaruhi oleh jenis organisme uji, konsentrasi senyawa antimikroba, jumlah inokulum, komposisi media kultur, waktu dan kondisi inkubasi seperti suhu, pH dan aerasi.
Ekstraksi
lebih murni. Ekstraksi ini didasarkan pada perbedaan kelarutan suatu zat dalam suatu pelarut. Semakin besar perbedaan kelarutan suatu zat maka akan semakin sempurna proses pemisahannya. Berdasarkan bentuk campuran yang akan diekstraksi, ekstraksi dapat dibedakan menjadi dua yaitu ekstraksi padat-cair dan ekstraksi cair-cair (Supriyanto 2005).
Ekstraksi cair-cair (corong pisah) merupakan pemisahan komponen kimia di antara dua fase pelarut yang tidak saling bercampur di mana sebagian komponen larut pada fase pertama dan sebagian larut pada fase kedua. Ekstraksi cair-cair biasanya dilakukan dengan menggunakan corong pemisah (separatory funnel). Corong pisah yang berisi sampel dan pelarut organik dikocok untuk mencampurkan pelarut dengan sampel sehingga terpisah menjadi dua lapisan yaitu fasa organik dan fasa cair. Ekstraksi cair-cair mempunyai tujuan untuk mendapatkan selektivitas yang tinggi pada tiap komponen. Komponen kimia akan terpisah ke dalam kedua fase tersebut sesuai dengan tingkat kepolarannya dengan perbandingan konsentrasi yang tetap (Sampurno 2000).
Menurut Harbone (1987), untuk mendapatkan ekstrak dengan jumlah dan hasil yang optimum dapat menggunakan beberapa pelarut yang berbeda tingkat kepolarannya. Ekstrasi dapat dilakukan dimulai dengan pelarut nonpolar (misalnya n-heksana atau kloroform), dilanjutkan dengan pelarut semipolar (etil asetat atau dietil eter) kemudian pelarut polar (metanol atau etanol). Pelarut nonpolar dapat memisahkan senyawa lemak, minyak atsiri dan steroid, sedangkan pelarut semipolar memisahkan senyawa seperti kumarin, kuinon dan alkaloid. senyawa yang dapat diperoleh dari ekstraksi pelarut polar berupa glikosida, saponin dan tanin. Senyawa yang diperoleh dari hasil ekstraksi menjadi lebih spesifik karena dilakukan pemisahan dari ekstrak yang lebih kompleks.
Kromatografi
Kromatografi adalah suatu teknik pemisahan senyawa kimia berdasarkan prinsip adsorbsi dan partisi yang ditentukan oleh fasa diam dan fasa gerak (Rohman 2009). Pemisahan senyawa kimia tergantung pada gerakan relatif dari dua fasa tersebut. Senyawa kimia bergerak naik mengikuti fasa gerak karena daya serap adsorben terhadap senyawa-senyawa kimia tidak sama sehingga senyawa kimia dapat bergerak dengan kecepatan yang berbeda berdasarkan tingkat kepolarannya. Teknik kromatografi dapat digolongkan sesuai dengan sifat- sifat dari fasa gerak, yang dapat berupa zat padat atau zat cair. Jika fasa tetap berupa zat padat maka dikenal sebagai kromatografi serapan (absorption chromatography) dan jika berupa zat cair maka disebut dengan kromatografi partisi (partition chromatography). Untuk mendapatkan senyawa murni dari suatu mikroba dapat dilakukan dengan metode kromatografi.
Kromatografi Lapis Tipis (KLT)
untuk mengetahui sistem pelarut dan sistem penyangga yang akan dipakai dalam kromatografi kolom atau kromatografi cair kinerja tinggi. Perkiraan identifikasi diperoleh dengan pengamatan bercak dengan harga Rf yang identik dan ukuran yang hampir sama. Perbandingan visual ukuran bercak dapat digunakan untuk memperkirakan kadar secara semi kuantitatif. Pengukuran kuantitatif dimungkinkan bila digunakan densitometri, fluoresensi atau pemadaman fluoresensi atau bercak dapat dikerok dari lempeng kemudian diekstraksi dengan pelarut yang sesuai dan diukur secara spektrofotometri (Rohman 2009).
Kromatografi ini dapat digunakan untuk mengetahui kemurnian zat, memisahkan dan mengidentifikasi komponen dalam campuran serta menganalisa secara kuantitatif komponen yang terdapat dalam campuran. Campuran yang akan dipisahkan dilarutkan dalam pelarut yang sesuai dan ditotolkan berupa bercak atau pada pelat KLT. Selanjutnya pelat diletakkan di dalam bejana tertutup yang berisi larutan pengembang yang sesuai. Pemisahan terjadi selama perambatan kapiler (pengembangan). Senyawa yang tidak berwarna dapat dideteksi dengan penyemprotan menggunakan pereaksi khusus dan dipanaskan di atas hot plate atau diletakkan di bawah sinar UV pada λ 245 nm atau 365 nm (Gritter et al. 1991).
Fasa diam (lapisan penjerap) yang umum dipakai adalah silika gel, aluminium oksida, kieselgur dan selulosa. Fasa gerak adalah medium angkut yang terdiri atas satu atau beberapa pelarut. Pelarut yang digunakan harus murni dan hanya dapat digunakan maksimum dua atau tiga kali. Komposisi campuran dapat berubah karena penyerapan atau penguapan.
KLT dapat dilakukan dalam bejana atau wadah yang dapat ditutup rapat. Penjenuhan biasanya dilakukan dengan melapisi dinding bejana dengan kertas saring. Cuplikan ditotolkan sebagai bercak bulat atau garis 1,5-2,0 cm dari tepi bawah. Pada umumnya cuplikan ditotolkan sebanyak 1-10 µl dengan menggunakan mikropipet. Pengembangan adalah proses pemisahan campuran cuplikan akibat pelarut pengembang merambat naik ke lapisan. Jarak pengembangan normal yaitu jarak antara garis awal dan garis depan ialah 100 mm.
Deteksi senyawa menunjukkan penyerapan di daerah sinar UV gelombang pendek (radiasi utama pada 254 nm) atau gelombang panjang (365 nm). Jika dengan kedua cara tersebut senyawa tidak dapat dideteksi maka digunakan peraksi semprot. Pereaksi semprot yang dipakai pada KLT dapat digunakan untuk mengidentifikasi senyawa-senyawa aktif pada sampel secara kualitatif. Identifikasi menggunakan pereaksi akan memberi hasil berupa perubahan warna atau terbentuknya endapan. Pereaksi yang biasa digunakan diantaranya, serium (IV) sulfat untuk mendeteksi adanya senyawa organik umum. FeCl3 digunakan untuk mengidentifikasi senyawa fenol, pereaksi semprot Dragendorff untuk senyawa alkaloid, pereaksi KMnO4 0,2% dalam air dapat mendeteksi senyawa terpenoid.
Kromatografi Kolom
Kromatografi kolom merupakan kromatografi cair yang menggunakan kolom untuk memisahkan komponen-komponen campuran dengan afinitas berbeda-beda menjadi fraksi-fraksi yang lebih sederhana. Pemisahan yang terjadi tergantung pada jenis fasa diam yang digunakan, biasanya terbuat dari kaca yang dilengkapi kran jenis tertentu pada bagian bawahnya untuk mengatur aliran pelarut.
Prisip kerja kromatografi kolom adalah campuran yang akan dipisahkan, dimasukkan ke dalam kolom berupa tabung kaca, logam atau plastik. Pelarut (fase gerak) dibiarkan mengalir melalui kolom kemudian senyawa campuran akan bergerak turun melalui kolom dengan dengan kecepatan tertentu sehingga terjadi pemisahan campuran menjadi fraksi-fraksi ketika keluar dari dasar kolom. Hasil tiap fraksi ditampung dan divakum dengan rotavapor kemudian dianalisa secara KLT dan hasilnya diamati secara visual serta disemprot dengan penampang bercak. Selanjutnya fraksi yang sama kemudian digabung.
Ukuran kolom bermacam-macam tetapi pada umumnya panjang sekurang-kurangnya 10 – 100 x garis tengah dalamnya. Ukuran kolom dan banyak penjerap yang dipakai ditentukan oleh bobot campuran yang akan dipisahkan. Penjerap yang bisa digunakan adalah silika gel, alumina, poliamida, selulosa, arang aktif. Namun yang paling berguna dan mudah didapat adalah silika gel dan alumina.
Identifikasi Senyawa Kimia
Identifikasi senyawa aktif suatu metabolit sekunder untuk pendekatan strukturnya diperoleh melalui ciri spektrumnya, termasuk pengukuran spektrum UV, IR, GC-MS (Gas Cromatography-Mass Spectometry) dan NMR (Nuclear Magnetic Resonance) (Johann et al. 2007). Spektrofotometri adalah suatu metode pengukuran serapan radiasi eletromagnetik dan molekul atom dari suatu zat kimia pada panjang gelombang tertentu.
Spektrofotometer IR (Infra Red)
Kromatografi Gas-Spektrometer Massa
Salah satu pendekatan nama dan struktur senyawa aktif dapat dilakukan dengan intepretasi data spektra yang dihasilkan dari analisis GC-MS (Gas Cromatography-Mass Spectometry). Spektrometer massa digunakan untuk mengetahui berat molekul senyawa dan ditunjang dengan adanya fragmentasi ion molekul yang menghasilkan pecahan-pecahan spesifik untuk senyawa berdasarkan bobot molekul. Sebelumnya, komponen senyawa aktif dipisahkan terlebih dahulu dengan kromatografi gas (GC) dengan prinsip yang sama dengan KLT. Perbedaan GC dengan KLT terletak pada penggunaan fase gerak. Pada GC, fase gerak yang digunakan adalah gas. Biasanya gas yang digunakan adalah gas He, H2 atau Ne. Tempat proses pemisahan komponen senyawa GC berupa kolom dari pipa kapiler atau stainless steel yang diisi zat pendukung dan fase diam yang menempel pada zat pendukung. Fase diam biasanya berupa zat cair kental yang sukar menguap seperti mentil penil silikon atau zat padat seperti alumina (Al2O3). Zat pendukung biasanya lapisan silika (Silverstein et al. 1991).
Hasil kromatografi gas berbentuk kerucut yang disebut puncak atau peak yang menunjukkan urutan keluarnya komponen dari kolom tiap satuan waktu (menit). Jumlah puncak menunjukkan jumlah komponen yang terdapat dalam senyawa yang dianalisa. Kuantitas tiap komponen dihitung dari luasan puncak. Untuk mengidentifikasi kemungkinan jenis dan struktur komponen dari senyawa yang dianalisis, dilakukan deteksi dengan spektrometri massa (Hendayana 2006).
Setiap komponen senyawa yang terpisahkan dengan kromatografi gas akan tergambar dalam satu spektra massa, dengan demikian jumlah spektra massa sesuai dengan jumlah puncak yang ada. Hasil berupa berat molekul dan pola fragmentasi dari senyawa yang dianalisis kemudian dibandingkan dengan basis data untuk mengetahui tingkat kemiripan dengan jenis senyawa terdekat (Silverstein et al. 1991).
Identifikasi Mikroba
Mikroba yang berpotensi sebagai penghasil senyawa antifungal perlu dilakukan identifikasi untuk mengetahui jenis dan karakteristik mikroba tersebut (Bardey 2005). Identifikasi bakteri yang diperoleh dari hasil isolasi dapat dilakukan berdasarkan pengamatan morfologi koloni, pengamatan mikroskopis menggunakan berbagai reaksi pewarnaan, pengujian sifat-sifat fisiologi atau biokimia maupun molekuler. Identifikasi mikroba secara molekuler menggunakan metode sekuen komparatif berdasarkan 16S atau 23S rRNA dengan spesifitas untuk taksa familia, genus ataupun galur (Iwen 2005).
Identifikasi Morfologi
kristal disebut bakteri Gram positif, sedangkan bakteri Gram negatif digambarkan dengan pewarna merah muda yang berasal dari safranin.
Perbedaan dalam pewarnaan Gram berhubungan ketebalan dan komposisi dinding sel. Bakteri Gram positif mempunyai dinding sel yang tebal yang terdiri dari beberapa lapisan peptidoglikan, yang menjadi kering oleh alkohol, sehingga menyebabkan pori-pori di dalam sel menutup dan menahan pewarna ungu kristal dan iodin terlepas dari sel serta tidak menyerap warna merah dari safranin (Madigan et al. 2006).
Bakteri Gram negatif mempunyai lapisan peptidoglikan tunggal. Membran luar yang mengelilingi sel Gram negatif tersusun atas fosfolipid, liposakarida, enzim dan protein lain, termasuk lipoprotein (White 1995). Selama proses pewarnaan, alkohol menembus membran luar sel yang kaya akan lipid dan menghilangkan pewarna ungu kristal dan iodin dari sel.
Identifikasi Molekuler
Metode genetika molekuler memberikan dampak terhadap identifikasi dan karakterisasi mikroba. Studi tentang urutan nukleotida gen rRNA menyediakan sarana untuk menganalisis hubungan filogenetik berbagai tingkat taksonomi dan membantu dalam pengembangan uji identifikasi untuk spesies bakteri. Aplikasi teknik molekuler untuk menganalisis keragaman rnikroba, seperti analisis gen 16S rRNA dengan metode polymerase chain reaction (PCR) mampu menampilkan keragaman genetika mikroba (Yusuf et al. 2002). Gen 16S rRNA merupakan gen yang bersifat spesifik pada semua prokariot (Amann et al. 1994). Metode ini menggunakan prinsip adanya daerah genom rRNA yang tetap (conserved) yang dimiliki oleh mikroba prokariot. Sekuen daerah ribosomal RNA dapat mendukung hasil identifikasi dan hubungan kekerabatan antar spesies (Iwen 2005).
Daerah target DNA diamplifikasi dengan teknik Polymerase Chain Reaction (PCR). PCR merupakan suatu reaksi in vitro untuk menggandakan jumlah molekul DNA pada sekuen tertentu dengan cara mensintesis molekul DNA baru yang berkomplemen dengan molekul DNA target dengan bantuan enzim dan primer, menggunakan bantuan peralatan thermocycler (Yang 2004). Sekuen basa nukleotida dari DNA yang telah diamplifikasi oleh PCR dapat diketahui dengan Automated DNA Sequencing (Sprangler 2002).
3 METODE
Bahan
Bahan penelitian yang digunakan adalah sampel daun dan ranting Taxus sumatrana, bakteri endofit, Candida albicans, kertas cakram, media Potato Dextrose Agar (PDA), Potato Dextrose Broth (PDB), Nutrien Agar (NA), Nutrien Broth (NB), nystatin, alkohol 75%, sodium hipoklorit 5,3%,buffer CTAB 10%, buffer 0,1X TE,Tris-Cl 1 M,SDS 10%,EDTA 0,5 M,isoamil alkohol 4%,NaCl 1,5 M, etanol 95%, isopropanol 30%, fenol 100%, lisozim 10 mg/ml, etidium bromida 10 mg/ml, primer F (5’-GACGAACGCTGGCGGCGTGC-3’) dan primer R (5’-TGCACCACCTGTCACTGTGG-3’), agarosa 0,8%, primer, kaca obyek, larutan ungu Kristal 2%, safranin 2,5%, iodium 0,8%, n-heksana, etil asetat, serium sulfat 10%, serbuk silika gel 60 GF254, sea sand B, celite 545, kertas saring.
Alat
Alat yang digunakan dalam penelitian adalah timbangan analitik, gelas ukur, magnetic stirer, tissue steril, pisau steril, cawan petri, erlenmeyer, pinset, bunsen, autoklaf, laminar air flow, mikropipet, mikroskop, botol vial, cawan porselin, hotplate detector KLT sinar UV, pengocok (shaker), plat silica gel GF254, chamber KLT, rotary evaporator, labu ekstraksi, pipa kapiler, alumunium silika gel 60 F254, kolom kromatografi, sentrifuge, mesin PCR, spektrofotometri IR dan GC-MS.
Metode Penelitian
Metode yang digunakan dalam penelitian ini dibagi menjadi beberapa tahap, yaitu: 1) isolasi dan seleksi bakteri endofit; 2) isolasi dan pemurnian senyawa aktif; 3) identifikasi senyawa kimia; dan 4) identifikasi mikroba.
Isolasi dan Seleksi Bakteri Endofit asal Taxus sumatrana Isolasi bakteri endofit asal Taxus sumatrana
dibelah dengan pisau steril dan diletakkan pada cawan petri yang berisi media NA (5 g Meat Extract, 10 g peptone, 5 g NaCl, 15 g agar-agar dan 100 mg nystatin per liter air). Setelah 3 hari sampai 4 minggu diinkubasi pada pada suhu ruang, bakteri yang muncul dimurnikan dan disimpan pada tabung media NA .
Seleksi bakteri endofit asal Taxus sumatrana
Seleksi dilakukan untuk mengetahui kemampuan seluruh isolat bakteri endofit dalam menghambat pertumbuhan jamur patogen. Pengujian aktivitas antifungal dilakukan dengan metode inokulasi titik dan difusi agar. Pengujian aktivitas antifungal menggunakan Candida albicans koleksi Puslit Bioteknologi-LIPI. Isolat C. albicans ditumbuhkan dalam 5 ml media PDB, kemudian digoyang dengan shaker selama 48 jam, suhu 28oC. Suspensi jamur patogen sebanyak 1 ml dimasukkan ke dalam 100 ml media PDA cair, kemudian dituang ke dalam cawan petri.
Metode inokulasi titik dilakukan dengan mengambil satu ose kultur bakteri endofit berumur 24 jam dan diletakkan di media agar-agar yang mengandung jamur patogen. Kultur diinkubasi selama 1 minggu. Adanya interaksi antagonis ditandai dengan terbentuknya zona penghambatan antara isolat bakteri dengan jamur patogen.
Metode difusi dilakukan dengan menumbuhkan bakteri endofit dalam media Nutrient Broth (NB) dan digoyang dengan kecepatan 150 rpm selama 24 jam. Kultur disentrifugasi dengan kecepatan 10.000 rpm selama 10 menit (Gayathri et al. 2010). Supernatan diambil sebanyak10 µl diteteskan pada paper disk kemudian diletakkan pada media padat yang berisi jamur patogen. Aktivitas antifungal ditandai dengan adanya zona penghambatan terhadap pertumbuhan jamur patogen di sekitar isolat bakteri dan paper disc.
Isolasi dan Pemurnian Senyawa Aktif Antifungal
Ekstraksi
Isolat berpotensi antifungal ditumbuhkan pada 200 ml media NB dalam Erlenmeyer 500 ml dan digoyang dengan shaker pada kecepatan 150 rpm dan suhu 28oC selama 24 jam. Proses fermentasi dilakukan beberapa kali sampai jumlah total media fermentasi sebanyak 15 L. Kultur bakteri disentrifugasi pada kecepatan 10.000 rpm selama 10 menit. Supernatan diekstraksi dengan pelarut non polar n-heksana dan semi polar etil asetat (1 : 1, v/v) (Udin 2009), kemudian dikocok kuat selama 10 menit dan didiamkan sampai terpisah. Lapisan atas diambil dan dimasukkan ke dalam botol untuk selanjutnya dievaporasi dan diuapkan. Ekstrak diuji antagonistik terhadap C. albicans.
Kromatografi Lapis Tipis (KLT)
Ekstrak yang telah diperoleh, dilarutkan dengan n-heksana kemudian ditotolkan pada lempeng silika gel GF254 berukuran 10 x 2 cm. Lempeng KLT
dipanaskan di atas hotplate. Adanya bercak pada lempeng KLT dapat memberikan informasi tentang banyaknya senyawa dalam ekstrak yang dapat dipisahkan dengan kromatografi kolom.
Kromatografi Kolom
Kromatografi kolom dilakukan terhadap fraksi n-heksana dengan menggunakan fase diam silika gel 60 ukuran 70-120 mesh. Fase gerak yang digunakan adalah n-heksana: etil asetat. Gelas kolom yang bersih diletakkan tegak lurus pada statip, kemudian dibilas dengan fase gerak (eluen) yang akan digunakan lalu dikeringkan. Dasar kolom diberi kapas dan diisi dengan sea sand
B, kemudian ditambahkan silika gel 60 mesh sebanyak 10-30 kali dari berat sampel yang telah disuspensikan ke dalam cairan eluasi. Campuran dimasukkan sedikit demi sedikit ke dalam gelas kolom berdiameter 4 cm, panjang 50 cm. Eluen dibiarkan mengalir rata pada permukaan absorben. Kolom digetarkan perlahan-lahan agar fase diamnya memadat dan rata.
Sebanyak 500 mg ekstrak n-heksana dicampur dengan celite 545 dan dihaluskan dalam cawan porselen hingga diperoleh campuran yang homogen. Campuran tersebut dimasukkan ke dalam kolom, kemudian dilanjutkan dengan cairan eluasi dituang sedikit demi sedikit. Cairan eluasi yang digunakan adalah pelarut n-heksana:etil asetat secara gradien dengan variasi nilai pembanding (Tabel 1). Eluat yang diperoleh dari tiap fraksi ditampung dalam botol dengan volume 20 ml kemudian diuapkan. Pada proses fraksinasi ini diperoleh 125 fraksi. Fraksi-fraksi tersebut kemudian diidentifikasi dengan KLT untuk melihat pola pemisahannya. Fraksi yang mempunyai pola kromatogram yang sama dilakukan penyederhanaan fraksi dengan KLT. Fraksi gabungan yang diperoleh, diuji antagonistik dengan C. albicans.
Tabel 1 Variasi eluen dalam fraksinasi ekstrak n-heksana
Fraksi Eluen Volume (ml)
Fraksi aktif dilarutkan dengan etil asetat kemudian ditotolkan pada lempeng silika gel GF254 membentuk pita. Fase gerak yang digunakan adalah n-heksana:
Identifikasi Senyawa Kimia
Spektrofotometer Infra Red (IR)
Fraksi yang memiliki aktivitas antifungal dianalisis dengan spektrofotometer infra merah untuk mengetahui bilangan gelombang dari struktur gugus fungsional (OH, C = O, aromatik dll). Sinar infra merah yang berperan sebagai sumber cahaya dibagi menjadi dua berkas, satu dilewatkan melalui sampel dan yang lain melalui pembanding. Selanjutnya cahaya dipecah menjadi frekuensi-frekuensi dalam monokromator. Intensitas relatif dari setiap frekuensi diukur oleh detektor dan diubah menjadi sinyal listrik yang kemudian direkam oleh rekorder.
Kromatografi Gas-Spektrometer Massa (GC-MS)
Fraksi yang memiliki aktivitas antifungal dianalisis dengan kromatografi gas-spektrometer massa (GC-MS) untuk melihat senyawa yang terkandung di dalamnya. Kromatografi gas spektrum massa merupakan perpaduan antara kromatografi gas dan spektroskopi massa. Analisis GC-MS dilakukan dengan melarutkan ekstrak sampel dengan etil asetat p.a kemudian diinjeksikan ke alat GC-MS. Pengujian menggunakan GC-MS dilakukan dengan mengubah sampel senyawa menjadi uap karena adanya suhu yang tinggi. Proses GC-MS menggunakan kolom kapiler tipe Agilent Technologies 6890 dengan panjang 30 m dan diameter 0,25 mm (Lampiran 1).
Identifikasi Mikroba Identifikasi morfologi
Identifikasi morfologi mikroba dilakukan dengan pewarnaan Gram (Somasegaran & Hoben 1985). Pewarnaan Gram dilakukan sebagai berikut: satu ose suspensi diletakkan pada kaca obyek dan diratakan. Kaca obyek dikeringanginkan di atas nyala api. Sampel yang telah kering ditambah dengan larutan ungu kristal dan didiamkan selama 1 menit. Setelah itu, dicuci dengan air mengalir dan dikeringanginkan. Setelah kering, sampel ditetesi dengan larutan iodium dan didiamkan selama 1 menit. Selanjutnya sampel dicuci dengan air mengalir dan dikeringanginkan. Sampel ditetesi dengan alkohol 95% selama 30 detik kemudian dicuci dan dikeringanginkan. Sampel ditetesi dengan safranin 2,5% dan didiamkan selama 2 menit. Setelah dicuci dengan air mengalir dan dikeringanginkan, sampel diamati di bawah mikroskop.
Identifikasi Molekuler
ditambah dengan 50 µl SDS 10% kemudian diinkubasi lagi pada suhu 65oC selama 1 jam (larutan dibolak-balik secara perlahan setiap 15 menit). Sebanyak 167 µl NaCl 5 M ditambahkan ke dalam tabung dan diinkubasi kembali pada suhu 65oC selama 1 jam (larutan dibolak-balik secara perlahan setiap 15 menit). Kloroform dingin sebanyak 400 µl ditambahkan pada larutan dan diinkubasi pada suhu kamar selama 30 menit (larutan dibolak-balik setiap 10 menit). Larutan disentrifugasi dengan kecepatan 13.000 rpm selama 10 menit. Supernatan dipindahkan ke dalam tabung baru lalu ditambah isopropanol sebanyak 1 x volume supernatan. Larutan dibolak-balik secara perlahan, kemudian diinkubasi selama 1 malam pada suhu -20oC. Larutan disentrifugasi dengan kecepatan 13.000 rpm selama 5 menit. Supernatan dibuang dan pelet dicuci dengan 10 µl etanol 70% dingin. Etanol dibuang dan pelet dikeringanginkan. Setelah pelet kering, pelet diresuspensi dengan 20 – 50 µl TE 0,12%. DNA hasil isolasi dielektroforesis.
Elektroforesis DNA dilakukan dengan menggunakan gel agarosa yang tersusun atas: 0,8 g agarosa dan 100 ml larutan TAE 2,4% 1x (Tris asetat 0,04 M dan EDTA 0,001 M). Hasil ekstraksi DNA sebanyak 5 µl dihomogenkan dengan 0,5 µl 6x larutan pemberat DNA (25% Ficoll, 0,25% bromophenol blue dan 0,25% xylene cyanol), kemudian dimasukkan ke dalam tiap sumur gel. Elektroforesis dijalankan pada tegangan sebesar 110 V selama ± 20 menit dengan larutan penyangga TAE 0,5x. Hasil elektroforesis dilihat di bawah UV (Spangler 2002).
Amplifikasi DNA dilakukan dengan metode PCR. Komposisi bahan untuk amplifikasi adalah 5,5 µl ddH2O dimasukkan ke dalam tabung PCR, ditambah 7,5 PCR Mix (Microzone Ltd, United Kingdom), 0,5 µl primer F
(5’-GACGAACGCTGGCGGCGTGC-3’), 0,5 µl primer R
4 HASIL DAN PEMBAHASAN
Isolasi dan Seleksi Bakteri Endofit Asal Taxus sumatrana Isolasi Bakteri Endofit Asal Taxus sumatrana
Hasil isolasi bakteri endofit dari bagian daun dan ranting Taxus sumatrana diperoleh 16 isolat (Tabel. 2). Isolat-isolat tersebut disimpan dalam media Nutrien Agar (NA) miring untuk digunakan dalam pengujian selanjutnya.
Tabel 2 Hasil isolasi bakteri endofit dari daun dan ranting Taxus sumatrana
Bagian yang diisolasi Jumlah Bakteri Kode Isolat
Daun 9 Tx 1, Tx 2, Tx 5, Tx 9, Tx 12,
Tx 13, Tx 14, Tx 15, Tx 16
Ranting 7 Tx 3, Tx 4, Tx 6, Tx 7, Tx 8,
Tx 10, Tx 11
Jumlah bakteri endofit yang diisolasi dari ranting T. sumatrana lebih sedikit dibandingkan dari daun. Hal ini menunjukkan daun merupakan preferential niche bagi bakteri endofit T. sumatrana. Jumlah isolat yang diperoleh dari bakteri endofit T. sumatrana lebih sedikit dibandingkan bakteri endofit dari T. chinensis yaitu 25 isolat (Zhao et al. 2010).
Lacava et al. (2004) melaporkan hasil isolasi bakteri endofit dari ranting jeruk manis dan jeruk keprok, jumlahnya lebih sedikit daripada daun. Yang et al. (2011) mendapatkan hasil yang berbeda dimana jumlah bakteri endofit dari batang tomat lebih banyak dibandingkan daun. Adanya variasi jumlah bakteri endofit yang diperoleh, berhubungan dengan jenis tanaman, umur tanaman, jenis jaringan yang terinfeksi, waktu pengambilan sampel dan lingkungan. Biasanya populasi bakteri lebih banyak di perakaran dan sedikit di daun dan ranting (Zinniel et al. 2002).
Bakteri endofit dapat diisolasi dari jaringan tanaman yang terinfeksi atau diekstrak dari jaringan tanaman bagian dalam. Bakteri endofit dapat diisolasi dari beberapa jenis jaringan pada sejumlah tanaman. Endofit memasuki jaringan tanaman terutama melalui perakaran, namun demikian, bagian tanaman seperti bunga, ranting dan kotiledon dapat juga digunakan sebagai jalan masuk. Bakteri memasuki jaringan melalui kecambah, akar sekunder, stomata atau daun-daun yang rusak. Endofit di dalam tanaman akan terletak pada satu tempat atau tersebar ke seluruh tanaman. Mikroba ini dapat tinggal di dalam sel, bagian intersel atau sistem vaskuler (Zinniel et al. 2002).
Seleksi Bakteri Endofit Asal Taxus sumatrana
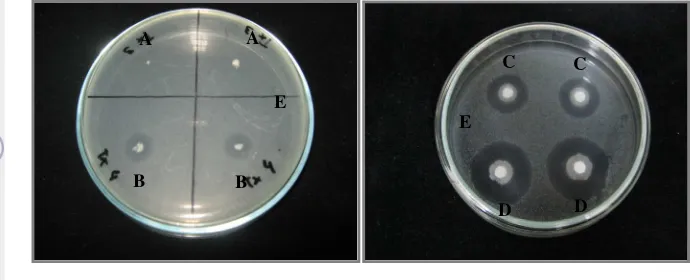
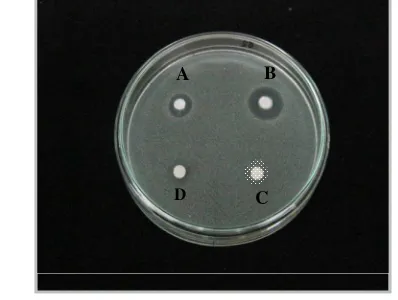
Gambar 2 Hasil uji antagonistik isolat Tx 4 dengan metode inokulasi titik dan difusi agar. A. Isolat Tx 3 (diameter hambat 0 mm); B. Isolat Tx 4 (diameter hambat 9 mm); C. Supernatan Tx 4 (diameter hambat 14 mm); D. Kultur Tx 4 (diameter hambat 16 mm); E. Suspensi C. albicans dalam agar
Menurut Tomita (2003), sekitar 10% - 30% endofit menunjukkan aktivitas antifungal atau antibakteri di dalam supernatan. Adanya daya hambat dari supernatan isolat Tx 4 mengindikasikan bahwa senyawa bioaktif Tx 4 bersifat ekstraseluler.
Adanya zona penghambatan pada aktivitas antifungal menunjukkan aktivitas biologis yang positif. Isolat bakteri endofit yang tidak mempunyai aktivitas antifungal, kemungkinan mempunyai senyawa aktif dalam jumlah kecil atau aktif melawan mikroba lain yang tidak diujikan (Radu and Kqueen 2002). Oleh karena itu, perlu dilakukan pengujian lebih lanjut pada isolat yang tidak mempunyai aktivitas antifungal, karena kemungkinan beberapa isolat tersebut dapat menghambat infeksi mikroba dengan merangsang sistem kekebalan tubuh inang, bukan oleh aktivitas antimikroba.
Isolasi dan Pemurnian Senyawa Aktif Antifungal Ekstraksi
Ekstrak isolat Tx 4 diperoleh dari ekstraksi hasil fermentasi selama 24 jam. Proses ekstraksi dilakukan secara bertahap dimana tahap pertama menggunakan pelarut semi polar (etil asetat) dan tahap kedua menggunakan pelarut non polar (n -heksana). Hal ini bertujuan agar ekstrak dapat terpisah berdasarkan polaritasnya. Ekstrak selanjutnya diuji daya antagonisnya dengan C. albicans (Gambar 3).
Ekstrak n-heksana mempunyai aktivitas penghambatan lebih besar daripada ekstrak etil asetat, sehingga sebagian besar senyawa antifungal yang terkandung dalam ekstrak tersebut bersifat non polar. Pelarut non polar seperti n-heksana mampu mengisolasi senyawa antikapang dan antikhamir yang bersifat non polar dalam jumlah lebih banyak dengan aktivitas antikapang dan antikhamir lebih besar daripada pelarut lain (Masoko and Eloff 2005). Ekstrak etil asetat tidak
A A
B B
E
C
D
C
mempunyai aktivitas penghambatan dimungkinkan karena senyawa antifungal yang terlarut dalam etil asetat sangat kecil.
Gambar 3 Aktivitas penghambatan isolat Tx 4 terhadap C. albicans. A. ekstrak n -heksana (diameter hambat 9 mm); B. kontrol positif (Nystatin 100 µg/ml) (diameter hambat12 mm); C. kontrol negatif (diameter hambat 0); D. ekstrak etil asetat (diameter hambat 0)
Ekstrak n-heksana mempunyai aktivitas penghambatan lebih kecil daripada kontrol positif (Nystatin). Rajput and Rajput (2011) melaporkan hasil yang sama dimana diameter hambat ekstrak n-heksana dari daun Corchorus fasciluraris lebih kecil (8,15 mm) dibandingkan Nystatin (9,53 mm). Hasil ekstrak n-heksana kemudian difraksinasi dengan kromatografi kolom yang dimonitor dengan KLT.
Nystatin sebagai kontrol positif merupakan antibiotik golongan poliene yang mempunyai spektrum luas serta aktif menghambat jamur secara in vitro dan in vivo termasuk Aspergillus fumigatus dan Candida albicans (Johnson et al. 1998). Antibiotik lain dari golongan azole dan alilamin juga digunakan untuk antifungal (Ghannoum and Rice 1998).
Pemurnian Senyawa Aktif Antifungal
Ekstrak n-heksana yang mempunyai aktivitas antifungal dianalisis dengan KLT menggunakan fase gerak n-heksana:etil asetat (2:1). Analisis KLT ini bertujuan untuk mengetahui pola bercak ekstrak n-heksana yang dapat terpisah sepanjang jarak pengembangan. Keberhasilan KLT ditentukan oleh pemilihan fase diam dan fase gerak. Fase diam yang biasa digunakan dalam KLT adalah silika gel, sedangkan fase gerak dipilih berdasarkan kepolaran dari ekstrak yang akan di KLT (Cannel 1998). Penggunaan fase gerak n-heksana:etil asetat (5:1 atau 10:1) tidak dilakukan karena kemungkinan bercak akan terlalu naik sedangkan perbandingan (1:1), bercak akan cenderung di bawah sehingga bercak tidak terpisah yang akan menyulitkan dalam proses fraksinasi.
Hasil KLT diamati di bawah UV λ 254 nm dan λ 366 nm, kemudian disemprot dengan pereaksi serium sulfat 1% (Gambar 4). Berdasarkan profil kromatogram, ekstrak n-heksana menunjukkan adanya bercak. Selanjutnya pola tersebut akan digunakan untuk kromatografi kolom.
A B
Gambar 4 Hasil KLT ekstrak n-heksana dengan fase gerak n-heksana:etil asetat (2:1). Bercak hasil KLT. Pereaksi semprot: serium sulfat 1%
Ekstrak n-heksana difraksinasi dengan kromatografi kolom menggunakan fase diam silika gel 60 mesh (0,063 – 0,200 mm) dan fase gerak n-heksana:etil asetat secara gradien dimulai dari 10:1, 8:1, 6:1, 4:1, 2:1, 1:1. Hal ini dimaksudkan untuk memisahkan senyawa dari yang non polar terlebih dahulu keluar dari kromatografi kolom yang kemudian secara bertahap terpisah senyawa yang polar. Hasil fraksinasi dengan kromatografi kolom diperoleh 125 fraksi, kemudian dilakukan penyederhanaan fraksi dengan KLT. KLT menggunakan fase gerak n-heksana:etil asetat (10:1) dengan tujuan mempertahankan fase gerak senyawa-senyawa dengan nilai Rf yang tinggi agar tidak turun sehingga dihasilkan pemisahan senyawa yang baik. Fraksi yang mempunyai nilai Rf sama digabungkan, sehingga diperoleh 7 fraksi (Tabel 3).
Tabel 3 Penggabungan fraksi n-heksana hasil kromatografi kolom
Fraksi gabungan Asal fraksi
I 1 – 12
II 13 – 18
III IV V VI VII
19 – 24 25 – 29 30 – 52 53 – 75 76 – 125
I II III IV V VI VII
III VI
VII III
V
Ketujuh fraksi gabungan tersebut kemudian di KLT dengan fase diam silika gel 60 F254 dan fase gerak n-heksana:etil asetat (10:1) untuk melihat pola bercak (Gambar 5). Pemilihan fase gerak tersebut berdasarkan fase gerak pada saat kromatografi kolom yang diawali dengan pelarut yang lebih polar.
Gambar 5 Hasil KLT fraksi gabungan dari isolat Tx 4. Bercak hasil KLT. I (fraksi asal 1-12), II (13-18), III (19-24), IV (25-29), V (30-52), VI (53-75), VII (76-125). Fase gerak n-heksana:etil asetat = 10:1 (v/v). Pereaksi semprot: serium sulfat 1%
Hasil KLT fraksi gabungan tersebut menunjukkan adanya bercak yang beragam. Selanjutnya ketujuh fraksi gabungan yang diperoleh, diuji aktivitas antagonistik terhadap C. Albicans untuk mendapatkan fraksi aktif (Gambar 6).
Gambar 6 Hasil uji antagonis fraksi-fraksi gabungan dari ekstrak isolat Tx 4. Tanda zona hambat. I (fraksi asal 1-12), II (13-18), III (19-24), IV (25-29), V (30-52), VI (53-75), VII (76-125).
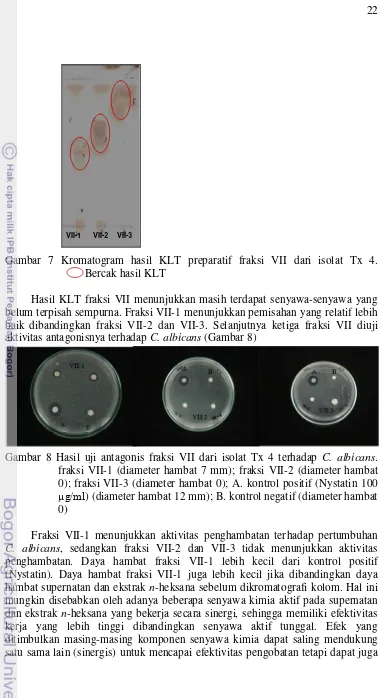
Hasil uji antagonistik terhadap fraksi-fraksi gabungan menunjukkan bahwa fraksi VII memiliki daya hambat terhadap C. albicans. Selanjutnya dilakukan KLT preparatif pada fraksi VII untuk melihat pola bercak pada fraksi tersebut (Gambar 7).
I
II III
IV V
VI
VII
Gambar 7 Kromatogram hasil KLT preparatif fraksi VII dari isolat Tx 4. Bercak hasil KLT
Hasil KLT fraksi VII menunjukkan masih terdapat senyawa-senyawa yang belum terpisah sempurna. Fraksi VII-1 menunjukkan pemisahan yang relatif lebih baik dibandingkan fraksi VII-2 dan VII-3. Selanjutnya ketiga fraksi VII diuji aktivitas antagonisnya terhadap C. albicans (Gambar 8)
Gambar 8 Hasil uji antagonis fraksi VII dari isolat Tx 4 terhadap C. albicans. fraksi VII-1 (diameter hambat 7 mm); fraksi VII-2 (diameter hambat 0); fraksi VII-3 (diameter hambat 0); A. kontrol positif (Nystatin 100 µg/ml) (diameter hambat 12 mm); B. kontrol negatif (diameter hambat 0)
Fraksi VII-1 menunjukkan aktivitas penghambatan terhadap pertumbuhan C. albicans, sedangkan fraksi VII-2 dan VII-3 tidak menunjukkan aktivitas penghambatan. Daya hambat fraksi VII-1 lebih kecil dari kontrol positif (Nystatin). Daya hambat fraksi VII-1 juga lebih kecil jika dibandingkan daya hambat supernatan dan ekstrak n-heksana sebelum dikromatografi kolom. Hal ini mungkin disebabkan oleh adanya beberapa senyawa kimia aktif pada supernatan dan ekstrak n-heksana yang bekerja secara sinergi, sehingga memiliki efektivitas kerja yang lebih tinggi dibandingkan senyawa aktif tunggal. Efek yang ditimbulkan masing-masing komponen senyawa kimia dapat saling mendukung satu sama lain (sinergis) untuk mencapai efektivitas pengobatan tetapi dapat juga
berlawanan (kontradiksi) (Ulfah 2006). Selanjutnya fraksi tersebut dianalisis kandungan senyawa kimianya dengan spektrofotometer IR dan GC-MS.
Identifikasi Senyawa Kimia Antifungal
Identifikasi senyawa dengan spektrofotometri infra merah
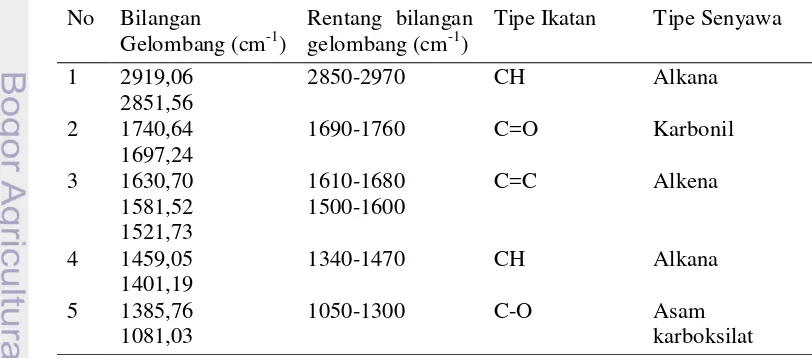
Hasil pengukuran spektrofotometri infra merah terhadap untuk fraksi VII-1 menunjukkan adanya, gugus karbonil (-C=O) pada bilangan gelombang 1740,64 cm-1 dan gugus aromatik pada bilangan gelombang 2919,06 cm-1 serta gugus alkena pada bilangan gelombang 1521,73 cm-1 dan gugus karboksil pada bilangan gelombang 1081,03 cm-1 (Gambar 9). Hasil interpretasi spektrum infra merah senyawa fraksi VII-1 (Tabel 4).
Gambar 9 Hasil spektra IR dari fraksi VII-1. Bilangan gelombang dari fraksi VII-1. % T = Persen transmiten
Tabel 4 Hasil interpretasi spektrum infra merah senyawa fraksi VII-1 (Skoog et al. 2007)
No Bilangan
Gelombang (cm-1)
Rentang bilangan gelombang (cm-1)
Tipe Ikatan Tipe Senyawa
1 2919,06 2850-2970 CH Alkana
2851,56
2 1740,64 1690-1760 C=O Karbonil
1697,24
3 1630,70 1610-1680
1500-1600
C=C Alkena
1581,52 1521,73
4 1459,05 1340-1470 CH Alkana
1401,19
5 1385,76 1050-1300 C-O Asam
karboksilat 1081,03
Standar Fraksi VII-1
Identifikasi senyawa dengan GC-MS
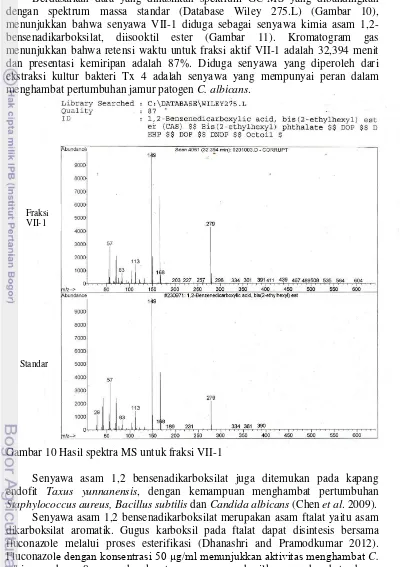
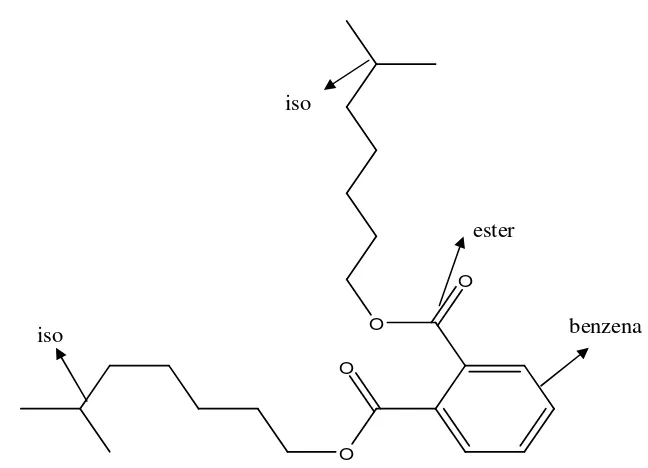
Berdasarkan data yang dihasilkan spektrum GC-MS yang dibandingkan dengan spektrum massa standar (Database Wiley 275.L) (Gambar 10), menunjukkan bahwa senyawa VII-1 diduga sebagai senyawa kimia asam 1,2-bensenadikarboksilat, diisooktil ester (Gambar 11). Kromatogram gas menunjukkan bahwa retensi waktu untuk fraksi aktif VII-1 adalah 32,394 menit dan presentasi kemiripan adalah 87%. Diduga senyawa yang diperoleh dari ekstraksi kultur bakteri Tx 4 adalah senyawa yang mempunyai peran dalam menghambat pertumbuhan jamur patogen C. albicans.
Gambar 10 Hasil spektra MS untuk fraksi VII-1
Senyawa asam 1,2 bensenadikarboksilat juga ditemukan pada kapang endofit Taxus yunnanensis, dengan kemampuan menghambat pertumbuhan Staphylococcus aureus, Bacillus subtilis dan Candida albicans (Chen et al. 2009).
O
O
O
O
1,2-benzenedicarboxylic acid-diisooctyl ester
Gambar 11 Struktur kimia asam 1,2 bensenadikarboksilat diisooktil ester dari isolat Tx 4
Fluconazole merupakan antibiotik golongan azole yang digunakan untuk pengobatan infeksi jamur. Obat golongan azole bersifat fungistatik, mempunyai spektrum luas dan bekerja dengan cara menghambat sintesis ergosterol jamur sehingga mengakibatkan kerusakan pada membran sel jamur (Madigan et al, 2006). Obat anti jamur golongan azole mempunyai kemampuan mengganggu kerja enzim sitokrom P-450 lanosterol14-demetilase yang berfungsi sebagai katalisator untuk mengubah lanosterol menjadi ergosterol (Ghanoum and Rice 1999).
Menurut El-Mehawalawy et al. (2008), senyawa asam 1,2-benzenadikarboksilat merupakan senyawa antifungal yang berhasil dipurifikasi dari bakteri Corynebacterium nitriphilus, Tsukamurella inchonensis dan Cellulosimicrobium cellulans. Senyawa tersebut dapat menjadi pilihan untuk pengobatan jamur patogen karena mempunyai kemampuan menghambat proses pertumbuhan, sintesis protein DNA, RNA dan lipid pada jamur patogen.
Identifikasi Mikroba Identifikasi Morfologi
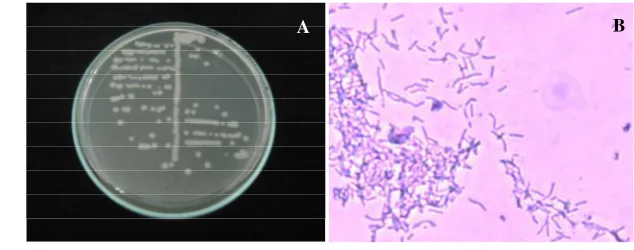
Hasil identifikasi morfologi dengan metode pewarnaan Gram diketahui bahwa isolat Tx 4 berbentuk batang dan berwarna ungu (Gambar 12). Warna ungu menunjukkan bahwa sel bakteri tersebut mampu menahan pewarna ungu kristal setelah diwarnai dengan etanol 95%. Sel yang mampu menahan pewarna ungu kristal disebut bakteri Gram positif.
benzena ester
iso
Gambar 12 Morfologi koloni (A) dan hasil pewarnaan Gram (B) isolat Tx 4
Warna ungu pada bakteri Gram positif berhubungan dengan ketebalan dan komposisi dinding sel yang berpengaruh pada respon yang berbeda terhadap reaksi pewarnaan gram (White 1995). Bakteri Gram positif mempunyai dinding sel yang tebal yang terdiri dari beberapa lapisan peptidoglikan, yang menjadi kering oleh alkohol, sehingga menyebabkan pori-pori di dalam sel menutup dan mencegah kompleks ungu kristal iodin terlepas dari sel (Madigan et al. 2006).
Identifikasi Molekuler
Isolat Tx 4 yang telah diuji kemampuannya sebagai penghasil senyawa antifungal, selanjutnya dianalisis menggunakan pendekatan molekuler berdasarkan sekuen gen 16S rRNA. Hasil amplifikasi gen 16s rRNA dengan teknik PCR diperoleh fragmen RNA berukuran sekitar 1000 bp (berdasarkan ukuran pita pada marker. (Gambar 13)
Untuk memastikan persen kemiripan genotipik isolat Tx 4 dengan mikroba lain maka dilakukan sekuensing gen 16S rRNA dari isolat tersebut. Hasil sekuensing isolat Tx 4 menunjukkan bahwa basa nukleotida yang terbaca adalah 1036 pasangan basa (Lampiran 3).
Gambar 13 Hasil PCR gen 16S rRNA isolat Tx 4. M: Marker Ukuran (bp)
Tx 4 M
250
1000
750 1000 1500 2000 8000 10000
500 5000