ASRI PUDJIRAHAJU
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi Biologi Reproduksi Muncak (Muntiacus muntjak muntjak, Zimmermann 1780) Betina Di Penangkaran adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Juli 2014
RINGKASAN
ASRI PUDJIRAHAJU. Biologi Reproduksi Muncak (Muntiacus muntjak muntjak, Zimmermann 1780) Betina di Penangkaran. Dibimbing oleh IMAN SUPRIATNA, SRIHADI AGUNGPRIYONO, dan MUHAMMAD AGIL
Muntjak (Muntiacus muntjak muntjak, Zimmermann 1780) merupakan salah satu dari empat spesies rusa endemik Indonesia dengan suara spesifiknya tersebut tersebar di sebagian besar kepulauan Indonesia, yaitu pulau Jawa, Bali, Sumatera dan Kalimantan. Muntjak termasuk hewan yang dilindungi oleh peraturan pemerintah Republik Indonesia Nomor 7 Tahun 1999.
Populasi muntjak di habitat alaminya diperkirakan mengalami penurunan, sehingga memerlukan suatu upaya untuk menunjang perkembangbiakan muntjak. Sedangkan informasi tentang anatomi dan morfometri organ reproduksi muntjak betina, pemantauan status reproduksi muntjak, terutama berdasarkan metabolit estrogen dan progesteron dari feses, masih sangat terbatas. Oleh karena itu tujuan penelitian ini antara lain: 1) mengetahui anatomi dan morfometri organ reproduksi muntjak betina; 2) melakukan validasi assay terhadap metabolit estrogen dan progesteron di feses muntjak betina; 3) mengetahui profil metabolit estrogen dan progesterone pada setiap tahapan reproduksi (pubertas, siklus estrus dan kebuntingan); dan 4) mengetahui perilaku reproduksi.Secara umum penelitian ini merupakan penelitian eksploratif, dimana semua data yang diperoleh diklasifikasikan sesuai tujuan masing-masing. Semua data dianalisis secara deskriptif.
Hasil penelitian menunjukkan bahwa uterus muncak termasuk bikornua. Kedua ovarium berbentuk oval dan tidak ada bursa ovarium. Kedua bagian organ reproduksi, yaitu uterus dan ovarium sama-sama aktif. Namun dalam morfologi dan morfometri menunjukkan bahwa organ sebelah kanan lebih aktif daripada kiri. Mukosa serviks membentuk lipatan, ke lipatan kranial semakin semakin kecil. Dalam muntjak ada 4 lipatan. Lipatan yang tampaknya membentuk saluran, sehingga memungkinkan inseminasi buatan. Vagina memiliki dinding tipis dari penyusun serviks uteri. Bagian dalam vagina yang secara langsung berhubungan dengan ruang depan vulva. Vulva terdiri dari labia majora dan labia minora yang jelas dibedakan. Pengamatan eksternal, klitoris tidak terlihat.
Analisis metabolit estrogen dan progesteron di feses muntjak dengan menggunakan enzyme immunoassay. Hasil uji paralelism terhadap metabolit estrogen dan progesteron pada muntjak betina menunjukkan hasil kurva sampel feses yang paralel dengan kurva standar, yaitu metabolit estrogen adalah Estrogen total dan progesteron adalah 20-oxo-pregnanes (20-oxo-P) dan Pregnanediol (Pg-diol). Tipe metabolit hormon bersifat spesifik spesies.
26,74±10,38 µg/g. Rerata konsentrasi Pg-diol maksimum meningkat ~8 kali lipat (3,25-26,74 µg/g) dari awal kebuntingan sampai kelahiran. Sedangkan rata-rata konsentrasi Pg-diol dan estrogen total saat kelahiran masing masing adalah 20,37±8,72 µg/g dan 185,0±100,0 ng/g. Lama kebuntingan dari muntjak adalah sekitar 234,7±5,8 hari (kisaran 228-238 hari).
Secara umum perilaku reproduksi pada muntjak betina sama seperti pada famili cervidae lainnya. Perilaku estrus pada betina dan perilaku seksual pada jantan dan betina mulai terlihat ketika hewan memasuki masa pubertas. Pada saat estrus muntjak tidak menunjukkan tanda-tanda yang jelas (silent heat). Perilaku seksual pada muntjak saat kawin : (1) Bercumbu dengan menciumi bagian kepala dan leher; (2) Mencium dan menjilati alat kelamin betina; (3) Betina menegakkan ekornya dan jantan menjilati alat kelamin betina; (4) Jantan menaiki betina dan diikuti dengan intromisi; (5) Jantan menjilati alat kelaminnya; (6) Kembali ke perilaku normal. Sedangkan perilaku-perilaku reproduksi lainnya seperti saat bunting, melahirkan dan merawat anak tidak berbeda jauh dengan hewan lainnya. Hasil penelitian ini diharapkan sebagai data dasar untuk menunjang dalam manajemen perkembangbiakan muntjak dan aplikasi teknologi reproduksi di penangkaran. Saran, perlu dilakukan penelitian-penelitian lanjutan untuk melengkapi data biologi reproduksi muncak.
SUMMARY
ASRI PUDJIRAHAJU. Reproductive Biology of Female Muntjak (Muntiacus muntjak muntjak, Zimmermann 1780) in Captive. Under supervisor of IMAN SUPRIATNA, SRIHADI AGUNGPRIYONO, and MUHAMMAD AGIL.
Muntjak (Muntiacus muntjak muntjak, Zimmermann 1780) or barking deer is one of four species of endemic deer in Indonesia, which is has a specific sound and distributed across the most of the Indonesian archipelago, Java, Bali, Sumatra and Borneo islands. Muntjak is listed as a protected animals by objective of this study include: 1) a study on the anatomy of female reproductive organs; 2) validating the hormone assay of the estrogen and progesterone metabolites in feces of muntjak ; 3) characterization of the pattern of estrogen and progesterone metabolites in each reproductive stage (puberty, estrous cycle and pregnancy); and 4) determining of the female reproductive behavior. In general, this study was an exploratory study, which all the data obtained were classified according to their respective goals. All data were analyzed descriptively.
The result of the study showed that muntjak has a bicornuate uterus. Both ovaries were oval-shaped and no ovarian bursa. The second part of the uterus and left and right of ovaries coruna organs were equally active. However, right side of both organs were tended to be more active compared than the left side organs. The cervical mucous is forming folds toward the cranial folds which is getting smaller. In muntjak there are 4 folds. The folds that seems forming a channel, allowing the artificial insemination. The vagina has a thinner wall than the compilers of the cervix uteri. The inside of the vagina is directly associated with vulvar vestibule. The vulva consists of the labia majora and labia minora were clearly distinguishable. Observations externally, the clitoris was not visible.
Estrogen and progesterone metabolites in feces of muntjak were analyzed by using an enzyme immunoassay. The results of the parallelism test showed that curve of estrogen metabolite in fecal of muntjak was parallel to the standard curve of hormone assay of Estrogen total (E2 total), whereas the curve of progesterone metabolites were parallel to the standard curve of hormone assay of 20-oxo-pregnanes (20-oxo-P) and pregnanediol (Pg-diol). Both of the hormone metabolites are species specific.
The results showed that the average of E2 total and Pg-diol during puberty from the age of 4-6 months were 85.7±52.7 ng/g and 1.6±0.7 µg/g reppectively.
concentration during pregnancy was 3.25±1.91 µg/g, whereas the average
maximum of Pg-diol concentration during pregnancy was 26.74±10.38 µg/g. The
average maximum of Pg-diol concentration was increased ~8-fold (3.25 to 26.74
µg/g) from the beginning of pregnancy till birth. The average of Pg-diol
concentration at the birth was 20.37±8.72 µg/g, whereas the average concentration
of E2 total was 185.0±100.0 ng/g (126,1-300,5 ng/g). The lenght of the gestation period was approximately 234.7±5.8 days (range 228-238 days).
In general, the reproductive behavior of female muntjak showed a similiar behavior with the other Cervidae family. Behavioral estrous in females and sexual behavior of males and females were begun appear when the animal enters the puberty. During estrous period, muntjak showed no obvious signs (silent heat). Sexual behavior during mating include : (1) courtship by the kissing the head and the neck; (2) kissing and licking the female genitalia; (3) the females enforce its tail and the male is licking of female genitalia; (4) males mounting the female followed with the intromission; (5) males is licking her genitals; (6) return to the normal behavior. In addition, behaviors during pregnancy, delivery, and maternal care were not much different from other animals.
The results of this study were expected to be used as a data base for supporting the management and application of technology proliferation of muntjaks reproduction in captivity. Suggestions, it is still required a further study to complete the data of muntjaks reproductive biology.
© HakCipta Milik IPB, Tahun 2014 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
ASRI PUDJIRAHAJU
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Biologi Reproduksi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup: Dr Ir Burhanuddin Masy’ud, MS Prof Dr Drh Mohamad Agus Setiadi
NRP : B362090021
Disetujui
Komisi Pembimbing
Prof Dr Drh Iman Supriatna Ketua
Prof Drh Srihadi Agungpriyono, PhDPAVet(K) Dr Drh Muhammad Agil, MScAgr
Anggota Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana
Biologi Reproduksi
Prof Dr Drh M ohamad Agus Setiadi Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Disertasi yang berjudul Biologi Reproduksi Muncak (Muntiacus muntjak muntjak, Zimmermann 1780) Betina di Penangkaran, diajukan untuk memperoleh gelar doktor pada Sekolah Pascasarjana Institut Pertanian Bogor.
Artikel ilmiah yang telah dikirimkan dan siap untuk dipublikasikan pada jurnal Nasional (Jurnal Veteriner) berjudul,” Deteksi Umur Pubertas Muncak (Muntiacus muntjak muntjak) Betina Berdasarkan Analisis Metabolit Estrogen dan Progesteron di Feses.” Sedangkan artikel ilmiah untuk Jurnal Internasional (Journal Biotropia) berjudul,”Profiles of Fecal Estrogen and Progesterone Metabolites during Pregnancy in Captive Muntjak (Muntiacus muntjak muntjak) through Non-Invasive Hormone Analysis using Enzyme Immmunoassay.”
Terima kasih dan penghargaan yang sangat tulus penulis sampaikan kepada Bapak Prof Dr Drh Iman Supriatna, Bapak Prof Drh Srihadi Agungpriyono, PhDPAVet(K) dan Bapak Dr Drh Muhammad Agil, MScAgr, selaku Ketua dan Anggota Komisi Pembimbing atas bimbingan, arahan, dan saran yang diberikan selama penulis melakukan penelitian untuk menempuh pendidikan doktor pada Program Studi Biologi Reproduksi, Sekolah Pascasarjana Institut Pertanian Bogor ( SPs IPB).
Ucapan terima kasih juga penulis sampaikan kepada:
1. Rektor Universitas Palangka Raya (UNPAR) dan Dekan Fakultas Pertanian UNPAR, Palangka Raya Propinsi Kalimantan Tengah, atas izin yang diberikan kepada penulis untuk melanjutkan studi doktor di PS BRP, SPs IPB. 2. Rektor Institut Pertanian Bogor dan Dekan Sekolah Pascasarjana (SPs IPB)
yang telah menerima penulis sebagai mahasiswa di SPs IPB angkatan 2009. 3. Direktorat Jenderal Pendidikan Tinggi (DIKTI), Kementerian Pendidikan
Nasional atas pemberian dana BPPS, beasiswa Sandwich-like tahun2012 dan Hibah Penelitian Disertasi Doktor tahun 2014.
4. Pemerintah Provinsi Kalimantan Tengah melalui Dinas Pendidikan Propinsi atas bantuan beasiswa yang diberikan untuk penyelesaian studi.
5. Kepala Balai Konservasi Sumber Daya Alam (BKSDA) Provinsi Jawa Tengah dan BKSDA Jawa Barat yang telah memberikan Surat Angkut Tumbuhan dan Satwa liar Dalam Negeri (SATS-DN) atas proses perizinan penggunaan muncak pada penelitian ini.
6. Direktorat Jenderal Perlindungan Hutan dan Konservasi Alam (PHKA) yang telah memberikan Surat Angkut Tumbuhan dan Satwa liar Luar Negeri (SATS-LN) untuk membawa sampel penelitian yang akan dianalisis di Laboratorium Biokimia University of Veterinary Medicine, Vienna Austria. 7. Pusat Penelitian Biologi LIPI atas rekomendasi yang diberikan terkait
penggunaan satwa muncak sebagai materi penelitian dan untuk membawa sampel penelitian yang dianalisis di Vienna Austria.
8. Dr Ir Burhanuddin Masy’ud, MS dan Bapak Prof Dr Drh Mohamad Agus Setiadi, selaku penguji luar komisi pada ujian tertutup.
11. Dr Drh Amrozi selaku Kepala Unit Rehabilitasi Reproduksi (URR) FKH IPB beserta staf atas izin penggunaan fasilitas kandang dan laboratorium serta bantuan teknis selama penelitian berlangsung.
12. Dr Drh Nurhidayat, PAVet, selaku Kepala Laboratorium Anatomi beserta staf: Prof Dr Drh Koeswinarning Sigit, MS, Dr Drh Heru Setijanto, PAVet, Dr Drh
Chairun Nisa’, MSiPAVet, Dr Drh Savitri Novelina, MSiPAVet, dan Drh
Supratikno, MSiPAVet, yang telah memberikan fasilitas untuk penelitian dan bimbingan selama penulis meneliti di Laboratorium Anatomi FKH IPB.
13. Prof Dr Franz Schwarzenberger, DVM, Miss Elke Leidner dan Miss Nadja Kneidinger (salah satu mahasiswi doktor di bawah bimbingan Prof Dr Franz Schwarzenberger) atas bimbingan dan bantuan pada kegiatan analisis hormon muncak betina dalam Program Sandwich-like 2012.
14. Ir Heri Sujoko, MSi (suami), Ayahanda H. Hanipan Ashari (alm) dan Ibunda Hj. Soelistyowati (alm), serta adinda Budi Purnomo, ST (alm) dan Wahyudi Setyawan, SSos, keluarga besar H. Sastrowiredjo (alm) dan Hj. Saudah (alm), atas segala dukungan dan doa yang selalu dipanjatkan.
15. Dr Drh Sri Wahyuni, MSi, Drh I Ketut Mudite Adnyane, MSiPhDPAVet, Gholib, SPtMSi, Drh Dedi Setiadi, MSi, Drh Danang Dwi Cahyo, Drh Yusrizal, Mahfud, SPd, dan Sri Murtini, SPd, atas segala bantuan yang diberikan selama penelitian.
16. Rumah Sakit Hewan IPB atas bantuan teknis saat proses pengambilan sampel penelitian dan perawatan satwa.
17. Seluruh teman-teman PS. BRP atas persahabatan yang baik, dukungan dan bantuan selama menjalankan studi di BRP, serta seluruh pihak yang tidak dapat disebutkan satu per satu, atas segala bantuan yang diberikan.
Semoga karya ilmiah ini dapat bermanfaat.
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
1 PENDAHULUAN
Latar Belakang 1
Tujuan Penelitian 19
Manfaat Penelitian 19
Ruang Lingkup Penelitian 20
Daftar Pustaka 21
2 ANATOMI DAN MORFOMETRI ORGAN REPRODUKSI MUNCAK (Muntiacus muntjak muntjak, Zimmermann 1780) BETINA
Pendahuluan 28
Bahan dan Metode 34
Hasil 36
Pembahasan 45
Simpulan 47
Daftar Pustaka 49
3 DETEKSI PUBERTAS MUNCAK (Muntiacus muntjak muntjak, Zimmermann 1780) BETINA BERDASARKAN UMUR DAN ANALISIS METABOLIT ESTROGEN DAN PROGESTERON
Pendahuluan 52
Bahan dan Metode 54
Hasil 56
Pembahasan 61
Simpulan 62
Daftar Pustaka 63
4 MONITORING NON-INVASIF SIKLUS ESTRUS MELALUI ANALISIS METABOLIT ESTROGEN DAN PROGESTERON DI FESES DAN SITOLOGI VAGINA MUNCAK
(Muntiacus muntjak muntjak, Zimmermann 1780) BETINA DI PENANGKARAN
Pendahuluan 66
Bahan dan Metode 67
Hasil 70
Pembahasan 73
Simpulan 74
ANALISIS HORMON NON-INVASIF DI FESES MENGGUNAKAN ENZYME IMMUNOASSAY
Pendahuluan 80
Bahan dan Metode 80
Hasil 83
Pembahasan 83
Simpulan 86
Daftar Pustaka 87
6 PERILAKU REPRODUKSI MUNCAK
(Muntiacus muntjak muntjak) BETINA DI PENANGKARAN
Pendahuluan 90
Bahan dan Metode 91
Hasil 92
Pembahasan 98
Simpulan 100
Daftar Pustaka 100
7 PEMBAHASAN UMUM 104
8 SIMPULAN DAN SARAN 107
LAMPIRAN 108
DAFTAR RIWAYAT HIDUP 112
DAFTAR TABEL
1 Perbandingan ukuran ovarium pada satwa liar ordo artiodactyla 36 2 Perbandingan ukuran panjang setiap bagian saluran reproduksi
muncak dan dibandingkan satwa lain 38
3 Data kelahiran, koleksi sampel feses dan umur muncak yang
digunakan dalam penelitian 54
4 Rataan konsentrasi Pg-diol selama masa kebuntingan pada muncak 84
5 Tahapan perilaku muncak selama proses perkawinan 94
6 Rekapitulasi kelahiran muncak selama penelitian 96
DAFTAR GAMBAR
1 Muncak (Muntiacus muntjak muntjak) Betina 3
2 Peta penyebaran muncak di seluruh dunia dan Indonesia 5 3 Gambaran skematis organ reproduksi ruminansia betina 7 4 Gambaran histologis sayatan melintang ovarium mamalia
memperlihatkan beberapa struktur ovarium 8
5 Perkembangan folikel dalam ovarium 9
6 Perkembangan mulai dari folikel tersier sampai menjadi korpus albikan 10
7 Jalur dalam metabolisme progesteron 13
8 Jalur dalam metabolisme estrogen 14
9 Struktur metabolit utama progesteron 15
10 Struktur metabolit utama estrogen 16
11 Mekanisme hormon axis hypothalamus-pituitary-ovary 18
12 Bagan alir kerangka pemikiran penelitian 20
13 Morfologi organ reproduksi dan bagian-bagian yang dianalisis untuk
Pembuatan preparat secara histologi 35
14 Anatomi organ reproduksi muncak betina 37
15 Gambaran Makroskopis ovarium muncak 37
16 Morfologi serviks muncak (Muntiacus muntjak muntjak
Zimmerman 1780) 39
17 Morfologi kelenjar preorbital pada muncak(Muntiacus muntjak muntjak
Zimmerman 1780) 40
18 Gambaran mikroskopis ampula muncak 40
19 Gambaran mikroskopis ithsmus muncak 41
20 Gambaran mikroskopis korpus uteri muncak 41
21 Gambaran mikroskopis serviks muncak 42
22 Gambaran mikroskopis vagina muncak 42
31 Hasil uji parallelism metabolit estrogen dan progesteron dari feses
Muncak betina 58
32 Profil metabolit estrogen dan progesterone feses pada individu ML-1 59 33 Profil metabolit estrogen dan progesterone feses pada individu MN-2 60 34 Profil metabolit estrogen dan progesterone feses pada individu MW-3 60 35 Profil metabolit estrogen dan pola sebaran tipe sel epitel vagina muncak
Betina selama tiga siklus estrus 71
36 Morfologi sel-sel epitel vagina dalam siklus estrus pada muncak 73 37 Profil Pg-diol dan estrogen total selama periode kebuntingan 84 38 Rataan konsentrasi Pg-diol dari tiga periode kebuntingan pada spesies
Muncak 84
39 Perilaku muncak selama proses perkawinan 94
40 Perilaku muncak saat bunting 95
41 Profil anak muncak jantan dan betina yang dilahirkan selama
Penelitian 97
42 Perilaku perawatan induk terhadap anaknya 98
DAFTAR LAMPIRAN
1 Proses Dehidrasi Jaringan 108
2 Prosedur Pewarnaan Giemsa 109
3 Prosedur Pewarnaan Hematoksilin dan Eosin (HE) 110
I.
PENDAHULUAN
Latar Belakang
Muncak (Muntiacus muntjak muntjak, Zimmermann 1780) adalah satwa ruminansia yang dikelompokkan dalam ordo Artiodactyla, famili Cervidae dan genus Muntiacus. Semiadi (2006), menyatakan bahwa muncak sebagai salah satu dari empat spesies rusa yang ada di Indonesia, yaitu rusa Sambar (Cervus unicolor), rusa Timor (Cervus timorensis), rusa Bawean (Axis kuhli). Satwa ini adalah satwa endemik yang tersebar di Pulau Jawa, Sumatera, Kalimantan dan Bali.
Muncak atau kijang yang juga disebut barking deer karena suaranya yang spesifik. Sejak tanggal 27 Januari 1999, berstatus sebagai satwa yang dilindungi, seperti yang tercantum pada Daftar Lampiran Peraturan Pemerintah Republik Indonesia Nomor 7 Tahun 1999 (PHKA 2004). Sedangkan menurut International Union for Concervation of Nature and Natural Resources (IUCN), bahwa spesies muncak masih memiliki status Least Concern atau beresiko rendah, kecuali muncak hitam (Muntiacus crinifrons), berstatus vulnerable yang berasal dari China (Wemmer 1998).
Meskipun muncak masih berstatus beresiko rendah, namun populasi di habitat aslinya diduga semakin menurun, sama seperti spesies satwa liar lainnya. Zubaidi (2004) menyatakan bahwa penyebab utama penurunan populasi tersebut adalah hilangnya habitat satwa liar akibat peningkatan aktivitas manusia di hutan. Data populasi muncak di habitat alaminya belum dapat diketahui secara pasti. Semiadi (2001) melaporkan bahwa reproduktifitas rusa rendah, yaitu jumLah anak yang dilahirkan dari jumLah induk potensial tersedia, hanya mencapai 48,80%±16,24% (SD) dengan kematian anak pra sapih sebesar 11,90%. Secara reproduksi, kendala reproduktifitas tersebut disebabkan karena pola perkembangbiakan rusa yang bersifat non seasonal polyoestrus yaitu tidak mempunyai musim perkawinan dan dapat menunjukkan estrus kembali dan berulang kapan saja kalau tidak bunting sepanjang tahun (Dradjat 2000).
Biologi reproduksi satwa liar bersifat spesifik spesies, dengan variasi yang sangat komplek meliputi anatomi dan morfologi organ reproduksi, tipe dan profil metabolit hormon reproduksi, pubertas, siklus estrus, dan lama kebuntingan. Data biologi reproduksi tersebut sangat penting untuk program pemeliharaan, perkembangbiakan maupun penerapan teknologi reproduksi seperti inseminasi buatan, embrio transfer, fertilisasi in vitro, bank plasma nutfah, mikro manipulasi gamet, semen sexing dan transfer inti sel somatik pada satwa liar (Andrabi dan Maxwell 2007).
Klasifikasi dan Morfologi Muncak
2
Muntiacus crinifrons, kijang hitam, Muntiacus feae , Muntiacus atherodes, kijang keemasan Kalimantan, Muntiacus rooseveltorum, Muntiacus gongshanensis, Muntiacus vuquangensis, kijang raksasa Vietnam, Muntiacus truongsonensi, Muntiacus putaoensis. Namun saat ini hanya tersisa 5 jenis, yaitu M. reevesi, M. rooseveltorum, M. feae, M. crinifrons dan M. muntjak (Ma et al. 1991).
Muncak yang berasal dari Jawa merupakan sub spesies M. m. muntjak, memiliki gambaran morfologi yang hampir sama dengan muncak Indian (M. muntjak, Zimmermann 1780), sehingga dapat diklasifikasikan sebagai berikut :
Kingdom : Animalia padat dan pendek, terutama yang tinggal di daerah dingin. Perubahan warna bulu dari coklat tua sampai coklat kekuningan dan keabu-abuan tergantung pada musim. Bulu muncak coklat keemasan di sisi punggung dan putih di sisi ventral tubuh, anggota badan berwarna coklat gelap sampai coklat kemerahan, dan wajah adalah coklat gelap (Worlddeer 2005).
Muncak tidak mengenal musim kawin dan dapat kawin kapan saja, namun perilaku musim kawin muncul, apabila muncak dibawa ke daerah beriklim sedang. Pola perkembangbiakannya dapat menunjukkan aktivitas estrus sepanjang tahun atau bersifat non seasonal polyoestrus, yaitu tidak mempunyai musim perkawinan dan dapat menunjukkan estrus kembali dan berulang kapan saja apabila tidak bunting sepanjang tahun. Hal yang sama juga terjadi pada rusa (Dradjat 2000). Asher (2011), juga menyatakan hal yang sama bahwa pada betina cervidae (beberapa spesies tropis) adalah polyoestrous dan hewan yang tidak bunting mampu menunjukkan siklus estrus yang terus berulang atau periode siklus estrus dan anestrus. Satwa liar ini sekarang menarik perhatian para peneliti evolusi molekular karena memiliki variasi jumLah kromosom yang sangat dramatis dan ditemukannya beberapa jenis baru (terutama di Indocina) (Wikipedia 2010). JumLah kromosom muncak Indian adalah 2n=6 (betina), 2n=7 (jantan), sedangkan pada muncak yang berasal dari China (muncak reeves) adalah 2n=46 (Liming et al. 1980). Morfologi muncak betina dapat dilihat seperti pada Gambar 1 di bawah ini.
Gambar 1 Morfologi Muncak (Muntiacus muntjak muntjak, Zimmermann 1780) Betina
Secara umum muncak merupakan satwa liar yang bersifat soliter, dapat beraktivitas pada siang dan malam hari (diurnality dan nocturnality). Disamping itu juga sebagai satwa liar yang sangat waspada. Ketika dimasukkan ke dalam situasi stres atau jika merasakan adanya pemangsa muncak akan mulai mengeluarkan suara yang spesifik. Gonggongan mulanya dianggap sebagai sarana komunikasi antara muncak selama musim kawin serta sebagai tanda peringatan. Mekanisme menggonggong lebih sering digunakan ketika visibilitas berkurang dan dapat berlangsung selama lebih dari satu jam dalam satu insiden (Wikipedia 2010). Menurut Oli dan Jacobson (1995) telah mendeteksi adanya 13 jenis teriakan yang dikeluarkan oleh rusa ini, sehingga disebut dengan barking deer, karena intensitas teriakannya yang tinggi. Lama alarm bark mencapai 0,62 detik dan distress call sekitar 1,01 detik.
4
satu media untuk saling mengenal dan terikat. Melalui pengamatan pada rusa di daerah dingin, yaitu rusa pere david’s (Elaphurus davidianus) (Beck dan Wemmer 1983) telah mendokumentasikan 14 kelompok dengan 83 jenis perilaku yang berkaitan dengan berkomunikasi.
Selain hal di atas untuk menunjang kelangsungan hidupnya, maka muncak memerlukan kondisi lingkungan (habitat) yang cocok. Habitat bagi muncak sangat penting karena berperan sebagai tempat untuk berlindung, berkembang biak, penyedia pakan dan air serta pergerakannya. Alikodra (2010) menyatakan bahwa habitat merupakan suatu kesatuan kawasan fisik maupun biotik yang dapat memenuhi semua kebutuhan dasar dan mendukung kehidupan dari suatu populasi tertentu.
Muncak menyukai habitat hutan tropika yang memiliki aneka vegetasi, padang rumput, sabana, hutan meranggas. Selain itu, muncak juga dapat mendiami hutan sekunder, daerah di tepi hutan, dan tepi perkebunan. Satwa ini mampu hidup di daerah dengan ketinggian mencapai 3.000 meter dpl. Meskipun secara ukuran badan antara muncak dan rusa sambar sangat berbeda, namun kedua satwa tersebut ternyata memiliki persamaan kehidupan sosial dan ekologi. Hal tersebut dapat terlihat dari tipe habitat, keterjalan medan (slope), keberadaan tegakan, serasah dan lebar kanopi yang dipergunakan yang sama, hanya pada intensitas penggunaan yang sedikit berbeda (Ilyas et al. 1998).
Habitat di penangkaran berbeda dengan habitat alami. Berdasarkan ciri habitatnya, pada habitat penangkaran terdapat peningkatan nutrisi, bertambahnya persaingan intraspesifik untuk memperoleh makanan, berkurangnya pemangsaan oleh predator alami, berkurangnya penyakit dan parasit serta meningkatnya kontak dengan manusia (Grier dan Burk 1992). Selain itu penangkaran juga dapat meningkatkan produktivitas dan reproduksi suatu satwa karena selama di penangkaran akan memudahkan dalam pengukuran-pengukuran terhadap nilai satuan produksi dan reproduksi satwa yang didomestikasi.
Penelitian yang berkaitan dengan kehidupan cervidae khususnya C. elaphus telah berkembang di negara negara maju (Sheely dan Vavra 1996; Clarke et al. 1995; Homolka 1993; Langvatn dan Hanley 1993; Bergstorm dan Donell 1995). Sedangkan penelitian tentang rusa dalam penangkaran khususnya untuk jenis C. timorensis Lyd dan C. unicolor sebagai spesies tropis khususnya yang ada di Indonesia masih sangat terbatas. Pada spesies C. timorensis Lyd telah dilakukan penelitian mengenai pola aktivitas harian selama 24 jam dan pola aktivitas makan oleh Lelono (1996; 2001). Sedangkan pada C. unicolor kajiannya berkisar pada pola aktivitas makan, merumput dan pemilihan makan (Semiadi et al.1993, 1994; House et al.1995; Barry et al. 1995).
Status Konservasi dan Penyebaran Muncak
Daftar Appendix CITES (Convention on International Trade in Endangered Species of Fauna and Flora) (IUCN 2010). Pada Gambar 2 berikut ini merupakan peta penyebaran muncak yang ada di negara Asia dan Indonesia (IUCN 2010 dan Wikipedia 2010).
Gambar 2 Peta penyebaran muncak di seluruh dunia dan Indonesia (IUCN 2010 dan Wikipedia 2010).
Karakteristik Reproduksi Muncak
Data tentang biologi reproduksi, khususnya untuk muncak betina masih sangat terbatas. Dengan keterbatasan tersebut, maka belum diperoleh informasi yang jelas terhadap pola reproduksi atau perkembangbiakan muncak di penangkaran. Menurut Sadleir (1987), ovulasi pertama kali (M. m muntjak) terdeteksi pada umur di bawah 12 tahun. Sedangkan siklus estrus, lama estrus dan lama kebuntingan muncak masing-masing adalah 14-21 hari, 48 jam dan 222-238 hari (Sadleir 1987). Sedangkan pada muncak reeves konsepsi pertama kali dapat terjadi pada umur 5-6 bulan, meskipun umumnya terjadi pada umur 7 bulan (Semiadi 2006). Selain itu muncak betina hingga umur 14 tahun masih mampu melahirkan anak, meskipun terlahir mati (Chapman et al. 1997). Pada muncak reeves menunjukkan perilaku post partum estrous, suatu hal yang tidak dijumpai pada kelompok rusa berbadan besar (Chapman et al. 1997).
6
Kemampuan bereproduksi merupakan salah satu indikator keberhasilan dari kelangsungan kehidupan hewan. Salah satu masalah dalam perkembangbiakan muncak adalah tidak memperlihatkan gejala estrus yang jelas (silent heat), sehingga agak kesulitan dalam menentukan waktu saat estrus. Pengetahuan siklus estrus muncak betina terutama lama periode estrus dan waktu ovulasi merupakan informasi yang sangat penting dalam menentukan tingkat keberhasilan dalam perkawinannya.
Pengaturan siklus estrus dipengaruhi oleh hormon estrogen dan progesteron melalui aktivitas ovarium. Hormon estrogen disekresikan oleh sel-sel granulosa dari folikel ovarium karena pengaruh Follicle Stimulating Hormone (FSH). Pada saat hormon progesteron rendah, maka peningkatan konsentrasi hormon estrogen akan menyebabkan umpan balik positif dengan meningkatnya sekresi Luteinizing Hormone (LH) dari hipofisa anterior ke dalam peredaran darah dan menyebabkan ovulasi folikel. Setelah ovulasi, maka akan terbentuk corpus luteum (CL) yang mensekresikan hormon progesteron. Pada akhir fase luteal, jika tidak terjadi kebuntingan, CL akan mengalami regresi atas pengaruh prostaglandin F2α (PGF2α). Dengan menurunnya hormon progesteron, maka terjadi umpan balik negatif terhadap hipotalamus dan hipofisa sehingga terjadilah pembentukan folikel baru untuk memasuki siklus estrus yang baru (Senger 2005).
Penentuan aktivitas reproduksi dapat diketahui melalui analisis profil dan dinamika hormon reproduksi secara non-invasif terhadap metabolit hormon yang terdapat di dalam urin dan feses. Penggunaan teknik non-invasif pada satwa liar seperti muncak menjadi pilihan utama, karena tidak menimbulkan stres pada satwa tersebut. Teknik tersebut telah terbukti bermanfaat untuk memantau fungsi gonad (status androgenik, siklus ovarium, kebuntingan, musiman) dalam berbagai spesies cervidae (white tailed deer: Kapke et al. 1999; moose: Monfort et al. 1993; water deer: Stoops et al. 1999; pudu: Blanvillain et al. 1997; Sika deer: Hamasaki et al. 2001; Pe`re David deer: Li et al. 2001; Pampas deer: Pereira et al. 2005); Hydropotes inermis: Mauget et al. 2007).
Organ Reproduksi Betina
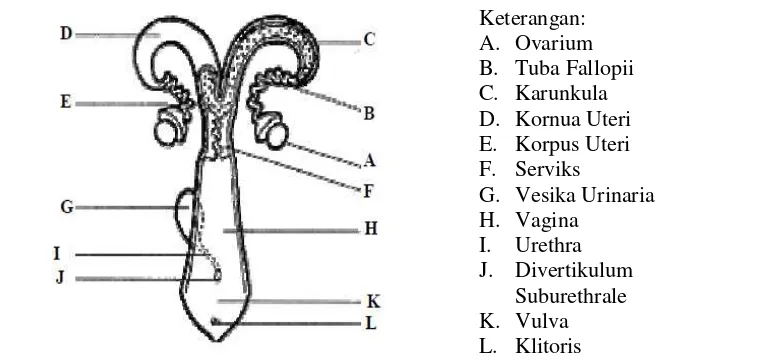
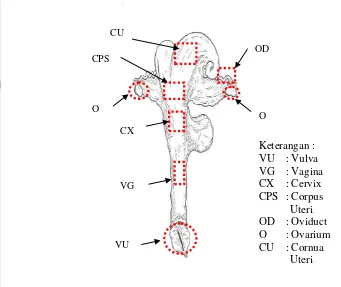
Anatomi organ reproduksi muncak betina terdiri atas : 1) organ reproduksi primer (gonad), yaitu ovarium, 2) organ kelamin sekunder, yaitu saluran kelamin betina yang terdiri atas tuba fallopii (oviduct), uterus, serviks, vagina dan vulva, dan 3) alat kelamin pelengkap yakni kelenjar air susu (glandula mammae) (Hafez
dan Hafez 2000). Gambaran umum organ reproduksi betina pada ruminansia
Gambar 3 Gambaran skematis organ reproduksi ruminansia betina. (Hafez dan Hafez 2000).
Ovarium merupakan organ reproduksi primer yang memiliki ukuran yang bervariasi tergantung kepada spesies, umur dan status reproduksinya. Ovarium memiliki dua fungsi utama yaitu sebagai kelenjar eksokrin dan endokrin, masing-masing karena kemampuannya menghasilkan oosit dan hormon-hormon estrogen serta progesteron (Hafez dan Hafez 2000).
Saluran reproduksi betina terdiri dari vulva, vagina, serviks, uterus dan tuba fallopii. Selain juga pada betina juga dilengkapi dengan kelenjar mamae merupakan organ pelengkap yang berfungsi menyediakan air susu bagi anak yang baru lahir.
Ovarium terletak retroperitoneal di dalam rongga pelvis, menggantung dan bertaut melalui mesovarium ke uterus. Bentuk ovarium juga sangat bervariasi sesuai dengan spesies dan jumLah anak yang mampu dilahirkan. Pada kelompok hewan yang melahirkan anak lebih dari satu (multipara), ovarium biasanya berbentuk seperti buah beri sedangkan pada kelompok hewan melahirkan tunggal (unipara), bentuk ovarium mendekati bulat telur (ovoid). Ukuran ovarium juga bervariasi antar spesies. Pada sapi, ovarium berukuran antara 0,8-5 cm, sedangkan pada domba dan kambing, ovarium berukuran kurang lebih 1,2 cm (Sukra et al. 1989).
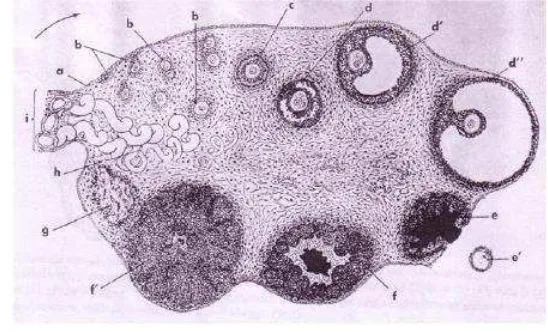
Struktur histologi ovarium tergantung pada spesies, umur dan fase siklus estrus dari hewan tersebut. Gambaran histologis sayatan melintang ovarium mamalia disajikan pada Gambar 4. Ovarium terdiri dari dua bagian yaitu korteks (bagian lateral) dan medula (bagian medial). Pada bagian korteks banyak ditemukan folikel-folikel pada berbagai tahap perkembangan dan juga korpus luteum, sedangkan pada bagian medula terdapat pembuluh darah dan syaraf yang masuk (ke bagian medula ovarium) melalui hillus yaitu pertautan antara ovarium dan mesovarium (Toelihere 1979). Bagian korteks dilapisi oleh satu lapisan epitelium kuboid rendah. Stroma pada bagian korteks terdiri atas jaringan ikat longgar. Tunika albuginea terdiri atas jaringan ikat yang terdapat pada bagian profundal lapisan epitel germinativum.
Tuba fallopii merupakan saluran kecil perluasan dari uterus yang berperan dalam transpor gamet jantan dan betina, serta sebagai tempat terjadinya proses
8
fertilisasi, kapasitasi sperma dan terjadinya proses pembelahan zigot. Uterus memegang peranan penting dalam sistem reproduksi sebagai tempat implantasi dan perkembangan embrio dan fetus, sedangkan kontraksi uterus penting untuk transpor spermatozoa. Bentuk uterus pada beberapa spesies hewan berbeda-beda. Pada ruminansia, uterus memiliki dua tanduk uterus yang besar, badan uterus dan serviks yang disebut uterus bikornua (Sukra et al. 1989). Uterus terdiri atas tiga lapisan yaitu endometrium, miometrium dan perimetrium. Mukosa endometrium akan mengalami penebalan pada saat estrus.
Gambar 4 Gambaran histologis sayatan melintang ovarium mamalia memperlihatkan beberapa struktur ovarium. (a) Epitel germinativum, (b) folikel primer, (c) folikel sekunder, (d’) folikel
tertier, (d”) folikel de Graff, (e) korpus hemarogikum, (f’) korpus luteum, (g) korpus albikan, (h) pembuluh darah, (i) mesovarium. (Sumber: Dellmann dan Brown: Textbook of Veterinary Histology, 1976).
Serviks terdiri atas bagian mukosa dan lapisan otot. Mukosa serviks menghasilkan lendir yang pada saat estrus menjadi lebih cair sedangkan pada saat hewan bunting membentuk sumbatan. Vagina berfungsi sebagai tempat penumpahan semen, jalur keluar fetus dan plasenta pada kelahiran. Vulva terdiri dari labia dan vestibula. Sedangkan klitoris merupakan bagian dari vestibula yang homolog dengan penis pada hewan jantan (Banks 1993).
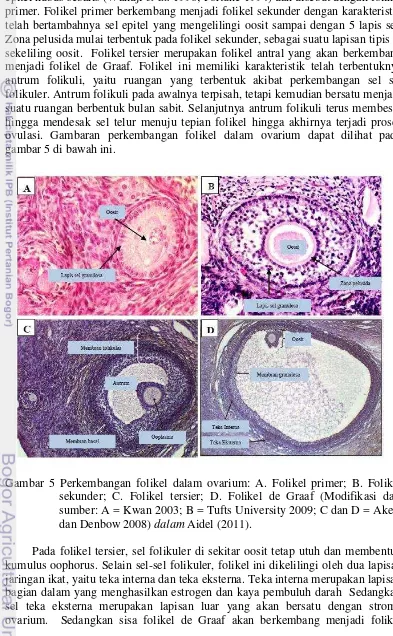
Folikel yang mengandung oosit mengalami perkembangan ketika hewan mencapai masa pubertas. Sel epitel yang mengelilingi oosit berubah menjadi epitel kubus sebaris (Wandji et al. 1996; Fortune 1994) dan disebut dengan folikel primer. Folikel primer berkembang menjadi folikel sekunder dengan karakteristik telah bertambahnya sel epitel yang mengelilingi oosit sampai dengan 5 lapis sel. Zona pelusida mulai terbentuk pada folikel sekunder, sebagai suatu lapisan tipis di sekeliling oosit. Folikel tersier merupakan folikel antral yang akan berkembang menjadi folikel de Graaf. Folikel ini memiliki karakteristik telah terbentuknya antrum folikuli, yaitu ruangan yang terbentuk akibat perkembangan sel sel folikuler. Antrum folikuli pada awalnya terpisah, tetapi kemudian bersatu menjadi suatu ruangan berbentuk bulan sabit. Selanjutnya antrum folikuli terus membesar hingga mendesak sel telur menuju tepian folikel hingga akhirnya terjadi proses ovulasi. Gambaran perkembangan folikel dalam ovarium dapat dilihat pada gambar 5 di bawah ini.
Gambar 5 Perkembangan folikel dalam ovarium: A. Folikel primer; B. Folikel sekunder; C. Folikel tersier; D. Folikel de Graaf (Modifikasi dari sumber: A = Kwan 2003; B = Tufts University 2009; C dan D = Akers dan Denbow 2008) dalam Aidel (2011).
10
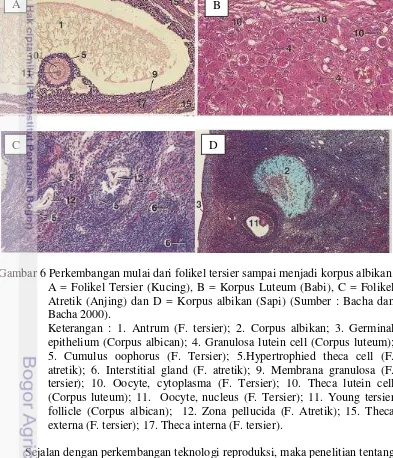
hemoragikum (korpus rubrum) setelah terjadi ovulasi. Selanjutnya korpus rubrum berkembang menjadi korpus luteum yang banyak mengandung sel lutein. Jika terjadi proses fertilisasi setelah ovulasi, korpus luteum akan berubah menjadi korpus luteum graviditatum. Jika tidak ada proses fertilisasi, maka korpus luteum akan mengalami regresi dan berubah menjadi korpus albikan yang mengandung banyak jaringan ikat (Aughey dan Frye 2001). Gambaran folikel tersier sampai menjadi korpus albikan pada ovarium kucing, babi dan anjing dapat dilihat pada gambar 6 berikut ini.
Gambar 6 Perkembangan mulai dari folikel tersier sampai menjadi korpus albikan. A = Folikel Tersier (Kucing), B = Korpus Luteum (Babi), C = Folikel Atretik (Anjing) dan D = Korpus albikan (Sapi) (Sumber : Bacha dan Bacha 2000).
Keterangan : 1. Antrum (F. tersier); 2. Corpus albikan; 3. Germinal epithelium (Corpus albican); 4. Granulosa lutein cell (Corpus luteum); 5. Cumulus oophorus (F. Tersier); 5.Hypertrophied theca cell (F. atretik); 6. Interstitial gland (F. atretik); 9. Membrana granulosa (F. tersier); 10. Oocyte, cytoplasma (F. Tersier); 10. Theca lutein cell (Corpus luteum); 11. Oocyte, nucleus (F. Tersier); 11. Young tersier follicle (Corpus albican); 12. Zona pellucida (F. Atretik); 15. Theca externa (F. tersier); 17. Theca interna (F. tersier).
Sejalan dengan perkembangan teknologi reproduksi, maka penelitian tentang anatomi dan morfologi organ reproduksi, khususnya betina juga telah dilakukan. Namun pada saat ini penelitian tentang anatomi dan morfologi organ reproduksi betina cervidae masih sangat sedikit. Adapun penelitian dan publikasi anatomi organ reproduksi pada spesies rusa langka antara lain: rusa pere david’s (Elaphurus davidianus, Milne Edwards) (Harrison dan Hamilton 1952); rusa rein
A B
(Rangifer tarandus) (Leader-Williams dan Rosser 1983); muskoxen (Ovibos moschatus) (Rowell et al. 1987); rusa wapiti and rusa merah (Haigh 2007); rusa brocket merah (Mazama americana) (Mayor et al. 2012) dan rusa pampas (Pe’rez et al. 2013).
Metode Pemantauan Status Reproduksi
Penentuan status reproduksi adalah salah satu faktor yang paling penting untuk manajemen pemeliharaan hewan di penangkaran. Hal tersebut terkait untuk lebih memahami biologi reproduksi dasar, termasuk hormonalnya (Wildt et al. 2010). Pemantauan hormon secara non-invasif memungkinkan untuk pengumpulan sampel dalam waktu lama, yaitu melalui urin, susu dan feses. Estimasi hormon steroid melalui urin telah digunakan secara luas untuk memantau status fisiologis hewan. Sedangkan analisis metabolit steroid melalui feses telah membuka wawasan baru untuk pemantauan non-invasif status reproduksi yang lebih praktis, terutama untuk hewan yang mudah stres (Schwarzenberger et al. 1993).
Pengukuran metabolit hormon dalam urin dan feses telah terbukti dapat digunakan sebagai metode analisis hormon selain menggunakan plasma darah untuk memantau status reproduksi di beberapa spesies hewan dengan hasil yang signifikan (Heistermann et al. 1995;Hodges dan Heistermann 2002). Oleh karena itu, saat ini analisis hormon melalui urin dan feses secara luas digunakan dalam banyak spesies baik domestik maupun satwa liar, terutama ketika bekerja dengan binatang yang sulit untuk ditangani, berpotensi berbahaya, dan peka terhadap gangguan fisik dan sosial (Heistermann 2010; Hodges dan Heistermann 2011). Sampai saat ini metode ini terus dikembangkan untuk mengetahui perilaku hewan yang dihubungkan dengan perubahan sekresi hormon dan membantu mengatasi masalah-masalah di bidang reproduksi, kesejahteraan hewan, ekologi, biologi konservasi, dan biomedis (Schwarzenberger et al. 1996; Mostl dan Palme 2002; Millspaugh dan Washburn 2004; Palme et al. 2005; Touma dan Palme 2005).
Selain itu pemantauan status reproduksi, khususnya betina sangat penting untuk program pemuliaan, terutama dalam manajemen pemeliharaan hewan di penangkaran. Informasi yang diperoleh sangat penting untuk meningkatkan perkembangbiakan secara alami. Dengan mengetahui status reproduksi hewan tersebut, maka dapat untuk memperkirakan dan mengetahui waktu ovulasi, awal kebuntingan, kesehatan janin dalam uterus dan waktu kelahiran.
Sekresi, Metabolisme dan Ekskresi Hormon Estrogen dan Progesteron
12
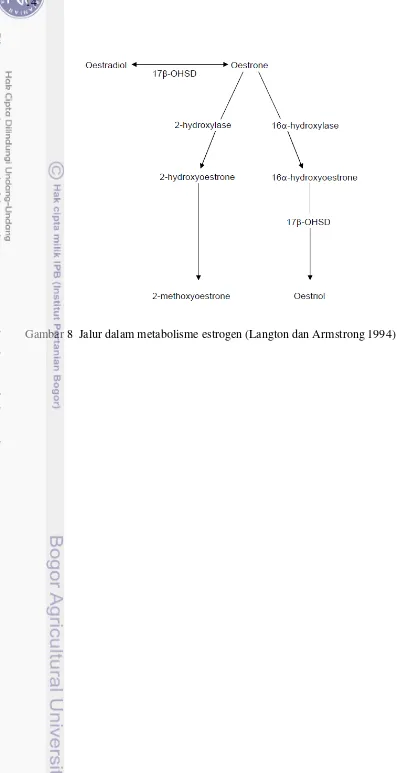
yang dihasilkan kemudian diekskresikan sebagai molekul steroid C-18, maka hal tersebut dikenali sebagai estrogen (Lasley et al. 1989). Selain itu, estron dapat dimetabolisme menjadi estriol terutama melalui reaksi yang terjadi di hati. Metabolisme estrogen melalui oksidasi atau konversi untuk glukuronat dan konjugat sulfat juga terjadi terutama di hati. Metabolit yang dihasilkan diekskresikan dalam empedu dan diserap ke dalam aliran darah melalui sirkulasi enterohepatic, sebelum produk akhirnya diekskresikan ke dalam urin atau kotoran. Kemungkinan jalur dalam metabolisme estrogen dijelaskan pada Gambar 8, dan struktur metabolit estrogen utama ditunjukkan pada Gambar 10.
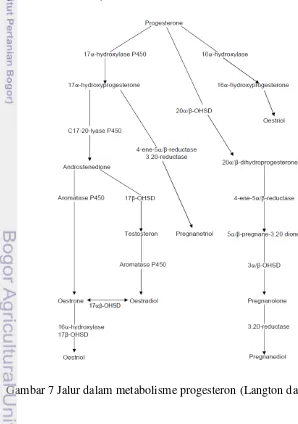
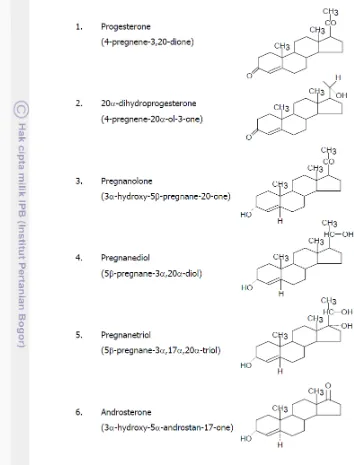
Sedangkan hormon progesteron merupakan hormon yang disekresikan oleh sel-sel lutein korpus luteum, plasenta dan kelenjar adrenal (Feradis 2010). Partodihardjo (1992) menambahkan bahwa korpus luteum merupakan jaringan tubuh yang paling banyak menghasilkan progesteron. Dalam proses metabolisme progesteron ditemukan lebih kompleks dengan tingkat lebih tinggi terhadap variasi spesies daripada estradiol. Sebagai contoh, pregnanediol-3-glukuronat (PdG) dan pregnanetriol-3glucuronide adalah metabolit utama pada urin hominoid dan beberapa spesies monyet platyrrhine (Axelson et al. 1984; Lasley dan Kirkpatrick 1991). Selain itu, Hindle dan Hodges (1990) dan Hindle et al. (1992) melaporkan bahwa ekskresi progesteron yang terdapat dalam urin pada badak putih Afrika, terutama 20-dihydroprogesterone (20-DHP) sulfat, sedangkan pada urin badak hitam Afrika adalah 20-DHP glukuronat. Pada badak India didominasi oleh pregnanediol glukuronat (Kasman et al. 1986). Hasil metabolisme progesteron pada badak Sumatra terutama pregnanolones, yang diekskresikan hampir sepenuhnya ke dalam feses (Heistermann et al. 1998). Mengingat begitu banyaknya variasi metabolit progesteron pada masing-masing spesies badak, maka dalam cervidae juga terjadi hal yang sama, dimana metabolit yang ekskresikan melalui feses dan darah bersifat spesifik spesies, contohnya pada lasser mouse deer (Tragulus javanicus), bahwa metabolit immunoreaktive progesteron dalam feses dengan metode High Performance Liquid Chromatography (HPLC) adalah 1: progesterone, 2: 5β-pregnan-3α-ol-20-one, 3: 5β-pregnan-3β-ol-20-one, 4: 5α-pregnan-3β-ol-20-one, 5: 5α-pregnan-3α -ol-20-one, dan 6: 5α-pregnan-3,20-dione (Kusudaa et al. 2013) Sedangkan pada muncak betina dengan metode analisis menggunakan enzyme immunoassay (EIA) diperoleh metabolit progesteron dalam feses adalah 20-oxo-pregnanes dan pregnanediol. Adapun jalur metabolisme hormon progesteron dapat dilihat pada Gambar 7.
metabolit hormon feses dengan teknik non-invasif dapat digunakan menilai berbagai fungsi endokrin pada mamalia dan burung (Touma dan Palme 2005).
Secara umum estrogen dalam feses dapat diukur menggunakan antibodi estrogen tertentu atau terhadap jumLah antibodi estrogen terkonjugasi. Sebagian besar spesies feses yang dikeluarkan mengandung persentase steroid bebas lebih tinggi daripada steroid terkonjugasi. Estrogen adalah produk akhir metabolisme steroid, sehingga senyawa dalam plasma dan feses adalah sama. Progesteron terutama dimetabolisme oleh hati sebelum ekskresi feses dalam ruminansia (Schwarzenberger et al.1996). Sekitar 99 % dari diekskresikan progesteron adalah senyawa unconjugated (Palme et al. 1996).
Rute ekskresi bervariasi antara spesies serta antara steroid dalam spesies yang sama. Sebagai contoh, pada domba 77% metabolit progesteron diekskresikan melalui feses (Palme et al.1996) dan sebaliknya 97% pada kucing domestik (Brown et al. 1994). Beberapa studi yang membandingkan antara hormon steroid plasma dan feses untuk pemantauan selama siklus estrus menunjukkan adanya penundaan ekskresi steroid feses dibandingkan dengan yang dalam plasma dengan jeda waktu sekitar 12-24 jam pada ruminansia dan sekitar 24 sampai lebih dari 48 jam pada jenis hewan yang lain seperti kuda, babi, badak, gajah dan primata (Wasser et al. 1994).
14
16
Gambar10 Struktur metabolit utama estrogen (Langton dan Armstrong 1994)
Perilaku Reproduksi Muncak
Kehidupan sosial dalam cervidae, terutama pada kelompok rusa tropis, termasuk muncak cenderung sama, yaitu jantan lebih soliter, sedangkan betina membentuk kelompok kecil dua hingga tiga ekor. Hal yang sama juga terjadi pada muncak selama penelitian, dimana kelompok kecil yang terjadi pada betina adalah antara induk, anak yang masih muda dan anak yang baru dilahirkan (Semiadi 2006)
Muncak merupakan satwa yang soliter dan beraktivitas pada siang dan malam hari (Wikipedia 2010). Hasil pengamatan perilaku sosial dari populasi rusa sambar di Florida menunjukkan bahwa rusa dewasa 69% adalah soliter dan sisanya 31%, hidup berkelompok dengan jumLah antara dua, empat hingga tujuh ekor (Shea et al. 1990 dalam Semiadi 2006). Sedangkan pengelompokan pada rusa sambar di Indonesia adalah 25% soliter, berkelompok 2-7 anggota 57,7% dan > 10 anggota 17,3% (Subagyo 2000 dalam Semiadi 2006).
Disamping gambaran dalam kehidupan sosial, maka pengamatan perilaku reproduksi juga sangat diperlukan. Pengetahuan tentang perilaku reproduksi sangat diperlukan sebagai dasar dalam manajemen perkembangbiakan satwa. Pengamatan perilaku reproduksi muncak dapat dilakukan di habitat alami dan di penangkaran. Pengamatan perilaku di penangkaran dapat dilakukan dengan mudah, karena ruang gerak satwa tersebut terbatas dan sebaliknya apabila pengamatan di habitat alaminya. Salah satu spesies cervidae di Indonesia yang telah berhasil dikembangbiakkan melalui proses domestikasi adalah rusa timor, sehingga populasinya pada saat ini cukup banyak.
dan betina berlangsung setelah muncak berumur di atas satu tahun. Siklus estrus muncak betina berkisar antara 14-21 hari dengan durasi estrus selama dua hari. Sedangkan periode kebuntingan berlangsung selama 210 hari dengan jumLah anak 1-2 ekor setiap kelahiran (Jackson 2002) dengan jarak per kelahiran sekitar tujuh bulan (Barrette 2004).
Selain itu informasi tentang perilaku reproduksi sangat diperlukan, terutama dalam manajemen perkawinan, yaitu untuk menentukan siklus estrus dan waktu optimal kawin. Penentuan siklus estrus dan waktu optimal kawin dapat dilakukan melalui perubahan perilaku seksual dan metode sitologi ulasan sel epitel vagina. Metode tersebut telah diterapkan pada banyak spesies, seperti anjing, kambing, gajah, kancil dan muncak (Bowen 1998; Doi et al. 2000; Ola et al. 2006; Najamudin 2010; Judi 2012). Sitologi ulasan vagina didasarkan pada perubahan tipe sel epitel pada saluran reproduksi terkait perubahan level estrogen yang memicu perubahan tipe dan proporsi sel epitel akibat dari proliferasi dan diferensiasi sel (Cooke et al. 1998).
Perilaku reproduksi pada hewan betina, tidak terlepas dengan keberadaan hormon dalam tubuhnya. Karena hal tersebut terkait secara langsung dengan terjadinya estrus, ovulasi, pendekatan pada jantan, percumbuan dan kopulasi. Perilaku pada betina, seperti adanya percumbuan tidak hanya dapat menerima jantan secara seksual tetapi juga menghasilkan bau dan suara yang khas serta adanya stimulasi fisik yang menandakan betina tersebut dalam kondisi estrus yang diperlihatkan dengan perilaku seksual. Perilaku seksual pada masing-masing spesies bersifat spesifik spesies.
Selanjutnya perilaku percumbuan merupakan seleksi tahap awal suatu satwa untuk mendapatkan pasangan. Hewan jantan umumnya berkompetisi dengan pejantan lain untuk mendapatkan betina sebagai pasangan kawin, kadang-kadang dengan cara mencoba membuat hewan betina terkesan. Pada sebagian besar spesies jantan melakukan percumbuan yang lebih sering dibandingkan dengan hewan betina (Campbell 2002). Berkaitan dalam mendapatkan pasangan yang cocok, biasanya antara satwa jantan dan betina secara bersama-sama berpartisipasi dalam menyeleksi pasangannya, sebagai contoh betina hanya berovulasi saat periode siklus, sedangkan jantan selalu siap kapan saja untuk dapat mengawini betina. Sedangkan pada satwa betina mempunyai keterbatasan dalam waktu kawin dibandingkan dengan jantan.
18
Gambar 11 Mekanisme hormon axis hypothalamus-pituitary-ovary (Saltzman et al. 2010)
Mekanisme tersebut diawali dari sel-sel syaraf pusat yang menstimulasi hypothalamus untuk melepaskan Gonadotropin-releasing hormone (GnRH) menyebabkan dilepaskannya FSH dan LH. Follicle-stimulating hormone (FSH) menyebabkan pertumbuhan folikel dan dalam pertumbuhannya, folikel menghasilkan estrogen, androgen, dan inhibin. Inhibin bekerja sebagai umpan balik negatif terhadap FSH saja, sedangkan estradiol dapat bekerja sebagai umpan balik positif pada hipothalamus. Peningkatan LH menyebabkan terjadinya ovulasi dan terbentuknya korpus luteum yang kemudian menghasilkan hormon progesteron. Progesteron bekerja sebagai umpan balik negatif terhadap pituitari anterior dan hipothalamus. Progesteron dengan atau tanpa estrogen bekerja sebagai umpan balik negatif. Estrogen sendiri dapat mempunyai efek positif dan negatif bergantung pada konsentrasinya.
Perilaku seksual pada betina terjadi secara periodik dan hanya muncul pada periode tertentu dalam kehidupannya. Perilaku seksual pada jantan dan betina keduanya terjadi akibat konsentrasi hormon gonadal di dalam plasma darah yang meningkat sampai level kritis. Sekresi hormon ini dipengaruhi oleh lingkungan seperti cahaya, nutrisi, bau khas dari pasangan, rangsangan perabaan, rangsangan sosial dan temperatur (Becker et al. 1992). Pada semua spesies mamalia kecuali manusia, ternak betina menunjukkan perilaku estrus atau kesediaan melakukan hubungan seksual hanya sekitar waktu ovulasi.
Penelitian tentang perilaku seksual pada ternak satwa liar telah banyak dilakukan antara lain: kambing jantan (Liano dan Mateos 1994), keledai jantan (Gastal et al. 1996); bison (Matsuda et al. 1995); gajah (Lincoln dan Sooriya 1996); roe deer (Capreolus) (Sempere et al. 1992); kerbau (Anzar et al. 1993), rusa timor (Nalley 2006; Handarini 2006), kancil (Najamudin 2010), muncak jantan (Wahyuni 2012) dan anoa (Judi 2012).
berhubungan erat dengan kemampuan jantan untuk menjadi pemimpin dalam kelompoknya yang ditandai dengan ukuran badan yang besar dan kuat serta adanya ranggah keras, dimana saat tersebut konsentrasi hormon testosteron sangat tinggi. Pada cervidae, ranggah keras menunjukkan bahwa konsentrasi hormon testosteron dalam tubuhnya sangat tinggi sebagai tanda dominasi seekor rusa jantan dalam suatu kelompoknya, sehingga memiliki sifat untuk mengawini betina. Meskipun demikian, keberhasilan dalam proses perkawinannya tergantung pada tingkat agresifitas dan daya tarik rusa jantan terhadap betina yang sedang estrus (Alexander et al. 1980).
Mengingat permasalahan yang terjadi dalam biologi reproduksi muncak betina sangat komplek, maka melalui penelitian eksploratif, diharapkan dapat memberikan informasi dasar untuk menunjang perkembangbiakan muncak di penangkaran. Berdasarkan hasil penelusuran literatur, informasi tentang anatomi dan morfologi organ reproduksi betina, hasil analisis jenis metabolit estrogen dan progesteron melalui feses dan perilaku reproduksi pada spesies muncak belum banyak diketahui. Dengan keterbatasan informasi tentang biologi reproduksi muncak, maka dalam penelitian ini menggunakan informasi reproduksi pada cervidae lainnya, seperti muncak reeves, rusa timor, rusa sambar sebagai bahan acuan dan pembanding untuk mempelajari morfologi dan fisiologi reproduksi muncak. Selanjutnya melalui penelitian diharapkan dapat untuk menentukan status reproduksi dan penerapan teknologi reproduksi dalam perkembangbiakan spesies muncak di penangkaran.
Tujuan Penelitian
Secara umum penelitian ini bertujuan untuk mengetahui biologi reproduksi muncak betina yang meliputi anatomi dan morfometri organ reproduksi muncak betina dan profil metabolit estrogen dan progesteron feses yang menggambarkan karakteristik siklus ovarium dan perilaku reproduksi muncak yang sangat diperlukan untuk menunjang usaha perkembangbiakan di penangkaran. Selanjutnya informasi yang diperoleh dapat digunakan untuk menunjang aplikasi teknologi reproduksi seperti inseminasi buatan (IB), embrio transfer (ET) dan in vitro fertilisasi (IVF). Sedangkan tujuan khusus dalam penelitian ini adalah :
1. Mengetahui anatomi dan morfologi organ reproduksi muncak betina 2. Melakukan validasi assay terhadap metabolit estrogen dan progesteron
di feses muncak betina
3. Mengetahui profil metabolit estrogen dan progesteron pada setiap tahapan reproduksi yang meliputi pubertas, siklus estrus dan kebuntingan
4. Mengetahui perilaku reproduksi muncak betina
Manfaat Penelitian
20
itu juga kemungkinan dapat mendukung aplikasi teknologi reproduksi pada spesies muncak (Muntiacus muntjak muntjak, Zimmermann 1780).
Ruang Lingkup Penelitian
Penelitian ini meliputi beberapa aspek biologi reproduksi pada muncak (Muntiacus muntjak muntjak, Zimmermann 1780) betina yang dipelihara di penangkaran. Aspek-aspek biologi reproduksi tersebut antara lain: anatomi dan morfologi organ reproduksi muncak betina, dan status reproduksi (periode pubertas, siklus estrus, dan kebuntingan) muncak dengan berdasarkan profil metabolit estrogen dan progesteron feses dan perubahan sel-sel epitel pada organ reproduksi betina (vagina) serta perubahan morfologi organ reproduksi luar. Selain itu penelitian ini juga melihat perilaku reproduksi muncak di dalam kandang individu dan exercise selama penelitian. Bagan alir kerangka pemikiran penelitian dapat dilihat pada gambar 12 berikut ini.
Gambar 12 Bagan alir kerangka pemikiran penelitian
MUNCAK BETINA
PROFIL HORMON ESTROGEN DAN
PROGESTERON
BUNTING SIKLUS
ANATOMI DAN MORFOLOGI ORGAN
REPRODUKSI
PRILAKU REPRODUKSI
BIOLOGI REPRODUKSI
SITOLOGI VAGINA
LAMA BUNTING
Daftar Pustaka
Agil M. 2007. Reproductive Biologi of the Sumatran Rhinoceros Dicerorhinus sumatrensis (FISHER 1814). [dissertation]. Bogor (ID). Bogor Agricultural University.
Aidel FR. 2011. Morfologi Organ Reproduksi Betina Trenggiling Jawa (Manis javanica) dengan Tinjauan Khusus pada Karakteristik Perkembangan Folikel dan Distribusi Karbohidrat pada Ovarium. [skripsi]. Bogor (ID). Institut Pertanian Bogor.
Alikodra 2010. Teknik Pengelolaan Satwa liar. (Dalam rangka mempertahankan keanekaragaman hayati Indonesia. Cetakan kedua. IPB Press.
Andrabi SMH, Maxwell WMC. 2007. A review on reproductive biotechnologies for conservation of endangered mammalian spesies [ulas balik]. Anim Reprod Sci. 99: 223-243 Farming Congress, Austin, Texas (USA): pp. 99–112
Asher GW. 2011. Reproductive cycles of deer. Anim Reprod Sci. 124: 170–175. doi:10.1016/j.anireprosci.2010.08.026.
Axelson M, Graham CE, Sjovall J. 1984. Identification and quantitation of steroid in sulphate fractions from plasma of pregnant chimpanzee, orangutan and rhesus monkey. J Endocrinol. 114: 337-344.
Bacha WJ, Bacha LM. 2000. Color Atlas of Veterinary Histology Ed ke-2. Philadelphia: Lippincott Williams danWilkins. hlm 221-243.
Banks WJ. 1993. Applied Veterinary Histology. Ed-3. Texas : Mosby.
Barrette C. 2004. Barking Deer or Muntjac (Muntiacus muntjac, Zimmermann, 1780). ENVIS Bulletin (Wildlife Institute of India, Dehra Dun) 7: 17–28. Barry TN, Semiadi G, Muir PD, Hodgson J. 1995. Dietary preferances of Sambar
(Cervus unicolor) and Red Deer (Cervus elaphus) offered browse, forage legume and grass species. Cambridge. Cambrigde University Press. J Agric Sci. 125: 99-107.
Beck BB, Wemmer C. 1983. Thebiology and management of and extinct species
Père David’s deer. Noyes Publ. New Jersey.
Becker JB, Breadlove M, Crews D. 1992. Behavioral Endocrinology. The Mit Press Cambridge, Masschusetts.
Bergstorm.R. Danell.K. 1995. Effects on Simulated Summer Browsing by Moose on Leaf and Shoot Biomase of Birch, Betula Pendula. Oikos. 72 (1): 132-138.
Blanvillain C, Berthier JL, Bomsel-Demontoy MC, Sempere AJ, Olbricht G. 1997. Analysis of reproductive data and measurement of fecal progesterone metabolites to monitor the ovarian function in the Pudu, Pudu pada Artiodactyla, Cervidae. JMammal. 61: 589–602.
22
Brown JL, Wasser SK, Wildt DE, Graham LH. 1994. Comparative aspects of steroid hormone metabolism and ovarian activity in felids, measured non invasively in faeces. Biol Reprod. 51: 776-786.
Campbell NA, Reece JB, Mitchell LG. 2004. Biologi Edisi Kelima Jilid III. Terjemahan: Rahayu Lestari. Jakarta (ID): Erlangga.
Chapman NG, Furlong M, Harris S. 1997. Reproductive strategies and the influence of date of birth on growth and sexual development of an aseasonally-breeding ungulate : Reeves’ Muntjak (Muntiacus reevesi). J Zoo. 241: 551-570.
Clarke JL, Welch. D, Gordon IJ. 1995. The influence of vegetation pattern on the grazing of heather moor land by red deer and sheep. Appl Eco. 32 (1): 177-186.
Cooke PS, Buchana DL, Lubahn DB, Cunha GR. 1998. Mechanism of Estrogen Action: Lessons from the Estrogen Receptor-α Knockout Mouse. Biol Reprod. 59: 470-475.
Constantinescu GM. 2007. Anatomy of reproductive organs. Di dalam: Schatten H, Constantinescu GM, editor. Comparative Reproductive Biology. USA: Blackwell Publishing. hlm 13-59.
Dellmann HD, Brown EM. 1976. Textbook of Veterinary Histology. Philadelphia: Lea dan Febinger.
Doi O, Komatsumoto M, Terazono M, Wada S, Akihisa N, Sakamoto H, Hamasaki T, Yanagimoto H, Nakano K, Matsuoka K, Ito A, Kusunoki H, Nakamura T. 2000. Exfoliative Cytology in Vaginal Vestibule of Female Asian Elephants: Relation to Circulating Progesterone Concentrations. Zool Sci. 17: 1303-1309.
Dradjat AS. 2000. Fertility diagnosis of timorensis deer (Cervus timorensis) semen during antler cycle. Prosidings Seminar Nasional Diagnosis Laboratoris, Klinis dan Nutrisi Veteriner. pp.48‐56. behaviour of donkey jackes; influence of ejaculatory frequency and season. Theriogenology. 593-602.
Gosling LM. 1985. The even-toe ungulates: odor Artiodactyla. Sources, behavioural context, and function of chemical signals. In Social Oudours in Mammals (ed. RE Brown and DW MacDonald). Clarendon Press, Oxford. Grier JW, Burk T. 1992. Biology of Animal Behavior. Mosby Year Book, Inc.
New Wellington.
Hafez ESE, Hafez B. 2000. Cycles Reproductive. Chapter 4. In: Reproduction in Farm Animals. Sevent Edition. Edited by Hafez B and Hafez ESE. Baltimore, Maryland USA: Lippincott Williams and Wilkins. Pp: 55-57. Haigh JC. 2007. Reproductive anatomy and physiology of male wapiti and red
Hamasaki SI, Yamauchi K, Ohki T, Murakami M, Takahara Y, Takeuchi Y, Mod Y. 2001. Comparison of various reproductive status in sika deer (Cervus nippon) using fecal steroid analysis. J Vet Med Sci. 63(2): 195-198.
Handarini R. 2006. Dinamika Aktivitas Reproduksi Berkaitan dengan Tahap Pertumbuhan Ranggah Rusa Timor (Cervus timorensis) Jantan Betina. [disertasi]. Bogor (ID). Institut Pertanian Bogor.
Harrison RJ, Hamilton WJ. 1952. The reproductive tract and the placenta and
membranes of Pere David’s deer (Elaphurus davidianus, Milne Edwards). J Anat. 86: 203–225.
Heistermann M, Möstl E, Hodges JK. 1995. Non-invasive endocrine monitoring of female reproductive status: Methods and applications to captive breeding
and conversation of exotic species. In: Gansloвer U. Hodges JK and
Kammans W. Editor. Research and Captive Propagation. Erlangen: Filander verlag GmBH. Hlm 36-48.
Heistermann M, Agil M, Buthe A, Hodges JK. 1998. Metabolism and excretion of oestradiol-17β and progesterone in the Sumatran rhinoceros (Dicerorhinus sumatrensis). Anim Reprod Sci. 53: 157-172.
Heistermann M. 2010. Non-invasive monitoring of endocrine status in laboratory primates: Methods, guidelines and applications. Adv Sci Res. 1: 1-9.
Hodges JK, Heistermann M. 2011. Field endocrinology: monitoring hormonal changes in fiee-ranging primates. In: Setchell JM, Curtis DJ (Eds) Field and Laboratory Methods in Primatolog: A Practical Guide. Cambridge: Cambridge University Press 353-370.
Hindle JE, Hodges JK. 1990. Metabolism of oestradiol-17β and progesterone in the white rhinoceros (Ceratotherium simun simun). J Reprod Fertil. 90: 571-580.
Hodges JK, Heistermann M. 2002. Non-invasive assesment of reproductive function in primate. JEvol Antropho. Suppl (1): 180-182.
Hodges JK, Heistermann M. 2011. Field endocrinology: monitoring hormonal changes in fiee-ranging primates. In: Setchell JM, Curtis DJ (Eds) Field and Laboratory Methods in Primatolog: A Practical Guide. Cambridge: Cambridge University Press 353-370. chewing behaviour of young sambar and red deer consuming a low quality roughage. J Agric-Sci, Cambridge. Cambridge, University Press. 125. pp 399-405.
Ilyas O, Khan JA, Khan A. 1998. Status distribution and conservation of deer populations of oak forest in Kumaon Himalaya, India. In: Advances in Deer Biology (Ed. Z. Zomborszky). Proceedings of the 4th International Deer Congress. Komposvar. 101-102.
IUCN] 2010. Muntiacus muntjac. (http://www.iucnredlist.org/apps/redlist /details / 42190/0 2010
24
Muntiacusmuntjac.htmL [3 Agustus 2008].
Judi. 2012. Kajian Perilaku Reproduksi, Preservasi Semen, dan Teknik Inseminasi Buatan pada Anoa (Bubalus Sp.) di Penangkaran. [disertasi] Bogor (ID): Institut Pertanian Bogor.
Kapke CA, Arcese P, Ziegler TE, Scheffler GR. 1999. Estradiol and progesterone metabolite concentration in white tailed deer (Odocoileus virginianus) feces. J Zoo Wildl Med. 30 (3): 361–371. PMID:10572858 [PubMed - indexed for MEDLINE].
Kasman LH, Ramsay EC, Lasley BL. 1986. Urinary steroid evaluation to monitor ovarian function in exotic ungulates: III. Estrone sulphate and pregnandiol-3glucuronid excretion in the Indian rhinoceros (Rhinoceros unicornis). J Zoo Biol..5: 355-361.
Langton REG, Armstrong DT. 1994. Follicular steroidogenesis and its control. In: The physiology reproduction. 2nd ed. Eds. E Knobill, JD Neil, GS Greenwald, CL Markert, DW Pfaff, Raven Press. New York. Pp. 571-612. Langvatn R, Hanley. TA. 1993. Feed-patch choice by red deer in relation to
foraging efficiency: an experiment. Oecologia. 95 (2): 164-170.
Lasley BL, Kirkpatrick JF. 1991. Monitoring ovarian function in captive and free ranging wildlife by means of urinary and faecal steroids. J Zoo Wildl Med.
22 (1): 23-31.
Lasley BL, Troedsson M, Bravo W, Haggerty MA. 1989. Oestrogen conjugate measurements to monitor ovarian activity. Theriogenology. 31 (1): 23-31. Leader-Williams N, Rosser AM.1983. Ovarian characteristics and reproductive
performance of reindeer, Rangifer tarandus. J Reprod Fertil. 67: 247–256. Lelono A. 1996. Ekologi perilaku makan rusa (Cervus timorensis Lyd) dalam
penangkaran di Ranca Upas Ciwidey. [thesis]. Bandung (ID). Institut Teknologi Bandung.
Lelono A. 2001. Pola aktivitas makan harian rusa (Cervus timorensis) dalam penangkaran. Seminar Biologi Nasional I di Jurusan Biologi FMIPA Universitas Jember.
Li C, Jiang Z, Jiang G, Fang J. 2001. Seasonal changes of reproductive and fecal
steroid concentrations in Pere David’s deer. Horm Behav. 40 (1): 198-215. Elsevier. http://dx.doi.org/10.1006/hbeh.2001.1711.
Liano B, Mateos RE. 1994. Influence of Photoperiod on the Secretion of testosterone a responese to sexual stimulus in male goats. Theriogenelogy. 127-135.
Liming S, Ying ying Y, Xingsheng D. 1980. Comparative cytogenetic studies on the red muntjac, Chinese munjac, and their F1 hybrids. J Cytogene Cell Genetic. 26: 22-27.
Lincoln GA, Sooriya WD. 1996. Testosterone secretion, much and social dominance in captive male Asian Elephants living near the equator J Reprod Fertil. 108: 107-113.
Lindner HR. 1972. Enterohepatic circulation and patterns of urinary excretion of cortisol metabolites in the ewe. J Endocrinol. 52: 19-20.
Ma S, Wang Y, Xu L. 1991. Taxonomic and phylogenetic studies on the genus Muntiacus. J Actheriol Sin. 3: 190 – 209.