PENGEMBANGAN METODE DETEKSI MOLEKULER
CHRYSANTHEMUM STUNT PTROID
(CSVd) PENYEBAB
PENYAKIT KERDIL PADA TANAMAN KRISAN
(Dendranthema grandiflora
Kitam.)
ERNIAWATI DININGSIH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
~ e & a n ini saya menyatakan bahwa tesis PENGEMBANGAN METODE DETEKSI MOLEKULER CHRYSANTHEMIIM STINT VIROID (C SVd)
PENYEBAB PENYAKIT KERDIL PADA TANAMAN KRISAN (Dendran-
thema grandflora Kitam.) adalah karya saya sendiri dan belum diajukan dalam
bentuk apa pun kepada perguruan tinggi mana pun. Sumber infonnasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalarn Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2008
Emiawati Diningslh
ABSTRACT
ERNIAWATI DININGSIH. The Development of Molecular-Based Detection Method for Chrysanthemum stunt viroid Causing Stunt Diseases of Chrysanthemum Plant (Dendranthema grandzjlora Kitam). Advised by GEDE SUASTIKA DAN YOYO SULYO.
Chrysanthemum stunt viroid (CSVd) is the most prevalent and
economically important viroid infecting chrysanthemum in Indonesia. In florist chrysanthemum, the viroid causes vein clearing, malformation on leaves and flowers and reduces plant growth. The viroid is readily transmitted by mechanical means and vegetative plant materials (such as plant cutting) and spreads efficiently in greenhouses or in the field in the absence of any specific vector. One possible control method for the disease, therefore, is using CSVd-fiee seedlings. In the seed certification program, a sensitive detection method is a crucial tool. The purpose of this research is to characterize CSVd Indonesian isolate, and to develop molecular-based detection method for CSVd. The research was carried out in Plant Virology Laboratory, Plant Protection Departemen, Bogor Agricultural University and in Indonesian Ornamental Crop Research Institute (IOCRI) Segunung, West Java from May 2007 to June 2008. Using reverse transcriptase-polymerase chain reaction (RT-PCR), a fragment of 250 bp was successfully amplified from diseased chrysanthemum plant. The nucleotide sequence of the amplified fragment of CSVd Indonesian isolate was found to have high homology to those of CSVd isolates from Japan, Korea, India, and USA. A
return polyacrylamide gel electrophoresis (return-PAGE) was also successfully applied for detection of CSVd. Based on the nucleotide sequence of CSVd Indonesian isolate, a specific, non-radioactive RNA probe was developed. Using the probe, a tissue blot hybridization method was successfully developed and could be applied to detect CSVd in large number of samples.
RINGKASAN
ERNIAWATI DININGSIEI. Pengembangan Metode Deteksi Molekuler Chrysanthemum Stunt Viroid (CSVd) Penyebab Penyakit Kerdil pada Tanaman Krisan (Dendranthema grandflora Kitam.). Dibimbing oleh GEDE SUASTIKA
dan YOYO SULYO.
Krisan (Dendrantlzema grandzj7ora Kitam.) merupakan tanaman bunga potong yang sudah menjadi komodtas dunia. Menurut Direktorat Jenderal Hortikultura (2008), produksi krisan dalam negeri meningkat dari 1,7 juta bibit pada tahun 2005 menjadi 5,9 juta bibit di tahun 2006 dan 6,5 juta bibit di tahun 2007. Walaupun te rjadi peningkatan produksi bibit krisan di dalam negeri, impor bibit juga mengalami peningkatan yang cukup tinggi pada tahun yang sama.
Kejadian penyakit oleh Chrysanthemum stunt viroid (CSVd) pada tanaman krisan di Indonesia sampai saat ini masih sangat tinggi sehingga produksi krisan mutunya masih rendah. Tanaman krisan yang sudah terserang viroid terrnasuk CSVd tidak dapat disembuhkan. Eradikasi tanaman yang terserang sering menjadi pilihan untuk melindungi tanaman di sekitarnya. Pada kejadian penyakit yang cukup tinggi, tindakan eradikasi menyebabkan penurunan kuantitas bunga yang cukup merugikan. Cara pengendalian yang paling menjanjikan adalah penggunaan bibit krisan bebas CSVd.
Dalam sertifikasi, terutama mengenai kesehatan bibit, metode deteksi patogen sasaran menjadi alat bantu penentu keberhasilan. Metode yang digunakan hams memenuhi persyaratan sensitivitas, massal dan ekonomis. Metode deteksi virus yang biasa digunakan, yaitu metode serologi, tidak dapat digunakan untuk mendeteksi viroid. Pendekatan molekuler merupakan salah satu cam yang dapat dilakukan untuk mendeteksi viroid karena kelompok patogen ini hanya tersusun dari asam nukleat.
Saat ini telah diketahui tiga metode utama yang dapat dilakukan untuk mendeteksi CSVd, yaitu return electrophoresis, dot-blot hybridization assay, dan reverse transcrrption-polymerase chain reaction (RT-PCR). Namun demikian, penelitian dan pendeteksian terhadap CSVd belum pernah dilakukan di Indonesia. Oleh karena itu dalam penelitian ini dikembangkan metode deteksi berbasis molekuler.
Penelitian ini bertujuan ( I ) mengungkap identitas molekuler CSVd isolat Indonesia melalui perunutan nukleotida sebagai landasan penyusunan metode deteksi, (2) eksplorasi metode deteksi CSVd berbasis molekuler yang optimal untuk penapisan bibit krisan bebas viroid, dan (3) menerapkan metode deteksi CSVd yang telah ditetapkan untuk pengujian massal pada berbagai bahan tanaman krisan.
Penelitian dilaksanakan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Institut Pertanian Bogor, Bogor, dan rumah kaca serta Laboratorium Virologi, Balai Penelitian Tanaman Hias (Balithi), Segunung, Cianjur, Jawa Barat, dari Mei 2007 sarnpai dengan Juni 2008.
radioaktif, (7) deteksi dengan return-PAGE, dan (8) deteksi dengan teknik tissue blot hybridization.
Tanaman krisan yang diduga terserang CSVd diambil dari kebun percobaan Balitlu (Segunung), pertanaman knsan petani di Bali dan Medan serta perusahaan swasta di Cianjur.
RNA total diekstraksi dari daun tanaman krisan menggunakan Rneasy
Plant Mini Kits (Qiagen, Germany). Prosedur ekstraksi sesuai dengan instruksi perusahaan penyedia kit. RNA total yang diperoleh dan terdapat dalam tabung, disimpan di ruang penyimpanan pada suhu -80 "C sampai akan digunakan.
Arnplifikasi seluruh genom CSVd dilakukan dengan teknik reverse transcrption-polymerase chain reaction (RT-PCR) menggunakan pasangan primer 5'-CAACTGAAGCTTCAACGCCTT-3' dan 5'-AGGATTACTCCTGTC TCGCA-3' yang dilaporkan dapat menghasilkan produk PCR dengan ukuran 250 bp (Hosokawa et al. 2004).
Tanaman yang diketahui hanya terinfeksi oleh CSVd digwlakan untuk uji kisaran inang. Setiap tanaman indikator dipersiapkan 3 tanaman sebagai ulangan dan memililu umur tanam yang sama. Parameter yang diamati meliputi gejala yang muncul dan masa inkubasi, serta keberadaan CSVd dalam tanaman uji. Keberadaan CSVd dalam tanaman uji dideteksi dengan teknik RT-PCR.
Deteksi dengan return-PAGE dilakukan mengikuti prosedur EPPO 2002 yang dimodifikasi. RNA total hasil ekstraksi, divisualisasikan dengan elektroforesis gel akrilamid 5%, dan diwarnai dengan perak nitrat.
Deteksi dengan tissue blot hybridization dilakukan menurut Dietzgen (1997). Pembuatan pelacak DNA non-radiokatif dilakukan melalui teknik PCR. Tangkai d a m pucuk bibit h s a n dipotong kemudian segera ditempelkan selama 1 menit pada membran nitrosellulose. Membran yang sudah dipersiapkan dan sudah mengandung cairan tanaman sampel, selanjutnyta diperlakukan dalam beberapa tahap proses hibridisasi, yaitu prehibridisasi dalam 10 ml larutan Dig Easy Hyb (50 "C selama 60 menit), hibridisasi dalam 2 ml larutan
Dig
Easy Hyb yang mengandung pelacak DNA (20 p1 pelacaM200 Dig Easy Hyb) yang sudah didenatwasi ( inkubasi 50 "C, semalam). Selanjutnya pewarnaan menggunakan NBTIBCIP.Berdasarkan pengamatan di lapangan pada saat pengambilan sampel,
gejala kerdil hampir ditemukan di seluruh lokasi tempat dibudidayakannya tanaman krisan.
Hasil amplifikasi menunjukkan primer Forward (F) (5'-CAACTGAA GCTTCAACGCCTT-3') dan primer Reverse (R) (5'-AGGATTACTCCTG TCTCGCA-3') dapat mengamplifikasi cDNA CSVd dengan ukuran 250 basa pada empat sampel tanaman knisan, yaitu isolat Bali 3, Bali 6 , Medan A dan Cipanas.
Analisa menunjukkan bahwa CSVd isolat Indonesia (isolat Cipanas) memiliki genom yang sangat identik (kesamaan genetik 94-99%) dengan genom- genom CSVd yang berasal dari negara-negara Jepang, Korea, India dan Amerika Serikat.
cruentus, P. hibrida dan D. grandflora F1 hibrid, dan tanaman yang menunjukkan gejala hanya S. cruentus dan
D.
grandrJlora F1 Hibrid.Teknik return-PAGE dengan menggunakan alat hasil modifikasi, dapat diaplikasikan untuk mendeteksi RNA CSVd dalam jaringan tanaman krisan yang ditunjukkan dengan diperolehnya suatu pita RNA CSVd yang terletak di bagian tengah gel dalam daerah running pada tanaman yang sakit dan kontrol positif.
Pelacak DNA CSVd yang dibuat dalam penelitian ini, dapat mendeteksi langsung keberadan RNA CSVd dalam jaringan tanaman krisan yang terinfeksi. Keberhasilan deteksi ini dibuktikan dengan adanya spot-spot berwarna ungu pada daerah tempat ditempelkannya potongan batang pucuk tanaman krisan sakit pada membran nylon, dan tidak ditemukannya signal tersebut pada tanaman yang sehat, termasuk penyangga sebagai kontrol negatif. Deteksi dengan tissue blot hybridization dapat diaplikasikan untuk sejurnlah sampel yang cukup banyak dalam waktu yang bersamaan sehngga efisiensi terhadap penggunaan waktu. Dari luasan membran nylon sekitar 12 cm2 dapat diuji sebanyak 48 buah sampel (terrnasuk kontrol positif dan negatif).
Berdasarkan hasil penelitian dapat disimpulkan bahwa urutan nukleotida CSVd isolat Indonesia (Cipanas) memiliki homologi yang tinggi dengan isolat CSVd lainnya yang terdapat di gene Bank, terutama dengan isolat-isolat dari
Jepang, Korea, India, dan Amerika Serikat, dengan kemiripan genom berkisar dari 94-99%.
Keberadaan RNA CSVd dalam tanaman krisan dapat dideteksi menggunakan teknik RT-PCR, tissue blot hybridization, dan return PAGE.
Tissue blot hybridization merupakan teknik yang paling memungkinkan diterapkan dalam program sertifikasi bibit krisan karena dapat diaplikasikan untuk sejurnlah besar sampel dalam waktu yang bersamaan.
@
Hak cipta miiik IPB, tuhun 2008
Hak Cipta dilindungi Undang-undung
I. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpu
mencantumkan atau menyebutkm sumber
a. Penyutipan hanya untuk kepentingan pendidikan, penelitiun, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Yengut pan tidak merugikan kepentingan yang wajar IPB
PENGEMBANGAN METODE DETEKSI MOLEKULER
CHRYSANTHEMUM STUNT KlROID
(CSVd) PENYEBAB
PENYAKIT KERDIL PADA TANAMAN KRISAN
(Dendranthema grandzjlora
Ki
tam.)
ERNLAWATI DININGSIH
Tes IS
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Proteksi Tanaman
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis
Nama NIM
Program Studi
: Pengembangan Metode Deteksi Molekuler Chrysanthemum Stunt Viroid (CSVd) Penyebab Penyakit Kerdil pada Tanaman Krisan (Dendranthema grandrflora Kitam. )
: Erniawati Diningsih
Disetujui Komisi Pembimbing
Dr. Ir. Gede Suastika, MSc. Ketua
Diketahui
I;. Yovo Sulyo. MSc. Awgota
Ketua Program Studi Entomologi-Fitopatologi
M - W
Dr. Ir. Sri Hendrastuti Hidayat, MScPRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karuniaNya yang telah diberikan sehingga penulis dapat menyelesaikan tesis ini dengan sebaik-baiknya. Solawat serta salam semoga dilimpahkan kepada Nabi Besar Muhammad SAW beserta keluarga dan para sahabatnya.
Penulisan tesis ini merupakan salah satu syarat untuk memperoleh gelar Magister Sains pada Fakultas Pertanian, Institut Pertanian Bogor.
Segala kemampuan baik tenaga maupun material telah penulis curahkan untuk menyelesaikan tesis ini dengan sebaik-baiknya. Pada kesempatan ini penulis tak lupa mengucapkan terimakasih yang sebesar-besarnya kepada :
1. Badan Litbang Pertanian yang telah memberi kesempatan kepada penulis dan memberikan beasiswa untuk melanjutkan 52 di Institut Pertanian Bogor, juga memberikan bantuan dam penelitian yang cukup besar melalui Kerjasama Kemitraan Penelitian Pertanian dengan Pergwuan Tinggi (KKP3T).
2. Bapak Dr. Ir. Gede Suastika, MSc (dosen Departemen Proteksi Tanaman, IPB) dan Bapak Ir. Yoyo Sulyo, MS (Peneliti Balai Penelitian Tanaman Hias) selaku pembimbing atas arahan dan bimbingannya sejak dimulainya penelitian sarnpai penyelesaian tesis ini.
3. Bapak Dr. Ir. Ali Nurmansyah, Msi selaku penguji luar komisi atas segala masukannya untuk perbaikan tesis ini.
4. Teknisi Balai Penelitian Tanman Hias, Saudardi Laily Qodriyah dan Ee Saepudin, serta teknisi dan laboran Laboratoriurn virologi, Departemen Proteksi Tanaman, IPB, atas bantuan tenaganya selama melaksanakan penelitian.
5. Ayahanda Edi Junaedi dan ibunda Wasilah, serta adlk-adik tercinta Meli, Wandi, Desi, Marni, dan Hani yang telah memberikan dorongan sepenuhnya demi keberhasilan studi.
7. Rekan-rekan dan semua pihak yang tidak dapat disebutkan satu persatu yang telah memberikan dorongan, dan semangat untuk penyelesaian tesis ini.
Penulis berharap semoga tesis ini dapat bermanfaat khususnya bagi penulis dan urnumnya bagi siapa saja yang memerlukannya.
Bogor, Agustus 2008
RIWAYAT HIDUP
Penulis Qlahrkan di Cianjur, Jawa Barat pada tanggal 25 Maret 1974, sebagai anak pertama dari enam bersaudara dari Bapak Edi Junaedi dan Ibu Wasilah. Sampai saat ini penulis telah memiliki satu orang putri dan satu orang putra.
Setelah lulus dari SD Negeri Q Cipanas pada tahun 1987 dan SMP Negeri
I Cipanas pada tahun 1990, penulis melanjutkan ke SMA Negeri I Cianjur, Jawa Barat dan lulus pada tahun 1993. Pada tahun yang sarna penulis Qterima sebagai mahasiswa Institut Pertanian Bogor melalui jalur Penelusuran Minat dan Bakat (PMDK). Setahun berikutnya penulis terdaftar sebagai mahasiswa jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian, dan lulus pada Februari 1998.
Dua tahun setelah lulus (Maret 2000), penulis bekerja sebagai pengajar mata ajaran biologi dan fisika Q salah satu SMP di Cipanas, Cianjur, Jawa Barat, dan pada tahun 2001 diangkat sebagai Calon Pegawai Negeri Sipil Q Balai Penelitian Tanaman Hias, Badan Litbang Pertanian, Departemen Pertanian, yang akhirnya diangkat sebagai Pegawai Negeri Sipil pada tahun 2003.
Semenjak bekerja
d~
Balai Penelitian Tanaman Hias sampai dengan sekarang, penulis terdaftar sebagai anggota Perhimpunan Fitophatolog Indonesia (PFI), dan telah pernah menulis karya ilmiah yang diterbitkan, baik sebagai penulis pertama maupun bukan.DAFTAR IS1
Halaman
...
DAFTAR TABEL
DAFTAR GAMBAR ...
PENDAHULUAN ... ...
Latar belakang
Tujuan Penelitian ...
Manfaat Penelitian ...
TINJAUAN PUSTAKA ...
Krisan (Dendranthema grandflora Kitam.) ...
Penyaht pada Tanaman Krisan ... Chrysanthemum stunt vzroid (CSVd) ...
Struktur Genom CSVd ... ...
Ciri Biomolekul CSVd
...
Cara Penularan CSVd
Persebaran Geografi CSVd ...
Kisaran Inang CSVd ...
Gejala Tanaman Terinfeksi CSVd ...
Patogenesis CSVd ...
Pengendalian CSVd ... ...
Pembebasan CSVd
...
Deteksi CSVd
BAHAN DAN METODE ...
Tempat dan Waktu ...
Metode ...
Pengambilan Tanaman Contoh dari Lapang ...
Persiapan Tanaman Indikator ... ...
Ekstraksi RNA Total
Amplifikasi dan Perunutan Nukleotida CSVd ...
...
X l l l
Uji Kisaran Inang CSVd ...
Deteksi dengan Return Polyacrylamide Gel Electrophoresis (Return-PAGE) ...
Preparasi Sampel ...
Pembuatan Gel ...
Elektroforesis Gel ... ...
Pewarnaan dengan Perak Nitrat
Pembuatan Pelacak (Probe) DNA Non-Radioaktif ...
Deteksi CSVd pada Bibit Krisan Melalui Tissue Blot
Hybridization ...
HASIL DAN PEMBAWASAN ... ...
Gejala Tanaman Krisan Terinfeksi CSVd di Lapangan
Amplifikasi Genom CSVd dengan RT-PCR ...
Perunutan Nukleotida CSVd ...
Kisaran Inang CSVd ...
Deteksi dengan Return Polyacrylamide Gel Electrophoresis (Return PAGE) ...
Deteksi CSVd pada Bibit Krisan Melalui Tissue Blot
Hybridization ...
Pembahasan Umum ...
KESIMPULAN DAN SARAN ...
Kesimpulan ...
Saran ...
UCAPAN TERIMAKASIH ...
DAFTAR PUSTAKA ...
LAMPIRAN ...
Halaman
DAFTAR TABEL
Nomor Halaman
1. Hasil pengujian serologi dengan teknik ELISA pada sumber inokulum CSVd (isolat Cipanas) terhadap antiserum CVB dan CMV . . .
.
. . ..
. .. . .
. . ..
. . ..
. . . ..
. . . ..
. ..
. . .. .
. . .. .
. . . ..
.DAFTAR GAMBAR
Nomor Halaman
Teks
1. Gejala pada tanaman knsan yang diduga terinfeksi oleh CSVd. a) Gejala kerdil pada tanaman D. grand$ora cv Puspita Kencana (A) dibandingkan tanaman yang normal cv
P. Nusantara (B) yang ditanam di salah satu rumah kaca Balai Penelitian Tanaman Hias, Segunung, Jawa Barat. b&c) Gejala kerdil pada jenis kultivar krisan lainnya (jenis kultivar tidak diketahui), tinggi tanaman hanya mencapai 1/3 dari tinggi tanaman yang normal. d) Gejala kerdil dan penguningan pada daun serta penipisan daun pada tanaman krisan pot.. ...
2. Gejala tanaman krisan terinfeksi CSVd berdasarkan analisa dengan RT-PCR. A) Perturnbuhannya kerdil, narnun tidak menunjukkan adanya gejala pada daun, B) mas-ruas batang lebih pendek ...
3. Fragmen DNA beberapa isolat CSVd hasil amplifikasi (PCR) menggunakan primer F dan primer R pada gel agarose 1,5%: 1) DNA marker 100 bp, 2) Kontrol negatif (tanaman sehat), 3) Isolat Bali 3 , 4) Isolat Bali 6, 5) Isolat Medan A, 6) Isolat
...
Medan B, 7) Isolat Medan C, dan 8) Isolat Cipanas
4. Fragmen DNA CSVd isolat Cipanas hasil amplifikasi (PCR) menggunakan primer F dan primer R pada gel agarose 1,5%: (1) annealing 60 OC, (2) annealing 61 OC, (3&4) annealing 62
...
"C, (M) DNA marker 100 bp..
...
5. Pohon filogenetik Chrysanthemum stunt viroid..
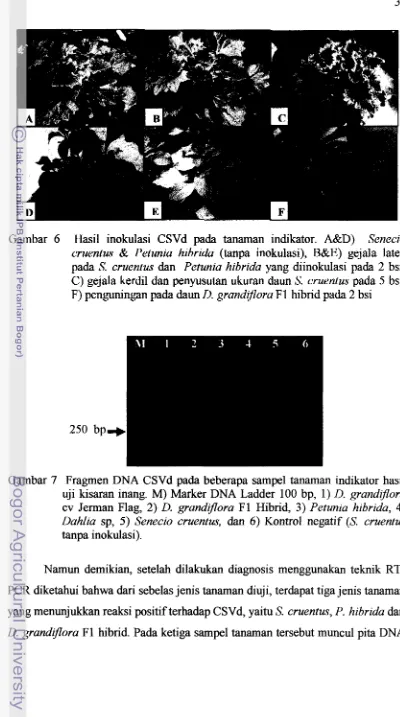
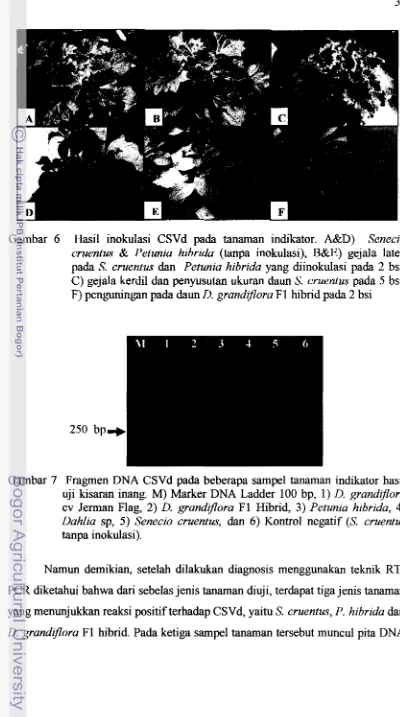
6 . Hasil inokulasi CSVd pada tanaman indikator. A&D)
Nomor
Teks
7. Fragmen DNA CSVd pada beberapa sampel tanaman indikator hasil uji kisaran inang. M) Marker DNA Ladder 100 bp, 1) D. grandzflora cv Jennan Flag, 2) D. grandflora F1 Hibrid, 3) Petunia hibrida, 4) Dahlia sp, 5) Senecio cruentus, dan 6) Kontrol negatif (S. cruentus tanpa inokulasi) ...
8. Hasil analisa pola pita CSVd berdasarkan metode return- PAGE. 1 kontrol negatif, 2. tanaman sehat, 3 tanaman sakit,
.
. 4-8. Kontrol positif ...9. Hasil analisa tissue blot hybridization. A1 dan B1 adalah kontrol positif (klon CSVd): C1 dan D l adalah kontrol negatif (bufer); A2-A12, B2-B 12, C2-C 10, dan D2-D 10 adalah sampel dari kebun percobaan Balitlv dengan gejala kerdil; C 1 1 dan D 1 1 adalah sampel kultur in vitro; C 12 dan D 12 adalah kontrol negatif (tanaman sehat, berdasarkan hasil deteksi dengan RT-PCR). ...
xvi
PENDAHULUAN
Latar Belakang
Krisan (Dendranthema grandrflora Kitam.) merupakan tanaman bunga potong yang sudah menjadi komoditas dunia. Jepang, Belanda dan Kolombia merupakan negara produsen utama krisan dunia (Bouwen 2003). Indonesia, sampai saat ini, masih mengimpor stek untuk memenuhi kebutuhan akan bunga tersebut. Menurut Direktorat Jenderal Hortikultura (2008), produksi krisan dalam negeri meningkat dari 1,7 juta bibit pada tahun 2005 menjadi 5,9 juta bibit Q tahun 2006 dan 6,5 juta bibit di tahun 2007. Walaupun terjadi peningkatan produksi bibit krisan di dalam negeri, impor bibit juga mengalami peningkatan yang cukup tinggi pada tahun yang sama. Hal ini disebabkan karena kebutuhan bibit krisan meningkat lebih cepat dibandng kemampuan produksi bibit di dalam negeri.
Pengadaan bahan tanaman melalui impor menyebabkan harga bunga krisan mahal, sehingga petani Indonesia berusaha memproduksi sendiri stek dengan menggunakan tanaman induk yang berasal dari impor. Namun demikian, penggunaan tanaman induk yang sama secara terus menerus mengakibatkan terjaQnya degenerasi, akibatnya pertumbuhan tanaman menjadi terhambat (stunting) dengan perakaran yang terbatas, dam-daun berukuran kecil dan benvarna hijau pucat, pembungaan lebih cepat (beberapa hari) dibandingkan dengan yang sehat, bunga yang dihasilkan berukuran sangat kecil dengan warna lebih pudar. Fenomena degenerasi ini menyebabkan petani kembali menggunakan bibit (asal stek) krisan impor. Penyebab utama terjadinya degenerasi pada tanaman krisan ialah Chrysanthemum stunt vzroid (CSVd) yang terbawa dalam bibit (Duran et al. 1996; Hill et al. 1996).
Gora-Sochacka 2004). Oleh karena itu, tidak mengherankan bahwa CSVd telah ditemukan tersebar luas di semua daerah sentra produksi krisan di Indonesia dan telah menyebabkan kerusakan dan p e n m a n hasil bunga potong pada beberapa daerah tersebut (hasil pengamatan peneliti, data tidak diperlihatkan).
Tanaman knsan yang sudah terserang viroid terrnasuk CSVd tidak dapat disembuhkan karena sampai saat ini belurn tersedia secara komersial bahan anti- viroid yang tidak merusak sel tanaman (Duran et al. 1996; Gora-Sochacka 2004). Eradikasi tanaman yang terserang sering menjadi pilihan untuk melindungi tanaman di sekitarnya dari infeksi sekunder karena CSVd juga dapat ditularkan melalui pisau potong. Pada kejadian penyalut yang cukup tingg, tindakan eradikasi menyebabkan p e n w a n kuantitas bunga yang cukup merugikan.
Untuk menghindari kerugian yang lebih besar dan untuk mengurangi impor (dengan demikian dapat mengurangi biaya produksi), fenomena degradasi pada tanaman h s a n perIu diatasi. Cara yang paling menjanjikan ialah menggunakan bibit krisan bebas CSVd. Perbanyakan tanaman (stek) dari tanaman induk yang bebas CSVd menjadi persyaratan utama untuk penyediaan bibit h s a n sehat tersebut. Oleh karena itu, sertifikasi penangkar benih h s a n menjadi ha1 yang krusial agar petani pengguna tidak mengalami kerugian yang tidak seharusnya mereka tanggung.
Pendekatan molekuler merupakan salah satu cara yang dapat dilakukan untuk mendeteksi viroid karena kelompok patogen ini hanya tersusun dari asam nukleat (Duran et al. 1996; Gora-Sochacka 2004).
Saat ini telah diketahui tiga metode utarna yang dapat dilakukan untuk mendeteksi CSVd, yaitu return electrophoresis (OEPP/ EPPO 2002), dot-blot
hybridization assay (Candrese et al. 1988), dan reverse transcription-polymerase
chain reaction (RT-PCR) (Hosokawa et al. 2006). Namun demikian, penelitian
dan pendeteksian terhadap CSVd belum pernah dilakukan di Indonesia. Oleh karena itu dalam penelitian ini dikembangkan metode deteksi berbasis molekuler yang handal yang diharapkan dapat mencegah masuknya CSVd isolat luar negeri yang mungkin terbawa dalam bahan tanaman krisan yang diimpor. Disamping itu juga akan dapat mencegah penyebaran CSVd yang sudah terdapat di Indonesia ke daerah-daerah sentra produksi krisan lainnya di Indonesia yang belurn terserang. Demiluan juga sebaliknya dapat mencegah peristiwa ditolaknya ekspor bibit krisan Indonesia karena sebelumnya telah dilakukan pemeriksaanldeteksi yang memadai melalui metode molekuler yang akan dihasilkan dalam penelitian ini.
Tujuan Penelitian
Penelitian ini bertujuan (1) mengungkap identitas molekuler CSVd isolat Indonesia melalui perunutan nukleotida sebagai landasan penyusunan metode deteksi, (2) eksplorasi metode deteksi CSVd berbasis molekuler yang optimal untuk penapisan bibit krisan bebas viroid, dan (3) menerapkan metode deteksi CSVd yang telah ditetapkan mtuk pengujian massal pada berbagai bahan tanaman krisan.
Manfaat Penelitian
(2) publikasi hasil penelitian yang diusulkan pada jurnal ilmiah nasional maupun
TINJAUAN PUSTAKA
Krisan (Dendrantherna grandijlora Kitam.)
Tanaman krisan merupakan tanaman h a s bunga yang sangat populer yang memiliki dua tipe siklus hidup, yaitu krisan semusim (hardy annual) dan krisan tahunan (hardy perennial). Tanaman h s a n dapat dijual baik dalam bentuk bunga potong maupun dalam bentuk tanaman pot.
Di daerah tropis, krisan umumnya dibudidayakan dan tumbuh baik di dataran medium sampai tinggi pada kisaran 650 hingga 1200 di atas permukaan laut (dpl) (Budiarto et al. 2006). Menurut Direktorat Jenderal Hortikultura (2008), daerah sentra produksi benih tanaman krisan dalam bentuk stek pucuk dilakukan di lokasi sentra pengembangan krisan di Kab. Cianjur dan Kab.Bandung (Jawa Barat), Kab. Sleman @I Yogyakarta) dan Kota Batu (Jawa Timur).
Krisan masuk ke Indonesia pada tahun 1800-an dan dikembangkan secara komersial sejak tahun 1940. Varietas krisan di Indonesia umumnya hbrida, berasal dari negeri Belanda, Amerika Serikat, dan Jepang. Krisan yang ditanam &
Indonesia terdiri atas (a) Krisan lokal, berasal dari luar negeri, tetapi telah lama dan beradaptasi di Indonesia, (b) Krisan introduksi (knsan hibrida), hidupnya berhari pendek dan dibudidayakan sebagai tanaman annual, dan (c) b s a n produk Indonesia yang diproduksi oleh Balai Penelitian Tanaman Hias (Marwoto et al. 1999).
Tanaman knsan banyak diminati oleh masyarakat di dunia, terutarna dari kalangan menengah sampai kalangan atas. Mereka memanfaatkan tanaman knsan baik untuk dipergunakan pada acara-acara pesta pernikahan, hiasan dalam rurnah, taman, maupun pada acara kematian bahkan peresmian sebuah gedung.
Penyakit pada Tanaman Krisan
infeksinya pada pertanaman krisan terbatas pada areal relatif kecil (Flores et al.
2004). Beberapa jenis patogen tersebut kemungkinan berada dalam tanaman yang sama dan menyebabkan kombinasi dalam gejala penyakit yang ditimbulkannya.
Chrysanthemum stunt viroid (CSVd)
Struktur Genom CSVd
CSVd merupakan spesies viroid dari genus Pospiviroid, famili
Pospiviroidae. Genom Pospiviroidae terdiri dari RNA utas tunggal dan bulat
melingkar, yang dapat bereplikasi sendiri dan tidak dapat dikode menjadi protein apapun (tidak ada OW). Genom Pospiviroidae terbagi menjadi 5 bagian, yaitu 1)
Terminal left (TL) domain, 2) Pathogenic (P) domain (merupakan daerah yang
mempengaruhi tingkat keparahan suatu penyakit yang ditimbulkannya, dan memiliki stabilitas terrnodinamik yang rendah), 3) Central (C) domain
(merupakan daerah yang memiliki urutan nukleotida yang relatif concerve diantara viroid), 4) Variable (V) domain (merupakan daerah yang bervariasi yang membedakan antara strain viroid yang satu dengan yang lainnya, dan 5) Terminal right (TR) domain (Steger & Riesner 2003).
Ciri Biomolekul CSVd
CSVd merupakan patogen yang terdiri dari asam nukleat (RNA) berbentuk sirkular single-stranded dengan panjang untai 354 atau 356 nukleotida dan memiliki berat molekul RNA yang rendah, yaitu 11 1-1 14 kDa (Diener & Lawson 1973; Nikahara et al., 1999 ). CSVd tidak memiliki mantel protein dan memiliki kekerabatan yang dekat dengan Potato spzndle tuber viroid (PSTVd) dan
Cucumber pale fiuit viroid (CPFVd). Ketiga viroid ini memiliki kisaran inang
dan viroid dapat bertahan dibekukan secara in vitro selama paling sedikit satu tahun. Pospiviroid memiliki struktur sekunder yang stabil secara termodinamika (Steger & Riesner 2003). Molekul viroid tidak akan rusak oleh sejurnlah Rnase
yang terdapat dalam tanaman.
Cara Penularan CSVd
CSVd dapat Qtularkan dar~ satu tanaman ke tanaman lainnya melalui berbagai cara, terutama ditularkan melalui perbanyakan, yaitu oleh stek yang diambil dari tanaman induk yang terinfeksi. Jika bahan tanaman h s a n yang terinfeksi dikirim dan masuk ke pembibitan, CSVd akan menyebar dengan cepat dari satu tanaman ke tanaman lainnya secara mekanik. Hal ini terutama dapat terjaQ melalui penggunaan peralatan gunting yang terkontaminasi. Selain itu, CSVd dapat juga ditularkan melalui Cuscuta sp. dan cairan perasan tanaman sakit. Percobaan di Polandia menunjukkan bahwa CSVd dapat juga ditularkan dengan polen akan tetapi tidak dapat ditularkan baik dengan serangga vektor maupun dengan biji (Diener 1979; Bouwen 2003). Penyakit dapat terjadi karena vektor, tetapi hanya sebagai kontaminan. Brierley & Smith (1949) menyebutkan bahwa CSVd dapat dengan mudah ditularkan melalui grafting. Penyebaran CSVd antar negara dapat terjadi dari transportasi tanaman dan stek krisan yang terinfeksi. Untuk mencegah terjadinya penularan dari tanaman sakit ke tanarnan sehat, gunting stek yang telah digunakan dapat diberi perlakuan dengan merendamnya dalam larutan 2% trisodium orthophosphate (TSP) atau di dalam larutan 2% formaldehyde selama 2-3 detik atau merendarn/mencelupkan tangan dalam larutan 2% TSP sebelum mengambil stek di lapangan (Bouwen-van Zaayen 2003).
Persebaran Geografi CSVd
(OEPP/EPPO 1999, Mumford 2001). Sampai saat ini belum dilaporkan adanya CSVd di Indonesia, akan tetapi gejala-gejala penyakit pada tanaman krisan yang mirip disebabkan oleh CSVd sudah banyak ditemukan di beberapa sentra produksi tanaman knsan di Indonesia (Pengamatan peneliti). Di dalam OEPPIEPPO (1978) disebutkan bahwa CSVd ialah termasuk patogen dalam kelompok A2 dalam daftar Karantina Tumbuhan.
Kisaran Inang CSVd
Menurut Singh (1983), beberapa tanaman yang rentan terhadap CSVd diketahui merupakan anggota dari famili Compositae, Cucurbitaceae, dan Solanaceae. Inang yang utama bagi CSVd adalah floris't chrysanthemum (Dendranthema mor~folium/Dendranthema indicum) (Defra UK-Plant Health 2000; Bouwen 2003). Petunia h i b r i h var. Surfinia dan Ageratum juga dilaporkan dapat diinfeksi secara alami (Defra UK-Plant Health 2000). Beberapa tanaman lainnya yang juga dilaporkan dapat terinfeksi oleh CSVd secara eksperimen ialah dari famili Asteraceae, seperti Achillea spp, Ambrosia trtpida, Anthemis tinctoria, Centaurea cyanus, Chrysanthemum spp yang lain, Dahlia pinnata, Echinacea purpurea, Emilia javanica, Gynura aurantiacu, Heliopsis pitcheriana, Liatris pycnostachya, Senecio spp, Tanacetum spp, Venidium fastuosum dan Zinnia elegans. Dari 39 spesies dan kultivar rentan yang ditemukan, hanya 7 spesies yang perkembangan gej alanya dapat dilihat (OEPPIEPPO 19 89).
Gejala Tanaman Terinfeksi CSVd
alami, dan semua tanaman krisan yang terinfeksi berbunga secara otonomi di bawah kondisi hari panjang menggunakan sistem night break.
Patogenesis CSVd
CSVd masuk ke dalam inangnyaherpenetrasi melalui luka dan merupakan parasit yang intraselular. Infeksi sistemik oleh viroid pada suatu tanaman inang terdiri dari beberapa proses: pertama, viroid masuk ke dalam sel inang diikuti oleh pergerakan viroid ke tempat replikasi intraselular (cell to cell movement); melakukan replikasi, dan progenil keturunan yang dihasilkan keluar dari tempat ini dan menyebar ke sel disekitarnya; dan akhirnya viroid bergerak dari organ ke organ melalui jaringan pembuluh (long distance movement) untuk menginfeksi tanaman secara keseluruhan (Ding & Owen 2003). Pergerakan viroid di dalam jaringan tanaman lebih cepat dibandingkan dengan pergerakan virus (Hull 2002). Kejadian utarna dari patogenesis mungkin melibatkan beberapa interaksi antara genom viroid dan genom inang yang berpengaruh terhadap ekspresi gen. Hal ini meliputi berfungsinya viroid secara langsung sebagai suatu elemen genetik, atau sebagai suatu signal atau elicitor dari suatu senyawa sekunder seperti etilen, asam salisilat, atau asam gentisic. Senyawa ini dalam suatu rangkaian reaksi mengubah komposisi dan pengaturan jalur matabolisme. Contoh metabolit sekunder yang mungkin dalam proses ini dapat digambarkan dari kemunculan pathogenesis- related (PR) protein, modifikasi enzim spesifik, dan ketidakseimbangan hormon yang menyebabkan perubahan dalam komposisi dan perkembangan jaringan. Kemunculan PR protein yang menyertai infeksi viroid meningkatkan aktivitas enzim termasuk enzim alkaline cysteine proteinase, chitinuse, dan J 1,3-
kepada suatu penyimpangan perkembangan daripada respon spesifik terhadap viroid (Hull 2002).
Pengendalian CSVd
Pengendalian penyakit yang disebabkan CSVd sangat sulit dilakukan. Hal ini disebabkan tingginya tingkat penularan di lapangan, periode laten yang lama, dan adanya perbanyakan vegetatif krisan. Sebagai konsekuensinya, pengendalian terutama terdiri dari usaha untuk mencegah penyebaran (Lawson 1987). Tindakan pengendalian yang dapat dilakukan untuk mencegah terjadinya infeksi oleh CSVd adalah dengan cara (1) mengendalikan serangga setiap waktu, (2) tanaman induk untuk perbanyakan disimpan seluruhnya di dalam rumah kaca dan dipelihara dari serangan serangga apapun (bebas dari serangga), (3) untuk perbanyakan digunakan tanah dan media tanam lain yang steril, dan (4) alat-alat yang digunakan untuk menggunting tanaman hams steril (Diener 1979). Dengan kata lain pengendalian penyakit yang disebabkan oleh viroid didasarkan pada penggunaan bahan perbanyakan yang bebas viroid, membuang dan menghancurkan tumbuhan yang terinfeksi viroid, dan mencuci tangan dan mensterilkan alat-alat setelah menangani tanaman yang terinfeksi viroid, sebelum pindah ke tanaman sehat (Agrios 2005). Disamping itu tanaman krisan yang dijaQkan tanarnan induk (stoch'mother plant) tidak boleh Qgunakan lebih dari tiga generasi (Defra UK-Plant-Healt 2000).
Pembebasan CSVd
perlakuan tanaman pada suhu dingin, yaitu pada suhu 5 "C, paling sedikit selama 4 bulan, diikuti dengan kultur meristem. Paludan (1985) menyatakan bahwa ia mendapatkan 67% tanaman bebas CSVd dengan aplikasi kombinasi perlakuan dingin dan kultur meristem ini. Menurut Hosokawa (2004), pembebasan virus dengan metode perbanyakan tunas dari primorha daun tunas meristem apikal dapat menghasilkan laju tanaman bebas virus sekitar 14%. Kultur meristem dapat menghasilkan tanaman bebas CSVd karena pada bagian meristem ini terdapat suatu daerah yang diketahui terbebas dari infeksi viroid ataupun virus. Dalam perkembangannya dalam jaringan tanaman, viroid atau virus tidak dapat mencapai daerah ini. Namun dalam kultur meristem ini, bagian tanaman yang dapat dikulturkan berukuran sangat kecil sekali. Sehingga perlu keahlian yang cukup di bidang ini
Deteksi CSVd
Pengujian gejala CSVd secara visual pada tanaman yang terinfeksi dapat dilihat hanya dalam periode waktu tertentu dalam satu tahun, ketika gejala muncul, karena kemunculan gejala bergantung pada kultivar tanaman, keadaan lingkungan, dan pada keahlian dari petanitpenanam atau inspektor. Ketiadaan gejala bukan merupakan bukti bahwa infeksi CSVd tidak terjadi. Metode deteksi yang biasa digunakan untuik virus, yaitu metode serologi, tidak dapat digunakan untuk mendeteksi viroid. Hal ini disebabkan metode serologi hanya dapat digunakan untuk mendeteksi protein, sedangkan viroid itu sendiri tidak memiliki mantel protein seperti halnya virus (Bos 1990).
Sekarang telah diketahui bahwa untuk mendeteksi keberadaan CSVd dalam tanaman dapat dilakukan dengan menggunakan beberapa metode. Ada tiga metode utama yang dapat dilakukan untuk mendeteksi CSVd, yaitu 1) Return
polyacrylamide gel electropl~oresis (return PAGE) ( OEPPt EPPO 2002), 2) Dot-
blot hybridization assay (Candrese et al. 1988), dan 3) Reverse transcrption-
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Institut Pertanian Bogor, Bogor, dan rumah kaca serta Laboratorium Virologi, Balai Penelitian Tanaman Hias (Balithi), Segunung, Cianjur, Jawa Barat, dari Mei 2007 sampai dengan Juni 2008.
Metode
Penelitian ini meliputi delapan kegiatan, yaitu (1) pengambilan tanaman contoh dari lapangan, (2) persiapan media tanam dan penanaman tanaman indikator, (3) ekstraksi RNA total, (4) amplifikasi dengan RT-PCR dan perunutan nukleotida CSVd, (5) uji kisaran inang CSVd, (6) pembuatan pelacak non- radioaktif, (7) deteksi dengan return-PAGE, dan (8) deteksi dengan teknik tissue
blot hybridization.
Pengambilan Tanaman Contoh dari Lapangan
Tanaman krisan yang diduga terserang CSVd (dengan melihat gejala yang muncul) Qambil dan kebun percobaan Balithi (Segunung), pertanaman h s a n petani di Bali dan Medan serta perusahaan swasta di Cianjur. Tanaman contoh ini disimpan dan dipelihara di rumah kaca Balithi, Segunung atau disimpan dalam ruang penylmpanan -80 "C (untuk sampel dari Medan dan Bali).
Persiapan Tanaman indikator
Media tanam disiapkan dari campuran tanah dan pupuk kandang (1 : 1 vlv) yang telah dipasteurisasikan (80 "C, 3 jam). Media tanam ini dimasukkan ke dalam pot plastik yang berdiameter 15 cm, yang hpersiapkan untuk menanam biji tanaman indikator untuk uji kisaran inang.
Pot pesemaian disiinpan di dalam rumah kaca hingga tanaman siap dipindahkan ke dalam pot-pot individu yang berisi media tanam, dan tanaman siap digunakan
untuk
uji kisaran inang CSVd.Ekstraksi RNA Total
RNA total diekstraksi dari daun tanaman krisan menggunakan Rneasy Plant Mini Kits (Qiagen, Germany). Prosedur ekstraksi sesuai dengan instruksi perusahaan penyedia kit. Sebanyak 100 mg daun tanaman yang diduga terinfeksi CSVd digerus dalam nitrogen cair. Serbuk hasil gerusan tersebut kemudian ditambah 450 pl bufer lisis (bufer lisis mengandung 1% merkaptoetanol), kemudian dimasukkan ke dalam tabung Eppendorf dan dipanaskan (dalam penangas air) 56 "C selama 10 menit. Selanjutnya dimasukkan ke dalarn spin
column ungu dan disentrifugasi pada kecepatan 13.000 rprn selama 2 menit pada
suhu ruang. Supernatan diambil dan ditambahkan 0,5 volume etanol 96%, selanjutnya dihomogenisasi dengan ppeting. Campuran dipindahkan ke spin
column warna merah muda dan disentrifugasi pada 13.000 rprn selama 1 menit.
Spin column dipindahkan ke tabung yang baru kemudian ditambahkan 700 pl
bufer RW I (Qiagen, Germany) dan disentrifugasi pada 10.000 rprn selama 1 menit. Cairan pada spin column dibuang, ditambahkan 500 pl bufer WE (Qiagen, Germany), kemuhan disentrifugasi 10.000 rprn selama 1 menit (pencucian dengan W E dilakukan 2 kali dengan lama sentrifugasi yang kedua 2 menit). Spin
column dipindahkan ke collection tube baru dan disentrifugasi pada 13.000 rprn
Amplifikasi dan Perunutan Nukleotida CSVd
Amplifikasi seluruh genom CSVd dilakukan dengan tekmk reverse
transcription-polymerase chain reactzon (RT-PCR) menggunakan pasangan
primer 5'-CAACTGAAGCTTCAACGCCTT-3' dan 5'-AGGATTACTCCTGTC TCGCA-3' yang dilaporkan dapat menghasilkan produk PCR dengan ukuran 250 bp (Hosokawa et al. 2004). Amplifikasi dilakukan pada sebuah Gene Amp PCR System 9700 Thermocycler.
Reaksi RT sebanyak 25 p1 terlri dari 5 pl cetakan RNA; 5 pl dNTP 10
mM; 2,5 pl bufer RT lox ( l x = 150 rnM NaCl, 50 rnM Tris-HC1 [pH 7,6], 0,l mM EDTA, 1 mM dithiothreitol, 0,1% NP-40 dan 50% glycerol); 1 p1 enzim
reverse transcrlptase Moloney Murine Leukemia Virus (MmuLV) (New England
BioLabs); 1 pl Recomblnant Rnasin Ribonuclease Inhibitor (Promega, Madison,
WI, USA); 1,5 p1 d(T) 10 pM; dan 9 pl dH20. Reaksi RT dilakukan pada kondisi 25 "C selama 3 menit, 37 "C selama 90 menit, diikuti dengan inaktivasi pada 70 "C selama 15 menit.
Reaksi PCR sebanyak 25 p1 terdiri dari 1 p1 primer Forward 10 pM dan 1 pl primer Reverse 10 pM; 2,5 pl bufer PCR 1 Ox ( l x = 10 mM KC1,20 mM Tris-
HCl [pH 8,8 pada 25"C], 10 mM (r\TH4)2s04, 2
m M
MgSO,, dan 0,1% Triton X-100); 0,5 p1 dNTP 10 mM; 0,2 p1 tag DNA polimerase 5 unit/pl (New England BioLabs); dan 3 pl cetakan (cDNA). Amplifikasi cDNA dilakukan sebanyak 35 siklus yang melalui tiga tahapan yaitu pemisahan utas DNA (denaturasi) pada 96°C selama 30 detik, penempelan primer (annealing) pada 61 "C selarna 45 detik, dan sintesis DNA (extention) pada 72°C selama 1 menit. Khusus untuk siklus terakhir ditarnbah tahapan sintesa selarna 5 menit, kemudian siklus diakhiri pada suhu 4°C (Hosokawa et al. 2006).
Produk PCR yang telah murni (terbebas dari komponen lain) ini langsung dirunut menggunakan Direct DNA Sequence Kit (Takhara Inc., Japan) dengan
DNA Sequencer (ABI, Australia). Proses perunutan ini dilakukan oleh PT.
Charoen Pokhpand, Jakarta.
Hasil runutan dianalisa menggunakan program Bio Edit. Urutan nukleotida yang diperoleh digunakan untuk menganalisa tingkat kesamaan genetiknya dengan isolat CSVd yang berada di belahan dunia lain melalui situs www.ebi.ac.uk dan Clustal W. Filogenetik CSVd isolat Cipanas dianalisa dengan menggunakan program Clustal X dan TreeView X.
Uji Kisaran Inang CSVd
Sebelum dilakukan uji kisaran inang, terlebih dahulu dilakukan deteksi dengan metode double anti sandivich-enzyme linked immuno-sorbent assay (DAS- ELISA) menggunakan antiserum Cucumber mosaic virus (CMV) dan
Chrysanthemum virus B (CVB) terhadap tanaman krisan yang sudah diketahui
terinfeksi CSVd berdasarkan diagnosis sebelumnya menggunakan metode RT- PCR. Dalam ha1 ini hanya dgunakan dua macam antiserum, karena kedua macam virus tersebut merupakan jenis virus yang umum dijumpai menginfeksi tanaman krisan di Indonesia. Tanaman yang diketahui hanya terinfeksi oleh CSVd digunakan untuk uji kisaran inang.
Tanaman indikator yang digunakan untuk uji kisaran inang adalah
Chenopodium amaranticolor, C. quinoa, Gynura aurantiacu, Senecio cruentus,
Zinnia elegan, Petunia sp, Dahlia sp, Chrysanthemum spp. , Ageratum conizozdes,
D. grandzjlora F1 Hybrid dan D. grandzjlora cv Zerman Flag.
Inokulasi pada tanaman yang sama dilakukan sebanyak 3 kali dengan selang waktu satu minggu.
Parameter yang diamati meliputi gejala yang muncul dan masa inkubasi, serta keberadaan CSVd dalam tanaman uji. Keberadaan CSVd dalam tanaman uji dideteksi dengan teknik RT-PCR.
Deteksi dengan Return Polyacrylamide Gel Electrophoresis (Return-PAGE)
Deteksi dengan return-PAGE dilakukan mengikuti prosedur EPPO 2002 yang dimodifi kasi. RNA total hasil ekstraksi, divisualisasikan dengan elektroforesis gel akrilamid 5%, dan diwarnai dengan perak nitrat.
Preparasi sampel. RNA total disiapkan dengan cara menggerus 0,3 g daun pucuk tanarnan krisan sakit dalam mortar dingin yang berisi 450 p1 bufer ekstraksi, 0,5% 2-Mercaptoethanol (ME) dan 19 mg polyvinilpirolidon (PVP). Hasil gerusan dimasukkan ke dalam tabung Eppendorf 1,5 ml yang berisi 750 p1 phenol-chloroform-isoamylalcohol (PCI) (25:24:1) dan divorteks 90 detik. Selanjutnya tabung disentrifugasi pada kecepatan 10.000 rpm selama 10 menit pada suhu 4 "C. Supernatan yang dihasilkan dipipet sebanyak 400 p1 dan dimasukkan ke dalam tabung Eppendorf baru yang berisi 40 p13M natrium asetat. Tabung divorteks kemudian ditambahkan ke dalamnya etanol dingin 96% dan diinkubasi pada suhu -20 "C paling sedilut selama satu jam. Setelah itu, tabung disentrifugasi kembali seperti tahap sebelumnya. Supernatan yang dihasilkan dibuang, dan pelet dikeringanginkan sebelum diresuspensi dalam 30 pl DEPC
treated water yang mengandung 0,05% xylenecyanol (XC). RNA yang dihasilkan disimpan pada suhu -20 "C sampai akan digunakan pada hari berikutnya.
Pembuatan gel. Poliakrilamid gel disiapkan (dicetak) pada lembaran kaca (12,5 cm x 18,5 cm). Gel dibuat dengan mencarnpur 5% poliakrilamid dari stok 40% (37,5:1) dengan 3 ml TBE lox (890 mM Tris pH 8,3,890 mM boric acid, 20
Elektroforesis gel. Gel yang sudah berpolimerisasi di dalarn cetakan kaca, diletakkan pada dasar tangki secara horizontal (alas keramik). Wick (1 8,5 x 18,5 cm, tebal 1,5 mm) yang telah direndam dalam TBE 0,5 x, diletakkan menutup kedua ujung gel selebar 1-1,5 cm. Sampel dimasukkan dengan pipet sebanyak 30
p1. Disertakan juga kontrol positif dan negatif (tanaman sehat). Gel dan wick ditutup dengan kaca (ukuran 18,5 x 26 cm, tebal3 mm). Kedua ujung wick yang lainnya masing-masing menyentuh bufer 0,5 x TBE yang di dalamnya terdapat elektroda negatif atau positif, kutub negatif dekat sampel dan kutub positif jauh dari sampel. Pada kondisi tidak terdenaturasi, suhu dipertahankan pada k 15 "C. Power supply dijalankan pada 20 mA arus konstan, selama 6 menit. Kemudian arus dinaikkan menjadi 40 rnA, selama 90 menit. Atau jika posisi xylenecyanol sudah berada pada posisi 1 cm dari ujung gel yang tertutup wick. Power supply
dimatikan, sementara air yang berada di bawah gel dipanaskan hingga mencapai 60 "C . Running dilanjutkan dengan membalikkan polaritas elektroda. Arus diatur sebesar 2 mA selama 8 menit, kemudian dinaikkan sampai 50 mA selama 25 sld 30 menit. Atau posisi pita xylenecyanol sudah mencapai sumbu (wick) yang berlawanan. Gel dilepas dari tangki, dan dlwarnai dengan perak nitrat.
Pembuatan Pelacak (Probe) DNA Non-Radioaktif
Pembuatan pelacak DNA non-radiokatif dilakukan melalui teknik PCR (Dietzgen 1997). Fragrnen cDNA CSVd yang sudah diklon ke dalam plasmid yang diperoleh dari Laboratorium Virologi, Departemen Proteksi Tanaman, IPB, digunakan sebagai cetakan untuk pembuatan pelacak DNA menggunakan Random Primed Lubeling with DIG-High Prime (Boehringer, Germany).
Ke dalam tabung PCR (0,6 ml) dimasukkan 10 p1 lox bufer PCR (15 mM
MgCI2 ), 5 pl plasmid cetakan DNA, 10 pl PCR DIG labelrng mix, dan 72 p1 Rnase/"Dnase free water. Bahan-bahan dicampurkan kemudian didenaturasi dengan cara dipanaskan pada suhu 95 "C selama 10 menit. Campuran yang sudah didenaturasi dengan segera disimpan dalam wadah berisi pecahan es. Beberapa bahan lainnya, yaitu 1 pl primer F (S7GGACTTACTTGTGGTTCCTGTG3'), 1 pl primer R
(S'AGGGAACAAAACTAAGCTTCCA3'),
dan 1 p1 Tag DNA polimerase, kemudian dimasukkan ke dalam campuran dalam tabung PCR yangsudah didenaturasi tersebut. Setelah tercampur dengan baik dilakukan PCR dengan kondisi denaturasi pada 96°C selama 30 detik, penempelan primer (annealing) pada 61 "C selama 45 detik, dan sintesis DNA pada 72°C selama 1 menit. Khusus untuk siklus terakhir ditambah tahapan sintesis selama 5 menit, kemudian siklus diakhiri pada suhu 4°C (Hosokawa et al. 2006).
Deteksi CSVd pada Bibit Krisan Melalui Tissue Blot Hybridization
Persiapan Mernbran Nylon dan Penernpelan Jaringan Tanarnan.
Membran nylon yang akan digunakan, dipersiapkan terlebih dahulu dengan membuat lajur dan kolom dengan pensil lunak pada perrnukaannya, kemudian diberi perlakuan dengan cara mencelupkannya selama beberapa detik ke dalam air bebas RNase (DEPC treated water), selanjutnya direndam selama 3 menit dalam larutan 20x SSC (175,3 g NaC1; 88,2 g sodium sitrat; 800 ml H20; dan 10 N NaOH). Membran nylon dikeringkan di atas kertas saring, dan siap untuk dipergunakan atau dapat disimpan dalam -20 "C selama beberapa waktu.
Tangkai daun pucuk bibit krisan dipotong kemudian segera Qtempelkan selama 1 menit pada membran nitrosellulose. Sebagai kontrol positif digunakan klon CSVd yang didenaturasi pada suhu 100 "C selama 10 menit, dan sebagai kontrol negatif digunakan bufer AMES dan tanaman sehat (berdasarkan RT-PCR). Setelah penempelan jaringan tanaman selesai dilakukan, membran dikeringanginkan di atas kertas saring, selanjutnya dilakukan fiksasi (crosslink) asam nukleat dengan menggunakan UV transzlumlnator selama 3 menit. Fiksasi ini dilakukan agar asam nukleat melekat dengan kuat pada membran nylon (terimrnobilisasi). Membran dapat langsung digunakan dalam deteksi atau dapat disimpan pada suhu ruang dalam gelap (ditutup aluminium foil) sampai akan digunakan.
PreHibridisasi. Membran yang sudah dipersiapkan dan sudah mengandung cairan tanaman sampel, ditempatkan dalam wadah plastik yang berisi larutan prehibridisasi (10 ml larutan Dlg Easy Hyb (Boehringer, Germany) untuk setiap wadah plastik) yang sudah dipanaskan sebelumnya pada suhu 50 "C. Prehibridisasi dilakukan dalarn oven dengan suhu 50 OC selama 60 menit. Sementara itu, pelacak DNA (20 p1/200 pl Dig Easy
Hyb)
didenaturasi pada suhu 100°C selama 10 menit dan segera dimasukkan ke dalam wadah berisi es. Setelah selesai, larutan prehibridisasi dibuang dan dimasukkan larutan hbridisasi.hibridisasi bisa disimpan dalam tabung Eppendorf 2 ml pada -20 "C untuk dapat dipergunakan kembali. Membran dicuci 3 kali masing-masing selama 5 menit pada suhu ruang dengan 50 ml larutan 2x SSC yang mengandung 1% SDS. Pencucian dilakukan dalam wadah plastik yang bersih. Membran dicuci kembali 2 x 20 menit pada suhu 68 "C (dalam penangas air ) dengan larutan 0,2x SSC yang mengandung 0,1% SDS. Membran diangkat dan diletakkan di antara kertas saring, disimpan pada suhu ruang (posthibridisasi).
Deteksi dengan kolorimetri menggunakan NBTIBCIP. Setelah posthibridisasi, membran dipindahkan ke tempat yang baru dan dicuci dengan menggunakan l x bufer pencuci (washing b g e r ) selama 1-2 menit (dlgoyang). Selanjutnya, membran di blok dengan larutan blocking (2 ml blocking solution l x
+
18 ml l x maleic acid buffer) dan diinkubasi selama 60 menit sambil digoyang. Kemudian ditambahkan 4 yl anti DIG-alkaline phosphatase Fab langsung dalam larutan blocking (pengenceran akhir 1 : 5.000) dan linkubasi selama 30 menit. Larutan blocking dibuang dan membran dicuci 2x dengan larutan pencuci masing- masing selama 15 menit. Larutan pencuci dibuang dan membran dikondisikan dalam 10 ml bufer deteksi selama 2-5 menit. Membran dipindahkan ke tempat baru, ditambahkan substrat yang terdiri dari 45 y1 larutan NBT, dan 35 y1 X-phosphate (5-bromo-4-chloro-3 -indolyl phosphate (BCP)) dalam 10 ml I x
ELASIL DAN PEMBAHASAN
Hasil Penelitian
Gejala Tanaman Krisan Terinfeksi CSVd di Lapangan
Berdasarkan hasil pengamatan pada saat pengambilan tanaman sampel di lapangan, diketahui bahwa gejala kerdil pada tanaman krisan ltemui hampir di seluruh lokasi tempat dibudidayakannya tanaman tersebut. Seperti terlihat pada Gambar 1.
Gambar l a menunjukkan kondisi pertanaman D. grandflora cv Puspita Kencana (A) dan cv Puspita Nusantara (B) yang ditanam di salah satu rumah kaca Balithi, Segunung, Cianjur, Jawa Barat. Dari kedua jenis tanaman krisan yang ditanam tersebut, cv Puspita Kencana menunjukkan pertumbuhan yang tidak normal, sebagian besar pertumbuhannya kerdil, daun-daunnya benvarna hijau pucat dan tipis. Menurut peneliti di Balithi, tanaman D. grandflora cv Puspita Kencana merupakan tanaman krisan yang sangat rentan terhadap penyakit yang disebabkan oleh CSVd Insiden penyakit yang diduga disebabkan oleh CSVd ini pemah terjadi pada tanaman D. grandrJlora cv Puspita Kencana yang ditanam oleh salah satu penangkar bibit yang terdapat di daerah Cipanas. Insiden penyakit ini menyebabkan terjadinya pertumbuhan yang sangat kerdil sehngga tanaman mengalami kehancuran. Sejak saat itu, tidak dilakukan lagi perbanyakan terhadap jenis kultivar Puspita Kencana.
Selain pada cv Puspita Kencana, gejala kerdil juga ditemukan pada pertanaman krisan jenis kultivar lainnya (jenis kultivar tidak diketahui) yang ditanam di nunah kasa lainnya di Balithi (Gambar l b dan lc). Perturnbuhan tanaman yang diduga terinfeksi oleh CSVd, tingginya hanya mencapai sepertiga dari tinggi tanaman yang normal.
Gejala kerdil pada tanaman krisan ada kalanya disertai dengan terjadinya penguningan pada daun dan dam-daunnya menjadi lebih tipis. Gejala ini ditemukan pada sampel tanaman yang berasal dari salah satu penangkar bibit l
Gambar 1 Gejala pada tanaman krisan yang diduga terinfeksi oleh CSVd. a) Gejala kerdil pada tanaman D. grandrflora cv Puspita Kencana (A)
dibandingkan tanaman yang normal cv Puspita Nusantara (B) yang ditanam di salah satu rumah kaca Balai Penelitian Tanaman Hias, Segunung, Jawa Barat. b&c) Gejala kerdil pada jenis kultivar h s a n lainnya (jenis kultivar tidak diketahui), tinggi tanaman hanya mencapai 1/3 dari tinggi tanarnan yang normal. d) Gejala kerdil dan penguningan pada daun serta penipisan daun pada tanaman krisan pot.
Gejala kuning pada daun dan kerdil pada tanaman h s a n yang terinfeksi CSVd kemun&nan disebabkan terganggunya metabolisme tanaman, sehngga pembentukan klorofil terganggu. Sebagai akibatnya, perkembangan tanaman terhambat, karena hasil fotosintesis tidak optimal.
Gambar 2 Gejala tanaman krisan terinfeksi CSVd berdasarkan analisa dengan RT-PCR. A) Pertumbuhannya kerdil, namun tidak menunjukkan adanya gejala pada dam, B) ruas-ruas batang lebih pendek.
infeksi oleh virus lain yang biasa mengrnfeksi tanaman krisan. Sebagaimana yang diungkapkan oleh Murnford (2001) bahwa gejala pengerutan daun pada tanaman knsan yang terinfeksi CSVd disebabkan adanya kombinasi infeksi dengan
Chrysanthemun Virus B (CVB).
Menurut Handley & Horst (1988)' gejala penyakit yang disebabkan oleh CSVd dan jurnlah RNA viroid yang dapat diekstraksi dipengaruhi oleh faktor lingkungan, seperti suhu, intensitas cahaya, dan fotoperiod, baik secara individu maupun dalam kombinasi. Ekspresi gejala paling tinggi terjadi antara suhu 26 clan 29 "C, tetapi konsentrasi viroid maksimurn terjadi antara suhu 22 dan 26 "C pada saat intensitas cahaya dan fotoperiod tetap.
Amplifikasi Nukleotida CSVd Melalui RT-PCR
Hasil penelitian menunjukkan bahwa primer Forward (F) (5'-
[image:41.547.126.449.99.279.2]Gambar 3 Fragmen DNA beberapa isolat CSVd hasil amplifikasi (PCR) menggunakan primer F dan primer R pada gel agarose 1,5%: 1) DNA marker 100 bp, 2) Kontrol negatif (tanaman sehat), 3) Isolat Bali 3 , 4) Isolat Bali 6, 5) Isolat Medan A, 6) Isolat Medan
By
7) Isolat Medan C, dan 8) Isolat Cipanas.sesuai dengan hasil penelitian Hosokawa et al, 2004, yang menunjukkan bahwa kedua primer tersebut dapat mengamplifikasi cDNA CSVd pada ukuran 250 bp.
Pada isolat Bali 3 dan Cipanas menunjukkan adanya pita DNA yang cukup jelas pada ukuran basa 250 bp, sedangkan pada isolat Bali 6, Medan A dan Medan C, pita DNA yang ditunjukkan sangat lemah (kurang jelas). Ukuran jelas tidaknya pita DNA yang muncul menginhkasikan bahwa konsentrasi viroid dalam tanaman krisan berbeda-beda. Pita DNA yang sangat terang menunjukkan tingginya konsentrasi CSVd dalam tanarnan uji, dan sebaliknya. Ketidakrnunculan pita DNA pada posisi basa 250 bp menunjukkan bahwa tanarnan uji tidak terinfeksi oleh CSVd, seperti yang ditunjukkan oleh isolat Medan B dan kontrol negatif (tanaman sehat).
Garnbar 4 Fragmen DNA CSVd isolat Cipanas hasil amplifikasi (PCR) menggunakan primer F dan primer R pada gel agarose 1'5%: (1)
annealing 60 OC, (2) annealing 61 OC, (3&4) annealing 62 OC, ( M )
DNA marker 100 bp
Perunutan Nukleotida CSVd
Perunutan nukleotida CSVd dilakukan menggunakan fiagrnen DNA produk PCR hasil amplifikasi menggunakan primer forward 5 ' -
CAACTGAAGCTTCAACGCCTT-3' dan primer reverse 5'-AGGATTACTCCT GTCTCGCA-3'. Dalam penelitian ini hanya satu sampel produk PCR yang digunakan untuk perunutan, yaitu produk PCR dari sampel isolat Cipanas. Proses perunutan dilakukan oleh PT. Charoen Pokhpand, Jakarta.
Berdasarkan hasil perunutan menggunakan mesin perunut asam nukleat dan analisa menggunakan program Bio Edit diperoleh data urutan nukleotida CSVd isolat Cipanas yaitu 250 basa. Urutan nukleotida CSVd isolat Cipanas tersebut adalah sebagai berikut :
CTTAGGATTA CTCCTGTCTC GCAGGAGTGG GGTCCTAAGC 1-40 CTCATTCGAT TGCGCGAATC TCGTCGTGCA CTTCCTCCAG 4 1-80 GGATTTCCCC GGGGGATACC CTGTAAGGAA CTTCTTCGCC 8 1
-
120 TCATTTCTTT TTCTTGTAAA GCAGCAGGGT TCAGGAGTGC 121 -1 60 ACCACAGGAACCACAAGTAAGTCCCGAGGGAACAAAACTA 16 1-200 AGGTTCCACGGGCTTACTCC CTAGCCCAGG TAGGCTAAAG 201-240Urutan nukleotida tersebut merupakan panjang bagian genom CSVd yang teramplifikasi oleh primer forward 5'-CAACTGAAGCTTCAACGCCTT-3' dan primer reverse 5'-AGGATTACTCCTGTCTCGCA-3' yang mengapit nukleotida sekitar 250 bp. Urutan nukleotida ini digunakan untuk menganalisa tingkat kesamaan genetiknya dengan isolat CSVd yang berada di belahan dunia lain melalui situs www.ebi.ac.uk dan Clustal W.
Hasil analisa menunjukkan bahwa genom CSVd isolat Cipanas yang teramplifikasi oleh kedua primer di atas memiliki kesamaan genetik 99% dengan isolat K1 (Dendranthema grandzjlorum) dari Korea, 98% dengan beberapa genom CSVd yang terdapat di Gene Bank diantaranya adalah dengan nomor asesi AB279770 (Chrysanthemum yoshinaganthum) dari Jepang, AB05 5974 (D.
grandzjlora) dari Jepang, AB255880 (isolat Dahlia tipe 2), DQ094298 (Vinca mayorlisolat CSVd Vm), AJ585258 (isolat India [Chrysanthemum sp]), U82445 (isolat petunia). Dari beberapa nomor asesi tersebut diketahui bahwa lima nomor asesi merupakan genom CSVd isolat Jepang, dan yang lainnya berasal dari isolat Kanada, Korea, India dan Amerika Serikat (Lampiran 1).
Berdasarkan hasil analisa tersebut dapat diketahui bahwa CSVd isolat Indonesia (dalam ha1 ini isolat Cipanas) memilih genom yang sangat mirip dengan genom-genom CSVd yang berasal negara-negara yang sudah disebutkan di atas. Hal ini mengindikasikan bahwa CSVd isolat Indonesia kemungkinan merupakan kontarninan dari CSVd yang berasal dari isolat yang berada di belahan dunia lainnya, seperti Jepang atau negara pengekspor krisan lainnya, yang kemungkinan menyebar dan terbawa ke Indonesia bersamaan dengan bibit tanaman krisan impor. Menurut Sano et al. (2003), penyakit kerdil pada tanaman krisan yang disebabkan oleh CSVd merupakan salah satu penyakit viroid paling penting di Jepang dan telah menyebar ke harnpir semua lahan produksi krisan terutarna melalui penyebaran stek yang terkontaminasi atau stok.
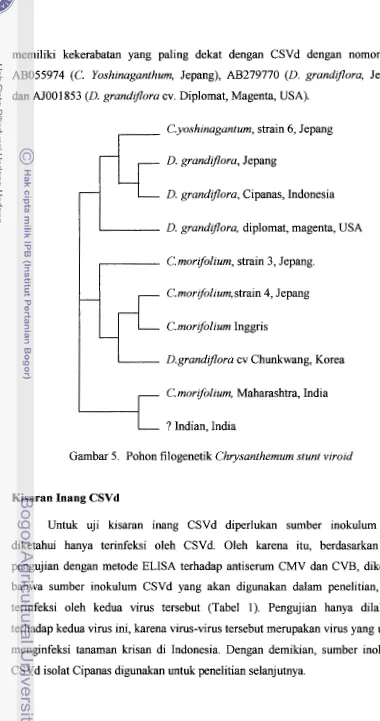
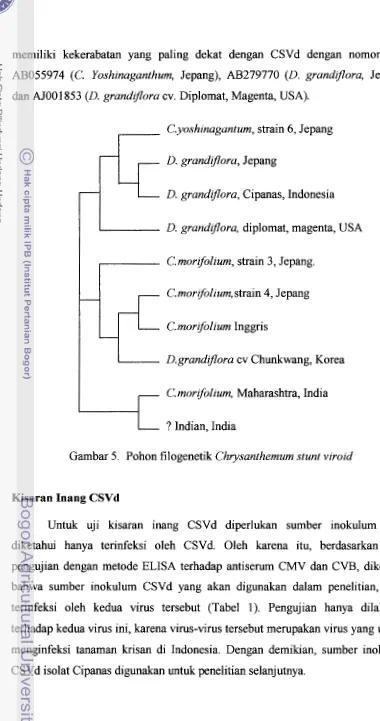
memiliki kekerabatan yang paling dekat dengan CSVd dengan nomor asesi AB055974 (C. Yoshinaganthum, Jepang), AB279770 (D. grandflora, Jepang), dan AJOO 1853 (D. grandflora cv. Diplomat, Magenta, USA).
C.yoshinagantum, strain 6, Jepang
D. grundlflora, Jepang
D. grandzflora, Cipanas, Indonesia
D. grandflora, diplomat, magenta, USA
C'. morifolium, strain 3, Jepang.
C. morrfolium, strain 4, Jepang
C. morifolium Inggris
D.grandzflora cv Chunkwang, Korea
C'.morifolium, Maharashtra, India
? Indian, India
Gambar 5. Pohon filogenetik Chrysanthemum stunt viroid
Kisaran Inang CSVd
[image:45.541.60.440.40.761.2]Tabel 1 Hasil pengujian serologi dengan t e h k ELISA pada sumber inokulum CSVd (isolat Cipanas) terhadap antiserum CVB dan CMV
No Sumber inokulum CVB CMV
Absorban Reaksi Absorban Reaksi 1 Kontrol positif 0.29
+
0.12+
2 Kontrol negatif 0.02-
0.00-
3 Isolat Cipanas 0.03-
0.00-
Berdasarkan pengamatan terhadap hasil pengujian kisaran inang pada sebelas jenis tanaman indikator melalui teknik inokulasi mekanis menggunakan bufer phosphat, dapat diketahui bahwa tidak ditemukan adanya gejala penyakit CSVd pada hampir semua tanaman indikator uji, kecuali pada D. grandrflora F1 hibrid dan Senecio cruentus. Pada D. grundzflora F1 hibrid terdapat gejala yang muncul berupa penguningan pada daun, sedangkan pada S. cruentus terjadi penghambatan terhadap pertumbuhan tanaman (Garnbar 6). Tanaman menjadi kerdil dan ukuran daun menjadi lebih kecil. Ekspresi gejala pada D. grandflora
F1 hibrid terjad pada 2 bulan setelah inokulasi (bsi), sedangkan pada S. cruentus
terjadi pada 5 bsi (Tabel 2).
Tabel 2 Analisa uji kisaran inang CSVd pada beberapa tanaman indlkator
Tanaman Indikator Chenopodium amaranticolor C. quinoa Gynura aurantiaca Chrysunthemm spp. Ageratum conizoides Zinnia elegan Senecio cruentus Petunia sp Dahlia sp
D. grandflora F1 Hybrid
D. grandrflora cv Zerrnan
Frekuensi Infeksi CSVd *
013 013 013 013 0/3 0/3 313 313 013 313 0/3 Frekuensi Tanaman 013 013 0/3 013 013 313 (k) 013 013 313 (kl)
013
Masa In ku basi
-
5 bulan-
2 bulan
-
-- Fla -
[image:46.545.42.481.82.745.2]Gambar 6 Hasil inokulasi CSVd pada tanaman indikator. A&D) Senecio cruentus & Petunia hibrida (tanpa inokulasi), B&E) gejala laten pada S. cruentus dan Petunia hibrida yang diinokulasi pada 2 bsi, C) gejala kerdil dan penyusutan ukuran daun S. cruentus pada 5 bsi, F) penguningan pada daun D. grandzjlora F 1 hibrid pada 2 bsi
Gambar 7 Fragrnen DNA CSVd pada beberapa sampel tanaman indikator hasil uji kisaran inang. M) Marker DNA Ladder 100 bp, 1)
D.
grandfloracv Jerrnan Flag, 2) D. grandzflora F1 Hibrid, 3) Petunia hibrida, 4)
Dahlia sp, 5 ) Senecio cruentus, dan 6 ) Kontrol negatif (S. cruentus
tanpa inokulasi).
Namun demiluan, setelah dilakukan diagnosis menggunakan teknik RT- PCR diketahui bahwa dari sebelas jenis tanaman dluji, terdapat tiga jenis tanaman yang menunjukkan reaksi positif terhadap CSVd, yaitu S. cruentus, P. hibrida dan
[image:47.545.68.468.63.780.2]pada posisi 250 bp (Gambar 7) . Interaksi antara gejala yang muncul dan hasil deteksi RT-PCR ditampilkan pada Tabel 2.
Dari Tabel 2 dapat diketahui bahwa reaksi positif Petunia sp terhadap CSVd tidak disertai dengan munculnya gejala pada tanaman (symptomless). Hal ini menunjukkan bahwa gejala akibat infeksi CSVd pada Petunia bersifat laten. Fenomena ini didukung oleh pernyataan yang dikemukakan dalam EPPO (1989) yang menyatakan bahwa dalam banyak varietas krisan, hampir 30% tanaman yang terinfeksi adalah symptomless. Ekspresi gejala yang bersifat symptomles ini sangat membahayakan bagi perkembangan tanaman hias di Indonesia, karena sangat menyulitkan dalam pengendalian secara dini berdasarkan pengamatan secara visual.
Terdeteksinya CSVd walaupun tanpa disertai munculnya gejala pada tanaman in&kator, menunjukan bahwa CSVd dapat ditularkan secara mekanis, dan ketiga tanaman indikator yang bereaksi positif pada penelitian ini dapat menjadi inang bagi CSVd.
Ketidakrnunculan gejala dan tidak terdeteksinya CSVd pada beberapa tanaman indikator kemungkinan sangat dipengaruhi oleh beberapa faktor, diantaranya adalah ketidaksesuaian umur tanaman indikator yang digunakan untuk terjadinya infeksi CSVd, atau konsentrasi RNA CSVd dalam tanaman uji yang sangat rendah.
Deteksi dengan Return Plyacrylamide Gel Electrophresis (Return-PAGE)
Berdasarkan hasil deteksi melalui metode return PAGE dengan menggunakan alat hasil modifikasi, diperoleh suatu pita RNA CSVd yang terletak di bagian tengah gel dalarn daerah running (Gambar 8).
Deteksi CSVd dengan sistem ini juga berjalan dengan baik seperti RT-PCR dan tissue blot hybridization, karena dapat membedakan antara tanaman yang sakit dengan tanaman yang sehat berdasarkan ada tidaknya pita RNA yang muncul pada bagian tengah gel. Dari 8 sampel yang dideteksi, 5 sampel merupakan
tanaman sehat dan tanarnan sakit (menunjukkan gejala kerdil). Pada tanaman yang sakit dan kontrol positif, terdapat pita RNA pada bagian tengah gel, sedangkan pada tanarnan yang sehat dan kontrol negatif tidak terlihat adanya pita
RNA tersebut.
Dalam sistem ini, elektroforesis dilakukan dalam dua tahap, tahap pertama pada kondisi tidak terdenaturasi (i15 "C), dan tahap kedua pada kondisi terdenaturasi (60 "C). Pada kondisi tidak terdenaturasi, molekul RNA CSVd bergerak dalarn gel akrilamid dalam bentuk sirkuler, sedangkan pada kondisi terdenaturasi (dengan merubah polaritas elektroda) molekul RNA terdenaturasi menjah bentuk linier sehingga pergerakannya menjadi lebih lambat. Dengan demikian pada saat elektroforesis dalam kondisi terdenaturasi ini, molekul RNA CSVd yang linier dapat terpisahkan dari molekul asam nukleat lainnya.
Gambar 8 Hasil analisa pola pita CSVd berdasarkan metode return-PAGE. 1 kontrol negatif, 2. tanaman sehat, 3 tanaman sakit, 4-8. Kontrol positif.
Menurut Hanold et al. (2003), metode diagnosis dengan sistem return- PAGE di bawah kondisi terdenaturasi digunakan untuk mendapatkan RNA yang murni untuk perunutan RNA secara langsung. Disamping itu, juga merupakan suatu alat yang penting untuk mendeteksi viroid yang belwn diketahui inforrnasi urutan nukleotidanya.
CSVd, karena tidak memerlukan peralatan yang mahal dan bahan kimia yang digunakan tidak terlalu mahal dibandingkan kedua metode lainnya.
Deteksi CSVd pada Bibit Krisan Melalui Tissue Blot Hybridization
Hasil penelitian menunjukkan bahwa pelacak DNA CSVd yang dibuat dalam penelitian ini, dapat mendeteksi langsung keberadan RNA CSVd dalam jaringan tanaman krisan yang terinfeksi. Keberhasilan deteksi ini dibuktikan dengan adanya spot-spot berwama ungu pada daerah tempat diblotnya potongan batang pucuk tanaman krisan sakit pada membran nylon, dan tidak ditemukannya signal tersebut pada tanaman yang sehat, termasuk bufer sebagai kontrol negatif (Gambar 9). Kuat tidaknya signal yang muncul mengindikasikan bahwa konsentrasi RNA CSVd dalam jaringan tanaman krisan berbeda-beda.
Disamping dapat mendeteksi RNA secara langsung dalam jaringan tanaman sakit, pelacak DNA CSVd ini juga dapat mendeteksi keberadaan DNA CSVd dalam suatu Mon (plasmid rekombinan) yang digunakan sebagai cetakan pada pembuatan pelacak.
Gambar 9 Hasil analisa tissue blot hybridization. A1 dan B1 adalah kontrol positif (Mon CSVd); C1 clan D l adalah kontrol negatif (bufer); A2-
A12, B2-B12, C2-C10, dan D2-Dl0 adalah sampel clan kebun percobaan Balithl dengan gejala kerdil; C11 dan D l 1 adalah sampel kultur in vitro; C12 dan Dl2 adalah kontrol negatif (tanaman sehat, berdasarkan hasil deteksi dengan RT-PCR).
Dari sejumlah sampel yang dideteksi, hampir semua sampel menunjukkan reaksi positif terhadap pelacak DNA CSVd, kecuali sampel yang berasal dari kultur in vitro (Gambar 9). Sampel yang bereaksi positif tersebut merupakan sampel tanaman knsan yang diambil dari kebun percobaan Balithi yang menunjukkan gejala kerdil disamping adanya penguningan daun pada beberapa sampel. Dengan demikian, sistem ini dapat bekerja dengan baik untuk mendeteksi secara langsung keberadaan RNA CSVd dalam jaringan tanaman krisan.
Pembahasan Umum
Terjadnya penyebaran CSVd di sentra-sentra produksi krisan di Indonesia disebabkan belum tersedianya metode diagnosis untuk viroid. Badan Karantina Pertanian yang merupakan pintu gerbang bagi masuknya tanaman-tanaman krisan introduksi masih mengalami kesulitan untuk melakukan diagnosis terhadap viroid yang menginfeksi tanaman krisan, terutama CSVd Oleh karena itu, dengan adanya penelitian mengenai pengembangan metode deteksi molekuler terhadap CSVd ini, diharapkan dapat membantu Badan Karantina Pertanian untuk dapat melakukan tugasnya dengan sebaik-baiknya, dalam ha1 melakukan diagnosis CSVd dengan metode yang akurat terhadap tanaman-tanaman knsan baik impor maupun ekspor, sehingga tidak akan terjadi penyebaran CSVd lebih lanjut, baik antar negara, maupun antar daerah di &lam negeri Indonesia.
Disamping itu, dengan ditemukannya metode diagnosis terhadap CSVd di Indonesia ini, diharapkan dapat membantu para pemulia tanarnan dalam menghasilkan varietas-varietas baru yang tahan CSVd. Bagi produsen benih, teknik ini diperlukan untuk menghasilkan produk yang terjamin kesehatannya, terbebas dari penyakit sistemik, terutarna viroid,