IDENTIFIKASI ISOLAT BAKTERI TAHAN KROM(VI) DAN
PENGUJIAN AKTIVITAS ENZIM KROM(VI) REDUKTASE
NINA HERMAYANI SADI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa tesis IDENTIFIKASI ISOLAT BAKTERI TAHAN KROM(VI) DAN PENGUJIAN AKTIVITAS ENZIM KROM(VI) REDUKTASE adalah karya saya sendiri dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2009
ABSTRACT
NINA HERMAYANI SADI. Identification of Cr(VI)-Resistant Bacteria and the Study of Its Cr(VI)-Reductase Activity. Under the direction of LAKSMI AMBARSARI and YOPI.
Cr(VI) (chromate) is a toxic, soluble environmental contaminant. A Gram-negative, Cr(VI)-resistant bacterium, has been isolated from effluent of electroplating wastewater treatment reactor. This strain had maximum identity value as high as 96% to Ralstonia pickettii and Ralstonia sp. M2S3. This value indicated that the strain was a species of Ralstonia genera. Because of this reason, the strain was designated as Ralstonia sp. Cr6NS.
Ralstonia sp. Cr6NS was able to grow aerobically in 250 ppm Cr(VI) and had Cr(VI) reducing-capacity as high as 4,11 x 10-8µg Cr(VI)/hour/cell. From the study of enzymatic activity, Ralstonia sp. Cr6NS showed the activity of Cr(VI)-reductase both in periplasmic and sitoplasmic content. The highest activity was found in periplasmic matrix. However, the strain seemed not secreting this enzyme to the external medium.
RINGKASAN
Nina Hermayani Sadi. Identifikasi Isolat Bakteri Tahan Krom(VI) dan Pengujian Aktivitas Enzim Krom(VI) Reduktase. Dibimbing oleh LAKSMI AMBARSARI dan YOPI.
Krom(VI) adalah ion logam berat toksik karena sifatnya sebagai oksidator kuat dan bersifat mutagenik. Masuknya Cr(VI) ke lingkungan akan menimbulkan polusi bagi lingkungan tersebut. Industri logam dan pelapisan logam merupakan industri yang menghasilkan limbah yang mengandung Cr(VI) dalam kisaran 0,1-100 mg/L. Salah satu alternatif sistem pengolahan limbah Cr(VI) adalah pengolahan secara biologis dengan menggunakan bakteri sebagai agen bioremediasi. Cr(VI) yang toksik direduksi secara enzimatis menjadi Cr(III) yang kurang toksik dalam sistem ini. Oleh sebab itu, bakteri yang dapat digunakan sebagai agen bioremediasi Cr(VI) adalah bakteri tahan Cr(VI) yang memiliki aktivitas enzim Cr(VI) reduktase.
Penelitian ini bertujuan untuk mengisolasi bakteri tahan Cr(VI) dari reaktor pengolahan limbah pelapisan logam yang terdapat di Laboratorium Pengendalian Pencemaran Puslit Limnologi LIPI, menyeleksi dan mengidentifikasi isolat unggul, serta menguji aktivitas enzim Cr(VI) reduktase dari ekstrak kasar enzim ekstraseluler, enzim periplasma, dan enzim sitoplasma. Isolat unggul dipilih berdasarkan nilai daya penyisihan Cr(VI) tertinggi. Identifikasi isolat unggul dilakukan melalui pengamatan morfologi bakteri dan analisis 16 rRNA. Sebagai substrat pada uji aktivitas enzim digunakan larutan K2CrO4 dengan konsentrasi akhir 0,2 mM. Diamati juga pengaruh NADH sebagai
donor elektron terhadap aktivitas enzim Cr(VI) reduktase.
Hasil penelitian mendapatkan bahwa 95 isolat bakteri tahan Cr(VI) berhasil diisolasi dari efluen reaktor pengolahan limbah pelapisan logam. Dari ke-95 isolat tersebut ternyata isolat nomor 15 memiliki nilai daya penyisihan Cr(VI) tertinggi dibanding isolat uji lainnya, yaitu 4,11 x 10-8 µg Cr(VI)/jam/sel bakteri. Oleh sebab itu isolat nomor 15 dijadikan isolat unggul dan digunakan dalam uji selanjutnya. Isolat no.15 memiliki bentuk sel batang dan merupakan bakteri Gram negatif. Bakteri ini merupakan anggota dari genus Ralstonia karena memiliki kemiripan sebesar 96% dengan dua bakteri dari genus Ralstonia, yaitu Ralstonia pickettii 12D dan Ralstonia sp. M2S3. Berdasarkan hal ini, isolat nomor 15 selanjutnya diberi nama Ralstonia sp. Cr6NS. Hasil uji aktivitas enzim menunjukkan bahwa enzim Cr(VI) reduktase terdapat di daerah periplasma dan sitoplasma bakteri. Aktivitas spesifik enzim terbesar ditemukan di daerah periplasma dengan nilai aktivitas spesifik 27,30 unit/mg protein. Penambahan NADH dalam uji aktivitas enzim meningkatkan aktivitas enzim sebesar 17,88% pada enzim periplasma dan 306,21% pada enzim sitoplasma. Walau di daerah periplasma terdapat enzim pereduksi Cr(VI), enzim ini tidak disekeresikan ke luar sel karena dalam medium kutur tidak ditemukan adanya reduksi Cr(VI) dalam uji aktivitas enzim.
© Hak Cipta milik Institut Pertanian Bogor, tahun 2009
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
IDENTIFIKASI ISOLAT BAKTERI TAHAN KROM(VI) DAN
PENGUJIAN AKTIVITAS ENZIM KROM(VI) REDUKTASE
NINA HERMAYANI SADI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biokimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Identifikasi Isolat Bakteri Tahan Krom(VI) dan Pengujian Aktivitas Enzim Krom(VI) Reduktase
Nama : Nina Hermayani Sadi
NIM : G851070031
Disetujui
Komisi Pembimbing
Dr. Laksmi Ambarsari, M.S. Ketua
Dr. Yopi Anggota
Diketahui
Ketua Program Studi Biokimia
Prof. Dr. drh. Maria Bintang, M.Si.
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Khairil Anwar Notodiputro, M.S.
PRAKATA
Alhamdulillahirabbil’alamin, segenap puja dan puji syukur penulis
panjatkan ke hadirat Allah SWT atas rahmat dan hidayah-Nya yang telah dilimpahkan kepada penulis sehingga tesis ini dapat diselesaikan. Tesis ini mengambil tema mengenai identifikasi bakteri tahan krom(VI) dan pengujian aktivitas enzim pereduksi krom (VI) yang diisolasi dari isolat bakteri tersebut.
Penyusunan tesis bukanlah pekerjaan yang mudah. Tanpa adanya dukungan dari berbagai pihak tentu sukar bagi penulis untuk menyelesaikan tugas ini. Oleh sebab itu, penulis mengucapkan terima kasih dengan tulus dan penghargaan setinggi-tingginya kepada: Ibu Dr. Laksmi Ambarsari, M.S., dan Bapak Dr. Yopi selaku pembimbing yang telah banyak memberikan masukan dan pengetahuan baru kepada penulis; Ibu Dr. Ir. Gadis Sri Haryani selaku Kepala Puslit Limnologi LIPI dan Bapak Dr. Tri Widiyanto, M.Si., selaku Kepala Bidang Poduktivitas Perairan Darat Puslit Limnologi LIPI yang telah memberikan dukungan dan fasilitas untuk terlaksananya penelitian ini; Bapak Dr. Ir. I Made Artika, M.App.Sc. atas koreksi dan masukannya bagi perbaikan tesis ini; Tanoto Foundation, yang memberi kepercayaan melalui pemberian beasiswa kepada penulis; Bapak Ahmad Thontowi, S.Si, M.Si., yang telah membimbing penulis selama melakukan analisis 16S rRNA di Laboratorium Bioremediasi Puslit Bioteknologi LIPI, Cibinong; Ibu Sekar Larasati, S.Si., M.Si., Ibu Dra. Djamhuriyah S. Said, M.Si., Ibu Evy Susanti, S.Si., M.Si., Bapak Drs. Tjandra C., M.Sc., Adisty Juniar dan rekan-rekan di Laboratorium Mikrobiota Puslit Limnologi LIPI, Cibinong; suami tercinta Ir. Gunawan Pratama Yoga, M.Sc., ayahanda, ibunda, anak-anakku tersayang Mbak Ajeng dan Pipiet, dan seluruh keluarga untuk kasih sayang, doa, dan dukungannya selama penulis menjalankan studi.
Penulis menyadari bahwa karya ini masih memiliki banyak kekurangan dalam berbagai sisi. Karena itu, saran dan kritik bagi penulis akan sangat berharga untuk perbaikan-perbaikan di masa yang akan datang.
Semoga sekelumit pengetahuan yang penulis tuangkan dalam karya ini dapat bermanfaat.
Bogor, Agustus 2009
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 1 April 1974 dari ayah Let.Kol.Pol.(Purn.) Emon Sadi dan ibu Nunung R. Pada tanggal 10 Agustus 1997 penulis menikah dengan Ir. Gunawan Pratama Yoga, M.Sc., dan saat ini telah dikaruniai dua orang putri yaitu Ajeng Meiwita Nurrizky dan Vitaya Nur Khaleeda.
Setelah lulus dari Sekolah Menengah Analis Kimia Bogor pada tahun 1993, penulis bekerja di Puslit Limnologi LIPI sebagai analis kimia air. Perkenalan dengan dunia bakteri dimulai pada tahun 2002 ketika penulis ditugaskan di Laboratorium Mikrobiota pada puslit yang sama. Pada awalnya
penulis banyak ‘bersentuhan’ dengan bakteri fotosintetik anoksigenik dan
metabolisme sulfidanya dalam penerapannya sebagai agen bioremediasi perairan. Pada tahun 2000 penulis mendapat kesempatan melanjutkan pendidikan sarjana pada Program Studi Kimia FMIPA Universitas Pakuan, Bogor. Dengan mengambil tema skripsi mengenai karakteristik penyerapan beberapa logam berat pada bakteri fotosintetik anoksigenik (BFA), penulis lulus dan memperoleh gelar Sarjana Sains pada tahun 2005.
Atas dukungan dari Dr. Tri Widiyanto, M.Si., sebagai Kepala Bidang Produktivitas Perairan Darat Puslit Limnologi LIPI, tahun 2007 penulis melanjutkan pendidikan pascasarjana S2 pada Program Studi Biokimia, Sekolah Pascasarjana Institut Pertanian Bogor. Selama mengikuti perkuliahan di Program Studi Biokimia, penulis sangat tertarik pada bidang enzimologi. Artikel mengenai pemanfaatan enzim dalam pengolahan limbah pestisida yang dibuat penulis dan dimuat pada majalah Warta Limnologi tahun 2008, telah di ulas oleh harian Koran Jakarta pada bulan Oktober 2008.
IDENTIFIKASI ISOLAT BAKTERI TAHAN KROM(VI) DAN
PENGUJIAN AKTIVITAS ENZIM KROM(VI) REDUKTASE
NINA HERMAYANI SADI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa tesis IDENTIFIKASI ISOLAT BAKTERI TAHAN KROM(VI) DAN PENGUJIAN AKTIVITAS ENZIM KROM(VI) REDUKTASE adalah karya saya sendiri dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2009
ABSTRACT
NINA HERMAYANI SADI. Identification of Cr(VI)-Resistant Bacteria and the Study of Its Cr(VI)-Reductase Activity. Under the direction of LAKSMI AMBARSARI and YOPI.
Cr(VI) (chromate) is a toxic, soluble environmental contaminant. A Gram-negative, Cr(VI)-resistant bacterium, has been isolated from effluent of electroplating wastewater treatment reactor. This strain had maximum identity value as high as 96% to Ralstonia pickettii and Ralstonia sp. M2S3. This value indicated that the strain was a species of Ralstonia genera. Because of this reason, the strain was designated as Ralstonia sp. Cr6NS.
Ralstonia sp. Cr6NS was able to grow aerobically in 250 ppm Cr(VI) and had Cr(VI) reducing-capacity as high as 4,11 x 10-8µg Cr(VI)/hour/cell. From the study of enzymatic activity, Ralstonia sp. Cr6NS showed the activity of Cr(VI)-reductase both in periplasmic and sitoplasmic content. The highest activity was found in periplasmic matrix. However, the strain seemed not secreting this enzyme to the external medium.
RINGKASAN
Nina Hermayani Sadi. Identifikasi Isolat Bakteri Tahan Krom(VI) dan Pengujian Aktivitas Enzim Krom(VI) Reduktase. Dibimbing oleh LAKSMI AMBARSARI dan YOPI.
Krom(VI) adalah ion logam berat toksik karena sifatnya sebagai oksidator kuat dan bersifat mutagenik. Masuknya Cr(VI) ke lingkungan akan menimbulkan polusi bagi lingkungan tersebut. Industri logam dan pelapisan logam merupakan industri yang menghasilkan limbah yang mengandung Cr(VI) dalam kisaran 0,1-100 mg/L. Salah satu alternatif sistem pengolahan limbah Cr(VI) adalah pengolahan secara biologis dengan menggunakan bakteri sebagai agen bioremediasi. Cr(VI) yang toksik direduksi secara enzimatis menjadi Cr(III) yang kurang toksik dalam sistem ini. Oleh sebab itu, bakteri yang dapat digunakan sebagai agen bioremediasi Cr(VI) adalah bakteri tahan Cr(VI) yang memiliki aktivitas enzim Cr(VI) reduktase.
Penelitian ini bertujuan untuk mengisolasi bakteri tahan Cr(VI) dari reaktor pengolahan limbah pelapisan logam yang terdapat di Laboratorium Pengendalian Pencemaran Puslit Limnologi LIPI, menyeleksi dan mengidentifikasi isolat unggul, serta menguji aktivitas enzim Cr(VI) reduktase dari ekstrak kasar enzim ekstraseluler, enzim periplasma, dan enzim sitoplasma. Isolat unggul dipilih berdasarkan nilai daya penyisihan Cr(VI) tertinggi. Identifikasi isolat unggul dilakukan melalui pengamatan morfologi bakteri dan analisis 16 rRNA. Sebagai substrat pada uji aktivitas enzim digunakan larutan K2CrO4 dengan konsentrasi akhir 0,2 mM. Diamati juga pengaruh NADH sebagai
donor elektron terhadap aktivitas enzim Cr(VI) reduktase.
Hasil penelitian mendapatkan bahwa 95 isolat bakteri tahan Cr(VI) berhasil diisolasi dari efluen reaktor pengolahan limbah pelapisan logam. Dari ke-95 isolat tersebut ternyata isolat nomor 15 memiliki nilai daya penyisihan Cr(VI) tertinggi dibanding isolat uji lainnya, yaitu 4,11 x 10-8 µg Cr(VI)/jam/sel bakteri. Oleh sebab itu isolat nomor 15 dijadikan isolat unggul dan digunakan dalam uji selanjutnya. Isolat no.15 memiliki bentuk sel batang dan merupakan bakteri Gram negatif. Bakteri ini merupakan anggota dari genus Ralstonia karena memiliki kemiripan sebesar 96% dengan dua bakteri dari genus Ralstonia, yaitu Ralstonia pickettii 12D dan Ralstonia sp. M2S3. Berdasarkan hal ini, isolat nomor 15 selanjutnya diberi nama Ralstonia sp. Cr6NS. Hasil uji aktivitas enzim menunjukkan bahwa enzim Cr(VI) reduktase terdapat di daerah periplasma dan sitoplasma bakteri. Aktivitas spesifik enzim terbesar ditemukan di daerah periplasma dengan nilai aktivitas spesifik 27,30 unit/mg protein. Penambahan NADH dalam uji aktivitas enzim meningkatkan aktivitas enzim sebesar 17,88% pada enzim periplasma dan 306,21% pada enzim sitoplasma. Walau di daerah periplasma terdapat enzim pereduksi Cr(VI), enzim ini tidak disekeresikan ke luar sel karena dalam medium kutur tidak ditemukan adanya reduksi Cr(VI) dalam uji aktivitas enzim.
© Hak Cipta milik Institut Pertanian Bogor, tahun 2009
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
IDENTIFIKASI ISOLAT BAKTERI TAHAN KROM(VI) DAN
PENGUJIAN AKTIVITAS ENZIM KROM(VI) REDUKTASE
NINA HERMAYANI SADI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biokimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Identifikasi Isolat Bakteri Tahan Krom(VI) dan Pengujian Aktivitas Enzim Krom(VI) Reduktase
Nama : Nina Hermayani Sadi
NIM : G851070031
Disetujui
Komisi Pembimbing
Dr. Laksmi Ambarsari, M.S. Ketua
Dr. Yopi Anggota
Diketahui
Ketua Program Studi Biokimia
Prof. Dr. drh. Maria Bintang, M.Si.
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Khairil Anwar Notodiputro, M.S.
PRAKATA
Alhamdulillahirabbil’alamin, segenap puja dan puji syukur penulis
panjatkan ke hadirat Allah SWT atas rahmat dan hidayah-Nya yang telah dilimpahkan kepada penulis sehingga tesis ini dapat diselesaikan. Tesis ini mengambil tema mengenai identifikasi bakteri tahan krom(VI) dan pengujian aktivitas enzim pereduksi krom (VI) yang diisolasi dari isolat bakteri tersebut.
Penyusunan tesis bukanlah pekerjaan yang mudah. Tanpa adanya dukungan dari berbagai pihak tentu sukar bagi penulis untuk menyelesaikan tugas ini. Oleh sebab itu, penulis mengucapkan terima kasih dengan tulus dan penghargaan setinggi-tingginya kepada: Ibu Dr. Laksmi Ambarsari, M.S., dan Bapak Dr. Yopi selaku pembimbing yang telah banyak memberikan masukan dan pengetahuan baru kepada penulis; Ibu Dr. Ir. Gadis Sri Haryani selaku Kepala Puslit Limnologi LIPI dan Bapak Dr. Tri Widiyanto, M.Si., selaku Kepala Bidang Poduktivitas Perairan Darat Puslit Limnologi LIPI yang telah memberikan dukungan dan fasilitas untuk terlaksananya penelitian ini; Bapak Dr. Ir. I Made Artika, M.App.Sc. atas koreksi dan masukannya bagi perbaikan tesis ini; Tanoto Foundation, yang memberi kepercayaan melalui pemberian beasiswa kepada penulis; Bapak Ahmad Thontowi, S.Si, M.Si., yang telah membimbing penulis selama melakukan analisis 16S rRNA di Laboratorium Bioremediasi Puslit Bioteknologi LIPI, Cibinong; Ibu Sekar Larasati, S.Si., M.Si., Ibu Dra. Djamhuriyah S. Said, M.Si., Ibu Evy Susanti, S.Si., M.Si., Bapak Drs. Tjandra C., M.Sc., Adisty Juniar dan rekan-rekan di Laboratorium Mikrobiota Puslit Limnologi LIPI, Cibinong; suami tercinta Ir. Gunawan Pratama Yoga, M.Sc., ayahanda, ibunda, anak-anakku tersayang Mbak Ajeng dan Pipiet, dan seluruh keluarga untuk kasih sayang, doa, dan dukungannya selama penulis menjalankan studi.
Penulis menyadari bahwa karya ini masih memiliki banyak kekurangan dalam berbagai sisi. Karena itu, saran dan kritik bagi penulis akan sangat berharga untuk perbaikan-perbaikan di masa yang akan datang.
Semoga sekelumit pengetahuan yang penulis tuangkan dalam karya ini dapat bermanfaat.
Bogor, Agustus 2009
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 1 April 1974 dari ayah Let.Kol.Pol.(Purn.) Emon Sadi dan ibu Nunung R. Pada tanggal 10 Agustus 1997 penulis menikah dengan Ir. Gunawan Pratama Yoga, M.Sc., dan saat ini telah dikaruniai dua orang putri yaitu Ajeng Meiwita Nurrizky dan Vitaya Nur Khaleeda.
Setelah lulus dari Sekolah Menengah Analis Kimia Bogor pada tahun 1993, penulis bekerja di Puslit Limnologi LIPI sebagai analis kimia air. Perkenalan dengan dunia bakteri dimulai pada tahun 2002 ketika penulis ditugaskan di Laboratorium Mikrobiota pada puslit yang sama. Pada awalnya
penulis banyak ‘bersentuhan’ dengan bakteri fotosintetik anoksigenik dan
metabolisme sulfidanya dalam penerapannya sebagai agen bioremediasi perairan. Pada tahun 2000 penulis mendapat kesempatan melanjutkan pendidikan sarjana pada Program Studi Kimia FMIPA Universitas Pakuan, Bogor. Dengan mengambil tema skripsi mengenai karakteristik penyerapan beberapa logam berat pada bakteri fotosintetik anoksigenik (BFA), penulis lulus dan memperoleh gelar Sarjana Sains pada tahun 2005.
Atas dukungan dari Dr. Tri Widiyanto, M.Si., sebagai Kepala Bidang Produktivitas Perairan Darat Puslit Limnologi LIPI, tahun 2007 penulis melanjutkan pendidikan pascasarjana S2 pada Program Studi Biokimia, Sekolah Pascasarjana Institut Pertanian Bogor. Selama mengikuti perkuliahan di Program Studi Biokimia, penulis sangat tertarik pada bidang enzimologi. Artikel mengenai pemanfaatan enzim dalam pengolahan limbah pestisida yang dibuat penulis dan dimuat pada majalah Warta Limnologi tahun 2008, telah di ulas oleh harian Koran Jakarta pada bulan Oktober 2008.
DAFTAR ISI
Halaman
Daftar Tabel i
Daftar Gambar ii
Daftar Lampiran iii
PENDAHULUAN... 1 TINJAUAN PUSTAKA
Bakteri Tahan Krom ... Reduksi Krom (VI) secara Enzimatis pada Beberapa Bakteri ... 16S RNA Ribosoma (rRNA) ...………... Reaktor Pengolah Limbah Pelapisan Krom ...
6 8 11 13
BAHAN DAN METODE
Waktu dan Tempat Penelitian ... Alat dan Bahan ... Metode Penelitian ...
17 17 18
HASIL DAN PEMBAHASAN
Isolat Bakteri Tahan Krom(VI) ... Hasil Identifikasi Isolat Unggul Tahan Cr(VI) ... Aktivitas Enzim Cr(VI) Reduktase ...
25 28 31
DAFTAR TABEL
Halaman
1. Nilai Km dan Vmax dari enzim pereduksi Cr(VI) yang diisolasi dari
beberapa jenis bakteri
11
2. Hasil pengujian aktivitas enzim Cr(VI) reduktase pada ekstrak kasar enzim dari isolat Ralstonia sp. Cr6NS
DAFTAR GAMBAR
Halaman
1. Kerangka pemikiran penelitian ... 5 2. Pohon filogenetik rDNA ... 12 3. Disain reaktor kolom dan instalasi reaktor kolom pengolahan
limbah cair pelapisn logam dan limbah dari kegiatan analisis
Laboratorium Hidrokimia Puslit Limnologi LIPI ... 14 4. Ukuran Fe(0) yang digunakan dalam reaktor kolom... 15 5. Pertumbuhan koloni di tepi kertas saring pada uji resistensi
terhadap Cr(VI) 250 mg/L ... 25 6. Bentuk koloni ke enam isolat bakteri tahan Cr(VI) ... 26 7. Bentuk kurva pertumbuhan ke enam isolat bakteri tahan Cr(VI) ... 27 8. Nilai daya penyisihan isolat bakteri tahan Cr(VI)
...
28
9. Hasil elektroforesis amplikon
...
29
10.Hasil pensejajaran urutan basa dari primer 9F pada program
BLASTN ... 30 11.Hasil analisis taksonomi dari genus Ralstonia pada program
BLASTN ... 30 12.Kurva pertumbuhan Ralstonia sp. Cr6NS dalam medium PYECr-25
100% ... 32 13.Mekanisme penyerapan Cr(VI) oleh sel hidup O. anthropi ... 34 14.Pengaruh penambahan NADH sebagai donor elektron terhadap
DAFTAR LAMPIRAN
Halaman
PENDAHULUAN
Latar Belakang
Kromium heksavalen, Cr(VI), merupakan bahan pencemar lingkungan yang bersifat toksik, mutagenik, dan karsinogenik bagi hampir semua mahluk hidup (ATSDR, 2001; Sugden, et.al,. 2001). Oksianion kromat (CrO42-) adalah
bentuk Cr(VI) yang paling toksik dan bersifat mudah larut. Struktur kromat yang mirip ion fosfat dan sulfat menjadikannya lebih mudah masuk melewati membran sel dengan perantaraan jalur penukaran untuk anion fosfat dan sulfat (Alexander and Aaseth, 1995; Ohtake, et.el., 1987). Ion Cr(VI) di dalam sel akan direduksi oleh glutation menjadi Cr(III) melalui pembentukan senyawa antara Cr(V) dan Cr(IV) dan radikal dari oksigen (ROS) (Goyer, 1986; Shi and Dalal, 1988; Sumner, et.el. 2005).
Toksisitas Cr(VI) diakibatkan oleh sifat Cr(VI) sebagai oksidator kuat dan juga karena dalam reaksi reduksinya pada sistem biologis menghasilkan spesies-spesies radikal yang tidak stabil seperti reactive oxygen species (ROS) dan Cr(V) (ATSDR, 2001; Sumner, et.al., 2005). Potensi genotoksisitas kromium valensi tinggi dipelajari oleh Sugden, et.al. (2001), secara in vitro dengan menggunakan kompleks Cr(V)-organik dan oligonukleotida sintetik berbasa 25 (5’ -d(ATGGCGTAATCATXGTC-ATAGCTGT)-3’). Kerusakan oksidatif akibat senyawa antara Cr(V) memacu pembentukan basa termodifikasi, terutama 8-okso-G. Bentuk senyawa ini sangat tidak stabil dan mudah teroksidasi menjadi guanidinohidantoin (GH) dan spiroiminodihidantoin (SH). GH dan SH telah lama digunakan sebagai biomarker bagi tingkat keparahan penyakit seperti kanker dan penuaan (aging). GH dan SH bersifat mutagenik karena menyebabkan kesalahan penggabungan oposit dimana basa sitosin yang seharusnya bergabung digantikan oleh adenin. Akibat lanjutnya ketika terjadi replikasi atau transkripsi, basa G akan digantikan oleh basa T. Walau penelitian ini dilakukan secara in vitro, penemuan ini dapat menggambarkan mekanisme in vivo dari interaksi kromium dengan oligonukleotida yang menghasilkan lesi DNA akibat reaksi mutasi transversi G
Jalur utama masuknya Cr(VI) ke dalam tubuh manusia adalah melalui pernafasan, pencernaan, dan absorpsi oleh kulit. Organ yang menjadi target toksisitas Cr(VI) yang masuk melalui pernafasan adalah paru-paru sehingga meningkatkan resiko kanker paru-paru. Pencemaran kromium di udara disebabkan antara lain oleh hasil pembakaran bahan bakar minyak dan dari menara pendingin pabrik yang menggunakan bahan kimia yang mengandung kromat sebagai bahan pencegah karat. Cr(VI) yang kontak dengan kulit akan menimbulkan gejala dermatitis dan pelepuhan kulit. Penelitian yang dilakukan di Amerika Serikat mendapatkan bahwa sekitar 20% dari pekerja yang bidang kerjanya terpapar Cr(VI), seperti pekerja percetakan, tukang cat, penyamakan kulit, dan pekerja bangunan, menunjukkan gejala alergi dermatitis dalam bentuk eksim di kulit (ATSDR, 2001).
Studi yang dilakukan Sumner, et.al. (2005), menunjukkan bahwa pada ragi Saccharomyces cerevisiae toksisitas Cr(VI) terutama disebabkan oksidasi protein oleh spesies oksigen reaktif (ROS), dibandingkan interaksi ROS dengan makromolekul lainnya seperti fosfolipid dan DNA. Sejumlah enzim glikolitik dan
heat-shock protein (HSP) menjadi target spesifik perusakan oksidatif akibat Cr. Toksisitas Cr(VI) pada beberapa tanaman, seperti tebu, buncis, padi, jagung, dan lain-lain, telah dipelajari. Pemaparan kromium berefek terhadap proses pertumbuhan dan perkembangan tanaman dan fisiologis tanaman (Shanker, et.al., 2005). Efek Cr(VI) terhadap respon pertumbuhan alga hijau Chlorella pyrenoidosa telah dipelajari oleh Hörcsik dan Balogh (2002). Peningkatan konsentrasi Cr(VI) dengan nyata mempengaruhi pertumbuhan alga ini dengan nilai EC50 sebesar 1,6 mg/L dan nilai LC50 pada kisaran 20 mg/L, walau pada
konsentrasi yang sangat rendah kromium meningkatkan pertumbuhan alga. Akumulasi kromium terbesar terdapat pada dinding sel alga, yaitu sebesar 70%, sementara jumlah kromium pada fraksi membran setara dengan jumlah pada fraksi terlarut. Masuknya kromium ke dalam sel alga diduga melalui mekanisme pertukaran ion dengan besi dan terutama magnesium.
Industri penyamakan kulit dan pengolahan kulit, industri pembuatan baja, dan industri elektronik dan peralatan listrik merupakan sumber utama limbah kromium industrial. Konsentrasi Cr(VI) yang terdapat dalam limbah dari ketiga jenis industri diatas berkisar antara 0,1 – 100 mg/L. Teknologi konvensional pengolahan limbah yang mengandung Cr(VI) sebagian besar melibatkan metoda reduksi Cr(VI) secara kimia membentuk Cr(III) yang kurang toksik dan dilanjutkan dengan tahap pengendapan dalam kondisi basa (Patterson, et.al., 1998). Menurut Ganguli dan Tripathi (2002), metoda pengolahan limbah Cr(VI) konvensional membutuhkan bahan kimia dan sumber energi dalam jumlah besar sehingga cara tersebut secara ekonomis kurang cocok untuk diterapkan pada industri berskala kecil. Selain itu, studi pendahuluan menunjukkan bahwa reaktor pengolahan limbah pelapisan logam yang menggunakan metoda reduksi oleh serbuk besi (dalam bentuk Fe(0) dan Fe(II)) menghasilkan efluen yang mengandung Fe (II) terlarut 68,062 mg/L dan Fe(III) terlarut 50,383 mg/L.
Sejumlah bakteri telah diketahui kemampuannya dalam mereduksi Cr(VI) menjadi Cr(III) yang tidak toksik (Bopp, et.al., 1983; Goris, 2001; McLean and Beveridge, 2001; Michel, et.al., 2001) dan telah dipelajari kemampuannya dalam pengolahan air yang tercemar Cr(VI) (Bhide, et.al., 1996; Ganguli and Tripathi, 2002). Reduksi Cr(VI) menjadi Cr(III) secara biologis menawarkan suatu alternatif baru dalam penanganan limbah berCr(VI) karena lebih ekonomis, aman, dan berkelanjutan (Eccless dalam Ganguli and Tripathi, 2002). Dalam proses reduksi tersebut, bakteri-bakteri menggunakan berbagai tipe enzim Cr(VI)-reduktase (enzim ekstraseluler, enzim sitoplasma terlarut, enzim yang terikat pada membran plasma, atau sitokrom). Enzim Cr(VI) reduktase yang dimiliki bakteri memberikan peluang untuk dimanfaatkan dalam mengatasi masalah pencemaran Cr(VI) di lingkungan perairan dan tanah yang tidak dapat diolah menggunakan sistem pengolah limbah biologis, atau merupakan pelengkap bagi sistem pengolahan limbah yang telah ada (Goris, et.al., 2001).
et.al., 2002). Identifikasi bakteri dapat dilakukan melalui pengamatan morfologi, pengujian biokimia terhadap struktur sel maupun produk yang dihasilkan, atau melalui pendekatan molekuler. Salah satu metoda identifikasi bakteri secara molekuler adalah dengan melakukan perbandingan urutan basa 16S RNA ribosom (rRNA) (Pangastuti, 2006). Identifikasi berdasarkan urutan basa 16S rRNA telah banyak diterapkan, antara lain dalam bidang kesehatan (Claridge,
et.al., 2004), pertanian (Khakvar, et.al., 2008), dan pertahanan (Sacchi, et.al., 2002).
Tujuan Penelitian
Penelitian yang telah dilakukan bertujuan untuk mengisolasi bakteri tahan Cr(VI) berkonsentrasi tinggi dari efluen reaktor pengolahan limbah pelapisan logam sebagai sumber isolat, menyeleksi isolat unggul, mengidentifikasi isolat unggul melalui analisis 16S rRNA, melakukan isolasi enzim Cr(VI) reduktase dari isolat unggul, dan menguji aktivitas enzim Cr(VI) reduktase.
Manfaat Penelitian
Isolat bakteri tahan Cr(VI) diharapkan dapat dimanfaatkan dalam pengolahan limbah yang mengandung Cr(VI) dan enzim Cr(VI) reduktase yang dihasilkan oleh bakteri tahan Cr(VI) dapat dimanfaatkan untuk aplikasi lain seperti biosensors Cr(VI).
Hipotesis
1. Dalam reaktor pengolahan limbah pelapisan logam krom terdapat isolat bakteri yang tahan terhadap Cr(VI) berkonsentrasi tinggi.
2. Bakteri yang tahan Cr(VI) konsentrasi tinggi dapat mereduksi Cr(VI). 3. Bakteri yang dapat mereduksi Cr(VI) dapat memproduksi enzim Cr(VI)
reduktase.
Kerangka Pemikiran
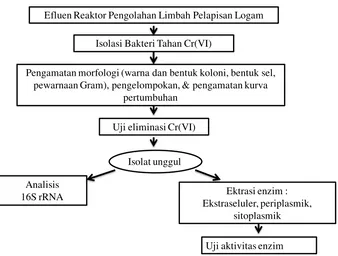
limbah kimiawi yang menggunakan prinsip reaksi redoks dalam menyisihkan Cr(VI). Cr(VI) yang berasal dari limbah pelapisan logam dalam reaktor tersebut direduksi oleh logam besi Fe0 sehingga terbentuk Cr3+ yang kemudian mengendap bersama-sama Fe3+ hasil oksidasi dan keluar sebagai efluen reaktor. Efluen reaktor dengan konsentrasi logam-logam yang tinggi diduga mengandung bakteri yang tahan terhadap logam Cr(VI) yang toksik dengan reaksi reduksi Cr(VI) secara enzimatis sebagai strategi pertahanannya. Bakteri tahan Cr(VI) tersebut diisolasi dan diidentifikasi, untuk kemudian dipilih satu isolat unggul yang memiliki daya penyisihan Cr(VI) tertinggi dan dikarakterisasi sistem enzim Cr(VI)-reduktase yang dimilikinya. Kerangka pemikiran penelitian ini dapat dilihat pada Gambar 1.
Efluen Reaktor Pengolahan Limbah Pelapisan Logam
Isolasi Bakteri Tahan Cr(VI)
Pengamatan morfologi (warna dan bentuk koloni, bentuk sel, pewarnaan Gram), pengelompokan, & pengamatan kurva
pertumbuhan
Uji eliminasi Cr(VI)
Ektrasi enzim : Ekstraseluler, periplasmik,
sitoplasmik Analisis
16S rRNA
Isolat unggul
Uji aktivitas enzim
TINJAUAN PUSTAKA
Bakteri Tahan Krom
Banyak mikroorganisme dapat hidup dan bereproduksi dalam habitat yang terkontaminasi logam berat seperti Cr(VI). Kelompok Pseudomonas,
Enterobacteria, Streptomyces spp., dan Corynebacteria yang diisolasi dari sedimen sungai Ottawa yang tercemar limbah industri mampu hidup dalam medium yang mengandung 100 µg Cr(VI) /L, dengan Pseudomonas sebagai kelompok yang paling banyak ditemukan (Luli, et.al., 1983). Dari lindi tempat pembuangan akhir sampah, Larashati (2004) mengisolasi bakteri Bacillus pumilus, Bacillus firmus, dan Bacillus brevis yang tahan terhadap kromat dalam konsentrasi tinggi dan mampu menyisihkan kromat dari medium. B. pumilus dan
B. firmus resisten terhadap kromat sampai konsentrasi 500 mg/L, sedangkan
Bacillus brevis resisten sampai konsentrasi kromat mencapai 400 mg/L. Bakteri jenis Bacillus banyak ditemukan di tempat pembuangan sampah dan ada yang memiliki resistensi dan kemampuan reduksi terhadap Cr(VI).
Kemampuan mikroorganisme untuk hidup dalam lingkungan yang terkontaminasi logam berat disebabkan oleh sejumlah mekanisme pertahanan yang dikembangkan mikroorganisme dalam mengatasi toksisitas logam berat. Gadd (1990) menyebutkan bahwa mekanisme pertahanan tersebut dapat melalui:
1. Presipitasi atau pembentukan kompleks ekstraseluler.
2. Menurunkan permeabilitas logam atau transport logam melewati membran sel.
3. Kompartementalisasi intraseluler, antara lain melalui penumpukan dalam vakuola.
4. Detoksifikasi melalui sejumlah reaksi kimia dalam sel.
(efluks logam), modifikasi spesies logam, pengurungan logam, atau kombinasi dari mekanisme tadi. Mayoritas faktor penentu resistensi logam bersifat terinduksi oleh ion logam. Sistem metaloregulator yang telah diidentifikasi hingga saat ini adalah untuk kation atau oksianion Ag, As, Cd, Cr, Cu, Fe, dan Hg (Bontidean, et. al., 2000).
Terdapat indikasi bahwa resistensi terhadap kromium berkorelasi dengan keberadaan plasmid pada beberapa isolat (Bopp, et.el., 1983; Luli, et.al., 1983; Ohtake, et.al. 1987). Pseudomonas fluorescens LB300 yang diisolasi dari sedimen sungai Hudson yang terkontaminasi kromium dapat tumbuh dalam medium yang mengandung lebih dari 1,5 mg K2CrO4 per mL atau 200 kali lebih
resisten dibandingkan bakteri lain yang diisolasi dari lokasi yang sama. Resistensi terhadap Cr(VI) ini diperoleh dari plasmid pLHB1 (Bopp, et.al.,1983). Penelitian selanjutnya terhadap bakteri yang sama, yaitu Pseudomonas fluorescens LB300, mendapatkan bahwa adanya plasmid pLBH1 berhubungan dengan penurunan penyerapan Cr(VI). Strain sensitif-Cr(VI) P. fluorescens LB303 yang tidak memiliki plasmid, menyerap Cr(VI) 2,2 kali lebih banyak dibandingkan P. fluorescens LB300 yang resisten-Cr(VI). Selain itu, sensitivitas seluler terhadap kromat dipengaruhi oleh sulfat (Ohtake, et.al., 1987).
Hasil penelitian Wang, et.al. (1990) mendapatkan bahwa pada
Enterobacter cloacae HO1 yang diisolasi dari lumpur aktif menggunakan CrO4
2-sebagai akseptor elektron pada kondisi anaerob dengan cara mereduksinya. Hal ini ditandai oleh:
1. Pertumbuhan bakteri dalam kondisi anaerob yang disertai dengan penurunan krom dalam medium.
2. Aktivitas reduksi-kromat pada sel yang sedang tumbuh dihambat oleh oksigen.
3. Reduksi terjadi lebih cepat dalam sel yang ditumbuhkan dalam medium gliserol dan asetat dibandingkan sel yang ditumbuhkan dalam medium glukosa.
logam-logam terdapat dalam bentuk yang bioavailable. Penelitian Cummings dan kawan-kawan (2007) mendapatkan bahwa bakteri pereduksi Fe(III) Acidiphilum cryptum memiliki toleransi yang tinggi terhadap beberapa logam berat termasuk Cr(VI) dan mampu mereduksi Cr(VI) melalui dua cara. Cara pertama, Cr(VI) direduksi secara langsung oleh komponen seluler yang sensitif terhadap Hg2+ dan tergantung pH (enzim). Reduksi Cr(VI) secara enzimatis ini tidak berhubungan dengan konservasi energi, tetapi lebih ditujukan sebagai strategi detoksifikasi. Cara kedua, Cr(VI) direduksi secara tidak langsung melalui perantaraan reaksi reduksi enzimatis Fe(III) menjadi Fe(II) yang secara cepat mentranspor elektronnya ke Cr(VI) sehingga tereduksi menjadi Cr(III) dalam tiga kali transfer elektron. Cara kedua tersebut dapat ditemui pada respirasi mikroba seperti
Shewanell alga strain BrY (Wielinga, et.al., 2001). Pada bakteri tersebut reduksi besi merupakan proses penerimaan elektron terminal (TEAP, terminal electron accepting process) yang dominan dan reduksi tak langsung terhadap kromat oleh hasil samping respirasi tampaknya merupakan jalur reduktif utama seperti pada reaksi berikut:
¾ C3H5O3
+ 3Fe(OH)3 ¾ C2H3O2
+ 3Fe2+ + ¾ HCO3
+ 2H2O + 5¼ OH
(1)
3Fe2+ + HCrO4
+ 8H2O 3Fe(OH)3 + Cr(OH)3 + 5H+ (2)
Reduksi Krom (VI) secara Enzimatis pada Beberapa Bakteri
Pseudomonas putida PRS2000 yang dipelajari oleh Ishibashi dan kawan-kawan (1990) diketahui memiliki aktivitas enzim kromium reduktase dalam ekstrak sel, sementara pada fraksi membran sel tidak ditemukan aktivitas pereduksi krom (VI). Enzim terlarut ini bersifat heat labile dimana pemanasan pada 50oC selama 10 menit dapat menurunkan aktivitas hingga 40-50%, sementara pH optimum diperoleh pada kisaran 6,5 – 7,5. Ekstrak enzim dari sel
P. putida PRS2000 membutuhkan NADH atau NADPH sebagai donor elektron untuk mereduksi kromat. Walau konsentrasi sulfat dalam medium mempengaruhi sensitivitas seluler terhadap Cr(VI) (sebagai CrO42-) (Ohtake, et.al., 1987),
reduksi kromat tidak dipengaruhi oleh sulfat dan oksianion lain (SO32-, MoO42-,
VO42-, PO42-, dan NO3-), serta Cr3+. Hg2+ dan Ag+ merupakan inhibitor kuat bagi
enzim ini.
Enzim solubel pereduksi Cr(VI) yang didapatkan dari ekstrak periplasma sel P. putida MK1 (Park, et.al., 2000) memiliki perbedaan dari P. putida
PRS2000, dimana enzim MK1 memiliki pH optimum 5,0 dan suhu optimum 80oC. Selain itu, enzim MK1 ini dihambat oleh sulfat, sedangkan enzim PRS2000 tidak terhambat. Karena kromat dengan mudah melewati membran sel dan di dalam sitoplasma bersifat toksik, maka sifat enzim MK1 sebagai protein periplasmik memberi keuntungan bagi sel karena detoksifikasi kromat dapat langsung terjadi begitu kromat memasuki sel bakteri.
Proses reduksi enzimatis ekstraseluler ditemukan di bakteri Enterobacter cloacae HO1, Escherichia coli ATCC 33456, dan Ochrobactrum anthtopi. Wang,
et.al. (1990) mendapatkan bahwa, pada Enterobacter cloacae HO1 dalam kondisi anaerobik, aktivitas tertinggi enzim yang dapat mereduksi Cr(VI) terdapat di fraksi membran sel. Aktivitas enzim kromat-reduktase membran paling tinggi (yaitu sebesar 5,47 µg CrO42-/menit/mg protein) terjadi ketika fenazin metosulfat
yang telah direduksi oleh asam askorbat ditambahkan sebagai donor elektron ke dalam medium. Pemanasan membran sel pada 100oC selama satu menit menyebabkan hilangnya aktivitas reduksi (Wang, et.al, 1990). Penelitian terhadap
reduksi enzimatis ekstraseluler mendominasi reduksi Cr(VI) dan hanya sebagian kecil saja Cr(VI) ditemukan di dalam sel dan tereduksi menjadi Cr(III). Akumulasi kromium dipermukaan sel menyebabkan permukaan sel menjadi kasar.
Reduksi enzimatis Cr(VI) menjadi Cr(III) secara intraseluler ditemukan pada P. ambigua G-1 (Suzuki, et.al.,1992), P. putida (Ishibashi et al., 1990; Park, et.al., 2000; Ackerley, et.al., 2004), dan P.fluorescens (Mc Lean, 2000 dan 2001) yang menggunakan enzim reduktase terlarut yang terdapat di dalam sitoplasma untuk mereduksi kromat baik secara aerobik maupun anaerobik. Walau demikian laju reduksi tertinggi terjadi di dalam kondisi anaerobik. Beberapa enzim yang diketahui memiliki aktivitas pereduksi-Cr(VI) adalah glutation reduktase, aldehida oksidase, dan sitokrom P-450 (Suzuki, et.al., 1992).
Suzuki, et.al. (1992) mendapatkan bahwa ekstrak sel P. ambigua G-1 membutuhkan 3 mol NADH sebagai donor elektron untuk mereduksi secara enzimatis 1 mol Cr(VI) menjadi Cr(III). Dalam reaksi ini, Cr(V) terbentuk sebagai senyawa antara sehingga Suzuki dan kawan-awan menyimpulkan bahwa reaksi reduksi Cr(VI) adalah reaksi dua tahap. Pertama, Cr(VI) menerima satu elektron dari satu molekul NADH dan menghasilkan senyawa antara Cr(V). Tahap kedua, senyawa antara Cr(V) menerima dua elektron dari dua molekul NADH sehingga terbentuk Cr(III). Tahap pertama terjadi lebih cepat dari tahap kedua. Pada kedua tahap ini, NADH berubah menjadi NAD+.
Isolat Pseudomonad CRB5 yang berkerabat dekat dengan P. fluorescens
reduksi minor Cr(VI) yang berasosiasi dengan membran ditemukan dalam kondisi anaerob non-pertumbuhan dengan adanya donor elektron organik.
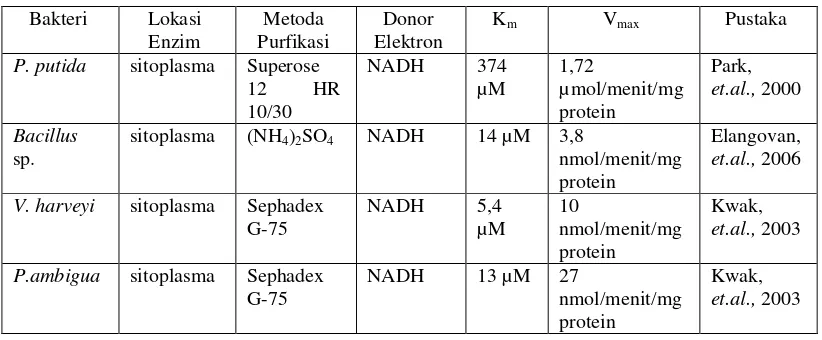
Tabel 1 menyajikan nilai Km dan Vmax enzim pereduksi Cr(VI) dari
beberapa bakteri. Enzim pereduksi Cr(VI) dari bakteri P. putida, yang telah dipurifikasi menggunakan kolom Superose 12 HR 10/30, memiliki nilai Km dan
Vmax yang lebih tinggi dibandingkan bakteri lainnya. Metoda pemurnian enzim
[image:35.595.107.518.282.452.2]mempengaruhi nilai Km dan Vmax enzim.
Tabel 1. Nilai Km dan Vmax dari enzim peredusi Cr(VI) yang diisolasi dari
beberapa jenis bakteri.
Bakteri Lokasi
Enzim
Metoda Purfikasi
Donor Elektron
Km Vmax Pustaka
P. putida sitoplasma Superose
12 HR
10/30
NADH 374
µM
1,72
µmol/menit/mg protein
Park,
et.al., 2000
Bacillus
sp.
sitoplasma (NH4)2SO4 NADH 14 µM 3,8
nmol/menit/mg protein
Elangovan,
et.al., 2006
V. harveyi sitoplasma Sephadex G-75
NADH 5,4
µM
10
nmol/menit/mg protein
Kwak,
et.al., 2003
P.ambigua sitoplasma Sephadex G-75
NADH 13 µM 27
nmol/menit/mg protein
Kwak,
et.al., 2003
16S RNA Ribosom (rRNA)
RNA ribosom (rRNA) merupakan komponen inti dari mesin pembentuk protein pada semua makhluk hidup yaitu ribosom. Molekul rRNA bersifat ubikuitus dengan fungsi yang identik pada seluruh organisme (Pangastuti, 2006). Ribosom merupakan kompleks ribonukleoprotein yang terdiri atas dua subunit yaitu subunit kecil (small subunit) dan subunit besar (large subunit). Terdapat tiga jenis RNA dalam ribosom prokaryot berdasarkan nilai koefisien sedimentasi, yaitu 5S, 16S, dan 23S rRNA. 16S rRNA merupakan bagian dari subunit kecil
ribosom dan berperan penting dalam pengenalan ujung 5’-mRNA serta memposisikannya pada letak yang tepat dalam ribosom.
mengalami perubahan dengan relatif lambat dan mencerminkan kronologi evolusi bumi. Sebaliknya, urutan basa yang bersifat variatif dapat digunakan untuk melacak keragaman dan menempatkan galur-galur dalam satu spesies (Pangastuti, 2006).
[image:36.595.207.449.332.626.2]Dari tiga jenis rRNA yang dimiliki prokaryot, gen penyandi 16S rRNA paling sering digunakan sebagai penanda molekuler karena memiliki ukuran basa yang paling ideal dari segi analisis statistika dibandingkan gen penyandi 5S rRNA dan 23S rRNA. Molekul 5S rRNA memiliki ukuran basa yang terlalu pendek sehingga tidak ideal untuk analisis statistika, sementara molekul 23S rRNA memiliki srtuktur sekunder dan tersier yang cukup panjang sehingga menyulitkan analisis (Pangastuti, 2006).
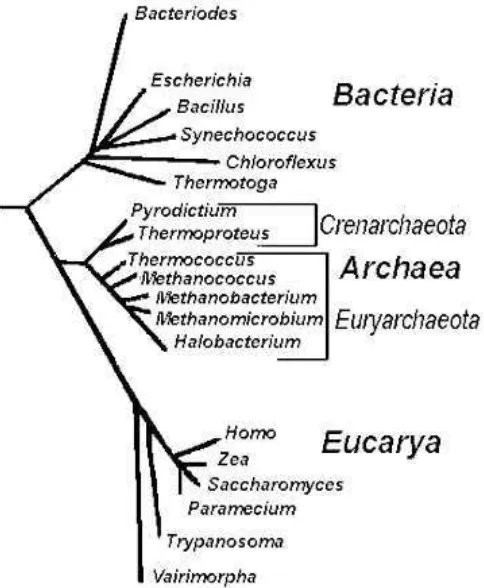
Gambar 2. Pohon filogenetik rDNA
(http://lecturer.ukdw.ac.id/dhira/ClassAndPhylo/molPhylogeny.html)
memperkirakan laju penyebaran bakteri (Weisburg, et.al., 2001). Penelitian mengenai kekerabatan evolusioner di antara mikroorganisme berdasarkan perbandingan urutan basa 16S rDNA dipelopori oleh Carl Woese (Krane and Raymer, 2003). Berdasarkan urutan basa 16S rDNA, Woese mengajukan tiga Domain dalam sistem klasifikasi yaitu Archaea, Bacteria, dan Eucarya (Gambar 2). Dua bakteri dapat dikelompokkan dalam satu genus bila memiliki kemiripan maksimum (maximum identity) > 93% (Hagstrom, et.al., 2002), sementara dua bakteri dianggap sebagai satu spesies bila memiliki kemiripan maksimum >97% (Hagstrom, et.al., 2002; Schloss and Handelsman, 2004; Pangastuti, 2006).
Reaktor Pengolah Limbah Pelapisan Krom
Cr(VI) mudah tereduksi oleh Fe(II) di alam (Moore and Ramamoorthy, 1984). Mineral besi yang melimpah, seperti pirit dan mineral besi-sulfur lainnya, memegang peranan penting dalam siklus geokimia sejumlah unsur-unsur renik termasuk kromium (Houda, et.al.,2007).
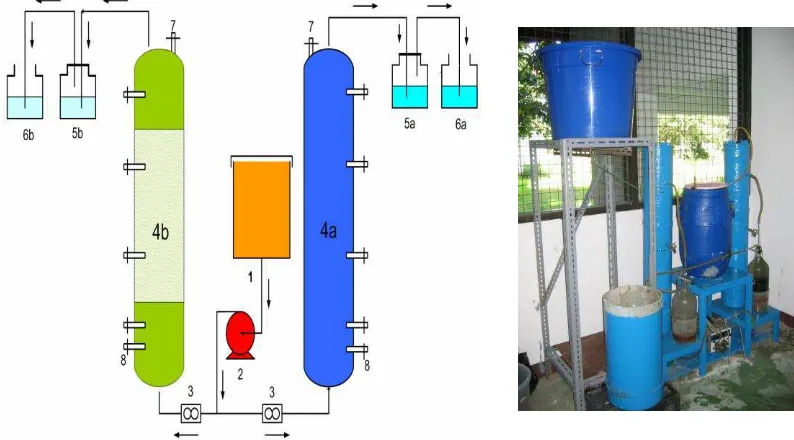
Laboratorium Pengendalian Pencemaran di Puslit Limnologi LIPI telah mengembangkan reaktor kolom pengolahan limbah cair Cr(VI) yang berasal dari produk akhir limbah pelapisan logam berdasarkan reaksi reduksi-oksidasi antara krom dan besi. Disain reaktor tersebut dapat dilihat pada Gambar 8. Spesifikasi reaktor kolom pengolahan limbah Cr(VI) sebagai berikut:
Dimensi : Diameter : 16 cm
Tinggi : 80 cm
Volume void : 16 L Media Reaktor : tinggi 70 cm Komposisi: Fe(0) diameter : 10 mm Karakteristik: Porosity Fe : 10,7349%
Bulk sample : 1,7945 gram/cm3 Q (Loading rate) : 4 Liter/hari
HRT : 0,5 day
Gambar 3. Disain reaktor kolom dan Instalasi reaktor kolom pengolahan limbah cair pelapisan logam dan limbah dari kegiatan analisis Laboratorium Hidrokimia P2-Limnologi LIPI.Keterangan: 1. Influent; 2. Pompa; 3. Flowmeter; 4a. Reaktor kolom 1; 4b. Reaktor kolom 2; 5a.
Effluent 1 (tertutup); 5b. Effluent 2 (tertutup); 6a. Gas Buangan (terbuka, larutan NaCl); 6b. Gas Buangan (terbuka, larutan NaCl); 7. Gas Port; 8.
Sampling Port
Prinsip reaktor pengolah limbah ini adalah berdasarkan reaksi reduksi-oksidasi antara Cr(VI) dan Fe(0) yang menghasilkan Cr(III) dan Fe(II) dan Fe(III). Ketika Fe(0) terendam air anoksik maka akan terjadi korosi secara elektrokimia dan elektron-elektron dilepaskan pada suatu area (bagian anoda). Sementara pada bagian katoda ion-ion hidrogen dihasilkan dari disosiasi air untuk memproduksi atom-atom hidrogen atau molekul-molekul pada daerah katoda:
Fe0 Fe2+ + 2e- anoda 2H+ + 2e- H2(g) katoda
____________________________________ Fe0 + 2H+ Fe2+ + H2(g) reaksi
Fe0 Fe3+ + 3e- anoda
CrO42- + 4H2O+ 3e- Cr(OH)3 + 5OH- katoda
__________________________________________________ Fe0 + CrO42- + 4H2O Fe3+ + Cr(OH)3 + 5OH- reaksi
Reaksi redoks melibatkan oksidasi Fe0 dengan oksigen terlarut dan reduksi ion kromat dengan kation Fe(II), berdasarkan persamaan berikut:
2Fe0 + O2 +H2O 2Fe2+ +4OH- (1)
Fe2+ + CrO42- + 4H2O Fe(OH)3 +Cr(OH)3 + 2OH- (2)
Reaksi ini meningkatkan pH pada sistem dan membentuk Cr(III) dalam bentuk hidroksida tak larut (Crx Fe1-x )(OH)3 sebagai hasil reduksi kromat.
Reaktor pengolahan ini menggunakan dua jenis materi Fe(0) yang memiliki ukuran partikel berbeda. Pada reaktor kolom 1, Fe(0) yang digunakan berupa partikel halus dan pada reaktor kolom 2, Fe(0) yang digunakan berbentuk memanjang. Bahan materi besi Fe(0) diperoleh dari produk sisa pembubutan besi. Ukuran partikel Fe(0) yang berbeda menyebabkan adanya perbedaan porositas, Fe(0) berbentuk partikel halus memiliki porositas 4,7911 % dan bulk sample
[image:39.595.147.515.563.655.2]1,6605 gram/cm3 (hasil analisis Laboratorium Geologi – Badan Geologi) (Gambar 9).
Gambar 4. Ukuran Fe(0) yang digunakan pada reaktor kolom; (a) 1 cm, (b) memanjang 1-2 cm dan (c) partikel halus
Rahayu dan Tontowi (2000) menggunakan FeSO4 untuk mereduksi
Cr(VI) dalam air limbah industri tekstil, industri penyamakan kulit, dan industri
pembuatan shampoo (konsentrasi Cr(II) 0,275 – 1,22 mg/L) dengan persentase penyisihan mencapai 100%,. Pada sistem ini, FeSO4 selain berperan sebagai
pereduksi senyawa ini juga bertindak sebagai koagulan. Sementara Houda dan kawan-kawan (2007) menggunakan mineral besi pirit untuk mereduksi Cr(VI) sebagai kromat. Houda mendapatkan bahwa laju penyisihan kromat dipengaruhi oleh konsentrasi awal pirit dan kromat, pH, suhu, dan jenis pirit. Penyisihan kromat meningkat dalam kondisi asam (pH 3) dan suhu tinggi (37oC).
Walaupun sistem pengolahan limbah krom(VI) yang memanfaatkan reaksi redoks antara Fe0 – Cr6+ tersebut relatif murah dan bahannya mudah didapat, metoda ini memiliki kelemahan. Dari penelitian pendahuluan didapatkan bahwa pada reaktor tersebut penurunan konsentrasi Cr6+ ternyata disertai kenaikan konsentrasi yang tinggi dari Fe2+ dan Fe3+, serta pembentukan gas H2S.
Konsentrasi Fe2+ terlarut dalam inlet reaktor meningkat dari 0,181 mg/L menjadi 68,062 mg/L dalam outlet reaktor, sementara Fe3+ terlarut yang awalnya 0,984 mg/L meningkat menjadi 50,838 mg/L. Selain itu, pada outlet reaktor terbentuk H2S sebesar 2,562 mg/L. Walaupun besi relatif kurang toksik dibandingkan
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan di Laboratorium Mikrobiologi dan Laboratorium Rekayasa Genetika Puslit Limnologi LIPI Cibinong, Laboratorium Bioremediasi Puslit Bioteknologi LIPI Cibinong, dan Laboratorium Mikrobiologi PT Charoen Pokphan Jakarta. Waktu pelaksanaan dimulai pada bulan September 2008 hingga bulan Juni 2009.
Alat dan Bahan
Alat
Alat yang digunakan dalam penelitian ini adalah: pH meter, sentrifus merk IEC Sentra tipe MP-4R, orbital shaker, otoklaf, pipet mikro, pengaduk vortex, inkubator, mikroskop digital merk DinoLite, penyaring vakum, spektrofotometer UV-Vis merk Hach tipe DR/2010, elektroforesis BioRad Mini-Sub Cell GT CA, PCR merk TOUCH, neraca analitik, pengaduk magnetik, sonikator, dan peralatan gelas.
Bahan
Bahan yang digunakan adalah efluen reaktor pengolahan limbah pelapisan logam (asal kawasan industri Kabupaten Bekasi) yang terdapat di Laboratorium Prototipe Puslit Limnologi LIPI Cibinong, medium PYECr-25 25% dalam bentuk
cair dan padat (komposisi pada Lampiran 1) yang diperkaya dengan efluen pengolahan limbah sebanyak 1%, air demin (demineralized water), K2CrO4,
membran selulosa merk Whatman dengan ukuran pori 0,45 µm, buffer Tris-HCl,
bovine serum albumin, Comassie brilliant blue G-250, asam fosfat 85%, metanol, NADH disodium salt, H2SO4, difenil karbazid, KOH 3%, PrepMan Ultra
(Applied BioSystem), GoTaq Green Master Mix (Promedia), primer DNA, dan
Metode Penelitian
Isolasi Bakteri Tahan Krom
Sebanyak 100 uL air outlet reaktor pengolahan limbah pelapisan logam, yang terdapat di Laboratorium Pengendalian Pencemaran Puslit Limnologi LIPI Cibinong, diaduk dengan pengaduk vortex lalu disebarkan pada medium padat
Peptone Yeast Extract (PYE) 25% yang mengandung krom(VI) 25 mg/L sebagai K2CrO4 (medium ini selanjutnya disebut PYECr-25 25%). Inokulum diinkubasi
selama 2 hari pada suhu 30oC. Bakteri-bakteri yang muncul pada medium dengan kandungan krom tertinggi kemudian ditumbuhkan kembali pada medium padat PYECr-25 25%. Isolat-isolat yang diperoleh kemudian disimpan pada agar miring
dalam lemari pendingin. Peremajaan isolat dilakukan dengan cara menumbuhkan biakan stok sebanyak satu mata ose di dalam medium agar PYECr-25 25%.
Uji Ketahanan Terhadap Krom(VI)
Uji ketahanan bakteri terhadap 50, 100, dan 250 mg/L Cr(VI) dilakukan berdasarkan metoda yang digunakan oleh Luli dan kawan-kawan (1983) yang dimodifikasi. Sebanyak satu mata ose isolat bakteri dari medium cair PYECr-25
25% disebarkan di medium agar PYECr-25 25% dalam diameter 5 mm. Di atas
sebaran tadi diletakkan kertas saring steril berdiameter 8 mm yang masing-masing telah direndam semalam dalam larutan K2CrO4 50,100, dan 250 mg/L
serta dikeringkan dalam suhu 37oC selama 2 jam. Kultur diinkubasi selama 24-48 jam pada suhu 30oC. Pembentukan koloni di pinggir kertas saring menunjukkan bahwa isolat tahan terhadap Krom(VI). Sebagai pembanding, digunakan isolat
Alcaligenes sp. dan Pseudomonas stutzeri koleksi Labortorium Mikrobiota Puslit Limnologi LIPI.
Identifikasi Isolat
warna koloni, bentuk koloni, dan bentuk sel bakteri. Dari masing-masing kelompok diambil satu koloni yang memiliki ukuran diameter terbesar sebagai calon isolat unggul. Calon isolat unggul tersebut diamati reaksi Gram menggunakan teknik Ryu (Powers, 1995).
Seleksi Isolat Bakteri Tahan Cr(VI)
Calon isolat bakteri unggul diamati kurva pertumbuhannya dalam medium cair PYECr-25 25% (suhu 30oC, 100 rpm) untuk mengetahui fase eksponensialnya.
Selanjutnya dibuat kultur bakteri dalam kondisi yang sama hingga mencapai fase eksponensial. Sebanyak 1,0 mL kultur diambil dan dimasukkan ke dalam tabung Eppendorf. Biakan disentrifus pada kecepatan 8000 g selama 6 menit pada suhu 20oC. Pelet bakteri kemudian dicuci tiga kali dengan 1,0 mL medium cair PYE
Cr-25 25%; pada tiap pencucian, pelet bakteri dipisahkan dari supernatan dengan
sentrifugasi. Selanjutnya pelet bakteri diresuspensi dalam 1,0 mL medium cair PYECr-25 25% dan diinkubasi selama 2 jam pada suhu 30oC sambil di-shaker pada
kecepatan 100 rpm. Setelah dua jam, kultur bakteri diaduk dalam pengaduk
vortex dan dipipet sebanyak 100 uL untuk perhitungan jumlah sel menggunakan metoda pengenceran bertingkat. Sisa kultur disentrifus pada kecepatan 8000 g dan suhu 20oC selama 6 menit. Supernatan dipisahkan kemudian dianalisis kadar Cr(VI) dalam supernatan secara spektrofotometri menggunakan metoda difenil karbazid (Lampiran 3).
Untuk mengetahui jumlah krom yang diserapkan oleh isolat, dilakukan juga pengukuran kadar awal Cr6+ dalam medium sebelum inkubasi. Sebagai kontrol untuk mengetahui adanya penyisihan krom oleh medium, digunakan medium tanpa bakteri yang diinkubasikan pada kondisi yang sama. Selanjutnya dihitung daya penyisihan tiap isolat bakteri. Daya penyisihan isolat didefinisikan sebagai jumlah krom(VI) yang hilang dari medium tiap satuan waktu untuk setiap sel isolat, yang dihitung menurut persamaan:
dimana:
A : selisih kadar Cr6+ (dalam satuan mg/L) sebelum dan sesudah inkubasi dalam medium kultur uji.
fk : selisih kadar Cr6+ (dalam satuan mg/L) sebelum dan sesudah inkubasi dalam medium kontrol tanpa bakteri.
B : Jumlah sel dalam kultur uji (sel/L) T : Waktu uji (menit)
Isolat unggul, yaitu isolat yang memiliki nilai daya penyisihan tertinggi, akan digunakan dalam pengujian selanjutnya.
Isolasi DNA Genom
Isolasi DNA genom merupakan tahap awal dalam analisis 16S rRNA. DNA genom bakteri diisolasi dari kultur murni isolat nomor 15 yang dibiakkan dalam medium agar PYECr-25 25% selama 48 jam. Sebanyak satu mata ose biakan
dimasukkan ke dalam tabung Eppendorf yang telah berisi 200 µL pereaksi campuran Prepman Ultra (Applied BioSystem, www.acugenix.com) dan diaduk menggunakan vortex selama 15 detik. Suspensi dipanaskan dalam penangas air bersuhu 100oC selama 10 menit kemudian didinginkan dalam suhu ruang selama 2 menit, campuran disentrifugasi pada kecepatan 10.000 rpm selama 2 menit pada suhu 4oC. Supernatan dipisahkan dari pelet dan disimpan pada suhu 4oC sebelum digunakan sebagai cetakan DNA pada tahap amplifikasi DNA menggunakan
polymerase chain reaction (PCR).
Amplifikasi Gen 16S rDNA
Gen bakteri yang menyandikan 16S rRNA (rDNA) diamplifikasi dalam PCR menggunakan universal primer yaitu primer 9F(5’
-GAGTTTGATCCTGGCTCAG) dan primer 1492R(5’
-GGCTACCTTGTTACGACTT). Terlebih dahulu dibuat 96 µL campuran pereaksi dalam tabung Eppendorf yang terdiri atas 50 µL GoTaq Green Master Mix, 2 µL masing-masing primer 9F dan 1492R, dan 42 µL air bebas nuklease. Ke dalam campuran tadi kemudian dimasukkan 4 µL DNA genom bakteri sebagai cetakan. Campuran segera dimasukkan ke dalam PCR dengan kondisi
Annealing primer (55oC, 30 detik), Elongation (75oC, 1 menit), dan Post PCR (75oC, 5 menit). Jumlah siklus polimerisasi DNA sebanyak 30 kali.
Sebanyak 10 µL DNA hasil PCR (amplikon) kemudian di-running pada mesin elektroforesis (BioRad) selama 25 menit dengan menggunakan arus sebesar 100 V. Konsentrasi agarose yang digunakan adalah sebesar 2%, sedangkan sebagai running buffer digunakan bufer 1xTAE (pH 8,0). Spot hasil elektroforesis kemudian dilihat di bawah UV Transiluminator.
Pemurnian Amplikon
Wizard SV Gel and PCR Clean System (www.promega.com) digunakan untuk memurnikan amplikon. Sebanyak 90 µL amplikon dimasukkan ke dalam satu set SV Minicolumn, kemudian ditambahkan membrane binding solution
sebanyak volume amplikon yang digunakan dan didiamkan selama 1 menit pada suhu ruang. Kolom disentrifugasi pada kecepatan 12.000 x g selama 1 menit pada suhu ruang. Amplikon yang terikat pada kolom dicuci dengan 700 µL membrane wash solution dan disentrifugasi pada kecepatan 12.000 x g selama 5 menit pada suhu ruang. Amplikon dicuci kembali dalam 500 µL larutan pencuci dan disentrifugasi pada kondisi yang sama. Supernatan dibuang dan kolom disentrifus kembali dalam kondisi tabung terbuka untuk menguapkan sisa larutan pencuci. Amplikon yang terikat di kolom kemudian dilarutkan dalam 50 µL air bebas nuklease. Kolom dibiarkan dalam suhu ruang selama 1 menit , kemudian disentrifugasi pada kecepatan 12.000 x g selama 1 menit. Supernatan dipisahkan dan konsentrasi DNA dalam supernatan dianalisis menggunakan spektrofotometer pada panjang gelombang 260 nm (Mac Kenzie, 1990). Supernatan yang diperoleh kemudian digunakan dalam analisis urutan basa (sequencing).
Penentuan Urutan Nukleotida Gen 16S rDNA
rDNA berbagai jenis bakteri menggunakan program BLASTN (http://blast.ncbi.nlm.nih.gov.) untuk mengetahui kekerabatan filogenetik isolat bakteri.
Ekstraksi Enzim Krom(VI) Reduktase Ekstraseluler, Periplasma, dan Sitoplasma
Isolat bakteri dibiakkan dalam medium cair PYECr-25 100% selama 24 jam
dengan perbandingan 1:10 pada suhu 30oC dan kecepatan pengadukan 100 rpm.. Biakan disentrifus pada kecepatan 5000 g selama 10 menit pada suhu 4oC. Supernatan disaring dalam kondisi steril menggunakan membran selulosa nitrat Whatman dengan ukuran pori-pori 0,45 µm. Hasil saringan yang mengandung enzim ekstraseluler digunakan untuk uji aktivitas reduksi Cr(VI) ekstraseluler pada tahap selanjutnya.
Pelet bakteri yang diperoleh dari tahap sentrifugasi selanjutnya diekstraksi menurut metoda Van der Westen dkk untuk mendapatkan protein periplasma (Michel, et.al. 2001). Pelet bakteri dicuci dalam larutan fisiologis NaCl 0,85% dan diresuspensi dalam campuran buffer Tris-HCl dan EDTA, yang konsentrasi akhir masing-masing larutan sebesar 100 mM dan pH 9. Suspensi bakteri diinkubasi selama 30 menit dalam suhu 37oC. Kemudian suspensi tersebut disentrifus selama 15 menit pada kecepatan 12.000 x g dan suhu 4oC. Supernatan yang mengandung ekstrak kasar enzim periplasma dipisahkan, sedangkan pelet bakteri yang diperoleh digunakan untuk mengekstrak bahan sitoplasma.
Ekstrak kasar enzim sitoplasma dipisahkan dari debris dengan cara sentrifugasi pada kecepatan 12.000 x g selama 30 menit pada suhu 4oC dan total volume ekstrak enzim yang diperoleh kemudian diukur.
Kadar protein dalam ekstrak kasar enzim ekstraseluler, enzim periplasma, dan enzim sitoplasma dianalisis secara spektrofotometri menggunakan metoda Bradford (Mac Kenzie, 1990) (Lampiran 2).
Uji Aktivitas Enzim Krom(VI) Reduktase
Dibuat campuran pereaksi dalam tabung Eppendorf yang terdiri atas 0,12 mL ekstrak enzim, 0,24 mL air demin, dan 0,12 mL buffer Tris-HCl 125 mM dengan tiga ulangan sampel. Sebagai kontrol negatif, digunakan campuran pereaksi dengan komposisi yang sama yang telah dipanaskan dalam air mendidih (suhu 96-100oC) selama 2 menit. Uji aktivitas enzim krom(VI) reduktase dilakukan dengan cara memipet substrat yaitu 0,12 mL K2CrO4 1,0 mM ke dalam
campuran pereaksi. Selanjutnya diinkubasi pada suhu 30oC selama 30 menit. Reaksi enzimatis pada sampel uji dihentikan dengan memanaskannya dalam air mendidih selama 2 menit. Setelah didinginkan dalam suhu ruang, larutan uji disentrifus pada kecepatan 12.000 x g dan suhu 4oC selama 5 menit untuk menurunkan uap air yang menempel di dinding tabung. Dianalisis kadar Cr(VI) dalam larutan uji dan kontrol dengan cara memipet 0,5 mL sampel ke dalam tabung reaksi, kemudian ditambahkan secara berturut-turut 0,1 mL larutan difenil karbazida 0,5% (w/v dalam aseton) dan 4,5 mL H2SO4 0,1 M. Warna merah-pink
yang terbentuk diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 540 nm. Sebagai larutan standar digunakan larutan K2CrO4
pada konsentrasi 0 – 0,2 mM. Kadar Cr(VI) dalam sampel dihitung dengan menggunakan kurva kalibrasi standar.
Dari hasil analisis kadar Cr(VI), dihitung selisih penurunannya antara larutan kontrol dan larutan uji. Unit aktivitas enzim Cr(VI) reduktase didefinisikan sebagai nmol K2CrO4 yang hilang tiap menit dan aktivitas spesifik
Pengaruh Donor Elektron Terhadap Aktivitas Enzim
Pada uji ini, sebagai donor elektron digunakan NADH dengan konsentrasi akhir dalam larutan uji sebesar dua kali konsentrasi substrat K2CrO4 (Park, et.al.,
2000). Uji aktivitas enzim krom(VI) reduktase dilakukan dengan cara memipet 0,12 mL K2CrO4 1,0 mM ke dalam campuran pereaksi dalam tabung Eppendorf
yang terdiri atas 0,12 mL ekstrak enzim, 0,12 mL air demin, 0,12 mL NADH 2 mM, dan 0,12 mL buffer Tris-HCl 125 mM. Tahap selanjutnya dilakukan sama dengan uji aktivitas enzim krom(VI) reduktase di atas.
Dari hasil analisis kadar Cr(VI), dihitung selisih penurunannya antara larutan kontrol dan larutan uji. Unit aktivitas enzim Cr(VI) reduktase didefinisikan sebagai nmol K2CrO4 yang hilang tiap menit dan aktivitas spesifik
HASIL DAN PEMBAHASAN
Isolat Bakteri Tahan Krom(VI)
Bakteri tahan logam dapat ditemukan dalam lingkungan alamiah atau lingkungan buatan yang mengandung ion logam dalam konsentrasi tinggi (Atlas and Bartha, 1998). Berdasarkan data penelitian yang memantau kinerja reaktor pengolahan limbah pelapisan logam yang terdapat di Laboratorium Pengendalian Pencemaran Puslit Limnologi LIPI (komunikasi pribadi) diketahui bahwa kisaran konsentrasi Cr(VI) dalam reaktor tersebut adalah berkisar antara 25-30 mg/L. Dalam kondisi yang demikian diharapkan dari efluen reaktor pengolah limbah dapat diisolasi bakteri yang tahan terhadap Cr(VI). Isolasi bakteri tahan Cr(VI) dilakukan dengan menginokulasikan efluen reaktor pengolahan limbah dalam medium agar Peptone Yeast Extract yang mengandung Cr(VI) 25 mg/L. Penambahan Cr(VI) ke dalam medium dimaksudkan agar hanya bakteri yang tahan terhadap Cr(VI) saja yang akan tumbuh. Pada tahap ini sebanyak 95 isolat bakteri berhasil diisolasi dari efluen reaktor pengolahan limbah.
Seluruh isolat bakteri yang diperoleh diuji ketahanannya terhadap Cr(VI) 50, 100, dan 250 mg/L. Uji ketahanan dimaksudkan sebagai seleksi awal bagi isolat unggul. Uji ini dilakukan dengan menggunakan metoda Luli, et.al., (1983) dan ketahanan terhadap Cr(VI) diketahui dengan kemunculan koloni bakteri pada tepi kertas saring dalam waktu 24-48 jam (Gambar 5).
Kertas saring
[image:49.595.169.454.541.701.2]Dari uji ketahanan didapatkan bahwa ke-95 isolat bakteri memiliki ketahanan terhadap Cr(VI) 50 mg/L dan 100 mg/L. Sementara pada konsentrasi Cr(VI) 250 mg/L hanya satu isolat uji, yaitu isolat nomor 84, yang tidak dapat tumbuh dalam kondisi tersebut. Fakta bahwa hanya satu isolat saja yang tidak dapat tumbuh dalam Cr(VI) 250 mg/L menunjukkan bahwa isolat-isolat bakteri yang diperoleh dari efluen reaktor pengolahan limbah memiliki ketahanan yang baik terhadap Cr(VI). Hal ini dikuatkan juga dengan penggunaan bakteri pembanding yaitu Alcaligenes sp. dan Pseudomonas stutzeri dalam uji ketahanan. Kedua bakteri pembanding tidak dapat tumbuh dalam waktu 48 jam pada konsentrasi Cr(VI) 250 mg/L.
Gambar 6. Bentuk koloni ke enam isolat bakteri tahan Cr(VI).
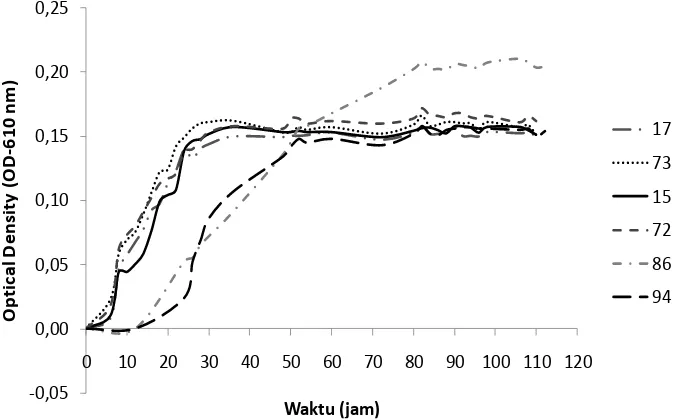
dan bentuk sel bakteri ke-94 isolat bakteri tahan Cr(VI), diperoleh enam kelompok bakteri. Dari masing-masing kelompok bakteri diambil satu isolat yang memiliki ukuran diameter koloni terbesar sebagai calon isolat unggul untukdiuji lanjut. Diharapkan bakteri dari koloni berukuran terbesar memiliki daya tahan terhadap Cr(VI) yang paling baik. Keenam isolat tersebut adalah isolat nomor 15, 17, 72, 73, 86, dan 94. (Gambar 6). Dari hasil uji Gram, diketahui bahwa isolat nomor 15, 17, 72, 73, dan 86 bersifat Gram negatif, sedangkan isolat nomor 94 bersifat Gram positif. Pengamatan kurva tumbuh ke enam isolat uji yang ditumbuhkan dalam medium cair PYECr-25 25% bertujuan untuk mengetahui fase
eksponensial bakteri. Pengamatan dilakukan dalam dua ulangan. Fase eksponensial perlu diketahui karena diperlukan dalam tahap uji penyisihan Cr(VI) untuk seleksi isolat unggul. Kurva tumbuh keenam isolat dapat dilihat pada Gambar 7. Dari kurva tersebut terlihat bahwa isolat 15, 17, 72, dan 73 yang bentuk koloninya hampir sama ternyata memiliki pola kurva pertumbuhan yang hampir sama, dengan fase eksponensial pada waktu 18 jam. Isolat bakteri nomor 86 dan 94 menunjukkan pola pertumbuhan yang berbeda, dengan fase eksponensial lebih lama yaitu masing-masing 54 jam dan 35 jam.
-0,05 0,00 0,05 0,10 0,15 0,20 0,25
0 10 20 30 40 50 60 70 80 90 100 110 120
[image:51.595.142.483.464.674.2]O p ti c a l D e n si ty ( O D -6 1 0 n m ) Waktu (jam) 17 73 15 72 86 94
(B)
Gambar 7. Bentuk kurva pertumbuhan ke enam isolat bakteri tahan Cr(VI).
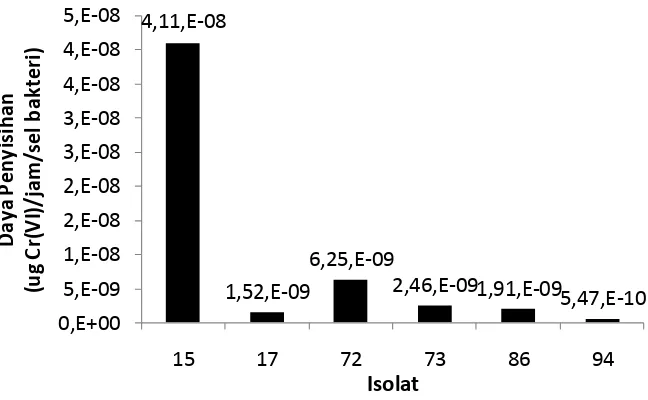
isolat unggul dipilih berdasarkan nilai rata-rata daya penyisihan yang tertinggi. Dari uji daya penyisihan Cr(VI) didapatkan bahwa isolat nomor 15 memiliki daya penyisihan Cr(VI) terbesar dengan nilai 4,11 x 10-8 µg Cr(VI)/jam/sel bakteri sedangkan daya penyisihan terkecil dimiliki oleh isolat nomor 94 dengan nilai daya penyisihan sebesar 5,47 x 10-10 µg Cr(VI)/jam/sel bakteri (Gambar 8). Tingginya daya penyisihan isolat nomor 15 diduga berhubungan dengan laju pertumbuhannya yang relatif cepat dibandingkan isolat 94 dan 86. Oleh karena itu, isolat nomor 15 potensial untuk dijadikan agen bioremediasi untuk Cr(VI) dalam lingkungan perairan.
4,11,E-08 1,52,E-09 6,25,E-09 2,46,E-091,91,E-095,47,E-10 0,E+00 5,E-09 1,E-08 2,E-08 2,E-08 3,E-08 3,E-08 4,E-08 4,E-08 5,E-08
15 17 72 73 86 94
[image:52.595.147.471.295.495.2]D a y a P en y isi h a n (u g C r( V I) /j a m /sel b a k ter i) Isolat
Gambar 8. Nilai daya penyisihan isolat bakteri tahan Cr(VI).
Hasil Identifikasi Isolat Unggul Tahan Cr(VI)
1200 bp
1000 bp
500 bp
100 bp
Marker 15 Marker
[image:53.595.216.415.89.244.2]2000 bp 4300 bp 23130 bp
Gambar 9. Hasil elektroforesis amplikon
Konsentrasi DNA hasil pemurnian amplikon adalah sebesar 3600 ng/µ L dengan volume total hasil pemurnian sebanyak 50 µL. Konsentrasi DNA ini cukup untuk analisis urutan basa. Jumlah DNA yang diperlukan dalam analisis urutan basa berkisar antara 200-500 ng DNA dengan volume larutan DNA berkisar antara 8-11 uL (Spangler, 2002).
Kromatogram dari primer 1492R memiliki lebih banyak gangguan (noise) daripada kromatogram dari primer 9F (Lampiran 5). Sumber kesalahan pada hasil sekuen dapat berasal dari penanganan sampel, tahap sekuensing, dan adanya variasi secara intergenom maupun secara intraspesies (Hagstrom, et.al., 2002). Rendahnya kualitas kromatogram dapat diatasi antara lain dengan merubah suhu
annealing pada tahap amplifikasi rDNA genom atau pada tahap analisis urutan basa dan menaikkan jumlah pereaksi ddNTP dan pewarna pada tahap analisis urutan basa (Harwood and Wipat, 2001). Suhu annealing (55oC) pada amplifikasi rDNA menggunakan PCR sudah sesuai karena primer 9F dan 1492R memiliki nilai Tm rata-rata sebesar 57. Amplifikasi DNA yang optimal dapat diketahui
dengan melakukan amplifikasi DNA pada rentang suhu antara 47oC-55oC.
Gambar 10. Hasil pensejajaran urutan basa dari primer 9F pada program BLASTN
Nilai keidentikan sebesar 96% dengan dua spesies bakter