EKSPLORASI DAN UJI PATOGENISITAS
Fusarium
spp.
ASAL RIZOSFER KELAPA SAWIT DI KEBUN PERCOBAAN
CIKABAYAN, BOGOR, JAWA BARAT
GUSTO WIRYAWAN SIMATUPANG
DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Eksplorasi dan Uji Patogenisitas Fusarium spp. Asal Rizosfer Kelapa Sawit di Kebun Percobaan Cikabayan, Bogor, Jawa Barat adalah benar karya saya dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2015
Gusto Wiryawan Simatupang
ABSTRAK
GUSTO WIRYAWAN SIMATUPANG. Eksplorasi dan Uji Patogenisitas
Fusarium spp. Asal Rizosfer Kelapa Sawit di Kebun Percobaan Cikabayan, Bogor, Jawa Barat. Dibimbing oleh EFI TODING TONDOK.
Kelapa sawit merupakan komoditas pertanian global utama dan digunakan dalam sebagian besar produk pangan dan nonpangan. Salah satu masalah utama dalam budidaya kelapa sawit yaitu penyakit tanaman yang menyerang tanaman kelapa sawit, seperti yang terjadi di kebun percobaan Cikabayan, IPB dan menyerang tanaman kelapa sawit muda. Gejalanya berupa pembengkokan pelepah daun dan diikuti nekrosis pada anak daun dari pelepah yang bengkok tersebut. Tujuan dari penelitian ini yaitu untuk mengidentifikasi cendawan patogen yang menyebabkan gejala tersebut muncul pada tanaman kelapa sawit di kebun percobaan Cikabayan, IPB. Dua puluh isolat Fusarium spp. berhasil diisolasi dari rizosfer tanaman kelapa sawit dan teridentifikasi sebagai Fusarium oxysporum
(morfotipe a dan b) dan F. solani. Sembilan isolat merupakan F. oxysporum
morfotipe a, 3 isolat F. oxysporum morfotipe b dan 8 isolat F. solani. Pada uji patogenisitas Fusarium spp., 14 isolat menyebabkan tanaman sakit dan 6 isolat tidak menyebabkan tanaman sakit. Persentase kejadian penyakit tertinggi yaitu sebesar 55% disebabkan oleh F. oxysporum morfotipe b isolat H2B.
ABSTRACT
GUSTO WIRYAWAN SIMATUPANG. The Exploration and Pathogenicity Test of Fusarium spp. from the Oil Palm Rizosphere at Cikabayan Experimental Field, Bogor, West Java. Supervised by EFI TODING TONDOK.
Oil palm is a major global agricultural commodity and being used in a large number of food and nonfood products. One of the most important problems in oil palm cultivation is plant diseases that attack oil palms. One disease problem occurs at Cikabayan experimental field that attacks young oil palm. The symptoms are frond bending and at the same time necrotic on the leaflets of oil palms. The aim of this research was to identify the fungal pathogen(s) that causing the disease symptoms shown at Cikabayan experimental field. Twenty isolates of
Fusarium spp. have been isolated from oil palm’s rizosphere and have identified as Fusarium oxysporum (morphotype a and b) and Fusarium solani. Nine isolates are F. oxysporum morphotype a, three isolates F. oxysporum morphotype b, and eight isolates are F. solani. On pathogenicity test of isolates Fusarium spp., 14 isolates were causing diseased plants and 6 isolates were not. The highest percentation of disease incidence were caused by F. oxysporum morphotype b isolate H2B at level 55% of diseases incidence.
©
Hak Cipta milik IPB, tahun 2015 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
EKSPLORASI DAN UJI PATOGENISITAS
Fusarium
spp.
ASAL RIZOSFER KELAPA SAWIT DI KEBUN PERCOBAAN
CIKABAYAN, BOGOR, JAWA BARAT
GUSTO WIRYAWAN SIMATUPANG
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Allah Yang Maha Kuasa atas segala berkat dan kasihNya sehingga penulis mampu menyelesaikan tugas akhir sarjana yang berjudul “Eksplorasi dan Uji Patogenisitas Fusarium spp. asal Rizosfer Kelapa Sawit di Kebun Percobaan Cikabayan, Bogor, Jawa Barat”.
Dengan terselesaikannya penulisan skripsi ini, penulis mengucapkan terima kasih yang sebesar-besarnya kepada Dr. Efi Toding Tondok, SP. M.Sc. sebagai dosen pembimbing skripsi yang selalu memberikan bimbingan, pengetahuan, saran, arahan, dan masukan kepada penulis. Ucapan terima kasih juga diucapkan kepada Dr. Ir. Widodo, MS yg juga turut membantu dalam penelitian ini, juga kepada Dr. Ir. Giyanto, MSi sebagai dosen pembimbing akademik yang juga turut memberikan dukungan selama masa studi penulis.
Terima kasih kepada Papa dan Mama juga kak Eci dan kak Fani selaku keluarga yang selalu mengasihi dan mendoakan penulis selama melaksanakan tugas akhir maupun selama kuliah di IPB.
Penulis juga mengucapkan banyak terima kasih kepada teman-teman penulis yang juga cukup banyak membantu penulis selama melaksanakan tugas akhir penulis.
Pada penulisan tugas akhir ini penulis menyadari masih banyak kekurangan. Oleh karena itu, penulis berharap ada masukan, kritik dan saran yang bersifat membangun dan memotivasi penulis agar dapat menuliskan karya tulis yang lebih baik. Semoga skripsi ini dapat bermanfaat bagi penulis maupun pembaca.
DAFTAR ISI
Identifikasi isolat Fusarium spp. 4
Penghitungan Kelimpahan Fusarium spp. 4
Uji Patogenisitas 4
Reisolasi Fusarium spp. 5
HASIL DAN PEMBAHASAN 6
Isolasi dan Identifikasi Isolat Fusarium spp. 6 Karakteristik morfologi isolat Fusarium oxysporum 8 Karakteristik morfologi isolat Fusarium solani 8
Uji Patogenisitas 10
Reisolasi Fusarium spp. 13
Pengaruh Isolat Fusarium spp. terhadap Tinggi Kecambah Kelapa Sawit 14
xv
DAFTAR TABEL
Tabel 1 Jumlah isolat yang berhasil diisolasi dari rizosfer tanaman kelapa sawit 6 Tabel 2 Karakteristik morfologi isolat Fusarium spp. 8 Tabel 3 Tinggi kecambah kelapa sawit pada 8 MST 15
DAFTAR GAMBAR
Gambar 1 Pertumbuhan koloni Fusarium spp. pada media KSM 7 Gambar 2 Morfologi koloni isolat umur 14 hari pada media PDA 9
Gambar 3 Morfologi mikroskopis Fusarium spp. 9
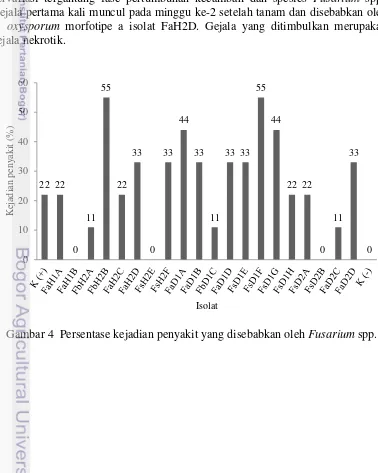
Gambar 4 Persentase kejadian penyakit yang disebabkan oleh Fusarium spp. 10 Gambar 5 Busuk kecambah yang disebabkan oleh F. oxysporum 11 Gambar 6 Gejala penyakit yang disebabkan oleh Fusarium spp. 11 Gambar 7 Gejala nekrotik yang disebabkan oleh F. solani 12 Gambar 8 Hasil reisolasi Fusarium spp. dari kecambah kelapa sawit 13
DAFTAR LAMPIRAN
Lampiran 1 Komposisi media 19
Lampiran 2 Daftar sidik ragam pengaruh isolat Fusarium spp. terhadap tinggi
kecambah pada 8 MST 19
1
PENDAHULUAN
Latar Belakang
Kelapa sawit (Elaeis guineensis Jacq.) merupakan tanaman asli Afrika yang sudah menjadi komoditas pertanian global utama. Komoditas ini digunakan dalam sejumlah besar produk pangan dan nonpangan, serta dipandang sebagai bahan bakar nabati yang menjanjikan (Teoh 2010). Indonesia saat ini menguasai pangsa produksi minyak sawit mentah atau Crude Palm Oil dunia sebesar 50.06%, dengan jumlah produksi mencapai 26.9 juta ton pada tahun 2013 dan 28.02 juta ton pada tahun 2014 (BPS 2014). Selama tiga dasawarsa terakhir konsumsi minyak sawit dunia meningkat tiga kali lipat dari semula. Tahun 2020 mendatang diperkirakan kebutuhan pangan dan energi meningkat sehingga kebutuhan minyak sawit dunia akan mencapai 60 juta ton (World Growth 2011).
Salah satu kendala bagi usaha budidaya kelapa sawit di dunia adalah penyakit tanaman yang menyerang kelapa sawit, dan saat ini di kebun percobaan Cikabayan IPB ditemukan gejala penyakit yang timbul pada tajuk kelapa sawit. Gejala tersebut berupa pembengkokan pada pelepah daun disertai lesio nekrosis yang terjadi pada anak daun dari pelepah yang bengkok tersebut. Penyakit seperti ini mirip seperti yang dilaporkan oleh Chincilla et al. (1997) dan disebut penyakit tajuk kelapa sawit. Kerugian yang ditimbulkan oleh penyakit ini mencapai 20% pada 38 bulan pertama penanaman kelapa sawit. Penyakit tajuk kelapa sawit juga dilaporkan telah menyerang perkebunan kelapa sawit di sebagian wilayah Sumatera dan Bangka Belitung dan Fusarium spp. merupakan cendawan yang paling banyak diisolasi dari tajuk tanaman yang menunjukkan gejala penyakit tersebut (Suwandi et al. 2012). Hafizi et al. (2013) berhasil mengisolasi cendawan
Fusarium solani dan F. oxysporum dari tanaman kelapa sawit yang terserang penyakit tajuk pada perkebunan kelapa sawit di Malaysia dan sebagian wilayah Sumatera.
Cendawan Fusarium merupakan patogen tular tanah yang tersebar di hampir seluruh dunia dan dapat diisolasi dari setiap lahan pertanian. Cendawan Fusarium oxysporum (Fox) merupakan salah satu dari banyak sekali patogen yang menyebabkan penyakit layu pada tanaman pertanian. Fox tidak hanya dijumpai di negara-negara Afrika maupun Indonesia saja, namun cendawan ini tersebar luas di seluruh dunia. Meskipun strain patogenik Fox dianggap mampu berkoloni di dalam pembuluh xylem tanaman, namun ada strain lain yang ternyata tidak menimbulkan penyakit bagi tanaman, faktanya kebanyakan strain Fox terbukti bersifat avirulen/nonpatogenik bagi inang di mana fusarium diisolasi. Fox yang mampu mengolonisasi akar tanaman namun tidak menimbulkan gejala penyakit dapat digolongkan sebagai strain nonpatogenik (Alabouvette dan Couteaudier 1992). F.oxysporum nonpatogenik (Fnp) merupakan saprofit yang cukup kuat bersaing dengan patogen tular tanah lainnya dalam hal pengambilan nutrisi dari sisa-sisa tanaman di tanah (Appel dan Gordon 1995). Fnp dapat berkoloni di dalam korteks tanpa menimbulkan gejala penyakit dan bertahan sebagai saprofit pada bahan organik.
2
Tujuan Penelitian
Penelitian ini bertujuan mengetahui kelimpahan cendawan Fusarium spp. pada rizosfer kelapa sawit dan mengidentifikasi cendawan Fusarium patogenik penyebab penyakit tajuk kelapa sawit di Kebun Percobaan Cikabayan IPB.
Manfaat Penelitian
Penelitian ini memberikan informasi mengenai kelimpahan cendawan
3
BAHAN DAN METODE
Tempat dan Waktu
Penelitian ini dilaksanakan di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Institut Pertanian Bogor (IPB) dan kebun percobaan Cikabayan, Institut Pertanian Bogor (IPB) pada bulan Februari 2014 hingga Desember 2014.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini di antaranya adalah sampel tanah dari rizosfer tanaman kelapa sawit di kebun percobaan Cikabayan, IPB, media selektif Fusarium Komada (Komada’s Selective Medium/ KSM), media Potato Dextrose Agar (PDA), media Banana Leaf-piece Agar (BLA), biakan murni Fusarium oxysporum strain patogen (koleksi Laboratorium Mikologi Tumbuhan). Alat-alat yang digunakan antara lain rotary shaker, cawan petri, tabung reaksi, laminar air flow, mikroskop cahaya dan kamera.
Metode
Pengambilan Sampel Tanah
Lokasi pengambilan sampel tanah merupakan areal pertanaman kelapa sawit di kebun percobaan Cikabayan milik Institut Pertanian Bogor yang terletak di Kecamatan Dramaga, Kabupaten Bogor, Provinsi Jawa Barat, Indonesia. Tanah diambil dari rizosfer tanaman kelapa sawit.
Sampel tanah yang diambil sebanyak dua jenis, yaitu tanah dari rizosfer tanaman kelapa sawit sehat dan tanah dari rizosfer tanaman kelapa sawit yang menunjukkan gejala pembengkokan pelepah daun. Sampel tanah sebanyak 1 kg diambil pada kedalaman 30 cm dari permukaan tanah area piringan tanaman kelapa sawit. Sampel tanah masing-masing diambil dari 5 titik sekeliling tanaman kelapa sawit kemudian dicampur.
Jumlah sampel tanah yang diambil masing-masing 12 sampel tanah tanaman kelapa sawit sehat dan 12 sampel tanah tanaman kelapa sawit yang menunjukkan gejala pembengkokan pelepah daun. Sampel tanah kemudian disimpan ke dalam kantong plastik dan diberi kode berdasarkan jenis sampel tanah dan penomoran secara acak. Untuk sampel tanah yang berasal dari rizosfer tanaman kelapa sawit sehat diberi kode SH dan untuk sampel tanah yang berasal dari rizosfer tanaman kelapa sawit yang menunjukkan gejala pembengkokan pelepah daun diberi kode SD.
Isolasi Fusarium spp.
4
dalam tabung reaksi yang berisi 9 ml air destilasi steril. Pengenceran dilanjutkan hingga seri pengenceran 10-3.
Suspensi tanah dari setiap pengenceran selanjutnya diambil masing-masing sebanyak 1 ml dan dituang ke dalam media KSM (Komada’s Selective Medium), kemudian disebar dengan menggunakan spatula kaca. Setiap seri pengenceran diulang sebanyak 3 kali. Biakan selanjutnya diinkubasi pada suhu ruang selama 5 hingga 7 hari agar koloni tumbuh dengan baik. Koloni yang tumbuh diberi kode kemudian dimurnikan dan diperbanyak pada media PDA. Pengkodean isolat berdasarkan spesies isolat, sumber isolat dan penomoran secara acak. Misalnya isolat FaD1A, Fa merupakan F. oxysporum morftipe a, huruf D1 merupakan sumber isolat yaitu rizosfer tanaman kelapa sawit yang menunjukkan gejala pembengkokan pelepah daun sampel SD1, huruf A berarti penomoran secara acak.
Identifikasi isolat Fusarium spp.
Isolat-isolat Fusarium spp. diidentifikasi berdasarkan karakteristik morfologi koloni yang tumbuh pada media PDA dan morfologi mikroskopis yang tumbuh pada media BLA. Identifikasi dilaksanakan dengan bantuan kunci identifikasi (Leslie dan Summerell 2006).
Penghitungan Kelimpahan Fusarium spp.
Kelimpahan Fusarium spp. ditentukan dengan menghitung langsung koloni yang tumbuh pada media KSM, kemudian dihitung per satuan colony forming unit (cfu) berdasarkan rumus (Sutton 2006). Untuk mengetahui kelimpahan (cfu/g) digunakan rumus:
Kelimpahan (cfu/g) =
Uji Patogenisitas
Dua puluh isolat murni Fusarium spp. diuji pada kecambah kelapa sawit dan sebagai pembanding menggunakan isolat Fusarium oxysporum patogenik koleksi Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman. Sumber inokulum Fusarium spp. diperoleh melalui suspensi konidia yang dibuat dengan cara mencampurkan 10 ml air destilasi steril ke dalam cawan petri yang berisi biakan murni isolat Fusarium spp. berumur 2 minggu, kemudian dikeruk dengan menggunakan lup inokulasi sehingga diperoleh suspensi yang berisi masa spora (konidia) dengan konsentrasi 105/ml. Inokulasi dilakukan dengan cara merendam kecambah kelapa sawit ke dalam suspensi konidia Fusarium spp. selama 1 jam. Kecambah yang telah diinokulasi kemudian ditanam pada polibek berukuran 20 x 15 cm berisi media tanah steril. Kecambah yang diinokulasi dengan isolat Fox patogenik dijadikan sebagai kontrol positif.
Terdapat 22 perlakuan pada uji patogenisitas dan masing-masing perlakuan diulang sebanyak sembilan kali, sehingga total satuan amatan berjumlah 189 satuan amatan. Satuan amatan merupakan satu polibek yang berisi satu kecambah kelapa sawit. Pengamatan dilakukan setiap hari hingga 8 Minggu Setelah Tanam (MST). Peubah yang diamati yaitu kejadian penyakit dan tinggi/panjang kecambah. Persentase kejadian penyakit dihitung dengan rumus:
rata-rata jumlah koloni per cawan
5
Rancangan percobaan untuk uji patogenisitas isolat adalah rancangan acak lengkap (RAL). Data yang diperoleh kemudian diolah menggunakan perangkat lunak Statistical Analysis System (SAS) versi 9.1. Perlakuan yang berpengaruh nyata diuji lanjut dengan uji Duncanpada taraf α=5% (Mattjik et al. 2006).
Reisolasi Fusarium spp.
6
HASIL DAN PEMBAHASAN
Isolasi dan Identifikasi Isolat Fusarium spp.
Rizosfer tanaman kelapa sawit menyediakan nutrisi seperti gula dan berbagai macam asam amino yang dibutuhkan propagul cendawan untuk berkecambah (Ho dan Varghese 1985). Fusarium spp. yang berhasil diisolasi dari rizosfer tanaman kelapa sawit berjumlah 20 isolat di mana 12 isolat berasal dari tanaman kelapa sawit sehat dan 8 isolat berasal dari tanaman kelapa sawit yang menunjukkan gejala pembengkokan pelepah daun (Tabel 1).
Tabel 1 Hasil isolasi Fusarium spp. dari rizosfer kelapa sawit Sampel Kelimpahan
(cfu/g)
Keragaman Isolat
SH1
Rizosfer kelapa sawit sehat
7 Hasil isolasi menunjukkan Fusarium spp. hanya ditemukan pada 4 sampel tanah yang terdiri atas 2 sampel tanah SH dan 2 sampel tanah SD, sampel tersebut yaitu SH1, SH2, SD1, dan SD2. Sedangkan pada 16 sampel tanah yang terdiri atas 8 sampel tanah SH dan 8 sampel tanah SD, Fusarium spp. tidak berhasil diisolasi dari sampel-sampel tersebut. Ketidakberhasilan isolasi Fusarium spp. dari keenam belas sampel tersebut diduga disebabkan oleh perbedaan waktu pengambilan sampel tanah, yaitu pengambilan sampel pada saat musim kemarau dengan pengambilan sampel pada saat musim hujan. Keenam belas sampel tersebut diambil pada saat musim kemarau, dimana kelembaban atau kadar air di dalam tanah tersebut berada pada tingkat rendah.
Kelimpahan propagul Fusarium spp. di dalam tanah dipengaruhi oleh beberapa faktor seperti kesuburan tanah, kesuburan tanaman dan vegetasi di sekitar tanaman (Ho dan Varghese 1985). Kelimpahan propagul Fusarium spp. tertinggi diperoleh dari sampel tanah SD1 yaitu 6000 cfu/g tanah, sedangkan kelimpahan terendah diperoleh dari sampel tanah rizosfer tanaman kelapa sawit sehat SH1 sebesar 2000 cfu/g tanah. Kelimpahan propagul Fusarium spp. yang lebih besar pada SD1 kemungkinan disebabkan oleh rizosfer kelapa sawit tempat diambilnya sampel tersebut lebih kondusif bagi pertumbuhan propagul Fusarium
spp., terutama vegetasi di sekitar SD1 lebih banyak dibandingkan sampel yang lainnya. Ho dan Varghese (1985) juga berhasil mengisolasi Fusarium spp. dari rizosfer kelapa sawit di Malaysia dan mencatat kelimpahan propagul Fusarium
spp. sebanyak 5946 cfu/g tanah.
Media KSM merupakan media selektif yang mengisolasi cendawan Fusarium (Komada 1975). Miselium Fusarium spp. yang tumbuh pada media KSM berwarna putih dan tidak menghasilkan pigmen sama sekali. Cendawan selain Fusarium spp. juga ditemukan tumbuh pada media tersebut, tetapi pertumbuhannya tertekan dengan ukuran koloni yang jauh lebih kecil dibandingkan koloni Fusarium spp. yang pertumbuhannya sangat cepat (Gambar 1).
Semua isolat Fusarium spp. berhasil diidentifikasi berdasarkan karakteristik morfologi koloni pada media PDA dan karakteristik mikroskopis pada media BLA. Dari total 20 Isolat Fusarium spp. yang berhasil diisolasi dari rizosfer tanaman kelapa sawit teridentifikasi sebagai Fusarium oxysporum morfotipe a,
Fusarium oxysporum morfotipe b dan F. solani. Sembilan isolat merupakan spesies F. oxysporum morfotipe a, 3 isolat F. oxysporum morfotipe b dan 8 isolat merupakan spesies F. solani. Identifikasi dilakukan berdasarkan karakterisitik morfologi yang mengacu pada Leslie dan Summerel 2006.
Gambar 1 Pertumbuhan koloni Fusarium spp. pada media KSM: (a) SH, (b) SD
8
Karakterisitik morfologi isolat Fusarium oxysporum
Isolat F. oxysporum yang diidentifikasi mempunyai 2 morfotipe yang berbeda yaitu morfotipe a dan morfotipe b. Secara garis besar kedua morfotipe ini memiliki karakteristik yang hampir sama, yang membedakan ialah kelengkungan dari makrokonidia yang dihasilkan pada sporodokia. F. oxysporum morfotipe b memiliki bentuk makrokonidia yang lebih melengkung dari bentuk makrokonidia morfotipe a. Miselium keduanya berwarna putih, merah muda, hingga putih-keunguan (Gambar 2). Makrokonidia berbentuk seperti sabit dengan jumlah sekat tiga hingga lima sekat dan dihasilkan pada fialid tunggal pendek pada hifa dan sporodokia (Gambar 3).
Karakteristik morfologi isolat Fusarium solani
Miselium F.solani berwarna putih dan tidak menghasilkan pigmen sama sekali (Gambar 2). Salah satu ciri khas yang dimiliki oleh F. solani yaitu fialid tunggal yang ukurannya sangat panjang (Gambar 3). Makrokonidia berbentuk lurus dan sedikit melengkung dengan jumlah lima hingga tujuh, dihasilkan dari fialid tunggal panjang pada hifa dan sporodokia (Gambar 3). Sporodokia berwarna coklat muda.
Tabel 2 Karakteristik morfologi isolat Fusarium spp. Karakteristik
Morfologi
F. oxysporum F. solani
Warna koloni Putih, ungu Putih
Pigmentasi Merah muda, ungu Putih - kekuningan Bentuk makrokonidia Morfotipe a: Lurus-Sel basal makrokonidia Berbentuk menyerupai
9
Gambar 2 Morfologi koloni isolat umur 14 hari pada media PDA: (a) F. oxysporum morfotipe a, (b) F.oxysporum morfotipe b, (c) F. solani
Gambar 3 Morfologi mikroskopis Fusarium spp.: F. oxysporum morfotipe a: (a) makrokonidia, (d) mikrokonidia, (g) klamidospora; F. oxysporum
morfotipe b: (b) makrokonidia, (e) mikrokonidia, (h) klamidospora; F. solani: (c) makrokonidia, (f) mikrokonidia, (i) klamidospora
b c
f e
d
i h
g a
10
Uji Patogenisitas
Pada pengujian ini diperoleh 14 isolat yang meyebabkan munculnya gejala penguningan daun dan nekrosis dari total 20 isolat yang diuji. Isolat tersebut ialah FaD1A, FaD1B, FaD2C, FaD2D, FaH1A, FaH2C, FaH2D, FbD1C, FbH2A, FbH2B, FsD1E, FsD1F, FsD1G, dan FsD2A. Kemampuan isolat dalam menginfeksi tanaman dari yang mempunyai persentase kejadian penyakit paling tinggi ke rendah secara berturut-turut yaitu: isolat FbH2B dan FsD1F dengan persentase kejadian penyakit sebesar 55%, diikuti dengan isolat FaD1A dan FsD1G (44%), kemudian isolat FaD1B, FaD2D, FaH2D, FsD1E (33%), isolat FaH1A, FaH2C, FsD2A (22%), dan isolat FbD1C, FaD2C, FbH2A dengan persentase kejadian penyakit sebesar 11%. Isolat yang tidak berhasil menyebabkan kejadian penyakit berjumlah 6 isolat yaitu isolat FaD1D, FaH1B, FsD1H, FsD2B, FsH2E, dan FsH2F (Gambar 4).
Cendawan F. oxysporum mampu menyebabkan rebah kecambah, layu, busuk akar dan perusakan warna pada sistem pembuluh tanaman pada persemaian maupun tanaman yang tua (Horinouchi et al. 2010). Gejala yang muncul bervariasi tergantung fase pertumbuhan kecambah dan spesies Fusarium spp.. Gejala pertama kali muncul pada minggu ke-2 setelah tanam dan disebabkan oleh
F. oxysporum morfotipe a isolat FaH2D. Gejala yang ditimbulkan merupakan gejala nekrotik.
11
Gambar 5 Busuk kecambah yang disebabkan oleh F. oxysporum (kiri), kontrol tanpa patogen (kanan)
Gambar 6 Gejala penyakit yang disebabkan oleh Fusarium spp.: F. oxysporum: (a) nekrotik, (d) daun kering; F. solani: (c) nekrotik, (f) daun kering; (b) kontrol (+); (e) kontrol (-)
Gejala lain yang disebabkan oleh isolat F. oxysporum yaitu gejala daun memelintir diikuti dengan gejala nekrotik yang muncul pada ujung daun (Gambar 6). Gejala daun memelintir atau disebut juga dengan epinasti disebabkan oleh pertumbuhan petiol bagian atas yang relatif lebih tinggi dibandingkan dengan pertumbuhan bagian bawah petiol sebagai akibat dari prduksi etilen yang berlebihan atau meningkatnya sensitivitas hormon. Gejala epinasti tersebut juga terjadi pada tomat yang terinfeksi F. oxysporum f. sp. lycopersici (Strange 2003). Pada tanaman yang daunnya telah terbuka gejala yang muncul yaitu menguningnya daun yang paling tua diikuti dengan daun yang lebih muda. Agrios
a
d
b
e
c
12
(2005), menyatakan bahwa perubahan warna tersebut disebabkan oleh aktivitas patogen yang menimbulkan adanya gangguan kloroplas sehingga menyebabkan penurunan kandungan klorofil pada daun. Menguningnya daun dimulai dari tepi daun menuju ke bagian tengah daun. Waktu munculnya gejala penguningan daun bervariasi mulai dari kecambah berdaun satu hingga kecambah berdaun tiga pada minggu terakhir pengamatan. Cendawan F. oxysporum juga menghasilkan fitotoksin yang disebut asam fusarat (Fusaric acid) yang bersifat toksik bagi tanaman sehingga menjadi salah satu penyebab tanaman menjadi layu (Smith 2007).
Gejala penyakit yang diakibatkan oleh F. solani mirip dengan gejala penyakit yang diakibatkan oleh F. oxysporum. Gejalaterjadi pada kecambah yang daunnya belum terbuka maupun kecambah yang daunnya telah terbuka, gejala muncul pada minggu ke-3 setelah tanam. Gejala yang muncul berupa gejala nekrotik yang dimulai pada pucuk daun yang belum terbuka kemudian menyebar hingga ke pangkal hingga akhirnya tanaman mati. Isolat tersebut yaitu isolat FsD1E, FsD1F, FsD1G, dan FsD2A. Isolat F. solani juga menyebabkan pertumbuhan kecambah mengalami stagnasi dengan gejala nekrosis pada pucuk daun, namun tidak mengakibatkan tanaman mati hingga minggu terakhir pengamatan (Gambar 7). Hal tersebut diduga sebagai akibat dari fitotoksin yang diproduksi oleh isolat F. solani. F. solani memproduksi fitotoksin naphtazarin
dan dihydrofusarubin yang mampu menyebabkan klorosis pada tanaman dan juga menghambat pertumbuhan tanaman (Ondrej et al. 2008).
Kecambah kontrol positif yang diinokulasi dengan F. oxysporum patogenik koleksi Laboratorium Mikologi, nilai persentase kejadian penyakit sebesar 22% Nilai persentase kejadian penyakit yang rendah tersebut mungkin dikarenakan degenerasi isolat yaitu menurunnya daya virulensi isolat karena isolat telah disimpan dalam waktu yang cukup lama. Gejala yang diakibatkan yaitu daun menjadi kering yang dimulai dari pangkal batang semu kemudian menjalar hingga ujung daun (Gambar 6) dan diikuti dengan pertumbuhan miselium berwarna putih yang keluar dari sekitar batang. Gejala ini mulai muncul pada saat awal daun pertama terbuka yaitu pada minggu ke-2 setelah inokulasi. Gejala berlanjut hingga mengakibatkan kecambah mati dalam waktu 1 minggu.
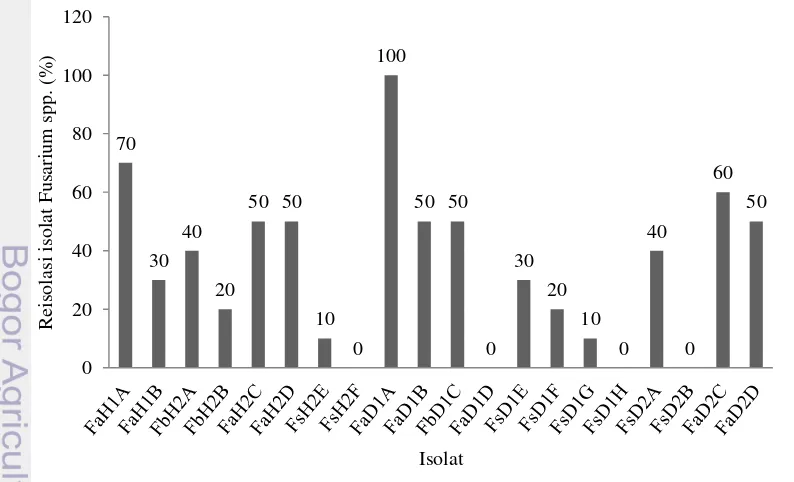
13 Reisolasi Fusarium spp.
Fusarium spp. yang diperoleh dari reisolasi sama dengan Fusarium spp. pada tahap isolasi dan yang digunakan pada uji patogenisitas. Reisolasi isolat
Fusarium spp. dari kecambah kelapa sawit pada uji patogenisitas dilakukan pada minggu ke-8 setelah tanam. Kemampuan Fusarium spp. dalam mengolonisasi tanaman tidak selalu berakibat buruk bagi tanaman. Meskipun Fusarium spp. merupakan penyebab dari banyak penyakit layu yang terjadi pada tanaman, cendawan tersebut secara umum mengolonisasi akar tanaman tanpa menyebabkan gejala penyakit (Edel et al. 1997). Isolat FaH1B dan isolat FsH2E yang berhasil mengolonisasi jaringan tanaman, namun tidak menimbulkan gejala penyakit pada tanaman atau pertumbuhan tanaman tidak berbeda dengan kontrol. Kedua isolat tersebut dapat dikatakan bersifat seperti cendawan endofit yang tinggal di dalam jaringan tanaman tetapi tidak menyebabkan tanaman sakit atau tidak menggangu pertumbuhan tanaman. Kedua isolat ini didapatkan dari rizosfer kelapa sawit sehat. Rodrigues dan Menezes (2006) menyatakan bahwa tanaman toleran terhadap pertumbuhan cendawan yang terbatas di dalam jaringannya tanpa melakukan mekanisme pertahanan. Menurut Isniah (2012), cendawan Fusarium oxysporum nonpatogenik yang diisolasi dari tanaman bawang merah mampu meningkatkan pertumbuhan dan hasil panen bawang merah yang diinokulasi dengan cendawan tersebut. Dengan demikian, kedua isolat tersebut berpotensi dijadikan sebagai agens pengendali hayati.
Terdapat tiga isolat yang tidak berhasil direisolasi, namun muncul gejala pada kecambah yang diinokulasikan dengan isolat-isolat tersebut, isolat tersebut yaitu isolat FsH2F, FaD1D, dan FsD1H.
14
Tidak berhasilnya isolat FsH2F, FaD1D, FsD1H direisolasi dari kecambah kelapa sawit menunjukkan isolat-isolat tersebut tidak berhasil masuk ke dalam jaringan kecambah kelapa sawit, dan munculnya gejala kemungkinan disebabkan oleh faktor lain seperti kelainan genetik kecambah atau disebabkan oleh mikroba patogen lain yang mungkin sudah ada atau terbawa di dalam benih kelapa sawit tersebut, namun tidak dilakukan identifikasi terhadap mikroba patogen terbawa benih tersebut. Flood et al. (1990) menemukan cendawan Fusarium spp. di dalam benih kelapa sawit, tepatnya pada permukaan inti sawit (kernel).
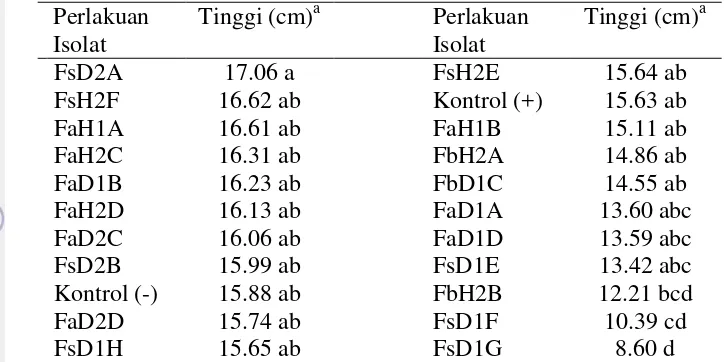
Pengaruh Isolat Fusarium spp. Terhadap Tinggi Kecambah Kelapa Sawit
Isolat Fusarium spp. memberikan pengaruh yang bervariasi terhadap tinggi kecambah. Berdasarkan uji F pada taraf 5% perlakuan berpengaruh nyata terhadap tinggi kecambah. Rata-rata tinggi kecambah tertinggi dicapai oleh kecambah yang diinokulasi isolat FsD2A, sedangkan rata-rata tinggi kecambah terendah diperoleh dari kecambah yang diinokulasi dengan isolat FsD1G (Tabel 3). Berdasarkan uji DMRT antara tinggi kecambah kontrol dengan kecambah yang diinokulasi menggunakan isolat FsD2A tidak berbeda nyata, sedangkan kecambah yang diinokulasi dengan isolat FsD1G dan FsD1F tingginya berbeda nyata terhadap kontrol, dimana kedua isolat tersebut merupakan isolat F. solani
patogenik. Perbedaan tinggi antara kecambah kontrol (-) dengan kecambah yang diinokulasi dengan isolat FsD2A yang berbeda nyata dimungkinkan disebabkan oleh adanya pengaruh asam giberelin (Gibberellic Acid) hasil produksi cendawan
Fusarium spp..
Smith (2007) menyatakan bahwa tanaman padi yang terinfeksi Fusarium
spp. mengalami pertumbuhan tinggi yang berlebihan, namun lemah dan produktivitasnya rendah, dan tanaman padi tersebut terdeteksi mengandung asam giberelin yang diproduksi oleh Fusarium spp.. Sedangkan perbedaan tinggi antara kecambah kontrol (-) dengan kecambah yang diinokulasi dengan isolat FsD1F dan FsD1G dimungkinkan disebabkan oleh beberapa faktor, diantaranya tingkat virulensi kedua isolat tersebut dan ketahanan kecambah kelapa sawit yang digunakan. Killerbrew et al. 1988 menginokulasi F. solani pada benih kacang kedelai dan menemukan kejadian penyakit yang lebih tinggi pada benih-benih kedelai yang berkualitas buruk.
15 Tabel 3 Tinggi kecambah kelapa sawit pada 8 MST
Perlakuan Isolat
Tinggi (cm)a Perlakuan Isolat
Tinggi (cm)a
FsD2A 17.06 a FsH2E 15.64 ab
FsH2F 16.62 ab Kontrol (+) 15.63 ab
FaH1A 16.61 ab FaH1B 15.11 ab
FaH2C 16.31 ab FbH2A 14.86 ab
FaD1B 16.23 ab FbD1C 14.55 ab
FaH2D 16.13 ab FaD1A 13.60 abc
FaD2C 16.06 ab FaD1D 13.59 abc
FsD2B 15.99 ab FsD1E 13.42 abc
Kontrol (-) 15.88 ab FbH2B 12.21 bcd
FaD2D 15.74 ab FsD1F 10.39 cd
FsD1H 15.65 ab FsD1G 8.60 d
a
16
SIMPULAN DAN SARAN
Simpulan
Kelimpahan Fusarium spp. dalam rizosfer tanaman kelapa sawit tertinggi diperoleh dari sampel tanah kelapa sawit sakit SD1 sebesar 6000 cfu/g tanah, sedangkan kelimpahan Fusarium spp. terendah diperoleh dari sampel SH1 sebesar 2000 cfu/g tanah. Spesies Fusarium spp. yang berhasil diisolasi dan diidentifikasi sebanyak 20 isolat dimana 12 isolat merupakan Fusarium oxysporum yang terbagi dalam 2 morfotipe yaitu morfotipe a sebanyak 9 isolat (FaH1A, FaH1B, FaH2C, FaH2D, FaD1A, FaD1B, FaD1D, FaD2C, dan FaD2D) dan morfotipe b sebanyak 3 isolat (FbH2A, FbH2B, dan FbD1C) dan 8 isolat merupakan Fusarium solani
(FsH2E, FsH2F, FsD1E, FsD1F, FsD1G, FsD1H, FsD2A, dan FsD2B).
Berdasarkan hasil uji patogenisitas dan hasil reisolasi, isolat-isolat yang bersifat patogenik terhadap kecambah kelapa sawit berjumlah 14 isolat (FaH1A, FbH2A, FbH2B, FaH2C, FaH2D, FaD1A, FaD1B, FbD1C, FsD1E, FsD1G,
Perlu dilakukan uji antagonisme secara in vitro maupun in vivo antara isolat
17
DAFTAR PUSTAKA
Agrios GN. 2005. Plant Pathology. Ed ke-5. New York (US): Academic Pr. Alabouvette C, Couteaudier Y. 1992. Biological control of fusarium wilts with
non-patogenic fusaria. D dalam: Tjamos EC, Papavizas GC, Cook RJ, editor. Biological Control of Plant Diseases Progress and Challenges for the Future. New York (US): NATO ASI Series.
[BPS] Badan Pusat Statistik. 2013. Statistik Kelapa Sawit Indonesia 2013. Katalog BPS: 05130.1410
Cooper RM. 2011. Fusarium wilt of oil palm: a continuing threat to South Asia plantations. The Planter 87(1023):409-418.
Chinchilla C, Salas A, dan Castrillo G. 1997. Common spear rot/crown disease in oil palm: Effect on growth and initial yields. ASD Oil Palm Pap. 16:1-18 [ABSTRAK]
Edel V, Steinberg C, Gautheron N, Alabouvette C. 1997. Population of nonpathogenic Fusarium oxysporum associated with roots of four plant species compared to soilborne populations. Phytopathol 87:693-697.
Gordon TR, Martyn RD. 1997. The evolutionary biology of Fusarium oxysporum.
Phytopathol 35:111-128.
Flood J, Mepsted R, Cooper RM. 1990. Contamination of oil palm pollen and seeds by Fusarium spp. Mycol Res 94(2):99-108.
Hafizi R, Salleh B, dan Latiffah Z. 2013. Morphological and molecular characterization of Fusaium solani and F. oxysporum associated with crown disease of oil palm. Braz J Microbiol 44(3):959-986.
Ho YW, Varghese G. 1985. Soil fusaria from oil palm habitats in Malaysia.
Pertanika 8(3):331-336.
Horinouchi H, Muslim A, Hakumachi M. 2010. Biocontrol of fusarium wilt by the plant growth promoting fungus Fusarium eqiseti GF183. J Plant Pathol
92(1):249-254.
Isniah US. 2012. Eksplorasi Fusarium nonpatogenik dalam pengendalian busuk pangkal batang (Fusarium oxysporum f. sp. cepae) pada bawang merah [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Killerbrew JF, Roy KW, Lawrence GW, McLean KS, Hodges HH. 1988. Greenhouse and field evaluation of Fusarium solani pathogenicity to soybean sidlings. Plant dis 72: 1067-1070.
Komada H. 1975. Development of a selective medium for quantitie isolation of
Fusarium oxysporum from natural soil. Rev Plant Protect. Res. 8 : 114-125. Leslie JF, Summerell BA. 2006. The Fusarium Laboratory Manual. Oxford (UK):
Blackwell Publishing.
Mattjik AA, Sumertajaya IM. 2006. Perancangan Percobaan. Bogor (ID): IPB Press.
Ondrej M, Dostalova R, Trojan R. 2008. Evaluation of virulence of Fusarium solani isolates on pea. Plant Protect Sci 44: 9-18.
18
Smith SN. 2007. An overview of ecological and habitat aspects in the genus
Fusarium with special emphasis on the soil-borne pathogenic forms. Plant Pathol Bull. 16: 97-120.
Strange RN. 2003. Introduction to Plant Pathology. London (GB): J Wiley. hlm 199.
Sutton S. 2006. Counting colonies. Pharmaceutical Microbiol Forum Newsletter. 12(9): 2–12.
Suwandi, Akino S, dan Kondo N. 2012. Common spear rot of oil palm in Indonesia. Plant Dis. 96:537-543.
Teoh, 2010. Persoalan keberlanjutan kunci dalam sektor minyak kelapa sawit. IFC, World Bank Group.
19
LAMPIRAN
Lampiran 1 Komposisi media yang digunakan
Nama Media Komposisi Bahan (untuk 1 L media)
KSM K2HPO4 1 g
Lampiran 2 Daftar sidik ragam pengaruh isolat Fusarium spp. terhadap tinggi kecambah pada 8 MST
Sumber db JK KT F hit Pr > F
Perlakuan 21 761.250458 36.250022 2.71 0.0002 Galat 152 2031.641726 13.366064
20