IMOBILISASI LIPASE Rhizopus oryzae PADA BERBAGAI
BAHAN PENDUKUNG UNTUK PRODUKSI
DIASILGLISEROL DARI CPO
SUSY SAADAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Imobilisasi Lipase Rhizopus oryzae pada Berbagai Bahan Pendukung untuk Produksi Diasilgliserol dari CPO adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
SUSY SAADAH. Imobilisasi Lipase Rhizopus oryzae pada Berbagai Bahan Pendukung untuk Produksi Diasilgliserol dari CPO. Dibimbing oleh MARIA BINTANG dan TRI PANJI.
Diasilgliserol (DAG) dikategorikan sebagai salah satu minyak sehat yang telah dijadikan menu diet sehari-hari oleh masyarakat terutama di Jepang. Selain itu, DAG telah dimanfaatkan sebagai emulsifier dan surfaktan makanan serta digunakan dalam bidang farmasi dan kedokteran. DAG dapat diproduksi dari Crude Palm Oil (CPO) yang ketersediannya melimpah di Indonesia. Namun produksi DAG di Indonesia terkendala oleh tingginya harga lipase yang masih diimpor. Untuk mengatasi masalah tersebut, telah dilakukan penelitian produksi DAG menggunakan ekstrak kasar lipase yang dihasilkan oleh fungi lokal Rhizopus oryzae. Fungi R. oryzae ini bersifat edible sehingga aman untuk dimanfaatkan dalam produksi produk pangan seperti DAG. Imobilisasi enzim merupakan teknik perolehan kembali enzim yang menjadi perhatian dalam beberapa tahun belakangan, dilakukan dengan bantuan bahan pendukung sebagai media yang dapat mencegah terlarutnya enzim. Beberapa macam pendukung yang digunakan ialah zeolit, CaCO3, silika gel dan tulang sapi.
Metode imobilisasi yang digunakan dalam penelitian ini ialah metode adsorpsi, menggunakan lipase spesifik dari R. oryzae. Penentuan protein enzim dilakukan untuk mengetahui jumlah enzim yang teradsorpsi pada berbagai bahan pendukung dengan metode Bradford menggunakan spektrofotometri UV-Vis. Konsentrasi enzim imobil diperoleh dari selisih konsentrasi larutan lipase sebelum proses imobilisasi, larutan lipase setelah proses imobilisasi dan larutan pencuci. Dalam penelitian ini, diselidiki faktor dari setiap bahan pendukung seperti pH optimum, suhu optimum, dan waktu penyimpanan. Aktivitas lipase dihitung dengan penentuan asam lemak bebas menggunakan metode titrasi. Komposisi asam lemak bebas, monoasilgliserol, diasilgliserol, dan triasilgliserol pada proses gliserolisis diidentifikasi menggunakan TLC Scanner.
CaCO3 memiliki kemampuan adsorbsi terbesar (99,46%), lebih besar
dibandingkan zeolit (90,69%), tulang sapi (91,56%), dan silika gel (59,63%). Lipase bebas bekerja optimal pada pH 7 dan suhu 30 °C. Hasil yang sama didapatkan untuk lipase terimobilisasi pada tulang sapi. Lipase terimobilisasi pada CaCO3 bekerja optimal pada pH 8 dan suhu 35 °C. Lipase terimobilisasi pada zeolit
dan silika gel bekerja optimal pada pH 8 dan suhu 30 °C. Lipase imobil lebih stabil dibandingkan lipase bebas pada penyimpanan lipase di minggu pertama hingga minggu ke enam, dengan kondisi penyimpanan pada suhu 4 °C dan pH optimum masing-masing bahan pendukung. Lipase terimobilisasi pada CaCO3 dapat
digunakan kembali hingga tiga kali pengulangan. Konversi gliserolisis lipase terimobilisasi CaCO3 mencapai 15,02% selama 9 jam lebih rendah dibandingkan
menggunakan lipase bebas sebesar 18,41% selama 15 jam.
SUMMARY
SUSY SAADAH. Immobilization of Rhizopus oryzae Lipase on Various Supporting Materials for Diacylglycerol Production from CPO. Supervised by MARIA BINTANG and TRI PANJI.
Diacylglycerol (DAG) is categorized as one of the healthy oil types that has been used in daily diet by the society, especially in Japan. In addition, the DAG has been used as an emulsifier and surfactant in the food and in pharmaceutical and medical fields. DAG can be produced from Crude Palm Oil (CPO) that is abundantly produced in Indonesia. However, DAG production in Indonesia is constrained by the high cost of lipase that is still imported from abroad. To overcome this problem, research of DAG production has been conducted using crude extract of lipase produced by indigenous species of fungi Rhizopus oryzae. The R. oryzae is edible indicating that it is safe to be used in the production of food products such as DAG. Enzyme immobilization is a recovery technique that has been studied in several years, using supporting materials as a medium to help enzyme dissolutions to the substrate. Several supporting materials such as zeolit, CaCO3, silica gel, and cow bone were selected by its ability to adsorb lipase.
Immobilization method used in this study was adsorption method, using spesific lipase from R. oryzae. The protein determination for an enzyme was used for knowing amount of enzyme which can be adsorbed in various supporting materials by Bradford method using spectrophotometry UV-Vis. The enzyme loading value was obtained from the difference among lipase solution before immobilization process, lipase solution after immobilization process and washing solution. In this research, condition factors, such as optimum pH, optimum temperature, and storage ability of the matrix were investigated. The lipase activity was measured by free fatty acid determination using titrimetric method. Glycerolysis was analyzed for identifying the compositions of free fatty acid, monoacylglycerol, diacylglycerol, and triacylglycerol using TLC Scanner.
CaCO3 shows enzyme loading rate respectively 99.46%, giving more lipase
to adsorb than zeolit (90.69%), cow bone (91.56%), and silica gel (59.63%). Free lipase reacts optimally in pH 7 and temperature 30°C. Identical result showed for lipase immobilized on cow bone. Lipase on CaCO3 reacts optimally in pH 8 and
temperature 35°C. Lipase on zeolit and silica gel reacts optimally in pH 8 and temperature 30°C. Immobilized lipase is more stable than free lipase from storage in the first to six week, in storage condition temperature at 4°C and optimum pH. Lipase on CaCO3 reaches 15.02% for the conversion of glycerolysis at 9 hours, less
than using free lipase 18.41% at 15 hours.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
IMOBILISASI LIPASE Rhizopus oryzae PADA BERBAGAI
BAHAN PENDUKUNG UNTUK PRODUKSI
DIASILGLISEROL DARI CPO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Imobilisasi Lipase Rhizopus oryzae pada Berbagai Bahan Pendukung untuk Produksi Diasilgliserol dari CPO
Nama : Susy Saadah NIM : G851130161
Disetujui oleh Komisi Pembimbing
Prof Dr drh Maria Bintang, MS Ketua
Dr Tri Panji MS.APU Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof Dr drh Maria Bintang, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 28 Agustus 2015
PRAKATA
Puji dan syukur penulis haturkan kepada Tuhan atas segala karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini. Judul karya ilmiah dalam penelitian yang dilaksanakan sejak September 2014 sampai dengan Maret 2015 ini ialah Imobilisasi Lipase Rhizopus oryzae pada Berbagai Bahan Pendukung untuk Produksi Diasilgliserol dari CPO.
Ucapan terima kasih kepada Prof Dr drh Maria Bintang, MS dan Dr Tri Panji, MS.APU selaku pembimbing atas ilmu, saran dan kesabaran yang telah diberikan. Terima kasih juga kepada keluarga besar Biokimia (Dosen, Staff TU, Laboran dan teman-teman Biokimia 2013) yang telah memberikan motivasi dan membantu penulis dalam menyelesaikan karya ilmiah ini. Ungkapan terima kasih juga diberikan kepada para teknisi dan teman-teman Pusat Penelitian Bioindustri dan Bioteknologi Indonesia, terima kasih untuk kerja samanya. Penulis juga mengucapkan terima kasih kepada Direktorat Jenderal Pendidikan Tinggi (DIKTI) sebagai sponsor Beasiswa Pendidikan Pascasarjana Dalam Negeri 2013. Ucapan spesial kepada orang tua yang selalu memberikan doa dan dukungannya.
Penulis menyadari bahwa makalah hasil penelitian ini jauh dari kesempurnaan, oleh sebab itu penulis mengharapkan adanya kritik dan juga saran yang konstruktif demi perbaikan di masa yang akan datang. Semoga karya ilmiah ini bermanfaat bagi kita semua.
DAFTAR ISI
Waktu dan Tempat Penelitian 3
Bahan 3
Alat 4
Prosedur penelitian 4
3 HASIL 7
Produksi, Pengendapan, dan Analisis Aktivitas Lipase 7
Imobilisasi Lipase Rhizopus oryzae 7
Pengaruh pH pada Kestabilan Lipase Imobil 8
Pengaruh suhu pada Kestabilan Lipase Imobil 8
Kestabilan Lipase Rhizopus oryzae Imobil 9
Penggunaan Kembali Lipase Rhizopus oryzae Imobil 9 Produksi Diasilgliserol, Analisis Produk, dan Perbesaran Skala
Gliserolisis 10
4 PEMBAHASAN 12
Produksi, Pengendapan, dan Analisis Aktivitas Lipase 12
Imobilisasi Lipase Rhizopus oryzae 12
Pengaruh pH pada Kestabilan Lipase Imobil 13
Pengaruh suhu pada Kestabilan Lipase Imobil 13
Kestabilan Lipase Rhizopus oryzae Imobil 13
Penggunaan Kembali Lipase Rhizopus oryzae Imobil 13 Produksi Diasilgliserol, Analisis Produk, dan Perbesaran Skala
DAFTAR GAMBAR
1 Kurva pengaruh pH pada lipase imobil 8
2 Kurva pengaruh suhu pada lipase imobil 9
3 Pengaruh waktu penyimpanan pada lipase imobil 9 4 Fraksi massa DAG pada penggunaan kembali lipase imobil CaCO3 10
5 Fraksi massa ALB, MAG, DAG, dan TAG menggunakan lipase
bebas 10
6 Fraksi massa DAG pada lipase bebas dan lipase imobil 11 7 Fraksi massa ALB, MAG, DAG, dan TAG pada perbesaran skala
gliserolisis 11
8 Reaksi hidrolisis trigliserida menjadi diasilgliserol 15
9 Reaksi hidrolisis TAG oleh lipase 15
10 Reaksi esterifikasi asam lemak dan gliserolisis oleh lipase 16
DAFTAR LAMPIRAN
1 Diagram alir penelitian 20
2 Kurva standar protein 21
3 Aktivitas lipase bebas 22
4 Fraksi Massa ALB, MAG, DAG, dan TAG menggunakan lipase
1
PENDAHULUAN
Latar Belakang
Indonesia merupakan salah satu negara produsen utama minyak kelapa sawit dunia karena setiap tahun luas areal perkebunan kelapa sawit terus meningkat diiringi dengan peningkatan produksi Crude Palm Oil (CPO) (Anggirasti et al. 2008). CPO merupakan produk turunan minyak sawit, hasil olahan daging buah kelapa sawit yang dapat dimanfaatkan sebagai bahan baku biodiesel, bahan makanan seperti minyak goreng dan margarin, maupun produk-produk industri kimia seperti sabun dan detergen (Kong 2010). Produk olahan CPO klasifikasi khusus seperti specialty fats, contienary fat, dan minyak sehat (healthy oil) memiliki harga jauh lebih tingi dibandingkan dengan minyak makan (cooking oil) atau shortening. Penggunaan CPO untuk produksi diasilgliserol (DAG) memiliki keunggulan karena ketersediaan CPO di Indonesia melimpah, memiliki kandungan asam lemak tak jenuh tunggal (asam oleat) yang tinggi sehingga cocok untuk
minyak goreng, mengandung nutrisi penting seperti β-karoten, vitamin E, dan tokotrienol (Suharyanto et al. 2011).
Diasilgliserol merupakan senyawa ester dari gliserol dimana terdapat dua gugus hidroksil yang teresterifikasi oleh asam lemak (Kusumo 2008). DAG telah terbukti secara klinis memiliki berbagai manfaat seperti menurunkan level lipid
postprandial, meningkatkan β-oksidasi lemak yang dapat mencegah obesitas (Takase 2007). Bahkan, efek kesehatan minyak DAG telah diakui oleh pemerintah Jepang dengan pemberian status makanan sehat (FOSHU) (Cheong dan Lai2009). Diasilgliserol dapat diproduksi secara kimiawi dari minyak atau lemak nabati dengan gliserol pada suhu tinggi (240–260 °C) menggunakan katalis anorganik seperti natrium hidroksida, kalium hidroksida atau kalsium hidroksida. Namun teknik tersebut memiliki kelemahan, yaitu pemakaian energi yang tinggi, terbentuknya produk samping hasil reaksi peroksidasi dan polimerisasi yang bersifat toksik bagi kesehatan manusia serta produk yang diperoleh berwarna gelap (Elisabeth et al. 1999). Selain itu proses gliserolisis pada suhu tinggi dapat merusak kandungan senyawa-senyawa minor dalam CPO seperti tokoferol, tokotrienol dan karoten (Suharyanto et al. 2011). Untuk mengatasi kerusakan minyak dan senyawa minor dalam produksi monoasilgliserol (MAG) dan DAG, Hasanuddin et al. (2003) telah mengembangkan proses etanolisis pada suhu ruang. Pramana dan Mulyani (2007) juga telah melakukan proses gliserolisis dengan katalis MgO dan pelarut Tert-butanol pada suhu 70-90 °C dan dapat meningkatkan konversi produk hingga 97 %. Akan tetapi, proses pemecahan ikatan ester pada minyak dengan proses kimia seperti ini tetap memiliki kelemahan meskipun telah dicoba dilakukan pada suhu lebih rendah, karena proses kimia berlangsung secara acak sehingga masih sulit untuk memperoleh produk DAG yang murni dan terkontrol (Suharyanto et al. 2011).
2
biaya pengolahan limbah yang murah dan produk yang dihasilkan lebih aman (Suharyanto et al. 2011)
Lipase banyak ditemukan di alam baik pada hewan, tumbuhan, maupun mikroorganisme. Lipase komersial pada umumnya berasal dari jamur (Rhiomur, Rhyomur, dan Candida) dan bakteri (Pseudomonas dan Chromobacterium) (Shah et al. 2009). Harga lipase komersial biasanya sangat tinggi karena proses produksinya yang sulit dan memerlukan waktu yang lama (Kirk et al. 2002). Untuk mengatasi masalah tersebut diperlukan suatu metode dalam memproduksi lipase dengan murah. Salah satunya dapat dilakukan dengan memfermentasikan mikroba tertentu yang mampu menghasilkan lipase (Palilingan 2013). Panji et al. (2008) telah melakukan fermentasi CPO dengan Neurospora sitophila dan dilaporkan mampu memproduksi lipase spesifik 1,3-gliserida. Kapang lokal jenis ini dikenal aman (edible) karena biasa digunakan dalam pembuatan oncom merah. Kapang lokal lain yang juga aman adalah Rhizopus sp yang dikenal sebagai jamur tempe kedelai. Perwitasari (2008) telah melakukan optimasi produksi DAG dengan lipase dari Rhizopus oryzae melalui gliserolisis hingga didapatkan rendemen DAG sebesar 20,76 %.
Lipase yang biasa digunakan dalam proses industri merupakan lipase imobil. Beberapa keuntungan dari lipase imobil adalah peningkatan aktivitas dan stabilitas enzim, dan kemudahan perolehan enzim imobil di akhir reaksi (Kharrat et al. 2011). Metode adsorpsi merupakan metode penjeratan enzim berdasarkan interaksi ikatan ionik, interaksi ikatan hidrogen, ikatan hidrofobik antara enzim atau sel mikrob dengan bahan penyangga. Metode ini merupakan menyebabkan konformasi enzim atau destruksi pada pusat aktif enzim (Wang et al. 2009).. Untuk melakukan immobilisasi enzim, perlu dilakukan pengamatan tentang bahan pendukung yang akan dipakai. Terdapat beberapa macam bahan pendukung yang dapat dipakai untuk metode adsorpsi, yaitu bahan pendukung organik seperti tulang sapi dan bahan pendukunganorganik seperti silica gel, CaCO3, dan zeolit.
Perumusan Masalah
Potensi dari lipase pada Rhizopus oryzae yang berasal dari Indonesia belum banyak diungkap. Screening awal mengenai aktivitas lipase pada isolat Rhizopus oryzae koleksi laboratorium Bioproses Pusat Penelitian Boteknologi dan Bioindustri Indonesia (PPBBI) merupakan salah satunya. Lipase dari Rhizopus oryzae telah dimurnikan secara parsial dan diungkap karakternya oleh Putranto et al. (2006). Namun, imobilisasi lipase dari Rhizopus oryzae menggunakan zeolit, CaCO3, silica gel, atau tulang sapi belum dilakukan. Salah satu aplikasi lipase
3 Tujuan Penelitian
Penelitian ini bertujuan untuk mengimobilisasi lipase dari Rhizopus oryzae. Lipase imobil yang diperoleh digunakan untuk gliserolisis triasilgliserol yang terkandung dalam CPO menjadi diasilgliserol.
Manfaat Penelitian
Penelitian ini dapat memberikan informasi ilmiah mengenai karakter lipase dari Rhizopus oryzae dan teknik imobilisasinya. Lipase imobil yang telah diketahui karakternya digunakan untuk gliserolisis triasilgliserol yang terkandung dalam CPO menjadi diasilgliserol oleh lipase.
Ruang Lingkup Penelitian
Lingkup kegiatan penelitian meliputi prduksi enzim kasar lipase, dilanjutkan dengan pengendapan dan isolasi lipase menggunakan aseton. Enzim yang diperoleh diimobilisasi menggunakan zeolit, CaCO3, silika gel dan tulang sapi
dan setiap lipase imobilisasi dilakukan pengujian pengaruh terhadap pH, temperatur, waktu penyimpanan, Km, Vmaks, penggunaan kembali. Persen adsorb lipase terbesar dan aktivitas spesifik tertinggi digunakan untuk produksi diasilgliserol dari CPO.
2
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan di Laboratorium Bioproses, Pusat Penelitian Bioteknologi dan Bioindustri Indonesia. Penelitian ini diselesaikan selama enam bulan dari September 2014 hingga Maret 2015.
Bahan
Bahan yang digunakan dalam penelitian ini adalah Rhizopus oryzae dari Pusat Penelitian Bioteknologi dan Bioindustri Indonesia, CPO, enzim lipase yang diproduksi dari isolat Rhizopus oryzae, akuades, PDA, MgSO4, KH2PO4, pepton,
gliserol, heksana, buffer Tris-HCl, aseton, polivinil alkohol, buffer fosfat-sitrat, etanol, NaOH, fenolftalein, petroleum benzena, dietil eter, asam asetat glasial, CaCO3, silica gel, zeolit, tulang sapi, kertas HVS 80 g, lempeng KLT silika gel
4
Alat
Alat yang digunakan dalam penelitian ini adalah labu Erlenmeyer, shaker, chamber KLT (Kromatografi Lapis Tipis), autoklaf, kertas pH, gelas piala, gelas ukur, corong Buchner, pompa vakum, pompa peristaltik, sentrifus Beckman Coulter Allegra X-22R, oven, batang pengaduk, cawan petri, pipet tetes, labu ukur, neraca analitik, inkubator, magnetic stirrer, freezer, pipet mikro, jarum ose, bunsen, laminar air flow, buret, Spektrofotometer UV-Vis Shimadzu, TLC Scanner Camag 3, dan peralatan lainnya.
Prosedur Penelitian
Produksi Enzim Kasar Lipase (Palilingan 2013)
Isolat kapang yang tumbuh dalam media agar-agar kentang (PDA) diremajakan kembali dengan diinokulasikan ke dalam media PDA baru, kemudian diinkubasi pada suhu ruang (27-30°C) selama 3-4 hari. Spora yang tumbuh dalam media PDA diambil sebanyak 1 ose lalu diinokulasikan dalam masing-masing 100 mL medium fermentasi steril yang mengandung Crude Palm Oil (CPO) 3% dengan total volume sebanyak 500 mL dan diinkubasi pada suhu ruang (27-30°C) selama 5 hari sambil digoyang dengan kecepatan agitasi 75 rpm. Setelah dilakukan proses fermentasi, enzim yang dihasilkan dipanen. Untuk memisahkan biomassa (spora) dengan filtrat dilakukan penyaringan vakum dengan menggunakan kertas saring yang telah diketahui bobot massanya. Biomassa sel dikeringkan dalam oven dengan suhu 60°C hingga bobotnya konstan dan dihitung biomassa sel keringnya sedangkan filtrat diambil untuk dilakukan proses pengendapan dan isolasi enzim. Pengendapan dan Isolasi Enzim Lipase (Palilingan 2013)
Pengendapan dan isolasi enzim lipase dari kapang R. oryzae dilakukan menurut metode pengendapan enzim menggunakan aseton. Semua tahap dikerjakan pada suhu 4 °C. Filtrat enzim kasar lipase yang diperoleh dari tahap pemanenan enzim diendapkan proteinnya menggunakan aseton dingin dengan nisbah filtrat dan aseton 1:2 (v/v). Setelah itu campuran disentrifugasi dengan kecepatan 8.400g selama 15 menit pada suhu 4 °C. Setiap endapan yang diperoleh dilarutkan ke dalam 1 ml bufer Tris HCl 0,05 M pH 7. Larutan enzim yang didapat, diambil 1-2 mL untuk diuji aktivitasnya.
Imobilisasi Enzim Lipase
Imobilisasi Enzim Lipase dengan Zeolit (Apriyanti 2012)
5 dilakukan berdasarkan pengurangan kadar protein cairan enzim sebelum dan setelah imobilisasi menggunakan metode Bradford dengan standar protein BSA (Bovine Serum Albumin), serta pengurangan lipasenya.
Imobilisasi Enzim Lipase dengan CaCO3 (Ghamgui et al. 2004)
Sebanyak 70 gram ditambahkan CaCO3 ke dalam 210 mL larutan enzim
hasil pengendapan dengan aseton. Campuran diinkubasi selama 1 jam pada suhu 4°C. Setelah itu ditambahkan 100 mL aseton, lalu suspensi disaring menggunakan corong Buchner, kemudian dicuci dua kali dengan 100 mL aseton dingin, dan dikeringkan menggunakan vakum desikator pada suhu kamar (25-30°C) selama 6 jam dan disimpan pada suhu 4°C sampai digunakan. Penentuan jumlah enzim imobil dilakukan berdasarkan pengurangan kadar protein cairan enzim sebelum dan setelah imobilisasi menggunakan metode Bradford dengan standar protein BSA (Bovine Serum Albumin), serta pengurangan lipasenya.
Imobilisasi Enzim Lipase dengan Silika gel (Lee et al. 2006)
Sebanyak 70 mg silika gel dicampur dengan 210 mL larutan lipase dan diinkubasi pada 20°C. Lipase imobil yang diperoleh dicuci dengan akuades dan kemudian dikeringkan pada suhu kamar (25-30°C) semalaman. Penentuan jumlah enzim imobil dilakukan berdasarkan pengurangan kadar protein cairan enzim sebelum dan setelah imobilisasi menggunakan metode Bradford dengan standar protein BSA (Bovine Serum Albumin), serta pengurangan lipasenya.
Imobilisasi Enzim Lipase dengan Butiran Tulang Sapi (Panji et al. 2010) Tulang paha sapi dikeringkan menggunakan oven, dihancurkan dengan grinder hingga berdiameter 0,3-1,0 cm. Butiran tulang dicuci dengan heksana hingga terbebas dari lemak, dicuci dengan detergen (surfaktan) dan dikeringkan kembali dengan oven pada suhu 105°C sampai beratnya tetap. Imobilisasi lipase dilakukan dengan cara menambahkan masing-masing 70 gram butiran tulang ke dalam 210 mL larutan lipase hasil pengendapan dengan aseton, digoyang menggunakan shaker pada 180 rpm selama satu jam, kemudian cairan dipisahkan. Penentuan jumlah enzim imobil dilakukan berdasarkan pengurangan kadar protein cairan enzim sebelum dan setelah imobilisasi menggunakan metode Bradford dengan standar protein BSA (Bovine Serum Albumin), serta pengurangan lipasenya. Analisis Aktivitas Enzim Lipase (Ibegbulam-njoku et al. 2014)
Penentuan aktivitas enzim lipase dilakukan dengan melarutkan 3 gram CPO dan 1 gram polivinil alkohol dalam 40 mL bufer fosfat-kalium pH 7. Sebanyak 1mL enzim lipase ditambahkan dalam larutan lalu diinkubasi selama 30 menit pada suhu 37°C. Reaksi dihentikan dengan menambahkan 20 mL campuran aseton : etanol (1:1 v/v). Kemudian sampel dititrasi menggunakan NaOH 1 N menggunakan indikator fenolftalein hingga titik akhir berwarna merah muda. Untuk blanko dilakukan prosedur yang sama tanpa perlakuan penambahan enzim. Penentuan kadar asam lemak bebas dapat dihitung menggunakan persamaan sebagai berikut:
Aktivitas enzim lipase = Vol lipase mL x Waktu reaksi menitVol NaOH mL x [NaOH] M
6
Karakterisasi lipase
Pengaruh pH pada stabilitas lipase imobil (Yesiloglu dan Sit, 2011)
Optimasi pH dilakukan dengan menggunakan bufer tris-HCl pada pH 5, 6, 7, 8, dan 9. Aktivitas ditentukan pada suhu 37°C selama 5 menit. Aktivitas tertinggi berdasarkan uji aktivitas lipase imobil menunjukkan pH optimum lipase. Stabilitas enzim imobil terhadap pH diuji dengan menginkubasikan larutan enzim pada larutan bufer pada berbagai pH (5-10 dengan selang 1) selama 1 jam. Setelah inkubasi selesai larutan enzim dengan cepat didinginkan dalam wadah berisi es dengan suhu 0 °C selama 10 menit. Aktivitas enzim yang tersisa diuji dengan reaksi enzimatis lipase pada pH optimum. Nilai aktivitas enzim imobil tersisa dinyatakan dalam persentase dari aktivitas setelah perlakuan dibandingkan dengan kontrol (enzim imobil tanpa perlakuan).
Pengaruh suhu pada stabilitas lipase imobil (Yesiloglu dan Sit, 2011)
Uji aktivitas enzim imobil dengan variasi suhu antara 25°C hingga 40°C dilakukan untuk penentuan suhu optimum. Pengujian aktivitas dilakukan berdasarkan pH optimum selama 5 menit. Aktivitas tertinggi berdasarkan uji aktivitas lipase menunjukkan suhu optimum lipase. Stabilitas enzim terhadap suhu diuji dengan menginkubasikan larutan enzim pada berbagai suhu (25-40 °C dengan selang 5°C) selama 1 jam dalam bufer dengan pH hasil stabilitas. Setelah inkubasi selesai larutan enzim dengan cepat didinginkan dalam penangas es. Aktivitas enzim imobil yang tersisa diuji dengan reaksi enzimatis lipase pada pH dan suhu optimum. Nilai aktivitas enzim imobil tersisa dinyatakan dalam persentase dari aktivitas setelah perlakuan dibandingkan dengan kontrol (enzim tanpa perlakuan).
Stabilitas penyimpanan lipase imobil (Yesiloglu dan Sit, 2011)
Enzim bebas dan imobil disimpan dalam suhu 4°C dalam 50 mM bufer tris-HCl berdasarkan pH optimum. Stabilitas penyimpanan dinyatakan dalam persen dari aktivitas sampel yang diperoleh dari pengambilan pada minggu pertama hingga minggu keenam dibandingkan dengan kontrol (enzim tanpa perlakuan).
Penggunaan kembali lipase imobil (Suharyanto et al. 2011)
Medium gliserolisis mengandung 0,8 gram gliserol, 40 mL heksana, 50 mL buffer tris HCl 50 mMol pH 7, dan 3 gram CPO. Sebanyak 1g enzim imobil ditambahkan dalam medium tersebut. Sampel diinkubasi pada suhu 37°C selama 24 jam. Setiap 3 jam sekali dilakukan pengambilan sampel untuk dilakukan analisis produk hasil gliserolisis. Seluruh prosedur dilakukan pengulangan hingga tiga kali. Aplikasi Lipase pada Produksi Diasilgliserol (Suharyanto et al., 2011)
Medium gliserolisis mengandung 0,8 gram gliserol, 40 mL heksana, 50 mL buffer tris HCl 50 mMol pH 7, dan 3 gram CPO. Sebanyak 20 µL enzim lipase bebas atau enzim imobil ditambahkan dalam medium tersebut. Sampel diinkubasi pada suhu 37°C selama 27 jam. Setiap 3 jam sekali dilakukan pengambilan sampel untuk dilakukan analisis produk hasil gliserolisis.
Analisis Produk Hasil Gliserolisis (TAG, DAG, MAG dan ALB) (Suharyanto et al. 2011)
7 Lempeng KLT yang sudah dielusikan dibiarkan mengering terlebih dahulu, kemudian visualisasi noda dilakukan dengan menggunakan uap iodine. Kristal iodine dituangkan ke dalam cawan petri hingga rata. Lempeng KLT yang sudah kering diletakkan di atas cawan petri selama dua menit (hingga terlihat noda cokelat). Noda yang terlihat langsung dilihat menggunakan TLC scanner
Perbesaran Skala Gliserolisis
Reaksi gliserolisis CPO dan teknik pemisahan komponen hasil gliserolisis digunakan untuk reaksi gliserolisis dalam skala yang lebih besar. Perhitungan kadar TAG dihitung menggunakan metode KLT. Skala gliserolisis diperbesar menjadi 25 kali lipat dari skala sebelumnya. Besarnya medium yang digunakan menjadi 1000 mL heksana, 1250 mL buffer tris HCl 50 mM pH 7, 20 g gliserol, dan 75 g CPO. Suhu reaksi gliserolisis pada suhu kamar (25-30 °C) dan diinkubasi selama 27 jam. Kemudian ALB, MAG, DAG,dan TAG dianalisis menggunakan TLC Scanner.
3
HASIL
Produksi, Pengendapan, dan Analisis Aktivitas Lipase
Isolat Rhizopus orzyae diremajakan dalam media PDA, kemudian difermentasikan. Isolasi enzim dilakukan menggunakan metode pengendapan dengan aseton dingin dengan perbandingan 1:2 (v/v). Sebanyak 1 mL enzim diperoleh dari isolasi dengan aseton dingin diperoleh dari 10 mL filtrat enzim kasar. Enzim diambil sebanyak 1% dari jumlah ekstrak yang didapat untuk diuji aktivitas lipasenya, diperoleh hasil sebesar 4,244 mol/menit.
Imobilisasi Lipase Rhizopus oryzae
Empat bahan pendukung yang diuji untuk imobilisasi lipase Rhizopus oryzae ialah zeolit, CaCO3, silika gel, dan tulang sapi. Persentase penyerapan setiap
bahan pendukung dihitung dengan menganggap jumlah protein yang terkandung dalam larutan enzim bebas adalah 100%. Konsentrasi protein imobil diperoleh dari selisih konsentrasi larutan enzim sebelum dan setelah imobilisasi. Secara lengkap konsentrasi protein yang imobil pada masing-masing bahan pendukung dapat dilihat pada tabel 1.
Tabel 1 Konsentrasi protein imobil Bahan % Enzim dalam larutan Pendukung yang imobil
Zeolit 90.69
CaCO3 99.46
Silika gel 59.63
8
Pengaruh pH pada Kestabilan Lipase Imobil
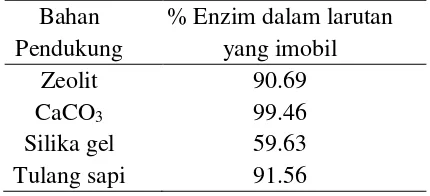
Lingkungan dimana enzim akan mengkatalis reaksi harus berada pada kondisi optimum enzim untuk bereaksi. Zona ini diberikan oleh parameter derajat keasaman (pH). Setiap enzim memiliki karakter yang berbeda dimana kondisi optimum pH lingkungan akan spesifik untuk tiap enzim. Kondisi pH yang jauh dari kondisi spesifik ini akan menyebabkan inaktivasi enzim karena enzim mengalami kerusakan struktur. Secara lengkap pengaruh pH terhadap stabilitas enzim imobil pada masing-masing bahan pendukung dapat dilihat pada gambar 2.
Gambar 1 Kurva pengaruh pH pada lipase imobil
Pengaruh Suhu terhadap Kestabilan Lipase Imobil
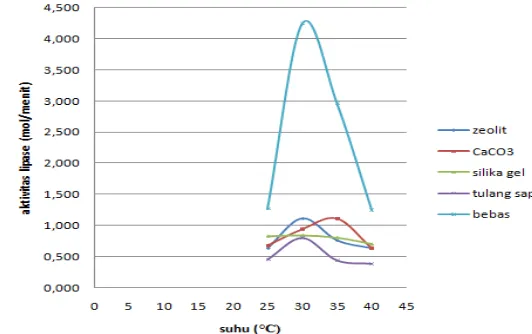
Seperti halnya perubahan kondisi pH, enzim memiliki kondisi optimal dengan adanya perubahan suhu. Laju reaksi akan meningkat sejalan dengan kenaikan suhu sampai pada batas optimalnya, kemudian aktivitas akan menurun setelah melewati kondisi tersebut karena enzim akan mengalami denaturasi. Suhu yang terlalu rendah akan menyebabkan aktivitas enzim kurang baik. Secara lengkap pengaruh suhu terhadap stabilitas enzim imobil pada masing-masing bahan pendukung dapat dilihat pada gambar 3.
9 Kestabilan Lipase Rhizopus oryzae Imobil
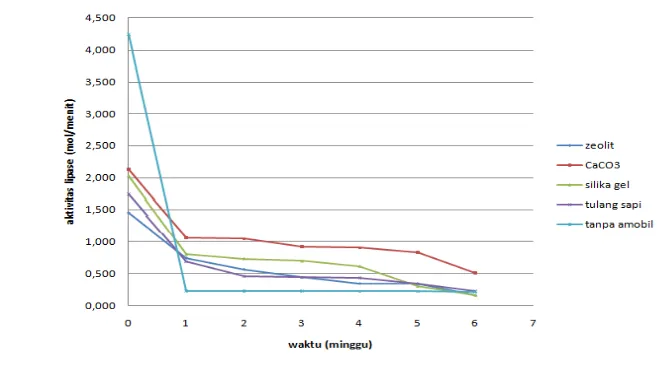
Penyimpanan lipase imobil pada jangka waktu pada suhu tertentu adalah salah satu faktor kunci yang cukup dipertimbangkan. Enzim umumnya tetap aktif saat disimpan pada suhu rendah, dikarenakan lipase cenderung untuk menjaga struktur aslinya. Atas dasar tersebut lipase disimpan pada suhu 4°C. Secara lengkap pengaruh waktu penyimpanan terhadap stabilitas enzim imobil pada masing-masing bahan pendukung dapat dilihat pada gambar 4.
Gambar 3 Pengaruh waktu penyimpanan pada lipase imobil Penggunaan Kembali Lipase Rhizopus oryzae Imobil
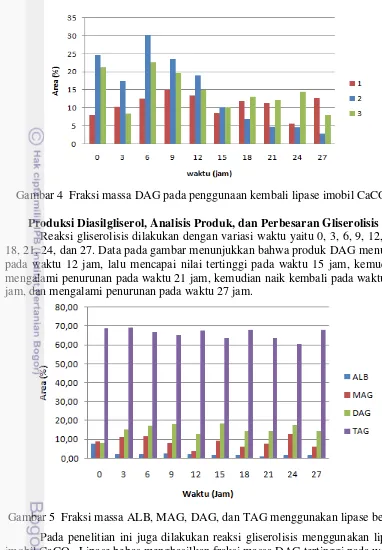
Penentuan kemampuan penggunaan kembali lipase imobil, dilakukan proses pergantian substrat sebanyak tiga kali dalam proses gliserolisis yang berlangsung selama 81 jam, dimana setiap 27 jam dilakukan pergantian substrat, tetapi lipase imobil yang digunakan tetap dipertahankan (tidak diganti). Prosedur tersebut dimaksudkan untuk menguji stabilitas lipase imobil ketika dilakukan pengamatan berulang dalam proses gliserolisis setiap tiga jam.
10
Gambar 4 Fraksi massa DAG pada penggunaan kembali lipase imobil CaCO3
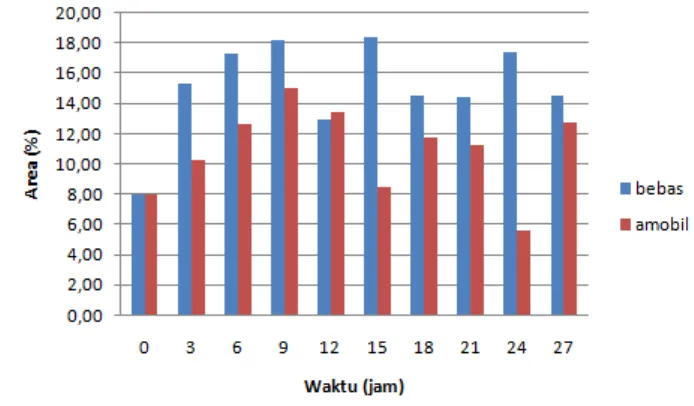
Produksi Diasilgliserol, Analisis Produk, dan Perbesaran Gliserolisis Reaksi gliserolisis dilakukan dengan variasi waktu yaitu 0, 3, 6, 9, 12, 15, 18, 21, 24, dan 27. Data pada gambar menunjukkan bahwa produk DAG menurun pada waktu 12 jam, lalu mencapai nilai tertinggi pada waktu 15 jam, kemudian mengalami penurunan pada waktu 21 jam, kemudian naik kembali pada waktu 24 jam, dan mengalami penurunan pada waktu 27 jam.
Gambar 5 Fraksi massa ALB, MAG, DAG, dan TAG menggunakan lipase bebas Pada penelitian ini juga dilakukan reaksi gliserolisis menggunakan lipase imobil CaCO3. Lipase bebas menghasilkan fraksi massa DAG tertinggi pada waktu
15 jam sebesar 18,41%, sedangkan lipase imobil CaCO3 menghasilkan fraksi massa
11
Gambar 6 Fraksi massa DAG pada lipase bebas dan lipase imobil
Pada penelitian ini juga dilakukan perbesaran skala gliserolisis hingga 25 kali lipat dari skala sebelumnya. Data pada gambar menunjukkan produk DAG menurun pada waktu 3 jam, kemudian meningkat hingga mencapai nilai tertinggi pada waktu 21 jam, lalu mengalami penurunan pada waktu 24 jam.
12
4
PEMBAHASAN
Produksi, Pengendapan, dan Analisis Aktivitas Lipase
Rhizopus orzyae merupakan fungi yang termasuk dalam jenis kapang yang banyak digunakan dalam proses pembuatan tempe kedelai. Rhizopus orzyae dipilih karena kapang lokal jenis ini bersifat tidak toksik, mudah diperoleh, pertumbuhan relatif cepat. Isolat Rhizopus orzyae diremajakan dalam media agar kentang (PDA) lalu diinkubasi selama tiga hari, dan inkubasi fermentasi dilakukan selama lima hari, dikarenakan berdasarkan penelitian Perwitasari (2008) yang menunjukkan tingginya aktivitas lipase isolat Rhizopus orzyae pada saat tersebut. Selanjutnya dilakukan isolasi enzim lipase untuk memekatkan lipase dari cairan hasil fermentasi (Murni et al. 2015). Isolasi enzim yang diperoleh menggunakan teknik pengendapan dengan pelarut organik aseton. Penambahan pelarut organik dalam cairan fermentasi mengurangi kelarutan protein dengan mengurangi konstanta dielektrik larutan. Pengendapan terjadi lebih mudah ketika pH dekat dengan pI protein (Panesar et al. 2010). Selanjutnya, aktivitas lipase ditentukan dengan penentuan kadar asam lemak bebas yang terbentuk melalui proses pemecahan ikatan ester oleh lipase (Ibegbulam-njoku et al. 2014). Diperoleh hasil sebesar 4,244 mol/menit (4,244 U), yang berarti terjadi pembebasan 4,244 mol asam lemak bebas dalam setiap satu menit oleh enzim lipase.
Imobilisasi Lipase Rhizopus oryzae
Seperti dapat dilihat pada tabel 1, bahan pendukung CaCO3 menunjukkan
konsentrasi protein teringgi sebesar 99.46%, dibandingkan tulang sapi yang sebesar 91.56% dan zeolit yang hanya sebesar 90.69%. Hal ini dikarenakan luas permukaan struktur bubuk CaCO3 yang lebih besar dibandingkan butiran tulang sapi dan
butiran zeolit. Semakin besar luas permukaan bahan pendukung maka semakin besar konsentrasi protein yang dapat terabsorpsi (Zou et al. 2014). Dari sisi struktur bahan, CaCO3 merupakan garam yang memiliki gaya antarmolekul dengan larutan
lipase cukup baik (Wulan et al. 2007).
Tulang sapi merupakan adsorben organik yang sudah dideproteinasi dan de-mineralisasi, meninggalkan pori yang dapat diisi oleh zat lain. Dengan pori yang besar dan luas permukaan yang besar, tulang sapi dapat menyerap lipase dengan baik dibandingkan zeolit. (Wulan et al. 2007). Zeolit merupakan padatan kristal yang telah digunakan secara luas dalam adsorpsi molekul. Zeolit memiliki gugus hidroksil yang dapat membentuk ikatan hidrogen yang kuat dengan enzim. Selain itu, zeolit memiliki permukaan heterogen yang cocok dengan beberapa sisi adsorpsi enzim (Datta et al. 2013)
Namun pada bahan pendukung silika gel menunjukkan aktivitas terendah yaitu sebesar 59.63%. Silika adalah material yang porous dan amorphous. Silika gel merupakan partikel adsorben alamiah, dimana zat ini akan menyerap air dengan batas tertentu. Kemampuan adsorpsi permukaan dan intra molekul silika gel sudah terbukti luas. Namun yang membuat kemampuan adsorpsi silika gel rendah adalah karena silika gel yang berbentuk padat memiliki kekuatan tarik antar partikel yang rendah dibandingkan CaCO3 (Wulan et al. 2007). Selain itu, hal tersebut
13 (Ghamgui et al. 2004). Hal ini yang diperkirakan menyebabkan lipase tidak terikat kuat dengan silika gel.
Pengaruh pH pada Kestabilan Lipase Imobil
pH optimum lipase bebas sama seperti lipase imobil tulang sapi yaitu pada pH 7. Namun pH optimum diperoleh pada pH 8 untuk lipase yang imobil zeolit, CaCO3, dan silika gel. Hal ini menunjukkan matriks bersifat polianion.
Pendistribusian ion hidroksida yang berbeda antara dekat dengan permukaan di dalam matriks, dimana muatan positif dekat dengan sisi pengikatan enzim, mengakibatkan enzim imobil zeolit, CaCO3, dan silika gel memiliki pH optimum
yang lebih tinggi dibandingkan pH optimum pada lipase bebas (Pereira et al. 2001) Pengaruh Suhu terhadap Kestabilan Lipase Imobil
Suhu optimum pada lipase bebas sama seperti suhu optimum pada lipase imobil zeolit, silika gel, dan tulang sapi yaitu sebesar 30°C. Namun terjadi peningkatan suhu optimum pada lipase imobil CaCO3 yaitu sebesar 35°C.
Imobilisasi lipase Rhizopus oryzae pada CaCO3 dapat mengakibatkan
meningkatnya termostabilitas enzim dan memperluas potensi bioteknologi, karena bioproses berjalan pada suhu yang lebih tinggi dapat meningkatkan tingkat difusi, menurunkan viskositas substrat, dan meningkatkan kelarutan reaktan (Kilinc et al. 2006). Hal ini merupakan hal yang diinginkan, karena suhu operasional yang lebih tinggi akan menyebabkan resiko yang lebih rendah dari kontaminasi mikroba (Pereira et al. 2001).
Kestabilan Lipase Rhizopus oryzae Imobil
Pada gambar 4 terlihat bahwa aktivitas lipase bebas lebih tinggi lipase imobil pada minggu pertama. Namun aktivitas lipase imobil lebih tinggi daripada lipase bebas sejak minggu kedua hingga minggu keenam. Lipase imobil lebih stabil dibandingkan enzim bebas dikarenakan dukungan matriks mencegah proses antarmolekul seperti proteolisis dan agregasi, oleh karena itu menciptakan molekul enzim yang lebih kaku(Yesiloglu & Sit 2011).
Penggunaan Kembali Lipase Rhizopus oryzae Imobil
Pada gambar 4 terlihat bahwa lipase imobil memiliki kemampuan untuk mengkatalisis proses gliserolisis berulang-ulang. Dari hasil pada gambar terlihat fraksi massa DAG dari tiap siklus dan tiap perlakuan pergantian substrat CPO relatif sama atau tidak berbeda jauh. Hal ini mengindikasikan bahwa aktivitas lipase tetap stabil dan tidak menurun drastis seiring dengan bertambahnya waktu gliserolisis dan banyaknya penggunaan substrat baru.
14
Produksi Diasilgliserol, Analisis Produk, dan Perbesaran skala Gliserolisis Gliserolisis merupakan suatu reaksi antara gliserol dengan minyak/lemak untuk menghasilkan produk MAG dan DAG (Kimmel 2004). Salah satu faktor penting pada proses gliserolisis adalah kelarutan atau kontak antara TAG dan gliserol (Cheirshilp et al. 2007; Susi 2010), karena alasan tersebut maka dalam penelitian ini digunakan heksana sebagai pelarut organik. Dipilihnya heksana sebagai pelarut organik karena heksana merupakan pelarut yang dapat melarutkan substrat CPO; membantu dalam meningkatkan rendemen produk DAG serta dapat meningkatkan kelarutan minyak dan gliserol dalam proses gliserolisis, sehingga proses gliserolisis dapat berlangsung lebih optimal (Nuraeni 2008). Selain itu, penggunaan pelarut heksana memiliki bau yang tidak tajam sehingga tidak mengganggu nilai organoleptik produk akhir yang dihasilkan (Susi 2010). Adanya penambahan heksana dapat membuat kandungan TAG pada CPO berkurang. Hal ini dikarenakan heksana adalah pelarut non polar dan TAG dalam CPO dapat terlarut di dalamnya, karena TAG lebih bersifat non polar daripada DAG dan MAG, membuat TAG dapat terpisah dari DAG dan MAG.
Enzim merupakan katalisator sejati. Molekul ini dapat meningkatkan kecepatan reaksi kimia. Katalis yang digunakan dalam rekasi gliserolisis ini adalah enzim lipase. Rhizopus orzyae dapat menghasilkan enzim lipase yang bersifat spesifik 1,3 gliserida. Spesifitas lipase dari R. oryzae yang bersifat spesifik 1,3 telah dilaporkan melalui penelitian yang dilakukan antara lain Arini (2005); Putranto et al. (2006); Perwitasari (2008), serta Suharyanto et al. (2011). Enzim lipase dari R. oryzae yang bersifat spesifik dalam menghidrolisis TAG pada posisi 1,3 dapat pula dibuktikan dengan rumusan yang dikemukakan oleh Arini (2005) dan Panji et al. (2008). Hasil penelitian ini menunjukkan bahwa nilai perbandingan DAG/TAG lebih besar dari ALB/TAG, yaitu 0,23 > 0,04, sehingga dapat disimpulkan bahwa lipase yang digunakan bersifat 1,3-gliserida. Kerja lipase yang spesifik 1,3 ini sangat penting dalam penggunaannya untuk produksi DAG karena reaksi gliserolisis enzim dapat dikendalikan dan tidak menghasilkan pemecahan total gliserida menjadi ALB seperti yang biasa terjadi pada pemecahan secara non-enziatis (kimiawi) (Panji et al. 2008)
15
Gambar 8 Reaksi hidrolisis trigliserida menjadi diasilgliserol (Paques dan Macedo 2006)
Pada gambar 5 dan 7terlihat adanya ketidakstabilan enzim dalam presentase perubahan fraksi massa DAG, dapat disebabkan karena kerja lipase yang mengkatalisis reaksi hidrolisis TAG menjadi DAG, juga reaksi esterifikasi MAG dengan ALB ataupun ALB dengan gliserol untuk membentuk DAG. Adanya penurunan fraksi massa produk DAG seperti terlihat pada waktu ke 12, 21, dan 21 jam disebabkan karena DAG yang terbentuk dapat mengalami hidrolisis kembali menjadi MAG dan ALB. Hal ini menunjukkan bahwa lipase merupakan enzim yang dapat mengkatalisis reaksi dua arah, yaitu hidrolisis dan esterifikasi (Turner et al. 2008).
16
Gambar 10 Reaksi esterifikasi asam lemak dan gliserolisis oleh lipase (Hermansyah et al. 2010)
Pada gambar 6 terlihat adanya ketidakstabilan enzim dalam presentase perubahan fraksi massa DAG saat menggunakan lipase imobil. Hal ini dikarenakan teknik imobilisasi CaCO3 menggunakan metode imobilisasi adsorpsi. Menurut
Kneevic et al. (2004), metode adsorpsi merupakan teknik yang paling mudah dan murah dilakukan. Akan tetapi teknik imobilisasi dengan adsorpsi membentuk ikatan antara enzim dengan bahan pendukung yang sangat lemah (terutama ikatan Van der Waals, ikatan hidrogen, dan interaksi hidrofobik), sehingga memungkinkan lipase untuk terdesorpsi dari materi pendukung, dan dapat berakibat pada menurunnya aktivitas lipase.
Selain itu, menurut Su et al. (2007) adanya pelarut heksana yang digunakan dalam proses gliserolisis, diduga dapat menyebabkan perubahan konformasi dari lipase, sehingga dapat menyebabkan lipase terdenaturasi, sehingga aktivitas menurun. Kondisi tersebut berbeda dengan gliserolisis menggunakan lipase bebas, dimana lipase bebas terlidung/terlarut dalam larutan buffer dalam jumlah yang banyak sehingga kemungkinan lipase untuk terdenaturasi oleh heksana menjadi lebih kecil dibandingkan lipase imobil.
5
SIMPULAN DAN SARAN
Simpulan
Imobilisasi enzim lipase Rhizopus oryzae dengan teknik adsorpsi dapat dilakukan menggunakan zeolit, CaCO3, silika gel, dan tulang sapi. Adsorpsi enzim
tertinggi pada CaCO3 yaitu sebesar 99,46%, lalu tulang sapi (91,56%), zeolit
17 35°C. Seluruh lipase imobil lebih stabil dibandingkan enzim bebas sejak penyimpanan pada minggu pertama. Lipase imobil CaCO3 dapat digunakan
kembali hingga tiga kali penggunaan. Konversi gliserolisis lipase imobil CaCO3
mencapai 15,02% selama 9 jam lebih rendah dibandingkan menggunakan lipase bebas sebesar 18,41% selama 15 jam.
Saran
Sebaiknya dilakukan tahap pemurnian lipase lebih lanjut dengan dialisis dan kolom filtrasi gel. Pemurnian lebih lanjut meningkatkan ketelitian dan identifikasi karakteristik lipase. Selain itu, memodifikasi teknik imobilisasi pada setiap bahan pendukung untuk memperoleh adsorpsi enzim yang lebih baik.
DAFTAR PUSTAKA
Anggirasti, Hariyadi P, Andarwulan N, Haryati T. 2008. Gliserolisis RBDPO (Refined Bleached Deodorized Palm Oil) dengan Lipase untuk Sintesis MDAG (Monodiasilgliserol). Prosiding Seminar PATPI, Palembang.
Apriyanti S. 2012. Optimasi Produksi Diasilgliserol dari CPO dengan Biokonversi Enzim Lipase Spesifik 1,3 Amobil [Skripsi]. Bogor (ID) : Universitas Pakuan. Arini N. 2005. Isolasi dan penapisan mikroba penghasil lipase spesifik 1,3-gliserida
serta penentuan kondisi optimum produksi diasilgliserol menggunakan minyak sawit mentah [tesis]. Depok (ID): Universitas Indonesia.
Cheirsilp B, Kaewtong W, Kittikun AH. 2007. Kinetic study of glycerolysis of palm olein for monoacylglycerol production by immobilied lipases. Biochl Engineering Journal. 35:71-80
Cheong LZ, Lai MO. 2009. Diacylglycerol oil: Healthful or Hype? Inform. 20(6)391-393.
Datta S, Christena LR, Rajaram YRS. 2013. Enzyme immobiliation: an overview on techniques and support materials. Journal Biotech. 3:1-9. DOI:10.1007/s13205-012-0071-7
Ghamgui H, Chaabouni MK, Gargouri Y. 2004. 1-butyl oleate synthesis by immobilzed lipase from Rhizopus oryzae: a comparative study between n-hexane and solvent free system. Enzyme and Microbial Technology. 35:355-363. DOI: 10.1016/j.enzmictec.2004.06.002
Hasanuddin A, Mappiratu, Hutomo GS. 2003. Pola perubahan mono dan diasilgliserol dalam reaksi etanolisis minyak sawit mentah. J Tekn & Indust Pangan. 14(3):241-247.
Hermansyah H, Utami TS, Arbianti R, Achmadi F. 2010. Simulasi reaksi esterifikasi asam lemak bebas dan gliserol untuk menghasilkan minyak diasilgliserol. Reaktor. 13(2):95-120.
18
Journal of Sciencetific & Engineering Research. 5(2):1631-1640. DOI: 10.1590/S1516-89132011000100015
Keenevic D, Siler-Marinkovic SS, Mojovic LV. 204. Immobilied lipase as practical catalysts. APTEFF. 35:1-280
Kharrat N, Yassine BA, Sana M, Youssef-Talel G, Maha K. 2011. Immobilization of Rhizopus oryzae lipase on silica aerogels by adsorption: Comparison with the free enzyme. Process Biochemistry. 46:1083-1089. DOI:10.1016/j.procbio.2011.01.029
Kilinc A, Mustafa T, Azmi T. 2006. Immobilization of pancreatic lipase on chitin and chitosan. Prep Biochem Biotechnol. 36:153-163. DOI: 10.1080/10826060500533976
Kimel T. 2004 Kinetic investigation of the base-catalyed glycerolysis of fatty acid methyl esther. Genehmigte Dissertation, Technischen Universtat Berlin. Berlin. Germany.
Kirk, O. Vedel T. Crone C. 2002. Industrial Enzyme Application. Current opinion on biotechnology. 13:345-351. DOI: 10.1016/S0958-1669(02)00328-2 Kong GT. 2010. Peran Biomassa Bagi Energi Terbarukan. Jakarta: Elex Media
Komputindo.
Kusumo DP. 2008. Sintesis dan Karakterisasi Minyak Kaya DAG (MKDAG) Berbahan Baku RBDPO (Refined Bleached Deodorized Palm Oil) dengan Metode Gliserolisis Enzimatis [skripsi]. Bogor (ID): Institut Pertanian Bogor. Lee DH, Kim JM, Kang SW, Lee JW, Kim SW. 2006. Pretreatment of lipase with soybean oil before immobilization to prevent loss of activity. Biotechnol Lett. 28:1965-1969. DOI: 10.1007/s10529-006-9181-9
Murni SW, Kholisoh SD, Tanti DL, Petrissia EM. 2015. Produksi, karakterisasi, dan isolasi lipase dari Aspergillus niger menggunakan minyak goreng sawit sebagai induser. Eksergi. 12(1):1-4.
Nuraeni F. 2008. Sintesis mono-diasilgliserol (M-DAG) dari destilat asam lemak minyak sawit (DALMS) melalui esterifikasi enimatis. [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Palilingan SC. 2013. Optimasi produksi enzimatis diasilgliserol dari CPO dengan sistem kontinu [tesis]. Bogor (ID): Institut Pertanian Bogor.
Panesar PS, Marwaha SS, Chopra HK. 2010. Enzymes Food Processing: Fundamental and Potential Application. New Delhi: International Publishing House Pvt. Ltd.
Panji T, Suharyanto, Arini N. 2008. Lipase Spesifik 1,3-Gliserida dari Fungi Lokal Untuk Biokonversi CPO Menjadi Diasilgliserol. Menara Perkebunan. 76(1):11-22.
Panji T, Syamsu K, Suharyanto, Fathurachman I. 2010. Amobilisasi desaturase asal Absidia corymbifera menggunakan butiran tulang sapi dan zeolit. J. Tek. Ind. Pert. 11(3):101-107.
Paques, FW dan Macedo GA. 2006. Lipases de Látex Vegetais: Propriedades e Aplicações Industriais: A Review. Química Nova, 29(1):93-99.
19 Perwitasari U. 2008. Optimasi Produksi Enzimatik dan Isolasi DAG dari CPO
[tesis]. Bogor (ID): Institut Pertanian Bogor.
Pramana YS, Mulyani S. 2007. Proses Gliserolisis CPO Menjadi Mono dan Diasilgliserol Dengan Pelarut Tert-Butanol dan Katalis MgO [tesis]. Semarang (ID) : Universitas Diponegoro.
Putranto R, Santoso D, Panji T, Suharyanto, Budiani A. 2006. Karakterisasi gen penyandi lipase dari kapang Rhizopus oryzae dan Absidia corymbifera. Menara Perkebunan. 74(1):23-31.
Su E, hang MJ, hang JG, Gao JF, Wei D. 2007 ipase catalyed irreversible transesterification of vegetable oils for fatty acid methyl esters production with dimethyl carbonate as the acyl acceptor. Biochemical Engineering Journal. 36:167-173
Suharyanto, Panji T, Perwitasari U. 2011.Optimasi Produksi Diasilgliserol dari Crude Palm Oil menggunakan Lipase Spesifik 1,3-gliserida dari Rhyzopus oryzae TP-2. Menara perkebunan. 79(1):23-29.
Susi. 2010. Potensi pemanfaatan minyak sawit sebagai emulsifier monoasilgliserol. Agroscientiae. 17(3):156-163.
Takase H. 2007. Metabolism of Diacylglycerol in Human. Asia Pac. J. Clin. Nutr. 16(1)391-393.
Turner C, King JW, Mckeon T. 2004. Selected uses of enymes with critical fluids in analytical chemistry. J AOAC Int. 87(4):797-810.
Wang K et al. 2009. Direct electrochemistry and electrocatalysis of glucose oxidase immobilized on glassy carbon electrode modified by nafton and ordered mesoporous. Journal of Molecular Catalysis B: Enzymatic 58: 194-198. Wulan M, Rejoso MT, Hermansyah H. 2007. Seminar Tjipto Utomo. Bandung, 30
Agustus 2007.
Yesiloglu Y dan Sit L. 2011. Biochemical properties of free and immobilized Candida rugosa lipase onto Al2O3: a comparative study. Artificial cells, blood
substitutes and bitechnology. 39:247-251. DOI: 10.3109/10731199.2010.533125
20
Lampiran 1 Diagram alir penelitian
Produksi enzim kasar lipase
Pengendapan dan isolasi enzim Analisis aktivitas
enzim lipase
Amobilisasi
Zeolit
CaCO3
silica gel
tulang sapi
Penentuan kadar protein
Aplikasi lipase pada produksi diasilgliserol
21 Lampiran 2 Kurva standar protein
y = 0,0129x + 0,0114 R² = 0,994
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8
0 20 40 60
A
b
sor
b
an
si
Konsentrasi (ppm)
Konsentrasi vs Abs
22
Lampiran 3 Aktivitas lipase bebas
Sampel
Volume NaOH (mL) Volume Aktivitas Lipase
Awal Akhir NaOH
(mL) (mol/menit)
Blanko 15,60 18,15 2,55
Enzim 1 12,00 24,00 12,00 4,200
Enzim 2 3,30 15,60 12,30 4,333
Enzim 3 0,00 12,00 12,00 4,200
23 Lampiran 4 Fraksi Massa ALB, MAG, DAG, dan TAG menggunakan lipase
bebas
Waktu % Area Perbandingan
(Jam) ALB MAG DAG TAG DAG/TAG ALB/TAG
0 7,62 8,80 7,96 68,75 0,12 0,11
3 1,99 11,17 15,31 69,02 0,22 0,03
6 2,00 11,54 17,32 66,67 0,26 0,03
9 2,39 8,01 18,22 65,25 0,28 0,04
12 2,16 3,76 12,90 67,54 0,19 0,03
15 1,91 9,44 18,41 63,51 0,29 0,03
18 1,79 6,19 14,52 67,94 0,21 0,03
21 1,10 7,71 14,46 63,61 0,23 0,02
24 1,86 13,00 17,45 60,48 0,29 0,03
27 1,79 6,19 14,52 67,94 0,21 0,03
24
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 27 Agustus 1990, sebagai anak tunggal dari pasangan Zen Nasir dan Ida Soraya. Penulis bersekolah di SMAN 39 Jakarta, lalu melanjutkan pendidikan sarjana di Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Negeri Jakarta, lulus pada tahun 2012. Penulis sempat bekerja di PT Suryamas Gemilang Lubricant sebagai Quality Staff. Pada tahun 2013 penulis diterima di Sekolah Pascasarjana IPB pada program studi Biokimia dengan sponsor beasiswa pascasarjana dari Direktorat Jenderal Pendidikan Tinggi (DIKTI) melalui program Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPPDN) untuk calon dosen dari tahun 2013-2015.