IKA NURMEILIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Sintesis Kemosensor Ion Hg(II) Berbasis Hemisianin adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
IKA NURMEILIA. Sintesis Kemosensor Ion Hg(II) Berbasis Hemisianin. Dibimbing oleh TUN TEDJA IRAWADI dan NOVIYAN DARMAWAN.
Pada penelitian ini senyawa kemosensor berbasis hemisianin telah berhasil disintesis dari 3-(karboksimetil)-2-metilbenzotiazolium bromida (garam kmb) dan 4-dietilamino-2-hidroksibenzaldehidamelalui reaksi kondensasi. Hemisianin yang dihasilkan dari reaksi tersebut adalah (E )-2-(2-(4-(dietilamino)-2-hidroksistiril)benzo[d]tiazol-3-ium-3-il)asetat (hemisianin 1). Garam kmb dan hemisianin 1 dicirikan menggunakan spektroskopi resonans magnet inti 1H dan inframerah transformasi Fourier. Adanya ion Hg(II) dalam larutan hemisianin 1 mengakibatkan pergeseran panjang gelombang maksimum dari 541 ke 462.5 nm. Hemisianin 1 mampu mengenali secara selektif ion Hg(II) ditandai dengan adanya perubahan warna larutan dari merah menjadi hijau kekuningan. Peran gugus –OH dalam selektivitas dan sensitivitas hemisianin 1 terhadap ion Hg(II) dibuktikan dengan menyintesis senyawa hemisianin lainnya, tetapi tanpa gugus –OH, yaitu hemisianin 2. Spektrum ultraviolet-tampak hemisianin 2 dengan ion Hg(II) tidak menunjukkan pergeseran panjang gelombang maksimum dan warna larutan hemisianin 2 tidak berubah, sehingga hemisianin 2 tidak dapat dijadikan sebagai kemosensor ion Hg(II).
Kata kunci: hemisianin, Hg(II), kemosensor
ABSTRACT
IKA NURMEILIA. Synthesis of Hemicyanine-Based Hg(II) Ion Chemosensor. Supervised by TUN TEDJA IRAWADI and NOVIYAN DARMAWAN.
In this study, hemicyanine-based chemosensor was successfully synthesized from 3-(carboxymethyl)-2-methylbenzotiazolium bromide (kmb salt) and 4-diethylamino-2-hydroxybenzaldehyde through condensation reaction. Hemicyanine product was (E)-2-(2-(4-(diethylamino)-2-hydroxystyryl)benzo[d] thiazol-3-ium-3-yl)acetate (hemicyanine 1). Kmb salt and hemicyanine 1 were characterized using 1H nuclear magnetic resonance and Fourier transform infrared spectroscopy. The presence of Hg(II) ions shifted the maximum absorption wavelength from 541 to 462.5 nm. The ability of hemicyanine 1 to selectively recognize Hg(II) ions was evidenced by solution color change from red to yellowish green. The role of –OH group on selectivity and sensitivity of hemicyanine 1 toward Hg(II) ions was proven by synthesizing another hemicyanine compound without –OH group, that was (E )-2-(2-(4-(dimethylamino)styryl)benzo[d]thiazol-3-ium-3-yl)acetate (hemicyanine 2). Ultraviolet-visible spectrum of hemicyanine 2 with Hg(II) ions did not shift the maximum absorption wavelength and did not change the color of hemicyanine solution. As the result, hemicyanine 2 cannot be used as chemosensor for Hg(II) ions.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
SINTESIS KEMOSENSOR ION Hg(II) BERBASIS
HEMISIANIN
IKA NURMEILIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Sintesis Kemosensor Ion Hg(II) Berbasis Hemisianin Nama : Ika Nurmeilia
NIM : G44100024
Disetujui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Pembimbing I
Dr rer nat Noviyan Darmawan, MSc Pembimbing II
Diketahui oleh
Prof Dr Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu Wa Ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan April−September 2014 ialah Sintesis Kemosensor Ion Hg(II) Berbasis Hemisianin.
Terima kasih penulis ucapkan kepada Ibu Prof Dr Ir Tun Tedja Irawadi, MS dan Bapak Dr rer nat Noviyan Darmawan, MSc selaku pembimbing atas bimbingan, arahan, dan sarannya kepada penulis. Penghargaan penulis sampaikan kepada Bapak Sabur atas kesediaannya dalam membantu menyiapkan peralatan di laboratorium. Penulis juga mengucapkan terima kasih kepada Bapak, Mama, dan Dicky Annas atas segala doa, nasihat, dan kasih sayangnya. Ungkapan terima kasih juga disampaikan kepada Hasna Tazkia Nikmawahda, Ferra Dwiangga Noviadinni, Muhamad Alif Hamimdal, Kak Febrina Miharti, Kak Ichsan Irwanto, dan Mas Yono, Kak Tari serta Awalia Khairun Nisa yang telah membantu penulis.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
BAHAN DAN METODE 3
Alat dan Bahan 3
Langkah Percobaan 3
Sintesis Piperidina (Marvel dan Lazier 1941) 4
Sintesis 3-(Karboksimetil)-2-metilbenzotiazolium bromida (Garam kmb)
(Tatay et al. 2006) 4
Sintesis (E)-2-(2-(4-(Dietilamino)-2-hidroksistiril)benzo[d ]tiazol-3-ium-3-il)asetat atau Hemisianin 1 (Tatay et al. 2006) 5 Sintesis (E)-2-(2-(4-(Dimetilamino)stiril)benzo[d]tiazol-3-ium-3-il)asetat atau Hemisianin 2 (Modifikasi Tatay et al. 2006) 5
HASIL DAN PEMBAHASAN 6
Hemisianin 1 6
Hemisianin 2 9
SIMPULAN DAN SARAN 13
Simpulan 13
Saran 13
DAFTAR PUSTAKA 13
LAMPIRAN 15
DAFTAR TABEL
1 Analisis spektrum 1H NMR hemisianin 1 7
2 Analisis spektrum FTIR hemisianin 1 7
3 Hasil analisisis 1H NMR hemisianin 2 10
4 Analisis FTIR struktur hemisianin 2 11
DAFTAR GAMBAR
1 Struktur hemisianin 1 (a) dan kompleks hemisianin 1 dengan ion Hg(II) (b) 2 2 Struktur hemisianin dengan pengkelat NO2Se2 (a) dan kompleks hemisianin
dengan ion Hg(II) (b) 2
3 Struktur hemisianin 2 3
4 Reaksi sintesis piperidina 4
5 Reaksi sintesis garam kmb 4
6 Reaksi sintesis hemisianin 1 5
7 Reaksi sintesis hemisianin 2 5
8 Hemisianin 1 hasil sintesis 6
9 Spektrum UV-Vis hemisianin 1 10 µM 8
10Larutan hemisianin 1 10 µM (a) dan larutan hemisianin 1 dengan ion Hg(II) (b), Mn(II) (c), Fe(II) (d), Pb(II) (e), Mg(II) (f), dan campuran kelima ion 0.1
mM (g) 8
11Spektrum tumpuk UV-Vis hemisianin 1 10 µM (█), hemisianin 1 dengan ion Hg(II) (█), Mg(II) (█), Mn(II) (█), Fe(II) (█), dan Pb(II) (█) 0.1 mM 9
12Hemisianin 2 hasil sintesis 10
13Spektrum UV-Vis hemisianin 2 10 µM 11
14Larutan hemisianin 1 (a) dan hemisianin 2 (b) dengan konsentrasi 0.1 mM 12 15Larutan hemisianin 2 10 µM (a), dan larutan hemisianin 2 dengan ion Hg(II) (b), Pb(II) (c), Fe(II) (d), Mn(II) (e), Mg(II) (f), dan campuran kelima ion 0.1
mM (g) 12
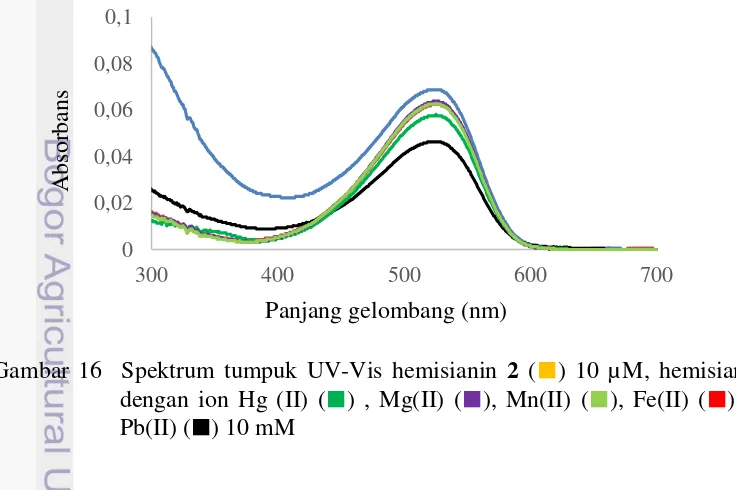
16Spektrum tumpuk UV-Vis hemisianin 2 (█) 10 µM, hemisianin 2 dengan ion Hg(II) (█), Mg(II) (█), Mn(II) (█), Fe(II) (█) , dan Pb(II) (█) 10 mM 12 17Reaksi antara hemisianin 2 dengan ion Hg(II) 13
DAFTAR LAMPIRAN
1 Bagan alir penelitian 15
2 Perhitungan rendemen 16
3 Elusidasi garam kmb 17
4 Spektrum tumpuk FTIR garam kmb, hemisianin 1, dan hemisianin 2 18
5 Elusidasi hemisianin 1 18
PENDAHULUAN
Logam merkuri menjadi salah satu masalah lingkungan yang harus ditangani. Dalam sistem akuatik, merkuri dapat diubah menjadi metilmerkuri yang berpotensi sebagai neurotoksin. Selain itu, metilmerkuri bersifat bioakumulasi pada rantai makanan sehingga berbahaya bagi makhluk hidup (Selin 2009). Dalam tubuh manusia, merkuri dapat berikatan dengan makromolekul yang mengandung gugus sulfur seperti glutation. Ikatan merkuri dengan glutation menyebabkan cadangan glutation semakin menipis sehingga menimbulkan kerusakan neurologis seperti yang ditemukan pada penyakit Parkinson (Patrick 2002). Deteksi ion Hg(II) umumnya menggunakan instrumen canggih seperti spektrofotometer serapan atom dan spektrometer massa-plasma gandeng induktif. Namun, cara tersebut memiliki kekurangan, yaitu tidak dapat digunakan untuk analisis in situ, mahal, serta memerlukan teknisi khusus, dan banyak tahap preparasi (Shunmugam et al. 2008; Nolan dan Lippard 2008). Oleh karena itu, dikembangkan cara lain untuk mendeteksi ion Hg(II) tanpa menggunakan instrumen canggih, yaitu dengan kemosensor.
Kemosensor adalah molekul organik yang digunakan untuk mendeteksi adanya analit berupa kation, anion, atau molekul organik melalui ikatan kovalen atau nonkovalen, sehingga menghasilkan sinyal yang dapat diukur (Wang dan Anslyn 2011). Dikenal berbagai jenis sinyal dari kemosensor, yaitu elektrokimia, kromogenik, atau fluorogenik (Diez-Gil et al. 2007) serta resonans plasmon permukaan (SPR) dan quartz crystal microbalance (Liu et al. 2011). Kemosensor dengan prinsip kolorimetri berpotensi sebagai teknik yang lebih mudah dan murah, tetapi tetap selektif dan sensitif untuk mendeteksi ion Hg(II).
2
(a)
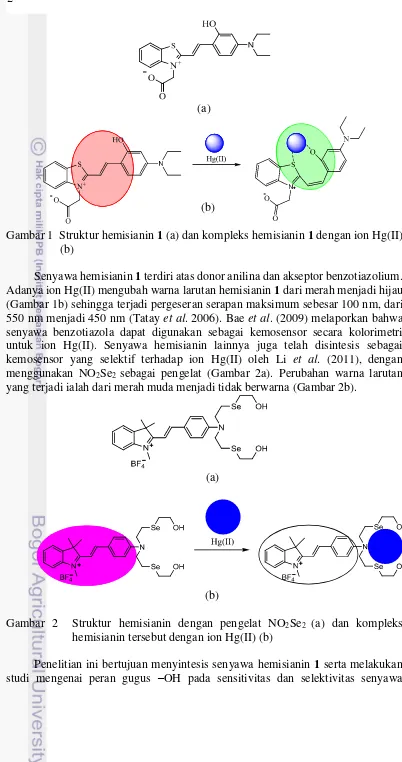
Gambar 1 Struktur hemisianin 1 (a) dan kompleks hemisianin 1 dengan ion Hg(II) (b)
Senyawa hemisianin 1 terdiri atas donor anilina dan akseptor benzotiazolium. Adanya ion Hg(II) mengubah warna larutan hemisianin 1 dari merah menjadi hijau (Gambar 1b) sehingga terjadi pergeseran serapan maksimum sebesar 100 nm, dari 550 nm menjadi 450 nm (Tatay et al. 2006). Bae et al. (2009) melaporkan bahwa senyawa benzotiazola dapat digunakan sebagai kemosensor secara kolorimetri untuk ion Hg(II). Senyawa hemisianin lainnya juga telah disintesis sebagai kemosensor yang selektif terhadap ion Hg(II) oleh Li et al. (2011), dengan menggunakan NO2Se2 sebagai pengelat (Gambar 2a). Perubahan warna larutan
yang terjadi ialah dari merah muda menjadi tidak berwarna (Gambar 2b).
(a)
(b)
Gambar 2 Struktur hemisianin dengan pengelat NO2Se2 (a) dan kompleks
hemisianin tersebut dengan ion Hg(II) (b)
Penelitian ini bertujuan menyintesis senyawa hemisianin 1 serta melakukan studi mengenai peran gugus –OH pada sensitivitas dan selektivitas senyawa
3 hemisianin terhadap ion Hg(II) dengan menggunakan prinsip kolorimetri. Hal tersebut dilakukan dengan cara menyintesis senyawa hemisianin lainnya yang tidak memiliki gugus –OH (hemisianin 2) (Gambar 3). Penelitian ini merupakan bagian dari penelitian besar untuk mendesain molekul kemosensor yang dapat mendeteksi logam berat dengan sensitif dan selektif secara kolorimetri.
Gambar 3 Struktur hemisianin 2
BAHAN DAN METODE
Penelitian dilaksanakan pada bulan April sampai September 2014 di Laboratorium Kimia Organik, Departemen Kimia, IPB. Spektrum ultraviolet- tampak (UV-Vis) dan spektrum inframerah transformasi Fourier (FTIR) yang dianalisis dengan metode pelet KBr diukur di Laboratorium Terpadu, Departemen Kimia, IPB. Spektrum resonans magnet inti (NMR) dianalisis di Pusat Penelitian Kimia LIPI, Puspiptek, Serpong.
Alat dan Bahan
Alat yang digunakan adalah labu bulat leher dua, radas refluks, penguap putar, spektrofotometer UV-Vis (Shimadzu UV Pharmaspec 1700), FTIR (IR Prestige), dan 1H NMR (JEOL ECA 500).
Bahan yang digunakan antara lain 2-metilbenzotiazola berasal dari Sigma Aldrich®, 4-dietilamino-2-hidroksibenzaldehida, dan asam bromoasetat berasal dari TCI. Piridina, toluena, molecular sieve, HgCl2, Pb(NO3)2, MnSO4, MgCl2,
(NH4)2Fe(SO4)2, NaHPO4∙H2O, Na2HPO4∙2H2O, dan etanol absolut berasal dari
Merck®. Selain itu, digunakan etanol teknis.
Langkah Percobaan
4
secara kolorimetri menggunakan ion Hg(II), Mn(II), Mg(II), Pb(II), dan Fe(II). Setelah itu, arutan hemisianin 1 dan 2 dengan ion-ion tersebut dianalisis menggunakan spektrofotometer UV-Vis.
Sintesis Piperidina (Marvel dan Lazier 1941)
Sebanyak 20 mmol piridina kering dilarutkan dalam 37 mL etanol absolut, lalu direfluks selama 40−50 menit. Setelah itu, 5.5 g logam natrium dan 19 mL etanol ditambahkan di dalam campuran tersebut, dan campuran direfluks kembali selama 3 jam. Hasil refluks didistilasi dengan menambahkan 22 mL air dan logam Zn sebanyak 1 butir. Proses ini dihentikan jika tidak ada lagi etanol yang tertampung. Piperidina yang terbentuk berada dalam distilat dan langsung digunakan tanpa pemurnian. Reaksi yang terjadi ditunjukkan pada Gambar 4.
Gambar 4 Reaksi sintesis piperidina
Sintesis 3-(Karboksimetil)-2-metilbenzotiazolium bromida (Garamkmb) (Tatay et al. 2006)
Sebanyak 10 mmol 2-metilbenzotiazola dan 15 mmol asam bromoasetat direfluks dengan 50 mL toluena selama 16 jam dan hasil reaksi didinginkan pada suhu ruang. Endapan yang diperoleh berwarna cokelat, lalu dicuci menggunakan tetrahidrofuran (THF) sampai warna cokelatnya hilang dan dikeringkan dengan vakum. Reaksi yang terjadi diberikan pada Gambar 5.
Gambar 5 Reaksi sintesis garam kmb
1H NMR (DMSO-d
6, 500 MHz) (ppm): δ 8.51(dd, 8.4, 1.3 1H), 8.29 (d, 8.45, 1H),
5 Sintesis (E)-2-(2-(4-(Dietilamino)-2-hidroksistiril)benzo[d
]tiazol-3-ium-3-il)asetat atau Hemisianin 1 (Tatay et al. 2006)
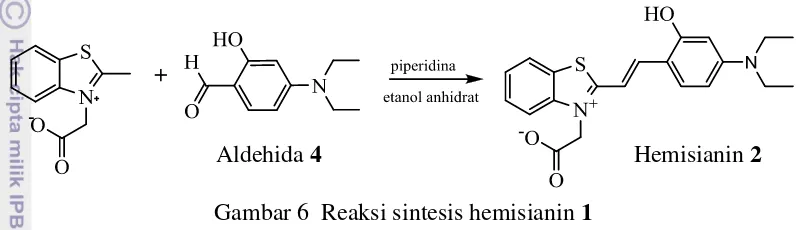
Sebanyak 3 mmol garam kmb dan 3 mmol 4-dietilamino-2-hidroksibenzaldehida (aldehida 3) dilarutkan dalam 75 mL etanol anhidrat dan ditambahkan 0.15 mmol piperidina, lalu direfluks selama 24 jam. Hasil sintesis didinginkan pada suhu ruang. Endapan yang dihasilkan dicuci dengan dietil eter dan dikeringkan dalam vakum. Reaksi yang terjadi tersaji pada Gambar 6.
Gambar 6 Reaksi sintesis hemisianin 1
1H NMR (CD
Sintesis (E)-2-(2-(4-(Dimetilamino)stiril)benzo[d]tiazol-3-ium-3-il)asetat atau
Hemisianin 2 (Modifikasi Tatay et al. 2006)
Sebanyak 3 mmol garam kmb dan 3 mmol 4-dimetilaminobenzaldehida (aldehida 4) dilarutkan dalam 75 mL etanol anhidrat dan ditambahkan 0.15 mmol piperidina, lalu direfluks selama 24 jam. Hasil sintesis didinginkan pada suhu ruang. Endapan yang dihasilkan dicuci dengan dietil eter dan dikeringkan dalam vakum. Reaksi yang terjadi dapat dilihat pada Gambar 7.
Gambar 7 Reaksi sintesis hemisianin 2
1H NMR (CD
(272; 0.033), (282.5; 0.033), (306.5; 0.024), (312.5; 0.022), (314; 0.022), (340,5; 0.011), (342; 0.012), (524.5; 0.101), dan (616; 0.003).
Aldehida 3 Aldehida 4
6
HASIL DAN PEMBAHASAN
Hemisianin 1
Dari reaksi umum pembentukan hemisianin 1 (Gambar 6), senyawa tersebut dapat disintesis dari suatu garam benzotiazolium (garam kmb) dengan 4-dietilamino-2-hidroksibenzaldehida (aldehida 3). Garam kmb tidak tersedia secara komersial, sehingga perlu disintesis berdasarkan reaksi pada Gambar 5. Asam bromoasetat akan berikatan dengan atom nitrogen pada 2-metilbenzotiazola karena sifatnya yang kurang elektronegatif dibandingkan dengan atom sulfur sehingga memiliki nukleofilisitas yang tinggi. Rendemen garam kmb yang diperoleh sebesar 69%, lalu dicirikan menggunakan 1H NMR dan FTIR. Setelah garam kmb didapatkan, garam tersebut digunakan untuk menyintesis hemisianin 1 melalui reaksi kondensasi. Basa piperidina digunakan sebagai katalis untuk mengambil proton dari gugus metil garam kmb sehingga gugus tersebut menjadi bersifat nukleofili kuat dan mampu menyerang gugus karbonil pada aldehida 3. Saat garam kmb dan aldehida 3 ditambahkan etanol anhidrat, warna larutan berubah menjadi ungu yang konstan selama 24 jam. Setelah hasil sintesis didinginkan, terbentuk endapan berwana ungu yang ketika dikeringkan akan berwarna cokelat dengan rendemen sebesar 77% (Gambar 8).
Gambar 8 Hemisianin 1 hasil sintesis
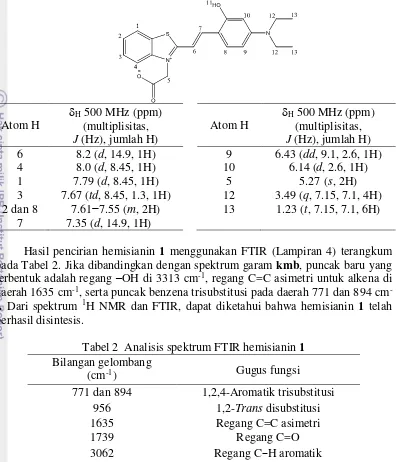
7 Tabel 1 Analisis spektrum 1H NMR hemisianin 1
Atom H pada Tabel 2. Jika dibandingkan dengan spektrum garam kmb, puncak baru yang terbentuk adalah regang –OH di 3313 cm-1, regang C=C asimetri untuk alkena di
daerah 1635 cm-1, serta puncak benzena trisubstitusi pada daerah 771 dan 894 cm
-1. Dari spektrum 1H NMR dan FTIR, dapat diketahui bahwa hemisianin 1 telah
berhasil disintesis.
Tabel 2 Analisis spektrum FTIR hemisianin 1 Bilangan gelombang
(cm-1) Gugus fungsi
771 dan 894 1,2,4-Aromatik trisubstitusi 956 1,2-Trans disubstitusi
1635 Regang C=C asimetri
1739 Regang C=O
3062 Regang C−H aromatik
3313 Regang OH
Larutan hemisianin 1 memiliki puncak serapan pada 263, 271.5, 397, dan 541 nm (Gambar 9), sedangkan garam kmb tidak memiliki puncak serapan (Lampiran 3b). Puncak serapan pada daerah ultraviolet kuarsa (200−400 nm) disebabkan oleh adanya transisi n → π* (Creswell et al. 2005). Transisi tersebut dihasilkan oleh gugus yang memiliki pasangan elektron bebas, yaitu sulfur, oksigen, dan nitrogen. Sementara pada daerah 541 nm (daerah sinar tampak) terjadi transisi π→π* yang dihasilkan oleh ikatan rangkap 2 pada senyawa hemisianin 1. Nilai keterserapan molar (ɛ) pada panjang gelombang 263, 271.5, 397, dan 541 nm berturut-turut adalah 17900, 18100, 6400, dan 52500 M-1 cm-1. Pada 397 nm terjadi transisi
8
Gambar 9 Spektrum UV-Vis hemisianin 1 10 µM Selektivitas Hemisianin 1 sebagai Kemosensor Hg(II)
Hemisianin 1 dilarutkan dalam larutan bufer fosfat pH 7:etanol (10:1) (v/v). Larutan tersebut dibuat dengan konsentrasi 10 µM, kemudian ditambahkan ion Mg(II), Hg(II), Mn(II), Pb(II), dan Fe(II)masing-masingsebanyak 0.1 mM. Hal yang sama juga dilakukan pada garam kmb. Penambahan ion tidak mengubah warna larutan garam kmb karena pada strukturnya belum terdapat gugus yang mampu mengikat ion Hg(II) secara selektif (Lampiran 3a). Berdasarkan hasil yang dilaporkan Tatay et al. (2006), adanya ion Hg(II) akan mengubah warna larutan hemisianin 1 dari merah menjadi hijau kekuningan. Hasil yang diperoleh sedikit berbeda, yaitu warna larutan setelah penambahan ion Hg(II) agak kuning (Gambar 10). Adanya perubahan warna tersebut menunjukkan bahwa hemisianin 1 hasil sintesis dapat mengenali dengan selektif dan sensitif adanya ion Hg(II).Bahkan tidak terjadi gangguan saat ion-ion lain seperti Mg(II), Mn(II), Pb(II), dan Fe(II) berada dalam satu larutan dengan Hg(II)(Gambar 10g).
Gambar 10 Larutan hemisianin 1 10 µM (a) dan larutan hemisianin 1 dengan ion Hg(II)(b), Mn(II) (c), Fe(II) (d), Pb(II) (e), Mg(II) (f), dan campuran kelima ion 0.1 mM (g)
Ikatan yang terbentuk antara senyawa hemisianin 1 dan ion Hg(II) terjadi pada atom sulfur dan gugus –OH. Berdasarkan teori asam basa keras dan lunak, Hg(II) yang bersifat asam lunak akan menyukai berikatan dengan basa lunak, yaitu gugus sulfur. Adanya ikatan tersebut akan mengurangi konjugasi pada senyawa
9 hemisianin 1 karena elektron bebas yang dimiliki oleh atom sulfur dan gugus –OH digunakan untuk berikatan koordinasi dengan ion Hg(II). Selain itu, hemisianin 1 mengalami isomerisasi dari trans menjadi cis (Tatay et al. 2006). Hal tersebut menyebabkan deplanarisasi sehingga kompleks hemisianin 1 dengan ion Hg(II) memiliki energi yang tinggi. Pembentukan kompleks tersebut menggeser panjang gelombang maksimum pada spektrum UV-Vis dari 541 ke 462.5 nm (Gambar 11). Penambahan ion Mn(II), Fe(II), Pb(II), dan Mg(II) tidak mengubah panjang gelombang maksimum dari larutan hemisianin 1, tetapi menurunkan intensitas serapan pada 541 nm(Gambar 11). Untuk mengkaji lebih lanjut peran gugus –OH pada pembentukan ikatan hemisianin 1 dengan ion Hg(II), senyawa yang strukturnya mirip dengan hemisianin 1 (Gambar 3), tetapi tanpa gugus –OH pada bagian aldehida disintesis dari garam kmb dan aldehida lainnya (4-dengan cara mengganti aldehida 3 dengan 4-dimetilaminobenzaldehida (aldehida 4). Hasil sintesis berupa padatan berwarna ungu kebiruan (Gambar 12) dengan rendemen sebesar 99%. Rendemen tersebut lebih besar daripada rendemen hemisianin 1. Hal ini diduga karena piperidina yang digunakan dapat bereaksi dengan gugus –OH pada hemisianin 1 sehingga konsentrasi piperidina untuk mengambil proton dari gugus metil pada garam kmb berkurang. Hemisianin 2 hasil sintesis dicirikan dengan 1H NMR dan FTIR. Spektrum 1H NMR (Lampiran 6) dirangkum hasil analisisnya pada Tabel 3.
10
Gambar 12 Hemisianin 2 hasil sintesis
Spektrum 1H NMR menunjukkan adanya 18 proton. Hasil tersebut sesuai dengan jumlah proton yang terdapat pada senyawa hemisianin 2. Sinyal multiplet pada 8.0−8.1 ppm diduga dari proton alkena pada C-6 dan C-4. Pada daerah medan bawah, yaitu 8, 7.89, 7.6, dan 7.7 ppm merupakan sinyal dari proton aromatik cincin benzotiazolium karena memiliki nilai J yang tidak jauh berbeda. Sedangkan sinyal pada 7.4 ppm diduga merupakan proton dari C-7 karena memiliki nilai J yang besar (14.9 Hz), diduga untuk konformasi trans. Proton pada C-5 terdeteksi pada 5.6 ppm dengan pembelahan singlet karena tidak memiliki proton tetangga. Sinyal metil yang terikat pada N tersier terdeteksi pada 3.1 ppm dengan pembelahan singlet.
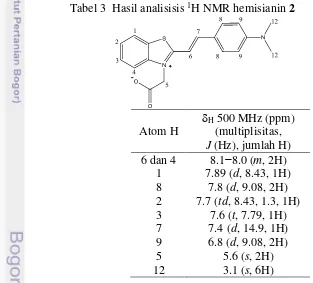
Tabel 3 Hasil analisisis 1H NMR hemisianin 2
Atom H
Hasil analisis menggunakan FTIR terangkum pada Tabel 4 berdasarkan spektrum terdapat yang pada Lampiran 4. Spektrum FTIR yang dihasilkan mirip dengan spektrum FTIR hemisianin 1, hanya saja tidak terdapat puncak regang –OH pada daerah 3300 cm–1 dan benzena trisubstitusi pada daerah 771 dan 894 cm–1. Dari hasil analisis spektrum 1H NMR dan FTIR dapat disimpulkan bahwa
11 Tabel 4 Analisis FTIR struktur hemisianin 2
Bilangan gelombang
(cm-1) Gugus fungsi
812 Aromatik disubstitusi para
1452-1573 C=C aromatik
1730 Regang C=O
3062 Regang C−H aromatik
Hemisianin 2 memiliki puncak serapan pada 257.5, 272, 282.5, 306.5, 312.5, 314, 340, 342, 524.5, dan 616 nm (Gambar 13). Nilai ɛ pada 524.5 nm ialah 10100 M-1 cm-1 (ɛ >10000 M-1 cm-1), sedangkan pada puncak serapan lainnya nilai ɛ <10000 M-1 cm-1. Hal tersebut menunjukkan serapan yang tinggi dan transisi yang
terjadi pada 524.5 nm merupakan transisi yang diizinkan. Transisi tersebut merupakan transisi π→π* yang dihasilkan dari adanya ikatan rangkap terkonjugasi.
Gambar 13 Spektrum UV-Vis hemisianin 2 10 µM
Selektivitas Hemisianin 2 sebagai Kemosensor Hg(II)
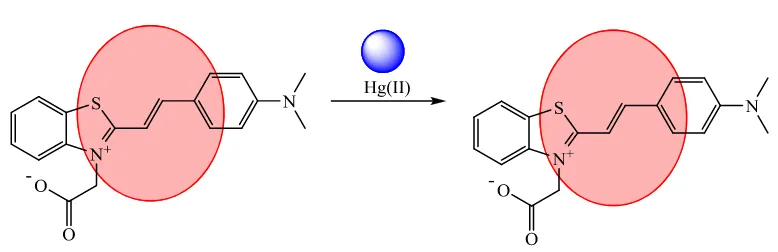
Hemisianin 2 dilarutkan dalam larutan bufer fosfat pH 7:etanol (10:1) (Gambar 14b). Larutan tersebut berwarna merah lebih terang jika dibandingkan dengan larutan hemisianin 1 (Gambar 14a). Saat larutan hemisianin 2 dengan konsentrasi 0.1 µM ditambahkan ion Hg(II), Pb(II), Fe(II), Mn(II), dan Mg(II), warna larutan tidak berubah (Gambar 15). Hal tersebut menandakan bahwa hemisianin 2 hasil sintesis tidak dapat mengenali dengan selektif adanya ion Hg(II). Ketidakselektifan tersebut disebabkan oleh tidak adanya gugus yang dapat mengikat atau berfungsi sebagai pengelat ion (selain atom sulfur) seperti gugus – OH yang terdapat pada hemisianin 1. Dari hasil tersebut, dapat disimpulkan bahwa hemisianin 2 tidak dapat digolongkan sebagai kemosensor secara kolorimetri.
12
Gambar 14 Larutan hemisianin 1 (a) dan hemisianin 2 (b) dengan konsentrasi 0.1 mM
Gambar 15 Larutan hemisianin 2 10 µM (a), dan larutan hemisianin 2 dengan ion Hg(II)(b), Pb(II) (c), Fe(II) (d), Mn(II) (e), Mg(II) (f), dan campuran kelima ion 0.1 mM (g)
13
Gambar 17 Reaksi antara hemisianin 2 dengan ion Hg(II)
SIMPULAN DAN SARAN
Simpulan
Hemisianin 1 berhasil disintesis dari garam kmb dan aldehida 3. Senyawa ini dapat mendeteksi ion Hg(II) yang ditandai dengan perubahan warna larutan dari merah menjadi hijau kekuningan dan perubahan panjang gelombang maksimum. Namun, adanya ion Hg(II) pada larutan hemisianin 2 tidak mengubah warna larutan maupun panjang gelombang maksimum pada spektrum cahaya tampak. Hal tersebut menunjukkan bahwa gugus –OH berperan penting pada selektivitas dan sensitivitas hemisianin dalam mengelat ion Hg(II).
Saran
Perlu dilakukan penentuan konsentrasi optimum hemisianin 1, studi lebih lanjut menggunakan substituen selain –OH yang terikat pada gugus aromatik di aldehida 3 agar dapat diketahui selektivitasnya dalam mengelat ion Hg(II), dan pencirian secara kuantitatif agar dapat menentukan limit deteksi hemisianin 1.
DAFTAR PUSTAKA
Bae JS, Son YA, Kim SH. 2009. Benzothiazole-based semisquaraine as colorimetric chemosensor for Hg2+. Fibers and Polymers. 10(3):403-405.doi:10.1007/s12221-009-0403-3.
Creswell CJ, Olaf AR, Malcolm MC. 2005. Analisis Spektrum Senyawa Organik. Padmawinata K, Soediro I, penerjemah. Bandung (ID): Penerbit ITB.
14
Li Y, He S, Zeng X. 2011. Novel hemicyanine dye as colorimetric and fluorometric dual-modal chemosensor for mercury in water. Org Biomol Chem. 9(8):2606-2609.doi: 10.1039/c0ob01060j.
Liu Y, Jaiswal A, Poggi MA, Wilson WD. 2011. Surface plasmon resonance and quartz crystal microbalance methods for detection of molecular interactions. Di dalam: Chemosensors: Principles, Strategies, and Applications. Wang B, Anslyn EV, editor. Hoboken (NJ): J Wiley.
Loew LM. 2011. Design and use of organic voltage sensitive dyes. Di dalam: Membrane Potential Imaging in the Nervous System: Methods and Applications. Canepari M, Zecevic D, editor. Grenoble (FR): Springer.
Marvel CS, Lazier WA. 1941. Benzoyl piperidine. Org Synth. 1:99.
Nolan ME, Lippard SJ. 2008. Tools and tactics for the optical detection of mercuric ion. Chem Rev. 108(9):3443–3480.doi:10.1021/cr068000q.
Patrick L. 2002. Mercury toxicity and antioxidants: part I: role of glutathione and alpha-lipoic acid in the treatment of mercury toxicity. Alt Med Rev. 7(6):456-471.
Selin NE. 2009. Global biogeochemical cycling of mercury: A review. Annu Rev Environ Resour. 34:43-63.
Shunmugam R, Gabriel GJ, Smith CE, Aamer KA, Tew GN. 2008. A highly selective colorimetric aqueous sensor for mercury. Chem Eur J. 14:3904-3907.doi: 10.1002/chem.200701895.
Tatay S, Gavina P, Coronado E, Palomares E. 2006. Optical mercury sensing using a benzothiazolium hemicyanine dye. Org Lett. 8(17):3857-3860.
15 Lampiran 1 Bagan alir penelitian
Sintesis prekursor hemisianin (garam kmb)
Garam kmb Analisis 1H NMR
dan FTIR
Sintesis hemisianin 2 Sintesis hemisianin 1
Analisis 1H
NMR dan FTIR Hemisianin 1 Hemisianin 2
Analisis 1H NMR dan FTIR
16
Lampiran 2 Perhitungan rendemen
Contoh perhitungan rendemen garam kmb
2-metilbenzotiazola = 1.28 mL (10.06 mmol) pereaksi pembatas As. Bromoasetat = 2.1062 g (15.15 mmol)
Massa vial kosong = 17.5092 g Massa vial + hasil sintesis = 19.5127 g
Massa hasil sintesis = 2.0035 g (6.9757 mmol) Mol hasil sintesis = (2.0035 g) ÷ (287.21 g/mol)
= 6.9757 mmol
Rendemen = (mmol hasil sintesis ÷ mmol teoretis) × 100% = (6.9757 mmol ÷ 10.06 mmol) × 100%
17 Lampiran 3 Elusidasi garam kmb
a) Larutan garam kmb 0.1 µM (1), larutan garam kmb dengan ion Hg(II) (2), Mg(II) (3), Pb(II) (4), Mn(II) (5), Fe(II) (6), dan campuran kelima ion 0.1 mM (7)
b) Spektrum UV-Vis garam kmb 0.1 mM 0
0,2 0,4 0,6 0,8 1
200 300 400 500 600
Ke
li
mpaha
n
Geseran kimia (ppm)
Panjang gelombang (nm)
Absor
ba
ns
1 2 3 4
1
5 6
18
Lampiran 4 Spektrum tumpuk FTIR garam kmb, hemisianin 1, dan hemisianin 2
Lampiran 5 Elusidasi hemisianin 1
19
Lampiran 6 Elusidasi hemisianin 2
Geseran kimia (ppm)
Ke
li
mpaha
20
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 23 Mei 1992, merupakan putri pertama dari 3 bersaudara dari pasangan Wasino dan Indriyati. Penulis menyelesaikan pendidikan di Sekolah Menengah Atas Negeri 47, Jakarta pada tahun 2010 dan pada tahun yang sama lulus seleksi masuk Institut Pertanian Bogor melalui jalur Undangan Seleksi Mahasiswa IPB (USMI).