VIABILITAS PARASIT Ichtyophthirius multifiliis
YANG DIPELIHARA PADA SUHU RENDAH
RAHMAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Viabilitas Parasit Ichtyophthirius multifiliis yang Dipelihara pada Suhu Rendah adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2012
Rahman
ABSTRACT
RAHMAN. The Viability of Ichthyophthirius multifiliis Maintained at Low Temperature. Under direction of SUKENDA and SRI NURYATI
The ciliate Ichthyophthirius multifiliis, an obligat fish parasite, was maintained at low temperature as attempt to prolong its life span and reduce the number of fish hosts required in its laboratory propagation. The experiments were conducted using trophont stage of parasite which originally isolated from any outbreaks of white spot disease. Briefly, parasites were subjected at optimal temperature 25-28°C (control) and at low temperature 9°C for 14 consecutive days of observation. The survival rate, encystation rate, excystation rate, and the abnormality of descendants which produced by maintained parasites were examined at the last day of observation. Here the infectivity of parasites then performed by means of infecting the animal model either black moly Poecilia sphenops or red belly pacu
Colossoma macropomum with escaping theronts which collected during excystation. The results revealed that the survival rate and the excystation rate of parasites were decreased, while the encystation rate and the abnormality increased as maintaining period increased. Spesifically, the final rate of survival, encystation, and excystation of parasites were 35%, 100%, and 33,33% respectively. Additionally, the descendants came out with highly abnormality recognized by their weak mobility and their lower infectivity (40-50%) compared to the control (80-100%). Overall, from the study concluded that, it is possible to maintain I. multifiliis at low temperature without its host for 14 days, where it still gain its infectivity, eventhough being decreased.
.
RINGKASAN
RAHMAN. Viabilitas Parasit Ichtyophthirius multifiliis yang Dipelihara pada Suhu Rendah. Dibimbing oleh SUKENDA dan SRI NURYATI.
Parasit Ichtyophthirius multifiliis adalah protozoa yang mengakibatkan gejala bintik putih pada hampir semua jenis ikan air tawar. Penyakit yang
diakibatkannya dikenal dengan istilah ‘ich’ atau white spot. Wabah parasit ini terjadi ketika adanya inang yang mengalami kerentanan, dan kondisi lingkungan yang mendukung pertumbuhan parasit terutama dari faktor suhu. Secara umum dengan meningkatnya suhu perairan (25-28°C) akan meningkatkan aktivitas parasit, dan siklus hidupnya akan selesai dalam waktu yang lebih cepat.
Usaha penanggulangan dengan kemoterapi tidak memberikan hasil yang maksimal karena tidak membunuh parasit pada stadia trophont dan kista. Akan tetapi terdapat fenomena ikan yang bertahan hidup dari infeksi parasit ini akan menjadi lebih resisten pada infeksi selanjutnya, sehingga membuka peluang untuk mengembangkan tindak imunoprofilaksis.
Langkah awal dalam mengembangkan tindak imunoprofilaksis adalah mendapatkan antigen yang mencukupi secara kontinyu. Namun, karena tidak ada kepastian wabah penyakit dan hambatan musim, maka langkah tersebut harus ditempuh melalui propagasi parasit di laboratorium baik secara in vivo maupun in vitro. Propagasi I. multifiliis di laboratorium dicirikan dengan laju peralihan stadia yang tinggi serta adanya kebutuhan inang sehingga meningkatkan biaya dan tenaga dalam proses propagasinya.
Tujuan penelitian ini adalah untuk mengevaluasi efektivitas suhu rendah dalam memperpanjang viabilitas parasit I. multifiliis yang dipelihara terpisah dari inangnya. Hasil penelitian ini diharapkan dapat menambah pengetahuan dalam teknik propagasi I. multifiliis, mengurangi jumlah inang yang dibutuhkan, dan membuka peluang untuk menghasilkan antigen parasit I. multifiliis.
Parasit dipelihara pada suhu 9°C selama 14 hari dan diamati viabilitasnya melalui nilai kelangsungan hidup parasit, persentase encystment, persentase
excystment, abnormalitas parasit, dan infektifitas pada ikan uji. Analisa data dilakukan secara deskriptif. Sebagai kontrol digunakan parasit sama yang dipelihara pada suhu normal 27°C.
Berdasarkan hasil pengamatan yang dilakukan, terlihat bahwa persentase
encystment dan abnormalitas parasit semakin meningkat dengan bertambahnya waktu pengamatan, sedangkan persentase excystment dan kelangsungan hidup parasit semakin menurun. Pada akhir pengamatan, nilai parameter persentase
encystment, persentase excystment, dan kelangsungan hidup parasit berturut-turut adalah 100%, 33,33%, dan 35%. Terjadi penurunan infektifitas parasit pada perlakuan suhu rendah yang hanya berkisar antara 30 hingga 40% jika dibandingkan pada perlakuan kontrol yang mencapai 80 hingga 100%. Berdasarkan penelitian ini, dapat disimpulkan bahwa terdapat peluang untuk memperpanjang masa simpan parasit I. multifiliis pada suhu 9°C, meskipun viabilitas dan infektifitas parasit mengalami penurunan.
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
VIABILITAS PARASIT Ichtyophthirius multifiliis YANG
DIPELIHARA PADA SUHU RENDAH
RAHMAN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Viabilitas Parasit Ichtyophthirius multifiliis yang Dipelihara pada Suhu Rendah
Nama : Rahman
NIM : C151090281
Disetujui
Komisi Pembimbing
Dr. Ir. Sukenda, M.Sc Ketua
Dr. Sri Nuryati, M.Si Anggota
Diketahui
Ketua Program studi Dekan Sekolah Pascasarjana
Ilmu Akuakultur
Prof. Dr. Enang Harris, MS Dr. Ir. Dahrul Syah, M.Sc. Agr
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan tesis dengan judul Viabilitas Parasit Ichtyophthirius multifiliis yang Dipelihara pada Suhu Rendah. Penelitian ini dilaksanakan pada bulan Maret sampai September 2011 bertempat di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Tesis ini disusun sebagai salah satu syarat untuk menyelesaikan studi pada program Magister Sains di Program Studi Ilmu Akuakultur Sekolah Pascasarjana, Institut Pertanian Bogor.
Ucapan terima kasih yang sebesar-besarnya penulis sampaikan kepada Dr. Ir. Sukenda, M.Sc dan Dr. Ir. Sri Nuryati, M.Si selaku komisi pembimbing yang telah memberikan arahan dan saran-sarannya dalam penulisan tesis ini, serta kepada Dr. Ir. Widanarni, M.Si sebagai penguji luar komisi yang banyak memberikan koreksi dan masukan dalam tulisan ini.
Ucapan terima kasih penulis sampaikan pula kepada kedua orang tua serta kelima saudara penulis atas segala doa dan dukungannya selama ini. Penulis juga menyampaikan terima kasih kepada Pak Ranta, dan kepada adik saya Ghita Ryan Septiani, Damayanti, Dwi, serta rekan-rekan laboratorium kesehatan ikan lainnya yang telah membantu selama penelitian.
Semoga tulisan ilmiah ini bermanfaat.
Bogor, Januari 2012
RIWAYAT HIDUP
Penulis dilahirkan di Rengat pada tanggal 18 Juli 1980 dari pasangan Kateman dan Suparmi. Penulis merupakan putra kelima dari enam bersaudara.
DAFTAR ISI
2.1Protozoa Bersilia, Ichtyophthirius multifiliis Forquet ... 5
2.1.1 Epidemiologi Ichtyophthirius multifiliis Forquet ... 5
2.1.2 Siklus Hidup Parasit ... 5
2.1.3 Mekanisme Sakit ... 9
2.2 Propagasi Parasit ... 11
III. METODE PENELITIAN ... 13
3.1Waktu dan Tempat Penelitian ... 13
3.2Isolasi Parasit I. multifiliis ... 13
3.3Pemeliharaan pada Suhu Rendah ... 13
3.4Parameter Pengamatan ... 13
3.4.1Persentase Survival Rate ... 14
3.4.2Persentase Encystment ... 14
3.4.3Persentase Excystment ... 14
3.4.4 Abnormalitas Sel Theront ... 15
3.6Uji Infektifitas Parasit ... 15
3.7 Analisis Data ... 15
IV. HASIL DAN PEMBAHASAN ... 16
4.1Kelangsungan Hidup Parasit ... 16
4.2Persentase Encystment ... 18
4.3Persentase Excystment ... 19
4.4 Abnormalitas Parasit ... 20
4.5Uji Infektifitas Sel Theront ... 21
V. KESIMPULAN DAN SARAN ... 25
5.1 Kesimpulan ... 25
5.2 Saran ... 25
DAFTAR PUSTAKA ... 26
DAFTAR GAMBAR
Halaman
1. Morfologi beberapa stadia parasit I. multifiliis a) sel trophont dengan makronukleus (tanda panah). b) sel tomont yang sedang melakukan
pembelahan sel. c) sel theront yang berenang bebas ... 6 2. Siklus hidup parasit I. multifiliis ... 6 3. Perubahan bentuk sel theront sebelum dan sesudah kontak dengan plasma
ikan. a) Sel theront sebelum kontak dengan bentuk lancip, dan b) sel
theront setelah kontak dengan bentuk yang relatif bulat ... 7 4. Produksi mukus yang berlebihan pada ikan yang terinfeksi I. multifiliis .. 10 5. (a). Parasit pada stadia thropont pada perlakuan suhu rendah pada hari
pertama. (b). Pada hari kedua sel parasit sudah memulai membentuk kista (panah hitam) dan melakukan inisiasi pembelahan
sel (panah putih) ... 18 6. (a) Proses lepasnya sel theront dari kista (excystment) setelah 24 jam
inkubasi pada sel parasit hari pertama, dan (b) proses excystment dari
parasit pada perlakuan suhu rendah hari ke-14. ... 19 7. (a). Sel theront normal berenang meninggalkan kista yang sudah kosong.
(b) Sel tomite abnormal yang gagal menembus kista dari parasit yang dipelihara pada suhu rendah selama 8 hari. (c) Beberapa sel tomite
abnormal pada perlakuan suhu rendah pada hari ke-14 ... 20 8. Ikan black molly Poecilia sphenops setelah diinfeksi dengan sel theront
yang berasal dari parasit yang telah dipelihara selama 14 hari pada
suhu rendah ... 23 9. Infestasi sel trophont pada ikan bawal yang terinfeksi ringan oleh parasit
I. multifiliis pada a) sirip dada, b) sirip ekor, dan c) insang. Titik
DAFTAR TABEL
Halaman
1. Nilai survival rate parasit, persentase encystment, persentase excystment, dan abnormalitas sel theront yang dihasilkan setelah inkubasi pada
suhu 27±1°C ... 16 2. Nilai prevalensi parasit I. multifiliis pada ikan uji bawal air tawar dan
DAFTAR LAMPIRAN
Halaman
1
I. PENDAHULUAN
1.1 Latar Belakang
Produksi akuakultur seringkali dipengaruhi oleh interaksi parasitik yang terjadi antara ikan budidaya dengan beberapa organisme akuatik lainnya. Interaksi parasit mencakup hubungan dengan golongan organisme uniseluler (bakteri dan protozoa) maupun dengan organisme multiseluler. Interaksi ini tidak jarang menghasilkan penyakit pada budidaya ikan. Salah satu serangan penyakit yang paling banyak menyerang ikan budidaya air tawar dan air laut adalah penyakit bintik putih. Pada ikan air tawar penyakit ini disebabkan oleh parasit
Ichtyophthirius multifiliis yang menyerang semua jenis ikan yang dibudidayakan di seluruh dunia (Xu et al. 2009), sedangkan pada ikan air laut disebabkan oleh parasit Cryptocaryon irritans (Dickerson 2006; Yambot and Song 2006).
Parasit I. multifiliis adalah organisme ciliata yang menyerang epidermis ikan dan menimbulkan bintik putih pada sekujur tubuh ikan. Parasit ini memiliki spesifisitas inang yang rendah dan infeksinya dapat menimbulkan tingkat kematian ikan yang tinggi (Buchmann et al. 2001; Wang et al. 2002). Wabah parasit ini terjadi ketika inang mengalami kerentanan, dan kondisi lingkungan yang mendukung untuk proliferasinya terutama dari faktor suhu. Secara umum, dengan meningkatnya suhu perairan (25-28°C) akan meningkatkan aktivitas parasit, dan siklus hidupnya akan selesai dalam waktu yang lebih cepat jika dibandingkan pada suhu yang lebih rendah (Dickerson 2006). Serangan I. multifiliis pada benih ikan lele dumbo (Clarias gariepinus) umur 14 hari dapat mengakibatkan peningkatan kematian benih hingga 100% dengan dosis lethal, sedangkan pada dosis sublethal akan menghasilkan penurunan bobot ikan hingga 14% (Barizi 1990).
2
untuk mengembangkan tindak imunoprofilaksis (Buchmann et al. 2001; Xu dan Klesius 2002).
Langkah awal dalam mengembangkan tindak imunoprofilaksis adalah mendapatkan antigen dalam jumlah yang mencukupi. Namun, karena tidak ada kepastian mengenai wabah penyakit dan hambatan musim, maka langkah tersebut harus ditempuh melalui propagasi parasit di laboratorium baik secara in vivo
maupun secara in vitro (Dan et al. 2009). Akan tetapi kemudian ditemukan banyak faktor yang menghambat tujuan tersebut. Propagasi parasit secara in vitro
di laboratorium terhambat dengan adanya sifat obligat inang dari I. multifiliis,
yang mengakibatkan propagasi parasit selama ini dilakukan hanya pada inang dengan menggunakan ikan hidup untuk multiplikasi dan koleksinya (Nielsen dan Buchmann 2000). Usaha beberapa peneliti untuk mencari komposisi media buatan yang tepat yang mendukung perbanyakan I. multifiliis secara in vitro masih belum mendapatkan hasil yang memuaskan (Dan et al. 2009).
Protozoa membutuhkan penanganan yang lebih rumit untuk ditumbuhkan dalam suatu media. Kontaminasi mikroorganisme lain dalam media kultur menjadi permasalahan yang sering ditemui. Hadirnya beberapa jenis protozoa lain dalam media kultur dapat menjadi kompetitor nutrisi atau predator (Lee dan Mora 2005). Kontaminasi fungi dan bakteri dapat merusak media kultur, sedangkan buangan metabolisme ke dalam media diduga memperburuk kualitas media dan menurunkan sintasan organisme uji (Lima 2006). Beberapa peneliti seperti Nielsen dan Buchmann (2000) menduga bahwa faktor-faktor inang mungkin dibutuhkan dalam mengkultur beberapa parasit ikan dalam media buatan. Penelitian mereka yang menggunakan serum dan mukus ikan walaupun tidak menghasilkan parasit dalam jumlah banyak dan kontinyu, namun membuktikan bahwa viabilitas parasit dalam media buatan bertahan jauh lebih lama dibandingkan dengan parasit yang dipelihara dalam media air.
3
siklus hidup parasit yang cepat dan laju peralihan stadia yang tinggi. Parasit yang dihasilkan dari sistem propagasi ini harus dimanfaatkan sesegera mungkin sebelum lepas atau beralih stadia, dan propagasi harus tetap diteruskan pada inang berikutnya. Hal ini jelas membutuhkan tenaga dan biaya yang tinggi sehingga memperlambat beberapa tujuan dan kepentingan eksperimen lainnya (Dan et al.
2009).
Usaha untuk mempertahankan viabilitas parasit pada stadia tertentu telah dilakukan oleh beberapa peneliti. Syawal (1995) mencoba untuk mempertahankan stadia infektif I. multifiliis pada 12 media buatan. Walaupun tidak semua parasit berhasil hidup, penelitian tersebut berhasil membuktikan bahwa media buatan dapat mempertahankan viabilitas parasit.
Pendekatan yang berbeda dilakukan oleh beberapa peneliti. Dan et al.
(2009) berusaha memisahkan parasit Cryptocaryon irritans dari inangnya dan menekan kecepatan laju siklus parasit pada suhu rendah (12°C) selama empat bulan. Mereka mendapatkan sintasan parasit yang tinggi hingga akhir perlakuan tanpa kehilangan infektifitasnya. Sementara itu Noe dan Dickerson (1995) tanpa memisahkan parasit I. multifiliis dari inangnya, berhasil memperlambat perkembangan parasit pada ikan channel catfish Ictalurus punctatus. Parasit tetap tinggal pada inangnya selama 20,4 hari pada suhu 9°C jauh lebih lama dibandingkan pada suhu 25°C yang hanya tinggal 5-6 hari saja pada inangya.
1.2 Rumusan Masalah
4
normal. Sementara itu penelitian yang mencoba mengkultur parasit I. multifiliis
dalam media buatan menemukan bahwa parasit I. multifiliis dapat dipelihara terpisah dari inangnya dalam masa tertentu. Oleh karena itu perlu dilakukan sebuah penelitian yang bertujuan untuk mengevaluasi viabilitas parasit I. multifiliis bila dipelihara terpisah dari inangnya pada suhu rendah (9±2°C) selama waktu yang singkat.
1.3 Tujuan dan Manfaat
Tujuan penelitian ini adalah untuk mengevaluasi efektivitas suhu rendah (9±2°C) dalam mempertahankan viabilitas parasit I. multifiliis yang dipelihara terpisah dari inangnya. Hasil penelitian ini diharapkan dapat menambah pengetahuan dalam pemeliharaan parasit I. multifiliis, mengurangi jumlah inang yang dibutuhkan dalam propagasi in vivo, membuka peluang untuk menghasilkan antigen parasit I. multifiliis dalam penelitian imunisasi ikan, serta dapat dipakai sebagai pendekatan untuk penelitian yang sama untuk jenis parasit protozoa lainnya.
1.4 Hipotesis Penelitian
Parasit I. multifiliis dapat dipelihara terpisah dari inangnya pada suhu rendah tanpa kehilanganan viabilitas dan infektifitasnya.
5
II. TINJAUAN PUSTAKA
2.1 Protozoa Bersilia, Ichtyophthirius multifiliis Forquet
Ichtyophthirius multifiliis adalah satu-satunya spesies parasit di dalam genusnya (Lee et al. 1985 dalam Dickerson 2006). Sistematika lengkapnya menurut Hoffman (1967) adalah filum Protozoa, Subfilum Ciliaphora, kelas Ciliata, Subkelas Holotrica, Famili Holophrydae, Genus Ichthyophthirius, dan Spesies Ichtyophthirius multifiliis. Protozoa ini mengakibatkan penyakit bintik putih pada semua jenis ikan air tawar yang dikenal sebagai penyakit 'ich' atau white spot (Dickerson 2006; Davis et al. 2002).
2.1.1 Epidemiologi I. multifiliis
Distribusi geografi parasit I. multifiliis menyebar dari daerah tropik hingga sub-Artik yaitu pada wilayah-wilayah dimana beberapa jenis ikan air tawar masih dibudidayakan. Diduga ada perbedaan subspesies antara I. multifiliis yang menyerang di daerah tropik dengan daerah sub-Artik. Ikan dengan kemampuan toleransi suhu yang luas seperti cyprinid dan catfish berpeluang lebih besar untuk terserang oleh dua subspesies parasit tersebut (Dickerson 2006).
Wabah I. multifiliis membutuhkan lingkungan yang tepat dan juga adanya populasi inang yang rentan. Suhu yang relatif hangat mempermudah multiplikasi jumlah parasit, sedangkan stress akibat padat tebar, penanganan ikan, rendahnya kadar oksigen terlarut, adanya polutan, dan aktivitas pemijahan dapat menurunkan kompetensi sistem imunitas ikan yang akhirnya akan memicu wabah parasit (Dickerson 2006). Dalam suatu populasi, ikan dengan usia yang lebih muda akan lebih rentan terserang parasit ini dibandingkan ikan dewasa yang pernah terserang parasit yang sama, akan tetapi jika populasi tersebut untuk pertama kalinya terserang, maka semua usia ikan akan rentan terhadap serangan I. multifiliis
(Dickerson 2006).
2.1.2 Siklus Hidup Parasit
Siklus hidup I. multifiliis terdiri dari dua tahap, yaitu tahap yang bersifat parasit pada epidermis ikan, dan tahap berenang bebas di lingkungan akuatik (Xu
6
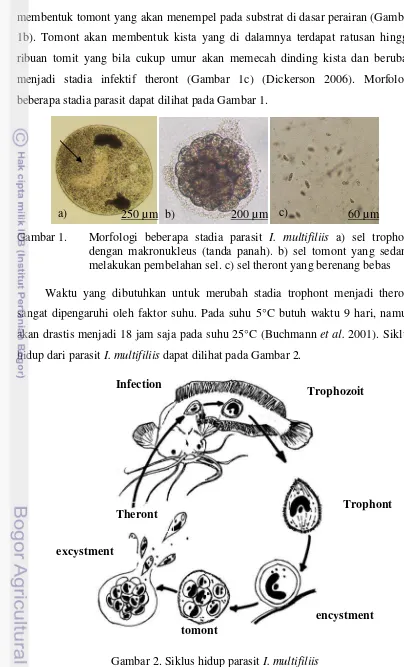
membentuk tomont yang akan menempel pada substrat di dasar perairan (Gambar 1b). Tomont akan membentuk kista yang di dalamnya terdapat ratusan hingga ribuan tomit yang bila cukup umur akan memecah dinding kista dan berubah menjadi stadia infektif theront (Gambar 1c) (Dickerson 2006). Morfologi beberapa stadia parasit dapat dilihat pada Gambar 1.
Gambar 1. Morfologi beberapa stadia parasit I. multifiliis a) sel trophont dengan makronukleus (tanda panah). b) sel tomont yang sedang melakukan pembelahan sel. c) sel theront yang berenang bebas
Waktu yang dibutuhkan untuk merubah stadia trophont menjadi theront sangat dipengaruhi oleh faktor suhu. Pada suhu 5°C butuh waktu 9 hari, namun akan drastis menjadi 18 jam saja pada suhu 25°C (Buchmann et al. 2001). Siklus hidup dari parasit I. multifiliis dapat dilihat pada Gambar 2.
Gambar 2. Siklus hidup parasit I. multifiliis
Trophont
encystment tomont
excystment
Theront
Trophozoit Infection
7
Stadia infektif dari parasit I. multifiliis berasal dari sel tomite yang berdiferensiasi di dalam kista sel tomont dan melepaskan diri pada proses
excystment dengan memecah kista. Proses diferensiasi mencakup perubahan bentuk sel menjadi lebih lancip (pyriform), dan pembentukan perforatorium yang sangat berperan dalam proses infeksi (Dickerson 2006).
Stadia infektif theront sangat tertarik dengan komponen serum di dalam mukus, terutama pada daerah kulit yang lebih banyak diseliputi oleh mukus (Buchmann et al. 2001). Mekanisme theront dalam menginfeksi telah dipahami dengan baik, dimana theront melakukan gerakan berputar untuk menembus mukus ikan (Buchmann et al. 2001). Theront dapat bertahan hidup dalam perairan normal selama lebih 48 jam dan akhirnya mati jika tidak mendapatkan inang yang sesuai (Nielsen dan Buchmann 2000).
Tidak terdapat bukti bahwa stadia tomont dan theront melakukan aktivitas makan selama di lingkungan perairan. Vakuola makanan hanya terbentuk sesaat setelah theront menembus mukus ikan, dan semakin sempurna pada stadia trophont (Dickerson 2006). Namun beberapa peneliti menduga bahwa pada beberapa taraf, sel theront mampu memanfaatkan nutrisi dari lingkungannya. Hal tersebut dibuktikan oleh kemampuan sel theront untuk bertahan lebih lama jika dipelihara dalam media bernutrisi (Ekless 1993).
Gambar 3. Perubahan bentuk sel theront sebelum dan sesudah kontak dengan plasma ikan. a) Sel theront sebelum kontak dengan bentuk lancip, dan b) sel theront setelah kontak dengan bentuk yang relatif bulat
Terdapat perbedaan morfologi sebelum dan sesaat setelah sel theront melakukan kontak dengan faktor dari inang seperti mukus dan serum (Nielsen dan Buchmann 2000). Perubahan tersebut adalah beralihnya bentuk lancip, pyriform,
8
menjadi lebih bulat, spherical. Contoh perubahan bentuk yang teramati setelah sel theront mengalami kontak dengan plasma ikan dapat dilihat pada Gambar 3.
I. multifiliis biasanya tidak tersebar merata pada permukaan tubuh ikan, kecuali pada serangan yang parah. Parasit ini hanya terdeteksi pada permukaan punggung, sirip, dan beberapa bagian di kepala ikan. Selain sirip dan kulit, insang adalah bagian yang penting dalam serangan parasit. Adanya pergantian volume air dan sedikitnya mukus yang melindunginya, menjadikan organ ini berpeluang besar untuk penempelan parasit pada stadia infektif (Dickerson 2006). Tingkat keberhasilan sel theront dalam menginfeksi insang hanya 50% dari total populasi sel theront (Ewing et al. 1986).
Sel theront memiliki setidaknya 6 pola yang berbeda dalam mencari dan menemukan inangnya, dimana 4 pola diantaranya sangat dipengaruhi oleh komponen yang ada pada kulit ikan. Pola-pola tersebut diantaranya “berhenti dan mencari lalu mengubah arah” ketika terstimulasi oleh asam amino kulit ikan. Ketika terstimulasi oleh makromolekul glikoprotein kulit pada ikan maka sel theront akan “berhenti dan mendekati”, namun ketika terstimulasi oleh makromolekul glikokonjugat sel theront akan “berhenti dan menjauh” dari komponen kulit ikan tersebut (Hass et al. 1993).
Sesaat setelah sel theront berhasil menembus lapisan basal epidermis ikan, sel theront akan berdiferensiasi menjadi sel trophont yang dilengkapi dengan vokuola makanan. Secara bertahap ukuran parasit akan menjadi lebih besar dimana kecepatan pertumbuhanya sangat dipengaruhi oleh suhu lingkungan (Ewing et al. 1986). Stadia trophont dapat mudah dikenali dengan adanya makronukleus yang berbentuk ladam kuda jika diamati dengan menggunakan mikroskop (Dickerson 2006).
Walaupun sel trophont terlihat pada hampir semua bagian insang pada awal infeksi, namun pada hari ke-3 sel trophont bermigrasi dan lebih banyak berada di sekitar pembuluh darah insang. Selanjutnya sel-sel tersebut bermigrasi pada bagian sel epithelial inang dan tumbuh dengan diameter yang dapat mencapai 248 µm dalam 5 hari (Ewing dan Kocan 1986).
9
jaringan kulit ikan. Ruang ini terkadang berisi lebih dari satu sel trophont yang mungkin dikarenakan oleh adanya aktivitas migrasi bersama atau dikarenakan sel theront menginfeksi pada titik yang sama pada epithel ikan (Dickerson 2006). Sel trophont akan meninggalkan inang pada saat inang mati yang mekanismenya mungkin terkait dengan kemampuan parasit dalam mendeteksi perubahan tekanan osmotik pada tubuh inangnya (Nielsen dan Buchmann 2000). Sel trophont yang lepas dari tubuh inangnya segera berdiferensiasi menjadi sel tomont.
Sel trophont yang lepas dari inang akan berenang bebas kurang lebih 1 jam dan kemudian memproduksi materi lengket saat menempel pada substrat. Proses pembentukan kista (encystment) segera terjadi dan sel memulai pembelahan biner beberapa kali untuk menghasilkan sel tomite. Kecepatan pembelahan pada sel tomont sangat dipengaruhi oleh suhu lingkungan (Dickerson 2006).
2.1.3 Mekanisme Sakit
Tingkah laku ikan akan mengalami perubahan pada tahap awal infeksi, dimana ikan akan berenang dan mendekati pemasukan air (inlet) sebagai usaha untuk menghindari populasi sel theront. Ikan juga menggesek tubuhnya pada substrat atau objek tertentu sebagai reaksi dari proses infeksi. Pada infeksi lanjut, ikan menjadi kurang aktif dan banyak berdiam di dasar wadah atau berbaring dengan laju ventilasi operkulum yang meningkat (Dickerson 2006).
Selain modifikasi pada tingkah laku, infeksi parasit I. multifiliis juga mengakibatkan produksi mukus yang berlebihan. Ikan yang terinfeksi parah akan terlihat terbalut oleh lapisan putih pada tubuh dan siripnya. Infeksi ich yang berkembang menjadi ulcer akan menjadi pintu masuk bagi infeksi sekunder baik oleh bakteri maupun fungi oportunis. Kematian massal dapat dikaitkan dengan kerusakan sistem osmoregulasi pada tubuh ikan akibat infeksi parasit ini pada jaringan epidermis (Dickerson 2006). Kerusakan jaringan dapat terjadi dalam dua cara yaitu akibat luka dan apoptosis (Xu et al. 2005).
10
Infestasi berat parasit pada insang dapat memicu hiperplasia sebagai reaksi sistem imunitas. Pada beberapa kasus infestasi juga mengakibatkan nekrosis pada insang dan juga produksi mukus yang menutup lembaran insang, sehingga kemampuan insang dalam mengambil oksigen dan melepas amoniak menjadi berkurang (Dickerson 2006).
Gambar 4. Produksi mukus yang berlebihan pada ikan yang terinfeksi
I. multifiliis
Infeksi parasit ini bersama dengan parasit lainnya seperti Trichodina dan
Gyrodactylus dapat menekan efikasi vaksinasi terhadap Streptococcus iniae pada ikan nila. Ikan yang divaksinasi namun terinfeksi parasit I. multifiliis memiliki nilai relative percent survival (RPS) sebesar 72%, lebih rendah dari ikan yang juga divaksin tapi bebas dari parasit ini yang nilai RPSnya mencapai 95% (Martins et al. 2011a). Efikasi vaksin I. multifiliis juga mengalami penurunan pada ikan-ikan yang dipelihara pada suhu rendah 15-25°C. Ikan tersebut tidak mampu menghasilkan antibodi yang mencukupi dan setelah uji tantang populasi ikan mengalami kematian yang tinggi (Martins et al. 2011b).
11
2.2 Propagasi Parasit
Usaha untuk mengkultur beberapa organisme sederhana dalam media buatan telah dilakukan terhadap golongan bakteri, fungi, dan sebagian dari keluarga protozoa. Untuk beberapa organisme yang bersifat parasit obligat harus dikultur dalam organisme hidup ataupun dalam suatu kultur jaringan atau sel (cell line). Kultur secara in vitro memungkinkan untuk mendapatkan organisme dalam jumlah yang cukup karena tidak adanya predator atau kompetitor dalam media biakannya (Lee dan Mora 2005).
Kemampuan untuk menghasilkan organisme yang terbebas dari kontaminan sangat diperlukan bahkan dalam bidang biologi molekuler. Beberapa penelitian termasuk diagnosis dan studi etiologi hanya dapat dilakukan ketika tersedia sejumlah kecil organisme parasit, atau beberapa penelitian justru membutuhkan sejumlah organisme parasit tanpa kontaminasi dengan organisme atau materi dari inangnya. Satu keuntungan dari kultur in vitro terutama kultur murni, adalah kemampuan menghasilkan suplai organisme yang kontinyu (Visvesvara dan Garcia 2002).
Hasil dari beberapa penelitian yang menggunakan media buatan, membuktikan bahwa selain sebagai media untuk perbanyakan parasit, media buatan juga dapat dimanfaatkan sebagai media preservasi untuk waktu yang singkat. Nielsen dan Buchmann (2000) membuktikan bahwa media EMEM dan L-15 yang disuplementasi dengan faktor inang dapat memperpanjang masa hidup parasit I. multifiliis selama 11 hari, dibandingkan perlakuan tanpa faktor inang (7 hari) dan tanpa media buatan (2 hari). Sementara Syawal (1995) berhasil memperpanjang viabilitas sel theront I. multifiliis dalam media peptone dan glukosa walaupun sel tidak berkembang menjadi trophont.
12
maka propagasi secara in vivo merupakan satu-satunya jalan untuk memperbanyak sel parasit.
Keberhasilan pada propagasi secara in vivo sangat ditentukan oleh kualitas parasit, kuantitas parasit, dan kualitas lingkungan. Jumlah inang yang dibutuhkan dalam suatu seri infeksi, kecepatan peralihan stadia, sifat infektif yang tidak stabil dari parasit, dan fenomena menurunnya patogenisitas parasit dengan bertambahnya seri infeksi adalah hal-hal yang harus diperhatikan dalam suatu propagasi parasit secara in vivo (Dan et al. 2006).
Penelitian yang dilakukan dengan menggunakan parasit C. irritans
13
III. METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, IPB. Pelaksanaan penelitian dimulai sejak bulan Maret hingga September 2011.
3.2 Isolasi Parasit I. multifiliis (Dan et al. 2006)
Ektoparasit yang digunakan dalam penelitian ini adalah I. multifiliis stadia trophont yang diperoleh dari wabah white spot. Ikan yang sekarat akibat penyakit
white spot ditempatkan pada cawan petri yang berisi air kolam steril bersuhu 10°C. Parasit yang lepas dari tubuh ikan kemudian dikumpulkan pada satu wadah setelah dibilas beberapa kali untuk menghilangkan debris dan kotoran. Parasit kemudian diambil 20 sel secara acak untuk identifikasi secara morfologi dengan menggunakan mikroskop (Olympus CX 31).
.
3.3 Pemeliharaan pada Suhu Rendah (modifikasi Noe dan Dickerson 1995)
Sel trophont dengan ukuran minimal 350 µm dipilih dan ditransfer ke dalam tabung reaksi berisi air kolam steril 10 ml dan bersuhu 10°C. Ukuran tersebut dipilih untuk memastikan parasit mampu bertahan diluar tubuh inangnya, dan suhu 10°C bertujuan untuk mencegah terbentuknya kista. Selanjutnya sel tersebut ditransfer ke dalam tabung reaksi dan disimpan dalam ruang bersuhu 9±2°C selama 14 hari. Sebagai pembanding (kontrol), adalah parasit yang dipelihara dalam media air yang bersuhu 27±1°C.
3.4 Parameter Pengamatan (Dan et al. 2006)
Pengamatan dilakukan setiap hari selama 14 hari. Parameter yang diamati adalah persentase survival rate, aktivitas sel, persentase encystment, persentase
14
3.4.1 Persentase Survival Rate
Persentase survival rate parasit dihitung dengan rumus :
SR = 100%
No Nt
Keterangan:
SR = tingkat kelangsungan hidup parasit (%)
Nt = jumlah parasit yang hidup pada akhir pemeliharaan No = jumlah parasit yang ditebar pada awal pemeliharaan
3.4.2 Persentase Encystment
Encystment adalah proses pembentukan kista (stadia tomont) setelah sel trophont dipelihara. Sel tomont dikenali dengan warna sel yang lebih pekat, hilangnya makronukleus, dan terjadinya pembelahan sel. Dari tabung reaksi seluruh parasit dituang ke dalam cawan petri dan dengan pipet secara acak dipilih 3 sel untuk diinkubasi pada air kolam steril selama 24 jam. Perhitungan persentase
encystment dilakukan dengan rumus:
A = jumlah sel tomont saat pengamatan
B = jumlah sel trophont yang dipelihara pada awal penelitian
3.4.3 Persentase Excystment
Excystment adalah proses lepasnya sel anakan (sel theront) dari sel tomont setelah terjadinya pemecahan pada dinding sel tomont. Sel tomont yang mengalami excystment dikenali dengan tidak adanya tomite di dalamnya, dan adanya keberadaan sel sel theront di sekitar sel tomont yang pecah. Perhitungan persentase excystment dilakukan dengan rumus:
PEx = 100
D C
Keterangan:
PEx = persentase excystment (%)
C = jumlah sel tomont yang pecah (rupture) D = jumlah sel tomont awal
15
3.4.4 Abnormalitas Sel Theront
Sel tomite abnormal dicirikan dengan sel tomite yang gagal keluar dari sel tomont setelah 48 jam inkubasi pada suhu 27°C. Sedangkan sel theront abnormal dicirikan dengan sel yang tidak bergerak atau bergerak tapi lemah. Penilaian dilakukan secara deskriptif, dimana:
+++ = sangat banyak ++ = banyak + = sedikit
- = tidak terdapat abnormalitas.
3.5 Uji Infektifitas Parasit
Tujuan uji ini adalah untuk mengetahui apakah sel parasit masih mampu menginfeksi ikan uji setelah dipelihara selama 14 hari pada suhu rendah. Sel theront yang dihasilkan setelah proses inkubasi 27°C selama 24 jam, selanjutnya diinfeksikan pada 10 ekor ikan black moly (1,5±0,5 g) dan ikan bawal air tawar (3±0,3 g) yang dilakukan dengan cara perendaman, hingga memunculkan gejala
white spot dalam waktu pengamatan maksimal 14 hari pasca infeksi.
Proses infeksi pada ikan black moly dilakukan pada akuarium di dalam ruangan tertutup dimana suhu air diatur stabil pada kisaran 23-24°C. Sedangkan infeksi pada ikan bawal air tawar dilakukan pada suhu 27°C. Jika selama 14 hari pasca infeksi tidak menunjukan gejala white spot, maka parasit dianggap tidak infektif. Persentase ikan yang terinfeksi dari populasinya (prevalensi) dicatat untuk kemudian dibandingkan terhadap infektifitas parasit dari perlakuan kontrol.
3.6 Analisis Data
16
IV. HASIL DAN PEMBAHASAN
Pada saat diisolasi dari ikan, sel trophont menunjukan pergerakan yang aktif selama 4 jam pengamatan. Selanjutnya sel parasit pada suhu kontrol menempel pada dasar petri dan menjadi lebih lengket yang menandakan dimulainya proses
encystment, sedangkan parasit pada suhu 10°C tidak mengalami proses
encystment dan sel parasit tidak lengket pada dasar petri. Parasit selanjutnya ditransfer pada tabung reaksi untuk perlakuan suhu rendah dan diamati viabilitasnya selama 14 hari. Nilai hasil pengamatan nilai survival rate,
encystment, excystment, dan abnormalitas dapat dilihat pada Tabel 1.
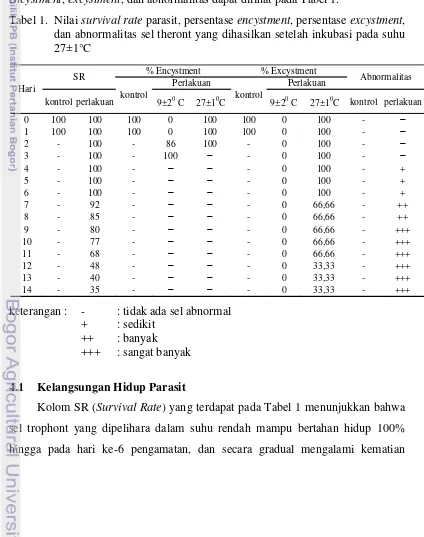
Tabel 1. Nilai survival rate parasit, persentase encystment, persentase excystment, dan abnormalitas sel theront yang dihasilkan setelah inkubasi pada suhu 27±1°C
Kolom SR (Survival Rate) yang terdapat pada Tabel 1 menunjukkan bahwa sel trophont yang dipelihara dalam suhu rendah mampu bertahan hidup 100% hingga pada hari ke-6 pengamatan, dan secara gradual mengalami kematian
17
sehingga nilai SR populasi parasit hanya 35% di akhir pengamatan. Sel parasit yang mati tidak mengalami lisis sehingga tetap bisa diamati pada hari terakhir pengamatan. Sedangkan seluruh sel trophont yang dipelihara pada suhu optimal (kontrol) menyelesaikan proses encystment dan excystment hanya dalam 18-24 jam, sehingga pada hari pertama pengamatan seluruh parasit sudah dalam stadia theront.
Ukuran sel yang besar memungkinkan parasit dapat menyimpan cadangan energi yang lebih banyak untuk proses pembelahan sel. Pada perlakuan suhu rendah, proses pembelahan sel diduga melambat dan mencegah proses pembentukan sel tomite, sehingga tersedia energi yang cukup bagi parasit untuk tetap bertahan hidup pada suhu rendah selama berada di luar tubuh inangnya.
Terdapat hubungan lurus antara ukuran sel trophont dengan viablitasnya, dimana sel trophont yang ukurannya lebih kecil dari 95 µm tidak akan mampu bertahan di luar tubuh inangnya (Dickerson 2006). Dalam penelitian ini, parasit yang digunakan adalah parasit dengan ukuran minimal 350 µm sehingga mampu bertahan selama beberapa hari. Pengamatan pada hari ke-14 menemukan hanya sel parasit yang berukuran minimal 600 µm yang terlihat masih hidup.
Kelangsungan hidup parasit yang rendah pada penelitian ini diduga disebabkan oleh beberapa kemungkinan, yaitu keterbatasan energi dan pengaruh suhu. Pemisahan parasit dari inangnya mengakibatkan tidak adanya suplai energi dari luar tubuh parasit dan memaksa parasit menggunakan cadangan energi yang ada untuk bertahan hidup. Kemampuan membentuk kista dan cadangan lipid diduga sangat menentukan kemampuan bertahan parasit saat meninggalkan inang (Ewing dan Kocan 1986). Jumlah energi yang terbatas dan sangat ditentukan oleh ukuran parasit akan menentukan berapa lama parasit tersebut mampu bertahan di luar tubuh ikan.
18
perlakuan kontrol 5-6 hari walaupun suhu diturunkan pada 9°C. Hal ini menjadi dugaan bahwa parasit I. multifiliis strain subtropik bertahan selama musim dingin dengan cara tinggal lebih lama pada tubuh inangnya dan berkembang jauh lebih lambat.
Penelitian terkait pada perlakuan suhu yang dilakukan oleh beberapa peneliti (Noe dan Dickerson 2006; Dan et al. 2009) masih menggunakan kisaran suhu yang secara alami terjadi dalam siklus satu tahun di perairan setempat. Hal ini berbeda dengan penelitian yang dilakukan oleh penulis karena menggunakan suhu 9°C yang jarang sekali terjadi di perairan daerah tropik sehingga kelangsungan hidup parasit hanya 35% saja setelah 14 hari perlakuan. Diduga parasit yang merupakan isolat tropik ini tidak mampu bertahan hidup lebih lama pada suhu 9°C.
4.2 Persentase Encystment
Kolom encystment pada Tabel 1 menunjukkan bahwa suhu rendah hanya mampu menunda proses encystment (pembentukan kista) pada sel thropont pada hari pertama pengamatan (Gambar 5a) akan tetapi tidak mampu mencegah proses tersebut pada hari selanjutnya. Sel parasit yang dipelihara, melakukan inisiasi pembentukan kista pada hari ke-2 sebesar 86%, dan akhirnya pada hari ke-3, seluruh parasit yang dipelihara dalam suhu rendah sudah dalam stadia tomont (Gambar 5b).
Gambar 5. (a). Parasit pada stadia thropont pada perlakuan suhu rendah pada hari pertama. (b). Pada hari kedua sel parasit sudah memulai membentuk kista (panah hitam) dan melakukan inisiasi pembelahan sel (panah putih).
Proses encystment berjalan dengan normal setelah sel parasit diinkubasi pada suhu optimal 27°C. Pengamatan ini sesuai dengan hasil penemuan Dickerson
19
(2006), bahwa proses pembentukan kista dapat ditunda secara temporer dengan mengkondisikan parasit pada media air yang bersuhu di bawah 10°C, namun akan segera pulih kembali jika parasit dikondisikan pada suhu 21-23°C. Pembentukan kista diduga sebagai salah satu mekanisme bertahan bagi parasit untuk mencegah pengaruh lingkungan luar terhadap proses pembelahan biner yang terjadi di dalam sel, seperti infeksi oleh bakteri dan fungi, atau predasi oleh protozoa lainnya (Dickerson 2006).
4.3 Persentase Excystment
Berdasarkan nilai persentase excystment yang terdapat pada Tabel 1, terlihat bahwa proses excystment tidak terjadi selama parasit dipelihara dalam suhu rendah walaupun telah terjadi pembelahan sel pada sebagian parasit. Excystment
hanya terjadi pada sel parasit setelah diinkubasi pada suhu 27°C. Diawali dengan penyempurnaan pembelahan sel hingga pembentukan sel tomite, selanjutnya sel tomite berusaha keluar dari sel induk dengan cara menembus dinding kista. Perbedaan proses excystment di antara perlakuan suhu rendah dapat dilihat pada Gambar 6.
Gambar 6. (a) Proses lepasnya sel theront dari kista (excystment) setelah 24 jam inkubasi sel parasit pada hari pertama, dan (b) proses
excystment dari parasit pada perlakuan suhu rendah hari ke-14.
Secara umum seluruh sel parasit yang dipelihara selama 7 hari pertama mampu menyempurnakan proses excystment (100%) dimana sel tomite yang ukurannya seragam mulai bergerak untuk memecah dinding kista pada beberapa bagian sel tomont (Gambar 6a). Akan tetapi kemampuan tersebut semakin menurun dengan bertambahnya hari perlakuan dimana pada akhir pengamatan yaitu pada hari ke-14, hanya 33,33% dari parasit yang diinkubasi pada suhu 27°C yang mampu melakukan proses excystment. Selain menurunnya persentase
20
excystment, waktu yang dibutuhkan untuk menyelesaikan proses excystment juga lebih panjang (36-48 jam) dibandingkan pada perlakuan kontrol (18-24 jam) dengan ciri ukuran tomite yang tidak seragam dikarenakan tidak serentaknya proses pembelahan sel (Gambar 6b).
Perlakuan pada suhu diduga telah menekan metabolisme parasit dan bertambahnya waktu pemeliharaan di luar tubuh inang juga telah memaksa parasit untuk menggunakan cadangan energi yang lebih besar selama bertahan hidup, sehingga mengurangi cadangan energi yang dibutuhkan oleh sel tomite untuk proses excystment.
4.4 Abnormalitas Parasit
Abnormalitas dalam pengamatan ini dicirikan dengan sel tomite yang tidak mampu menembus dan keluar dari kista setelah inkubasi selama 24 jam dalam suhu 27°C, mobilitas sel theront yang lemah, atau berputar-putar di tempatnya saja. Beberapa perbedaan abnormalitas sel parasit pada hari perlakuan yang berbeda dapat dilihat pada Gambar 7.
Gambar 7. (a). Sel theront normal berenang meninggalkan kista yang sudah kosong. (b) Sel tomite abnormal yang gagal menembus kista dari parasit yang dipelihara pada suhu rendah selama 8 hari. (c) Beberapa sel tomite abnormal pada perlakuan suhu rendah pada hari ke-14.
Berdasarkan Tabel 1 pada kolom abnormalitas sel, diketahui bahwa abnormalitas sel parasit terdeteksi pada hari ke-4 dan jumlahnya semakin meningkat hingga pada hari ke-14. Suhu rendah diduga telah mengakibatkan distribusi energi pada sel tomite menjadi tidak merata atau energi yang didistribusikan tidak mencukupi bagi sebagian sel tomite untuk melepaskan diri dari kista. Pada sel yang sehat sel parasit akan meninggalkan induk dalam 24 jam
b)
21
tanpa adanya sel tomite yang tersisa (Gambar 7a). Sementara sel parasit abnormal terlihat menyisakan beberapa sel tomite dalam kista sel induk (Gambar 7b) dan jumlahnya semakin banyak dengan bertambahnya hari pengamatan (Gambar 7c).
Sel theront diyakini tidak memanfaatkan energi dari luar karena vokuola makanan hanya terbentuk sempurna sesaat setelah sel theront mampu menginfeksi dan berkembang menjadi sel trophont pada tubuh ikan (Dickerson 2006). Oleh karena itu energi pada sel theront adalah energi yang terbatas dan hanya didapatkan dari sel induknya. Pemanfaatan cadangan energi oleh sel induk agar tetap dapat hidup selama pemeliharaan pada suhu rendah mungkin telah mengurangi jumlah energi yang didistribusikan kepada sel anakan (tomite).
Mobilitas sel theront yang rendah selain dimungkinkan oleh kekurangan energi, juga dapat disebabkan oleh cacat morfologi. Penelitian yang dilakukan Dan et al. (2009) pada parasit Cryptocaryon irritans menunjukan terjadinya peningkatan persentase sel theront yang cacat morfologi dengan bertambahnya hari pemeliharaan pada suhu rendah. Cacat ini mengakibatkan menurunnya infektifitas parasit pada ikan uji. Pada penelitian ini cacat morfologi (deformity) tidak diamati, namun tidak menutup kemungkinan bahwa rendahnya mobilitas sel theront dapat disebabkan oleh bentuk sel yang cacat akibat pemeliharaan pada suhu rendah di luar tubuh inangnya.
4.5 Uji Infektifitas Sel Theront
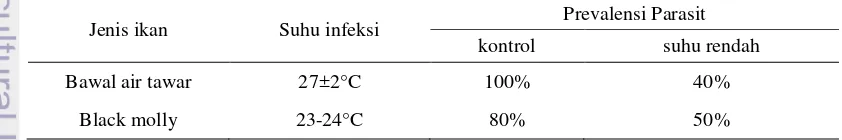
Infektifitas parasit yang dihasilkan dilihat dari nilai prevalensi parasit dari ikan uji yang diinfeksi oleh sel theront yaitu pada ikan bawal air tawar C. macropomum dan ikan black molly P. sphenops. Uji dilakukan pada dua suhu berbeda, yaitu pada suhu 27±2°C yang mendekati suhu alami pada kolam budidaya dan suhu yang lebih rendah 23-24°C. Nilai prevalensi parasit disajikan pada Tabel 2.
Tabel 2. Nilai prevalensi parasit I. multifiliis pada ikan uji bawal air tawar dan black molly yang diinfeksi dengan sel theront
Jenis ikan Suhu infeksi Prevalensi Parasit
kontrol suhu rendah
Bawal air tawar 27±2°C 100% 40%
22
Ikan uji menunjukan gejala penyakit white spot setelah 7 hari infeksi, baik pada ikan bawal air tawar yang diinfeksi pada suhu 27°C maupun pada ikan black molly yang diinfeksi pada suhu 23-24°C. Hal tersebut menunjukan bahwa suhu 23-27°C merupakan kisaran suhu yang masih mendukung proses infeksi.
Hasil perhitungan prevalensi yang disajikan pada Tabel 2 menunjukkan bahwa nilai prevalensi parasit perlakuan jauh lebih rendah jika dibandingkan pada parasit kontrol. Rendahnya nilai prevalensi parasit pada ikan bawal dan ikan black molly (40 dan 50%) yang diinfeksi parasit dari perlakuan suhu rendah (9±2°C) diduga disebabkan oleh tingginya abnormalitas sel parasit I. multifiliis setelah pemeliharaan selama 14 hari. Abnormalitas sel mempengaruhi jumlah sel tomite yang mampu berdiferensiasi menjadi theront. Sedangkan abnormalitas pada sel theront selanjutnya akan mempengaruhi kemampuan sel theront dalam menginfeksi inang karena mengurangi mobilitas sel dalam mencari inang dan menginfeksinya. Dalam kondisi sel dan suhu inkubasi normal, diperkirakan hanya 50% saja dari populasi sel theront mampu menginfeksi inang, terutama pada bagian insang ikan (Ewing et al. 1986).
23
Gambar 8. Ikan black molly Poecilia sphenops setelah diinfeksi dengan sel theront yang berasal dari parasit yang telah dipelihara selama 14 hari pada suhu rendah.
Sel theront sesaat setelah berhasil menginfeksi akan menembus lapisan basal epidermis ikan dan berdiferensiasi menjadi sel trophont. Selanjutnya sel trophont yang dilengkapi vokuola makanan akan berotasi dan bergerak dalam pola amoeboid untuk menggerus dan memakan sel dan debris dari luka yang dihasilkan. Titik putih yang terlihat sebagai gejala white spot pada ikan sebenarnya berasal dari parasit yang mengisi ruang pada jaringan kulit (Dickerson 2006). Ruang ini biasanya diisi oleh satu sel trophont namun beberapa kasus dapat ditemui lebih dari satu sel trophont hidup bersama-sama di dalam ruang tersebut. Infestasi parasit pada sirip dan insang ikan bawal dapat dilihat pada Gambar 9.
Gambar 9. Infestasi sel trophont pada ikan bawal yang terinfeksi ringan oleh parasit I. multifiliis pada a) sirip dada, b) sirip ekor, dan c) insang. Titik hitam merupakan sel trophont yang teramati pada perbesaran 40x.
2,5 mm
mm
24
Pada ikan yang menunjukan infeksi ringan, titik putih hanya terlihat dengan jelas pada sirip dada dan ekor ikan uji (Gambar 9a dan 9b). Namun saat dilakukan pengamatan pada bagian insang, terlihat intensitas parasit pada bagian insang jauh lebih tinggi dibandingkan pada bagian lainnya (Gambar 9c). Hal ini mengindikasikan bahwa sel infektif (sel theront) memiliki preferensi lokasi tertentu dalam menginfeksi ikan dalam hal ini insang ikan.
Ikan uji yang digunakan mengalami kematian untuk pertama kalinya pada hari ke-8 pasca infeksi. Selanjutnya secara bertahap, nilai akumulasi kematian mencapai 100% pada hari ke-14 pasca infeksi. Kematian massal pada ikan yang terinfeksi diduga lebih dikarenakan gejala hipoksia dan keracunan amoniak yang merupakan indikasi kegagalan fungsi utama insang akibat kerusakan yang ditimbulkan oleh infeksi parasit I. multifiliis (Dickerson 2006).
Dalam memilih organ target dan bertahan terhadap sistem imunitas inang, parasit memiliki beberapa strategi yaitu memilih area yang kompetensi imunitasnya lemah atau memanfaatkan mekanisme imunitas inang (Bobadilla 2008). Parasit I. multifiliis memilih area atau organ yang kompetensi sistem imunitasnya lemah dalam hal ini insang diduga karena beberapa alasan. Pertama, secara alami lapisan lendir pada insang jauh lebih tipis untuk memastikan insang dapat melakukan pertukaran oksigen dan karbondioksida lebih efisien, namun hal tersebut secara bersamaan akan mengurangi proteksi sistem imunitas pada insang ikan. Kedua, adanya pertukaran volume air akan membantu parasit dalam melakukan infestasi pada insang menjadi jauh lebih mudah (Dickerson 2006). Selain itu parasit I. multifiliis juga memiliki strategi memanfaatkan sistem imunitas ikan untuk keuntungannya sendiri, dimana produksi lendir yang berlebihan akan mengurangi mobilitas antibodi dan elemen imunitas lainnya dalam memburu parasit I. multifiliis (Bobadilla 2008).
25
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Parasit I. multifiliis dapat dipelihara dalam waktu yang singkat (14 hari) pada suhu rendah 9±2°C tanpa inangnya. Pemeliharaan pada suhu tersebut mempengaruhi viabilitas parasit yang terlihat dari rendahnya nilai SR, encystment,
excystment dan tingginya abnormalitas parasit yang dihasilkan. Parasit yang dihasilkan masih memiliki kemampuan untuk menginfeksi ikan tetapi dengan virulensi yang lebih rendah.
5.2 Saran
Untuk penelitian selanjutnya, perlu dievaluasi viabilitas parasit I. multifiliis
DAFTAR PUSTAKA
Barizi II. 1990. Kekebalan buatan benih ikan lele dumbo Clarias gariepinus umur 14 hari terhadap ichtyophthiriasis [Skripsi]. Fakultas Perikanan Institut Pertanian Bogor.
Bobadilla AS. 2008. Living off a fish: a trade off between parasites and the immune system. Fish &Shellfish Immunology. 25, 358-372.
Buchmann K, J Sigh, CV Nielsen, M Dalgaard. 2001. Host response against the fish parasitizing ciliate Ichtyophtirius multifiliis. Veterinery Parasitology vol 100: 105-116p.
Davis KB, BR Griffin, WL Gray. 2002. Effect of handling stress on susceptibility
of channel catfish Ictalurus punctatus (Rafinesque) to
Ichtyophtirius multifiliis and channel catfish virus infection. Aquaculture 214: 55-66p.
Dan XM, Li AX, Lin XT, Teng N, Zhu X.Q. 2006. A standardized method to propagate Cryptocaryon irritans on a susceptible host pompano
Trachiaonatus ovatus. Aquaculture 258, 127-133p.
Dan XM, Lin XT, Yan YX, Teng N, Tan ZL, Li AX. 2009. A technique for the preservation of Cryptocaryon irritans at low temperatures. Aquaculture 297: 112-115p.
Dickerson HW. 2006. Ichtyophthirius multifiliis and Cryptocaryon irritans
(phylum Ciliophora). In Fish Diseases and Disorder. Vol 1. Protozoan and Metazoan Infection. 2nd edition.
Ekless LM. 1993. Ichthyophthirius multifiliis: axenic isolation and short-term maintenance in selected monophasic media. Journal of Fish Diseases. 16(5): 437-447p.
Ewing MS, KM Kocan. 1986. Ichthyophthirius multifiliis (Ciliophora) Development in Gill Epithelium. Journal of Eukaryotic Microbiology. 33(3): 369-374p.
Ewing MS, Melanie EL, Ewing SA. 1986. Critical periods in development of
Ichthyophthirius multifiliis (Ciliophora) population. Journal of Eukaryotic Microbiology. 33: 388-391p.
Hass W, B Haberl, M Hoffman, S Kerschensteiner, U Ketzer. 1993.
27
He J, Z Yin, G Xu, Z Gong, TJ Lam, YM Sin. 1997. Protection of goldfish against
Ichtyophthirius multifiliis by immunization with a recombinant vaccine. Aquaculture 158: 1-10p.
Hoffman GL. 1967. Parasites of north american freshwater fishes. University of California Press. Barkeley.
Lee HH, DA Mora.2005. Survival of glochidia of freshwater mussels, Pygonodon grandis (Molusca:Unionidae) in vitro in the United States. Worl Aquaculture vol. 36(4).
Martins ML, CA Shoemaker, D Xu, PH Klesius. 2011a. Effects of paratism on vaccine eficacy against Streptococcus iniae in nile tilapia. Aquaculture 314: 18-23p.
Martins ML, D Xu, CA Shoemaker, PH Klesius. 2011b. Temperature effect on immune response and hematological parameters of channel catfish
Ictalurus punctatus vaccinated with live theronts of Ichtyophthirius multifiliis. Fish and Shellfish Immunology. 31 : 774-780p.
Nielsen CV, Buchmann. 2000. Prolonged in vitro cultivation of Ichtyophthirius multifiliis using an EPC cell line as substrate. Dis Aquat Org. vol 42: 215-219p.
Noe JG, Dickerson HW. 1995. Sustained growth of Ichthyophthirius multifiliis at low temperature in the laboratory. J. Parasitology. 81: 1022-1024.
Sigh J, T Lindenstorm, K Buchmann. 2004. The parasitic ciliate
Ichthyophthirius multifiliis induces expression of immune relevant genes in rainbow trout, Onchorynchus myskiis. Jou. of Fish Dis. 27: 409-417p.
Syawal H. 1995. Prospek media buatan untuk mempertahankan
Ichtyophthirius multifiliis pada stadia infektif [Tesis]. Sekolah Pascasarjana Institut Pertanian Bogor.
Visvesvara GS, LS Garcia. 2002. Culture of protozoan parasite. Clinical Microbiology Review july: 327-328p.
Wang X, TG Clark, J Noe, HW Dickerson. 2002. Immunizatio of channel catfish
Ictalurus punctatus (Rafinesque) with Ichthyopthirius multifiliis
immobilization antigens elicits serotype spesific protection. Fish&Shellfish Immunology. 13: 337-350p.
Xu DH, PH Klesius. 2002. Antibody mediated immune response against
Ichthyopthirius multifiliis using excised skin from channel catfish
28
Xu DH, PH Klesius. 2003. Protective effect of cutaneous antibodies produced by cahnnel catfish Ictalurus punctatus (Rafinesque) immune to
Ichthyopthirius multifiliis on cohabitated non immune catfish. Jou. of Fish Dis. 26: 287-291p.
Xu DH, PH Klesius, RA Shelby. 2004. Immune response and host protection of channel catfish, Ictalurus punctatus (Rafinesque) against
Ichthyopthirius multifiliis after immunization with live theronts and sonicated trophonts. Jou.of Fish Dis. 27: 135-145p.
Xu DH, PH Klesius, CA Shoemaker. 2005. Cutaneous antibodies from channel
catfish, Ictalurus punctatus (Rafinesque) immune to
Ichthyopthirius multifiliis may induces apoptosis of ich theronts. Jou.of Fish Dis. 28: 213-220p.
Xu DH, PH Klesius, CA Shoemaker. 2008. Protective immunity of nile tilapia against Ichthyopthirius multifiliis post immunization with live theronts and sonicated trophonts. Fish&Shellfish Immunology 25: 124-127p.
Xu DH, PH Klesius, CA Shoemaker. 2009. Effect of immunization of channel catfish with inactivated trophonts on serum and cutaneous antibody titre and survival against Ichthyopthirius multifiliis. Fish&Shellfish Immunology. 26: 614-618p.
Xu DH, JW Pridgeon, PH Klesius, CA Shoemaker. 2011. Paratism by protozoan
Ichtyophthirius multifiliis enhanced invasion of Aeromonas hydrophilla in tissues of channel catfish. Vet.Parasitol. doi: 10.1016/j.vetpar.2011.09.020 (article in press).
Yambot AV, YL Song. 2006. Immunization of grouper Epinephelus coioides
confers protection against a protozoan parasite, Cryptocaryon irritans. Aquaculture 260: 1-9p.
Lampiran 1. Komposisi larutan alkohol-formalin-asam asetat glacial (AFA)
Semua bahan dicampur menjadi satu dan disimpan dalam botol gelap dan dalam suhu ruang.
Bahan Jumlah Satuan
Formalin 6 mℓ
Alkohol 50 mℓ
Asam asetat glacial 4 mℓ