KARYA TULIS ILMIAH Halaman Judul
UJI AKTIVITAS ANTIOKSIDAN DAN FOTOPROTEKTIF FRAKSI ETILASETAT EKSTRAK ETANOLIK KULIT BUAH NAGA MERAH
(Hylocereus polyrhizus)
Disusun untuk Memenuhi Sebagian Syarat Memperoleh Derajat Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Muhammadiyah Yogyakarta
Disusun oleh
NURHASNA SUSHMITA SARI 20120350015
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN UNIVERSITAS MUHAMMADIYAH YOGYAKARTA
KARYA TULIS ILMIAH
Halaman Judul
UJI AKTIVITAS ANTIOKSIDAN DAN FOTOPROTEKTIF FRAKSI
ETILASETAT EKSTRAK ETANOLIK KULIT BUAH NAGA MERAH
(Hylocereus polyrhizus)
Disusun untuk Memenuhi Sebagian Syarat Memperoleh Derajat Sarjana Farmasi
pada Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Muhammadiyah Yogyakarta
Disusun oleh
NURHASNA SUSHMITA SARI
20120350015
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
UNIVERSITAS MUHAMMADIYAH YOGYAKARTA
iii
PERNYATAAN KEASLIAN TULISAN
Saya yang bertanda tangan di bawah ini:
Nama
:
Nurhasna Sushmita Sari
NIM
:
20120350015
Program Studi
:
Farmasi
Fakultas
:
Kedokteran dan Ilmu Kesehatan
Menyatakan dengan sebenarnya bahwa Karya Tulis Ilmiah yang saya tulis
benar-benar merupakan hasil karya saya sendiri dan belum diajukan dalam bentuk
apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau
yang dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis
lain telah disebutkan dalam teks dan tercantum dalam Daftar Pustaka dibagian
akhir Karya Tulis Ilmiah ini.
Apabila dikemudian hari terbukti atau dibuktikan Karya Tulis Ilmiah ini hasil
jiplakan, maka saya bersedia menerima sanksi atas perbuatan tersebut.
Yogyakarta, 23 Juni 2016
Yang membuat pernyataan
iv
MOTTO
“Dan apabila hamba- hambaKu bertanya kepadamu tentang Aku, maka
(jawablah), bahwasanya Aku adalah dekat. Aku mengabulkan permohonan orang
yang berdoa apabila ia memohon kepadaKu, maka hendaklah mereka itu
memenuhi (segala perintah)Ku dan hendaklah mereka beriman kepadaKu, agar
mereka selalu berada dalam kebenaran” (Al Baqarah ayat 186)
“Jadilah alasan kebahagiaan orang lain, sedangkan alasan kebahagiaan diri
sendiri biarlah Allah yang melakukannya” (Mario Teguh)
“Watch your thoughts, they become words. Watch your words, they become
actions. Watch your actions, they become habits. Watch your habits, they become
character. Watch your character, it becomes your destiny” (Lao Tzu)
“Bila kamu tak tahan lelahnya belajar, bersiaplah menanggung perihnya
kebodohan” (Imam Syafi’i)
“Hiduplah seperti huruf aksara jawa, huruf itu akan tetap hidup dan bisa dibaca
walau di ‘wulu’, di ‘suku’, di ‘taling’, di ‘pepet’, di ‘layar’, di ‘cecak’, tapi akan
v
HALAMAN PERSEMBAHAN
Syukur kupanjatkan kepada Allah SWT yang telah mengabulkan segala doa yang
kupanjatkan serta memberikan berbagai nikmat yang tak terhitung jumlahnya.
Karya Tulis Ilmiah ini kupersembahkan kepada:
Kedua orang tuaku yang sangat aku hormati dan sayangi, bapak dan ibu yang
selalu menyelipkan namaku di setiap doanya, menyayangi dan mencintaiku tak
kenal lelah, menjadi motivasiku dalam mencapai citaku
Untuk adikku Nur Allisia Rahmasari yang selalu memberiku semangat, dukungan,
doa dan telah menjadi adik terbaik yang aku miliki.
Untuk keluarga besarku yang selalu mendoakanku.
Untuk sahabat kecilku, Nur, Anggun, Tita, Nita, Putri, teman- teman almamater
SD Muhammadiyah Wirobrajan 3 Yogyakarta, SMP Negeri 7 Yogyakarta, dan
SMA Negeri 4 Yogyakarta
Untuk Ratih, Seftina, Hida, Jihan, Indah, Anggi, Nopril, dan Neng terimakasih
telah memberi warna baru dalam hidupku.
Serta untuk guru- guruku yang telah memberikan ilmu, mendidik dan membuatku
vi
KATA PENGANTAR
Bismillahirrohmanirrohim
Assalamu’alaikum warahmatullahi wabarakatuh
Puji dan syukur ke hadirat Allah SWT yang telah melimpahkan rahmat dan
karunia-Nya sehingga penulis dapat menyelesaikan Karya Tulis Ilmiah dengan
judul “Uji Aktivitas Antioksidan dan Fotoprotektif Fraksi Etilasetat Ekstrak
Etanolik Kulit Buah Naga Merah (Hylocereus polyrhizus)” sebagai tugas akhir
untuk memenuhi persyaratan dalam memperoleh gelar sarjana Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Muhammadiyah Yogyakarta. Karya
Tulis Ilmiah ini dapat selesai karena dukungan dan bimbingan dari berbagai pihak
diantaranya kepada:
1. Ibu Sabtanti Harimurti, M.Sc., Ph.D., Apt. selaku Kepala Program Studi
Farmasi
Fakultas
Kedokteran
dan
Ilmu
Kesehatan
Universitas
Muhammadiyah Yogyakarta.
2. Bapak Hari Widada, M., Sc., Apt., selaku dosen pembimbing. Terimakasih
atas bimbingan, ilmu, dan kepercayaan yang diberikan kepada penulis selama
penulis melakukan penelitian dan menempuh pendidikan di Program Studi
Farmasi
Fakultas
Kedokteran
dan
Ilmu
Kesehatan
Universitas
Muhammadiyah Yogyakarta.
3. Bapak Andy Eko Wibowo., M.Sc., Apt., selaku dosen penguji 1. Terimakasih
atas saran yang diberikan kepada penulis sehingga Karya Tulis Ilmiah ini
dapat menjadi lebih baik lagi.
vii
5. Mas Satria, Mbak Linggar, Mbak Zelmi yang telah membantu penelitian di
Laboratorium di Program Studi Farmasi Fakultas Kedokteran dan Ilmu
Kesehatan Universitas Muhammadiyah Yogyakarta.
6. Mbak Linda Karlina (farmasi angkatan 2011) dan Aditya Dwi Pamungkas
(farmasi angkatan 2012) yang telah menjadi rekan seperjuangan dalam
menyelesaikan penelitian di Program Studi Farmasi Fakultas Kedokteran dan
Ilmu Kesehatan Universitas Muhammadiyah Yogyakarta.
7. Kepala LP3M UMY yang telah memberikan dana penelitian melalui program
Hibah Penelitian Kemitraan.
8. Teman-teman farmasi angkatan 2012 yang telah menjadi saudara baru bagi
penulis. Semoga persaudaraan ini dapat terus berjalan meskipun telah lulus
dari Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Muhammadiyah Yogyakarta.
9. Teman-teman KKN 05 tahun 2015 yang telah memberikan semangat dan
dukungan.
10. Semua pihak yang terkait dalam penelitian ini. Terimakasih atas dukungan
yang diberikan baik yang bersifat material maupun non material, alunan doa,
dukungan serta bimbingan selama penulisan Karya Tulis Ilmiah.
Penulis menyadari bahwa Karya Tulis Ilmiah ini masih banyak kekurangan.
Oleh karena itu, penulis mengharapkan kritik dan saran yang InsyaAllah akan
membuat Karya Tulis Ilmiah ini menjadi lebih baik lagi dan bermanfaat bagi
penulis maupun pembaca.
Wassalamu’alaikum Warahmatullahi Wabarakatuh
Yogyakarta, 23 Juni 2016
Penulis
viii
DAFTAR ISI
Halaman Judul... i
HALAMAN PENGESAHAN... ii
PERNYATAAN KEASLIAN TULISAN...iii
MOTTO... iv
HALAMAN PERSEMBAHAN... v
KATA PENGANTAR... vi
DAFTAR ISI... viii
DAFTAR TABEL...x
DAFTAR GAMBAR...xi
DAFTAR LAMPIRAN... xii
INTISARI... xii
ABSTRACT...xiv
BAB I Pendahuluan... 1
A. Latar Belakang...1
B. Perumusan Masalah... 3
C. Keaslian Penelitian...4
D. Tujuan Penelitian... 5
E. Manfaat Penelitian... 5
BAB II Tinjauan Pustaka...6
A. Radikal bebas...6
B. Efek radikal bebas...7
C. Radiasi Ultraviolet Dan Fotoprotektif...8
D. Antioksidan...10
E. Buah Naga Merah (Hylocereus polyrhizus)...13
F. Metode Ekstraksi... 16
I. Spektrofotometri UV-Vis...19
J. Kerangka Konsep...20
G. Hipotesis... 22
BAB III Metode Penelitian...
A. Desain Penelitian...
B. Tempat Dan Waktu Penelitian...
C. Sampel Penelitian...23
D. Identifikasi Variabel Penelitian dan Definisi Operasional...24
1. Variabel Penelitian... 24
2. Definisi Operasional...24
E. Instrumen Penelitian... 26
F. Cara Kerja... 27
G. Skema langkah kerja...32
ix
BAB IV HASIL DAN PEMBAHASAN... 33
A. Penyiapan sampel...33
B. Analisis Kualitatif Flavonoid dengan Kromatografi Lapis Tipis (KLT).... 35
C. Penetapan Kuantitatif Kandungan Flavonoid Total...36
D. Analisis Kuantitatif Kandungan Fenolik Total...38
E. Uji Antioksidan Metode DPPH... 40
F. Panjang Gelombang Maksimal dan SPF secara in vitro...42
BAB V KESIMPULAN DAN SARAN... 44
A. Kesimpulan... 44
B. Saran... 44
DAFTAR PUSTAKA... 45
x
DAFTAR TABEL
Tabel 1. Tingkat kemampuan tabir surya ...9
Tabel 2. ROS dan antioksidan yang berperan ...11
Tabel 3. Tingkat aktivitas antioksidan dengan metode DPPH...13
Tabel 4. Pelarut dan parameternya ...16
Tabel 5. Panjang gelombang dan nilai EE (λ) x I (λ) ...31
Tabel 6. Warna tiap bercak sampel uji pada Plat KLT... 36
Tabel 7. Uji Flavonoid total standar kuersetin...37
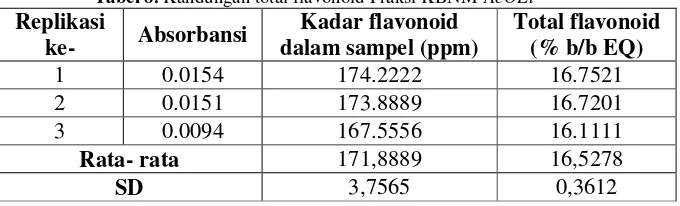
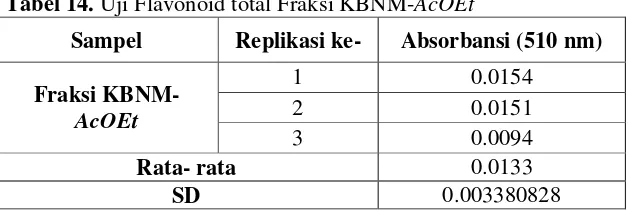
Tabel 8. Kandungan total flavonoid Fraksi KBNM-AcOEt...37
Tabel 9. Uji Fenolik Standar Asam Galat...38
Tabel 10. Perhitungan Konsentrasi fenol sampel fraksi KBNM- AcOEt...39
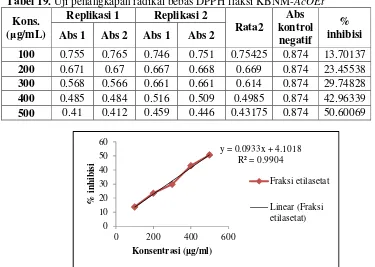
Tabel 11. Uji penangkapan radikal bebas DPPH...40
Tabel 12. Scanning panjang gelombang maksimal fraksi KBNM-AcOEt...42
Tabel 13. Uji Flavonoid total standar kuersetin...56
Tabel 14. Uji Flavonoid total Fraksi KBNM-AcOEt... 56
Tabel 15. Standar asam galat... 58
Tabel 16. Uji penangkapan radikal bebas DPPH kuersetin replikasi 1... 60
Tabel 17. Uji penangkapan radikal bebas DPPH kuersetin replikasi 2... 60
Tabel 18. Uji penangkapan radikal bebas DPPH kuersetin replikasi 3... 60
Tabel 19. Uji penangkapan radikal bebas DPPH fraksi KBNM-AcOEt...61
xi
DAFTAR GAMBAR
Gambar 1. Contoh radikal bebas ...6
Gambar 2. Struktur kuersetin ...10
Gambar 3. Resonansi radikal bebas fenol ...11
Gambar 4. Tanaman buah naga merah ...13
Gambar 5. Kerangka konsep...20
Gambar 6. Skema langkah kerja... 32
Gambar 7. Hasil uji kualitatif menggunakan plat KLT... 35
Gambar 8. Kurva standar kuersetin pada uji total flavonoid... 56
Gambar 9. Kurva standar asam galat... 58
Gambar 10. Grafik uji aktivitas antioksidan kuersetin... 61
Gambar 11. Grafik uji aktivitas antioksidan fraksi KBNM- AcOEt...68
Gambar 12. Perajangan kulit buah naga merah... 68
Gambar 13. Proses maserasi... 68
Gambar 14. Proses Evaporasi... 68
Gambar 15. Proses fraksinasi...68
Gambar 16. Penangkapan Radikal Bebas DPPH...68
xii
DAFTAR LAMPIRAN
Hasil Determinasi Tanaman...53
Perhitungan nilai rendemen... 54
Perhitungan Rf... 55
Analisis Total Flavonoid sampel uji... 56
Analisis kandungan fenolik total... 58
Uji aktivitas antioksidan sampel uji...60
Uji SPF...63
HALAMANPENGESAHAN
UJ[ AKT[VITAS ANTIOKSIDAN DAN FOTOPROTEKTlF FRAKS[
ETILASETAT EKST RAK ETAN OLIK KULlT BUAH NAGA MERAI-I
(Hyloeereus polyrhizus)
Disusun o[eh
NURHASNASUSHMUTASAIU
20 [20350015
Te lah disetujui dan disemi narkan pada tanggal23 Jun i 2016
Dosen Pembimbing,
Hari Wi da, M., Sc., Apt.
N UC
1977072 1 201004 1731 20
Dosen
Penguji 2
Sri Tasmin atun, M. Si .. Apt
NlK.
19880602 20 1504173237
Nil<.197 1 1[ 06 19990417 303 6
Mengetahui.
Kepala Program Studi Farmasi
Fakultas
Kedokteran dan IImu Kesehatan
u ョゥ カ・イウゥエ 。 セ@
Muhammadiyah Yogyakarta
M[Lオセ
s··
'l ZGセNBGBIt セG@ ,
セ|セセ@
',
..
ZZセ@ Zセ@
Sabtlinti
Han
1 M .Sc. Ph.D. A t.
NlK.:
1973
2320131 0 173 127
xiv ABSTRACT
Free radicals can be caused by exposure of UV rays. Free radicals in the body can be a trigger of many diseases. Photoprotective agent can protected the skin from exposure of UV rays. In addition, antioxidant compound can also reduced a negative impact of free radicals. Red dragon fruit (Hylocereus polyrhizus) was one of the fruits which contain a flavonoid compound. This compound can acted as photoprotective and antioxidant agents. This study aims to know the content of flavonoid in the peel of red dragon fruit (Hylocereus polyrhizus) and knowing the antioxidants and photoprotective activities.
The peel of red dragon fruit (Hylocereus polyrhizus) extracted within ethanol then macerate fractionated with ethylacetate. The content of phenolic and flavonoid compounds of ethylacetate fraction of the red dragon fruit
(KBNM-AcOEt) tested with TLC method, Folin-Ciocalteu method, and chelation AlCl3 method. Furthermore, the free radical (DPPH) scavenging test was be done to found out the antioxidant activities of KBNM-AcOEt and in vitro test with spectrophotometry method was conducted to found out the SPF value of
KBNM-AcOEt.
The Total Phenolic Content of KBNM-AcOEt was 1493,4641 ± 14,9757 mg GAE/100g and the Total Flavonoid Content of KBNM-AcOEt was 16,5278 ± 0,3612 % b/b EQ. Antioxidant activities of KBNM-AcOEt was weak (> 150 g/mL). It was seen from the IC50 value of KBNM-AcOEt (491.9421 g/mL). Meanwhile, the SPF value of KBNM-AcOEt was very low (0.0069 ± 0.0071). The KBNM-AcOEt at a concentration of 5, 25, 50 and 100 mg / L does not have photoprotective activities.
xiii INTISARI
Radikal bebas dapat disebabkan oleh paparan radiasi sinar UV. Kadar radikal bebas yang tinggi di dalam tubuh dapat menyebabkan berbagai macam penyakit. Suatu agen fotoprotektif dapat melindungi kulit dari paparan sinar UV. Selain itu, senyawa antioksidan juga dapat mengurangi efek negatif radikal bebas. Buah naga merah (Hylocereus polyrhizus) merupakan salah satu buah yang mengandung senyawa flavonoid yang dapat bertindak sebagai agen fotoprotektif dan antioksidan. Penelitian ini bertujuan untuk mengetahui kandungan flavonoid dalam kulit buah naga merah (Hylocereus polyrhizus) serta mengetahui daya antioksidan dan daya fotoprotektifnya.
Kulit buah naga merah (Hylocereus polyrhizus) diekstraksi dengan etanol dan difraksinasi cair-cair menggunakan etilasetat. Kandungan senyawa fenolik dan flavonoid fraksi etilasetat ekstrak etanolik kulit buah naga merah
(KBNM-AcOEt) diuji dengan metode KLT, metode Folin-Ciocalteu, dan metode khelasi AlCl3. Selanjutnya, uji penangkapan radikal bebas DPPH dilakukan untuk
mengetahui daya antioksidan fraksi KBNM-AcOEt dan uji secara in vitro dengan metode spektrofotometri dilakukan untuk mengetahui nilai SPF fraksi
KBNM-AcOEt.
Kandungan fenolik total fraksi KBNM-AcOEt adalah 1493,4641 ± 14,9757 mg GAE/100g dan kandungan total flavonoid fraksi KBNM-AcOEt
adalah 16,5278 ± 0,3612 % b/b EQ. Daya antioksidan fraksi KBNM-AcOEt
diketahui bersifat lemah (>150 μg/mL). Hal ini dilihat dari nilai IC50 fraksi
KBNM-AcOEt yaitu 491,9421 g/mL. Sementara itu, nilai SPF yang dihasilkan oleh fraksi KBNM-AcOEt sangat rendah yaitu sebesar 0,0069 ± 0,0071. Hal ini menunjukkan fraksi KBNM-AcOEt konsentrasi 5, 25, 50 dan 100 mg/L tidak memiliki daya fotoprotektif.
1
1
BAB I
Pendahuluan
A. Latar Belakang
Matahari merupakan sumber energi terbesar bagi bumi. Berbagai
manfaat dapat diperoleh dari sinar matahari. Salah satunya adalah untuk
meningkatkan suplai vitamin D bagi manusia melalui paparan radiasi UVB
(Ultraviolet B) (Mead, 2008). Manfaat tersebut didapatkan ketika radikal
bebas yang terbentuk dari paparan radiasi UV berada pada konsentrasi normal.
Kadar radikal bebas yang tidak normal atau tinggi di dalam tubuh akan
menghasilkan stres oksidatif yang dapat menyebabkan berbagai macam
penyakit seperti kanker kulit, arthritis, penuaan, gangguan autoimun, jantung
dan penyakit neurodegeneratif (Pham-Huy et al., 2008).
World Health Organization (WHO) memperkirakan akan terjadi
peningkatan kejadian kanker kulit non-melanoma sebesar 300.000 dan
melanoma sebanyak 4.500 akibat penipisan lapisan ozon (WHO, 2015). Tabir
surya atau suatu agen fotoprotektif dapat melindungi kulit dari paparan sinar
UV dengan menyerap, memantulkan, serta menyebar (scatter) sinar matahari
(Mishra et al., 2011). Tubuh kita membutuhkan suatu senyawa yang dapat
membantu menangkal radikal bebas atau sering disebut dengan antioksidan
(Pietta, 1999). Senyawa antioksidan yang umum digunakan adalah vitamin E
atau α-tokoferol, BHA, dan BHT (Fessenden, 1986). Senyawa antioksidan
2
yang dapat digunakan sebagai antioksidan dan fotoprotektif adalah buah naga
merah (Hylocereus polyrhizus). Penelitian sebelumnya menunjukkan bahwa
kandungan antioksidan kulit buah naga merah (Hylocereus polyrhizus) lebih
tinggi dibanding daging buahnya (Nurliyana et al., 2010). Penggunaan kulit
buah naga merah yang memiliki berat 22% dari berat buah ternyata belum
dimanfaatkan secara optimal (Jamilah, 2011). Pemanfaatan tumbuhan telah
dijelaskan dalam Al-Quran surat Asy- Syu’ara ayat 7 yang berbunyi:
Artinya: “Dan apakah mereka tidak memperhatikan bumi, berapakah
banyaknya Kami tumbuhkan di bumi itu berbagai macam tumbuh-tumbuhan
yang baik?”
Beberapa penelitian telah dilakukan untuk mengetahui daya antioksidan
dari kulit buah naga merah. Pranata (2013) mengambil senyawa dalam kulit
buah naga merah (Hylocereus lemairei Britton dan Rose) yang bersifat
semipolar dalam bentuk fraksi kloroform ekstrak kloroform dengan hasil nilai
IC50 sebesar 3349,936 g/mL, sedangkan Budilaksono et al. (2014)
mengambil senyawa non polar dari ekstrak yang bersifat semipolar dalam
bentuk fraksi n-heksana ekstrak kloroform yang menghasilkan nilai IC50
sebesar 206,591 g/mL. Kuersetin adalah salah satu kelas flavonoid
(flavonol) yang bersifat semipolar yang mempunyai aktivitas antioksidan
lebih tinggi dibanding vitamin C dengan perbandingan 4,7:1 (Sugrani et al.,
2009). Kuersetin pada konsentrasi 10% juga diketahui memiliki nilai SPF
3
2008). Oleh karena itu, penelitian ini ingin mengambil senyawa yang bersifat
semipolar dari ekstrak yang bersifat polar dalam bentuk fraksi etilasetat
ekstrak etanol sehingga senyawa flavonoid seperti kuersetin dapat diambil
dan dapat diketahui daya antioksidan dan fotoprotektif untuk mencegah
paparan sinar ultraviolet yang berlebihan.
B. Perumusan Masalah
1. Apakah terdapat kandungan flavonoid dan fenolik dalam fraksi etilasetat
ekstrak etanolik kulit buah naga merah (Hylocereus polyrhizus) yang diuji
dengan uji KLT, metode khelasi AlCl3, serta metode Folin-Ciocalteu?
2. Bagaimana daya antioksidan fraksi etilasetat ekstrak etanolik kulit buah
naga merah (Hylocereus polyrhizus) dilihat dari nilai IC50 yang diuji
menggunakan metode DPPH?
3. Bagaimana daya fotoprotektif fraksi etilasetat ekstrak etanolik kulit buah
naga merah (Hylocereus polyrhizus) dilihat dari nilai SPF yang diuji
4
C. Keaslian Penelitian
No Judul Penelitian
(Penulis, tahun) Hasil Persamaan Perbedaan
1
Uji Aktivitas Antioksidan Fraksi Kloroform Kulit
Buah Naga Merah (Hylocereus lemairei
Britton dan Rose) Menggunakan Metode
DPPH (1,1-Difenil-2- Pikrilhidrazil)
(Pranata, 2013)
Nilai IC50 pada fraksi
kloroform kulit buah naga merah
(Hylocereus lemairei
Britton dan Rose) adalah 3349,936
g/mL.
Sampel yang digunakan adalah kulit buah naga merah, namun beda spesies (penelitian ini menggunakan
Hylocereus polyrhizus)
1. Sampel yang digunakan oleh Pranata adalah fraksi kloroform ekstrak kloroform (semipolar dari ekstrak semipolar), sedangkan penelitian ini menggunakan fraksi etilasetat ekstrak etanolik (semipolar dari ekstrak polar) 2. Kontrol positif yang digunakan Pranata
adalah vitamin C, sedangkan kontrol positif yang digunakan pada penelitian ini adalah kuersetin.
2
Uji Aktivitas Antioksidan Fraksi n-Heksana Kulit
Buah Naga Merah (Hylocereus lemairei
Britton dan Rose) Menggunakan Metode
DPPH (1,1-Difenil-2-Pikrilhidrazil)
(Budilaksono et al., 2014)
Nilai IC50 pada fraksi
n-heksana kulit buah naga merah (Hylocereus lemairei Britton dan Rose) adalah 206,591
g/mL.
Sampel yang digunakan adalah kulit buah naga merah, namun beda spesies (penelitian ini menggunakan
Hylocereus polyrhizus)
1. Sampel yang digunakan oleh
Budilaksono et al. adalah fraksi n-heksan ekstrak kloroform (non polar dari ekstrak semipolar), sedangkan penelitian ini menggunakan fraksi etilasetat ekstrak etanolik (semipolar dari ekstrak polar) 2. Kontrol positif yang digunakan
5
D. Tujuan Penelitian
1. Mengetahui adanya senyawa flavonoid dan fenolik dalam fraksi etilasetat
ekstrak etanolik kulit buah naga merah (Hylocereus polyrhizus) yang diuji
dengan uji KLT, metode khelasi AlCl3, serta metode Folin-Ciocalteu.
2. Mengetahui daya antioksidan fraksi etilasetat ekstrak etanolik kulit buah
naga merah (Hylocereus polyrhizus) dengan nilai IC50 yang diuji
menggunakan metode DPPH.
3. Mengetahui daya fotoprotektif fraksi etilasetat ekstrak etanolik kulit buah
naga merah (Hylocereus polyrhizus) dengan nilai SPF yang diuji
menggunakan metode spektrofotometri.
E. Manfaat Penelitian
Apabila terbukti pada fraksi etilasetat ekstrak etanolik kulit buah naga merah
(Hylocereus polyrhizus) memiliki daya antioksidan dan daya fotoprotektif,
maka dapat digunakan sebagai landasan ilmiah untuk pengembangan sediaan
6 BAB II
Tinjauan Pustaka
A. Radikal bebas
Radikal bebas merupakan suatu atom atau gugus atom yang memiliki
satu atau lebih elektron yang tidak berpasangan, bersifat sangat reaktif dan
mempunyai energi yang tinggi. Simbol dari suatu radikal bebas adalah sebuah
titik yang menggambarkan elektron yang tidak berpasangan (Fessenden,
1986).
OH• O2 • NO •
Hidroksil Superoksid Nitrit oksid
NO2• ROO• LOO•
Nitrogen dioksid Peroxyl Lipid peroxyl
Mekanisme reaksi radikal bebas dapat dibagi menjadi 3, yaitu:
1. Inisiasi
Tahap inisiasi adalah pembentukan awal dari radikal-radikal bebas
(Fessenden, 1986).
Cahaya UV atau kalor
Cl – Cl 2 Cl • --- persamaan 1
2. Propagasi
Pembentukan radikal bebas akan mengakibatkan terbentuknya radikal baru
dengan suatu reaksi yang disebut reaksi rantai (Fessenden, 1986).
Cl • + CH4 CH3 • + HCl --- persamaan 2
Cl2 + CH3 • CH3Cl + Cl • --- persamaan 3
7
Secara teoritis, proses ini akan berlangsung terus menerus karena sebuah
Cl • akan mengalami reaksi yang menyebabkan terbentuknya sebuah Cl •
yang lain (Fessenden, 1986).
3. Terminasi
Reaksi rantai yang terjadi akan berhenti pada tahap terminasi yaitu ketika
radikal bebas bergabung dengan radikal bebas yang lain sehingga tidak
membentuk radikal bebas yang baru (Fessenden, 1986).
Cl • + • CH3 CH3Cl --- persamaan 4
Sumber radikal bebas dapat dibagi menjadi 3, yaitu (Kumar, 2011):
1. Sumber internal: berasal dari reaksi enzimatik yang menghasilkan suatu
radikal bebas seperti pada reaksi pernafasan, fagositosis, sintesis
prostaglandin, serta dalam sistem sitokrom P450.
2. Sumber eksternal: asap rokok, polutan lingkungan, radiasi, sinar UV,
ozon, obat-obatan, anestesi, pestisida, dan pelarut industri.
3. Faktor fisiologis: status mental seperti stres, emosi dan kondisi penyakit
yang dapat memicu terbentuknya radikal bebas.
B. Efek radikal bebas
Radikal bebas mempunyai peran positif bagi tubuh manusia (Droge,
2002). Namun, ketika kadarnya di dalam tubuh melebihi batas normal maka
radikal bebas menjadi suatu senyawa yang berbahaya bagi manusia.
Akumulasi radikal bebas yang terjadi akan menyebabkan terjadinya stres
8
Penyakit yang dapat ditimbulkan dari adanya stres oksidatif diantaranya
adalah kanker, gangguan autoimun, penuaan dini, katarak, rheumatoid
arthritis, jantung dan penyakit neurodegeneratif (Pham-Huy et al., 2008).
Mekanisme terjadinya kanker sebagian besar disebabkan oleh adanya mutasi
pada gen p53 atau gen yang berperan dalam proses apoptosis (Thomas, 2009).
Oleh karena itu, keseimbangan antara dua efek antagonis dari radikal bebas
menjadi aspek penting bagi kehidupan manusia (Pham-Huy et al., 2008).
C. Radiasi Ultraviolet Dan Fotoprotektif
Radiasi ultraviolet (UV) merupakan bagian dari spektrum
elektromagnetik yang berada diantara area sinar-X dan sinar tampak atau
antara 40 dan 400 nm (30-3 eV) (Webber, 1997). Berdasarkan spektrum
elektromagnetik, wilayah ultraviolet dibagi menjadi 3 yaitu ultraviolet A
(UVA: 320-400 nm), ultraviolet B (UVB: 290 -320 nm) dan ultraviolet C
(UVC: 200-290 nm) (Dutra, 2004). Radiasi UVA yang mencapai permukaan
bumi yaitu sebesar 95-98%, radiasi UVB sebanyak 2-5%, sedangkan UVC
diabsorbsi oleh lapisan ozon pada bagian stratosfer (McKinlay, 1987).
Radiasi ultraviolet dapat masuk ke dalam kulit melalui kromofor atau
suatu molekul tertentu yang dapat menangkap gelombang elektromagnetik
pada panjang gelombang tertentu (Lucas, 2015). Ketika kulit dirangsang oleh
radiasi ultraviolet, kulit akan melakukan beberapa mekanisme sebagai
perlindungan diri. Pertama, epidermis akan membengkak akibat adanya
radiasi UVB. Hal ini akan meningkatkan perlindungan pada kulit sebesar 3-4
9
sehingga akan memberikan perlindungan terhadap kulit 2-3 kali (Mishra et al.,
2011). UVB dapat menyebabkan kejadian sunburn 1000 kali lebih banyak
dibanding dengan UVA dan UVA 1000 kali lebih efektif dalam membuat efek
tanning akibat dari melanin pada lapisan epidermis yang membuat kulit lebih
gelap dibandingkan UVB (Brenner & Hearing, 2008; Saewan et al., 2013).
Tabir surya dapat digunakan sebagai agen fotoprotektif karena dapat
melindungi kulit dari paparan UV dengan menyerap, memantulkan, serta
menyebar (scatter) sinar matahari (Mishra et al., 2011). Tingkat efektif suatu
tabir surya didasarkan pada pengukuran nilai SPF (Sun Protection Factor).
Semakin tinggi nilai SPF suatu tabir surya, maka kemampuan dalam
melindungi kulit dari terjadinya sunburn juga semakin besar (Kaur & Saraf,
2010) (Tabel 1). SPF (Sun Protection Factor) adalah nilai yang diperoleh
dengan membandingkan waktu yang dibutuhkan untuk terjadinya sunburn
pada kulit yang dilindungi tabir surya dengan kulit yang tidak dilindungi tabir
surya(Mishra et al., 2011).
Tabel 1. Tingkat kemampuan tabir surya (Wasitaadmatdja, 1997; Damogalad, 2013)
Nilai SPF Keterangan
2-4 Minimal
4-6 Sedang
6-8 Ekstra
8-15 Maksimal
>15 Ultra
Senyawa kimia yang terkandung di dalam tabir surya umumnya adalah
senyawa aromatis yang terkonjugasi dengan gugus karbonil. Struktur ini
dapat menyerap energi yang tinggi dari matahari kemudian melepas energi
10
digunakan sebagai tabir surya antara lain ozybenzon, sulisobenzon, dan oktil
metoksi cinnamat (Saewan & Jimtaisong, 2013). Namun, bagi sebagian orang
yang memiliki sensitifitas terhadap senyawa kimia tersebut tidak dapat
memakai tabir surya yang mengandung bahan-bahan yang terkait. Para
peneliti meyakini kosmetik yang menggunakan bahan herbal adalah pilihan
yang tepat bagi kulit yang hipersensitif (Mishra et al., 2011).
Flavonoid adalah salah satu senyawa alami yang berpotensi sebagai agen
fotoprotektif karena memiliki kemampuan dalam menyerap sinar UV serta
dapat menjadi senyawa antioksidan (Saewan et al., 2013). Suatu agen
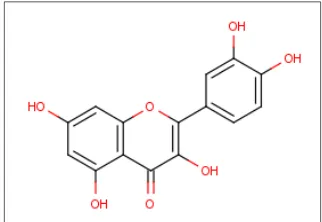
fotoprotektif dari flavonol yaitu kuersetin (Gambar 2) dan rutin
(kuersetin-3-O-rutinosida) sebesar 10% menunjukkan nilai SPF yang sama dengan
homosalat (agen tabir surya sintetik) (Choquenet et al., 2008).
Gambar 2. Struktur kuersetin (Sing, 2007)
D. Antioksidan
Inhibitor radikal bebas adalah suatu senyawa yang dapat bereaksi dengan
radikal bebas reaktif membentuk radikal bebas yang tidak reaktif dan bersifat
relatif stabil. Suatu inhibitor yang berperan dalam menghambat auto-oksidasi
atau oksidasi oleh udara disebut dengan antioksidan. Senyawa antioksidan
tersebut dapat melawan radikal bebas karena memiliki gugus-gugus fenol atau
11
bebas yang terbentuk pada tahap propagasi dari senyawa antioksidan akan
terstabilkan secara resonansi sehingga menjadi radikal bebas yang tidak reaktif
(Gambar 3) (Fessenden, 1986).
Gambar 3. Resonansi radikal bebas fenol (Fessenden, 1986)
Dibawah ini adalah senyawa antioksidan beserta radikal bebas yang dapat
distabilkan (Tabel 2):
Tabel 2. ROS dan antioksidan yang berperan (Pervical, 1996)
ROS Antioksidan
Radikal hidroksil (OH•) vitamin C, glutation, flavonoid, asam lipoat Radikal superoksida (O2 • ) vitamin C, glutation, flavonoid, SOD Hidrogen peroksida (H2O2) vitamin C, glutation, beta karoten, vitamin
E, CoQ10, flavonoid, asam lipoat Lipid peroksida (LOOH) beta karoten, vitamin E, flavonoid
Flavonoid merupakan senyawa dengan kerangka karbon C6-C3-C6
(Grotewold, 2006). Flavonoid yang paling besar ada 4, yaitu antosianin
(pigmen merah sampai ungu), flavonol (kurang berwarna hingga pigmen
kuning pucat), flavanol (pigmen yang kurang berwarna yang menjadi coklat
setelah oksidasi), dan proantosianidin (Pas) (Petrussa et al, 2013). Flavonoid
dibagi menjadi tiga kelas, antara lain:
1. Flavonoid (2-phenylbenzopyrans)
Flavonoid (2-phenylbenzopyrans) dibagi menjadi flavan, flavanon,
flavon, flavonol, dihidroflavonol, flavon-3-ol, 4-ol, dan
12
2. Isoflavonoid (3-benzopyrans)
Kelompok isoflavonoid (3-benzopyrans) terdiri dari isoflavan, isoflavon,
isoflavanon, isoflav-3-en, isoflavanol, rotenoid, coumestan,
3-arilcoumarin, coumaronochromen, coumaronochromon, dan pterocarpan
(Grotewold, 2006).
3. Neoflavonoid (4-benzopyrans)
Neoflavonoid terdiri dari 4-arilcoumarin, 3,4-dihidro-arilcoumarin, dan
neoflaven (Grotewold, 2006).
Metode DPPH (1,1-difenil-2-pikrilhidrazil) adalah metode yang paling
umum digunakan untuk menentukan kapasitas antioksidan dalam makanan
ataupun minuman karena bersifat cepat, sederhana, akurat, dan juga murah
(Marinova & Batchvaron, 2011). Dasar dari uji DPPH adalah pada perubahan
warna radikal DPPH akibat reaksi antara radikal bebas DPPH dengan satu
atom hidrogen yang dilepaskan oleh senyawa yang terkandung dalam bahan
uji yang membentuk senyawa 1,1-difenil-2-pikrilhidrazin yang berwarna
kuning. Absorbansi yang diukur adalah absorbansi larutan DPPH yang tidak
bereaksi dengan senyawa antioksidan (Josephy, 1997). Tingkat aktivitas
antioksidan suatu sampel dapat dilihat dari nilai IC50 (konsentrasi yang
ekuivalen memberikan 50% efek aktivitas antioksidan) (Ciptaningsih, 2012).
Semakin kecil nilai IC50, maka semakin aktif sampel tersebut sebagai
13
Tabel 3. Tingkat aktivitas antioksidan dengan metode DPPH (Ariyanto, 2006)
IC50 Keterangan
<50 g/mL Sangat kuat
50 -100 g/mL Kuat
100- 150 g/mL Sedang
>150 g/mL Lemah
E. Buah Naga Merah (Hylocereus polyrhizus)
1. Taksonomi
Klasifikasi
Kingdom : Plantae
Subkingdom : Tracheobionta
Superdivisio : Spermatophyta
Divisio : Magnoliophyta
Kelas : Magnoliopsida
Subkelas : Hamamelidae
Ordo : Caryophyllales
Famili : Cactaceae
Genus : Hylocereus
Spesies : Hylocereus polyrhizus
(Kristanto, 2008)
2. Karakterisasi tanaman
Buah naga atau dalam Bahasa Inggris dikenal dengan nama “pitaya”
atau “pitahaya” merupakan buah yang berasal dari Meksiko, Amerika
Tengah, dan Amerika Selatan (Puspita, 2011). Secara morfologis, tanaman
ini termasuk tanaman yang tidak lengkap karena tidak memiliki daun.
14
Akar buah naga tidak terlalu panjang dan berupa akar serabut yang sangat
tahan pada kondisi tanah yang kering dan tidak tahan genangan yang
cukup lama. Bunga buah berukuran besar dan mekar penuh pada malam
hari dan menyebarkan bau yang harum (Dembitsky et al., 2011).
Buah naga memiliki bentuk bulat agak lonjong yang terletak di ujung
cabang atau batang dengan ketebalan kulit buah sekitar 2-3 cm dengan
sisik seperti naga dikulit buahnya. Buah naga merah (Hylocereus
polyrhizus) memiliki kulit berwarna merah dan daging yang berwarna
merah keunguan dengan kadar kemanisan 13-15% briks (Puspita, 2011).
Biji buah naga berbentuk bulat berukuran kecil dengan warna hitam dan
setiap buah terdapat sekitar 1200-2300 biji (Kristianto, 2008). Biasanya,
buah naga akan banyak ditemukan pada bulan April-Mei dan
September-November (Dembitsky et al., 2011).
3. Kandungan buah naga merah (Hylocereus polyrhizus)
Buah naga merah (Hylocereus polyrhizus) mengandung berbagai
senyawa bioaktif seperti asam stearat, asam oleat, campesterol,
stigmasterol, asam asetat, betanin, isobetanin, fenolik, dan flavonoid
(Foong et al., 2012). Asam stearat, asam oleat, serta fitosterol dapat
digunakan untuk mengurangi konsentrasi LDL-kolesterol dan
menghambat penyerapan kolesterol (Fong et al., 2012; Isabelle et al.,
2009). Kandungan tujuh betacyanin pada buah naga merah (betanin,
15
bougainvillein-R-I) dapat menjadi pewarna alami, antioksidan, dan untuk
menurunkan kolesterol (Foong et al., 2012).
Senyawa fenolik seperti flavonoid juga bersifat sebagai antioksidan
sehingga berpotensi untuk mengurangi risiko penyakit seperti penyakit
jantung koroner dan kanker. Selain bersifat sebagai antioksidan, flavonoid
juga bersifat sebagai penghambat enzim dan mempunyai efek terhadap
bakteri (Fong et al., 2012). Kulit buah naga merah juga mengandung
beberapa senyawa seperti triterpenoid, betasianin, alkaloid, steroid, dan
flavonoid (flavon dan flavonol) (Pranata, 2013; Budilaksono et al., 2014).
Menurut Wee Sim Choo dan Wee Khing Yong (2011), daging dan
kulit buah naga merah (Hylocereus polyrhizus) memiliki nilai EC50
sebesar 11,34 ± 0,22 mg/mL atau memiliki daya antioksidan lebih besar
daripada daging dan kulit buah naga putih (Hylocereus undatus) dengan
nilai EC50 sebesar 14,61 ± 0,82 mg/mL. Namun, daging dan kulit buah
naga putih memiliki total fenolik lebih besar (20,14 ± 1,15 mg GAE/100g)
daripada daging dan kulit buah naga merah (15,92 ± 1,28 mg GAE/100g).
Nurliyana et al. (2010) juga menyatakan bahwa daya antioksidan
(nilai IC50) tertinggi terdapat di kulit buah naga merah (Hylocereus
polyrhizus), diikuti kulit buah naga putih (Hylocereus undatus), daging
buah naga merah (Hylocereus polyrhizus) dan daging buah naga putih
(Hylocereus undatus). Total fenolik tertinggi terdapat di kulit buah naga
16
polyrhizus), daging buah naga merah (Hylocereus polyrhizus) dan daging
buah naga putih (Hylocereus undatus).
F. Metode Ekstraksi
Ekstraksi adalah istilah yang digunakan dalam bidang farmasi yang
menggambarkan akan adanya proses pemisahan bagian aktif tanaman atau
jaringan hewan dari komponen yang tidak aktif atau inert menggunakan
pelarut yang dipilih secara selektif dengan mengikuti standar prosedur
ekstraksi (CSI-UNIDO, 2008). Selama ekstraksi, pelarut akan berdifusi ke
dalam bahan tanaman dan melarutkan senyawa yang memiliki kepolaran yang
sama (Pandey, 2014). Senyawa flavonoid yang kurang polar misalnya
isoflavon, flavanone, flavon yang termetilasi, dan flavonol dapat diekstraksi
dengan pelarut seperti diklorometana, kloroform, dietil eter atau etil asetat,
sementara glikosida flavonoid dan aglikon yang lebih polar diekstraksi dengan
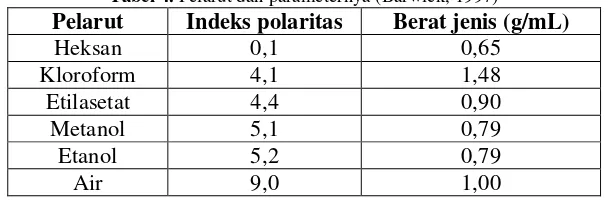
[image:31.612.167.473.477.577.2]pelarut polar seperti alkohol atau campuran alkohol-air (Andersen et al, 2006).
Tabel 4. Pelarut dan parameternya (Barwick, 1997)
Pelarut Indeks polaritas Berat jenis (g/mL)
Heksan 0,1 0,65
Kloroform 4,1 1,48
Etilasetat 4,4 0,90
Metanol 5,1 0,79
Etanol 5,2 0,79
Air 9,0 1,00
Semakin besar nilai indeks polaritas suatu pelarut maka semakin polar
pelarut tersebut (Sadek, 2002). Oleh karena itu, urutan pelarut diatas apabila
diurutkan dari yang non polar ke polar adalah heksan, kloroform, etilasetat,
metanol, etanol dan air. Etilasetat dan kloroform merupakan pelarut yang
17
Metode dalam ekstraksi tanaman diantaranya adalah maserasi, infus,
perkolasi, digesti, soxhlet, sonikasi, dan destilasi (Pandey, 2014). Ada
beberapa parameter yang digunakan untuk memilih metode ekstraksi dengan
tepat. Pertama, bagian simplisia yang dapat mengganggu dihilangkan terlebih
dahulu. Simplisia yang akan digunakan adalah bagian dari tanaman yang
benar dan untuk mengendalikan kualitas simplisia maka usia tanaman, waktu,
musim, dan tempat pengambilan sebaiknya dicatat. Selanjutnya, proses
pengeringan dilakukan tergantung pada sifat kimia dari simplisia
(CSI-UNIDO, 2008).
Serbuk simplisia yang didapatkan diayak dengan ayakan yang sesuai
untuk mendapatkan ukuran yang seragam, biasanya menggunakan mesh
ukuran 30-40. Jika senyawa yang akan diukur bersifat non polar maka pelarut
yang digunakan adalah yang bersifat non polar, begitu pula sebaliknya.
Apabila senyawa yang akan diambil bersifat termolabil, metode ekstraksi
seperti maserasi dingin, perkolasi, dan CCE (Counter-Current Extraction)
lebih dianjurkan. Namun, apabila senyawa yang akan diambil bersifat
termostabil maka dapat dilakukan dengan ekstraksi soxhlet (jika menggunakan
pelarut bukan air) dan dekoksi (CSI-UNIDO, 2008).
Apabila mengambil senyawa seperti flavonoid dan fenil propanoid
sebaiknya berhati-hati ketika menggunakan pelarut organik karena dapat
mendegradasi senyawa tersebut. Ketika menggunakan metode ekstraksi panas,
maka suhu yang tinggi harus dihindari karena beberapa glikosida dapat
18
penting karena waktu ekstraksi yang terlalu lama akan menyebabkan senyawa
yang tidak diinginkan juga dapat terekstraksi. Kualitas pelarut yang digunakan
juga perlu diperhatikan. Proses pengeringan harus aman dan dapat menjaga
stabilitas senyawa yang diambil. Parameter yang terakhir adalah parameter
analisis ekstrak seperti TLC (Thin Layer Chromatography) dan HPLC harus
didokumentasikan untuk memantau kualitas ekstrak dari batch yang berbeda
(CSI-UNIDO, 2008).
Maserasi merupakan proses ekstraksi yang banyak digunakan karena
bersifat sederhana (Mahdi, 2010). Proses maserasi secara umum adalah
dengan menempatkan bahan tanaman dalam bentuk bubuk serbuk kedalam
bejana tertutup dengan menambahkan pelarut selama tujuh hari dengan
sesekali diaduk. Bejana dalam keadaan tertutup untuk mencegah penguapan
pelarut selama periode ekstraksi. Pelarut akan berdifusi masuk melalui dinding
sel untuk melarutkan konstituen dalam sel kemudian pelarut akan berdifusi
keluar. Proses difusi tanpa pengadukan akan berjalan sangat lambat. Faktor
yang mempengaruhi proses maserasi diantaranya kecepatan pelarut masuk
kedalam serbuk bahan, tingkat kelarutan dari senyawa yang larut dengan
pelarut, kecepatan pelarut keluar dari senyawa yang tidak larut (CSI-UNIDO,
2008).
Metode maserasi termasuk kedalam golongan ekstraksi padat-cair,
sedangkan ekstraksi cair-cair dilakukan dengan cara fraksinasi. Fraksinasi
merupakan proses pemisahan antara zat cair dengan zat cair berdasarkan
19
pelarut non polar, yang semi polar akan larut dalam pelarut semi polar, dan
yang bersifat polar akan larut kedalam pelarut polar (Harborne 1987).
Fraksinasi dilakukan menggunakan corong pisah. Pada akhir proses fraksinasi,
larutan dalam corong pisah akan menghasilkan dua lapisan. Pelarut yang
mempunyai berat jenis lebih besar akan berada di lapisan bawah, sedangkan
pelarut dengan berat jenis yang lebih kecil akan berada di lapisan atas
(Suwendiyanti, 2014).
I. Spektrofotometri UV-Vis
Sinar ultraviolet (200-400 nm) dan sinar tampak (400-750 nm)
merupakan salah satu radiasi elektromagnetik dan energi yang merambat
dalam bentuk gelombang. Jika suatu molekul dikenai suatu radiasi
elektromagnetik pada frekuensi (panjang gelombang) yang sesuai sehingga
energi molekul tersebut ditingkatkan ke level yang lebih tinggi, maka terjadi
peristiwa penyerapan (absorpsi) energi oleh molekul (Gandjar dan Abdul
Rohman, 2012).
Suatu zat dapat dianalisis menggunakan spektrofotometer UV-Vis
apabila mempunyai zat tersebut memiliki gugus kromofor dan auksokrom.
Kromofor merupakan ikatan rangkap yang terkonjugasi atau gugus atau atom
dalam senyawa organik yang mampu menyerap sinar ultraviolet dan sinar
tampak (misalnya, gugus alken, alkin, karbonil, karboksil, amido, azo, nitro,
nitroso, dan nitrat). Auksokrom atau suatu gugus fungsional yang mempunyai
elektron bebas seperti OH, -O, -NH2, dan –OCH3 (Gandjar dan Abdul
20
Lampu Wolfram merupakan sumber cahaya tampak pada
spektrofometer UV-Vis, sedangkan lampu hidrogen atau deuterium sebagai
sumber radiasi ultraviolet. Sumber cahaya tersebut dipancarkan melalui
monokromator. Monokromator akan menguraikan sinar yang masuk dari
sumber cahaya tersebut menjadi pita-pita panjang gelombang yang diinginkan
untuk pengukuran suatu zat tertentu. Cahaya atau energi radiasi dari
monokromator diteruskan dan diserap oleh suatu larutan yang akan diperiksa
di dalam kuvet. Jumlah cahaya yang diserap oleh larutan akan menghasilkan
signal elektrik pada detektor, yang mana signal elektrik ini sebanding dengan
cahaya yang diserap oleh larutan tersebut. Besarnya signal elektrik yang
dialirkan ke pencatat dapat dilihat sebagai angka (Triyati, 1985).
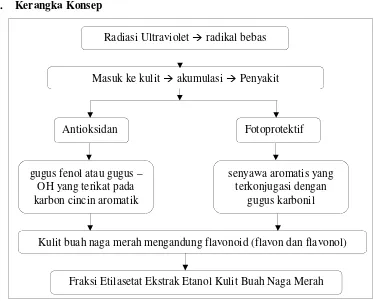
J. Kerangka Konsep
Fraksi Etilasetat Ekstrak Etanol Kulit Buah Naga Merah Masuk ke kulit akumulasi Penyakit
Antioksidan Fotoprotektif
gugus fenol atau gugus – OH yang terikat pada karbon cincin aromatik
senyawa aromatis yang terkonjugasi dengan
gugus karbonil
[image:35.612.138.512.393.694.2]Kulit buah naga merah mengandung flavonoid (flavon dan flavonol) Radiasi Ultraviolet radikal bebas
21
Radiasi sinar UV merupakan salah satu sumber radikal bebas (Kumar,
2011). Radikal bebas yang masuk ke dalam tubuh dan mengalami akumulasi
akan memicu berbagai macam penyakit seperti kanker, gangguan autoimun,
penuaan dini, katarak, rheumatoid arthritis, jantung dan penyakit
neurodegeneratif (Pham-Huy et al., 2008). Flavonoid merupakan salah satu
contoh senyawa yang dapat berperan sebagai antioksidan karena mempunyai
gugus fenol yang bertugas untuk melawan radikal bebas (Kumar, 2011).
Radikal bebas yang terbentuk pada tahap propagasi dari senyawa antioksidan
akan terstabilkan secara resonansi sehingga menjadi radikal bebas yang tidak
reaktif (Fessenden, 1986).
Selain sebagai antioksidan, flavonoid juga dapat digunakan sebagai agen
fotoprotektif karena memiliki kemampuan dalam menyerap sinar UV
(Saewan and Jimtaisong, 2013). Senyawa kimia dalam tabir surya sintetik
umumnya adalah senyawa aromatis yang terkonjugasi dengan gugus karbonil.
Struktur ini dapat menyerap energi yang tinggi dari matahari kemudian
melepas energi tersebut menjadi lebih rendah (Rai et al., 2007).
Buah naga merah (Hylocereus polyrhizus) merupakan buah yang
mengandung berbagai senyawa bioaktif, salah satunya adalah senyawa
fenolik dan flavonoid (Foong et al., 2011). Daya antioksidan kulit buah naga
merah dapat diketahui dengan melakukan analisis kadar fenolik total dan uji
DPPH. Kadar fenol akan menentukan bagaimana daya antioksidan kulit buah
naga merah. Daya fotoprotektif kulit buah naga merah diketahui dengan
22
KLT dan analisis kadar flavonoid total menyatakan bagaimana kandungan
flavonoid dalam kulit buah naga merah. Kandungan flavonoid akan
menentukan bagaimana daya fotoprotektif kulit buah naga merah.
G. Hipotesis
Hipotesis pada penelitian ini adalah:
1. Fraksi etilasetat ekstrak etanolik kulit buah naga merah (Hylocereus
polyrhizus) mengandung flavonoid yang diuji menggunakan uji KLT dan
metode khelasi AlCl3 serta mengandung senyawa fenolik yang diuji
menggunakan metode Folin-Ciocalteu.
2. Fraksi etilasetat ekstrak etanolik kulit buah naga merah (Hylocereus
polyrhizus) memiliki daya antioksidan yang kuat dilihat dari nilai IC50
yang diuji dengan metode DPPH.
3. Fraksi etilasetat ekstrak etanolik kulit buah naga merah (Hylocereus
polyrhizus) memiliki daya fotoprotektif dilihat dari nilai SPF yang diuji
BAB III
Metode Penelitian
A. Desain Penelitian
Jenis penelitian ini adalah observasional laboratorik untuk mengetahui
kandungan fenolik total, kandungan flavonoid total, nilai IC
50serta nilai SPF
pada fraksi etilasetat ekstrak etanolik kulit buah naga merah (
Hylocereus
polyrhizus)
sebagai agen antioksidan dan fotoprotektif.
B. Tempat Dan Waktu Penelitian
1.
Tempat Penelitian
Penelitian dilaksanakan di Laboratorium Farmasi dan Laboratorium
Penelitian Fakultas Kedokteran dan Ilmu Kesehatan Universitas
Muhammadiyah Yogyakarta.
2. Waktu Penelitian
Penelitian dilakukan dari bulan November 2014 sampai dengan Juni 2015.
C. Sampel Penelitian
Sampel yang digunakan pada penelitian ini adalah kulit buah naga merah
(
Hylocereus polyrhizus
). Buah naga merah yang digunakan berasal daerah
Banyuwangi (diambil pada bulan November 2014). Kulit buah naga merah
diambil dari 20 kg buah naga merah. Kulit buah naga merah kemudian
dikeringkan dan diekstraksi dengan etanol λ5% menjadi ekstrak etanolik kulit
buah naga merah. Selanjutnya ekstrak kental difraksinasi untuk mendapatkan
D. Identifikasi Variabel Penelitian dan Definisi Operasional
1. Variabel Penelitian
a. Variabel bebas
Variabel bebas pada penelitian ini adalah konsentrasi fraksi etilasetat
ekstrak etanolik kulit buah naga merah (
Hylocereus polyrhizus
).
b. Variable tergantung
Variabel tergantung pada penelitian ini adalah kadar fenolik total,
kadar flavonoid total, nilai IC
50, serta panjang gelombang absorbsi
maksimum dan nilai SPF.
2. Definisi Operasional
Definisi operasional pada penelitian ini adalahμ
a. Kadar fenolik total merupakan kadar senyawa fenolik dalam sampel
yang dinyatakan sebagai ekuivalen asam galat atau
Gallic Acid
Equivalent
(GAE). Kadar fenolik total didapatkan dari perhitungan
menggunakan rumus TPC (
Total Phenolic Content
), dimana nilai C
(kadar fenol total larutan) atau sumbu x didapatkan dengan
memasukkan nilai absorbansi sampel ke dalam sumbu y pada
persamaan regresi linier standar asam galat. Persamaan regresi ini
didapatkan dari hubungan antara konsentrasi asam galat (10, 20, 30, 40,
dan 50
µ
g/mL) dan absorbansi asam galat. Absorbansi didapatkan dari
hasil pengukuran menggunakan spektrofotometer UV-Vis dengan
metode Folin-Ciocalteau. Metode ini merupakan reaksi
fosfotungstad) dan senyawa polifenol yang terdapat pada sampel
sehingga terbentuk malibdenum-tungsen dengan kompleks warna biru
(Wisesa dan Widjanarko, 2014).
b. Kadar flavonoid total merupakan kadar flavonoid dalam sampel yang
dinyatakan sebagai ekuivalen kuersetin (EQ). Kadar flavonoid total
didapatkan dari perhitungan menggunakan rumus Total Flavonoid,
dimana kadar flavonoid dalam sampel (sumbu x) diketahui dengan
memasukkan absorbansi sampel ke dalam sumbu y pada persamaan
regresi linier kuersetin. Persamaan regresi linier kuersetin dibuat dari
hubungan antara konsentrasi kuersetin (400, 800, 1200, 1600 dan 2000
g /mL) dengan absorbansi kuersetin. Absorbansi didapatkan dari hasil
pengukuran menggunakan spektrofotometer UV-Vis dengan metode
kolorimetri mengunakan khelasi AlCl
3.Metode ini merupakan reaksi
AlCl
3yang akan membentuk kompleks dengan gugus keto pada atom
C-4 dan juga dengan gugus hidroksi pada atom C-3 atau C-4 yang
bertetangga dari flavon dan flavonol (Desmiaty, 200λ).
c. IC
50(
Inhibitory Concentration
) merupakan konsentrasi yang ekuivalen
memberikan 50% efek aktivitas antioksidan atau efek menangkap
radikal bebas (Ciptaningsih, 2012; Marxen
et al
., 2007). IC
50digunakan sebagai parameter yang menunjukkan aktivitas antioksidan
yang didapatkan dengan menggunakan uji DPPH. Absorbansi DPPH
biasanya diukur pada panjang gelombang 515-520 nm (Marxen
et al
,
reaksi antara radikal bebas DPPH dengan satu atom hidrogen yang
dilepaskan oleh senyawa yang terkandung dalam bahan uji untuk
membentuk senyawa 1,1-difenil-2-pikrilhidrazin yang berwarna
kuning (Josephy, 1λλ7).
d. Panjang gelombang absorbsi maksimum dan nilai SPF ditentukan
dengan metode spektrofotometri menggunakan daerah serapan UVB
yaitu antara 2λ0 hingga 320 nm. Nilai SPF didapatkan dari
perhitungan menggunakan rumus SPF yang telah dikembangkan oleh
Mansur
et al
. (1λ86) (Dutra, 2004).
E. Instrumen Penelitian
Alat dan bahan yang digunakan adalah sebagai berikutμ
1. Alat
Oven, bejana maserasi, bejana KLT, Blender (Philips
®), cawan porselen,
Rotary evaporator
(IKA
®RV10), waterbath (Memmert
®), plat selulosa (E
merck
®), pipa kapiler, kipas angin (Sekai
®), lampu UV 254 dan UV 366
nm, termometer, timbangan analitik (Mettler Toledo
®), corong pisah
(Pyrex
®), rak tabung reaksi, mikropipet (Socorex
®), pipet tetes, sendok
tanduk, tabung reaksi (Pyrex
®), erlenmeyer (Pyrex
®), gelas ukur (Pyrex
®),
labu takar (Pyrex
®), vortex, propipet, pipet volume (Pyrex
®), kuvet,
Spektrofotometer UV-Vis mini-1240 (Shimadzu
®).
2. Bahan
Buah naga merah (
Hylocereus polyrhizus
), alkohol λ6% (pro analisis, E
(teknis, Bratac), metanol (teknis, Bratac), pereaksi sitroborat (asam borat
dan asam sitrat) (E Merck), n-butanol (pro analisis, E Merck), asam asetat
(pro analisis, E Merck), aquades (teknis, Bratac), Folin-ciocalteu (E
Merck), Na
2CO
3(E Merck), kuersetin standard (Sigma), AlCl
3(E Merck),
NaNO
2(E Merck), NaOH (J.T. Baker), DPPH (E Merck).
F. Cara Kerja
1. Bahan tumbuhan
Kulit buah naga merah (
Hylocereus polyrhizus
) dipisahkan dengan
daging buahnya karena hanya kulit buahnya yang digunakan sebagai
sampel. Setelah itu, kulit buah naga merah dipotong kecil-kecil (± 5mm)
kemudian dikeringkan dengan bantuan sinar matahari dalam keadaan
tertutup kain hitam. Namun, dikarenakan kulit buah naga yang tidak
segera mengering maka dilanjutkan dengan pengeringan menggunakan
oven pada suhu 50
0C. Kulit buah naga merah yang sudah kering
dihaluskan dengan cara diblender sehingga didapatkan serbuk kering kulit
buah naga merah.
2.
Ekstraksi
Serbuk kering kulit buah naga merah (
Hylocereus polyrhizus
)
dimaserasi dengan etanol λ5% dengan perbandingan bahanμpelarut (1μ10)
selama 7 hari (5 hari maserasi dan 2 hari remaserasi) pada suhu kamar
dalam bejana kedap cahaya. Larutan ekstrak kemudian disaring dan
dipekatkan mengunakan
rotary evaporator
pada suhu 50
0C dilanjutkan
ekstrak etanolik kulit buah naga merah (
Hylocereus polyrhizus
)
(KBNM-EtOH).
3. Fraksinasi
KBNM-EtOH dilarutkan dalam campuran H
2O-MeOH (3μ7).
Selanjutnya, dilakukan fraksinasi cair-cair dengan etilasetat (
AcOEt
)
sehingga diperoleh fraksi metanol ekstrak etanolik kulit buah naga merah
(KBNM-MeOH) dan fraksi etilasetat ekstak etanolik kulit buah naga
merah (KBNM-
AcOEt
). Fraksi KBNM-
AcOEt
dipekatkan menggunakan
kompor listrik suhu 50
0C. Fraksi kental digunakan untuk melakukan
berbagai pengujian selanjutnya (Junior
et al.,
2013).
4. Analisis Kualitatif Flavonoid dengan Kromatografi Lapis Tipis (KLT)
Mula-mula bejana kromatografi dijenuhi dengan uap fase gerak
n-butanolμasam asetatμair (4μ1μ5 v/v, lapisan atas). Penjenuhan fase gerak
dilakukan dengan cara memasukkan kertas saring ke dalam bejana
kromatografi yang terisi fase gerak dalam keadaan tertutup rapat hingga
fase gerak mencapai ujung atas kertas saring. Plat KLT selulosa dioven
pada suhu 70°C selama 10 menit untuk menghilangkan kadar air.
Selanjutnya, standar kuersetin dan fraksi KBNM-
AcOEt
ditotolkan pada
plat KLT selulosa dengan menggunakan pipet kapiler pada jarak 1 cm dari
bagian bawah. Bercak penotolan dibiarkan hingga kering kemudian dielusi
dalam bejana kromatografi. Jarak elusi yang digunakan adalah 8 cm.
nm dan 366 nm sebelum dan setelah disemprot dengan pereaksi sitroborat
(Suhendi
et al
., 2011).
5. Penetapan Kuantitatif Kandungan Flavonoid Total
Kadar flavonoid total ditetapkan dengan cara khelasi AlCl
3.
Sebanyak 0,4 mL fraksi KBNM-
AcOEt
ditambahkan dengan 0,6 mL
aquadest dan 0,06 mL NaNO2 (5%). Larutan diinkubasi selama 6 menit
pada suhu kamar lalu ditambahkan 0,06 mL AlCl
3(10%), setelah 5 menit
kemudian tambahkan NaOH 0,4 mL (1mM). Selanjutnya absorbansi
diukur pada panjang gelombang 510 nm mengunakan spektrofotometer
UV-Vis. Replikasi dilakukan sebanyak 3 kali (Saini
et al
., 2011).
Kuersetin konsentrasi 400
,
800, 1200, 1600 dan 2000
μ
g /mL diuji
seperti prosedur diatas. Persamaan regresi linier kuersetin dibuat dari
hubungan antara konsentrasi dengan nilai absorbansi kuersetin. Persamaan
regresi ini digunakan untuk menghitung kadar flavonoid dalam sampel.
6. Analisis Kuantitatif Kandungan Fenolik Total
Kandungan fenolik total diuji menggunakan reagen Folin-Ciocalteu,
dimana sejumlah 400
L fraksi KBNM-
AcOEt
ditambahkan 3,16 mL
aquadest dan 200
L reagen Folin-Ciocalteu, dicampur hingga homogen.
Larutan digojog selama 6 menit. Selanjutnya, ditambahkan 600
L larutan
Na
2CO
32% untuk membentuk suasana basa dan dihomogenkan dengan
cara divortex (Talapessi
et al.
, 2013). Larutan didiamkan pada suhu kamar
dengan spektrofotometer UV-Vis. Replikasi dilakukan sebanyak 3 kali
(Junior
et al.,
2013).
Asam galat konsentrasi 10, 20, 30, 40, dan 50 µg/mL diuji seperti
prosedur diatas. Persamaan regresi linier asam galat dibuat dari hubungan
antara konsentrasi dengan nilai absorbansi asam galat. Persamaan regresi
ini digunakan untuk menghitung kadar fenol total larutan.
7. Uji Penangkapan Radikal Bebas DPPH
Fraksi KBNM-
AcOEt
(kadar 100, 200, 300, 400 dan 500 µg/mL)
masing-masing dicampur dengan 1 mL DPPH (2,2-difenil-1-pikrilhidrasil)
0,4 mM dilarutkan dalam larutan etanol hingga 5 ml. Larutan didiamkan
bereaksi pada temperatur ruangan dan gelap selama 30 menit. Absorbansi
masing-masing larutan dibaca pada panjang gelombang 518 nm
mengunakan spektrofotometer UV-Vis (Sumarny
et al
., 2014). Replikasi
dilakukan 2 kali dengan masing-masing absorbansinya diukur sebanyak 2
kali.
Nilai absorbansi yang didapat adalah absorbansi sampel, sedangkan
absorbansi kontrol adalah absorbansi yang didapatkan dari larutan yang
berisi 1 mL DPPH dalam 5 mL etanol. % inhibisi dihitung menggunakan
rumusμ
Persamaan regresi linier dibuat dari hubungan antara konsentrasi dan %
Kuersetin konsentrasi 1, 2, 3, 4, dan 5 µg/mL diuji seperti prosedur diatas
untuk dijadikan pembanding.
8.
Penetapan Panjang Gelombang Absorbsi Maksimum dan SPF
Untuk menetapkan panjang gelombang absorbsi maksimum
( maks), fraksi kental KBNM-
AcOEt
dilarutkan dalam etanol absolut
sehingga didapatkan seri kadar 5, 25, 50 dan 100 mg/L. Selanjutnya,
dilakukan
scanning
spektrofotometer UV-Vis pada panjang gelombang
antara 260-400 nm dengan interval 2 nm. Blanko yang digunakan adalah
etanol (Junior
et al.,
2013).
Tabel 5.Panjang gelombang dan nilai EE ( ) x I ( ) (Junioret al., 2013)
Panjang gelombang (nm)
EE x I
2λ0
0.0150
2λ5
0.0817
300
0.2874
305
0.3278
310
0.1864
315
0.083λ
320
0.0180
Total
1.0000
Panjang gelombang maksimum yang didapatkan selanjutnya
disesuaikan dengan nilai EE x I yang sudah ditentukan oleh Sayre
et al
.
(1λ7λ) (Tabel 5). Nilai SPF dihitung menggunakan rumus yang telah
dikembangkan oleh Mansur
et al
. (1λ86) yaitu (Dutra, 2004)μ
SPF
Spektrofotometrik= CF x Σ
2λ0-320EE ( ) x I ( ) x Abs ( )
Keteranganμ
EE ( )
μ Spektrum efek erythemal
I ( )
μ Spektrum intensitas matahari
CF
μ Faktor koreksi (= 10)
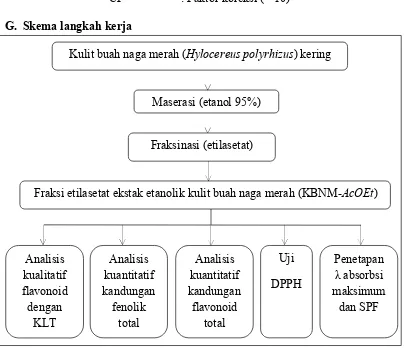
G. Skema langkah kerja
H. Analisis data
Daya antioksidan dilihat dari nilai IC
50yang dihitung dengan
menggunakan persamaan regresi linier yang didapatkan dari hubungan antara
konsentrasi sampel ( g/mL) dengan % inhibisi, sedangkan daya fotoprotektif
dilihat dari nilai SPF ekstrak etanolik kulit buah naga merah (
Hylocereus
[image:47.595.112.516.122.470.2]polyrhizus
) fraksi etilasetat yang didapatkan dari perhitungan rumus SPF.
Gambar 6.Skema langkah kerja
Kulit buah naga merah (
Hylocereus polyrhizus
) kering
Maserasi (etanol λ5%)
Fraksinasi (etilasetat)
Fraksi etilasetat ekstak etanolik kulit buah naga merah (KBNM-
AcOEt
)
Analisis
kuantitatif
kandungan
fenolik
total
Penetapan
absorbsi
maksimum
dan SPF
Uji
DPPH
Analisis
kuantitatif
kandungan
flavonoid
total
Analisis
kualitatif
flavonoid
dengan
33
BAB IV
HASIL DAN PEMBAHASAN
A. Penyiapan sampel
Kulit buah naga merah (Hylocereus polyrhizus) dalam keadaan basah
yang didapatkan dari 20 kg buah naga merah utuh adalah sebanyak 7 kg.
Kulit buah naga merah ini dipotong menjadi ukuran yang lebih kecil (± 5mm)
untuk mempercepat proses pengeringan (Sudewo, 2009). Proses pengeringan
bertujuan untuk menghentikan proses enzimatik yang mungkin masih bisa
terjadi, sehingga degradasi zat aktif dapat dikurangi. Pengeringan dilakukan
dengan bantuan sinar matahari dalam keadaan tertutup kain hitam
dikarenakan kain hitam dapat menyerap sinar ultraviolet sehingga UV
protektor dari kulit buah naga merah tidak mengalami kerusakan akibat
paparan sinar matahari (Nuria et al., 2009).
Pengeringan dilanjutkan dengan bantuan oven pada suhu 50oC. Suhu
yang digunakan merupakan suhu yang tidak merusak senyawa flavonoid. Hal
ini dikarenakan menurut Chet (2009), pemanasan yang dilakukan pada suhu
80oC dapat merusak senyawa flavonoid. Setelah proses pengeringan,
didapatkan kulit buah naga merah sebanyak 470 gram.
Kulit buah naga merah yang sudah kering diekstraksi dengan etanol
95%. Menurut Chaiwut et al. (2012), ekstraksi kulit buah naga menggunakan
pelarut etanol 95% akan menghasilkan kapasitas antioksidan tertinggi dengan
34
mgGAE/g sampel) dibanding menggunakan pelarut etanol 50% dan air.
Perbandingan serbuk dengan pelarut yang digunakan adalah 1:10. Menurut
Handayani et al. (2016), perbandingan ini merupakan rasio terbaik untuk
mendapatkan kadar fenol, kadar flavonoid dan aktivitas antioksidan (IC50)
paling besar.
Ekstrak kental etanolik kulit buah naga merah (Hylocereus polyrhizus)
(KBNM-EtOH) yang didapatkan adalah sebanyak 19,273 gram. Ekstrak
kental KBNM-EtOH yang digunakan untuk fraksinasi cair-cair hanya
sebanyak 5,046 gram. Fraksinasi cair-cair dilakukan untuk memisahkan
senyawa yang bersifat polar dengan senyawa yang bersifat semi polar dalam
ekstrak kental KBNM-EtOH. Senyawa yang bersifat polar (seperti betasianin
dan antosianin) akan tertarik ke dalam pelarut campuran H2O-MeOH,
sedangkan senyawa yang bersifat semipolar (senyawa flavonoid seperti
flavon dan flavonol) akan tertarik ke dalam pelarut etilasetat (AcOEt)
(Indriasari, 2012; Pranata, 2013; Budilaksono et al., 2014).
Ketika proses fraksinasi, fraksi campuran H2O-MeOH ekstrak etanolik
kulit buah naga merah (KBNM-MeOH) berada pada lapisan atas, sedangkan
fraksi etilasetat ekstrak etanolik kulit buah naga merah (KBNM-AcOEt)
berada pada lapisan bawah karena pelarut etilasetat memiliki massa jenis
yang lebih besar. Fraksi kental KBNM-AcOEt yang diperoleh adalah
sebanyak 2,886 gram. Oleh karena itu, dari hasil perhitungan didapatkan nilai
rendemen fraksi kental KBNM-AcOEt terhadap kulit buah naga kering
35
B. Analisis Kualitatif Flavonoid dengan Kromatografi Lapis Tipis (KLT)
Kromatografi merupakan suatu teknik pemisahan yang menggunakan
fase diam dan fase gerak (Gandjar dan Abdul Rohman, 2012). Fase gerak
yang digunakan adalah n-butanol:asam asetat:air (4:1:5) dan fase diam yang
digunakan adalah selulosa. Pembanding yang digunakan pada uji KLT ini
adalah kuersetin (salah satu golongan flavonoid). Campuran n-butanol:asam
asetat:air yang diambil untuk fase gerak adalah pada lapisan atas karena pada
lapisan ini mengandung air dan asam asetat yang terdispersi dalam n-butanol.
Selulosa dipilih sebagai fase diam dikarenakan fase diam yang lain
seperti silika dapat menyebabkan terbentuknya kompleks antara senyawa
flavonoid yang banyak mengandung gugus –OH dengan logam CaSO4 pada
silika. Fase gerak yang bersifat polar dan fase diam yang bersiat non polar
mengakibatkan senyawa flavonoid (kuersetin) akan lebih tertarik pada fase
gerak (Christinawati, 2007). Berikut adalah hasil uji KLT yang diamati
dibawah sinar tampak, UV 254 nm, UV 366 nm sebelum dan setelah
[image:50.612.202.440.517.688.2]disemprot pereaksi sitroborat:
Gambar 7. Hasil uji KLT(A) Fraksi KBNM-AcOEt (B) Kuersetin
Sinar tampak UV 254 nm UV 366 nm
sebelum disemprot
36
Kandungan flavonoid (kuersetin) pada fraksi KBNM-AcOEt dapat
diketahui apabila nilai Rf fraksi KBNM-AcOEt sama dengan nilai Rf
kuersetin. Berdasarkan hasil perhitungan, nilai Rf fraksi KBNM-AcOEt
adalah 0,9812, sedangkan Rf kuersetin adalah 0,855 (Lampiran 3). Hal ini
[image:51.612.152.505.254.338.2]menunjukkan bahwa kedua nilai Rf berbeda.
Tabel 6. Warna tiap bercak sampel uji pada Plat KLT (A) Fraksi KBNM-AcOEt (B) Standard Kuersetin
Sampel Sinar
tampak
UV 254 nm
UV 366 nm sebelum disemprot
sitroborat
UV 366 nm setelah disemprot
sitroborat
A Kun