PENGARUH KEASAMAN (pH), WAKTU TERHADAP
TEBAL LAPISAN DAN KECERAHAN PERMUKAAN PADA
PELAPISAN EMAS TERHADAP TEMBAGA
TESIS
Oleh
FRIDAYUNI LESTARI SIREGAR
087026028/ FIS
PROGRAM PASCASARJANA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PENGARUH KEASAMAN, WAKTU TERHADAP
TEBAL LAPISAN DAN KECERAHAN PERMUKAAN PADA
PELAPISAN EMAS TERHADAP TEMBAGA
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh
gelar Magister Sains dalam Program Studi
Magister Ilmu Fisika pada Program Pascasarjana
Fakultas MIPA Universitas Sumatera Utara
Oleh
FRIDAYUNI LESTARI SIREGAR
087026028/FIS
PROGRAM PASCASARJANA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PENGESAHAN TESIS
Judul Tesis : PENGARUH KEASAMAN, WAKTU TERHADAP TEBAL LAPISAN DAN KECERAHAN PERMUKAAN PADA PELAPISAN EMAS TERHADAP TEMBAGA
Nama Mahasiswa : FRIDAYUNI LESTARI SIREGAR Nomor Induk Mahasiswa : 087026028
Program studi : Magister Fisika
Fakultas : Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Menyetujui Komisi Pembimbing
Prof. Dr. Eddy Marlianto, M.Sc Prof. Basuki Wirjosentono, MS, Ph.D
Ketua Anggota
Ketua Program Studi, Dekan, Magister Ilmu Fisika
PERNYATAAN ORISINALITAS
PENGARUH KEASAMAN, WAKTU TERHADAP
TEBAL LAPISAN DAN KECERAHAN PERMUKAAN PADA
PELAPISAN EMAS TERHADAP TEMBAGA
T E S I S
Dengan ini saya nyatakan bahwa saya mengakui semua karya tesis ini adalah hasil kerja saya sendiri kecuali kutipan dan ringkasan yang tiap satunya telah dijelaskan sumbernya dengan benar.
Medan, Juni 2010
PERNYATAAN PERSETUJUAN PUBLIKASI
KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademika Universitas Sumatera Utara, saya yang bertanda tangan dibawah ini :
N a m a : FRIDAYUNI LESTARI SIREGAR
N I M : 087026028
Program Studi : Magister Fisika Jenis Karya Ilmiah : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non–Eksklusif (Non Exclusive Royalty Free Right) atas Tesis saya yang berjudul :
PENGARUH KEASAMAN, WAKTU TERHADAP TEBAL LAPISAN DAN KECERAHAN PERMUKAAN PADA
PELAPISAN EMAS TERHADAP TEMBAGA
Beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Non-Eksklusif ini. Universitas Sumatera Utara berhak menyimpan, mengalih media, memformat, mengelola dalam bentuk data-base, merawat dan mempublikasikan Tesis saya tanpa meminta izin dari saya sealam tetap mencantumkan nama saya sebagai penulis dan sebagai pemegang dan atau sebagai pemilik hak cipta.
Demikian pernyataan ini dibuat dengan sebenarnya.
Medan, Juni 2010
RIWAYAT
HIDUP
DATA PRIBADI
Nama lengkap berikut gelar : FRIDAYUNI LESTARI SIREGAR, S.Pd Tempat dan tanggal lahir : Medan, 05 Juni 1981
Alamat Rumah : Jl. Kiwi xxv No. 555 Perumnas Mandala Medan No. Hp : 081367503439
e–mail : fridayuni81@gmail.com
Instansi Tempat Bekerja : SMA UISU Medan
Alamat Kantor : Jl. H. Bahrum Jamil, SH. Gg. UISU No. 2 Medan
Telepon : 061-7867984
DATA PENDIDIKAN
7
Telah diuji pada Tanggal : 22 Juni 2010
PANITIA PENGUJI TESIS
Ketua : Prof. Dr. Eddy Marlianto, M.Sc
KATA PENGANTAR
Pertama-tama penulis panjatkan puji syukur kehadirat Allah SWT atas segala limpahan rahmat dan karunia-Nya sehingga tesis ini dapat diselesaikan.
Penulis ucapkan terima kasih sebesar-besarnya kepada Pemerintah Republik Indonesia c.q. Pemerintah Provinsi Sumatera Utara yang telah memberikan bantuan dana sehingga kami dapat melaksanakan Program Magister Sains pada Program Studi Magister Imu Fisika Program Pascasarjana FMIPA Universitas Sumatera Utara.
Dengan selesainya tesis ini, perkenankanlah penulis mengucapkan terima kasih yang sebesar-besarnya kepada :
Rektor Universitas Sumatera Utara, Prof. Dr. dr. Syahril Pasaribu, DTM&H, M.Sc (CTM),Sp.A(K) atas kesempatan yang diberikan kepada penulis untuk mengikuti dan menyelesaikan pendidikan Program Magister Sains.
Dekan Fakultas MIPA Universitas Sumatera Utara, Prof. Dr. Eddy Marlianto,M.Sc atas kesempatan menjadi mahasiswa Program Magister Sains pada Program Pascasarjana FMIPA Universitas Sumatera Utara.
Ketua Program Studi Magister Fisika, Prof. Dr. Eddy Marlianto,M.Sc Sekretaris Program Studi Fisika, Drs. Nasir Saleh, M. Eng. Sc beserta seluruh Staf Pengajar pada Program Studi Magister Fisika Program Pascasarjana Fakultas MIPA Universitas Sumatera Utara.
Terimakasih yang tak terhingga dan penghargaan setinggi-setingginya penulis ucapkan kepada Prof. Dr. Eddy Marlianto,M.Sc selaku Pembimbing Utama yang dengan penuh perhatian dan telah memberikan dorongan, bimbingan dan arahan, demikian juga kepada Prof. Basuki Wirjosentono,MS. Ph.D selaku Pembimbing Lapangan yang dengan penuh kesabaran menuntun dan membimbing penulis hingga selesainya penelitian ini.
Kepada Ayah H. Herman L Siregar,BSc,M.Pd dan Bunda Dra. Tati Rostiati Nst (Almh) dan juga Ibunda Hj. Wan Fatimah, SH serta suami tersayang M. Alekson Siahaan dan anak-anakku tercinta Rahmad Angga Nugraha Siahaan dan Raiqah Salsabila Siahaan. Kepada orang-orang yang penulis sayangi Dwi Harwita Sari Siregar,S.Pd (Adinda), Sertu Darmawansyah Putra Siregar (Adinda), Salman Paris Altobelli Siregar (Sepupu). Terima kasih atas segala pengorbanan kalian baik berupa moril maupun materil, dan ucapan terimakasih yang tulus penulis sampaikan kepada rekan-rekan Mahasiswa Sekolah Pasca Sarjana Program Studi Magister Ilmu Fisika Universitas Sumatera Utara angkatan 2008-2009 yang telah memberikan semangat dan dukungan kepada penulis selama dalam pendidikan dan penulisan tesis ini budi baik ini tidak dapat dibalas hanya diserahkan kepada Allah SWT.
PENGARUH KEASAMAN, WAKTU TERHADAP
TEBAL LAPISAN DAN KECERAHAN PERMUKAAN PADA
PELAPISAN EMAS TERHADAP TEMBAGA
ABSTRAK
Elektroplating merupakan suatu proses pelapisan logam pada elektroda yang bertujuan membentuk permukaan yang memiliki sifat yang berbeda dengan sifat logam dasarnya, logam yang dilapisi adalah logam tembaga karena mudah dibentuk menjadi perhiasan, alat-alat untuk keperluan industri dan alat-alat dekoratif lainnya. Logam pelapis yang digunakan pada penelitian ini adalah emas. Dalam pelapisan ini digunakan tegangan dan arus konstan serta waktu yang tetap dengan perubahan pada pH larutan mulai dari pH 4,5 sampai dengan ph 6,5, karena pelapisan yang terjadi adalah pada suasana larutan asam moderat. Hasil penelitian menunjukkan hasil paling baik diperoleh pada keasaman larutan pH sekitar 5,6 dan pH 5,7, sementara pada nilai pH yang lainnya memberikan hasil yang tidak optimum.
TIME AND pH INFLUENCE ON SURFACE BRIGHTNESS
AND THICKNESS ON COPPER GOLD ELECTROPLATING
ABSTRACT
Electroplating is a metal coat electrodeposition on electrode which aim to form a new surface with a new characteristics that totally different to its original metal. The metal at this experiment was copper because this metal can be easily to be formed to be coming an ornament, jewelry, or for industrial appliance purposes, etc. The metal coater at this work was gold. At this electroplating a constant voltage and current at a certain time is used with a variance in pH solution with vary from pH 4,5 to pH 6,5, this is done because the plating should be done in moderate acid in order to established a good coating. This work to a result that the optimum surface was achieved when the pH of the solution is about pH5,6 to pH 5,7, while others shows a lack perfomances.
DAFTAR ISI
Halaman
KATA PENGANTAR i
ABSTRAK ii ABSTRACT iii
DAFTAR ISI iv
DAFTAR TABEL vi
DAFTAR GAMBAR vii
BAB I PENDAHULUAN 1
1.1 Latar Belakang 1
1.2 Perumusan Masalah 4
1.3 Tujuan Penelitian 5
1.4 Manfaat Penelitian 5
1.5 Batasan Masalah 5
BAB II TINJAUAN PUSTAKA 7
2.1 Proses Elektroplating 7
2.1.1 Elektroplating Pada Tembaga 8
2.2 Elektrolit 12
2.3 Anoda 12
2.4 Katoda 13
2.5 Korosi 13
2.6 Faktor Faktor Yang Mempengaruhi Elektroplating 14
BAB III METODOLOGI PENELITIAN 16
3.1 Tempat dan Waktu Penelitian 16
3.2 Bahan dan Alat Penelitian 16
3.2.1 Bahan Penelitian 16
3.2.2 Alat Penelitian 16
3.3 Proses Elektroplating 18
3.4 Cara Kerja Pada Pelapisan 19
3.5 Diagram Alir 22
BAB IV HASIL DAN PEMBAHASAN 23
4.1 Ruang Pelapisan 23
4.2 Peralatan Secara Keseluruhan 24
4.3 Prosedur Pengoperasian 25
4.4 Pemeriksaan Parameter Untuk Larutan 26
4.5 Pengaturan Pada Instrument 30
4.6 Data dan Hasil Pengukuran 33
4.7 Cara Pengukuran Ketebalan Lapisan 37
BAB V KESIMPULAN DAN SARAN 45
5.1 Kesimpulan 45
5.2 Saran 45
DAFTAR TABEL
Nomor
Tabel J u d u l Halaman
1. Larutan Emas Untuk Keperluan Elektroplating 4
2. Pengelompokan Umum Pelapisan Emas 4
4.1 Hasil Pengukuran Pada pH 5,7 33
4.2 Hasil Pengukuran Pada pH 4,7 35
DAFTAR GAMBAR
Nomor
Gambar J u d u l Halaman
1.1 Skema Dasar Elektroplating 5
2.1 Skema Dasar Pelapisan Logam 8
3.1 Sketsa Dasar Proses Elektroplating 18
4.1 Ruang Pelapisan dan Kaca Pelindung 23
4.2 Peralatan Pendukung Secara Keseluruhan 24
4.3 Instrumen Pengatur Elemen Pemanas 25
4.4 Instrumen Pengatur Temperatur 25
4.5 Pengaturan Tinggi Larutan Dalam Bak Pelapisan 26 4.6 Termometer Internal Untuk Menampilkan Temperatur Larutan 26 4.7 Pengukuran pH Sebelum Pelapisan Dimulai 27
4.8 Katoda 27
4.9 Katoda Dengan Penjepit Bahan 28
4.10 Proses Pemasangan Sumber Arus Listrik 28
4.11 Penyambungan Elektroda Katoda 29
4.12 Penyambungan Kabel-Kabel Luar Ke Instrumentasi Sumber Arus
29
4.13 Pemasangan Arus Dengan Penjepit Ke Elektroda 29
4.14 Instrumen Pengatur Arus Dan Tegangan 30
4.15 Ketelitian Perubahan Arus Dan Tegangan Adalah 1 millivolt 30
4.16 Pengaturan Pulsa 31
4.17 Pengaturan Arus dan Waktu 31
viii
4.19 Ruang Pencucian Bahan yang Sudah Dilapis 32
4.20 Grafik Data Optimum 34
4.21 Cara Menentukan Tebal Lapisan 37
4.22 Waktu Pelapisan 5 menit 38
4.23 Waktu Pelapisan 10 menit 39
4.24 Waktu Pelapisan 15 menit 40
4.25 Waktu Pelapisan 20 menit 41
4.26 Waktu Pelapisan 25 menit 42
PENGARUH KEASAMAN, WAKTU TERHADAP
TEBAL LAPISAN DAN KECERAHAN PERMUKAAN PADA
PELAPISAN EMAS TERHADAP TEMBAGA
ABSTRAK
Elektroplating merupakan suatu proses pelapisan logam pada elektroda yang bertujuan membentuk permukaan yang memiliki sifat yang berbeda dengan sifat logam dasarnya, logam yang dilapisi adalah logam tembaga karena mudah dibentuk menjadi perhiasan, alat-alat untuk keperluan industri dan alat-alat dekoratif lainnya. Logam pelapis yang digunakan pada penelitian ini adalah emas. Dalam pelapisan ini digunakan tegangan dan arus konstan serta waktu yang tetap dengan perubahan pada pH larutan mulai dari pH 4,5 sampai dengan ph 6,5, karena pelapisan yang terjadi adalah pada suasana larutan asam moderat. Hasil penelitian menunjukkan hasil paling baik diperoleh pada keasaman larutan pH sekitar 5,6 dan pH 5,7, sementara pada nilai pH yang lainnya memberikan hasil yang tidak optimum.
TIME AND pH INFLUENCE ON SURFACE BRIGHTNESS
AND THICKNESS ON COPPER GOLD ELECTROPLATING
ABSTRACT
Electroplating is a metal coat electrodeposition on electrode which aim to form a new surface with a new characteristics that totally different to its original metal. The metal at this experiment was copper because this metal can be easily to be formed to be coming an ornament, jewelry, or for industrial appliance purposes, etc. The metal coater at this work was gold. At this electroplating a constant voltage and current at a certain time is used with a variance in pH solution with vary from pH 4,5 to pH 6,5, this is done because the plating should be done in moderate acid in order to established a good coating. This work to a result that the optimum surface was achieved when the pH of the solution is about pH5,6 to pH 5,7, while others shows a lack perfomances.
BAB I
PENDAHULUAN
1.1.Latar Belakang
Sekitar abad ke 19 pelapisan tembaga dengan emas banyak dilakukan orang, baik secara manual maupun secara listrik terhadap benda-benda logam. Pelapisan logam dapat berupa lapis seng (zinc), galvanis, perak, emas, brass, tembaga, nikel dan krom. Penggunaan lapisan tersebut disesuaikan dengan kebutuhan dan kegunaan masing-masing material. Perbedaan utama dari pelapisan tersebut selain anoda yang digunakan, adalah larutan elektrolisisnya. Proses electroplating mengubah sifat fisis, mekanik, dan sifat teknologi suatu material. Salah satu contoh perubahan fisik ketika material dilapis dengan nikel adalah bertambahnya daya tahan material tersebut terhadap korosi, serta bertambahnya kapasitas konduktifitasnya. Adapun dalam sifat mekanik, terjadi perubahan kekuatan tarik maupun tekan dari suatu material sesudah mengalami pelapisan dibandingkan sebelumnya. Karena itu, tujuan pelapisan logam tidak luput dari tiga hal, yaitu untuk meningkatkan sifat teknis/mekanis dari suatu logam, yang kedua melindungi logam dari korosi, dan ketiga memperindah tampilan (decorative). (Hunt, 1973, 1991; Weisberg, 1974, 1993, 1997).
Berdasarkan sifat tembaga yang mudah dibentuk baik dengan panas maupun dingin maka peneliti mengadakan penelitian tentang proses pelapisan tembaga dengan emas secara elektroplating.
meninggalkan noda hijau atau hitam dikulit. Karena tembaga sebagai logam penghantar arus dan panas yang baik cocok dijadikan perhiasan (Foulke, 1974; Weisberg, 1997; Okinaka, 2000).
Untuk memperoleh hasil pelapisan emas pada tembaga yang baik dan tahan lama memerlukan waktu kurang lebih 25 menit dan sifat keasaman sekitar pH 6, kuat arus yang dibutuhkan kurang lebih 150 mA s.d 500 mA.
Pelapisan tembaga dengan emas mempergunakan waktu lama lebih besar dari 25 menit tingkat kecerahan lapisan kurang baik (agak kehitaman) dan pH yang diperlukan pada proses pelapisan berkisar 6 < pH < 6 hasil iluminasi cahaya tidak cerah. (Lowenheim, 1978).
Metode perlindungan anti korosi ini memiliki potensi aplikasi yang sangat luas. Semua komponen (polielektrolit dan inhibitor) dapat disesuaikan untuk berbagai permukaan aplikasi. Sistem pelapisan baru ini dapat diaplikasikan dalam dirgantara, otomotif, industri maritim dan bidang lainnya yang rentan terhadap kerusakan akibat korosi, seperti pipa gas dan minyak. Dalam teknologi pengerjaan logam, proses electroplating dikategorikan sebagai proses pengerjaan akhir (metal finishing). Secara sederhana, electroplating dapat diartikan sebagai proses pelapisan logam, dengan menggunakan bantuan arus listrik dan senyawa kimia tertentu guna memindahkan partikel logam pelapis ke material yang hendak dilapis.
pengaturan rapat arus dan temperature larutan yang moderate, akan diperoleh jumlah produksi yang memadai dan menguntungkan. (Nosal Pratama, 2009).
1.2.Perumusan Masalah
Bagaimana pengaruh pH pada larutan untuk mengerjakan pelapisan emas baik alloy emas untuk keperluan perhiasan maupun untuk keperluan benda-benda seni, termasuk cara kontak listrik maupun pemilihan elektroda dan konektornya. Secara umum pelapisan emas dapat dibagi empat bagian seperti pada tabel 1. Larutan emas untuk keperluan pelapisan emas juga terbagi atas empat bagian utama seperti pada tabel 1. (Weisberg, 1993) berikut ini:
Tabel 1. Larutan emas untuk keperluan elektroplating
Group Larutan
Group 1 Emas Sianida basa dengan pH > 10, untuk Class A, B, C, dan D Group 2 Emas Sianida netral dengan pH 6 s/d 9, untuk Class D dan G Group 3 Emas Sianida asam dengan pH 3,5 s/d 5, untuk alloy emas Group 4 Emas Non Sianida untuk pelapisan perhiasan emas
Tabel 2 berikut ini adalah keterangan tambahan untuk tabel 1 diatas. Tabel 2. Pengelompokan umum pelapisan emas (Weisberg, 1993).
Class A Pelapisan emas untuk keindahan 24k Class B Pelapisan emas alloy untuk keindahan
Class C Pelapisan emas alloy dengan warna C-1 dan C-2
Class D Untuk keperluan industri elektronika dengan emas lunak kemurnian tinggi
Class E Untuk keperluan industri elektronika dengan emas keras dengan kemurnian 99.5 %
Class F Untuk keperluan industri elektronika dengan emas alloy Class G Untuk keperluan perbaikan dan keperluan umum
1.3.Tujuan Penelitian
Penelitian ini bertujuan untuk menghasilkan teknik pelapisan emas sederhana dengan larutan dasar yang ramah lingkungan dengan hasil pelapisan emas yang berkilau dan tahan untuk keperluan perhiasan berkualitas dan murah. Larutan elektrolit tidak perlu dibuang, hanya perlu penambahan asam untuk mengatur pH jika diperlukan, sehingga tidak menimbulkan banyak limbah.
1.4.Manfaat Penelitian
Penelitian ini diharapkan memberikan manfaat untuk menghasilkan suatu teknik elektroplating yang sederhana dengan kualitas yang baik untuk dapat digunakan pada masyarakat umum dengan resiko rendah dan aman terhadap lingkungan.
1.5.Batasan Masalah
Pelapisan emas secara elektroplating dilakukan dalam larutan kimia dengan pengaturan pH. Variasi dilakukan dengan nilai pH 4,5 sampai dengan 6,5 untuk menghasilkan pelapisan emas yang diperlukan, karena pelapisan dikerjakan dalam suasana asam yang moderate.
a b
BAB II
TINJAUAN PUSTAKA
Pelapisan logam tidak mulia dengan logam tidak mulia merupakan dasar praktek dalam melakukan pelapisan logam dengan emas pada industri pelapisan, merupakan dasar dalam pelapisan secara elektro_kimia. Pelapisan dari bentuk dasar uap sampai kepada pelapisan dalam bentuk dasar larutan, kedua-duanya membutuhkan perpindahan logam emas secara ion untuk sampai ke permukaan untuk membentuk lapisan tipis ataupun kristalisasi. Plating dari logam dalam larutan logam juga dikenal sebagai elektro_kristalisasi (Lyons Jr. 1974; Bard dan Faulkner, 1980; Ritchie et al. 1999). Ada tiga bentuk proses elektrokima yang dikenal yaitu electro_plating, immersion_plating, dan elektroless_plating.
2.1. Proses Elektroplating
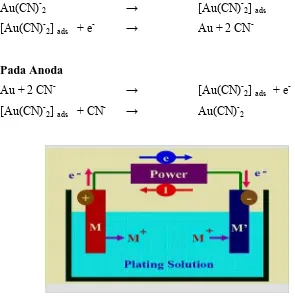
Kemajuan pelapisan emas dengan menggunakan larutan pada umumnya menggunakan Au(I) complex dalam larutan basa Cyanida dengan pH sekitar 12.2 akan menghasilkan Au(CN)-2 dengan bentuk menengah (MacArthur, 1972). Proses secara elektro kimia yang terjadi pada elektroda dapat dijelaskan sebagai berikut:
Pada katoda
Au(CN)-2 → [Au(CN)-2] ads [Au(CN)-2] ads + e- → Au + 2 CN-
Pada Anoda
-Gambar 2.1. Skema dasar pelapisan logam
Emas teroksidasi menjadi [Au(CN)-2] ads pada tegangan listrik kurang dari -0.6 volt (Cathro dan Koch, 1964), dan menjadi pasif pada -0.3 volt. Elektro_plating disimpulkan sebagai pelapisan emas dengan pengaruh utama adalah atas dasar tegangan dan arus listrik dengan bantuan larutan secara kimia, sementara elektro_kimia adalah pelapisan emas secara kimia dengan bantuan arus listrik. Secara sederhana elektroplating adalah pelapisan tipis pada permukaan suatu logam dengan hasil mengubah sifat-sifat permukaan tersebut, dengan tujuan untuk mencapai suatu ketahanan terhadap gesekan, karat, maupun kehantaran listrik dari logam tersebut.
2.1.1. Elektroplating Pada Tembaga
sebagai kation. Kutub negatif juga mengeluarkan ion, bergerak menuju anoda dan disebut sebagai anion. Larutannya disebut elektrolit.
Hubungan antara voltase dalam elektrolit dan kekuatan arus listrik yang mengalir ditunjukkan oleh hukum Ohm yaitu :
I = V/ R
Dimana I = arus listrik (ampere) V = tegangan listrik (volt) R = Hambatan (ohm)
Besarnya listrik yang mengalir yang dinyatakan dengan Coulomb adalah sama dengan arus listrik dikalikan dengan waktu. Dalam pemakaian secara umum atau dalam pemakaian elektroplating satuannya adalah ampere-jam (Ampere-hour) yang besarnya 3600 coulomb, yaitu sama dengan listrik yang mengalir ketika arus listrik sebesar 1 ampere mengalir selama 1 jam.
Michael Faraday pada tahun 1833 menetapkan hubungan antara kelistrikan dan ilmu kimia pada semua reaksi elektrokimia. Dua hukum Faraday ini adalah :
1. Hukum I : Jumlah dari tiap elemen atau grup dari elemen-elemen yang dibebaskan pada kedua anoda dan katoda selama elektrolisa sebanding dengan jumlah listrik yang mengalir dalam larutan. 2. Hukum II : Jumlah dari arus listrik bebas sama dengan jumlah ion atau jumlah
substansi ion yang dibebaskan dengan memberikan sejumlah arus listrik adalah sebanding dengan berat ekivalennya.
dengan berat 1 elektrokimia. Untuk menentukan logam yang terdeposisi dengan arus dan waktu dapat ditentukan :
1 Faraday = ampere detik/ 96500
Langkah selanjutnya adalah mengalihkan bilangan Faraday dengan bilangan gram yang diendapkan oleh arus listrik sebesar 1 Faraday yaitu:
G = (I x t)/96500 x (Ar/Mr) / Valensi G = berat logam yang terdeposisi (gram) I = rapat arus (ampere)
T = waktu (detik)
Ar/Mr = massa atom / molekul relatif
Untuk menentukan tebal pelapisan yang terjadi perlu diketahui berat jenis dari logam yang terlapis pada katoda. Hubungan berat jenis dengan harga-harga yang lainnya adalah sebagai berikut :
Volume (cc) = berat endapan (gram) / berat jenis
Efisiensi plating pada umumnya dinyatakan sebagai efisiensi arus anoda maupun katoda. Efisiensi katoda yaitu arus yang digunakan untuk pengendapan logam pada katoda dibandingkan dengan total arus masuk. Arus yang tidak dipakai untuk pengendapan digunakan untuk penguraian air membentuk gas hidrogen, hilang menjadi panas atau pengendapan logam-logam lain sebagai impuritas yang tak diinginkan. Efisiensi anoda yaitu perbandingan antara jumlah logam yang terlarut dalam elektrolit dibanding dengan jumlah teoritis yang dapat larut menurut Hukum Faraday.Kondisi plating yang baik bila diperoleh efisiensi katoda sama dengan efisiensi anoda, sehingga konsentrasi larutan bila menggunakan anoda aktif akan selalu tetap.
listrik, larutan yang tidak homogen dan elektrolisis air merupakan beberapa penyebab rendahnya efisiensi.
Elektrolisis air merupakan reaksi samping yang menghasilkan gas hidrogen pada katoda dan gas oksigen pada anoda.Reaksi elektrolisis air dapat dituliskan sebagai berikut :
Anoda (+) : 2H+ + 2e → H2
Katoda (-) : 4OH- → 2H2O + O2 + 4e
: 4H+ + 4OH - → 2H2O + H2 + O2
Secara praktis efisiensi plating dinyatakan sebagai perbandingan berat nyata terhadap berat teoritis endapan pada katoda.
Apabila logam dimasukkan pada larutan yang mengandung ionnya sendiri akan menimbulkan beda potensial antara logam tersebut dengan larutan. Beda potensial ini disebabkan karena atom dari logam untuk menjadikan satu atau lebih muatan negatif dan lepas ke dalam larutan dalam bentuk ion.
Pada saat yang bersamaan terjadi reaksi kebalikan dalam larutan. Dua reaksi yang berlawanan tersebut berlangsung pada kecepatan yang tidak sama, maka potensial ini akan diatur oleh permukaan logam dan elekrolit yang berhubungan dengan permukaan logam. Akhirnya kondisi setimbang tercapai dimana ionisasi dan pelepasan berlangsung tepat pada kecepatan yang sama. Kesetimbangan ini disebut dengan potensial kesetimbangan atau potensial bolak-balik pada partikel logam pada laruan yang dipergunakan.
Potensial elektroda standar berdasarkan skala hidrogen, dimana semua logam-logam sebelum hidrogen pada skala hidrogen mampu menggantikan hidrogen dari larutan yang mengandung ion hidrogen, dan logam-logam setelah hidrogen pada skala hidrogen biasanya tidak dapat menggantikan hidrogen secara langsung.
kebalikan dari ketiga logam diatas adalah logam mulia seperi tembaga, perak dan emas ditunjukkan oleh tanda potensial positif.
2.2. Elektrolit
Elektrolit adalah suatu zat yang larut atau terurai ke dalam bentuk ion-ion dan selanjutnya larutan, larutan adalah campuran homogen yang terdiri dari dua atau lebih zat. Zat yang jumlahnya lebih sedikit di dalam larutan disebut (zat) terlarut atau solut, sedangkan zat yang jumlahnya lebih banyak daripada zat-zat lain dalam larutan disebut pelarut atau solven. Komposisi zat terlarut dan pelarut dalam larutan dinyatakan dalam konsentrasi larutan, sedangkan proses pencampuran zat terlarut dan pelarut membentuk larutan disebut pelarutan atau solvasi. menjadi konduktor elektrik, konduktor elektrik adalah material yang dapat menghantarkan arus listrik dengan mudah. ion-ion merupakan atom-atom bermuatan elektrik. Elektrolit bisa berupa air, asam, basa atau berupa senyawa kimia lainnya. Elektrolit umumnya berbentuk asam, basa atau garam. Beberapa gas tertentu dapat berfungsi sebagai elektrolit pada kondisi tertentu misalnya pada suhu tinggi atau tekanan rendah. Elektrolit kuat identik dengan asam, basa, dan
garam kuat. Elektrolit merupakan senyawa yang berikatan ion dan kovalen polar. Sebagian besar senyawa yang berikatan ion merupakan elektrolit sebagai contoh ikatan ion NaCl yang merupakan salah satu jenis garam yakni garam dapur. NaCl dapat menjadi elektrolit dalm bentuk larutan dan lelehan. atau bentuk liquid dan aqueous. sedangkan dalam bentuk solid atau padatan senyawa ion tidak dapat berfungsi sebagai elektrolit.
2.3 Anoda
Anoda adalah elektroda, elektroda adalah konduktor yang digunakan untuk bersentuhan dengan bagian atau media non-logam dari sebuah sirkuit (misal
lain, pada sel elektrokimia yang terpolarisasi jika arus listrik mengalir ke dalamnya. Arus listrik mengalir berlawanan dengan arah pergerakan elektron. Pada proses
elektrokimia, baik sel galvanik (baterai) maupun sel elektrolisis, anoda mengalami
oksidasi.
2.4. Katoda
Katoda adalah elektroda dalam sel elaktrokimia yang terpolarisasi jika arus listrik mengalir keluar darinya. Pada baterai biasa (Baterai Perak-Seng), yang menjadi katoda adalah seng, yang juga menjadi pembungkus baterai. Sedangkan, pada baterai alkalin, yang menjadi katoda adalah mangan dioksida (MnO2).
2.5. Korosi
Korosi adalah kerusakan atau degradasi logam, logam adalah Dalam kimia, sebuah logam (bahasa Yunani: Metallon) adalah sebuah unsur kimia yang siap membentuk ion (kation) dan memiliki ikatan logam, dan kadangkala dikatakan bahwa ia mirip dengan kation di awan elektron. Metal adalah salah satu dari tiga kelompok unsur yang dibedakan oleh properti ionisasi dan ikatan, bersama dengan metaloid dan
nonlogam. Dalam tabel periodik, garis diagonal digambar dari boron (B) ke polonium
(Po) membedakan logam dari nonlogam. Unsur dalam garis ini adalah metaloid, kadangkala disebut semi-logam; unsur di kiri bawah adalah logam; unsur ke kanan atas adalah nonlogam. akibat reaksi dengan lingkungan yang korosif. Korosi dapat juga diartikan sebagai serangan yang merusak logam karena logam bereaksi secara kimia
atau elektrokimia dengan lingkungan. Yang dimaksud elektrokimia adalah Elektrokimia adalah ilmu yang mempelajari aspek elektronik dari reaksi kimia. Elemen yang digunakan dalam reaksi elektrokimia dikarakterisasikan dengan banyaknya elektron
kebalikan dari proses ekstraksi logam dari bijih mineralnya yaitu proses pemisahan suatu zat berdasarkan perbedaan kelarutannya terhadap dua cairan tidak saling larut yang berbeda, biasanya air dan yang lainnya pelarutorganik.. Contohnya, bijih mineral logam besi di alam bebas ada dalam bentuk senyawa besi oksida atau besi sulfida, setelah diekstraksi dan diolah, akan dihasilkan besi yang digunakan untuk pembuatan
baja atau baja paduan. Selama pemakaian, baja tersebut akan bereaksi dengan lingkungan yang menyebabkan korosi (kembali menjadi senyawa besi oksida).
2.6. Faktor-Faktor Yang Mempengaruhi Elektroplating a. Suhu.
Suhu sangat penting untuk menyeleksi cocoknya jalan reaksi dan melindungi lapisan. Keseimbangan suhu ditentukan oleh beberapa faktor seperti ketahanan, jarak anoda dengan katoda, serta besarnya arus yang digunakan.
b. Kerapatan Arus.
Kerapatan arus yang baik adalah arus yang tetap pada saat awal sampai pada akhir pelapisan.
c. Konsentrasi Ion
Konsentrasi ion akan berpengaruh pada stuktur deposit, dengan naiknya konsentrasi logam dapat menaikkan seluruh kegiatan anion yang membantu mobilitas ion, d. Agitasi
Agitasi, atau goncangan dapat membantu proses elektroplating, terutama untuk menjaga lapisan agar semua permukaan mendapat lapisan yang sama tebalnya. e. Throwing Power
f. Konduktivitas
Konduktivitas larutan tergantung kepada konsentrasi ion yang besar atau konsentrasi molekul.
g. Nilai pH
Nilai pH merupakan faktor penting dalam menjaga kestabilan proses pelapisan. h. Passivitas
Gejala passivitas sering ditemui pada logam yang mengalami korosi, karena itu elektroda harus benar-benar bersih dan bebas dari korosi.
i. Waktu Pelapisan.
Waktu pelapisan sangat berperngaruh kepada ketebalan lapisan yang diharapkan, semakin lama waktu pelapisan maka semakin tebal lapisan yang diperoleh walaupun suatu saat akan tercapai juga masa jenuh, yaitu dimana ketebalan tidak lagi bertambah walaupun waktu pelapisan terus diperpanjang.
2.7. Kecerahan Lapisan
Penampilan lapisan dekoratif merupakan suatu hal yang penting tetapi sering kali dinilai secara subjektif, artinya intensitas cahaya yang dipantulkan secara fisika yang diukur dengan fotometri, tidak merupakan patokan yang sesuai dengan kecerahan yang dapat dinikmati oleh mata manusia. Secara fisika intensitas dan iluminasi diukur dengan:
Intensitas I = dF/dΩ Dan
Iluminasi E = dF/dA (Lux)
Dimana: F = fluks cahaya (lumen)
Ω = sudut ruang ( steradian = Sr)
BAB III
METODOLOGI PENELITIAN
3.1. Tempat dan Waktu Penelitian
Proses elektroplating dilakukan dilaboratorium lembaga penelitian USU dan pengukuran iluminasi cahaya serta pengukuran ketebalan dilakukan di laboratorium bahan teknik mesin Universitas Gajah Mada.
3.2. Bahan dan Alat Penelitian 3.2.1 Bahan Penelitian.
a. Bahan dan larutan:
(NH4)3{Au(SO3)2} [Au+]=10 g/l pH 9.5
Temperature 400 C
Current density 0.15-0.5 A/dm²
( rapat arus katoda (arus listrik) yang dikirimkan untuk membuat proses itu terjadi)
Agitation Magnetic stirring
b. Jarak anoda dan katoda 13 cm dan dapat divariasikan
c. Specimen uji yang diplating adalah tembaga dengan bentuk datar.
3.2.2 Alat Penelitian a. Power Supply.
Power supply laboratorium yang besar arus dan tegangannya dapat diatur secara stabil dan teliti.
b. Bak Plating.
Bak plating yang digunakan adalah terbuat dari kaca sehingga tidak pengaruh dari bahan bak terhadap proses elektroplating.
c. Bak Pembersih
Setelah speciment diplating speciment akan dibersihkan dari larutan dan zat sisa dari bak plating dengan bahan netralisasi.
d. Thermometer
Thermometer digunakan untuk mengukur temperatur dari larutan karena diperlukan temperatur sekitar 40o Celcius selama masa elektroplating berlangsung.
e. Agitator
Agitator yang digunakan adalah jenis magnetik agitator sehingga tidak menyebabkan gangguan terhadap arus dan tegangan yang digunakan.
f. Water Heater
Water heater digunakan adalah tipe kontak heater sehingga untuk memanaskan larutan, heater tersebut tidak diletakkan dalam larutan tapi pada dinding luar bak plating.
g. Stop Watch
Stop watch digunakan untuk menghitung waktu yang digunakan dalam masa proses elektroplating.
h. Alat Ukur Intensitas Dan Iluminasi Cahaya
Alat ukur intensitas dan iluminasi cahaya digunakan dari jenis He-Ne dengan specifikasi P = 20 VA, p = 20 mW, diameter cahaya laser 2 mm, λ = 632.8 nm, DIN 58126Kl2.
3.3. Proses elektroplating
Kemajuan pelapisan emas dengan menggunakan larutan pada umumnya menggunakan Au(I) complex dalam larutan basa Cyanida dengan pH sekitar 12.2 akan menghasilkan Au(CN)-2 dengan bentuk menengah (MacArthur, 1972). Proses secara elektro kimia yang terjadi pada elektroda dapat dijelaskan sebagai berikut:
Pada katoda
Au(CN)-2 → [Au(CN)-2] ads [Au(CN)-2] ads + e- → Au + 2 CN-
Pada Anoda
[image:35.612.139.434.237.537.2]Au + 2 CN- → [Au(CN)-2] ads + e -[Au(CN)-2] ads + CN- → Au(CN)-2
Gambar 3.1 Sketsa dasar proses elektroplating
Perhitungan dasar pada pengukuran ketebalan dihitung berdasarkan hukum Faraday. Massa dari macam-macam zat yang diendapkan pada masing-masing elektroda (terbentuk pada masing-masing elektroda) oleh sejumlah arus listrik yang sama banyaknya akan sebanding dengan berat ekivalen masing-masing zat tersebut.
tidak mulia. Logam yang akan dilapisi dihubungkan dengan kutub negatif (sebagai katoda) dan logam pelapis dihubungkan dengan kutub positif (sebagai anoda) selanjutnya kedua elektroda tersebut dicelupkan ke dalam suatu larutan elektrolit dan dihubungkan dengan sumber arus listrik searah (DC). Mengalirnya arus listrik searah melalui suatu larutan berkaitan dengan gerak partikel bermuatan (ion) (Kirck dan Otmer, 1983; Hartomo dan Kaneko, 1992). Pada anode terjadi reaksi oksidasi, sedangkan pada katoda terjadi reaksi reduksi, . Reaksi oksidasi reduksi pada kedua elektrode berlangsung bersamaan yang menyebabkan terjadinya pelarutan logam pada anode menghasilkan ion
ne Mn
M → + + Mn+ + ne→M
+
M dan penempelan logam M pada katode (Graw-hill, 1991; Simpen, 1996).
3.4 Cara Kerja Pada Pelapisan
Pada modul pelapisan ini dalam melakukan praktikum di Laboratorium harus melalui langkah-langkah kerja, sebagai berikut :
Langkah I : Pada awalnya bersihkan plat katoda dengan menggunakan amplas dan kemudian menimbang dengan neraca. Hal ini dimaksudkan agar dapat mengetahui berat sebelum elektrolisa dari plat katoda.
Langkah II : Pasang katoda ekstra pada tempatnya hal ini dimaksudkan agar dapat mengetahui bagaimana cara menyusun rangkaian dalam percobaan elektrolisa dan tetapkan besar arus dengan mengatur besar hambatan geser dan usahakan agar arus selalu konstan dengan mengatur hambatan geser apabila harga arus berubah.
Langkah IV: Setelah elektrolisa selesai katoda kemudian dicelupkan ke dalam air, supaya larutan komplex yang menempel hilang tetapi jangan digosok supaya Cu yang menempel pada katoda tidak berkurang.
Langkah V : Kemudian keringkan dengan alat pengering.
Langkah VI: Timbang katoda tersebut dan catat jumlah massa yang diendapkan, hal ini dimaksudkan agar dapat mengetahui berat setelah elektrolisa dan dalam percobaan ini menggunakan arus 1 Ampere dan 1,5 Ampere dalam waktu 5 menit untuk setiap kali pengamatan.
Caranya :
- Bahan tembaga dibersihkan
- Dihubungkan dengan elektroda negatif dalam bak larutan - Isi bak dengan larutan emas yang sudah dipersiapkan - Ukur pH, atur penambahan asam sampai pH diperlukan - Set Heater dan hidupkan Heater
3.5. Diagram alir
Tembaga dibersihkan dengan larutan peroksida (H2O2)dan di amplas dan ditimbang
Heater dihidupkan untuk memanasi larutan 48,8 derajat
mulai
Ditambah asam sampai pH diukur sampai 5,7
Tembaga diletakkan pada elektroda dan dicelupkan kedalam bak pelapisan
Arus diatur dengan
pengatur arus konstan yang tersedia.
Selesai
BAB IV
HASIL DAN PEMBAHASAN
4.1 Ruang Pelapisan
Gambar 4.1. Ruang pelapisan dan kaca pelindung
4.2 Peralatan Secara Keseluruhan Adalah Sbb:
Pengatur Panas Tempat Pelapisan
[image:41.612.105.526.133.472.2]Power Supply
Gambar 4.2. Peralatan pendukung secara keseluruhan
4.3 Prosedur Pengoperasian
a. Tutup dibuka pada pengatur elemen pemanas
[image:42.612.206.424.179.368.2]b. Pemanas dihidupkan dengan cara menekan tombol besar yang disediakan
Gambar 4.3 Instrumen pengatur elemen pemanas c. Atur nilai temperatur maksimum 48,8ºC.
[image:42.612.213.428.425.616.2]
d. Ketinggian larutan diperiksa tidak lebih rendah atau lebih tinggi dari tanda batas yang ditentukan, kalau melewati batas yang ditentukan maka proses pelapisan tidak terbentuk.
Gambar 4.5 Pengaturan tinggi larutan dalam bak pelapisan
4.4 Pemeriksaan Parameter Untuk Larutan a. Temperatur larutan 48,8ºC.
[image:43.612.182.431.445.610.2]b. pH sekitar 5,7 (alat ukur pH : pH meter digital)
Gambar 4.7. Pengukuran pH sebelum pelapisan dimulai
c. bahan yang mau dilapis emas dimasukkan elektroda Katoda
[image:44.612.184.445.436.628.2]d. bahan Tembaga dengan luas permukaan 1 cm², diletakkan dengan rapi diatas elektoda.
Gambar 4.9. Katoda dengan penjepit bahan
e. Penjepit ditekan sehingga bahan tidak terlepas dari elektroda
[image:45.612.104.511.360.602.2]f. penyambungan elektroda ke sumber arus konektor positif
Gambar 4.11. Penyambungan elektroda Katoda
[image:46.612.108.509.340.463.2]g. penyambungan elektroda ke sumber arus konektor negatif
Gambar 4.12. Penyambungan kabel-kabel luar ke instrumentasi sumber arus
h. menghubungkan arus ke sistem pelapisan
[image:46.612.131.474.515.648.2]4.5 Pengaturan Pada Instrumen a. bagian power supply
Gambar 4.14. Instrumen pengatur arus dan tegangan
b. pengaturan arus
[image:47.612.156.474.413.604.2]c. pengaturan pulsa
[image:48.612.201.430.183.344.2]Arus yang dipergunakan pada saat pelapisan adalah arus diskrit, artinya arus dikirim dalam bentuk pulsa, dengan frekwensi 100 Hertz.
Gambar 4.16. Arus dan tegangan dikirim dalam bentuk pulsa dengan waktu on dan off yang dapat diatur sesuai dengan kebutuhan
d. pengaturan arus dan waktu
[image:48.612.203.393.438.588.2]e. pemutusan arus tidak boleh tiba-tiba tapi arus dikurangi sedikit demi sedikit sampai nol baru power supply dimatikan.
Gambar 4.18. Perubahan pemutusan arus dengan mengurangi tegangan perlahan-lahan sampai tegangan 1 millivolt barulah power supply dapat dimatikan total.
f. Pencucian hasil pelapisan
[image:49.612.185.401.360.586.2]4.6 Data dan Hasil Pengukuran
[image:50.612.140.471.192.646.2]Tingkat kecerahan diukur dengan alat ukur iluminasi, dan berdasarkan waktu pelapisan terhadap beberapa sampel diperoleh data sebagai berikut:
Tabel 4.1. Hasil pengukuran pada pH 5,7
Waktu pelapisan (menit) pH 5,7 Spesimen Iluminasi Cahaya pantul (Lux) Iluminasi Cahaya Referensi (Lux)
5 1 3299,027 21431,685 2 3299,027 21431,685 3 3299,027 21431,685 Jumlah 9896,081 64295,055 Rata – rata 3299,027 21431,685
10 1 4947,877 21431,685 2 4947,877 21431,685 3 4947,877 21431,685 Jumlah 14843,631 64295,055 Rata – rata 4947,877 21433,685
15 1 6596,054 21433,685 2 6596,054 21433,685 3 6596,054 21433,685 Jumlah 19788,162 64301,055 Rata – rata 6596,054 21433,685
20 1 8244,904 21433,685 2 8244,904 21433,685 3 8244,904 21433,685 Jumlah 24734,712 64301,055 Rata - rata 8244,904 21433,685
Dari tabel diatas diperoleh grafik sebagai berikut, bahwa waktu pelapisan sekitar 20 menit menghasilkan bahan dengan iluminasi paling besar, artinya bahan tersebut adalah paling mengkilap dibanding dengan waktu pelapisan yang lebih sedikit ataupun yang lebih lama.
Gambar 4.20. Grafik data optimum
Gambar 4.20 Grafik Data Optimum Keterangan :
Tabel 4.2. Hasil pengukuran pada pH 4,7 Waktu pelapisan
(menit) pH 4,7
Spesimen Iluminasi Cahaya pantul (Lux)
Iluminasi Cahaya Referensi
(Lux)
5 1 2275,065 21431,685
2 2275,065 21431,685
3 2275,065 21431,685
Jumlah 6825,195 64295,055
Rata – rata 2275,065 21431,685
10 1 3653,769 21431,685
2 3653,769 21431,685
3 3653,769 21431,685
Jumlah 10961,307 64295,055
Rata – rata 3653,769 21433,685
15 1 4325,989 21433,685
2 4325,989 21433,685
3 4325,989 21433,685
Jumlah 12977,967 64301,055
Rata – rata 4325,989 21433,685
20 1 4432,875 21433,685
2 4432,875 21433,685
3 4432,875 21433,685
Jumlah 13298,625 64301,055
Rata - rata 4432,875 21433,685
25 1 3574,675 21433,685 2 3574,675 21433,685
3 3574,675 21433,685 Jumlah 10724,025 64301,055
Tabel 4.3. Hasil pengukuran pada pH 6,7 Waktu pelapisan (menit) pH 6,7 Spesimen Iluminasi Cahaya pantul (Lux)
Iluminasi Cahaya Referensi
(Lux)
5 1 1269,032 21431,685
2 1269,032 21431,685
3 1269,032 21431,685
Jumlah 3807,093 64295,055
Rata – rata 1269,032 21431,685
10 1 1974,643 21431,685
2 1974,643 21431,685
3 1974,643 21431,685
Jumlah 5923,929 64295,055
Rata – rata 1974,643 21433,685
15 1 4532,876 21433,685
2 4532,876 21433,685
3 4532,876 21433,685
Jumlah 13598,628 64301,055
Rata – rata 4532,876 21433,685
20 1 4532,765 21433,685
2 4532,765 21433,685
3 4532,765 21433,685
Jumlah 13598,295 64301,055
Rata - rata 4532,765 21433,685
25 1 4765,765 21433,685 2 4765,765 21433,685 3 4765,765 21433,685 Jumlah 14297,295 64301,055
4.7 Cara pengukuran ketebalan lapisan
Pengukuran ketebalan dilakukan dengan cara : 1. Tembaga yang dilapis dipotong penampangnya 2. Dilihat dengan Mikroskop Elektron
3. Di Foto berikut skala yang tampil pada layar 4. Dibandingkan dengan skala yang tersedia tersebut 5. Dihitung jumlah garis berdasarkan skala
6. Dikonversikan berdasarkan skala perbesaran Mikroskop 7. Diperoleh hasil ketebalan
Skala 10 strip berarti ketebalan setebal 50 mikrometer,
Gambar 4.22. Foto pelapisan tembaga yang dilapisi emas dalam waktu 5 menit
Gambar 4.23. Foto pelapisan tembaga yang dilapisi emas dalam waktu 10 menit
Gambar 4.24. Foto pelapisan tembaga yang dilapisi emas
elapisan sudah kelihatan dengan ketebalan sangat tipis dan warna keemasan masih dalam waktu 15 menit
P
Gambar 4.25. Foto pelapisan tembaga yang dilapisi emas
elapisan tembaga dengan emas sudah sempurna warna dan ketebalan emas sudah a dalam waktu 20 menit
P
Gambar 4.26. Foto pelapisan tembaga yang dilapisi emas
arna keemasan sudah tidak cerah, artinya dalam waktu 25 menit proses pelapisan lap dalam waktu 25 menit
W
Gambar 4.27. Grafik perubahan ketebalan dengan waktu pelapisan
Keterangan :
BAB V
KESIMPULAN DAN SARAN
.1 Kesimpulan
maksimum diperoleh pada waktu pelapisan 20 menit
dengan ph 5,7
san yang diperoleh walaupun
akuan yang sama dapat digunakan sebagai referensi untuk keperluan
engan permintaan pasar, karena 5
1. Kecerahan
2. Hasil iluminasi cahaya paling optimum diperoleh pada pelapisan kondisi ini adalah kondisi pH yang asam moderat.
3. Semakin lama pelapisan semakin tebal hasil pelapi nilai ketebalan tersebut tidak linear dengan waktu. 5.2 Saran
1. Perl
pelapisan bahan perak, chrom, maupun nikel. 2. Semakin tebal tidak berarti semakin sesuai d
DAFTAR PUSTAKA
A. Fanigliulo and B. Bozzini, 2002, 80, 13, Trans. Inst. Metal Finishing.
ntiquity. , N.
Corbitt, R rd Handbook of Environmental Engineering,
Davis, ntroduction to
Environmental Engineering.
. T. S Handbook: Surface Engineering, Vol. 5, p. 274, F.
Foulk eview of Commercial Material
akob Co roperties of Gold-Nickel Alloy
Brazed Joints in High Temperature Materials.
enniver , 1993, 1997, 18 Carat White
J. C. Hunt, 1973 , 1991, Heat Treatment of Gold Alloys.
Concorde Airframe Hydraulis
J. W. Din Simpen, 1996, Influence of Temperature on the Properties of Gold Electrodeposits.
aka, K. Nishitani and M. Otsubo, M. Datta, K. Sheppard and D. Snyder, Editors, PV92-3, 1992, p.317, Proceedings of the First Symposium on Electrochemical Microfabrication.
Andrew Oddy, Okinaka Samura, 2000, The Production of Gold Wire in A
Brian Cathro and Lamberto Koch, 1964, A New Approach to the Chemistry of Gold P. Finkelstein & R. D. Hancock.
.A., pp 6.99-6.220, 1990, Standa
McGraw-Hill, McGraw-Hill, Inc., p. 431, 1991 [Tchobanoglous, G. and Burton, F.L., Wastewater Engineering: Treatment, Disposal, and Reuse.
M.L. and Cornwell, D.A., McGraw-Hill, pp373-374, 1991, I
chwartz, OH (1994), in ASM D
Reidenbach, Editor, ASM Int., Materials Park. Normandeau, 1974, 1992, White Golds : A R
Characteristics & Alloy Design Alternatives. lbus & Karl Friedich Ritchie et al. 1999, P J
MM Dugmore & Charles D. Weisberg 1974 J
Behaviour of a Gold – Nickel Alloy.
J.D. Rosser, Mac Arthur, 1972, Gold Brazing on the System.
i, William
heim, Frederick. A, 1978, Electroplating, McGraw – Hill Book Company, New York.
Lowen
a.
ronic Packaging.
. Kubaschewski & O. von Goldbeck, and Graw Hill, 1991, The Thermochemestry of
gation of Gold Compounds.
t.
McMillan, G.K., 1994, pH Measurement and Control, 2nd Ed., Instrument Society of Americ
M. Datta, T. Osaka and J.W. Schultze Editors, CRC Press, Boca Raton, 2005, Microelect
N. Issaev, and J. G. Osteryoung, J. Electrochem. Soc., 1998, 145, 974, X. Wang. O
Gold.
Peter G. Jones, Hartomo Ardi, Isuzu Kaneko, 1983, 1992, X-Ray Structural Investi
Purwanto dan Syamsul Huda, 2004, “Teknologi Industri Elektroplating”, Badan Penerbit Universitas Diponegoro.
R. K. Dube, Bard and Faulkner, 1980, Gold Powder: Its Preparation & Application as Described in Ancient Sanskrit Tex
Suparni Setyowati Rahayu, 2009, http://www.chem-is-try.org/proses-elektroplating-tembaga-nikel-khrom/.
Vesilind, P.A. and Peirce, J.J., p.105, 1983, Environmental Pollution and Control, utterworth Publishers.
B
of Carat Gold Jewelry Alloys.
fe ochemical Engineering Journal.
W. A. O., Lyons Jr. 1974, Symposium on the History of Technology of the Precious Metals.
William S. Rapson, John Kirck, and Michael Otmer 1983, Precipitation Hardening and Ordering
48
--- 2009. Mengenal Cara Pelapisan Logam
http://nosalpratama.blogspot.com/2009/09/mengenalcarapelapisanlogam. --- Bahan-bahan Kerajinan Logam.