1
PENDAHULUAN
Penggunaan berbagai jenis flokulan (polimer organik sintetik) seperti turunan poliakrilamid, polivinilpirimidin, polietilenimin, dan sodiumpoliakrilat merupakan agen yang banyak digunakan untuk pengolahan limbah cair (Yokoi 1998). Polimer organik ini bersifat unbiodegradabel sehingga tidak mudah pembuangannya dan meninggalkan residu di lingkungan. Turunan poliakrilamid paling banyak digunakan dalam industri pengolahan limbah cair karena merupakan agen flokulasi yang bersifat efektif dan ekonomis (Kurane et al. 1986). Turunan poliakrilamid membahayakan lingkungan secara nyata dan merupakan sumber polusi yang berbahaya juga berpengaruh buruk untuk generasi mendatang. Monomer akrilamid juga bersifat neurotoksik dan bersifat karsinogen kuat pada tubuh manusia (Kurane et al. 1986). Eksplorasi dari sumber-sumber alami terutama dari sumber-sumber mikrobiologi seperti bakteri merupakan salah satu jalan keluar untuk mendapatkan agen flokulan alternatif yang disebut bioflokulan yang bersifat lebih aman bagi manusia juga ramah terhadap lingkungan.
Bioflokulan merupakan polimer esensial yang diproduksi oleh mikroorganisme pada masa pertumbuhannya dengan aktivitas flokulasi yang bergantung pada karakteristik dari flokulan. Dibandingkan dengan sintetis flokulan, bioflokulan memiliki keuntungan yang khusus seperti, aman, biodegradable, dan tidak berbahaya bagi manusia juga lingkungan, sehingga berpotensi untuk diaplikasikan dalam pengolahan limbah cair, proses industri hulu dan proses fermentasi (Jie et al. 2005).
Banyak mikroorganisme penghasil bioflokulan termasuk bakteri, fungi, dan aktinomisetes yang telah dilaporkan memproduksi substansi polimer ekstraseluler, seperti polisakarida, protein, dan glikoprotein yang berfungsi sebagai bioflokulan. Setiap mikroorganisme dapat menghasilkan bioflokulan yang berbeda sehingga dengan perbedaan tersebut dapat dihasilkan bioflokulan yang dapat di manfaatkan dalam industri secara luas. Flokulan yang diproduksi Bacillus sp. Haloalkalofilik, Alcaligenes cupidus, dan Bacillus substilis merupakan bioflokulan polisakarida. Nocardia amarae, Bacillus licheniformis, dan Rhodococcus erythropolis memproduksi bioflokulan protein, sedangkan Arcuaden sp. dan
Arachrobacter sp. memproduksi bioflokulan glikoprotein (Jie et al. 2005).
Ditemukannya berbagai mikroorganisme dengan aktivitas flokulasi yang tinggi dari bioflokulan sangat menarik untuk digunakan dalam industri secara luas. Penelitian ini dilakukan untuk mendapatkan mikrob potensial penghasil bioflokulan yang berasal dari lumpur aktif.
Banyaknya dampak negatif (sumber polusi) terhadap lingkungan dan kesehatan manusia (karsinogen, neurotoksik) karena penggunaan polimer sintetik di berbagai industri, mendorong akan kebutuhan flokulan yang bersifat biodegradable. Oleh karena itu isolasi mikroorganisme yang mampu menghasilkan bioflokulan dan mempunyai aktivitas dalam memflokulasi secara efisien perlu dilakukan. Mikroorganisme tersebut dapat diisolasi dari berbagai sumber seperti lumpur aktif, tanah, perairan, serta limbah-limbah industri. Pada penelitian ini mikroorganisme diisolasi dari lumpur aktif. Seleksi diprioritaskan terhadap mikrob yang dapat menghasilkan bioflokulan dengan aktivitas flokulasi tinggi. Penelitian ini dilakukan untuk mendapatkan bioflokulan yang memiliki aktivitas flokulasi tinggi melalui proses isolasi mikrob, produksi dan optimasi bioflokulan.
Bakteri hasil isolasi dari lumpur aktif mampu menghasilkan bioflokulan yang bersifat biodegradable dengan aktivitas flokulasi tinggi. Bioflokulan yang dihasilkan diharapkan dapat bermanfaat di industri pengolahan limbah, sehingga penggunaan flokulan sintetik dapat dihilangkan karena sifatnya yang berbahaya. Juga dapat bermanfaat bagi perkembangan Ilmu Pengetahuan dan Teknologi (IPTEK).
TINJAUAN PUSTAKA
Proses Koagulasi1
PENDAHULUAN
Penggunaan berbagai jenis flokulan (polimer organik sintetik) seperti turunan poliakrilamid, polivinilpirimidin, polietilenimin, dan sodiumpoliakrilat merupakan agen yang banyak digunakan untuk pengolahan limbah cair (Yokoi 1998). Polimer organik ini bersifat unbiodegradabel sehingga tidak mudah pembuangannya dan meninggalkan residu di lingkungan. Turunan poliakrilamid paling banyak digunakan dalam industri pengolahan limbah cair karena merupakan agen flokulasi yang bersifat efektif dan ekonomis (Kurane et al. 1986). Turunan poliakrilamid membahayakan lingkungan secara nyata dan merupakan sumber polusi yang berbahaya juga berpengaruh buruk untuk generasi mendatang. Monomer akrilamid juga bersifat neurotoksik dan bersifat karsinogen kuat pada tubuh manusia (Kurane et al. 1986). Eksplorasi dari sumber-sumber alami terutama dari sumber-sumber mikrobiologi seperti bakteri merupakan salah satu jalan keluar untuk mendapatkan agen flokulan alternatif yang disebut bioflokulan yang bersifat lebih aman bagi manusia juga ramah terhadap lingkungan.
Bioflokulan merupakan polimer esensial yang diproduksi oleh mikroorganisme pada masa pertumbuhannya dengan aktivitas flokulasi yang bergantung pada karakteristik dari flokulan. Dibandingkan dengan sintetis flokulan, bioflokulan memiliki keuntungan yang khusus seperti, aman, biodegradable, dan tidak berbahaya bagi manusia juga lingkungan, sehingga berpotensi untuk diaplikasikan dalam pengolahan limbah cair, proses industri hulu dan proses fermentasi (Jie et al. 2005).
Banyak mikroorganisme penghasil bioflokulan termasuk bakteri, fungi, dan aktinomisetes yang telah dilaporkan memproduksi substansi polimer ekstraseluler, seperti polisakarida, protein, dan glikoprotein yang berfungsi sebagai bioflokulan. Setiap mikroorganisme dapat menghasilkan bioflokulan yang berbeda sehingga dengan perbedaan tersebut dapat dihasilkan bioflokulan yang dapat di manfaatkan dalam industri secara luas. Flokulan yang diproduksi Bacillus sp. Haloalkalofilik, Alcaligenes cupidus, dan Bacillus substilis merupakan bioflokulan polisakarida. Nocardia amarae, Bacillus licheniformis, dan Rhodococcus erythropolis memproduksi bioflokulan protein, sedangkan Arcuaden sp. dan
Arachrobacter sp. memproduksi bioflokulan glikoprotein (Jie et al. 2005).
Ditemukannya berbagai mikroorganisme dengan aktivitas flokulasi yang tinggi dari bioflokulan sangat menarik untuk digunakan dalam industri secara luas. Penelitian ini dilakukan untuk mendapatkan mikrob potensial penghasil bioflokulan yang berasal dari lumpur aktif.
Banyaknya dampak negatif (sumber polusi) terhadap lingkungan dan kesehatan manusia (karsinogen, neurotoksik) karena penggunaan polimer sintetik di berbagai industri, mendorong akan kebutuhan flokulan yang bersifat biodegradable. Oleh karena itu isolasi mikroorganisme yang mampu menghasilkan bioflokulan dan mempunyai aktivitas dalam memflokulasi secara efisien perlu dilakukan. Mikroorganisme tersebut dapat diisolasi dari berbagai sumber seperti lumpur aktif, tanah, perairan, serta limbah-limbah industri. Pada penelitian ini mikroorganisme diisolasi dari lumpur aktif. Seleksi diprioritaskan terhadap mikrob yang dapat menghasilkan bioflokulan dengan aktivitas flokulasi tinggi. Penelitian ini dilakukan untuk mendapatkan bioflokulan yang memiliki aktivitas flokulasi tinggi melalui proses isolasi mikrob, produksi dan optimasi bioflokulan.
Bakteri hasil isolasi dari lumpur aktif mampu menghasilkan bioflokulan yang bersifat biodegradable dengan aktivitas flokulasi tinggi. Bioflokulan yang dihasilkan diharapkan dapat bermanfaat di industri pengolahan limbah, sehingga penggunaan flokulan sintetik dapat dihilangkan karena sifatnya yang berbahaya. Juga dapat bermanfaat bagi perkembangan Ilmu Pengetahuan dan Teknologi (IPTEK).
TINJAUAN PUSTAKA
Proses Koagulasi2
(1994) adalah partikel-partikel yang memiliki beberapa karakteristik dalam larutan juga memiliki diameter yang berukuran 0.001-1 µm dan beberapa koloid ada yang sampai berukuran 10 µm. Partikel koloid dapat dipisahkan dari larutannya dengan cara pendestabilisasian partikel koloid menjadi agregat-agregat yang memiliki ukuran yang lebih besar sehingga mudah diendapkan. Proses pendestabilan koloid ini disebut koagulasi.
Koagulasi secara umum didefinisikan sebagai penambahan zat kimia (koagulan) ke dalam air baku dengan maksud mengurangi gaya tolak menolak antar partikel koloid, sehingga partikel-partikel tersebut dapat bergabung menjadi flok-flok halus (Mujiadi & Karnaningroem 2001). Koagulasi terpenuhi dengan penambahan ion-ion yang mempunyai muatan yang berlawanan dengan partikel koloid. Partikel koloid umumnya bermuatan negatif oleh karena itu ion-ion yang ditambahkan harus kation atau bermuatan positif. Kekuatan koagulasi ion-ion tersebut bergantung pada bilangan valensi atau besarnya muatan. Ion bivalen (+2) 30-60 kali lebih efektif dari ion monovalen (+1). Ion trivalent (+3) 700-1000 kali lebih efektif dari ion monovalen.
Proses koagulasi dipengaruhi oleh muatan ion yang berasal dari larutan elektrolit yang ditambahkan. Hal ini diperjelas dengan data yang terdapat pada Tabel 1. Tabel tersebut memberikan hubungan antara jenis elektrolit dengan gaya koagulasinya pada koloid bermuatan positif atau negatif. Efek penambahan ion tersebut akan semakin meningkat tergantung pada jumlah muatan (jenis ion) yang dimilikinya (Sawyer et al. 1994).
Tabel 1 Perbandingan kekuatan koagulasi relatif dari beberapa elektrolit
Kekuatan koagulasi relatif Elektrolit Koloid
positif
Koloid negatif
NaCl 1 1
Na2SO4 30 1
Na3PO4 1000 1
BaCl2 1 30
MgSO4 30 30
AlCl3 1 1000
Al2(SO4)3 30 > 1000
FeCl3 1 1000
Fe2(SO4)3 30 > 1000
Proses Flokulasi
Proses koagulasi biasanya dilanjutkan dengan proses flokulasi. Flokulasi adalah proses penggumpalan koloid dan agregat yang telah mengalami koagulasi membentuk bahan-bahan padat (flok) yang cukup besar untuk diendapkan. Proses flokulasi dilakukan dengan menambahkan flokulan, yaitu senyawa kimia berupa polimer. Polimer disebut juga polielektrolit jika monomernya mengandung gugus fungsi yang dapat terionissi. Flokulan biasanya dibagi dalam tiga kelompok besar yaitu, flokulan anorganik seperti aluminium sulfat dan polialuminium klorida, flokulan organik sintetik seperti asam poliakril dan turunan poliakrilamid, dan bioflokulan seperti sitosan, natrium alginate, gelatin, dan polimer mikrob (Dermlim et al. 1999).
Proses flokulasi dapat terjadi dalam tiga tahap (Gambar 1), yaitu (1) penyerapan polimer pada permukaan partikel (2) persilangan antara segmen polielektrolit untuk membentuk jembatan antara partikel koloid (3) pembentukan struktur tiga dimensi. Proses pembentukan jembatan akan terjadi apabila terjadi penggabungan antara molekul polimer dengan partikel koloid (reaksi1). Apabila polimer dan partikel koloid yang akan bergabung berbeda muatan, maka proses penggabungan akan dipengaruhi gaya Coulomb. Sedangkan proses penggabungan akan dipengaruhi oleh adanya pertukaran ion, terbentuknya ikatan hidrogen atau gaya tarik Van der Waals apabila molekul polimer dan partikel koloidnya bermuatan sama. Ekor polimer yang telah bergabung dengan partikel koloid akan mengikat partikel koloid lain sehingga terbentuk jembatan antar partikel koloid. Proses pembentukan jembatan ini akan dihasilkan partikel flok yang dapat mengendap (reaksi 2). Apabila perpanjangan segmen polimer tidak dapat berikatan dengan sisi aktif partikel koloid lain, polimer tersebut akan berbalik dan terikat pada sisi aktif partikel koloid semula kemudian membentuk partikel yang restabil (stabil kembali) seperti yang digambarkan pada reaksi 3.
3
Pengadukan yang terlalu cepat dan lama akan mengakibatkan putusnya jembatan yang telah terbentuk sehingga terjadi restabilisasi pertikel seperti yang digambarkan pada reaksi 5 dan 6 (Benefield et al 1982).
Gambar 1 Skema reaksi antara partikel koloid dengan polimer.
Mikroorganisme dalam Lumpur Aktif
Lumpur aktif merupakan gabungan dari flok-flok mikroorganisme, bahan orgnik dan bahan anorganik. Umumnya lumpur aktif mempunyai komposisi 70-90% bahan organik dan 10% bahan anorganik. Struktur flok lumpur akif cenderung bermuatan negatif sebagai hasil interaksi kimia-fisika antara mikroorganisme (khususnya bakteri), partikel organik (oksida silikat, fosfat, besi), polimer eksoseluler dan berbagai kation (Cheremisinoff 1987). Lumput aktif biasanya digunakan pada pengolahan limbah cair industri tekstil (Gambar 2).
Gambar 2 Lumpur aktif pada pengolahan limbah cair industri tekstil.
Istilah lumpur aktif digunakan karena mikrob aerobik umumnya tampak menggumpal seperti lumpur tanah. Lumpur aktif terdiri dari berbagai jenis mikrob aerobik yang terdiri dari 95% bakteri dan 5% adalah fungi, alga, rotifera dan protozoa. Bakteri aerobik yang mendukung keberhasilan unit lumpur aktif harus memiliki keaktifan metabolisme yang tinggi. Keaktifan metabolisme dapat dinilai melalui banyaknya O2 yang dibutuhkan oleh bakteri, mampu
membentuk lumpur yang mudah mengendap. Bakteri lumpur aktif dapat dikelompokkan sebagai bakteri penggumpal (floc-foming bacteria) dan bakteri filamen. Keberadaan bakteri filamen sangat menentukan karakteristik pengendapan lumpur aktif.
Mikroorganisme yang terdapat dalam lumpur aktif dibagi menjadi empat kelompok, yaitu mikroorganisme pembentuk flok, saprofit, predator dan organisme penghambat. Organisme pembentuk flok merupakan mikroorganisme yang paling berperan dalam proses lumpur aktif. Bakteri merupakan mikroorganisme yang termasuk dalam kelompok pembentuk flok. Mikroorganisme saprofit berfungsi mendegradasi senyawa organik melalui metabolisme selnya, mikroorganisme yang termasuk ke dalam kelompok ini adalah bakteri aerob. Mikroorganisme predator merupakan mikroorganisme yang memakan organisme lain di dalam lumpur aktif. Mikroorganisme yang termasuk dalam kelompok ini adalah protozoa. Mikroorganisme penghambat pembentuk flok, menghambat terjadinya reduksi rapat massa dari flok yang telah terbentuk adalah berbagai jenis jamur dan alga.
4
(1998) di dalam proses lumpur aktif, bakteri merupakan partikel biokoloid-hidrofilik yang memiliki muatan permukaan elektronegatif. Bakteri dominan dalam reaktor aerasi karena mampu mendegradasi senyawa organik dan mampu membentuk flok supaya biomassanya mudah dipisahkan dari effluent serta diharapkan mikroorganisme tersebut dapat bertahan hidup dalam sistem pengolahan ini (Jenkins 1993).
Pertumbuhan Mikroorganisme
Pertumbuhan dan pengendalian mikroorganisme merupakan faktor yng sangat penting dalam pengolahan limbah cair secara biologi, karena aktivitas bio-oksidasi bergantung pada biomassa populasi mikroorganisme. Berdasarkan laju pertumbuhannya, mikroorganisme dapat dibagi menjadi empat fase (Gambar 3), yaitu fase pertumbuhan lambat (lag phase), fase eksponensial, fase stasioner, dan fase kematian.
Fase lag merupakan periode aklimatisasi mikroorganisme pada kondisi lingkungan baru. Meskipun tidak terjadi perubahan biomassa atau jumlah sel dalam periode ini, namun banyak terjadi aktivitas metabolisme di dalam mikroorganisme. Substrat diasimilasi dan digunakan untuk sintesis enzim-enzim baru dan untuk pertumbuhan sel sebelum berkembang biak.
Fase eksponensial, mikroorganisme berkembang biak secara meningkat karena mikroorganisme telah mampu beradaptasi dan melakukan aktivitas metabolismenya secara optimum sampai medium tidak mampu mendukung pertumbuhan mikroorganisme tersebut. Akibat habisnya substrat, nutriant, serta faktor lain yang esensial bagi pertumbuhan mikroorganisme, adanya ekskresi metabolisme menjadi penyebab adanya perubahan pH medium akibat asam yang terbentuk dari ekskresi metabolisme mikroorganisme menyebabkan sejumlah sel-sel tidak mampu lagi berkembang biak dan mati sehingga mikroorganisme memasuki fase stasioner (Milono 1998).
Gambar 3 Kurva pertumbuhan mikroorganisme
Fase stasioner ini terjadi jika perbandingan antara bakteri mati dengan yang tumbuh berada dalam keadaan seimbang. Pada fase ini, nutrien telah habis dan populasi mikroorganisme berada pada konsentrasi tinggi. Fase stasioner ini disebut juga fase endogen. Mikroorganisme mengalami fase kematian setelah mengalami fase stasioner. Laju kematian meningkat pada fase ini dan ada kemungkinan sel-sel hancur oleh pengaruh enzim yang berasal dari sel itu sendiri (Benefield 1980).
Bioflokulan
Beberapa tahun terakhir ini telah berhasil diisolasi mikrorganisme yang dapat menghasilkan flokulan dan sering disebut sebagai bioflokulan. Penggunaan bioflokulan dianggap lebih aman dan lebih ramah lingkungan karena bersifat biodegradable dibandingkan flokulan sintetik. Mikroorganisme yang berhasil diisolasi dari lumpur aktif terbatas pada jenis bakteri seperti Pseudomonas, Zooglea, Alcaligenes, Flavobacterium dan Nocardia (Nakamura et al. 1976). Bahan polimer ekstrasel yang diisolasi dari kultur lumpur aktif memiliki aktivitas yang hampir setara dengan flokulan polielektrolit sintetik. Flokulan tersebut menunjukkan akivitas flokulasi yang tinggi terhadap bahan anorganik seperti kaolin (kaolin clay).
5
Bioflokulan dari Alcaligenes latus merupakan super bioabsorben polisakarida baru yang dapat menyerap air lebih dari 1000 kali bobotnya dan diperkirakan lima kali lebih kuat dari polimer sintetik. Kurane et al. (1986) menjelaskan bahwa bakteri Rhodococcus erythropolis diketahui menghasilkan bahan yang dapat memflokulasikan bahan organik seperti mikroorganisme dan bahan anorganik seperti arang aktif.
Kebutuhan Fisik dan Lingkungan Mikroorganisme
Setiap mikroorganisme memerlukan sejumlah syarat agar dapat tumbuh dan berkembang biak dengan baik. Syarat tersebut selain nutrisi adalah keasaman lingkungan serta suhu. Keasaman suatu lingkungan tempat tumbuhnya mikroorganisme sangat penting bagi mikroorganisme dimana pH diluar rentan pH minimal dan pH maksimal, mikroorganisme tidak dapat tumbuh bahkan dapat mengalami kematiaan. Hal ini disebabkan karena lingkungan yang ekstrim dapat merusak struktur dinding sel mikroorganisme sehingga merusak sistem metabolisme sel secara keseluruhan. Tingkat keasaman dari lingkungan tempat mikroorganisme tumbuh tidak hanya berasal dari peristiwa biokimia melainkan juga dapat berasal dari produk akhir metabolisme mikroorganisme yang terakumulasi dilingkungan dimana produk akhirnya cenderung bersifat racun bagi mikroorganisme tersebut.
Semua pertumbuhan mikroorganisme tergantung pada reaksi kimiawi dan laju reaksi, maka pola pertumbuhan bakteri sangat dipengaruhi oleh suhu. Keragaman suhu dapat merubah proses-proses metabolik tertentu serta morfologi sel. Setiap spesies bakteri tumbuh pada suatu kisaran suhu tertentu seperti psikrofil yang tumbuh pada 0-30 oC, mesofil yang tumbuh pada suhu 25-40 oC, dan termofil yang tumbuh pada suhu 50 oC atau lebih (Pelczar & Chan 1986). Suhu inkubasi yang memungkinkan pertumbuhan tercepat adalah selama periode waktu yang singkat (12-24 jam) dan dikenal sebagai suhu pertumbuhan optimum.
Faktor-faktor yang Mempengaruhi Aktivitas Flokulasi
Beberapa faktor yang mempengaruhi kerja flokulan agar terjadi flokulasi antara lain adalah kecepatan dan lama pengadukan, konsentrasi flokulan, pH, kekeruhan, serta
sifat flokulan (Novita 1997). Pengadukan sangat mempengaruhi terbentuknya flok setelah penambahan flokulan. Tujuan dari pengadukan adalah untuk menyempurnakan proses homogenisasi antara flokulan atau koagulan dengan air limbah yang akan diolah. Kecepatan pengadukan yang tidak efiaien dapat menyebabkan pemborosan zat dan lambatnya proses pembentukan agregat. Penambahan flokulan serta pengadukan dapat meningkatkan interaksi antarpartikel tetapi pengadukan yang terlalu kuat dapat menghancurkan flok yang telah terbentuk. Namun pengadukan yang kurang kuat juga menghasilkan flok yang kurang sempurna.
Konsentrasi flokulan yang digunakan juga berpengaruh terhadap terbentuknya flok. Kurangnya konsentrasi flokulan yang dipakai menyebabkan flok mudah goyah sedangkan jika jumlahnya terlalu banyak juga menghalangi terbentuknya flok karena jembatan antarpartikel tidak terjadi akibat tidak adanya sisi aktif partikel yang tersedia. Flokulasi optimum terjadi jika separuh permukaan partikel ditempati oleh flokulan.
Faktor lain yang sangat berpengaruh adalah pH. Tiap jenis flokulan memiliki kisaran pH optimumnya masing-masing. Umumnya sebagian besar kation multivalen yang bereaksi membentuk hidroksida bekerja pada pH alkali. Oleh karena itu, untuk jenis flokulan tertentu kadang-kadang dalam proses pengolahan ditambahkan bahan lain selain flokulan seperti kapur atau soda kaustik untuk menaikkan pH.
Kekeruhan juga ikut berpengaruh dalam proses flokulasi secara tidak langsung. Kekeruhan berbanding terbalik dengan efek flokulasi. Semakin banyak flok yang terbentuk, nilai kekeruhan semakin kecil (dekolorisasi). Faktor ini menjadi salah satu tolok ukur efektivitas flokulasi.
BAHAN DAN METODE
Alat dan BahanAlat yang digunakan yaitu labu Erlenmeyer, mikropipet, pipet volumetrik, gelas ukur, termometer, pH meter, spektrofotometer, rotary shaker, laminar air flow, homogenizer, tabung reaksi, batang pengaduk, cawan petri, pemanas.
Bahan yang digunakan adalah lumpur aktif, larutan fisiologis, pepton, NaCl, bakto agar, glukosa, sukrosa, KH2PO4, HCl,
(NH4)2SO4,, urea, Yeast ekstract, aquades,
5
Bioflokulan dari Alcaligenes latus merupakan super bioabsorben polisakarida baru yang dapat menyerap air lebih dari 1000 kali bobotnya dan diperkirakan lima kali lebih kuat dari polimer sintetik. Kurane et al. (1986) menjelaskan bahwa bakteri Rhodococcus erythropolis diketahui menghasilkan bahan yang dapat memflokulasikan bahan organik seperti mikroorganisme dan bahan anorganik seperti arang aktif.
Kebutuhan Fisik dan Lingkungan Mikroorganisme
Setiap mikroorganisme memerlukan sejumlah syarat agar dapat tumbuh dan berkembang biak dengan baik. Syarat tersebut selain nutrisi adalah keasaman lingkungan serta suhu. Keasaman suatu lingkungan tempat tumbuhnya mikroorganisme sangat penting bagi mikroorganisme dimana pH diluar rentan pH minimal dan pH maksimal, mikroorganisme tidak dapat tumbuh bahkan dapat mengalami kematiaan. Hal ini disebabkan karena lingkungan yang ekstrim dapat merusak struktur dinding sel mikroorganisme sehingga merusak sistem metabolisme sel secara keseluruhan. Tingkat keasaman dari lingkungan tempat mikroorganisme tumbuh tidak hanya berasal dari peristiwa biokimia melainkan juga dapat berasal dari produk akhir metabolisme mikroorganisme yang terakumulasi dilingkungan dimana produk akhirnya cenderung bersifat racun bagi mikroorganisme tersebut.
Semua pertumbuhan mikroorganisme tergantung pada reaksi kimiawi dan laju reaksi, maka pola pertumbuhan bakteri sangat dipengaruhi oleh suhu. Keragaman suhu dapat merubah proses-proses metabolik tertentu serta morfologi sel. Setiap spesies bakteri tumbuh pada suatu kisaran suhu tertentu seperti psikrofil yang tumbuh pada 0-30 oC, mesofil yang tumbuh pada suhu 25-40 oC, dan termofil yang tumbuh pada suhu 50 oC atau lebih (Pelczar & Chan 1986). Suhu inkubasi yang memungkinkan pertumbuhan tercepat adalah selama periode waktu yang singkat (12-24 jam) dan dikenal sebagai suhu pertumbuhan optimum.
Faktor-faktor yang Mempengaruhi Aktivitas Flokulasi
Beberapa faktor yang mempengaruhi kerja flokulan agar terjadi flokulasi antara lain adalah kecepatan dan lama pengadukan, konsentrasi flokulan, pH, kekeruhan, serta
sifat flokulan (Novita 1997). Pengadukan sangat mempengaruhi terbentuknya flok setelah penambahan flokulan. Tujuan dari pengadukan adalah untuk menyempurnakan proses homogenisasi antara flokulan atau koagulan dengan air limbah yang akan diolah. Kecepatan pengadukan yang tidak efiaien dapat menyebabkan pemborosan zat dan lambatnya proses pembentukan agregat. Penambahan flokulan serta pengadukan dapat meningkatkan interaksi antarpartikel tetapi pengadukan yang terlalu kuat dapat menghancurkan flok yang telah terbentuk. Namun pengadukan yang kurang kuat juga menghasilkan flok yang kurang sempurna.
Konsentrasi flokulan yang digunakan juga berpengaruh terhadap terbentuknya flok. Kurangnya konsentrasi flokulan yang dipakai menyebabkan flok mudah goyah sedangkan jika jumlahnya terlalu banyak juga menghalangi terbentuknya flok karena jembatan antarpartikel tidak terjadi akibat tidak adanya sisi aktif partikel yang tersedia. Flokulasi optimum terjadi jika separuh permukaan partikel ditempati oleh flokulan.
Faktor lain yang sangat berpengaruh adalah pH. Tiap jenis flokulan memiliki kisaran pH optimumnya masing-masing. Umumnya sebagian besar kation multivalen yang bereaksi membentuk hidroksida bekerja pada pH alkali. Oleh karena itu, untuk jenis flokulan tertentu kadang-kadang dalam proses pengolahan ditambahkan bahan lain selain flokulan seperti kapur atau soda kaustik untuk menaikkan pH.
Kekeruhan juga ikut berpengaruh dalam proses flokulasi secara tidak langsung. Kekeruhan berbanding terbalik dengan efek flokulasi. Semakin banyak flok yang terbentuk, nilai kekeruhan semakin kecil (dekolorisasi). Faktor ini menjadi salah satu tolok ukur efektivitas flokulasi.
BAHAN DAN METODE
Alat dan BahanAlat yang digunakan yaitu labu Erlenmeyer, mikropipet, pipet volumetrik, gelas ukur, termometer, pH meter, spektrofotometer, rotary shaker, laminar air flow, homogenizer, tabung reaksi, batang pengaduk, cawan petri, pemanas.
Bahan yang digunakan adalah lumpur aktif, larutan fisiologis, pepton, NaCl, bakto agar, glukosa, sukrosa, KH2PO4, HCl,
(NH4)2SO4,, urea, Yeast ekstract, aquades,
6
70%, CaCl2, MgSO4, AlCl3, FeCl3, dan
ZnSO4.
Metode
Penelitian ini dilakukan dalam enam tahapan yang meliputi: (1). Isolasi bakteri penghasil bioflokulan yang berasal dari lumpur aktif; (2). Produksi bioflokulan; (3). Pengujian aktivitas flokulasi; (4). Optimasi produksi bioflokulan; (5). Karakterisasi Bioflokulan; (6). Identifikasi bakteri
Isolasi Bakteri
Lumpur aktif diambil sebanyak 1 mL dan ditambahkan ke dalam 9 mL akuades steril kemudian dikocok menggunakan vortex. Diambil sebanyak 1 mL dari larutan tersebut kemudian dilakukan pengenceran bertingkat. Sebanyak 100 µL suspensi larutan ditumbuhkan dalam media nutrient agar (NA) dengan metode cawan sebar. Kemudian diinkubasi selama 16 jam pada suhu 37o C. Koloni yang muncul pada cawan diambil dan diisolasi pada agar miring kemudian diinkubasi kembali selama 16 jam pada suhu 37 oC (Shimizu & Odawara 1985).
Produksi Bioflokulan
Koloni yang telah dimurnikan kemudian ditumbuhkan pada media produksi bioflokulan. Komposisi media produksi bioflokulan sebagai berikut: glukosa 10 g, sukrosa 10 g, yeast ekstrak 0.5, pepton 0,5 g, urea 0.5 g, MgSO4 0.2 g, KH2PO4 5.0 g,
(NH4)2SO4 0.5 g, dan NaCl 0.1 g dalam 1L
akuades (Wang et al. 1995). Koloni terpilih diinokulasi dalam 10 mL media dalam Erlenmeyer 100 mL dan diinkubasi pada suhu 27 oC untuk persiapan inokulasi. Setelah 16 jam diremajakan, kultur cair digunakan sebagai kultur biakan dan 1% dari kultur ini diinokulasikan ke dalam 20 mL media dalam Erlenmeyer 125 mL. Contoh medium diambil pada jam ke-72 dan diuji aktivitas flokulasinya.
Pengujian Aktivitas Flokulasi
Pengujian aktivitas flokulasi kultur bakteri terhadap suspensi kaolin dilakukan dalam gelas ukur 100 mL. Sebanyak 80 mL suspensi kaolin (5.5 g/L) dicampur dengan 10 mL koagulan FeCl3 0.05% dan 1.0 mL cairan
kultur, ditambahkan air destilata hingga volume total 100 mL. Campuran kemudian diaduk pada suhu 27 oC dan dibiarkan tegak
selama 2 menit. Pembentukkan agregat diamati untuk menentukan terbentuk atau tidaknya flok dalam campuran reaksi. Dengan mengukur penurunan turbiditas lapisan atas campuran maka dapat dihitung derajat flokulasi. Kerapatan optis (OD) lapisan atas campuran setelah pengadukan dibiarkan tegak selama 2 menit dan diukur pada panjang gelombang 550 nm menggunakan spektrofotometer. Aktivitas flokulasi dihitung menurut persamaan : (A-B)/A x 100% dimana A adalah OD kontrol dan B adalah OD sampel.
Optimasi Produksi Bioflokulan
Komposisi media untuk produksi bioflokulan adalah sebagai berikut: glukosa 10 g, sukrosa 10 g, yeast ekstrak 0.5 g, pepton 0,5 g, urea 0.5 g, MgSO4 0.2 g, KH2PO4 5.0 g,
(NH4)2SO4 0.5 g, dan NaCl 0.1 g dalam 1L
akuades (Wang et al. 1995). Isolat yang telah dipilih diremajakan di dalam 10 mL media produksi didalam tabung 100 mL dan diaduk (120 rpm) pada suhu 25 oC untuk persiapan inokulasi. Setelah 16 jam diremajakan, kultur cair dipakai sebagai kultur biakan dan 1% dari kultur ini diinokulasikan ke dalam 50 mL media yang berada di dalam tabung berukuran 100 mL. Kultur diambil pada interval waktu 12 jam sekali selama 96 jam kemudian diamati pH, pertumbuhan sel, dan aktivitas flokulasi.
Karakterisasi Bioflokulan
Karakterisasi meliputi penentuan pH, suhu dan penambahan kation terhadap aktivitas flokulasi. Pengaruh penambahan kation terhadap aktivitas flokulasi dilakukan dengan mencampurkan 80 mL suspensi kaolin (5.5 g/L), 1.0 ml bioflokulan dan berbagai larutan garam sebanyak 10 mL sebagai sumber kation, yang meliputi larutan CaCl2,
MgSO4, AlCl3, FeCl3, dan ZnSO4.
Pengaruhnya dilihat dari pembentukan sedimentasi terbesar dan penentuan OD supernatannya. Pengaruh pH diberikan pada range pH 4-10 pada saat pengujian bioflokulan pada suspensi kaolin. Sedangkan karakterisasi terhadap suhu dilakukan pada suhu 30 oC – 70 oC.
Identifikasi Bakteri
7
diidentifikasi dilakukan pemurnian terhadap isolat potensial dan dilakukan pengamatan morfologi sel di bawah mikroskop, pewarnaan Gram dan identifikasi genus. Hasil identifikasi genus dilanjutkan dengan pengujian karakteristik biokimianya untuk melihat tingkat taksonomi yang lebih rendah lagi (spesies) dan hasil dari pengujian biokimiawi kemudian dicocokkan dengan kunci taksonomi yang terdapat dalam Bergey’s Manual of Determinative Bacteriology.
HASIL DAN PEMBAHASAN
Isolat Bakteri Penghasil Bioflokulan
Indonesia merupakan salah satu negara yang memiliki banyak industri tekstil. Untuk mengolah limbah yang dihasilkannya tidak semua industri di Indonesia menggunakan pengolahan limbah secara biologis. Pada umumnya dalam pengolahan limbah secara biologis digunakan lumpur aktif yang merupakan gumpalan yang terdiri atas ribuan jenis bakteri aerobik dengan komposisi terbanyak adalah bakteri 95% dan 5% merupakan campuran fungi, alga, rotifera, dan protozoa. Proses pengolahan limbah dengan metode lumpur aktif ini lebih aman karena menggunakan campuran mikroorganisme. Bakteri yang berada di dalam lumpur aktif bertanggung jawab dalam mengoksidasi bahan-bahan organik, dan beberapa diantaranya dapat membentuk flok. Beberapa penelitian telah melaporkan bahwa bakteri yang diisolasi dari lumpur aktif yaitu Zooglea ramigera merupakan bakteri pembentuk flok (Shimizu & Odawara 1985).
Bakteri diisolasi dalam penelitian ini dari lumpur aktif yang berasal dari industri tekstil PT Indonesian Toray Synthetics (PT ITS), Tangerang dan PT UNITEX, Bogor. Isolasi bakteri dilakukan dengan metode cawan sebar menggunakan media Nutrient Agar (NA) kemudian diinkubasi selama 16 jam pada suhu 37 oC. Media ini digunakan karena sebagian besar mikroorganisme lebih menyukai media nutrien daripada media lengkap seperti ester pthalate (Kurane et al. 1986). Koloni murni yang memiliki morfologi yang berbeda secara visual baik bentuk atau warna dipilih sebagai bakteri yang akan diuji lebih lanjut kemudian dikumpulkan dalam satu cawan petri yang berisi media NA dan diinkubasi kembali selama 16 jam pada suhu 37 oC (Gambar 4) .
Gambar 4 Isolat-isolat yang diisolasi dari lumpur aktif.
Hasil percobaan diperoleh delapan isolat bakteri dengan bentuk dan warna yang berbeda yaitu lima jenis bakteri berasal dari PT UNITEX dan tiga jenis bakteri berasal dari PT ITS. Semua isolat yang didapat bentuknya bulat, secara umum berwarna putih dan diberi kode sesuai dengan nama sampel yang diambil yaitu LA yang berarti lumpur aktif (Tabel 2). Untuk menghindari terjadinya kontaminasi, masing-masing isolat bakteri yang terpilih ditumbuhkan pada media agar miring (Gambar 5). Setelah ditumbuhkan pada media agar miring, warna dari masing-masing isolat terlihat lebih jelas dan terjadi perubahan warna pada isolat LA-7 dan LA-8 yang asalnya hasil isolasi berwarna putih tipis dan putih bening menjadi hijau berpendar untuk LA-7 dan hijau tua berpendar untuk LA-8.
Tabel 2 Jenis-jenis bakteri hasil isolasi dari lumpur aktif
Jenis isolat
Lokasi pengambilan
sampel
Bentuk/Warna
LA-1 PT UNITEX Bulat/kuning LA-2 PT UNITEX Bulat/ merah kecoklatan LA-3 PT UNITEX Bulat/kuning tebal LA-4 PT UNITEX Bulat/putih tipis LA-5 PT UNITEX Bulat/putih tebal LA-6 PT ITS Bulat/putih keruh LA-7 PT ITS Bulat/putih tipis LA-8 PT ITS Bulat/putih bening
Gambar 5 Isolat-isolat yang diisolasi dari lumpur aktif pada media agar miring.
7
diidentifikasi dilakukan pemurnian terhadap isolat potensial dan dilakukan pengamatan morfologi sel di bawah mikroskop, pewarnaan Gram dan identifikasi genus. Hasil identifikasi genus dilanjutkan dengan pengujian karakteristik biokimianya untuk melihat tingkat taksonomi yang lebih rendah lagi (spesies) dan hasil dari pengujian biokimiawi kemudian dicocokkan dengan kunci taksonomi yang terdapat dalam Bergey’s Manual of Determinative Bacteriology.
HASIL DAN PEMBAHASAN
Isolat Bakteri Penghasil Bioflokulan
Indonesia merupakan salah satu negara yang memiliki banyak industri tekstil. Untuk mengolah limbah yang dihasilkannya tidak semua industri di Indonesia menggunakan pengolahan limbah secara biologis. Pada umumnya dalam pengolahan limbah secara biologis digunakan lumpur aktif yang merupakan gumpalan yang terdiri atas ribuan jenis bakteri aerobik dengan komposisi terbanyak adalah bakteri 95% dan 5% merupakan campuran fungi, alga, rotifera, dan protozoa. Proses pengolahan limbah dengan metode lumpur aktif ini lebih aman karena menggunakan campuran mikroorganisme. Bakteri yang berada di dalam lumpur aktif bertanggung jawab dalam mengoksidasi bahan-bahan organik, dan beberapa diantaranya dapat membentuk flok. Beberapa penelitian telah melaporkan bahwa bakteri yang diisolasi dari lumpur aktif yaitu Zooglea ramigera merupakan bakteri pembentuk flok (Shimizu & Odawara 1985).
Bakteri diisolasi dalam penelitian ini dari lumpur aktif yang berasal dari industri tekstil PT Indonesian Toray Synthetics (PT ITS), Tangerang dan PT UNITEX, Bogor. Isolasi bakteri dilakukan dengan metode cawan sebar menggunakan media Nutrient Agar (NA) kemudian diinkubasi selama 16 jam pada suhu 37 oC. Media ini digunakan karena sebagian besar mikroorganisme lebih menyukai media nutrien daripada media lengkap seperti ester pthalate (Kurane et al. 1986). Koloni murni yang memiliki morfologi yang berbeda secara visual baik bentuk atau warna dipilih sebagai bakteri yang akan diuji lebih lanjut kemudian dikumpulkan dalam satu cawan petri yang berisi media NA dan diinkubasi kembali selama 16 jam pada suhu 37 oC (Gambar 4) .
Gambar 4 Isolat-isolat yang diisolasi dari lumpur aktif.
Hasil percobaan diperoleh delapan isolat bakteri dengan bentuk dan warna yang berbeda yaitu lima jenis bakteri berasal dari PT UNITEX dan tiga jenis bakteri berasal dari PT ITS. Semua isolat yang didapat bentuknya bulat, secara umum berwarna putih dan diberi kode sesuai dengan nama sampel yang diambil yaitu LA yang berarti lumpur aktif (Tabel 2). Untuk menghindari terjadinya kontaminasi, masing-masing isolat bakteri yang terpilih ditumbuhkan pada media agar miring (Gambar 5). Setelah ditumbuhkan pada media agar miring, warna dari masing-masing isolat terlihat lebih jelas dan terjadi perubahan warna pada isolat LA-7 dan LA-8 yang asalnya hasil isolasi berwarna putih tipis dan putih bening menjadi hijau berpendar untuk LA-7 dan hijau tua berpendar untuk LA-8.
Tabel 2 Jenis-jenis bakteri hasil isolasi dari lumpur aktif
Jenis isolat
Lokasi pengambilan
sampel
Bentuk/Warna
LA-1 PT UNITEX Bulat/kuning LA-2 PT UNITEX Bulat/ merah kecoklatan LA-3 PT UNITEX Bulat/kuning tebal LA-4 PT UNITEX Bulat/putih tipis LA-5 PT UNITEX Bulat/putih tebal LA-6 PT ITS Bulat/putih keruh LA-7 PT ITS Bulat/putih tipis LA-8 PT ITS Bulat/putih bening
Gambar 5 Isolat-isolat yang diisolasi dari lumpur aktif pada media agar miring.
8
Media Produksi Bioflokulan
Media produksi bioflokulan digunakan untuk menstimulasi bakteri mengeluarkan bioflokulannya yang merupakan polimer esensial yang diproduksi oleh mikroorganisme pada waktu masa pertumbuhannya (Jie et al. 2005). Komposisi media produksi bioflokulan mengandung yeast ekstract yang bertujuan dalam menstimulasi produksi bioflokulan dan sebagai sumber nitrogen organik yang paling baik untuk pembentukan bioflokulan dibanding sumber nitrogen organik lain. Penambahan yeast ekstract yang paling sesuai adalah pada konsentrasi 0.5 % (Nohata dan Kurane 1994). Selain itu ditambahkan juga urea yang berfungsi sebagai sumber nitrogen anorganik. Senyawa KH2PO4 berfungsi
sebagai sumber energi dan mampu menjaga pH media selama kultivasi agar selalu berkisar pada kondisi pH netral. Glukosa dan sukrosa selain sebagai sumber karbon atau substrat pada media pertumbuhannya juga dapat menstimulasi bioflokulan.
Produksi bioflokulan pada penelitian ini dilakukan setelah propagasi tujuannya untuk mempersiapkan dan mengaktifkan sel sampai pada fase eksponensial sehingga dapat mempercepat fase adaptasi (lag phase) pada waktu produksi bioflokulan. Didalam propagasi tersebut, mikroorganisme melakukan pengaturan metabolisme sintesa enzim dan aktivitas enzim sehingga mampu tumbuh lebih efisien dalam kondisi baru. Bakteri yang telah dipropagasi dinamakan kultur bioflokulan. Kultur bioflokulan diambil 1% kemudian ditumbuhkan pada media produksi bioflokulan dan dikocok dengan kecepatan 180 rpm selama 72 jam pada suhu 27 oC. Waktu yang ditetapkan digunakan sebagai screening untuk menghasilkan kultur bioflokulan dan selanjutnya kultur bioflokulan tersebut diuji aktivitas flokulasinya terhadap suspensi kaolin clay. Penggunaan waktu kultivasi yang lebih lama dimaksudkan untuk memperoleh jumlah bioflokulan yang lebih banyak, dikarenakan adanya kemungkinan terdapatnya jenis bakteri yang lebih lambat dalam mensintesis bioflokulan. Selain itu lamanya waktu yang ditetapkan dikarenakan kurva aktivitas flokulasi paralel dengan kurva pertumbuhan sel dan aktivitas flokulasi meningkat dengan meningkatnya umur biakan ( Jie et al. 2005).
Hasil Pengukuran Aktivitas Flokulasi
Kultur bioflokulan dari isolat bakteri yang terpilih kemudian diuji kemampuan
flokulasinya terhadap suspensi kaolin clay (5.5 g/L) yang merupakan bahan uji standar dalam penentuan aktivitas flokulasi (Kurane et al. 1986). Kedalam suspensi kaolin clay tersebut ditambahkan kultur bioflokulan dari masing-masing isolat sebanyak 1 mL. Selain itu ditambahkan juga FeCl3 dengan
konsentrasi 0.05% (Susanti et al. 2007) dan sisanya ditambah akuades sampai volume akhir 100 mL.
Penentuan aktivitas flokulasi dilakukan dalam dua waktu yaitu, pada lima dan dua menit diawal saat terjadinya flokulasi. Hasil yang diperoleh pada pengamatan lima menit menunjukkan ada ketidaksesuaian antara pengamatan secara visual dengan hasil persentase aktivitas flokulasi yang didapat melalui pengukuran OD supernatan pada ë
550 nm. Hal ini terlihat pada isolat LA-7. Hasil pengamatan secara visual, isolat LA-7 dapat membentuk flok yang lebih besar dan dapat mengendap dengan cepat jika dibandingkan dengan isolat lain khususnya LA-6. Tetapi berdasarkan hasil pengukuran OD supernatan, nilai kekeruhan dari isolat LA-7 tidak jauh berbeda dengan isolat LA-6. Hal ini dikarenakan jika dilihat secara visual aktivitas flokulasi terjadi pada menit-menit pertama sehingga dengan pengamatan yang cukup lama tingkat kekeruhan antara sampel dan kontrol dengan pengambilan supernatan sebanyak 5 mL kurang memberikan perbedaan yang signifikan (Tabel 3).
Pengamatan kedua dilakukan selama dua menit, dengan tujuan untuk membandingkan hasil pengamatan selama lima menit dan dua menit. Hasil dari pengamatan menunjukkan adanya perbedaan yang sangat signifikan dari kedelapan isolat tersebut. Aktivitas flokulasi kultur bioflokulan beberapa isolat cukup bervariasi (Gambar 6). Pada pengamatan selama dua menit, isolat LA-7 dan LA-2 mempunyai persentase aktivitas flokulasi yang lebih besar jika dibandingkan isolat lain. Selain itu diperoleh hasil yang sesuai antara pengukuran OD dengan pengamatan visual terhadap terbentuknya flok dan kecepatan pengendapan (Tabel 4). Dengan mengetahui penurunan turbiditas yang diukur menggunakan spektrofotometer pada ë 550
nm maka aktivitas flokulasi (AF) dapat dihitung mengikuti persamaan AF = (A – B) /A x 100%. Dalam hal ini A adalah optikal densiti kontrol pada ë 550 nm dan B adalah
optikal densiti sampel pada ë 550 nm.
9
Tabel 3 Aktivitas flokulasi dari delapan isolat hasil pengamatan selama lima menit
No Kode isolat OD550 supernatan Aktivitas Flokulasi (%)
1 LA-1 0.109 27.81
2 LA-2 0.062 58.94
3 LA-3 0.113 25.17
4 LA-4 0.092 39.07
5 LA-5 0.108 28.48
6 LA-6 0.088 41.72
7 LA-7 0.092 39.07
8 LA-8 0.127 15.89
9 Kontrol 0.151 -
Tabel 4 Aktivitas flokulasi dari delapan isolat hasil pengamatan selama dua menit
Gambar 6 Aktivitas flokulasi kultur bioflokulan dari delapan isolat terhadap suspensi kaolin pada pengamatan lima menit (=) dan dua menit (=).
Optimasi Waktu Produksi Bioflokulan
Optimasi waktu produksi bioflokulan dilakukan terhadap kultur yang memiliki aktivitas flokulasi tinggi yaitu pada isolat LA-2 dan LA-7. Tujuannya adalah untuk
mengetahui hubungan antara pola perubahan kemampuan flokulasi dengan pola perubahan dari beberapa karakteristik kulturnya seperti pertumbuhan bakteri, pH kultur, dan aktivitas flokulasi. Selain itu untuk mengetahui waktu optimum kultur tersebut menghasilkan bioflokulan. Pengamatan dilakukan dari jam ke 0-96. Penetapan lamanya waktu tersebut karena pada tahap screening produksi bioflokulan dilakukan selama 72 jam selain itu untuk mengetahui masih ada atau tidaknya bioflokulan yang diproduksi setelah 72 jam. Hal tersebut dapat diketahui dengan melakukan pengujian aktivitas flokulasi.
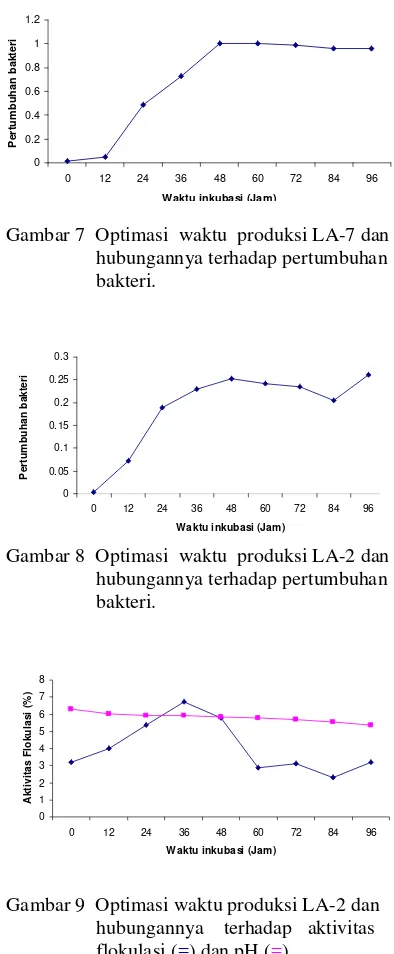
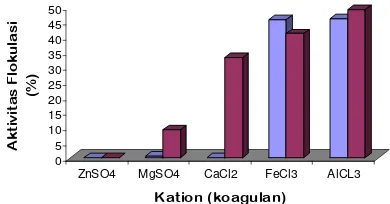
Hasil pengamatan optimasi bioflokulan terhadap isolat LA-7 dapat dilihat pada Gambar 7 sedangkan untuk LA-2 dapat dilihat pada Gambar 8. Dari gambar tersebut dapat dilihat bahwa pertumbuhan bakteri dalam kultur pada kedua isolat terus mengalami peningkatan selama selang waktu kultivasi. Pertumbuhan bakteri dari isolat 2 dan LA-7 memiliki pola yang sama, yaitu pada awal kultivasi meningkat dengan lambat diikuti pertumbuhan yang makin pesat, kemudian mencapai titik maksimum pada jam tertentu dan cenderung menurun pada akhir kultivasi. Laju pertumbuhan menurun akibat persediaan substrat atau nutrien berkurang dan terjadi akumulasi zat-zat metabolik yang menghambat pertumbuhan. Laju pertumbuhan akan menurun terus menerus sampai nilainya sama dengan nol (jumlah sel yang tumbuh sama dengan jumlah sel yang mati). Selanjutnya total massa sel akan konstan, tetapi jumlah sel hidup akan berkurang dan adanya lisis akan menyebabkan penurunan massa sel (Wang et al. 1979).
Pertumbuhan mikroorganisme pada media tertentu terbagi menjadi tiga fase pertumbuhan yaitu, fase awal (lag phase) yang diikuti dengan fase eksponensial atau fase logaritmik, fase stasioner dan fase menurun atau kematian (Wang et al. 1978). Dari data hasil penelitian (Gambar 7 dan Gambar 8) diketahui bahwa fase pertumbuhan lambat tidak terjadi pada produksi mikrobial karena isolat-isolat tersebut sebelum di produksi dilakukan dulu propagasi. Propagasi bertujuan untuk mempersiapkan sel sampai pada fase eksponensial. Fase eksponensial terjadi mulai jam ke 12 sampai jam ke 48 untuk LA-2 dan jam ke 60 untuk LA-7. Hal ini dapat terlihat dari makin meningkatnya OD bakteri pada pengukuran spektrofotometre
ë 550 nm. Fase stasioner dan fase kematian
terjadi apabila jumlah sel yang tumbuh sama jumlahnya dengan sel yang mati. Fase No Kode
isolat OD550 supernatan Aktivitas Flokulasi (%)
1 LA-1 0.121 57.54
2 LA-2 0.082 71.23
3 LA-3 0.099 18.60
4 LA-4 0.112 60.70
5 LA-5 0.154 45.96
6 LA-6 0.137 14.80
7 LA-7 0.083 70.87
8 LA-8 0.184 35.44
9 Kontrol 0.285 -
0 10 20 30 40 50 60 70 80 A k ti v it a s F lo k u la s i (% )
LA-1 LA-2 LA-3 LA-4 LA-5 LA-6 LA-7 LA-8
10
stasioner terjadi pada jam ke 60 untuk LA-2 dan jam ke 72 untuk LA-7 dan kemudian diikuti oleh fase kematian. Hal ini dapat dilihat dari nilai OD bakteri yang semakin menurun. Fase kematian terjadi disebabkan oleh terbatasnya jumlah substrat yang akan digunakan untuk pertumbuhan dan terbentuknya metabolit sekunder yang diperkirakan dapat menghambat pertumbuhan mikroorganisme. Hal ini juga dapat disebabkan oleh menurunnya produk (bioflokulan) yang merupakan sumber cadangan makanan untuk bakteri.
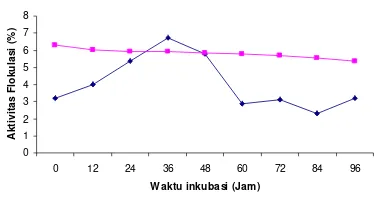
Optimasi waktu produksi bioflokulan dari kedua isolat potensial jika dilihat hubungannya terhadap pH terus mengalami penurunan pada kulturnya hingga jam ke 96 dengan sedikit fluktuasi (Gambar 9 dan Gambar 10). Penurunan pH kultur ini terjadi karena terbentuknya asam-asam organik hasil fermentasi glukosa dan sukrosa yang digunakan sebagai sumber karbon dalam medium pertumbuhannya. Selain itu turunnya nilai pH dapat dijadikan indikasi bahwa pertumbuhan mikroorganisme telah mengalami fase stasioner. Pada fase stasioner ini mikroorganisme tidak memproduksi biomassa sehingga proses metabolismenya menurun dan asam yang merupakan produk sampingnya tidak dihasilkan lagi.
Aktivitas flokulasi diukur berdasarkan tingkat kejernihan larutan yang mengandung kaolin yang ditambahkan kultur bioflokulan. Setelah didiamkan selama dua menit akan terbentuk agregat-agregat yang lebih besar yang mempercepat proses pengendapan. Aktivitas flokulasi dari kultur bakteri LA-2 dan LA-7 meningkat selama selang waktu kultivasi seiring dengan terus meningkatnya pertumbuhan bakteri pada kulturnya. Aktivitas flokulasi mencapai puncaknya pada awal fase pertumbuhan eksponensial. Hal ini menunjukkan bahwa pembentukkan bioflokulan terkait dengan pertumbuhan sel-sel bakteri dalam kultur. Penurunan aktivitas flokulasi seperti yang terlihat pada grafik dapat disebabkan oleh kultur bioflokulan yang sedikit dan juga disebabkan oleh kultur bioflokulan yang mempunyai tingkat kekeruhan tinggi yang mengakibatkan bertambah keruhnya larutan.
Aktivitas flokulasi optimum untuk kedua isolat dicapai pada jam ke 36 dengan persentase sebesar 67.25% untuk LA-2 dan 64.04% untuk LA-7 pada pH 5.92 dan 5.19 dan OD bakteri 0.229 dan 0.729 (Gambar 9 dan Gambar 10).
Gambar 7 Optimasi waktu produksi LA-7 dan hubungannya terhadap pertumbuhan bakteri.
Gambar 8 Optimasi waktu produksi LA-2 dan hubungannya terhadap pertumbuhan bakteri. 0 1 2 3 4 5 6 7 8
0 12 24 36 48 60 72 84 96
Waktu inkubasi (Jam)
A k ti v it a s F lo k u la s i (% )
Gambar 9 Optimasi waktu produksi LA-2 dan hubungannya terhadap aktivitas flokulasi (=) dan pH (=).
Gambar 10 Optimasi waktu produksi LA-7 dan hubungannya terhadap aktivitas flokulasi (=) dan pH (=).
0 0.2 0.4 0.6 0.8 1 1.2
0 12 24 36 48 60 72 84 96
Waktu inkubasi (Jam)
P e rt u m b u h a n b a k te ri 0 1 2 3 4 5 6 7
0 12 24 36 48 60 72 84 96
Waktu inkubasi (Jam)
A k ti v it a s F lo k u la s i (% ) 0 0.05 0.1 0.15 0.2 0.25 0.3
0 12 24 36 48 60 72 84 96
Waktu inkubasi (Jam)
11
Karakterisasi Bioflokulan
Karakterisasi bioflokulan dilakukan untuk mengetahui kondisi optimum dari bioflokulan tersebut terhadap hubungannya dengan kation (koagulan), pH, dan suhu. Karakterisasi dilakukan terhadap isolat LA-2 dan LA-7 yang merupakan isolat potensial.
Karakterisasi bioflokulan dari kedua isolat potensial terhadap kation dilakukan dengan menggunakan ZnSO4, MgSO4, CaCl2,
FeCl3, dan AlCl3. Alasan pemilihan
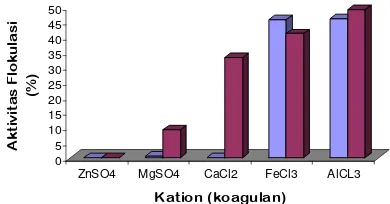
kation-kation ini adalah untuk membandingkan kekuatan valensi ion dari kation-kation tersebut terhadap kemampuannya dalam memflokulasi koloid-koloid dalam suspensi kaolin. Menurut Siregar (2005) valensi ion akan berpengaruh terhadap proses koagulasi. Ion yang memiliki muatan berlawanan dengan koloid akan dinetralkan kemudian diendapkan melalui proses koagulasi. Semakin besar valensi koagulan maka efektivitas gaya koagulasi makin besar.
Kation yang paling efektif dalam memflokulasikan suspensi kaolin adalah AlCl3 dengan pengamatan selama dua menit.
Aktivitas flokulasi yang diperoleh sebesar 46.12% untuk LA-2 dan 49.16% untuk LA-7 (Gambar 11). Aktivitas flokulasi yang cukup besar ini diperoleh karena AlCl3 merupakan
kation multivalen yang memiliki ion valensi lebih tinggi (+3) daripada ion-ion lain. Sehingga kemampuannya dalam mengikat koloid-koloid bermuatan negatif dalam suspensi kaolin semakin besar. Karena sifat muatannya yang lebih positif, kation multivalen ini akan menggantikan posisi kation monovalen yang terikat pada partikel bermuatan negatif sehingga terbentuk agregat-agregat. Agregat-agregat tersebut merupakan ikatan antara bioflokulan, ion Al3+ dan padatan yang tersuspensi. Semakin besar agregat yang terbentuk berarti semakin besar pula flok dan bobot yang dihasilkan sehingga mempermudah terjadinya pengendapan.
Kation AlCl3 dan FeCl3 sama-sama
merupakan kation multivalen. Jika dilihat dari hasil uji flokulasi, kedua kation tersebut dapat digunakan sebagai koagulan yang baik. Tetapi pada penelitian ini setelah dibandingkan keefektifannya antara kedua kation multivalen tersebut, AlCl3 memiliki aktivitas flokulasi
lebih tinggi daripada FeCl3 dengan perbedaan
yang sangat kecil (Gambar 11). Oleh karena itu pada tahap optimasi selanjutnya menggunakan kation AlCl3 sebagai koagulan.
Sama halnya dengan kation bervalensi dua pada ZnSO4, MgSO4, CaCl2. Kation-kation
tersebut memiliki valensi ion yang sama yaitu (+2) tetapi jika dilihat dari hasil penelitian ketiga kation tersebut memiliki kemampuan memflokulasi yang berbeda-beda setelah penambahan kultur bioflokulan. Isolat LA-7 memiliki kemampuan memflokulasi hampir pada semua kation yang digunakan kecuali pada ZnSO4. Berbeda dengan isolat LA-2 yang
hanya memiliki kemampuan flokulasi pada penambahan kation AlCl3 dan FeCl3 saja.
Gambar 11 Hubungan kation (koagulan) dengan aktivitas flokulasi isolat LA-2 (=) dan LA-7 (=).
Rentang pH dalam proses koagulasi-flokulasi merupakan salah satu faktor penting untuk mengetahui kondisi optimum dari bioflokulan dan koagulan yang digunakan. AlCl3 merupakan koagulan yang paling efektif
diabandngkan dengan koagulan lainnya. AlCl3
dan bioflokulan kemudian dioptimasi terhadap pH pada rentang 4-10. Hasil dari optimasi terhadap koagulan dan bioflokulan diperoleh pada pH 6. Untuk koagulan kondisi ini berada dalam spesi bermuatan positif sehingga spesi yang bermuatan positif tersebut akan segera teradsorpsi oleh permukaan koloid (Gambar 12). Proses flokulasi biasanya menggunakan flokulan dalam bentuk polimer organik yang monomer-monomernya dapat terionisasi (Turkman & Uslu 1991). Proses ionisasinya merupakan suatu reaksi kesetimbangan yang dapat dipengaruhi oleh perubahan pH larutan. Penambahan bioflokulan dilakukan pada rentang pH 4–10, dimana setelah dilakukan uji flokulasi bioflokulannya efektif pada pH 6. Hal ini dapat diketahui dari presentase aktivitas flokulasi dari kultur bioflokulan isolat LA-2 dan LA-7 yaitu sebesar 55.05% untuk LA-2 dan 47.22% untuk LA-7.
Karakterisasi bioflokulan terhadap suhu dilakukan setelah diperoleh kondisi optimum untuk bioflokulan terhadap kation dan pH. Suhu merupakan salah satu faktor yang berpengaruh terhadap proses
koagulasi-0 5 10 15 20 25 30 35 40 45 50 A k ti v it a s F lo k u la s i (% )
ZnSO4 MgSO4 CaCl2 FeCl3 AlCL3
12
0 10 20 30 40 50 60 A k ti fi ta s F lo k u la s i (% )30 40 50 60 70
Suhu
flokulasi. Pada suhu air dingin (jauh dibawah temperatur standar, 25 oC) dapat menambah kesulitan pada proses koagulasi (http://www.geocities.com). Pada temperatur tersebut kebanyakan reaksi kimia berjalan lebih lambat, sehingga penambahan koagulan pada air menghasilkan proses koagulasi yang kurang efisien oleh karena itu konsesntrasi koagulan yang besar diperlukan untuk mengganti kerugian pengaruh tersebut. Optimasi bioflokulan terhadap suhu dilakukan mulai suhu 30 oC – 70 oC. Karakterisasi bioflokulan LA-2 dan LA-7 dilakukan menggunakan koagulan efektif yaitu AlCl3
dan pH yang optimum. Hasil dari penelitian terhadap suhu pada kondisi optimum dengan penambahan bioflokulan, diperoleh hasil yang paling tinggi dengan presentase aktivitas flokulasi terbesar yaitu pada suhu 30 oC. Presentase dari kedua isolat tersebut diperoleh 54.24% untuk LA-2 dan 49.36% untuk LA-7 (Gambar 13). Bioflokulan dari kedua isolat tersebut masih menunjukkan akifitasnya pada suhu 40-70 dengan persentase yang relatif terus menurun.
Gambar 12 Hubungan antara pH suspensi kaolin dengan aktivitas flokulasi isolat LA-2 (=) dan LA-7 (=).
Gambar 13 Hubungan antara suhu bioflokulan dengan aktivitas flokulasi isolat LA-2 (=) dan LA-7 (=).
Identifikasi Bakteri
Identifikasi bakteri dilakukan terhadap isolat yang mempunyai aktivitas flokulasi tinggi yaitu isolat LA-2 dan LA-7. Tujuan dari identifikasi bakteri ini adalah untuk mengetahui jenis dan spesies bakteri tersebut dan patogenitasnya terhadap manusia. Sehingga jika digunakan dalam berbagai industri bersifat aman. Pewarnaan Gram dilakukan untuk mengetahui morfologi bakteri tersebut. Pewarnaan Gram dilakukan di Laboratorium Taksonomi, Lembaga Ilmu Pengetahuan Indonesia (LIPI).
Hasil yang diperoleh melalui pewarnaan Gram diamati di bawah mikroskop pada perbesaran 10 x 100. Setelah dilakukan pewarnaan Gram diperoleh Gram negatif untuk kedua isolat dengan bentuk kokus untuk LA-2 dan basil untuk LA-7 (Gambar 14 dan Gambar 15). Identifikasi bakteri dilakukan oleh Balai Penelitian Veteriner (BALITVET). Hasil dari identifikasi didapat jenis bakteri Pseudomonas diminuta untuk LA-7 dan Flavobacterium sp. untuk LA-2. Menurut Nakamura et al. (1976) mikrob penghasil flok yang diisolasi dari lumpur aktif sangat terbatas pada bakteri seperti Pseudomonas, Zooglea, Alcaligenes, Flavobacterium, Nocardia, dan lain-lain.
Gambar 14 Morfologi isolat LA-2 dengan pewarnaan Gram.
Gambar 15 Morfologi isolat LA-7 dengan pewarnaan Gram. 0 10 20 30 40 50 60 A k ti v it a s F lo k u la s i (% )
4 5 6 7 8 9 10
ISOLASI DAN OPTIMASI FLOKULASI MIKROB POTENSIAL
PENGHASIL BIOFLOKULAN DARI LUMPUR AKTIF
PURNAMA DEWI
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
13
SIMPULAN DAN SARAN
Simpulan
Isolasi bakteri dari lumpur aktif industri tekstil diperoleh delapan isolat dengan morfologi dan warna yang berbeda untuk setiap jenis bakteri. Diperoleh dua isolat dengan aktivitas flokulasi tinggi yaitu LA-2 dan LA-7 dengan persentase 71.23% untuk LA-2 dan 70.87% untuk LA-7. Kedua isolat potensial tersebut optimum memproduksi bioflokulannya pada jam ke 36 dengan kondisi optimum AlCl3 sebagai koagulan, pH
6, dan suhu 30 oC. Hasil pewarnaan Gram kedua isolat diperoleh Gram negatif dengan bentuk kokus untuk 2 dan basil untuk LA-7. Hasil identifikasi diperoleh bakteri Pseudomonas diminuta untuk LA-7 dan Flavobacterium sp. untuk LA-2.
SARAN
Saran untuk penelitian lanjutan adalah perlu diadakannya pemurnian terhadap bioflokulan yang dihasilkan dari bakteri sehingga dapat diketahui jenis dari bioflokulan tersebut. Selain itu perlu dilakukan uji efektifitas dari kedua isolat yang didapat terhadap limbah industri tekstil.
DAFTAR PUSTAKA
Anonim. 2002. Metode pengujian koagulasi, flokulasi, filtrasi bertekanan. SNI19-6784-2002 (PD M-37-2000-93).
Achyani. 1999. Pengaruh dosis bioflokulan bakteri Alcaligenes latus dan alum terhadap proses flokulasi limbah cair pabrik tapioka [tesis]. Bogor: Institut Pertanian Bogor.
Ajeng T. 1999. Aplikasi bioflokulan Alcaligenes latus dan CaCl2 untuk
menangani limbah cair organik industri tapioka [tesis]. Bogor: Institut Pertanian Bogor.
Belmonts WTA. 1996. Coagulation. http://www.geocities.com/CaveCanave ral/3000/juli/coag.htm. [April 2002].
Benefield et al. 1982. Process Chemistry for Water and Wastewater Treatment. New York:Printice Hall.
Cheremisinoff PN. 1987. Wastewater Treatment. London: Publishing.
Dermlim et al. 1999. Screening and characterization of biofloculant produced by isolated Klabsiella sp. J Appl Microbiol Biotechnol 52:698-703. Eckenfelder WW. 1989. Industrial Water
Pollution Control. Ed ke-2. Boston: McGraw-Hill.
Elida N. 2001. Optimasi proses koagulasi flokulasi pada limbah cair yang mengandung melanoidin. 2001. J Ilmu dasar 2 (1):61-67. http://www.unej.ac.id/ fakultas/mipa/vol2,no2/optimasi%20pros
Farrah SR, Richard F. 1976. Isolation of exocelluler polymer from zoogloea strain MP6 and 106 and from activated sludge. Applied and Enviromental Mikrobiologi 32 (1): 33-37.
Jenkins D. 1993. Manual on the Cause & Control of Activated Sludge Bulking and Forming. Ed ke-2. London: Lewis Publisher.
Jie G et al. 2005. Characterization of a bioflocculant from a newly isolated Vagococcus sp. W31. J of Zheijiang University Science B 7: 186-192.
Kurane R et al. 1986. Screening for and characteristic of microbial flokulan. Agric. Biol. Chem 50: 2301-2307. --- 1986. Culture
condition for production of microbial flocculant by Rhodococcus erythropolis. Agric. Biol. Chem 50 (9): 2309-2313. Manahan SE. 1994. Environmental Chemistry.
Ed ke-6. London: Lewis Publisher.
14
Metcalf, Eddy. 1981. Wastewater Engineering Collection. New Delhi: Tata.McGraw-Hill.
Milono P. 1998. Bioflokulasi Mikroorganisme dan Peranannya dalam Pengolahan Air Limbah secara Biologis, JKTI, 8, No. 1-2, Desember.
Parwono A. 1998. Uji kemampuan flokulasi dan aktivitas flokulasi isolat bakteri potensial penghasil bioflokulan pada suspensi kaolin [skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Pelczar MJ, Chan. 1986. Dasar-Dasar Mikrobiologi. Jakarta: UI Pr.
Sari YF. 2003. Flokulan alternatif melastoma polyantum B. : Optimasi dan aplikasinya dalam proses pengolahan limbah cair industri tekstil [skripsi]. Bandung: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Pendidikan Indonesia.
Sawyer et al. 1994. Chemistry for Environmental Engineering. Ed ke-4. Singapore : Mc. Graw-Hill.
Shimizu N, Yooji O. 1985. Flock-forming bacteria isolated from activated sludge in high-BOD loading treatment. Fermen Technol 63:67-71.
Siregar SA. 2005. Instalasi Pengolahan Air Limbah. Yogyakarta: Kanisius. Stumm, Omelia. 1968. Stoichiometry of
Coagulation University of North Carolina: Chappel Hill.
Sumarno L. 2000. Studi kinetika pertumbuhan Alcaligenes latus pada produksi bioflokulan menggunakan medium hidrolisat pati ubi jalar [skripsi]. Bogor: Institut Pertanian Bogor.
Suryadarma P. 1997. Studi kinetika produksi bioflocculant Alcaligenes latus pada substrat hidrolisat limbah padat (serbuk kayu) industri pulp dan kertas [skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Turkman, Uslu. 1991. Polymer Application Examples in Industrial Wastewater Treatment. Turkey: Dukuz Eylul Unuversity. Izmir..
Takeda M et al. 1992. Factors affecting the activity of a protein bioflocculant produced by Nocardia amarae. Journal of Fermentation and bioengineering 71: 408-409.
Vincent JF et al. 2000. Structure and properties of the exopolysaccarida producced by Streptococcus macedonicus Sc 136. Glikobiologi 11 (2): 131-139.
Yokoi H et al. 1998. Biopolymer floculant produced by an Pseudomonas sp. Biotechnology Technicuques 12 (7): 511-514.
Yu-lu W et al. 2005. A Novel biofloculant poducced by Enterobacter aerogenes and its use in defecating the trona suspension. J Biochem Engineering 27: 1-7.
Wang et al. 2001. Production of an exopolysaccaharide bioflocculant by Sorangium cellulosum. Letter in Applied Microbiology 34 : 178-181. --- 2002. Characterization of
ISOLASI DAN OPTIMASI FLOKULASI MIKROB POTENSIAL
PENGHASIL BIOFLOKULAN DARI LUMPUR AKTIF
PURNAMA DEWI
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
PURNAMA DEWI. Isolasi dan Optimasi Flokulasi Mikrob Potensial Penghasil
Bioflokulan dari Lumpur Aktif. Dibimbing oleh LAKSMI AMBARSARI dan I MADE
ARTIKA.
Bioflokulan merupakan polimer esensial yang diproduksi oleh mikroorganisme
pada masa pertumbuhannya. Penelitian ini bertujuan untuk mendapatkan bioflokulan
dengan aktivitas flokulasi tinggi melalui proses isolasi mikrob, produksi, dan optimasi
bioflokulan. Delapan isolat diperoleh dengan morfologi dan warna berbeda. Semua
isolat ditumbuhkan dalam media produksi bioflokulan selama 72 jam dan diuji aktivitas
flokulasinya terhadap suspensi kaolin.
Berdasarkan hasil diperoleh dua isolat dengan aktivitas flokulasi tinggi yaitu
isolat LA-2 sebesar 71.23% dan LA-7 sebesar 70.87%. Berdasarkan hasil, diperoleh
waktu optimum kedua isolat pada jam ke 36 dengan aktivitas flokulasi sebesar 64.04%
untuk LA-7 dan 67.25% untuk LA-2. Hasil karakterisasi memperlihatkan bahwa kedua
isolat tersebut optimum menggunakan AlCl
3dengan aktivitas flokulasi 46.12% untuk
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan
karunia yang telah diberikan sehingga penulis dapat menyelesaikan karya ilmiah ini.
Karya ilmiah ini merupakan salah satu syarat memperoleh gelar Sarjana Sains pada
Program Studi Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Penelitian
ini dilaksanakan dari bulan Februari 2007 sampai Agustus 2007 dengan judul Isolasi
dan Optimasi Flokulasi Mikroba Potensial Penghasil Bioflokulan dari Lumpur Aktif.
Terimakasih penulis sampaikan kepada Ibu Dr. Laksmi Ambarsari, M.S. selaku
pembimbing pertama, dan Bapak Ir. I Made Artika, M. App. Sc. selaku pembimbing
kedua yang telah membimbing dengan penuh kesabaran, memberi masukan, dan
mengajarkan penulis banyak hal hingga terselesaikannya karya ilmiah ini. Ucapan
terimakasih juga penulis sampaikan kepada DIKTI yang telah mendanai penelitian ini
hingga selesai serta kepada Bapak, Mama, Farid, Lina, A Doni atas segala materi,
dukungan, perhatian, kasih sayang, dan doanya. Tak lupa penulis sampaikan
terimakasih kepada Kak Dimas, Kak Algi, Sri, serta teman-teman biokimia 40, Eka, Efi,
Ratna, Nia, Kak Novan, Henri, Meti, Dini, dan Adi atas semua bantuan, dukungan dan
semangatnya juga kepada seluruh laboran dan staf biokimia atas kerjasama dan fasilitas
yang telah diberikan.
Penulis menyadari bahwa karya ilmiah ini masih jauh dari sempurna. Penulis
berharap karya ilmiah ini dapat bermanfaat untuk penulis, pembaca, dan bagi pihak
yang membutuhkan.
Bogor, September 2007
RIWAYAT HIDUP
Penulis dilahirkan di Garut tanggal 06 Maret 1985. Penulis merupakan putri
pertama dari tiga bersaudara dari pasangan Osa Kosasih dan Nani Rohani.
ISOLASI DAN OPTIMASI FLOKULASI MIKROB POTENSIAL
PENGHASIL BIOFLOKULAN DARI LUMPUR AKTIF
PURNAMA DEWI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
1
Judul Skripsi : Isolasi dan Optimasi Flokulasi Mikrob Potensial Penghasil
Bioflokulan dari Lumpur Aktif
Nama
: Purnama Dewi
NIM
: G44103028
Disetujui
Komisi Pembimbing
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131 473 999
Tanggal Lulus :
Dr. Laksmi Ambarsari, M.S.
Ketua
Dr. Ir. I Made Artika, M.App.Sc.
2
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR . ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN . ... 1
TINJAUAN PUSTAKA
Proses Koagulasi ... 1
Proses Flokulasi ... 2
Mikroorganisme dalam lumpur aktif... 3
Pertumbuhan Mikroorganisme ... 4
Bioflokulan ... 4
Kebutuhan Fisik dan Lingkungan Mikroorganisme ... 5
Faktor-Faktor yang Mempengaruhi Aktivitas Flokulasi ... 5
BAHAN DAN METODE
Alat dan Bahan ... 5
Metode Penelitian ... 6
HASIL DAN PEMBAHASAN
Isolasi Bakteri Penghasil Bioflokulan ... 7
Media Produksi Bioflokulan ... 8
Hasil Pengukuran Aktifitas Flokulasi ... 8
Optimasi Waktu Produksi Bioflokulan ... 9
Karakterisasi Bioflokulan ... 10
Identifikasi Bakteri ... 12
SIMPULAN DAN SARAN
3
DAFTAR TABEL
Halaman
1 Perbandingan kekuatan koagulasi relatif dari beberapa elektrolit... 2
2 Jenis-jenis bakteri hasil isolasi dari lumpur aktif ... 7
3 Aktivitas flokulasi delapan isolat hasil pengamatan selama lima menit ... 9
4 Aktivitas flokulasi delapan isolat hasil pengamatan selama dua menit ... 9
DAFTAR GAMBAR
Halaman
1 Skema reaksi antara partikel koloid dengan polimer ... 2
2 Lumpur aktif pada pengolahan limbah cair industri tekstil ... 4
3 Kurva pertumbuhan mikroorganisme ... 4
4 Isolat-isolat yang diisolasi dari lumpur aktif ... 7
5 Isolat-isolat yang diisolasi dari lumpur aktif pada media agar miring ... 7
6 Aktivitas flokulasi kultur bioflokulan dari delapan isolat terhadap
suspensi kaolin pada pengamatan lima menit dan dua menit ... 9
7 Optimasi waktu produksi LA-7 dan hubungannya terhadap pertumbuhan
bakteri ... 10
8 Optimasi waktu produksi LA-2 dan hubungannya terhadap pertumbuhan
bakteri ... 10
9 Optimasi waktu produksi LA-2 dan hubungannya terhadap aktivitas
flokulasi dan pH ... 10
10 Optimasi waktu produksi LA-7 dan hubungannya terhadap aktivitas
flokulasi dan pH ... 10
11 Hubungan kation (koagulan) dengan aktivitas flokulasi isol