PEROKSIDASI LIPJD, AKTIVITAS SOD, DAN SEKRESI
ASAM SITRAT PADA PAD1 LOKAL INDONESIA SELAMA
MENDAPAT CEKAMAN ALUMINIUM
EKA WAHYUNINGSIH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis berjudul " Peroksidasi Lipid, Aktivitas SOD, dan Sekresi Asam Sitrat pada Padi Lokal Indonesia selama Mendapat Cekaman A1
" adalah karya saya dengan arahan dari komisi peinbimbing dan beluin diajukan dalam
bentuk apapun kepada perguruan tinggi inanapun. Sumber informasi yailg berasal atau dikutip dari karya yang diterbitkan maupun yailg tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juni 2009
Eka Wahyuningsih
ABSTRACT
EKA WAHYUNINGSIH. Lipid peroxydation, SOD activity, and citrate acid secretion in Indonesia for local rice get Aluminum stress. Dibimbing ole11 Dr. Ir. MIFTAHUDIN, M.Si and Dr. Ir. HAMIM, M.Si.
Aluminum (Al) is the main constraint of plant growth and production on acid soil. This research aims to study the accumulation and distribution of A1 in relation to lipid peroxydation of cell membrane, the activity of superoxide dismutase (SOD) enzyme, and the secretion of citric acid on local Indonesian rice under A1 stress condition. Four rice varieties, i.e.: IR64 (Al-sensitive), Hawarabunar, Grogol and Krowal Panjang, were used in this study. The Al treatment was given hydrophonically to four-days old rice seedlings as ~ 1 ~ ' i n the form of A1CI3.6Hz0 at 15 ppm Al for 72 hours. The parameters observed in the experiment were Root Regrowth, Al accumulation, lipid peroxidation, SOD enzyme activity and citric acid secretion. Root regrowth analysis showed that the primary root of rice var. IR64 had lower ability to grow after Al-stressed treatment than that of rice var. Hawarabunar, Grogol and Krowal Panjang. The root of Al-sensitive variety (IR64) showed higher lipid peroxidation, higher Al accumulation, and lower SOD activity than that of the other three varieties under 15 ppm Al stress. Analysis of citrate secretion showed that the Al-stressed root of rice var. IR64 secreted less citrate than that of those three varieties. The citrate secretion phenomenon was also analyzed in an F2 population derived from the cross between rice var. IR64 and Hawarabunar. The analysis showed that the citrate secretion character was controlled by two dominant epistatic genes.
RINGKASAN
EKA WAHYUNINGSIH. Peroksidasi lipid, aktivitas SOD, dan sekresi asam sitrat pada padi lokal Indonesia selama mendapat cekaman Aluminium.
Dibimbing oleh Dr. Ir. MIPTAHUDIN, M.Si dan Dr. Ir. HAMIM, M.Si.
Pengembangan padi (Oryza sativa L.) pada lahan kering dihadapkan pada
kendala-kendala seperti keasaman tanah (pH 3,5 - 5,5), kahat hara makro dan mikro dan tingkat kejenuhan aluminium (Al) tinggi. Tingginya konsentrasi A1 pada tanah asam berpengaruh buruk terhadap sistem perakaran yang meliputi pertumbuhan akar terhambat, pendek, tebal, percabangan akar tidak normal sehingga menyebabkan gangguan penyerapan hara mineral oleh tanaman. Cekaman A1 pada akar padi dapat menyebabkan peningkatan peristiwa peroksidasi lipid dan perubahan aktivitas SOD agar tanaman mampu beradaptasi pada lahan yang mengandung A1 tinggi. Untuk mengatasi masalah tersebut, salah satu cara adalah menggunakan varietas toleran terhadap cekaman Al. Untuk memperoleh varietas tersebut diperlukan informasi tentang latar belakang fisiologi dan pola pewarisan sifat toleransi terhadap cekaman A1 dari suatu varietas padi yang akan dijadikan tetua dalam pemuliaan. Tujuan penelitian ini adalah mempelajari akumulasi dan distribusi A1 dan hubungannya dengan terjadinya peroksidasi lipid, perubahan aktivitas SOD, dan sekresi asam organik pada padi lokal Indonesia dalam kondisi cekaman Al. Varietas padi yang digunakan pada penelitian ini addah varietas IR64 (sensitif Al), Hawarabunar, Grogol dan Krowal Panjang. Kecambah padi yang berum~u 4 hari ditumbuhkan pada media air dengan hara minimum diberi perlakuan A1 dalam bentuk AICl3.6H20 dengan
konsentrasi 15 ppm selama 72 jam.
Analisis Root Regrowth (RRG) pada tanaman dengan cekaman A1 15 ppm
selama 72 jam dan masa pemulihan (recovery) pada kultur hara tanpa A1 selama
48 jam diperoleh hasil bahwa varietas IR64 yang bersifat sensitif A1 memiliki kemampuan recovery yang jauh lebih rendah dibandingkan varietas Hawarabunar, Grogol dan Krowal Panjang.
Analisis akumulasi A1 pada ujung akar dengan metode histokimia diperoleh hasil bahwa akumulasi A1 ditemukan pada daerah ujung akar sampai daerah 1 mm dari ujung akar, yaitu pada tudung a k a , meristematik akar dan daerah perpanjangan, sedangkan distribusi A1 dalam jaringan ditemukan pada dinding sel, apoplas dari korteks dan epidermis akar. Dari analisis kuantitatif diperoleh hasil bahwa konsentrasi A1 pada varietas IR64 lebih tinggi daripada varietas Hawarabunar, Grogol dan Krowal Panjang. Hal ini menunjukan bahwa varietas Hawarabunar, Grogol dan Krowal Panjang yang merupakan varietas lokal mampunyai kemampuan menyerap dan mengakumulasi A1 lebih lambat dan lebih sedikit daripada varietas IR64.
efektif pada varietas Hawarabunar, Grogol dan Krowal Panjang untuk meminimalkan pengaruh dari peroksidasi lipid dan memelihara struktur membran dari kerusakan. Tingginya aktivitas enzim SOD pada perlakuan A1 diduga sangat efisien sebagai mekanisme pertahanan tanaman dalam menghadapi cekaman
oksidatif. Aktivitas SOD pada varietas Hawarabunar, Grogol. Dan Krowal
Panjang lebih tinggi dari pada varietas IR64, ini berarti bahwa ketiga varietas
tersebut memiliki kemampuan sintesis SOD lebih tinggi pada saat mendapatkan cekaman oksidatif untuk mengelimenir kerusakan sel.
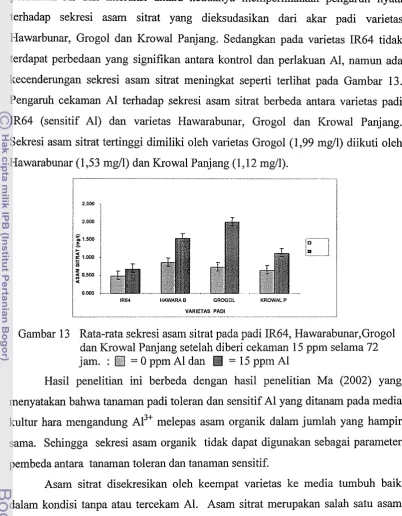
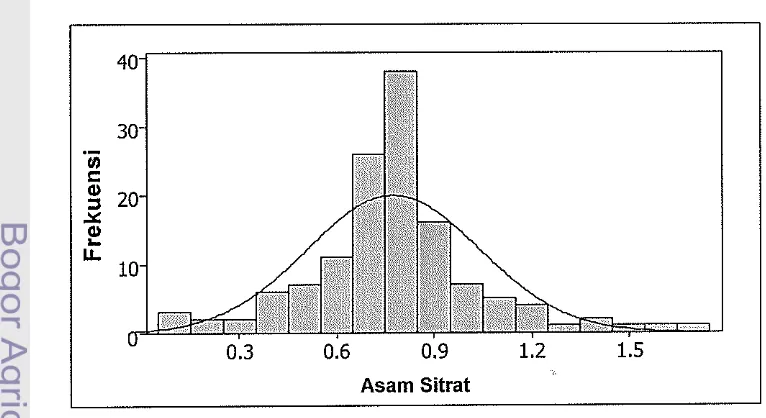
Kandungan asam sitrat dari media turnbuh akar padi yang dianalisis secara enzimatik menunjukan bahwa perlakuan A1 menginduksi sekresi asam sitrat dari akar padi. Sekresi asam sitrat pada varietas-varietas Hawarabunar, Grogol dan Krowal Panjang lebih tinggi daripada varietas IR64 saat diberikan cekaman Al. Hal ini menunjukan bahwa varietas toleran mempunyai mekanisme ekstemal yang lebih tinggi untuk mengkelat A1 pada daerah rhizofer, sebaliknya
asam sitrat yang disekresikan dari varietas IR64 tidak cukup untuk mengkelat Al
pada rhizofer. Berdasarkan analisis korelasi antar peubah, maka selain nilai RRG, sekresi asam sitrat dapat dijadikan parameter toleransi Al pada padi. Kisaran sekresi asam sitrat 0,77 mgll dijadikan batas pembeda kelompok padi sensitif dan toleran Al. Jika nilai asam sitrat < 0,77 mgll maka tanaman digolongkan padi sensitif A1 dan jika nilai sekresi asam sitrat > 0,77 mgll maka tanaman digolongkan ke padi toleran Al. Pola segregasi asam sitrat pada F2 mengikuti
pola pewarisan dihibrid (9:7), yang menunjukan bahwa sekresi asam sitrat
dikendalikan oleh dua gen yang berinteraksi secara komplementasi.
O
Hak Cipta milik Institut Pertanian Bogor, tahun 2009
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantutnkan atau tnenyebutkan sumbernya. Pengutipan hanya unttlk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatzi nasala ah;
dun pengutipnn tidak tnerugikan kepentingan yang wajar IPB.
PEROKSIDASI LIPID, AKTIVITAS SOD, DAN SEKRESI
ASAM SITRAT PADA PADS LOKAL INDONESIA SELAMA
MENDAPAT CEKAMAN ALUMINIUM
EKA WAHYUNINGSIH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Biologi Tumbuhan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Peroksidasi Lipid, Aktivitas SOD, dan Sekresi Asam Sitrat pada Padi Lokal Indonesia selama Mendapat Cekaman A1
Nama : Eka Wahyuningsih
NIM : G353070091
Departemen : Biologi
Disetujui
Komisi Pembimbing
Dr. Ir. Miftahudin. M.Si Ketua
Diketahui
Dr. Ir. Hamim, M.Si Anggota
Ketua Mayor Biologi
w
-
A
Dr. Ir. Miftahudin, M.Si
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Tema penelitian yang dilaksanakan sejak bulan April 2008 ini adalah cekaman Aluminium dengan judul Peroksidasi Lipid, aktivitas SOD, dan Sekresi Asam Sitrat pada Padi Lokal Indonesia Selaina Mendapat Cekaman Al.
Penelitian ini merupakan bagian dari proyek penelitan KKP3T berjudul "Pengembangan Galur Padi Toleran Aluminium melalui Aplikasi Marka Molekular pada Populasi Silang Balik " atas nama Dr. Ir. Miftahudin, MSi.
Terima kasih penulis ~icapkan kepada Dr. Ir. Miftahudin, M.Si dan Dr. Ir. Hamim, M.Si. yang telah meluangkan waktu dan pikiran dalam membimbing dan mengarahkan penulis hingga tesis ini selesai, kepada Dr. Ir. Ghulamahdi, MSi selaku dosen penguji yang telah memberikan saran dan perbaikan untuk kesempurnaan tesis ini. Serta seluruh staf biologi khususnya staf fisiologi tumbuhan yang telah memberikan bantuan fasilitas dalam pelakanaan penelit.
Terima kasih penulis sampaikan kepada Departemen Agama RI yang telah memberikan kesempatan dan beasiswa. Ungkapan terima kasih juga penulis sampaikan kepada suami tercinta dan kedua anakku Faried Abdillah Santoso dan Fierda Azizy Santoso, atas pengorbanan, cinta, dan doa tulus yang diberikan, serta semua keluarga besar. Tidak lupa ucapan terima kasih kepada selnua rekan Lab. Fisiologi Tumbuhan dan BUD atas segala dukungan dan semangat yang diberikan.
Penulis ini menyadari penulisan tesis ini jauh dari sempurna. Oleh karena itu saran dan kritik yang meinbangun sangat penulis harapkan. Semoga tesis ini dapat bermanfaat, Amin Ya Robbal 'alamin
Bogor, Juni 2009
RIWAYAT HIDUP
Penulis Dilahirkan Kabupaten Probolinggo pada tanggal 28 Januari 1970 dari
ayah Sukotjo (Alm.) dan ibu Nunuk Nurdiati. Penulis merupakan putri pel-tama dari
enam bersaudara.
Pada tahun 1988 penulis lulus dari SMA Negeri 1 Praya Lombok-Tengah dan
pada tahun yang sama lulus seleksi masuk Universitas Mataram melalui jalur PMDK.
Penulis memilih program studi Biologi, Fakultas Keguruan dan Ilmu Pendidikan.
Pendidikan sarjana diselesaikan pada tahun 1992.
Tahun 1997 penulis diangkat menjadi Calon Pegawai Negeri Sipil dan
ditempatkan di Madrasah Aliyah Negeri 1 Praya Kabupaten Lombok-Tengah Nusa
Tenggara Barat. Tahun 2007 penulis mendapatkan kesempatan melanjutkan studi
sebagai mahasiswa pada Program Studi Biologi Sekolah Pascasarjana Institut Pertanian
iii
DAFTAR IS1
DAFTAR TABEL
...
DAFTAR GAMBAR
...
...
DAFTAR LAMPIRAN
PENDAEIULUAN
...
...
Latar Belakang
. .
...
Tujuan Penel~t~an
TINJAUAN PUSTAKA
...
Botani Padi
...
Pengaruh Cekamaan A1 pada Pertumbuhan Tanaman
...
...
Mekanisme Toleransi Tanaman Terhadap Ceka~nan A1
...
Pewarisan Sifat Toleransi A1 pada Tanaman
...
BAHAN DAN METODE
Waktu dan Tempat
...
...
Bahan Tanam
...
Rancangan Percobaan
. .
Alur Penel~t~an
...
. .
Metode Penel~tlan
...
Kultur Hara
...
Analisis Root ReGrowth
...
Analisis Kuantitatif Akumulasi A1
...
Analisis Histokimia A1
...
Distribusi A1 pada Akar
...
Analisis Kuantitatif Peroksidasi Lipid
...
...
Analisis Histokimia Peroksidasi Lipid
Analisis Enzim Superoksid Dismutase
...
Analisis Sekresi Asam Sitrat
...
Pola Pewarisan Sekresi Asam Sitrat
...
.
.
Anahsis Data
...
HASIL DAN PEMBAHASAN
...
Pertumbuhan Kembali Akar (Root ReGrowth)
...
...
Akumulasi dan Distribusi A1
. . . .
Peroksidasi Lipid
...
28Aktivitas SOD
...
30Sekresi Asanl Sitrat
...
31...
Pola Pewarisan Sifat Sekresi Asam Sitrat 35
...
KESIMPULAN DAN SARAN 38
...
Kesimpulan 38
Saran
...
38...
DAFTAR PUSTAKA 38
LAMPIRAN
...
39DAPTAR TABEL
Halaman
1. Uji khi-kuadrat dari pola segregasi parameter asam sitrat pada
DAFTAR GAMBAR
Halaman
Tahapan proses terjdinya peroksidasi pada lipid membran
...
8. .
Bagan alir penelltian
...
16Penanaman kecambah padi pada larutan hara dan cekaman A1 15 pprn selama 72 jam pada pH 4
...
17Morfologi akar padi IR64, Hawarabunar, Grogol dan Krowal Panjang
tanpa cekaman (A),sesudah cekaman 15 pprn selama 72 Jam (B) dan
recovery (C)
...
22Rata-rata Root Regrowth (RRG) pada padi IR64, Hawarabunar,
Grogol dan Krowal Panjang setelah ditumbuhkan kembali dalam
kultur hara tanpa A1 selama 48 Jam.
...
23Analisis Histokimia Akumulasi A1 dengan Pewarnaan Hematoksilin
pada akar padi IR64, Hawarabunar, Grog01 dan Krowal Panjang
...
24Sayatan Membujur Akar padi IR64, Hawarabunar, Grogol dan Krowal Panjang pada daerah 1 dan 2 mm dari ujung a k a
...
25 Sayatan Melintang Akar padi IR64, Hawarabunar, Grogol danKrowal Panjang Pada Daerah 1 mm dari Ujung Akar
...
26Akumulasi A1 pada daerah 15 mm dari ujung akar padi IR64,
Hawarabunar, Grogol dan Krowal Panjang setelah diberi cekaman A1 selama 72 jam
...
27Analisis histokimia peroksidasi lipid dengan pewamaan Schiff s pada akar padi IR64, Hawarabunar, Grogol dan Krowal Panjang setelah
...
perlakuan A1 15 ppm selama 72 jam 28
Rata-rata Konsentrasi MDA pada Akar padi IR64, Hawarabunar, Grogol dan Krowal Panjang Setelah Mendapat Cekaman A1 15 pprn Selama 72 Jam
...
29Rata-rata SOD akar padi IR64, Hawarabunar, Grogol dan Krowal
...
Panjang setelah diberi cekaman 15 ppm selama 72 Jam 3 1
Rata-rata sekrsi asam sitrat pada padi IR64, Hawarabunar,Grogol dan
...
Krowal Panjang setelah diberi cekaman 15 ppm selama 72 jam 3 1
Sebaran tingkat sekresi asam sitrat dari individu pada populasi F2
DAFTAR LAMPIRAN
Halaman
Larutan hara minimum Miftahudin (2002)
. . . . .. . .
. . .
. .. . . ...
45Larutan Larutan dan bahan kimia yang digunakan dalam penelitian peroksidasi lipid, aktivitas SOD, dan sekresi asam sitrat pada padi lokal Indonesia selama mendapat cekaman Aluminium
. . .
. .
.
. . . ..
46Analisis Sidik Ragam Root Regrowth (RRG)
. .. . ..
.. . .
. . . .... . .
47Analisis Sidik Ragam akurnulasi A1 dan uji lanjut Duncan
... . . ... ...
48Analisis Sidik Ragam peroksidasi lipid dan uji lanjut Duncan
...
49Analisis Sidik Ragam SOD Akar dan uji lanjut Duncan
... . . . . ....
50Analisis Sidik Ragam asam sitrat pada populasi F2
.. . .
... . . . ...
5 1 Tabel korelasi RRG, Akumulasi Al, Peroksidasi Lipid, Aktivitas SOD dan Asam Sitrat. . .
. . .
. .
.
. . . .
. .
.
. . .
. . .
.
. .
.
. . .
. .
. . .
.
,. . .
52PEND AHULU AN
Latar Belakang
Usaha peningkatan produksi padi (Oryza sativa L.) nasional untuk
mengimbangi peningkatan kebutuhan beras di masa yang akan datang dilakukan
melalui program intensifikasi dan ekstensifikasi tanaman padi. Program
ekstensifikasi di pulau Jawa dan Bali sudah sulit dilakukan lagi karena lahan
pertanian yang tersedia semakin terbatas akibat terjadinya alih fungsi lahan
pertanian. Untuk itu lahan pasang surut dan lahan kering merupakan tipologi
lahan yang sering menjadi perhatian untuk pengembangan tanaman pangan
walaupun berbagai kendala yang ada harus diatasi terlebih dahulu.
Luas lahan kering di luar Pulau Jawa mencapai 54,4 juta Ha dan 45,s juta
Ha diantaranya termasuk golongan tanah Podsoil Merah Kuning (PMK) atau
Ultisol (BPS 2007), dan sekitar 11 juta Ha dari lahan kering yang tersedia
berpotensi untuk dikembangkan sebagai lahan pertanian padi gogo (Puslitbangtan
2006). Lahan kering untuk perluasan penanaman padi gogo disamping untuk
memenuhi kebutuhan pangan dan meningkatkan kesejahteraan petani setempat
juga dapat diharapkan dapat meningkatan produksi beras nasional.
Pengembangan padi di lahan marginal dihadapltan pada kendala-kendala
seperti keasaman tanah (pH 3.5 - 5.5), kahat hara makro-mikro dan tingkat
kejenuhan Aluminium (Al) tinggi yang dapat menghambat pertumbuhan tanaman
sehingga akan menurunkan produksi tanaman (Sanches 1992). Proses asidifikasi
tanah pada lahan-lahan masam dapat disebabkan oleh adanya proses pencucian
kation dari tanah hasil praktek pertanian dan hujan asam (Marschener 1995).
Tingginya konsentrasi A1 berpengaruh buruk terhadap sistem perakaran yang
meliputi pertumbuhan akar terhambat, pendek, tebal, percabangan akar tidak
normal sehingga dapat menyebabkan gangguan penyerapan hara mineral oleh
tanaman (Matsumoto 1991).
Secara normal, A1 berada dalam bentuk oksida dan kompleks aluminosilikat
yang tidak larut dan tidak toksik. Pada kondisi basa A1 terdapat dalam bentuk
formasi tetrahedaral Al(0H);. Pada pH netral, A1 membentuk kompleks dengan
Al berada dalam bentuk oktahedral ~ 1 ( ~ 2 0 ) 6 3 + atau sering disingkat A I ~ + yang
merupakan ion paling toksik bagi tanaman (Matsumoto 2000).
Keracunan Al dalam sel dapat memicu produksi Reaktif Oxygen Species
(ROS), menghambat respirasi, menguras ATP dan menghilangkan kemampuan
untuk tumbuh (Yamamoto et al. 2002). Keracunan Al dapat juga mempengaruhi
metabolisme fosfat, struktur dan fungsi dinding sel, struktur dan fungsi membran
sel, dinamika sitoskeleton, transduksi signal dan menyebabkan cekaman oksidatif
(Vitorrelo et al. 2005). Cekaman oksidatif dapat memicu kerusakan sel dan
mengganggu metabolisme seluler. Untuk mengurangi dampak kerusakan tersebut
tanaman membentuk senyawa senyawa antioksidan yang dapat mengkatalisis
reaksi pengurangan tingkat detoksifikasi ROS secara langsung atau tidak langsung
di dalam tanaman (Pritcbard et al. 2002).
Perlakuan Al yang diberikan pada daerah perakaran kecambah padi yang
ditumbuhkan pada larutan hara dapat meningkatkan peristiwa peroksidasi lipid,
perubahan aktivitas enzim Stperoxide Dismutase (SOD) dan peroksidase, dan
bahkan dapat menyebabkan kerusakan DNA pada tanaman padi (Balaji et al.
2004). Selanjutnya Ma (2007) mengemukakan bahwa Al dalam jaringan
menyebabkan peningkatan produksi H202 dan kandungan Malondialdehid (MDA)
lebih nyata pada padi sensitif Al dari pada yang toleran Al. Pada perlakuan Al,
varietas padi toleran mempunyai aktivitas enzim katalase, askorbat peroksidase,
gluthation peroksidase dan superoksida dismutase lebih tinggi dibandingkan
dengan padi yang sensitif Al.
Menurut Kochian (1995) mekanisme ketahanan tanaman terhadap
kelebiban A1 dapat dilakukan secara eksklusi dan inklusi. Mekanisme eksklusi
dilakukan dengan mengeluarkan A1 dari jaringan dan senyawa-senyawa organik
yang disekresikan dari ujung akar sehingga ion Al tidak mencapai daerah
metabolisme atau protoplasma. Mekanisme inklusi biasanya terjadi dengan cara
detoksifikasi atau inaktivasi A1 yang telah memasuki sel kemudian ditimbun
dalam vakuola.
Sejauh ini kajian tentang perbedaan tingkat peroksidasi lipid, aktivitas
enzim SOD dan sekresi asam organik terhadap varietas padi lokal Indonesia pada
berusaha mengungkap tingkat peroksidasi lipid, aktivitas enzim SOD, dan pola
sekresi asam organik pada padi gogo lokal Indonesia. Hal ini diharapkan dapat
menlberikan informasi tambahan yang dapat digunakan dalam usaha pemuliaan
tanaman padi untuk mendapatkan varietas padi toleran Al.
Tujuan Penelitian
Penelitian ini bertujuan :
1. Mempelajari akumulasi dan distribusi A1 dan hubungannya dengan tingkat
peroksidasi lipid, aktivitas enziln SOD dan sekresi asam sitrat pada akar,padi
lokal Indonesia dalam kondisi cekaman Al.
2. Mempelajari pola pewarisan sifat sekresi asam sitrat populasi F2 hasil
TINJAUAN PUSTAKA
Botani Padi
Padi (Oryza sativa L.) merupakan salah satu dari tanaman pangan tertua
yang dibudidayakan. Tanaman padi adalah serealia semusim yang merupakan
sumber karbohidrat utama bagi penduduk dunia. Nenek moyang dari padi
budidaya sudah ada di Asia sejak 40 juta tahun yang lalu. Secara taksonomi padi
termasuk dalam Devisi Angiospe~mae, Kelas Monokotiledonae, Ordo Poales,
Famili Poaceae atau Gramineae serta Genus Oryza.
Oryza sativa terdiri dari dua sub spesies yaitu indica dan japonica sinonim
dari sinica. Sub spesies japonica memiliki ciri-ciri, (a) d a m sempit dan
benvarna hijau tua, (b) bentuk bulir membulat, lebar dan tebal, (c) memiliki bulu
yang panjang atau ada juga yang tidak berbulu, rambut pada glurne tebal dan
panjang, (d) distribusinya meliputi Jepang, Korea dan Cina bagian utara. Sub
spesies indica mempunyai ciri-ciri, (a) daun yang sempit dan benvarna hijau
terang, (b) bulir ramping dan tipis, (c) umumnya tidak berbulu, namun kadang-
kadang bulunya hanya pendek saja, (d) dan mempunyai glume dengan bulu yang
tipis dan pendek, dan (e) distribusinya meliputi Cina bagian selatan, Taiwan, India
dan Sri Langka (Matsuo & Hoshikawa 1993). Sejumlah ciri dari famili
Gramineae juga menjadi ciri padi, yaitu berakar serabut, daun berbentuk lanset
(sempit memanjang), urat daun sejajar, memiliki pelepah daun, bunga tersusun
sebagai bunga majemuk dengan satuan bunga berupa floret, floret tersusun dalam
spikelet, khusus untuk padi satu spikelet hanya memiliki satu floret. Dalam famili
Gramineae, buah dan bulir sulit dibedakan karena merupakan bulir (grain) atau
kariopsis (Matsuo dan Hoshikawa 1993).
Padi tersebar luas di seluruh dunia dan tumbuh di hampir semua bagian
dunia yang memiliki cukup air. Padi menyukai tanah yang lembab dan becek.
Sejumlah ahli menduga, padi merupakan hasil evolusi dari tanaman nenek
moyang yang hidup di rawa. Pendapat ini berdasarkan pada adanya tipe padi
yang hidup di rawa-rawa (dapat ditemukan di sejumlah tempat di pulau
Kalimantan), kebutuhan padi yang tinggi akan air pada sebagian tahap
kehidupannya, dan adanya pembuluh khusus di bagian akar padi yang disebut
Varietas padi IR 64, Hawarabunar, Grogol, dan Krowal Panjang termasuk
ke dalam Oryza sativa indica. Galur padi gogo Hawarabunar berasal dari
Banyuasin, Sumatera Selatan (Jagau 2000). Hawarabunar memiliki lamina d a m
berwama hijau tua. Ciri khusus Hawarabunar yaitu memiliki pangkal batang atau
pelepah berwarna ungu. Pada ujung kulit juga berwarna ungu dan jumlah anakan
7 dengan tinggi tanaman rata-rata 172 cm.
Padi Grogol adalah padi gogo lokal yang berasal dari Bantu], Yogyakarta
(Jagau 2000) mempunyai ciri adanya batang berwama putih yang mendukung
bulir, warna lamina daun hijau tua, jumlah anakan pada tanaman dewasa (umur 4
bulan) paling banyak empat anakan dan memiliki postur tanaman yang tinggi.
Baik varietas Hawarabunar dan Grogol memiliki bentuk bulir yang oval
dengan bulu yang pendek. Varietas Krowal Panjang merupakan padi gogo berasal
dari Lumajang Jawa Timur memiliki postur tubuh hampir sama dengan IR64
dengan jumlah anakan 10 dan tinggi tanaman 156 cm, wama lamina d a m hijau
t e r k g dan mempunyai bentuk bulir lebih kecil dari IR64. Sebaliknya, IIi64
merupakan galur padi sawah yang mempunyai bentuk bulir panjang, lebih rendah
dibandingkan dengan padi Hawarabunar dan Grogol, jumlah anakan pada
tanaman dewasa (umur 4 bulan) sekitar 10 buah, walna lamina daun hijau dan
waktu berbunganya lebih cepat 12-14 hari daripada ketiga padi gogo tersebut.
Pengaruh A1 Terhadap Pertumbuhan Tanaman
Dalam pertumbuhan tanaman di alam selalu dihadapkan pada berbagai
cekaman lingkungan baik biotik maupun abiotik. Cekaman biotik disebabkan
oleh serangan hama, penyakit dan gulma, sedangkan cekaman abiotik disebabkan
oleh kekeringan, salinitas, suhu tinggi, suhu rendah dan tanah asam.
Keracunan A1 merupakan hambatan dalam produksi pertanian di tanah
asam. Keracunan A1 mampu menurunkan produksi tanaman 25% sampai 85%
(Herrera-Estrella 2003). Kelarutan A1 berhubungan dengan bentuk senyawa Al.
Menurut Kochian (1995) terdapat tiga bentuk senyawa A1 yaitu mononuklear
(A?+), A1 polinuklear, dan molekul A1 kompleks. Endapan Al(OH)3 terbentuk
pada pH netral, sedangkan pada pH tinggi A1 terdapat dalam bentuk Al(Ot1)i.
Ketika pH rendah (kurang dari 4) akan terbentuk A I ( H ~ o ) ~ ~ + atau dikenal dengan
Pengaruh A1 terhadap pertumbuhan tanaman antara lain menurunkan
penyerapan kation bivalen oleh akar terutama penyerapan ca2+ dan ~ g ~ + ,
menghambat pembelahan sel-sel meristem akar serta menurunkan penyerapan
SO^'.,
~ 0 4 ~ - dan Cl-. Kerusakan akibat A1 terhadap tanaman tampak jelas padaakar. Akar menjadi tebal, pendek dan terhambat perpanjangannya (Delhaize et al.
1993). Keracunan A1 terutama terlihat pada ujung akar menyebabkan akar utama
menjadi kerdil dan akar lateral terhambat pertumbuhannya (Samac and Tesfaye
2003).
Meskipun A1 dalam kondisi asam dapat menghambat pertumbuhan,
terdapat beberapa jenis atau kultivar tanaman yang toleran terhadap cekaman Al.
Bahkan diantara spesies terdapat keragaman genetik terhadap cekaman Al.
Adaptasi tanaman terhadap tanah asam sangat ditentukan oleh sifat toleran
terhadap cekaman. Padi dan Rye (Secale cereale L.) tergolong ke dalam spesies
yang paling toleran diantara spesies Graminae. Beberapa padi gogo lokal
Indonesia dapat tumbuh dan berproduksi dalam kondisi tercekam A1 pada tanah
asam (Khatiwada el al. 1996; Suparto 1999; Jagau 2000).
Keracunan A1 dapat menyebabkan peningkatan produksi reactive oxygen
species (ROS), seperti radical Superoxide ( 0 2 9 , radical FIidroxyil (*OH) dan
Hidroxigen peroxide (H202) (Alia et al. 1995), yang mana dapat menyebabkan
kerusakan biomolekul seperti lemak, protein, asam nukleat dan mengganggu
metabolisme seluler. Hal ini disebabkan karena A1 menyebabkan stress oksidatif
ketika A1 dilibatkan pada berbagai proses metabolisme, termasuk peningkatan
aktivitas enzim yang dihubungkan dengan ROS dan peroksidasi lipid dalam
kedelai (Cakmak dan Worst 1991). Panjangnya waktu perkecambahan padi yang
tercekam A1 meningkatkan peristiwa peroksidasi lipid, perubahan aktivitas SOD
dan peroksidase bahkan menyebabkan kerusakan DNA pada tanaman padi (Balaji
et al. 2004).
Ion A1 yang masuk ke dalanl jaringan akar akan terikat pada protein dan
fosfolipid pada membran sel, sehingga membran ~nenjadi kaku (rigid) dan
fluiditasnya menurun. Terikatnya A1 pada protein membran juga menyebabkan
terganggunya sirkulasi ca2+ dan berbagai senyawa hara penting (Kochian 1995).
karena A1 menggantikan kedudukan ca2+ pada lamela tengah. Ion ca2+
merupakan second messenger dalam aktivitas
P - A T P ~ S ~
dengan bantuan proteinregulator calmodulin. Digantikannya ca2+ yang melekat pada calmodulin akan
terjadi perubahan aktivitas enzim. Selain itu, Ryan et al. (1997) melaporkan hasil
penelitiannya bahwa A1 juga berhubungan dengan membran lipid bilayer pada sel
dimana A1 memblok saluran ca2' dan K+ sehingga mengganggu proses
penyerapan hara. Ion A1 juga reaktif dengan asam lemak dan menyebabkan
meningkatnya peroksidasi asam lemak membran sel (Ono et al. 1995).
Aluminium dapat terikat kuat pada asam nukleat dan mengganggu replikasi
DNA dalam pembelahan sel serta transkripsi dalam ekspresi gen (Aniol et al.
1984). Silva et al. (2000) memperlibatkan terhambatnya pembelahan sel di daerah
meristimatis ujung akar kedelai disebabkan oleh akumulasi A1 pada inti sel.
Reaktivitas A1 juga berpengaruh terhadap mitokondria (De Lima & Coveland
1994), sitoskeleton (Kocbian 1995; Sivaguru et al. 2000) dan aktin kerangka sel.
Adanya ikatan A1 terhadap senyawa-senyawa penyusun komponen sel itulah yang
menyebabkan perubahan stmktur dan fisiologi tanaman. Kelai~lan akar juga
menyebabkan terhambatnya penyerapan NHJ dan NO3 serta terganggunya
aktivitas enzim nitrat reduktase (Cumming & Taylor 1990).
Aluminium juga berpengaruh terhadap metabolisme tanaman selain organ
akar, misalnya terhambatnya asimilasi C 0 2 karena kerusakan struktur tilakoid
(Pereira et al. 2000). Selanjutnya disebutkan bahwa A1 juga menyebabkan
penurunan kandungan glukosa, sorbitol, dan karbohidrat pada daun tanaman
persik (Prunuspersica).
Efek utama cekaman A1 pada tanaman rye dan gandum (Triticum aestivum
2+
.
L.)adalah menginduksi peningkatan Ca sltoplasma pada sel-sel apikal akar.
Peningkatan ini mengganggu proses metabolisme yang membutuhkan ca2+,
seperti regulasi pembelahan dan pemanjangan sel, yang akhimya akan
mengbambat pertumbuhan akar (Ma et al. 2002).
Ion A I ~ + berinteraksi kuat dengan komponen membran plasma
(Matsumoto 2000). Ikatan A I ~ ' dengan lipid membran menyebabkan membran
menjadi kaku yang berdampak pada metabolisme di membran plasma. Salah satu
peroksidasi lipid (Yamamoto et al. 2001). Peroksidasi lipid merupakan suatu
reaksi autooksidasi, dalam ha1 ini lipid membran mengalami kelebihan oksigen
radikal bebas (superoksida). Interaksi Al dengan protein dan lipid membran dapat
meningkatkan produksi Reactive Oxygen Species (ROS) seperti 0 2 - yang
berdampak pada peroksidasi lipid. Proses peroksidasi lipd diawali dengan tahap
inisiasi. Pada tahap ini terjadi pemisahan atom H oleh radikal bebas dari suatu
grup metal (-CH2-) pada PUFA. Reaksi ini menghasilkan pembentukan suatu
karbon radikal bebas (-*CHI) pada PUFA. Karbon radikal bebas ini distabilkan
melalui ikatan rangkap yang menghasilkan diena terkonjugasi. Diena adalah
senyawa yang mempunyai ikatan rangkap, bila letaknya berdekatan dapat
melakukan konjugasi. Bila diena terkonjugasi bereaksi dengan 02, maka akan
terbentuk radical lipid peroxide (ROO*). Tahap selanjutnya adalah propagasi,
dimana radikal peroksida lipid dapat menghilangkan sebuah atom H dari molekul
lipid lain yang berdekatan untnk membentuk radikal lipid lain. Bila radikal lipid
ini bereaksi lagi dengan 02, maka reaksi peroksidasi lipid akan terus berlanjut
(Gambar 1). Peroksidasi lipid sebagai akibat cekaman Al merupakan penyebab
langsung kematian sel (Yamamoto et al. 2001).
H H H H H H H H
I I I I I I I
H-C-C-C-C C-C-C-C-C-C-C-C-COOH
. .- . .. . .
_
-...
H H H H H H
I I I I I
- c = c - C -
,
,
:?:
I p e ~ o x y l
:?*:
.
.. radicalhydroxyl HUH 2 0 :
radical oxyeen
Gambar 1. Tahapan proses terjadinya peroksidasi pada lipid membran
(Yamamoto et al. 2001)
Mekanisme Toleransi Tanaman Terhadap Cekaman Al
Ada beberapa alternatif untuk mengatasi pemlasalahan diatas diantaranya
melalui peningkatan pH tanah dengan pengapuran dan penggunaan varietas
toleran Al. Banyak kendala yang harus dibadapi melalui pendekatan pengapuran,
diantaranya biaya yang harus dikeluarkan lebih besar, ketersediaan pupuk dan
hanya mampu meningkatkan pH pada kedalaman tanah yang terbatas (Kamprath
1980). Sebaliknya penggunaan varietas toleran Al dianggap lebih efisien dan
efektif karena tanaman secara alamiah memiliki toleransi terhadap Al.
Genotipe tanarnan tertentu dapat bertahan hidup pada tanah asam karena
mempunyai mekanisme untuk menenggang kelebihan Al yang ada dalam media
tanam. Kochian (1995) mengusulkan dua mekanisme toleran tanaman terhadap
cekaman Al, yaitu mekanisme ekstemal dan mekanisme internal. Perbedaan
utarna antara kedua mekanisme tersebut adalah tempat detoksifikasi Al, yaitu
pada apoplas untuk ekstemal dan pada simplas untuk internal.
Tanaman dikatakan toleran Al jika memiliki kemampuan menekan
pengaruh racun dari Al. Menurut Sanches (1976) beberapa kriteria tanaman
toleran Al diantaranya 1) akar sanggup tumbuh terus dan ujung akar tidak rusak,
2) mengurangi absorbsi Al, 3) memiliki berbagai cara untuk menetralkan
pengaruh toksik A1 setelah diserap tanaman, 4) sanggup menciptakan keadaan
yang kurang asam di daerah perakaran, 5) translokasi ion Al ke bagian atas
tanaman sedikit, karena sebagian besar ditahan di a k a , 6 ) adanya mekanisme
tertentu sehingga ion Al tidak sanggup menghambat serapan Ca, Mg dan K.
Kelnampuan yang rendah dari dalam dinding sel akar menyerap Al dan
permeabilitas selektif dari membran sel terhadap Al diduga terlibat dalaln
mekanisme toleransi Al secara ekstemal. Beberapa peneliti menunjukkan bahwa
genotipe toleran cenderung menyerap Al dalam jumlah kecil dibandingkan
genotipe sensitif (Matsumoto 2000; Silva et al. 2000). Jumlah A1 yang dapat dipertukarkan pada dinding sel akar padi varietas sensitif Al lebih tinggi
dibandingkan varietas toleran Al (Okada et al. 2003), sehingga kandungan Al
pada akar padi toleran A1 lebih rendah dibandingkan padi sensitif Al (Watanabe
dan Okada 2005b).
Berdasarkan akumulasi Al di dalam tajuk, adaptasi tanaman terhadap
cekaman Al dibagi menjadi tiga (3) kelompok, yaitu 1) kelompok tanaman yang
tidak menyerap A1 dan tidak mengakumulasi A1 di tajuk (mekanisme
penghindaran). Mekanisme ini dapat terjadi karena tanaman mengeksudasi
senyawa asam organik. Senyawa organik tersebut dapat mengkelat A1 sehingga
lebih rendah dibanding kandungan A1 di akar karena A1 ditahan dan diakumulasi
di akar terutama pada korteks dan epidermis a k a . Pada jaringan muda yang
belum mempunyai endodermis, A1 bisa 1010s ke tajuk melalui jaringan meristem
akar dan pembuluh a k a . Pada tanaman gandum, bila sudah melebihi ambang
batas maka dapat ditolelir oleh sitoplasma, sehingga A1 yang akan diakumulasi di
dalarn akar akan dikeluarkan, 3) kelompok tanaman yang mempunyai akumulasi
A1 di tajuk (A1 akumulator) seperti teh (Camelia sinensis), pinus sp, bakau
(Rhyzophora Sp), dan Melastoma malabathricum L. (Watanabe dan Osaki 2001).
Taylor (1991) membagi mekanisme toleransi tanaman menjadi dua bagian.
Mekanisme pertama adalah ehklusi, yaitu mengeluarkan A1 atau senyawa organik
dari ujung akar sehingga ion A1 tidak mencapai daerah daerah metabolik atau
protoplasma. Mekanisme kedua adalah inklusi, yaitu detoksifikasi atau inaktivasi
A1 yang telah mencapai sel dan kemudian ditimbun. Mekanisme ini juga dikenal
dengan mekanisme internal.
Mekanisme eksklusi dilakukan dengan tiga cara. Pertama, dengan
meningkatkan selektivitas mernbran sel, terutama terhadap ion logam berat, yang
dapat dilakukan dengan mengatur permeabelitas membran yaitu melalui
perubahan tingkat kejenuhan asam lernak dan fosfolipid penyusun membran
(Curnming and Taylor 1990). Kedua, dengan mengatur effluks ion logam. Hal ini
ditemukan pada gandum baik toleran dan sensitif yang apabila diberi perfakuan
sikloheksamida maka akan kehilangan toleransinya. Diduga toleransi pada
gandum terkait dengan produksi protein membran (effluks H + A T P ~ ~ ~ ) (Zhang dan
Taylor 1989). Ryan et al. (1997) juga mengamati bahwa A1 menginduksi
pembentukan kana1 ion pada protoplas yang diisolasi dari akar gandum. Ketiga,
dengan memodifikasi rizofer akar. Modifikasi dilakukan dengan melepaskan
asam organik ke permukaan akar. Menurut Li et al. (2000) asam organik yang
dikeluarkan melalui akar akan mengikat A I ~ + untuk rnenghindari pengaruh A1
terhadap sistem yang ada di dalam dan ruang antar sel. Asam organik tersebut di
antaranya adalah asam oksalat (Ma et al. 1997; Watanabe et al. 1998), asam sitrat
(Pellet et al. 1995; Yang et al. 2000), dan malat (Miyasaka et al. 1991; Zang et al.
1998; Osawa dan Matsumoto 2001). Kasim et al. (2000) juga mengamati adanya
toleran Al. Modifikasi juga dilakukan dengan melepaskan ion fosfat (Larsen
1998).
Salah satu mekanisme toleransi tanaman terhadap cekaman Al adalah
dengan memodifikasi rizofer akar. Adanya A1 di daerah rhizofer dapat
menginduksi sekresi asam organik dari akar tanaman (Li et al. 2000). Sementara
itu Yang et al. (2006) melaporkan bahwa pada tanaman kacang-kacangan, asam
sitrat adalah asam organik yang terbanyak disekresikan setelah perlakuan ~ 1 ~ '
dengan konsentrasi 50 pM selama 3 jam. Perlakuan A1 menstimulasi effluk asam
sitrat dari ujung akar sampai daerah 5 mm, akan tetapi kandungan asam sitrat pada
jaringan akar dua kali lebih tinggi pada daerah 10 mm dari ujung akar. Cekaman
A1 yang diberikan pada tanaman padi memberikan respon berbeda terhadap
peningkatan kandungan asam malat di antara padi yang sensitif dan toleran Al.
Hal tersebut ditunjukan dari hasil percobaan bahwa varietas I-Iawarabunar yang
merupakan varietas toleran Al, menunjukan peningkatan jumlah asam malat yang
tinggi pada konsentrasi 15 ppm dalam jangka waktu 72 jam bila dibandingkan
dengan varietas IR64 yang merupakan varietas sensitif At (Martiansyah 2008).
Over ekskresi enzim yang terlibat dalam metabolisme asam organik
seperti sitrat sintase (Koyama et al. 200) dan malat dehidrogenase (Tasfaye el al.
2001) pada tanaman transgenik dapat meningkatkan kandungan asam organik dan
toleransi terhadap Al. Asarn oragnik dapat mengkelat A1 dengan membentuk
asam organik-Al yang tidak beracun bagi tanaman (Ma et al. 2001; Kochian et al.
2004). Namun demikian sekresi asam organik dari akar bukan mekanisme utama
untuk ketegangan A1 pada padi (Ishikawa et al. 2000). Hasil penelitian Ma et al.
(2002) menunjukan bahwa tanaman padi toleran dan sensitif A1 yang ditanain
pada kultur hara yang mengandung ,413+ melepas asam organik dalam jumlah
yang hampir sama. Hal ini menunjukan toleransi Al pada tanaman padi tidak
berhubungan dengan pelepasan asain organik.
Mekanisme ketahanan secara inklusi dilakukan dengan cara
mendetoksifikasi Al yang telah masuk jaringan, kemudian diekskresikan atau
ditranslokasi dan ditimbun dalam vakuola (kompautementasi). Detoksifikasi
dilakukan dengan pembentukan kompleks A1 dengan senyawa-senyawa pengikat
untuk meningkatkan mobilitas ion A1 sehingga mudah ditranslokasikan.
Mekanisme toleransi secara inklusi umumnya dimiliki oleh spesies tanaman
akurnulator A1 seperti tanaman teh (Nagata et al. 1992), Hydrangeae (Ma et al.
1997) dan Melastomata (Watanabe et al. 1998). Selanjutnya Watanabe et
aL(2006) melaporkan bahwa mekanisme ketegangan inklusi dijumpai pada
tanaman bukan akurnulator A1 seperti tanaman pakan temak Brachiaria hybrid.
Mekanisme inklusi juga dapat dilakukan dengan menginduksi sintesis protein d m
iso enzim tertentu.
A1 dapat menyebabkan cekaman oksidatif. Sebagai upaya untuk mengurangi
cekaman oksidatif maka tanaman membutuhkan senyawa-senyawa antioksidan
yang dapat mengkatalis reaksi-reaksi untuk mengurangi tingkat detoksifikasi ROS
secara langsung maupun tidak langsung didalam sel tanaman (Pritchard et al.
2000).
Enzim SOD merupakan salah satu enzim antioksidan yang dibutuhkan
untuk merubah superoksida menjadi bentuk radikal oksigen H202. H202 ini
merupakan oksidan kuat yang dapat mengganggu proses fotosintesis dikloroplas,
keberadaan katalase dapat mengubah H202 menjadi air dan oksigen, reduksi 13202
ini membutuhkan asam askorbat (Noctor and Foyer 1998). Selanjutnya Ushimau
et al. (1999) menyatakan bahwa peningkatan aktivitas semua isoform SOD
(CuIZn SOD, Fe SOD dan Mn SOD) merupakan bagian mekanisme pertahanan
tanaman di bawah kondisi cekaman oksidatif, umumnya dalam sitosol,
mitokondria dan kloroplas.
Penelitian terbaru mendapatkan sebanyak 17 protein responsif A1 telah
diidentifikasi, 12 diantaranya meningkat dan 5 lainnya menurun (Yang et al.
2007). Di antara protein yang meningkat akibat cekaman A1 adalah copperlzink
superoksida dismutase (Cu/Zn SOD), dan S-adenosilmetionin sintase 2, sistein
sintase ( 0 , 1-aminosiklopropana-1-karboksilat oksidase, G protein beta subunit-
like protein, protein yang diinduksi ABA dan diinduksi cekaman, protein putatif
Avr9/Cf-9 rapidly elicited 141 kDa dan protein secretory 33 kDa merupakan
protein terinduksi Al. Sebagian besar protein tersebut merupakan protein
fungsional yang berkaitan dengan transduksi sinyal, antioksidan, dan
aktivitas CS pada cekaman Al. Hasil metabolisme yang dikatalis oleh CS seperti
total pool glutathion dan glutathion tereduksi juga meningkat secara nyata dalam
merespon cekaman Al. Mereka juga dilaporkan bahwa antioksidan dan
detoksifikasi berhubungan dengan metaboliseme sulfur, terutama CS (Yang et al.
2007). Pada tahun yang sama Sharma et al. (2007) menduga bahwa keracunan
AI~' berhubungan dengan induksi cekaman oksidatif dalam akar pada saat
perkecambahan, karena perlakuan A I ~ ' menyebabkan peningkatan OY, H202,
peroksidasi lipid dan penurunan rasio redoks, glutation dan askorbat. Di antara
enzim antioksidan, SOD, guaiacol, dan APX berperan penting dalam mekanisme
pertahanan antoksidatif dibawah kondisi keracunan Al. Profil isoenzim dan
analisis imonoblot menunjukan bahwa A1 menginduksi peningkatan aktivitas
APX yang dihubungkan dengan perubahan pola isoenzim. Isoenzim APX sitosol
memainkan peranan penting dalam melawan cekaman oksidatif.
Petvarisan Sifat Toleransi Aluminium pada Tanamarl
Mekanisme toleransi cekaman A1 berbeda antar tanaman dan antar varietas
dalam spesies. Keanekaragaman genetika toleransi tanaman terhadap A1 telah
dilaporkan pada beberapa spesies tanaman pertanian terutama tanaman serealia
dari sub famili Triticeae (Vitorello et al. 2005). Pada tanaman gandum dan rye,
sifat toleransi Al ditentukan oleh satu atau beberapa gen. Sebaliknya, pada
tanaman padi atau jagung (Zea mays L.), toleransi cekaman Al bersifat multigen
dan kuantitatif. Tanaman rye lebih toleran terhadap cekaman A1 dibanding dengan
gandum. Walaupun demikian, tanaman gandum merupakan spesies tanaman
pertanian yang diteliti secara komprehensif untuk mempelajari mekanisme
toleransi tanaman terhadap A1 baik secara morfologi, fisiologi, maupun secara
molekuler.
Tanaman memiliki keragaman dalam ha1 mekanisme toleransi terhadap
cekaman Al. Sekresi asam organik seperti malat, sitrat dan oksalat diyakini
sebagai salah satu mekanisme toleransi terhadap cekaman Al (Delhaize el al.
1993; Pineros el al. 2005). Ryan et 01. (1995) menyatakan bahwa asam organik
terutama asam malat yang disekresikan oleh akar gandum akan melind~mgi
tanaman dengan cara mengkelat dan mendetoksifikasi A1 pada bagian yang
mekanisme toleransi Al antara lain, sekresi asam malat distimulasi secara spesifik
oleh Al, asam malat melindungi bagian tanaman gandum yang sensitif A1 di ujung
akar dan sekresi asam malat dari akar dikendalikan oleh gen yang terdapat pada
lokus Alt I. Selanjutnya Ryan et al. (2008) menyatakan bahwa mekanisme
kontrol secara genetik yang terpaut toleransi Al pada populasi F2 hasil
persilangan antara gandum varietas Carrozinho dan varietas EGA-Burhe
ditemukan bahwa efluks asam sitrat dari ujung akar dikendalikan oleh gen
TaMATE-1 pada kromosom 4BL.
Mekanisme kontrol secara genetik untuk sifat-sifat yang terpaut toleransi Al
pada tanaman-tanaman pertanian telah banyak diketahui. Demikian pula pada
tanaman padi, tetapi diduga dikontrol oleh beberapa gen (Wu et al. 2000; Nguyen
et al. 2001). Pada barley (Hordeum vulgare L.) mekanisme toleransi A1 dikontrol
oleh gen tunggal. (Minella and Sorrells 1992) sedangkan pada gandum dikontrol
oleh gen mayor dan gen minor serta pada rye yang merupakan tanaman serealia
yang paling toleran Al lokus pengendali sifat toleransi A1 terletak pada kromosom
3R, 4R dan 6RS (Aniol dan Gustafson 1984).
Toleransi A1 pada tanaman rye dikendalikan oleh gen tunggal Alt3 yang
terletak pada kromosorn 4RL. Gen Alt3, AltBH pada gandum dan Alp pada barley,
yang semuanya mengendalikan toleransi cekaman A1 sangat terpaut dengan
penanda molekuler BCD1230 (Miftahudin et al. 2002). Berdasarkan hubungan
homeologous di antara anggota Triticeae, Miftahudin et al. (2002) menduga
hahwa gen-gen toleran cekaman A1 tersebut kemungkinan memiliki fungsi yang
sama dalam mengendalikan sifat toleransi cekaman Al.
Kajian pewarisan sifat yang menggunakan kriteria pertumbuhan akar pada
kultur hara menunjukan bahwa sifat toleran A1 dikendalikan oleh sekelompok gen
dan diwariskan secara kuantitatif. Pengaruh gen-gen aditif diketahui cukup
berperan dibandingkan pengaruh gen-gen non-aditif (Khatiwada et al. 1996).
Sementara itu Zhang et al. (1989) menemukan bahwa toleransi terhadap cekaman
A1 tidak hanya dikendalikan oleh gen-gen dengan aksi aditif dominan tetapi juga
dipengaruhi oleh interaksi gen (epistasis).
Studi pewarisan toleransi A1 pada tanaman gandum pada umumnya
utama dan kemungkinan interaksi dari beberapa faktor (Budzianowski & Wos
2004). Toleransi A1 narnpaknya lebih merupakan sifat yang multigenik, walaupun
hingga saat ini belum ada gen toleransi A1 yang berhasil diklon (Vitorello et al.
2005).
Secara fisiologi dan molekuler pada populasi F2 hasil persilangan padi
IR64 dengan Hawarabunar, karakter RRG, jumlah anakan dan umur berbunga
BAHAN DAN M E T O D E
Waktu dan Tempat
Penelitian dilaksanakan di Laboratorium Fisiologi Tumbuhan,
Laboratorium Anatomi dan Morfologi Tumbuhan Departemen Biologi, FMIPA
IPB, Bogor. Waktu penelitian yang diperlukan sekitar 12 bulan, dimulai dari
bulan April 2008 sampai dengan bulan April 2009.
Bahan Tanaman
Bahan tananlan yang digunakan adalah benih padi varietas IR64 (padi
sawah sensitif Al) dan Hawarabunar, Grogol, Krowal Panjang yang merupakan
padi gogo (padi lokal Indonesia).
Rancangan Percobaan
Percobaan disusun berdasarkan Rancangan Acak Kelompok (RAK)
dengan 2 faktor. Faktor pertarna yaitu varietas dan faktor kedua adalah
konsentrasi cekaman (0 dan 15 ppm) dengan 3 ulangan.
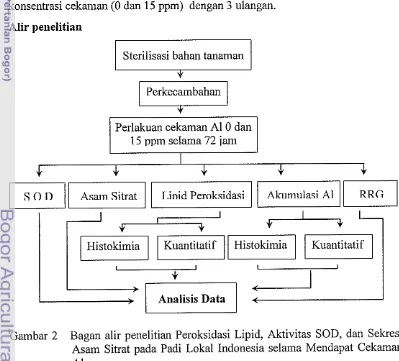
Alir penelitian
Sterilisasi bahan tanaman
I
Perkecambahan
*
15 ppm selama 72 iam
[image:31.595.87.486.372.733.2]Metode Penelitian
Kultur Hara
Benih padi disterilkan dengan NaClO 0.5% (vlv) selama 15 menit
kemudian dibilas dengan aquades sebanyak 3 kali. Benih direndam selama 24
jam, setelah itu dikecambahkan di cawan petri beralas kertas merang lembab.
Selanjutnya dikecambahkan pada ruang gelap dengan kisaran suhu 25-27'~
selama 48 jam.
Kecambah ditanain pada net plastik(Gambar 3) yang diapungkan diatas
media kultur hara minimum tanpa A1 dengan pH 4.0 (Mifiahudin et al. 2002)
untuk diadaptasikan selama 24 jam dan diberi aerasi. Perlakuan A1 dilakukan
dengan pemberian AI~' dalam bentuk AlC13.6HzO dengan konsentrasi 15 ppm
pada pH 4.0 selama 72 jam (Quarrie et al. 2006). Larutan harus diganti setiap hari
untuk mempertahankan pH larutan.
Garnbar 3 Penanaman kecambah padi pada larutan hara dan cekaman A1 1.5 ppm
selama 72 jam pada pH 4
Analisis Root Regrowth (RRG)
Pengukuran RRG dari tanaman yang telah diberi perlakuan cekaman A1
dilakukan dengan mengukur panjang akar pada saat akhir perlakuan cekaman A1
dan pada saat akhir recovery. Selisih antara panjang akar pada saat akhir recovery
dengan pengukuran cekainan A1 adalah parameter RRG tersebut (Mifiahudin et
al. 2005).
Analisis Kuantitatif Akumulasi Al
Seratus potong akar, masing-masing sepanjang 15 mm (dipotong dari
8 0 ' ~ selama 24 jam, kemudian ditimbang berat keringnya. Selanjutnya sampel
akar tersebut diabukan pada suhu 550 OC selama 2 jam. Abu tersebut dilarutkan
di dalam 4 ml larutan FINO3 pekat ditambah dengan 10 tetes HzO, dipanaskan
pada suhu 100 - 200 OC selama 2 jam, kemudian ditambahkan 6 N HCI sebanyak
10 ml. Setelah itu, campuran larutan tersebut diencerkan dengan akuades sampai
volumenya menjadi 25 ml (Cunnif 1999). Hasil ekstraksi diukur kandungan A1 -
nya dengan menggunakan atomic absorption spectroscopy (Varian, SpectrAA-
30). Analisis akumulasi A1 untuk masing-masing perlakuan diulang sebanyak 3
kali.
Analisis Histokimia Akumulasi Al
Akar kecambah padi yang telah diberi perlakuan cekaman A1 dibilas
dengan aquades selama 30 menit. Kemudian direndam dalam larutan
hemotoksilin 0.2% dalam NaI03 0.02% selama 60 menit. Selanjutnya akar
tersebut dibilas kembali dengan aquades selama 30 menit (Polle et al. 1978).
Kemudian akar direndam ke dalam larutan FAA (formaldehid 37% : asam asetat
glacial : alkohol 70% = 5 : 5 : 90) selama 24 jam. Lapisan warna merah sampai
coklat pada ujung akar menunjukkan akumulasi Al, kemudian dilanjutkan dengan
pengambilan gambar menggunakan foto stereo mikroskop pada pembesaran 5 x
0,8 x 1
Distribusi A1 pada Akar
Akumulasi A1 pada akar diamati dengan membuat sediaan mikroskopis
akar. Akar tanaman dari setiap perlakuan diwarnai dengan larutan hematoksilin
seperti yang telah dilakukan pada analisis histokimia. Selanjutnya akar disayat
melintang dan membujur menggunakan mikrotom setebal 10 pm, setelah terlebih
dahulu difiksasi dengan FAA dan infiltrasi dengan menggunakan parafin secara
bertahap (Nakamura 1995).
Akumulasi A1 pada jaringan akar ditandai dengan lapisan warna coklat.
Pengambilan foto akar dilakukan dengan menggunakan fotomikroskop Olympus
Analisis Kuantitatif Peroksidasi Lipid
Metode analisis kuantitatif peroksidasi lipid merujuk pada Mihara et al.
(1980) yang dimodifikasi dalam jurnlah tanaman, suhu dan waktu inkubasi, serta
kecepatan dan waktu sentrifugasi. Akar padi yang sudah diberi perlakuan
dipotong 1.5 em dari ujungnya (masing-masing 80 tanaman tiap perlakuan atau
setara dengan 0.2 gram), digems menggunakan mortar dalam 0.5 ml lan~tan Asam
triklor asetik (TCA) 0.1% (wlv) yang mengandung 1 mM Btrtylafed Hydroxy
Toluena (BHT) pada suhu 4 OC. Homogenat tersebut kemudian ditambah 3 ml
larutan H3P04 2% (vlv) dan lml TBA 0.6% (wlv) dalam TCA 20% (wlv).
campuran tersebut diinkubasi pada suhu 100 OC selama 30 menit, kemudian
didinginkan sampai mencapai suhu ruang. Setelah dingin, campuran ditambah 4
ml n-butanol 100% (vlv) kemudian dikocok dengan kuat menggunakan vortex.
Fase butanol dan fase larutan dipisahkan dengan sentrifugasi 4200 rpm selama 30
menit. Absorbansi kompleks TBA-MDA pada fase butanol diuk~u dengan
spektrofotometer pada panjang gelombang 532 nm, sedang nilai absorban non-
spesifik diukur pada panjang gelombang 520 nm. Konsentrasi MDA sebagai
produk akhir peroksidasi lipid dapat dihitung dengan mengurangi nilai absorban
pada h 523 nm dengan nilai absorban pada h 520 nm. Akar tanaman tanpa
perlakuan A1 digunakan sebagai kontrol.
Konsentrasi MDA dihitung berdasarkan rumus :
A
[MDA] = x V
E X d
Keterangan : [MDA] = Konsentarsi MDA yang terbentuk
A = Selisih nilai absorban
E = Nilai ekstansi MDA ( 155 m ~ - ' em-')
d = Lebar kuvet (em)
V = Volume sampel (ml)
Analisis Histokimia Peroksidasi Lipid
Pendeteksian terjadinya peroksidasi lipid secara histokimia dilakukan
mengikuti metode Pompella et al. (1987). Akar tanaman yang sudah diberi
Schiff s {basic fuchsin 0.5% (wlv), KzSzOs 0.5%(Wlv), HC1 10% (vlv)} selama
20 menit untuk medeteksi aldehid fungsional hasil peroksidasi lipid. Kemudian
akar dicuci dengan larutan sulfit (K2S20s 0.5% (wlv) dalam 0.05 M HCI selama
15-30 menit. Akar yang telah diwarnai disimpan dalam larutan sulfit untuk
mempertahankan warna, diamati dan diambil gambanlya dengan menggunakan
foto stereo mikroskop pada pembesaran 5 x 0,3 x 1.
Analisis Enzim Superoksid Dismutase (SOD)
Persiapan ekstrak sampel dilakukan dengan menggerus 0.2 gram sampel
dengan 2 ml 50 mM buffer fosfat pH 7.0, 1 ml 1% PVP, 0.2 mM Asam askorbat
(ASA) di sentrifuse pada 1000 rpm, 30 menit, 4 OC sehingga di dapat supernatan.
Untuk analisis SOD menggunakan metode spektrofotometer dengan h =
560 nm merupakan modifikasi dari metode yang dikembangkan Giannopolitis dan
Reis (1997). Kedalam kuvet spektro dimasukkan 2670 p1 50 mM buffer Fosfat
(pH 7.8), 90 p1 EDTA 0.1 mM, 90 p1 riboflavin 0.3 mM dan 90 pl sampel
kemudian di inkubasi selama 5 menit pada suhu nlang. Kemudian ditambahkan
60 p1 NBT 0.03 mM dan di spektro pada h = 560 nm tiap 30 detik selama 1.5
menit dan dihitung peningkatan absorbsannya. SOD larutan tanpa ekstrak
digunakan sebagai kontrol. Aktifitas enzim digunakan dengan unit mg-' protein,
satu unit merupakan 50% penghambatan pembentukan Bludifomazam
Analisis Asam Sitrat
Analisis asam sitrat menggunakan metode Delhaize et al. 1993. 1 ml
larutn sampel ditambahkan 120 p1 buffer tris-HC1 1 M (pH 7.8) dan 15 pl NADH
10 mM diinkubasi selama 40 menit pada suhu 25 OC. Kemudian ditamballkan 2
p1 campuran enzim (1,25 unit laktat dehidrogenase dan 0.5 unit malat
dehidrogenase) dan diinkubasi lagi selama 40 menit. Pengukuran absorbansi pada
h = 340 nm. Sebagai A1 daun setelah itu ditambah 10 p1 sitrat liase 0.5 unit dn
pencatatan kedua (A2) dilakukan 15 menit kemudian. Perhitungan jumlah
konsentrasi asam sitrat dengan rumus :
C = x A A Asam sitrat [gll]
dimana : C = Konsentrasi asam sitrat [mg/l]
V = Volume akhir [ml]
v = Volume sampel [ml]
MW = Berat molekul asarn sitrat [g/L]
E = koefisien kerusakan NADH pada h 340 nm
= 6.3 [1 x mol-1 x cm-1]
d = alur cahaya [cm]
Pola Pewarisan Sekresi Asam Sitrat
Analisis pola pewarisan sekresi asam sitrat menggunakan 133 tetua
individu populasi F2 hasil persilangan tetua IR64 dengan Hawarabunar.
Konsentrasi asam sitrat tertinggi pada tetua IR64 dan konsentrasi asam sitrat
terendah pada tetua Hawarabunar yang mengalami cekaman At dijadikan batas
pembeda antara padi sensitif A1 dan padi toleran.
Analisis Data
Data hasil percobaan dianalisis dengan menggunakan SPSS 15 for
windows, analisis sidik ragam (Anova) dilakukan dengan uji F pada tingkat
kepercayaan 95%, sedangkan uji lanjut menggunakan uji Duncan Multiple Range
HASIL DAN PEMBAHASAN
Pertumbuhan Akar Kembali (RootRegrowtlr)
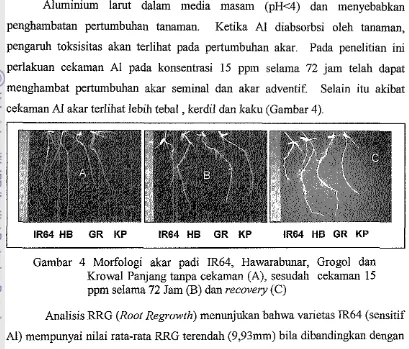
Aluminium larut dalam media masam (pH<4) dan menyebabkan
penghambatan pertumbuhan tanaman. Ketika A1 diabsorbsi oleh tanaman,
pengaruh toksisitas akan terlihat pada pertumbuhan akar. Pada penelitian ini
perlakuan cekaman A1 pada konsentrasi 15 ppm selana 72 jam telah dapat
menghambat pertumbuhan akar seminal dan akar adventif. Selain itu akibat
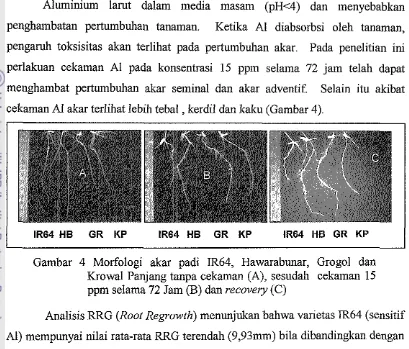
[image:37.599.97.506.135.484.2]cekaman A1 akar terlihat lebih tebal , kerdil dan kaku (Gambar 4).
Gambar 4 Morfologi akar padi IR64, Hawarabunar, Grogol dan
Krowal Panjang tanpa cekaman (A), sesudah cekaman 15
ppm selama 72 Jam (B) dan recovery (C)
Analisis RRG (Root Regrowth) menunjukan bahwa varietas lR64 (sensitif
Al) inempunyai nilai rata-rata RRG terendah (9,93mm) bila dibandingkan dengan
varietas Krowal Panjang (15,2inm), Grogol (33,7tnm) dan Hawarabunar (35,5
mm) (Gambar 5). Hasil ini menunjukan bahwa IR 64 memiliki kemampuan yang
rendah untuk memulihkan kemnbali (recovely) pertumbuhan akamya setelah
mengalami cekaman A1 selama 72 jam. Sebaliknya Hawarabunar, Grogol dan
Krowal Panjang yang merupakan varietas lokal Indonesia mempunyai
kemampuan yang tetap tinggi dalam pertumbuhan akarnya setelah mendapat
perlakuan A1 72 jam. Hal tersebut diperkuat oleh pernyataan Marschner (1995)
bahwa akuinulasi A1 pada ujung akar menyebabkan kerusakan sel yang
menghambat perpanjangan sel-sel akar dan ujung akar membengkak. RRG
merupakan parameter yang baik untuk melihat tingkat penghambatan A1 terhadap
sel tanaman padi.
Menurut Matsumoto (1991), penghambatan perpanjangan pada akar
sel berikatan dengan gugus fosfat dari DNA menyebabkan terhambatnya proses
replikasi pada mitosis sehingga pembelahan sel terhambat. Selain itu, A I ~ + juga
dapat berinteraksi dengan pektin yang berada pada dinding sel menggantikan
posisi Ca, sehingga menyebabkan dinding sel kaku dan menghambat pertukaran
kation,dan akibatnya sel tidak dapat membesar dan memanjang (Blamey et al.
1993).
Gambar 5 Rata-rata Root Regrowth (RRG) pada padi IR64,
Hawarabunar, Grogol dan Krowal Panjang setelah ditumbuhkan kembali dalam kultur hara tanpa Al
selama 48 Jamm = Rata-rata RRG
Menurut Samuel et al. (1997), kemampuan untuk menekan pengaruli
buruk keracunan A1 sehingga akar dapat tumbuh terus dan ujung akar tidak rusak
merupakan salah satu parameter tanaman dikatakan toleran terhadap cekaman Al,
seperti yang terlihat pada Hawarabunar dan Grogol.
Akumulasi dan Distribusi A1
Akumulasi dan distribusi A1 pada akar padi dapat dideteksi dengan metode
histokimia. Hasil analisis histokimia menunjukan bahwa akumulasi A1 tertinggi
terdapat pada varietas IR64 dibandingkan dengan varietas Hawarabunar, Grogol
dan Krowal Panjang. Hal ini dilihat dari wama coklat pekat yang terbentuk pada
ujung akar setelah diberi pewarnaan Hematoksilin (Gambar 6). Hematoksilin
merupakan salah satu metode pewamaan yang mudah digunakan untuk
mengamati A1 pada jaringan akar. Metode tersebut pemah digunakan oleh Polle
et al. 1983, untuk mendeteksi akumulasi A1 pada akar tanaman gandum.
Perbedaan kemampuan penyerapan A1 pada tanaman diamati berdasarkan
akurnulasi A1 lebih tinggi, sedangkan wama lebih terang menunjukan tingkat
akumulasi A1 lebih rendah.
Pada penelitian ini pengamatan anatomi akar membuktikan bahwa
cekaman A1 dapat menyebabkan perubahan struktur sel epidermis. Ujung akar
menebal dan permukaannya luka atau retak, kerusakan itu terlihat pada daerah
ujung akar.
Ga~nbar 6 Analisis histokimia akurnulasi A1 dengan pewarnaan
Hematoksilin pada akar padi IR64, Hawarabunar, Grogol
dan Krowal Panjang. 0 = tanpa A1 dan 15 = 15 ppm Al.
Menurut Jan (1991) bahwa tingkat kerusakan akar akibat A1 bergantung
pada genetiknya. Pada tanaman padi dan Oat yang merupakan tanaman relatif
toleran terhadap Al daripada tanaman lain menunjukkan bahwa kerusakan akar
hanya terbatas pada bagian luar dan ujung akar. Sebaliknya pada tanainan relatif
sensitif seperti jagung dan ercis kerusakan akar terjadi pada jaringan yang lebih
dalam dan kearah jariugan lebih tua. Hal yang saina dinyatakan oleh Matsumoto
(2000) bahwa keretakan pada akar akibat cekaman A1 disebabkan adanya
kerusakan lapisan kedua dan ketiga korteks. Kerusakan pada permukaan ujung
akar berkorelasi dengan akumulasi A1 pada daerah meristematik. Pada ujung akar
padi Hawarabunar, Grogol maupun Krowal Panjang tidak terdapat adanya
kerusakan karena A1 yang terakumulasi pada daerah meristematik tidak sebanyak
pada IR64.
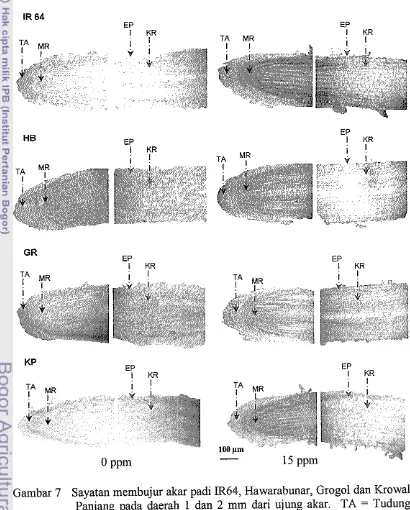
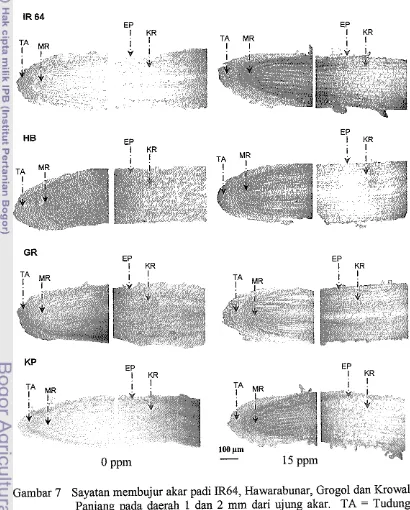
Akumulasi A1 pada daerah meristematik akar ini menunjukan sensitifitas
suatu genotipe terhadap cekaman Al. Irisan meinbujur akar (Gambar 7)
menunjukan bahwa genotipe yang sensitif (IR64) diteinukan A1 lebih banyak pada
daerah meristematik akar daripada genotipe yang toleran, seperti terlihat pada
Akurnulasi A1 pada akar ditemukan dari ujung akar sainpai daerah 1 rnm.
Menurut Matsumoto (2000), A1 diakumulasi di tudung akar, meristem apikal dan
zona pemanjangan akar. Selanjutnya Kataoka et al. (2001) menyatakan bahwa
sel-sel pada daerah tersebut relatif lebih muda dan dapat dengan inudah berikatan
dengan A1 bila dibandingkan dengan sel yang telah dewasa. Hal ini dikarenakan
sel yang lebih muda memiliki potensial membran yang lebih rendah dibandingkan
sel yang lebih dewasa.
Gambar 7 Sayatan membujur akar padi IR64, Hawarabunar, Grog01 dan Krowal
Panjang pada daerah I dan 2 mm dari ujung akar. TA = Tudung
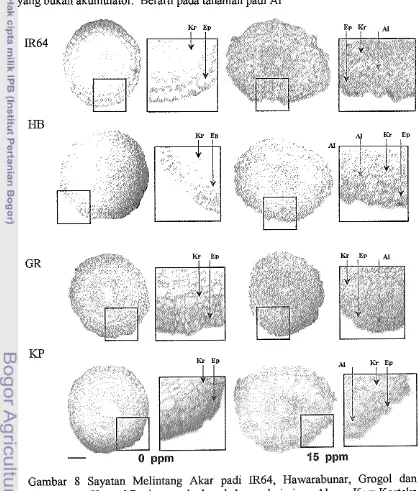
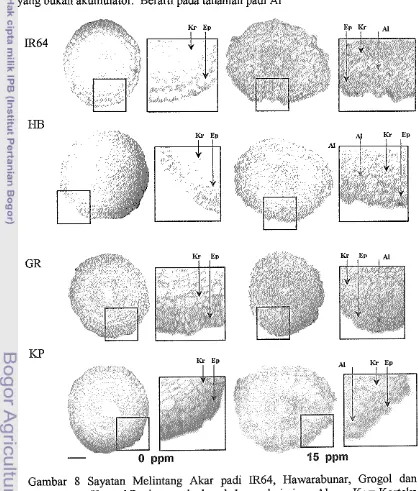
[image:40.595.89.499.219.729.2]Berdasarkan pengamatan mikroskopis dengan sayatan melintang
lnenunjukan bahwa akumulasi dan distribusi A1 dijumpai pada bagian dinding sel
dan apoplas di daerah epidermis dan korteks (Gambar 8). Hal ini memperkuat
pernyataan Taylor et al. (1997) bahwa jlunlah A1 yang berhasil menembus
ine~nbran plasma sangat kecil, karena 99% dari total A1 yang diserap akar berada
di dinding sel dan terikat kuat pada apoplas. Lebih lanjut Ishikawa et a1.(1996)
menambahkan bahwa A1 tidak dapat masuk ke bagian endodermis pada tanaman
yang bukan akumulator. Berarti pada tanaman padi A1
Gambar 8 Sayatan Melintang Akar padi IR64, Hawarabunar, Grog01 dan
Krowal Panjang pada daerah 1 mnm dari ujung Akar. Kr = Korteks
[image:41.595.84.502.229.720.2]sudah dapat menyebabkan kerusakan pada akar sejak A1 masih berada
pada dinding sel tanpa masuk ke dalam sel. Bila dibandingkan dengan kontrol
tampak jelas permukaan jaringan akar yang mendapat perlakuan A1 terdapat
bagian yang rusak dan retak. Kerusakan ini mungkin berhubungan dengan
keberadaan A1 di bagian apoplas menggantikan posisi Ca pektat pada dinding sel.
Perlakuan cekaman Al, varietas dan interaksi antara keduanya
memperlihatkan pengaruh yang sangat nyata terhadap kandungan A1 dalam
jaringan akar (gambar 9). Semua varietas menunjukan peningkatan konsentrasi
A1 yang signifikan setelah diberi cekaman A1 15 ppm selama 72 jam bila
dibandingkan dengan kontrol. Pengaruh cekaman A1 terhadap kandungan A1
diakar berbeda secara signifikan antara padi lokal Indonesia dengan padi IR64
(sensitif Al). Kandungan A1 tertinggi terdapat pada varietas IR64 yaitu 3,62 mglg
sedangkan Hawarabunar, Grogol dan Krowal Panjang berturut-turut adalah 2,29
mglg, 2,25 mglg dan 1,36 mglg. Hal ini dapat diartikan bahwa IR 64 yang
merupakan varietas sensitif lebih cepat dan lebih banyak menyerap A1 dari media
dibandingkan varietas Hawarabunar, Grogol dan Krowal Panjang. Menurut
Matsumoto (2000) bahwa perbedaan akumulasi A1 berhubungan dengan tingkat
sensitifitas tanaman terhadap Al. Tanaman yang sensitif akan mengakumulasi
dan menyerap A1 lebih cepat dan lebih banyak daripada tanaman toleran. Selain
itu banyaknya ion A1 yang dipertukarkan pada tanaman sensitif lebih banyak dari
pada tanaman toleran. Akumulasi A1 dalam jumlah sedikit merupakan salah satu
mekanisme pertahanan tanaman terhadap cekaman A1 (Kochian 1995).
I
I I W HB GR KP
VANETAS PAM
~
I
~ -. . . .1
Gambar 9 Akumulasi A1 pada padi IR64, Hawarabunar, Grogol dan Krowal
Panjang daerah 15 mm dari ujung akar padi setelah diberi cekarnan
Peroksidasi Lipid
Dari hasil analisis histokimia untuk melihat tejadinya peroksidasi lipid
menunjukan nilai positif yang didasarkan pada intensitas wama yang berbeda
antara ujung akar tanaman yang mendapat cekaman Al dibandingkan kontrol
(gambar 10). Varietas IR64 yang mendapatkan cekaman A1 menunjukan
intensitas wama yang lebih pekat dan lebih luas komplek wama merah inuda yang
terbentuk dibandingkan dengan varietas Hawarabunar, Krowal Panjang dan
grogol. Hal ini menandakan bahwa akar padi IR64 mengalami peroksidasi lipid
lebih banyak dan lebih luas daripada padi varietas Hawarabunar, Krowal Panjang
dan Grogol. Wama pekat yang terbentuk pada altar padi merupakan hasil ikatan
antara pereaksi Schiff s dengan gugus aldehid fungsional dan hasil perokasidasi
lipid.
Gambar 10 Analisis histokimia peroksidasi lipid dengan pewamaan Schiff's
pada akar padi IR64, Hawarabunar, Grogol dan Krowal Panjang.
setelah perlakuan A1 15 ppm selama 72 jam 0 = tanpa Al; 15 =
Perlakuan 15 ppm A1
Selain secara kualitatif, tingginya peroksidasi lipid juga dapat diukur
secara kuantitatif melalui analisis Malondyaldehyde (MDA). Analisis MDA
didasarkan pada pengujian Thiobarbituric acid dengan MDA sebagai hasil akhir
dari peroksidasi lipid (Mihara et al. 1980). Malondyaldehyde merupakan produk
akhir peroksidasi lipid dan diakumulasi ketika tanaman inengalami cekainan
oksidatif. Pada penelitian ini perlakuan cekainan A1 15 ppm, varietas dan
interaksi antara keduanya meinperlihatkan pengaruh yang sangat nyata terhadap
produksi MDA. Bila dibandingkan dengan kontrol semua varietas menunjukan
pemyataan Yamamoto (2001) bahwa akar yang diberi perlakuan A1 pada media
tumbuh akan mengalami peningkatan peroksidasi lipid. Konsentrasi MDA
tertinggi ditunjukan oleh varietas IR64 yang tercekam Al yaitu 794 nmol,
sedagkan Hawarabunar, Grogol, dan Krowal Panjang yang tercekam hanya
memiliki kosentrasi MDA yang