KAJIAN ANTIDIABETOGENIK EKSTRAK DAUN SIRIH
MERAH (
Piper crocatum
)
IN VITRO
MUHAMMAD ALFARABI G851080051
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Kajian Antidiabetogenik Ekstrak Daun Sirih Merah (Piper crocatum)In Vitro adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, 18 Februari 2010
Muhammad Alfarabi
ABSTRACT
MUHAMMAD ALFARABI. Study on Antidiabetogenic of The Leaf Extract of
Piper crocatum (Sirih merah) In Vitro. Under direction of MARIA BINTANG and SURYANI.
Diabetes mellitus can be caused by the existence of free radical which attacks membrane lipid of pancreatic cells. Previous research showed that the extract of Piper crocatum leaf has an activity as antidiabetic and antioxidant. However, there is no scientific reports about the mechanism of Piper crocatum as antidiabetogenic. The main goal of this research is to elucidate the mechanism of
Piper crocatum as antidiabetogenic by acting as antioxidant and inhibitor of α -glucosidase. This study used ethanol 70% as an eluent to extract Piper crocatum
leaf, followed by testing antioxidant activity of the extract and testing its ability to inhibit α-glucosidase. Extract compounds detected by GC-MS.The results of this study was extract of Piper crocatum leaf has an antidiabetogenic activity through as antioxidants, which inhibited the oxidation of fatty acids and radical scavenger as well as a competitive inhibitor of the α-glucosidase. Antioxidative activity extract of Piper crocatum leaf could inhibit the oxidation of fatty acids 80.40% (200 ppm) and radical scavenger (IC50 = 85.82 ppm). Inhibition activity of α
-glucosidase could inhibit 39.62% (1% b/v). Compounds in extract of Piper crocatum leaf were groups of fatty acids, terpenoids, flavonoids, steroids, alkaloids, pyrimidine, essential oils, polyphenols, and vitamin E.
RINGKASAN
MUHAMMAD ALFARABI. Kajian Antidiabetogenik Ekstrak Daun Sirih Merah (Piper crocatum) In Vitro. Dibimbing oleh MARIA BINTANG dan SURYANI.
Pola hidup masyarakat yang tidak sehat menyebabkan masuknya senyawa-senyawa xenobiotik ke dalam tubuh sehingga menyebabkan terjadinya berbagai penyakit. Senyawa-senyawa xenobiotik tersebut dapat berupa logam berat atau senyawa radikal bebas. Salah satu penyakit tersebut adalah diabetes mellitus yang terjadi akibat beberapa proses xenobiotik yang merusak sel beta pankreas sehingga menyebabkan terganggunya proses metabolisme. Karakteristik diabetes mellitus adalah terjadinya hiperglikemia, yaitu tingginya kadar glukosa di dalam darah akibat kurangnya sekresi insulin, menurunnya aktivitas insulin, atau keduanya. Indonesia menempati urutan ke empat di dunia dalam jumlah penderita diabetes mellitus. Oleh karena itu, diabetes mellitus merupakan suatu penyakit yang sangat serius bagi masyarakat Indonesia.
Hiperglikemia kronis pada diabetes dapat menghasilkan senyawa radikal bebas akibat terjadinya autooksidasi glukosa sehingga menyebabkan kerusakan sel dan jaringan pada tubuh termasuk sel beta pankreas. Radikal bebas yang terbentuk akan mengoksidasi serta merusak senyawa lipid, protein, dan menurunkan aktivitas enzim. Banyaknya senyawa radikal bebas di dalam tubuh dapat menimbulkan berbagai macam penyakit lainnya sehingga terjadi komplikasi penyakit pada penderita diabetes Saat ini, selain menggunakan insulin dan obat-obat sintetik, masyarakat di Indonesia melakukan pengobat-obatan alternatif dengan menggunakan tumbuhan-tumbuhan yang berkhasiat sebagai antihiperglikemia dan antioksidan untuk menurunkan peningkatan kadar peroksidasi lipid pada penderita diabetes mellitus. Salah satu tumbuhan yang memiliki kedua khasiat tersebut adalah sirih merah. Secara ilmiah, daun sirih merah mengandung senyawa bioaktif flavonoid, tanin, dan alkaloid serta memiliki aktivitas antihiperglikemia. Selain itu, air rebusan daun sirih merah memiliki aktivitas antioksidan. Berdasarkan data penelitian ilmiah tersebut perlu dikaji lebih lanjut mengenai mekanisme sirih merah sebagai antihiperglikemia, apakah karena sifat antioksidasinya atau sebagai inhibitor α-glukosidase, yaitu enzim yang berperan dalam penyerapan glukosa di usus sehingga kadar glukosa di dalam darah dapat diturunkan.
Penelitian ini dilakukan dengan menguji aktivitas antioksidasi ekstrak etanol 70% daun sirih merah (metode TBA dan DPPH) dan daya inhibisi terhadap α -glukosidase serta komponen ekstrak dianalisis dengan GC-MS. Hasil penelitian ini menunjukkan bahwa ekstrak etanol 70% daun sirih merah memiliki aktivitas sebagai antidiabetogenik. Proses antidiabetogenik ini melalui aktivitas antioksidasi, yaitu menghambat oksidasi asam lemak dan radical scavenger serta sebagai inhibitor competitive α-glukosidase. Aktivitas antioksidasi ekstrak etanol 70% daun sirih merah dapat berperan sebagai penghambat oksidasi asam lemak dengan daya hambat terbesar 80.40% dan sebagai radical scavenger dengan nilai IC50 85.82 ppm. Aktivitas inhibisi terhadap α-glukosidase mempunyai daya
lemak, terpenoid, flavonoid, steroid, alkaloid, pirimidin, minyak atsiri, polifenol, dan vitamin E. Senyawa yang diperkirakan memiliki aktivitas antidiabetogenik adalah polifenol, alkaloid, flavonoid, terpenoid, dan vitamin E.
© Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
KAJIAN ANTIDIABETOGENIK EKSTRAK DAUN SIRIH
MERAH (
Piper crocatum
)
IN VITRO
MUHAMMAD ALFARABI
Tesis
sebagai salah satu syarat memperoleh gelar Magister Sains pada
Program Studi Biokimia
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Kajian Antidiabetogenik Ekstrak Daun Sirih Merah (Piper crocatum)In Vitro
Nama : Muhammad Alfarabi
NIM : G851080051
Disetujui
Komisi Pembimbing
Prof. Dr. drh. Maria Bintang, M.S Dr. Suryani, S.P, M.Sc
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Biokimia
Prof. Dr. drh. Maria Bintang, M.S Prof. Dr. Ir. Khairil A. Notodiputro, M.S
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala nikmat dan karunia Nya sehingga karya ilmiah ini berhasil diselesaikan. Tak lupa penulis panjatkan shalawat serta salam bagi teladan penulis Nabi Muhammad SAW. Karya ilmiah berjudul Kajian Antidiabetogenik Ekstrak Daun Sirih Merah (Piper crocatum)In Vitro disusun berdasarkan penelitian yang dilaksanakan mulai bulan Juli 2009 hingga November 2009 di Laboratorium Biokimia Departemen Biokimia dan Pusat Studi Biofarmaka, Institut Pertanian Bogor.
Ucapan terima kasih penulis sampaikan kepada Prof. Dr. drh. Maria Bintang, MS dan Dr. Suryani, SP, M.Sc yang telah memberikan bimbingan dan saran selama berlangsungnya penelitian dan dalam penyusunan karya ilmiah. Terima kasih juga penulis ucapkan kepada orang tua, adik, Mega Safithri S.Si, M.Si, dan Tyas yang telah memberi dukungan materi, non materi, dan doa kepada penulis dalam penelitian dan penulisan karya ilmiah ini. Ucapan terima kasih penulis tujukan kepada Waras, Dimas, Rangga, Nophe, Olga, staf laboratorium Pusat Studi Biofarmaka dan laboratorium Biokimia, Departemen Biokimia, FMIPA IPB atas kerja samanya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2010
RIWAYAT HIDUP
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... x
DAFTAR TABEL ... x
DAFTAR LAMPIRAN ... xi
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Sirih Merah ... 4
Diabetes mellitus ... 5
Radikal Bebas ... 7
Antioksidan ... 8
Inhibitor enzim α-glukosidase ... 9
Analisis Aktivitas Antioksidasi dan Inhibisi Enzim α-glukosidase ... 11
BAHAN DAN METODE Bahan dan Alat ... 13
Metode penelitian ... 14
HASIL DAN PEMBAHASAN Ekstraksi daun sirih merah ... 18
Aktivitas antioksidasi ekstrak daun sirih merah (metode TBA) ... 19
Aktivitas antioksidasi ekstrak daun sirih merah (metode DPPH) ... 24
Inhibisi dan kinetika inhibisi enzim α-glukosidase ... 27
Analisis komponen senyawa ekstrak etanol 70% daun sirih merah ... 29
SIMPULAN DAN SARAN ... 31
DAFTAR PUSTAKA ... 32
DAFTAR GAMBAR
Halaman
1 Tanaman sirih merah (Piper crocatum) ... 4
2 Beberapa senyawa antioksidan eksogen ... 8
3 Grafik Lineweaver-Burk ... 10
4 Kurva kadar MDA terhadap waktu ... 19
5 Kadar MDA ekstrak etanol 70% daun sirih merah ... 20
6 Mekanisme reaksi pembentukkan MDA ... 22
7 Pembentukkan senyawa kompleks MDA-TBA ... 23
8 Kadar p-nitrofenol ekstrak etanol 70% daun sirih merah dan grafik jenis inhibisi ekstrak etanol 70% daun sirih merah ... 28
DAFTAR TABEL
Halaman 1 Aktivitas antioksidasi ekstrak etanol 70% daun sirih merah dan vitamin E metode DPPH ... 25DAFTAR LAMPIRAN
Halaman
1 Tahapan umum penelitian ... 37
2 Ekstraksi daun sirih merah ... 37
3 Analisis ekstrak etanol 70% daun sirih merah dengan GC-MS ... 38
4 Penentuan waktu inkubasi maksimum asam linoleat ... 38
5 Analisis aktivitas antioksidasi metode TBA ... 39
6 Analisis aktivitas antioksidasi metode DPPH ... 39
7 Analisis inhibisi enzim α-glukosidase... 40
8 Analisis kinetika inhibisi enzim α-glukosidase ... 40
9 Rendemen hasil ekstraksi daun sirih merah dengan etanol 70% ... 41
10 Absorban inkubasi kadar MDA (µM) terhadap waktu (λ = 532 nm) ... 41
11 Aktivitas antioksidasi ekstrak etanol 70% daun sirih merah metode TBA ... 42
12 Absorban kurva standar 1,1,3,3-tetrametoksipropana (TMP) ... 42
13 Aktivitas antioksidasi ekstrak etanol 70% daun sirih merah metode DPPH .... 43
14 Aktivitas antioksidasi α-tokoferol (vitamin E) metode DPPH... 44
15 Inhibisi ekstrak etanol 70% daun sirih merah terhadap enzim α-glukosidase .. 45
16 Hasil kurva standar p-nitrofenol... 45
17 Hasil analisis kinetika inhibisi ekstrak etanol 70% daun sirih merah terhadap enzim α-glukosidase ... 46
18 Hasil analisis GC-MS ... 47
19 Analisa statistika data aktivitas antioksidasi dan inhibisi enzim ... 49
PENDAHULUAN
Pola hidup masyarakat yang tidak sehat menyebabkan masuknya senyawa-senyawa xenobiotik ke dalam tubuh sehingga menyebabkan terjadinya berbagai penyakit. Senyawa-senyawa xenobiotik tersebut dapat berupa logam berat atau senyawa radikal bebas. Salah satu penyakit tersebut adalah diabetes mellitus yang terjadi akibat beberapa proses xenobiotik yang merusak sel beta pankreas sehingga menyebabkan terganggunya proses metabolisme. Karakteristik diabetes mellitus adalah terjadinya hiperglikemia, yaitu tingginya kadar glukosa di dalam darah akibat kurangnya sekresi insulin, menurunnya aktivitas insulin, atau keduanya (The Expert Committee on the Diagnosis and Classification of Diabetes Mellitus 2003). Diabetes mellitus merupakan salah satu penyakit yang banyak diderita di dunia. Terdapat 171 juta kasus diabetes mellitus di dunia dan diperkirakan pada tahun 2030 akan menjadi 366 juta kasus (Wild 2004). Indonesia menempati urutan ke empat di dunia dalam jumlah penderita diabetes mellitus. Oleh karena itu, diabetes mellitus merupakan suatu penyakit yang sangat serius bagi masyarakat Indonesia.
darah. Namun saat ini, selain menggunakan insulin dan obat-obat sintetik, masyarakat di Indonesia melakukan pengobatan alternatif dengan menggunakan tumbuhan-tumbuhan yang berkhasiat sebagai antihiperglikemia dan antioksidan untuk menurunkan peningkatan kadar lipid peroksida pada penderita diabetes mellitus. Salah satu tumbuhan yang memiliki kedua khasiat tersebut adalah sirih merah.
Sirih merah (Piper crocatum) merupakan jenis sirih yang merambat dan banyak tumbuh di daerah tropis khususnya Indonesia. Sirih jenis ini sebelumnya terkenal sebagai tanaman hias, kemudian berubah menjadi tanaman obat sejak diperkenalkan oleh produsen obat di Bulnyahrejo (Duryatmo 2005). Kegunaannya di masyarakat selain antiseptik, daun sirih merah dapat digunakan untuk mengobati diabetes mellitus, maag, tekanan darah tinggi, asam urat, batu ginjal, dan ambeien dengan cara memakan daunnya (Sudewo 2005). Secara ilmiah, daun sirih merah mengandung senyawa bioaktif flavonoid, tanin, dan alkaloid serta memiliki aktivitas antihiperglikemia (Safithri & Fahma 2005). Selain itu, air rebusan daun sirih merah memiliki aktivitas antioksidasi (Alfarabi 2008). Oleh karena itu, sirih merah ini merupakan tumbuhan yang berkhasiat obat multifungsi bagi penderita diabetes mellitus. Selain dapat sebagai antihiperglikemia, daun sirih merah dapat mengurangi kadar peroksida lipid bagi penderita diabetes mellitus yang mengalami peningkatan kadar peroksidasi lipid akibat autooksidasi glukosa. Berdasarkan data penelitian ilmiah tersebut perlu dikaji lebih lanjut mengenai mekanisme sirih merah sebagai antihiperglikemia, apakah karena sifat antioksidasinya sehingga dapat mengurangi efek radikal bebas yang terbentuk pada penderita diabetes mellitus atau sebagai inhibitor enzim α-glukosidase, yaitu enzim yang berperan dalam penyerapan glukosa di usus sehingga kadar glukosa di dalam darah dapat diturunkan.
Penelitian ini bertujuan untuk mengkaji daun sirih merah sebagai antidiabetogenik secara in vitro. Mekanisme tersebut dapat melalui reaksi
TINJAUAN PUSTAKA
Sirih Merah (Piper crocatum)
Tumbuhan sirih dikenal sebagai antiseptik sejak 600 SM. Sirih termasuk famili Piperaceae yang merambat dan bersandar di batang pohon lain (Duryatmo 2005). Salah satu jenis sirih adalah sirih merah. Klasifikasi ilmiah dari sirih merah ini adalah kingdom Plantae, subkingdom Tracheobionta, super divisi Spermatophyta, divisi Magnoliophyta, kelas Magnoliopsida, subkelas Magnoliidae, bangsa Piperales, suku Piperaceae, genus Piper, spesies Piper crocatum. Sirih merah tumbuh menjalar seperti sirih hijau, batangnya bersulur dan beruas dengan jarak buku 5-10 cm dengan setiap buku tumbuh bakal akar. Daunnya bertangkai membentuk jantung dengan bagian atas meruncing, bertepi rata, mengkilap atau tidak berbulu, dan mempunyai warna yang khas yaitu permukaan atas hijau gelap berpadu dengan tulang daun dan bagian bawah daun berwarna merah hati keunguan, daun berasa pahit, berlendir, serta mempunyai bau tidak khas seperti sirih.
Sirih merah bisa tumbuh dengan baik di tempat yang teduh dan tidak terlalu banyak kena sinar matahari. Jika terlalu sering kena sinar matahari maka warna merah daunnya bisa menjadi pudar, buram, kurang menarik dan batangnya cepat mengering. Sirih merah akan tumbuh baik jika mendapatkan 60-75% cahaya matahari sehingga tempat tumbuh yang paling cocok untuk sirih merah adalah lingkungan berhawa dingin (Gambar 1).
Sirih merah (Piper crocatum) merupakan salah satu jenis sirih yang banyak dimanfaatkan sebagai tanaman hias pada tahun 1900-an namun sekarang mengalami perubahan fungsi menjadi tanaman obat sejak dikenalkan oleh Bambang Sudewo, seorang produsen tanaman obat di Bulnyahrejo (Duryatmo 2005). Daun sirih merah ini dapat digunakan untuk mengobati diabetes mellitus, maag, tekanan darah tinggi, asam urat, batu ginjal, dan ambeien. Selain itu sirih merah dapat digunakan secara bersama dengan tanaman obat lainnya untuk mengobati penyakit (Sudewo 2005). Secara ilmiah, air rebusan daun sirih merah dengan dosis pemberian 20 g/kg bobot badan dapat berfungsi sebagai antihiperglikemia (Safithri & Fahma 2005), tidak memiliki efek toksik (Salim 2006), dapat memperbaiki pankreas terhadap tikus hiperglikemia (Permata 2006), dan memiliki potensi sebagai hepatoprotektor (Windyagiri 2006). Selain itu, air rebusan daun sirih merah mempunyai aktivitas antioksidasi dalam menghambat oksidasi asam lemak (Alfarabi 2008).
Diabetes Mellitus
kemampuan untuk memproduksi insulin. Peristiwa ini terjadi akibat rusaknya
sel-β pankreas akibat proses autoimun tubuh atau serangan virus. Diabetes mellitus tipe 2 merupakan penyakit diabetes mellitus yang tidak tergantung dengan insulin. Penyakit jenis ini diasumsikan bahwa penderita mampu memproduksi insulin tetapi kerja insulin tidak maksimal (The Expert Committee on the Diagnosis and Classification of Diabetes Mellitus 2003). Kerja insulin ini dapat diganggu dengan terjadinya stress oksidatif sehingga terbentuk radikal bebas di dalam tubuh. Radikal bebas tersebut akan mengganggu kerja insulin sehingga insulin tidak maksimal menurunkan kadar glukosa darah (Ceriello 2000).
Keadaan hiperglikemia akan memproduksi banyaknya radikal bebas (Ceriello 2003). Hiperglikemia kronis pada diabetes dapat juga menyebabkan autooksidasi glukosa (Dobretsov et al. 2007). Banyaknya terbentuk senyawa radikal bebas akan meningkatkan stress oksidatif dan banyak merusak senyawa-senyawa makromolekul lainnya seperti lipid dan protein. Kerusakan makromolekul tersebut akan menyebabkan penurunan fungsi kerja organ sehingga terjadi penyakit lainnya seperti kebutaan, gagal ginjal, dan aterosklerosis (Maritim
Radikal Bebas
Radikal bebas adalah molekul yang kehilangan elektron sehingga molekul tersebut tidak stabil dan sangat reaktif berusaha mengambil elektron dari molekul atau sel lain (Betteridge 2000). Radikal bebas dapat berasal dari dalam tubuh seperti hasil oksidasi enzimatik, fagositosis dalam respirasi, transpor elektron di mitokondria, atau oksidasi ion-ion logam transisi. Selain itu, radikal bebas dapat berasal dari luar tubuh seperti asap rokok, asap kendaraan bermotor, hasil penyinaran sinar ultra violet, bahan kimia dalam makanan, dan polutan lainnya (Murray 2003).
Contoh akibat adanya radikal bebas dari luar tubuh adalah terkenanya lapisan kulit oleh sinar UV. Peristiwa ini bila terjadi dalam jangka waktu lama akan membentuk lapisan atau titik hitam pada kulit akibat rusaknya lapisan kulit yang terdiri dari senyawa lipid dan protein (Nakayama et al. 2003). Beberapa contoh lain kerusakan di dalam tubuh yang dapat timbul akibat radikal bebas dari luar tubuh adalah kerusakan protein, DNA, peroksidasi lipid, kerusakan membran sel. Kerusakan tersebut menyebabkan penyakit yang bersifat kronis, yaitu dibutuhkan waktu untuk penyakit tersebut menjadi nyata (terjadi akumulasi dalam tubuh). Radikal bebas yang biasa terdapat di dalam tubuh dan dapat merusak berasal dari turunan oksigen reaktif. Contoh oksigen reaktif ini mencakup superoksida (O2`), hidroksil (`OH), peroksil (ROO`), hidrogen peroksida (H2O2),
singlet oksigen (O`), oksida nitrit (NO`), peroksinitrit (ONOO`) dan asam hipoklorit (HOCl) (Murray 2003).
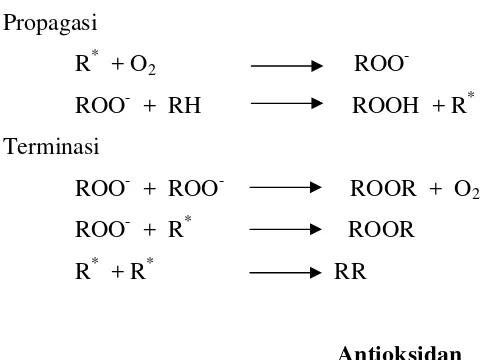
Radikal bebas, baik dari dalam maupun luar tubuh terjadi melalui tahap-tahap mekanisme reaksi dan menimbulkan reaksi berantai sehingga radikal bebas yang terbentuk semakin banyak. Tahap pertama adalah pembentukan awal radikal bebas (inisiasi), lalu perambatan atau terbentuknya radikal baru (propagasi), dan tahap terakhir (terminasi), yaitu pemusnahan atau pengubahan menjadi radikal bebas stabil dan tak reaktif. Mekanisme reaksinya dapat dituliskan sebagai berikut (Hart et al. 2003):
Inisiasi
Propagasi
R* + O2 ROO
-ROO- + RH ROOH + R* Terminasi
ROO- + ROO- ROOR + O2
ROO- + R* ROOR R* + R* RR
Antioksidan
Antioksidan adalah senyawa yang dapat menetralisir radikal bebas dan mencegah kerusakan yang ditimbulkan oleh radikal bebas terhadap sel normal, protein, dan lemak dengan cara melengkapi kekurangan elektron yang dimiliki radikal bebas sehingga senyawa radikal bebas tersebut stabil dan menghambat terjadinya reaksi berantai dari pembentukkan radikal bebas. Berdasarkan cara kerjanya, antioksidan terbagi menjadi dua bagian, yaitu antioksidan pelindung merupakan antioksidan yang mereduksi rantai inisiasi radikal bebas, kemudian yang kedua antioksidan pemutus rantai propagasi radikal bebas. Selain itu, berdasarkan sumbernya, antioksidan terbagi menjadi antioksidan dari dalam tubuh (endogen) dan dari luar tubuh (eksogen). Antioksidan endogen contohnya seperti superoksida dismutase (SOD), katalase dan glutation peroksidase (GSH.Prx). Enzim-enzim ini bekerja menetralkan senyawa-senyawa radikal bebas hasil metabolisme tubuh atau radikal bebas dari luar tubuh. Antioksidan eksogen
contohnya berupa vitamin dan senyawa bioaktif dari tumbuhan, seperti α -tokoferol (vitamin E), beta karoten (vitamin A), dan asam askorbat (vitamin C) (Murray 2003) (Gambar 2).
Gambar 2 Beberapa senyawa antioksidan eksogen (Murray 2003, Hans & Heldt 2005)
Secara umum, senyawa bioaktif dari tumbuhan yang memiliki aktivitas antioksidasi merupakan golongan flavonoid (Harborne & William 2000). Namun selain flavonoid, golongan tanin dan alkaloid juga mempunyai aktivitas antioksidasi. Senyawa-senyawa tersebut banyak terdapat di sayuran dan buah (Hans & Heldt 2005). Oleh karena itu, mengkonsumsi buah dan sayuran yang cukup akan membantu kerja tubuh untuk menurunkan kadar senyawa-senyawa radikal bebas. Bagi penderita diabetes mellitus, hal tersebut akan menurunkan tingkat peroksidasi lipid, karena terdapat banyak kasus diabetes mellitus yang terjadi peningkatan lipid peroksida (Kalaivanam et al. 2006). Penelitian dengan menggunakan kuarsetin (flavonoid) dari daun Annona squamosa memiliki efek antioksidasi dengan menurunkan kadar lipid peroksida pada tikus yang menderita diabetes mellitus (Panda & Kar 2007). Selain itu, senyawa polifenol dari Citrus sinensis mampu menurunkan kadar lipid peroksida (Parmar & Kar 2007).
Inhibitor α-glukosidase
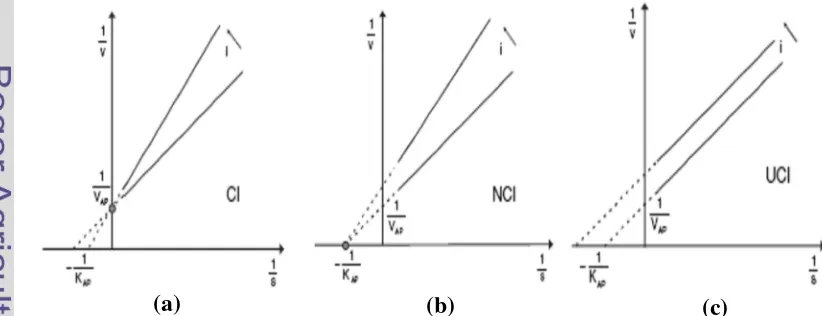
Senyawa yang dapat menghambat kerja katalisis enzim disebut dengan inhibitor. Senyawa ini merupakan bagian dari modulator enzim yang memberikan efek negatif terhadap kerja katalisis enzim. Terdapat dua jenis inhibitor, yaitu yang bersifat reversible dan irreversible. Inhibisi reversible merupakan jenis inhibisi enzim yang tidak merusak gugus fungsi dari enzim tersebut, hanya menghambat proses katalisis. Jenis inihibisi reversibel dibagi menjadi tiga jenis, yaitu competitive, noncompetitive, dan uncompetitive. Inhibisi competitive
diketahui bila reaksi enzim dengan dan tanpa inhibitor diplotkan ke grafik Lineweaver-Burk (Gambar 3). Jenis inhibisi kedua adalah inhibisi irreversible. Jenis inhibisi ini merupakan inhibisi yang dapat merusak struktur atau gugus fungsi dari enzim sehingga enzim tersebut menjadi tidak aktif. Mekanisme inhibisi ini merupakan mekanisme yang dimiliki oleh obat-obat tertentu seperti obat kanker (Stryer 2000). Proses inhibisi ini dapat membantu penderita diabetes mellitus untuk mengurangi kadar gula darah yang tinggi dengan cara menghambat kerja enzim yang berperan membantu penyerapan karbohidrat, yaitu enzim α -glukosidase.
α-glukosidase (EC 3.2.1.20) merupakan enzim dari golongan hidrolase. Enzim ini berfungsi mengkatalisis reaksi akhir dari proses penyerapan karbohidrat di usus. Enzim ini mengkatalisis hidrolisis ikatan α-1,4 sehingga menghasilkan α -D-glukosa (Stuart et al. 2004). Terhambatnya kerja enzim α-glukosidase menyebabkan berkurangnya glukosa yang diserap oleh usus sehingga berkurangnya sumber glukosa yang masuk ke dalam aliran darah. Peristiwa ini mampu membantu menurunkan keadaan hiperglikemia sehingga penderita diabetes dapat mengatur kadar glukosa darahnya. Saat ini banyak obat-obat yang dibuat untuk menghambat (inhibitor) kerja α-glukosidase. Beberapa obat inhibitor
enzim α-glukosidase dapat ditemukan dengan mudah seperti, acarbose, miglitol, dan voglibose. Namun, saat sekarang banyak penelitian yang telah melaporkan bahwa banyak ekstrak tumbuhan yang berkhasiat sebagai inhibitor α-glukosidase. Salah satu penelitian melaporkan bahwa asam triterpen yang diisolaasi dari daun
Gambar 3 Grafik Lineweaver-Burk: (a) inhibisi competitive, (b) noncompetitive, (c) uncompetitive (Illanes A 2008)
Lagerstroemia speciosa mampu sebagai inhibitor α-glukosidase (Wenli et al.
2009). Selain itu, beberapa ekstrak tumbuhan asal Meksiko yang mengandung kaempferol seperti Cecropia obtusifolia, Equisetum myriochaetum, Acosmium panamense, dan Malmea depressa dapat menghambat kerja α-glukosidase secara
in vitro dan in vivo (Cetto et al. 2008).
Analisis Aktivitas Antioksidasi dan Inhibisi α-glukosidase
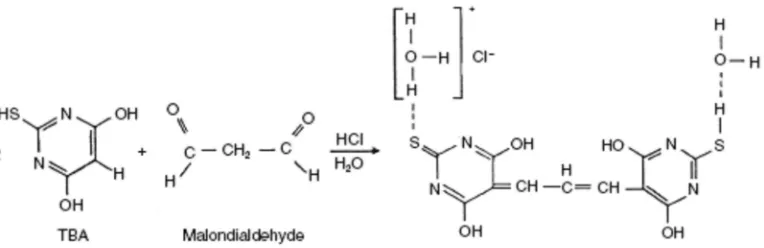
Analisis aktivitas antioksidasi yang dilakukan dalam percobaan ini menggunakan dua metode, yaitu metode DPPH (2,2-diphenil-1-picryl hydrazyl) dan TBA (thiobarbituric acid). Kedua metode ini digunakan karena dapat menunjukkan aktivitas dari ekstrak daun sirih merah sebagai penangkap senyawa radikal bebas dan penghambat terjadinya peroksidasi lipid. Prinsip metode DPPH adalah menguji kemampuan penangkapan senyawa radikal bebas (DPPH) oleh senyawa ekstrak daun sirih merah (Aqil et al. 2006), kemudian prinsip metode TBA adalah untuk menguji kemampuan ekstrak daun sirih merah menghambat proses terjadinya peroksidasi lipid (Kikuzaki & Nakatani 1993). Adanya aktivitas antioksidasi dengan cara menangkap senyawa radikal bebas pada ekstrak daun sirih merah ini dapat mencegah radikal bebas dari dalam dan luar tubuh untuk mengganggu proses metabolisme tubuh sehingga dapat mengurangi kemungkinan terjadinya penyakit diabetes mellitus. Selain itu, kemampuan ekstrak daun sirih merah menghambat terjadinya proses lipid peroksida dapat membantu penderita diabetes mellitus kronis yang terjadi komplikasi dengan meningkatnya kadar lipid peroksida di dalam tubuh. Selain itu, penggunaan konsentrasi yang sama untuk kedua metode tersebut adalah untuk mempermudah melihat aktivitas ekstrak daun sirih merah sebagai penangkap senyawa radikal bebas dan penghambat proses peroksidasi lipid. Penggunaan α-tokoferol (vitamin E) dalam metode ini bertujuan sebagai pembanding karena α-tokoferol telah diketahui merupakan senyawa antioksidan (Linder 2006). Konsentrasi yang digunakan adalah 200 ppm berdasarkan jumlah maksimum dalam makanan yang diperbolehkan dalam peraturan Uni Eropa (Pokorny et al. 2001).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan untuk membuat ekstrak daun sirih merah adalah daun sirih merah 25 gram dan etanol 100 mL. Bahan-bahan untuk analisis aktivitas antioksidasi metode DPPH (2,2-diphenil-1-picryl hydrazyl) adalah larutan DPPH (2,2-diphenil-1-picryl hydrazyl) (Sigma Aldrich), metanol, dan α -tokoferol (vitamin E) (Sigma Aldrich). Bahan-bahan untuk penentuan waktu inkubasi asam linoleat, analisis aktivitas antioksidasi, dan pembuatan kurva standar metode TBA adalah buffer fosfat 0,1 M pH 7, asam linoleat 50 mM (Sigma Aldrich), etanol absolut, α-tokoferol (vitamin E) (Sigma Aldrich), TCA (trichloroacetic acid) 20%, TBA (tiobarbituric acid) 1% (Sigma Aldrich), asam asetat 50%, dan TMP (1,1,3,3-tetrametoksipropana) (Sigma Aldrich). Bahan-bahan untuk analisis inhibisi dan kinetika inhibisi enzim α-glukosidase adalah
enzim α-glukosidase (Sigma Aldrich), 0,1 M buffer fosfat pH 7, DMSO, 0,02 M p-nitrofenil-α-D-glukopiranosida (Sigma Aldrich), 0,2 M Na2CO3, dan acarbose.
Bahan-bahan untuk analisis komponen senyawa ekstrak etanol 70% daun sirih merah adalah larutan pendukung perangkat GC-MS (Gas Chromatography Mass Spectro).
Alat-alat untuk analisis komponen senyawa ekstrak etanol 70% daun sirih merah adalah kolom, detektor, dan perangkat pendukung GC-MS (Agilent 6890N).
Metode Penelitian
Ekstraksi Daun Sirih Merah Cara Maserasi (Harborne 1987)
Daun sirih merah sebanyak 25 g diekstrak dengan 100 mL etanol 70% dan dimaserasi pada suhu ruang selama 24 jam. Selanjutnya disaring menggunakan kertas saring, kemudian dipekatkan dengan rotavapor pada suhu 50 °C sehingga diperoleh ekstrak kasar. Ekstrak kasar tersebut dikeringkan dengan freeze dryer dengan suhu – 50 °C dan tekanan 8 mBar. Rendemen dihitung dengan rumus sebagai berikut:
Rendemen (%) = bobot ekstrak x 100% bobot daun
Analisis Aktivitas Antioksidasi Ekstrak Daun Sirih Merah dengan Metode TBA (thiobarbituric acid) (Kikuzaki & Nakatani 1993)
Analisis antioksidasi ekstrak daun sirih merah sebagai larutan sampel dibuat dalam konsentrasi 25, 50, 75, 100, dan 200 ppm. Masing-masing sampel diambil sebanyak 1 mL kemudian ditambahkan 2 mL bufer fosfat 0,1 M pH 7 dan 2 mL asam linoleat 50 mM dalam etanol 99.8%. Larutan kontrol positif digunakan 1 mL
α-tokoferol, 2 mL bufer fosfat 0,1 M pH 7 dan 2 mL asam linoleat 50 mM dalam etanol 99,8%, sedangkan larutan kontrol negatif ditambahkan 1 mL air bebas ion, 2 mL bufer fosfat 0.1 M pH 7 dan 2 mL asam linoleat 50 mM dalam etanol 99.8%.
Semua larutan ini kemudian dimasukkan dalam botol gelap dan diinkubasi di penangas 40°C selama waktu inkubasi optimum dari metode TBA. Pada hari waktu inkubasi optimum, dilakukan pengukuran MDA (malondialdehida) melalui metode TBA dengan mengambil 1 mL dari setiap larutan, kemudian ditambahkan 2 mL larutan TCA 20% dan 2 mL larutan TBA 1% dalam asam asetat 50%. Campuran reaksi diletakkan dalam penangas air 100°C selama 10 menit. Setelah dingin larutan disentrifus dengan kecepatan 15,5 g selama 15 menit. Kemudian panjang gelombangnya diukur pada panjang gelombang 532 nm. Larutan blanko digunakan 1 mL campuran 3 mL etanol 99,8 % dan 2 mL buffer fosfat 0,1 M pH 7, kemudian ditambahkan 2 mL TCA 20 % dan 2 mL TBA 1 % dalam asetat 50 %. Larutan blanko tersebut diletakkan dalam penangas air 100°C selama 10 menit. Setelah dingin larutan disentrifus dengan kecepatan 15,5 g selama 15 menit. Pembuatan kurva standar dilakukan dengan menggunakan larutan 1,1,3,3-tetrametoksipropana (TMP) dengan konsentrasi 1, 2.5, 5, 7.5, dan 10 µM. Tiap larutan dipipet 1 mL dan ditambahkan 2 mL larutan TCA 20% dan 2 mL larutan TBA 1% dalam asam asetat 50%. Campuran reaksi diletakkan dalam penangas air 100°C selama 10 menit. Setelah dingin larutan disentrifus dengan kecepatan 15,5 g selama 15 menit. Serapannya diukur pada panjang gelombang 532 nm. Larutan blanko menggunakan 1 mL akuades yang diberi perlakuan seperti larutan konsentrasi TMP lainnya (konsentrasi 0 TMP). Persentase daya hambat ekstrak dapat dihitung dengan menggunakan rumus sebagai berikut:
Analisis Aktivitas Antioksidasi Ekstrak Daun Sirih Merah dengan Metode DPPH (2,2-diphenil-1-picryl hydrazyl) (Aqil et al. 2006)
Penentuan aktivitas antioksidasi dengan metode DPPH menggunakan 2 mL ekstrak 70% daun sirih merah dengan berbagai konsentrasi (25, 50, 75, 100, 200 ppm). Ekstrak tersebut dicampurkan dengan 0,1 mM DPPH 2 mL (larutan DPPH di dalam metanol). Larutan kontrol adalah 2 mL larutan DPPH dicampurkan dengan 2 mL metanol. Selanjutnya diinkkubasi pada suhu ruang selama 30 menit. Reduksi dari sejumlah konsentrasi DPPH dihitung serapannya dengan panjang gelombang 517 nm. Senyawa α-tokoferol dengan berbagai konsentrasi (1, 2.5, 5, 7.5, 10 ppm)digunakan sebagai pembanding. Persentase daya hambat dapat dihitung dengan menggunakan rumus sebagai berikut:
% daya hambat = absorban kontrol – absorban ekstrak x 100% absorban kontrol
Analisis Ekstrak Daun Sirih Merah Sebagai Inhibitor Enzim α-glukosidase (Suteja L 2003)
Enzim α-glukosidase sebanyak 0,5 mg dilarutkan dengan 0,1 M buffer fosfat pH 7 yang mengandung 100 mg BSA (Bovine Serum Albumin). Sebelum digunakan enzim diencerkan 25 kali dengan 0.1 M buffer fosfat pH 7. Selanjutnya untuk sistem reaksi enzim terdiri dari 500 µL 20 mM p-nitrofenil-α -D-glukopiranosida (substrat), 980 µL buffer fosfat 0,1 M pH 7, 20 µL ekstrak dengan konsentrasi 0,1%, 0,25%, 0,5%, 0,75%, dan 1% b/v dalam DMSO (dimethylsulfoxide). Campuran reaksi diinkubasi suhu 37 °C selama 5 menit. Reaksi enzimatis dimulai dengan mencampurkan 500 µL enzim dengan pereaksi lainnya dan diinkubasi 37 °C selama 15 menit. Produk yang terbentuk dari reaksi enzimatis tersebut adalah p-nitrofenol (pNP). Reaksi dihentikan dengan penambahan 2 mL 200 mM Na2CO3 dan diukur serapannya dengan panjang
12,5, dan 15 µM. Larutan blanko menggunakan larutan buffer fosfat 0,1 M pH 7 (pelarut larutan standar p-nitrofenol) Serapannya diukur pada panjang gelombang 400 nm. Persentase daya hambat ekstrak dapat dihitung dengan menggunakan rumus sebagai berikut:
% daya hambat = [pNP] kontrol negatif – [pNP] ekstrak x 100% [pNP] kontrol negatif
Analisis Komponen Senyawa Ekstrak Etanol 70% Daun Sirih Merah MenggunakanGC-MS (Gas Chromatography Mass Spectrometry)
Ekstrak etanol 70% daun sirih merah dideteksi komponen senyawanya dengan GC-MS. Ekstrak etanol 70% sebanyak 842,1 mg dilarutkan dengan 1 mL
etanol 99% dan diinjeksikan sebanyak 1 µL. Kondisi GC-MS menggunakan kolom kapiler HP-5 (Agilent 19091J-433: 0,25 mm x 30 m x 0,25 µm mengandung 5% difenil 95% dimetilpolisilosan), laju alir yang digunakan adalah 1,0 mL/menit dengan suhu injeksi 300 °C mode split, dan tekanan 10,47 psi. Gas pembawa yang digunakan adalah He (Helium). Parameter MS yang digunakan adalah mendeteksi senyawa dengan massa 50-800. Kondisi MS adalah suhu MS
quad 150-200 °C dan suhu MS source 250-300 °C. Hasil kromatogram dianalisis dengan database, untuk menentukan komponen senyawa yang terdapat di dalam ekstrak.
Analisis Data
Pengolahan data dari pengukuran aktivitas antioksidasi dan analisis inhibitor
enzim α-glukosidase dilakukan dengan Anova (Analysis of Variance) dengan model rancangan percobaan RAL (Rancangan Acak Lengkap). Selanjutnya bila terdapat perbedaan yang nyata dilakukan dengan uji lanjut Duncan. Model rancangan tersebut adalah:
Yij= + + εij
keterangan:
= Pengaruh rataan umum
λi = Pengaruh perlakuan (konsentrasi ekstrak) ke-i, i = 1,2,3,..,6 ij= Pengaruh galat perlakuan ke-i dan
HASIL DAN PEMBAHASAN
Ekstraksi Daun Sirih Merah
Hasil ekstraksi etanol 70% didapatkan rerata rendemen dari 25 g daun sirih merah segar adalah 4,42% (1,1195 g) (Data lengkap pada Lampiran 9). Hasil rendemen ini lebih besar dari ekstrak etanol 30% daun sirih merah sebesar 2,47% dengan bobot daun 30,8416 g dan bobot ekstrak 0,7633 g (Marlina PW 2008), hal ini menunjukkan bahwa etanol dengan kadar yang lebih tinggi dapat mengekstrak senyawa-senyawa bioaktif dari daun sirih merah lebih banyak dibandingkan dengan etanol dengan kadar yang lebih rendah. Ekstraksi merupakan salah satu cara untuk memisahkan satu atau lebih senyawa dari suatu bahan. Bahan tersebut dapat berupa suatu jaringan atau organ tumbuhan. Metode ekstraksi yang digunakan adalah maserasi. Metode ini dilakukan dengan cara merendam jaringan atau organ tumbuhan dengan larutan yang tepat untuk mendapatkan senyawa yang diinginkan (Harborne 1987). Maserasi yang dilakukan dalam penelitian ini adalah daun sirih merah segar yang telah digerus direndam dengan larutan etanol 70% selama 24 jam. Penggunaan daun yang segar bertujuan untuk mencegah terjadinya perubahan kimia terhadap senyawa-senyawa yang terdapat di daun sehingga tidak merusak senyawa yang diinginkan.
penggerusan maka dinding dan membran sel daun akan rusak sehingga memudahkan etanol berinteraksi dengan senyawa-senyawa yang ingin diekstrak.
Penggunaan etanol 70% dalam maserasi ini bertujuan untuk dapat mengekstrak senyawa aktif yang bersifat polar atau semipolar. Selain itu dapat mencegah berkembangnya mikroba karena penggunaan daun segar rentan terkontaminasi mikroba. Setelah dimaserasi, larutan tersebut dipekatkan dengan rotavapor dengan suhu 50 °C. Penggunaan suhu 50 °C ini bertujuan untuk mencegah rusaknya senyawa yang diekstrak oleh suhu tinggi. Setelah itu ekstrak dikeringkan dengan freeze dryer untuk menghilangkan pelarut-pelarut yang masih terdapat dari hasil pemekatan dengan rotavapor.
Aktivitas Antioksidasi Ekstrak Daun Sirih Merah (Metode TBA)
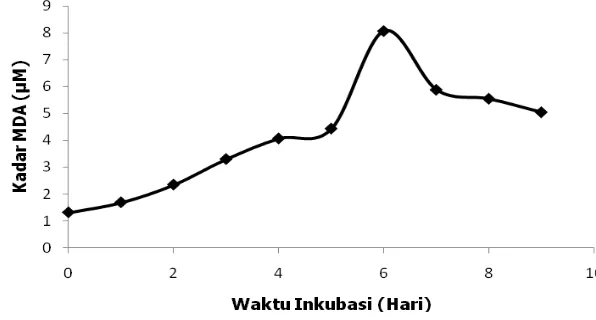
[image:33.595.160.458.567.727.2]Hasil percobaan penentuan waktu inkubasi asam linoleat menunjukkan kadar MDA dari hari ke-0 hingga hari ke-6 mengalami peningkatan dan setelah hari ke-6 mengalami penurunan. Pembentukan MDA sebagai produk hasil oksidasi asam linoleat terjadi maksimum di hari ke-6 (Gambar 4). Proses ini dapat ditentukan karena ada lonjakan tinggi kadar MDA dari hari sebelumnya (hari ke-5) dan hari berikutnya (hari ke-7) terjadi penurunan kadar MDA (Data lengkap pada Lampiran 10). Hasil penelitian ini juga menunjukkan bahwa ekstrak etanol 70% daun sirih merah memiliki kemampuan menghambat terjadinya oksidasi asam linoleat. Aktivitas ini dapat ditunjukkan dengan rendahnya kadar MDA setiap konsentrasi dari ekstrak etanol 70% daun sirih merah dibandingkan dengan
kontrol negatif (larutan asam linoleat tanpa ekstrak) (Gambar 5). Peningkatan konsentrasi ekstrak etanol 70% daun sirih merah berbanding terbalik dengan kadar MDA yang terbentuk. Konsentrasi ekstrak etanol 70% daun sirih merah terbesar (200 ppm) memiliki kadar MDA terkecil (1,0586 µM) dibandingkan dengan konsentrasi lainnya. Konsentrasi esktrak etanol 70% daun sirih merah 200 ppm memiliki daya hambat terbesar, yaitu 80,40%. Kemampuan menghambat pembentukkan MDA sekitar 50% dimiliki oleh esktrak etanol 70% daun sirih merah 50 ppm, yaitu sebesar 56,30%. Daya hambat terkecil dimiliki ekstrak etanol 70% daun sirih merah dengan konsentrasi 25 ppm, yaitu 44,31% dan nilai ini merupakan setengah dari daya hambat konsentrasi terbesar (200 ppm) ekstrak etanol 70% daun sirih merah. Oleh karena itu, konsentrasi 25 ppm ekstrak etanol 70% daun sirih merah dapat diasumsikan aktivitas antioksidasinya setengah dari konsentrasi 200 ppm (Data lengkap pada Lampiran 11). Aktivitas antioksidasi setiap konsentrasi ekstrak berbeda nyata dengan konsentrasi ekstrak lainnya dan
kontrol negatif (α = 0,05). Namun aktivitas antioksidasi konsentrasi ekstrak etanol 70% daun sirih merah 200 ppm tidak berbeda nyata dengan α-tokoferol 200 ppm
(α = 0,05). Hal ini menunjukkan bahwa aktivitas antioksidasi ekstrak etanol 70% daun sirih merah 200 ppm sama dengan aktivitas antioksidasi α-tokoferol 200 ppm (Data lengkap hasil analisisa statistika pada Lampiran 19). Senyawa 1,1,3,3-tetrametoksipropana (TMP) digunakan sebagai larutan baku, dengan persamaan garis adalah y = 0,0163 + 0,1096 x; r = 99,68% (Data lengkap pada Lampiran 12). Aktivitas antioksidasi ekstrak etanol 70% daun sirih merah sebagai penghambat oksidasi asam lemak lebih besar bila dibandingkan dengan air rebusan daun sirih merah. Konsentrasi terbesar air rebusan daun sirih merah, yaitu
20 mg/ mL larutan mempunyai daya hambat pembentukkan MDA 81,78% (Alfarabi 2008). Data tersebut nilainya lebih tinggi bila dibandingkan dengan daya hambat dari penelitian ini menggunakan konsentrasi terbesar dari ekstrak etanol 70% daun sirih merah yaitu 200 ppm, yaitu 80,40%. Namun konsentrasi ekstrak yang digunakan dalam penelitian ini jauh lebih kecil dari konsentrasi rebusan daun sirih merah, yaitu ppm (mg/L). Hal ini membuktikan bahwa ekstrak etanol 70% lebih besar mengekstrak senyawa aktif dari daun sirih merah dibandingkan dengan air.
Daya hambat ekstrak etanol 70% daun sirih merah ini lebih besar bila dibandingkan dengan daun sirih hijau dan daun tembakau. Ekstrak etanol 95% daun sirih hijau dengan konsentrasi 100 ppm menghambat pembentukkan MDA dari oksidasi lipid sebesar 42% (Bhattacharya et al. 2007), sedangkan fraksi ekstrak daun tembakau yang sudah dihidrolisis proteinnya dengan menggunakan enzim dan suhu tinggi untuk inaktivasi enzimnya menghambat pembentukkan MDA 42,62% (Guohua R et al. 2007). Hal ini dimungkinkan terjadi karena etanol 95% lebih mudah menguap daripada etanol 70% yang digunakan dalam penelitian ini sehingga proses ekstraksi tidak sempurna. Suhu tinggi juga dapat mengurangi aktivitas karena rusaknya senyawa bioaktif sehingga dalam penelitian ini menggunakan suhu 50 °C untuk proses pemekatan.
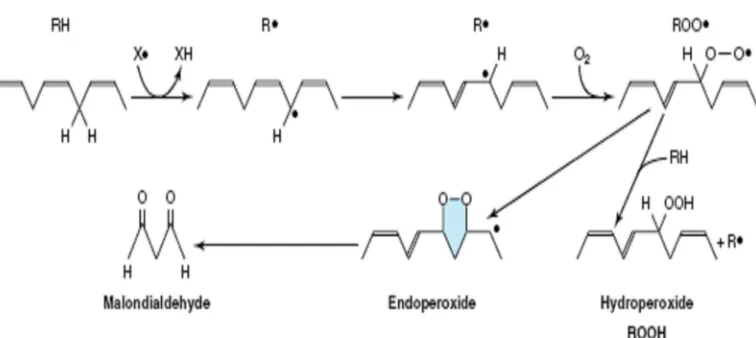
Gambar 6 Mekanisme reaksi pembentukkan MDA (Murray 2003)
Gambar 7 Pembentukkan senyawa kompleks MDA-TBA (Pokorny et al. 2001)
Metode lainnya (diena terkonjugasi dan FTC) dapat juga digunakan untuk mengukur kadar MDA dengan cara mencari terlebih dahulu waktu terbentuk senyawa peroksida dan diena terkonjugasi terbanyak, dua hari setelah waktu tersebut dapat diasumsikan jumlah MDA telah banyak terbentuk (Kikuzaki & Nakatani 1993).
memiliki kemapuan untuk memutuskan reaksi berantai pembentukkan senyawa radikal bebas (Evans CAR et al. 1996).
Senyawa-senyawa aktif dari tumbuhan yang merupakan hasil dari proses metabolisme sekunder memiliki kemampuan tersebut. Senyawa tersebut seperti flavonoid, alkaloid, dan senyawa fenol lainnya (Harborne 2000). Flavonoid yang memiliki efek antioksidasi kuat memiliki kemampuan untuk memodifikasi ikatan lemak membran yang telah diinduksi menjadi radikal, bahkan mampu berinteraksi dan mempenetrasi lipid dwi lapis (Saija A et al 1995). Selain flavonoid, senyawa tanin dari ekstrak Allium sativum L., Cichorium intybus L., dan Terminalia bellerica Roxb.juga memiliki aktivitas antioksidasi (Aqil et al. 2006).
Aktivitas Antioksidasi Ekstrak Daun Sirih Merah (Metode DPPH)
Hasil uji aktivitas antioksidasi dengan DPPH menunjukkan bahwa setiap konsentrasi ekstrak etanol 70% daun sirih merah memiliki kemampuan menghambat senyawa radikal bebas DPPH. Hal ini terjadi karena nilai absorban setiap konsentrasi ekstrak etanol 70% daun sirih merah lebih kecil dibandingkan dengan absorbansi kontrol negatif (larutan DPPH tanpa ekstrak). Daya hambat terbesar dimiliki oleh konsentrasi ekstrak 200 ppm sebesar 73,41% dan daya hambat terkecil dimiliki oleh konsentrasi 25 ppm sebesar 13,10%. Senyawa α -tokoferol juga direaksikan dengan senyawa radikal bebas DPPH sebagai pembanding. Daya hambat terbesar α-tokoferol sebesar 80,36% pada konsentrasi 10 ppm dan daya hambat terkecilnya sebesar 37,87% pada konsentrasi 1 ppm. Konsentrasi ekstrak etanol 70% daun sirih merah yang memberikan daya hambat 50% adalah 85,82 ppm dan konsentrasi α-tokoferol yang memberikan daya hambat 50% adalah 2.12 ppm (Tabel 1). Daya hambat 50% atau yang biasa disebut dengan IC50 (Inhibiton Concentration 50) ini menyatakan nilai konsentrasi
suatu senyawa antioksidan yang dapat menghambat reaksi senyawa radikal bebas sebanyak 50%. Rendahnya nilai IC50 suatu senyawa antioksidan terhadap senyawa
menyatakan bahwa nilai IC50 ekstrak etanol 70% daun sirih merah lebih tinggi
daripada nilai IC50α-tokoferol (Data lengkap pada Lampiran 13 dan 14).
Hasil ini terjadi karena ekstrak daun sirih merah tidak senyawa murni
seperti α-tokoferol sehingga terdapat senyawa-senyawa yang tidak memiliki aktivitas antioksidasi menghambat reaksi antioksidasi seperti senyawa-senyawa karbohidrat, lipid, dan protein. Bila dibandingkan dengan tumbuhan lain, yaitu ekstrak etanol daun kemuning dengan nilai IC50 sebesar 126,17 ppm (Rohman A
& Riyanto 2005), nilai IC50 ekstrak etanol 70% daun sirih merah lebih rendah
sehingga daun sirih merah mempunyai aktivitas antioksidasi yang lebih tinggi daripada daun kemuning. Namun aktivitas ini lebih rendah dengan ekstrak daun ginseng Korea yang sudah terfraksinasi dengan etanol pada konsentrasi 200 ppm yang mampu menghambat sebesar 80% (ekstrak etanol 70% daun sirih merah 200 ppm menghambat 73,41%) (Chang HJ et al. 2005). Hal ini mungkin terjadi karena perlakuan fraksinasi menyebabkan komponen-komponen lain yang dapat mengganggu proses antioksidasi telah terpisahkan pada fraksi pelarut lainnya.
[image:39.595.89.517.504.737.2]Uji aktivitas antioksidasi suatu senyawa antioksidan dapat berupa aktivitas menghambat oksidasi senyawa stabil tertentu yang mudah dioksidasi dengan suhu atau cahaya seperti senyawa asam lemak atau senyawa lipid seperti metode TBA,
Tabel 1 Aktivitas antioksidasi ekstrak etanol 70% daun sirih merah dan vitamin E metode DPPH
Larutan Daya hambat (%) IC50
Ekstrak (25 ppm) 13,10
Ekstrak (50 ppm) 28,90
Ekstrak (75 ppm) 47,47 85,82 ppm
Ekstrak (100 ppm) 59,34
Ekstrak (200 ppm) 73,41
Vitamin E (1 ppm) 37,87
Vitamin E (2,5 ppm) 52,91
Vitamin E (5 ppm) 59,72 2,12 ppm
Vitamin E (7,5 ppm) 74,75
namun dapat berupa kemampuan menangkap senyawa radikal bebas atau yang biasa disebut radical scavenger. Kedua metode ini dapat dijadikan model bagi kemampuan daun sirih merah dalam mengurangi tingginya kadar lipid peroksidasi dan senyawa radikal bebas pada penderita diabetes mellitus. Metode radical scavenger dapat menggunakan larutan DPPH (2,2-diphenil-1-picryl hydrazyl). Senyawa DPPH ini merupakan senyawa radikal bebas yang mudah bereaksi dengan senyawa antioksidan pada suhu kamar. Larutan senyawa ini berwarna ungu, ketika bereaksi dengan senyawa antioksidan warna larutan berubah menjadi kuning. Prinsip metode ini adalah menetralkan senyawa radikal bebas DPPH dengan senyawa antioksidan yang dapat ditunjukkan dengan perubahan warna larutan. Secara mekanisme, terdapat dua macam reaksi senyawa DPPH dengan senyawa antioksidan. Mekanisme reaksi pertama merupakan proses transfer secara langsung elektron atau atom H dari senyawa antioksidan ke senyawa DPPH. Mekanisme reaksi kedua adalah proses transfer elektron dengan proton terkonsentrasi, yaitu senyawa DPPH kehilangan proton yang diberikan ke senyawa antioksidan, sehingga senyawa DPPH bermuatan negatif. Senyawa antioksidan berubah bermuatan positif dan mentransfer atom hidrogen ke senyawa DPPH (Lan FW dan Hong YZ 2003). Mekanisme reaksinya sebagai berikut:
DPPH· + RXH DPPHH + RX· (1)
DPPH· + RXH DPPH¯ + RXH·+ DPPHH + RX· (2)
Hasil penelitian aktivitas antioksidasi dengan dua metode berbeda menunjukkan bahwa ekstrak etanol 70% daun sirih merah dapat menghambat oksidasi asam lemak dan juga dapat berperan sebagai radical scavenger. Namun daya hambat yang dihasilkan lebih besar pada metode TBA dengan konsentrasi yang sama sehingga dapat diasumsikan bahwa ekstrak etanol 70% daun sirih merah lebih efektif sebagai penghambat oksidasi asam lemak daripada sebagai
Inhibisi dan Kinetika Inhibisi α-glukosidase
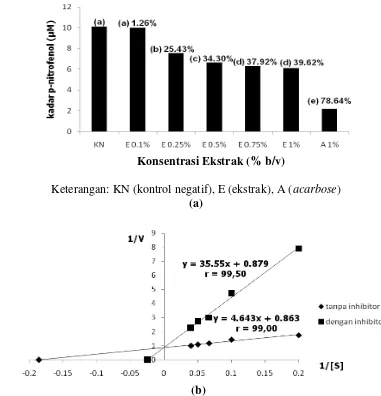
Hasil penelitian menunjukkan bahwa ekstrak etanol 70% daun sirih merah memiliki aktivitas inhibisi kerja α-glukosidase. Aktivitas ini dapat ditunjukkan dengan rendahnya kadar p-nitrofenol setiap konsentrasi dari ekstrak etanol 70% daun sirih merah dibandingkan dengan kontrol negatif (larutan enzim substrat tanpa ekstrak daun sirih merah). Peningkatan konsentrasi ekstrak etanol 70% daun sirih merah berbanding terbalik dengan kadar p-nitrofenol yang terbentuk. Konsentrasi ekstrak etanol 70% daun sirih merah terbesar (1% b/v) memiliki kadar p-nitrofenol terkecil (6,1038 µM) dibandingkan dengan konsentrasi lainnya. Konsentrasi ekstrak etanol 70% daun sirih merah 1% b/v memiliki daya inhibisi terbesar, yaitu 39,62%. Daya inhibisi terkecil dimiliki ekstrak etanol 70% daun sirih merah dengan konsentrasi 0,1% b/v, yaitu 1,26% dengan kadar p-nitrofenol sebesar 9,9816 µM. Daya inhibisi acarbose 1% b/v sebesar 78,64% (Gambar 8a). Aktivitas inhibisi konsentrasi terbesar ekstrak daun sirih merah berbeda nyata dengan acarbose dan kontrol negatif (α = 0,05). Namun aktivitas inhibisi konsentrasi ekstrak daun sirih merah terkecil tidak berbeda nyata dengan kontrol
negatif (α = 0,05) sehingga kurang efektif dalam menghambat kerja α -glukosidase. Daya inhibisi ekstrak dengan konsentrasi 1% b/v dengan konsentrasi 0,75% b/v tidak berbeda nyata sehingga dapat diasumsikan aktivitasnya sama dalam menghambat kerja α-glukosidase (Data lengkap hasil analisisa statistika pada Lampiran 19). Bila dibandingkan daya inhibisi acarbose 1% b/v dengan konsentrasi terbesar ekstrak (1% b/v), daya inhibisi ekstrak adalah setengah dari daya inhibisi acarbose (Data lengkap pada Lampiran 15). Daya inhibisi ekstrak daun sirih merah ini lebih besar bila dibandingkan dengan tumbuhan lain seperti buah salak yang mempunyai daya inhibisi 13,18% pada konsentrasi 1% b/v
terhadap α-glukosidase (Pratama NR 2009). Namun daya inhibisi daun sirih ini lebih rendah daripada fraksi etanol daun sukun yang sudah menghambat α -glukosidase sebesar 50% pada konsentrasi 12,9 ppm (Udin et al. 2005). Senyawa p-nitrofenol digunakan sebagai larutan baku, sehingga persamaan garis adalah y = -0,012971 + 0,044612 x; r = 99,75% (Data lengkap pada Lampiran 16).
Setelah diketahui bahwa ekstrak etanol 70% daun sirih merah memiliki
inhibisi ekstrak tersebut terhadap enzim. Jenis inhibisi ini dapat diketahui setelah hasil analisis diplotkan pada kurva Lineweaver-Burk (Data lengkap pada Lampiran 17). Hasil penelitian menunjukkan inhibisi ekstrak etanol 70% daun sirih merah adalah competitive (Gambar 8b). Jenis inhibisi sama dengan inhibisi
acarbose terhadap α-glukosidase (Myo JK et al. 1999). Penghambatan oleh inhibitor competitive dapat dikurangi dengan cara menambahkan jumlah substrat sehingga dapat meningkatkan peluang bagi substrat untuk berikatan dengan enzim. Enzim merupakan suatu biomakromolekul yang mempunyai kemampuan katalitik dan spesifisitas tinggi. Reaksi enzim dengan senyawa kimia sangat terkendali karena enzim akan optimal bekerja dengan substrat tertentu dan keadaan lingkungan yang sesuai (suhu dan pH). Enzim sebagian besar merupakan
Keterangan: KN (kontrol negatif), E (ekstrak), A (acarbose)
(a)
Gambar 8 (a) kadar p-nitrofenol ekstrak etanol 70% daun sirih merah, (b) grafik jenis inhibisi ekstrak etanol 70% daun sirih merah
(b)
[image:42.595.116.497.315.711.2]molekul protein. Namun, enzim dapat dihambat dengan suatu senyawa kimia atau biasa disebut dengan inhibitor. Inhibitor ini akan menghambat kerja enzim sehingga produk yang dihasilkan sedikit. Substrat yang digunakan dalam penelitian ini adalah p-nitrofenil-α-D-glukopiranosida sehingga produknya berupa senyawa p-nitrofenol. Terhambatnya kerja α-glukosidase oleh ekstrak daun sirih merah, maka senyawa p-nitrofenol yang dihasilkan jumlahnya sedikit. Adanya inhibitor tidak selalu memberikan efek negatif karena inhibitor dapat dijadikan obat bagi suatu penyakit. Prinsip tersebut yang digunakan dalam penelitian ini.
Analisis Komponen Senyawa Ekstrak Etanol 70% Daun Sirih Merah
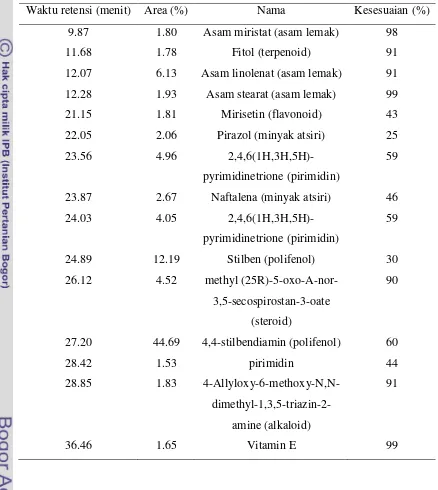
Hasil analisis GC-MS (Gas Chromatography Mass Spectrometry) dengan parameter MS untuk mendeteksi senyawa dengan massa 50-800 menunjukkan pola kromatogram dari senyawa yang terkandung di dalam ekstrak etanol 70% daun sirih merah (Data lengkap pada Lampiran 18). Senyawa yang terdeteksi dengan instrumen ini adalah senyawa-senyawa yang dapat berubah menjadi gas atau yang bersifat volatil, karena prinsip dari instrumen ini adalah menguapkan senyawa dengan suhu tinggi. Hasil kromatogram tersebut diolah dengan database
perangkat lunak menunjukkan komponen senyawa ekstrak etanol 70% daun sirih merah terdiri atas golongan asam lemak, terpenoid, flavonoid, steroid, alkaloid, pirimidin, minyak atsiri, polifenol, dan vitamin E. Namun terdapat beberapa senyawa yang mempunyai nilai kesesuaian rendah dengan database. Kemungkinan hal ini terjadi karena database yang digunakan tidak mempunyai data-data kromatogram yang sesuai dengan kromatogram ekstrak (Tabel 2).
-tokoferol merupakan suatu senyawa yang sudah banyak dikenal sebagai antioksidan.
Tabel 2 Komponen senyawa ekstrak etanol 70% daun sirih merah
Waktu retensi (menit) Area (%) Nama Kesesuaian (%)
9.87 1.80 Asam miristat (asam lemak) 98
11.68 1.78 Fitol (terpenoid) 91
12.07 6.13 Asam linolenat (asam lemak) 91
12.28 1.93 Asam stearat (asam lemak) 99
21.15 1.81 Mirisetin (flavonoid) 43
22.05 2.06 Pirazol (minyak atsiri) 25
23.56 4.96
2,4,6(1H,3H,5H)-pyrimidinetrione (pirimidin)
59
23.87 2.67 Naftalena (minyak atsiri) 46
24.03 4.05
2,4,6(1H,3H,5H)-pyrimidinetrione (pirimidin)
59
24.89 12.19 Stilben (polifenol) 30
26.12 4.52 methyl
(25R)-5-oxo-A-nor-3,5-secospirostan-3-oate (steroid)
90
27.20 44.69 4,4-stilbendiamin (polifenol) 60
28.42 1.53 pirimidin 44
28.85 1.83
4-Allyloxy-6-methoxy-N,N- dimethyl-1,3,5-triazin-2-amine (alkaloid)
91
SIMPULAN DAN SARAN
Simpulan dari penelitian ini adalah ekstrak etanol 70% daun sirih merah memiliki aktivitas sebagai antidiabetogenik. Proses antidiabetogenik ini melalui hambatan oksidasi asam lemak dan radical scavenger serta sebagai inhibitor
competitive α-glukosidase. Aktivitas antioksidasi ekstrak etanol 70% daun sirih merah dapat berperan sebagai penghambat oksidasi asam lemak dengan daya hambat terbesar 80,40% dan sebagai radical scavenger dengan nilai IC50 85,82
ppm. Aktivitas inhibisi terhadap α-glukosidase mempunyai daya hambat terbesar 39,62% dengan jenis inhibisi competitive. Oleh karena itu, daun sirih merah berpotensi mengurangi kadar senyawa radikal bebas dan oksidasi lipid serta kadar gula darah bagi penderita diabetes mellitus. Komponen senyawa yang terkandung pada ekstrak etanol 70% daun sirih merah adalah golongan asam lemak, terpenoid, flavonoid, steroid, alkaloid, pirimidin, minyak atsiri, polifenol, dan vitamin E. Senyawa yang diperkirakan memiliki aktivitas adalah polifenol, alkaloid, flavonoid, terpenoid, dan vitamin E.
Saran bagi penelitian selanjutnya adalah perlunya isolasi dan pemurnian senyawa aktif dari daun sirih merah serta diuji aktivitasnya. Perlu dikaji mekanisme antioksidasi dari daun sirih merah dan uji in vivo antioksidasi untuk menurunkan kadar peroksidasi lipid. Selain itu perlu diketahui dosis yang tepat bagi senyawa murni ekstrak daun sirih merah untuk uji klinis pada hewan coba sehingga dapat dikonsumsi penderita diabetes mellitus.
DAFTAR PUSTAKA
Alfarabi M. 2008. Aktivitas antioksidasi ekstrak daun sirih merah [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Aqil F, Ahmad I, Mehmood Z. 2006. Antioxidant and free radical scavenging properties of twelve traditionally used Indian medicinal plants. Turk J Biol
30:177-183
Betteridge DJ. 2000. What is oxidative stress. Metabolism 49 (Suppl 1): 3-8
Bhattacharya S et al. 2007. Inhibitory property of Piper betel extract against photosensitization-induced damages to lipids and proteins. Food Chemistry
100: 1474-1480
Ceriello A. 2000. Oxidative stress and glycemic regulation. Metabolism 49 (Suppl 1): 27-29
Ceriello A. 2003. New insights on oxidative stress and diabetic complications may lead to a causal antioxidant therapy. Diabetes Care 26: 1589-1596
Cetto AA, Jimenez JB, Vazquez RC . 2008. Alfa-glucosidase inhibiting activity of some Mexican plants used in the treatment of type 2 diabetes. Journal of Ethnopharmacology 117: 27-32
Chang HJ, Ho MS, In WC, Hong YC. 2005. Antioxidant activities of cultivated and wild korean ginseng leaves. Food Chemistry 92: 535-540
Chen HM, Muramoto K, Yamauchi F, Nokihara K. 1996. Antioxidant activity of designed peptides base on the antioxidative peptide isolated from digest of soybean protein. J Agric Food Chem 44: 2619
Dobretsov M, Romanovsky D, Stimers JR. 2007. Early diabetic neuropathy: triggers and mechanism. World J Gastroenterol 13: 175-191
Duryatmo S. 2005. Dulu hiasan kini obat. Trubus 427:37
Evans CAR, Miller NJ, Paganga G. 1996. Sturcture antioxidant activity relationships of flavonoids and phenolic acids. Free Radical Biology and Medicine 20: 933-956
Guohua R, Mouming Z, Weifeng L, Haiyan L. 2007. Antioxidative activity of tobacco leaf protein hydrolysates. Food Technol Biotechnol 45: 80-84
Harborne JB. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. K Padmawinata, I Sudiro, penerjemah. Bandung: ITB. Terjemahan dari: Phytochemical Method
Harborne JB, Williams CA. 2000. Advances in flavonoid research since 1992.
Phytochemistry 55: 481-504
Hart H, Craine LE, Hart DJ. 2003. Kimia Organik: Suatu Kuliah Singkat.
Achmadi S, penerjemah; Safitri A, editor. Jakarta: Erlangga. Terjemahan dari:
Organic Chemistry: A Short Course
Illanes A. 2008. Enzyme Biocatalysis: Principles and Applications. Chile: Springer
Jankyova S et al. 2009. Pycnogenol efficiency on glycaemia, motor nerve conduction velocity, and markers of oxidative stress in mild type diabetes in rats. Phytotherapy Research 23: 1169-1174
Kalaivanam KN, Dharmalingam M, Marcus SR. 2006. Lipid peroxydation in type 2 diabetes mellitus. Int J Diab Dev Ctries 26: 30-32
Kikuzaki H, Nakatani N. 1993. Antioxidant effect of some ginger constituents.
Journal of Food Science 58(6):1407-1410
Lan FW, Hong YZ. 2003. A theoretical investigation on DPPH radical scavenging mechanism of edaravone. Bioorganic and Medicinal Chemistry Letters 13: 3789-3792
Lau et al. 2009. Radix Astragali and Radix Rehmanniae, the principal components of two antidiabetic foot ulcer herbal formulae, elicit viability-promoting effects on primary fibroblast cultured from diabetic foot ulcer tissues. Phytotherapy Research 23: 809-815
Linder MC. 2006. Biokimia Nutrisi dan Metabolisme dengan Pemakaian Secara Klinis. Aminuddin Parakkasi, penerjemah. Jakarta: UI Press. Terjemahan dari:
Nutritional Biochemistry and Metabolism
Maritim AC, Sanders RA, Watkins JB. 2003. Diabetes, oxidative stress, and antioxidant: a review. J Biochem Molecular Toxicology 17: 24-38
Marlina PW. 2008. Konsentrasi flavonoid dan lethal concentration 50 (LC50)
ekstrak daun sirih merah (Piper crocatum) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor
Murray RK, Granner DK, Mayes PA, Rodwell VW. 2003. Biokimia Harper Edisi 25. Hartono, penerjemah. Jakarta: EGC. Terjemahan dari: Harper’s Biochemistry
Myo JK et al. 1999. Comparative study of the inhibition of α-glucosidase, α -amylase, and cyclomaltodextrin glucanosyltransferase by acarbose, isoacarbose, and acarviosine-glucose. Archives of Biochemistry and Biophysics
371: 277-283
Nakayama S, Katoh EM, Tsuzuki T, Kobayashi S. 2003. Protective effect α -tocopherol-6-O-phosphate against ultraviolet B-induced damage in cultured mouse skin. The Journal Investigative Dermatology 121: 406-411
Panda S, Kar A. 2007. Antidiabetic and antioxidative effects of Annona squamosa
leaves possibly mediated through quercetin-3-O-glucoside. BioFactors 31: 201-210
Parmar HS, Kar A. 2007. Antidiabetic potential of Citrus sinensis and Punica granatum peel extracts in alloxan treated meal mice. BioFactors 31: 17-24
Permata DA. 2006. Potensi rebusan daun sirih merah (Piper crocatum) terhadap perbaikan pankreas tikus putih hiperglikemia [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor
Pokorny J, Yanishlieva N, Gordon M. 2001. Antioxidants In Food: Practical Applications. New York: CRC Press
Pratama NR. 2009. Aktivitas antihiperglikemik ekstrak daging dan kulit buah salak (Salacca edulis Reinw) varietas bongkok [skripsi] Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor
Purwakusumah ED. 2003. Tumbuhan sebagai sumber biofarmaka. Di dalam:
Pelatihan Tanaman Obat Tradisional (Swamedikasi). Prosiding Pertemuan Pengobatan Penyakit Diabetes Mellitus; Bogor, 3-4 Mei 2003. Bogor: Pusat Studi Biofarmaka Lembaga Penelitian IPB
Rohman A, Riyanto S. 2005. Daya antioksidan ekstrak etanol daun kemuning (Murrayapaniculata (L) Jack) secara in vitro. Majalah Farmasi Indonesia 16: 136-140
Saija A et al. 1995. Flavonoids as antioxidant agents: important of their interaction with biomembranes. Free Radical Biology and Medicine 19: 481-486
Salim A. 2006. Potensi rebusan daun sirih merah (Piper crocatum) sebagai senyawa antihiperglikemia pada tikus putih galur Sprague-Dawley [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor
Sen CK, Packer L, Hanninen O. 2000. Handbook of Oxidants and Antioxidants in Exercise. Amsterdam: Elsevier
Stryer L. 2000. Biokimia Edisi ke 4. Sadikin M et al., penerjemah; Soebianto S, Setiadi E, editor. Jakarta: EGC. Terjemahan dari: Biochemistry
Stuart AR, Gulve EA, Wang M. 2004. Chemistry and biochemistry of type 2 diabetes. Chemical Reviews 104: 1255-1282
Sudewo B. 2005. Basmi Penyakit dengan Sirih Merah. Jakarta: Agromedia Pustaka
Suteja L. 2003. Bioprospecting tumbuhan obat Indonesia sebagai sediaan fitofarmaka antidiabetes. Laporan kemajuan tahap II riset unggulan terpadu. Pusat Penelitian Kimia LIPI
The Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. 2003. Report of the expert committee on the diagnosis and classification of diabetes mellitus. Diabetes Care 26 (Suppl 1): 5-20
Udin LZ, Sutedja L, Soemardji AA, Dewi P, Sundawati U. 2005. Daun sukun (Artocarpus communis) sebagai fitofarmaka antidiabetes. Proyek Industri Bahan Baku Kimia Jadi
Wenli et al. 2009. Triterpene acid isolated from Lagerstroemia speciosa leaves as
α-glucosidase inhibitors. Phytotherapy Research 23: 614-618
Wild S, Roglic G, Green A, Sicree R, King H. 2004. Global prevalence of diabetes: estimates for the year 2000 and projections 2030. Diabetes Care 27: 1047-1053
Lampiran 1 Tahapan umum penelitian
Lampiran 2 Ekstraksi daun sirih merah
Daun sirih merah
Ekstraksi daun sirih merah dengan etanol 70%
Analisis aktivitas antioksidasi metode
TBA
Analisis komponen ekstrak dengan GC-MS Analisis aktivitas
antioksidasi metode DPPH
Analisis inhibitor
α-glukosidase
25 gram daun sirih merah ditambah etanol 70% 100 mL,
dimaserasi 24 jam suhu ruang
Rotavapor 50 °C
Lampiran 3 Analisis ekstrak etanol 70% daun sirih merah dengan GC-MS
Lampiran 4 Penentuan waktu inkubasi maksimum asam linoleat Ekstrak etanol 70% 842,1 mg dilarutkan dengan 1
mL etanol 99% dan diinjeksikan sebanyak 1 µL
Kondisi GC-MS: kolom HP-5 (Agilent 19091J-433: 0,25 mm x 30 m x 0,25 µm mengandung 5% difenil 95% dimetilpolisilosan), laju alir 1,0 mL/menit, suhu injeksi 300 °C mode split, tekanan 10,47 psi, gas
pembawa adalah He
Parameter MS: deteksi senyawa dengan massa 50-800. Kondisi MS adalah suhu MS quad 150-200 °C
dan suhu MS source 250-300 °C, hasil dianalisis dengan database
6 ml asam linoleat dalam etanol 99,8 % 6 mL buffer fosfat 0.1 M pH 7
3 mL akuades
Campuran dipipet ke dalam botol gelap (terdapat 11 botol dan 1 mL campuran untuk setiap botol),
diinkubasi 40 °C
1 mL diambil setiap 24 jam, ditambahkan 2 mL TCA 20 % dan 2 mL TBA 1 %
dalam asam asetat 50 %
Larutan diinkubasi 100 °C, dinginkan
Lampiran 5 Analisis aktivitas antioksidasi metode TBA
Lampiran 6 Analisis aktivitas antioksidasi metode DPPH
1 mL ekstrak etanol 70% daun sirih merah (25, 50, 75, 100, 200 ppm), vitamin E 200 ppm, dan
akuades
Inkubasi 40 °C.
Larutan
diukur serapannya pada λ 532 nm Masing-masing diambil 1 mL
2 mL TCA 20%
2 mL TBA 1 % dalam asam asetat 50%
2 mL ekstrak etanol 70 % daun sirih merah (25, 50, 75, 100, 200 ppm) dan vitamin E dicampur dengan 2 mL DPPH 0.1 mM
diinkubasi 30 menit dengan suhu ruang
diukur reduksi DPPH
dengan λ = 517 nm
2 mL buffer fosfat 0,1 M pH 7 2 mL asam linoleat 50 mM
lama inkubasi optimum hasil pengukuran
Lampiran 7 Analisis inhibisi α-glukosidase
Lampiran 8 Analisis kinetika inhibisi enzim α-glukosidase 0,5 g α-glukosidase + buffer
fosfat 0,1 M pH 7 (mengandung 100 mg BSA)
500 µL 20 mM p-nitrofenil-α
-D-glukopiranosida + 980 µL buffer fosfat pH 7 + 20 µL ekstrak (0,1%, 0,25%, 0,5%, 0,75%, 1% b/v dalam DMSO) diinkubasi suhu 37 °C selama 5 menit. Pembanding acarbose 1%.
Reaksi enzimatis dimulai diinkubasi 37 °C selama 15 menit
Penghentian reaksi dengan 2 mL 200 mM Na2CO3
Diukur dengan λ= 400 nm
Enzim + substrat (5, 10, 15, 20, 25 mM)
Enzim + substrat (5, 10, 15, 20, 25 mM) + ekstrak daun sirih merah 1%
Reaksi enzimatis dimulai diinkubasi 37 °C selama 15
Penghentian reaksi dengan 2 mL 200 mM Na2CO3
Lampiran 9 Rendemen hasil ekstraksi daun sirih merah dengan etanol 70% Ekstrak Bobot daun
(g)
Bobot botol kosong (g)
Bobot botol + ekstrak (g)
Bobot ekstrak (g)
Rendemen (%)
Daun 1 25,0078 37,3183 38,2874 0,9691 3,87
Daun 2 25,8432 37,6933 38,6341 0,9408 3,64
Daun 3 25,1343 35,9828 37,4315 1,4487 5,76
Rerata 25,3284 1,1195 4,42
Contoh perhitungan: Rendemen (%) = bobot ekstrak x 100% bobot daun
= 1,1195 x 100% 25,3284 = 4,42%
Lampiran 10 Absorban inkubasi kadar MDA (µM)terhadap waktu (λ = 532 nm)
Hari A1 A2 A3 [MDA]1 [MDA]2 [MDA]3 Rerata [MDA] ± SD
0 0,156 0,154 0,170 1,2746 1,2564 1,4024 1,3111 ± 0,0795
1 0,193 0,201 0,209 1,6122 1,6852 1,7582 1,6852 ± 0,0730
2 0,262 0,283 0,275 2,2417 2,4333 2,3604 2,3451 ± 0,0967
3 0,387 0,350 0,397 3,3823 3,0447 3,4735 3,3002 ± 0,2258
4 0,456 0,487 0,444 4,0118 4,2947 3,9024 4,0663 ± 0,2024
5 0,500 0,509 0,498 4,4133 4,4954 4,3951 4,4346 ± 0,0534
6 0,893 0,901 0,910 7,9991 8,0721 8,1542 8,0751 ± 0,0775
7 0,670 0,660 0,653 5,9644 5,8732 5,8093 5,8823 ± 0,0779
8 0,621 0,621 0,631 5,5173 5,5173 5,6086 5,5477 ± 0,0527
9 0,550 0,575 0,583 4,8695 5,0976 5,1706 5,0459 ± 0,1569
Contoh perhitungan :
Kadar MDA hari ke-0 (A1) y = 0,0163 + 0,1096 x
0,156 = 0,0163 + 0,1096 x
Lampiran 11 Aktivitas antioksidasi ekstrak etanol 70% daun sirih merah metode TBA (532 nm)
Larutan A1 A2 A3 [MDA]1
(µM)
[MDA]2
(µM)
[MDA]3
<