PENGARUH METODE PENGERINGAN
TERHADAP AKTIVITAS ENZIM FIBRINOLITIK
CACING
Lumbricus rubellus
EKO SETIAWAN
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
EKO SETIAWAN. Pengaruh Metode Pengeringan terhadap Aktivitas Enzim Fibrinolitik Cacing Lumbricus rubellus. Dibimbing oleh DONDIN SAJUTHI dan IRMA HERAWATI SUPARTO.
Tepung cacing Lumbricus rubellus diyakini sangat berkhasiat untuk menyembuhkan berbagai penyakit yang berhubungan dengan trombosis. Metode pengeringan yang efektif dan efisien untuk menghasilkan tepung cacing yang berdaya fibrinolitik tinggi belum pernah dilaporkan. Penelitian ini bertujuan mencari metode pengeringan cacing L. rubellus yang efektif dan efisien serta menghasilkan enzim fibrinolitik yang optimum.
Cacing dikeringkan dengan metode kering-matahari, kering-oven vakum pada 50°C; 0.73 bar, dan kering-beku pada –80°C; 1 kbar. Rendemen tertinggi dihasilkan oleh metode kering-oven vakum, yaitu 11.42% dan biaya produksinya lebih murah 71% terhadap kering-beku. Kering-oven vakum menghasilkan tepung dengan kadar air terendah, yaitu 9.76%. Untuk mengisolasi enzim, tepung cacing (10% b/v) disentrifus pada laju 6000 G dan suhu 4°C selama 10 menit lalu aktivitas proteasenya ditentukan dengan modifikasi metode Bergmeyer. Hasilnya, aktivitas protease metode kering-oven vakum lebih rendah 0.93% terhadap kering-beku. Kadar protein contoh dari kering-oven vakum lebih rendah 24.53% terhadap kering-beku. Bobot molekul protein yang ditetapkan dengan analisis elektroforesis menunjukkan bahwa kering-beku memiliki 5 pita protein dengan bobot molekul 12.7, 42, 48, 58.6, dan 103 kD. Uji aktivitas fibrinolitik secara in vitro menunjukkan aktivitas enzim yang tinggi pada metode kering-oven vakum dan kering-beku. Simpulannya adalah metode kering-kering-oven vakum lebih efektif dan efisien bila dibandingkan dengan kering-matahari dan kering-beku serta enzim proteasenya masih memiliki aktivitas fibrinolitik yang cukup tinggi.
ABSTRACT
EKO SETIAWAN. Influence of Drying Methods on Fibrinolytic Enzymes Activity in Lumbricus rubellus. Supervised by DONDIN SAJUTHI and IRMA HERAWATI SUPARTO.
Lumbricus rubellus earthworm powder is believed to be effective to heal various diseases which related to thrombosis. The effective and efficient drying method to produce powered earthworm powder of high fibrinolytic activity has not been reported. The objective of this research is to evaluate the most effective and efficient drying method of earthworm L. rubellus which have the optimum fibrinolytic enzymes.
3
PENGARUH METODE PENGERINGAN
TERHADAP AKTIVITAS ENZIM FIBRINOLITIK
CACING
Lumbricus rubellus
EKO SETIAWAN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Pengaruh Metode Pengeringan terhadap Aktivitas Enzim Fibrinolitik Cacing Lumbricus rubellus
Nama : Eko Setiawan NIM : G44203069
Menyetujui,
Pembimbing I Pembimbing II
Prof. drh. Dondin Sajuthi, MST, Ph.D Dr. dr. Irma H Suparto, MS
NIP 131 536 684 NIP 131 606 776
Mengetahui,
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. drh. Hasim, DEA
NIP 131 578 806
5
PRAKATA
Alhamdulillah, puji dan syukur penulis panjatkan kepada Allah SWT atas limpahan rahmat dan karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Shalawat serta salam semoga tercurah kepada manusia termulia, Muhammad SAW. Penelitian yang dilaksanakan sejak bulan Juli 2007 ini mengambil judul “Pengaruh Metode Pengeringan terhadap Aktivitas Enzim Fibrinolitik Cacing Lumbricus rubellus”.
Ucapan terima kasih kepada Bapak Prof. drh. Dondin Sajuthi, MST, Ph.D. dan Ibu Dr. dr. Irma H Suparto, MS. selaku pembimbing atas kesabaran dan pengarahannya selama menyusun rencana dan pelaksanaan penelitian serta penulisan skripsi. Di samping itu, ucapan terima kasih juga disampaikan kepada seluruh staf Laboratorium Kimia Anorganik (Pak Sawal, Pak Mul, Pak Caca) dan staf Laboratorium Mikrobiologi Pusat Studi Satwa Primata atas pelayanannya selama pelaksanaan penelitian. Penghargaan penulis terhadap Agus Saputra, SSi dan Ibu Nenah yang telah memberi masukan secara teknis selama penelitian berlangsung.
Teristimewa ucapan terima kasih yang tulus dan mendalam penulis sampaikan kepada Ayah dan almarhumah Ibu tercinta, serta kakak-kakakku atas segala doa dan kasih sayangnya. Tak lupa, rasa terima kasih kepada sahabat-sahabatku seperjuangan di Laboratorium Kimia Anorganik (Ono, Mario, dan Uti) atas kebersamaan selama melakukan penelitian. Terima kasih kepada rekan-rekan Kimia-Q yang selalu membawa keceriaan di setiap kebersamaan, terutama Ichan, Dicky, Rani, dan Julia yang bersedia membantu dalam menyelesaikan masalah yang penulis hadapi. Ucapan terima kasih juga tidak lupa kepada Mas Heri atas bantuannya.
Semoga karya ilmiah ini dapat memberikan manfaat bagi semua orang yang membacanya.
Bogor, Maret 2008
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 17 Juni 1984 dari ayah Sumardi dan ibu almarhumah Samini. Penulis adalah anak ketiga dari tiga bersaudara.
Tahun 2003, penulis lulus dari Sekolah Menengah Umum Negeri 47 Jakarta dan pada tahun yang sama lulus seleksi masuk Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru, kemudian diterima pada Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
7
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Cacing Lumbricus rubellus ... 1
Protease Cacing ... 2
Metode Pengeringan ... 3
Spektrofotometri UV/Vis ... 4
Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS-PAGE) .. 4
Fibrinolisis ... 5
BAHAN DAN METODE Bahan dan Alat ... 6
Metode Penelitian ... 6
HASIL DAN PEMBAHASAN Rendemen Tepung ... 8
Kadar Air ... 9
Penentuan Aktivitas Protease ... 10
Penentuan Bobot Molekul Protein dengan Metode Elektroforesis SDS-PAGE 11
Uji Aktivitas Fibrinolitik ... 11
SIMPULAN DAN SARAN Simpulan ... 13
Saran ... 13
DAFTAR PUSTAKA ... 13
DAFTAR TABEL
Halaman
1 Komposisi gel pemisah dan gel penahan untuk SDS-PAGE ... 8
2 Kadar protein ekstrak kasar L. rubellus pada tiap metode pengeringan ... 11
DAFTAR GAMBAR
Halaman 1 Cacing Lumbricus rubellus ... 22 Rendemen tepung cacing pada tiap metode pengeringan ... 8
3 Rerata kadar air pada tiap metode pengeringan ... 9
4 Rerata aktivitas enzim pada tiap metode pengeringan ... 10
5 Pita protein hasil SDS-PAGE 15% tiap metode pengeringan: (M) marker; (KM) kering-oven vakum; (KM) kering-matahari; (KB) kering-beku ... 11
6 Produk degradasi fibrin oleh enzim (a) 10%; (b) 5%; (c) 2.5% dengan perbesaran 40x ... 12
7 Perbandingan produk degradasi fibrin oleh enzim 10% (b/v) dengan perbesaran 40x: (KB) kering-beku; (KO) kering-oven vakum; (KM) kering-matahari; (K) kontrol (tanpa enzim) ... 12
8 Pengaruh konsentrasi substrat (a) 0.01 g dan (b) 0.02 g pada produk degradasi fibrin oleh enzim 2.5%; perbesaran 40x ... 13
DAFTAR LAMPIRAN
Halaman 1 Prosedur pembuatan pereaksi kimia ... 172 Bagan alir penelitian ... 19
3 Rendemen tepung cacing yang dihasilkan dengan metode kering-matahari, kering-oven vakum, dan kering-beku ... 20
4 Biaya produksi tepung cacing dengan metode kering-matahari, kering-oven vakum, dan kering-beku ... 21
5 Kadar air tepung cacing dari metode kering-matahari, kering-oven vakum, dan kering-beku ... 22
6 Data penentuan aktivitas enzim protease pada λmaks = 578 nm ... 24
7 Penentuan panjang gelombang maksimum pada kisaran 560–580 nm ... 26
8 Pembuatan kurva standar Bradford dan penentuan kadar protein contoh ... 27
9 Kurva standar SDS-PAGE 15% dan penentuan BM protein contoh ... 28
PENDAHULUAN
Cacing Lumbricus rubellus sering dianggap sebagai hewan yang sangat menjijikkan, padahal cacing tersebut memiliki manfaat dalam dunia pengobatan yang tidak dapat diabaikan begitu saja. Khasiat L.
rubellus sudah diketahui sejak dahulu kala oleh negara-negara bagian timur, seperti Jepang, Cina, Taiwan, dan Korea sebagai pengobatan tradisional untuk penyakit tifus dan demam. Seiring dengan kemajuan teknologi, cacing ini mulai digunakan untuk pengobatan modern seperti antitrombosis, hipotensi, hiperlipidemia, diabetes, hipertensi, antipiretik, dan analgesik (Ishii et al. 1992).
Ekstrak enzimnya pertama kali ditemukan oleh Mihara et al. (1991), yaitu enam fraksi protease fibrinolitik yang diberi nama generik lumbrokinase, sedangkan Yanti (2003) melaporkan bahwa ekstraknya memiliki tiga fraksi enzim dengan aktivitas optimum pada suhu 60°C dan pH 8.0. Enzim lumbrokinase yang dihasilkan memiliki daya proteolitik dan fibrinolitik yang tinggi sehingga berpotensi untuk dikembangkan sebagai obat antitrombosis (Mihara et al. 1991; Yanti 2003).
Lumbrokinase merupakan kelompok enzim protease fibrinolitik dari ekstrak L.
rubellus yang bekerja secara ganda dalam menghidrolisis fibrin atau fibrinogen dan sekaligus menstimulasi plasminogen menjadi plasmin (Mihara et al. 1991; Nakajima et al. 1993). Kelebihan lumbrokinase dibandingkan enzim fibrinolitik komersial lainnya ialah dapat dikonsumsi secara oral, aman, tidak toksik, dan tidak menimbulkan efek samping terhadap fungsi jantung, hati, ginjal, sistem respirasi, dan sistem saraf (Suhartono et al. 2004). Oleh karena itu, lumbrokinase sangat menjanjikan untuk dikembangkan sebagai obat antitrombosis yang berdaya fibrinolitik tinggi sehingga dapat berkompetisi dengan obat trombolitik komersial lainnya yang telah ada di Indonesia.
Obat berbahan baku cacing dijual dalam bentuk tepung yang dikemas, seperti kapsul. Kelebihan tepung cacing adalah lebih tahan lama, karakteristik sifat tetap dan seimbang, tidak mempengaruhi penampakan fisik (warna dan bau), kandungan bakteri kontaminan minim, dan tidak mengalami degradasi selama proses penyimpanan (Yanti 2003). Nakajima
et al. (2000) menyatakan bahwa protease cacing dari tepung cukup stabil (aktivitas relatif >80%) pada penyimpanan suhu ruang hingga lima tahun.
Usaha untuk mendapatkan produk tepung cacing yang efektif dan efisien belum banyak dilakukan oleh kalangan industri. Proses pengeringan dengan cahaya matahari telah dilakukan oleh industri kecil. Walaupun biaya yang dikeluarkan relatif rendah, metode ini membutuhkan waktu yang lama karena suhu udara yang tidak stabil. Kelebihan dari metode ini adalah mudah dan murah. Sementara, metode kering-beku baru beberapa industri yang sudah mulai melakukannya, terutama industri besar. Namun, biaya produksi yang relatif tinggi mengakibatkan harga jual produk ikut melonjak. Keuntungan dari metode ini adalah enzim yang terdapat dalam cacing tidak terganggu aktivitasnya akibat panas (Widodo & Suwondo 2006). Di sisi lain, metode pengeringan dengan oven vakum bisa menjadi pilihan alternatif dalam usaha memproduksi tepung cacing. Kelebihan metode ini dibandingkan dengan oven biasa (tanpa vakum) adalah sirkulasi udara yang terjadi selama proses pemanasan lebih baik karena menggunakan pompa vakum sehingga pengeringan merata (Thomas & Holly 1997).
Penelitian ini bertujuan mencari metode pengeringan cacing yang efektif dan efisien serta menghasilkan enzim dengan aktivitas fibrinolitik yang optimum. Adapun metode pengeringan yang dipilih adalah metode kering-matahari, kering-oven vakum, dan kering-beku.
TINJAUAN PUSTAKA
Cacing Lumbricus rubellus
Di Indonesia, cacing L. rubellus sering disebut juga dengan nama cacing Jayagiri. Cacing ini mampu menghasilkan kompos dan bahan organik dalam jumlah besar. Perkembangbiakannya dapat berlangsung pada media yang rendah nutrisi dengan daya reproduksi yang tinggi, yaitu 106 kokon per tahun (Rukmana 1999).
memiliki sifat hermaprodit biparental, peka terhadap cahaya, sentuhan, dan getaran, tidak memiliki gigi, serta rentan pada berbagai minyak dan detergen (Palungkun 1999). Hegner dan Engemann (1968) mengklasifikasikan cacing L. rubellus sebagai berikut:
Dunia : Animalia Divisi : Vermes Filum : Annelida Kelas : Oligochaeta Ordo : Opisthopora Famili : Lumbricidae Genus : Lumbricus
Spesies : rubellus
Cacing ini memiliki ciri-ciri tubuh gilig ventral pipih, panjang 7.5–10 cm, warna tubuh bagian punggung cokelat cerah sampai ungu kemerahan, warna tubuh bagian ventral krem, dan bagian ekor kekuningan. Jumlah segmen 95–100, klitelium berbentuk sadel dan menonjol, jumlah segmen pada klitelium antara 6–7 segmen yang berada pada segmen ke-27 sampai 32. Lubang kelamin jantan terletak pada segmen ke-14, sedangkan lubang kelamin betina pada segmen ke-13, bergerak kurang aktif, dan kadar air berkisar antara 70– 80% (Edward dan Lofty 1977; Minnich 1977; Rukmana 1999).
Cacing jenis ini mempunyai peran yang penting bagi umat manusia. Selain sebagai obat-obatan, cacing juga berperan sebagai dekomposer dan membantu pengolahan tanah dan taman. Sebagai obat, cacing ini diyakini ampuh menyembuhkan berbagai macam penyakit seperti tifus, demam, antitrombosis, hipotensi, hiperlipidemia, diabetes, hipertensi, antipiretik, dan analgesik (Ishii et al. 1992). Ekstraknya juga mengandung berbagai enzim dan asam amino esensial yang potensial untuk menghaluskan dan melembutkan kulit sehingga dapat diaplikasikan sebagai bahan baku kosmetik. Sebagai dekomposer, cacing dapat menguraikan dan merombak benda-benda yang sudah lapuk menjadi tanah. Di dalam pertamanan, cacing ini dapat membantu membawa udara dan mengalirkan air hujan ke dalam tanah, serta mencampur mineral-mineral (Rukmana 1999).
Secara umum, kandungan gizi pada cacing sebagai berikut: protein (64–76%), lemak (7–10%), kalsium (0.55%), fosfor (1%), dan serat kasar (1.08%). Komposisi asam amino cacing tanah terdiri atas 9 asam amino esensial (arginin, histidin, leusin, isoleusin, lisin, metionin, fenilalanin, treonin,
dan valin) dan 4 asam amino non-esensial (sistein, glisin, serin, dan tirosin) (Palungkun 1999).
Gambar 1 Cacing Lumbricus rubellus.
Protease Cacing
Protease merupakan enzim yang menghidrolisis ikatan peptida pada protein dengan bantuan molekul air. Sumber protease berasal dari hewan, tumbuhan, dan mikroba. Enzim ini dapat diproduksi secara ekstraseluler maupun intraseluler. Cacing tanah mensekresikan protease secara intraseluler (Ward 1985).
Mihara et al. (1991) pertama kali berhasil mengekstrak dan memurnikan enam fraksi protease dari cacing L. rubellus yang diberi nama generik lumbrokinase. Nakajima et al. (2000) menyatakan bahwa enzim protease L.
rubellus memiliki aktivitas proteolitik dan fibrinolitik yang potensial dan tahan terhadap pelarut organik, termasuk toluena dan n -heksana. Selain itu, enzim ini juga mampu mendigesti berbagai substrat protein, seperti kasein, elastin, hemoglobin, kolagen, albumin, dan keratin serta dapat mengkatalisis hidrolisis ester, terutama etil asetat dan bioplastik poli (R)3-hidroksibutirat.
PENGARUH METODE PENGERINGAN
TERHADAP AKTIVITAS ENZIM FIBRINOLITIK
CACING
Lumbricus rubellus
EKO SETIAWAN
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
EKO SETIAWAN. Pengaruh Metode Pengeringan terhadap Aktivitas Enzim Fibrinolitik Cacing Lumbricus rubellus. Dibimbing oleh DONDIN SAJUTHI dan IRMA HERAWATI SUPARTO.
Tepung cacing Lumbricus rubellus diyakini sangat berkhasiat untuk menyembuhkan berbagai penyakit yang berhubungan dengan trombosis. Metode pengeringan yang efektif dan efisien untuk menghasilkan tepung cacing yang berdaya fibrinolitik tinggi belum pernah dilaporkan. Penelitian ini bertujuan mencari metode pengeringan cacing L. rubellus yang efektif dan efisien serta menghasilkan enzim fibrinolitik yang optimum.
Cacing dikeringkan dengan metode kering-matahari, kering-oven vakum pada 50°C; 0.73 bar, dan kering-beku pada –80°C; 1 kbar. Rendemen tertinggi dihasilkan oleh metode kering-oven vakum, yaitu 11.42% dan biaya produksinya lebih murah 71% terhadap kering-beku. Kering-oven vakum menghasilkan tepung dengan kadar air terendah, yaitu 9.76%. Untuk mengisolasi enzim, tepung cacing (10% b/v) disentrifus pada laju 6000 G dan suhu 4°C selama 10 menit lalu aktivitas proteasenya ditentukan dengan modifikasi metode Bergmeyer. Hasilnya, aktivitas protease metode kering-oven vakum lebih rendah 0.93% terhadap kering-beku. Kadar protein contoh dari kering-oven vakum lebih rendah 24.53% terhadap kering-beku. Bobot molekul protein yang ditetapkan dengan analisis elektroforesis menunjukkan bahwa kering-beku memiliki 5 pita protein dengan bobot molekul 12.7, 42, 48, 58.6, dan 103 kD. Uji aktivitas fibrinolitik secara in vitro menunjukkan aktivitas enzim yang tinggi pada metode kering-oven vakum dan kering-beku. Simpulannya adalah metode kering-kering-oven vakum lebih efektif dan efisien bila dibandingkan dengan kering-matahari dan kering-beku serta enzim proteasenya masih memiliki aktivitas fibrinolitik yang cukup tinggi.
ABSTRACT
EKO SETIAWAN. Influence of Drying Methods on Fibrinolytic Enzymes Activity in Lumbricus rubellus. Supervised by DONDIN SAJUTHI and IRMA HERAWATI SUPARTO.
Lumbricus rubellus earthworm powder is believed to be effective to heal various diseases which related to thrombosis. The effective and efficient drying method to produce powered earthworm powder of high fibrinolytic activity has not been reported. The objective of this research is to evaluate the most effective and efficient drying method of earthworm L. rubellus which have the optimum fibrinolytic enzymes.
3
PENGARUH METODE PENGERINGAN
TERHADAP AKTIVITAS ENZIM FIBRINOLITIK
CACING
Lumbricus rubellus
EKO SETIAWAN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Pengaruh Metode Pengeringan terhadap Aktivitas Enzim Fibrinolitik Cacing Lumbricus rubellus
Nama : Eko Setiawan NIM : G44203069
Menyetujui,
Pembimbing I Pembimbing II
Prof. drh. Dondin Sajuthi, MST, Ph.D Dr. dr. Irma H Suparto, MS
NIP 131 536 684 NIP 131 606 776
Mengetahui,
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. drh. Hasim, DEA
NIP 131 578 806
5
PRAKATA
Alhamdulillah, puji dan syukur penulis panjatkan kepada Allah SWT atas limpahan rahmat dan karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Shalawat serta salam semoga tercurah kepada manusia termulia, Muhammad SAW. Penelitian yang dilaksanakan sejak bulan Juli 2007 ini mengambil judul “Pengaruh Metode Pengeringan terhadap Aktivitas Enzim Fibrinolitik Cacing Lumbricus rubellus”.
Ucapan terima kasih kepada Bapak Prof. drh. Dondin Sajuthi, MST, Ph.D. dan Ibu Dr. dr. Irma H Suparto, MS. selaku pembimbing atas kesabaran dan pengarahannya selama menyusun rencana dan pelaksanaan penelitian serta penulisan skripsi. Di samping itu, ucapan terima kasih juga disampaikan kepada seluruh staf Laboratorium Kimia Anorganik (Pak Sawal, Pak Mul, Pak Caca) dan staf Laboratorium Mikrobiologi Pusat Studi Satwa Primata atas pelayanannya selama pelaksanaan penelitian. Penghargaan penulis terhadap Agus Saputra, SSi dan Ibu Nenah yang telah memberi masukan secara teknis selama penelitian berlangsung.
Teristimewa ucapan terima kasih yang tulus dan mendalam penulis sampaikan kepada Ayah dan almarhumah Ibu tercinta, serta kakak-kakakku atas segala doa dan kasih sayangnya. Tak lupa, rasa terima kasih kepada sahabat-sahabatku seperjuangan di Laboratorium Kimia Anorganik (Ono, Mario, dan Uti) atas kebersamaan selama melakukan penelitian. Terima kasih kepada rekan-rekan Kimia-Q yang selalu membawa keceriaan di setiap kebersamaan, terutama Ichan, Dicky, Rani, dan Julia yang bersedia membantu dalam menyelesaikan masalah yang penulis hadapi. Ucapan terima kasih juga tidak lupa kepada Mas Heri atas bantuannya.
Semoga karya ilmiah ini dapat memberikan manfaat bagi semua orang yang membacanya.
Bogor, Maret 2008
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 17 Juni 1984 dari ayah Sumardi dan ibu almarhumah Samini. Penulis adalah anak ketiga dari tiga bersaudara.
Tahun 2003, penulis lulus dari Sekolah Menengah Umum Negeri 47 Jakarta dan pada tahun yang sama lulus seleksi masuk Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru, kemudian diterima pada Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
7
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Cacing Lumbricus rubellus ... 1
Protease Cacing ... 2
Metode Pengeringan ... 3
Spektrofotometri UV/Vis ... 4
Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS-PAGE) .. 4
Fibrinolisis ... 5
BAHAN DAN METODE Bahan dan Alat ... 6
Metode Penelitian ... 6
HASIL DAN PEMBAHASAN Rendemen Tepung ... 8
Kadar Air ... 9
Penentuan Aktivitas Protease ... 10
Penentuan Bobot Molekul Protein dengan Metode Elektroforesis SDS-PAGE 11
Uji Aktivitas Fibrinolitik ... 11
SIMPULAN DAN SARAN Simpulan ... 13
Saran ... 13
DAFTAR PUSTAKA ... 13
DAFTAR TABEL
Halaman
1 Komposisi gel pemisah dan gel penahan untuk SDS-PAGE ... 8
2 Kadar protein ekstrak kasar L. rubellus pada tiap metode pengeringan ... 11
DAFTAR GAMBAR
Halaman 1 Cacing Lumbricus rubellus ... 22 Rendemen tepung cacing pada tiap metode pengeringan ... 8
3 Rerata kadar air pada tiap metode pengeringan ... 9
4 Rerata aktivitas enzim pada tiap metode pengeringan ... 10
5 Pita protein hasil SDS-PAGE 15% tiap metode pengeringan: (M) marker; (KM) kering-oven vakum; (KM) kering-matahari; (KB) kering-beku ... 11
6 Produk degradasi fibrin oleh enzim (a) 10%; (b) 5%; (c) 2.5% dengan perbesaran 40x ... 12
7 Perbandingan produk degradasi fibrin oleh enzim 10% (b/v) dengan perbesaran 40x: (KB) kering-beku; (KO) kering-oven vakum; (KM) kering-matahari; (K) kontrol (tanpa enzim) ... 12
8 Pengaruh konsentrasi substrat (a) 0.01 g dan (b) 0.02 g pada produk degradasi fibrin oleh enzim 2.5%; perbesaran 40x ... 13
DAFTAR LAMPIRAN
Halaman 1 Prosedur pembuatan pereaksi kimia ... 172 Bagan alir penelitian ... 19
3 Rendemen tepung cacing yang dihasilkan dengan metode kering-matahari, kering-oven vakum, dan kering-beku ... 20
4 Biaya produksi tepung cacing dengan metode kering-matahari, kering-oven vakum, dan kering-beku ... 21
5 Kadar air tepung cacing dari metode kering-matahari, kering-oven vakum, dan kering-beku ... 22
6 Data penentuan aktivitas enzim protease pada λmaks = 578 nm ... 24
7 Penentuan panjang gelombang maksimum pada kisaran 560–580 nm ... 26
8 Pembuatan kurva standar Bradford dan penentuan kadar protein contoh ... 27
9 Kurva standar SDS-PAGE 15% dan penentuan BM protein contoh ... 28
PENDAHULUAN
Cacing Lumbricus rubellus sering dianggap sebagai hewan yang sangat menjijikkan, padahal cacing tersebut memiliki manfaat dalam dunia pengobatan yang tidak dapat diabaikan begitu saja. Khasiat L.
rubellus sudah diketahui sejak dahulu kala oleh negara-negara bagian timur, seperti Jepang, Cina, Taiwan, dan Korea sebagai pengobatan tradisional untuk penyakit tifus dan demam. Seiring dengan kemajuan teknologi, cacing ini mulai digunakan untuk pengobatan modern seperti antitrombosis, hipotensi, hiperlipidemia, diabetes, hipertensi, antipiretik, dan analgesik (Ishii et al. 1992).
Ekstrak enzimnya pertama kali ditemukan oleh Mihara et al. (1991), yaitu enam fraksi protease fibrinolitik yang diberi nama generik lumbrokinase, sedangkan Yanti (2003) melaporkan bahwa ekstraknya memiliki tiga fraksi enzim dengan aktivitas optimum pada suhu 60°C dan pH 8.0. Enzim lumbrokinase yang dihasilkan memiliki daya proteolitik dan fibrinolitik yang tinggi sehingga berpotensi untuk dikembangkan sebagai obat antitrombosis (Mihara et al. 1991; Yanti 2003).
Lumbrokinase merupakan kelompok enzim protease fibrinolitik dari ekstrak L.
rubellus yang bekerja secara ganda dalam menghidrolisis fibrin atau fibrinogen dan sekaligus menstimulasi plasminogen menjadi plasmin (Mihara et al. 1991; Nakajima et al. 1993). Kelebihan lumbrokinase dibandingkan enzim fibrinolitik komersial lainnya ialah dapat dikonsumsi secara oral, aman, tidak toksik, dan tidak menimbulkan efek samping terhadap fungsi jantung, hati, ginjal, sistem respirasi, dan sistem saraf (Suhartono et al. 2004). Oleh karena itu, lumbrokinase sangat menjanjikan untuk dikembangkan sebagai obat antitrombosis yang berdaya fibrinolitik tinggi sehingga dapat berkompetisi dengan obat trombolitik komersial lainnya yang telah ada di Indonesia.
Obat berbahan baku cacing dijual dalam bentuk tepung yang dikemas, seperti kapsul. Kelebihan tepung cacing adalah lebih tahan lama, karakteristik sifat tetap dan seimbang, tidak mempengaruhi penampakan fisik (warna dan bau), kandungan bakteri kontaminan minim, dan tidak mengalami degradasi selama proses penyimpanan (Yanti 2003). Nakajima
et al. (2000) menyatakan bahwa protease cacing dari tepung cukup stabil (aktivitas relatif >80%) pada penyimpanan suhu ruang hingga lima tahun.
Usaha untuk mendapatkan produk tepung cacing yang efektif dan efisien belum banyak dilakukan oleh kalangan industri. Proses pengeringan dengan cahaya matahari telah dilakukan oleh industri kecil. Walaupun biaya yang dikeluarkan relatif rendah, metode ini membutuhkan waktu yang lama karena suhu udara yang tidak stabil. Kelebihan dari metode ini adalah mudah dan murah. Sementara, metode kering-beku baru beberapa industri yang sudah mulai melakukannya, terutama industri besar. Namun, biaya produksi yang relatif tinggi mengakibatkan harga jual produk ikut melonjak. Keuntungan dari metode ini adalah enzim yang terdapat dalam cacing tidak terganggu aktivitasnya akibat panas (Widodo & Suwondo 2006). Di sisi lain, metode pengeringan dengan oven vakum bisa menjadi pilihan alternatif dalam usaha memproduksi tepung cacing. Kelebihan metode ini dibandingkan dengan oven biasa (tanpa vakum) adalah sirkulasi udara yang terjadi selama proses pemanasan lebih baik karena menggunakan pompa vakum sehingga pengeringan merata (Thomas & Holly 1997).
Penelitian ini bertujuan mencari metode pengeringan cacing yang efektif dan efisien serta menghasilkan enzim dengan aktivitas fibrinolitik yang optimum. Adapun metode pengeringan yang dipilih adalah metode kering-matahari, kering-oven vakum, dan kering-beku.
TINJAUAN PUSTAKA
Cacing Lumbricus rubellus
Di Indonesia, cacing L. rubellus sering disebut juga dengan nama cacing Jayagiri. Cacing ini mampu menghasilkan kompos dan bahan organik dalam jumlah besar. Perkembangbiakannya dapat berlangsung pada media yang rendah nutrisi dengan daya reproduksi yang tinggi, yaitu 106 kokon per tahun (Rukmana 1999).
memiliki sifat hermaprodit biparental, peka terhadap cahaya, sentuhan, dan getaran, tidak memiliki gigi, serta rentan pada berbagai minyak dan detergen (Palungkun 1999). Hegner dan Engemann (1968) mengklasifikasikan cacing L. rubellus sebagai berikut:
Dunia : Animalia Divisi : Vermes Filum : Annelida Kelas : Oligochaeta Ordo : Opisthopora Famili : Lumbricidae Genus : Lumbricus
Spesies : rubellus
Cacing ini memiliki ciri-ciri tubuh gilig ventral pipih, panjang 7.5–10 cm, warna tubuh bagian punggung cokelat cerah sampai ungu kemerahan, warna tubuh bagian ventral krem, dan bagian ekor kekuningan. Jumlah segmen 95–100, klitelium berbentuk sadel dan menonjol, jumlah segmen pada klitelium antara 6–7 segmen yang berada pada segmen ke-27 sampai 32. Lubang kelamin jantan terletak pada segmen ke-14, sedangkan lubang kelamin betina pada segmen ke-13, bergerak kurang aktif, dan kadar air berkisar antara 70– 80% (Edward dan Lofty 1977; Minnich 1977; Rukmana 1999).
Cacing jenis ini mempunyai peran yang penting bagi umat manusia. Selain sebagai obat-obatan, cacing juga berperan sebagai dekomposer dan membantu pengolahan tanah dan taman. Sebagai obat, cacing ini diyakini ampuh menyembuhkan berbagai macam penyakit seperti tifus, demam, antitrombosis, hipotensi, hiperlipidemia, diabetes, hipertensi, antipiretik, dan analgesik (Ishii et al. 1992). Ekstraknya juga mengandung berbagai enzim dan asam amino esensial yang potensial untuk menghaluskan dan melembutkan kulit sehingga dapat diaplikasikan sebagai bahan baku kosmetik. Sebagai dekomposer, cacing dapat menguraikan dan merombak benda-benda yang sudah lapuk menjadi tanah. Di dalam pertamanan, cacing ini dapat membantu membawa udara dan mengalirkan air hujan ke dalam tanah, serta mencampur mineral-mineral (Rukmana 1999).
Secara umum, kandungan gizi pada cacing sebagai berikut: protein (64–76%), lemak (7–10%), kalsium (0.55%), fosfor (1%), dan serat kasar (1.08%). Komposisi asam amino cacing tanah terdiri atas 9 asam amino esensial (arginin, histidin, leusin, isoleusin, lisin, metionin, fenilalanin, treonin,
dan valin) dan 4 asam amino non-esensial (sistein, glisin, serin, dan tirosin) (Palungkun 1999).
Gambar 1 Cacing Lumbricus rubellus.
Protease Cacing
Protease merupakan enzim yang menghidrolisis ikatan peptida pada protein dengan bantuan molekul air. Sumber protease berasal dari hewan, tumbuhan, dan mikroba. Enzim ini dapat diproduksi secara ekstraseluler maupun intraseluler. Cacing tanah mensekresikan protease secara intraseluler (Ward 1985).
Mihara et al. (1991) pertama kali berhasil mengekstrak dan memurnikan enam fraksi protease dari cacing L. rubellus yang diberi nama generik lumbrokinase. Nakajima et al. (2000) menyatakan bahwa enzim protease L.
rubellus memiliki aktivitas proteolitik dan fibrinolitik yang potensial dan tahan terhadap pelarut organik, termasuk toluena dan n -heksana. Selain itu, enzim ini juga mampu mendigesti berbagai substrat protein, seperti kasein, elastin, hemoglobin, kolagen, albumin, dan keratin serta dapat mengkatalisis hidrolisis ester, terutama etil asetat dan bioplastik poli (R)3-hidroksibutirat.
3
mikroba, protease serin terbagi dalam beberapa jenis, antara lain protease serin serupa tripsin, alkali, α-litik Myxobacter, dan stafilokokal (Suhartono 1992).
Mihara et al. (1991) melaporkan bahwa ekstrak lumbrokinase dari L. rubellus
dihambat spesifik oleh senyawa DFP, LBTI, dan SBTI. Adanya reaksi antara DFP dengan gugus hidroksil dari residu serin pada sisi aktif enzim menyebabkan enzim mengalami inaktivasi. Lumbrokinase juga dihambat oleh TLCK, tapi tidak dipengaruhi oleh etilenadiamina tetraasetat (EDTA) dan ε-asam amino kaproat. Hal ini membuktikan bahwa enzim tersebut tergolong protease serin serupa tripsin (Park et al. 1998). Umumnya, ciri-ciri protease serin serupa tripsin, yaitu aktif pada pH 8, bobot molekul sekitar 20 kD, nilai pI sekitar 4, dan sensitif terhadap inhibitor DFP dan TLCK (Suhartono 1989). Selain itu, uji sekuen N-terminal asam amino pada protease cacing tersebut menunjukkan bahwa enzim memiliki similaritas lokal dengan protease serin lainnya seperti plasmin, tripsin, kimotripsin, elastase, dan faktor koagulan IX (Nakajima et al. 1993, 1996).
Yanti (2003) menyatakan bahwa enzim lumbrokinase L. rubellus memiliki aktivitas optimum pada suhu 60°C dan pH 8 serta termasuk dalam kelompok protease serin karena dihambat sempurna oleh PMSF pada konsentrasi total 1 mM. Sementara, Prasetiya (2005) melaporkan bahwa enzim lumbrokinase memiliki aktivitas optimum pada suhu 65°C dan pH 9, tergolong protease serin, serta bersifat termostabil.
Struktur protease cacing L. rubellus
berupa satu rantai polipeptida tunggal yang tersusun atas 282 asam amino dengan ukuran molekul 30 kD (Choi et al. 1996). Hasil analisis SDS-PAGE menunjukkan bahwa protease murni L. rubellus terdiri atas enam fraksi dengan bobot molekul 23.5, 27, 27.4, 28.5, 34, dan 34.2 kD (Mihara et al. 1991) serta 24, 27, 36, 38, 40, dan 43 kD (Nakajima
et al. 1993). Sementara, Park et al. (1998) hanya mendapatkan dua fraksi dengan bobot molekul 34 dan 34.2 kD. Komposisi asam aminonya memperlihatkan bahwa lumbrokinase kaya akan asam amino asparagin dan asam aspartat, tetapi miskin akan lisin dan prolin (Mihara et al. 1991; Nakajima et al. 1993). Selain itu, lumbrokinase tidak mengandung gula (Nakajima et al. 1993).
Metode Pengeringan
Pengeringan zat padat adalah pemisahan sejumlah kecil air atau zat cair dari bahan sehingga mengurangi kandungan sisa zat cair di dalam zat padat itu sampai suatu nilai rendah yang dapat diterima. Ada beberapa metode pengeringan yang lazim dilakukan, yaitu sun drying (kering-matahari), oven drying (kering-oven), dan freeze drying
(kering-beku)(Thomas & Holly 1997).
Kering-matahari adalah metode pengeringan yang paling mudah dan murah. Metode ini sangat tergantung pada cuaca, kelembaban, dan suhu lingkungan sekitar. Jika lingkungan sangat panas dan kering, metode initidak memerlukan waktu yang lama. Akan tetapi, jika kondisi lingkungan dingin dan lembab, metode ini cukup merugikan karena prosesnya memerlukan waktu yang sangat lama sehingga kurang efisien (Thomas & Holly 1997). Selain itu, kerugian metode kering-matahari lainnya adalah pengeringan yang relatif lama di udara terbuka membuat contoh rentan terkontaminasi oleh bakteri dan cendawan sehingga aktivitas enzim proteolitiknya akan berkurang hingga 70% (Widodo & Suwondo 2006).
Kering-oven adalah metode pengeringan yang mengandalkan panas dari energi listrik sehingga membutuhkan asupan energi yang lebih besar daripada kering-matahari. Kelebihan dari metode ini ialah suhu yang dihasilkan konstan dan dapat diatur sesuai kebutuhan, waktu pengeringan relatif lebih singkat, serta kontaminan dapat dieliminasi sekecil mungkin. Modifikasi dari metode kering-oven adalah kering-oven vakum yang menggunakan pengatur tekanan sehingga tidak diperlukan suhu yang terlalu tinggi dalam prosesnya. Metode ini sangat cocok untuk contoh yang sensitif terhadap suhu, seperti enzim. Tekanan dapat disesuaikan untuk mengatur kekuatan vakum dalam menyedot uap air yang lepas dari contoh (Thomas & Holly 1997).
Setelah gelas terhubung dan terkunci oleh pipa, alat pendingin diaktifkan. Suhu ruang menurun hingga di bawah –50°C sehingga contoh membeku (Widodo & Suwondo 2006). Pompa vakum segera menyedot udara di ruang pengering dengan tekanan tertentu sehingga tekanan di ruang pengering menjadi di bawah 1 atm, lalu radiator energi juga diaktifkan. Saat itulah, air yang sudah berbentuk kristal mengalami proses sublimasi. Tekanan udara sangat rendah menyebabkan kristal es berubah menjadi uap air. Energi berupa udara panas itu memacu molekul air untuk melepaskan diri dari molekul contoh yang mengikatnya. Mesin vakum menyedot uap air dan membuang ke luar ruang pengering melewati alat pendingin. Uap air terkumpul dan berubah menjadi butiran es kembali pada alat pendingin ini (Thomas & Holly 1997; Widodo & Suwondo 2006).
Aktivitas enzim proteolitik contoh hasil proses kering-beku tetap tinggi sehingga dapat menentukan kualitas contoh tersebut. Contoh perlu disterilkan dari bakteri dan cendawan terlebih dahulu sebelum dikeringbekukan, biasanya dengan cara dicuci dengan alkohol. Kekurangan dari metode ini adalah harga peralatan yang relatif mahal sehingga biaya produksi tinggi dan mengakibatkan harga jual produk yang relatif tinggi (Hu et al. 2008).
Spektrofotometri UV/Vis
Spektrofotometri merupakan salah satu teknik analisis kualitatif dan kuantitatif yang cukup andal karena sederhana dan mudah dioperasikan. Dasar penggunaan metode ini dalam analisis kimia adalah interaksi antara radiasi elektromagnetik dan contoh. Spektrofotometri serapan sinar tampak dan ultraviolet memanfaatkan sinar dengan panjang gelombang 400–750 nm untuk daerah sinar tampak dan 100–400 nm untuk daerah sinar ultraviolet (Khopkar 1990).
Peralatan spektrofotometri dinamakan spektrofotometer yang pada prinsipnya terdiri atas sumber radiasi, monokromator, sel, fotosel, dan detektor. Sumber radiasi dalam spektrofotometri serapan mempunyai dua fungsi. Pertama, memberikan energi radiasi pada daerah panjang gelombang yang tepat untuk pengukuran. Kedua, mempertahankan intensitas sinar yang tetap selama pengukuran. Sinar yang dikeluarkan oleh sumber radiasi merupakan sinar polikromatis, yaitu mengandung berbagai panjang gelombang. Sementara itu, untuk pengukuran zat
diperlukan sinar tertentu yang khas dan sebaiknya monokromatis. Monokromator berfungsi untuk mendapatkan dan melewatkan sinar monokromatis ke zat yang akan diukur. Monokromator ini bisa berupa prisma maupun kisi difraksi. Cara kerja kedua jenis monokromator tersebut tidak sama, yaitu prisma berdasarkan prinsip pembiasan, sedangkan kisi difraksi berdasarkan pemantulan sinar.
Sel merupakan tempat zat yang akan diukur penyerapannya. Wadah yang biasa digunakan untuk pengukuran dan ditempatkan pada bagian sel tersebut biasa disebut kuvet. Sinar yang dilewatkan oleh monokromator tidak seluruhnya diserap oleh zat tetapi sebagian ada yang diteruskan. Bagian sinar yang diteruskan tersebut kemudian mencapai fotosel dan di sini energi sinar diubah menjadi energi listrik. Penggandaan sinar terjadi pada bagian ini agar dihasilkan energi listrik yang cukup. Energi listrik yang dihasilkan dalam fotosel memberikan sinyal pada detektor. Berdasarkan sinyal itu kemudian dapat terbaca besarnya serapan ataupun transmisi radiasi oleh zat tersebut (Suradikusumah et al. 2004). Spektrofotometer ada yang memiliki berkas tunggal dan berkas ganda. Spektrofotometer berkas ganda memiliki kelebihan, yaitu pembacaan serapan contoh tidak dipengaruhi oleh perubahan tegangan listrik karena blanko dan contoh diukur pada saat yang bersamaan. Spektrofotometer berkas ganda juga ada yang dilengkapi perekam. Hal ini memudahkan pembuatan spektrum absorpsi suatu contoh bila diperlukan.
Pengukuran berdasarkan pada perbandingan antara intensitas cahaya yang melalui zat (I) dan sebelum mengenai zat (I0).
Rasio I / I0 disebut transmitans dan biasanya
dituliskan dalam persen (%T). Hubungan antara absorbans dan transmitans sebagai berikut: A = – log T (Khopkar 1990).
Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS-PAGE)
5
boundary, elektroforesis zona/wilayah, dan elektroforesis kontinyu (Khopkar 1990).
Elektroforesis SDS-PAGE termasuk ke dalam kelompok elektroforesis zona/wilayah, yaitu kelompok elektroforesis yang dibedakan berdasarkan medium penyangganya. Elektroforesis SDS-PAGE menggunakan gel buatan sebagai medium penyangga. Gel yang digunakan terbentuk dari polimerisasi akrilamida dengan N’N’-metilen bis-akrilamida sehingga terbentuk ikatan silang karena polimerisasi akrilamida sendiri hanya menghasilkan ikatan linear yang tidak dapat membentuk gel kaku (Girindra 1993).
Polimerisasi dapat terjadi dengan cepat pada suhu ruang dengan adanya katalis dan inisiator. Katalis dan inisiator yang umum digunakan berturut-turut adalah N,N,N’,N’-tetrametiletilendiamin (TEMED) dan amonium persulfat (APS). APS berperan sebagai sumber radikal bebas yang akan menginisiasi pembentukan polimer (Khopkar 1990). Metode ini menggunakan natrium dodesil sulfat (SDS) dan 2-merkaptoetanol. SDS merupakan detergen anionik yang bersama dengan 2-merkaptoetanol dan pemanasan menyebabkan rusaknya struktur tiga dimensi protein menjadi konfigurasi acak. Hal ini disebabkan karena pecahnya ikatan disulfida yang selanjutnya tereduksi menjadi gugus-gugus sulfhidrin. Bufer tris digunakan untuk mengarahkan dan mengatur arus pada medium penyangga (Girindra 1993).
Pergerakan partikel di dalam media tergantung pada ukuran partikel dan ukuran pori media penunjang. Ukuran pori dari gel akan ditentukan oleh konsentrasi gel poliakrilamida. Protein yang besar mempunyai mobilitas yang lebih lambat dibandingkan dengan kompleks protein yang lebih kecil. Bobot molekul protein dapat ditentukan dengan kalibrasi menggunakan standar protein yang sudah diketahui bobot molekulnya. Selain ukuran partikel dan media penunjang, faktor-faktor yang mempengaruhi teknik pemisahan elektroforesis zona adalah medan listrik yang digunakan, waktu pemisahan, pH larutan, dan kalor yang dihasilkan saat running (Khopkar 1990). Teknik elektroforesis gel banyak digunakan baik di bidang kimia maupun biokimia karena memiliki banyak keuntungan, diantaranya memiliki daya resolusi tinggi, sederhana, dan mudah dibawa (Girindra 1993).
Fibrinolisis
Fibrinogen adalah protein utama dalam sistem gumpalan darah. Fibrinogen merupakan protein yang berukuran besar dengan bobot molekul sekitar 340 kD dan terdiri atas dua subunit identik yang mengandung tiga rantai polipeptida, yaitu α,
, dan . Semua rantai-rantainya dihubungkan dengan ikatan disulfida. Fibrinopeptida A (1– 16 asam amino) dan B (1–17 asam amino) berturut-turut dihasilkan oleh trombin dari bagian N-terminal rantai α dan . Melalui jalur ini fibrinogen dikonversi menjadi fibrin, yang diartikan sebagai bentuk polimerisasi gumpalan fibrin (Anonim 2004).
Proses penggumpalan fibrinogen dimulai dengan putusnya ikatan peptida N-terminal dari rantai α (fibrinopeptida A) dan rantai (fibrinopeptida B) oleh trombin yang terbentuk selama reaksi berlangsung. Peningkatan jumlah fibrinopeptida A adalah indikator tidak langsung dari gumpalan fibrinogen. Konsentrasi fibrinogen normal di dalam plasma sekitar 3 mg/ml. Tingginya jumlah fibrinopeptida A dapat dijumpai pada penderita infarksi myokardial, sakit jantung koroner, dan penyakit-penyakit yang berhubungan dengan sistem penggumpalan darah lainnya atau disebut juga dengan istilah penyakit kardiovaskular (Anonim 2004).
D-dimer atau fragmen D-dimer adalah suatu jenis uji contoh darah di laboratorium yang bertujuan untuk membantu melakukan diagnosis penyakit dan kondisi yang menyebabkan hiperkoagulabilitas, yaitu suatu kecenderungan darah untuk membeku melebihi ukuran normal. Salah satu kondisi yang umum ditemukan adalah pada trombosis vena dalam yang berhubungan dengan pembekuan darah di dalam pembuluh darah balik (vena) terutama di kaki sehingga menimbulkan nyeri dan kerusakan jaringan. Hal ini juga dapat menimbulkan gumpalan kecil yang terpecah dan menyebar mengikuti aliran darah menuju bagian lain di tubuh sehingga dapat menimbulkan bekuan darah di paru-paru atau embolisme paru (PE). Uji laboratorium yang terkait dengan D-dimer adalah produk degradasi fibrin, waktu protrombin, waktu tromboplastin parsial, fibrinogen, dan hitung plasma. Uji D-dimer biasanya dipakai untuk memonitor dan menjaga agar tingkat pembekuan darah tidak meningkat (Anonim 2004).
sehingga diperoleh produk berupa peptida-peptida berukuran lebih kecil dan larut (Sadikin 2001). Publikasi Nakajima et al. (2000) menyebutkan bahwa protease L.
rubellus mampu mendigesti berbagai substrat protein, seperti kasein, elastin, kolagen, dan hemoglobin. Sementara, Yanti (2003) melaporkan bahwa protease dari ekstrak kasar
L. rubellus mampu menghidrolisis berbagai substrat protein, seperti kasein, albumin, gelatin, protein susu, fibrinogen, dan fibrin.
Sistem enzim proteolitik di dalam darah merupakan protein yang paling bertanggung jawab dalam mendegradasi gumpalan fibrin, yang sering disebut sebagai sistem fibrinolitik. Sistem ini terdiri atas tiga komponen utama, yaitu (1) plasminogen proenzim, dapat diaktifkan melalui proses proteolisis menjadi plasmin enzim proteolitik; (2) aktivator plasminogen, komponen yang memulai proses fibrinolitik dapat berlangsung di dalam sel endotel; (3) inhibitor, dapat menetralkan plasmin dengan cepat atau mengganggu aktivasi plasminogen. Enzim plasmin proteolitik memiliki spesifisitas yang luas, tidak jauh berbeda dengan tripsin. Walaupun demikian, target utama plasmin secara in vivo
adalah fibrin (Wiman & Desire 1978).
Alkjaersig et al. (1959) menyatakan bahwa plasminogen terjerap pada polimerisasi fibrin dan diubah menjadi enzim aktif (plasmin) oleh aktivator yang berdifusi ke dalam trombus. Setelah itu, plasmin beraksi membebaskan lingkungannya dari inhibitor. Ambrus dan Markus (1960) mengemukakan bahwa kompleks plasmin-inhibitor terbentuk pada sirkulasi penguraian fibrin karena plasmin memiliki afinitas yang lebih besar terhadap fibrin daripada inhibitor. Chesterman
et al. (1972) menyatakan bahwa aktivator mengikat fibrin dan ubahan plasminogen secara selektif, yang berdifusi ke dalam trombus, menjadi plasmin.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah cacing L. rubellus, akrilamida, bis-akrilamida, bufer Tris-HCl 2 M pH 8.8, bufer Tris HCl 1 M pH 6.8, bufer fosfat 50 mM pH 7, standar tirosin 5 mM, trichloroacetic acid (TCA) 0.1 M, kasein Hammarsten 2% (b/v), pereaksi Folin-Ciocalteu 1:2, bromfenol biru 1% (b/v), N,N,N’,N’-tetrametiletilendiamina (TEMED), larutan natrium dodesil sulfat (SDS) 10%
(b/v), bovin serum albumin (BSA) Fraction V, isopropanol, marker (broad range), coomassie brilliant blue R-250 dan G-250, fibrin, dan NaCl hipotonik. Pembuatan pereaksi kimia dapat dilihat pada Lampiran 1.
Alat-alat yang digunakan adalah Spectronic 20D+, kuvet, perangkat sel SDS-PAGE (Advantec SPG-1500), sentrifus berpendingin (Beckman GS-6R), alat kering-beku (Labconco), pH meter (JD-21), mikroskop fotostereo (Labophot-2 Nikon), dan peralatan kaca.
Metode Penelitian
Secara garis besar, tahapan penelitian ini meliputi (1) pengeringan dan pembuatan tepung cacing; (2) analisis kadar air; (3) ekstraksi enzim protease; (4) analisis aktivitas protease; (5) analisis kadar protein; (6) analisis SDS-PAGE; (7) analisis aktivitas fibrinolitik (Lampiran 2).
Pengeringan dan Pembuatan Tepung Cacing
Sebanyak ±2 kg cacing L. rubellus yang berukuran kurang lebih sama dibersihkan dan dicuci dengan air mengalir lalu direndam selama 15 menit, kemudian cacing tersebut direndam dalam larutan etanol 30% selama 1 menit untuk mengeluarkan kotorannya sekaligus untuk mematikannya. Setelah itu, cacing direndam kembali dalam air beberapa saat. Selanjutnya, cacing-cacing tersebut ditimbang dan dibagi menjadi 3 bagian untuk dikeringkan dengan 3 metode pengeringan yang berbeda, yaitu matahari, kering-oven vakum, dan kering-beku.
Kering-matahari dilakukan dengan cara cacing ditempatkan pada nampan yang beralaskan aluminium foil dan dijemur di bawah cahaya matahari sampai benar-benar kering dengan mencatat kisaran suhu yang digunakan. Kering-oven vakum dilakukan dengan cara cacing dikeringkan dengan oven vakum bersuhu 50°C pada tekanan 0.73 bar (0.72 atm). Kering-beku dilakukan dengan cara cacing yang telah beku dimasukkan ke alat kering-beku dengan suhu –80°C dan tekanan vakum 1 kbar (986 atm).
7
AnalisisKadar Air (AOAC 1999)
Cawan porselen kosong dimasukkan ke dalam oven dan dikeringkan pada suhu 105°C selama 30 menit, lalu didinginkan pada suhu ruang kemudian dimasukkan ke dalam desikator dan ditimbang bobot kosongnya. Tepung cacing halus ditimbang sebanyak ±1 g di dalam cawan porselen yang telah diketahui bobot kosongnya, lalu dimasukkan ke dalam oven bersuhu 105°C selama 5 jam atau sampai bobotnya tetap. Setelah itu, cawan ditutup dan didinginkan pada suhu ruang lalu dimasukkan ke dalam desikator selama 30 menit kemudian ditimbang. Kadar air dihitung dengan rumus:
Keterangan:
W = bobot contoh uji (g)
W1 = bobot cawan kosong (g)
W2 = bobot cawan + contoh uji bebas air (g)
Ekstraksi Enzim Protease
Tepung cacing L. rubellus (10% b/v) disuspensikan dalam 50 mM bufer fosfat pH 7 dan diaduk vorteks hingga tercampur, kemudian suspensi tersebut disentrifus pada laju 6000 G dan suhu 4°C selama 10 menit. Supernatan yang diperoleh berupa ekstrak kasar dari cacing L. rubellus. Ekstrak kasar ini merupakan ekstrak enzim yang mempunyai konsentrasi 10% (b/v). Suhu dan waktu inkubasi optimum enzim merujuk pada penelitian Yanti (2003), yakni pada suhu 60°C dan 10 menit.
Analisis Aktivitas Protease
Aktivitas protease diukur secara kuantitatif dengan modifikasi metode Bergmeyer (1983) dengan menggunakan substrat kasein Hammarsten (2% b/v). Ada tiga perlakuan analisis yang dilakukan, yaitu blanko, standar, dan contoh. Sebanyak 50 µl larutan contoh (enzim) ditambahkan ke dalam tabung eppendorf yang berisi 250 µl kasein 2% (b/v) dan 250 µl bufer fosfat 50 mM, pH 7. Perlakuan pada blanko dan standar, enzim digantikan dengan akuades dan tirosin 5 mM.
Larutan tersebut diinkubasi pada suhu 60°C selama 10 menit (suhu dan waktu inkubasi optimum enzim). Reaksi hidrolisis dihentikan dengan cara penambahan 500 µl TCA 0.1 M. Blanko dan standar ditambahkan 50 µl larutan enzim, sedangkan pada enzim ditambahkan 50 µl akuades. Selanjutnya, larutan diinkubasi kembali pada suhu 37°C selama 10 menit, dilanjutkan dengan sentrifus
pada laju 6000 G dan suhu 4°C selama 10 menit.
Sebanyak 375 µl supernatan ditambahkan ke dalam tabung berisi 1.25 ml Na2CO3 0.4 M
dan 250 µl pereaksi Folin-Ciocalteu, lalu diinkubasi kembali pada suhu 37°C selama 20 menit. Absorbans larutan diukur pada panjang gelombang maksimum dengan kisaran 560– 580 nm. Satu unit aktivitas protease didefinisikan sebagai jumlah enzim yang dapat menghasilkan 1 µmol produk tirosin per menit pada kondisi pengukuran. Aktivitas enzim dihitung berdasarkan persamaan berikut:
Keterangan: Asp = absorbans contoh Astd = absorbans standar Ablk = absorbans blanko Fp = faktor pengenceran Th = waktu hidrolisis (menit)
Analisis Kadar Protein
Kadar protein ditentukan dengan metode Bradford (1976). Sebanyak 0.1 ml ekstrak kasar enzim (contoh) ditambahkan ke dalam tabung yang berisi 5 ml pereaksi Bradford. Perlakuan pada blanko, ekstrak enzim diganti dengan akuades. Standar protein yang digunakan adalah BSA Fraction V. Larutan stok BSA (1 mg/ml) dibuat dengan cara sebanyak 100 mg BSA dilarutkan dalam 100 ml akuades, kemudian stok tersebut diencerkan menjadi konsentrasi 0.1, 0.2, 0.3, 0.4, 0.6, dan 0.8 mg/ml. Pembuatan kurva standar protein, contoh digantikan dengan larutan standar BSA dengan konsentrasi yang tersebut di atas.
Selanjutnya, larutan tersebut divorteks dan didiamkan selama 2 menit pada suhu ruang. Absorbans larutan diukur pada panjang gelombang 595 nm. Konsentrasi protein dari contoh ditentukan berdasarkan persamaan garis linear hubungan antara konsentrasi BSA dan absorbans.
Analisis SDS-PAGE
Analisis SDS-PAGE adalah analisis kualitatif yang bertujuan untuk mengetahui berapa banyak pita protein yang muncul pada gel sekaligus menentukan bobot molekul dari protein yang muncul. Tahapan kerja yang dilakukan dalam analisis SDS-PAGE meliputi preparasi gel pemisah dan penahan, preparasi contoh dan loading, kondisi running, pewarnaan gel, dan dekolorisasi warna. {W – (W2 – W1)}
W × 100%
Kadar air (%) = Aktivitas enzim (U/ml) = × Asp – Ablk Fp
Preparasi gel pemisah dan gel penahan. Pembuatan gel pemisah 15% dan gel penahan 4% untuk SDS-PAGE dengan komposisi yang tertera pada Tabel 1.
Tabel 1 Komposisi gel pemisah dan gel penahan untuk SDS-PAGE
Gel Gel
Pereaksi pemisah penahan 15% 4%
Larutan A (ml) * 15.00 1.34
Larutan B (ml) * 6.00 –
Larutan C (ml) * – 2.50 Akuades (ml) 9.00 6.00
APS (ml) ** 0.30 0.10
TEMED (ml) *** 0.03 0.01 Total (ml) 30.33 9.95
Keterangan:
* Komposisi larutan A, B, dan C dapat dilihat di
Lampiran 1.
** APS = amonium persulfat
*** TEMED = N,N,N’,N’-tetrametiletilendiamin
Preparasi contoh dan loading. Sebanyak 0.2 ml contoh yang telah dipresipitasi dengan amonium sulfat 60% ditambahkan ke dalam 0.2 ml bufer contoh yang mengandung 2-merkaptoetanol, lalu dipanaskan pada suhu 100°C selama 2–5 menit. Tiap contoh dimasukkan (loading) ke dalam sumur gel dengan volume 0.04 ml dan volume marker yang digunakan adalah 0.02 ml dengan perbandingan marker:bufer contoh (1:4).
Kondisi running, pewarnaan gel, dan dekolorisasi warna. Gel dijalankan (running) pada tegangan 200 V selama ±3 jam dalam bufer elektroforesis. Setelah proses running, gel langsung diwarnai dengan larutan pewarna (coomassie brilliant blue R-250) selama minimal 6 jam. Pelunturan warna pada gel dilakukan dengan larutan dekolorisasi berulang kali hingga didapatkan pita protein biru dengan latar belakang gel tidak berwarna.
Analisis Aktivitas Fibrinolitik
Analisis ini dilakukan dengan metode
serial dilution yang didahului oleh preparasi substrat (Lampiran 1). Contoh ekstrak kasar enzim dibuat menjadi 3 konsentrasi, yaitu 2.5, 5, dan 10%, kemudian sebanyak 1 ml larutan enzim tersebut dimasukkan ke dalam vial-vial dan siap untuk direaksikan dengan fibrin sebagai substratnya. Tiap konsentrasi diulang
sebanyak 3 kali dan dilakukan pada ekstrak enzim dari semua metode pengeringan. Blanko yang digunakan adalah bufer fosfat 50 mM dengan pH 7.
Sebanyak 0.01 g dan 0.02 g substrat yang telah bersih direaksikan dengan larutan enzim di atas pada suhu 60°C (suhu optimum enzim) selama 30 menit. Kelarutan substrat antarperlakuan dinilai secara kualitatif dengan mikroskop pada perbesaran 40x. Banyaknya gumpalan menunjukkan bahwa enzim tidak dapat menghidrolisis fibrin pada kondisi perlakuan.
HASIL DAN PEMBAHASAN
Rendemen Tepung
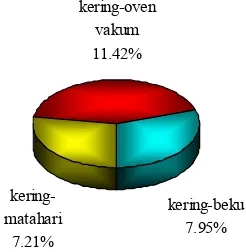
Berdasarkan rendemen yang dihasilkan oleh masing-masing metode pengeringan, kering-oven vakum memiliki produktivitas paling tinggi dengan rerata nilai rendemen sebesar 11.42%. Rendemen metode kering-beku memiliki rerata 7.95%, sedangkan kering-matahari rerata rendemennya sebesar 7.21% (Gambar 2, Lampiran 3). Waktu pengeringan yang diperlukan dengan metode kering-matahari, kering-oven vakum, dan kering-beku berturut-turut adalah 96 jam, 29 jam, dan 20 jam.
kering-beku 7.95% kering-matahari 7.21% kering-oven vakum 11.42%
Gambar 2 Rendemen tepung cacing pada tiap metode pengeringan.
9
efektif dan mengubahnya menjadi wujud yang berbeda (padat atau gas). Semakin baik proses pengeringannya, maka semakin banyak tepung yang dihasilkan dengan waktu tertentu serta tidak mengganggu aktivitas enzim yang terdapat di dalamnya. Prinsipnya, faktor yang menjadi penentu dihentikannya proses pengeringan adalah tingkat kekeringan dari contoh itu sendiri (Thomas & Holly 1997). Efisiensi waktu dan harga menjadi pertimbangan tersendiri dalam memilih metode pengeringan yang ideal. Ditinjau dari efisiensi harga dan peralatan, kering-matahari adalah yang paling efisien karena hanya mengandalkan cahaya matahari. Akan tetapi, metode ini efisiensi waktunya sangat rendah karena laju pengeringannya hanya sekitar 0.08% per jam.
Metode kering-oven vakum lebih efisien dibandingkan dengan kering-beku bila ditinjau dari efisiensi harganya. Walaupun kedua metode ini memiliki laju pengeringan yang relatif sama, yaitu 0.39% per jam untuk kering-oven vakum dan 0.40% per jam untuk beku, biaya produksi metode kering-oven vakum lebih murah 71% bila dibandingkan dengan kering-beku (Lampiran 4). Hal ini disebabkan teknologi mesin kering-beku lebih canggih daripada oven vakum sehingga diperlukan perawatan yang mahal. Daya listrik yang dibutuhkan oleh mesin kering-beku juga lebih besar karena vakum yang digunakan mampu menghasilkan tekanan sampai 1 kbar (986 atm), sedangkan oven vakum hanya 0.73 bar (0.72 atm).
Kadar Air
Kadar air suatu bahan adalah nilai persen banyaknya air yang terkandung dalam suatu bahan terhadap bobot keringnya. Kadar air tepung cacing sangat ditentukan oleh metode pengeringan yang digunakan. Semakin baik metode pengeringan yang digunakan, maka semakin kecil kadar air yang terdapat di dalam tepung. Nilai kadar air hasil pengeringan ditentukan dengan metode gravimetri berdasarkan AOAC (1999).
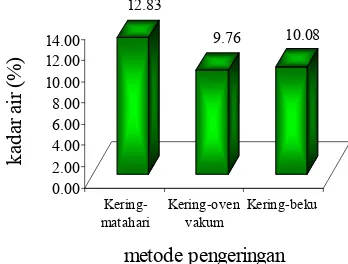
Metode pengeringan dengan matahari setelah dilakukan ulangan sebanyak 3 kali menghasilkan rerata kadar air sebesar 12.83% dengan standar deviasi relatif (%RSD) sebesar 0.91%. Metode kering-oven vakum dan kering-beku berturut-turut rerata kadar air dan %RSD-nya sebesar 9.76%; 0.81% dan 10.08%; 1.26% (Lampiran 5). Nilai %RSD menunjukkan kesesuaian antara beberapa
hasil pengukuran yang diukur dengan cara yang sama. Ketelitian suatu ulangan pengukuran dikatakan baik jika nilai %RSD-nya lebih kecil dari 2% (USP 1995). Ini berarti pengukuran kadar air pada tiap metode pengeringan sudah cukup baik karena memiliki %RSD di bawah 2%.
Perbandingan kadar air antarmetode pengeringan menunjukkan bahwa kering-oven vakum memiliki nilai rerata kadar air paling rendah, yaitu 9.76%. Metode kering-beku dan kering-matahari berturut-turut rerata kadar airnya sebesar 10.08% dan 12.83% (Gambar 3). Metode kering-oven vakum selain produktivitas tepung cacingnya tinggi ternyata juga memiliki efektivitas pengeringan yang cukup tinggi sehingga mampu meminimalisasi kadar air yang terdapat pada tepung cacing. Kadar air yang rendah menyebabkan daya simpan produk tepung cacing menjadi lebih tahan lama sehingga lebih ekonomis.
12.83 9.76 10.08 0.00 2.00
Gambar 3 Rerata kadar air pada tiap metode pengeringan.
Salah satu kendala yang dihadapi pada pengeringan dengan matahari adalah suhu udara yang selalu berubah mengakibatkan proses pengeringan menjadi tidak stabil, yaitu berada pada kisaran 38–58°C. Kondisi ini berdampak pada tekstur fisik cacing menjadi sedikit liat karena tidak kering secara sempurna dan menyeluruh serta warnanya menjadi cokelat tua. Metode kering-oven vakum yang dilakukan pada suhu 50°C dan tekanan 0.73 bar menghasilkan tepung cacing yang berwarna cokelat kehitaman serta teksturnya keras dan mudah hancur (seperti kerupuk) karena telah kering sempurna. Tepung cacing yang dihasilkan dengan metode kering-beku berwarna krem serta teksturnya halus dan lembut. Ini terjadi karena prinsip sublimasi pada metode kering-beku tidak menggunakan panas sehingga tepung tidak berubah warna akibat panas.
4. 6. ad a 00 00 8.00 10.00 12.00 14.00 k
r air (
Penentuan Aktivitas Protease
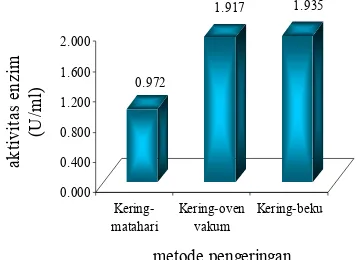
Metode kering-matahari memberikan rerata nilai aktivitas protease sebesar 0.972 U/ml, kering-oven vakum sebesar 1.917 U/ml, dan kering-beku sebesar 1.935 U/ml (Gambar 4, Lampiran 6). Berdasarkan hasil dapat dilihat bahwa metode kering-oven vakum dan kering-beku memiliki aktivitas yang tidak jauh berbeda dan nilainya pun cukup tinggi. Sangat jauh berbeda dengan metode kering-matahariyang berada di bawah level 1 U/ml. Hal ini terjadi karena pengeringan dengan matahari dilakukan pada kondisi terbuka sehingga bakteri dan cendawan sangat mungkin terdapat pada tepung cacing yang dikeringkan dengan metode ini. Menurut Widodo & Suwondo (2006), bakteri dan cendawan dapat menurunkan aktivitas proteolitik enzim sebesar 70%.
Gambar 4 Rerata aktivitas enzim pada tiap metode pengeringan.
Metode kering-oven vakum yang digunakan dapat dikatakan baik karena aktivitas proteasenya tidak jauh berbeda dengan aktivitas yang dihasilkan oleh metode kering-beku, yakni hanya selisih 0.93%. Aktivitas protease dari enzim lumbrokinase yang dikeringkan dengan oven vakum masih tetap tinggi karena suhu yang digunakan masih di bawah suhu optimumnya. Menurut Yanti (2003) jika cacing L. rubellus
dikeringkan pada suhu optimumnya (60°C), maka aktivitas enzim proteasenya akan turun hingga 50%. Akan tetapi, jika dikeringkan sedikit di bawah suhu optimumnya, stabilitas enzim akan tercapai. Hal itu mengindikasikan bahwa tidak ada kesesuaian antara suhu optimum enzim dan suhu pengeringan tepung cacing. Tingkah laku tersebut dapat dimengerti mengingat suhu optimum enzim menggunakan parameter stabilitas suhu terhadap aktivitas enzim. Stabilitas suhu ini ditujukan untuk melihat ketahanan enzim bila
diinkubasi dalam jangka waktu yang relatif singkat (0–60 menit) pada suhu tertentu.
Suhu mempengaruhi laju reaksi katalisis enzim dengan dua cara. Pertama, kenaikan suhu akan meningkatkan energi molekul substrat dan pada akhirnya meningkatkan laju reaksi enzim. Peningkatan suhu juga berpengaruh terhadap perubahan konformasi enzim sehingga substrat mengalami hambatan untuk memasuki sisi aktif enzim dan menyebabkan turunnya aktivitas enzim. Kedua, peningkatan energi termal molekul yang membentuk struktur enzim itu sendiri akan menyebabkan rusaknya interaksi-interaksi nonkovalen (ikatan hidrogen, interaksi van der Waals, interaksi hidrofobik, interaksi elektrostatik) yang menjaga struktur 3D enzim secara bersama-sama sehingga terkonversi menjadi struktur yang lebih sederhana. Konversi itu menyebabkan struktur lipatan enzim membuka pada bagian permukaannya sehingga sisi aktif enzim berubah dan terjadi penurunan aktivitas enzim (Hames & Hooper 2000).
0.972 1.917 1.935 0.000 0.400 0.800 1.200 1.600 2.000 ak tiv ita s e n zi m (U /m l) Kering-matahari Kering-oven vakum Kering-beku metode pengeringan
Penentuan aktivitas enzim protease kasar dilakukan secara kuantitatif dengan menggunakan modifikasi metode Bergmeyer (1983). Menurut Rahayu et al. (1989), prinsip kerja metode ini adalah substrat kasein akan terhidrolisis oleh protease dengan bantuan molekul air menjadi peptida dan asam amino.
Kasein Peptida + Asam amino
protease
Laju pembentukan peptida dan asam amino tersebut dapat dijadikan sebagai tolak ukur aktivitas katalisis protease. Asam amino yang terbentuk harus dipisahkan dari substrat yang tidak terhidrolisis. Umumnya, pemisahan ini dilakukan dengan cara menambahkan TCA. Penambahan TCA tersebut menyebabkan produk yang mengandung peptida dan asam amino akan larut dalam TCA, sedangkan protein yang tidak terhidrolisis akan mengendap. Penambahan TCA ini sekaligus akan menginaktifkan enzim protease. Asam-asam amino tirosin dan triptofan yang larut dalam TCA akan bereaksi dengan reagen Folin-Ciocalteu menghasilkan warna ungu. Penambahan Na2CO3 bertujuan untuk
11
berbanding lurus dengan konsentrasi protein yang terhidrolisis.
Penentuan Bobot Molekul Protein dengan Metode Elektroforesis SDS-PAGE
Berdasarkan kurva standar protein, dapat ditentukan kadar protein pada contoh (Lampiran 8). Tabel 2 menunjukkan bahwa metode kering-beku menghasilkan ekstrak kasar dengan kadar protein paling tinggi, yaitu 1.2709 mg/ml. Sementara, metode kering-oven vakum dan kering-matahari berturut-turut kadar proteinnya sebesar 0.9591 mg/ml dan 0.9219 mg/ml. Berarti kadar protein contoh pada metode kering-beku lebih tinggi sebesar 24.53% bila dibandingkan dengan kering-oven vakum.
Tabel 2 Kadar protein ekstrak kasar L.
rubellus pada tiap metode
pengeringan
Metode T A A terkoreksi
[protein] (mg/ml)
Kering-matahari 4.4 1.3565 0.9650 0.9219
Kering-oven
vakum 4.0 1.3979 1.0064 0.9591
Kering-beku 1.8 1.7447 1.3532 1.2709
Keterangan: T = transmitans
A = absorbans
Berdasarkan hasil yang diperoleh, ada kedekatan kadar protein antara kering-oven vakum dan kering-matahari dengan selisih 3.88%. Kedua metode pengeringan tersebut sama-sama menggunakan prinsip vaporasi atau penguapan, sedangkan kering-beku prinsipnya adalah sublimasi. Hal ini mengindikasikan bahwa panas yang dihasilkan oleh metode kering-oven vakum maupun kering-matahari dapat menurunkan kadar protein tepung, dalam hal ini enzim. Penggunaan energi panas dapat menyebabkan struktur kompleks protein berubah menjadi struktur yang lebih sederhana sehingga mempengaruhi aktivitasnya (Hames & Hooper 2000).
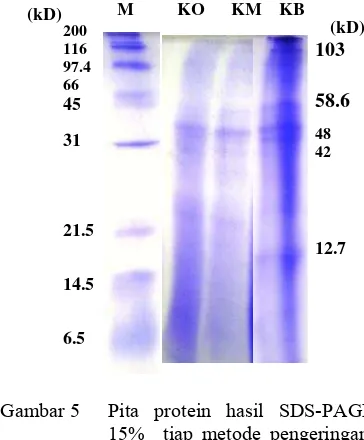
Pengaruh panas yang digunakan oleh metode oven vakum dan kering-matahari terhadap protein contoh juga ditunjukkan dengan sedikitnya pita protein yang muncul pada analisis elektroforesis SDS-PAGE 15% (Gambar 5). Metode kering-beku memiliki 5 pita protein yang masing-masing mempunyai bobot molekul 12.7, 42, 48, 58.6,
dan 103 kD, sedangkan metode kering-oven vakum dan kering-matahari sama-sama hanya memiliki 1 pita protein dengan bobot molekul 48 kD dan diduga protein ini memiliki aktivitas fibrinolitik. Bobot molekul tersebut ditentukan dengan persamaan kurva hubungan antara jarak migrasi dan log BM (Lampiran 9).
M KO KM KB
Gambar 5 Pita protein hasil SDS-PAGE 15% tiap metode pengeringan: (M) marker; (KO) kering-oven vakum; (KM) kering-matahari; (KB) kering-beku.
Berdasarkan hasil uji SDS-PAGE, protease dari cacing L. rubellus dilaporkan terdiri atas enam fraksi enzim dengan bobot molekul 23.5, 27, 27.4, 28.5, 34, dan 34.2 kD (Mihara et al. 1991) dan 24, 27, 36, 38, 40, dan 43 kD (Nakajima et al. 1993). Sementara, Park et al. (1998) mendapatkan dua fraksi enzim protease dengan bobot molekul 34 dan 34.2 kD.
Uji Aktivitas Fibrinolitik
Hasil uji fibrinolitik yang dilakukan secara in vitro terhadap gumpalan darah memperlihatkan bahwa protease L. rubellus
dengan konsentrasi 10% mampu mendegradasi substrat fibrin dan fibrinogen pada pH 7 dan suhu 60°C. Enzim tidak dapat melarutkan fibrin dan fibrinogen secara sempurna pada suhu 37°C, relatif sedikit yang dapat larut. Hasil uji tersebut menunjukkan bahwa proses hidrolisis substrat oleh enzim berlangsung lebih cepat pada kondisi suhu optimum (60°C) daripada suhu tubuh normal
(37°C). Uji fibrinolitik menunjukkan protease
[image:30.595.324.512.161.406.2]L. rubellus relatif stabil hingga suhu 60°C (Mihara et al. 1991; Nakajima et al. 1993; Yanti 2003). Hal ini berhubungan dengan laju reaksi enzim yang meningkat seiring dengan kenaikan suhu sampai pada kondisi tertentu. Secara umum, enzim dengan konsentrasi 5% dapat menghidrolisis sebagian besar fibrin, sedangkan konsentrasi 2.5% hanya sedikit sekali dapat mendegradasi fibrin (Gambar 6, Lampiran 10).
Gambar 6 Produk degradasi fibrin oleh enzim (a) 10%; (b) 5%; (c) 2.5% dengan perbesaran 40x.
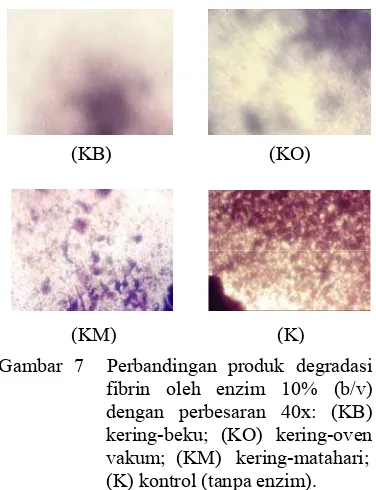
Secara makroskopik, produk degradasi fibrin antarmetode pengeringan dengan konsentrasi enzim yang sama menunjukkan tidak adanya perbedaan, tetapi jika dilihat secara mikroskopik ternyata hasilnya sangat berbeda (Gambar 7). Enzim fibrinolitik dari metode kering-beku mampu mendegradasi fibrin dengan sangat baik, artinya gumpalan fibrin telah larut bersama enzim di dalam bufer menjadi fibrinopeptida yang berukuran lebih kecil. Demikian halnya dengan enzim fibrinolitik dari metode kering-oven vakum yang dapat mendegradasi fibrin dengan cukup baik karena hanya sedikit sekali gumpalan fibrin yang tampak di bawah mikroskop.
Proses yang terjadi selama hidrolisis fibrin adalah enzim akan mendegradasi semua rantai fibrin Aα, B , dan secara serentak menghasilkan fibrinopeptida yang dapat larut. Sementara dalam hidrolisis fibrinogen, pertama kali enzim akan memotong rantai fibrinogen Aα dan B , dilanjutkan dengan degradasi rantai yang menghasilkan fibrinopeptida-fibrinopeptida yang berbobot molekul rendah (Sadikin 2001).
Metode kering-matahari menghasilkan tepung dengan enzim fibrinolitik yang kurang baik karena aktivitasnya sangat rendah, yang ditunjukkan dengan banyaknya gumpalan fibrin yang tidak terdegradasi. Hal ini terjadi karena proses pengeringan dengan matahari secara langsung mengakibatkan enzim sangat rentan terkontaminasi oleh bakteri dan jamur sehingga dapat mengurangi aktivitas
fibrinolitiknya (Widodo & Suwondo 2006). Selain itu, suhu yang tidak stabil juga dapat menurunkan aktivitas fibrinolitik enzim, apalagi suhu tertinggi yang tercatat adalah 58°C, lebih tinggi daripada suhu yang dipakai pada oven vakum.
(KB) (KO)
(a) (b) (c)
(KM) (K)
Gambar 7 Perbandingan produk degradasi fibrin oleh enzim 10% (b/v) dengan perbesaran 40x: (KB) kering-beku; (KO) kering-oven vakum; (KM) kering-matahari; (K) kontrol (tanpa enzim).
Penelitian ini menggunakan 2 konsentrasi substrat yang berbeda, ditunjukkan dengan bobot gumpalan darah sebesar 0.01 g dan 0.02 g. Tujuannya adalah untuk melihat pengaruh konsentrasi substrat, dalam hal ini fibrin, terhadap produk degradasi yang terhidrolisis. Gambar 8 memperlihatkan bahwa enzim dengan konsentrasi 2.5% dapat mendegradasi fibrin lebih baik pada bobot 0.01 g daripada bobot 0.02 g. Aktivitas enzim sangat dipengaruhi oleh konsentrasi substrat, semakin besar konsentrasi substrat maka aktivitas enzim akan meningkat sampai kondisi jenuh, yakni kondisi ketika sisi aktif enzim telah habis bereaksi dengan substrat (Lehninger 1982; Girindra 1990).
[image:30.595.113.301.221.334.2]13
Gambar 8 Pengaruh konsentrasi substrat (a) 0.01 g dan (b) 0.02 g pada produk degradasi fibrin oleh enzim 2.5%; perbesaran 40x.
SIMPULAN DAN SARAN
Simpulan
Hasil penelitian yang diperoleh menunjukkan bahwa kering-oven vakum adalah metode yang sangat efektif dan efisien dalam usaha memproduksi tepung cacing L.
rubellus yang ditunjukkan dengan rendemen tepung cacing sebesar 11.42% dan laju pengeringannya sekitar 0.39% per jam serta kadar air sebesar 9.76%. Selain itu, metode ini 71% lebih murah daripada metode kering-beku sehingga sangat ekonomis. Secara kualitatif, ekstrak kasar enzim memiliki aktivitas fibrinolitik yang tinggi pada konsentrasi minimal 10%.
Hasil analisis kadar protein menunjukkan bahwa selisih kadar protein total antara metode kering-beku dan kering-oven vakum sebesar 24.53%, sedangkan aktivitas proteasenya memiliki selisih 0.93%. Hasil analisis SDS-PAGE 15% menunjukkan bahwa metode kering-beku memiliki 5 pita protein yang berbobot molekul 12.7, 42, 48, 58.6, dan 103 kD, sedangkan metode kering-oven vakum dan kering-matahari sama-sama hanya memiliki 1 pita protein yang berbobot molekul 48 kD dan diduga protein ini memiliki aktivitas fibrinolitik. Metode kering-matahari kurang baik untuk diterapkan karena tepung cacing mudah terkontaminasi bakteri dan cendawan.
Saran
Variasi suhu dan tekanan pada proses pengeringan dengan oven vakum perlu dilakukan untuk mengetahui kondisi optimum pengeringannya. Analisis zimografi dengan
substrat fibrin murni sangat perlu dilakukan agar aktivitas fibrinolitik enzim proteasenya lebih jelas terlihat. Analisis aktivitas fibrinolitik secara in vivo perlu dilakukan untuk mengetahui pengaruh metode pengeringan terhadap aktivitas fibrinolitik dari protease L. rubellus secara langsung.
(a) (b)
DAFTAR PUSTAKA
[Anonim]. 2004. Fibrinogen. http://www. researchd.com [6 Sep 2007].
[AOAC]. 1999. Official Methods of Analysis of AOAC International. 5th Revision.
Volume ke-2. Cunnif P, editor. Maryland: AOAC International.
[USP]. 1995. The United States Pharmacopea Convention. USA: Twinbrook Park Way Rockvill.
Alkjaersig N, Fletcher AP, Sherry S. 1959. The mechanism of clot dissolution by plasmin. J Clin Invest 38:1086–1095.
Ambrus CM, Markus G. 1960. Plasmin-antiplasmin complex as a reservoir of fibrinolytic enzyme. Am J Physiol
199:491–494.