EVALUASI METODE ISOLASI ASAM NUKLEAT
DALAM DETEKSI PCR UNTUK PATOGEN ANTRAKNOSA,
BULAI, HUANGLONGBING DAN MOSAIK
ADE SYAHPUTRA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa Evaluasi Metode Isolasi Asam Nukleat dalam Deteksi PCR untuk Patogen Antraknosa, Bulai, Huanglongbing dan Mosaik adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2016
4
RINGKASAN
ADE SYAHPUTRA. Evaluasi Metode Isolasi Asam Nukleat dalam Deteksi PCR untuk Patogen Antraknosa, Bulai, Huanglongbing dan Mosaik. Dibimbing oleh KIKIN HAMZAH MUTAQIN dan TRI ASMIRA DAMAYANTI.
Pengujian dengan metode molekuler seperti Polymerase Chain Reaction (PCR) bagi Badan Karantina Pertanian sangat penting mengingat diperlukan deteksi dan identifikasi yang cepat, efisien dan akurat. Oleh sebab itu perlu dilakukan evaluasi beberapa metode isolasi asam nukleat dalam deteksi PCR untuk beberapa macam penyakit tumbuhan berdasarkan golongan patogen dan tipe penyakitnya. Penelitian ini bertujuan untuk mengevaluasi metode isolasi asam nukleat secara konvensional, kit komersial, dan FTA-card yang digunakan dalam teknik PCR dan modifikasinya untuk deteksi patogen-patogen penyakit antraknosa cabai, bulai jagung, huanglongbing jeruk dan mosaik kacang panjang. Sebanyak tiga bagian tanaman diambil dari setiap contoh tanaman sakit di lapangan yaitu buah cabai yang terserang Colletotrichum acutatum, daun jagung yang terserang Peronosclerospora sorghi, daun jeruk yang terserang Candidatus Liberibacter asiaticus dan daun kacang panjang yang terserang BCMV. DNA hasil isolasi masing-masing metode tersebut diukur dengan UV-vis nanodrop-spektrofotometer dalam satuan konsentrasi ng µ L-1. Jumlah total asam nukleat dari metode kit dan konvensional dihitung dari perkalian antara konsentrasi dengan volume total suspensi asam nukleat; sedangkan untuk metode FTA-card standar dan modifikasi yaitu perkalian antara konsentrasi, volume suspensi dan luas kertas FTA yang berisi contoh dibagi dengan luas tiap punch. Untuk PCR asam nukleat hasil isolasi sebagai cetakan DNA pada konsentrasi 15 ng µL-1 dan konsentrasi primer yaitu 0.4, 0.6, 0.8 dan 1.0 µM untuk tiap metode isolasi.
menunjukkan bahwa semua contoh DNA menghasilkan pita DNA amplikon yang lebih tebal dan merata. Secara umum ditunjukkan bahwa konsentrasi asam nukleat yang terbaik secara umum diperoleh melalui metode isolasi konvensional yang lebih membutuhkan tahap dan waktu lebih banyak dibandingkan metode kit komersial atau FTA card dan modifikasinya. Kualitas asam nukleat yang baik lebih sering diperoleh melalui metode kit komersial. Jumlah total asam nukleat tertinggi diperoleh melalui metode FTA card yang lebih praktis dan singkat namun kualitasnya lebih rendah. Asam nukleat hasil isolasi keempat metode isolasi keempat jenis patogen tumbuhan dalam penelitian ini tergolong layak untuk langsung digunakan sebagai template DNA dalam PCR. Perbaikan hasil PCR dapat dilakukan melalui optimasi jumlah template DNA dan konsentrasi primer dalam reaksi PCR. Penyiapan DNA melalui metode konvensional atau kit komersial lebih bermanfaat untuk digunakan dalam kegiatan penelitian berbasis biologi molekuler yang memerlukan kuantitas dan kualitas asam nukleat yang sebaik mungkin, sedangkan dalam bidang terapan atau kepentingan deteksi cepat penggunaan FTA card yang ringkas dan praktis akan lebih bermanfaat.
6
SUMMARY
ADE SYAHPUTRA. Evaluation of Nucleic Acid Isolation Methods Used in PCR Detection for Pathogens of Anthracnose, Downy Mildew, Huanglongbing and Mosaic. Supervised by KIKIN HAMZAH MUTAQIN and TRI ASMIRA DAMAYANTI.
Nucleic acid-based molecular techniques like Polymerase Chain Reaction (PCR) is important for Indonesian Agricultural Quarantine to support its duties to conduct detection, identification and surveillance of quarantine pests. An efficient DNA isolation method from diverse target organism is a required step to provide DNA template for performing PCR. The research objective is to compare conventional, commercial kit and FTA-card and its modification methods of DNA isolation to be used in PCR detection for Colletotrichum acutatum from chilli fruit (anthracnose), Peronosclerospora sorghi from maize leaves (downy mildew), Candidatus Liberibacter asiaticus from citrus leaf petioles and veins (huanglongbing) and BCMV from long bean leaves (mosaic). Observations of pathogen symptom were conducted on field whereas pathogen morphology was in laboratory. Concentrations of nucleic acid obtained (ng µL-1) from different isolation methods were measured using UV-vis nanodrop-spectrophotometry. Total amounts of total nucleic acids isolated with kit and conventional method were calculated as multiplication of nucleic acid concentration by yield total volume. Whereas total amount of nucleic acid for modified and standar FTA-card method were calculated as multiplication of the nucleic acid concentration by suspension volume, and FTA paper punch area. Nucleic acid from those isolations were used as PCR DNA template at concentration 15 ng µL-1 and primer employed at gradual concentrations of 0.4, 0.6, 0.8 and 1.0 M.
The highest DNA concentration was achieved with conventional methods for C. acutatum from pure culture and P. sorghi from maize leaf. Good DNA purity was obtained from isolation method using commercial kit for C. acutatum from infected fruit (1.94), from conventional method for C. acutatum from pure culture (1.91), Ca. L. asiaticus from kit commercial method (1.96) and BCMV RNA from kit commercial method (2.08). The highest total yield of nucleic acid is significantly obtained only by C. acutatum from pure culture using modified FTA-card method, whereas the other methods for the rest pathogens were not different. In general, quantity and quality of each nucleic acid isolated with four methods were sufficient to be used as DNA template directly for PCR amplification. Detection of each of four pathogens by PCR with its related specific primer pair at equal volume of DNA template without concentration adjustment resulted in visible positive amplification, although varied in band intensity. The best result of PCR amplification of each of for pathogens were achieved with adjusment of optimum amount of DNA template or primers applied in PCR reaction. Further PCRs using optimized primer concentration and increased DNA template showed improved amplification indicated with thicker, brighter and even DNA bands.
to conduct that of commercial kit and FTA-card or its modifification methods. Good quality of isolated nucleic acid was often achieved with conventional or commercial kit methods. The highest total yield of isolated nucleic acid was always resulted from FTA-card whose method is very practical and brief, but with lower quality of nucleic acid. Nucleic acids of four type of pathogens isolated from four methods in this reasearch can be used directly as DNA template in PCR, however PCR results were improved by optmization of its DNA template amount and primer concentration. Nucleic acid preparation through conventional and commercial kit methods is likely better used in research activity based on molecular biology which required very good quality and quantity of isolated DNA, whereas for regular application and rapid detection, the use FTA-card method is adequate and practical.
8
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
EVALUASI METODE ISOLASI ASAM NUKLEAT
DALAM DETEKSI PCR UNTUK PATOGEN ANTRAKNOSA,
BULAI, HUANGLONGBING DAN MOSAIK
ADE SYAHPUTRA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
10
Judul Tesis : Evaluasi Metode Isolasi Asam Nukleat dalam Deteksi PCR untuk Patogen Antraknosa, Bulai, Huanglongbing dan Mosaik
Nama : Ade Syahputra NRP : A351130484
Disetujui oleh
Komisi Pembimbing
Dr Ir Kikin Hamzah Mutaqin, MSi Ketua
Dr Ir Tri Asmira Damayanti, MAgr Anggota
Diketahui oleh
Ketua Program Studi Fitopatologi
Prof Dr Ir Sri Hendrastuti Hidayat, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
12
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
karunia-Nya sehingga karya tulis dengan judul “Evaluasi Metode Isolasi Asam Nukleat
dalam Deteksi PCR untuk Patogen Antraknosa, Bulai, Huanglongbing dan Mosaik” dapat saya selesaikan.
Terima kasih penulis ucapkan kepada Dr Ir Kikin Hamzah Mutaqin, MSi, Dr Ir Tri Asmira Damayanti, MAgr selaku komisi pembimbing, Prof Dr Ir Sri Hendrastuti Hidayat, MSc selaku Ketua Program Studi Fitopatologi, Dr Ir Pudjianto, MSi selaku ketua Program Studi Entomologi serta staf pengajar Departemen Proteksi Tanaman IPB yang telah memberikan ilmu selama penulis mengikuti pendidikan sehingga dapat dijadikan bekal penulisan karya ilmiah ini. Ucapan terimakasih juga disampaikan kepada Dr Ir Eliza Suryati Rusli, MSi sebagai penguji luar komisi pada ujian tesis saya. Penulis juga menyampaikan penghargaan kepada Pimpinan Badan Karantina Pertanian sebagai penyandang dana beasiswa Program Khusus Karantina pada Sekolah Pascasarjana IPB, kepada Dr Ir Ummu Salamah Rustiani, MSi dan Dr Sri Hartati, SP, MSi yang telah membantu, merancang dan berkenan memberikan primer PCR dalam penelitian ini. Penulis juga menyampaikan rasa terima kasih kepada Ir. Samsul Hedar selaku Kepala dan rekan kerja pejabat fungsional Balai Uji Terap Teknik Metode Karantina Pertanian (BUTTMKP) Bekasi atas bantuan sarana dan fasilitas yang diberikan dalam penelitian ini. Penulis juga menyampaikan rasa terima kasih kepada Dr drh Syafril Daulay, MM selaku Kepala Balai Besar Uji Standar Karantina Pertanian (BBUSKP) yang telah memberikan fasilitas di Laboratorium Biologi Molekuler. Selain itu, ucapan terima kasih kepada staf pejabat fungsional BBUSKP terutama Ir Riza Desnurvia, MSc dan Ir Tuti Murdiati yang telah banyak memberikan bimbingan dalam penggunaan alat nanodrop-spektrofotometer. Ucapan terima kasih kepada rekan-rekan kuliah satu angkatan (Kelas 2013-2014) dan teman-teman di Laboratorium Bakteriologi Departemen Proteksi Tanaman terutama kepada Tatit Sastrini, SP, MSi dan Muhammad Rizal, SP, MSi atas bantuan dan bimbingannya. Selain itu penulis juga mengucapkan terima kasih kepada seluruh pegawai Departemen Proteksi Tanaman terutama Pak Tarya dan Pak Rofiq serta petani di Desa Neglasari Kab. Bogor dan Desa Situgede Kota Bogor yang telah memberikan contoh dari lapangan. Penulis juga mengucapkan terima kasih kepada seluruh pihak yang telah memberikan dukungan berupa doa, pikiran dan tenaga dalam proses penelitian ini yang namanya tidak dapat disebutkan satu persatu.
Ungkapan terima kasih juga disampaikan kepada emak, istri tercinta Fithri Erawati, SPdI, serta anak-anakku Muhammad Umar Al-Faruq, Abdullah Ahmad Azzam, Farras Hafidzah dan Azma Mutmainnah, serta keluarga besar penulis atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2016
DAFTAR ISI
Tugas Pokok dan Fungsi Badan Karantina Pertanian 4 Deteksi Patogen Tanaman Secara Molekuler Menggunakan PCR 4
Bioekologi Beberapa Patogen Penting Tanaman 8
3 BAHAN DAN METODE 13
Waktu dan Tempat 13
Bahan
Penyiapan Patogen Tanaman untuk Isolasi Asam Nukleat dan Deteksi dengan PCR
Isolasi Asam Nukleat Beberapa Patogen Tanaman Pengukuran Asam Nukleat Hasil Isolasi
Deteksi Patogen Tanaman Menggunakan PCR dan RT-PCR Elektroforesis Gel Agarosa dan Visualisasi Asam Nukleat 4 HASIL DAN PEMBAHASAN
Penyakit-penyakit Tanaman yang Menjadi Objek Isolasi Asam Nukleat untuk Dideteksi dengan Teknik PCR/RT-PCR
Asam Nukleat Hasil Isolasi Menggunakan Metode Kit Komersial, FTA-card dan Konvensional
14
DAFTAR TABEL
1 2 3
Pasangan primer yang digunakan dalam PCR Reaktan standar PCR
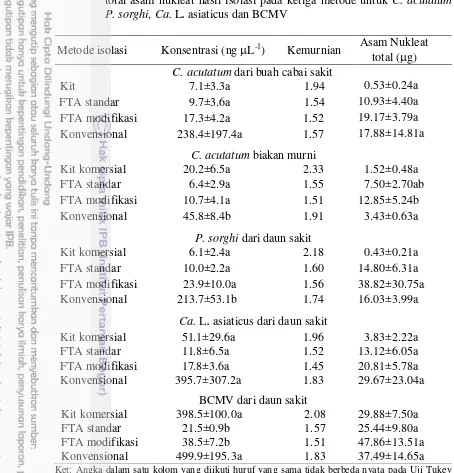
Konsentrasi, kemurnian pada nilai absorbansi A260/280 dan jumlah total DNA hasil isolasi pada ketiga metode untuk C. acutatum, P. sorghi,
1 Penyakit antraknosa pada buah cabai yang disebabkan oleh cendawan C.
acutatum 22
2 Penyakit bulai pada daun jagung yang disebabkan oleh P. sorghi 23 3 Penyakit Huanglongbing pada daun jeruk yang disebabkan oleh Ca. L.
asiaticus 24
4 Penyakit mosaik pada daun kacang panjang yang disebabkan oleh Bean
common mosaic vrus 25
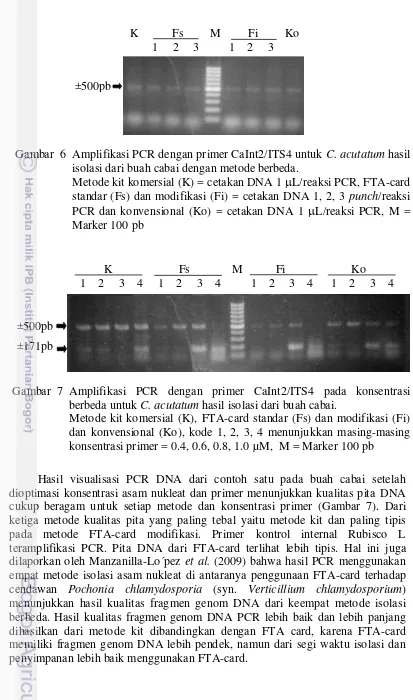
5 Visualisasi hasil isolasi DNA total dari daun jeruk dengan metode kit, FTA-card modifikasi, FTA-card standar dan konvensional 28 6 Amplifikasi PCR dengan primer CaInt2/ITS4 untuk C. acutatum hasil
isolasi dari buah cabai dengan metode berbeda 29 7 Amplifikasi PCR dengan primer CaInt2/ITS4 pada konsentrasi berbeda
untuk C. acutatum hasil isolasi dari buah cabai 29 8 Amplifikasi PCR dengan primer CaInt2/ITS4 untuk C. acutatum hasil
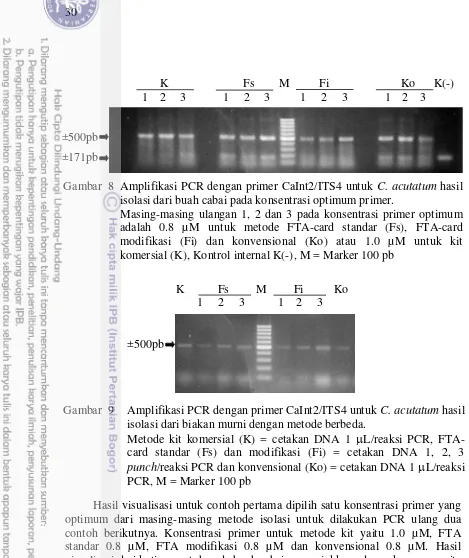
isolasi dari buah cabai pada konsentrasi optimum primer 30 9 Amplifikasi PCR dengan primer CaInt2/ITS4 untuk C. acutatum hasil
isolasi dari biakan murni dengan metode berbeda 30 10 Amplifikasi PCR dengan primer CaInt2/ITS4 pada konsentrasi berbeda
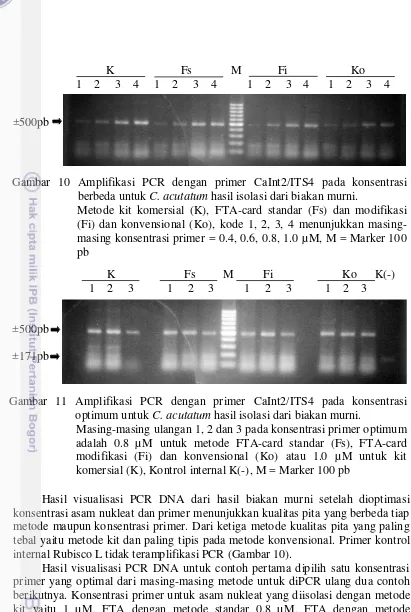
untuk C. acutatum hasil isolasi dari biakan murni 31 11 Amplifikasi PCR dengan primer CaInt2/ITS4 pada konsentrasi optimum
untuk C. acutatum hasil isolasi dari biakan murni 31 12 Amplifikasi PCR dengan primer PsUF/PsUR untuk P. sorghi hasil
isolasi dari daun jagung dengan metode berbeda 32 13 Amplifikasi PCR dengan primer PsUF/PsUR pada konsentrasi berbeda
untuk P. sorghi hasil isolasi dari daun jagung 32 14 Amplifikasi PCR dengan primer PsUF/PsUR pada konsentrasi optimum
untuk P. sorghi hasil isolasi dari daun jagung 33 15 Amplifikasi PCR dengan primer A2/J5 untuk Ca. L. asiaticus hasil
isolasi dari daun jeruk dengan metode berbeda 33 16 Amplifikasi PCR dengan primer A2/J5 pada konsentrasi berbeda untuk
Ca. L. asiaticus hasil isolasi dari daun jeruk 34 17 Amplifikasi PCR dengan primer A2/J5 pada konsentrasi optimum untuk
DAFTAR LAMPIRAN
cabai dengan metode kit komersial, FTA-card dan konvensional yang dihitung dengan nanodrop-spektrofotometerKonsentrasi asam nukleat C. acutatum diisolasi dari tiga isolat dengan metode kit komersial, FTA-card dan konvensional yang dihitung dengan nanodrop-spektrofotometer
Konsentrasi asam nukleat P. sorghi diisolasi dari tiga contoh daun jagung dengan metode kit komersial, FTA-card dan konvensional yang dihitung dengan nanodrop-spektrofotometer
Konsentrasi asam nukleat Ca. L. asiaticus diisolasi dari tiga contoh daun jeruk dengan metode kit komersial, FTA-card dan konvensional yang dihitung dengan nanodrop-spektrofotometer
Konsentrasi asam nukleat BCMV diisolasi dari tiga contoh daun kacang panjang dengan metode kit komersial, FTA-card dan konvensional yang dihitung dengan nanodrop-spektrofotometer
Berat DNA total untuk ketiga metode isolasi C. acutatum pada tiga contoh buah cabai
Berat DNA total untuk ketiga metode isolasi asam nukleat C. acutatum pada tiga contoh isolat
Berat DNA total untuk ketiga metode isolasi asam nukleat P. sorghi pada tiga contoh daun jagung
Berat DNA total untuk ketiga metode isolasi asam nukleat Ca. L. asiaticus pada tiga contoh daun jeruk
Berat RNA total untuk ketiga metode isolasi asam nukleat BCMV pada tiga contoh daun kacang panjang
Analisis ragam pengaruh konsentrasi asam nukleat C. acutatum pada buah terhadap ketiga metode isolasi
Analisis ragam pengaruh konsentrasi asam nukleat C. acutatum pada biakan murni terhadap ketiga metode isolasi
Analisis ragam pengaruh konsentrasi asam nukleat P. sorghi terhadap ketiga metode isolasi
Analisis ragam pengaruh konsentrasi asam nukleat Ca. L. asiaticus terhadap ketiga metode isolasi
Analisis ragam pengaruh konsentrasi asam nukleat BCMV terhadap ketiga metode isolasi 18 Amplifikasi PCR dengan primer BlC-cpf/BlC-cpr untuk BCMV hasil
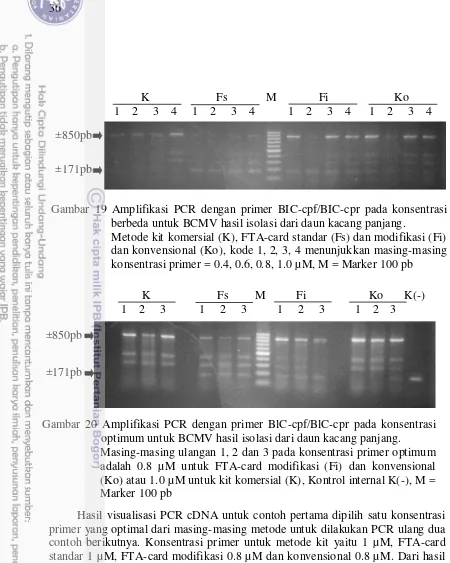
isolasi dari daun kacang panjang dengan metode berbeda 35 19 Amplifikasi PCR dengan primer BIC-cpf/BIC-cpr pada konsentrasi
berbeda untuk BCMV hasil isolasi dari daun kacang panjang 36 20 Amplifikasi PCR dengan primer BlC-cpf/BlC-cpr pada konsentrasi
16
17
18
19
20
terhadap ketiga metode isolasi
Analisis ragam pengaruh berat asam nukleat C. acutatum pada biakan murni terhadap ketiga metode isolasi
Analisis ragam pengaruh berat asam nukleat P. sorghi terhadap ketiga metode isolasi
Analisis ragam pengaruh berat asam nukleat Ca. L. asiaticus terhadap ketiga metode isolasi
Analisis ragam pengaruh berat asam nukleat BCMV terhadap ketiga metode isolasi
58
58
58
58
1 PENDAHULUAN
Latar Belakang
Saat ini negara-negara di dunia sedang memasuki era perdagangan bebas, yang ditandai dengan meningkatnya frekuensi dan volume perdagangan komoditas pertanian antar negara. Konsekuensi yang ditimbulkan akibat perdagangan bebas ini terhadap perkarantinaan adalah semakin besarnya peluang masuknya Organisme Pengganggu Tumbuhan Karantina (OPTK) baik yang belum ada di suatu wilayah negara maupun yang sudah ada namun masih terbatas di sebagian wilayah tertentu. Negara Indonesia adalah negara agraris yang memiliki kekayaan sumber daya alam hayati sehingga perlu dilindungi dari ancaman masuknya OPTK dari luar negeri. Badan Karantina Pertanian (BKP) adalah lembaga pemerintah yang bertanggung jawab terhadap pencegahan dan penangkalan masuknya OPTK ke wilayah Negara Kesatuan Republik Indonesia.
Kegiatan mitigasi resiko terhadap peluang masuknya OPTK ke wilayah Negara Republik Indonesia (RI) terhadap ekspor/impor komoditas pertanian telah dilakukan oleh Badan Karantina Pertanian. Salah satu kegiatan tersebut adalah pembuatan daftar hama dan penyakit (pest list) atas komoditas pertanian yang akan dikirim sebagai persyaratan oleh negara pengekspor atas permintaan negara pengimpor. Disamping itu tugas Badan Karantina Pertanian juga harus mengevaluasi status OPTK yang ada di daftar OPTK pada Peraturan Menteri Pertanian (Permentan) no. 51 tahun 2015. Dinyatakan bahwa tidak kurang dari 500 spesies OPTK yang belum terdapat di wilayah Indonesia. Evaluasi status OPTK yang ada di daftar OPTK perlu dilakukan secara periodik untuk memastikan status OPTK di lapangan apakah terdapat perubahan baik dari status tidak ada (A1) atau sudah ada tapi terbatas (A2) di wilayah RI (BKP 2012).
2
Salah satu kendala yang sering ditemukan petugas karantina pertanian adalah penanganan contoh tanaman dari hasil pemantauan OPTK dari lapangan. Contoh tanaman yang diambil dari lapangan tidak langsung dapat diproses karena biasanya pemantauan dilakukan di daerah yang jauh dari laboratorium. Hal ini menyebabkan contoh tanaman yang akan diuji rusak sebelum dideteksi karena tidak disimpan dengan baik selama pemantauan. Contoh tanaman sangat mudah rusak, tidak dapat bertahan lama jika tidak segera disimpan pada tempat penyimpanan yang sesuai suhunya untuk contoh tanaman. Disamping itu untuk memudahkan deteksi dan identifikasi bagi petugas karantina dalam pemantauan di lapangan diperlukan metode yang lebih praktis, efisien dan dapat dipertanggungjawabkan.
Selain teknik isolasi asam nukleat secara konvensional maupun menggunakan kit komersial, suatu teknik pengambilan contoh dan isolasi asam nukleat dari tanaman di lapangan adalah menggunakan sejenis membran selulosa berbentuk kartu atau lembaran kertas yang mengandung bahan kimiawi untuk denaturasi protein dari jaringan dan menangkap asam nukleat. Teknik ini dikembangkan secara komersial sebagai Flinder Technology Associate card (FTA-card Whatman) (Burgoyne 1996). Evaluasi dan pemanfaatan teknik FTA-card untuk isolasi dan penyimpanan asam nukleat dari tanaman hasil pemantauan lapangan perlu dilakukan dan dibandingkan dengan teknik isolasi yang sudah ada terhadap berbagai tipe patogen tanaman.
Perumusan Masalah
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi metode isolasi asam nukleat secara konvensional, kit komersial, dan FTA-card yang digunakan dalam teknik PCR dan modifikasinya untuk deteksi patogen-patogen penyakit antraknosa cabai, bulai jagung, huanglongbing jeruk dan mosaik kacang panjang.
Hipotesis
1. Di antara keempat metode isolasi asam nukleat yang dievaluasi (kit komersial, FTA-card standar dan dimodifikasi dan konvensional), terdapat metode yang paling sesuai untuk diaplikasikan pada keempat jenis patogen.
2. Optimasi konsentrasi komponen PCR yaitu cetakan DNA, dan primer dapat memberikan hasil deteksi yang terbaik.
Manfaat Penelitian
2 TINJAUAN PUSTAKA
Tugas Pokok dan Fungsi Badan Karantina Pertanian
Karantina pertanian di Indonesia telah lahir sejak zaman Hindia-Belanda dilatarbelakangi upaya pengaturan masuknya kopi dan biji kopi dari Srilanka di tahun 1832 yang berpotensi membawa penyakit yang dituangkan dalam Ordonansi 19 Desember 1877 (Staatsblad No. 262) (Diphayana 2008). Risiko masuknya Organisme Pengganggu Tumbuhan Karantina (OPTK) melalui importasi komoditas pertanian hingga saat ini sangat tinggi. Salah satu lembaga pemerintah dalam hal ini Badan Karantina Pertanian yang dapat menghambat secara teknis (Technical Barrier to Trade/TBT) terhadap komoditas impor pertanian. Badan Karantina Pertanian telah mengeluarkan berbagai regulasi terhadap masuknya komoditas pertanian dari luar negeri di antaranya pemasukan komoditas tertentu di salah satu tempat pintu pemasukan seperti pelabuhan. Salah satu tindakan Badan Karantina Pertanian dalam mencegah masuknya OPTK juga dilakukan survei atau pemantauan ke lapangan sesuai dengan Peraturan Pemerintah No. 14 Tahun 2002 tentang Karantina Tumbuhan pada pasal 85. Pemantauan adalah tindakan resmi yang dikeluarkan oleh lembaga atau institusi yang dilaksanakan dalam kurun waktu tertentu untuk menetapkan karakteristik populasi OPT atau untuk menetapkan spesies mana yang ada di suatu area (McMaugh 2007). Pemantauan yang dilaksanakan oleh Badan Karantina Pertanian bertujuan untuk mengetahui keberadaan OPTK, baik sebagai A1 yang belum ada di Indonesia maupun A2 yang sudah ada tapi masih terbatas di lapangan. Ebbels (2003) menyatakan bahwa program pemantauan ini diatur dalam regulasi internasional berupa International Standar for Phytosanitary Measures (ISPM) No. 6 Tahun 1998 dalam sistem perdagangan internasional yang dikeluarkan oleh Food Agriculture Organization (FAO).
Pedoman survei yang disusun oleh Badan Karantina Pertanian menyatakan bahwa pelaksanaan survei atau pemantauan harus memenuhi syarat di antaranya: sumber daya manusia yang terlatih dan telah dilakukan audit terhadap metode sampling, preservasi, pengiriman contoh untuk diidentifikasi dan pemeliharaan rekaman; fasilitas yang memadai dan metode yang valid. Permasalahan yang sering muncul pada saat pemantauan OPTK di lapangan oleh petugas karantina adalah lokasi daerah yang sangat jauh, keterbatasan peralatan dan bahan, serta contoh yang ditemukan di lapangan tidak bertahan lama. Sehingga perlu suatu tindakan dalam penanganan contoh dari lapangan tidak rusak ketika akan dikirim ke laboratorium atau disimpan di tempat suhu yang diinginkan. Oleh sebab itu penanganan contoh yang baik menjadi prioritas utama dalam pemantauan OPTK (BKP 2007).
Deteksi Patogen Tanaman Secara Molekuler Menggunakan PCR
dalam deteksi patogen ditentukan oleh jenis patogen sasaran yang akan dideteksi. Metode deteksi patogen tanaman yang paling sederhana adalah pengamatan terhadap gejala dan tanda penyakit di lapangan. Metode ini seringkali kurang begitu akurat dalam menentukan patogen suatu penyakit serta personal yang berpengalaman dan seringkali harus menggunakan kunci identifikasi
Saat ini deteksi patogen tanaman sudah berkembang dengan teknik molekuler sampai ke tingkat asam nukleat dan protein. Pengujian dengan teknik molekuler memberi hasil yang akurat dan sangat meyakinkan. Menurut Capote et al. (2012) deteksi dan identifikasi patogen secara molekuler dapat didasarkan atas komponen protein atau asam nukleat dari patogen sasaran. Metode deteksi dan identifikasi molekuler sudah diuji dengan beberapa metode di antaranya untuk target protein menggunakan metode ELISA dan Western Blot, sedangkan untuk target asam nukleat adalah metode PCR dan metode Southern Blot. Deteksi PCR untuk patogen tanaman pertama kali dilaporkan oleh Puchta dan Hanger (1989) terhadap patogen Hop stunt viroid (HSVd) pada tanaman anggur.
Amplifikasi Asam nukleat
Teknik amplifikasi asam nukleat yang dikenal dengan Polymerase Chain Reaction (PCR), pertama kali dikembangkan oleh Kary Mullis pada tahun 1984. Menurut Carter dan Saunder (2007); van Pelt-Verkuil et al. (2008) PCR dapat dilakukan dengan dua tahap berdasarkan target yaitu DNA menggunakan PCR dan RNA menggunakan Reverse Transcription-PCR (RT-PCR). Pengujian PCR menurut Corkill dan Rapley (2008) yaitu reaksi pengamplifikasian atau pengkopian sikuen DNA spesifik dari jumlah kecil target DNA heterogen (sekitar 105 kopi atau kira-kira 0.25-0.5 µg) atau meningkatkan genom sel total. Peranan PCR dalam metode deteksi asam nukleat sangat membantu dalam alternatif pengujian dengan teknik metode deteksi serologi, karena butuh jumlah sampel contoh yang sedikit, baik dalam bentuk segar, beku maupun kering (Robertson et al. 1991). Pengujian RT-PCR yaitu teknik amplifikasi cetakan RNA secara invitro dengan menggunakan enzim reverse transcriptase melalui molekul messenger RNA (mRNA) sehingga membentuk DNA komplementer (cDNA). Salah satu manfaat pengujian PCR/RT-PCR ini adalah mengidentifikasi penyakit tanaman yang disebabkan oleh cendawan dengan target DNA (Capote et al. 2012), bakteri dengan target DNA (Ruangwong & Akarapisan 2006) dan virus dengan target RNA (Damayanti et al. 2005)
6
polimerase, dNTP, konsentrasi Mg2+, dan DNA cetakan. Pemakaian konsentrasi primer terlalu tinggi akan menyebabkan penempelan pada cetakan yang tidak spesifik (mispriming) dan akan terakumulasi secara non spesifik serta akan membentuk primer dimer, namun jika terlalu sedikit hasil PCR tidak optimal. Jumlah DNA polimerase yang diperlukan dalam reaksi PCR sekitar 0.5-2.5 unit. Kelebihan jumlah enzim mengakibatkan akumulasi produk non-spesifik, sedangkan jika terlalu rendah maka dihasilkan produk yang sedikit (Innis et al. 1990). Konsentrasi DNA optimum adalah sebesar 0.01-0.1 µg. Kualitas DNA cetakan juga ditentukan dengan konsentrasi kontaminan seperti protein atau bahan lain seperti fenol. DNA yang digunakan sebagai cetakan dapat berupa rantai tunggal maupun rantai ganda. Efisiensi amplifikasi biasanya lebih tinggi jika menggunakan molekul DNA yang sudah dilinearkan dengan suatu enzim restriksi tertentu daripada menggunakan DNA yang berbentuk sirkular (Sambrook et al. 1989).
Proses RT-PCR yaitu reaksi balik atau Reverse Transcription (RT-PCR) yang terlebih dahulu merubah RNA ke cDNA target, setelah itu proses PCR. Reaksi RT-PCR dengan target RNA dengan komponen pendukung yaitu cetakan RNA, bufer RT (Reverse Transcription), DTT (dithiothreitol), dNTP, enzim Reverse Transcriptase dari Moloney Murine Leukemia Virus (M-MuLV), RNase inhibitor, oligo d(T) dan air bebas enzim nukleat (nuclease free water) (Baltimore 1970). Proses amplifikasi mRNA ke cDNA membutuhkan proses pemanasan untuk aktivasi enzim M-MuLV antara 37-55 °C. Hasil produk dari RT-PCR berupa cDNA yang digunakan untuk uji PCR (Gerard et al. 2002). Target deteksi dan identifikasi untuk molekul rRNA terbanyak berada di spesies prokariot terletak pada 23S dan 16S sedangkan eukariot di 18S (Corkill & Rapley 2008).
Aplikasi metode PCR telah banyak digunakan di antaranya identifikasi patogen cendawan menggunakan PCR konvensional sebagaimana Torres et al. (2011) melaporkan bahwa identifikasi Colletotrichum capsici dapat didasarkan atas amplifikasi sikuen spesifik daerah Internal Transcribed Spacer (ITS) gen ribosomal RNA. Daerah gen ITS-1 berada antara 18S rRNA dan 5.8S rRNA dan gen ITS-2 antara 5.8S rRNA dan 26S rRNA, yang hanya ditemukan pada sel eukariotik, yaitu berada diantara gen rDNA kecil dan gen rDNA besar (White et al. 1990; Brown et al. 1996). Ruangwong dan Akarapisan (2006) melakukan pengujian PCR menggunakan primer A2/J5 untuk deteksi bakteri huanglongbing Candidatus Liberibacter asiaticus pada tanaman jeruk dengan target gen protein ribosomal. Aplikasi pengujian RT-PCR untuk mendeteksi dan menentukan variabilitas genetik virus tanaman telah dilakukan oleh Damayanti et al. (2005) pada Banana streak virus; melihat keragaman genetik geminivirus (Hidayat 1999) dan identifikasi geminivirus yang menginfeksi tomat (Aidawati 2005).
Isolasi Asam Nukleat
Menurut Doyle (1996) proses isolasi asam nukleat secara umum ada empat tahap yaitu melepaskan asam nukleat dari sel, denaturasi dari komplek nukleoprotein, menghambat proses enzim RNase dan DNAse dan pemisahan asam nukleat dari kontaminan. Tahapan isolasi asam nukleat sangat dipengaruhi oleh asal sel atau jaringan sumber asam nukleat. Tahap pertama dan kedua dari isolasi asam nukleat adalah pelepasan asam nukleat dari sel dengan melakukan penghancuran secara mekanis. Penghancuran tersebut umumnya menggunakan mortar dan pistil dengan bantuan nitrogen cair (Liu 2009). Tahap kedua dan ketiga adalah denaturasi dari komplek nukleoprotein dan inaktivasi enzim RNase dan DNase dengan menggunakan beberapa bahan kimia antara lain SDS (sodium dodecyl sulphate), Tween, HCl, Triton, EDTA (ethylene diamine tetraacetic acid), penol: kloroform: isoamilalkohol dan Cetyltrimethylammonium bromide (CTAB) (Chan et al. 2004; van Pelt-Verkuil et al. 2008). Tahap keempat adalah pemisahan asam nukleat dengan kontaminan (protein, karbohidrat dan lemak) sehingga asam nukleat yang diperoleh dapat dianalisis dan atau dimodifikasi lebih lanjut dengan teknik biologi molekuler yaitu PCR.
Metode awal isolasi asam nukleat adalah metode konvensional dengan menggunakan beberapa jenis bahan kimia yang ditentukan volume dan konsentrasi sesuai dengan target tertentu yang sudah dikembangkan oleh peneliti. Proses isolasi asam nukleat dengan metode ini sangat komplek sehingga membutuhkan waktu lama (Tan et al. 2013). Pengembangan metode isolasi selanjutnya telah menggunakan bahan yang siap pakai dan ditambah kolom filter untuk memisahkan senyawa yang tidak terpakai dari asam nukleat. Metode isolasi ini disebut metode kit yang sudah dikomersialkan sesuai dengan target isolasi di antaranya target DNA, RNA dan protein (Tan & Yiap 2009). Metode kit ini dikembangkan lagi dalam bentuk lembaran kertas membran yang berfungsi untuk mengisolasi asam nukleat contohnya FTA-card Whatman (Mbogori et al. 2006).
Isolasi RNA pada prinsipnya hampir sama dengan DNA hanya saja prosesnya harus terhindar dari enzim RNase yang dapat mendenaturasi RNA, penambahan DNase untuk mengeluarkan DNA serta target gen isolasi yang dicapai yaitu di antaranya mRNA (Dale & Schantz 2002; Corkill & Rapley 2008; Liu 2009).
Pengukuran dan Kuantifikasi Asam Nukleat
8
terkontaminasi protein dan larutan fenol. Kuantifikasi konsentrasi DNA cendawan pada tanaman telah dilakukan oleh Doan et al. (2014). Konsentrasi RNA cetakan dapat mempengaruhi hasil RT-PCR (Fleige & Pfaffi 2006). Menurut Bustin dan Nolan (2004a) bahwa konsentrasi RNA dengan rasio A260/A280 dengan kemurnian 1.8 maka hanya 40% RNA dan sisanya protein. Pengukuran kualitas keberadaan fragmen genom 18S dan 28S ribosomal DNA (Ulfah 2014) maupun RNA tanaman dapat digunakan dengan gel elektroforesis baik dengan menambahkan etidium bromida maupun SYBR green dye (molecular probe) atau menggunakan reagen Ribo Green (molecular probe) (Bustin & Nolan 2004b).
Bioekologi Beberapa Patogen Penting Tanaman
Penyakit tanaman dibagi menjadi dua kelompok yaitu penyakit patologis dan fisiologis. Penyakit patologis disebabkan oleh faktor biotik atau organisme dan bersifat menular. Penyakit fisiologis disebabkan oleh faktor abiotik dan bersifat tidak menular. Faktor biotis terdiri dari dua golongan besar organisme yaitu organisme seluler dan non seluler (Agrios 2005). Organisme seluler adalah organisme yang memiliki sel sebagai unit struktural dan fungsional terkecil. Organisme seluler dikelompokkan menjadi prokariota dan eukariota. Prokariota tidak memiliki inti sel secara khusus, ukuran lebih kecil dari cendawan, struktur lebih sederhana contohnya adalah bakteria dan mollicute (Narayanasamy 2011). Eukariota memiliki struktur inti yang jelas contohnya animalia (nematoda), fungi, chromista, protozoa, algae dan plantae (tumbuhan parasit tingkat tinggi) (Agrios 2005; Adl et al. 2012). Menurut Carter dan Suander (2007) organisme non seluler yaitu organisme yang tidak mempunyai sel, hanya terdiri dari material asam nukleat, DNA atau RNA, dengan atau tanpa selubung protein, contohnya yaitu virus dan viroid.
Berdasarkan cara hidup dan memperoleh nutrisi, organisme patogen tanaman dapat dibagi menjadi dua kelompok yaitu organisme parasit dan saprofit. Parasit mengambil nutrisi dari jaringan hidup sedangkan saprofit mengambil nutrisi dari jaringan yang mati. Organisme parasit dapat bersifat fakultatif yaitu mengambil nutrisi tidak hanya dari jaringan hidup, contohnya yaitu Colletotrichum acutatum, dan bersifat obligat yaitu mengambil nutrisi hanya di jaringan hidup contohnya yaitu Peronosclerospora sorghi, Candidatus Liberibacter asiaticus dan Bean common mosaic virus (BCMV). Sebagai parasit obligat virus hanya dapat hidup pada sel hidup, memperbanyak diri dengan cara menginduksi sel inang untuk memproduksi enzim RNA polimerase. Enzim tersebut menggunakan RNA virus sebagai cetakan untuk membentuk RNA komplementer yang berfungsi untuk memperbanyak RNA virus (Ahlquist et al. 2003).
Organisme saprofit dapat bersifat obligat dan fakultatif. Saprofit obligat adalah organisme yang hanya hidup pada jaringan mati, jarang ditemukan umumnya adalah cendawan dengan relung ekologi yang luas. Saprofit fakultatif adalah parasit yang pada kondisi yang sesuai dapat hidup di jaringan mati contohnya yaitu cendawan Phytophthora infestan (Pearson 1995; Ellis et al. 2008).
tertentu, sedangkan gejala sistemik adalah gejala penyakit yang menyebar dari titik infeksi ke bagian lain tanaman. Berdasarkan munculnya gejala penyakit dibagi dua yaitu gejala primer dan sekunder. Gejala primer adalah inokulum yang menyebabkan munculnya gejala asli pada musim tumbuh, sedangkan gejala sekunder yaitu gejala primer yang menyebar di bawah kondisi lingkungan yang cocok (Sharma 2004).
Colletotrichum acutatum
Cendawan Colletotrichum acutatum digolongkan ke dalam Kingdom Fungi, Filum Ascomycota, Kelas Sordariomycetes, Ordo Glomerellales, Famili Glomerellaceae dan Genus Colletotrichum. Cendawan ini menyebabkan penyakit antraknosa pada cabai dengan gejala yang sangat bervariasi, dapat berupa luka kecil atau besar, infeksi dapat terjadi pada daun atau buah. Gejala antraknosa pada daun berupa nekrosis berbentuk lingkaran berwarna coklat bagian dalam dan tepinya berwarna kuning. Gejala pada buah berupa tambalan berwarna ungu atau coklat yang ditandai dengan bintik-bintik kecil yang merupakan aservuli dalam jumlah besar (Mordue 1979; Agrios 2005).
Aservulus adalah tanda cendawan yang berbentuk setengah lingkaran dan berukuran diameter 70-120 µ m (Singh 1998). Aservulus dibentuk oleh konidiofor dan konidia. Konidium berukuran 8-16 x 2.5-4 µm, dinding sel tipis, tidak bersepta, satu sel, hialin. Konidium akan berkecambah membentuk apresoria berukuran 6.5-11 x 4.5-7.5 µm pada proses infeksi. Di dalam aservulus juga terdapat seta yang merupakan struktur berbentuk seperti jarum, berwarna coklat berukuran 150 µm (Mordue 1979; Agrios 2005).
Harp et al. (2008) melaporkan penyakit antraknosa dapat disebabkan oleh spesies Colletotrichum yang lain seperti C. capsici dan C. gloeosporioides. Ketiga spesies tersebut memiliki perbedaan morfologi di antaranya bentuk konidia. Konidia pada C. capsisi berbentuk bulan sabit sedangkan C. acutatum dan C. gloeosporioides berbentuk seperti gada. Patogen menginfeksi umumnya pada daerah kelembaban tinggi atau pada malam hari dengan kisaran suhu antara 25 - 29 °C (Semangun 1996). Cendawan C. capsici umumnya hanya menginfeksi buah yang telah matang, sedangkan C. gloeosporioides dan C. acutatum menyerang buah matang dan masih hijau. Patogen C. acutatum berkembang di daerah tropis maupun subtropis dan memiliki banyak inang CABI (2007), bertahan hidup pada benih dalam bentuk aservuli, dalam jaringan inang mati dan dapat menyerang selama pascapanen. Konidia menyebar dengan bantuan air, angin dan dapat bertahan di tanah dalam bentuk klamidospora (Agrios 2005). Kehilangan hasil disebabkan oleh penyakit antraknosa pada cabai di India sekitar 8-60% (Raj et al. 2014).
10
tersebut digunakan untuk mengidentifikasi spesies cendawan secara spesifik dengan PCR (Anand et al. 2001; Embong et al. 2008).
Peronosclerospora sorghi
Peronosclerospora sorghi digolongkan ke dalam Kingdom Chromista, Filum Oomycota, Kelas Oomycetes, Ordo Sclerosporales, Famili Sclerosporaceae dan Genus Peronosclerospora. Organisme ini sering disebut sebagai cendawan semu (pseudofungi) karena memiliki dinding sel yang mengandung selulosa seperti kelompok ganggang. Patogen ini menyebabkan gejala bulai (downy mildew) pada daun dari tanaman poaceae. Menurut Safeeulla (1976) serangan penyakit bulai pada awal pertumbuhan menyebabkan tanaman menjadi kerdil, gejala pada daun berupa garis klorotik atau menguningnya seluruh daun pertama dan daun selanjutnya. Pada permukaan daun tersebut terdapat embun bulu yang dapat menempel pada jari jika disentuh. Embun bulu merupakan kumpulan dari sporangiofor dan sporangia patogen bulai. Sporangia terbentuk lebih banyak pada permukaan bawah daun dari pada atas daun. Patogen dapat menyebabkan malformasi dan berkurangnya jumlah polen pada bunga jantan juga menyebabkan gugurnya bunga betina. Patogen bulai mampu menginvasi batang dan ujung tunas meskipun tidak bergejala. Patogen bertahan pada benih berupa miselium di dalam perikarp (dinding ovari), embrio dan endosperm, namun kualitas benih jagung tidak terganggu.
Tanda cendawan berupa sporangiofor dengan panjang sekitar 180-300 µ m dan sporangium berbentuk oval. Terdapat 3 jenis patogen penyebab bulai pada tanaman jagung di Indonesia yaitu, Peronosclerospora sorghi, P. philippinensis dan P. maydis (Burhanuddin 2011; Hikmawati et al. 2011). Menurut CIMMYT (2004) sporangia P. sorghi berbentuk oval dengan ukuran 14.4-27.3 x 15-28.9 µ m, hialin. Struktur seksual patogen ini berupa oospora sperikal berdiameter sekitar 36 µm dan memiliki sterigmata (tempat menempel oospora) menyempit. Menurut Burhanuddin (2010) suhu optimum untuk reproduksi patogen ini berkisar antara 17-29 °C dan perkecambahan spora 21-25 °C. Penyakit menyebar dan berkembang baik pada iklim tropis, tanah yang lembab dengan bantuan air (Hikmawati et al. 2011). Kerugian karena penyakit ini dapat mencapai 90-100%, sehingga penyakit ini menyebabkan kerusakan pertanaman jagung yang cukup tinggi (Wakman & Kontong 2000; Hadiatmi et al. 2004).
genomik yang umum digunakan untuk identifikasi dari kelompok hewan maupun Chromista (Ratnasingham & Hebert 2007).
Candidatus Liberibacter asiaticus
Candidatus Liberibacter asiaticus (Ca. L. asiaticus) digolongkan ke dalam Kingdom Bacteria, Filum Proteobacteria, Kelas Alphaproteobacteria, Ordo Rhizobialea, Famili Phyllobacteriaceae, Genus Candidatus Liberibacter. Bakteri ini menyebabkan penyakit citrus vein phloem degeneration (CVPD) pada tanaman jeruk di Indonesia dan secara internasional dikenal dengan nama huanglongbing. Penyakit ini disebabkan oleh tiga jenis Candidatus Liberibacter, yaitu Ca. L. asiaticus (Asia dan Amerika), Ca. L. africanus (Afrika), dan Ca. L. americanus (Amerika) (da Graca 1991; Jagoueix et al. 1994; Garnier et al. 2000). Warna daun jeruk yang terserang CVPD menjadi kuning atau belang tidak beraturan (mottle), karena berkurangnya pembentukan klorofil, daun menjadi kecil, kaku dan warna tulang daun tetap hijau (Sarwono 1995; Wijaya 2003). Patogen dapat hidup di daerah tropis dan subtropis dan toleran terhadap suhu 30-35 °C (Jagoueix et al. 1994).
Menurut Meitayani et al. (2014) tanaman jeruk di Bali terserang CVPD mencapai 83% yang disebabkan oleh penggunaan bibit jeruk yang terinfeksi CVPD untuk perbanyakan tanaman secara vegetatif. Patogen menyerang tanaman jeruk lewat vektor serangga yaitu Diaphorina citri yang menghisap cairan daun jeruk yang terinfeksi huanglongbing (Nakashima et al. 1996).
Villechanoux et al. (1992) telah melakukan deteksi patogen CVPD dengan uji serologi dan hibridisasi DNA/dengan probe spesifik, namun teknik ini membutuhkan waktu 2 hari dan belum bisa mengidentifikasi sampai ke tingkat spesies. Metode PCR telah terbukti lebih peka dan cepat dalam deteksi CVPD (Jagoueix et al. 1996; Hung et al. 1999). Berbagai primer telah dikembangkan untuk deteksi penyakit huanglongbing pada jeruk, termasuk primer spesifik OI1 untuk forward dan OI2c untuk reverse dengan ukuran produk asam nukleat sebesar 1160 pb. Target primer OI1 dan OI2c terletak pada daerah genomik 16S rDNA. Daerah genomik 16S rDNA adalah daerah gen target yang umum digunakan untuk mengidentifkasi organisme prokariotik, dan untuk target yang lebih spesifik digunakan primer A2 dan J5 untuk target genom protein ribosom rplKAJL-rpoBC operon (β-operon) pada penyakit huanglongbing yang disebabkan oleh Ca. L. asiaticus dengan produk ±703 pb (Jagoueix et al. 1994; Hocquellet et al. 1999). Primer OI1 dan OI2c tersebut juga digunakan oleh Ulfah (2014) untuk deteksi penyakit huanglongbing di Indonesia.
Bean common mosaic virus (BCMV)
12
3 BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Agustus 2014 sampai dengan Mei 2015, di Laboratorium Bakteriologi Fakultas Pertanian, Institut Pertanian Bogor, Laboratorium Biologi Molekuler Balai Besar Uji Standar Karantina Pertanian Jakarta dan Laboratorium Bioteknologi Balai Uji Terap Teknik dan Metode Karantina Pertanian Bekasi.
Bahan
Bahan yang digunakan selama penelitian yaitu buah cabai yang bergejala antraknosa disebabkan oleh C. acutatum, daun jagung bergejala bulai yang disebabkan oleh P. sorghi, daun jeruk bergejala CVPD yang disebabkan oleh Ca. L. asiaticus diambil dari Kelurahan Situgede, Kecamatan Bogor Barat, Kota Bogor, dan daun kacang panjang yang bergejala mosaik yang disebabkan oleh BCMV diambil dari Desa Neglasari, Kecamatan Dramaga, Kabupaten Bogor, bufer isolasi (Tris–HCl, pH 8.0; EDTA; NaCl; 1% Cetyltrimethylammonium bromide (CTAB) (w/v), 1% 2-mercaptoethanol), etanol 70%, kloroform:isoamilalkohol (24/1 v/v), isopropanol, ethylene diamine tetraacetic acid (EDTA), sodium dodecyl sulphate (SDS), NaCl 5M, TE (Tris/EDTA), asam borat, Tris HCl pH 7, alkohol 90%, akuades, nuclease free water, PDB, kertas tisu, etidium bromida, agarosa, PDA, petri dish, bufer TAE 50X, primer kontrol internal (Rubisco L), primer C. acutatum, primer P. sorghi, primer Ca. L. asiaticus, primer spesifik BCMV, dream Taq green master mix PCR (Thermo Scientific), Whatman FTA®Plant Card, 0.1 M glycine; pH 9.0; 50 mM NaCl dan Triton X-100.
Penyiapan Patogen Tanaman untuk Isolasi Asam Nukleat dan Deteksi dengan PCR
Pengamatan dan dokumentasi gejala penyakit pada tanaman sasaran di lapangan dilakukan sebagai tahap awal identifikasi dan deteksi. Contoh yang diambil masing-masing tiga tanaman yang bergejala untuk setiap patogen dalam suatu lokasi pertanaman. Keempat penyakit tersebut yaitu bulai (P. sorghi) pada jagung, CVPD atau huanglongbing (Ca. L. asiaticus) pada jeruk, mosaik (BCMV) pada kacang panjang, dan antraknosa (C. acutatum) pada cabai.
Isolasi Asam Nukleat Beberapa Patogen Tanaman
14
Isolasi Asam Nukleat Menggunakan Metode Konvensional
Isolasi asam nukleat secara konvensional berbeda-beda metodenya tergantung dari jenis patogennya, sumber contoh atau jaringan tanamannya.
Colletotrichum acutatum dari buah cabai dan Peronosclerospora sorghi dari
daun jagung. Isolasi DNA total C. acutatum dari buah cabai dan
Peronosclerospora sorghi dari daun jagung menggunakan metode yang dikembangkan oleh Warburton dan Hoisington (2001) yaitu sebagai berikut: Sebanyak 0.1 g contoh jaringan yang telah dipotong-potong halus direndam dengan nitrogen cair dalam mortar dan digerus dengan pistil hingga diperoleh bentuk tepung. Hasil gerusan dipindahkan ke tabung eppendorf 2 ml dan ditambahkan 400 µL bufer ekstraksi (1 M Tris pH 8, 5 M NaCl dan 0.5 M EDTA, CTAB 2%), 5 µL 2-mercaptoethanol v/v dan diinkubasi pada suhu 65 ºC selama 60 menit dalam waterbath. Suspensi dihomogenasi dengan dibolak-balik tiap 10 menit. Sebanyak 500 µL kloroform:isoamilalkohol (24:1, v/v) ditambahkan ke dalam suspensi, kemudian disentrifus pada kecepatan 3 500 rpm selama 20 menit pada suhu 4 ºC. Supernatan yang bening dipindahkan ke tabung baru dan ditambahkan 1X volume isopropanol. Pelet DNA diendapkan dengan sentrifugasi pada 12 000 rpm selama 20 menit. Supernatan dibuang, pelet dicuci dengan etanol 70% dengan sentrifugasi 8 000 rpm selama 5 menit kemudian dikeringkan dan pelet DNA dilarutkan dalam bufer TE 1X 75 µL.
Colletotrichum acutatum dari isolat murni. Isolasi DNA C. acutatum dari biakan murni berumur 4 hari menggunakan metode yang dikembangkan oleh Abd-elsalam et al. (2003) dengan modifikasi minor sebagai berikut: Contoh berupa miselium dalam PDB sebanyak 250 mL, disaring dengan kertas saring hingga mendapatkan miselium sebanyak 0.1 g. Contoh digerus dengan nitrogen cair dalam mortar dan digerus dengan pistil. Hasil gerusan dipindahkan ke tabung eppendorf 1.5 mL dan dicuci dengan menambahkan 500 µL bufer Tris-EDTA (pH 8). Suspensi disentrifugasi pada kecepatan 13 000 rpm selama 10 menit. Supernatan dibuang, sedangkan pelet ditambahkan 300 µL bufer ekstraksi (200 mM Tris-HCl pH 8.5, 250 nM NaCl, 25 mM EDTA, dan 0.5% SDS) dan homogenasi dengan tangan selama 5 menit. Suspensi ditambahkan 150 µ L natrium asetat (CH3COONa) pH 5.2. Suspensi diinkubasi pada suhu 20 ºC selama 10 menit. Suspensi disentrifugasi pada 13 000 rpm selama 5 menit pada suhu 4 ºC. Supernatan dimasukkan ke tabung baru dan ditambahkan isopropanol dengan volume yang sama, lalu disentrifugasi pada 13 000 rpm selama 10 menit, sehingga diperoleh pelet DNA. Pelet tersebut dicuci dengan 500 µL etanol 70%, disentrifus pada 8 000 rpm selama 5 menit, lalu dikeringanginkan pada suhu ruang. Selanjutnya pelet dilarutkan dalam 75 µ L bufer TE 1X kemudian simpan pada suhu -20 ºC.
Candidatus Liberibacter asiaticus dari tulang daun jeruk. Isolasi DNA total
2-mercaptoethanol (1%), yang sudah dipanaskan 60 ºC selama 10 menit. Suspensi Ca. L. asiaticus dipanaskan pada suhu 60 ºC selama 60 menit dalam waterbath, dan dibolak-balikkan setiap 10 menit. Suspensi didiamkan selama 2-3 menit pada suhu ruang, kemudian ditambahkan 750 µL kloroform:isoamilalkohol (24:1, v/v). Suspensi digetar dengan vortek selama 3-5 menit, lalu disentrifugasi 12 000 rpm selama 15 menit pada suhu 4 ºC. Supernatan dimasukkan ke tabung baru lalu dihitung volume, modifikasi dengan penambahan natrium asetat 3M pH 5.2 (1:10, v/v) dan isopropanol absolut (2:3, v/v) lalu dibolak-balik. Suspensi digetar selama 1 menit, lalu diinkubasi overnight pada -20 ºC, kemudian disentrifugasi 12 000 rpm selama 10 menit, supernatan yang diperoleh ditambahkan 500 µL etanol 80% dingin, lalu disentrifugasi 12 000 rpm selama 2 menit. Pelet dikering-anginkan pada suhu ruang, lalu diresuspensikan dengan bufer TE 1X 75 µL.
Bean common mosaic virus (BCMV) dari daun kacang panjang. Isolasi total asam nukleat BCMV dari daun kacang panjang menggunakan metode Doyle dan Doyle (1990). Sebanyak 0.1 g tulang daun contoh digerus dengan nitrogen cair dalam mortar menggunakan pistil hingga menjadi tepung, lalu dimasukkan ke dalam tabung 2 mL. Selanjutnya masukkan 500 µL CTAB (2%), 5 µL 2- mercaptoethanol (1%), yang sudah dipanaskan 60 ºC selama 10 menit. Suspensi dipanaskan pada suhu 65 ºC selama 60 menit dalam waterbath, dan dibolak-balikkan setiap 10 menit. Suspensi didiamkan selama 2-3 menit pada suhu ruang, kemudian ditambahkan 750 µ L kloroform:isoamilalkohol (24:1, v/v). Suspensi digetar selama 3-5 menit, lalu disentrifugasi 12 000 rpm selama 15 menit pada suhu 4 ºC. Supernatan dimasukkan ke tabung baru lalu dihitung volume, lalu ditambahkan 600 µ L isopropanol. Contoh digetar selama 1 menit, lalu disentrifugasi 12 000 rpm selama 10 menit. Fase larutan bagian atas diambil dan ditambahkan 500 µL etanol 80% dingin, lalu disentrifugasi 8 000 rpm selama 15 menit. Pelet dikeringkan di suhu ruang, lalu diresuspensikan dengan bufer TE 1X 75 µL.
Isolasi Asam Nukleat dari Kit Komersial
16
selama 2 menit. Supernatan dibuang dan dimasukkan kembali XPPG ke dalam tabung 2 mL. Sebanyak 500 µL wash buffer1 dimasukkan ke dalam kolom XPPG, disentrifugasi 13 000 rpm selama 30 detik. Supernatan dibuang dan ditambahkan kembali 750 µL wash buffer2 ke XPPG, kemudian disentrifugasi 13 000 rpm selama 30 detik. Supernatan dibuang dan diulang sentrifugasi 13 000 rpm selama 3 menit. XPPG dipindahkan ke tabung 1.5 mL, kemudian ditambahkan 75 µ L elution buffer ke dalam XPPG dan diinkubasi di suhu ruang selama 3 menit. Contoh disentrifugasi 13 000 selama 2 menit untuk mendapatkan suspensi DNA.
Isolasi RNA total BCMV dari daun sakit menggunakan metode RNA XPrep Plant Total RNA Mini Kit (Phile Korea Technology/PKT) sesuai dengan protokol yang tersedia. Sebanyak 0.1 g dimasukkan ke dalam mortar, digerus dengan nitrogen cair menggunakan pistil hingga menjadi tepung, lalu dimasukkan ke dalam tabung 2 mL, dan ditambahkan 450 µL XPRB yang sudah ditambahkan 2-mercaptoethanol (1%). Suspensi dimasukkan ke tabung filter, dan disentrifugasi 12 000 rpm selama 2 menit, supernatan dimasukkan ke dalam tabung 1.5 mL, lalu ditambahkan etanol 96% sebanyak 0.5 kali volume supernatan, dan dicampur menggunakan mikropipet. Suspensi dimasukkan ke dalam tabung berfilter XPPLR mini dalam tabung koleksi 2 mL, disentrifugasi 12 000 rpm selama 2 menit. Sisa suspensi disentrifugasi ulang 12 000 rpm selama 2 menit. Suspensi ditambahkan 500 µL wash buffer1, dan disentrifugasi 12 000 rpm selama 1 menit. Supernatan dibuang, XPPLR mini dicuci kembali dengan 700 µL wash buffer2, suspensi disentrifugasi 12 000 rpm selama 1 menit, disentrifugasi kembali 12 000 rpm selama 3 menit. Supernatan dibuang dan XPPLR mini diletakkan ke tabung 1.5 mL. XPPLR mini ditambahkan 75 µ L bufer TE 1X, kemudian diamkan selama 1 menit. Contoh disentrifugasi 12 000 rpm selama 2 menit. Suspensi RNA disimpan di suhu -70 ºC.
Isolasi Asam Nukleat dari FTA-card
Metode standar. Bagian tanaman yang bergejala penyakit diambil
sebanyak 0.1 g dan dari biakan murni C. acutatum diambil berdiameter 3 cm. Contoh diletakkan di atas kertas FTA-card, ditutup dengan kertas penutup lalu digerus. Contoh daun dan isolat cendawan digerus menggunakan pinset sedangkan contoh tulang daun jeruk yang sudah dipisahkan dari daging daun
Contoh pada potongan FTA-card (punch) dimasukkan ke dalam tabung PCR 250 μL masing-masing sebanyak 1, 2, 3 punch, lalu ditambahkan 200 μL purification reagent, dan dibolak-balik sebanyak dua kali, kemudian diinkubasi pada suhu ruang selama 4-5 menit. Reagen dan punch diaduk menggunakan mikropipet dengan cara menaik-turunkan sebanyak dua kali. Purification reagent dibuang sebanyak mungkin menggunakan mikropipet serta tinggalkan punch tetap di dalam tabung. Prosedur di atas diulangi satu kali lagi. Punch ditambahkan 200
Contoh diinkubasi dalam suhu ruang selama 4-5 menit. Bufer TE0.1 dibuang sebanyak mungkin menggunakan mikropipet serta tinggalkan punch tetap di dalam tabung. Prosedur di atas diulangi satu kali lagi. Punch dikeringanginkan pada suhu ruang selama 1 jam (dengan membuka penutup tabung PCR) atau dikeringkan di dalam oven bersuhu 56 °C selama 20 menit. Selanjutnya punch dapat digunakan untuk PCR atau disimpan pada suhu 4 °C atau 20 °C.
Metode isolasi yang dimodifikasi. Biakan murni cendawan C. acutatum
berumur 4 hari pada media PDA dengan diameter 3 cm diambil menggunakan tusuk gigi, lalu dimasukkan ke dalam tabung PCR yang berisi 25 µL bufer TE 1X (10 mM Tris-HCl, pH 8.0, 1 mM EDTA). Tabung PCR dengan tutup terbuka dimasukkan ke dalam microwave dengan daya 1100 Watt selama 1 menit, selanjutnya contoh dan bufer diaduk dengan menaik turunkan menggunakan mikropipet sebanyak dua kali. Pemanasan dengan microwave diulang satu kali (modifikasi metode Suzuki et al. 2006). Suspensi cendawan dalam tabung PCR tersebut diambil 5 µ L, lalu diteteskan pada FTA-card dan dikeringkan pada suhu ruang selama 10 menit. FTA-card dipotong menjadi berukuran diameter 2 mm (punch) menggunakan Harris Micro Punch, selanjutnya sebanyak 1, 2 dan 3 punch siap untuk dijadikan sebagai sumber cetakan dalam PCR.
Contoh dari daun yang bergejala Ca. L. asiaticus, P. sorghi dan buah dari C. acutatum sebanyak 0.1 g digerus dengan benda tumpul. Contoh daun dan isolat cendawan digerus menggunakan pinset besi putih sedangkan contoh tulang daun jeruk yang sudah dipisahkan dari daging daun ditekan dengan palu kecil pada bagian kertas penutup hingga contoh menempel pada kertas lalu sisa contoh tersebut dibuang dari FTA-card. Contoh pada FTA-card dikeringkan selama 60 menit lalu diletakkan di atas cutting mat, kemudian dipotong dengan diameter 2 mm menggunakan Harris Micro Punch, atau menggunakan scalpel yang tajam. Contoh pada potongan FTA-card (punch) dimasukkan ke dalam tabung PCR 250
μl masing-masing sebanyak 1, 2, 3 punch, lalu ditambahkan 200 μl purification reagent, dan dibolak-balik sebanyak dua kali, kemudian diinkubasi pada suhu ruang selama 4-5 menit. Reagen dan punch diaduk menggunakan mikropipet dengan cara menaikturunkan sebanyak dua kali purification reagent dibuang sebanyak mungkin menggunakan mikropipet serta tinggalkan punch tetap di dalam tabung. Prosedur di atas diulangi satu kali lagi. Contoh ditambahkan 10 µL bufer TE0.1 ke dalam tabung PCR, dalam posisi tabung PCR terbuka contoh di microwave dengan daya 1100 watt selama 1 menit, selanjutnya bufer dan punch diaduk dengan menaikturunkan bufer menggunakan mikropipet sebanyak dua kali. Pemanasan dengan microwave diulang sekali lagi. Kertas punch dikeluarkan dan dikeringanginkan pada suhu ruang. Contoh siap digunakan dalam PCR.
18
µL bufer denaturasi (GES bufer: 0.1 M glycine; pH 9.0; 50 mM NaCl, 1 mM EDTA, 0.5% Triton X-100) dan 2 µL 2-mercaptoethanol (1%). Contoh FTA-card diinkubasi di water bath pada suhu 95 ºC selama 10 menit dan segera didinginkan dalam lemari es selama 5 menit atau sampai digunakan dalam proses RT-PCR.
Pengukuran Asam Nukleat Hasil Isolasi
Konsentrasi asam nukleat total pada metode kit dan konvensional langsung diukur dari hasil isolasi asam nukleat. Asam nukleat yang melekat pada potongan (punch) FTA-card diameter 2 mm diresuspensi dengan bufer elusi 10 µ L yang sudah dipanaskan dengan suhu 65 ºC selama 10 menit dan bufer TE 1X untuk BCMV dalam tabung PCR. Setiap tabung PCR disentrifugasi kecepatan 13 000 rpm selama 3 menit agar asam nukleat keluar dari punch FTA-card tersuspensi ke dalam bufer tersebut. Cetakan DNA hasil isolasi diukur dengan meneteskan sebanyak 1 µ L suspensi ke atas UV-Vis nanodrop-spektrofotometer (Thermo Scientific) dan diulang sebanyak tiga kali.
Kemurnian asam nukleat dengan pengukuran absorbansi pada panjang gelombang A260/A280 dianggap baik pada kisaran nilai 1.8-2.0. Jika nilai kemurnian kurang dari kisaran tersebut maka konsentrasi protein bawaan cukup tinggi, sedangkan jika lebih besar nilainya maka konsentrasi RNA bawaan cukup tinggi.
Jumlah berat asam nukleat total yang berhasil diisolasi dari FTA-card menggunakan metode standar dan modifikasi dihitung berdasarkan hasil kali konsentrasi asam nukleat (ng µL-1), volume suspensi yaitu 10 µ L dan luas kertas FTA yang berisi contoh dibagi dengan luas satu punch (3.14 mm2). Penghitungan konsentrasi asam nukleat dari metode konvensional dan kit berdasarkan hasil kali konsentrasi asam nukleat (ng µL-1) dengan volume larutan hasil resuspensi asam nukleat dari total volume 75 µL.
Analisis Statistika
Data konsentrasi dan total asam nukleat hasil isolasi dengan ketiga cara di atas untuk masing-masing patogen dilakukan analisis ragam (ANOVA) dan dilanjutkan dengan uji perbedaan nilai tengah metode Tukey pada taraf nyata 5%. Perhitungan ANOVA dan uji Tukey tersebut dilakukan menggunakan program Minitab 16.
Deteksi Patogen Tanaman Menggunakan PCR dan RT-PCR
PCR untuk C. acutatum, P. sorghi dan Ca. L. asiaticus
Proses PCR selanjutnya adalah amplifikasi DNA target dengan menentukan komposisi dari komponen PCR yaitu di antaranya pasangan primer spesifik dan pengaturan siklus amplifikasi DNA sesuai dengan target yang diinginkan (Tabel 1) dan komposisi volume reaktan standar amplifikasi PCR (Tabel 2).
RT-PCR untuk Bean common mosaic virus
Reaksi transkripsi balik PCR dengan dua tahap (tabung terpisah) yaitu tahap pertama 1.5 µL nuclease free water, 1 µL (10 µM µL-1) Primer BlC-cpr, dan 3 µ L RNA total dengan total volume 5.5 µL, dipanaskan di 65 ºC selama 5 menit, segera didinginkan. Tambahkan 2 µL bufer RT 5x, 0.5 µL dNTP 10 mM, 1 µL DTT (Dithiothreitol) 0.1 µM, 0.5 µL RNase inhibitor (Thermo Scientific) (40 U uL-1), 0.5 µL Reveraid Reverse Transcriptase (M-MuLV) (Thermo Scientific) (200 U µL-1) dengan total volume 10 µL dalam tabung mikro. Reagen RT diinkubasi pada suhu 42 ºC selama 1 jam. Hasil akhir reaksi transkripsi balik adalah produk cDNA (1 µL) yang digunakan pada tahap kedua yaitu amplifikasi cDNA. Pasangan primer, urutan nukleotida dan siklus PCR dapat dilihat pada tabel 1.
Reaksi PCR dilakukan dengan menggunakan mesin thermal cycle AB (Applied Biosystem) Veriti dengan komponen reaksi PCR untuk keempat patogen dapat dilihat pada tabel 2.
Optimasi PCR
Optimasi PCR dilakukan untuk mendapatkan PCR yang baik, di antaranya modifikasi konsentrasi komponen-komponen atau kondisi PCR dari metode yang diacu. Komponen PCR yang dioptimasi pada penelitian ini adalah konsentrasi primer target. Konsentrasi cetakan DNA atau RNA yang digunakan dalam optimasi adalah 15 ng µL-1. Khusus untuk optimasi metode FTA-card, cetakan DNA terlebih dahulu diteteskan pada punch FTA-card, untuk selanjutnya digunakan pada uji PCR. Untuk mengevaluasi keberhasilan isolasi asam nukleat patogen (kecuali P. sorghi) digunakan primer kontrol internal Rubisco L.
20
Tabel 1 Primer dan siklus PCR yang digunakan untuk deteksi keempat patogen
Primer Urutan nukleotida (5’3’) dan siklus PCR
CaInt2 GGGGAAGCCTCTCGCGG ±500 pb
Gen ITS1,
PsUF CCAGCAACTCCAGTTATGGAA ±154 pb
Gen
A2 TATAAAGGTTGACCTTTCGAGTTT ±703 pb
Gen protein
Reaktan Volume (L) Konsentrasi akhir 2X Dream taq green (Thermo Scientific)
Primer Forward 10 M
Elektroforesis Gel Agarosa dan Visualisasi Asam Nukleat
22
4 HASIL DAN PEMBAHASAN
Penyakit-penyakit Tanaman yang Menjadi Objek Isolasi Asam Nukleat untuk Dideteksi dengan Teknik PCR/RT-PCR
Penelitian tentang deteksi patogen tanaman ini dilakukan terhadap empat jenis penyakit dengan golongan atau tipe patogen yang berbeda-beda. Masing-masing jenis tanaman sakit di lapangan diidentifikasi berdasarkan pengamatan gejala (simtomatologi). Contoh tanaman sakit kemudian diambil dan dibawa ke laboratorium untuk diamati tanda patogennya (jika ada) dan dilakukan konfirmasi penyakitnya untuk selanjutnya digunakan dalam isolasi dan pengujian PCR atau RT-PCR. Berikut ini adalah ciri dan sifat secara ringkas tentang masing-masing keempat penyakit.
Penyakit Antraknosa pada Cabai oleh C. acutatum
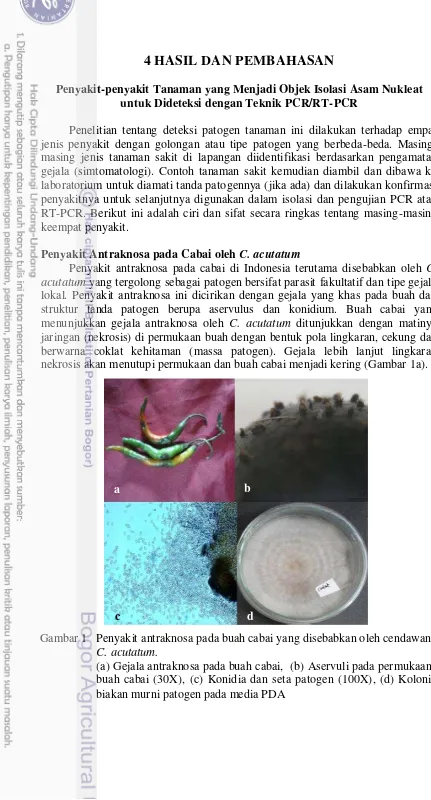
Penyakit antraknosa pada cabai di Indonesia terutama disebabkan oleh C. acutatum yang tergolong sebagai patogen bersifat parasit fakultatif dan tipe gejala lokal. Penyakit antraknosa ini dicirikan dengan gejala yang khas pada buah dan struktur tanda patogen berupa aservulus dan konidium. Buah cabai yang menunjukkan gejala antraknosa oleh C. acutatum ditunjukkan dengan matinya jaringan (nekrosis) di permukaan buah dengan bentuk pola lingkaran, cekung dan berwarna coklat kehitaman (massa patogen). Gejala lebih lanjut lingkaran nekrosis akan menutupi permukaan dan buah cabai menjadi kering (Gambar 1a).
C
Gambar 1 Penyakit antraknosa pada buah cabai yang disebabkan oleh cendawan C. acutatum.
(a) Gejala antraknosa pada buah cabai, (b) Aservuli pada permukaan buah cabai (30X), (c) Konidia dan seta patogen (100X), (d) Koloni biakan murni patogen pada media PDA
b a
Pengamatan mikroskopi stereo menunjukkan tanda patogen berupa aservuli berwarna coklat yang memiliki seta berwarna coklat dan pendek yang tumbuh pada permukaan buah cabai (Gambar 1b). Tanda patogen lainnya berupa konidia bersel satu, hialin, fusiform, berukuran10 µ m x 3.5 µm (Gambar 1c).
Koloni cendawan umur 4 hari memiliki ciri warna koloni putih, pucat abu-abu atau pucat kuning terkadang membentuk pigmen ungu (Gambar 1d). Pengamatan morfologi patogen ini sulit untuk membedakan antara C. acutatum dan C. gloeosporioides, sehingga perlu diuji secara PCR. Pengamatan morfologi patogen antara C. acutatum dan C. gloeosporioides sulit untuk dideteksi dengan kunci identifikasi secara manual, sehingga perlu diuji secara molekuler (Andrade et al. 2007; Whitelaw-Weckert et al. 2007).
Penyakit Bulai pada Jagung oleh P. sorghi
Penyakit bulai pada jagung disebabkan oleh P. sorghi (Oomycetes) yang tergolong sebagai patogen yang bersifat parasit obligat dan tipe gejala sistemik. Infeksi patogen ditunjukkan dengan gejala pada daun berupa warna hijau dan kuning tidak beraturan searah tulang daun. Daun tanaman sakit mengalami malformasi, lebih sempit dan tegak. Gejala lebih lanjut seluruh daun tanaman menjadi belang dan nekrosis. Tanaman menjadi kerdil, daun klorosis berwarna coklat dan mati sebelum waktunya apabila tanaman terserang berumur kurang dari 4 minggu. Serangan pada fase generatif menyebabkan malformasi dan nekrosis pada buah.
Gejala di lapangan sangat sulit dibedakan antara patogen yang disebabkan oleh P. sorghi maupun patogen lainnya seperti P. maydis dan P. philippinensis (Gambar 2a). Pertumbuhan patogen melalui pengamatan mikroskopi nampak seperti embun air yang menempel pada permukaan atas dan bawah daun, apabila diraba propagul patogen akan menempel pada jari. Sporangiofor (konidiofor) patogen ini tegak, bercabang dan hialin (Gambar 2b). Pada sporangiofor dibentuk sporangia (konidia) berbentuk oval dan hialin (Gambar 2c). Sporangiofor muncul dalam bentuk kelompok dari jaringan tanaman melalui stomata, dapat tumbuh pada bagian atas atau bawah daun dan jaringan yang terinfeksi (Agrios 2005).
Gambar 2 Penyakit bulai pada daun jagung yang disebabkan oleh P. sorghi. (a) Gejala bulai pada daun jagung, (b) Tanda penyakit berupa spora di permukaan daun (35 X), (c) Sporangia dan sporangiofor P. sorghi (400 X)
24
Penyakit Huanglongbing pada Jeruk oleh Ca. L. asiaticus
Gejala penyakit huanglongbing atau citrus vein phloem degeneration (CVPD) pada daun jeruk di lapangan sering menyerupai gejala akibat kekurangan unsur hara seperti kimia seng (Zn) atau mangan (Mn) (gejala abiotik). Huanglongbing yang disebabkan oleh Ca. L. asiaticus sebagai bakteri patogen yang bersifat parasit obligat dan tipe gejala sistemik. Sebagaimana disebutkan oleh Zekri dan Obreza (2002), bahwa gejala kekurangan seng (Zn) di tanaman jeruk menyerang tajuk tanaman menjadi lebih kecil karena daun menjadi kecil, runcing, dan tegak.
Gejala huanglongbing pada tanaman jeruk dicirikan adanya tulang daun hijau, tepi lamina antara tulang daun yang menguning. Gejala belang pada daun dan keseluruhan tanaman dikenal dengan nama huanglongbing yang artinya penyakit dragon kuning (Gambar 3a dan 3b). Jika tanaman terinfeksi pada fase vegetatif maka tanaman tidak dapat berbuah, daun berkembang abnormal (runcing dan melengkung) dan kemudian ranting menjadi mati. Pada fase generatif buah jeruk tumbuh tidak normal baik ukuran maupun bentuk, warna kurang cerah (alami berwarna kehijauan), rasa buah menjadi lebih asam atau pahit dan rontok sebelum waktunya (Gambar 3b).
Patogen huanglongbing di Asia diketahui adalah Candidatus Liberibacter asiaticus yang merupakan bakteri Gram negatif yang belum dapat dibiakkan dalam media buatan (Garnier et al. 1984). Patogen diketahui ditularkan oleh vektor serangga yaitu Diaphorina citri (Nakashima et al. 1996) (Gambar 3c).
Penyakit Mosaik pada Kacang Panjang oleh Bean common mosaik virus
Kacang panjang bergejala penyakit mosaik di lapangan dicirikan dengan perubahan warna daun yang tidak normal. Gejala yang disebabkan oleh BCMV sebagai patogen yang bersifat parasit obligat dan tipe gejala sistemik yang ditunjukkan dengan adanya pola warna hijau tua (vein banding) yang tidak beraturan (Gambar 4a).
Gambar 3 Penyakit Huanglongbing pada daun jeruk yang disebabkan oleh Ca. L. asiaticus.
(a) Gejala huanglongbing pada daun jeruk, (b) Tanaman jeruk yang terserang Ca. L. asiaticus, (c) Vektor Diaphorina citri (30 X)
b