UJI AKTIVITAS MERKURI REDUKTASE BAKTERI
DARI EKOSISTEM AIR HITAM KALIMANTAN TENGAH
OLEH
SULASTRI
PROGRAM PASCA SARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
SULASTRI. Uji Aktivitas Merkuri Reduktase Bakteri dari Ekosistem Air Hitarn, Kalimantan Tengah (Mercuric Reductase Activity Assay of Bacteria Isolatedfrom Black Wafer Ecosystem, Central Kalimantan) Dibimbing oleh DWI ANDREAS SANTOSA
dan MAGGY T. SUHARTONO.
Penelitian ini dilakukan dengan tujuan untuk mengisolasi bakteri pereduksi merkuri dari Ekosistem Air Hitam (EAH) Kalimantan Tengah serta melakukan uji aktivitas merkuri reduktase dan identifikasi terhadap isolat terpilih.
Isolasi bakteri pereduksi merkuri dilakukan pada media agar LB yang mengandung HgC12 20 pg/ml. Isolat yang diperoleh diseleksi lebih lanjut dengan menumbuhkan pada media agar LB yang mengandung HgC12 lebih tinggi yaitu: 50, 100, 200, 300, 400, 500 dan 1000 pglml. Sebanyak 7 isolat dapat tumbuh pada konsentrasi HgC12 1000 pg/ml yaitu ICBB 2798, ICBB 2799, ICBB 2810, ICBB 2812, ICBB 2813, ICBB 2820 dan ICBB 2847. Uji aktivitas merkuri reduktase dilakukan pada ke-7 isolat tersebut ditambah isolat bakteri pereduksi merkuri koleksi ICBB yaitu ICBB 1507, ICBB 1508 diisolasi dari EAH Kalimantan Tengah dan ICBB 1506, ICBB 15 12 diisolasi dari Pongkor Jawa Barat. Aktivitas merkuri reduktase diukur berdasarkan oksidasi NADPH pada h 340 nrn mengikuti metode yang dilakukan oleh Ogunseitan (1 998).
SURAT
PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang berjudul :
Uji Aktivitas Merkuri Reduktase Bakteri dari Ekosistem Air Hitam Kalimantan Tengah
adalah benar merupakan hasil karya saya sendiri dart belurn pernah dipublikasikan. Semua sumber data dan inforrnasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, Maret 2002
UJI AKTIVITAS MERKURI REDUKTASE BAKTERI
DARI- EKOSISTEM AIR HITAM KALIMANTAN TENGAH
SULASTRI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program
Studi
Ilmu
Tanah
PROGRAM PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Uji Aktivitas Merkuri Reduktase Bakteri Dari Ekosistem Air Hitam Kalimantan Tengah
Nama Mahasiswa : Sulastri
NRP
: 99747Program Studi : Ilmu Tanah
Menyetujui,
1. Komisi Pembimbing
,-'
Dr. Ir.
/yA
Prof. Dr. Ir. Magw T. Suhartono
Ketua Anggota
2. Ketua Program Studi Ilmu Tanah
Prof. Dr. Ir. H. Sudarsono, MSc
RIWAYAT HIDUP
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis ini. Tesis ini disusun sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Pasca Sarjana di Institut Pertanian Bogor.
Penulis menyampaikan ucapan terima kasih dan penghargaan yang setinggi- tingginya kepada :
1. Bapak Dr. Ir. Dwi Andreas Santosa, MS selaku pembimbing dan juga selaku Direktur Indonesian Center For Biodiversity And Biotechnology (ICBB) yang telah memberikan dukungan dana bagi pelaksanaan penelitian ini. Perhatian, dorongan semangat, bimbingan, saran, arahan dan keteladanan beliau sangat membantu penulis dalam menyelesaikan semua pekerjaan ini.
2. Ibu Prof. Dr. Ir. Maggy T. Suhartono selaku pembimbing yang telah banyak memberikan dukungan, bimbingan, saran, serta arahan selama penelitian dan penulisan tesis ini.
3. Kepala Lababoratorium PPLH IPB, Kepala Laboratorium Biologi Tanah Faperta IPB, dan Kepala Laboratorium Pusat Antar Universitas Bioteknologi IPB, yang telah memberikan ijin untuk penggmaan Laboratoriurn beserta fasilitasnya.
4. Bapak Dr. Ir. H. Sudarsono, MSc, Dr. Ir. Gunawan Djajakirana, MSc., clan seluruh staf Program Studi Ilmu Tanah Pascasarjana IPB atas semua bimbingan bantuan dan perhatiannya.
5. Staf Lababoratorium PPLH IPB: Pak Ade, Pak Gamal, Pak Hendrik dan Pak
Deni, staf Laboratoriurn Biologi Tanah Faperta IPB: Pak Sarjito, Ibu Asih, Ibu Juleha dan staf Laboratorium PAU Bioteknologi IPB: Ibu Ika, Mbak Ari, Pak Eddy dan Pak Mulya.
6. Rekan-rekan di Lab. Mikrobiologi PPLH IPB: Mbak Rina, Mbak Donna, Rizal, Pak IWB. Suyasa, Bu Umi, Bu Yus, Bu Saida, Pak Heru, Pak Puji, Bu Etik, Reza, Mbak Neni, dan Mbak Amah atas bantuan, kebersamaan dan
ke
j
asarnanya.7. Teman-teman di Program Studi Ilmu Tanah: Ninuk, Mbak Desi, Bu Deni, Pak Wayan, Uut, Bu Hanum, Pak Kasno, Pak Mulxadi, dan semua teman-teman angkatan 1999 dan 2000 serta semua angota HMPIT atas bantuan, persahabatan dan kebersamaannya selama ini, serta semua pihak baik secara langsung ataupun tidak langsung yang telah berperan dalarn pelaksanaan penelitian ataupun penulisan tesis ini.
8. Secara khusus penulis mengucapkan terima kasih kepada "Ayah" Ir. Kasw Djumar dan "Ibu" Admilah, Mbah Deje (alm), Mbah Siti, Om Nano, Om Pay- Tante Susi, Tante Nia-Om Hojin, adiku Adri, Rudi dan Ibu Olga sekeluarga atas doa, dorongan semangat, perhatian dan kasih sayangnya, serta Dede Ace1 dan Kevina yang selalu memberi keceriaan.
Bogor, Maret 2002
DAFTAR
IS1
DAFTAR TABEL ...
...
DAFTAR GAMBAR
... DAFTAR LAMPIRAN ... PENDAHULUAN ... Latar Belakang
Tujuan Penelitian ...
...
TINJAUAN PUSTAKA
... Merkuri
... Mekanisme Detoksifikasi Merkuri
... Faktor-faktor yang Mempengaruhi Aktivitas Enzim
Tanah Sebagai Habitat Mikroba ...
Ekosistem Air Hitam ...
BAHAN DAN METODE ... Tempat dan Waktu ... Bahan dan Alat ...
... Metode
...
HASIL DAN PEMBAHASAN
... Isolasi dan Seleksi Bakteri Pereduksi Merkuri
Aktivitas Merkuri Reduktase pada Berbagai Konsentrasi HgC12 ...
Kinetika Merkuri Reduktase ...
Pengaruh pH Terhadap Aktivitas Merkuri Reduktase ...
...
Pengaruh Suhu Terhadap Aktivitas Merkuri Reduktase
...
Penggunaan NADH Sebagai Koenzim
Identifikasi Bakteri Pereduksi Merkuri ...
KESIMPULAN DAN SARAN ...
...
Kesimpulan
... Saran
DAFTAR PUSTAKA ...
DAFTAR
TABEL
Halaman 1 . Mekanisme transformasi merkuri ... 5
2 . Klasifikasi enzim secara internasional berdasarkan atas reaksi yang dikatalisis 8 3 . Hasil seleksi bakteri pereduksi merkuri ... 21 4 . Hasil uji aktivitas enzim pada berbagai konsentrasi HgClz ... 23 5 . Hasil pengujian aktivitas enzim pada konsentrasi HgClz 1000 d m 1 .... 26 6 . Hasil uji aktivitas enzim dengan NADH sebagai koenzim ... 33.
DAFTAR GAMBAR
1.
Proses detoksifikasi merkuri pada bakteri resisten merkuri...
8
2.
Model operon mer...
9
3.
Mekanisme reduksiH ~ ~ +
menjadi ~ ~ O ~ a d a ~seudomonas aeruginosa...
9
4. Skema deteksi kalorimetrik merkuri reduktase
...
17
5.
Aktivitas merkuri reduktase dari (a) isolat ICBB1506,
ICBB1507,
ICBB1508,
ICBB15 12,
ICBB2798,
ICBB2810,
dan (b) isolat ICBB2799,
ICBB
2812,
ICBB2813,
ICBB2820,
ICBB2847,
pada berbagaikonsentrasi HgC12
...
25
DAFTAR LAMPIRAN
Halaman 1 . Daftar sampel tanah dari EAH Kalimantan Tengah yang diisolasi ... 43 2 . Pembuatan larutan stok ... 43 3
.
Kurva pertumbuhan bakteri pada konsentrasi HgC12 50 pg'ml yangditurnbuhkan pada 50 ml media cair LB ... ... 4 . Kurva standar protein
PENDAHULUAN
Latar Belakang
Pembuangan limbah yang tidak layak, penyalahgunaan bahan kimia dan efek
dari penggunaan bahan kimia yang menyebabkan pelepasan senyawa organik dan
anorganik beracun ke lingkungan telah menyebabkan pencemaran terhadap tanah,
air tanah dan wilayah perairan. Limbah bahan beracun dan berbahaya (B3) yang
telah mencemari lingkungan terutama adalah golongan logam berat (Co, A g Sb, Cd,
Cr, Zn, Au,
Mn,
Sn, Hg, Mo, Pd, Pb dan Ti). Salah satu logam berat yang bersifatmeracun dan telah masuk lingkungan dalam jurnlah yang cukup banyak adalah
merkuri (Hg).
Sumber terbesar pelepasan senyawa merkun ke lingkungan adalah
pembakaran batu b a a dan produk minyak bumi yang secara alami kaya den@
merkuri. Deposit alam (ore) yang mengandung merkuri tersebar pada batuan, tanah,
udara dan air. Cinnabar (merkuri sulfida) adalah bentuk mineral yang paling umum
ditemukan di alam. Menurut Dugan (1 974), pada batuan sedimen, organrc-nch
shale dan minyak bumi mentah kandungan merkurinya mencapai 20.000 pbb.
Sumber pencemaran merkuri yang juga cukup banyak adalah dari industri
pertarnbangan, terutama yang tanpa izin seperti penambangan emas rakyat. Merkuri
digunakan untuk memisahkan emas dari pasir sungai. Industri lain yang potensial
mengeluarkan limbah merkuri adalah industri pupuk. Pada industri pupuk, gas yang
digunakan pada proses produksinya banyak mengandung merkuri. Industri soda
kausatik yang banyak diperlukan pabrik kertas, baterai dan kosmetik j u g banyak
digunakan dalam peralatan nunah tangga dan digunakan sebagai desinfektan pada
rumah sakit. Fenil merkuri dm metil merkuri digunakan dalam pertanian sebagai
v
fungisida, insektisida dan bakteriosida (Misra, 1992).
Banyaknya pelepasan merlnui dari berbagai sumber tersebut telah
mengakibatkan permasalahan lingkungan yang cukup serius. Beberapa peneliti
melaporkan bahwa kandungan Hg pada beberapa jenis biota tambak di Teluk Jakarta
sudah mencapai tingkat mengkhawatirkan, yaitu antara 0 sampai 7,9 pg Hg/g biota
basah, pada udang rata-rata 1,19 pg Hg/g udang basah, pada ikan 1,23 pg HgJg ikan
basah dan pada rajungan 3,72 pg Hglg rajungan basah (Anonim, 1991). WHO
menetapkan kadar Hg yang diizinkan adalah 0,s pg Hglg ikan basah. Selain itu
Sungai Cisadane, Ciliwung dan Sunter juga mengalami tingkat pencemaran yang
sudah sangat mengkhawatirkan. Kandungan merkuri di Sungai Cisadane mencapai
3,33 pbb, jauh diatas baku mutu konsumsi yang 1 pbb. Sungai Kenjeran di
Surabaya juga mengalami ha1 yang serupa akibat dari pembuangan limbah industri
dan limbah nunah tangga yang memadati areal sepanjang sungai (Anonim, 2000).
Sementara itu pencemaran merkuri di Pasaman Sumatra Barat juga telah melebihi
arnbang batas. Hasil penelitian yang dilakukan oleh Bapedalda di desa Talang
Babungo Kecarnatan Lembah G h a n t i Kabupaten Solok dan Batang Palangki
Kabupaten Sawahlunto/Sijunjung menemukan bahwa dari 100 pekerja tambang
kadar merkuri yang ditemukan sebesar 11,7-89 mgkg rambut. Jumlah tersebut
masuk dalam koridor pencemaran merkuri di Minamata yaitu antara 17,7-705 mglkg
rambut. Penelitian di Batang Malandu dan Batang Masus, menemukan limbah yang
Berbagai usaha untuk membersihkan lingkungan dari bahan pencemar
berbahaya telah banyak dilakukan dan teknologi yang digunakan juga semakin
.
-
- berkembang. Berbagai macam teknologi diantaranya adalah pembenarnan, vapor extraction, stabilisasi dan solidifikasi, soil washing, soil jlushing, critical fluid
extraction, presipitsi kimia, vitrification, desorpsi thermal dan pembakaran
(Skadany dan Meeting, 1993). Teknologi fisikokimia yang telah banyak dilakukan
pada beberapa industri yang menghasilkan lirnbah berbahaya tersebut tidak dapat
secara nyata memusnahkan senyawa-senyawa yang berbahaya, bahkan kadang-
kadang justru bertarnbah. Adanya dampak negati f dari teknologi tersebut
mendorong berkembangnya penerapan metode bioremediasi diatas pemukaan tanah
(ex situ) dan di dalam tanah (in situ).
Bioremediasi adalah merupakan proses penyehatan (remediasi) secara
biologis terhadap komponen lingkungan, tanah dan air yang telah tercemar oleh
kegiatan manusia (Sa'id dan Fauzi, 1996). Metode ini sangat dibutuhkan untuk
mengatasi dampak negatif dari metode fisikokimia dan sangat penting untuk
digunakan bersama dengan teknologi yang lain agar usaha perlindungan tanah akibat
pencemaran bahan-bahan berbahaya berhasil dengan baik. Bakteri resisten merkuri
merupakan salah satu mikroorganisme yang dapat digunakan dalam metode
bioremediasi. Bakteri resisten merkun dapat mereduksi
H$
menjadi bentuk inertdan volatile (H~') yang kemudian didihsikan keluar sel melalui membran sel.
Proses ini berlangsung secara intraseluler oleh merkun reduktase (Gupta et al.,
1999). Bakteri pereduksi merkuri dapat ditemukan pada bakteri Gram positif
Ekosistem Air Hitam (Black Water Ecosystem), suatu ekosistem yang dicirikan dengan kondisi airnya yang berwarna inerah kehitaman jernih dan memiltki komposisi flora dan fauna khas dan terbentuk melalui proses yang berlangsung lebih dari 5000 tahun. Ekosistem unik semacarn ini tidak hanya penting karena jenis flora dan fauna khas yang dimilikinya, tetapi yang lebih penting adalah terdapatnya rnikroba-mikroba yang niampu hidup dalam kondisi ekstrim baik pada pH rendah (acidofilik), pH tinggi (alkalofilik), suhu tinggi (termofilik), serta
mikroba-mikroba lain yang memiliki potensi untuk dikembangkan dalam industri bioteknologi dan bioremediasi. Pada Ekosistem Air Hitam ini telah berhasil dieksplorasi bakteri pendegradasi minyak bumi dengan kemampuan mendegradasi minyak bumi yang tinggi (18,69°/~0,49%), bakteri penghasil protease dengan aktivitas yang cukup tinggi juga (1,5-3 UNmVmnt), bakteri perombak fenol, bakteri penghasil selulosa dan lain-lain (Santosa et al., 2000).
Berdasarkan ha1 tersebut, diperkirakan pada Ekosistem Air Hitarn (EAH) juga dapat ditemukan bakteri resisten merkuri yang memiliki potensi yang tinggi, dimana nantinya diharapkan dapat digunakan untuk mengatasi pencemaran oleh merkuri baik pada lahan pertanian maupun daerah perairan.
Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mengisolasi bakteri resisten merkuri dari Ekosistem Air Hitam Kalimantan
Tengah.
2. Melakukan pengujian aktivitas merkuri reduktase terhadap isolat terpilih.
3. Melakukan identifikasi terhadap isolat yang mempunyai aktivitas merkuri
TINJAUAN PUSTAKA
Merkuri
Pelepasan merkuri dan senyawa merkuri dari sumber antropogenik dan
geogenik telah menyebabkan pencemaran air, tanah, sedirnen dan atmosfer. Merkuri
dan senyawa merkuri toksisitasnya sangat tinggi karena reaktif terhadap gugus
sulfihdril pada molekul-molekul yang aktif secara biologi, sehingga menyebabkan
molekul-molekul tersebut tidak aktif. Selain itu jika telah mas& lingkungan, polutan
merkuri cepat tersebar luas karena mobilitasnya sangat tinggi dan dapat terkonsentrasi
melalui rantai makanan (Chang et al. 1999).
Transformasi merkuri di alam dapat terjadi secara biologi dan non biologi
seperti yang ditunjukan pada Tabel 1 dibawah ini.
Tabel 1 . Mekanisme transformasi merkuri (Barkay, 1992).
Reduksi Hg2+ Demetilasi Metilasi
Biologi Enzimatik : Enzimatik: Transfer gugus metil
Merkuri reduktase Organomerkurial oleh korinoid koenzim
Iiase (bakteri)
Tidak langsung:
reduksi metabolit Sintesis metionin
(fungi)
Non biologi Radikal bebas Protonolitik pada Asarn humik dan hlfik berasosiasi dengin ikatan C-Hg (reaksi
senyawa humik sangat lambat) Fotolisis
Metilasi CH3Hg'
menjadi (CH3)zHg
dengan adanya H2S
Merkuri di alam terdapat dalarn empat bentuk yaitu H ~ O atau logam merkuri,
ion merkuri
( ~ 2 3 ,
alkil merkuri (metil merkuri dan dimetil merkuri) dan sebagai [image:84.559.79.496.425.618.2]disebabkan oleh : ( I ) afinitas yang tinggi dari H$ dan organomerkuri terhadap gugus
thiol, (2) kecenderungan untuk membentuk ikatan kovalen dengan molekul organik,
(3) stabilitas yang tinggi dari ikatan Hg-C yang menyebabkan afinitasnya rendah
terhadap oksigen dm, (4) memiliki kecenderungan yang kuat untuk memaksimalkan
ikatan 2 ligan dalam struktur kimia linier (Barkay, 1992).
Merkuri di atmosfer berada dalam bentuk gas atau diabsorpsi menjadi partikel
(Hapl). Fraksi gas terdiri dari H$, C H ~ H ~ + , Hg2+, (CH3)zHg dan bentuk terklorinasi.
Keberadaan merkuri di atmosfer tergantung pada kondisi fisikokimia atmosfer. Pada
kondisi masam, H$ teroksidasi oleh H202 (terbentuk dari reaksi Hz0 dengan 03)
menjadi Hg2+ dengan reaksi yang sangat lambat. Selanjutnya dengan adanya
penambahan H~~~ ke sedimen, H~~~ ini akan mengalami metilasi dengan
methylocobalamin (B 12) sebagai donor menjadi metil merkuri yang merupakan
bentuk yang sangat stabil. Proses metilasi merkuri dapat juga terjadi oleh bakteri
yang terdapat pada insang, perut ikan atau organ ikan yang lain secara langsung. Pada
sedimen mikroorganisme aerob sebagaimana juga mikroorganisme anaerob, dapat
juga membentuk metil merkuri (Silver dan Kinscherf, 1982). Metil merkuri
meningkat dengan meningkatnya tempera- dan konsentrasi H$+ dan optimal pada
pH <5. Reaksi metilasi merkuri distimulasi oleh adanya ion logam seperti Fe3+, Fe2+,
cu2+, h4n2+, dan ~ l ~ + yang bertindak sebagai katalis (Barkay, 1992). Mekanisme lain adalah pembentukan HgS dari H$+ oleh suwate reducing bacteria (SRB) yang sangat
tidak larut. Bentuk HgS ini hanya dapat larut dalam alkalin dan asarn. Fotosolubilitas HgS menjadi H$ terjadi dibawah cahaya dengan panjang gelombang <650 nm
Mekanisme Detoksifikasi Merkuri
Bakteri resisten merkuri terdistribusi secara luas di alam yang terdiri dari
bakteri Gram positif dan Gram negatif. Beberapa contoh bakteri resisten merkuri ..
-
Gram negatif adalah Serattia marcescens, Klebsiella sp., Thiobaccilus ferooxidans,
Alcaligenes euthropus, Acinetobacterium erwinia dan bakteri Gram positif yaitu:
Staphylococcus aureus, Group B Streptococcus, Streptomyces sp., Bacillus sp., dan
Mycobacterium scofilaceum. Diantara strain bakteri yang resisten terhadap merkuri
inorganik, h a n g lebih 10-30% juga toleran terhadap senyawa organo merkuri
(Barkay, 1992). Bakteri spektrurn luas yang juga toleran terhadap organomerkuri
(seperti fenilmerkuri asetat, PMA), mempunyai gen tambahan yaitu merB pada
operon mernya yang menyandi enzirn organomerkurial liase, yang mengkatalisis
pemecahan ikatan C-Hg (Bogdanova, 1998; Gupta el al., 1999).
Proses detoksifikasi merkuri secara umum terdiri dari dua tahap. Tahap
pertama, senyawa organomerkun didegradasi melalui pemecahan secara katalis ikatan
C-Hg oleh organomerkurial liase, yang merupakan produk dari merB. Pada tahap
kedua, ion merkuri hasil dari tahap pertama direduksi secara enzimatik dengan
menggunakan enzim merkuri reduktase (hasil dari merA) dan mengkonsumsi
NADPH. Hasil akhir bempa logam merkuri (Silver dan Kinscherf, 1982; Misra,
1992). Proses tersebut oleh Gadd (1990) digambarkan sebagai berikut:
Organomercurial liase
Fenil merkuri benzena
C H J H ~ +
-
CHqt
+
H ~ ~ +c2EI5ESg+
-
~ 2t
~+
~8
6Etil merkuri etana
Gambar 1. Proses detoksifikasi merkuri pada b&teri resisten merkuri (Gadd, 1990).
Menurut klasifikasi enzim secara internasional merkuri reduktase ditempatkan
dalam kelas 2 (oksidoreduktase), )iaitu enzim yang d g k a t a i s i s naksi pemindahan elektron. Organomerkurial liase merupakan enzim kelas 4 (liase), yaitu enzim yang
mengkatalisis reaksi penambahan gugus ke ikatan ganda atau sebaliknya
(Lehninger, 1982).
Tabel 2. Klasifikasi enzim secara internasional berdasarkan atas reaksi yang dikatalisis (Lehninger, 1982)
Bakteri resisten meriiuri merupairan rnikroorganisme prokariot dan gen resisten ditemukan pada plasmid atau transposon (Ravel et al., 2000). Operon terdiri
dari 3 sarnpai 4 gen struktural dan 2 gen yang menyandikan fungsi regulasi yaitu
merR dan merD.
Struktur
dari operon mer terdiri dari merA yang menyandi subunitmerkuri reduktase, merT menyandi protein transport untuk FIg2+ yang ditemukan
berasosiasi dengan membran sitoplasma, merP yang menyandi pmtein pencari Eig2+
yang terletak pada pemukaan Ijeriplasmik dan merB yang menyandi subunit
Jenis reaksi yang dikatalisis Pemindahan elektron
Reaksi pemindahan gugus fungsional
Raksi hidrolisis (pemindahan gugus hgsional ke air) Penambahan wgus ke ikatan ganda atau sebaliknya
Pernindaha'n gugus di dalam mdekul, rnenghasilkan bentuk isomer Pembentukan ikabn
C-C,
C-S, C-0, dan C-N oleh reaksi kondensasi yang behitan dengan penguraian ATPNo .
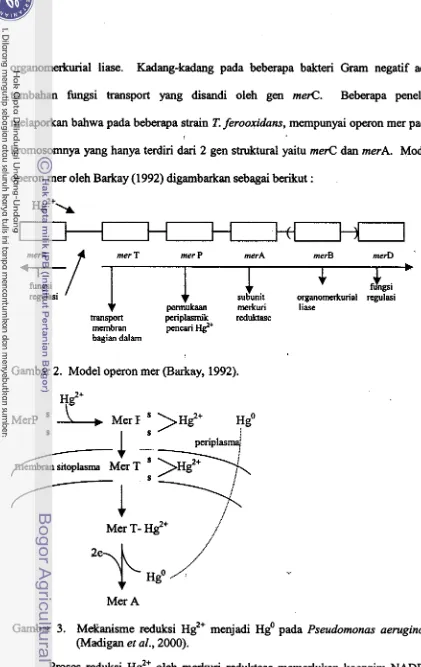
[image:87.524.61.491.46.716.2]o r g a n o m e ~ a l liase. Kadang-kadang pada beberapa bakteri Gram negatif ada
tambahan fhgsi trimsport yang disandi oleh gem merC. Beberapa peneliti
melaporkan bahwa pada bebaapa strain
T.
ferooxidans, mernpunyai operon mer padakromosomnya yang hanya terdiri dari 2 gen struktural yaitu merC dan merA. Model operon mer oleh Barkay (1 992) digambarkan sebagai bedcut :
+
merR mer T mer P merA merB merD
b
fungsi
-/
regulasiv
organomericurial regulasiwmukaan merkuri liase
m & r t &riplasmik reduktase membran pencari H$+
[image:88.515.36.457.35.702.2]bagian dalam
Gambar 2. Model operon mer (Barkay, 1992).
MerP
'
,Lb
Mer F>
H ~ ~ +S S
yo
I
periplasmjMer T-
li@+
ii'
Mer A
Gambar 3. Melimisme d u k s i H~~~ menjadi Elgo pada Pseudomonas aeruginosa (Madigm et al., 2000).
Proses reduksi
H ~ ~ +
oleh m e h u i reduktase memeriukan koenzimNADPH.
1992; Shadhukhan, 1997). Mekanism~, kerja merkuri reduktase diduga melalui transfer elektron dari NADPH via FAD untuk mereduksi bagian sistein yang aktif,
kemudian sistein .
-
diubah menjadi dua bentuk sistein yang bergugus fimgsi SH. Satu- ..-
dari bentuk sistein ini membentuk muatan koinpleks transfer dengan FAD. Bagian aktif dari sistein kemudian mereduksi
HC
menjadi C-terminal sistein, membentuk H~O. Merkuri reduktase biasanya berada dalam bentuk monomer, dimer, dan trimer, meskipun secara in vivo yang aktif adalah struktur dimer (Gadd, 1990).L- Faktor-faktor yang Mempengaruhi Aktivitas Enzim
Faktor-faktor utarna yang mempengaruhi aktivitas enzim adalah konsentrasi
enzim, subtrat, produk, senyawa inhibitor dan aktivator, pH dan jenis pelarut yang terdapat pada l i n m g a n , kekuatan ion dan suhu. Pembentukan komplek
enzimsubtrat (ES) membatasi kecqatan reaksi enzimatis. Kecepatan reaksi enzim
maksirnurn dicapai pada tingkat konsentrasi subtrat yang sudah mampu mengubah
seluruh a i m menjadi komplek ES pada keadaan lingkungan yang memunglunkan.
Pada konsentrasi subtrat dibawahnya reaksi enzim tergantung pada konsentrasi subtrat yang ditambahkan dan pada konsentrasi subtrat diatasnya kecepatan reaksi en&
tidak tergantung pada konsentrasi subtrat (Suhartono, 1989).
Beberapa penelitim menunjukan bahwa beberapa organisme mempunyai 2
sistem enzim pada subtrat yang sama. Sistem yang pertama relatif mempunyai
afinitas yang rendah terhadap subtrat dan digunakan jika subtrat tersedia dalarn
jumlah yang cukup banyak. Sebaliknya pada sistem yang kedua enzim diproduksi jika
pasolcan subtrat rendah. Enzinl ini mempunyai a h i t a s yang sangat tinggi terhadap senyawa target. Organisme ini mampu mencari subtrat pada konsentrasi yang ekstrim
digwakan sxara tidak efisien, tetapi pada kondisi -b&an yang jelek mungkin
enzim digmakan lebih efisien. Adanya dua sistem enzim yang berlawanan ini belum
digelajari pengaruhnya pada teknologi bioremediasi, sebagai contoh suatu problem
yang
dihadapi pada penerapan beberapa xenobiotik dimana senyawa target gaga1menginduksi sistem enzim yang penting (Skladany dan Metting, 1993).
Studi aktivitas enzim sebagai fimgsi pH bertujuan
untulc
mempelajari reaksi enzimatis pada k d i s i alami dan untuk mengetahui kondisi yang paling efisien untuk apiikasi enzim dalarn praktek. Kisaran keaktifan enzim dapat mencltpai pH 5-
9 atau konsentrasi ion hydrogen 10-~-10-~! (Suhartono, 1989)..
Hasil penelitian Chang et al. (1990) menunjukan bahwa aktivitas enzim merkuri reduktase dari bakteri Escherichia c d i PWSl optimum pada pH sekitar netral (7-7,s) dan pada suhu 37°C. Perubahan kecepatan reaksi enzim akibat fungsi dari pH dikarenakan oieh 3 ha1 sebagai berikut :(1) protonasi pada bagian aktif rantai asam amino pada kompleks ES mungkin berubah, (2) perubahan muatan ion pada molekul subtrat atau perubahan bagian aktif kedua molekul untuk membentuk kombinasi ES, (3) perubahan pH dari netral mugkin melemahkan kekuatan stabilitas protein, yang mempercepat proses dmaturasi enzim (penurunan aktivitas yang tidalc bisa balik) pada suhu pengujian (Staufer, 1989).
Pengaruh suhu terhadap aktivitas enzim adalah mempengaruhi energi untuk mengkatalisis reaksi clan pengaruh terhadap kecepatan denatusasi enzim. Peningkatan suhu dalam reaksi enzimatis mengakibatkan dua ha1 yaitu meningkatnya kecepatm reaksi enzim dan meningkatnya kecepatan denaturasi enzim. Setiap 9rsnaika.n suhu sebesar 10°C mengakibatkan peningkatan kecepatan reaksi enzim dua kali lipat, sedangkan kecepatan inaktivasi enzim meningkat 64 kali lipat. Peningkatan ini tidak sama untuk setiap percobam yang diiakukan, tergantung pada larnanya
waktu penguj ian (Staufer, 1989).
Tanah Sebagai Habitat Mikroba
Habitat ekologi adalah tempat atau lokasi yang pada keadaan m a 1 dihuni
oleh organisme tertentu (individu atau populasi). Tanah merupakan habitat yang
komplek dan mempunyai rasio padat dan cair yang tinggi, yang membedakan dari
habitat alami yang lain. Tanah dapat merupakan habitat
yang
baik atau burukuntuk
e o b a
Tanah
merupakan habitat yang buruic apabila secara umumkeadaan
nutrisiuntuk mikroba tidak tersedia dengan baik, khususnya ketersediaan karbon
dan
sumberenergi.
Tanah-tanah yang memiliki kondisi lingkungan yang ekstrim (ketersediaanair, suhu, radiasi, nutrisi, tekanan osmotik) kadang-kadang juga kondddif untuk
perturnbuhan miboba. Tanah lebih banyak mengandung genus dan spesies mikroba dibanding habitat lainnya (Wuertz dan Mergeay, 1997).
Aktivitas d m pertumbuhan mikroorganisme sangat dipengadi oleh faktor
fisik dan faktor kimia. Faktor fisik meliputi suhu, tekanan osmotik, , tegangan
pennukaan, viskositas dan radiasi, sedangkan faktor kimia adalah pH, halitas dan
v
kuantitas bahan organik, gas, zat pemacu dan pengharnbat tumbuh serta potensiai
reduksi
dm oksidasi. B h r a p a lingkungan perrnukaan tanah d m sebagian besar lapisan subsoiladdah
lingkungan oligotropikyang
kandungan nutrisinya rendah.Hasil studi menunjukan bahwa jika nutrisi terdapat dalam komentrasi
rendah,
makasecara
umum
yang d q a t hidup adalah bakteri yang telah berkembangdalam
lingkungan oligothropik, yang mampu menerima dan mengambil senyawa organik
yang lebih bervarisi pada konsentrasi rendah. Mikroba h l e h jadi merupakan
organisme yang nlempunyai adaptasi paling tin& baik secara fisiologi maupun
genetik pada berbagai kondisi yang beragam, selain itu bakteri telah ada kurang lebih
Ekosistem Air Hitam
Ekosistern Air Hitam (black water ecosystem) merupalran sungai atau danau
yang memiliki air berwarna hitam jemih, tidak berbau, terbentuk melalui proses
.
-
- ..-
ribuan tahun, kaya bahan organ& dan dipengaruhi baik langsung maupun tidak
langsung oleh lahan garnbut. Derajat keasaman (pH) baik air maupun sedimen
ekosistem air hitarn sangat rendah, yaitu berkisar antara 3-4, kandungan senyawa
toksik yaitu H2S 1000 kali dan fen01 300 kali baku mutu air yang dipersyaratkan
untuk biota air. Konsentrasi logam berat (Mn, Cu, dan Pb) 3-30 kali lipat diatas baku
mutu air, BOD rendah tetapi COD tinggi (40-100 m g ) , minyak dan lemak 8,5-12,98 mgtl (Tim Amdal IPB, 1996).
Lingkungan ekstrirn dan unik seringkali menyirnpan potensi luar biasa yang bisa dikembangkan baik untuk kepentingan industri, pertanian maupun kesehatan.
Dunia mikroba menyumbang potensi ekonomis terbesar dibanding kelompok-
kelompok organisme lainnya, karena keragamannya yang sangat tinggi, kemampuan
untuk hidup dan bertahan pada berbagai kondisi ekstrim, perkembangbiakan yang
cepat, kemampuan untuk menghasilkan produk dalam laju dan konsentrasi tinggi serta
sifat fisiologis yang relatif mudah dikendalikan dan dimanupulasi. Melihat
kemaxnpuan bakteri untuk hidup dalam suasana ekstrim maka kemungkinan akan dapat diisolasi enzi~~-enzim yang mampu bertahan dan bekerja normal dalam suasana
BAHAN DAN METODE
Tempat dan Waktu - ' -'-
Penelitian ini dilakukan di Laboratorium Mikrobiologi dan Bioteknologi Lingkungan PPLH, IPB, Laboratorium Pusat Antar Universitas Biotehlogi, IPB dan Laboratorium Biologi Tanah Jurusan Tanah Faperta, IPB. Penelitian dilaksanakan dari bulan Februari 200 1 sampai dengan Februari 2002.
Bahan dan Alat
k h a n
Bahan-bahan yang digunakan dalam penelitian ini adalah sampei tanah dan
Ekosistem Air Hitam Kalimantan Tengah, media LB (1% Tryptone, 0.5% ekstrak yeast,
0.5% NaCI), media LA (LB + 1.5% Agar), HgC12, NADPH, NaH2P042H20, N ~ ~ H P O ~ ,
EDTA, MgC126H20, f3-merkaptoetanol, Bovine Serum Albumin, Comassie Blue,
glukosa, NaOH, HCl (sigma). Semua bahan kimia yang digunakan dalam penelitian ini
berspesifikasi pro-analisis (pa), Microbact 24E (Medvet Science PTY, Ltd, Adelaide,
Australia), Isolat ICBB 1506, ICBB 1507, ICBB 1508 dan ICBB 15 12 yang diperoleh
dari koleksi Indonesian Center for Biodiversity and Biotechnology (ICBB).
Alat
Alat-alat yang digunakan dalarn penelitian ini adalah : alat-alat standar
vortek, spektrofotometer (Jenway 6 100 spectrophotometer), sentrikce ultra (Beckman
L8-M Ultracentrifbge), sonicator (Ultasonic Processor VDX, Inc),
UV
transluminator(UVP, Inc), incubator, mikroskop. - .
. -
-
Metode
Isolasi Bakteri Pereduksi Merkuri
Sumber isolat berupa sampel tanah dan sedimen dari Ekosistem Air Hitarn,
Kalirnantan Tengah. Sebanyak 1 gram sampel disuspensikan dalam larutan garam
fisiologis (0,85% NaCl) sampai homogen dan dilakukan pengenceran hingga lo4, lalu
dicawankan pada media LA
(LB
+
1.5% agar) dengan kandungan HgC12 20 pglrnl dandiinkubasi selama 3 hari pada suhu 37°C. Koloni-koloni bakteri yang b e e
kenampakannya secara visual ditumbuhkan kembali pada media yang samh dengan
kandungan HgC12 20 pglml. Bakteri-bakteri yang dapat tumbuh pada media ini
merupakan bakteri resisten merkuri. Isolat yang diperoleh ini kemudian disimpan pada
agar
miring dengan suhu 8°C sampai 10°C serta pada kompos dan gliserol20% pada suhu-20°C.
Seleksi Isolat Pereduksi Merkuri
Isolat-isolat yang diperoleh pada tahap isolasi ditumbuhkan kembali pada 30 ml
kandungan HgC12 bertingkat (50, 100, 200, 300, 400, 500 dan 1000 pgfml) secara serentak. Setelah inkubasi selama 3
hari,
maka isolat-isolat yang mampu tumbuh pada konseiitrasi HgClz tertinggi adalah merupakan isolat unggul yang akan diuji ddivitasmerkuri reduktasenya.
Persiapan Filtrat Ennm
Isolat yang akan diuji aktivitas merkuri reduktasenya diturnbuhkan pada 50 ml media cair LB (HgC12 50 pg/ml) yaitu dengan menambahkan 0,s ml isolat dengan OD (optical density) 0,s-0,6 (620
nm)
yang berumur 24-48 jam. Sel dipanen setelah inkubasi 24 jam (digoyang) dengan cara disentrifbs pada kecepatan 15000x rpm (BeckmanL8-M)
selama 20 menit, suhu 4°C. Supernatan dibuang, lalu sel disuspensikan kembali dengan 30 ml sodium fosfat (Nap) buffer pH 7,O. Suspensi sel tersebut kemudian disonikasi selama 60 detik dengan ultrasonic processor (600 watt, amplitude 50%). Setelah itu disentrih kembali pada kecepatan 1 5 0 0 0 ~ rpm selama 30 menit pada suhu 4°C. Supernatan dipindahkan ke dalam botol bersih dan steril secara hati-hati menggunakan pipet pasteur lalu diberi label.
Pengukuran Kadar Protein
Kadar
protein pada larutan bebas sel (ekstrak enzimkasar)
diukur dengan metode Comassie Blue (Bradford). Standar protein menggunakan bovineserum
albumin (BSA) pada kisaran 0,l-1,O mg proteidml.Pengujian Aktivitas Merkuri Reduktase pada Berbagai Konsentrasi HgClz
Aktivitas merkuri redulrtase diukur berdasarkan oksidasi NADPH pada h 340 rim
dilabkan okh Ogmseitan (1998) yaitu dengan menggunakan 3 ml larutan MRA
{mercury reductwn assay) yang mengandung 50
m M
larutan buffer Nap pH 7,4,500 pMEDTA,
2.00 @M MgC126Hfl, 0,1% (voVvol) 9-merkaptoetanol, dm 0,lm M
NADPH.Pada lamtan
hrlRA
tersebut kemudian ditambahkan 0,s mi ekstrak enzim kasar darimasing-masing isolat. HgC12 yang ditambahkan sesuai dengan perlakuan yang dicobakan, yaitu 50,100,200,300,400,500 dan 1000 pg/ml. Inkubasi dilakukan selama
60 menit pada suhu 37C. Pengukuran dengan spektrofotometer pada h 340 nm
dilakukan pada saat ditambahkan enzim dan setelah inkubasi 60 menit untuk mengetahui
NADPH
awal dan NADPH akhir sehingga dapat diketahui jumlah NADPH yangteroksidasi. Kadar NADPH ditentukan dengan rumus : [NADPH] = -8,498 + 347,28
(r = 0,9925), yang diperoleh dari kurva standar NADPH. Satu unit aktivitas didefinisikan
sebagai jumlah NADPH yang teroksidasi per rng protein per rnenit (pM NADPWmg
proteinlmnt)
.
H ~ ~ * NADPH
-+
diukur
OD
pada h 340Merkuri r e d u k e
NADP
Pengukuran Kinetika Enzim
Untuk mengetahui kinetika enzim, pengukuran absorbansi pada h 340
nm
dilakukan setiap 4 menit selama 60 menit inkubasi. Pengujian aktivitas merkuri reduktase difakukan dengan larutan MRA yang mengandung HgC12 50 pg/ml dan inkubasi pada 37°C.Pengujian Aktivitas pada Suhu Inkubasi Berbeda
Aktivitas merkuri reduktase ditentukan dengan larutan MRA seperti tersebut di atas pada konsentrasi HgC12 50 pg/ml. Inkubasi dilakukan pada suhu 2TC, 37"C, 50°C
dan
70°C.Pengujian Aktivitas pada pH Larutan MRA Berbeda
Aktivitas merkuri reduktase ditentukan pada pH larutan
MRA
yang berbeda yaitupH 5, 7 dan 9 dengan cara menambahkan HCl atau NaOH pada larutan MRA.
Konsentrasi HgC12 pada larutan MRA 50 &ml dan inkubasi pada 37°C selama 60
menit.
Penggunaan NADH Sebagai Koenzim
Komposisi larutan MRA sarna seperti di atas, hanya penggunaan NADPH diganti NADH dengan konsentrasi 0,2 mM. Prosedur pengujian aktivitas merkuri reduktase dilakukan pada konsentrasi HgC12 0, 25, 50, 100, 150,
dan
200 pg!ml. Inkubasidilakukan pada suhu 37°C selama 60 menit. Pengukuran dengan spektrofotometer (340
mengetahui NADH awal dan NADH akhir sehingga dapat diketahui jumlah NADH yang teroksidasi. Kadar NADH ditentukan dengan rumus : WADHI = -1 1,4
+
382,82 (r = 0,99 19), yang diperoleh dari kurva standar NADH. Satu unit aktivitas didefinisikansebagai jumlah NADH yang teroksidasi per mg protein per menit (pM NADWmg
proteinlmnt).
Identifikasi Isolat Unggul
Ciri morfologi dan ciri mikroskopi yang diamati meliputi bentuk koloni, warna
koloni, bentuk tepian, diameter koloni, bentuk sel dan motilitas, serta dilakukan
pewarnaan
gram
dan foto mikroskopi bakteri pada perbesaran 400 kali. Ciri-ciri fisiologi (biokimia) diuji dengan kit Microbact 24E (Medvet SciencePty,
Ltd, Adelaide,Australia). Kit Microbact 24E terdiri dari 24 sumur reaksi pengujian biokimia ditambah
uji oksidase, nitrat
dan
motilitas. Biakan yang akan diamati ciri fisiologisnyaditurnbuhkan pada media agar LB. Sebanyak satu lup biakan disuspensikan ke dalarn
larutan gararn f~iologis (NaCI 0, 85%). Kemudian 200 pl suspensi kultur diteteskan ke
dalarn sumur-sumur kit Microbact. Setelah diinkubasi
semalam
pada suhu 3TC,ke
dalarn setiap sumur ditetesi reagen yang sesuai dengan uji yang dilakukan. Reaksi yang
terbentuk dibandingkan dengan standar. Uji katalase dilakukan dengan menumbuhkan isolat
pada
media NA. Hidrogen peroksida 3% diteteskan pada kaca obyek, kemudianHASIL DAN PEMBAHASAN
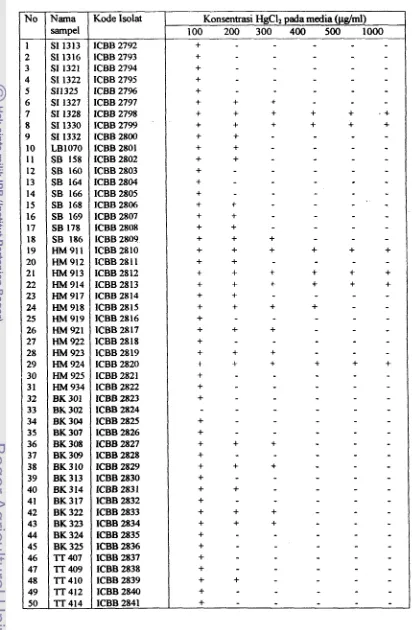
Isolasi dan Seleksi Bakteri Pereduksi Merkuri
Penelitian ini menghasilkan bakteri pereduksi merkuri sebanyak 91 isolat
dari 210 sampel tanah yang diisolasi. Dari 91 isolat ini kemudian diseleksi dan
diperoleh 59 isolat yang dapat tumbuh pada konsentrasi HgC12 100 p g / d atau lebih
Menurut Barkay (1992), bakteri resisten merkuri dapat tumbuh pada media dengan
kandungan merkuri 10 M m l atau leblh, sedangkan bakteri yang sensitif hanya
mampu tumbuh pada range 0,2 pglml merkuri. Selanjutnya Hongri (1996),
mengunglcapkan bahwa pada bakteri resisten merkuri konsentrasi intraselluler
tidak pernah sampai jenuh, sebab secara terns menerus
~f
direduksi menjadi H ~ O ,Pada bakteri sensitif merkuri ditimbun pada sitoplasma. Hasil seleksi selengkapnya
disajikan pada Tabel 3. Hasil seleksi dari 59 isolat ini diperoleh 7 isolat unggul,
yaitu mampu tumbuh pada media dengan konsentrasi HgC12 1000 pgfml. Hasil penelitian Frismuth et al. (1993), dari 28 isolat yang dicoba diperoleh 10 isolat yang
toleran pada HgC12 50 Mml, pada konsentrasi HgC12 75 pg/ml tidak ada yang tumbuh. Selanjutnya isolat-isolat yang
akan
diuji aktivitas merkuri reduktasenya adalah ICBB 2798,l CBB 2799, ICBB 2810, ICBB 2812, ICBB 2813, ICBB 2820,ICBB2847 ditambah 4 isolat dari koleksi Indonesian center for Biodiversity and
Biotechnology (ICBB) hasil isolasi Handayani (200 I), yaitu ICBB 1507, ICBB 1508
Tabel 3. Hasil seleksi bakteri pereduksi merkuri
Konsentrasi HgCI2 pada media (Wml)
100 200 300 400 500 1000
+
+
-
+
-
+
-
+
-
+
+
+-
-
+
+
+
+
+
.+
+
+
++
+
+
+
+
+
+
-
-
+
+
-
-
+
+
-
-
+
--
+
+
+
+
+
+
-
+
+
+
-
-
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
-
-
-
-
+
+
+
+
-
-
+
+
+
++
-
+
+
+
+
+
++
+
+
+
+
+
-+
-
+
-
-
+
+
+
-
-
+
-
-
+
+
+
-
-
+
-
-
+
+
-
-
-
+
-
-
+
+
+-
+
+
+
-
+
-
-
+
-
-
-
+
-
-
+
-
-
+
+
-
-
+
-
-
+
-
Kode Isolat
ICBB 2792 ICBB2793 ICBB 2794 ICBB 2795 ICBB 27% ICBB 2797 ICBB 2798 ICBB 2799 ICBB 2800 ICBB 2801 ICBB 2802 ICBB 2803 ICBB 2804 ICBB 2805 ICBB 2806 ICBB 2807 ICBB 2808 ICBB 2809 ICBB2810 ICBB2811 ICBB2812 ICBB 2813 ICBB2814 ICBB2815 ICBB2816 ICBB2817 ICBB2818 ICBB 2819 ICBB 2820 ICBB 2821 ICBB 2822 ICBB 2823 ICBB 2824 ICBB2825 ICBB 2826 ICBB 2827 ICBB 2828 ICBB 2829 ICBB 2830 ICBB 2831 ICBB 2832 ICBB 2833 ICBB 2834
ICBB 2835
ICBB 2836 ICBB 2837 ICBB 2838 ICBB 2839 ICBB 2840 ICBB 2841 No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 Narna sampel SI 1313 SI1316 SI 1321 SI 1322 SI1325 SI 1327 SI 1328 SI 1330 SI I332 LB1070 SB I58 SB 160 SB 164 SB 166 SB 168 SB 169 SB 178 SB 186 HM911 HM912 HM913 HM914 HM917 HM918 HM919 HM921 HM922 HM 923 HM 924
HM 925 HM 934 BK301 BK302 BK 304 BK307 BK308 BK309 BK310 BK 313 BK 314 BK 317 BK322 BK323 BK324 BK 325
[image:100.564.82.494.109.739.2]Aktivitas
Merkuri Reduktase pada Berbagai Konsentrasi
HgClz. .
Hasil uji aktivitas
enzim
menunjukan bahwa isolat ICBB 15 12 mengoksidasiNADPH paling tinggi dibanding isoiat lain, yaitu 30,05 pM tanpa HgC12 dan
151 :
52 53 54 55 56 57 58 59
oksidasi tertinggi 96,61 pM pada konsentrasi H&12 300 pglml
untuk
setiap 0,23 mgTT415 TR1162 TR1164 : TR1167 TR1169 TR1173
BK 303 LU 522 LU 523
ICE382842
1
ICBB 2843 ICBB 2844 ICBB 2845 ICBB 2846 ICBB 2847 E B B 2848 ICBB 2849 ICBB 2 8 0piatein yang ditambahkan. Isoiat ICBB 2813 mengoksidasi NADPH 20,14
pM
-
-
-
-
-
1
+
+
+
-
-
-
+
+
+
-
-
-
+
-
-
-
+
-
-
-
+
+
+
+
+
+
+
+
-
-
-
+
-
-
-
+
-
-
-
-
-
pada kontrol dan oksidasi NADPH tertinggi pada HgC12 200 p g h l yaitu sebesar
93,42
pM
untuk setiap 0,084 mg protein yang diberikan. Selmjutnya pada isolatICBB 2810 sebesar 19,80 p M NADPH yang teroksidasi pada kontrol dan tertinggi
87,% pM pada konsentrasi
H&i2
200 pg/ml untuk setiap 0,176 mg protein yangdiberikan. Sdanjutnya bexbmt-turut dadi yang mengobsidasi NADPH lebih besar
adalah isolat E B B 2820, ICBB 1506, ICBB 2798, ICBB ICBB 2847, ICBB 2812,
ICBB
2799,
ICBB
1507 dm ICBB1508 (Tabel 4). Hal tersebut sejalan dengan hasilpenelitian Handayani (2001) bahwa isdat ICBB 1512 dapat mereduksi
HC
palingbesar dibanding isdat lain yaitu sarnpai dengan 993%.
Merkuri
red&= yang dikode olehen
merA mereduksi ion Hg? menjadi H$ yang tergantung pada reaksi NADPH sebagai sumber kekuatan reduksi (Remex et al. 1994; Bogdanova et al.*
Tabel 4. Hasil uji aktivitas enzim pada berbagai konsentrasi HgCI2
Kode lsolat
ICBB 1506 ICBB 1507 ICBB 1508 ICBB 151 2 ICBB 2798 ICBB 2799 ICBB 2810 ICBB 2812 ICBB 281 3 ICBB 2820 ICBB 2847
Jumlah protein ditambahkan
( m a
0.160 0.127 0.078 0.230 0.250 0.236 0.176 0.281 0.084 0.093 0.157 Total protein terekstrak (mdml) 0.324 0.254 0.156 0.460 0.503 0.472 0.352 0.562 0.168 0.1 87 0.31 3 *
Konsentrasi HgCb (uglml) 0 NADPH terokddasi (uM) 23.53 29.54 23.09 30.05 45.60 33.34 19.80 21.88 20.14 11.11 21.88 50 AkMtaa
S p M k
Hasil pada Tabel 4. menunjukan bahwa aktivitas spesifik yang paling tinggi
\
adalah isolat ICBB 2813, yaitu sebesar 18,53 pM NADPH mg-'mnt-' pada konsentrasi HgC12 200 pg/ml. Selanjutnya ICBB 1508, ICBB 2819, ICBB 1507, ICBB 1506, ICBB 2847, ICBB 2810, ICBB 1512, ICBB 2799, ICBB 2798 dan
ICBB 2812. Disini terlihat bahwa isolat ICBB 15 12 clan ICBB 2810 walaupm dapat mengoksidasi NADPH lebih besar, narnun aktivitas spesifihya kecil yaitu
masing-masing 7,00 untuk ICBB 1512 pada HgC12 300 pg/ml dan 5,05 untuk ICBB 2810 pada HgC12 200 pg/ml. Hal ini disebabkan kadar protein pada larutan ekstrak enzirn kasar (crude extract) yang ditambahkan besar yaitu 0,23 mg untuk isolat ICBB 15 12 clan 0,176 mg untuk ICBB 28 10. Isolat ICBB 1508 yang mengoksidasi
NADPH terendah dibanding isolat lain mempunyai aktivitas yang lebih tinggi, karena jurnlah protein yang ditambahkan untuk setiap satuan ekstrak enzirn lebih kecil yaitu hanya 0,078 mg. Hasil penelitian Ogunseitan (1998) menunjukan pada konsentrasi protein yang lebih tinggi maka NADPH yang teroksidasi juga lebih tinggi yaitu pada konsentrasi protein 0,015 pdpl <0,03 1 pg/p.l ~ 0 , 0 6 3 pg/@ ~0,0125 pg/pl <O7O25pg/pl <0,05 pg/pl.
Isolat ICBB 1506, ICBB 1508, ICBB 2798, ICBB 2810, ICBB 2812, ICBB
281 3, ICBB 2820,dan ICBB 2847 mempunyai aktivitas maksimurn pada konsentrasi
H g Q 200 pg/ml dengan aktivitas berhuut-turut adalah 9.08; 17,5 1; 5.74; 8.33; 5.05;
18.53; 15.66 clan 9.03 pM NADPH mg-'mnt-I . Isolat ICBB 1507 pada konsentrasi 400 p@ml HgC12, ICBB 1512 pada 300 pg/ml HgCh dan ICBB 2799 pada 100 pg/ml HgC12 dengan aktivitas berturut-turut sebesar 10,94; 7,00 dan 5.94; ph4
1/
NADPH mg-'mf' (Gambar 5). Chang et al. (1999) melaporkan bahwa padaGarnbar 5. Aktivitas spesifik
merkuri
reduktase dari (a) isolat ICBB 1506, ICBB 1507, ICBB 1508, ICBB 1512, ICBB 2798, ICBB 2810 dan (b) isolat ICBB 2799, ICBB 2812, E B B 2813, ICBB 2820, ICBB 2847, pada berbagai konsentrasi HgC12.; 20
18
16
14
E 12
c
10
3
G O 8
0
6
4
2
0
+
CBB 2799-t- ICBB 2812 +lCBB 2813. +K=BB 2820 4- 2847
Salah satu kriteria isolat unggul adalah yang mempunyai aktivitas tinggi
pada penambahan protein yang lebih kecil. Dari biteria ini maka isolat yang lebih
potensial dibanding isolat yang lain adalah isolat ICBB 2813, ICBB 1508, ICBB
2820, dan ICBB 1507. Isolat unggul juga dapat dilihat dari daya pereduksi yang
tinggi, dalam ha1 ini adalah yang dapat mengoksidasi NADPH tertinggi dalarn waktu
yang sama. Bila dilihat dari kriteria ini maka isolat yang Iebih potensial dibanding
isolat lain adalah ICBB 1512, ICBB 2813, ICBB 2810, ICBB 2820, sehingga
apabila dilihat dari dua segi maka isolat yang paling unggul adalah isolat ICBB
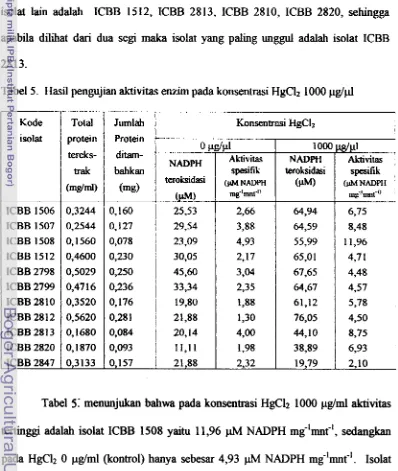
2813.
Tabel 5. Hasil pengujian aktivitas enzim pada konsentrasi HgC12 1000 pg/pl
Tabel 5: menunjukan bahwa pada konsentrasi HgCG 1000 pgml aktivitas tertinggi adalah isolat ICBB 1508 yaitu 1 1,96 pM NADPH mg-'mt-', sedangkan
pada HgClz 0 pg/ml (kontrol) hanya sebesar 4,93 pM NADPH mg-'mnt-I. Isolat Kode
isolat
ICBB 1506 ICBB 1507 ICBB 1508 ICBB 15 12 ICBB 2798 lCBB 2799 ICBB 2810 ICBB 281 2
ICBB 28 1 3
ICBB 2820 ICBB 2847 Total protein tereks- trak (mdml) 0,3244 0,2544 0,1560 0,4600 0,5029 0,4716 0,3520 0,5620 0,1680 0,1870 0,3133
Jumlah Konsentrasi HgClz
Protein
ditarn- 0 Pg/CII
NADPH
bahkan
/
teroksidasi
(mg)
1
(PM)
0,160
/
25,530,127
,
29,54I
0,078 1 23,09
0,230 ' 30,05
0,250
1
45,600,236
1
33,340,176
1
19,800,281 21,88
0,084
1
20.140,093
,
11,110,157 1 21,88
1000 P d ~ l
Aktivitas spesifik
( w ~ m p ~
mg"mt-l' 2,66 3,88 4,93 2,17 3,04 2,35 1,88 1,30 4,oo 1,98 2,32 NADPH teroksidasi
(w)
64,94 64,59 5599 65,Ol 67,65 64,67 61,12 76,OS 44,lO 38,89 19,79 Aktivitas spesifik (fl NADPHw"mnt")
6,75 8,48 11,96
4,7 1
[image:105.518.71.469.241.712.2]ICBB 2813 mempmyai aktivitas spesifik pada 1000 &ml sebesar 8,75 dari 4,00
phi NADPH ing-'nmt" tanpa HgC12 dan isolat ICBB 1507 sebesar 8,48 dari 3,88
phf
NADPH
mg-'mnt" tanpa HgC12. Pada Isolat ICBB 2874 aktivitas spesifik padakonsentrasi 1000 pglml scbesar 2,10 pM NNAW mg-'mnt-' dari 2,32 phf
NADPH
mg-lmnt-l tanpa HgC12, sehingga dapat diatakan pada isolat ICBB 2847 tidak ada
aktivitas merkuri red- pada konsentrasi 1000 pg/ml. Pada konsentrasi
HgCb
1000 pglml NADPH teroksidasi yang tertinggi terjadi pada isolat ICBB 2812, yaitu
76,05 pM, karena jumlah protein yang ditambahkan untuk setiap reaksi paling besar yaitu 0,281
mg
dari total protein terekstrak 0,562 mg/ml. Pada isolat ICBB 28 12,jumlah sel yang tumbuh pada umur 24 jam (waktu inkdasi) sudah cukup banyak,
ha1 ini juga terlihat dari kurva pertumbuhan isolat tersebut (Lampiran 3). Masil
penelitian Ogunseitan (1998), pada konsentrasi sel P. aeruginosa 1
o6
CFU ml-' totalprotein terekstrak 0,888 mgml sedang pada 10'~ CFU ml" sebesar 0,971 mg/ml.
Menurut Doubler et al. (2000), tingkat resistensi merkwi sangat tergantung pada
jumlah sel bakteri yang digunakan ddarn pengujian. Tingkat resistensi yang lebih
tin& ditemukan pada kepadatan sel yang lebih tinggi pada kapasitas medium yang sama.
Isolat ICBB 1506 dan isolat ICBB 1512 adalah isolat yang diisolasi dari Pongkor, Jawa Barat, sedangkan isolat yang lain adalah isolat dari Ekosistem Air
Hitarn Kalimantan Tengah. Kedua isolat tersebut mempmyai aktivitas spesifik yang
lebih rendah dibandingkan isolat ICBB 2813, ICBB 2820, ICBB 1508 yang diisolasi
dari Ekosistem Air Hitam Kalimantan Tengah, namun oksidasi NADPH tertinggi
Kinetika Merkuri Reduktase
Gambar 6. Kinetika merkuri reduktase pada konsentrasi HgCl2 50 Wml.
Kecepatan reaksi enzimatis
dipengaruhi
oleh konsentrasienzim,
konsentrasif
substrat,
pH,
suhu, telcanandm
fase reaksi enzimatis itu sendiri(Staufer,
1989).Pada
Gambar 6. terlihat bahwa kinetika merkuri reduktase untuk masing-masingisolat berbeda. Hal
ini
mungkm disebabkan kandungan protein dalam 0,sml
larutan ekstrak enzim kasar
yang
ditambahkan untuk setiap reaksi pada masing-masing isolat tidak sama yaitu: 0.16 mg untuk isolat
ICBB
1506, 0.127 mg isolatICBB
1507, 0.078 mg isolatICBB
1508, 0.23 mg isolatICBB
1512, 0.25 mg isolatICBB
2798, 0.176 mg isolatICBB
2810, 0.281 isolatICBB
2812, 0.084 mg isolatICBB
2813, 0.093 mg isolatICBB
2820,dan
0.157 rnguntuk
isolatICBB
2847.berkda-beda. Pada umur inkubasi 12-16 menit secara
umum
penurunan OD (optical density) pada h 340 nm telah mencapai maksimum, kecuali untuk isolatICBB 1508, ICBB 2813 dan ICBB 2820 mempunyai waktu purunan OD
maksimum lebih lama. Hal ini disebabkan kadar protein yang ditambahkan ke larutan MRA untuk reaksi enzimatis pada ke-3 isolat tersebut lebih kecil
dibandingkan isolat yang lain. Menurut Suhartono (1989), kecepatan reaksi
maksimum
(Vd)
buicanlah m q a k a n sifkt yang tetap dari enzim, Vd dapatditingkatkan dengan meningkatkan konsentrasi enzim dan mengubah faktor lingkungan.
Pengaruh pH terhadap Aktivitas Merkuri Reduktase
ICBB ICBB ICBB lCBB EBB EBB lCBB ICBB ICE8 ICBB ICBB
2810 2812 2813 2820 2847 1512 1508 2798 2799 1506 1507
Aktivhi merkuri d d d a s e dengan konsentrasi HgC12 50 pdml pada pH 5 semua isdat menunjukan aktivitas yang menurun, bahkan isolat ICBB 2812 dan E B B 2847 aktivitasnya nol. Pada pH 9 juga terjadi penurunan aktivitas untuk s m u a isolat. Isolat ICBB 1512, ICBB 2820 dan ICBB 2847 aktivitasnya masing-
masing hanya
.
9,14%; 9%dan
73% dari aktivitas maksimalnya (pH 7), sedangkan isolat yang lain berkisar antara 69,26% sampai dengan 88,28% +(Gainbar 7). Menunit Staufer (1989),penurunan
aMivitasenzim
akibat menurunnya pHdari
7 menjadi 4karena
protonasi dari beberapa gugus dalam enzim tidak mampu mengkatalisis reaksi, sedmgkan penwunan aktivitas pada pH yang lebih tin@ terjadi karena enzim mengalami denaturasi selama waktu inkubasi. Berdasarkanha1
tersebut maka dapat disimpulkan bahwa pH optimum merkuri reduktase dari semua isolat yang diuji berada pada &saran pH normal. Chang at al. (1999), mengungkapkan bahwa aktivitas merkuri reduktase dari Escherichia coli PWSl optimal pada pH 7,O-7,5, baik untuk enzim yang termobilisasi maupun enzim yang terlarut
.
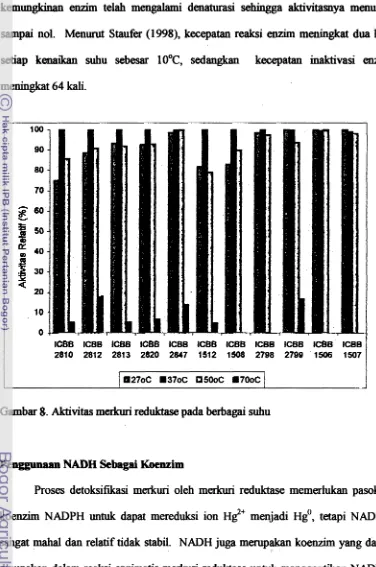
Pengaruh Suhu Terhadap Aktivitas Merkuri Reduktase
Pada Gambar 8. Wihat bahwa isolat ICBB 2810, ICBB 2812, ICBB 2813,
ICBB 2820, ICBB 1512, ICBB 2798 ban ICBB 1508 aktivitas maksimumnya pada
suhu 3TC yaitu berhuut-tmut
sebesar
7,79; 4,75; 16,6; 15,l; 6,79; 5,49dan
16,54phf
NADPH
mg"mnfl. isolat ICBB 2799, ICBB 1506 dan ICBB 1507 mempunyaiaktivitas maksimurn pada suhu ruang (270C) yaitu sebesar 5,8 1; 8,47 d m 10,12 pM
NADPH mg-'mnfl, sedan@ isolat ICBB 2847 kivitas maksimum rnerkuri Kdt&asenya pada suhu W C yaitu sebesar 8,lS pM NADPH mg-'mtt'. Pada suhu
kemungkinan enzim telah mengalami denaturasi -a aktivitasnya menurun sampai nol. Menurut Staufer (1998), kecepatan reaksi enzim meningkat dua kali setiap kenaikan suhu sebesar 10°C, sedangkan kecepatan inaktivasi
enzim
meningkat 64 kali.Gambar 8. Aktivitas merkuri reduktase pa& berbagai suhu
ICBB lCBB ICBB tCBB ICBB ICBB ICBB ICBB ICBB lCBB ICBB 2810 2812 2813 2820 2847 1512 1508 2798 2799 1506 1507
Peqgpnaan NADH Seborgai Koenzim
Proses detoksifikasi merkuri oleh merkuri reduktase memerlukan pasokan a
koenzirn NADPH untuk dapat mereduksi ion H$ menjadi EIg0, tetapi NADPH sangat mahal dan relatif tidak stabil. NADH juga merupakan koenzim yang dapat digunakan dalam reaksi enzimatis merkuri reduktase untuk menggantikan NADPH pada beberapa bakteri.
U27oC m370C 13500C m700C
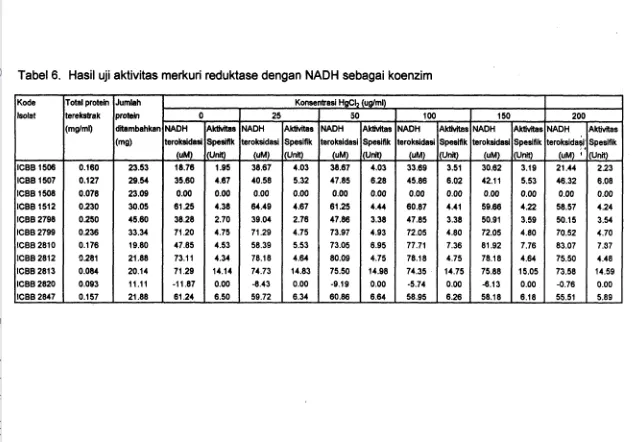
Pada Tabel 6. terlihat bahwa selain isolat ICBB 1508 dan ICBB 2820, semua
isolat dapat menggunakan NADH sebagai koenzim dalam reaksi enzimatis merlcllri
reduktase, namun aktivitas merkuri reduktase yang terukur pada berbagai
.
-
-
..-
konsentrasi HgC12 tidak jauh berbeda dengan kontrol, sehingga aktivitas enzim yang
sebenarnya tidak tampak. Pada isolat ICBB 1508 dan ICBB 2820 aktivitasnya nol,
atau dengan kata lain merkuri reduktase dari kedm isolat tersebut tidak dapat
menggunakan NADH sebagai koenzim. Kedua isolat tersebut mempunyai kadar
protein lebih rendah dibandingkan dengan isolat yang lain, sehingga aktivitas enzim
tidak terukur. Berdasarkan hasil pada Tabel 6. tersebut, maka tidak dapat disimpullcan isolat mana yang dapat menggunakan NADH sebagai koenzirn
menggantikan NADPH dan isolat mana yang tidak dapat menggunakan NADH
sebagai koenzim. Hal ini dapat disebabkan konsentrasi NADH yang digunakan
dalam pengujian ini kurang tinggi. NADH dilaporkan dapat mengganakan NADPH untuk enzim K-62 dari strain Pseudomonas K-62, namun derajat spesifitasnya
tergantung pada kondisi pengujian. Semua hail pengujian menunjukan bahwa
merkuri reduktase lebih memilih NADPH sebagai koenzim, namun NADH dapat
digunakan dengan kondisi konsentrasi Hg rendah dan NADH yang diberikan lebih
Tabel 6. Hasil uji aktivitas merkuri reduktase dengan NADH sebagai koenzim Kode lsolat ICBB 1506 ICBB 1507 ICBB 1508 ICBB 1512 ICBB 2798 ICBB 2799 ICBB 2810 ICBB 2812 ICBB 2813 ICBB 2820 ICBB 2847 Jumlah protek, ditambahkan ( m ~ )
23.53 29.54 23.09 30.05 45.60 33.34 19.80 21.88 20.14 11.11 21.88 Total protein terekstrak (mglml) 0.160 0.127 0.078 0.230 0.250 0.236 0.176 0.281 0.084 0.093 0.1 57
Konsentrasi HgCh (uglml)
200 NADH teroksidapi.
(uM) '
21.44 46.32 0.00 58.57 50.15 70.52 83.07 75.50 73.58 -0.76 55.51 0 Aktivitas Spesifik (Unit) 2.23 6.08 0.00 4.24 3.54 4.70 7.87 4.48 14.59 0.00 5.89 NADH teroksidad (uM) 18.76 35.60 0.00 61.25 38.28 71.20 47.85 73.11 71.29 -11.87 61.24
25 50
[image:112.799.54.686.69.511.2]Identifikasi Bakteri Pereduksi Merkuri
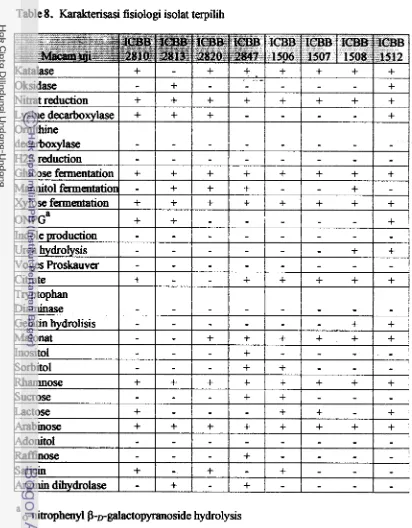
Berdasarkan uji gram, semua isolat unggul yang diperoleh adalah bakteri gram negatif Isolat ICBB 2798 bersifat non motil, sedangkan isolat yang lain
. * - ..-
semuanya motil. Oksidase positif hanya terjadi pada isolat ICBB 15 12 d m ICBB
2813. Hasil uji katalase untuk semua isolat menunjukan hasil positif dm semua isolat unggul yang diperoleh dapat mereduksi nitrat. Hasil kadcterisasi morfologi
dan fisiologi selengkapnya disajikan pada Tabel 7 dan 8.
Hasil identifikasi menggunakan kit Microbact 24E (Australia) dan dengan
berpedoman pada buku "Bergey's Manual of Determinative Bacteriology "
(Holt et al. 1994), menunjukkan hasil berikut: isolat ICBB 2810 diduga adalah
Escherichia coli-inactive, ICBB 28 13 adaldl Aeromonas caviae, ICBB 2820 adalah
Hafnia alvei, ICBB 2847 adalah Citrobacter fmdii, ICBB 1512 adalah
Pseudomonas psedonzallei dan isolat ICBB 1 506, ICBB 1507, ICBB 1508 berturut- turut adalah Enterobacter agglomerans (revisi dari sebelumnya yang diduga
Pseudomonas sp (Handayani, 200 1)). Escherichia coli-inactive, Aeromonas caviae.
Hafnia alvei, Citrobacter frundii dan Enterobacter agglomerans adalah bakteri
anaerob fakultatif sedangkan Pseudomonaspsedomallei adalah bakteri obligat aerob
Tabel
.7.Karakterisasi morfologi isolat terpilih
Karakter yang diamati Koloni Bentuk sel Sifat gram Motilitas Kode Isolat ICBB 28 10krem transparan cembung tepi rata bulat d.0.5-lmm Batang Negatif
Non motil
ICBB 2820 krem transparan cembung tepi rata bulat d.0.5-lmm Batang Negatif Motil ICBB 28 13
krem tdk.transp.
pmk. kasar tepi tdk rata
d.0,5-1 mm Batang Negatif Motil ICBB 2847 krem transparan cembung tepi rata bulat d.0.5- lmm Batang Negatif Motil ICBB 1506 krem transparan cembung tepi rata bulat d.0.5-lmm Batang Negatif Motil ICBB 1507 krem transparan cembung tepi rata bulat d.0.5-lmm Rantai rods Negatif Motil ICBB 1508 krem transparan cembung tepi rata bulat d.0.5-lmm Diplorods Negatif Motil
ICBB 15 12
krem transparan cembung tepi rata bulat d.0.5-lmm Batang Negatif Motil
ICBB 28 12
krem transparan cembung tepi rata bulat d.0.5-lmm bat an^ Negatif Motil ICBB 2798 kuning transparan cembung tepi rata bulaf